POTENSI JERUK NIPIS Citrus aurantifolia UNTUK
PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI
Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
DEWI MAHARANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
POTENSI JERUK NIPIS Citrus aurantifolia UNTUK PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skirpsi ini.
Bogor, Januari 2009
RINGKASAN
DEWI MAHARANI. Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo
Clarias sp. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan MUNTI YUHANA.
Ikan lele dumbo Clarias sp. merupakan salah satu jenis ikan air tawar yang banyak dibudidayakan karena pertumbuhannya cepat dan permintaannya cukup tinggi. Namun dalam budidaya lele dumbo sering ditemukan adanya penyakit. Penyakit yang biasa menyerang ikan lele adalah penyakit bercak merah atau MAS (Motile Aeromonad Septicaemia) yang disebabkan oleh bakteri Aeromonas hydrophila. Penggunaan bahan alami jeruk nipis Citrus aurantifolia didugadapat menjadi alternatif pengganti antibiotik dalam mengobati penyakit yang disebabkan oleh bakteri. Oleh karena itu penelitian ini bertujuan untuk mengetahui potensi jeruk nipis untuk mencegah dan mengobati infeksi bakteri A. hydrophila pada ikan lele dumbo.
Penelitian terdiri dari beberapa tahap, yang pertama uji LD50, untuk mengetahui tingkat kepadatan bakteri yang dapat menyebabkan kematian ikan sebanyak 50% populasi dalam waktu satu minggu. Selanjutnya adalah uji in vitro
untuk mengetahui dosis efektif dari jeruk nipis dan yang terakhir adalah uji in vivo. Analisis data menggunakan uji Anova dan uji lanjut Beda Nyata Terkecil (BNT) pada selang kepercayaan 95%, serta secara deskriptif.
Uji LD50 menghasilkan konsentrasi bakteri A. hydrophila 105 cfu/ml dapat mematikan 50% populasi ikan uji dalam waktu 1 minggu. Hasil uji in vitro
menunjukkan bahwa sari jeruk nipis berpotensi sebagai antibakteri yang terlihat dari zona hambat yang terbentuk pada dosis 5%.
Hasil uji in vivo menunjukkan respon makan perlakuan pencegahan yang lebih baik dibandingkan perlakuan pengobatan dan kontrol positif. Pertambahan bobot rata-rata perlakuan pencegahan sebesar 40.16% dan pengobatan sebesar 37.66% tidak berbeda nyata dengan kontrol positif sebesar 51.21%. Rata-rata skor gejala klinis perlakuan pencegahan lebih kecil dan berbeda nyata dibandingkan perlakuan pengobatan dan kontrol positif. Mortalitas perlakuan pencegahan sebesar 0% dan pengobatan sebesar 13.33% berbeda nyata terhadap kontrol positif sebesar 26.67%. Pengamatan organ dalam menunjukkan perlakuan pencegahan normal, mendekati kontrol negatif, sedangkan perlakuan pengobatan terjadi perubahan warna organ dalam, mendekati kontrol negatif. Kualitas air yang terukur sebelum dan setelah uji in vivo masih termasuk dalam kisaran toleransi ikan lele dumbo.
Dari hasil penelitian ini didapatkan kesimpulan bahwa perlakuan pencegahan dengan dosis sari jeruk nipis 5% berpotensi mencegah infeksi bakteri
POTENSI JERUK NIPIS Citrus aurantifolia UNTUK
PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI
Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
DEWI MAHARANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila
pada Ikan Lele Dumbo Clarias sp.
Nama Mahasiswa : Dewi Maharani
Nomor Pokok : C 14104068
Disetujui,
Komisi Pembimbing
Dr. Dinamella Wahjuningrum Dr. Munti Yuhana NIP. 132 234 940 NIP. 132 092 238
Diketahui
Dekan Fakultas Perikanan dan Ilmu kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur Penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Skripsi ini merupakan hasil penelitian yang dilaksanakan sejak bulan April 2008 sampai dengan November 2008, dengan judul “Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp.”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Orangtua dan kakak-kakakku tercinta atas doa dan dukungannya selama penulis menyelesaikan skripsi ini
2. Dr. Dinamella Wahjuningrum selaku pembimbing akademik dan pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis dari awal masa perkuliahan sampai penyelesaian skripsi
3. Dr. Munti Yuhana selaku pembimbing yang telah banyak membantu penulis dalam menyelesaikan skripsi
4. Dr. Tatag Budiardi selaku dosen tamu yang memberikan arahan untuk kesempurnaan skripsi ini
5. Pak Ranta, Pak Aam, Bang Abe, Pak Mar, Mbak Yuli, Kang Asep atas kerjasamanya yang baik dalam menyelesaikan skripsi
6. Temen-teman BDP’41 untuk doa, semangat, bantuan dan kebersamaannya selama penelitian dan penyusunan skripsi
Semoga karya ilmiah ini bermanfaat khususnya bagi penulis dan juga semua pihak yang membutuhkan. Penulis menyadari bahwa penulisan karya ilmiah ini masih jauh dari sempurna, karenanya penulis sangat mengharapkan kritik dan saran dari semua pihak. Terima kasih.
Bogor, Januari 2009
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 13 Januari 1986 dari Ayah Moehammad Roem dan Ibu Handayaningsih. Penulis merupakan anak ketiga dari tiga bersaudara.
Pendidikan formal yang dilalui penulis adalah Madrasah Ibtidaiyah Pembangunan IAIN Jakarta dan lulus tahun 1998, kemudian penulis melanjutkan pendidikan di SLTPN 1 Pamulang dan lulus tahun 2001, selanjutnya penulis melanjutkan pendidikan di SMUN 1 Ciputat dan lulus pada tahun 2004. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah melakukan magang di
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Ikan Lele Dumbo Clarias sp ... 3
2.2 Bakteri Aeromonas hydrophila ... 4
2.3 Jeruk nipis Citrus aurantifolia Swingle... ... 7
III. METODOLOGI ... 11
3.1 Waktu dan Tempat ... 11
3.2 Alat dan Bahan ... 11
3.3 Metode Penelitian ... 11
3.3.1 Uji LD50 ... 11
3.3.2 Pembuatan Sari Jeruk Nipis ... 12
3.3.3 Uji In Vitro... 12
3.3.4 Uji In Vivo ... 13
3.3.4.1 Persiapan Wadah ... 13
3.3.4.2 Adaptasi Ikan Uji ... 13
3.3.4.3 Uji In Vivo ... 13
3.3.4.4 Parameter yang Diamati ... 15
3.3.4.4.1 Respon Makan dan Uji Refleks Ikan ... 15
3.3.4.4.2 Pertambahan Bobot Rata-rata ... 15
3.3.4.4.3 Gejala Klinis dan Pengukuran Diameter Klinis ... 15
3.3.4.4.4 Mortalitas ... 16
3.3.4.4.5 Pengamatan Organ Dalam ... 16
3.3.4.4.6 Analisa Kualitas Air ... 16
3.3.5 Analisis Data ... 17
IV. HASIL DAN PEMBAHASAN ... 18
4.1 Hasil ... 18
4.1.1 Uji LD50 ... 18
4.1.2 Uji In Vitro... 18
4.1.3 Uji In Vivo ... 19
4.1.3.1 Respon Makan dan Uji Refleks Ikan ... 19
4.1.3.2 Pertambahan Bobot Rata-rata ... 21
4.1.3.3 Gejala Klinis dan Pengukuran Diameter Klinis ... 22
4.1.3.4 Mortalitas ... 24
4.1.3.5 Pengamatan Organ Dalam ... 25
4.1.3.6 Kualitas Air... 25
4.2 Pembahasan ... 26
viii
V. KESIMPULAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
ix
DAFTAR TABEL
Halaman
1. Kandungan buah jeruk nipis ... 9
2. Respon makan ikan lele dumbo selama uji in vivo ... 20
3. Pengamatan organ dalam ikan lele dumbo... 25
POTENSI JERUK NIPIS Citrus aurantifolia UNTUK
PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI
Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
DEWI MAHARANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul :
POTENSI JERUK NIPIS Citrus aurantifolia UNTUK PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skirpsi ini.
Bogor, Januari 2009
RINGKASAN
DEWI MAHARANI. Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo
Clarias sp. Dibimbing oleh DINAMELLA WAHJUNINGRUM dan MUNTI YUHANA.
Ikan lele dumbo Clarias sp. merupakan salah satu jenis ikan air tawar yang banyak dibudidayakan karena pertumbuhannya cepat dan permintaannya cukup tinggi. Namun dalam budidaya lele dumbo sering ditemukan adanya penyakit. Penyakit yang biasa menyerang ikan lele adalah penyakit bercak merah atau MAS (Motile Aeromonad Septicaemia) yang disebabkan oleh bakteri Aeromonas hydrophila. Penggunaan bahan alami jeruk nipis Citrus aurantifolia didugadapat menjadi alternatif pengganti antibiotik dalam mengobati penyakit yang disebabkan oleh bakteri. Oleh karena itu penelitian ini bertujuan untuk mengetahui potensi jeruk nipis untuk mencegah dan mengobati infeksi bakteri A. hydrophila pada ikan lele dumbo.
Penelitian terdiri dari beberapa tahap, yang pertama uji LD50, untuk mengetahui tingkat kepadatan bakteri yang dapat menyebabkan kematian ikan sebanyak 50% populasi dalam waktu satu minggu. Selanjutnya adalah uji in vitro
untuk mengetahui dosis efektif dari jeruk nipis dan yang terakhir adalah uji in vivo. Analisis data menggunakan uji Anova dan uji lanjut Beda Nyata Terkecil (BNT) pada selang kepercayaan 95%, serta secara deskriptif.
Uji LD50 menghasilkan konsentrasi bakteri A. hydrophila 105 cfu/ml dapat mematikan 50% populasi ikan uji dalam waktu 1 minggu. Hasil uji in vitro
menunjukkan bahwa sari jeruk nipis berpotensi sebagai antibakteri yang terlihat dari zona hambat yang terbentuk pada dosis 5%.
Hasil uji in vivo menunjukkan respon makan perlakuan pencegahan yang lebih baik dibandingkan perlakuan pengobatan dan kontrol positif. Pertambahan bobot rata-rata perlakuan pencegahan sebesar 40.16% dan pengobatan sebesar 37.66% tidak berbeda nyata dengan kontrol positif sebesar 51.21%. Rata-rata skor gejala klinis perlakuan pencegahan lebih kecil dan berbeda nyata dibandingkan perlakuan pengobatan dan kontrol positif. Mortalitas perlakuan pencegahan sebesar 0% dan pengobatan sebesar 13.33% berbeda nyata terhadap kontrol positif sebesar 26.67%. Pengamatan organ dalam menunjukkan perlakuan pencegahan normal, mendekati kontrol negatif, sedangkan perlakuan pengobatan terjadi perubahan warna organ dalam, mendekati kontrol negatif. Kualitas air yang terukur sebelum dan setelah uji in vivo masih termasuk dalam kisaran toleransi ikan lele dumbo.
Dari hasil penelitian ini didapatkan kesimpulan bahwa perlakuan pencegahan dengan dosis sari jeruk nipis 5% berpotensi mencegah infeksi bakteri
POTENSI JERUK NIPIS Citrus aurantifolia UNTUK
PENCEGAHAN DAN PENGOBATAN INFEKSI BAKTERI
Aeromonas hydrophila PADA IKAN LELE DUMBO Clarias sp.
DEWI MAHARANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila
pada Ikan Lele Dumbo Clarias sp.
Nama Mahasiswa : Dewi Maharani
Nomor Pokok : C 14104068
Disetujui,
Komisi Pembimbing
Dr. Dinamella Wahjuningrum Dr. Munti Yuhana NIP. 132 234 940 NIP. 132 092 238
Diketahui
Dekan Fakultas Perikanan dan Ilmu kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji dan syukur Penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Skripsi ini merupakan hasil penelitian yang dilaksanakan sejak bulan April 2008 sampai dengan November 2008, dengan judul “Potensi Jeruk Nipis Citrus aurantifolia untuk Pencegahan dan Pengobatan Infeksi Bakteri Aeromonas hydrophila pada Ikan Lele Dumbo Clarias sp.”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Orangtua dan kakak-kakakku tercinta atas doa dan dukungannya selama penulis menyelesaikan skripsi ini
2. Dr. Dinamella Wahjuningrum selaku pembimbing akademik dan pembimbing skripsi yang telah banyak memberikan arahan dan bimbingan kepada penulis dari awal masa perkuliahan sampai penyelesaian skripsi
3. Dr. Munti Yuhana selaku pembimbing yang telah banyak membantu penulis dalam menyelesaikan skripsi
4. Dr. Tatag Budiardi selaku dosen tamu yang memberikan arahan untuk kesempurnaan skripsi ini
5. Pak Ranta, Pak Aam, Bang Abe, Pak Mar, Mbak Yuli, Kang Asep atas kerjasamanya yang baik dalam menyelesaikan skripsi
6. Temen-teman BDP’41 untuk doa, semangat, bantuan dan kebersamaannya selama penelitian dan penyusunan skripsi
Semoga karya ilmiah ini bermanfaat khususnya bagi penulis dan juga semua pihak yang membutuhkan. Penulis menyadari bahwa penulisan karya ilmiah ini masih jauh dari sempurna, karenanya penulis sangat mengharapkan kritik dan saran dari semua pihak. Terima kasih.
Bogor, Januari 2009
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta tanggal 13 Januari 1986 dari Ayah Moehammad Roem dan Ibu Handayaningsih. Penulis merupakan anak ketiga dari tiga bersaudara.
Pendidikan formal yang dilalui penulis adalah Madrasah Ibtidaiyah Pembangunan IAIN Jakarta dan lulus tahun 1998, kemudian penulis melanjutkan pendidikan di SLTPN 1 Pamulang dan lulus tahun 2001, selanjutnya penulis melanjutkan pendidikan di SMUN 1 Ciputat dan lulus pada tahun 2004. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan memilih Program Studi Teknologi dan Manajemen Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan, penulis pernah melakukan magang di
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Ikan Lele Dumbo Clarias sp ... 3
2.2 Bakteri Aeromonas hydrophila ... 4
2.3 Jeruk nipis Citrus aurantifolia Swingle... ... 7
III. METODOLOGI ... 11
3.1 Waktu dan Tempat ... 11
3.2 Alat dan Bahan ... 11
3.3 Metode Penelitian ... 11
3.3.1 Uji LD50 ... 11
3.3.2 Pembuatan Sari Jeruk Nipis ... 12
3.3.3 Uji In Vitro... 12
3.3.4 Uji In Vivo ... 13
3.3.4.1 Persiapan Wadah ... 13
3.3.4.2 Adaptasi Ikan Uji ... 13
3.3.4.3 Uji In Vivo ... 13
3.3.4.4 Parameter yang Diamati ... 15
3.3.4.4.1 Respon Makan dan Uji Refleks Ikan ... 15
3.3.4.4.2 Pertambahan Bobot Rata-rata ... 15
3.3.4.4.3 Gejala Klinis dan Pengukuran Diameter Klinis ... 15
3.3.4.4.4 Mortalitas ... 16
3.3.4.4.5 Pengamatan Organ Dalam ... 16
3.3.4.4.6 Analisa Kualitas Air ... 16
3.3.5 Analisis Data ... 17
IV. HASIL DAN PEMBAHASAN ... 18
4.1 Hasil ... 18
4.1.1 Uji LD50 ... 18
4.1.2 Uji In Vitro... 18
4.1.3 Uji In Vivo ... 19
4.1.3.1 Respon Makan dan Uji Refleks Ikan ... 19
4.1.3.2 Pertambahan Bobot Rata-rata ... 21
4.1.3.3 Gejala Klinis dan Pengukuran Diameter Klinis ... 22
4.1.3.4 Mortalitas ... 24
4.1.3.5 Pengamatan Organ Dalam ... 25
4.1.3.6 Kualitas Air... 25
4.2 Pembahasan ... 26
viii
V. KESIMPULAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
ix
DAFTAR TABEL
Halaman
1. Kandungan buah jeruk nipis ... 9
2. Respon makan ikan lele dumbo selama uji in vivo ... 20
3. Pengamatan organ dalam ikan lele dumbo... 25
x
DAFTAR GAMBAR
Halaman
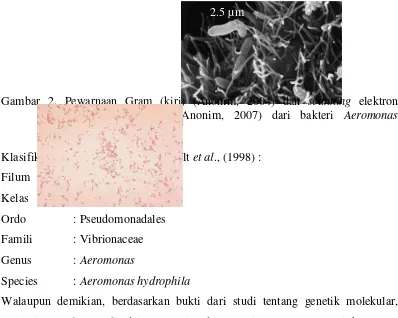
1. Lele Dumbo Clarias sp. ... 3 2. Pewarnaan Gram (kiri) (Anonim, 2004) dan scanning elektron
micrograph (kanan) (Anonim, 2007) dari bakteri Aeromonas hydrophila 5 3. Jeruk Nipis Citrus aurantifolia... 8 4. Skema metode penelitian (uji in vivo) ... 14 5. Rata-rata diameter zona hambat sari jeruk nipis terhadap bakteri
A.hydrophila... ... 18 6. Zona hambat jeruk nipis... 19 7. Pertambahan bobot rata-rata ikan lele dumbo (%) selama uji in
vivo... ... 21 8. Skor rata-rata gejala klinis ikan lele dumbo pada uji in
xi
DAFTAR LAMPIRAN
Halaman
1. Pembuatan sari jeruk nipis ... 38 2. Penyiapan media bakteri Aeromonas hydrophila ... 39 3. Metode uji in vitro ... 40
4. Setting akuarium pada uji in vivo ... 41 5. Metode penyiapan dan penyuntikan bakteri ... 42 6. Hasil penentuan LD50 bakteri A. hydrophila terhadap ikan lele
dumbo menurut Reed and Muench (1939) ... 43 7. pH jeruk nipis pada masing-masing dosis ... 44 8. Hasil uji in vitro ... 45 9. Pertambahan bobot rata-rata ikan lele dumbo selama uji in vivo ... 46 10.Uji statistik parameter pertambahan bobot rata-rata ikan lele dumbo ... 47 11.Skor gejala klinis pada ikan lele dumbo ... 48 12.Gejala klinis pada ikan lele dumbo perlakuan pencegahan dan
I. PENDAHULUAN
1.1 Latar Belakang
Ikan lele dumbo Clarias sp. adalah ikan yang cukup populer di kalangan masyarakat Indonesia, khususnya di pulau Jawa. Perkembangan lele dumbo di Indonesia cukup pesat dibandingkan lele lokal karena ukuran tubuhnya yang dapat tumbuh lebih cepat. Lele dumbo pertama kali didatangkan ke Indonesia pada tahun 1986 yang merupakan hasil persilangan antara lele asli dari Taiwan dengan lele yang berasal dari Afrika (Khairuman dan Amri, 2002).
Dahulu pada awal ikan lele dumbo didatangkan ke Indonesia, budidaya lele dumbo merupakan monopoli lembaga milik pemerintah ataupun perusahaan swasta dengan modal yang besar. Namun dengan adanya perkembangan teknologi, sekarang ini membudidayakan ikan lele bisa dilakukan oleh seorang petani dengan modal yang cukup terbatas (Khairuman dan Amri, 2002). Ikan ini juga dapat dipelihara dengan padat tebar yang tinggi dalam lahan yang terbatas. Hal inilah yang mendorong usaha budidaya lele berkembang sangat cepat, karena dengan modal yang terbatas, keuntungan tetap bisa diperoleh.
Produksi lele ukuran konsumsi secara nasional mengalami kenaikan sebesar 18.3% per tahun dari 24.991 ton (1999) menjadi 57.740 ton (2003). Revitalisasi lele sampai dengan akhir tahun 2009 ditargetkan mencapai produksi 175.000 ton atau meningkat rata-rata 21.64% per tahun (Mahyuddin, 2007). Seiring dengan meningkatnya permintaan, produksi lele juga harus ditingkatkan jumlahnya untuk memenuhi kebutuhan pasar. Untuk meningkatkan hasil produksi, dilakukan budidaya secara intensif dengan tingkat kepadatan yang tinggi. Dalam budidaya intensif, dapat diperkirakan target produksi yang akan dihasilkan dalam jangka waktu tertentu. Namun budidaya intensif juga memiliki kelemahan. Tingkat kepadatan yang tinggi menyebabkan kualitas air mudah menurun sehingga patogen mudah berkembang, ditambah lagi sistem ketahanan tubuh ikan juga ikut menurun akibat penurunan kualitas air. Hal ini menyebabkan ikan lele mudah terkena penyakit.
2
Septicemia (MAS) yang disebabkan oleh bakteri Aeromonas hydrophila. Sekitar tahun1980, terdapat kasus kematian puluhan ton ikan di daerah Jawa Barat akibat serangan bakteri Aeromonas (Kordi, 2004). Pada awalnya, penyakit bercak merah diobati dengan menggunakan antibiotik seperti oxytetracycline, streptomysin, atau kloramfenikol yang disuntikkan atau dicampurkan dalam pakan. Sayangnya, penggunaan antibiotik selain mahal, tidak ramah lingkungan, juga dapat menyebabkan resistensi pada bakteri. Hal ini menyebabkan manusia beralih menggunakan bahan-bahan alami sebagai pengganti antibiotik karena tidak berbahaya bagi kesehatan. Selain itu, penggunaan bahan-bahan alami juga lebih murah dibandingkan antibiotik serta mudah didapat.
Bahan-bahan alami yang telah banyak digunakan sebagai antibakteri pada ikan antara lain daun paci-paci (Abdullah, 2008), bawang putih (Normalina, 2007) dan lain sebagainya. Beruntung, Indonesia sebagai negara agraris yang memiliki iklim tropis memiliki kekayaan alam yang luar biasa, beragam jenis tanaman terdapat di negara ini sehingga masih banyak sekali jenis tanaman berkhasiat obat lainnya yang belum tergali potensinya secara maksimal. Salah satunya adalah tanaman yang sudah sangat akrab dengan kehidupan sehari-hari masyarakat Indonesia, jeruk nipis Citrus aurantifolia. Tanaman ini mudah didapat dan sudah lama dikenal mengandung khasiat obat. Jeruk nipis biasa digunakan untuk memasak, obat batuk hingga mengobati jerawat. Buahnya mengandung banyak air, vitamin C, asam sitrat, flavonoid dan minyak atsiri. Namun, penggunaan jeruk nipis sebagai bahan pengendalian infeksi bakteri pada ikan belum dilakukan. Oleh karena itu penelitian ini perlu dilakukan untuk mengetahui potensi jeruk nipis untuk mencegah dan mengobati infeksi bakteri A. hydrophila pada ikan lele dumbo.
1.2 Tujuan
Penelitian ini bertujuan untuk mengetahui potensi jeruk nipis C. aurantifolia
II. TINJAUAN PUSTAKA
2.1 Ikan Lele Dumbo Clarias sp.
Ikan lele dumbo Clarias sp.(Gambar 1) banyak ditemukan di Benua Afrika dan Asia Tenggara. Penyebutan ikan lele di berbagai daerah di Indonesia berbeda-beda, misalnya ikan kalang (Sumatera), ikan lele (Jawa), ikan keling (Sulawesi) atau ikan pintet (Kalimantan). Dalam perdagangan internasional, ikan lele dikenal dengan sebutan catfish (Mahyuddin, 2007).
Gambar 1. Lele Dumbo Clarias sp.
Klasifikasi ikan lele dumbo menurut Saanin (1984) adalah sebagai berikut : Kingdom : Animalia
Filum : Chordata Kelas : Pisces Sub kelas : Teleostei Ordo : Ostariophyta Sub ordo : Siluroidae Famili : Clariidae Genus : Clarias
Species : Clarias sp.
4
berfungsi untuk perabaan dan penciuman serta penglihatan lele yang kurang berfungsi dengan baik (Mahyuddin, 2007). Sebagai alat bantu untuk berenang, lele dumbo memiliki tiga buah sirip tunggal, yakni sirip punggung (dorsal), sirip dubur (anal), dan sirip ekor (caudal). Ikan ini juga memiliki sirip berpasangan, yaitu sirip dada (pectoral) dan sirip perut (ventral). Sirip dada dilengkapi dengan tulang keras dan runcing yang biasa disebut patil untuk membela diri. Lele dumbo memiliki alat pernafasan tambahan yaitu aborescent organ yang dapat membantunya mengambil oksigen langsung dari udara, sehingga mampu hidup di dalam perairan dengan kadar oksigen yang rendah atau dalam lumpur.
Menurut Khairuman dan Amri (2002), kualitas air yang dianggap baik untuk kehidupan lele adalah perairan dengan suhu 20-30°C, oksigen terlarut (DO) minimum 3 mg/l, pH atau derajat keasaman 6.5-8, kandungan karbondioksida (CO2) kurang dari 15 ppm, NH3 sebesar 0.05 mg/l, NO2 sebesar 0.25 mg/l dan NO3 sebesar 250 mg/l. Sedangkan untuk ammonia total, konsentrasi yang baik untuk budidaya lele menurut Mahyuddin (2007) adalah maksimum 1 mg/l.
Ikan lele dumbo tergolong ikan yang sangat responsif terhadap pakan, baik dalam habitat asli di alam maupun di dalam kolam pemeliharaan (Khairuman dan Amri, 2002). Oleh karena itu, ikan lele dumbo dapat tumbuh cepat dalam waktu yang relatif singkat.
Pada ikan lele ukuran fingerling, metabolisme dalam tubuh ikan belum stabil sehingga proses pembentukan imunitas di dalam tubuhnya belum sempurna (Viveen et al.,1987 dalam Riyanto, 1993). Seiring dengan pertumbuhan ikan, maka ikan juga dalam proses membangun sistem kekebalan tubuh dan mekanisme pertahanan tubuh lainnya (Kabata, 1985).
2.2 Bakteri Aeromonas hydrophila
5
dunia pada beberapa jenis ikan air tawar, amfibi, reptil dan manusia. A. hydrophila tersebar luas di air tawar dan di dasar sedimen yang mengandung bahan organik tinggi (Aoki, 1999). Tanda-tanda awal adanya infeksi penyakit ini pada ikan adalah hilangnya nafsu makan, diikuti dengan banyaknya lendir yang keluar, pendarahan pada kulit, kerusakan pada sirip dan insang, hilangnya keseimbangan renang dan akhirnya berujung pada kematian (Djajadiredja et al.,
1982).
2.5 µm
Gambar 2. Pewarnaan Gram (kiri) (Anonim, 2004) dan scanning elektron
micrograph (kanan) (Anonim, 2007) dari bakteri Aeromonas hydrophila
Klasifikasi A. hydrophila menurut Holt et al., (1998) : Filum : Protophyta
Kelas : Schizomycetes Ordo : Pseudomonadales Famili : Vibrionaceae Genus : Aeromonas
Species : Aeromonas hydrophila
Walaupun demikian, berdasarkan bukti dari studi tentang genetik molekular, Colwell et al. (1986) dalam Austin dan Austin (1993) mengajukan agar
Aeromonas digolongkan dari famili Vibrionaceae menjadi famili Aeromonadaceae.
6
oksidase sitokrom positif. Kisaran pH untuk A. hydrophila adalah 5.5-9 (Kordi, 2004).
A. hydrophila sangat mudah menyerang ikan yang keadaannya stres, antara lain karena penurunan kualitas air, tingkat kepadatan yang tinggi, penanganan (handling) yang tidak baik ataupun kelarutan oksigen yang rendah. Bakteri ini juga dengan mudah menyerang ikan yang telah terinfeksi parasit atau ikan yang tubuhnya luka (infeksi sekunder).
Kabata (1985) mengungkapkan bahwa ikan yang terserang penyakit ini umumnya tubuhnya berwarna gelap, menunjukkan pendarahan, borok atau tukak dan perut menggembung berisi cairan kemerahan. Pada kasus di Thailand, ikan lele yang terinfeksi A. hydrophila memperlihatkan tingkah laku yang tidak normal, berenang lambat, tidak mau makan, megap-megap di permukaan atau diam lesu di dasar kolam. Gejala awal penyakit ini antara lain kulit terasa kering dan kasar, melepuh dan berwarna pucat. Luka yang terjadi pada kulit dapat bertambah parah sampai ke dalam otot. Borok berkembang menjadi tukak dan dapat bertambah parah hingga tulang terlihat. Pendarahan terjadi pada pada organ internal, ginjal dan limpa tampak berair. Ginjal membengkak dan lunak, hati juga dapat membengkak dan berwarna kuning. Bagian dubur juga dapat membengkak dan berwarna kemerahan. Penyakit ini bersifat musiman dan cenderung meningkat selama musim panas.
Menurut Snieszko dan Axelrod (1971), gejala dropsi (kembung) sering telihat pada ikan mas ketika suhu berubah dari dingin menjadi panas atau hangat dan menyebabkan kematian dalam beberapa hari. Pada gejala dropsi, terlihat akumulasi asam, berwarna bening atau kuning pada abdomen, terlihat pula kerusakan patologi dari hati, limpa, ginjal dan sepanjang usus.
7
berkembang lebih lambat, dapat pula dikenali dengan adanya lepuh tipis yang dapat berubah menjadi abses sampai ke otot. Terakhir bentuk laten yang tidak memperlihatkan gejala namun terdapat penyakit di dalamnya. Bakteri dapat diisolasi dari organ internal, usus, darah dan selaput perut, tetapi tidak ada tanda-tanda yang dapat terlihat secara eksternal maupun internal.
Munro (1982) dalam Hanafi (2006) mengatakan bahwa bakteri A. hydrophila yang patogen diduga memproduksi faktor-faktor eksotoksin yang penting dalam patogenitas terhadap penyakit. Bakteri A. hydrophila memproduksi enzim dan toksin yang dikenal sebagai produk ekstraseluler yaitu hemolisin, enterotoksin, sitotoksin dan protease. Produksi toksin ekstraseluler yang mengandung enzim protease dan hemolisin dari A. hydrophila bersifat racun bagi ikan. Apabila disuntikan ke tubuh ikan, produk ekstraseluler ini dapat menimbulkan kematian dan perubahan jaringan.
Di samping menghasilkan eksotoksin, bakteri A. hydrophila juga memproduksi endotoksin yang merupakan suatu toksin yang dihasilkan di dalam tubuh organisme dan hanya dibebaskan jika organisme tersebut hancur (Pelczar dan Chan, 1988 dalam Husein, 1993). Endotoksin yang diproduksi A. hydrophila
terdiri dari protein, lipid dan polisakarida. Endotoksin atau lipopolisakarida (LPS) dari bakteri Gram negatif adalah toksik karena dapat menginduksi berbagai kondisi patologi termasuk shock, hemoragi, demam dan kematian (Munro, 1982 dalam Hanafi, 2006).
2.3 Jeruk Nipis Citrus aurantifolia
8
Gambar 3. Jeruk Nipis Citrus aurantifolia
Klasifikasi jeruk nipis adalah sebagai berikut (Rukmana, 1996) : Kingdom : Plantae
Divisi : Spermatophyta Sub-divisi : Angiospermae Kelas : Dicotyledonae Ordo : Rutales
Famili : Rutaceae Genus : Citrus
Species : Citrus aurantifolia Swingle
Tanaman jeruk nipis memiliki susunan tubuh yang terdiri atas pohon, daun, bunga, buah dan akar. Pohon jeruk nipis berukuran relatif kecil, berkayu dan bercabang banyak. Tinggi pohonnya dapat mencapai 1.5-3.5 m atau lebih. Pada bagian batang, cabang dan ranting terdapat banyak duri dengan tata letak berjauhan dan ukurannya relatif pendek. Daun jeruk nipis berbentuk bulat telur, memiliki tangkai daun bersayap dan ujung daun agak tumpul. Bila daun digosok-gosok dengan tangan, akan menebar aroma khas yang harum (Rukmana, 1996).
Tanaman jeruk nipis pada umur 2 ½ tahun sudah mulai berbuah. Buah yang dihasilkan berbentuk bundar dengan ujung runcing, pada waktu muda berwarna hijau namun setelah tua (matang) berubah menjadi kuning cerah. Buah yang telah tua mempunyai diameter sekitar 3.5–5 cm dan tebal kulitnya antara 0.2–0.5 mm. Cita rasa buah sangat masam dan berbau sedap dengan kadar asam sitrun + 6%. Daging buah berwarna putih atau kehijauan, berair asam, wangi dan kadar vitamin C-nya tinggi (Sarwono, 1994).
9
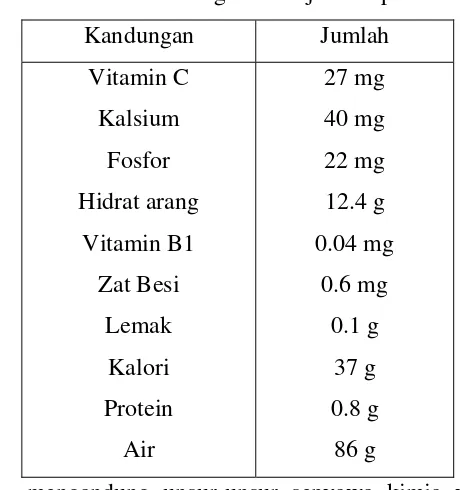
[image:31.595.196.426.427.672.2](Anderson, 1992 dalam Darmanto, 2003). Beberapa faktor nutrisi seperti vitamin B dan C terbukti mempunyai efek imunostimulan (Iwama dan Nakanishi, 1996 dalam Darmanto, 2003). Buah jeruk nipis telah lama dikenal sebagai bahan alami yang mempunyai khasiat obat. Trisbiantara (2008) mengemukakan bahwa kandungan vitamin C yang tinggi dari jeruk nipis sangat berguna sebagai antioksidan dan meningkatkan daya tahan tubuh sehingga kuman-kuman patogen (kuman yang dapat menyebabkan timbulnya penyakit) dapat dimatikan oleh tubuh. Menurut Robinson (1991) dalam Affandi dan Tang (2002), vitamin C dosis tinggi mampu meningkatkan ketahanan tubuh ikan, vitamin C ini mempunyai peranan dalam sintesa protein yang diperlukan dalam pembentukan respon imun dan biosintesa kolagen untuk mempercepat proses penyembuhan luka. Vitamin C dibutuhkan untuk diferensiasi aktivitas limfoid organ (Dieter dan Breitenbach, 1971 dalam Affandi dan Tang, 2002). Protein berguna untuk memperbaiki jaringan tubuh yang mengalami kerusakan ataupun memperbaharui jaringan yang sudah tua. Kandungan dalam tiap 100 g buah jeruk nipis dapat dilihat pada Tabel 1 (Trisbiantara, 2008).
Tabel 1. Kandungan buah jeruk nipis
Kandungan Jumlah Vitamin C Kalsium Fosfor Hidrat arang Vitamin B1 Zat Besi Lemak Kalori Protein Air 27 mg 40 mg 22 mg 12.4 g 0.04 mg 0.6 mg 0.1 g 37 g 0.8 g 86 g
10
hesperidin, tangeretin, naringin, eriocitrin, eriocitrocide. Hesperidin bermanfaat untuk anti inflamasi, anti oksidan dan menghambat sintesis prostaglandin (Chang dalam Adina et al., 2008). Jeruk nipis juga mengandung 7% minyak essensial yang mengandung citral, limonen, fenchon, terpineol, bisabolene dan terpenoid lainnya.
Oboh et al. (1992) dalam Taiwo (2007) telah membuktikan efek antimikroba dari tanaman ini pada beberapa bakteri seperti Bacillus sp., Staphylococcus aureus, Escherichia coli dan Salmonella sp. Efek farmakologis dan hasil penelitian dari Pertiwi (1992) dalam Trisbiantara (2008) menunjukkan bahwa minyak atsiri daun jeruk nipis mempunyai hambatan terhadap pertumbuhan
III. METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan April sampai November 2008
bertempat di Laboratorium Kesehatan Ikan dan Teaching Farm, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian
Bogor.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah akuarium berukuran
50x30x25 cm sebanyak 12 buah, instalasi aerasi, selang, ember, saringan ikan,
syringe, penggaris, alat bedah, oven, autoclave, penangas air, erlenmeyer, cawan
petri, tabung reaksi, ose, ependorf, mikropipet, tip, batang penyebar, aluminium foil, kertas Whatman no.42, pisau, saringan, corong, pinset, bunsen dan korek api.
Bahan yang digunakan adalah ikan Lele Dumbo (Clarias sp.) dengan panjang 9-10 cm yang berasal dari Laboratorium Lapangan Departemen Budidaya
Perikanan IPB, sari jeruk nipis Citrus aurantifolia, bakteri Aeromonas hydrophila
yang berasal dari Balai Riset Perikanan Air Tawar (Bariskanwar), Sempur Bogor.
Media bakteri TSA (Tripticase Soy Agar), LB, PBS (Phosphat Buffer Saline), kaporit, akuades, spirtus, alkohol dan pelet komersil.
3.3 Metode Penelitian 3.3.1 Uji LD50
Uji LD50 dilakukan untuk mengetahui tingkat kepadatan bakteri yang dapat
menyebabkan kematian ikan sebanyak 50% populasi dalam waktu satu minggu.
Ikan untuk uji LD50 dimasukkan ke dalam akuarium sebanyak enam ekor untuk
masing-masing akuarium. Kemudian secara intramuskular ikan disuntikkan
dengan bakteri A. hydrophila sebanyak 0.1 ml/ekor. Kepadatan bakteri yang digunakan adalah 107, 106, 105, dan 104 cfu/ml. Pada akhir pengamatan dicatat
jumlah kematian ikan dari masing-masing akuarium. Kepadatan bakteri yang
dapat menyebabkan ikan mati sebanyak 50% populasi dalam waktu satu minggu
12
3.3.2 Pembuatan Sari Jeruk Nipis
Untuk mendapatkan sari jeruk nipis, pertama-tama buah jeruk nipis dibelah
menjadi empat bagian. Kemudian masing-masing bagian diperas dan disaring agar
ampas jeruk nipis dapat terpisah. Sari jeruk nipis yang telah didapatkan
ditempatkan dalam wadah kaca. Kemudian dilakukan pengenceran sari jeruk nipis
agar didapatkan berbagai konsentrasi. Pengenceran dilakukan dengan cara
mengambil sari jeruk nipis dari wadah kaca ke dalam eppendorf, kemudian
ditambahkan akuades steril sampai mendapat konsentrasi yang diinginkan
(Lampiran 1). Konsentrasi pengenceran sari jeruk nipis yang dilakukan adalah
5%, 10%, 20%, 40%, 60%, 80%, dan 100%.
3.3.3 Uji In Vitro
Uji in vitro dilakukan untuk mengetahui daya antibakteri dari jeruk nipis dan menentukan dosis terbaiknya dalam menghambat pertumbuhan bakteri A. hydrophila. Dosis terbaik yang didapatkan dari uji in vitro akan digunakan dalam uji in vivo. Uji ini dilakukan dengan menggunakan metode Kirby-Bauer (Lay, 1994) atau kertas cakram.
Dalam uji in vitro, pertama-tama disiapkan isolat murni bakteri A. hydrophila, kemudian secara aseptik diambil isolat bakteri tersebut sebanyak satu ose dan dibiakkan dalam media LB (Lampiran 2). Setelah umur bakteri dalam
media LB mencapai 18 jam, bakteri dapat dipanen dan dilakukan pengenceran
berseri sampai kepadatan 105 (sesuai dengan kepadatan bakteri yang didapatkan
dari uji LD50). Setelah itu disiapkan media TSA (Lampiran 2) dalam cawan petri
sebagai media tempat hidup bakteri A. hydrophila. Isolat cair bakteri A. hydrophila dengan kepadatan 105 diambil sebanyak 0.1 ml menggunakan mikropipet dan disebar menggunakan batang penyebar dalam cawan petri.
Pengujian antibakteri dilakukan dengan metode kertas cakram, sehingga
perlu disiapkan kertas cakram steril. Kertas cakram yang digunakan adalah kertas
Whatman no.42 berdiameter 6 mm yang mempunyai kemampuan dalam
menyerap bahan sebanyak 15 µm. Sebelum digunakan, kertas cakram disterilkan
menggunakan autoclave selama 15 menit. Setelah itu, kertas cakram direndam
13
diambil secara aseptik dan dimasukkan ke dalam cawan petri yang telah disebar
bakteri. Kemudian cawan petri diinkubasi selama 24 jam dan diukur zona hambat
yang terbentuk (Lampiran 3).
3.3.4 Uji In Vivo
3.3.4.1 Persiapan Wadah
Akuarium yang digunakan berjumlah 12 buah, diletakkan dalam 2 buah rak
yang berhadapan (Lampiran 4). Sebelum digunakan akuarium terlebih dahulu
didesinfeksi menggunakan kaporit 100 mg/l, kemudian didiamkan atau dijemur
sampai benar-benar kering. Air yang akan digunakan juga didesinfeksi
menggunakan kaporit 30 mg/l dan Na-thiosulfat sebanyak 30% dari jumlah
kaporit kemudian diberi aerasi kuat. Setelah proses desinfeksi selesai, akuarium
dapat diisi dengan air yang telah didesinfeksi. Sekeliling akuarium ditutup dengan
plastik hitam untuk menghindari stres pada ikan lele.
3.3.4.2 Adaptasi Ikan Uji
Ikan lele yang akan digunakan untuk uji in vivo diadaptasikan terlebih dahulu untuk menghindari stres karena perpindahan tempat. Sebelum dimasukkan
ke dalam akuarium, ikan terlebih dahulu direndam dalam larutan PK 4 ppm
selama + 5 menit, hal ini bertujuan untuk mematikan parasit dan penyakit yang
mungkin menempel pada tubuh ikan. Kemudian ikan ditimbang bobot dan diukur
panjang tubuhnya untuk data awal sebelum dimulai perlakuan. Setelah itu ikan
dapat dimasukkan ke dalam akuarium dengan kepadatan lima ekor ikan dalam
satu akuarium. Ikan diadaptasikan selama tiga hari dan diberi makan pelet
komersil dengan kadar protein 28% pada pagi dan sore hari. Dilakukan pula
penyiponan dan penggantian air setiap hari untuk menjaga kualitas air.
3.3.4.3 Uji In Vivo
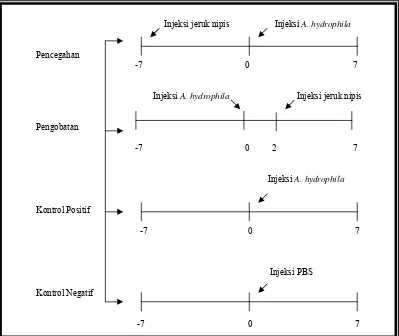
Uji in vivo dilakukan dengan dua macam perlakuan, yaitu pencegahan dan pengobatan, serta kontrol positif dan kontrol negatif (Gambar 4). Masing-masing
14
penyiponan dan pergantian air setiap hari untuk menjaga kualitas air. Sebelum
dilakukan penyuntikan bakteri, terlebih dahulu disiapkan bakterinya (Lampiran 5).
Pada perlakuan pencegahan, ikan disuntik secara intramuskular dengan sari
jeruk nipis dosis 5% (dosis yang didapatkan dari uji in vitro) sebanyak 0.1 ml/ekor. Penyuntikan dilakukan tujuh hari sebelum uji tantang atau H-7.
Kemudian uji tantang dilakukan pada hari ke-0 dengan cara ikan disuntik secara
intramuskular dengan bakteri A. hydrophila kepadatan 105 (kepadatan bakteri yang didapatkan dari uji LD50) sebanyak 0.1 ml/ekor.
Pada perlakuan pengobatan, ikan disuntik secara intramuskular dengan sari
jeruk nipis dosis 10% (dua kali lipat dari dosis pencegahan)sebanyak 0.1 ml/ekor.
Penyuntikan dilakukan dua hari setelah uji tantang atau H+2.
Pada hari ke-0, ikan kontrol positif disuntik secara intramuskular dengan
bakteri A. hydrophila kepadatan 105 sebanyak 0.1 ml/ekor. Sedangkan pada kontrol negatif, ikan disuntik dengan PBS (Lampiran 2) sebanyak 0.1 ml/ekor
juga secara intramuskular.
[image:36.595.116.515.395.731.2]Injeksi jeruk nipis Injeksi A. hydrophila
Gambar 4. Skema metode penelitian (uji in vivo)
Pencegahan
-7 0 7
Injeksi A. hydrophila Injeksi jeruk nipis
Pengobatan
-7 0 2 7
Injeksi A. hydrophila
Kontrol Positif
-7 0 7
Injeksi PBS Kontrol Negatif
15
3.3.4.4 Parameter yang Diamati
Pengamatan masing-masing perlakuan dilakukan selama 14 hari yang terdiri
dari beberapa parameter, antara lain:
3.3.4.4.1 Respon Makan dan Uji Refleks Ikan
Pengujian terhadap respon makan dilakukan dengan cara ikan diberi pakan
kemudian diamati responnya, kemudian diamati pula banyaknya pakan yang
tersisa. Untuk uji refleks ikan, bagian luar akuarium ditepuk kemudian diamati
respon dari ikan uji tersebut.
3.3.4.4.2 Pertambahan Bobot Rata-rata
Pengukuran bobot tubuh ikan uji dilakukan pada awal dan akhir perlakuan
dengan menggunakan timbangan digital. Ikan pada masing-masing akuarium
ditimbang bobot biomassanya, kemudian dihitung nilai rataan bobot tiap
perlakuan dan pertambahan bobotnya. Pertambahan bobot tubuh ikan dihitung
dengan menggunakan rumus:
Wo Wo Wt−
x 100% Pertambahan bobot (%) =
Keterangan : ΔW = pertambahan bobot (%)
Wo = bobot awal (g)
Wt = bobot akhir (g)
3.3.4.4.3 Gejala Klinis dan Pengukuran Diameter Kelainan Klinis
Pengamatan terhadap gejala klinis dilakukan setiap hari setelah ikan uji
diinfeksi bakteri A. hydrophila. Pengukuran diameter klinis dilakukan dengan mengukur luas tukak dengan menggunakan penggaris, kemudian data yang
diperoleh diberi skor (skoring). Dari nilai skor tersebut dapat diketahui kondisi
tubuh ikan uji, semakin tinggi nilai skor maka kondisi tubuh ikan semakin buruk.
Nilai skor kelainan klinis dilakukan dengan ketentuan sebagai berikut
16
Sn = ikan sembuh nilai skor 0
N = ikan normal nilai skor 0
R = ikan radang nilai skor 1
H = ikan hemoragi nilai skor 2
T = ikan tukak nilai skor 3
M = ikan mati nilai skor 4
Diameter klinis dibagi menjadi 4 kelompok :
- bila diameter kelainan klinis berada diantara (0.1-0.4 cm) diberi angka 1
- bila diameter kelainan klinis berada diantara (0.5-0.8 cm) diberi angka 2
- bila diameter kelainan klinis berada diantara (0.9-1.2 cm) diberi angka 3
- bila diameter kelainan klinis berada diantara (1.3-1.7 cm) diberi angka 4
3.3.4.4.4 Mortalitas
Pengamatan terhadap mortalitas ikan uji dilakukan setiap hari, mulai dari
awal hingga akhir perlakuan. Kematian ikan dicatat untuk mengetahui mortalitas
ikan uji dan dihitung dengan menggunakan rumus:
Mortalitas (%) = Jumlah ikan yang mati (ekor) x 100% Jumlah populasi (ekor)
3.3.4.4.5 Pengamatan Organ Dalam
Pada akhir perlakuan, ikan uji dibedah untuk mengetahui keadaan organ
dalam tubuh ikan tersebut kemudian dilakukan pembandingan antara perlakuan
pencegahan, pengobatan, kontrol positif dan kontrol negatif.
3.3.4.4.6 Analisis Kualitas Air
Selama perlakuan kualitas air dijaga dengan disipon dan dilakukan
pergantian air sekali sehari sebanyak 10-20%. Suhu air diukur setiap hari
menggunakan termometer. Selain itu, dilakukan pula pengukuran terhadap pH,
17
3.3.5 Analisis Data
Data hasil uji in vitro dianalisis menggunakan uji Anova, kemudian jika hasilnya berbeda nyata dilakukan uji lanjut Beda Nyata Terkecil (BNT) pada
selang kepercayaan 95%. Data hasil pengamatan uji in vivo dianalisis secara deskriptif, juga menggunakan uji Anova dan jika hasilnya berbeda nyata
dilakukan uji lanjut BNT pada selang kepercayaan 95%. Data dianalisis
IV. HASIL DAN PEMBAHASAN
4.1 Hasil 4.1.1 Uji LD50
Hasil perhitungan LD50 bakteri A. hydrophila terhadap ikan lele dumbo didapatkan konsentrasi bakteri sebanyak 105 cfu/ml (Lampiran 6). Dengan konsentrasi tersebut dapat membuat populasi ikan lele dumbo mati sebanyak 50% dalam waktu 7 hari.
4.1.2 Uji In Vitro
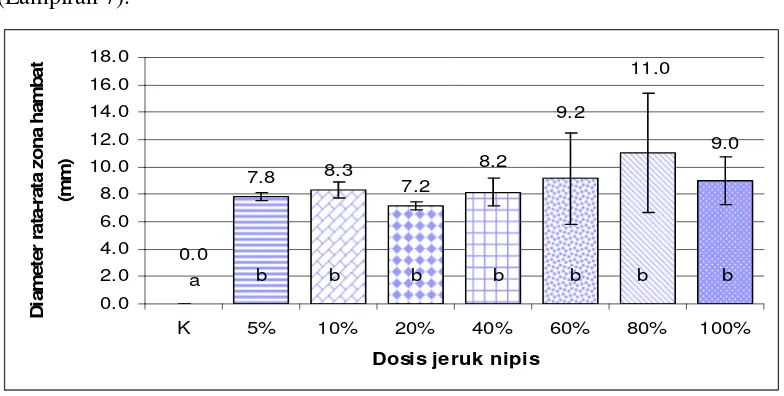
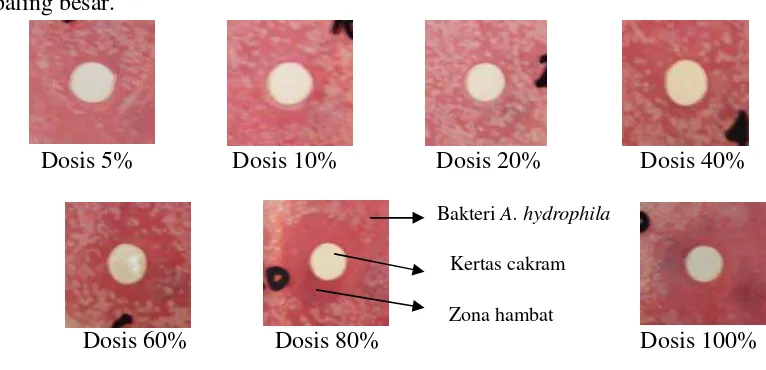
Dari hasil uji in vitro, dapat diketahui bahwa sari jeruk nipis dapat berfungsi sebagai bahan antibakteri, hal ini dapat terlihat dari zona hambat yang terbentuk di sekitar kertas cakram dalam cawan petri yang telah disebar bakteri A. hydrophila
dengan kepadatan 105 cfu/ml (Gambar 5 dan 6). Adanya zona hambat diduga berkaitan dengan pH asam dari sari jeruk nipis pada masing-masing dosis (Lampiran 7). 9.0 11.0 9.2 8.2 7.2 8.3 7.8 0.0 0.0 2.0 4.0 6.0 8.0 10.0 12.0 14.0 16.0 18.0
K 5% 10% 20% 40% 60% 80% 100%
Dosis jeruk nipis
D iam et e r r a ta -r a ta z o na ha m b a t (m m )
a b b b b b b b
[image:40.595.115.507.408.606.2]Keterangan : Huruf dalam grafik yang berbeda menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
Gambar 5. Rata-rata diameter zona hambat sari jeruk nipis terhadap bakteri
A.hydrophila
19
20%, kemudian meningkat kembali pada dosis 40%. Zona hambat terbesar terlihat pada dosis 80% dengan rata-rata zona sebesar 11 mm lalu menurun kembali pada dosis 100%. Hal ini menunjukkan bahwa pada dosis 80% merupakan puncak aktivitas antibakteri dari sari jeruk nipis sehingga menghasilkan zona hambat yang paling besar.
Dosis 5% Dosis 10% Dosis 20% Dosis 40%
Bakteri A. hydrophila
Kertas cakram
Zona hambat
[image:41.595.117.500.174.359.2]Dosis 60% Dosis 80% Dosis 100% Gambar 6. Zona hambat jeruk nipis
Dari hasil uji statistik menunjukkan bahwa perlakuan dosis sari jeruk nipis berbeda nyata terhadap kontrol (Lampiran 8). Kemudian dilakukan uji lanjut Beda Nyata Terkecil (BNT), hasilnya menunjukkan semua perlakuan dosis berbeda nyata terhadap kontrol (Lampiran 8). Oleh sebab itu, digunakan dosis 5% yang merupakan dosis paling kecil dan tidak berbeda nyata dengan dosis lainnya (Lampiran 8) agar lebih efisien dan efektif.
4.1.3 Uji In Vivo
4.1.3.1 Respon Makan dan Uji Refleks Ikan
20
Tabel 2. Respon makan ikan lele dumbo selama uji in vivo
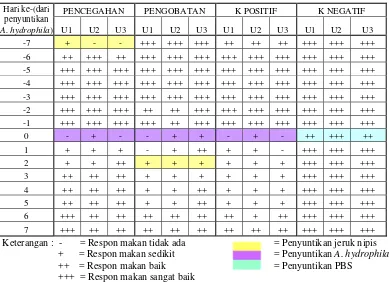
Hari ke-(dari penyuntikan A. hydrophila)
PENCEGAHAN PENGOBATAN K POSITIF K NEGATIF
U1 U2 U3 U1 U2 U3 U1 U2 U3 U1 U2 U3
-7 + - - +++ +++ +++ ++ ++ ++ +++ +++ +++
-6 ++ +++ ++ +++ +++ +++ +++ +++ +++ +++ +++ +++
-5 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
-4 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
-3 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
-2 +++ +++ +++ ++ ++ +++ +++ +++ +++ +++ +++ +++
-1 +++ +++ +++ +++ ++ +++ +++ +++ +++ +++ +++ +++
0 - + - - + + - + - ++ +++ ++
1 + + + - + ++ + + - +++ +++ +++
2 + + ++ + + + + + + +++ +++ +++
3 ++ ++ ++ + + + + + + +++ +++ +++
4 ++ ++ ++ + + ++ + + + +++ +++ +++
5 ++ ++ ++ + + ++ + + + +++ +++ +++
6 +++ ++ ++ ++ ++ ++ ++ + ++ +++ +++ +++
7 +++ ++ ++ ++ ++ ++ ++ ++ ++ +++ +++ +++
Keterangan : - = Respon makan tidak ada = Penyuntikan jeruk nipis + = Respon makan sedikit = Penyuntikan A. hydrophila ++ = Respon makan baik = Penyuntikan PBS
+++ = Respon makan sangat baik
Dari Tabel 2 dapat diketahui bahwa respon makan ikan pada perlakuan pencegahan hari H-7 sedikit bahkan cenderung tidak ada, hal ini disebabkan adanya penyuntikan sari jeruk nipis ke dalam tubuh ikan sehingga ikan mengalami stres dan tidak mau makan. Tetapi memasuki hari selanjutnya nafsu ikan mulai kembali normal dan cenderung sangat baik sampai hari ke-0. Ketika dilakukan uji tantang dengan penyuntikan bakteri A. hydrophila pada hari ke-0, ikan menurun kembali nafsu makannya, bahkan cenderung tidak mau makan. Nafsu makan ikan mulai membaik memasuki hari ke-3. Tetapi nafsu makan ikan tidak terlihat sebaik seperti sebelum disuntikkan bakteri sampai akhir perlakuan.
Pada perlakuan pengobatan, ikan terlihat sangat baik nafsu makannya dari awal perlakuan sampai hari ke-0, yaitu ketika dilakukan penyuntikan bakteri. Setelah dilakukan penyuntikan bakteri ikan terlihat tidak nafsu makan. Pada hari ke-2 ketika dilakukan penyuntikan sari jeruk nipis ikan terlihat makan sedikit. Kurangnya nafsu makan telihat sampai hari ke-5, lalu mulai membaik sampai akhir perlakuan.
21
makan hanya sedikit. Memasuki hari ke-6 ikan mulai membaik nafsu makannya tetapi tidak sebaik seperti sebelum dilakukan penyuntikan bakteri. Sedangkan pada kontrol negatif nafsu makan ikan terlihat sangat baik dari awal hingga akhir perlakuan.
Hasil pengamatan uji refleks menunjukkan bahwa refleks ikan paling kuat terjadi pada kontrol negatif, ikan dengan lincah langsung bergerak menjauhi dinding akuarium ketika dinding tersebut ditepuk. Sebaliknya, pada kontrol positif ikan cenderung diam, tidak langsung menjauhi sumber tepukan. Pada perlakuan pencegahan dan pengobatan tingkah laku ikan juga cenderung kurang aktif ketika terdapat tepukan di dinding akuarium. Ikan tidak langsung menjauhi sumber tepukan melainkan menunggu beberapa saat, kemudian berenang menjauhi sumber tepukan.
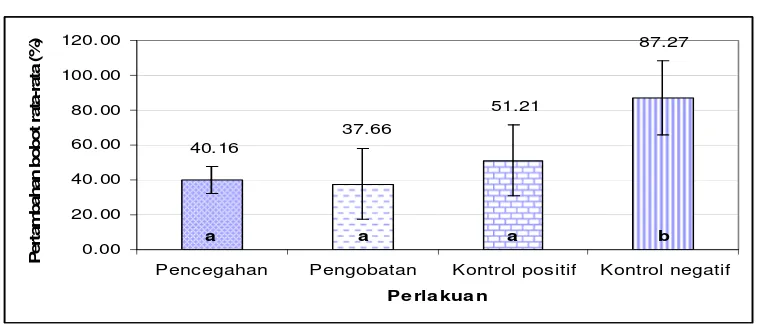
4.1.3.2 Pertambahan Bobot Rata-rata
87.27 51.21 37.66 40.16 0.00 20.00 40.00 60.00 80.00 100.00 120.00
Pencegahan Pengobatan Kontrol positif Kontrol negatif
Pe rla kua n
Pe rt a m ba han bobot r a ta -r at a ( % )
a a a b
[image:43.595.122.502.369.535.2]Keterangan : Huruf dalam grafik yang berbeda menunjukkan pengaruh perlakuan yang berbeda nyata (P<0,05)
Gambar 7. Pertambahan bobot rata-rata ikan lele dumbo (%) selama uji in vivo
22
bahwa pertambahan bobot rata-rata kontrol positif tidak berbeda nyata dengan perlakuan pencegahan dan pengobatan. Sedangkan kontrol negatif berbeda nyata terhadap kontrol positif, perlakuan pencegahan dan pengobatan (Lampiran 10).
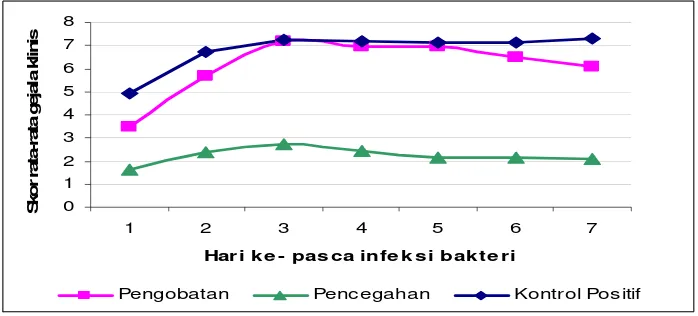
4.1.3.3 Gejala Klinis dan Pengukuran Diameter Klinis
Gejala klinis didapatkan dari pengukuran diameter tukak yang terdapat pada tubuh ikan, kemudian dilakukan skoring. Gejala klinis menunjukkan seberapa parah tubuh ikan terinfeksi bakteri, semakin tinggi skor yang didapat, berarti kerusakan pada tubuh ikan juga semakin parah.
0 1 2 3 4 5 6 7 8
1 2 3 4 5 6 7
Har i k e - pas ca infe k s i bak te r i
S ko r r at a-rat a g ej al a kl in is
[image:44.595.137.486.274.432.2]Pengobatan Pencegahan Kontrol Positif
Gambar 8. Skor rata-rata gejala klinis ikan lele dumbo pada uji in vivo
23
radang tetapi diameter radang terlihat lebih kecil. Radang dan tukak terlihat semakin kecil pada hari selanjutnya sampai akhir perlakuan, bahkan ada penambahan 1 ekor ikan yang mengalami penyembuhan. Pada akhir perlakuan, terdapat 7 ekor ikan (50%) terlihat sehat, 2 ekor ikan (13.3%) mengalami radang dengan diameter yang kecil dan 5 ekor ikan (35.7%) mengalami tukak (Lampiran 12). Hasil uji statistik menunjukkan perlakuan pencegahan berbeda nyata dengan kontrol positif (Lampiran 13).
Pada perlakuan pengobatan, skor gejala klinis terlihat lebih besar daripada pada pencegahan, namun demikian skor pengobatan masih lebih baik dibandingkan kontrol positif. Skor rata-rata awal adalah 3.47 kemudian meningkat sampai hari ke-3 menjadi 7.20 lalu mengalami penurunan sampai hari ke-7 menjadi 6.07. Pada pencegahan, semua ikan mengalami peradangan pada hari pertama setelah penyuntikan bakteri (Lampiran 11). Hari selanjutnya dilakukan penyuntikan sari jeruk nipis sebagai pengobatan dan 11 ekor ikan (73.3%) mengalami hemoragi atau pendarahan dan kerusakan jaringan, sedangkan sisanya (26.6%) telah mengalami tukak. Setelah dilakukan penyuntikan, terlihat peningkatan gejala klinis menjadi tukak, 12 ekor ikan (80%) mengalami tukak dan 1 ekor ikan (6.7%) mengalami kematian. Memasuki hari ke-4, terdapat 1 ekor ikan lagi yang mati, sedangkan ikan yang lain mulai mengalami penurunan diameter gejala klinis. Penurunan gejala klinis terus terjadi sampai akhir perlakuan, bahkan terdapat ikan yang sembuh pada hari ke-4 dan ke-6 (Lampiran 12). Hasil uji statistik menunjukkan perlakuan pengobatan tidak berbeda nyata dengan kontrol positif (Lampiran 13).
24
Hari ke-3 rata-rata ikan mengalami tukak dan terus berlanjut sampai akhir perlakuan (Lampiran 12). Pada hari ke-7, terdapat satu ekor ikan lagi yang mati.
Pada kontrol negatif tidak terdapat gejala klinis karena tidak dilakukan penyuntikan bakteri A. hydrophila. Tidak terlihat adanya peradangan, kerusakan jaringan, hemoragi atau tukak.
4.1.3.4 Mortalitas
0 5 10 15 20 25 30
1 2 3 4 5 6 7
Hari pasca infeksi bakteri
M
o
rt
a
li
tas (%
)
[image:46.595.133.490.231.394.2]Pencegahan Pengobatan K Positif K Negatif
Gambar 9. Mortalitas (%) ikan lele dumbo pada uji in vivo
Dari Gambar 9 terlihat bahwa tingkat mortalitas tertinggi terjadi pada kontrol positif sebesar 26.67%. Kemudian diikuti oleh perlakuan pengobatan sebesar 13.33%, kematian terjadi di hari ke-3 dan ke-4 dan terus konstan sampai akhir perlakuan. Pada perlakuan pencegahan, tidak terjadi kematian karena penyuntikan sari jeruk nipis maupun infeksi bakteri. Kematian terjadi pada hari H-3, tetapi hal ini bukan disebabkan penyuntikan jeruk nipis karena tidak terlihat adanya peradangan di sekitar area suntikan, melainkan karena kanibalisme antara sesama ikan yang ditandai dengan kulit ikan yang koyak karena dimakan oleh ikan yang lain (Gambar 10).
[image:46.595.218.407.612.710.2]25
Pada kontrol negatif, nilai mortalitas 0% atau tidak terjadi kematian sampai akhir perlakuan (Lampiran 14). Hasil uji statistik menunjukkan bahwa mortalitas pada perlakuan pencegahan dan pengobatan berbeda nyata dengan kontrol positif (Lampiran 15).
[image:47.595.114.511.229.388.2]4.1.3.5 Pengamatan Organ Dalam
Tabel 3. Pengamatan organ dalam ikan lele dumbo
Organ Pencegahan Pengobatan Kontrol Positif Kontrol Negatif Ginjal Merah tua
kecoklatan
Merah tua Merah tua kehitaman dan
membengkak
Merah kecoklatan
Hati Merah gelap Merah sedikit pucat Merah kekuningan dan membengkak Merah kecoklatan Empedu Hijau kebiruan Hijau kekuningan
Kuning Hijau kebiruan
Limpa Merah gelap Merah kecoklatan
Merah kecoklatan dan membengkak
Merah tua
Dari hasil pembedahan organ dalam (Tabel 3), dapat terlihat bahwa pada perlakuan pencegahan ginjal terlihat berwarna merah tua kecoklatan, hati terlihat merah gelap, empedu berwarna hijau kebiruan dan limpa terlihat berwarna merah gelap. Pada perlakuan pengobatan ginjal terlihat merah tua, hati terlihat berwarna merah sedikit pucat, empedu hijau kekuningan, dan limpa berwarna merah kecoklatan. Pada perlakuan kontrol positif terlihat ginjal berwarna merah tua kehitaman dan membengkak, hati merah kekuningan dan membengkak, empedu berwarna kuning dan limpa merah kecoklatan serta membengkak. Sedangkan pada perlakuan kontrol negatif ginjal dan hati berwarna merah kecoklatan, empedu terlihat hijau kebiruan dan limpa berwarna merah tua.
4.1.3.6 Kualitas Air
Air merupakan media tempat hidup ikan, karenanya kualitas air merupakan faktor yang perlu diperhatikan dalam pemeliharaan ikan. Ikan akan tumbuh secara optimal apabila parameter kualitas air di tempat hidupnya sesuai dengan kisaran toleransi yang dapat diterima oleh ikan tersebut. Ikan lele dumbo memiliki
26
Tabel 4. Kisaran kualitas air selama uji in vivo
Perlakuan Suhu (0C) pH DO (mg/l) TAN (mg/l)
Pencegahan 25-27 6.6-6.8 4.23-6.89 0.07-0.072
Pengobatan 25-27 6.6-6.8 4.21-6.89 0.07-0.114
Kontrol Positif 25-27 6.5-6.8 5.13-6.89 0.07-0.058
Kontrol Negatif 25-27 6.6-6.8 4.40-6.89 0.07-0.089
Dari Tabel 4 diatas, dapat diketahui bahwa kisaran kualitas air selama perlakuan memenuhi syarat kualitas air dalam memelihara lele. Kualitas air diukur sebelum dan setelah perlakuan, khusus untuk suhu dilakukan pengukuran setiap hari. Kualitas air yang terukur selama perlakuan untuk suhu adalah antara 25-270C, pH antara 6.5-6.8, DO antara 4.21-6.89 dan TAN antara 0.07-0.114 (Lampiran 16).
4.2 Pembahasan
Berdasarkan penghitungan LD50 bakteri A. hydrophila dengan menggunakan metode Reed and Muench (1939), didapatkan hasil bahwa bakteri yang digunakan merupakan bakteri dengan virulensi yang tinggi yaitu sebesar 105 cfu/ml (Lampiran 6). Lallier et al. (1981) dalam Haliman (1993) mengklasifikasikan tingkat virulensi bakteri A. hydrophila berdasarkan nilai LD50 bakteri tersebut, yaitu bakteri yang memiliki nilai LD50 antara 104.5– 105.5 cfu/ml tergolong dalam kelompok bakteri yang virulen, nilai LD50 antara 105.5– 107cfu/ml tergolong dalam kelompok bakteri yang memiliki virulensi lemah dan bakteri yang memiliki nilai LD50 lebih dari 107 cfu/ml merupakan bakteri yang avirulen.
27
zona hambat 10-20 mm berarti kekuatan antibakteri kuat, zona hambat 5-10 mm berarti kekuatan antibakteri sedang dan zona hambat 5 mm atau kurang berarti kekuatan antibakteri kurang atau lemah.
Terbentuknya zona hambat diduga karena pengaruh pH asam dalam sari jeruk nipis. pH pada perlakuan dosis dalam uji in vitro berkisar antara 2.2-2.4 (Lampiran 7). Nilai pH ini jauh lebih rendah dari kisaran toleransi A. hydrophila
yang berkisar antara 5.5-9 (Kordi, 2004), sehingga bakteri tidak dapat bertahan dan mati. Selain itu, zona hambat yang terbentuk juga dapat disebabkan karena kandungan yang terdapat dalam jeruk nipis antara lain minyak atsiri dan flavonoid (Chang dalam Adina, 2008). Hasim (2008) menyebutkan bahwa daya antibakteri dalam minyak atsiri disebabkan oleh adanya senyawa fenol dan turunannya yang dapat mendenaturasi protein. Kehadiran fenol yang merupakan senyawa toksik mengakibatkan struktur tiga dimensi protein terganggu dan terbuka menjadi struktur acak tanpa adanya kerusakan pada struktur kerangka kovalen. Hal ini menyebabkan protein terdenaturasi. Deret asam amino protein tersebut tetap utuh setelah terdenaturasi, namun aktivitas biologisnya menjadi rusak sehingga protein tidak dapat melakukan fungsinya. Sedangkan aktivitas flavonoid kemungkinan disebabkan oleh kemampuannya untuk membentuk kompleks dengan protein ekstraseluler dan terlarut, dan dengan dinding sel. Flavonoid yang bersifat lipofilik mungkin juga akan merusak membran mikroba (Naim, 2004).
28
tidak mau makan dan megap-megap di permukaan atau diam lesu di dasar kolam. Pernyataan tersebut dapat menjelaskan pasifnya ikan kontrol positif ketika dilakukan uji refleks. Sedangkan pada kontrol negatif, ikan terlihat normal nafsu makannya sampai akhir perlakuan, kecuali pada hari ke-0 ketika dinjeksikan PBS ikan terlihat menurun sedikit nafsu makannya yang diduga karena stress akibat masuknya benda asing (PBS) ke dalam tubuhnya dan luka yang diakibatkan oleh spuid. Ikan juga terlihat sangat responsif menjauhi sumber tepukan pada uji refleks.
Pada perlakuan pencegahan, hilangnya nafsu makan ikan terjadi sampai kira-kira hari ke-2, setelah itu ikan mulai meningkat kembali nafsu makannya sampai akhir perlakuan. Hal ini menunjukkan bahwa injeksi sari jeruk nipis dapat mengembalikan nafsu makan ikan, karena bila dibandingkan dengan kontrol positif, ikan perlakuan pencegahan nafsu makannya lebih cepat kembali normal. Sedangkan pada perlakuan pengobatan, respon makan ikan tidak jauh berbeda dengan kontrol positif. Nafsu makan ikan baru membaik kira-kira pada hari ke-6. hal ini dapat disebabkan oleh adanya penyuntikan jeruk nipis 2 hari setelah dilakukan penyuntikan bakteri, sehingga ikan mengalami stress berlipat ganda.
Tingginya nafsu makan ikan pada kontrol negatif menyebabkan pertambahan bobot ikan juga besar, yaitu 87.27%. Menurut Abdullah (2008), semakin besar konsumsi pakan maka semakin besar kesempatan ikan tersebut untuk memperoleh nutrien (karbohidrat, lemak, protein, vitamin dan mineral). Ditambah lagi hasil uji refleks yang baik menunjukkan ikan sehat sehingga ikan dapat tumbuh secara optimal.
29
perlakuan pencegahan dan pengobatan, pertambahan bobotnya sebesar 40.16% dan 37.66%. Nilai ini lebih kecil dibandingkan kontrol positif, diduga karena pengaruh pH asam dari sari jeruk nipis. Talbot (1985) dalam Hasan (2000) mengatakan bahwa di dalam saluran pencernaan ikan, makanan dicerna dan kemudian diserap melalui dinding usus dan masuk ke dalam sistem peredaran darah. Usus ikan menghasilkan enzim proteolitik yang bekerja pada pH antara 8 – 8.5 (Huisman, 1987 dalam Hasan, 2000). Nilai pH rendah dari sari jeruk nipis diduga menghambat proses penyerapan makanan pada usus, sehingga pertambahan bobot ikan ikut terhambat. Walaupun demikian, nilai pertambahan bobot perlakuan pencegahan dan pengobatan tidak berbeda nyata dengan kontrol positif (Lampiran 10).
Gejala klinis yang terlihat pada ikan yang terinfeksi A. hydrophila umumnya dimulai dengan peradangan, hiperemia pada sirip dan daerah bekas suntikan, lalu berkembang menjadi nekrosis atau kerusakan jaringan dan akhirnya menjadi tukak. Kematian ikan juga terjadi ketika ikan masih berada dalam tahap peradangan. Menurut Angka et al., (2004), hal ini terjadi karena adanya toksin A. hydrophila yang menyebabkan hemolisis darah, kemungkinan hemolisis ini yang menyebabkan kematian walaupun kelainan klinis yang tampak dari luar karena peradangan. Reaksi radang merupakan reaksi untuk mencegah masuknya mikroorganisme di sekitar tempat infeksi. Selain itu, pada proses peradangan juga terjadi reaksi antara fibrinogen dan faktor-faktor penggumpal lainnya dalam darah dan membentuk jaringan fibrin untuk mencegah keluarnya cairan tubuh dan mencegah masuknya benda asing ke dalam tubuh (Anderson, 1974 dalam Snieszko dan Axelrod, 1971). Dengan pemberian uji tantang melalui injeksi, maka antigen (A. hydrophila) akan langsung menembus lapisan mukus dan sistem pertahanan non spesifik, langsung masuk ke pembuluh darah dan jaringan. Hal ini berakibat terjadinya reaksi kekebalan yang hebat, terutama pada daerah bekas injeksi (Darmanto, 2003).
30
pertahanan non spesifik antara lain adalah mukus, epidermis, dermis dan sisik. Menurut Darmanto (2003), sistem pertahanan ini bersifat permanen (selalu ada) dan tidak perlu dirangsang terlebih dahulu, sehingga sering menentukan suatu jenis ikan lebih tahan terhadap patogen dibanding jenis ikan lainnya. Pada pertahanan spesifik organ-organ yang berperan antara lain ginjal, limpa dan timus (Anderson, 1974 dalam Hanafi, 2006). Sistem pertahanan spesifik disebut juga sebagai sistem pertahanan humoral, dimana pada pertahanan ini yang berperan adalah antibodi. Terbentuknya antibodi spesifik dimulai dari masuknya suatu antigen ke dalam tubuh ikan, kemudian antigen tersebut difagosit oleh makrofag. Selanjutnya makrofag mengirim pesan ke limfosit sehingga memberikan respon melalui poliferasi dan memproduksi antibodi yang spesifik sesuai dengan antigen yang memberikan rangsangan (Anderson, 1974 dalam Darmanto, 2003). Sistem pertahanan tersebut disamping menghancurkan patogen juga akan mengaktifkan sistem memori, sehingga apabila ada serangan kembali oleh patogen yang sama akan segera direspon lebih cepat dari serangan pertama (Darmanto, 2003).
Pada kontrol positif hari ke-1 pasca infeksi A. hydrophila ikan mengalami radang dengan diameter yang cukup besar (Lampiran 11), kemudian berkembang menjadi tukak rata-rata pada hari ke-3. Empat ekor ikan mengalami kematian pada kontrol positif. Munro (1982) dalam Hanafi (2006) mengatakan bahwa endotoksin atau lipopolisakarida (LPS) dari bakteri Gram negatif adalah toksis karena dapat menginduksi berbagai kondisi patologi termasuk shock, hemoragi, fever dan kematian.
31
Pada perlakuan pencegahan, hari pertama pasca infeksi A. hydrophila ikan mengalami radang dengan diameter yang lebih kecil dibandingkan kontrol positif (Lampiran 11). Kemudian hanya 5 ekor ikan yang berkembang menjadi tukak, 3 ekor ikan mengalami peradangan sampai akhir penelitian, 4 ekor ikan mengalami penyembuhan, bahkan 3 ekor ikan terlihat normal atau tidak mengalami gejala klinis pasca infeksi A. hydrophila. Menurut Abdullah (2008), infeksi A. hydrophila berkembang cepat dalam waktu 24 jam setelah infeksi, sehingga pertahanan awal yang baik sangat penting untuk mencegah serangan infeksi penyakit. Daya tahan alami memungkinkan suatu hewan menjadi terbebas dari serangan patogen karena tidak adanya jaringan spesifik atau reseptor seluler bagi kolonisasi patogen, atau tidak mampu mendukung syarat-syarat optimum baik dari sisi kecukupan nutrisi maupun lingkungan bagi pertumbuhan patogen (Normalina, 2007). Adanya flavonoid pada sari jeruk nipis diduga berperan penting dalam pencegahan penyakit MAS pada ikan lele. Flavonoid bersifat antiinflamasi sehingga dapat mengurangi peradangan serta membantu mengurangi rasa sakit bila terjadi pendarahan atau pembengkakan pada luka. Flavonoid juga mampu meningkatkan kerja sistem imun karena leukosit sebagai pemakan benda asing lebih cepat dihasilkan dan sistem limfe lebih cepat dihasilkan (Angka et al., 2004). Trisbiantara (2008) mengemukakan bahwa kandungan vitamin C yang tinggi dari jeruk nipis sangat berguna sebagai antioksidan dan meningkatkan daya tahan tubuh sehingga kuman-kuman patogen (kuman yang dapat menyebabkan timbulnya penyakit) dapat dimatikan oleh tubuh. Vitamin A di dalamnya dapat meningkatkan daya tahan kulit terhadap infeksi dan protein yang berguna untuk memperbaiki jaringan tubuh yang mengalami kerusakan ataupun memperbaharui jaringan yang sudah tua.
32
adanya stressor berupa penyuntikan 2 kali (penyuntikan bakteri dan sari jeruk nipis) dalam waktu yang relatif singkat, sehingga ikan mengalami kematian. Walupun begitu, terdapat pula 2 ekor ikan yang mengalami penyembuhan total setelah disuntikan sari jeruk nipis.
Pengamatan organ dalam menunjukkan bahwa pada kontrol positif hati terlihat berwarna merah kekuningan dan membengkak, ginjal merah tua kehitaman dan membengkak, empedu berwarna kuning dan limpa merah kecoklatan dan membengkak. Menurut Oliver et al., (1981) dalam Taufik (2001) patogen A. hydrophila disamping memakan dan merusak jaringan organ tubuh juga mengeluarkan toksin yang disebarkan ke seluruh tubuh melalui aliran darah sehingga menyebabkan hemolisis dan pecahnya pembuluh darah yang mengakibatkan warna kemerahan pada tubuh ikan. Penampakan pada organ dalam perlakuan pengobatan mirip dengan kontrol positif, ginjal terlihat berwarna merah tua, hati merah sedikit pucat, empedu hijau kekuningan dan limpa berwarna merah kecoklatan. Sedangkan pada kontrol negatif organ dalam terlihat normal, ginjal dan hati berwarna merah kecoklatan, limpa berwarna merah tua dan empedu terlihat hijau kebiruan. Organ dalam pada pencegahan terlihat mendekati kontrol negatif, ginjal terlihat berwarna merah tua kecoklatan, hati terlihat merah gelap, limpa terlihat berwarna merah gelap dan empedu berwarna hijau kebiruan. Hal ini dapat menggambarkan jeruk nipis yang diinjeksikan pada ikan dapat mencegah rusaknya organ dalam akibat infeksi A. hydrophila. Vitamin A yang terkandung di dalam jeruk nipis dapat meningkatkan daya tahan kulit terhadap infeksi dan protein yang berguna untuk memperbaiki jaringan tubuh yang mengalami kerusakan ataupun memperbaharui jaringan yang sudah tua (Trisbiantara, 2008).
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Jeruk nipis Citrus aurantifolia secara in vitro berpotensi sebagai antibakteri terhadap bakteri Aeromonas hydrophila. Dosis sari jeruk nipis 5% efektif dan efisien dalam menghambat pertumbuhan A. hydrophila dengan rata-rata zona hambat sebesar 7.8 mm.
Dari hasil uji in vivo, didapatkan kesimpulan bahwa perlakuan pencegahan dengan dosis sari jeruk nipis 5% berpotensi mencegah infeksi bakteri A. hydrophila pada ikan lele dumbo. Sedangkan perlakuan pengobatan dengan dosis 10% tidak berpotensi untuk mengobati infeksi bakteri A. hydrophila pada ikan lele dumbo.
5.2 Saran
Saran yang dapat diberikan dari hasil penelitian ini adalah sebagai berikut : 1. Perlu dilakukan penelitian lebih lanjut dengan mengamati parameter gambaran
darah
2. Mengkombinasikan sari jeruk nipis dengan bahan alami lain yang memiliki efek sinergis dalam mengendalikan infeksi bakteri A. hydrophila.
DAFTAR PUSTAKA
Abdullah Y. 2008. Efektivitas Ekstrak Daun Paci-paci Leucas lavandulaefolia
untuk Pencegahan dan Pengobatan Infeksi Penyakit MAS Motile Aeromonad Septicaemia Ditinjau dari Patologi Makro dan Haematologi Ikan Lele Dumbo Clarias sp. [Skripsi]. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Adina AB, Handoko FF, Setyarini II, Sulistyorini E. 2008. Jeruk Nipis. http://ccrcfarmasiugm.wordpress.com/ensikl