PENGARUH PENEPUNGAN, PEREBUSAN, PERENDAMAN
ASAM, DAN FERMENTASI TERHADAP KOMPOSISI KIMIA
KACANG MERAH (
Phaseolus vulgaris
L.)
VEGA WIDYA KARISMA
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Pengaruh Penepungan, Perebusan, Perendaman Asam, dan Fermentasi Terhadap Komposisi Kimia Kacang Merah (Phaseolus vulgaris L.)” adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 13 Juni 2014
Vega Widya Karisma
ABSTRAK
VEGA WIDYA KARISMA. Pengaruh Penepungan, Perebusan, Perendaman Asam, dan Fermentasi Terhadap Komposisi Kimia Kacang Merah (Phaseolus vulgaris L.). Dibimbing oleh FERI KUSNANDAR dan ANTUNG SIMA FIRLIEYANTI.
Proses pengolahan pangan dapat mencakup beberapa tahapan proses, seperti penepungan, pemanasan basah (seperti perebusan), pemanasan kering (penyang-raian), perendaman, fermentasi, dsb. Proses pengolahan yang dilalui dapat mem-pengaruhi perubahan komposisi kimia dari bahan pangan tersebut, dapat mening-kat atau menurun.Penelitian ini bertujuan untuk mempelajari pengaruh pengo-lahan (penepungan, perebusan, perendaman asam, dan fermentasi) terhadap komposisi kimia kacang merah.Tahapan proses perebusan, perendaman, dan fermentasi biasanya digunakan dalam proses pembuatan tempe. Komposisi kimia yang dianalisis mencakup kadar air, protein kasar, protein terlarut, kandungan asam amino, isoflavon, antitripsin dan oligosakarida kacang merah. Secara keseluruhan semua proses pengolahan tersebut menyebabkan peningkatan kadar air, protein kasar, protein terlarut, komposisi asam amino dan kandungan isoflavon kacang merah. Penurunan yang terjadi adalah kadar abu, lemak, karbo-hidrat, antitripsin dan oligosakarida (stakiosa dan rafinosa). Proses fermentasi sangat berpengaruh signifikan terhadap komposisi kimia kacang merah terutama kandungan protein, protein terlarut dan asam aminonya. Proses fermentasi menu-runkan kandungan antitripsin dan oligosakarida.
ABSTRACT
VEGA WIDYA KARISMA. The Effect of Grinding, Boiling, Acid Soaking and Fermentation Process on Chemical Composition of Red Kidney Bean (Phaseolus vulgaris L.). Supervised byFERI KUSNANDAR and ANTUNG SIMA FIRLIEYANTI.
Food processing are including a several process stage, likes grinding, wet heating (boiling), dry heating (frying without oil), soaking, fermentation, etc. Food processing influences change of a chemical composition of foods, it can be increased or decreased. The aims of this research are to study the effect of pro-cessing (grinding, boiling, acid soaking, and fermentation process) to the chemical composition of red bean. Boiling, soaking, and fermentation are usually used for making tempeh. The chemical composition that is analized including moisture content, crude protein, soluble protein, amino acid content, isoflavone, antitrypsin and oligosaccharide of red bean. Overall, food processing caused the increament of moisture content, crude protein, soluble protein, amino acid and isoflavone content on red kidney bean. On the other hand, processing caused decreasing of ash content, fat, carbohydrate, antitrypsin and oligosaccharide (stachiose and rafinose) content of red bean. Fermentation process had significant effect on chemical composition of red bean especially its crude protein, soluble protein, and amino acid content. This process also caused significant reduction of antitrypsin and oligosaccharide of red bean.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PENGARUH PENEPUNGAN PEREBUSAN, PERENDAMAN
ASAM, DAN FERMENTASI TERHADAP KOMPOSISI KIMIA
KACANG MERAH (
Phaseolus vulgaris
L.)
VEGA WIDYA KARISMA
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga skripsi tugas akhir ini berhasil selesai tepat waktu.Penelitian dilakukan di Laboratorium Departemen Ilmu dan Teknologi Pangan, IPB. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 ini ialah tempe kacang merah sebagai substitusi kacang kedelai, dengan judul “Pengaruh Perebusan, Perendaman Asam, dan Fermentasi Terhadap Kom-posisi Kimia Kacang Merah (Phaseolus vulgaris L.)”.
Pada kesempatan ini penulis mengucapkan terima kasih kepada papa, mama, Mbak Tyas, Mbak Christine, dan mas Jefri yang selalu memberi dukungan, doa, dan kasih sayang. Terima kasih penulis ucapkan kepada Bapak Dr.Ir. Feri Kusnandar,MSc dan Ibu Antung Sima Firlieyanti,STP,MSc selaku dosen pem-bimbing yang selalu memberikan saran, pengarahan, dan pem-bimbingan selama kuliah, penelitian, hingga tersususnnya skripsi ini. Terima kasih kepada Bapak Dr.Ir. Eko Hari Purnomo,MSc atas saran dan kesediaan waktu sebagai dosen penguji. Terima kasih kepada Ibu Didah Nur Faridah atas saran dan masukan selama analisis. Terima kasih kepada rekan selama penelitian Tim Kacang Merah Alexander Tommy W, Andini Giwang K, Barli Abiyoga K, Dewi Ratna Sari, Isnaini Ayu L, Lulu Maknun dan Munirah yang telah bekerjasama dengan sangat baik. Terima kasih untuk laboran dan teknisi Bapak Rojak, Bapak Gatot, Bapak Sobirin, Bapak Yahya, Bapak Junaedi, Bapak Wahid, Mas Edi, Mbak Ririn, Mbak Irin, Mbak Nurul yang membantu dalam kegiatan analisis. Terima kasih teman-teman ITP 47 yang saya sayangi dan saya banggakan khususnya Livia, Raditya, Stephanie, Nesya, Cindy, Suma, Fanny, Nurul, Agisio serta rekan-rekan yang tidak bisa saya sebutkan satu per satu. Terima kasih kepada teman-teman Keluarga Mahasiswa Katolik IPB (KeMaKI) dan teman-teman Himpunan Keluarga Rembang di Bogor (HKRB) angkatan 47 khususnya untuk Lutfia. Terima kasih kepada staf UPT ITP dan Departemen ITP Mbak Tika, Mbak May, Ibu Novie, serta Ibu dan Bapak UPT lainnya untuk informasi dan pelayanan yang ramah.
Bogor,13 Juli 2014
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODOLOGI PENELITIAN 3
Bahan 3
Alat 3
Metode Penelitian 3
HASIL DAN PEMBAHASAN 11
Karakteristik Fisik Tempe Kacang Merah dan Tepung Kacang Merah 11 Karakteristik Kimia Kacang Merah dengan Berbagai Perlakuan 11
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
DAFTAR TABEL
1 Karakteristik fisik kacang merah dan tepung kacang merah 11 2 Kandungan proksimat kacang merah dengan berbagai perlakuan 12 3 Komposisi asam amino kacang merah dengan berbagai perlakuan 15
DAFTAR GAMBAR
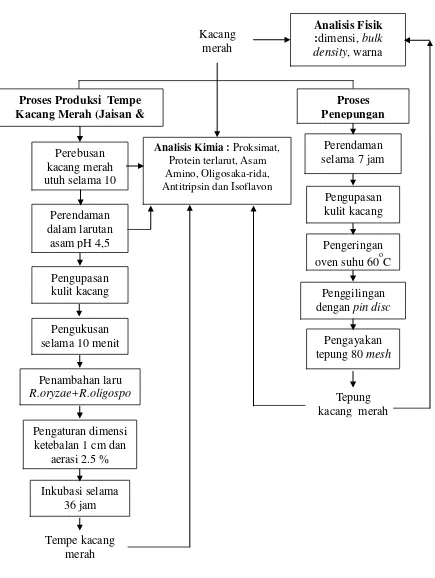
1 Diagram alir penelitian tempe kacang merah 5
2 Kadar protein terlarut kacang merah dengan berbagai perlakuan 14 3 Kadar isoflavon kacang merah dengan berbagai perlakuan 17 4 Kadar antitripsin kacang merah dengan berbagai perlakuan 19 5 Kadar oligosakarida kacang merah dengan berbagai perlakuan 20 6 Kromatogram monosakarida tempe kacang merah fermentasi 36 jam 21
DAFTAR LAMPIRAN
1 Densitas kamba sampel kacang merah dan tepung kacang merah 27 2 Dimensi panjang dan dimensi ketebalan kacang merah utuh 27 3 Kadar proksimat kacang merah berbagai ukuran dalam basis basah 27 4 Uji One Way ANOVA dan uji lanjut Duncan kadar air kacang merah
berbagai perlakuan 28
5 Uji One Way ANOVA dan uji lanjut Duncan kadar abu kacang merah
berbagai perlakuan 28
6 Uji One Way ANOVA dan uji lanjut Duncan kadar protein kacang
merah berbagai perlakuan 29
7 Uji One Way ANOVA dan uji lanjut Duncan kadar lemak merah
berbagai perlakuan 29
8 Uji One Way ANOVA dan uji lanjut Duncan kadar karbohidrat merah
berbagai perlakuan 30
9 Kurva standar BSA 30
10 Data protein terlarut kacang merah dengan berbagai perlakuan 31 11 Data kadar isoflavon kacang merah dengan berbagai perlakuan 31 12 Data kadar antitripsin kacang merah dengan berbagai perlakuan 32 13 Data kadar stakiosa dan rafinosa kacang merah dengan berbagai
PENDAHULUAN
Latar Belakang
Kacang merah merupakan salah satu jenis kacang yang banyak terdapat di masyarakat dan sering dikonsumsi dalam bentuk sop/sayuran. Di Indonesia kacang merah kering umumnya dimasak menjadi bubur, sup atau campuran sayur, nasi tim dan es kacang merah. Selain itu kacang merah juga dapat diolah menjadi selai untukpengisi kue. Kacang merah merupakan kacang-kacangan yang memi-liki gizi yang tinggi, yaitu kaya akan asam folat, kalsium, karbohidrat kompleks, serat, dan protein. Kandungan karbohidrat kompleks dan serat yang tinggi dalam kacang merah membuatnya dapat menurunkan kadar kolesterol darah (Ekawati 1990). Kadar indeks glikemik kacang merah juga termasuk rendah sehingga menguntungkan penderita diabetes dan menurunkan risiko timbulnya diabetes (Aulina 2010). Kacang merah kering merupakan sumber karbohidrat kompleks, serat makanan (fiber), vitamin B (terutama asam folat dan vitamin B6), fosfor, mangan, besi, thiamin, dan protein (Agustina et al 2013).Seperti jenis kacang-kacang lainnya kacang-kacang merah juga mengandung senyawa anti nutrisi yang menyebabkan pengurangan nilai gizi seperti asam fitat, oligosakarida, hema-glutinin atau lektin dan antitripsin (Ekawati 1999).
Kacang merah belum banyak dimanfaatkan dalam proses produksi pangan di industri. Di antara potensi pemanfaatan kacang merah adalah untuk pembuatan tempe.Tempe merupakan sumber protein nabati yang cukup tinggi. Kandungan gizi tempe mampu bersaing dengan bahan pangan hewani seperti daging, ikan dan telur baik dari segi protein, vitamin maupun karbohidrat. Dengan komposisi gizi yang baik dari kacang merah, maka tempe kacang kedelai akan menjadi sumber zat gizi nabati yang sangat baik.
Dwinaningsih (2010) membedakan tempe non kedelai berdasarkan bahan bakunya, yaitu tempe leguminosa nonkedelai dan tempe non leguminosa. Tempe non leguminosa biasanya dapat terbuat dari ampas tahu, gandum, sorgum, cam-puran beras dan kedelai, tempe bongkrek, ampas kacang dan ampas tela. Tempe leguminosa non kedelai dapat dibuat dari kacang kedelai hitam, kacang hijau, tempe bengkuk, tempe kecipir, tempe lamtoro dan tempe dari kacang merah.
Proses pembuatan tempe melewati beberapa tahapan, yaitu proses peren-daman, perebusan, dan fermentasi. Proses pengolahan pangan tersebut dapat umumnya mempengaruhi karakteristik kimia yang terkandung dalam bahan pangan tersebut, baik perubahan yang diinginkan maupun tidak diinginkan. Pengaruh yang diinginkan di antaranya inaktivasi senyawa antinutrisi(seperti anti-tripsin), dan oligosakarida, sedangkan yang tidak diinginkan adalah penurunan kandungan zat gizi (protein, lemak, karbohidrat dan komponen mikro).
2
peningkatan karena pengaruh asam (Susi 2012). Selain itu asam menyebabkan beberapa zat anti gizi mengalami penurunan. Pengolahan pangan dengan cara fermentasi juga dapat meningkatkan kandungan protein dan jumlah asam amino dalam produk fermentasi (Almasyhuri et al 1999).Selain itu beberapa senyawa anti nutrisi maupun oligosakarida akan mengalami penurunan akibat proses fermentasi (Susi 2012)
Berbagai proses pengolahan tersebut diduga juga berpengaruh terhadap komposisi kimia kacang merah. Penelitian mengenai pengaruh proses perebusan, perendaman asam, dan fermentasi yang umum diterapkan dalam proses pem-buatan tempe terhadap komposisi kimia kacamg merah yang meliputi kandungan protein, protein terlarut, asam amino, isoflavon, antitripsin dan oligosakarida kacang merah selama proses pengolahan.Proses penepungan juga sering dila-kukan untuk tujuan kacang merah sebagai ingredien pangan, sehingga perlu juga diketahui pengaruh proses tersebutterhadap perubahan komposisi kimianya.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menentukan pengaruh penepungan, perebusan, perendaman asam, dan fermentasi terhadap komposisi kimia kacang merah, yang meliputi kandungan protein, protein terlarut, asam amino, isoflavon, antitripsin dan oligosakarida kacang merah.
Manfaat Penelitian
3
METODOLOGI PENELITIAN
Bahan dan Alat
Bahan
Bahan baku yang digunakan dalam penelitian ini adalah kacang merah yang diperoleh dari pasar Anyar Bogor. Bahan lainnya adalah air bersih, laru tempe,dan asam asetat 25%.Bahan-bahan yang digunakan untuk analisis di antaranya adalah heksana, larutan HCl 25 %, H2SO4 pekat, HgO, K2SO4, Larutan 60% NaOH - 5%
Na2S2O3.5H2O, H2BO3 jenuh, HCl 0.02 N, NaOH 2 N, hexana, etanol
pro-analysis 70%, air destilata, indikator metilen red, metilen blue, indikator phenof-talein, standard glukosa, standar stakiosa, standar asam amino, standar isoflavon genistein, standar isoflavon daidzin, standar isoflavon glycitein, standar tripsin inhibitor, standar BSA (Bovine Serum Albumin), larutan BAPNA (N-α -benzoyl-l-arginine-p-nitronalidine), asam asetat, aquabidestilata, acetonitril pro-analysis, metanol pro-analysis, asam asetat glacial pro-analysis, regenerated membran 0.45µm, dietil eter, TCA (Trichloro asetic acid), reagen Bradford, AccQ-Fluor Borate.
Alat
Alat-alat yang digunakan dalam proses pembuatan tempe dan penepungan antara lain panci, kompor, baskom, plastik, alat pelubang, oven, disc mili dan pin disc mill.Sedangkan peralatan yang digunakan dalam analisis kimia antara lain alat gelas, cawan aluminium (bertutup), desikator berisi bahan pengering, oven listrik, neraca analitik, termometer, penjepit cawan (gegep), cawan porselen, tanur listrik, kertas saring, alat ekstraksi Soxhlet (kondensor dan pemanas listrik), pemanas Kjeldahl lengkap, alat destilasi lengkap, buret, pengaduk magnetik, HPLC (High Performance Liquid Chromatography), spektrofotometer, sentrifuse,
alat penyaring dengan ukuran membran 22µm, Amino Acid Analyzer, kolom C18
reverse phase, dan kolom Zorbax Carbohydrate.
Metode Penelitian
Penelitian ini mencakup analisis kimia dari kacang merah setelah melewati setiap tahapan proses pembuatan tempe (perendaman asam, perebusan dan fermentasi) dan setelah proses. Tahapan penelitian secara skematis disajikan pada Gambar 1.
Persiapan Sampel dari Tahap Proses Pembuatan Tempe
4
(laru tempe). Kacang merah diberi laru yang mengandung kapang R. oryzae dan R. Oligosporus, kemudian dimasukkan ke dalam wadah plastik yang diberi lubang aerasi 2.5%. Ketebalan tempe adalah 1 cm dengan tingkat aerasi 2.5% (Munirah, 2013). Inkubasi tempe dilakukan selama 36 jam. Pada setiap tahapan proses pembuatan tempe tersebut (setelah proses perebusan, perendamandan dan fermen-tasi) dilakukan pengambilan sampel untuk analisis kimia.
Persiapan Sampel Tepung Kacang Merah
Dalam persiapan sampel lainnya, dilakukan proses penepungan kacang merah dengan mengacu Ningrum (2012) yang dimodifikasi. Proses penepungan diawali dengan perendaman kacang merah dalam air selama 7 jam. Selama perendaman air masuk kedalam matriks kacang merah sehingga kacang lebih mengembang. Kacang merah kemudian dikupas kulitnya dengan alat pengupas kulit, lalu dikeringkan dalam oven (60oC selama 3 jam). Kacang merah kering selanjutnya digiling dengan pin disc mill lalu, diayak dengan vibrating screen80
mesh. Keseluruhan proses di atas menghasilkan tepung kacang merah dengan ukuran 80 mesh. Tepung yang diperoleh kemudian dilakukan analisis kimia.
AnalisisFisikokimia Kacang Merah
Kacang merah dianalisis sifat fisik (warna, densitas kamba, dimensi) dan komposisi kimia (proksimat, protein terlarut, asam Amino, oligosakarida, anti-tripsin dan isoflavon).
Analisis Tepung Kacang Merah
Tepung kacang merah dianalisis sifat fisik (derajat putih), densitas kamba dan komposisi kimia (proksimat, protein terlarut, asam Amino, oligosakarida, antitripsin dan isoflavon).
Analisis Kacang Merah Setelah Perlakuan Proses Pengolahan
Kacang merah yang telah melewati tahapan proses perebusan, perendaman asam dan fermentasi dianalisis sifat kimianya (proksimat, protein terlarut, asam Amino, oligosakarida, antitripsin dan isoflavon).
Metode Analisis
Warna
Warna sampel kacang merah diukur dengan menggunakan Chromameter
Hunter L*a*b.
Densitas kamba (bulk Density)
Densitas kamba kacang merah diukur dengan cara menimbang contoh yang telah dimasukkan kedalam gelas ukur yang volumenya telah diketahui secara pasti. Sampel dimasukkan ke dalam gelas ukur kemudian diketuk-ketuk sampai tidak terdapat rongga dan ditimbang.Densitas kamba dihitung dengan perbandingan berat sampel dengan volume sampel. Perhitungan densitas kamba dapat diperoleh dengan rumus berikut :
Densitas kamba (gram/ml) = (� )
5
Gambar 1 Diagram alir penelitian tempe kacang merah Pengukusan
6
Dimensi
Analisis dimensi dilakukan dengan mengukur dimensi dari kacang merah utuh dan tempe kacang merah. Analisis dimensi pada kacang merah utuh meliputi panjang, lebar dan diameter kacang merah.
Derajat Putih
Derajat putih tepung kacang merah dilakukan dengan menggunakan White-ness meter.
Kadar Air (SNI 01-2891-1992)
Analisis kadar air dilakukan dengan terlebih dahulu mengeringkan cawan kosong dan tutupnya dalam oven selama 15 menit, setelah itu cawan didinginkan dalam desikator. Cawan yang sudah kering diambil dengan penjepit dan ditim-bang beratnya.Sampel lalu dimasukkan kedalam cawan sebanyak 1-2 gram sampel.Cawan beserta sampel kemudian dikeringkan dalam oven bersuhu 105oC selama 3 jam. Setelah 3 jam cawan diambil dengan penjepit lalu dinginkan dalam desikator dan ditimbang. Kadar air dihitung dengan rumus berikut:
%
Analisis kadar abu dilakukan dengan menggunakan metode pengabuan kering. Tahapan analisis diawali dengan cawan porselen beserta tutupnya dike-ringkan dalam oven bersuhu 105oC selama 15 menit lalu didinginkan dalam desi-kator. Setelah dingin, cawan porselen tersebut ditimbang. Sebanyak 2-3 gram sampel dimasukkan ke dalam cawan dan ditimbang kembali. Sampel dimasukkan ke dalam tanur listrik dan dipanaskan pada suhu maksimum 550oC sampai pengabuan sempurna. Setelah pengabuan selesai, sampel dan cawan didinginkan di dalam desikator lalu ditimbang. Kadar abu dihitung dalam basis kering dengan rumus berikut:
Kadar Protein Kasar (AOAC 960.52 yang Dimodifikasi)
Sebanyak 0.1-0.25 gram contoh ditimbang di dalam labu Kjeldahl, lalu ditambahkan 1.0 + 0.1 gram K2SO4, 40 + 10 mL HgO, dan 2.0 + 0.1 mL H2SO4,
7
Kjeldahl dibilas dengan 1-2 mL air destilata, kemudian air cuciannya dimasukan ke dalam alat destilasi, pembilasan dilakukan sebanyak 5-6 kali. Tambahkan 8-10 mL larutan 60% NaOH – 5% Na2S2O3.5H2O ke dalam alat destilasi.
Di bawah kondensor diletakkan erlenmeyer yang berisi 5 mL larutan H3BO3
jenuh dan 2-4 tetes indikator (campuran 2 bagian 0.2% metilen red dan 1 bagian 0.2% metilen blue dalam etanol 95%). Ujung tabung kondensor harus terendam dalam larutan H3BO3, kemudian dilakukan destilasi sehingga diperoleh sekitar 15
mL destilat. Destilat yang diperoleh kemudian dititrasi dengan HCl 0.02 N sam-pai terjadi perubahan warna dari hijau menjadi abu-abu. Kadar protein kasar
dimana: V(volum, ml); N(normalitas, N); Fk(faktor konversi, 6,25) Kadar Lemak (SNI 01-2891-1992)
Metode yang umum digunakan dalam analisis lemak adalah metode eks-traksi soxhlet. Untuk produk kering sampel perlu dilakukan hidrolisis terlebih dahulu karena matriks bahan yang cukup komplek.Labu lemak yang akan diguna-kan dikeringdiguna-kan dalam oven, kemudian didingindiguna-kan dalam desikator lalu ditim-bang. Sebanyak 1-2 gram contoh ditambahkan dengan 20 mL air dan 30 mL HCl 25%. Kemudian dididihkan selama 15 menit dalam gelas piala yang ditutup gelas arloji.Kemudian larutan tersebut disaring dengan kertas saring, selanjutnya dicuci dengan air panas hingga pH netral bila diuji dengan kertas lakmus.Kertas saring tersebut dikeringkan dalam oven bersuhu 105°C hingga kering.
Kertas saring yang telah dikeringkan dimasukkan ke dalam selongsong dengan sumbat kapas.Selongsong tersebut kemudian dimasukan ke dalam alat ekstraksi soxhlet dan dihubungkan dengan kondensor dan labu lemak. Alat kondensor diletakkan di atasnya dan labu lemak diletakkan di bawahnya. Pelarut hexana dimasukan ke dalam labu lemak secukupnya. Selanjutnya dilakukan ekstraksi selama 6 jam. Pelarut yang ada dalam labu lemak didestilasi dan ditam-pung kembali. Kemudian labu lemak yang berisi lemak hasil ekstraksi dikering-kan dalam oven pada suhu 105oC, didinginkan dalam desikator dan ditim-bang.Pengeringan diulangi hingga mencapai berat tetap.Kadar lemak dihitung dengan rumus berikut:
8
Kadar Karbohidrat
Kadar karbohidrat dihitung dengan by difference, yaitu 100%- kadar air, abu, lemak dan protein.
Kadar Protein Terlarut (Bradford 1976)
Analisis protein terlarut menggunakan metode Bradford dengan standar BSA (Bovine Serum Albumin). Sebanyak 1-2 gram ditimbang dan ditambahkan 5 mLakuades, kemudian sampel disaring dengan menggunakan kertas saring atau kapas.Ekstrak diambil sebanyak 1 ml dan ditambahkan 1 mLakuades dan1 mL TCA (Trichloro asetic acid)10%. Kemudian sampel disentrifuse selama 10 menit (3000 rpm,25oC). Setelah terpisah, supernatan dibuang sehingga hanya tersisa endapannya saja lalu pada endapan tersebut ditambahkan 2 mLetill eter dan disentrifuse kembali selama 10 menit (3000 rpm,25oC). Sampel yang telah terpi-sahdibiarkan semalaman pada suhu ruanghinggaetl eter menguap seluruh-nya.Sampel yang telah keringditambahkan 5 mL akuades dan5 mL reagent Brad-ford.Sampel divortex dan diamkan selama 30 menit agar reaksi pembentukan warna lebih sempurna, setelah itu ukur absorbansi sampel pada panjang gelom-bang 595 nm.Kadar protein terlarut ditentukan dengan menggunakan kurva standar BSA.
Kadar Asam Amino (Nollet dan Leo ML 1996, Waters AccQ 1993)
Sebanyak 0.1 gram sampel ditambahkan dengan 5 mL HCl 6N, kemudian vortex. Biarkan reaksi hidrolisis tersebut terjadi selama 22 jam pada suhu 110oC. Setelah itu, sampel didinginkan, kemudian dipindahkan ke dalam labu takar 50 mL dan ditera dengan menggunakan aquabidest. Hasil tersebut disaring dengan filter berukuran 0.45 µm. Filtrat dipipet sebanyak 500 µL dan direaksikan dengan 40 µ L AABA dan 460 µ L aquabidest. Sebanyak 10 µ L larutan hasil reaksi terse-but diambil, dan direaksikan dengan menggunakan AccQ-Fluor Borate sebanyak 70 µ L, vortex, lalu ditambahkan dengan 20 µL reagent fluor A, vortex, dan didiamkan selama 1 menit. Hasilnya diinkubasi pada suhu 55oC selama 10 menit.Sampel siap diinjeksi ke dalam HPLC.
HPLC yang digunakan dilengkapi dengan peralatan sebagai berikut:(a) Detektor: Fluorescense dengan eksitasi pada panjang gelombang 250 nm dan emisi pada panjang gelombang 395 nm; (b) Kolom: AccQtag column berukuran 3.9x150 mm, suhu 37oC; (c) Fase gerak: campuran Acetonitril 60% - AccqTag Eluent A dengan sistem gradient komposisi, dan kecepatan aliran 1.0 mL/menit; (d) Standar internal: AABA.
Perhitungan asam amino pada sampel dapat dilakukan dengan rumus : Kadar Asam Amino (mg/kg) =A std/ AABA std × Vs × FP × Cstd
A spl/ AABA × Wspl
9
Kadar Isoflavon (AOAC 2001)
Sebanyak 50 gram sampel dimasukkan ke dalam erlenmeyer 250 mL, kemudian ditambahkan larutan ekstraksi, yaitu metanol dan air dengan perban-dingan 80:20.Erlenmeyer kemudian ditutup dan dimasukkan ke dalam waterbath shaker bersuhu 65oC selama 2 jam.Setelah itu didinginkan, kemudian sebanyak 3 mL NaOH 2N ditambahkan, dan dikocok selama 10 menit. Asam asetat glasial ditambahkan sebanyak 3 mL, kemudian dikocok kembali dan dipindahkan secara kuantitatif ke dalam labu ukur 50 mL, tera dengan menggunakan larutan ekstraksi. Hasil tersebut disaring dengan kertas saring Whatman No. 42.Setelah disaring, filtrat dipipet sebanyak 5 mL ke dalam labu ukur 10 mL.Selanjutnya, sebanyak 4 mL aquabidest ditambahkan, kemudian tera dengan metanol dan air dengan perbandingan 1:1, kocok.Sampel tersebut disentrifuge dengan kecepatan 7000 rpm selama 5 menit. Supernatan yang dihasilkan kemudian dimasukkan ke dalam vial dan siap utnuk diinjeksi ke dalam HPLC.
Analisis isoflavon dilakukan dengan menggunakan HPLC yang dilengkapi dengan peralatan sebagai berikut: (a) Detektor:UV Detector dengan panjang gelombang 260 nm; (b) Kolom:C18 Reverse Phase dengan ukuran 200 x 2.1 mm, laju aliran sebesar 0.4 mL/menit dan volume injeksi sebesar 20µl; (c) Fase gerak:FG 1 dengan komposisi air:metanol:asam asetat glasial = 88:10:2 sedangkan FG 2 dengan komposisi metanol:asam asetat glasial = 98:2; (d) Standar:daidzin, genistin, daidzein, genistein dan glycitein.
Perhitungan kadar isoflavon total dilakukan dengan menggunakan rumus: Kadar Isoflavon (µg/g) = (A spl/A std × Cstd × FP)
W
dimana:Aspl (luas area peak sampel); Astd (luas area peak standar); Cstd (kon-sentrasi standar); FP (faktor pengencer); W (bobot sampel, gram)
Kadar Antitripsin (Kakade et al. 1974)
Sebanyak 1 gram tepung sampel dilarutkan dalam 50 mL NaOH 0.01 N. Sampel diaduk selama 3 jam dengan menggunakan magnetic strirer. Hasil dari pengadukan tersebut kemudian dilakukan sentrifuge dengan kecepatan 5000 rpm selama 10 menit pada suhu 5oC .Supernatan kemudian diencerkan dengan air destilata.Sejumlah ekstrak (0; 0.2; 0.4; 0.6; 0.8; 1.0 mL) dipipet ke dalam tabug reaksi.Masing-masing ekstrak ditambahkan dengan air destilata hingga volume mencapai 2 mL.Sebanyak 2 mL larutan tripsin ditambahkan ke dalam masing-masing tabung reaksi.Setelah itu, dipanaskan dalam penangas air bersuhu 37oC selama 5 menit.Setelah dingin, larutan BAPNA bersuhu 37oC ditambahkan sebanyak 5 mL, kemudian vortex. Ekstrak dipanaskan kembali menggunakan penangas air dengan suhu 37oC selama 10 menit. Setelah 10 menit, sebanyak 1 mL asam asetat 30% ditambahkan ke dalam masing-masing tabung, vortex. Bila larutan yang dihasilkan berwarna jernih, maka pengukuran absorbansi dengan spektofotometer langsung dilakukan dengan panjang gelombang 410 nm.Bila sampel yang dihasilkan keruh, maka perlu dilakukan penyaringan terlebih dahulu dengan menggunakan kertas saring.
10
TUI : � � −
0,01 x 10
Kadar Oligosakarida (Wang et al 2007 yang modifikasi)
Sebanyak 2 gram sampel tempe yang telah ditepungkan dihilangkan lemak-nya dengan penambahan heksana, kemudian dilakukan pengadukan dengan menggunakan magnetic stirer selama 3 jam. Sampel yang telah diekstrak kemu-dian disaring dengan kertas Whatman#41.Residu secara kuantitatif dipindahkan ke dalam gelas piala. Oligosakarida diekstrak dengan penambahan etanol pro analysis 70% sebanyak 20 ml, lalu dipanaskan dalam waterbath dengan suhu 70oC selama 1 jam. Saring ekstrak, lalu dimasukan dalam labu takar 25 mL, tera dengan etanol pro analysis 70%. Hasil ekstrak sebelum diinjeksi ke dalam HPLC, disaring terlebih dahulu dengan menggunakan penyaring membran berukuran 0.45 µm , sampel dimasukan dalam vial tertutup. Setelah itu sampel ditambahkan Natrium Azide sebanyak 10% dari volume dalam vial. Sampel kemudian siap untuk diinjeksi.
Analisis oligosakarida dilakukan dengan menggunakan HPLC yang dileng-kapi dengan peralatan sebagai berikut: (a) Degasser (model G1322A Agilent), pompa solvent (model G1310A Agilent), dan detektot Refractive Index (model G1362A Agilent); (b) Kolom HPLC untuk karbohidrat (ZORBAX Carbohydrate Analysis Columns) berukuran 150 mm x 4.6 mm x 5µm (Agilent) yang dilapisi dengan 3-aminopropilsilan pada partikel silica; (c) Fase gerak:campuran Aceto-nitril:air (75:25) dengan kecepatan alir 1.4 mL/menit; (d) Standar pengujian oligosakarida:rafinosa (Sigma) dan stakiosa (Sigma).
Kadar oligosakarida dihitung dengan rumus sebagai berikut:
�
� × Vs× Cstd
Kadar Gula =
W(bk)
11
HASIL DAN PEMBAHASAN
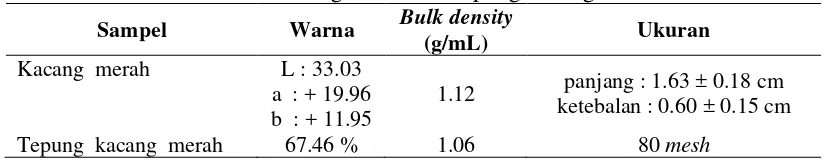
Karakteristik Fisik Kacang Merah dan Tepung Kacang Merah
Karakteristik fisik terhadap sampel kacang merah dan tepung kacang merah yang warna, densitas kamba dan ukuran disajikan pada Tabel 1. Pengukuran warna dilakukan terhadap sampel kacang merah utuh dan tepung kacang merah. Pengukuran warna kacang merah dilakukan pada permukaan kacang. Karena kulit kacang berwarna merah, maka nilai L tidak terlalu tinggi (33.03). Nilai notasi a* pada kacang merah adalah sebesar +19.96, yang menunjukkan warna kromatik dominan merah. Nilai notasi b* pada kacang merah sebesar +11.95, yang menunjukkan warna kromatik dominan kuning. Nilai a* lebih besar dibandingkan nilai b*, yang berarti warna dominan pada kacang adalah merah. Pengukuran warna pada tepung kacang dengan Whiteness Meter menunjukkan nilai sebesar 67.46%. Derajat putih ini tergolong rendah yang berarti warna tepung tidak terlalu putih.
Tabel 1 Karakteristik fisik kacang merah dan tepung kacang merah Sampel Warna Bulk density
(g/mL) Ukuran
Kacang merah L : 33.03
a : + 19.96 b : + 11.95
1.12 panjang : 1.63 ± 0.18 cm
ketebalan : 0.60 ± 0.15 cm
Tepung kacang merah 67.46 % 1.06 80 mesh
Kacang merah memiliki densitas kamba sebesar 1.12 g/mL sedangkan tepung kacang merah sebesar 1.06 g/mL. Densitas kamba kacang merah dan tepung kacang merah lebih besar dibandingkan dengan air. kamba menunjukkan tingkat kepadatan didalam ruang (volume) pada berat tertentu. Kacang merah dan tepung kacang merah memiliki ukuran panjang 1.63 ± 0.18 cm dan tebal 0.60 ± 0.15 cm. Tepung kacang merah disaring dengan vibrating screen 80 mesh, sehingga ukurannya 80 mesh atau kurang.
Karakteristik Kimia Kacang Merah dengan Berbagai Perlakuan
Kandungan Proksimat
12
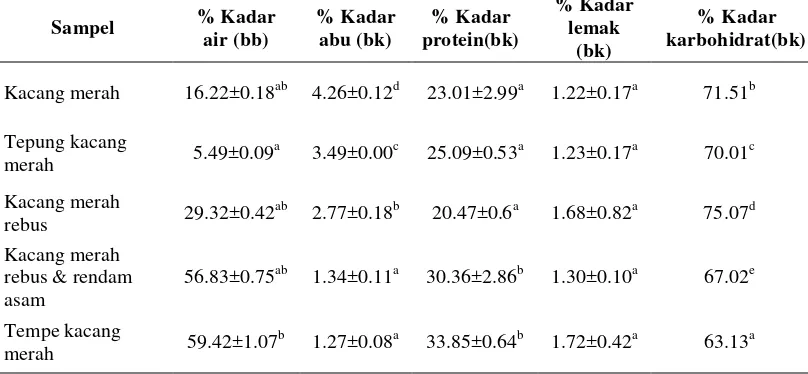
Tabel 2 Kandungan proksimat kacang merah dengan berbagai perlakuan
Sampel % Kadar
Keterangan: Notasi berbeda menunjukkan sampel berbeda nyata pada taraf signifikan 0.05
Kadar air kacang merah utuh sebesar 16.22% yang tidak jauh berbeda dengan literatur sebesar 17.70% (bb) (Hartayanie dan Retnaningsih 2006). Tepung kacang merah memiliki kadar air yang tergolong rendah yaitu 5.49%. Hasil ini sesuai dengan standar kadar air tepung yang ditetapkan oleh SNI maksimal 14.50%(bk) (SNI 3751 2009). Perlakuan perebusan pada kacang dan perendaman asam menunjukkan peningkatan yang cukup besar terhadap kadar air kacang merah, yaitu berturut-turut 29.32% dan 56.83%. Selama proses perlakuan dari kacang kering yang direbus dan selanjutnya direndam asam, menunjukkan bahwa air akan masuk dan mengisi matriks kacang sehingga kadar airnya akan semakin meningkat. Selama perebusan dan dilanjutkan perendaman, dinding sel kacang merah akan melunak dan menyerap air. Hal inilah yang menyebabkan kadar airnya sangat tinggi (Pangastuti HA et al 2013). Selain itu kadar air kacang merah semakin meningkat setelah dilakukan proses fermentasi menjadi tempe kacang merah (59.42%). Menurut Susi (2012) selama proses fermentasi terjadi pembe-basan uap air oleh kapang sebagai hasil penguraian senyawa kompleks yang terhalang oleh plastik kemasan. Dengan adanya fermentasi maka perombakan makromolekul akan semakin intensif sehingga kadar air tempe akan meningkat. Stainkraus (1996) menyatakan bahwa selama fermentasi, air dihasilkan sebagai hasil dari pemecahan karbohidrat oleh mikroorganisme. Berdasarkan uji statistik diperoleh adanya perlakuan penepungan dan fermentasi berpengaruh nyata terha-dap kadar air kacang merah, hasil uji statistik terha-dapat dilihat pada Lampiran 4.
13
statistik menunjukkan adanya perlakuan penepungan, perebusan, perebusan dan perendaman asam serta fermentasi berpengaruh nyata terhadap kadar abu dari kacang merah. Hasil uji statistik dapat dilihat pada Lampiran 5.
Kacang merah memiliki kandungan protein yang cukup tinggi yaitu sebesar 23.0%. Kadar protein pada tepung kacang merah sedikit meningkat menjadi 25.1%. Hal ini dikarenakan protein dalam tepung tidak terikat oleh matriks kacang merah sehingga akan diperoleh kadar protein yang lebih tinggi jika dibandingkan kacang merah utuh. Adanya perlakuan perebusan menurunkan kadar protein dalam kacang merah rebus sehingga diperoleh hasil sebesar 20.47%, namun pada perlakuan perebusan dan perendaman pada larutan asam kadar protein basis kering justru lebih besar yaitu 30.36%. Hal ini dikarenakan pengukuran pada basis kering mengeluarkan air yang terdapat pada bahan sehingga diperoleh kadar protein yang lebih besar. Protein tempe kacang merah meningkat menjadi 33.85%. Selama proses fermentasi, kapang akan menghasilkan enzim proteolitik yang mengurai protein menjadi asam amino sehingga nitrogen terlarutnya semakin meningkat (Susi 2012). Secara statistik diperoleh bahwa adanya perlakuan pene-pungan dan perebusan menghasilkan kadar protein yang berbeda nyata dengan perlakuan perendaman asam dan fermentasi pada taraf α 0.05. Hasil uji statistik dapat dilihat pada Lampiran 6.
Kadar lemak pada sampel kacang merah dan tempe kacang merah menun-jukkan kadar lemak yang sangat rendah yaitu berkisaran antara 1.22-1.72%. Hal yang dilaporkan oleh Astawan (2009), yaitu sebesar 1.5%. Adanya proses perlakuan terhadap kacang merah mulai dari penepungan, perebusan, perebusan yang dilanjutkan perendaman asam serta fermentasi menjadi tempe kacang merah menghasilkan kadar lemak yang fluktuatif yang secara statistik tidak berbeda nyata pada taraf signifikansi 0.05, hasil uji statistik dapat dilihat pada Lampiran 7.
14
Kadar Protein Terlarut
Protein dapat dibedakan berdasarkan kelarutannya, yaitu proteinlarut air dan protein tidak larut air. Jenis protein yang dapat larut air adalah albumin dan protamin, sedangkan yang tidak larut air antara lain globulin, glutelin, glidialin dan histon. Protein larut air(protein terlarut) umumnya adalahkelompok oligo-peptida dan terdapat rantai kurang dari 10 asam amino serta memiliki sifat yang mudah diserap oleh pencernaan. Protein terlarut juga menunjukkan kemampuan protein dapat larut didalam air sehingga protein tersebut akan mudah dicerna (Purwoko dan Handajani 2007).
Kadar protein terlarut dalam kacang merah dengan berbagai perlakuan dapat dilihat pada Gambar 2. Kadar protein kacang merah memiliki tingkat kelarutan protein yang sangat kecil, yaitu 0.71 g/100g. Pada kacang merah kandungan protein didalamnya masih terikat oleh matriks dari bahan sehingga sangat sedikit sekali protein yang dapat larut kedalam air. Pada perlakuan penepungan terjadi peningkatan protein terlarut pada tepung kacang merah menjadi sebesar 29.07 g/100g. Pada tepung kacang merah kandungan protein sudah terlepas dari bahan pangan sehingga memungkinkan akan banyak kandungan protein yang dapat larut. Tahapan proses mulai dari perebusan, perendaman asam dan fermentasi menye-babkan peningkatan kadar protein terlarut dari kacang merah. Pada proses fermentasi juga terlihat terjadi peningkatan protein yang cukup drastis dari tempe kacang merah. Kadar protein terlarut untuk perlakuan perebusan sebesar 1.79 g/100g sedangkan pada tahapan perebusan dan perendaman asam kadar protein terlarut bertambah menjadi 14.66 g/100g. Pada tempe kacang merah, kadar protein terlarut mencapai 51.92 g/100g.
Gambar 2 Kadar protein terlarut kacang merah dengan berbagai perlakuan Adanya tahapan proses di atas menyebabkan semakin mudahnya protein terlarut sehingga protein lebih mudah dicerna. Proses fermentasi menyebabkan peningkatan protein terlarut.Menurut Susi (2012) proses fermentasi dengan menumbuhkan kapang menghasilkan enzim proteolitik. Enzim proteolitik ini menguraikan protein menjadi asam amino sehingga nitrogen terlarutnya semakin
15
meningkat. Selama proses fermentasi terjadi peningkatan jumlah N yang larut dalam air dan padatan larut air. Selama fermentasi kandungan protein kasar hanya sedikit mengalami peningkatan, tetapi kelarutannya meningkat hingga50% (Deliani 2008). Tempe yang mengalami proses fermentasi mudah dicerna, karena banyak kandungan bahan yang mudah larut.
Asam Amino
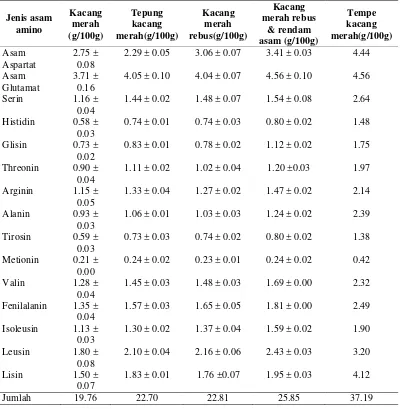
Protein tersusun dari berbagai jenis asam amino yang masing-masing dihubungkan dengan suatu ikatan peptida.Mutu suatu protein dinilai dari perban-dingan asam-asam amino yang tekandung dalam protein tersebut (Windrati et al
2010). Komposisi 15 asam amino dari kacang merah dengan berbagai perlakuan dapat dilihat pada Tabel 3.
Tabel 3 Komposisi asam amino kacang merah dengan berbagai perlakuan
16
tidak dapat dibentuk oleh tubuh, sedangkan asam glutamat dan asam aspartat merupakan komponen asam amino non-essensial. Menurut Astawan (2009) kandungan asam amino yang dominan pada kacang merah adalah asam amino leusin dan lisin. Adanya asam amino asam glutamat dan asam aspartat dapat mempengaruhi flavor yang terbentuk dari suatu protein, flavor yang terbentuk juga tergantung dari jenis asam amino yang lainnya (Susi 2012).
Secara keseluruhan kadar asam amino pada kacang merah dengan berbagai perlakuan mengalami peningkatan. Perlakuan penepungan, perebusan, perebusan dan perendaman asam serta fermentasi menjadi tempe kacang merah secara kese-luruhan meningkatkan kadar asam amino. Jumlah asam amino pada kacang merah sebesar 19.76 g/100g, jumlah tersebut mengalami peningkatan setelah proses penepungan menjadi 22.70 g/100g, pada proses perebusan jumlahnya meningkat menjadi 22.81 g/100g dan pada proses perendaman asam menjadi 25.85 g/100g. Pada perlakuan fermentasi jumlah asam amino meningkat menjadi 37.19 g/100g. Hal ini menunjukkan adanya korelasi antara kandungan protein dengan komposisi asam amino kacang merah. Semakin banyak kandungan asam amino akan meningkatkan kadar dari suatu protein (Supirman et al 2013).
Pada proses fermentasi tempe kacang merah terlihat bahwa kandungan asam aminonya semakin meningkat dan masih didominasi oleh asam amino jenis asam aspartat sebesar 4.44 g/100g, asam glutamat sebesar 4.56 g/100g, asam amino leusin sebesar 3.20 g/100g dan asam amino lisin sebesar 4.12g/100g. Selama proses fermentasi enzim yang dihasilkan kapang tempe meningkat dan memecah komponen protein menjadi komponen yang sederhana seperti peptida dan asam amino. Enzim protease yang dihasilkan oleh kapang ini menghidrolisis peptida protein menjadi peptida sederhana dan asam amino (Susi 2012). Oleh sebab itu kandungan asam amino pada sampel tempe kacang merah lebih tinggi diban-dingkan sampel kacang merah sebelum fermentasi.
Menurut Windrati et al (2010) pada prinsipnya suatu protein dapat menye-diakan asam amino essensial dalam suatu perbandingan yang menyamai kebu-tuhan manusia. Sebaliknya protein yang kekurangan satu atau lebih asam amino essensial mempunyai mutu yang rendah. Jumlah asam amino non-essensial tidak bisa dijadikan sebagai pedoman karena asam amino ini dapat disintesis oleh tubuh. Asam amino yang biasanya sangat kurang dalam suatu bahan pangan inilah yang disebut dengan asam amino pembatas. Berdasarkan data analisis diperoleh asam amino pembatas dalam kacang merah dengan berbagai perlakuan terdapat pada asam amino metionin, dimana asam amino ini memiliki kadar yang paling rendah. Kadar asam amino metionin pada kacang merah sampai proses menjadi tempe kacang merah berkisar antara 0.21-0.42 g/100g. Tejasari (2005) menyatakan bahwa asam amino pembatas yang sering terdapat dalam kacang-kacangan serta biji-bijian adalah asam amino metionin dan sistein.
Kadar Isoflavon
17
profil lipid serum pada tubuh.Walaupun kandungan isoflavonnya kurang tinggi jika dibandingkan kacang kedelai, tetapi kandungan isoflavon kacang merah sekitar 3741 µg/yang sudah cukup untuk mencegah peningkatan radikal bebas.Menurut Astuti (2008) Kandungan isoflavon pada jenis kacang-kacangan sama dengan kandungan isoflavon yang terdapat pada kedelai yang terdiri dari 4 bentuk yaitu (1) bentuk aglikon (non gula): genistein, daidzein dan glycitein; (2) bentuk glikosida: daidzin, genistin dan glisitin; (3) bentuk asetilglikosida dan (4) bentuk malonilglikosida. Bentuk glikosida dipertahankan oleh tanaman sebagai bentuk inaktif sehingga disimpan dalam bentuk antioksidan.Bentuk aglikon biasanya terdapat pada produk olahan kacang maupun produk fermentasinya. Kandungan isoflavon pada kedelai paling banyak terdapat pada bagian biji kedelai, khususnya bagian hipokotil (germ) yang akan tumbuh menjadi tanaman. Sebagian lagi terdapat dalam kotiledon yang akan menjadi daun pertama.
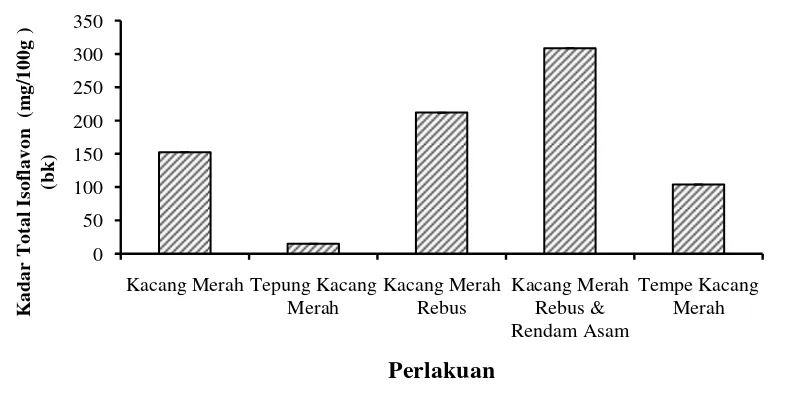
Kadar total isoflavon dari kacang merah dengan berbagai perlakuan dapat dilihat pada Gambar 3. Hasil pengujian kadar total isoflavon kacang merah menunjukkan kadar isoflavon yang dimiliki oleh kacang merah ini cukup tinggi yaitu sebesar 152.76 mg/100g. Namun apabila dibandingkan dengan kadar total isoflavon kedelai, kadar total isoflavon kacang merah memang lebih rendah. Kadar total isoflavon kedelai sendiri berkisar antara 47-422 mg/100g basis kering (Raharjo 1996). Pada sampel tepung kacang merah diperoleh hasil kadar total isoflavon yang sangat rendah yaitu sebesar 15.25 mg/100g. Proses penepungan diawali dengan pengeringan biji kacang merah, yangdapat menyebabkan isoflavon yang terkandung didalam bahan hilang karena panas. Menurut Utari et al (2010) isoflavon rentan terhadap panas yang tinggi, kandungan isoflavon semakin turun dengan peningkatan proses pemasakan karena terjadi kerusakan atau pemindahan isoflavon dari bahan dasar.
Gambar 3 Kadar isoflavon kacang merah dengan berbagai perlakuan Perlakuan proses pada kacang merah yang direbus dan kacang merah rebus dilanjutkan perendaman asam menyebabkan terjadinya peningkatan kadar total isoflavon. Kadar total isoflavon masing-masing sampel tersebut sebesar 212.03
18
mg/100g untuk kacang merah rebus dan 308.69 mg/100g pada kacang merah rebus dan rendam asam. Terjadi peningkatan yang cukup signifikan dari kacang merah utuh sampai proses perebusan dan perendaman asam. Pada kacang merah utuh isoflavon yang terdapat didalamnya berupa bentuk glikosida yang mengikat satu molekul gula. Ketika terjadi proses pengolahan bentuk glikosida terdregadasi menjadi bentuk aglikon yang bebas yang dihasilkan oleh pelepasan glukosa dari glikosida (Astuti 2008). Senyawa aglikon ini memiliki aktivitas yang lebih tinggi dan daya serap ke tubuh yang relatif lebih tinggi pula (Istiani 2010). Selain itu selama proses perendaman asam, terjadi hidrolisis isoflavon glikosida menjadi isoflavon aglikon karena adanya aktivitas enzim β-glukosidase dari mikroba yang hidup disekitar kacang merah. Enzim ini bekerja optimum pada suasana asam sehingga diperoleh isoflavon yang lebih banyak pada proses perendaman asam (Purwoko 2004). Hal inilah yang menyebabkan peningkatan kadar total isoflavon dari kacang merah utuh, kacang merah yang direbus dan selanjutnya pada kacang merah yang direbus dan direndam asam.
Proses fermentasi juga menyebabkan peningkatan total isoflavon,sehingga kadar isoflavon pada tempe akan lebih tinggi jika dibandingkan isoflavon yang terdapat dalam biji. Hal ini dikarenakan pada produk hasil fermentasi, isoflavon dalam bentuk aglikon lebih dominan lagi (Coward et al 1998). Tingginya kandungan isoflavon pada tempe disebabkan oleh adanya aktivitas kapang Rhizo-pus sp. dalam fermentasi tempe (Retno et al 2012). Berdasarkan hasil pengujian kadar total isoflavon yang dimiliki tempe kacang merah diperoleh bahwa setelah proses fermentasi menyebabkan kandungan total isoflavon yang menurun.
Kadar total isoflavon pada tempe kacang merah sebesar 104.08 mg/100g. Hasil ini jauh lebih rendah jika dibandingkan dengan kadar total isoflavon pada kacang merah utuh. Proses fermentasi seharusnya meningkatkan kadar total isoflavon dari tempe, namum berdasarkan pengujian justru diperoleh kadar yang menurun. Menurut Istiani (2010) selama proses fermentasi kemungkinan terjadi aktivitas mikroba yang bervariasi dan pembentukan aglikon berhenti, sehingga kadar total isoflavon pada tempe selama proses fermentasi menurun. Menurut Nakajima et al (2005) lamanya waktu fermentasi dapat menurunkan kadar total isoflavon (bentuk glukosida dan aglikon) dari tempe, namun kadar aglikon meng-alami sedikit peningkatan. Berdasarkan hasil ini maka dapat dikatan bahwa proses fermentasi memang dapat meningkatkan kadar isoflavon tempe, namun apabila waktu fermentasi terlalu lama justru dapat menurunkan kadar isoflavonnya.
Kadar Antitripsin
Antitripsin (trypsin inhibitor) merupakan suatu senyawa yang dapat meng-hambat aktivitas enzim proteolitik dalam mencerna protein (Palupi et al 2007). Antitripsin ini merupakan salah satu zat antinutrisi yang terdapat pada kacang-kacangan maupun olahannya. Antitripsindapat menghambat pencernan protein sehingga menghambat pertumbuhan (Astawan 2009). Kacang merah mentah mengandung antitripsin yang tinggi, sehingga tidak dianjurkan mengkonsumsi kacang merah tanpa proses pengolahan.
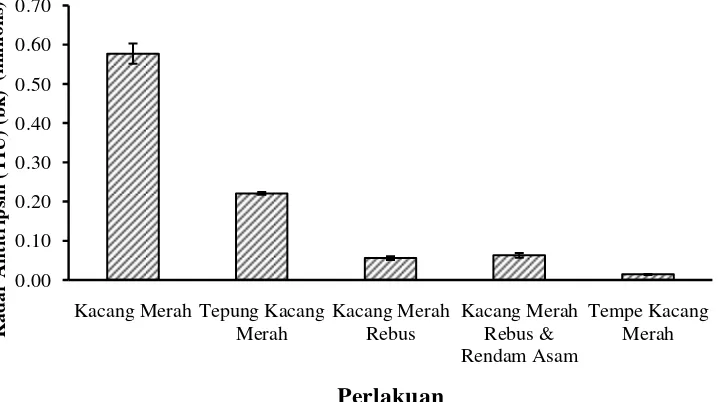
19
adanya perlakuan proses pengolahan terhadap kacang merah menunjukkan adanya penurunan kadar antitripsin. Kadar antitripsin menurun seiring dengan proses perlakuan pada kacang merah. Pada sampel tepung kacang merah diperoleh kadar antitripsin sebesar 220292.43 TUI, sedangkan pada sampel kacang merah rebus kadar antitripsin menurun lagi menjadi 55186.05 TUI. Pada perlakuan kacang merah rebus dan dilanjutkan perendaman asam, kadar antitripsin justru mengalami sedikit peningkatan menjadi 62169.33 TUI. Namun pada proses fermentasi kacang merah menjadi tempe kacang merah kadar antitripsin menurun drastis menjadi 13526.37 TUI. Kadar antitripsin pada kacang-kacangan dapat diinaktivasi oleh perlakuan panas dan dilakukan perendaman sehingga dapat mempertahankan nilai gizi pada protein kacang (Santoso 2005). Adanya fermentasi juga dapat mendegradasi senyawa penghambat seperti antitripsin sehingga aktivitasnya akan semakin menurun (Sujatmiko et al 2010).
Gambar 4 Kadar antitripsin kacang merah dengan berbagai perlakuan
Kadar Oligosakarida
Oligosakarida termasuk salah satu komponen yang terdapat pada kacang-kacangan.Menurut Weijers et al (2008) oligosakarida merupakan bagian dari polimer karbohidrat dengan berat molekul yang rendah dan mengandung molekul gula dengan derajat polimerisasi sntara 3 hingga 10.Komponan oligosakarida pada bahan pangan digolongkan kedalam zat anti gizi.Hal ini dikarenakan oligosa-karida menimbulkan gas seperti metana dan hidrogen dalam tubuh yang dapat menyebabkan flatulensi.Gas tersebut merupakan metabolisme bakteri pada saluran pencerrnaa (Ravindran 1990).Namun dengan berkembangnya teknologi dan ilmu pengetahuan, oligosakarida mulai dilihat sebagai komponen yang bermanfaat bagi kesehatan. Keberadaan oligosakarida dapat dimanfaatkan oleh bakteri yang menguntungkan didalam saluran pencernaan (Liying et al 2003). Komponen oligosakarida yang terdapat pada kacang merah mirip dengan kacang kedelai yaitu kelompok galaktooligosakarida (GOS) yaitu oligosakarida yang mengandung stakiosa dan rafinosa (Saifatah 2011). Menurut Kurniasih et al
20
dalam bentuk stakiosa dan rafinosa.Oleh karena itu analisis oligosakarida ini menggunakan standar gula stakiosa dan rafinosa yang menunjukkan kandungan oligosakarida yang terdapat pada sampel kacang merah dengan berbagai perlakuan.
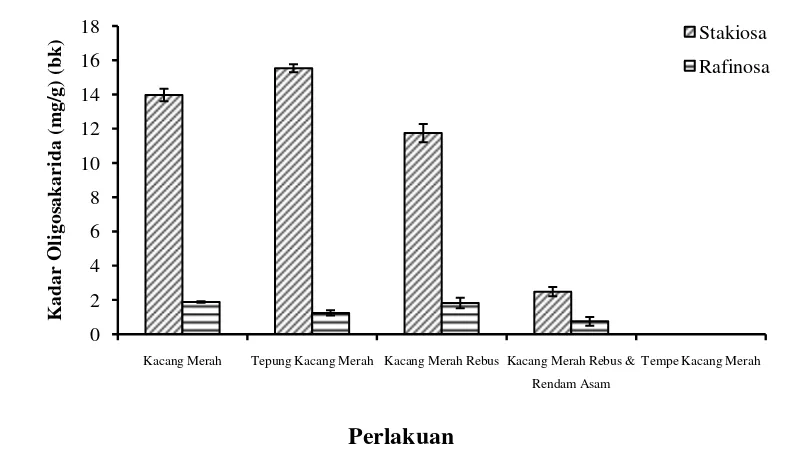
Gambar 5 menunjukkan kadar oligosakarida (stakiosa dan rafinosa) pada kacang merah dengan berbagai perlakuan.Kadar stakiosa pada kacag merah lebih tinggi jika dibandingkan kadar rafinosa. Secara keseluruhan adanya proses perla-kuan terhadap kacang merah menyebabkan penurunan pada kadar stakiosa dan rafinosa. Kadar stakiosa yang dimiliki oleh kacang merah sebesar 13.97 mg/g.Kadar stakiosa ini lebih rendah apabila dibandingkan dengan kadar stakiosa yang dimiliki kacang kedelai sebesar 41.30 mg/g (Wang et al 2003). Pada proses penepungan kacang merah diperoleh kadar stakiosa yang meningkat menjadi 15.53 mg/g. Sampel tepung memiliki kadar karbohidrat yang tinggi sehingga ada kemungkinan kadar stakiosa didalamnya akan tinggi pula. Selanjutnya pada perlakuan perebusan kacang, perendaman dalam asam sampai fermentasi terlihat penurunan kadar stakiosa yang signifikan. Kadar stakiosa sampel kacang merah rebus sebesar 11.74 mg/g, kadar stakiosa ini semakin menurun pada kacang merah rebus yang direndam asam menjadi sebesar 2.48 mg/g. Hal ini menunjukkan bahwa dengan adanya proses perebusan dan dilanjutkan dengan perendaman asam kadar stakiosa kacang merah semakin berkurang.
Gambar 5 Kadar oligosakarida kacang merah dengan berbagai perlakuan
Hal yang sama juga terlihat pada kadar rafinosa yang terdapat pada sampel kacang merah dengan berbagai perlakuan. Berdasarkan pengujian diperoleh kadar rafinosa dari sampel kacang merah utuh sebesar 1.88 mg/g.Hasil ini juga tergolong rendah apabila dibandingkan dengan kadar rafinosa yang terdapat dalam kacang kedelai yaitu sebesar 7.5 mg/g (Wang et al 2003). Kadar rafinosa juga
21
Namun pada sampel kacang merah yang direbus kadar rafinosa mengalami peningkatan menjadi1.82 mg/g. Pada sampel kacang merah yang direbus dan dilanjutkan perendaman asam kadar rafinosa berkurang menjadi 0.74 mg/g. Secara keseluruhan adanya proses perlakuan dapat menurunkan kadar rafinosa dari kacang merah.
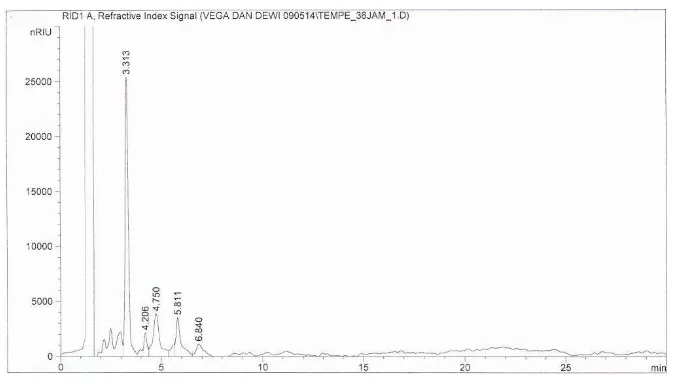
Perlakuan fermentasi kacang merah menjadi tempe kacang merah menun-jukkan bahwa proses fermentasi dapat menghilangkan kandungan oligosakarida baik stakiosa maupun rafinosa. Hasil analisis dengan HPLC juga menunjukkan adanya peak stakiosa danrafinosa (Gambar 6). Fermentasi mengakibatkan kandungan karbohidrat dari sampel kacang merah terhidrolisis menjadi gula-gula sederhana seperti monosakarida.
22
SIMPULAN DAN SARAN
Simpulan
Perlakuan proses pengolahan seperti penepungan, perebusan, perendaman asam, dan fermentasi mempengaruhi komposisi kimia kacang merah. Secara keseluruhan adanya proses pengolahan menyebabkan peningkatan kadar air, kandungan protein kasar, protein terlarut, asam amino dan kandungan isoflavon kacang merah. Selain itu proses pengolahan juga menyebabkan penurunan kadar abu, kadar lemak, karbohidrat, antitripsin dan kandungan oligosakarida (stakiosa dan rafinosa) kacang merah. Proses fermentasi sangat berpengaruh terhadap komposisi kimia kacang merah terutama kandungan protein, protein terlarut dan asam amino. Proses ini juga memberikan penurunan signifikan terhadap antitripsin dan oligosakarida dari kacang merah. Berdasarkan hasil terlihat bahwa oligosakarida terhidrolisis menjadi gula-gula sederhana karena pengaruh fermen-tasi.
Saran
23
DAFTAR PUSTAKA
[AOAC]. Association of Official Analytical Chemists. 1995. Official Methods of Analysis. 960.52
[AOAC]. Association of Official Analytical Chemists. 2001. Official Methods of Analysis. 10th ed. Arlington: AOAC.
[BSN]. Badan Standar Nasional. 1992. SNI 01-2891-1992. Cara Uji Makanan dan Minuman. Badan Standar Nasional.
[BSN]. Badan Standardisasi Nasional. 2009.Kadar Air Tepung. [terhubung berkala] http://www.bsn.go.id (diakses tanggal 3 Maret 2014).
Agustina N, Waluyo S, Warji, Amrin. 2013. Pengaruh suhu perendaman terhadap koefisien difusi dan sifat fisik kacang merah (Phaseolus vulgaris L). Jurnal Teknik Pertanian Lampung 2 (1) : 35-42.
Almasyhuri, Ridwan E, Yuniati H, dan Hermana. 1999. Pengaruh fermentasi terhadap kandungan protein dan komposisi asam aminodalam singkong.Jurnal Panel Gizi Makanan 22 : 55-61.
Analytical HPLC Application, Analysis of Amino Acid by High-Performance Liquid Chromatography, Merck.
Astawan M. 2009. Sehat Dengan Hidangan Kacang dan Biji-bijian. Jakarta: Penebar Swadaya.
Astuti S. 2008. Isoflavon kedelai dan potensinya sebagai penangkap radikal bebas.
Jurnal Teknologi Industri dan Hasil Pertanian 13 (2): 126-136.
Aulina R. 2010. Pengaruh pemberian diet kacang merah dengan berbagai proses pemasakan terhadap kadar glukosa darah [skripsi]. Semarang(ID): Univer-sitas Diponegoro.
Bradford MM. 1976. A rapid and sensitive method of the quantitation of micro-gram quantities of protein utilizing the principle of protein-dye binding.
Journal of Analytical Biochemistry 76: 248-254.
Coward L, Barnes N, Setchell KDR, Barnes S. 1993. Genestein and deidzein and their β-glicide conjugates antitumor isoflavones in soybeans food from American and Asian diets. J.Agri. Food. Chem. 41:1961-1967.
Deliani. 2008. Pengaruh lama fermentasi terhadap kadar protein, lemak, kompo-sisi asam lemak dan asam fitat pada pembuatan tempe [skripsi]. Medan(ID): Universitas Sumatra Utara.
Departemen Kesehatan Republik Indonesia.1992. Kandungan Gizi KacangJakarta. Dwinaningsih EA. 2010. Karakteristik kimia dan sensori tempe dengan variasai bahan baku kedelai atau beras dan penambahan angkak serta variasi lama fermentasi [skripsi]. Surakarta(ID): Universitas Sebelas Maret.
24
Hartayanie L dan Retnaningsih C. 2006. Pemanfaatan tepung kacang merah sebagai pengganti tepung terigu dalam pembuatan roti tawar: evaluasi sifat fisikokimia dan sensori. Jurusan Teknologi Pangan, Fakultas Teknologi Pertanian, Universitas Soegijapranata Semarang.
Istiani Y. 2010. Karakterisasi senyawa bioaktif isoflavon dan uji antioksidan dari ekstrak etanol tempe berbahan baku koro pedang (Canavaliaensiformis) [tesis]. Surakarta (ID): Universitas Sebelas Maret.
Jaisan C. 2013. Optimizing of fermentation process of red bean tempe [skripsi]. Bogor (ID): Institut Pertanian Bogor
Kakade M.L, J.J Rackis, J. E. McGhee dan G. Pusky. 1974. Determination of trypsin inhibitor activity of soy products: a collaborative analysis of improved procedure. Cereal Chem. 51: 376-382.
Kurniasih N dan Rosahdi TD. 2013. Perbandingan efektifitas sari kacang merah dan kacang hijau sebagai media pertumbuhan Lactobacillus acidophilus.
Prosiding Seminar Nasional Sains dan Teknik Nuklir; 2013 Jul 4; Bandung, Indonesia.
Liying Z, Li D, Qiao S, Johnson EW, Li B, Thacker PA, Han NK. 2013. Effect of stachyose on performance, diarrhea incidence and intestinal bacteria in wealning pigs. Arch Anim Nurt (57) 1-10.
Munirah. 2013. Effect of different aeration area and thickness on physicochemical properties of red kidney beans (Phaseoulus vulgaris L) tempeh [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nakajima N, Nozaki N, Ishihara K, Ishikawa A and Tsuji H. 2005. Analysis of isoflavone content in tempeh, a fermented soybean, and preparation of a new isoflavone-enrich tempeh. Journal Bioscience and Bioengineering 100 (6): 685-687
Ningrum MRB. 2012. Pengembangan produk cake dengan substitusi tepung kacang merah [skripsi]. Bogor (ID): Universitas Negri Yogyakarta.
Nollet, Leo ML. 1996. Handbook of Food Analysis, Amino Acid. CRC Press. Orviyanti G. 2012. Perbedaan pengaruh yoghurt susu, jus kacang merah dan
yoghurt kacang merah terhadap kadar kolesterol LDL dan kolesterol HDL serum pada tikus dislipidemia. [skripsi]. Semarang (ID): Universitas Diponegoro.
Palupi NS, Zakaria FR dan Prangdimurti E. 2007. Metode Evaluasi Efek Negatif Komponen Non Gizi. Modul e-learning ENBP. Bogor : IPB Press.
Pangastuti HA, Affandi DR, Ishartani D. 2013.Karakterisasi sifat fisik dan kimia tepung kacang merah (Phaseolus vulgaris L) dengan beberapa perlakuan pendahuluan.Jurnal Teknosains Pangan 2 (1): 20-29
Purwoko T. 2004. Kandungan isoflavon aglikon pada tempe hasil fermentasi
25
Purwoko dan Handajani. 2007. Kandungan protein kecap manis tanpa fermentasi moromi hail fermentasi Rhizophus oryzae dan R. oligosporus. Jurnal Ilmiah Biodiversity 8 (2): 223-227.
Raharjo S. 1996. Meta-analysis of the distribution of daidzein, genistein, glycitein and their glucosidic conjugates in soy foods. Jurnal Agritek 16 (2).
Ravindran G. 1990. Study on the flatus potential of distary fiber from some legumes. J. Natn. Sci. Coun. Sri langka 18 (2): 127-132.
Retno T, Widyastuti SK dan Suarsana N. 2012. Pengaruh pemberian isoflavon terhadap peroksidasi lipid pada hati tikus normal. Jurnal Indonesia Medicus Veterinus 1 (4): 483-491.
Saifatah L. 2011. Analisis oligosakarida pada dua puluh produk minuman bubuk komersial berbasis kedelai.[skripsi]. Bogor (ID): Institut Pertanian Bogor. Santoso SP. 2005. Teknologi Pengolahan Kedelai (Teori dan Praktek). Malang:
Universitas Widyagama Malang.
Steinkraus KH. 1996 Hanbook of Indigenous Fermented Food, Second Edition Revised and Expanded. New York:Marcel Dekker , Inc.
Sujatmiko B, Sutrisno A dan Sofia E. 2010. Degradasi senyawa tanin, asam fitat, antitripsin dan peningkatan daya cerna protein secara in vitro pada sorgum coklat (Sorgum bicolor L. Moench) dengan metode fermentasi ampok. Universitas Brawijaya.
Supirman, Kartikaningsih H, dan Zaelani K. 2013. Pengaruh perbedaan pH asam jeruk nipis (Citrus auratifolia) dengan pengeringan sinar matahari terhadap kualitas kimia teh alga coklat (Sargassum fillipendula). THPi Student Journal 1 (1): 46-52.
Susi. 2012. Komposisi kimia dan asam amino pada tempe kacang nagara (Vigna unguiculata ssp. Cylindrica). Jurnal Agroscientiae 19 (1): 28-36.
Tejasari. 2005. Nilai Gizi Pangan. Yogyakarta: Graha Ilmu.
Triyono A. 2010. Mempelajari pengaruh penambahan beberapa asam pada proses isolasi protein terhadap tepung protein isolat kacang hijau (Phaseolus radiatus L.). Prosiding Seminar Rekayasa dan Proses; 2010 Agustus 4-5; Subang, Indonesia.
Utari DM, Rimbawan, Riyadi H, Muhilal dan Purwantiyastuti. 2010. Pengaruh pengolahan kedelai menjadi tempe dan pemasakan tempe terhadap kadar isoflavon. Jurnal PGM 33(2):148-153.
Wang Q, Leqin K, Dongmei Y, Bili B, Jianmei J, Tiejin Y. 2007. Change in oligosaccharides during processing of soybean sheet. Asia Pac J Clint Nutr
16(1): 89-94.
Weijers CAGM, Franssen MRC, Visser GM. 2008. Glycosyltransferase catalyzed synthesis of bioactive oligosaccharides. Biotechno Adv 26:436-452.
26
27
Lampiran 1 Densitas kamba sampel kacang merah dan tepung kacang merah Sampel U V sampel
Lampiran 2 Dimensi panjang dan dimensi ketebalan kacang merah utuh
Dimensi Ulangan Rerata ± SD SEM
1 2 3 4 5 6 7 8 9 10
Panjang (cm) 1.6 1.7 1.9 1.9 1.3 1.5 1.7 1.5 1.6 1.6 1.63±0.18 0.13 Ketebalan (cm) 0.6 0.5 0.7 0.5 0.4 0.5 0.7 0.7 0.9 0.5 0.60±0.15 0.11
Lampiran 3 Kadar proksimat kacang merah berbagai perlakuan dalam basis basah
Sampel % Kadar
Kacang merah 16.22±0.10 3.57±0,12 19.28±2.99 1.02±0.17 59.91
Tepung kacang merah 5.49±0.26 3.47±0.00 23.71±0.53 1.16±0.17 66.17
Kacang merah rebus 29.32±0.83 1.96±0.18 14.47±0.64 1.19±0.82 53.06
Kacang merah rebus
& rendam asam 56.83±4.00 0.58±0.11 13.10±2.86 0.56±0.10 28.93
28
Lampiran 4 Uji One Way ANOVA dan uji lanjut Duncan kadar air kacang merah berbagai perlakuan
ANOVA
Sum of Squares df MeanSquare F Sig.
BetweenGroups 3295.569 4 823.892 3.158 .120
Within Groups 1304.423 5 260.885
Total 4599.992 9
Duncan
Perlakuan N Subset for alpha = 0.05
1 2
Tepung kacang merah 2 5.4950
Kacang merah 2 16.2200 16.2200
Kacang merah rebus 2 29.3150 29.3150
Kacang merah rebus &
rendam asam 2 31.8250 31.8250
Tempe kacang merah 2 59.4200
Sig. .176 .051
Keterangan: Subset yang berbeda menunjukkan sampel beda nyata pada α= 0.05
Lampiran 5 Uji One Way ANOVA dan uji lanjut Duncan kadar abu kacang merah berbagai perlakuan
ANOVA Sum of
Squares df Mean Square F Sig.
Between Groups 13.892 4 3.473 254.435 .000
Within Groups .068 5 .014
Total 13.960 9
Duncan
Perlakuan N
Subset for alpha = 0.05
1 2 3 4
Tempe kacang merah 2 1.2700 Kacang merah rebus
dan rendam asam 2 1.3400
Kacang merah rebus 2 2.7700
Tepung kacang merah 2 3.4900
Kacang merah 2 4.2650
Sig. .575 1.000 1.000 1.000
29
Lampiran 6 Uji One Way ANOVA dan uji lanjut Duncan kadar protein kacang merah berbagai perlakuan
ANOVA Sum of
Squares Df Mean Square F Sig.
Between Groups 238.747 4 59.687 16.383 .004
Within Groups 18.217 5 3.643
Total 256.963 9
Duncan
Perlakuan N Subset for alpha = 0.05
1 2
Kacang merah rebus 2 20.4650
Kacang merah 2 23.0150
Tepung kacang merah 2 25.0950 Kacang merah rebus
dan rendam asam 2 30.3600
Tempe kacang merah 2 33.8450
Sig. .065 .127
Keterangan: Subset yang berbeda menunjukkan sampel beda nyata pada α=0.05 Lampiran 7 Uji One Way ANOVA dan uji lanjut Duncan kadar lemak kacang
merah berbagai perlakuan
ANOVA Sum of
Squares Df Mean Square F Sig.
Between Groups .501 4 .125 .706 .621
Within Groups .887 5 .177
Total 1.388 9
Duncan
Perlakuan N
Subset for alpha = 0.05
1
Kacang merah 2 1.2200
Tepung kacang merah 2 1.2300
Kacang merah rebus dan
rendam asam 2 1.3000
Kacang merah rebus 2 1.6800
Tempe kacang merah 2 1.7250
Sig. .296
30
Lampiran 8 Uji One Way ANOVA dan uji lanjut Duncan kadar karbohidrat kacang merah berbagai perlakuan
Keterangan: Subset yang berbeda menunjukkan sampel beda nyata pada α=0.05
Lampiran 9 Kurva standar BSA
Konsentrasi BSA (ppm) Absorbansi
0 0
0 200 400 600 800 1000 1200
31
Lampiran10 Data protein terlarut kacang merah berbagai perlakuan
Sampel Abs
Lampiran 11 Data kadar isoflavon kacang merah berbagai perlakuan
Sampel Kadar
Kacang Merah Rebus 149.86
32
Lampiran 12 Data kadar antitripsin kacang merah dengan berbagai perlakuan
Sampel
Kacang merah 505019 483239.50±
30800.86 5,49
602791.84 576795.77± 25996.06
461460 550799.71
Tepung kacang merah 211611.75 208198.38±
4827.241 16,22
223904.08 220292.43± 5107.65
204785 216680.77
Kacang merah rebus 42432 39005.50±
4845.803 29,32
Tempe kacang merah 4959 5489.00±
749.5332 59,42
12220.31 13526.37± 1847.05
6019 14832.43
33