PENGARUH JENIS INOKULUM DAN WAKTU INKUBASI
TERHADAP SIFAT FISIKO-KIMIA TEMPE KACANG
MERAH (
Phaseolus vulgaris
L.)
LULU MAKNUN
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PETANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Jenis Inokulum dan Waktu Inkubasi Terhadap Sifat Fisiko-Kimia Tempe Kacang Merah (Phaseolus vulgaris L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
Lulu Maknun
ABSTRAK
LULU MAKNUN. Pengaruh Jenis Inokulum dan Waktu Inkubasi Terhadap Sifat Fisiko-Kimia Tempe Kacang Merah (Phaseolus vulgaris L.). Dibimbing oleh SULIANTARI.
Tempe merupakan salah satu pangan yang digemari masyarakat Indonesia dan dikenal sebagai sumber protein. Kacang merah mengandung protein dalam jumlah yang cukup tinggi sehingga memiliki potensi untuk digunakan sebagai bahan baku tempe. Miselium kapang yang tumbuh menyelimuti kacang merah akan membentuk tekstur tempe yang kompak sekaligus bertindak sebagai sumber protein. Penelitian ini menggunakan rancangan percobaan Rancangan Acak Lengkap Faktorial dengan dua faktor yaitu jenis laru dan waktu inkubasi. Pembuatan tempe kacang merah dalam penelitian ini menggunakan empat jenis inokulum yaitu Laru A (R.oligosporus), Laru B (R.oryzae), Laru C (R.oligosporus+R.oryzae 1:1), dan Laru D (Laru A+Laru B 1:1) sedangkan tiga waktu inkubasi yang digunakan sebagai perlakuan adalah 24, 36, dan 48 jam. Parameter yang diuji dalam menentukan laru dan waktu inkubasi optimal untuk produk tempe kacang merah adalah kadar protein terutama protein terlarut serta parameter lainnya yaitu rendemen, daya iris, dan warna. Tahap produksi tempe kacang merah yang dilakukan tidak jauh berbada dengan produksi tempe kedelai. Setiap jenis laru dan waktu inkubasi menghasilkan tempe kacang merah dengan karakteristik fisikokimia berbeda. Sampel-sampel yang memiliki kadar protein sama tingginya pada taraf signifikansi 5% adalah A48 (40.12%bk), C48 (41.15%bk), A36 (43.81%bk), dan B36 (46.05%bk). Sampel dengan kadar protein terlarut yang setara tingginya pada taraf 5% antara lain C36 (2.63%bk), A36 (2.67%bk), A48 (2.94%bk), dan C48 (3.00%bk). Rendemen sampel tertinggi di antaranya A36 (95.10%), D36 (95.15%), dan C36 (97.21%) yang setara tingginya dengan sampel yang diinkubasi selama 24 jam. Daya iris tertinggi dimiliki sampel A48 yaitu 198.1 N.mm sedangkan daya iris tempe kedelai sebagai kontrol 140.1 N.mm. Sampel yang memiliki nilai kecerahan yang sama dengan tempe kontrol (78.833%) antara lain A24 (80.575%), A36 (76.740%), B48 (74.110%), dan C36 (79.425%). Seluruh sampel tempe kacang merah memperlihatkan warna kromatik dominan kuning (nilai a = +0.230 hingga +6.150 dan nilai b = +5.840 hingga +19.025).
ABSTRACT
LULU MAKNUN. The Influence of Inoculum Type and Incubation Time on the Physicochemical Characteristics of Red Bean Tempeh (Phaseolus vulgaris L.) . Supervised by SULIANTARI.
Tempeh is one of Indonesian’s favourite food and it is known as source of protein. Red bean or red kidney bean contains protein in high amount so that it has big potency to be utilized as raw material of tempeh. Mold mycellium that growth covering the beans will form the compact texture and also being the source of protein. This research uses factorial experiment design with two factors: inoculum type and incubation time. The production of red bean tempeh in this reasearch is using four types of inoculum which are Laru A (R.oligosporus), Laru B (R.oryzae), Laru C (R.oligosporus+R.oryzae 1:1), and Laru D (Laru A+Laru B 1:1) On the other hand, the incubation times used for this research are 24, 36, and 48 hours. Parameter which are measured to determine the optimum inoculum type and incubation time for red bean tempeh is protein content, especially soluble protein content. The other parameters are yield, the slicing force, and color. The red bean tempeh production steps are similar with soybean tempeh. Every type of inoculum and incubation time produced red bean tempeh with different physicochemical characteristics. Samples which have similar high protein content with 5% significancy are A48 (40.12%db), C48 (41.15%db), A36 (43.81%db), and B36 (46.05%db). Samples whose similar high soluble protein content are C36 (2.63%db), A36 (2.67%db), A48 (2.94%db), dan C48 (3.00%db) with 5% significancy. Samples with the highest yield are A36 (95.10%), D36 (95.15%), and C36 (97.21%), similiar with yield of 24 hours tempeh. The highest slicing force 198.1 N.mm (A48) while slicing force of soybean temoeh as control is 140.1 N.mm.Samples with similar brightness value with control (78.833%) are A24 (80.575%), A36 (76.740%), B48 (74.110%), and C36 (79.425%). The whole red bean tempeh samples show yellow as their dominant chromatic colour (a value = +0.230 to +6.150 and b value = +5.840 to +19.025).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PENGARUH JENIS INOKULUM DAN WAKTU INKUBASI
TERHADAP SIFAT FISIKO-KIMIA TEMPE KACANG
MERAH (
Phaseolus vulgaris
L.)
LULU MAKNUN
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Pengaruh Jenis Inokulum dan Waktu Inkubasi Terhadap Sifat Fisiko-Kimia Tempe Kacang Merah (Phaseolus vulgaris L.)
Nama : Lulu Maknun NIM : F24100014
Disetujui oleh
Dr. Dra. Suliantari, MS. Dosen Pembimbing I
Diketahui oleh
Dr. Ir. Feri Kusnandar, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala nikmat dan karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 ini ialah Pengaruh Jenis Inokulum dan Waktu Inkubasi Terhadap Sifat Fisiko-Kimia Tempe Kacang Merah (Phaseolus vulgaris L.).
Sejak awal perkuliahan di tingkat persiapan bersama maupun departemen Ilmu dan Teknologi Pangan, masa penelitian ini, hingga tahap pembuatan skripsi, penulis banyak sekali memperoleh berbagai bentuk bantuan dan dukungan dari banyak pihak. Maka dari itu, penulis ingin mengucapkan terima kasih kepada Ibu Antung Sima Firlieyanti STP sebagai pembimbing selama lebih dari 2 tahun yang telah memberikan banyak bimbingan bukan hanya untuk penelitian ini namun juga dukungan dalam perkuliahan dan semangat untuk mengikuti kegiatan pertukaran pelajar dan mahasiswa berprestasi sehingga penulis memperoleh banyak manfaat khususnya dari kedua kegiatan tersebut. Ibu Dr. Dra. Suliantari, MS. selaku pembimbing skripsi yang telah memberikan banyak bimbingan, saran, nasihat, evaluasi, arahan sejak tahap penelitian hingga penyusunan skripsi. Bapak Dr. Eko Hari Purnama, STP, MSc serta Bapak Dr. Ir. Feri Kusnandar, M.Sc yang senantiasa memberikan bimbingan dan saran dalam penelitian tempe kacang merah ini. Ibunda Sumiati yang selalu menyertakan doa untuk kelancaran skripsi ini di setiap sujudnya dan seluruh kasih sayangnya selama ini. Ayahanda Saiful Bahri yang juga tak henti memberikan dukungan dan doa serta kakakku Dzulfaqor dan Riska yang selalu memotivasi. Gandang Maulana Andira yang selalu setia menemani dan memberikan dukungan selama ini. Seluruh laboran Departemen Ilmu dan Teknologi Pangan, Mbak Nurul, Mbak Ari, Mas Edi, Pak Gatot, Bu Antin, Mba Irin, Mba Ririn, Pak Yahya, Pak Rojak, Pak Sobirin, Bu Ika yang senantiasa membantu selama penelitian Rekan-rekan penelitian yaitu Dewi, Isna, Vega, Tommy, Andini, dan Barli yang telah sangat banyak membantu serta menemani selama penelitian. Segenap dosen serta staff Departemen Ilmu dan Teknologi Pangan atas ilmu yang telah diberikan kepada penulis. Teman-teman ITP 47 yang telah menemani dan berbagi segala cerita suka maupun duka.
Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Februari 2015
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 2
Bahan 2
Alat 2
Metode Analisis 7
HASIL DAN PEMBAHASAN 9
SIMPULAN DAN SARAN 18
DAFTAR PUSTAKA 19
DAFTAR GAMBAR
1 Diagram alir tahapan penelitian 3
2 Diagram alir pembuatan laru 5
3 Diagram alir pembuatan tempe kcang merah 6
4 Penampakan seluruh sampel tempe kacang merah yang dihasilkan 9 5 Pengaruh jenis laru dan waktu inkubasi terhadap total protein tempe
kacang merah 10
6 Pengaruh jenis laru dan waktu inkubasi terhadap kadar protein terlarut
tempe kacang merah 13
7 Pengaruh jenis laru dan waktu inkubasi terhadap rendemen tempe
kacang merah 14
8 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan daya iris
tempe kacang merah dengan kontrol 15
9 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan
kecerahan tempe kacang merah dengan kontrol 16
10 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan nilai a
tempe kacang merah dengan kontrol 17
11 Pengaruh jenis laru dan waktu inkubasi terhadap nilai b tempe kacang
merah 17
DAFTAR LAMPIRAN
1 Uji lanjut Duncan protein total sampel 22
2 Uji lanjut Duncan waktu inkubasi atas protein tempe kacang merah 22 3 Kurva standar BSA untuk pengukuran protein terlarut sampel 22 4 Uji lanjut Duncan jenis laru terhadap protein terlarut sampel 23 5 Uji lanjut Duncan protein terlarut seluruh sampel 23 6 Uji lanjut Duncan waktu inkubasi terhadap protein terlarut sampel 23
7 Uji lanjut Duncan rendemen sampel 24
PENDAHULUAN
Latar Belakang
Tempe diperoleh dari fermentasi biji kedelai dengan menggunakan kapang
Rhizopus sp., berbentuk padatan kompak, berwarna putih sedikit keabu-abuan, dan berbau khas tempe (SNI 3144:2009). Tempe kedelai merupakan produk pangan yang digemari masyarakat Indonesia hingga jumlah konsumsinya mencapai 8.5 kg per orang per tahunnya (BPS 2012). Demi memenuhi kebutuhan tempe masyarakat Indonesia, pemerintah harus mengimpor kedelai sebanyak 1.6 juta ton kedelai setiap tahunnya karena produksi kedelai dalam negeri hanya mencapai 600 ribu ton (BPS 2012). Maka dari itu, pembuatan tempe berbasis kacang lain selain kedelai dapat membantu mengurangi angka impor kedelai. Salah satu kacang yang dapat dimanfaatkan sebagai bahan baku pembuatan tempe adalah kacang merah yang mengandung protein sebesar 23.10% (Dinkes 1992) dan diproduksi di Indonesia sebanyak 103376 ton pada 2013. Kacang merah juga memiliki kadar karbohidrat tertinggi dibandingkan kacang-kacangan lainnya, kadar protein setara kacang hijau, kadar lemak yang jauh lebih rendah dibandingkan kacang kedelai dan kacang tanah, kadar serat yang setara dengan kadar serat kacang hijau, kacang kedelai, dan kacang tanah (Astawan 2009).
Kacang merah umumnya dikonsumsi sebagai campuran sayur dan sup serta dijadikan pasta isian produk bakeri. tidak baik dikonsumsi mentah karena masih mengandung beberapa senyawa antinutrisi seperti asam fitat, hemaglutinin, antitripsin, dan tanin (Wang et al. 2010). Pengolahan kacang merah menjadi produk olahan kacang merah termasuk tempe dapat mengurangi senyawa antinutrisi pada kacang merah seperti asam fitat, hemaglutinin, antitripsin, dan tanin (Wang et al. 2010). Selain itu, fermentasi kacang merah menjadi tempe diharapkan mampu meningkatkan kandungan dan kualitas gizi terutama protein (Hiran et al. 2011) .
Strain Rhizopus yang digunakan untuk pembuatan tempe menurut Shurtleff dan Aoyagi (1979) setidaknya harus memiliki karakteristik di antaranya tumbuh cepat pada 37oC, memiliki aktivitas protease yang tinggi sehingga menghasilkan ammonia bebas setelah 48 hingga 72 jam fermentasi, memiliki kemampuan memproduksi flavor, aroma, dan tekstur tempe yang disukai, tidak dapat fermentasi sukrosa, memiliki aktivitas lipolitik yang tinggi, mampu memproduksi antioksidan yang kuat. Spesies Rhizopus yang digunakan dalam produksi tempe antara lain Rhizopus oligosporus, Rhizopus oryzae, dan Rhizopus stolonifer
(Sapuan dan Sutrisno 2001).
Kapang yang digunakan dalam penelitian ini adalah R.oligosporus dan
R.oryzae. R.oligosporus memiliki aktivitas protease dan lipase tertinggi namun amilase terendah dibandingkan kapang tempe lainnya (Sapuan dan Sutrisno 2001) dan memiliki laju pertumbuhan paling cepat (Han dan Nout 2000). Penelitian Srapinkornburee et al. (2009) juga menyebutkan dalam pengembangan tempe kacang merah secara komersial digunakan Rhizopus oligosporus. Spesies
2
sehingga menjadi kapang utama juga dalam pembuatan tempe yang baik (Shurtleff dan Aoyagi 1979).
Penggunaan berbagai jenis laru dan waktu inkubasi dianalisis dalam penelitian ini untuk menghasilkan tempe kacang merah dengan kadar protein total, protein terlarut serta rendemen, daya iris dan warna yang diharapkan.
Tujuan Penelitian
Tujuan umum penelitian ini adalah sebagai program diversifikasi bahan baku tempe. Tujuan khusus penelitian ini adalah untuk menentukan karakteristik fisikokimia tempe kacang merah di antaranya kadar protein total, protein terlarut, rendemen, daya iris, dan warna akibat penggunaan berbagai jenis laru serta waktu inkubasi.
Manfaat Penelitian
Manfaat dari penelitian ini adalah diversifikasi tempe yang ada di Indonesia. Selain itu, diperoleh karakteristik fisikokimia tempe kacang merah dari berbagai perlakuan jenis laru dan waktu inkubasi.
METODE
Bahan
Bahan-bahan yang digunakan dalam pembuatan tempe kacang merah antara lain kacang merah kering yang dibeli dari Pasar Bogor, air, dan cuka makan. Bahan dalam pembuatan laru antara lain beras pera, air, kultur Rhizopus oligosporus Saito dan Rhizopus oryzae Went & Prins. Geerl. dari Pusat koleksi dan Kultur Mikroba LIPI MC, dan air steril sedangkan bahan-bahan untuk analisis di antaranya HCl, akuades, H2SO4 pekat, HgO, K2SO4, larutan 60% NaOH-5% Na2S2O3.5H2O, H3BO3 jenuh, akuades, indikator metilen red-metilen blue, indikator phenoftalein, NaOH, larutan protein standar Bovine Serum Albumin (BSA) dan larutan buffer Bradford.
Alat
3
Persiapan kultur R.oligosporus dan R.oryzae
Pembuatan laru (Gambar 2)
Tahap produksi tempe kacang merah 24, 36, 48 jam (Gambar 3)
Laru A/B/C/D
Tempe kacang merah dengan berbagai karakteristik fisikokimia dari perlakuan laru dan waktu inkubasi yang berbeda
a. Protein total b. Protein
terlarut c. Rendemen d. Daya iris e. Warna Pengolahan data
Metode Penelitian
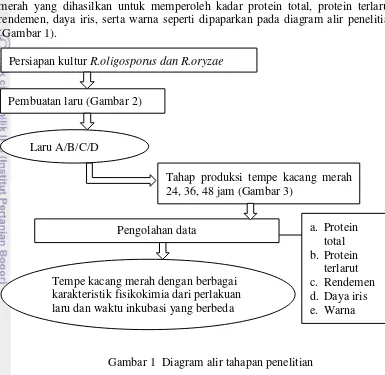
Penelitian ini dibagi menjadi beberapa tahap, yaitu tahap pembuatan laru tempe dan tahap pembuatan tempe kacang merah, serta analisis tempe kacang merah yang dihasilkan untuk memperoleh kadar protein total, protein terlarut, rendemen, daya iris, serta warna seperti dipaparkan pada diagram alir penelitian (Gambar 1).
Gambar 1 Diagram alir tahapan penelitian
Empat laru yang digunakan dalam penelitian ini adalah Laru A yang hanya mengandung kapang R.oligosporus, Laru B yang hanya mengandung kapang
4
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap Faktorial, dengan dua faktor perlakuan dan dua kali ulangan. Faktor perlakuan yang digunakan adalah jenis laru dengan 4 taraf faktor yaitu Laru A, Laru B, Laru C, dan Laru D serta waktu inkubasi dengan 3 taraf faktor yaitu 24 jam, 36 jam, dan 48 jam. Model matematik rancangan percobaan ini adalah sebagai berikut:
Yijkl= μ + Ai+ Bj+ (AB)ij + Ɛijkl
Di mana: Yijk = Nilai pengamatan respon
μ = Nilai rataan umum
Ai = pengaruh jenis laru tempe ke-i
Bj = pengaruh waktu inkubasi tempe ke-j
(AB)ij = pengaruh interaksi jenis laru dan waktu inkubasi tempe
Ɛijk = galat percobaan
Analisis statistika dilakukan dengan menggunakan ANOVA (Analysis of Variance) pada taraf kepercayaan 95% atau taraf nyata 5% dan uji lanjut menggunakan uji Duncan dan Dunnett. Perangkat lunak yang digunakan untuk analisis statistika sesuai dengan rancangan percobaan yang telah dibuat adalah SPSS 20.
Pembuatan Laru Tempe
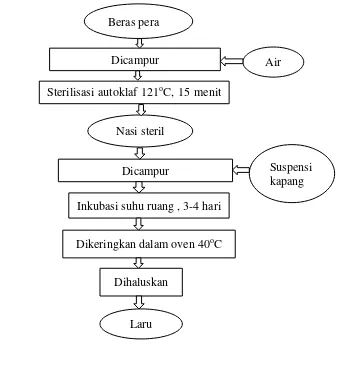
Media pertumbuhan kapang dalam pembuatan laru ini adalah nasi karena berdasarkan penelitian Yusuf (1985), spora kapang Rhizopus oligosporus NRRL 2710 yang digunakan sebagai inokulum tempe memiliki viabilitas tertinggi jika ditumbuhkan pada nasi dibandingkan pada gandum atau kedelai. Penelitian Sudiarso (1993) juga menunjukkan bahwa viabilitas spora kapang tertinggi ditemukan pada substrat beras atau nasi.
Cara pembuatan laru dapat dilihat pada Gambar 2. Sebanyak 10 gram beras pera dimasukkan ke dalam cawan petri dan ditambahkan 16 mL air. Cawan petri tersebut lalu disterilisasi di dalam autoklaf dengan suhu 121oC selama 15 menit hingga menghasilkan nasi steril. Suspensi kapang yang telah disiapkan lalu dipipet 1 mL secara steril ke dalam nasi steril. Cawan petri berisi nasi steril dan suspensi kapang kemudian diinkubasi pada suhu kamar selama 4 hari hingga miselium kapang tumbuh di seluruh cawan dan kapang tersebut dikeringkan dalam oven bersuhu 40-42oC selama 6 hari sampai kering dan dihaluskan dengan blender yang sebelumnya telah disemprot etanol 70% hingga diperoleh laru dalam bentuk seperti tepung halus dan kemas serta simpan dalam refrigerator.
5
Gambar 2 Diagram alir pembuatan laru
Pembuatan Tempe Kacang Merah
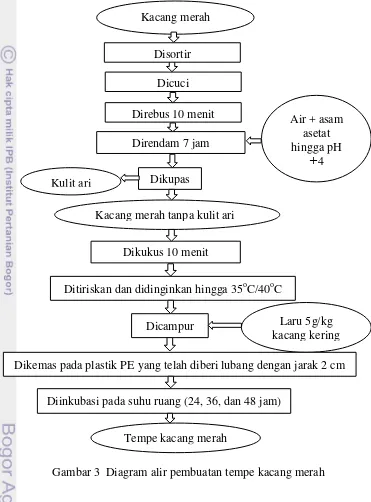
Pembuatan tempe kacang merah secara lengkap ditunjukkan pada Gambar 3 yaitu dimulai dengan melakukan sortasi dan mencuci kacang merah kering lalu direbus selama 10 menit dalam 2 liter air, dilanjutkan perendaman dalam larutan asam asetat dengan pH sekitar 4 selama 7 jam. Nilai pH air perendam tersebut sesuai dengan nilai pH yang dibutuhkan untuk pertumbuhan kapang tempe yaitu 3.5 hingga 5.2 (Sapuan dan Noer 2001). Setelah itu, kacang merah ditiriskan dan dicuci dari larutan asam sekaligus dipisahkan kulit arinya. Kacang merah tanpa kulit ari kemudian dikukus selama 10 menit dan ditiriskan hingga suhu 40oC. Sebanyak 5 gram laru setiap kg kacang merah kering, dicampur ke dalam kacang merah yang sudah ditiriskan lalu dikemas pada plastik yang telah diberi lubang dengan jarak 2 cm. Plastik yang digunakan sebagai pengemas adalah plastik jenis polietilen (PE) yang foodgrade atau aman untuk pangan karena memiliki keunggulan di antaranya bersifat inert terhadap bahan pangan, permeable
terhadap oksigen sehingga dapat mendukung pertumbuhan kapang (Dirim et al. 2004) serta daya tahan terhadap air yang baik. Menurut Syarief et al. (1999) plastik PE juga bening dan transparan sehingga penampakan tempe dapat dilihat dengan baik dan bersifat fleksibel. Oleh karena itu, tempe yang akan dibuat mudah diatur ketebalannya. Tempe kacang merah pada penelitian ini dibuat dengan ketebalan 1 cm.
Beras pera
Sterilisasi autoklaf 121oC, 15 menit menit
Dicampur Nasi steril
Air
Suspensi kapang Inkubasi suhu ruang , 3-4 hari
Dikeringkan dalam oven 40oC
Dihaluskan
6
Metode pembuatan tempe kacang merah yang digunakan dalam penelitian ini berasal dari metode pembuatan tempe kacang merah yang digunakan oleh Jaisan (2013). Tahapan-tahapan pembuatan tempe kacang merah dapat dilihat pada Gambar 3.
Gambar 3 Diagram alir pembuatan tempe kacang merah Dicuci
Disortir Kacang merah
kering
Direbus 10 menit Direndam 7 jam
Kulit ari Dikupas
Air + asam asetat hingga pH
±4
Kacang merah tanpa kulit ari
Dikukus 10 menit
Ditiriskan dan didinginkan hingga 35oC/40oC
Dicampur Laru 5g/kg
kacang kering Dikemas pada plastik PE yang telah diberi lubang dengan jarak 2 cm
Diinkubasi pada suhu ruang (24, 36, dan 48 jam)
7
Metode Analisis
Kadar Protein Total Metode Kjeldahl (AOAC 960.52 yang dimodifikasi)
Sebanyak 0.1-0.25 gram sampel ditimbang di dalam labu Kjeldahl, lalu ditambahkan 1.0 + 0.1 gram K2SO4, 40 + 10 mL HgO, dan 2.0 + 0.1 mL H2SO4, selanjutnya sampel didihkan sampai cairan jernih kemudian didinginkan. Larutan jernih ini dipindahkan ke dalam alat destilasi secara kuantitatif. Labu Kjeldahl dibilas dengan 1-2 mL air destilata, kemudian air cuciannya dimasukan ke dalam alat destilasi, pembilasan dilakukan sebanyak 5-6 kali. Tambahkan 8-10 mL larutan 60% NaOH – 5% Na2S2O3.5H2O ke dalam alat destilasi. Erlenmeyer yang berisi 5 mL larutan H3BO3 jenuh dan 2-4 tetes indikator (campuran 2 bagian 0.2% metilen red dan 1 bagian 0.2% metilen blue dalam etanol 95%) diletakkan di bawah kondensor. Ujung tabung kondensor harus terendam dalam larutan H3BO3, kemudian dilakukan destilasi sehingga diperoleh sekitar 15 mL destilat. Destilat yang diperoleh kemudian dititrasi dengan HCl 0.02 N sampai terjadi perubahan warna dari hijau menjadi abu-abu.
Kadar protein kasar dihitung dengan rumus berikut:
Kadar Nitrogen (%) = (V HCl sampel – V HCl blanko) N HCl x 14.007x100
mg sampel
Kadar Protein (%bb) = %N x FK
Kadar Protein (%bk) = Kadar protein (%bb) x 100 (100 - kadar air (%bb)*)
*Kadar air sampel ditentukan dengan Metode Oven (SNI 01-2891-1992) Di mana : V = Volume
N = Normalitas
FK = Faktor Konversi (6.25)
Rendemen Tempe
Rendemen tempe kacang merah dapat diketahui dengan mengukur rasio bobot tempe kacang merah dan bobot kacang merah sebelum ditumbuhi miselium kapang (bobot kacang merah yang telah dikukus dan dicampur laru).
Rendemen tempe (%) = bobot tempe kacang merah x 100 bobot kacang merah kukus + laru
Kadar Protein Terlarut (Bradford 1976)
8
dilakukan sentrifuse 3000 rpm 25oC selama 10 menit. Sebanyak 50 µl supernatan ditambahkan 1,25 mL akuades dan 1,25 mL pereaksi Bradford. Sampel divortex dan diamkan selama 30 menit agar reaksi pembentukan warna biru antara protein terlarut dengan pereaksi Bradford lebih sempurna, setelah itu ukur absorbansi sampel pada panjang gelombang 595 nm. Kadar protein terlarut ditentukan dengan menggunakan persamaan linear yang diperoleh dari kurva standar BSA.
Daya Iris (Lestari 2014)
Pengukuran daya iris tempe dilakukan dengan menggunakan alat Texture Analyzer. Probe yang digunakan adalah Warner-Bratzler Blader yang berbentuk pisau dengan pengaturan kecepatan probe dalam mengiris tempe yang ketebalannya 1 cm sebesar 1.5 mm/detik dan distance atau kedalaman pengirisan 10 mm. Data yang diperoleh dari pengukuran ini adalah kerja (N.mm), menyatakan besar gaya keseluruhan yang diperlukan probe untuk mengiris tempe yang ditunjukkan dengan data luas area (N.mm).
Analisis Warna(Hunterlab 2008)
9
A24 A36 A48
B24 B36 B48
C24 C36 C48
D24 D36 D48
HASIL DAN PEMBAHASAN
Tempe Kacang Merah
Penampakan dari sampel tempe kacang merah yang dihasilkan dengan 4 perlakuan laru serta 3 perlakuan waktu inkubasi berbeda dapat dilihat pada Gambar 4.
Gambar 4 Penampakan seluruh sampel tempe kacang merah yang dihasilkan Keterangan:
A24 = Tempe kacang merah yang diinkubasi selama 24 jam menggunakan Laru A B36 = Tempe kacang merah yang diinkubasi selama 36 jam menggunakan Laru B C48 = Tempe kacang merah yang diinkubasi selama 48 jam menggunakan Laru C D24 = Tempe kacang merah yang diinkubasi selama 24 jam menggunakan Laru D
10
dari itu, sampel B24 belum dapat dikatakan sebagai tempe kacang merah seperti SNI 3144:2009 (BSN 2009). Hal tersebut diduga karena R.oryzae membutuhkan waktu yang lebih lama untuk pembuatan tempe dibandingkan R.oligosporus
(Sapuan dan Sutrisno 2001) akibat aktivitas protease R.oryzae yang lebih rendah dibandingkan R.oligosporus. Selanjutnya pada analisis, sampel B24 tidak diikutsertakan karena belum dianggap sebagai tempe kacang merah.
Karakteristik Kimia
Total Protein
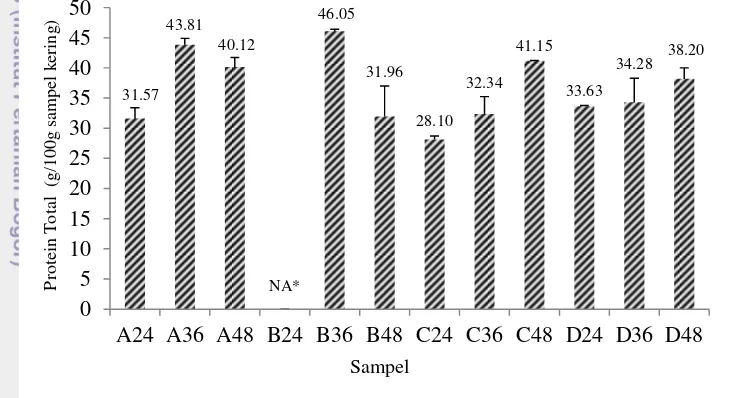
Protein merupakan parameter utama pada tempe karena tempe dikenal sebagai sumber protein nabati (Nout dan Kiers 2005). Total protein basis kering merupakan jumlah protein total dalam fraksi padatan sampel. Total protein tempe kacang merah yang dianalisis dapat dilihat pada Gambar 5.
Gambar 5 Pengaruh jenis laru dan waktu inkubasi terhadap total protein tempe kacang merah
Keterangan: NA*= Not available
Secara umum, kacang merah mengalami peningkatan total protein dari 23.10 g/100g (Depkes 1992) menjadi 28.10 g/100g – 46.05 g/100g pada tempe kacang merah (Gambar 5). Peningkatan protein tersebut disebabkan karena pertumbuhan kapang. Kapang mengandung asam nukleat yang memberikan kontribusi penambahan nitrogen (Pasaribu 2007). Bahan pangan yang berasal dari kapang misalnya miselium kapang tempe mengandung asam nukleat sebesar 8-10% (Firmansyah 2007). Maka dari itu, tempe kacang merah yang mengandung miselium kapang memiliki protein yang lebih tinggi dibandingkan kacang merah. Berdasarkan data protein total pada Gambar 5, terlihat seluruh sampel yang diinkubasi selama 24 jam memiliki protein total yang paling rendah dibandingkan sampel yang diinkubasi dengan laru yang sama selama 36 jam atau 48 jam sehingga waktu inkubasi 24 jam belum cukup menghasilkan tempe kacang merah
31.57
A24 A36 A48 B24 B36 B48 C24 C36 C48 D24 D36 D48
11 dengan total protein optimum. Sampel yang paling tinggi total proteinnya adalah sampel B36 yaitu sebesar 46.05 g/100g sampel kering sedangkan sampel paling rendah kandungan proteinnya adalah C24 yaitu 28.10 g/100g sampel kering. Kandungan sampel B36 tersebut setara dengan beberapa sampel lainnya yaitu C48, A48, dan A36 (Lampiran 1).
Sampel yang diinokulasi dengan Laru A (R.oligosporus tunggal) dan Laru B (R.oryzae tunggal) memiliki kadar protein optimum pada waktu fermentasi 36 jam akan tetapi mengalami penurunan protein pada waktu inkubasi 48 jam. Rhizopus oligosporus dan R.oryzae merupakan kapang tempe utama (Babu et al. 2009) karena memiliki aktivitas proteolitik tertinggi (Sapuan dan Noer 2001). Maka dari itu, waktu fermentasi lebih dari 36 jam menggunakan Rhizopus oligosporus maupun Rhizopus oryzae dapat menghasilkan senyawa ammonia (Sapuan dan Noer 2001) yang bersifat volatil. Ammonia terbentuk akibat penguraian protein berlebihan oleh protease kapang dan menyebabkan penurunan kandungan protein total dalam sampel. Selain itu pada tempe kedelai yang difermentasi selama 48 jam atau lebih, hampir seluruh asam amino turun sebesar 3.62% hingga 27.9% (Astuti et al. 2000). Hal tersebut menjelaskan mengapa sampel yang difermentasi menggunakan Laru A dan B mengalami penurunan protein total setelah mencapai waktu fermentasi 48 jam. laru. Adanya kompetisi penggunaan substrat antara R.oligosporus dan R.oryzae
menghasilkan laru dengan viabilitas lebih rendah serta penurunan kemampuan fermentasi kapang (Wiesel et al. 1997). Hal tersebut menyebabkan kadar protein tempe dengan Laru C atau D lebih rendah sekaligus laju pertumbuhan kapang lebih lambat. Maka, pada waktu inkubasi 48 jam pertumbuhan kapang campuran tersebut masih tinggi akibat aktivasi kapang yang sedikit lebih lambat dan menghasilkan protein berjumlah lebih besar dibandingkan sampel dengan waktu inkubasi 36 jam. Demi meningkatkan viabilitas dan aktivitas fermentasi kapang, campuran R.oligosporus dan R.oryzae harus dianalisis perbandingan campuran yang terbaik.
Peningkatan aktivitas fermentasi kapang dipengaruhi oleh sumber karbon dan nitrogen pada media tumbuh. Tingginya kadar karbohidrat pada kacang merah yaitu mencapai 59.5 g/100g (Depkes 1992) juga memberi ketersediaan karbon untuk Rhizopus oryzae yang memiliki aktivitas amilase tertinggi (Sapuan dan Noer 2001). Maka, tidak hanya Rhizopus oligosporus yang dapat tumbuh dengan baik pada kacang merah, namun juga Rhizopus oryzae. Penelitian Thanh (2004) juga menunjukkan asam amino L-alanin dapat mempercepat aktivasi
L-12
prolin (Karisma 2014) yang dapat mengganggu penggunaan alanin oleh
R.oligosporus (Thanh 2004).
Tempe kacang merah dengan Laru C (R.oligoporus dan R.oryzae 1:1, ditumbuhkan bersama pada nasi steril) menghasilkan protein dengan jumlah lebih tinggi dari Laru D yang maksimal hanya 38.20 g/100g sampel kering. Hal tersebut dikarenakan kompetisi penggunaan nutrisi pada kacang merah antara Rhizopus oligosporus dan R.oryzae pada Laru D. Rhizopus oligosporus dan R.oryzae pada Laru C juga mengalami kompetisi namun sudah terjadi lebih awal, yaitu sejak ditumbuhkan bersama pada nasi steril. Kompetisi yang berlangsung awal tersebut menyebabkan kedua kapang sudah lebih dulu beradaptasi untuk dapat tumbuh bersama pada substrat kacang merah selanjutnya. R.oryzae mampu menghasilkan glukosa dari pemecahan karbohidrat akibat aktivitas amilolitiknya yang tinggi. Glukosa merupakan sumber karbon untuk mendukung pertumbuhan kapang (Thanh 2004). Maka, pertumbuhan kapang pada sampel dengan Laru C lebih tinggi dibandingkan sampel dengan Laru D dan menghasilkan kadar protein yang juga lebih tinggi.
Hasil uji lanjut Duncan menunjukkan waktu inkubasi 48 jam dan waktu inkubasi 36 jam pada taraf signifikansi 5% menghasilkan protein total yang setara tingginya (Lampiran 2). Pemilihan waktu inkubasi disesuaikan dengan jenis laru yang digunakan. Jika dipilih laru tunggal yaitu Laru A maupun Laru B, waktu inkubasi 36 jam lebih disarankan karena total proteinnya paling tinggi pada waktu inkubasi 36 jam (Gambar 5). Apabila laru campuran yaitu Laru D atau Laru C dipilih, waktu inkubasi yang diterapkan sebaiknya 48 jam karena protein total pada sampel dengan laru campuran paling tinggi pada waktu inkubasi 48 jam (Gambar 5). Waktu inkubasi 24 jam tidak dipilih untuk seluruh jenis laru karena menghasilkan tempe kacang merah dengan kadar protein yang masih rendah. Hal tersebut serupa dengan waktu pembuatan tempe kedelai yang umumnya berkisar selama 36-48 jam (Astuti et al. 2000).
Protein Terlarut
13
Gambar 6 Pengaruh jenis laru dan waktu inkubasi terhadap kadar protein terlarut tempe kacang merah
Keterangan: NA*= Not available
Protein terlarut pada sampel tempe kacang merah ini mengalami peningkatan dari 0.71 g/100g kacang merah kering dari penelitian Karisma (2014) menjadi 0.72 g/100g – 3.00 g/100g (Gambar 6). Hal tersebut dikarenakan enzim proteolitik kapang selama fermentasi mampu mengurai protein menjadi asam amino dan oligopeptida sehingga meningkatkan jumlah nitrogen terlarut (Susi 2012). Asam amino dan peptida rantai pendek tersebut bersifat larut dalam air (Handoyo dan Morita 2006). Peningkatan protein terlarut pada tempe kacang merah serupa dengan protein terlarut tempe kedelai yang ditemukan meningkat hingga empat kali dari protein terlarut kedelai (Shurtleff dan Aoyagi 1979).
Tempe kacang merah yang difermentasi dengan Laru A dan C menghasilkan protein terlarut yang setara tingginya pada taraf kepercayaan 95% (Lampiran 4). Sampel C48 dan A48 memiliki kadar protein terlarut yang sama tingginya dengan sampel A36 dan C36 (Lampiran 5). Selain itu, waktu inkubasi 36 dan 48 jam juga menghasilkan tempe kacang merah dengan protein terlarut yang sama tinggi (Lampiran 6). Maka dari itu, pembuatan tempe kacang merah dapat menggunakan Laru A maupun C dengan waktu inkubasi 36 maupun 48 jam. Waktu inkubasi 24 jam belum menghasilkan aktivitas proteolitik kapang yang optimum sehingga belum mampu memecah banyak senyawa protein kompleks menjadi protein terlarut. Jumlah protein terlarut rendah karena lebih dari 90% padatan tempe merupakan padatan yang bersifat tidak larut air (Utami 2014).
Karakteristik Fisik
Rendemen
Rendemen tempe diperoleh dari rasio bobot tempe yang dihasilkan dengan bobot kacang merah yang telah dicampur laru. Miselium kapang akan tumbuh pada kacang dan mengikat setiap kotiledon kacang dan merupakan biomassa
0.75
A24 A36 A48 B24 B36 B48 C24 C36 C48 D24 D36 D48
14
sumber protein atau Single Cell Protein (Khan et al. 2009). Aktivitas enzimatis kapang selama fermentasi mampu mengurai senyawa kompleks seperti protein, karbohidrat, serta lemak pada kacang merah menjadi komponen-komponen lain yang lebih sederhana sehingga bobot tempe kacang merah lebih ringan dibandingkan bobot kacang merah sebelum menjadi tempe. Akibatnya, rendemen tempe kacang merah yang diperoleh tidak mencapai 100% seperti terlihat pada Gambar 7.
Gambar 7 Pengaruh jenis laru dan waktu inkubasi terhadap rendemen tempe kacang merah
Keterangan: NA*= Not available
Sampel yang paling tinggi rendemennya adalah seluruh sampel yang diinkubasi selama 24 jam yaitu mencapai 97.67% pada C24. Tingginya rendemen tersebut dapat menunjukkan bahwa proses penguraian senyawa kompleks pada kacang merah belum terjadi secara sempurna karena perbedaan bobot tempe yang dihasilkan dengan kacang merah sebelumnya tidak jauh berbeda.
Hal tersebut terbukti pada waktu inkubasi 24 jam, total protein maupun protein terlarut seluruh sampel jumlahnya paling rendah. Hasil uji One Way
ANOVA (Lampiran 7) menunjukkan rendemen C36 sama tingginya dengan sampel dengan rendemen tertinggi yaitu A24, C24, dan D24 pada taraf signifikansi 5%. Semakin lama waktu fementasi, semakin banyak nutrisi kacang merah yang terurai (Utami 2014) sehingga semakin rendah bobot tempe yang dihasilkan. Hal tersebut terjadi pada seluruh jenis laru.
Daya Iris
Tempe kacang merah yang optimal adalah tempe yang miseliumnya kompak sehingga memberikan tekstur dan daya iris yang baik pula. Luas area di bawah kurva (N.mm) yang dihasilkan pada pengukuran tekstur tempe kacang merah menggunakan Texture Analyzer dan Probe Warner-Bratzler Blader
97.43 95.10
A24 A36 A48 B24 B36 B48 C24 C36 C48 D24 D36 D48
15 menunjukkan besarnya gaya keseluruhan yang diperlukan untuk mengiris tempe. Data pengujian daya iris sampel tempe kacang merah dengan Texture Analyzer
dapat dilihat pada Gambar 8.
Gambar 8 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan daya iris tempe kacang merah dengan kontrol
*Keterangan: NA= Not available
Luas area juga menunjukkan kekompakan tempe yang dihasilkan. Sampel yang paling kompak adalah sampel A48 (198.1 N.mm) diikuti sampel B48 (147.1 N.mm). Selain kedua sampel tersebut, nilai kekompakan atau luas area tempe kacang merah lebih kecil dari tempe kedelai yang dijadikan kontrol (140.1 N.mm). Sampel yang diinkubasi selama 24 jam merupakan kelompok sampel yang nilai luas areanya rendah sehingga kekompakan atau daya iris sampel dengan waktu inkubasi 24 jam belum baik. Laru A yang mengandung R.oligosporus tunggal memiliki luas area yang tertinggi. Hal tersebut dikarenakan pertumbuhan
R.oligosporus miseliumnya paling tinggi atau panjang, sedangkan pertumbuhan miselium R.oryzae paling rendah atau pendek (Firmansyah 2007). Maka, tempe yang dihasilkan dengan R.oligosporus strukturnya lebih kompak seperti juga ditemukan pada hasil penelitian Karsono et al. (2009). Tempe kedelai komersial biasanya difermentasi selama 48 jam (Nout dan Kiers 2005) sehingga sampel tempe kacang merah yang difermentasi 48 jam daya irisnya atau kekompakannya pun paling menyerupai daya iris atau kekompakan tempe kedelai.
16
Analisis Warna
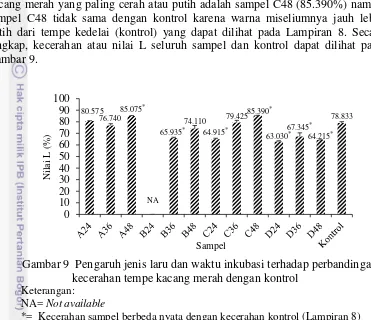
Pengukuran warna dilakukan pada bagian permukaan tempe karena penerimaan tempe umumnya dilihat dari warna permukaan tempe. Sampel tempe kacang merah yang paling cerah atau putih adalah sampel C48 (85.390%) namun sampel C48 tidak sama dengan kontrol karena warna miseliumnya jauh lebih putih dari tempe kedelai (kontrol) yang dapat dilihat pada Lampiran 8. Secara lengkap, kecerahan atau nilai L seluruh sampel dan kontrol dapat dilihat pada Gambar 9.
Gambar 9 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan kecerahan tempe kacang merah dengan kontrol
Keterangan: NA= Not available
*= Kecerahan sampel berbeda nyata dengan kecerahan kontrol (Lampiran 8)
Beberapa sampel misalnya C36 memiliki intensitas kecerahan yang sama putihnya dengan kontrol (Lampiran 8). Warna putih pada tempe tersebut berasal dari miselium kapang berwarna putih menyelimuti seluruh permukaan tempe (Wipradnyadewi et al. 2005) dan (Kwon et al. 2010). Semakin lama waktu inkubasi, semakin tinggi pertumbuhan kapang dan semakin banyak miselium yang dihasilkan. Tidak semua sampel yang diinkubasi selama 48 jam memiliki kecerahan yang paling tinggi bahkan sampel D48 hanya memiliki nilai L 64.215% (Gambar 9). Hal tersebut menunjukkan telah terjadi sporulasi sehingga terbentuk warna kehitaman yang menurunkan kecerahan tempe.
17
Gambar 10 Pengaruh jenis laru dan waktu inkubasi terhadap perbandingan nilai a tempe kacang merah dengan kontrol
Keterangan:
NA= Not available
*= Kecerahan sampel berbeda nyata dengan kecerahan kontrol (Lampiran 9)
Sampel paling tinggi intensitas warna merahnya adalah sampel B36 dan paling rendah intensitas warna merahnya adalah sampel C48. Sampel B36 sangat tinggi intensitas warna merahnya karena miselium Rhizopus oryzae belum menutupi seluruh permukaan tempe. Oleh karena itu, saat pengukuran warna merah yang diperoleh tinggi intensitasnya akan tetapi menurunkan nilai kecerahannya (Gambar 9).
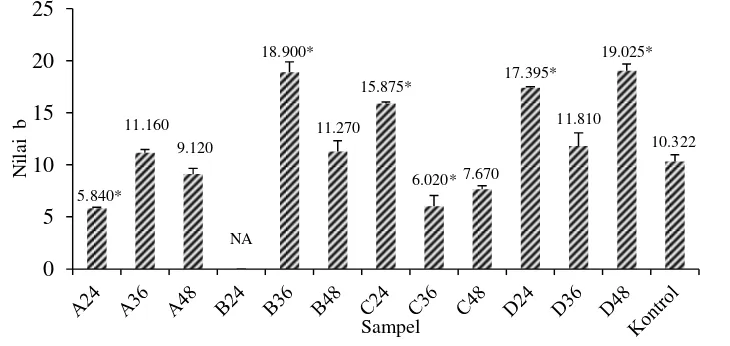
Nilai b menunjukkan warna kromatik campuran warna biru-kuning. Seluruh sampel tempe kacang merah memiliki nilai b yang positif (Gambar 11). Nilai b yang positif menunjukkan sampel cenderung berwarna kuning. Jika dibandingkan, nilai b pada seluruh sampel tempe kacang merah cenderung lebih tinggi daripada nilai a sehingga warna kromatik kuning lebih dominan pada tempe kacang merah.
Gambar 11 Pengaruh jenis laru dan waktu inkubasi terhadap nilai b tempe kacang merah
Keterangan: NA= Not available
18
SIMPULAN DAN SARAN
Simpulan
Setiap jenis laru dan waktu inkubasi menghasilkan sifat fisikokimia yang berbeda-beda. Laru yang terdiri dari R.oryzae tunggal menghasilkan tempe kacang merah dengan kadar protein total pada waktu inkubasi 36 jam yaitu 46.05%bk. Laru campuran R.oligosporus dan R.oryzae 1:1 yang ditumbuhkan bersama pada nasi steril menghasilkan tempe kacang merah dengan kadar protein terlarut tertinggi yaitu 3.00%bk dengan waktu inkubasi 48 jam. Laru R.oligosporus
tunggal menghasilkan tempe dengan kekompakan atau daya iris yang paling baik dibandingkan jenis laru lainnya. Laru campuran R.oligosporus dan R.oryzae 1:1 yang ditumbuhkan terpisah pada nasi steril menghasilkan kadar protein total, protein terlarut, maupun daya iris yang paling rendah dibandingkan jenis laru lainnya. Rendemen seluruh sampel dengan laru dan waktu inkubasi yang berbeda mencapai lebih dari 90%. Daya iris atau kekompakan tempe kacang merah yang dihasilkan sama baiknya daya iris atau kekompakan tempe kedelai yang dijadikan kontrol terutama yang diinkubasi selama 48 jam. Nilai kecerahan tempe kacang merah juga sama tingginya dengan tempe kontrol. Warna kromatik yang terukur pada sampel tempe kacang merah adalah merah dan kuning dengan kuning sebagai warna yang paling dominan. Pemilihan jenis laru disesuaikan dengan waktu inkubasi optimum (36 atau 48 jam) tiap laru dalam menghasilkan karakteristif fisikokimia yang diinginkan diantaranya kadar protein tinggi, tekstur yang kompak, rendemen tinggi, daya iris tinggi, serta warna yang cerah.
Saran
19
DAFTAR PUSTAKA
[AOAC]. Association of Official Analytical Chemists. 1995. Official Methods of Analysis. 960.52
Babu PD. R Bhakyaraj. R Vidhyalakshmi. 2009. A low cost nutritious food
“tempeh”- a review. World Journal of Dairy & Food Sciences 4 (1): 22-27. [BPS]. Badan Pusat Statistik Republik Indonesia. 2013. Produksi Sayuran di
Indonesia. 1997-2013. Jakarta (ID): BPS.
[BSN]. Badan Standardisasi Nasional. 1992. SNI 01-2891-1992. Cara Uji Makanan dan Minuman. Jakarta (ID): BSN.
[BSN] Badan Standardisasi Nasional. 2009. SNI Nomor 3144 Tahun 2009 tentang Tempe Kedelai. Jakarta (ID): BSN.
Astawan. M. 2009. Sehat dengan Hidangan Kacang dan Biji-bijian. Jakarta (ID): Penebar Swadaya.
Astuti M, Andreanyta M, Fabien SD, dan Mark LW. 2000. Review article: tempe, a nutritious and healthy food from Indonesia. Asia Pacific J Clin Nutr. 9(4): 322–325.
Bradford MM. 1976. A rapid and sensitive method of the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. J. of Anal. Biochem. 76: 248-254.
Departemen Kesehatan Republik Indonesia. 1992. Kandungan Gizi Kacang. Jakarta (ID): Depkes.
Dirim SN, HO Ozden, Alev B, dan Ali E. 2004. Modification of water vapour transfer rate of low density polyethylene films for food packaging. Journal of Food Engineering. 63: 9-13. doi:10.1016/S0260-8774(03)00276-0. Firmansyah R. 2007. Isolasi, identifikasi, dan produksi miselia Rhizopus sp.
berkadar asam nukleat rendah [skripsi]. Bogor (ID): Institut Pertanian Bogor. Han BZ dan Nout MJR. 2000 Effects of temperature, water activity and gas
atmosphere on mycelial growth of tempe fungi Rhizopus microsporus var.
microsporus and R. microsporus var. oligosporus. World Journal of Microbiology & Biotechnology 16: 853–858.
Handoyo T, Morita N. 2006. Structural and functional properties of fermented soybean (Tempeh) by using Rhizopus oligosporus. International Journal of Food Properties 9:347-55.
20
Hunterlab. 2008. Hunterlab Applications Note. Hunter Associates Laboratory. Jaisan C. 2013. Optimizing of fermentation process of red bean tempe [skripsi].
Bogor (ID): Institut Pertanian Bogor.
Karisma VW. 2014. Pengaruh penepungan, perebusan, perendaman asam, dan fermentasi terhadap komposisi kimia kacang merah (Phaseolus vulgaris L.) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Karsono Y, Abdi TCS, Arius W, dan Paramita A. 2009. Pengaruh jenis kultur starter terhadap mutu organoleptik tempe kedelai [artikel ilmiah]. Bogor (ID): Institut Pertanian Bogor.
Khan et al. 2009. Production of fungal single cell protein using Rhizopus oligosporus grown on fruit waste. Biological Forum – An International Journal. 1(2):32-39.
Kwon JH, Jinwoo K, Yong-Hwan L, dan Hong-Sik S. 2010. Soft rot on Cucumis melo var. makuwa caused by Rhizopus oryzae. Mycobiology 38(4) : 336-338. doi: 10.4489/MYCO.2010.38.4.336
Lestari IA. 2014. Pengaruh ketebalan dan persen aerasi terhadap karakteristik tempe grits kacang merah (Phaseolus vulgaris L.) ukuran 8 mesh [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nout MJR dan JL Kiers. 2005. Tempe fermentation, innovation and functionality: update into the third millenium. Journal of Applied Microbiology 98: 789– 805.
Pasaribu T. 2007. Produk fermentasi limbah pertanian sebagai bahan pakan unggas di indonesia. Wartazoa 17(3): 109-116.
Purwoko T dan Noor SH. 2007. Kandungan protein kecap manis tanpa fermentasi moromi hasil fermentasi Rhizopus oryzae dan R.oligosporus. Biodiversitas. 8(2): 223-227.
Sapuan dan N Sutrisno. editor. 1996. Bunga Rampai Tempe Indonesia. Jakarta: Yayasan Tempe Indonesia.
Sapuan dan Noer S. 2001. The Complete Handbook of Tempe: The Unique Fermented Soyfood of Indonesia 2nd ed. Jonathan A. editor. Singapore (SG): American Soybean Association Southeast Asia Regional Office. Shurtleff W dan Akiko A. 1979. The Book of Tempeh. New York (US): Harper &
Row.
21 Steinkraus KH, JP van Buren, dan DP Hand. 1961. Studies on Tempeh, an Indonesian fermented soybean food. Publikasi Pertemuan Kebutuhan Protein untuk Bayi dan Anak-anak.
Sudiarso FD. 1993. Kajian teknologis dan finansial produk laru tempe kedelai. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Susi. 2012. Komposisi kimia dan asam amino pada tempe kacang nagara (Vigna unguiculata ssp. Cylindrica). Jurnal Agroscientiae 19 (1): 28-36.
Syarief et al. 1999. Wacana Tempe Indonesia. Surabaya: Universitas Katolik Widya Mandala.
Thanh. 2004. Dormancy, activation, and viability of Rhizopus oligosporus
sporangiospores. [Thesis]. Wageningen University. The Netherland.
Utami R. 2014. Karakterisasi komponen pembentuk rasa yang terdapat dalam ekstrak larut air tempe terfermentasi lanjut [thesis]. Bogor (ID): Institut Pertanian Bogor.
Wang N, DW Hatcher, RT Tyler, R Toews, dan EJ Gawalko. 2010. Effect of cooking on the composition of beans (Phaseolus vulgaris L.) and chickpeas (Cicer arietinum L.). Food Research International 43: 589–594
Wiesel I, HJ Rehm, dan B Bisping. 1997. Improvement of tempe fermentation by application of mixed cultures consisting of Rhizopus sp. and bacterial strains.
Appl. Microbiol. Biotechnol. 47: 218-225.
Wipradnyadewi Putu AS, Endang SR, Sri R. 2005. Isolasi dan identifikasi
Rhizopus oligosporus pada beberapa inokulum tempe [laporan proyek hibah]. Yogyakarta (ID): Universitas Gadjah Mada.
22
LAMPIRAN Lampiran 1. Uji lanjut Duncan protein total sampel
Total_Protein_Basis_Kering
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 2. Uji lanjut Duncan waktu inkubasi atas protein tempe kacang merah
Total_Protein_Basis_Kering
Duncan
Waktu_Inkubasi N Subset
1 2
24 jam 8 23.3250
48 jam 8 37.8537
36 jam 8 39.1199
Sig. 1.000 .442
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = 10.128. a. Uses Harmonic Mean Sample Size = 8.000. b. Alpha = .05.
Lampiran 3. Kurva standar BSA untuk pengukuran protein terlarut sampel
23
Lampiran 4. Uji lanjut Duncan jenis laru terhadap protein terlarut sampel
Protein_Terlarut
Means for groups in homogeneous subsets are displayed.
Based on observed means.
The error term is Mean Square(Error) = .067. a. Uses Harmonic Mean Sample Size = 6.000. b. Alpha = .05.
Lampiran 5. Uji lanjut Duncan protein terlarut seluruh sampel
Protein_Terlarut
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 6. Uji lanjut Duncan waktu inkubasi terhadap protein terlarut sampel
Protein_Terlarut
Duncan
Waktu_Inkubasi N Subset
1 2
24 jam 8 .6175
36 jam 8 2.3563
48 jam 8 2.5662
Sig. 1.000 .130
Means for groups in homogeneous subsets are displayed.
Based on observed means.
24
Lampiran 7. Uji lanjut Duncan rendemen sampel
Rendemen
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 8. Uji lanjut Dunnett kecerahan sampel terhadap tempe kedelai
Multiple Comparisons
Dependent Variable: Nilai_L Dunnett t (2-sided)
(I) Sampel (J) Sampel Mean Difference (I-J)
Std. Error Sig. 95% Confidence Interval Lower Bound Upper Bound
A24 Kontrol 1.741333 1.821308 .966 -4.15270 7.63537
A36 Kontrol -2.093667 1.821308 .903 -7.98770 3.80037
A48 Kontrol 6.241333* 1.821308 .035 .34730 12.13537
B24 Kontrol -78.833667* 1.821308 .000 -84.72770 -72.93963
B36 Kontrol -12.898667* 1.821308 .000 -18.79270 -7.00463
*. The mean difference is significant at the 0.05 level.
25 Lampiran 9. Uji lanjut Dunnett nilai a sampel terhadap tempe kedelai (kontrol)
Multiple Comparisons
Dependent Variable: Nilai_a Dunnett t (2-sided)
(I) Sampel (J) Sampel Mean Difference (I-J)
Std. Error Sig. 95% Confidence Interval Lower Bound Upper Bound
A24 Kontrol -.969667* .284193 .036 -1.88936 -.04997
*. The mean difference is significant at the 0.05 level.
a. Dunnett t-tests treat one group as a control. and compare all other groups against it.
Lampiran 10. Uji lanjut Dunnett nilai b sampel terhadap tempe kedelai (kontrol)
Multiple Comparisons
Dependent Variable: Nilai_b Dunnett t (2-sided)
(I) Sampel (J) Sampel Mean Difference (I-J)
Std. Error Sig. 95% Confidence Interval Lower Bound Upper Bound
A24 Kontrol -4.481667* .881949 .002 -7.33579 -1.62754
*. The mean difference is significant at the 0.05 level.
26
RIWAYAT HIDUP
Lulu Maknun merupakan mahasiswi Ilmu dan Teknologi Pangan IPB angkatan 47 yang lahir di Bogor. 25 April 1992 dari pasangan Saiful Bahri dan Sumiati. Anak kedua dari dua bersaudara ini memulai pendidikan di RA Nurul Falah Bogor (1996-1998). Dilanjutkan di SDN Panaragan 2 Kota Bogor (1998-2004). SMP Negeri 1 Bogor (2004-2007) di kelas Rintisan SBI. SMA Negeri 1 Bogor (2007-2010) di kelas SBI. dan diterima di ITP IPB melalui jalur USMI IPB. Sejak bangku sekolah dasar hingga menengah akhir. penulis banyak memperoleh prestasi di bidang akademik maupun non-akademik. Di masa sekolah dasar prestasi yang diraih berupa juara 3 menggambar dan mewarnai tingkat Sekolah Dasar se-Kota Bogor serta peraih NEM/ nilai Ujian Nasinal tertinggi di SDN Panaragan 2 Bogor. Di tingkat sekolah menengah pertama. prestasi yang diperoleh antara lain Juara 1 menulis puisi Bahasa Sunda tingkat Kota Bogor oleh DPRD Kota Bogor serta Juara 1 Lomba Cepat Tepat Sastra Indonesia “La Sastra 5” tingkat Jabodetabek. Di masa sekolah menengah atas. beberapa prestasi yang berhasil diukir di antaranya Juara 7 Debat APBN tingkat Jabodetabek. Juara 4