PENGARUH JENIS KAPANG TERHADAP MUTU KIMIA
DAN AKTIVITAS ANTIMIKROBA TEMPE KACANG
MERAH (
Phaseolus vulgaris
L.)
DEWI RATNA SARI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Jenis Kapang terhadap Mutu Kimia dan Aktivitas Antimikroba Tempe Kacang Merah (Phaseolus vulgaris L.) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2014
Dewi Ratna Sari
ABSTRAK
DEWI RATNA SARI. Pengaruh Jenis Kapang terhadap Mutu Kimia dan Aktivitas Antimikroba Tempe Kacang Merah (Phaseolus vulgaris L.). Dibimbing oleh SULIANTARI.
Tempe merupakan salah satu pangan yang banyak digemari di Indonesia. Selain kedelai, bahan baku dalam pembuatan tempe bermacam-macam, salah satunya ialah kacang merah. Kandungan gizi tempe kacang merah dengan kedelai memiliki sedikit perbedaan, namun masih tergolong tinggi. Selain kandungan gizinya yang tinggi, tempe juga menghasilkan senyawa antimikroba yang dapat bermanfaat bagi penderita diare. Dalam pembuatan tempe, peranan laru tempe mempengaruhi hasil dari produk jadi tempe. Laru yang paling banyak digunakan ialah R. oligosporus dan R. oryzae. Karakteristik kedua kapang ini berbeda sehingga akan berpengaruh pada tempe yang dihasilkan. Dalam penelitian ini, akan dilihat pengaruh jenis kapang terhadap mutu kimia tempe dan aktivitas antimikrobanya. Pengujian antimikroba dilakukan dengan metode sumur dengan menggunakan bakteri S.aureus sebagai bakteri gram positif dan E.coli sebagai bakteri gram negatif. Hasil penelitian menunjukkan bahwa tempe kacang merah dengan kapang R. oligosporus menghasilkan mutu terbaik dari segi kandungan asam amino dan antitripsin. Kadar asam amino tertinggi ialah tempe dengan penambahan kapang campuran dalam satu laru, yaitu sebesar 314396 mg/kg. Namun tempe dengan laru Rhizopus oligosporus dan tempe dengan penambahan kapang campuran dalam satu laru memiliki kadar asam amino yang tidak berbeda nyata pada taraf signifikansi 0.05. Selain itu, tempe kacang merah dengan kapang
R. oligosporus mempunyai kandungan antitripsin paling rendah, yaitu 8360.4 TUI, bila dibandingkan dengan tempe kacang merah yang lainnya. Keempat tempe kacang merah yang dihasilkan tidak mengandung oligosakarida dan tidak memiliki aktivitas antimikroba terhadap bakteri S. aureus dan E. coli.
ABSTRACT
DEWI RATNA SARI. The influence of mold types on chemical qualities and antimicrobial activity of red bean tempeh (Phaseolus vulgaris L.) . Supervised by SULIANTARI
Tempeh is one of favourite food in Indonesia. In addition to soybean, raw materials for the manufacture of tempeh are various, one of them is red bean. Nutrient content of red bean tempeh with soybean have a slight difference, but still relatively high. In addition to its high content of nutrition value, tempeh also produces antimicrobial compounds that can be beneficial for patients with diarrhea. In the making of tempeh, mold is the one who will affect the product. The most commonly used of mold are R. oligosporus and R. oryzae. The characteristics of each molds are different, and it affects the result of tempeh. This research shows the influence of mold types in the chemical qualities of tempeh and antimicrobial activity. The testing of antimicroba was conducted using wells method with S. aureus as gram positive bacteria and E.coli as gram negative bacteria. The result shows that red bean tempeh with R. oligosporus produces the best quality in terms of amino acids and antitrypsin. The highest levels of amino acid is in tempeh C, i.e., 314396 mg/kg. However, tempeh B and tempeh C have no significantly different in level of amino acid (α<0.05). In addition, red bean tempeh with R. oligosporus have the lowest level of antitrypsin, i.e., 8360.4 TUI, if it compares to others. Four red bean tempeh do not contains oligosaccharide in all treatments, and they do not have antimicrobial activity against S. aureus and E. coli.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PENGARUH JENIS KAPANG TERHADAP MUTU KIMIA
DAN AKTIVITAS ANTIMIKROBA TEMPE KACANG
MERAH (
Phaseolus vulgaris
L.)
DEWI RATNA SARI
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 ini ialah Pengaruh Jenis Kapang terhadap Mutu Kimia dan Aktivitas Antimikroba Tempe Kacang Merah (Phaseolus vulgaris L.)
Selama masa perkuliahan, penelitian, hingga tahap pembuatan skripsi, penulis banyak sekali mendapat bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada :
1. Ibu Dr. Dra. Suliantari, MS. selaku pembimbing yang telah memberikan banyak bimbingan, saran, nasihat, evaluasi, arahan, dan senantiasa selalu memberikan motivasi dari masa perkuliahan, tahap penelitian, hingga penyusunan skripsi.
2. Ibu Antung Sima Firlieyanti STP, Msc. dan Bapak Dr. Eko Hari Purnama, STP, MSc yang senantiasa memberikan bimbingan dan saran dalam penelitian
3. Ibunda tercinta, Siti Rochaeni yang tak hentinya berdoa dan memberikan semangat serta kasih sayangnya. Tak lupa juga kepada kakak-kakak ku tersayang, Kusdiantoro, Bambang Suprapto, dan Heru Rudiyanto yang selalu mendukung dan memberikan banyak motivasi
4. Seluruh laboran Departemen Ilmu dan Teknologi Pangan, Mbak Nurul, Mbak Ari, Mas Edi, Pak Gatot, Bu Antin, Mba Irin, Mba Ririn, Pak Yahya, Pak Rojak, Pak Sobirin, Bu Ika yang senantiasa membantu selama penelitian
5. Rekan-rekan seperjuangan dalam penelitian, Vega, Isna, Lulu, Tommy , Barli, dan Andini, yang telah banyak membantu dan menemani
6. Sahabat tersayang, Alfia Nurul Ilma, Anggun S Putri, Desi Aristawati, dan Pipit Pratama yang senantiasa memberikan dukungan, saran, dan semangat
7. Segenap dosen serta staff Departemen Ilmu dan Teknologi Pangan atas ilmu yang telah diberikan kepada penulis serta selalu membantu dengan ramah
8. Teman-teman seangkatan, keluarga besar ITP 47 dan Himitepa yang telah banyak memberikan rasa suka dan duka bersama
9. Keluarga besar Pondok Harmoni, Ibu Oki, Mbak Ika, Eci, dan Sendy yang menjadi keluarga kedua di Bogor
10. Ikatan Keluarga Indramayu (IKADA) yang siap memberikan bantuan dan dukungan serta telah menjadi keluarga di Bogor
Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, Oktober 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 3
Bahan 3
Alat 3
Metode Analisis 5
HASIL DAN PEMBAHASAN 11
Pembuatan tempe 11
Karakteristik kimia 12
Aktivitas Antimikroba 20
SIMPULAN DAN SARAN 22
Simpulan 22
Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 26
DAFTAR TABEL
1 Komposisi zat gizi kacang tiap 100 gram bahan 1
2 Kemampuan ekstrak tempe kacang merah dalam menghambat
pertumbuhan bakteri uji 21
3 Komposisi Asam Amino Kacang Kedelai dan Kacang Merah 21
DAFTAR GAMBAR
1 Prosedur Pembuatan Tempe Kacang Merah 4
2 Penampakan tempe A, B, C, dan D 11
3 Kadar air tempe kacang merah basis basah perlakuan A, B, C, dan D 12 4 Kadar abu tempe kacang merah basis kering perlakuan A, B, C, dan D 13 5 Kadar lemak tempe kacang merah basis kering perlakuan A, B, C, D 14 6 Kadar protein tempe kacang merah basis kering perlakuan A, B, C, D 15 7 Kadar karbohidrat tempe kacang merah basis kering perlakuan A, B, C,
D 16
8 Kandungan antitripsin tempe kacang merah basis kering perlakuan A, B,
C, D 16
9 Kadar isoflavon tempe kacang merah basis kering tempe A, B, C, D 18 10 Komposisi asam amino tempe kacang merah perlakuan A, B, C, D 19 11 Kadar asam amino total tempe kacang merah basis kering tempe A, B,
C, D 20
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Tempe merupakan salah satu produk pangan tradisional yang banyak digemari oleh masyarakat khususnya di Indonesia. Selain memiliki rasa yang disukai, tempe juga mengandung banyak sekali manfaat bagi tubuh karena kandungan gizi di dalamnya, terutama kadar proteinnya yang tinggi, sehingga tempe dijadikan sebagai sumber protein nabati. Tempe diolah dengan teknologi fermentasi oleh kapang Rhizopus sp. yang dikenal sebagai ragi tempe. Proses fermentasi tersebut dapat menyebabkan terjadinya perubahan kimia dan fisik pada bahan baku tempe yang digunakan sehingga menjadi lebih mudah dicerna oleh tubuh. Dalam pembuatan tempe, bahan baku yang sering digunakan ialah kacang kedelai. Secara kuantitatif, nilai gizi tempe sedikit lebih rendah daripada nilai gizi kedelai. Namun, secara kualitatif, nilai gizi tempe lebih tinggi. Hal ini disebabkan tempe memiliki daya cerna yang baik.
Ada berbagai jenis tempe tergantung dari jenis bahan baku yang digunakan. Namun yang paling sering ada di pasaran adalah tempe berbahan baku kedelai (Winarno 1985). Bahan lain yang dapat digunakan untuk membuat tempe adalah koro benguk, lamtoro, kacang hijau, dan lain-lain. Kacang merah merupakan salah satu jenis kacang yang mempunyai kandungan gizi cukup tinggi dan tidak terlalu jauh berbeda dengan kacang kedelai. Kandungan gizi dari kacang merah dan kacang kedelai dapat dilihat pada Tabel 1.
Tabel 1. Komposisi zat gizi kacang tiap 100 Gram Bahan Zat Gizi per 100
gram Kacang Merah Kacang Kedelai
Energi (kkal) 336 331
Protein (g) 23.1 34.9
Lemak (g) 1.7 18.1
Karbohidrat (g) 59.5 34.8
Kalsium (mg) 80 227
Fosfor (mg) 400 585
Besi (mg) 5.0 8.0
Vitamin A (IU) 0 110
Vitamin B1 (mg) 0.6 1.07
Vitamin C (mg) 0 0
Air (g) 12.0 7.5
2
Tempe selain memiliki gizi yang tinggi, juga memiliki kelebihan lain yaitu terdapat aktivitas antimikroba di dalamnya. Aktivitas antibakteri pada tempe dilaporkan pertama kali oleh Wang et al. (1969) dalam Pawiroharsono (1996) yang menyatakan bahwa senyawa antibakteri pada ekstrak tempe terdiri dari senyawa gliko-protein dan dapat menghambat beberapa bakteri Gram positif. Menurut Kobayasi et al. (1992), tempe mengandung senyawa antibakteri yang memiliki aktivitas antibakteri terhadap bakteri Gram positif seperti Bacillus subtilis, Staphylococcus aureus, dan Streptococcus cremoris, serta Listeria. Hasil penelitian yang dilakukan oleh Affandi dan Mahmud (1985) menyatakan tempe mengandung zat antibakteri yang dapat menghambat pertumbuhan bakteri penyebab diare seperti Salmonella sp. dan Shigella sp.. Hal tersebut memberikan peluang untuk memanfaatkan tempe sebagai bahan makanan untuk penderita diare.
Dalam pembuatan tempe, peranan laru tempe sangat mempengaruhi hasil dari tempe yang dibuat. Hal ini disebabkan laru tempe mempunyai enzim yang dapat menghidrolisis komponen kompleks menjadi komponen yang lebih sederhana sehingga lebih mudah dicerna. Kapang yang berperan dalam pembuatan tempe adalah dari genus Rhizopus sp., yaitu umumnya Rhizopus oligosporus sebagai kapang pemeran utama yang terkandung dalam tempe (Pawiroharsono 1996). Namun ternyata ditemukan pula jenis kapang lain yang dapat menjadi kapang tempe dan membentuknya secara sempurna yaitu Rhizopus oryzae. Steinkraus et al. (1960) telah membuktikan sejumlah strain R. oryzae
dapat memfermentasi kedelai seperti R. oligosporus, namun membutuhkan waktu yang lebih lama. Kedua jenis kapang tersebut tentunya memiliki perbedaan. Kapang R. oligosporus mensintesis enzim protease lebih banyak untuk memecah protein dibandingkan dengan R. oryzae. Sedangkan R. oryzae mensintesis lebih banyak enzim amilase untuk memecah pati. Oleh karena itu, biasanya dipakai keduanya dengan kadar R. oligosporus lebih banyak, yaitu 1:2 (Koswara 1992). Untuk itu, dalam penelitian ini, akan diamati pengaruh jenis laru pada pembuatan tempe kacang merah. Selain itu, juga diamati pengaruh dari laru tersebut terhadap mutu kimia (kandungan oligosakarida, asam amino, isoflavon, dan antitripsin) dan aktivitas antimikroba. .
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh dari jenis kapang (R.oligosporus, R.oryzae, campuran keduanya dalam satu laru, dan campuran keduanya dalam laru yang berbeda) terhadap mutu kimia tempe kacang merah (kandungan oligosakarida, asam amino, isoflavon, serta antitripsin) dan aktivitas antimikroba.
Manfaat Penelitian
3
METODE
Bahan
Bahan yang digunakan dalam penelitian ini adalah kacang merah, laru tempe yang terdiri dari laru kapang Rhizous oryzae, Rhizopus oligosporus, dan campuran kedua kapang, serta cuka makan DIXITM 25%. Selain itu, bahan kimia yang digunakan untuk analisis yaitu seperti garam-garam jenuh, heksana, larutan HCl 25%, aquades, H2SO4 pekat, HgO, K2SO4, Larutan 60% NaOH 5%
Na2S2O2.5H2O, H2BO3 jenuh, HCl 0.02 N, etanol 95%, batu didih, indikator
metilen red dan metilen blue, etanol 70%, acetonitril, aquabidest, stakiosa, rafinosa, fruktosa, sukrosa, glukosa, maltosa, Natrium Azid, metanol, NaOH 2N, asam asetat glasial, genistin, daidzein, genistein, glycitein, HCl 6N, AABA, AccQ- Fluor Borate, reagent Fluor A, NaOH 0.01 N, larutan tripsin, larutan BAPNA, dan asam asetat 30%. Untuk analisis antimikroba, dibutuhkan kultur bakteri S. aureus dan E. coli, medium NA, NB, DMSO (Dimethyl Sulfoxide), Amoxicilin.
Alat
Alat yang digunakan adalah baskom, panci, saringan peniris, kompor, pengaduk kayu, sendok besar, plastik, rak. Selain itu, alat yang digunakan untuk analisis meliputi cawan alumunium, desikator, oven, neraca analitik, termometer, penjepit cawan (gegep), cawan porselen dan tutupnya, tanur, kertas saring Whatman, membran filter ukuran 0.22 µm dan 0.45 µm, alat ekstraksi soxhlet, labu lemak, kapas, pemanas Kjeldahl, labu Kjeldahl, alat destilasi lengkap, buret, labu takar, pipet mohr, erlenmeyer, gelas beaker, magnetic stirer, pipet tetes, botol semprot, tabung reaksi, gelas ukur, sentrifuse, HPLC (High Performance Liquid Chromatography) vortex, blender, freezer, sonikator, penyaring vakum, cawan petri, inkubator, waterbath, vial bertutup, syringe, dan alat pembentuk sumur.
Metode Penelitian
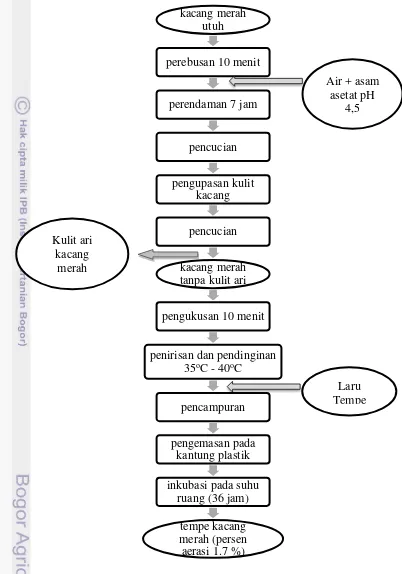
Penelitian ini terdiri dari beberapa tahap yaitu tahap I dan tahap II. Pada tahap I mempelajari pembuatan tempe kacang merah. Sedangkan pada tahap II, dilakukan produksi tempe kacang merah dengan berbagai jenis kapang. Pada tahap ini, dilakukan analisis mutu dan pengujian aktivitas antimikroba.
4
Gambar 1. Prosedur Pembuatan Tempe Kacang Merah kacang merah
utuh
perebusan 10 menit
perendaman 7 jam
pencucian
pengupasan kulit kacang
pencucian
kacang merah tanpa kulit ari
pengukusan 10 menit
penirisan dan pendinginan 35oC - 40oC
pencampuran
pengemasan pada kantung plastik inkubasi pada suhu
ruang (36 jam) tempe kacang merah (persen aerasi 1.7 %)
Air + asam asetat pH
4,5
Laru Tempe Kulit ari
5
Metode Analisis
Analisis Kadar Air Metode Oven (SNI 01-2891-1992)
Analisis kadar air dilakukan dengan terlebih dahulu mengeringkan cawan kosong dan tutupnya dalam oven selama 15 menit, lalu cawan didinginkan dalam desikator. Cawan yang sudah kering diambil dengan penjepit dan ditimbang beratnya. Sampel lalu dimasukkan ke dalam cawan sebanyak 2 gram sampel, kemudian cawan beserta sampel dikeringkan dalam oven bersuhu 105oC selama 3 jam. Setelah 3 jam ambil cawan dengan penjepit lalu didinginkan dalam desikator dan timbang. Kadar air dihitung dengan rumus:
%
W1: Bobot cawan+ sampel kering (gram) W2: Bobot cawan (gram)
Analisis Kadar Abu Metode Pengabuang Kering (SNI 01-2891-1992)
6
Analisis Kadar Lemak Metode Soxhlet (SNI 01-2891-1992)
Analisis kadar lemak dilakukan dengan metode ekstraksi soxhlet. Untuk produk kering sampel harus dihidrolisis terlebih dahulu karena matriks bahan yang cukup kompleks. Labu lemak yang digunakan dikeringkan dalam oven, kemudian didinginkan dalam desikator lalu ditimbang. Sebanyak 2 gram contoh ditambahkan dengan 20 ml air dan 30 ml HCl 25%, kemudian dididihkan selama 15 menit dalam gelas piala yang ditutup gelas arloji. Larutan tersebut disaring dengan kertas saring, selanjutnya dicuci dengan air panas hingga pH netral. Kertas saring tersebut dikeringkan dalam oven bersuhu 105oC hingga kering.
Kertas saring yang telah dikeringkan dimasukkan ke dalam selongsong dengan sumbat kapas lalu dimasukkan ke dalam alat ekstraksi soxhlet dan dihubungkan dengan kondensor dan labu lemak. Alat kondensor diletakkan di atasnya dan labu lemak diletakkan di bawahnya. Pelarut hexana dimasukkan ke dalam labu lemak secukupnya,lalu didiamkan selama 6 jam agar terjadi proses ekstraksi. Pelarut yang ada dalam labu lemak didestilasi dan ditampung kembali. Labu lemak yang berisi lemak hasil ekstraksi dikeringkan dalam oven pada suhu 105oC lalu didinginkan dalam desikator dan ditimbang. Pengeringan diulangi hingga mencapai berat tetap. Kadar lemak dihitung dengan rumus:
W 100%
Analisis Kadar Protein Metode Kjeldahl (AOAC 960.52)
Analisis kadar protein ini menggunakan metode Kjeldahl. Sebanyak 0.25 gram contoh ditimbang di dalam labu Kjeldahl, lalu ditambahkan 1.0 ± 0.1 gram K2SO4, 40 ± 10 ml HgO, dan 2.0 ± 0.1 ml H2SO4, selanjutnya contoh didihkan
sampai cairan jernih kemudian dididnginkan. Larutan jernih ini dipindahkan ke dalam alat destilasi secara kuantitatif. Labu Kjeldahl dibilas dengan 1-2 ml air destilata, kemudian air cuciannya dimasukkan ke dalam alat destilasi, pembilasan dilakukan sebanyak 5-6 kali. Tambahkan 8-10 ml larutan 60% NaOH – 5% Na2S2O3. 5H20 ke dalam alat destilasi.
Di bawah kondensor dilatakkan erlenmeyer yang berisi 5 ml larutan H3BO3
jenuh dan 2-4 tetes indikator (campuran 2 bagian 0.2% metilen red dan 1 bagian 0.2% metilen blue dalam etanol 95%). Ujung tabung kondensor harus terendam dalam larutan H3BO3, kemudian dilakukan destilasi sehingga diperoleh sekitar 15
7 terjadi perubahan warna dari hijau menjadi abu-abu. Kadar protein kasar Kjeldahl data dihitung denga rumus:
Analisis Karbohidrat Metode By Difference
Setelah diperoleh kadar air, abu, lemak, dan protein, maka kadar karbohidrat dapat ditentukan dengan menghitung selisih bobot sampel dengan kadar-kadar tersebut. Karbohidrat diasumsikan sebagai bobot sampel selain air, abu, lemak dn protein (Faridah et al. 2012). Cara perhitungan kadar karbohidrat metode by difference sebagai berikut:
Kadar karbohidrat (%) = 100% - (% air + %abu + %protein + % lemak)
Analisis Antitripsin (Kakade et al. 1974)
a. Persiapan Ekstrak
Sebanyak 1 gram tepung sampel dilarutkan dalam 50 mL NaOH 0.01 N. Sampel diaduk selama 3 jam dengan menggunakan magnetic stirer. Hasil dari pengadukan tersebut kemudian dilakukan sentrifuge dengan kecepatan 5000 rpm selama 10 menit pada suhu 5oC.
b. Analisis
Sejumlah ekstrak (0; 0.2; 0.4; 0.6; 0.8; 1.0 mL) dipipet ke dalam tabung reaksi. Masing-masing ekstrak ditambahkan dengan air destilata hingga volume mencapai 2 mL. Sebanyak 2 mL larutan tripsin ditambahkan ke dalam masing-masing tabung reaksi. Setelah itu, dipanaskan dalam penangas air dengan suhu 37oC selama 5 menit. Setelah dingin, larutan BAPNA bersuhu 37oC ditambahkan sebanyak 5 mL, kemudian vortex. Ekstrak dipanaskan kembali menggunakan penangas air dengan suhu 37oC selama 10 menit. Setelah 10 menit, sebanyak 1 mL asam asetat 30% ditambahkan ke dalam masing-masing tabung, vortex. Bila larutan yang dihasilkan berwarna jernih, maka pengukuran absorbansi dengan spektrofotometer langsung dilakukan dengan panjang gelombang 410 nm. Bila sampel yang dihasilkan keruh, maka perlu dilakukan penyaringan dengan kertas saring. Aktivitas inhibitor tripsin dinyatakan sebagai satuan tripsin yang dihambat (Trypin Unit Inhibited, TUI) dengan rumus:
8
Analisis Oligosakarida (Wang et al. 2007 yang dimodifikasi)
a. Ekstraksi Oligosakirda
Sebanyak 2 gram sampel tempe yang telah ditepungkan dihilangkan lemaknya dengan penambahan heksana, kemudian dilakukan pengadukan dengan menggunakan magnetic stirer selama 3 jam. Sampel yang telah diekstrak kemudian disaring dengan kertas Whatman#41. Residu secara kuantitatif dipindahkan ke dalam gelas piala. Oligosakarida diekstrak dengan penambahan etanol 70% sebanyak 20 mL, lalu dipanaskan dengan waterbath dengan suhu 70oC selama 1 jam. Ekstrak kemudian disaring, lalu dimasukan dalam labu takar 100 mL, tera dengan etanol 70%. Hasil ekstrak sebelum diinjeksi ke dalam HPCL, disaring terlebih dahulu dengan menggunakan penyaring membran berukuran 0.45 µm, sampel dimasukan dalam vial tertutup. Setelah itu, sampel ditambahkan Natrium Azid sebanyak 10% dari volume dalam vial. Sampel kemudian siap untuk diinjeksi.
Pada metode ini tidak dilakukan sentrifugasi dan penghilangan etanol dengan hembusan N2 seperti yang telah dilakukan oleh Wang. Hal ini disebabkan,
penghilangan etanol dengan N2 memerlukan waktu yang lama karena perbedaan
titik uap yang cukup jauh. Etanol bisa dihilangkan dengan rotary evaporator, namun dikhawatirkan oligosakarida yang akan dianalisis akan rusak karena perlakuan panas tersebut. Kemudian, tahap sentrifugasi diubah dengan melakukan penyaringan membran.
b. Analisis HPLC
HPLC yang digunakan menggunakan detektor Refractive Index dengan kolom ZORBAX Carbohydrate Analysis Columns berukuran 5 µm x 4.6 mm x 150 mm. Fase gerak yang digunakan ialah campuran acetonitril dan aquabides dengan perbandingan 75:25, dengan kecepatan aliran 1.4 mL/menit. Standar dalam pengujian kandungan oligosakarida ialah rafinosa dan stakiosa, sedangkan standar untuk menentukan kandungan gula sederhana ialah fruktosa, sukrosa, glukosa, dan maltosa. Kadar oligosakarida dihitung dengan rumus sebagai berikut:
dimana: A spl (luas area peak sampel); A std (luas area peak standar); Vs(volume larutan ekstrak sampel, ml); W (bobot sampel, g bk)
Analisis Isoflavon Metode HPLC (AOAC 2001)
a. Persiapan contoh
9 secara kuantitatif ke dalam labu takar 50 mL, tera dengan menggunakan larutan ekstraksi. Hasil tersebut disaring dengan kertas saring Whatman No. 42 dan kemudian filtrat dipipet sebanyak 5 mL ke dalam labu takar 10 mL. Selanjutnya ditambahkan aquabidest sebanyak 4 mL, kemudian tera dengan metanol dan air dengan perbandingan 1:1, kocok. Sampel tersebut disentrifuge dengan kecepatan 7000 rpm selama 5 menit. Supernatan yang dihasilkan kemudian dimasukkan ke dalam vial dan siap untuk diinjeksi ke dalam HPLC.
b. Analisis HPLC
HPLC yang digunakan ialah menggunakan UV Detector λ 260 nm dengan kolom C18 Reverse phase 200 x 2.1 mm dan laju aliran 0.4 mL/menit. Dalam analisis ini, digunakan dua fase gerak. Fase gerak yang pertama ialah air : metanol : asam asetat glasial (88:10:2), dan fase gerak kedua ialah metanol : asam asetat glasial (98:2). Standar yang digunakan ialah genistin, daidzein, genistein, dn glycitein. Perhitungan kadar isoflavon ialah dengan rumus:
dimana: Aspl (luas area sampel); Astd (luas area standar); Cstd (konsentrasi standar); FP (faktor pengencer); W (bobot sampel, kg); V (Volum labu L)
Analisis Komposisi Asam Amino (Nollet dan Leo ML 1996)
a. Persiapan contoh
Sebanyak 0.1 gram contoh ditambahkan dengan 5 mL HCl 6N dan divortex, lalu biarkan reaksi hidrolisis tersebut terjadi selama 22 jam pada suhu 110oC. Setelah itu, sampel didinginkan dan dipindahkan ke dalam labu takar 50 mL lalu ditera dengan menggunakan aquabidest, kemudian disaring dengan filter berukuran 0.45 µm. Filtrat dipipet sebanyak 500 µl dan direaksikan dengan 40 µl AABA dan 460 µl aquabidest, lalu sebanyak 10 µl larutan hasil reaksi tersebut diambil dan direaksikan dengan menggunakan AccQ-Fluor Borate sebanyak 70 µl, vortex. Selanjutnya, tambahkan dengan 20 µl reagent fluor A, vortex, dan didiamkan selama 1 menit. Hasilnya diinkubasi pada suhu 55oC selama 10 menit. Sampel siap untuk diinjeksi ke dalam HPLC.
a. Analisis HPLC
HPLC yang dipakai dalam analisis ini menggunakan detektor Fluorescense dengan eksitasi 250 nm dan emisi 395 nm, dan kolom yang digunakan ialah AccQtag column (3.9 x 150 mm). Analisis dilakukan pada suhu 37oC dengan laju aliran 1.0 mL/menit. Fase gerak yang digunakan ialah Acetonitril 60% - AccQTag Eluent A, sistem gradien komposisi. Standar yang digunakan ialah mix asam amino dan AABA sebagai internal standar. Perhitungan asam amino pada sampel dapat dilakukan dengan rumus:
Kadar Asam Amino (mg/kg) =
10
dimana: A std (luas area peak standar); A spl (luas area peak sampel); AABA std (standar AABA); BM (Bobot molekul); FP (faktor pengencer); Cstd (konsentrasi standar); Wspl (Bobot sampel, g).
Analisis Aktivitas Antimikroba
a. Ekstraksi Tempe (Metode Kuligowski et al. 2013 yang dimodifikasi)
Sebanyak 10 gram tempe dihomogenisasi dengan air sebanyak 20 mL menggunakan blender selama 3 menit. Hasil homogenisasi tersebut kemudian disaring dengan menggunakan kertas saring. Setelah itu, filtrat disentrifuge dengan kecepatan 3000 rpm selama 30 menit. Supernatan hasil sentrifuge disaring menggunakan membran filter steril dengan ukuran pori sebesar 0.22 µm (Mil-lipore).
Pada metode ini dilakukan penambahan tahapan sentrifugasi untuk mengendapkan padatan-padatan hasil hasil homogenisasi tempe. Selain itu, alat homogenizer H-500 Pol-Eko Aparatura yang digunakan oleh Kuligowski et al
untuk homogenisasi diganti dengan blender.
Pengujian Aktivitas Antibakteri Metode Difusi Agar (Wolf dan Gibbons 1996 yang dimodikfikasi)
1. Persiapan Kultur Uji
Sebanyak 1-2 ose mikroorganisme dari biakan agar miring diinokulasikan dalam medium NB cair 10 mL dan diinkubasikan pada suhu 37oC selama 24 jam.
2. Pengujian Aktivitas Antimikroba
Metode pengujian aktivitas antimikroba menggunakan metode difusi agar yang dimodifikasi, yaitu pada metode Wolf dan Gibbons menggunakan Nisin Bioassay Agar (NBA) dan pada penelitian ini media yang digunakan adalah Nutrient Agar (NA). Sebanyak 0.01 mL suspensi bakteri S. aureus dengan konsentrasi sekitar 107 koloni/mL dan 0.001 mL suspensi bakteri E.coli dengan konsentrasi sekitar 108 koloni/mL yang telah disegarkan selama 24 jam dalam medium NB, dicampurkan dengan medium NA steril masing-masing sebanyak 100 mL dalam erlenmeyer. Selanjutnya, dibuat 3-4 sumur pada agar tersebut dengan diameter 6 mm, lalu dimasukkan ± 40 µl sampel uji ke dalam masing-masing sumur. Cawan diinkubasi pada suhu 37oC selama 24-48 jam dengan posisi cawan menghadap ke atas. Kemudian, diamati adanya penghambatan dengan mengukur diameter zona bening.
Sampel uji yang digunakan ialah ekstrak tempe kacang merah dengan perlakuan laru A, B, C, dan D. Kontrol negatif yang digunakan ialah DMSO dan kontrol positifnya ialah amoxicillin. Ekstrak yang digunakan mempunyai konsentrasi 100% (tanpa diencerkan dengan DMSO), sedangkan amoxicillin
dilarutkan ke dalam DMSO. Konsentrasi amoxicillin untuk pengujian E. coli
ialah 0.05 % dan untuk pengujian S. aureus ialah 0.01 % ( Abdalla 2013). Penggunaan DMSO sebagai pelarut dilakukan karena DMSO dapat melarutkan senyawa organik polar dan senyawa organik non polar. Penggunaan amoxicillin
dengan konsentrasi yang lebih rendah pada S.aureus dilakukan karena
11 enterokokus yang biasanya menimbulkan penyakit infeksi pencernaan (Parhusip 2006).
Analisis Data
Untuk mengetahui apakah ada perbedaan nyata antar perlakuan, maka dilakukan uji one-way ANOVA dan uji lanjut Duncan dengan menggunakan SPSS 16.0.
HASIL DAN PEMBAHASAN
Pembuatan Tempe
Proses pembuatan tempe kacang merah sama dengan pembuatan tempe kedelai, yaitu melalui tahap perebusan, perendaman, pengupasan, dan pengukusan. Laru yang ditambahkan terdiri dari empat perlakuan, yaitu (A) R. oryzae; (B) R. oligosporus; (C) campuran R. oryzae dan R.oligosporus 1:1 dalam satu laru; dan (D) campuran R. oryzae dan R. oligosporus 1:1 dari laru yang berbeda, dimana masing-masing laru dicampurkan sebanyak 5 gr/kg kacang merah dalam kondisi hangat (sekitar 35oC – 40oC). Selanjutnya dikemas dalam kantung plastik yang telah diberi lubang.
Kacang yang telah dikemas kemudian disimpan pada suhu ruang selama 36 jam. Menurut Maknun (2013) (belum dipublikasi), waktu inkubasi tersebut merupakan waktu inkubasi terbaik untuk tempe kacang merah masing-masing laru . Penampakan dari tempe kacang merah masing-masing perlakuan dapat dilihat pada Gambar 2.
Tempe A Tempe B
Tempe C Tempe D
Gambar 2. Penampakan tempe kacang merah perlakuan A, B, C, dan D Keterangan: A = R. oryzae
B = R. oligosporus
C = campuran R. oryzae dan R.oligosporus dalam satu laru
12
Secara keseluruhan, penampakan tempe kacang merah dengan berbagai perlakuan tidak jauh berbeda dengan tempe kedelai. Tempe kacang merah memiliki tekstur yang kompak dengan miselium berwarna putih. Namun, aroma tempe kacang merah lebih menyengat atau berbau seperti alkohol. Pada proses fermentasi, terjadi penguraian senyawa kompleks menjadi senyawa yang lebih sederhana. Kandungan karbohidrat kacang merah lebih tinggi dibandingkan kacang kedelai, yaitu sekitar 59.5 gram/100 gram bahan, sehingga dari hasil fermentasi karbohidrat akan dihasilkan alkohol yang lebih tinggi dibandingkan kedelai.
Karakteristik Kimia
Kadar Air
Kadar air diukur dengan menggunakan metode oven. Kadar air tempe kacang merah dalam basis basah dapat dilihat pada Gambar 3.
Gambar 3. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar air tempe kacang merah
Kadar air tempe kacang merah (basis basah) dengan perlakuan laru A, B, C, dan D, berturut-turut ialah 60.8 %, 61.24 %, 62.52 %, dan 62.72 %. Kadar air tersebut tergolong tinggi sehingga tempe termasuk bahan pangan yang mudah rusak dan memiliki daya tahan sekitar 2-3 hari (Koswara 1992). Data kadar air tempe kacang merah dapat dilihat pada Lampiran 1. Dari keempat perlakuan tersebut, tempe dengan penambahan laru D (campuran R. oligosporus dan R. oryzae dari laru yang berbeda) mengandung kadar air lebih banyak, sedangkan tempe dengan penambahan laru A (R. oryzae) mengandung kadar air lebih sedikit. Berdasarkan hasil uji statistik, keempat perlakuan tempe tersebut tidak berbeda nyata pada taraf signifikansi 0.05 (Lampiran 2). Hal ini menunjukkan bahwa perlakuan jenis kapang tidak mempengaruhi kadar air pada tempe kacang merah.
Menurut Karisma (2014), kadar air kacang merah utuh adalah 16.22 % dan kacang merah yang telah direbus dan rendam asam adalah 56.83 %. Selama fermentasi, terjadi peningkatan kadar air dari produk yang dihasilkan. Kondisi ini diduga karena adanya metabolisme mikroba selama fermentasi dan menghasilkan air hasil dari pemecahan substrat tersebut (Dwinaningsih 2010).
13
Kadar Abu
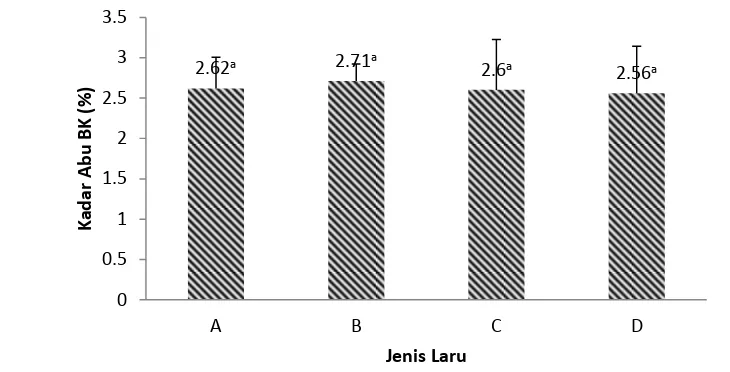
Analisis kadar abu dilakukan untuk mengetahui kandungan mineral yang terdapat dalam bahan pangan. Kadar abu diukur dengan menggunakan metode pengabuan kering. Kadar abu tempe kacang merah dalam basis kering dapat dilihat pada Gambar 4.
Gambar 4. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar abu tempe kacang merah
Kadar abu (basis kering) tempe kacang merah dengan penambahan laru A, laru B, laru C, dan laru D, berturut-turut ialah 2.62 %, 2.71 %, 2.60 %, 2.56 %. Data kadar abu tempe kacang merah dapat dilihat pada Lampiran 1. Dari keempat perlakuan, dapat diketahui bahwa tempe kacang merah dengan penambahan laru B (R. oligosporus) memiliki kadar abu terbesar, yaitu 2.71 %, sedangkan tempe kacang merah dengan penambahan laru D (campuran R. oligosporus dan R. oryzae
dari laru yang berbeda) memiliki kadar abu paling sedikit, yaitu 2.56 %. Namun menurut hasil uji statistik, keempat perlakuan tempe kacang merah tersebut tidak berbeda nyata pada taraf 0.05 (Lampiran 3). Hal ini menunjukkan perlakuan kapang tidak memberikan pengaruh yang nyata pada kadar abu tempe kacang merah.
Kacang merah utuh mempunyai kadar abu sebesar 4.26 % dan kacang merah yang telah direbus adalah 2.77 %. Adanya proses perebusan, perendaman, serta fermentasi dalam pembuatan tempe akan menyebabkan komponen mineral tersebut menjadi larut sehingga terjadi penurunan kadar abu pada tempe (Karisma 2014).
Kadar Lemak
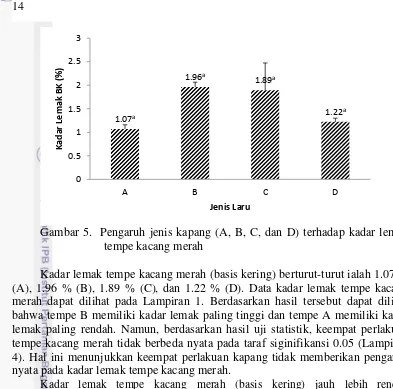
Kadar lemak diukur dengan menggunakan metode soxhlet. Kadar lemak tempe kacang merah dalam basis kering dapat dilihat pada Gambar 5.
14
Gambar 5. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar lemak tempe kacang merah
Kadar lemak tempe kacang merah (basis kering) berturut-turut ialah 1.07 % (A), 1.96 % (B), 1.89 % (C), dan 1.22 % (D). Data kadar lemak tempe kacang merah dapat dilihat pada Lampiran 1. Berdasarkan hasil tersebut dapat dilihat bahwa tempe B memiliki kadar lemak paling tinggi dan tempe A memiliki kadar lemak paling rendah. Namun, berdasarkan hasil uji statistik, keempat perlakuan tempe kacang merah tidak berbeda nyata pada taraf siginifikansi 0.05 (Lampiran 4). Hal ini menunjukkan keempat perlakuan kapang tidak memberikan pengaruh nyata pada kadar lemak tempe kacang merah.
Kadar lemak tempe kacang merah (basis kering) jauh lebih rendah dibandingkan dengan kadar lemak tempe kedelai menurut SNI 01-3144-2009 yaitu 28 %. Hal ini diduga karena kandungan lemak dari kacang merah lebih rendah dari kedelai yaitu 1.7 % untuk kacang merah dan 18.1 % untuk kedelai (Depkes 1992).
Proses fermentasi yang terjadi dalam pembuatan tempe dapat menurunkan kadar lemak. Penurunan kadar lemak dipengaruhi oleh aktivitas enzim lipase
Rhizopus sp.. Enzim tersebut akan menghidrolisis trigliserol menjadi asam lemak bebas yang akan digunakan sebagai sumber energi kapang tersebut. Hal itulah yang menyebabkan kandungan lemak menurun (Kumalasari 2012).
Kadar Protein
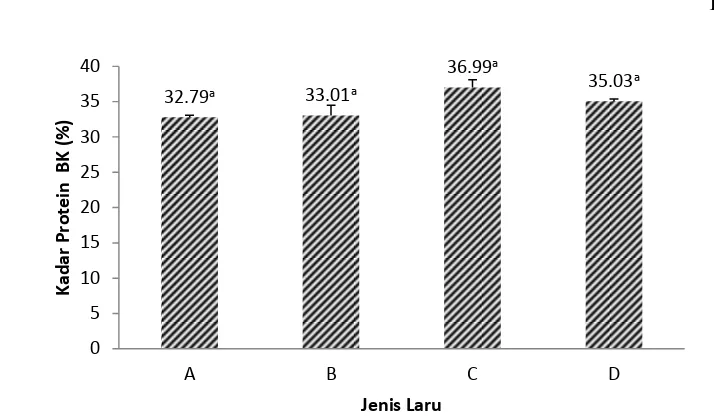
Pengujian kadar protein dapat dilakukan dengan metode Kjeldahl, dimana dalam metode ini akan diukur jumlah nitrogen (N) yang terkandung dalam sampel. Kadar protein tempe kacang merah dalam basis kering dapat dilihat pada Gambar 6.
Kadar protein tempe kacang merah (basis kering) berturut-turut ialah 32.79 % (A), 33.01 % (B), 36.99 % (C), dan 35.03 % (D). Data kadar protein tempe kacang merah dapat dilihat pada Lampiran 1. Tempe C memiliki kadar protein tertinggi, sedangkan tempe A memiliki kadar protein terendah. Namun, berdasarkan hasil uji statistik, keempat perlakuan tersebut tidak berbeda nyata pada taraf signifikansi 0.05 (Lampiran 5). Hal ini menunjukkan keempat perlakuan kapang tersebut tidak memberikan pengaruh nyata terhadap kadar protein tempe kacang merah.
15
Gambar 6. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar protein tempe kacang merah
Seperti halnya pada analisis yang sebelumnya, kadar protein tempe kacang merah lebih rendah dibandingkan dengan kadar protein minimal tempe kedelai menurut SNI 01-3144-2009 yaitu 45 % (basis kering). Hal ini diduga karena kandungan protein dari kacang merah lebih rendah dibandingkan dengan kedelai, yaitu 23.1 % untuk kacang merah dan 34.9 % untuk kedelai (Depkes 1992).
Kadar protein kacang merah utuh ialah sebesar 23.01 % dan dengan adanya proses fermentasi terjadi peningkatan kadar protein pada produk tempe kacang merah.
Kapang yang digunakan dalam proses pembuatan tempe dapat menghasilkan suatu enzim protease. Adanya enzim protease menyebabkan terjadinya degradasi protein menjadi asam amino, sehingga nitrogen terlarut meningkat (Deliani 2008).
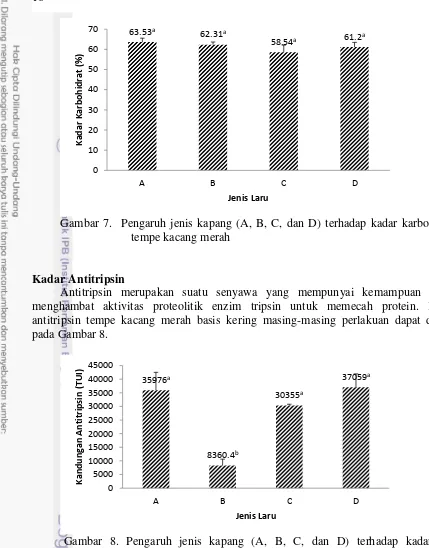
Kadar Karbohidrat
Kadar karbohidrat tempe kacang merah (basis kering) dengan menggunakan metode by difference dapat dilihat pada Gambar 7. Berdasarkan gambar tersebut, kadar karbohidrat tempe kacang merah berturut-turut ialah 63.53 % (A), 62.31 % (B), 58.54 % (C), dan 61.20 % (D). Data kadar karbohidrat dapat dilihat pada Lampiran 1. Tempe A dengan penambahan laru R. oryzae memiliki kadar karbohidrat tertinggi, sedangkan tempe C dengan penambahan laru campuran R. oryzae dan R. oligosporus dalam satu laru memiliki kadar karbohidrat terendah. Berdasarkan hasil uji statistik, keempat tempe tersebut tidak berbeda nyata pada taraf 0.05 (Lampiran 6). Keempat perlakuan laru tersebut tidak mamberikan pengaruh nyata pada kadar karbohidrat tempe kacang merah.
16
Gambar 7. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar karbohidrat tempe kacang merah
Kadar Antitripsin
Antitripsin merupakan suatu senyawa yang mempunyai kemampuan untuk menghambat aktivitas proteolitik enzim tripsin untuk memecah protein. Kadar antitripsin tempe kacang merah basis kering masing-masing perlakuan dapat dilihat pada Gambar 8.
Gambar 8. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar antitripsin tempe kacang merah
Kadar antitripsin tempe kacang merah (basis kering) berturut-turut ialah 35976 TUI (A), 8360.4 TUI (B), 30355 TUI (C), dan 37059 TUI (D). Data kadar antitripsin tempe kacang merah dapat dilihat pada Lampiran 7. Tempe dengan penambahan laru B (R. oligosporus) menghasilkan kandungan antitripsin terendah, yaitu 8360.4 TUI. Hal ini menunjukkan bahwa kapang R.oligosporus merupakan kapang yang paling efektif dalam menurunkan kandungan antitripsin yang terdapat pada bahan baku. Berdasarkan hasil uji statistik, kandungan antitripsin pada tempe B berbeda nyata dengan tempe A, C, dan D. Sedangkan kandungan antitripsin pada
17 tempe A, C, dan D, tidak berbeda nyata pada taraf signifikansi 0.05 (Lampiran 8). Hal ini menunjukkan bahwa perlakuan laru B dapat memberikan pengaruh nyata pada kadar antitripsin tempe kacang merah.
Kacang merah mengandung antitripsin, goitrogen, asam fitat, dan tannin yang banyak terdapat dalam kulit. Senyawa tersebut dapat dikurangi atau dihilangkan melalui proses, perendaman, pengupasan kulit, pemanasan, serta fermentasi. Menurut Karisma (2014), kadar antitripsin menurun seiring dengan proses perlakuan penepungan, perebusan, dan perendaman asam pada kacang merah. Menurut Pawiroharsono (1996), komponen anti gizi pada kacang dapat mengalami degradasi menjadi senyawa sederhana atau dapat dikurangi bahkan dihilangkan karena adanya aktivitas mikroorganisme selama fermentasi. Proses fermentasi dapat mendegradasi senyawa antitripsin sehingga aktivitasnya menurun (Sujatmiko et al 2010).
Kadar Oligosakarida
Oligosakarida merupakan bagian dari polimer karbohidrat dengan berat molekul rendah dan disebut rantai pendek polisakarida dengan 2-20 unit sakarida seperti stakiosa, rafinosa, fruktooligosakarida, dan galaktooligosakarida (Saifatah 2011). Tempe kacang merah A, B, C, dan D tidak mengandung oligosakarida (0 mg/g). Namun keempat sampel tempe tersebut menghasilkan peak pada menit munculnya standar monosakarida, yaitu glukosa, fruktosa, sukrosa, dan maltosa. Menurut Winarno (1980), selama proses fermentasi terjadi proses degradasi enzimatik oleh mikroorganisme. Oligosakarida yang terdapat pada kacang merah telah terdegradasi menjadi gula-gula sederhana karena adanya proses fermentasi.
Oligosakarida termasuk ke dalam zat antinutrisi karena dapat menghasilkan gas seperti metana dan hidrogen, sehingga menyebabkan flatulensi. Gas tersebut berasal dari hasil metabolisme oligosakarida oleh bakteri saluran pencernaan (Ravindran 1990). Kacang merah mengandung sejumlah oligosakarida dan menurut Karisma (2014), kandungan oligosakarida dari kacang merah mentah akan mengalami penurunan seiring dengan adanya proses perebusan, perendaman asam, dan fermentasi menjadi tempe. Kondisi ini dapat menyebabkan terjadinya penguraian oligosakarida sehingga kadar oligosakarida tempe menurun.
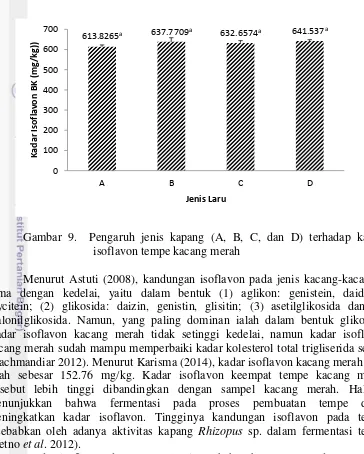
Kadar Isoflavon
Isoflavon merupakan senyawa metabolit sekunder yang dapat disintesis tanaman, namun tidak disintesis oleh mikroorganisme. Kandungan isoflavon yang tinggi banyak ditemukan dalam tanaman Leguminoceae atau kacang-kacangan, termasuk kacang merah. Kadar isoflavon tempe kacang merah dapat dilihat pada Gambar 9.
18
laru tersebut tidak memberikan pengaruh yang nyata terhadap kadar isoflavon tempe kacang merah.
Gambar 9. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar isoflavon tempe kacang merah
Menurut Astuti (2008), kandungan isoflavon pada jenis kacang-kacangan sama dengan kedelai, yaitu dalam bentuk (1) aglikon: genistein, daidzein, glycitein; (2) glikosida: daizin, genistin, glisitin; (3) asetilglikosida dan (4) malonilglikosida. Namun, yang paling dominan ialah dalam bentuk glikosida. Kadar isoflavon kacang merah tidak setinggi kedelai, namun kadar isoflavon kacang merah sudah mampu memperbaiki kadar kolesterol total trigliserida serum (Rachmandiar 2012). Menurut Karisma (2014), kadar isoflavon kacang merah utuh ialah sebesar 152.76 mg/kg. Kadar isoflavon keempat tempe kacang merah tersebut lebih tinggi dibandingkan dengan sampel kacang merah. Hal ini menunjukkan bahwa fermentasi pada proses pembuatan tempe dapat meningkatkan kadar isoflavon. Tingginya kandungan isoflavon pada tempe disebabkan oleh adanya aktivitas kapang Rhizopus sp. dalam fermentasi tempe (Retno et al. 2012).
Kadar isoflavon dapat mengalami perubahan bergantung pada prosesnya. Menurut penelitian yang telah dilakukan oleh Karisma (2014), perlakuan proses pada kacang merah yang direbus dan kacang merah yang direndam asam mengalami peningkatan kadar total isoflavon. Namun isoflavon akan mengalami penurunan bila diproses dengan panas yang terlalu tinggi, seperti penepungan. Sedangkan proses fermentasi dapat meningkatkan isoflavon karena isoflavon dalam bentuk aglikon lebih dominan (Istiani 2010). Isoflavon pada tempe dominan dalam bentuk aglikon atau dalam bentuk bebas karena telah melalui proses fermentasi. Kapang Rhizopus oligosporus lebih banyak menghasilkan isoflavon dalam bentuk aglikon dibandingkan dengan Rhizopus oryzae.
613.8265a 637.7709a 632.6574a 641.537
19
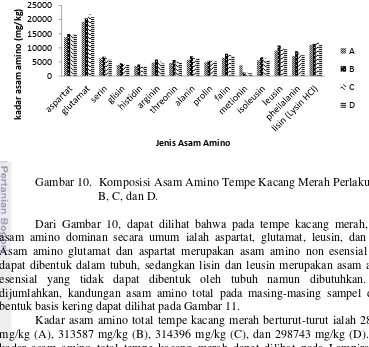
Komposisi Asam Amino
Asam amino merupakan bentuk sederhana dari protein. Asam amino memiliki satu atau lebih gugus karboksi (-COOH) dan satu atau lebih gugus amino (-NH2). Asam amino bersambung melalui ikatan peptida, yaitu ikatan antara gugus karboksil satu asam amino dengan gugus amin dari asam amino yang lain (Deliani 2008). Komposisi asam amino tempe kacang merah dapat dilihat pada Gambar 10.
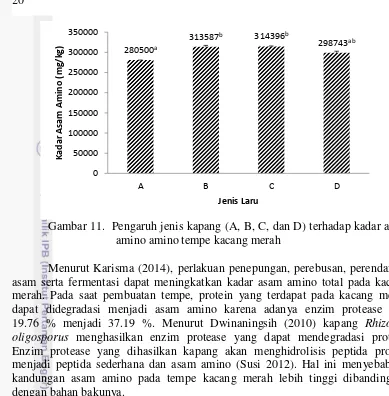
Gambar 10. Komposisi Asam Amino Tempe Kacang Merah Perlakuan A, B, C, dan D. dijumlahkan, kandungan asam amino total pada masing-masing sampel dalam bentuk basis kering dapat dilihat pada Gambar 11.
Kadar asam amino total tempe kacang merah berturut-turut ialah 280500 mg/kg (A), 313587 mg/kg (B), 314396 mg/kg (C), dan 298743 mg/kg (D). Data kadar asam amino total tempe kacang merah dapat dilihat pada Lampiran 11. Tempe dengan laru C memiliki kadar asam amino total tertinggi, sedangkan tempe A memiliki kadar asam amino total terendah. Berdasarkan hasil uji statistik, tempe B dan C memiliki kadar asam amino total yang tidak berbeda nyata pada taraf signifikansi 0.05. Hal ini menunjukkan bahwa adanya perlakuan penambahan laru B dan C tidak memberikan pengaruh yang nyata pada kadar asam amino total tempe kacang merah. Sedangkan kadar asam amino tempe A berbeda nyata dengan tempe D serta tempe B dan C, dan tempe D berbeda nyata dengan tempe A serta B dan C pada taraf signifikansi 0.05 (Lampiran 12).
20
Gambar 11. Pengaruh jenis kapang (A, B, C, dan D) terhadap kadar asam amino amino tempe kacang merah
Menurut Karisma (2014), perlakuan penepungan, perebusan, perendaman asam serta fermentasi dapat meningkatkan kadar asam amino total pada kacang merah. Pada saat pembuatan tempe, protein yang terdapat pada kacang merah dapat didegradasi menjadi asam amino karena adanya enzim protease dari 19.76 % menjadi 37.19 %. Menurut Dwinaningsih (2010) kapang Rhizopus oligosporus menghasilkan enzim protease yang dapat mendegradasi protein. Enzim protease yang dihasilkan kapang akan menghidrolisis peptida protein menjadi peptida sederhana dan asam amino (Susi 2012). Hal ini menyebabkan kandungan asam amino pada tempe kacang merah lebih tinggi dibandingkan dengan bahan bakunya.
Aktivitas Antimikroba
Tempe mengandung suatu senyawa yang aktif dalam menghambat pertumbuhan beberapa jenis bakteri, khususnya bakteri Gram positif seperti S. aureus, Bacillus sp., dan Listeria sp. (Van den Hil dan Nout 2011). Adanya aktivitas antibakteri ini maka tempe dapat digunakan untuk penyembuhan terhadap penderita diare, termasuk pada anak Balita (Affandi dan Mahmud 1985). Pengujian aktivitas antimikroba dapat dilakukan dengan menggunakan metode difusi sumur. Adanya aktivitas antimikroba pada ekstrak tempe ditandai dengan adanya zona bening yang terdapat di sekeliling sumur. Kekuatan atau daya hambat dapat diketahui dengan mengukur diameter rata-rata zona bening tersebut. Berdasarkan Tabel 2, dapat diketahui bahwa keempat ekstrak tempe kacang merah tidak memiliki aktivitas penghambatan terhadap kedua jenis bakteri yang diujikan. Menurut Van den Hil dan Nout (2010), ekstrak air tempe kedelai memiliki aktivitas antimikroba terhadap Bacillus cereus serta menurut Affandi dan Mahmud (1985), ekstrak air tempe kedelai memiliki aktivitas antimikroba terhadap Bacillus subtilis dan S. aureus. Menurut Mambang et al. (2014), ekstrak etanol dan etil asetat tempe kedelai memiliki aktivitas antimikroba terhadap bakteri B. subtilis dan S. aureus. Hal ini diduga bahwa jenis bahan baku dapat mempengaruhi kandungan antimikroba (Issani 2013). Kandungan gizi bahan baku kacang merah berbeda dengan kacang kedelai terutama dari segi proteinnya.
21 Menurut Kobayasi et al. (1992), senyawa antimikroba yang diproduksi R. oligosporus merupakan protein sederhana yang memiliki bobot molekul 5500 dengan kandungan sistein, glisin, dan asam amino basa yang tinggi (Lisin, Arginin, Histidin). Sedangkan Menurut Wang (1969) senyawa antibakteri pada ekstrak tempe terdiri dari senyawa gliko-protein dan aktif terutama terhadap bakteri Gram Positif. Kandungan protein kacang merah lebih rendah dibandingkan dengan kedelai, yaitu sebesar 23.1 g/100 g. Hal inilah yang diduga menyebabkan tidak adanya aktivitas antimikroba pada ekstrak tempe kacang merah terhadap bakteri uji.
Tabel 2. Kemampuan ekstrak tempe kacang merah dalam menghambat pertumbuhan bakteri uji
Sampel Rata-rata diameter penghambatan (mm)
S. aureus E.coli
Kontrol + 5.9 8.1
Kontrol - 0.0 0.0
Tempe A 0.0 0.0
Tempe B 0.0 0.0
Tempe C 0.0 0.0
Tempe D 0.0 0.0
Perbedaan komposisi asam amino pada kacang kedelai dan kacang merah dapat dilihat pada Tabel 3.
Tabel 3. Komposisi Asam Amino Kacang Kedelai dan Kacang Merah Jenis Asam Amino Kandungan Asam Amino (g/100 g)
Kedelai1 Kacang Merah2
Aspartat 4.50 2.75
Glutamat 7.60 3.71
Serin 2.20 1.16
Histidin 1.00 0.58
Glisin 1.90 0.73
Threonin 1.50 0.90
Arginin 3.20 1.15
Alanin 1.70 0.93
Tirosin 1.50 0.59
Metionin 0.60 0.21
Valin 1.60 1.28
Fenilalanin 2.00 1.35
Isoleusin 2.10 1.13
Leusin 3.30 1.80
Lisin 2.10 1.50
Keterangan: 1Sitompul (1997) 2 Karisma (2014)
22
sistein, glisin, dan asam amino basa (Lisin, Arginin, Histidin) yang banyak pada senyawa antimikroba tempe, pada kacang merah lebih rendah dibandingkan kacang kedelai. Hal ini menyebabkan kemungkinan protein sederhana yang terbentuk dari hasil degradasi kapang selama fermentasi tempe kacang merah mengandung komposisi asam amino tersebut yang lebih rendah dibandingkan tempe kedelai, sehingga diduga tempe kacang merah tidak mempunyai aktivitas antimikroba pada bakteri S. aureus dan E. coli, seperti pada tempe yang umumnya menggunakan kacang kedelai.
Antimikroba tempe lebih efektif menyerang bakteri Gram Positif ini diduga disebabkan oleh adanya perbedaan struktur penyusun dinding sel bakteri tersebut. Bakteri gram positif terdiri dari 90 % lapisan peptidoglikan dan asam teikoat, sedangkan bakteri gram negatif terdiri dari 5-20% peptidoglikan dan lapisan lainnya yaitu protein, lipopolisakarida, dan lipoprotein (Fardiaz 1992). Menurut Abdalla (2013), cara kerja komponen antimikroba pada tempe yaitu mencegah sintesis peptidoglikan pada sel yang sedang tumbuh, sehingga bakteri gram positif lebih sensitif. Hasil pengujian beberapa kapang Rhizopus sp. melalui fermentasi tempe menunjukkan bahwa R. oligosporus memiliki aktivitas antibakteri paling tinggi dan optimal pada tempe dengan waktu inkubasi 36-42 jam (Pawiroharsono et al 1996).
SIMPULAN DAN SARAN
Simpulan
Kapang jenis R. oligosporus dan R. oryzae baik dalam bentuk tunggal maupun campuran dapat digunakan untuk membuat tempe kacang merah. Dari keempat jenis perlakuan tersebut, kapang R. oligosporus secara tunggal menghasilkan produk tempe kacang merah dengan kandungan asam amino yang tinggi, yaitu 313587 mg/kg, dan antitripsin yang lebih rendah yaitu 8360.4 TUI. Dilihat dari kadar air, abu, lemak, protein, karbohidrat, dan isoflavon, keempat perlakuan tersebut tidak memiliki perbedaan yang nyata pada taraf signifikansi 0.05. Selain itu, keempat perlakuan tempe kacang merah menghasilkan tempe yang tidak mengandung oligosakarida. Dari hasil uji kemampuan aktivitas antimikroba, keempat ekstrak air tempe kacang merah tidak mempunyai kemampuan menghambat pertumbuhan bakteri S. aureus dan E. coli.
Saran
23
DAFTAR PUSTAKA
Abdalla B. 2013. Pengujian aktivitas antibakteri ekstrak tempe koro pedang (Canavalia ensiformis L.) terhadap Eschherichia coli dan Staphylococcus aureus. [skripsi]. Bogor: Institut Pertanian Bogor
Affandi E dan Mien KM. 1985. Pengujian Aktivitas Antibakterial pada Tempe terhadap Bakteri Penyebab Diare. Penelitian Gizi dan Makanan. 8:46-56 [AOAC]. Association of Official Analytical Chemists. 1995. Official Methods of
Analysis. 16th ed. Arlington : AOAC
[AOAC]. Association of Official Analytical Chemist. 2001. Official Methods of Analysis. 10th ed. Arlington: AOAC
Astuti S. 2008. Isoflavon kedelai dan potensinya sebagai penangkap radikal bebas.
Jurnal Teknologi Industri dan Hasil Pertanian 13 (2): 126-136
Deliani. 2008. Pengaruh Lama Fermentasi terhadap Kadar Protein, Lemak, Komposisi Asam Lemak, dan Asam Fitat pada Pembuatan Tempe. [Tesis]. Medan: Universitas Sumatera Utara
Departemen Kesehatan Republik Indonesia. 1992. Kandungan Gizi Kacang. Jakarta.
Dwinaningsih EA. 2010. Karakteristik kimia dan sensori tempe dengan variasi bahan baku kedelai atau beras dan penambahan angkak serta variasi lama fermentasi. [skripsi]. Surakarta: Universitas Sebelas Maret
Fardiaz S. 1992. Mikrobiologi Pengolahan Pangan Lanjut. Bogor: PAU
Faridah DN et al. 2012. Penuntun Praktikum Analisis Pangan. Bogor: Departemen Ilmu dan Teknologi Pangan, Fateta, IPB
Ilyas N, Peng CD dan Gould WA. 1977. Tempeh – An Indonesian Fermented Soybean Food. Part of review from PhD. Disertation. Ohio state University Issani V. 2013. Kajian aktivitas antibakteri ekstrak tempe komak terhadap bakteri
Staphylococcus aureus dan Escherichia coli. [skripsi]. Bogor: IPB
Istiani Y. 2010. Karakterisasi Senyawa Bioaktif Isoflavon dan Uji Antioksidan dari Ekstrak Etanol Tempe Berbahan Baku Koro Pedang (Canavaliaensiformis). [Tesis]. Surakarta (ID): Universitas Sebelas Maret Kakade M.L, J.J Rackis, J. E. McGhee dan G. Pusky. 1974. Determination of
trypsin inhibitor activity of soy products: a collaborative analysis of improved procedure. Cereal Chem. 51: 376-382.
Kuligowski et al. 2013. Evaluation of Bean and Soy Tempeh Influence on Intestinal Bacteria and Estimation of Antibacterial Properties of Bean Tempeh. Polish Journal of Microbiology Vol. 62, No 2, 189-194.
Karisma VW. 2014. Pengaruh Penepungan, Perebusan, Perendaman Asam, dan Fermentasi terhadap Komposisi Kimia Kacang Merah (Phaseolus vulgaris
L.). [skripsi]. Bogor: Institut Pertanian Bogor
Kobayasi SY, Okazaki N, Koseki T. 1992. Purification and Characterization of an antibiotic substance produced from Rhizopus oligosporus IFO 8631.
Bioscience, Biotechnology, and Biochemistry 56: 94-98.
Koswara S. 1992. Teknologi Pengolahan Kedelai Menjadikan Makanan Bermutu. Jakarta: Pustaka Sinar Harapan
24
Mambang DEP, Rosidah dan Dwi S. 2014. Aktivitas antibakteri ekstrak tempe terhadap bakteri Bacillus subtilis dan Staphylococcus aureus. J. Teknol. dan Industri Pangan Vol. 25 No.1 Th 2014
Nollet Leo ML. 1996. Handbook of Food Analysis, Amino Acid. CRC Press Parhusip AJN. 2006. Kajian Mekanisme Antibakteri Ekstrak Andaliman terhadap
Bakteri Patogen Pangan [disertasi]. Bogor : Institut Pertanian Bogor
Pawiroharsono S dan Siregar E. 1993. Influence of Incubation time on the bacterial activity of tempe produced by single strain R. oligosporus. Tempe Workshop, BPP Teknologi, February 15-16 , 1993, Jakarta
Pawiroharsono S. 1996. Microbiological Aspect of Tempe. Di dalam : Sapuan dan Soetrisno N (eds), Agranoff J (Penerjemah). The Complete Handbook of Tempe : The Unique Fermented Soyfood of Indonesia. Jakarta: Indonesian Tempe Foundatio. Terjemahan dari : Bunga Rampai Tempe Indonesia.
Rachmandiar R. 2012. Perbdaan Pengaruh Jus Kacag Merah, Yoghurt susus dan yoghurt kacang merah terhadap kadar kolesterol total dan trigliserida serum pada tikus dyslipidemia. [karya tulis ilmiah]. Semarang : Universitas Diponegoro
Ravindran G. 1990. Study on the flatus potential of distary fiber from some legumes. J. Natn. Sci. Coun. Sri langka 18 (2): 127-132
Retno T, Widyastuti SK dan Suarsana N. 2012. Pengaruh pemberian isoflavon terhadap peroksidasi lipid pada hati tikus normal. Jurnal Indonesia Medicus Veterinus 1 (4): 483-491
Saifatah L. 2011. Analisis Oligosakarida pada Dua Puluh Produk Minuman Bubuk Komersial Berbasis Kedelai. [Skripsi]. Bogor : Institut Pertanian Bogor
Sitompul S. 1997. Komposisi Asam – Asam Amino dari Biji-Bijian dan Kacang-Kacangan. Lokakarya Fungsional Non Peneliti. Bogor : Balai Penelitian Ternak Ciawi
[SNI]. Standar Nasional Indoensia. 1992. SNI 01-2891-1992. Cara Uji Makanan dan Minuman. Badan Standarisasi Nasional
[SNI] Standar Nasional Indonesia. 2009. SNI 3144 Tahun 2009 tentang Tempe Kedelai. Jakarta (ID): Badan Standarisasi Nasional
Steinkraus K. H, Yap B.H, Van Buren J.P, Provvidenti M.I and Hand D.B.1960. Studies on tempeh – An Indonesian fermented soybean food. Journal of Food Science (6): 777
Sujatmiko B, Sutrisno A dan Sofia E. 2010. Degradasi senyawa tanin, asam fitat, antitripsin dan peningkatan daya cerna protein secara in vitro pada sorgum coklat (Sorgum bicolor L. Moench) dengan metode fermentasi ampok. Universitas Brawijaya.28
Susi. 2012. Komposisi kimia dan asam amino pada tempe kacang nagara (Vigna unguiculata ssp. Cylindrica). Jurnal Agroscientiae 19 (1): 28-36
Van den Hil PJR, Dalmas E, Nout MJR, and Abee T. 2010. Soya bean tempe extracts show antibacterial activity against Bacillus cereus cells and spores.
Journal of Applied Microbiology Volume 109 No. 12010
Van den Hil PJR, Nout MJR. 2011. Anti-diarrhoeal aspects of fermented soy beans. [terhubung berkala]. http://cdn.intechweb.org/pdfs/19757.pdf (21
25 Wang H.L, D.I Ruttle and Hesseltine C.W. 1969. Antibacterial Compound from A Soybean Product Fermented by Rhizopus oligosporus. Proc. Soc. Exp. Biol. Med. 131, 579-582
Wang Q, Leqin K, Dongmei Y, Bili B, Jianmei J, Tiejin Y. 2007. Change in Oligosaccharides during Processing of Soybean Sheet. Asia Pac J Clint Nutr 16(1) : 89-94
Winarno, F.G., S. Fardiaz, dan D. Fardiaz. 1985. Pengantar Teknologi Pangan. PT. Gramedia. Jakarta
Winarno FG. 1980. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama Wolf C.E dan W.R. Gibbons. 1996. Improved method for quantification of
26
Lampiran 1. Kadar proksimat tempe kacang merah berbagai perlakuan Sampel % kadar air
Lampiran 2. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar air ANOVA
27 kadar_abu
Duncan
jenis_la
ru N
Subset for alpha
= 0.05
1
D 2 2.5650
C 2 2.5950
A 2 2.6150
B 2 2.7100
Sig. .842
Lampiran 4. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar lemak ANOVA
kadar_lemak
Sum of Squares df Mean Square F Sig.
Between Groups .175 3 .058 2.236 .226
Within Groups .104 4 .026
Total .279 7
kadar_lemak
Duncan
jenis_la
ru N
Subset for alpha
= 0.05
1
A 2 .4250
D 2 .4600
C 2 .7100
B 2 .7600
28
Lampiran 5. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar protein
ANOVA
kadar_protein
Sum of Squares df Mean Square F Sig.
Between Groups 1.464 3 .488 1.919 .268
Within Groups 1.017 4 .254
Total 2.482 7
kadar_protein
Duncan
jenis_la
ru N
Subset for alpha
= 0.05
1
B 2 12.7950
A 2 12.8550
D 2 13.0600
C 2 13.8650
Sig. .106
Lampiran 6. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar karbohidrat
ANOVA
kadar_karbohidrat
Sum of Squares df Mean Square F Sig.
Between Groups 27.193 3 9.064 .783 .562
Within Groups 46.314 4 11.579
29 kadar_karbohidrat
Duncan
jenis_la
ru N
Subset for alpha
= 0.05
1
C 2 58.5400
D 2 61.2000
B 2 62.3050
A 2 63.5350
Sig. .221
Lampiran 7. Data kadar antitripsin tempe kacang merah berbagai perlakuan Sampel Kadar Antitripsin
bb (TUI)
% Kadar Air Kadar Antitripsin bk (TUI)
Tempe A 14103.00 ±
3614.00
60.80 35975.77 ±
9219.45
Tempe B 3240.50 ±
1256.50
61.24 8360.42 ±
3241.82
Tempe C 11377.00 ±
226.27
62.52 30354.86 ±
603.72
Tempe D 13816.00 ±
2580.20
62.72 37058.74 ±
6921.22
Lampiran 8. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar antitripsin
ANOVA
Antitripsin
Sum of Squares df Mean Square F Sig.
Between Groups 1.074E9 3 3.579E8 9.958 .025
Within Groups 1.438E8 4 3.594E7
30
Antitripsin
Duncan
jenis_la
ru N
Subset for alpha = 0.05
1 2
B 2 8.3604E3
C 2 3.0355E4
A 2 3.5976E4
D 2 3.7059E4
Sig. 1.000 .332
Lampiran 9. Data kadar isoflavon tempe kacang merah berbagai perlakuan
Sampel Kadar Isoflavon bb (mg/kg)
% Kadar Air Kadar Isoflavon bk (mg/kg) Tempe A 240.62 ± 4.86 60.80 613.83 ± 12.41 Tempe B 247.20 ± 11.24 61.24 637.77 ± 29.01 Tempe C 237.12 ± 5.90 62.52 632.66 ± 15.73 Tempe D 239.16 ± 3.80 62.72 641.54 ± 10.18
Lampiran 10. Uji One Way ANOVA dan uji lanjut Duncan analisis kadar isoflavon
ANOVA
isoflavon
Sum of Squares df Mean Square F Sig.
Between Groups 907.484 3 302.495 .898 .516
Within Groups 1346.677 4 336.669
31
Lampiran 11. Data kadar asam amino total tempe kacang merah
32
asam_amino
Duncan
jenis_la
ru N
Subset for alpha = 0.05
1 2 3
A 2 2.8050E5
D 2 2.9874E5
B 2 3.1359E5
C 2 3.1440E5
33
RIWAYAT HIDUP