PURIFIKASI DAN KARAKTERISASI KATALASE DARI ISOLAT LOKAL KAPANG Neurospora crassa InaCC F226
PUGOH SANTOSO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Purifikasi dan Karakterisasi Katalase dari Isolat Lokal Kapang Neurospora crassa InaCC F226 adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Pugoh Santoso
RINGKASAN
PUGOH SANTOSO. Purifikasi Dan Karakterisasi Katalase Dari Isolat Lokal Kapang Neurospora crassa InaCC F226. Dibimbing oleh Laksmi Ambarsari, Suryani dan Yopi.
Katalase (hidrogen peroksida oksidoreduktase; EC1.11.1.6) merupakan kelompok oksidoreduktase yang berfungsi mengkatalisis reaksi perubahan hidrogen peroksida (H2O2) menjadi air dan oksigen. Aplikasinya yang luas, seperti pada industri pulp & paper, tekstil, farmasi, biosensor, bioremediasi dan pangan, menjadikan enzim ini prospektif untuk dikembangkan. Indonesia memiliki kekayaan mikrob yang melimpah dapat dijadikan sebagai sumber penghasil enzim ini. Oleh karena itu, perlu dilakukan eksplorasi terhadap isolat lokal dalam menghasilkan katalase. Penelitian ini bertujuan untuk produksi katalase dari isolat lokal kapang Neurospora crassa InaCC F226 pada media Vogel, pemurnian dengan gel filtrasi, karakterisasi enzim terhadap suhu, pH, logam, kinetika reaksi (Vmaks dan Km) dan prediksi jenis katalase berdasarkan berat molekulnya.
Produksi katalase dilakukan dengan menumbuhkan Neurospora crassa
InaCC F226 pada media Vogel selama 5 hari yang ditambah dengan 1,5% sukrosa. Biomassa yang diperoleh dilarutkan dalam 3% hidrogen peroksida, kemudian sel dilisis menggunakan sonikator. Enzim kasar yang terbentuk diendapkan dengan 60% amonium sulfat dan dilanjutkan dengan pemurnian menggunakan kromatografi gel filtrasi dengan matriks Sephadex G-75. Eluen Sephadex G-75 fraksi 16 merupakan puncak protein dengan aktivitas katalase tertinggi. Kemurnian katalase setelah pemurnian mencapai 10,7 kali dengan perolehan 21,7% dan aktivitas spesifik sebesar 1464,9 U/mg.
Karakterisasi dilakukan dengan menggunakan fraksi amonium sulfat kejenuhan 60%. Aktivitas katalase Neurospora crassa InaCC F226 optimum pada pH 7, suhu 40oC, dan stabilitas katalase terhadap suhu diperoleh pada suhu 35oC dan 40oC yang diinkubasi selama 2 jam. Ion Fe+2 dan Ca+2 merupakan aktivator katalase sedangkan EDTA, Cu+2 dan Mn+2 bersifat inhibitor bagi katalase. Nilai Km dan Vmaks katalase Neurospora crassa InaCC F226 menggunakan substrat hidrogen peroksida berturut-turut adalah 8,8 mM dan 5,7 s.mM-1. Berat molekul katalase Neurospora crassa InaCC F226 adalah 59,4 kDa.
SUMMARY
PUGOH SANTOSO. Purification and Characterization of Catalase from Indigenous Mold of Neurospora crassa InaCC F226. Supervised by Laksmi Ambarsari, Suryani and Yopi.
Catalase (hydrogen peroxida oxidoreductase; EC1.11.1.6) is oxidoreductase enzyme which catalyze conversion of hydrogen peroxide (H2O2) into water and oxygen. Wide application such as the material in pulp & paper industry, textile, pharmacy, biosensor, bioremediation and food, enables this enzyme prospective to be developed. Indonesia has abundant microbe resource that potential to produce the enzyme. Therefore, initial study should be conducted to determine the prospects of the indigenous isolate. This research aimed to produce catalase of indigenous fungi isolate Neurospora crassa InaCC F226 by using Vogel media, to purify by gel filtration method, to characterize the enzyme by analyzing the temperature, pH, metal, kineticks reaction (Vmax and Km value) and to predict catalase enzyme type due to its molecular weight.
Catalase production was undertaken by growing Neurospora crassa InaCC F226 in Vogel media for 5 days and added 1.5% sucrose. Obtained biomass was dissolved into 3% hydrogen peroxide and implemented to sonicator. Crude enzyme extract then precipitated with 60% ammonium sulphate and leaded to purifying by utilizing gel chromatography filtration used Sephadex G-75 matrix. Sephadex G-75 eluent from fraction 16 was protein peak with the highest catalase activity. Catalase purity was 21.7% which 10.7 times recovery with its specific activity in the number to 1464.9 U/mg.
Characterization was implemented by using ammonium sulphate fraction with the saturation level to 60%. Catalase activity of Neurospora crassa InaCC F226 was optimum at pH of 7.0, temperature of 40oC, and catalase stability to temperature was of 35oC and 40oC which incubated for 2 hours. The result of inhibitor and activator determination obtained that Fe2+ and Ca2+ ion were the activators whereas EDTA, Cu+2 and Mn+2 were the inhibitors. The Km and Vmax value of Neurospora crassa InaCC F226’s catalase which utilized hydrogen
peroxide substrat were 8.8 mM dan 5.7 s.mM-1, respectively. The outcome of molecular weight was of 59,4 kDa.
© Hak Cipta Milik IPB, Tahun 2016 Hak Cipta Dilindungi
Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPBPURIFIKASI DAN KARAKTERISASI KATALASE DARI
ISOLAT LOKAL KAPANG
Neurospora crassa
InaCC F226
PUGOH SANTOSO
Tesis
Sebagai salah satu syarat untuk memeperoleh gelar Magister Sains
Program Studi Biokimia
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Purifikasi Dan Karakterisasi Katalase Dari Isolat Lokal Kapang Neurospora crassa InaCC F226
Nama : Pugoh Santoso
NIM : G851140201
Disetujui oleh
Komisi Pembimbing
Dr Laksmi Ambarsari, MS Ketua
Dr Suryani, MSc Dr Yopi, MSc
Anggota Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana
Biokimia
Dr drh Hasim, DEA Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2015 ini ialah enzim katalase, dengan judul Purifikasi dan Karakterisasi Katalase dari Isolat Lokal Kapang Neurospora crassa InaCC F226. Terima kasih penulis ucapkan kepada Ibu Dr Laksmi Ambarsari, MS; Ibu Dr Suryani, MSc; dan Bapak Dr Yopi selaku pembimbing yang telah banyak memberi arahan dan masukan. Ungkapan terima kasih disampaikan kepada kedua orang tua yang telah memberikan perhatian, dukungan, dan doanya. Terimakasih juga penulis sampaikan kepada seluruh pihak yang telah membantu serta rekan-rekan Pascasarjana Biokimia 2013 atas segala doa dan kasih sayangnya.
Bogor, November 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 METODE 3
Tempat dan Waktu Penelitian 3
Bahan 3
Alat 3
Prosedur 3
3 HASIL 7
Pertumbuhan Miselia Kapang 7
Pemurnian dan Penentuan Berat Molekul Katalase 8
Suhu, pH Optimum dan Stabilitas Suhu 9
Pengaruh Aktivator dan Inhibitor 11
Kinetika Reaksi (Vmaks dan Km) 12
4 PEMBAHASAN 13
Pertumbuhan Miselia Kapang Neurospora crassa InaCC F226 13
Katalase Hasil Pemurnian 15
Berat Molekul Katalase 16
pH Optimum dan Stabilitas Suhu 17
Pengaruh Aktivator dan Inhibitor 19
Kinetika Reaksi (Vmaks dan Km) 20
5 SIMPULAN DAN SARAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 25
DAFTAR TABEL
Hasil pemurnian katalase dari Neurospora crassa InaCC F226 9 Pengaruh inhibitor dan ion logam terhadap aktivitas katalase 12
DAFTAR GAMBAR
Pertumbuhan miselia kapang Neurospora crassa InaCC F226 7 Kromatogram filtrasi gel dengan matriks Sephadex G-75 9
Elektroforegam hasil pemurnian katalase 9
Aktivitas relatif katalase terhadap suhu 10
Stabilitas katalase terhadap suhu 11
Aktivitas relatif katalase terhadap pH 11
Kurva Michaelis-Menten 12
Kurva Lineweaver-Burk 13
Struktur katalase 20
LAMPIRAN
Bagan Alir Penelitian 26
Pembuatan Larutan 27
Kurva standar Protein 29
Hasil perhitungan konsentrasi protein 29
Hasil uji aktivitas katalase 30
Aktivitas katalase tiap fraksi pemurnian 31
Aktivitas katalase pada berbagai suhu 32
Aktivitas katalase pada berbagai pH 32
Aktivitas katalase dalam berbagai ion logam 33
Kurva Michaelis-Menten 35
1 PENDAHULUAN
Latar Belakang
Katalase (hidrogen peroksida oksidoreduktase; EC1.11.1.6) merupakan kelompok oksidoreduktase yang berfungsi mengkatalisis reaksi perubahan hidrogen peroksida (H2O2) menjadi air dan oksigen (Zhenxiou Yu et al. 2016). Enzim ini dikelompokkan menjadi empat kelompok berdasarkan berat molekulnya, yaitu monofunctional heme katalase, katalase peroksidase, katalase manganase dan katalase fenol oksidase (CATPO). Monofunctional heme katalase merupakan katalase heme yang memiliki gugus prostetik berupa iron-protoporphyrin IX pada sisi aktifnya, berdasarkan berat molekulnya enzim ini dibagi menjadi dua, yaitu katalase yang memiliki subunit kecil dengan berat molekul kurang dari 60 kDa (katalase 1) dan katalase dengan subunit besar dengan berat molekul besar dari 75 kDa (katalase 3). Beberapa penelitian melaporkan bahwa monofunctional heme katalase telah banyak diaplikasikan dalam berbagai bidang, seperti bidang industri, pangan, tekstil, dan perangkat biosensor (Jessica Röcker et al. 2016; Fűtő et al. 2012; Malika Ammam & Jan Fransaer 2012; Akyilmaz E & Kozgus O 2009). Peningkatan pemanfaatan katalase mengakibatkan permintaan katalase di dunia meningkat dari US$ 2,2 milyar mencapai US$ 3,4 milyar (Sooch et al. 2014). Sementara konsumsi enzim kasar untuk industri di dalam negeri dengan pertumbuhan volume 4-6% per tahun diperkirakan mencapai sekitar 2.500 ton dengan nilai impor sebesar Rp 187,5 Milyar (BPPT 2014).
Sejumlah mikroorganisme seperti jamur, kapang, bakteri, dan khamir diketahui dapat memproduksi katalase secara efektif (Isobe et al. 2006). Salah satu mikrob penghasil katalase yang potensial yaitu kapang Neurospora crassa. Diaz et al. (2001) melaporkan bahwa katalase yang dihasilkan dari kapang ini memiliki aktifitas spesifik sebesar 1.404.891 U/mg, dan stabil pada rentang pH 4-12. Katalase yang dihasilkan dari isolat tersebut berupa katalase 1 dan 3. Katalase-1 banyak ditemukan pada pembentukan fase spora aseksual (konidia) dan menyumbang 0,6% dari total protein sedangkan katalase-3 banyak ditemukan pada fase pertumbuhan sel dan ketika terjadi kondisi stres oksidatif. Selain itu perbedaan katalase-1 dan katalase-3 pada Neurospora crassa, karena adanya situs aktif pada tirosin. Pada katalase-1 situs aktif tirosin terikat kovalen dengan bagian vicinal sistein sedangkan dalam katalase-3 tirosin tidak terikat kovalen pada bagian vicinal sistein (Diaz et al 2009). Katalase-1 lebih tahan terhadap pemanasan, konsentrasi garam tinggi, denaturasi protein, pelarut dan enzim proteinase K (Hansberg et al 2012).
Indonesian Culture Collection (InaCC) yang merupakan lembaga dari LIPI telah memiliki 10.000 koleksi mikrob berupa bakteri, Actinomycetes, jamur, kapang, khamir dan mikroalga. Berbagai mikroorganisme ini dapat digunakan sebagai sumber berbagai jenis enzim (xilanase, katalase, selulase, mananase, amilase, dan protease) yang potensial (LIPI 2013). Sejauh ini, belum ada laporan terkait produksi katalase menggunakan isolat kapang lokal Indonesia yang berasal dari koleksi lembaga ini.
2
Collection dengan media Potato Dextrose Agar (PDA) dan pengendapan amonium sulfat 60% dihasilkan aktifitas spesifik 3.338,6 U/mg, kemurnian 6,1 kali, dan perolehan 88,6%. Selain itu, enzim ini memiliki aktifitas tertinggi pada pH optimum 7 dan suhu 40oC. Hasil penelitian ini mengindikasikan bahwa isolat lokal tersebut cukup potensial untuk dikembangkan lebih lanjut. Penelitian yang dilakukan oleh Ema (2015) hanya sebatas isolasi, fraksinasi 60% amonium sulfat dan parsial purifikasi. Hasil ini masih membutuhkan kajian lebih lanjut hingga taraf penentuan berat molekul yang berguna untuk menentukan jenis katalase yang dihasilkan. Oleh karena itu, penelitian ini difokuskan untuk produksi katalase dalam media enrichment (media vogel) dengan penambahan 1,5% sukrosa (Diaz et al. 2001), pemurnian menggunakan gel filtrasi, mengkarakterisasi dan menenuntukan jenis katalase N. crassa InaCC F226 berdasarkan berat molekulnya. Hasil dari penelitian ini diharapkan dapat menambah pustaka informasi ilmiah terkait kemampuan isolat lokal kapang Neurospora crassa InaCC F226 dalam menghasilkan katalase serta sifat biokimianya yang nantinya dapat diaplikasikan dalam industri tekstil, pangan, dan biosensor.
Rumusan Masalah
Neurospora crassa koleksi InaCC belum dieksplorasi lebih jauh dalam menghasilkan enzim katalase. Penelitian pendahuluan yang dilakukan oleh Ema (2015) menggunakan media PDA dan pengendapan amonium sulfat memberikan aktifitas spesifik dan perolehan (yield) secara berturut-turut adalah 3,338.6140 U/mg dan 88,6%. Penelitian tersebut dilakukan hingga tahap fraksinasi amonium sulfat sedangkan jenis katalase yang dihasilkan dari isolat tersebut belum ditentukan. Diaz et al. (2001) melaporkan bahwa Neurospora crassa menghasilkan jenis katalase 1 dan 3. Oleh karena itu, dalam penelitian ini dilakukan pemurnian katalase menggunakan gel filtrasi dan penentuan berat molekul untuk mengetahui jenis katalase yang dihasilkan dari isolat ini.
Tujuan Penelitian
Penelitian ini bertujuan untuk produksi katalase dari isolat lokal kapang Neurospora crassa InaCCF226 pada media vogel, pemurnian dengan gel filtrasi, karakterisasi enzim terhadap suhu, pH, logam, kinetika reaksi (Vmaks dan Km) dan prediksi jenis katalase yang dihasilkan berdasarkan berat molekulnya.
Ruang Lingkup
3
dialisis, dan kromatografi filtrasi gel. Fraksi enzim 60% ammonium sulfat selanjutnya dilakukan karakterisasi pH, suhu, stabilitas enzim terhadap suhu, pengaruh aktivator/ inhibitor, kinetika reaksi (Vmaks dan Km), dan penentuan bobot molekulnya. Bagan alir penelitian dapat dilihat pada Lampiran 1.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat menambah pustaka informasi ilmiah terkait kemampuan isolat lokal kapang Neurospora crassa InaCC F226 dalam menghasilkan katalase serta sifat biokimianya yang nantinya dapat diaplikasikan dalam industri tekstil, pangan, dan biosensor
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini telah dilakukan di Laboratorium Biokatalis dan Fermentasi Bioteknologi LIPI, Cibinong dari bulan September 2015 hingga Mei 2016.
Alat
Alat-alat yang digunakan dalam penelitian ini adalah pipet volumetrik, mikropipet, inkubator, Shaker bath, pengaduk magnetik, sentrifuge, penangas air, spektrofotometer, selofan (Sigma), autoklaf, pH meter, neraca analitik, vortex, laminar, labu Erlenmeyer, sonikator Q-Sonika, CL-188, jarum ose, waterbath dan peralatan gelas yang biasa digunakan dalam laboratorium.
Bahan
Bahan-bahan yang digunakan meliputi isolat lokal kapang Neurospora crassa InaCCF226 diperoleh dari Indonesian Culture Collection Lembaga Ilmu Pengetahuan Indonesia yang diisolasi dari sampah daun di gunung Salak, Sukabumi, PDA (Potato Dextrose Agar), akuades, NaOH 0,1 N, BaCl2, (NH4)2SO4, EDTA (Etildiamintetraasetat), Na2HPO4۰7H2O, NaH2PO4۰7H2O, Bovine Serum Albumine (BSA), reagen Bradford, alkohol, H2O2 50%, CaCl2, MnCl2, CuSO4, FeCl3, trace element, dan media vogel.
Prosedur
Strain, Kondisi Kultur dan Persiapan Ekstrak Kasar Katalase (Vogel H. J
1994)
4
media miring, kemudian konidia yang telah disegarkan tiga hari di inokulasi pada media Vogel (Vogel H. J 1994) yang ditambah dengan sukrosa 1,5% (w/v) (Diaz et al. 2001) setelah itu kultur diinkubasi selama 72 jam pada suhu 30oC (kondisi kedap cahaya) dan dilanjutkan pada suhu 25oC selama 48 jam dengan terpapar cahaya ruangan. Setelah 120 jam, biomassa dipanen dan ditimbang setelah itu dilarutkan dalam hidrogen peroksida 3% (v/v) dalam bufer fosfat pH 7. Biomassa yang diperoleh dilisis selnya menggunakan sonikator (Q-Sonika, CL-188) pada amplitudo 50 putaran per menit dalam penangas es. Sel ekstrak yang telah disonikator kemudian disentrifugasi pada kecepatan 13000 x g dan suhu 4oC selama 15 menit. Supernatan (lapisan atas) dipisahkan dengan pelet (lapisan bawah), kemudian supernatan disimpan pada suhu 4oC sedangkan pelet dilarutkan kembali dalam hidrogen peroksida 3% dalam 50 mM bufer natrium fosfat (pH 7) sebanyak tiga kali dan disentrifugasi seperti tahapan diatas. Supernatan yang diperoleh digabungkan dan digunakan sebagai ekstrak kasar enzim yang akan digunakan untuk tahapan analisis berikutnya.
Pemurnian Katalase (Diaz et al. 2001 dan Kandakuri et al. 2012).
5
Penentuan Konsentrasi Protein (Junhuan Li et al. 2013)
Sampel enzim sebanyak 0,01 mL ditambahkan dengan 0,99 mL reagen Bradford (reagen Bradford dibuat dengan mencampur 100 mg Comassie Briliant Blue G-250 yang dilarutkan dalam 50 mL etanol (95%) dan 100 mL asam fosfat (85%), larutan kemudian ditambah dengan aquades menjadi 1 L). Kompleks warna biru yang terbentuk diinkubasi pada suhu ruang 10-15 menit dan serapan absorbannya diukur pada panjang gelombang 550 nm. Penghitungan konsentrasi protein dilakukan dengan menggunakan Bovine Serum Albumin (BSA) sebagai standar protein.
Pengujian Aktifitas Katalase (Didem et al. 2008)
Prosedur untuk penentuan aktifitas katalase dilakukan dengan modifikasi metode Didem et al. (2008). Aktifitas katalase ditentukan pada suhu yang terkontrol (35oC) dalam 50 mM bufer natrium fosfat pH 7. Enzim sebanyak 0,03 mL dicampur dengan 0,97 mL hidrogen peroksida (20 mM) dalam bufer natrium fosfat (pH 7) dan diinkubasi 3 menit dalam waterbath. Penurunan absorbansi hidrogen peroksida diamati pada panjang gelombang 240 nm. Perhitungan aktifitas katalase dilakukan dengan menggunakan pengurangan absorban kontrol dengan absorban sampel dan dibagi dengan koefisien ekstensi hidrogen peroksida 39,4 M-1cm-1 (Merley et al. 2007). Satu unit enzim didefinisikan sebagai jumlah enzim yang dapat mengkatalisis penguraian hidrogen peroksida menjadi air dan oksigen per 3 menit pada suhu 35oC.
Aktifitas katalase (U/mL) =
Keterangan:
Ak = absorbansi kontrol At = absorbansi sampel
εmaks = absorptivitas molar (39,4 mM-1 cm-1) d = tebal kuvet (1 cm)
Vtot = volume uji total fp = faktor pengenceran
Venzim = volume enzim yang ditambahkan t = waktu inkubasi
Karakterisasi Biokimia Katalase
6
fraksinasi 60% amonium sulfat diinkubasi dalam berbagai larutan buffer (1:1) pada suhu 35oC selama 15 menit. Hidrogen peroksida (20 mM) sebanyak 0,97 mL diinkubasi dalam waterbath selama 1 menit pada suhu 35oC, kemudian ditambahkan enzim yang telah diinkubasi dalam berbagai pH sebanyak 0,3 mL dan diinkubasi lagi selama 3 menit (35oC). Kontrol sampel dibuat dengan menginaktifasi katalase hasil fraksinasi 60% amonium sulfat pada suhu 90oC selama 3 menit kemudian ditambah hidrogen peroksida (20 mM) sebanyak 0,97 mL. Penurunan absorban (kontrol dan sampel) diukur pada panjang gelombang 240 nm. Aktifitas relatif katalase dihitung dengan membandingkan aktifitas enzim pada berbagai nilai pH dengan aktifitas maksimum katalase dikali 100%.
Optimasi suhu dan stabilitas enzim terhadap suhu (Dindem et al. 2008). Penentuan suhu optimum katalase Neurospora crassa InaCC F226 ditentukan dengan mengukur aktifitas katalase pada pH 7 dalam waterbath. Suhu yang digunakan dalam penelitian ini adalah 30-70oC. Katalase dari fraksinasi 60% amonium sulfat diinkubasi pada berbagai suhu selama 15 menit. Hidrogen peroksida (20 mM) sebanyak 0,97 mL di tambahkan kemudian diinkubasi selam 3 menit. Kontrol sampel di buat dengan menginaktifasi katalase hasil fraksinasi 60% amonium sulfat pada suhu 90oC selama 3 menit kemudian ditambah hidrogen peroksida (20 mM) sebanyak 0,97 mL. Stabilitas enzim terhadap suhu ditentukan dengan menginkubasi enzim selama 2 jam dalam suhu 35oC dan 40oC dengan interval waktu 15 menit; 30 menit; 1 jam; 1,5 jam; dan 2 jam. Penurunan absorban (kontrol dan sampel) diukur pada panjang gelombang 240 nm. Aktifitas relatif katalase dihitung dengan membandingkan aktifitas enzim pada berbagai nilai suhu dengan aktifitas maksimum katalase dikali 100% .
Pengaruh inhibitor dan aktivator (Kandakuri et al. 2012). Ion logam yang digunakan pada pengujian pengaruh inhibitor dan aktivator adalah CaCl2, MgCl2, ZnCl2, MnCl2, CuSO4, dan FeCl3. Enzim diinkubasi pada pH dan suhu optimum yang ditambahkan larutan logam dengan konsentrasi 0,5 mM; 1 mM; dan 1,5 mM selama 3 menit
7
Penentuan Berat Molekul Katalase Dengan SDS PAGE (Kandakuri et al. 2012)
Berat molekul katalase ditentukan menggunakan modifikasi metode Kandakuri et al. (2012) dengan SDS-PAGE menggunakan 30% Gel Poliakrilamid. Ekstrak kasar enzim, 60% amonium sulfat dan gel filtrasi diperlakukan dalam 30% SDS dan didenaturasi pada suhu 70oC selama 20 menit sebelum loading ke gel, sampel yang telah didenaturasi kemudian di loading ke gel dan dilakukan elektroforesis pada tegangan 200 V dan arus 40 A selama 140 menit. Setelah itu, pewarnaan dilakukan dengan Comassie Briliant Blue R-250 selama 24 jam. Berat molekul ditentukan dengan bantuan penanda (marker) yang memiliki nilai berat molekul 20-250 kDa (Bio-Red).
3 HASIL
Pertumbuhan Miselia Kapang Neurospora crassa InaCC F226
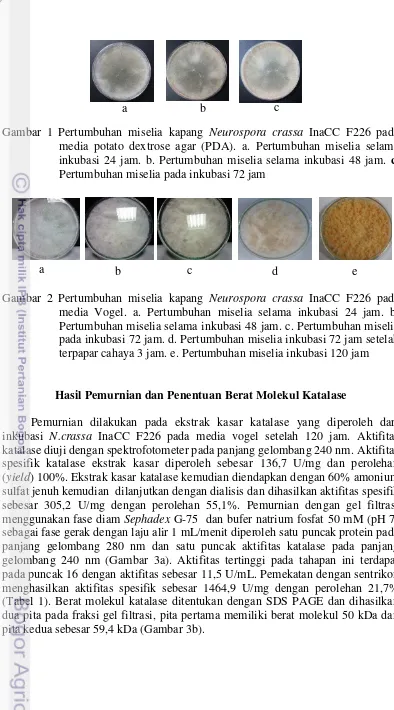
Kapang Neurospora crassa InaCC F226 sebelum digunakan untuk produksi katalase terlebih dahulu diremajakan pada media PDA selama 72 jam, hal ini bertujuan untuk memperoleh kapang yang aktif. Neurospora crassa InaCC F226 selama disimpan di dalam lemari pendingin berada pada kondisi tidak aktif, kondisi kapang yang tidak aktif ketika digunakan untuk produksi enzim maka hasilnya kurang optimal. Oleh karena itu, dilakukan peremajaan terlebih dahulu sebelum digunakan untuk produksi. Berdasarkan Gambar 1, pertumbuhan N. crassa InaCC F226 pada jam ke-24 mulai terbentuk hifa yang tipis berwarna putih, selanjutnya pada jam ke-48 hifa mulai sedikit menebal dan berwarna oranye (+). Hifa kapang mulai menebal dan bertambah oranye (++) pada jam ke-72.
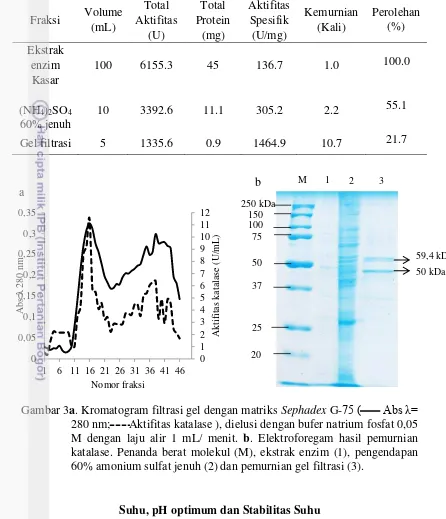
Neurospora crassa InaCC F226 yang telah diremajakan selama 72 jam, kemudian dikultivasi pada media vogel selama 120 jam (72 jam dalam kondisi kedap cahaya pada suhu 30oC dan 48 jam terpapar cahaya pada suhu 25oC). Pertumbuhan miselia kapang tumbuh baik tanpa kontaminasi dengan terbentuknya hifa-hifa berwarna putih hingga oranye. Hifa berwarna putih mulai terbentuk pada jam ke-24. Pertumbuhan hifa bertambah banyak setelah jam ke-48 dan mulai terjadi perubahan warna dari putih menjadi oranye (+) pada jam ke-72. Hifa yang diinkubasi selama 72 jam dalam kondisi kedap cahaya pada suhu 30oC kemudian dipapar oleh cahaya ruang dan terjadi perubahan warna oranye (+++) setelah terpapar cahaya selama 3 jam (Gambar 2d), warna terus bertambah oranye (++++) pada waktu inkubasi 120 jam dengan pertumbuhan miselium yang menebal (Gambar 2).
8
Gambar 1 Pertumbuhan miselia kapang Neurospora crassa InaCC F226 pada media potato dextrose agar (PDA). a. Pertumbuhan miselia selama inkubasi 24 jam. b. Pertumbuhan miselia selama inkubasi 48 jam. c. Pertumbuhan miselia pada inkubasi 72 jam
Gambar 2 Pertumbuhan miselia kapang Neurospora crassa InaCC F226 pada media Vogel. a. Pertumbuhan miselia selama inkubasi 24 jam. b. Pertumbuhan miselia selama inkubasi 48 jam. c. Pertumbuhan miselia pada inkubasi 72 jam. d. Pertumbuhan miselia inkubasi 72 jam setelah terpapar cahaya 3 jam. e. Pertumbuhan miselia inkubasi 120 jam
Hasil Pemurnian dan Penentuan Berat Molekul Katalase
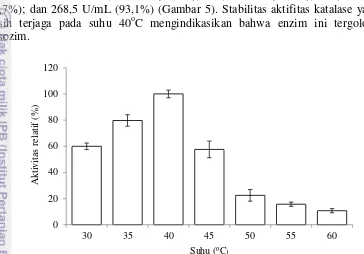
Pemurnian dilakukan pada ekstrak kasar katalase yang diperoleh dari inkubasi N.crassa InaCC F226 pada media vogel setelah 120 jam. Aktifitas katalase diuji dengan spektrofotometer pada panjang gelombang 240 nm. Aktifitas spesifik katalase ekstrak kasar diperoleh sebesar 136,7 U/mg dan perolehan (yield) 100%. Ekstrak kasar katalase kemudian diendapkan dengan 60% amonium sulfat jenuh kemudian dilanjutkan dengan dialisis dan dihasilkan aktifitas spesifik sebesar 305,2 U/mg dengan perolehan 55,1%. Pemurnian dengan gel filtrasi menggunakan fase diam Sephadex G-75 dan bufer natrium fosfat 50 mM (pH 7) sebagai fase gerak dengan laju alir 1 mL/menit diperoleh satu puncak protein pada panjang gelombang 280 nm dan satu puncak aktifitas katalase pada panjang gelombang 240 nm (Gambar 3a). Aktifitas tertinggi pada tahapan ini terdapat pada puncak 16 dengan aktifitas sebesar 11,5 U/mL. Pemekatan dengan sentrikon menghasilkan aktifitas spesifik sebesar 1464,9 U/mg dengan perolehan 21,7% (Tabel 1). Berat molekul katalase ditentukan dengan SDS PAGE dan dihasilkan dua pita pada fraksi gel filtrasi, pita pertama memiliki berat molekul 50 kDa dan pita kedua sebesar 59,4 kDa (Gambar 3b).
e d
c
a b
9
Tabel 1
Hasil pemurnian katalase dari Neurospora crassa InaCC F226
Fraksi Volume 280 nm; Aktifitas katalase ), dielusi dengan bufer natrium fosfat 0,05 M dengan laju alir 1 mL/ menit. b. Elektroforegam hasil pemurnian katalase. Penanda berat molekul (M), ekstrak enzim (1), pengendapan 60% amonium sulfat jenuh (2) dan pemurnian gel filtrasi (3).
Suhu, pH optimum dan Stabilitas Suhu
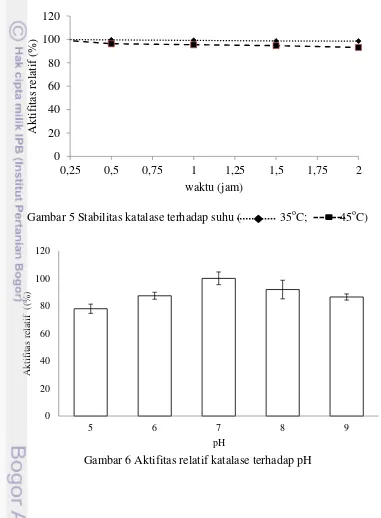
Katalase dari hasil pemurnian memiliki aktifitas optimum pada suhu 40oC aktifitasnya turun menjadi 44,7 U/mL (15,6%) dan terjadi penurunan aktifitas
10
secara dratis pada suhu 60oC yaitu 30,6 U/mL dengan nilai relatif aktifitas sebesar 10,7% (Gambar 4). Hasil pengujian stabilitas katalase terhadap suhu selama inkubasi 2 jam pada suhu 35oC menghasilkan nilai aktifitas katalase sebesar 284,2 U/mL (100%; 15 menit); 283 U/mL (99,6%; 30 menit); 281,9 U/mL (99,2%; 60 menit); 280 U/mL (98,7%; 90 menit);280,1U/mL (98,6%; 120 menit) seperti yang ditunjukan pada Gambar 4. Stabilitas enzim masih cukup terjaga saat inkubasi dilakukan pada suhu 40oC selama 15 menit dengan nilai aktifitas sebesar 288,2 U/mL (100%) dan mulai mengalami sedikit penurunan aktifitasnya pada
Gambar 4 Aktifitas relatif katalase terhadap suhu
Hasil penelitian yang diperlihatkan pada Gambar 6 menunjukkan bahwa dari rentang nilai pH 5-9 katalase Neurospora crassa InaCC F226 yang diinkubasi pada suhu 35oC selama 15 menit memiliki pH optimum 7.0 dengan aktivitas katalase sebesar 271,6 U/mL (100%). Enzim ini relatif stabil pada pH 5-9 dengan aktivitas katalase yang mengalami penurunan pada pH 5; 6; 8 dan 9 dengan nilai berturut-turut 211,7 U/mL (77,9% ); 237,5 U/mL (87,3%); 249,6 U/mL (91,9%) dan 234,9 U/mL (86,5%).
Pengaruh Aktivator dan Inhibitor
Pengaruh inhibitor dan aktivator dengan variasi konsentrasi inhibitor/aktivator (0,5-1,5 mM) terhadap aktifitas katalase disajikan pada Tabel 2. Penambahan EDTA dapat menurunkan aktifitas katalase secara drastis dengan aktifitas berturut-turut sebesar 81,8%; 33,2%; dan 13,5%. Penurunan aktifitas
11
katalase juga terjadi pada penambahan logam Cu+2 dan Mn+2, dengan nilai aktifitas relatif untuk ion tembaga sebesar 51,2% (0,5 mM); 28,8 mM (1 mM); dan 19,5 mM (1,5 mM) dan ion mangan sebesar 83,7% (0,5 mM); 76,1% (1 mM); dan 14,4% (1,5 mM). Penambahan ion besi dalam percobaan dapat meningkatkan aktifitas katalase sebesar 102,8%; 144,7% dan mengalami penurunan aktifitas pada konsentrasi ion besi 1 mM sebesar 89,6%, aktifitas katalase meningkat sebesar 111,2% sedangkan penambahan konsentrasi 1-1,5 mM ion kalsium mengakibatkan aktifitas turun sebesar 91,8% dan 82,5%.
Gambar 5 Stabilitas katalase terhadap suhu ( 35oC; 45oC)
12
Tabel 2
Pengaruh inhibitor dan ion logam terhadap aktifitas katalase
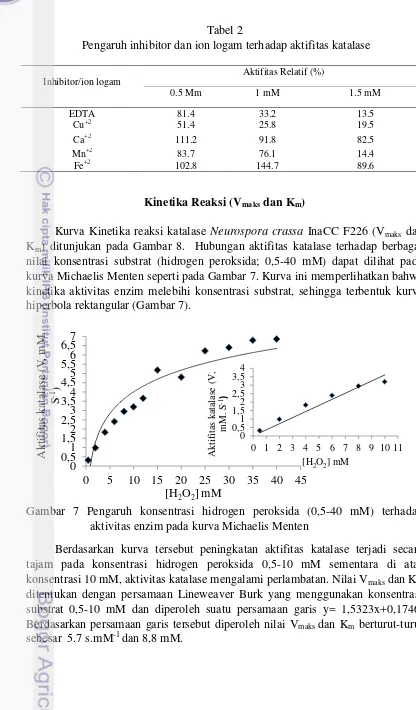
Inhibitor/ion logam nilai konsentrasi substrat (hidrogen peroksida; 0,5-40 mM) dapat dilihat pada kurva Michaelis Menten seperti pada Gambar 7. Kurva ini memperlihatkan bahwa kinetika aktivitas enzim melebihi konsentrasi substrat, sehingga terbentuk kurva hiperbola rektangular (Gambar 7).
Gambar 7 Pengaruh konsentrasi hidrogen peroksida (0,5-40 mM) terhadap aktivitas enzim pada kurva Michaelis Menten
13
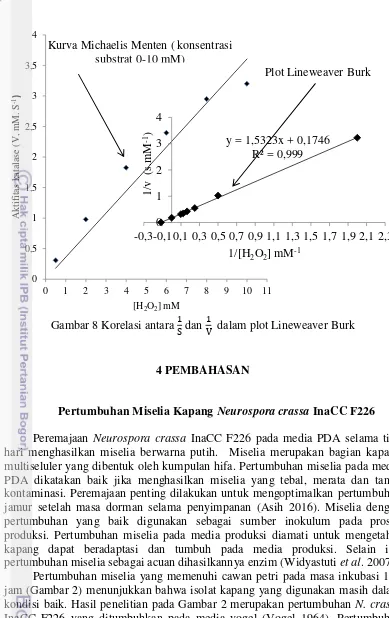
Gambar 8 Korelasi antara dan dalam plot Lineweaver Burk
4 PEMBAHASAN
Pertumbuhan Miselia Kapang Neurospora crassa InaCC F226
14
pembentukan hifa hingga spora (Gambar 2), dalam penelitian ini pengaruh cahaya terhadap pembentukan hifa juga diamati. Pemanenan biomassa untuk produksi katalase dilakukan setelah terpapar cahaya. Hal ini dikarenakan, bagi kapang, hifa memiliki peran yang sedikit banyak seperti akar dan daun pada tumbuhan sekaligus. Hifa tumbuh menyebar ke dalam tubuh atau semua bagian organisme. Bentuk hifa yang halus memperluas permukaan kontak dengan substrat (objek makanannya). Hifa kemudian melepaskan enzim atau substansi lain (khususnya pada kapang yang hidup pada jaringan hidup) pada substrat agar kemudian dihasilkan senyawa-senyawa kimia tertentu (terutama karbohidrat). Hifa kemudian kembali menyerap senyawa-senyawa kimia ini untuk dimanfaatkan dalam metabolisme internal. Menurut Aini dan Kuswytasari (2013), pertumbuhan miselia pada kapang dipengaruhi oleh suhu, pH, kelembaban, intensitas cahaya, dan aerasi udara. Pertumbuhan miselia kapang optimum pada suhu 22-28°C, pH 4-7, kelembaban 60-70%, intensitas cahaya 10%, dan kadar CO2 sebesar 15-20%. Penelitian ini dilakukan pada inkubasi selama 120 jam (72 jam dalam kondisi kedap cahaya pada suhu 30oC dan 24 jam pada kondisi terpapar cahaya pada suhu 25oC).
Inkubasi N. crassa selama 24 jam (Gambar 2a) menghasilkan guratan-guratan hifa (thallus) putih. Hifa tumbuh dari spora yang melakukan germinasi membentuk suatu tuba germ, dimana tuba ini akan tumbuh terus membentuk filamen yang panjang dan bercabang yang disebut hifa, seterusnya akan membentuk suatu massa hifa yang disebut miselium. Miselium pada penelitian ini mulai banyak terbentuk pada inkubasi 48 jam (Gambar 2b). Pada waktu inkubasi ini, miselium yang terbentuk masih berwarna putih. Perubahan warna mulai terjadi saat inkubasi 72 jam. Pada tahapan ini, miselium yang terbentuk mulai sedikit berubah warna menjadi oranye muda (+) (Gambar 2c) kemudian paparan cahaya ruangan selama 3 jam merubah warna miselium (+) menjadi miselium berwarna oranye yang sedikit lebih tua (++). Spora kapang mulai terbentuk pada inkubasi 120 jam dengan ciri morfologinya yaitu terjadi perubahan warna dari oranye ++ (Gambar 2d) menjadi oranye ++++ (Gambar 2e) dan terbentuknya sporangium. Produksi katalase dilakukan pada inkubasi 120 jam, hal ini dikarenakan pada waktu inkubasi tersebut pembentukan katalase 1 telah terbentuk (Diaz et al. 2001)
Diaz et al. (2001) melaporkan bahwa katalase 1 banyak terdapat pada proses pembentukan konidiospora (konidia). Terdapat tiga tahapan pada proses pembentukan konidia pada Neurospora crassa. Tahap pertama, pertumbuhan hifa menjadi kumpulan miselium. Miselium mulai tumbuh saat terjadi kontak langsung antara filamen (hifa) dengan udara dalam waktu 40 menit, kumpulan miselium (tahap dua) mulai terbentuk setelah aerial hifa terpapar oleh cahaya setelah dua jam dan tahapan terakhir konidia akan terbentuk pada ujung cabang aerial hifa setelah terpapar cahaya 9 jam ( Diaz et al. 2001; Toledo et al. 1991).
Katalase Hasil Pemurnian
15
sulfat dan kromatografi gel filtrasi. Amonium sulfat merupakan garam yang umum digunakan pada pengendapan protein karena kelarutannya yang tinggi di dalam air, relatif lebih murah, dan tersedia pada tingkat kemurnian yang tinggi. Selain itu, amonium sulfat umumnya dapat digunakan tanpa mempengaruhi aktivitas enzim. Pengendapan dengan amonium sulfat dilakukan pada suhu dingin (4oC) dengan tujuan agar aktifitas enzim tidak berubah, hal ini dikarenakan pada suhu tersebut enzim tidak terdenaturasi (Yunita 2006). Setelah itu, larutan didiamkan selama satu malam pada suhu 4oC agar proses agregasi molekul-molekul protein menjadi sempurna. Endapan yang diperoleh dapat diambil melalui sentrifugasi pada 10000 x g selama 20 menit. Endapan selanjutnya disuspensikan pada bufer fosfat dan didialisis untuk menghilangkan sisa garam yang terdapat dalam enzim.
Pemilihan pengendapan menggunakan 60% amonium sulfat berdasarkan penelitian Ema (2015). Ema melaporkan bahwa aktivitas tertinggi katalase Neurospora crassa InaCC F226 diperoleh pada pengendapan amonium sulfat dengan konsentrasi 60% (w/v) jenuh. Selain itu, pemilihan ini juga berdasarkan protein penyusun katalase. Protein penyususn katalase dari kapang ini diduga memiliki lebih banyak asam amino hidrofilik. Protein dengan asam amino hidrofilik membutuhkan garam ammonium sulfat yang lebih banyak untuk mengganggu interaksi yang kuat antara air dengan asam amino hidrofilik.
Hasil pemurnian (100 mL ekstrak kasar) menggunakan 60% amonium sulfat dihasilkan tingkat kemurnian 2,2 kali dengan perolehan 55,1% (Tabel 1). Jika dibandingkan dengan ekstrak kasar (136,7 U/mg), aktifitas spesifik yang diperoleh setelah dialisis meningkat sebanyak 2 kali. Selanjutnya, tahapan kemurnian dilakukan dengan kromatografi filtrasi gel dengan fase diamnya adalah Sephadex G-75 dan fase geraknya buffer natrium fosfat 50 mM (pH 7). Prinsip pemisahan protein menggunakan kromatografi kolom filtrasi gel adalah perbedaan bobot molekul protein. Sephadex adalah butiran gel makroskopis yang terbuat dari turunan polisakarida, yaitu dekstran. Sephadex G75 mampu memisahkan molekul protein dengan BM 3000—8,0 x 104 kDa. Oleh karena itu, Sephadex G75 sesuai untuk digunakan dalam pemisahan enzim katalase yang memiliki bobot molekul kurang dari 50 kDa (Diaz et al. 2001).
Hasil percobaan pemurnian menggunakan gel filtrasi dengan matriks Sphadex G-75 dihasilkan satu puncak pada pengukuran OD 280 nm (Gambar I), pada tahapan ini terjadi peningkatan aktivitas spesifik sebesar 1464,9 U/mg dengan nilai perolehan sebanyak 21,7%. Tingkat kemurnian yang diperoleh pada tahap akhir ini meningkat sekitar 10 kali dari hasil amonium sulfat (Tabel I)..
16
media dan jenis mikrob yang digunakan pada media yang digunakan dalam produksi. Sementara Ema (2015) melaporkan katalase dari N. crassa InaCC F226 dengan pengendapan amonium sulfat 60% dihasilkan aktifitas spesifik 3.338,6 U/mg, kemurnian 6,1 kali, dan perolehan 88,6%.
Tian et al. (2013) menggunakan Hansenula polymorpha dengan pemurnian menggunakan kromatografi afinitas dihasilkan perolehan (yield) sebanyak 52%. Sementara penelitian Kandakuri et al. (2012) menggunakan black gram (Vigma mango) dihasilkan perolehan (yield) sebesar 39,7%. Fang et al. (2004) menggunakan Thermoascus aurantiacus melaporkan bahwa penambahan 20 g/L dekstrin dan 1% etanol dan peptone dalam media pertumbuhan dapat meningkatkan aktivitas katalase. Sementara Zhenxiaou Yu et al. (2016) melaporkan bahwa penambahan 2% hingga 4% etanol dapat menurunkan aktivitas katalase dari 33.966±22,8 menjadi 18.564±20,2 U/mL.
Berat Molekul Katalase Neurospora crassa InaCC F226
Tingkat kemurnian suatu enzim dapat di lihat dari hasil elektroforesis SDS PAGE berupa pita-pita protein. Dalam hal ini, berat molekul suatu enzim dapat ditentukan dengan bantuan penanda (marker) yang diwarnai dengan larutan staining tertentu. Umumnya larutan staining yang digunakan dalam SDS PAGE dapat berupa pewarnaan perak nitrat maupun Commasie brilliant blue R-250. Pewarnaan perak nitrat dapat digunakan untuk kadar protein yang sangat kecil yaitu 10-100 g, dengan kadar tersebut pewarnaan perak nitrat 100 lebih peka sementara Commasie brilliant blue R-250 dapat mendeteksi 1-10 Gram protein dalam suatu pita. Dalam penelitian ini digunakan pewarnaan Commasie brilliant blue R-250.
17
Berdasarkan pita hasil pemurnian gel filtrasi, dapat diprediksikan berat molekul katalase dari Neurosopra crassa InaCC F226 adalah 59,4 kDa. Hasil ini mengindikasikan bahwa katalase yang diisolasi dari kapang ini termasuk pada kelompok monofuctional heme katalase. Xinhua Fu et al. (2014) dan Chelikani et al. (2004) melaporkan bahwa monofuctional katalase terdiri atas dua kelas yaitu subunit kecil katalase (<60 kDa) dan subunit besar katalase (>75 kDa). Kelompok ini merupakan katalase yang memiliki gugus prostetik iron-protophyrine IX pada sisi aktifnya. Pada umumnya, katalase yang diisolasi dari kapang memiliki berat molekul >75 kDa. Kacem-Chaouche et al. (2013) melaporkan bahwa berat molekul katalase Aspergilus phoenicis K30 adalah 158 kDa. Penelitian Pedrini et al. (2006) yang mengisolasi katalase dari Beauveria bassiana diperoleh berat molekul sebesar 84 kDa sementara Diaz et al. (2001) melaporkan bahwa berat molekul katalase Neurospora crassa sebesar 80 kDa.
Suhu, pH optimum dan Stabilitas suhu
Optimasi suhu dilakukan dengan cara menginkubasi katalase dalam berbagai kondisi suhu (30-60oC). Optimasi ini bertujuan untuk menentukan suhu optimum katalase, enzim akan bekerja secara optimal pada suhu optimumnya dan akan mengalami kerusakan struktur tiga dimensinya yang berkaitan dengan aktivitas katalitiknya di atas suhu optimum, dan di bawah suhu optimum kinerja enzim akan kurang efektif (Baehaki 2012).
Hasil penelitian menunjukan bahwa katalase Neurospora crassa InaCC F226 memiliki suhu optimum pada suhu 40oC (Gambar 4) dengan nilai aktifitas relatif sebesar 100% (286,1 U/mL). Pada kondisi ini, tumbukan antara enzim dan substrat terjadi secara efektif, akibat yang ditimbulkan dari gaya tumbukan ini adalah mudahnya terbentuk komplek antara enzim dan substrat sehingga produk yang terbentuk meningkat.
Hasil penelitian pada Gambar 4 memperlihatkan bahwa aktifitas katalase meningkat seiring bertambahnya suhu dan aktifitasnya mulai menurun saat suhu di atas 40oC. Kecepatan reaksi antara enzim dan substrat akan meningkat seiring bertambahnya suhu karena dengan kenaikan suhu gerakan partikel semakin cepat. Energi kinetik partikel-partikel semakin bertambah sehingga makin banyak terjadi tumbukan yang efektif. Dengan demikian, makin banyak partikel-partikel yang bereaksi. Energi kinetik didefinisikan sebagai besarnya energi yang ditimbulkan akibat terjadinya gerakan dalam suatu reaksi. Akibat yang ditimbulkan dari bertambahnya energi kinetik akan mempercepat gerak vibrasi, translasi, dan rotasi baik enzim maupun substrat. Selain memeperbesar energi kinetik, kenaikan suhu juga akan memperbesar frekuensi tumbukan antara enzim-substrat sehingga enzim akan semakin aktif (Kosim & Surya 2010).
18
optimum) pada enzim dapat mengganggu kestabilan ikatan kovalen, ikatan hidrogen, ikatan ion, ikatan Van der Walls dan ikatan hidrofobik pada enzim. Terganggunya ikatan ini dapat menginaktivasi enzim (Bommarius & Broering 2005). Stabilitas enzim terhadap suhu yang ditunjukan Gambar 5 mengindikasikan bahwa katalase ini termasuk mesozim, yaitu enzim yang dapat bekerja pada suhu sedang. Stabilitas aktifitas katalase yang masih terjaga pada waktu inkubasi selama 2 jam memberi makna bahwa enzim ini cukup bagus untuk di aplikasikan dalam industri.
Beberapa penelitian juga melaporkan bahwa suhu optimum bagi katalase yang berasal dari mikrob berbeda memiliki nilai yang berbeda, seperti Aspergillus niger memiliki suhu optimum di 28oC (Buckova et al. 2005), Aspergillus phoenicis K30 optimum di suhu 30oC (Kacem Chaouche et al. 2013), dan Aspergillus niger AM-11 optimum di suhu 30oC (Fiedurek dan Gromada 2000).
Stabilitas katalase juga dipengaruhi oleh kondisi pH. Hasil percobaan yang diperlihatkan pada Gambar 6 menunjukkan bahwa dari rentang nilai pH 5-9 katalase Neurospora crassa InaCC F226 yang diinkubasi pada suhu 35oC selama 15 menit memiliki pH optimum pada pH 7 dan relatif stabil pada pH 5-9. Kestabilan ini memberikan makna bahwa pada kisaran pH tersebut ion-ion hidrogen tidak banyak mempengaruhi gugus fungsional enzim sehingga konformasi enzim tetap terjaga (Hermawan 2008; Sumardi 2004).
Kondisi keasaman (pH) berpengaruh terhadap asam amino penyusun protein enzim. Gugus karboksil pada asam amino cenderung mengikat ion H+ pada suasana asam. Hal ini mengakibatkan gugus karboksil bersifat netral, sedangkan gugus amino bermuatan positif. Enzim pada suasana basa membuat gugus amino melepaskan H+ sehingga menjadi bermuatan netral, sedangkan gugus karboksil bermuatan negatif. Perubahan ionisasi asam amino penyusun protein enzim mempengaruhi bentuk molekul enzim. Perubahan bentuk molekul dapat mempengaruhi aktivitas katalitik enzim (Asih 2016; Nelson dan Cox 2008).
Penurunan dan kenaikan pH dapat mempengaruhi aktivitas enzim. Selisih pH yang kecil dari pH optimum enzim akan menyebabkan turunnya aktifitas enzim. Hal ini karena terjadi perubahan ionisasi gugus-gugus fungsi pada situs aktif enzim. Selisih pH yang besar dari pH optimum akan menyebabkan denaturasi. Denaturasi terjadi karena adanya gangguan pada ikatan-ikatan yang menjaga kestabilan struktur tiga dimensi enzim (Dian 2016; Hames dan Hooper 2005).
Sifat biokimia pH katalase dari isolat lokal ini memiliki karakteristik yang sama dengan hasil penelitian Diaz et al (2001) yang melaporkan bahwa katalase dari Neurospora crassa stabil pada kisaran pH 4-12. Hasil penelitian Kandakuri et al. (2012) melaporkan bahwa katalase memiliki pH dan suhu optimum pada pH 7 dan 40oC serta stabil pada pH 6-10. Asmaa Ali Hussein (2012) juga melaporkan bahwa katalase memiliki nilai pH optimum 9 dan stabil pada pH 6-11.
Pengaruh Aktivator dan Inhibitor
19
aktivator dan inhibitor yang digunakan dalam mempelajari aktivitas enzim berupa ion logam dari suatu garam. Aktivator dan inhibitor setiap enzim berbeda-beda, sehingga diperlukan pengujian untuk penentuan aktivator dan inhibitor suatu enzim. Dalam penelitian ini garam-garam yang digunakan untuk uji aktivator adalah CaCl2, MnCl2, CuSO4, dan FeCl3 sementara inhibitor yang digunakan adalah EDTA.
Berdasarkan data pada Tabel 2 terlihat bahwa ion Ca+2 dan ion Fe+2 merupakan aktivator bagi katalase Neurospora crassa InaCC F226. Penambahan 0,5 mM ion Ca+2 dapat meningkatkan aktifitas katalase dari 218,2 U/mL (kontrol) menjadi 242,7 U/mL. Sementara penambahan ion Fe+2 dapat meningkatkan aktifitas katalase sebesar 224,4 U/mL (0,5 mM) dan 315,8 U/mL (1 mM). Peningkatan aktifitas katalase akibat adanya ion tersebut dikarenakan katalase memiliki sisi aktif yang dapat mengikat kedua logam. Pengikatan ini mengakibatkan struktur heme katalase akan mengalami resonansi yang akan membentuk kationik katalase dengan geometri molekul penta coordinate high spin (5cHS) (Manu et al. 2008). Pembentukan kationik ini dapat menyebabkan elektron-elektron logam akan disumbangkan ke pusat katalitik dari katalase sehingga energi dari enzim akan bertambah.
Inhibitor bagi katalase Neurospora crassa InaCC F226 adalah EDTA dan Cu+2 dan Mn+2. Hasil penelitian menunjukkan bahwa EDTA dapat menurunkan aktifitas katalase sebesar 81,4% (0,5 mM); 33,2% (1 mM); dan 13,5% (1,5 mM). Senyawa EDTA merupakan senyawa pengkhelat logam. Dalam pembentukan kompleks, EDTA berperan sebagai asam Lewis atau ligan dan logam berperan sebagai basa Lewis atau ion pusat. Senyawa EDTA merupakan amina polikarboksilat dan termasuk jenis ligan multidentat, sehingga dapat berkoordinasi dengan suatu ion logam pada kedua gugus nitrogen dan keempat gugus karboksilnya (Sri Rizky et al. 2009). Kompleks yang terbentuk antara EDTA dan ion besi pada pusat aktif enzim dapat mengakibatkan perubahan konformasi struktur aktif katalase. Penambahan ion Cu+2 dan Mn+2 menurunkan aktifitas katalase berturut-turut sebesar 51,2% (0,5 mM); 28,8 mM (1 mM); dan 19,5 mM (1,5 mM) dan ion 83,7% (0,5 mM); 76,1% (1 mM); dan 14,4% (1,5 mM). Penurunan ini terjadi dikarenakan baik ion tembaga maupun mangan dapat menurunkan reaksi reduksi oksidasi pada penguraian H2O2.
20
Muatan-muatan positif Cu+2 dan Mn+2 cenderung terikat pada sisi aktif, karena residu asam amino pada sisi aktif bersifat lebih nukleofilik. Ion logam Cu+2 dan Mn+2 akan menetralkan residu asam amino pada sisi aktif dengan membentuk ikatan kovalen koordinasi. Sifat nukleofilik sisi aktif akan berkurang, sehingga hanya ada beberapa sisi aktif yang dapat berikatan dengan substrat, yaitu sisi aktif yang tidak terinhibisi oleh ion Cu+2 dan Mn+2. Hal ini menyebabkan pembentukan kompleks enzim substrat (ES) menjadi lambat dan berkurang, sehingga produk yang dihasilkan sedikit dan aktivitasnya menurun. Penghambatan ini termasuk jenis penghambatan kompetitif, maka akan terbentuk dua kompleks yang terjadi yaitu kompleks enzim substrat (ES) dan enzim inhibitor (EI), disatu pihak aktif dan di lain pihak tidak aktif (Sri Rizky et al. 2009; Shahib, 1992).
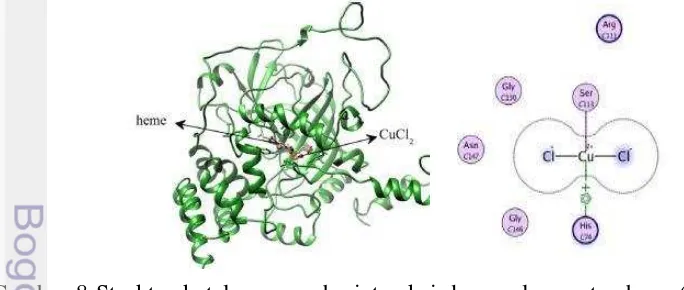
Simulasi molekuler tembaga terhadap katalase yang diperlihatkan pada gambar 8 menunjukkan posisi tembaga yang berikatan dengan katalase. Tembaga terletak diantara dua β-sheets yang berdekatan dengan gugus heme dan mengikat His 74 dan Ser 113 yang berdekatan dengan area hidrofobik. Interaksi antara ion tembaga dan His 74 dapat mengganggu sisi aktif enzim. Hal ini dikarenakan residu His 74 memiliki peran penting dalam reaksi katalitik yang membantu hidrogen peroksida untuk mengatasi halangan sterik pada pusat katalitik katalase.
Kinetika Reaksi (Vmaks dan Km)
Konsentrasi substrat sangat berpengaruh terhadap kecepatan reaksi enzim. Pada konsentrasi yang rendah, kecepatan reaksipun rendah dan kecepatan reaksi akan meningkat dengan bertambahnya konsentrasi substrat, hingga dicapai titik batas yang disebut Vmaks. Apabila telah melampaui titik ini peningkatan konsentrasi substrat tidak akan meningkatkan kecepatan reaksi, karena pada keadaan ini enzim dikatakan jenuh oleh substrat (Emmy Y et al. 2013). Konsentrasi substrat hidrogen peroksida yang digunakan dalam penelitian ini adalah 0-40 mM. Hubungan antara konsentrasi substrat dan aktivitas enzim digambarkan pada plot Michaelis-Menten (Gambar 6). Terbentuknya kurva hiperbola rektangular menunjukkan bahwa kinetika aktivitas enzim melebihi konsentrasi substrat (Gambar 6). Kurva Michaelis-Menten yang terbentuk menunjukkan bahwa pada konsentrasi hidrogen peroksida 0-10 mM, perubahan kecepatan reaksi akan linear terhadap substrat, sementara pada konsentrasi hidrogen peroksida diatas 10 mM peningkatan aktivitas terjadi secara landai. Hal ini dikarenakan saat kondisi tersebut enzim telah jenuh dengan substrat.
21
Pigmentiphage sp DL-8 sebesar 9,48 mM dan 81,2 s.mM-1. Tian et al. (2012) melaporkan nilai Vmaks dan Km dari Hansenula polymorpha adalah 25 s.mM-1 dan 0,95 mM. Kandakuri et al. (2012) menggunakan Black gram (Vigna mungo) diperoleh nilai Vmaks sebesar 2,5 s.mM-1 dan Km sebesar 16,2 mM. Sementara Diaz et al. (2001) menggunakan Neurospora crassa diperoleh nilai Km sebesar 21,7 mM. Nilai Km yang diperoleh dari hasil penelitian jika dibandingkan dengan hasil penelitian Diaz et al (2000), Weiling Dong et al. (2015) dan Kandakuri et al. (2012) nilainya lebih rendah. Rendahnya nilai Km ini mengindikasikan bahwa katalase Neursopora crassa InaCC F226 memiliki afinitas cukup besar jika dibandingkan dengan hasil dari Diaz et al (2000), Weiling Dong et al. (2015) dan Kandakuri et al. (2012). Nilai Vmaks yang diperoleh jika dibandingkan dengan hasil penelitian diatas nilainya lebih rendah. Hal ini menunjukkan bahwa kecepatan yang mampu dicapai dalam mengoksidasi substrat masih sangat rendah.
5 SIMPULAN DAN SARAN
SIMPULAN
Katalase dari kapang Neurospora crassa InaCC F226 memiliki aktivitas spesifik 1464.9 U/mg, tingkat kemurnian 10,7 kali, dengan perolehan 21,7%, suhu optimum 40oC, stabil pada suhu 30oC dan 40oC pada inkubasi 2 jam, pH optimum 7 dan berat molekul 59,4 kDa. Nilai Km dan Vmaks diperoleh sebesar 8.8 mM dan 5.7 s.mM-1.
SARAN
Perlu dilakukan pemurnian menggunakan kolom yang lebih panjang yang berdiameter besar, optimasi konsentrasi poliakrilamid yang digunakan, pemilihan matriks kolom yang sesuai, dan perlu dilakukan uji zimogram untuk menentukan subunit protein katalase.
DAFTAR PUSTAKA
Aini FN, Kuswytasari ND. 2013. Pengaruh penambahan eceng gondok (Eichornia crassipes) terhadap pertumbuhan jamur tiram putih (Pleurotus ostreatus). J Sains dan Seni Pomits 2(1):116-120
Akyilmaz E, Kozgus O. 2009. Determination of calcium in milk and water samples by using catalase enzyme electrode. Food Chem.115(1): 347–351. doi: 10.1016/j.foodchem.2008.11.075.
Asih Sri. 2016. Produksi, Purifikasi, Dan Karakterisasi Lakase Dari Pleurotus ostreatus (Ho) Dan Schizophyllum commune (Sc) Pada Fermentasi Padat Limbah Lignoselulosa. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
22
Baeza S, Vejar N, Gulppi M, Azocar M, Melo F, Monsalve A, Pérez-Donoso J, Vásquez CC, Pavez J, Zagal JH, Zhou X, Thompson GE, Páez MA. 2013. New evidence on the role of catalase in Escherichia coli-mediated biocorrosion. Corros Sci. 67 : 32–41. doi: 10.1016/j.corsci.2012.09.047. BPPT. 2015. Potensi dan Tantangan Menuju Kemandirian Enzim Nasional.
http://ptb.bppt.go.id. Diunduh 1 Januari 2016.
Bradford MM. 1976. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein–dye binding. Journal Analisys Biochem. 72: 248–254.
Buckova M, Godocikova J, Simonovicova A, Polek B. 2005. Production of catalases by Aspergillus niger isolates as a response to pollutant stress by heavy metals. Curr Microbiol. 50 (4): 175–179. doi: 10.1007/s00284-004-4458-5.
Chelikani P, Fita, and PC Loewen. 2004. Diversity of stuctures and properties among catalases. Cellular and Molecular Life Sciences. 10 (9): 192-208. Dian Novita D A. 2016. Produksi, Pemekatan, Dan Karakterisasi Enzim Protease
Dari Lactobacillus plantarum SK (5). [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Diaz A, Rangel P, Oca YM, Lledias F, HansbergW. 2001. Molecular and kinetic study of catalase-1, a durable large catalase of Neurospora crassa. Free Radic Biol Med. 31(11): 1323–1333. doi: 10.1016/S0891-5849(01)00637-2. Didem Sutay Kocabes, Ufuk Bakir, Simon E, V Philips, Michael J, Mc Pherson,
Zumrut B, Ogel. 2008. Purification, characterization, and identification of a novel bifunctional catalase-phenol oxidase from Scytalidium thermophilum. Appl Microbiol Biotechnol. 79: 407-415. doi: 10.1007/s00253-008-1437-y. Ema. 2015. Isolasi, pemurnian parsial dan karakterisasi katalase Neurospora
crassa InaCCF226. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Emmy Y, Erin R G, Lely K, Siti R K. 2013. Study Kinetika Reaksi Esterifikasi Enzimatis Asam Miristat Dengan Oleil Alkohol. Journal Ilmiah Molekul. 8 (1):9-19.
Fiedurek J, Gromada A. 2000. Production of catalase and glucose oxidase by Aspergillus niger using unconventional oxygenation of culture. J Appl Microbiol. 89 (1): 85–9.
Fűtő P, Markus G, Kiss A, Adányi N. 2012. Development of a catalase based amperometric biosensor for the determination of increased catalase content in milk samples. Electroanalysis. 24 (1): 107–113. doi: 10.1002/elan.201100399.
Hames D, Hooper N. 2005. Biochemistry: Bios Instant Notes. Ed ke-3. New York (US): Taylor & Francis Group
Hermawan Seftiono. 2008. Pemurnian dan karakaterisasi mananase dari Streptacidiphilus luteoalbus. [skripsi]. Bogor (ID): Institut Pertanian Bogor. Hussein AA. 2012. Purification and characterization of thermo-alkali stable
catalase from Bacillus sp. Int Res J Biotechnol. 3 (10): 207–214.
Isobe K, Inoue N, Takamatsu Y, Kamada K, Wakao N. 2006. Production of catalase by fungi at low pH and high temperature. Journal of Biosci Bioeng. 101 (3): 73-76.
S-23
1 T exhibiting high catalase activity. Journal of Bacteriology. 182 (7): 1903-1909.
Jessica Röcker, Matthias Schmitt, Ludwig Pasch, Kristin Ebert, Manfred Grossmann. 2016. The use of glucose oxidase and catalase for the enzymatic reduction of the potential ethanol content in wine. Food Chemistry. 210: 660–670 . doi: 10.1016/j.foodchem.2016.04.093.
Junhuan Li, Yang Zhang, Haiying Chen, Yuntao Liu, Yanjun Yang. 2013. Purification and characterization of recombinant Bacillus subtilis 168 catalase using a basic polypeptide from ribosomal protein L2. Biochemical Engineering Journal. 72: 83-89. doi:10.1016/j.bej.2013.01.002.
Kandukuri SS, Ayesha N, Shiva RS, Vijayalakshmi. 2012. Purification and characterization of catalase from sprouted black gram (Vigna mungo) seeds. Journal of Chromatography. 889: 50– 54.
Kacem-Chaouche N, Destain J,Meraihi Z, Dehimat L, Haddoum T,Wathelet J. 2013. Optimization of extracellular catalase production from Aspergillus phoenicis K30 by a linear regression method using date flour as single carbon source and purification of the enzyme. Africa J Biotechnol. 12 (19): 2646–2653.
Loncar N, Fraaije MW. 2014. Monofunctional-a case of thermostable Thermobifida fusca catalase with peroxidase activity. Appl Microbiol Biotechnol. 99 (5): 2225-2232. doi: 10.1007/s00253-014-6060-5.
LIPI. 2013. Bioresources untuk pembangunan ekonomi Indonesia. [laporan tahunan]. Cibinong (ID): Lembaga Ilmu Pengetahuan Indonesia.
Malika Ammam, Jan Fransaer. 2012. Combination of laccase and catalase in construction of H2O2-O2 based biocathode for application in glucosa biofuel cells. Biosensor and Bioelectronics. 39: 274-281.
Merle PL, Sabourault C, Richier S, Allemand D, Furla P. 2007. Catalase characterization and implication in bleaching of a symbiotic sea anemone. Free Radic Biol Med. 42: 236–246.
Nelson DL, Cox MM. 2008. Principles of Biochemistry 5th Ed. New York (US): WH
Freeman and Company.
Shahib M N. 1992. Pemahaman Seluk Beluk Biokimia dan Penerapan Enzim. PT. Citra Aditya Bakti. Bandung. 41-43, 47.
Shuang Li, Xiaofeng Yang, Shuai Yang, Muzi Zhu, Xiaoning Wang. 2012. Technology Prospective On Enzymes: Application, Marketing and Engineering. Computation and Structural Biotechnology Journal. 2(3): 1-11. doi: 10.5936/csbj.201209017.
Sooch BS, Kauldhar BS. 2014. A process for hyperproduction of catalase enzyme from novel extremophilic bacterium Geobacillus extremocatsoochus MTCC 5873 and strain thereof. [Indian Patent Application No. 362/DEL/2014]. India.
Sumardi. 2004. Isolasi, karakterisasi, dan produksi β-mananase ekstraseluler dari Geobacillus stearothermophilus I-07. [disertasi]. Bogor (ID): Institut Pertanian Bogor.
24
Sri Widyarti, Sri Rahayu, Fatchiyah, Estri L A. 2011. Biologi Molekuler. Erlangga
Tian YS, Xu H, Xu J, Peng RH, Yao QH. 2013. Heterlogous expression and initial characterization of the peroxisomal catalase from the methylotropic yeast Hansenula polymorpha in Pichia pastoris. Appl Biochem Microbiol: 49 (5): 507–13.
Vogel Hj. 1964. Distribution of lysine pathways among fungi, evolutionary implication. Am Nat. 98: 435-446.
Weiling Dong, Ying Hou, Shuhuan Li, Fei Wang, Jie Zhou, Zhoukun Li, Yicheng Wang. 2015. Purification, cloning, expression, and biochemical characteritzation of a monofunctional catalase, KatP, from Pigmentiphage sp Dl-8. Protein expression purification. 108: 54-61. doi: 10.1016/j.pep.2015.01.011.
Widiastuti H, Siswanto, Suharyanto. 2007. Optimasi pertumbuhan dan aktivitas ligninolitik Omphalina sp. dan Pleurotus ostreatus pada fermentasi padat. Menara Perkebunan 75(2): 93-105.
Xinhua Fu, Wei Wang, Jianhua Hao, Xianglin Zhu, and Mi Sun. 2014. Purification and characterization of catalase from marine bacterium Acinetobacter sp. YS0810. Biomed Research International. 2014: 1-7. doi: 10.1155/2014/409626.
Zeng HW, Cai YJ, Liao XR, Zhang F, Zhang DB. 2011. Production, characterization, cloning and sequence analysis of a monofunctional catalase from Serratia marcescens SYBC08. J Basic Microbio. 51: 205– 214.
25
26
Lampiran 1 Bagan Alir
Penentuan berat molekul dengan
SDS-PAGE
Pemurnian dengan gel filtrasi
Optimasi suhu, pH, inhibitor dan ion Logam
Penentuan Km dan Vmax
Uji aktivitas dan kadar protein
Peremajaan
Neurospora crassa InaCC
F226
Penyiapan ekstrak kasar
enzim
Pengendapan amonium sulfat
27
Lampiran 2 Pembuatan Larutan
A.Pembuatan Reagen Bradford
Commasie brilliant blue R-250 sebanyak 10 mg, etanol 95% sebanyak 5 mL dicampur kemudian dihomogenkan dengan ditambah asam fosfat 95% sebanyak 10 ml, ditambahkan dengan aquades hingga tanda tera labu ukur 100 mL.
B.Media Vogel
Na3Sitrate.2H2O sebanyak 12,5 gram, KH2PO4 anhidrous sebanyak 25 gram, NH4NO3.anhidrat sebanyak 10 gram, MgSO4.7H2O sebanyak 1 gram, CaCl2.2H2O sebanyak 5 gram dan Trace Element sebanyak 5 mL dilarutkan dalam 95 mL aquades.
C.Trace Element
Sitric acid.H2O sebanyak 5 gram, ZnSO4.7H2O sebanyak 5 gram, Fe(NH4)2(SO4)2.6H2O sebanyak 1 gram, CuSO4.5H2O sebanyak 0,25 gram, MnSO4.H2O sebanyak 0,05 gram, H3BO3 sebanyak 0,05 gram, Na2MoO4.2H2O sebanyak 0,05 gram dilarutkan dalam 95 mL aquades.
D.Larutan Standar BSA 1 ppm (mg/mL) dalam 100 mL (0,1 L) 1 ppm =
1 ppm =
1 mg/ L x 0,1 L = mg BSA mg BSA = 0,1 mg
Bovine Serum Albumin (BSA) yang harus di timbang untuk membuat larutan standar BSA 1 ppm adalah 0,1 mg dalam 100 mL buffer natrium fosfat 0,05 M.
E. Pembuatan larutan 3% hidrogen peroksida dalam 100 mL buffer natrium fosfat 0,05 M dari 50% hidrogen peroksida
V1. M1 = V2. M2
V H2O2 50% . M H2O2 50% = V H2O2 3% . M H2O2 3%
V . 50% = 100 mL . 3%
V H2O2 50% =
= 6 mL
28
F. Pembuatan larutan hidrogen peroksida 5 mM; 10 mM; 15 mM; 20 mM; 25 mM; 30 mM; 35 mM; 40 mM dan 45 mM dari 50% hidrogen peroksida
Massa jenis zat (ρ) =
Massa larutan hidrogen peroksida 50% =
=
= 1,196
x 1000 mL
= 1196 Gram
Massa hidrogen peroksida 50% = 50% hidrogen peroksida x 1196 Gram = 598 Gram
Mol hidrogen peroksida 50% =
Mol hidrogen peroksida 50% =
= 17,588 mol
Konsentrasi hidrogen peroksida 50% =
= 17,588 M = 17588 mM
Dengan menggunakan rumus pengencaran, dapat dihitung konsentrasi yang diinginkan:
a. 10 mM hidrogen peroksida dalam 100 mL buffer natrium fosfat 0,05 M VH2O2 50% x MH2O2 50% = VH2O2 10 Mm x M H2O2 10 mM
VH2O2 50% = = 0,057 mL = 56,8 L
56,8 L hidrogen peroksida 50% di pipet kemudian diencerkan dalam labu takar 100 mL hingga tanda tera.
b. 15 mM hidrogen perksida dalam 100 mL buffer natrium fosfat 0,05 M VH2O2 50% x MH2O2 50% = VH2O2 10 Mm x M H2O2 10 mM
VH2O2 50% = = 0,085 mL = 85,3 L
29
Lampiran 4 Hasil perhitungan konsentrasi protein
Fraksi Rata-rata
Persamaan kurva standar : y = 1,1526x Keterangan : y = absorbansi
30
Contoh perhitungan konsentrasi protein pada fraksi ekstrak kasar y = 1,1526x
0,2596 = 1,1526x
x = 0,2252 mg/mL x faktor pengenceran x = 0,2252 mg/mL x 2
x = 0,4504 mg/mL
Protein total = kadar protein (mg/mL) x volume total fraksi Protein total fraksi kasar = 0,4504 mg/mL x 100 mL
Protein total fraksi kasar = 45,04 mg
Lampiran 5 Hasil uji aktivitas katalase
Fraksi
Contoh perhitungan aktivitas katalase fraksi ekstrak kasar
Aktivitas katalase (U/mL) =
Aktivitas total (U) = Aktivitas unit katalase x Volume fraksi total = 61,5529 U/mL x 100 mL
31
Lampiran 6 Aktivitas katalase tiap fraksi pemurnian
Fraksi Aktivitas total (U)
Protein total (mg)
Aktivitas spesifik
(U/mg)
Kemurnian (kali)
Perolehan (%)
Ekstrak
Kasar 6155,0402
45,0402 136.7 1.0 100.0
Amonium
Sulfat 4071,0659
11,1146 305.2 2.2 55.1
Gel Filtrasi 1669,4867 0,9117 1464.9 10.7 21.7
Contoh perhitungan pada fraksi kasar
Aktivitas spesifik (U/mg) =
=
= 136.7 U/mg
Kemurnian =
=
= 1,00 kali
Perolehan (yield) = x 100%
=
x 100%
32
Lampiran 7 Aktivitas katalase pada berbagai suhu
Suhu (oC) Rata-rata
Contoh perhitungan aktivitas unit katalase pada suhu 30 0C
Aktivitas katalase (U/mL) =
Lampiran 8 Aktivitas katalase pada berbagai pH
33
Aktivitas Relatif = (
) x 100%
= 77,9%
Lampiran 9 Aktivitas katalase dalam berbagai ion logam
Ion logam
Rata-rata absorbansi
(Ab-As) Aktivitas katalase (U/mL) 0,5 mM 1 mM 1,5 mM 0,5 mM 1 mM 1,5 mM EDTA 0,1574 0,0642 0,0262 177,5522 72,3820 29,5168
Cu+2 0,0497 0,0249 0,0188 112,2015 56,2511 42,4891
Ca+2 0,1076 0,0889 0,0798 242,6772 200,4136 179,9586
Mn+2 0,1619 0,1473 0,0279 182,6659 166,1591 31,5473
Fe+2 0,0995 0,1399 0,0867 224,4031 315,7736 195,6007
Ion logam
Aktivitas katalase (U/mL) Aktivitas relatif (%) 0,5 mM 1 mM 1,5 mM 0,5 mM 1 mM 1,5 mM EDTA 177,5522 72,3820 29,5168 81,3787 33,1753 13,5286
Cu+2 112,2015 56,2511 42,4891 51,4261 25,7819 19,4744
Ca+2 242,6772 200,4136 179,9586 111,2279 91,8569 82,4817
Mn+2 182,6659 166,1591 31,5473 83,7225 76,1568 14,4593
Fe+2 224,4031 315,7736 195,6007 102,8522 144,7307 89,6510
Contoh perhitungan aktivitas unit katalase pada EDTA 0,5 mM
Aktivitas katalase (U/mL) =
=
= 177,5522 U/mL
Aktivitas Relatif = (
) x 100%
34
Lampiran 10 Konsentrasi substrat terhadap aktivitas katalase (Kurva Michaelis Menten)
Contoh perhitungan aktivitas katalase pada H2O2 0,5 mM
Aktivitas katalase (U/mL) =
36
RIWAYAT HIDUP
Penulis lahir di Pasir Pangaraian, Riau pada tanggal 14 April 1988. Penulis merupakan anak ke tujuh dari 10 bersaudara dari pasangan Bapak Gunawan Wiloso dan Ibu Tumini. Penulis menempuh pendidikan sarjana di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) Universitas Riau dan lulus tahun 2013. Penulis telah bekerja di Lembaga Ilmu Pengetahuan Indonesia (LIPI) sebagai asisten peneliti sejak tahun 2016-sekarang.
Tahun 2014, penulis diterima di Sekolah Pascasarjana Institut Pertanian Bogor pada program studi Biokimia dengan beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) Fresh Graduate dari Direktorat Jenderal Pendidikan Tinggi (Dirjen Dikti). Artikel bagian dari karya ilmiah ini dengan judul