AMIDASI ASAM PALMITAT MENJADI PALMITAMIDA
MENGGUNAKAN KATALIS NIKEL
SKRIPSI
ALFIENY PUTRI LUBIS 080822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
AMIDASI ASAM PALMITAT MENJADI PALMITAMIDA MENGGUNAKAN KATALIS NIKEL
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ALFIENY PUTRI LUBIS 080822027
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : AMIDASI ASAM PALMITAT MENJADI PALMITAMIDA MENGGUNAKAN KATALIS NIKEL
Kategori : SKRIPSI
Nama : ALFIENY PUTRI LUBIS
Nomor Induk Mahasiswa : 080822027
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Juli 2010
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Nimpan Bangun, M.Sc Prof. Dr. Seri Bima Sembiring, M.Sc NIP 195012221980031002 NIP 194907181976031001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
AMIDASI ASAM PALMITAT MENJADI PALMITAMIDA MENGGUNAKAN KATALIS NIKEL
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2010
PENGHARGAAN
Segala Puji dan Syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat serta karunianya sehingga penulis dapat meyelesaikan penelitian dan penyusunan skripsi ini dengan baik. Dalam pelaksanaan penelitian hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, motivasi dan dukungan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin menyampaikan terimakasih kepada :
1. Prof. Dr. Seri Bima Sembiring, M.Sc selaku pembimbing 1 sekaligus sebagai Kepala Laboratorium Kimia Anorganik FMIPA USU dan Drs. Nimpan Bangun, M.Sc selaku pembimbing 2 yang dengan sabar telah memberikan dorongan , bimbingan dan saran kepada penulis sehingga skripsi ini dapat diselesaikan.
2. Dr.Rumondang Bulan Nst.MS dan Drs.Firman Sebayang,MS selaku ketua dan sekretaris Departemen Kimia FMIPA USU
3. Bapak/ibu dosen Anorganik Bapak Drs.Hamonangan Nainggolan, MS ; Bapak Drs. Minto Supeno, MS; Ibu Dra. Saur Lumbanraja, M.Si; Ibu Andriayani, S.Pd, M.Si dan Ibu Dra.Nurhaida, MS atas segala dorongan dan waktu diskusinya
4. Teman – teman asisten Laboratorium Kimia Anorganik FMIPA USU atas bantuan dan kerjasamanya selama penulis melakukan penelitian dan teman-teman kuliah kimia ekstensi FMIPA USU stambuk '08 atas bantuan dan waktu diskusinya.
5. Pihak-pihak yang tidak disebutkan namun tulus membantu penulis dalam penyelesaian skripsi ini.
Akhirnya saya mengucapkan terimakasih yang sebesar - besarnya kepada kedua orangtua saya Ayahanda Ir. Anwar Lubis dan Ibunda Dra. Aflina, M.Hum, abang saya Alfiansyah Putra Lubis dan adik saya Alfientry Putri Lubis serta teman setia saya Riko Juliardi, S.Si serta seluruh keluarga besar yang telah memberikan kasih sayang, bimbingan, motivasi dan dukungan yang sangat besar untuk keberhasilan penulis.
Penulis menyadari sepenuhnya bahwa skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan saran dan masukan untuk kesempurnaan skripsi ini agar bermanfaat bagi kita semua.
ABSTRAK
Palmitamida (heksadekanamida) telah disintesis dengan mereaksikan asam palmitat dengan gas ammoniak pada tekanan 100 psi, suhu 1800C selama 10 jam menggunakan katalis nikel dengan yield 77,66%. Spektrum FT-IR menunjukkan adanya serapan pada
υ
NH2 3362.36 cm-1 danυ
NH23195.14 cm
-1 disebabkan oleh adanya gugus amida(NH2). Spektrum 1H-NMR menunjukkan 4 pergeseran kimia, masing-masing pada
δNH2 5,4 ppm (broad); δCH2 2,19 ppm (triplet); δCH2 1,5 ppm (multiplet); δCH3 0,9 ppm
AMIDASI PALMITIC ACID INTO PALMITAMIDA USING NICKEL
CATALYSTS
ABSTRACT
Palmitamide (hexadecanamide) has been synthesized by reacting palmitic acid and ammonia gas at a pressure of 100 psi, the temperature of 1800C for 10 hours using a nickel catalyst with a yield of 77.66%. FT-IR spectrum showed two strong absorptions at 3362.36 cm-1 and 3195.14 cm-1 due to amide group (NH2). 1H-NMR spectrum
showed four chemical shifts, at δNH2 5.4 ppm (broad); δCH2 2.19 ppm (triplet); δCH2
DAFTAR ISI
BAB 2. TINJAUAN PUSTAKA
2.1. Perkembangan Komoditi Kelapa Sawit ... 2.2 Oleokimia... 2.3. Asam karboksilat... 2.4. Amida...
2.4.1. Reaksi Senyawa amida... 2.5. Katalis ... 2.5.1. Sifat Katalitik Unsur-unsur Transisi ...
2.5.1.1 Katalis Homogen... 2.5.1.2 Katalis Heterogen... 2.6. Spektroskopi Inframerah ...
BAB 3. BAHAN DAN METODOLOGI PENELITIAN
3.1. Alat dan Bahan ... 3.1.1 Alat – Alat... 3.1.2 Bahan – Bahan... 3.2. Prosedur Penelitian... 3.2.1. Amidasi Asam Palmitat... 3.3. Bagan Penelitian...………...
3.3.1. Bagan Amidasi Asam Palmitat……...………....
BAB 4. HASIL DAN PEMBAHASAN
4.2.1 Reaksi Amidasi Asam Palmitat Dengan Gas NH3...
4.2.1.1 Dugaan Mekanisme Reaksi ... 4.2.2 Spektrum FT-IR Palmitamida ... 4.2.3 Spektrum 1H-NMR...
BAB 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan... 5.2. Saran...
DAFTAR PUSTAKA……… LAMPIRAN
22 23 23 27
29 29
DAFTAR GAMBAR
Gambar 1. Model kemisorpsi molekul gas H2 pada permukaan logam nikel...13
Gambar 2. Spektrum FT-IR Palmitamida...25
Gambar 3. Spektrum FT-IR Asam Palmitat ... 26
DAFTAR TABEL
DAFTAR LAMPIRAN
ABSTRAK
Palmitamida (heksadekanamida) telah disintesis dengan mereaksikan asam palmitat dengan gas ammoniak pada tekanan 100 psi, suhu 1800C selama 10 jam menggunakan katalis nikel dengan yield 77,66%. Spektrum FT-IR menunjukkan adanya serapan pada
υ
NH2 3362.36 cm-1 danυ
NH23195.14 cm
-1 disebabkan oleh adanya gugus amida(NH2). Spektrum 1H-NMR menunjukkan 4 pergeseran kimia, masing-masing pada
δNH2 5,4 ppm (broad); δCH2 2,19 ppm (triplet); δCH2 1,5 ppm (multiplet); δCH3 0,9 ppm
AMIDASI PALMITIC ACID INTO PALMITAMIDA USING NICKEL
CATALYSTS
ABSTRACT
Palmitamide (hexadecanamide) has been synthesized by reacting palmitic acid and ammonia gas at a pressure of 100 psi, the temperature of 1800C for 10 hours using a nickel catalyst with a yield of 77.66%. FT-IR spectrum showed two strong absorptions at 3362.36 cm-1 and 3195.14 cm-1 due to amide group (NH2). 1H-NMR spectrum
showed four chemical shifts, at δNH2 5.4 ppm (broad); δCH2 2.19 ppm (triplet); δCH2
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Komoditi kelapa sawit merupakan salah satu andalan komoditi pertanian Indonesia yang pertumbuhannya sangat cepat dan mempunyai peran strategis dalam perekonomian nasional. Salah satu hasil olahan kelapa sawit adalah minyak sawit mentah atau Crude Palm Oil (CPO) yang dapat diolah menghasilkan produk yang lebih bernilai, salah satunya adalah senyawa amida.
Potensi CPO Indonesia sangat besar dan mengalami peningkatan setiap tahunnya. Peningkatan produksi CPO menjadi 19,2 juta ton pada tahun 2008. Jumlah tersebut melampaui Malaysia yang hanya memiliki tingkat produksi sebesar 17,08 juta ton. Hal ini membuat Indonesia menjadi penghasil CPO nomor satu di dunia, kondisi ini lebih cepat dari prediksi awal yaitu tahun 2010. Minyak kelapa sawit (CPO) merupakan salah satu sumber minyak nabati relatif cepat diterima oleh pasar domestik dan pasar dunia. CPO yang dihasilkan Sebanyak 5 – 5,5 juta ton diserap pasar domestik, dan sekitar 4 juta ton diantaranya diproses menjadi minyak goreng. Pada saat ini kapasitas terpakai industri pengolahan CPO baru mencapai 54% (Pahan, I. 2006).
O
250 24 jam
senyawa amida, senyawa amina, surfaktan, gliserin dan turunan-turunannya.
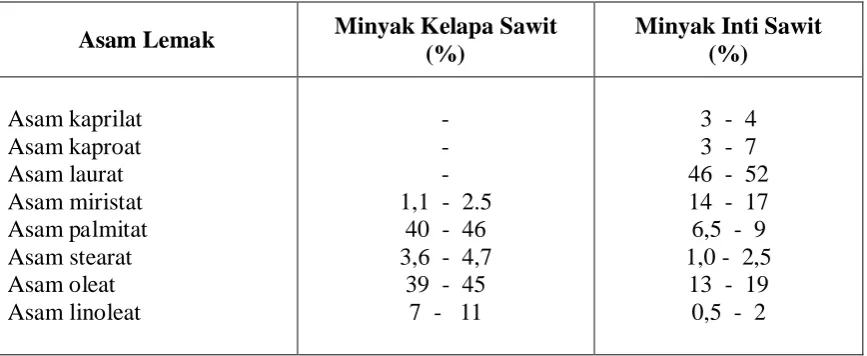
Asam palmitat merupakan salah satu asam lemak yang terdapat dalam minyak kelapa sawit (CPO). Kandungan asam palmitat dalam minyak kelapa sawit tinggi dan merupakan komponen yang terbanyak didalam minyak kelapa sawit tersebut yaitu sebesar 40 – 46%.
Senyawa amida dapat disintesis dengan beberapa cara yaitu dengan dehidrasi garam ammonium, dimana asam karboksilat dicampur dengan amina akan diperoleh garam ammonium yang kemudian didehidrasi membentuk senyawa amida. Menurut Fessenden, R.J. dan Fessenden, J.S. (1986) amida dapat disintesis dengan mereaksikan antara ester dengan amoniak cair dan menghasilkan hasil samping etanol.
Amida juga dapat disintesis dengan turunan asam karboksilat lainnya seperti anhidrida asam halida asam dengan amoniak cair.
Senyawa amida memiliki kegunaan yang luas dalam kehidupan antara lain dapat berguna dalam pembuatan obat-obatan seperti sulfoamida yang digunakan untuk melawan infeksi dalam tubuh manusia, sebagai zat antara dalam pembuatan amina, sebagai bahan awal dalam pembuatan suatu polimer seperti palmitamida yang digunakan sebagai bahan penyerasi pada penguatan karet alam dengan silika.
Sintesis senyawa amida telah banyak dilakukan oleh peneliti sebelumnya, diantaranya adalah Sintesis senyawa amida dari trigliserida telah dilakukan oleh Farizal (2004), dimana senyawa amida dibuat dengan mereaksikan antara trigliserida dengan amoniak berlebih dengan berbagai variasi waktu dan suhu tetapi tanpa menggunakan katalis. Hal yang sama juga telah dilakukan oleh Makmun, S.W (2004) yang mensintesis senyawa fatty amida dari minyak kelapa sawit dengan metode yang CH3CHCOCH2CH3 + NH3 CH3CHCNH2
O
+ CH3CH2OH
sama yaitu dengan mereaksikan metil oleat dengan amoniak berlebih tetapi tanpa penggunaan pelarut dan katalis, dimana mengalami kesulitan karena konsentrasi lemak yang tinggi sehingga reaksinya dengan amoniak kemungkinan akan membutuhkan energi yang sangat besar. Manihuruk (2009) juga telah berhasil mensintesis asam azelat dengan amoniak bertekanan menggunakan katalis nikel pada suhu 1800C selama 5 jam. Asam azelat tersebut merupakan asam dikarboksilat dimana senyawa ini mempunyai 2 gugus karboksil, reaksi asam azelat dengan ammoniak tersebut menghasilkan senyawa Nonana-1,9-diamida sebanyak 70,2%. Sintesis dekanamida dari asam dekanoat juga telah dilakukan oleh manihuruk (2008) yaitu dengan mereaksikan asam dekanoat (C10H21COOH) dengan amoniak bertekanan
menggunakan katalis nikel berlangsung pada suhu 1500C menghasilkan dekanamida (Hutauruk,2008).
Karena itu, dalam penelitian ini senyawa amida disintesis dari asam palmitat, suatu asam rantai panjang (C15H31COOH), dengan mereaksikan asam palmitat
dengan gas amoniak menggunakan katalis Nikel dilakukan selama 10 jam pada suhu 1800C sehingga diharapkan ikatan N-H dapat dipecah dengan energi yang lebih rendah dan memudahkan berjalannya reaksi amidasi.
1.2 Permasalahan
Dalam reaksi amidasi trigliserida menjadi senyawa amida yang telah dilakukan tanpa penggunaan katalis, diperlukan suhu yang tinggi agar reaksi tersebut dapat terjadi. Maka dalam penelitian ini, dipergunakan katalis nikel yang diharapkan reaksi amidasi asam palmitat menjadi palmitamida dapat berlangsung pada suhu rendah.
1.3 Pembatasan Masalah
1.4 Tujuan Penelitian
Untuk memahami prinsip logam transisi pada transformasi asam palmitat menjadi palmitamida dengan amoniak dalam autoclave bertekanan.
1.5 Manfaat Penelitian
Hasil penelitian ini ditujukan untuk pengembangan ilmu kimia anorganik logam transisi dan juga menambah informasi penganekaragaman bahan kimia yang berdasarkan hasil pertanian dan perkebunan.
1.6 Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Anorganik FMIPA – USU Medan. Karakterisasi secara Spektroskopi FT-IR, spektroskopi 1H-NMR dilakukan di laboratorium Dasar Bersama – UNAIR Surabaya.
1.7 Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Perkembangan Komoditi Kelapa Sawit Indonesia
Perkebunan kelapa sawit di Indonesia mempunyai peran yang sangat strategis dari sisi ekonomi antara lain sebagai komoditas untuk peningkatan ekspor, penyerapan kesempatan kerja, menekan jumlah penduduk miskin, mendorong pusat pertumbuhan wilayah, mencukupi kebutuhan konsumsi dalam negeri, dan lain-lain. Disamping itu, banyaknya permintaan CPO sebagai bahan baku bahan bakar nabati (biodiesel) maka semakin menambah kuatnya permintaan terhadap hasil produksi kelapa sawit.
Sejak tahun 2007, Indonesia merupakan produsen CPO terbesar dunia. Produksi CPO Indonesia pada tahun 2008 mencapai 20 juta ton. Sebanyak 5 – 5,5 juta ton diserap pasar domestik, dan sekitar 4 juta ton diantaranya diproses menjadi minyak goreng. Pada saat ini kapasitas terpakai industri pengolahan CPO baru mencapai 54% Dalam rangka mengantisipasi melimpahnya produksi CPO ini, maka diperlukan usaha untuk mengolah CPO menjadi produk hilir. Pengolahan CPO menjadi produk hilir memberikan nilai tambah tinggi. Produk olahan dari CPO dapat dikelompokkan menjadi dua yaitu produk pangan dan non pangan. Produk pangan terutama minyak goreng dan margarin. Produk non pangan terutama oleokimia.
2.2 Oleokimia
Oleokimia pada dasarnya merupakan cabang ilmu kimia yang mempelajari trigliserida yang berasal dari minyak dan lemak menjadi asam lemak dan gliserin serta turunan asam lemak baik dalam bentuk ester, amida, sulfat, sulfonat, alkohol, alkoksi maupun sabun. Beberapa produk oleokimia dapat dihasilkan dari petrokimia yang merupakan oleokimia sintetik, misalnya alkohol asam lemak dapat diperoleh dari etilen dan gliserol dari propilen, sedangkan yang dimaksud dengan oleokimia alami merupakan turunan dari lemak dan minyak (Richler, M.J, 1984).
Oleokimia adalah bahan baku industri yang diperoleh dari minyak nabati seperti minyak kelapa sawit. Olahan kelapa sawit yang digolongkan dalam oleokimia sebagai berikut:
a. fatty acid, fatty alcohol, dan fatty amin. b. metil ester (biodiesel)
c. gliserol
d. ethoxylate dan epoxylate
Bahan-bahan tersebut mempunyai spesifikasi penggunaan bahan baku pada industri-industri yang memerlukannya, mulai dari industri kosmetika sampai industri aspal (PS, 1997).
2.3 Asam Karboksilat
O O
R C OH R C O- + H+
Anion karboksilat R-COO- biasanya diberi nama dengan akhiran –ate, sebagai contoh asam asetat menjadi ion asetat. Tatanama menurut IUPAC, asam karboksilat berakhiran –oat atau –at, contohnya; asam heksadekanoat. Pemberian nama berdasarkan sistem trivial menggunakan huruf yunani α, β, γ, δ, ε dan seterusnya dimulai dari karbon yang berada disebelah atom karbon gugus karboksilat (Riswiyanto, 2009).
Sifat kimia yang paling menonjol dari asam karboksilat adalah keasamannya. Dibandingkan dengan asam mineral seperti HCl dan HNO3, asam karboksilat adalah
asam lemah dengan pKa sekitar 5. Namun asam karboksilat lebih bersifat asam
daripada alkohol atau fenol, terutama karena stabilisasi-resonansi anion karboksilatnya, RCOO-. Struktur asam karboksilat berbentuk planar, karena atom kerboksilat mempunyai hibridisasi sp2. bentuk planar karboksilat terjadi pada ikatan C-C-O dan O-C-O dengan membentuk sudut kira-kira 1200C.
Asam karboksilat memiliki struktur gugus karbonil yang sesuai untuk membentuk dua ikatan hidrogen antara sepasang molekul. Sepasang molekul asam karboksilat yang saling berikatan hidrogen disebut dengan dimer asam karboksilat. Karena kuatnya ikatan hidrogen ini (± 10 kkal/ mol untuk 2 ikatan hidrogen), asam karboksilat dijumpai dalam bentuk dimer.
Suatu dimer asam karboksilat
Sifat fisis asam karboksilat tercermin dari ikatan hidrogen yang kuat antara molekul-molekul asam karboksilat. Asam-asam yang berbobot molekul rendah larut dalam air maupun dalam pelarut organik.
Salah satu asam karboksilat yang banyak terdapat dalam minyak kelapa sawit adalah asam palmitat. Rata – rata komposisi asam lemak minyak kelapa sawit dapat dilihat dari tabel berikut :
Asam Lemak Minyak Kelapa Sawit (%)
Minyak Inti Sawit (%)
Tabel 1. komposisi asam lemak minyak kelapa sawit
(Ketaren, 1986) Asam palmitat adalah asam lemak jenuh yang tersusun dari 16 atom karbon (CH3(CH2)14COOH). Pada suhu ruang, asam palmitat berwujud padat berwarna putih.
Titik leburnya 63,1°C. Asam palmitat adalah produk awal dalam proses biosintesis asam lemak. Dalam industri, asam palmitat banyak dimanfaatkan dalam bidang kosmetika dan pewarnaan. Dari segi gizi, asam palmitat merupakan sumber kalori penting namun memiliki daya antioksidasi yang rendah.
2.4 Amida
Ikatan ini sangat stabil, dan ditemukan unit perulangan molekul protein, nylon dan produk – produk polimer lainnya.
( Hill , 1993)
Amida mempunyai sifat fisik yaitu berbentuk padat kecuali formamida yang berbentuk cair, tidak berwarna dan larut dalam pelarut-pelarut organik.Amida dapat dibuat dengan mereaksikan ester dengan amoniak cair, tetapi reaksi ini berjalan dengan lambat dibandingkan dengan reaksi antara halida asam atau anhidrida dan amonia. Reaksi pembuatan amida adalah sebagai berikut:
(Fessenden, R.J. dan Fessenden, J.S. 1986).
Selain dari ketiga reaksi diatas, senyawa amida dapat juga diperoleh dengan mereaksikan asam karboksilat dengan ammoniak encer sehingga terbentuk garam ammonium yang kemudian dipanaskan sampai terjadi dehidrasi untuk menghasilkan amida (Wilbraham, et al, 1992)
C
Gugus Amida Amida Sederhana Amida tersubstitusi
Amida primer dibuat dengan mereaksikan ammonia dengan metil ester asam lemak. Reaksi ini mengikuti konsep HSAB dimana H+ dari ammonia merupakan
hard-acid yang mudah bereaksi dengan hard-base CH3O- untuk membentuk metanol. Sebaliknya NH2- lebih soft-base dibandingkan dengan CH3O- akan terikat dengan
R-C+=O yang lebih soft-acid dibandingkan H+ membentuk amida (Ho, T.,1977). Reaksinya adalah sebagai berikut:
2.4.1 Reaksi Senyawa Amida
Amida merupakan turunan asam karboksilat yang paling tidak reaktif, dimana gugus -OH diganti dengan gugus -NH2 atau amonia. Amida merupakan suatu basa sangat
lemah dengan pKb bernilai 15-16. Struktur-struktur resonansi untuk suatu amida menunjukkan bahwa nitrogen suatu amida tidak bersifat basa maupun nukleofilik (Fessenden, R.J. dan Fessenden, J.S. 1986). Seperti asam karboksilat, amida memiliki titik cair dan titik didih yang tinggi karena adanya pembentukan ikatan hidrogen. Amida mampu membentuk ikatan hidrogen intermolekular selama masih terdapat hidrogen yang terikat pada nitrogen. Senyawa ini juga sangat istimewa karena nitrogennya mampu melepaskan elektron dan mampu membentuk sebuah ikatan π dengan karbon karbonil. Pelepasan elektron ini menstabilkan hibrida resonansi (Bresnick, S.M.D., 1996).
Senyawa amida telah banyak digunakan dalam industri yaitu sebagai surfaktan non ionik yang dapat digunakan sebagai bahan aditif pembuatan sampo contohnya adalah alkanolamida, amida digunakan dalam pembuatan pembuatan alat listrik contohnya nomex yaitu suatu poliamida yang rangka karbonnya terdiri dari cincin aromatik, amida sebagai serat untuk produksi tekstil, serat ban contohnya nilon 6 (Wilbraham, et al, 1992). Amida digunakan sebagai bahan baku setengah jadi untuk produksi fatty nitril dan fatty amina serta amida juga digunakan dalam industri obat-obatan. Palmitamida, stearamida dan oleoamida digunakan sebagai bahan penyerasi pada penguatan karet alam dengan silika (Surya, I. dkk, 2008).
2.5 Katalis
Katalis adalah suatu zat yang mengakibatkan reaksi lebih cepat mencapai kesetimbangan, tanpa mengubah nilai kesetimbangan dan tidak ikut bereaksi (Cotton dan Wilkinson,1989). Secara kimiawi, katalis tidak berubah dalam reaksi kimia, akan tetapi dapat mengalami perubahan fisik dengan komposisi yang tetap seperti sediakala. Entalpi reaksi dan faktor-faktor termodinamika lainnya merupakan fungsi sifat dasar dari reaktan dan produk, sehingga tidak dapat diubah dengan katalis. Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan untuk berlangsungnya reaksi. Jumlah katalis yang digunakan dalam reaksi sangat sedikit yaitu 1/100 dari mol sampel dan katalis akan bekerja efektif pada suhu optimum (Syukri, 1999).
2.5.1 Sifat Katalitik Unsur-unsur Transisi
Logam transisi dan senyawa-senyawanya dapat berfungsi sebagai katalis karena memiliki kemampuan mengubah tingkat oksidasi dan dapat mengadsorpsi substansi yang lain pada permukaan logam dan mengaktivasi substansi tersebut selama proses berlangsung. Katalis dibagi menjadi dua bagian yaitu katalis homogen dan katalis heterogen. Katalis homogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisisnya. Sedangkan katalis heterogen adalah katalis yang ada dalam fase sama dengan pereaksi dalam reaksi yang dikatalisisnya (Syukri, 1999).
2.5.1.1 Katalis Homogen
Cara kerja katalis homogen umumnya melibatkan pembentukan senyawa-senyawa kompleks antara yang bersifat tidak stabil dalam tahap-tahap reaksi. Katalis dengan reaktan membentuk kompleks antara yang mengakibatkan reaktan dalam kompleks menjadi aktif membentuk produk baru dengan disertai pelepasan kembali katalisatornya. Oleh karena itu, unsur-unsur transisi sangat berperan dalam reaksi katalitik karena sifatnya mudah membentuk senyawa kompleks. Katalis homogen merupakan kelarutan dari molekul-molekul di dalam reaktan yang biasanya berada dalam keadaan cair.
Ni 2.5.1.2 Katalis Heterogen
Katalis heterogen dalam bentuk padatan banyak dipakai dalam bidang industri untuk reaksi-reaksi fase gas yang biasanya berlangsung pada suhu tinggi. Oleh karena logam-logam transisi mempunyai titik leleh yang sangat tinggi dan kuat, maka dapat memenuhi syarat untuk berperan sebagai katalisator. Salah satu keuntungan memakai katalis heterogen adalah bahwa produk reaksi langsung terpisah dari fase katalisnya, sehingga tidak memerlukan tahapan pemisahan khusus. Katalisastor padatan ini dapat berupa logam murni, paduan maupun senyawa oksidanya (Sugiyarto, K.H.dan Suyanti, R.D., 2010).
Selain memberikan permukaan yang luas, fase padat dimaksudkan memberikan bentuk pori-pori yang sesuai untuk media terjadinya reaksi secara efektif. Untuk itu, katalisator dapat dibuat dalam bentuk serbuk yang disebarkan pada suatu wadah atau suporter. Interaksi molekul-molekul gas reaktan dengan logam katalis dibedakan dalam dua jenis, fisisorpsi dan kemisorpsi. Pada fisisorpsi, molekul-molekul gas reakstan sekedar mengumpul terkonsentrasi pada permukaan lorong-lorong katalis. Sedangkan jenis kemisorpsi, molekul-molekul gas reaktan terpecah ikatannya sebagian atau seluruhnya karena melekat berikatan secara lemah dengan logam katalis, sehingga ikatan menjadi lemah atau reaktan berubah menjadi atom-atomnya yang bersifat aktif sehingga dengan mudah dapat membentuk ikatan baru antar reaktan. Logam-logam transisi mempunyai kecenderungan lebih mudah melakukan kemisorpsi terhadap molekul gas-gas tertentu relatif terhadap logam-logam lain sehingga cocok dipakai sebagai katalisator. Contoh skematik kemisorpsi molekul gas H2 pada permukaan logam Ni ditunjukkan pada gambar berikut ini:
Gambar 1. Model kemisorpsi molekul gas H2 pada permukaan logam nikel
Molekul atau atom reaktan yang mengalami fisisorpsi ataupun kemisorpsi ternyata dapat melakukan migrasi pada permukaan dengan aktif sehingga interaksi antara molekul-molekul atau atom-atom reaktan terjadi lebih aktif membentuk molekul produk; molekul produk ini kemudian akan mengalami desorpsi (pelepasan) dari permukaan logam katalisnya (Sugiyarto, K.H.dan Suyanti, R.D., 2010).
Salah satu contoh katalis heterogen adalah katalis nikel. Nikel merupakan logam transisi yang berada pada golongan VIIIB dan telah digunakan sebagai katalis. Penggunaan nikel telah banyak dikenal dalam reaksi organik yaitu sebagai katalis heterogen. Katalis nikel sebagai contoh nikel raney sering digunakan untuk reduksi katalitik (Cotton dan Wilkinson,1989)
Nikel Raney adalah sejenis katalis padat yang terdiri dari butiran halus dikembangkan pada tahun 1926 oleh alternatif unt ini, katalis nikel digunakan sebagai
Katalis nikel sering juga disebut dengan katalis kerangka atau katalis logam spons digunakan untuk merujuk pada katalis yang mempunyai sifat-sifat fisika dan kimia yang mirip dengan nikel Raney. Nikel Raney dihasilkan ketika aloi nikel-aluminium diberikan melarutkan keluar kebanyakan aluminium dalam aloi tersebut. Struktur berpori-pori yang ditinggalkan mempunyai luas permukaan yang besar, menyebabkan tingginya aktivitas katalitik katalis ini. Katalis ini pada umumnya mengandung 85% nikel berdasarkan massa, berkorespondensi dengan dua atom nikel untuk setiap atom aluminium. Aluminium membantu menjaga stuktur pori katalis ini secara keseluruhan.
luas permukaan aktivasi, yang juga mengakibatkan aktivitas katalitik katalis yang relatif tinggi.
Selama proses aktivasi, aluminium diukeluarkan dari fase NiAl3 dan Ni2Al3
yang terdapat pada aloi, sedangkan aluminium yang tersisa berada dalam bentuk NiAl. Pengeluaran aluminium pada beberapa fase tertentu dikenal sebagai Dapat ditunjukkan bahwa fase NiAl berkontribusi dalam menjaga stabilitas struktural dan termal katalis. Oleh sebab itu, katalis ini cukup resistan terhadap dekomposisi. Resistansi ini mengijinkan nikel Raney untuk disimpan dan digunakan kembali untuk beberapa periode waktu; namun, nikel Raney yang baru dibuat biasanya lebih dipilih untuk digunakan dalam laboratorium. Karenanya, nikel Raney komersial tersedia dalam bentuk aktif dan takaktif.
Luas permukaan katalis biasanya ditentukan dengan pengukuran BET menggunaka hidrogen). Dengan menggunakan pengukuran ini, ditemukan bahwa hampir semua luas permukaan pada partikel katalis mempunyai nikel pada permukaannya. Oleh karena nikel merupakan logam aktif katalis, luas permukaan nikel yang besar mengimplikasikan terdapatnya luas permukaan yang besar yang tersedia untuk sebuah reaksi untuk berjalan secara bersamaan, merefleksikan peningkatan aktivitas katalitik. Nikel Raney yang tersedia secara komersial memiliki luas permukaan rata-rata 100 m² per menggunakan katalis nikel adalah sebagai berikut :
(Sugiyarto, K.H.dan Suyanti, R.D., 2010).
2.6 Spektrofotometri Inframerah
Spektrofotometri inframerah merupakan salah satu analisa kualitatif yang digunakan untuk menentukan gugus fungsi suatu senyawa organik serta untuk mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik CH2 = CH2 + H2
Ni
jarinya. Frekuensi di dalam spektroskopi inframerah seringkali dinyatakan dalam bentuk bilangan gelombang, dimana rentang bilangan gelombang yang dipergunakan adalah antara 4600 cm -1 sampai dengan 400 cm -1. Energi yang dihasilkan oleh radiasi inframerah menyebabkan vibrasi atau getaran pada molekul (Dachriyanus, 2004).
Spektrofotometer berkas ganda terdiri dari lima bagian utama yaitu : sumber cahaya, daerah cuplikan, fotometer, monokromator dan detektor.
1. Sumber Cahaya
Pancaran inframerah dihasilkan oleh sebuah sumber yang dipanaskan dengan listrik pada suhu 1000-18000C. Sumber cahaya yang umum digunakan adalah lampu tungsen, nernst glowers atau globar. Lampu nernst dibuat dari sebuah pengikat dan oksida-oksidazirkonium, torium dan serium. Sedangkan lampu globar terbuat dari batang kecil silikon karbida.
2. Daerah Cuplikan
Berkas acuan dan berkas cuplikan masuk kedalam daerah cuplikan dan masing-masing menembus sel cuplikan dan sel acuan.
3. Monokromator
Monokromator berfungsi untuk menyeleksi panjang gelombang.
4. Detektor
Detektor akan mendeteksi frekuensi yang dilewatkan pada sampel yang tidak diserap oleh senyawa. Banyaknya frekuensi yang melewati senyawa (yang tidak diserap) akan diukur sebagai persen transmitan (Silverstein, 1986).
Adanya gugus fungsional yang berbeda dari molekul akan memberikan perubahan yang menyolok pada distribusi puncak serapannya, oleh karena itu bila dua spektrum mempunyai penyesuaian yang tepat di daerah ini, maka hal tersebut merupakan bukti yang kuat bahwa senyawa – senyawa yang memberikan spektrum yang sama adalah identik.
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang dipergunakan dalam penelitian ini adalah:
Nama Alat Merk
1. Neraca analitik digital Mettler PM 2000
2. Hotplate stirrer Bibby
3. Autoclave stainless steel Duragauge
4. Pengatur Suhu 5. Pengaduk Magnet
6. Gelas Erlenmeyer Pyrex
7. Corong
8. Beaker Gelas Pyrex
9. Kaca Arloji
10. Labu Alas Bulat Pyrex
11. Kertas Saring Whatman no. 41
3.1.2 Bahan-bahan
Bahan-bahan yang dipergunakan dalam penelitian ini adalah:
Nama Alat Merk
1. Asam Palmitat p.a E’Merck
2. N-heksan kering 3. Katalis nikel 4. Gas amoniak
5. Dietil eter p.a E’Merck
3.2 Prosedur Penelitian
3.2.1 Amidasi Asam Palmitat
Sebanyak 25,3 gram asam palmitat dimasukkan ke dalam autoclave yang telah berisi magnetik stirrer kemudian ditambahkan 200 mL n-heksan kering. Ditambahkan katalis nikel sebanyak 0,06 gram lalu tabung autoclave ditutup rapat. Dialirkan gas NH3 dengan tekanan 100 psi. Autoclave diletakkan diatas hot plate stirrer dan diatur
suhu hingga suhu 1800C sambil diaduk dengan magnetik stirer selama 10 jam kemudian didinginkan hingga mencapai suhu ruang (tekanan NH3 menjadi 20 psi).
Dibuka penutup autoclave untuk membuang sisa gas NH3. campuran reaksi yang
terbentuk ditambahkan dengan etanol kemudian disaring. Endapan yang diperoleh dicuci dengan n-heksan kering dan disaring kembali. Endapan hasil pencucian dengan n-heksan lalu diekstraksi dengan dietil eter kering dan disaring. Endapan yang didapat merupakan katalis nikel. Ekstrak hasil penyaringan kemudian diuapkan dan dikeringkan. Hasil yang diperoleh diuji titik leburnya lalu dianalisis dengan FT-IR dan
1
3.3 Bagan Penelitian
3.3.1 Amidasi Asam Palmitat
BAB 4
Asam palmitat n-heksan Katalis nikel Gas NH3 berlebih
Tekanan 100 psi
Autoclave
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil
Pembuatan senyawa palmitamida dari asam palmitat dilakukan dengan mereaksikan senyawa asam palmitat (25,3 g; 0,094 mol) dengan gas ammoniak berlebih dalam pelarut n-heksan kering menggunakan katalis nikel dengan tekanan 100 psi pada suhu 1800C menghasilkan senyawa palmitamida sebanyak 77,66% (18,6 g; 0,073 mol) dengan titik lebur 1040C. Reaksi yang terjadi adalah sebagai berikut :
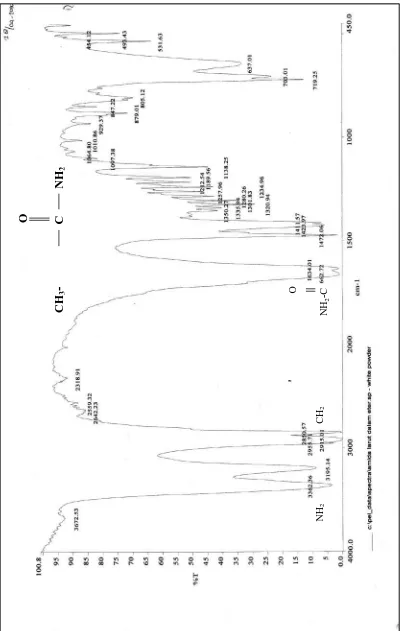
Spektrum FT-IR menunjukkan terbentuknya amida primer dengan munculnya pita serapan pada υNH2 3362 cm-1 dan 3195.14 cm-1, sedangkan spektrum 1H-NMR
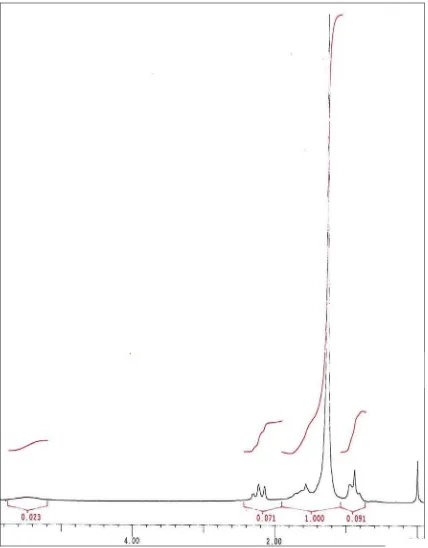
menunjukkan pergeseran kimia pada δNH2 5,4 ppm (broad); δCH2 2,19 ppm (triplet);
δCH2 1,5 ppm (multiplet) dan δCH3 0,9 ppm (triplet).
4.2 Pembahasan
4.2.1 Reaksi amidasi Asam Palmitat dengan gas NH3
Reaksi antara asam palmitat (CH3(CH2)14COOH) sebanyak 25,3 g (0,094 mol)
dengan gas ammoniak berlebih pada tekanan 100 psi menggunakan katalis nikel dalam pelarut n-heksan kering menghasilkan palmitamida (m.p. 1040C).
4.2.1.1Dugaan Mekanisme Reaksi
Filtrat dari campuran reaksi (lihat bagan penelitian halaman 19), diuapkan pelarutnya dan diperoleh padatan berwarnah putih kehijauan dengan titih lebur 750C yang menunjukkan bahwa padatan ini adalah ammonium palmitat. Dan dari kenyataan ini, diduga bahwa reaksi amidasi berlangsung melalui garam ammonim dengan reaksi sebagai berikut:
4.2.2 Spektrum FT-IR palmitamida
Spektrum FT-IR diatas (Gambar 2) menunjukkan adanya pita serapan pada bilangan-bilangan gelombang 3362.36 cm-1, 3195.14 cm-1, 2915.01 cm-1, 2850.57 cm-1, 1662.72 cm-1,1634.01 cm-1, 1472.06 cm-1, 1423.97 cm-1, 719.25 cm-1 dan 703.01 cm
-1
. Munculnya dua buah pita serapan pada bilangan gelombang 3362.36 cm-1 dan 3195.14 cm-1 yang tidak terdapat pada spektrum FT-IR asam karboksilat (Gambar3), pita serapan tersebut menunjukkan adanya uluran N - H dari amida primer ( -NH2 ).
Gugus Amida memiliki tiga buah atom, sehingga dapat terjadi dua cara rentangan atau bengkokan, yakni bentuk simetri dan asimetri (Pavia, 1979). Rentangan simetris muncul pada 3195.14 cm-1 dan rentangan asimetris muncul pada 3362.36 cm-1.
Adanya spektrum FT-IR ini menunjukkan bahwa telah terbentuknya senyawa amida primer.
Pita serapan pada 2915.01 cm-1dan 2850.57 cm-1 memperlihatkan adanya serapan –CH2- yang memberikan dua serapan rentangan C – H yang berbeda yang
dihasilkan dari ragam rentangan simetri dan asimetri. Bentuk asimetri menghasilkan momen dipol yang lebih besar dan memberikan intensitas yang lebih besar bila
dibandingkan dengan bentuk simetri (Sastrohamidjojo, 1992). Dan pita serapan 719.25 cm-1 dan 703.01 cm-1 merupakan pita yang dihasilkan dari getarang rocking CH2 yaitu semua gugus CH2 melakukan goyangan sefasa untuk alkana rantai lurus
yang terdiri dari tujuh atom karbon atau lebih. Pita serapan tersebut akan muncul kembar dalam spektrum tetapi bagi anggota awal deret n-alkana, pita akan muncul pada kerapan yang sedikit lebih tinggi. Serapan oleh hidrokarbon karena getaran liuk (twist) dan kibas (wag) teramati di daerah 1350-1150 cm-1, pita-pita itu biasanya rendah yang ditimbulkan oleh gugus CH2 dan merupakan kekhasan spektrum
asam-asam berantai panjang, amida dan ester. Pita-pita serapan CH2 ini menunjukkan
adanya senyawa amida rantai panjang.
Adanya pita serapan pada bilangan gelombang 1662.72 cm-1 menunjukkan rentangan karbonil amida. Pita serapan 1662.72 cm-1 lebih rendah dibandingkan dengan pita serapan karbonil asam palmitat yaitu 1703.06 cm-1 yang menunjukkan bahwa telah terikatnya NH2 menggantikan OH pada karbonil (COOH menjadi
CONH2). Vibrasi rentangan C – N simetris dan asimetris untuk amida primer muncul
G
am
ba
r 3.
S
pe
kt
rum
F
T
-I
R
a
sa
m pa
lmita
4.2.3 Spektrum 1H-NMR palmitamida
Spektrum 1H-NMR (Gambar 4) dalam pelarut CDCl3 menunjukkan empat kelompok
sinyal pergeseran kimia, yaitu: δ 5,4 ppm (broad) ; δ 2,19 ppm (triplet) ; δ 1,5 ppm (multiplet) dan δ 0,9 ppm (triplet). Pergeseran kimia pada δ 5,4 ppm menunjukkan adanya proton NH2, pada spektrum ini puncak proton N - H menjadi sangat melebar
(broad) karena terjadi proton exchange yaitu molekul pada NH2 berubah menjadi ND2.
Proton –CH2 terlihat berada pada pergeseran kimia δ 2,19 ppm lebih downfield dari
CH2 lainnya disebabkan karena CH2 ini terikat langsung pada karbonil amida.
Pergeseran kimia pada δ 1,5 ppm menunjukkan proton –CH2 dan pergeseran kimia
pada 0.9 ppm memperlihatkan proton –CH3 (Biemann, 1983; Pavia, 1979; Silverstein,
1986).
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Reaksi antara asam palmitat dengan gas amoniak yang dikatalisis oleh logam nikel dalam pelarut n-heksan kering pada suhu 1800C dengan tekanan 100 psi yang telah dilakukan menghasilkan palmitamida sebanyak 77,66%.
2. Data FT-IR dan 1H-NMR mengkonfirmasi terbentuknya palmitamida tersebut.
5.2 Saran
DAFTAR PUSTAKA
Bresnick, S.M.D. 2004. Intisari Kimia Organik. Jakarta : Penerbit Hipokrates.
Cotton, F.A. dan Wilkinson,G. 1989.Kimia Anorganik Dasar. Terjemahan Sahati Suharto. Jakarta: UI-Press.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. 2004. Padang: Andalas University Press, 2004.
Farizal. 2004. Sintesis Amida Asam Lemak dari Minyak Sawit dan Pengaruhnya
Terhadap Oksidasi. Skripsi. Bogor: Departemen Kimia FMIPA – IPB.
Fessenden ,R.J dan Fessenden, J.S.1986. Kimia Organik Jilid 2. Edisi Ketiga. Terjemahan Aloysius Hadyana Pudjaatmaka Ph.D. Jakarta: Erlangga
Gates, B.C.; Katzer, J.R.; Schuit, G.C.A. 1979. Chemistry of Catalytic Processes. New York: John Wiley & Sons.
Hart, Craine, Hart. 2003. Kimia Organik Suatu Kuliah Singkat. Edisi Kesebelas. Terjemahan Suminar Setiadi Achmadi. Jakarta : Penerbit Erlangga
Hill, J.W. 1993. General, Organic and Biological Chemistry. Fourth edition. New Jersey : Prentice Hall.
Ho, T. S. 1977. Hard and Soft Acid and Base in Organic Chemistry. New York : Academic Press.
Hutauruk, A. 2008. Sintesis Dekilamin dari Asam Dekanoat menggunakan Katalis
Nikel. Skripsi. Medan: Departemen Kimia FMIPA – USU.
Ketaren. 1986. Minyak dan Lemak Pangan. Jakarta: UI-Press.
Makmun,S.W. 2004. Produksi Fatty Amida dari Fatty Oil dengan Proses
Ammonolisis. Tesis. Bandung: Departemen Teknik Kimia – ITB.
Manihuruk, M. 2009. Aminasi Azelat Via Reduksi Dengan Hidrogen Memakai Katalis
Nikel. Tesis. Medan: Departemen Kimia FMIPA – USU.
Miessler, G.L, Tarr, D.A. 2004. Inorganic Chemistry. Third Edition. New Jersey : Pearson Prentice Hall, Inc.
Pahan, I. 2006. Panduan LengkapKelapa Sawit: Manajemen Agribisnis dari Hulu
hingga Hilir. Cetakan pertama. Jakarta: Penerbit Penebar Swadaya.
Pavia, D.L., G.M. Lampmann dan G.S.Kriz. 1979. Introduction to Spectroscopy: A
Guide for Student of Organic Chemistry. Washington: Saunders College
Publishing.
Permadi, W. 2001. Perkembangan Instrumentasi dan Metode Kimia Analisis
Instrumental serta Beberapa Aspek Praktis Penting yang erat kaitannya dengan Segi Aplikasi. Laboratorium Riset PT. Ditek Jaya.
PS, Tim Penulis. 1997. Kelapa Sawit : Usaha Budidaya, Pemanfaatan Hasil dan
Aspek Pemasaran. Cetakan kedelapan. Jakarta : Penebar Swadaya.
Riswiyanto. 2009. Kimia Organik. Jakarta : Penerbit Erlangga.
Sastrohamidjojo, H. 1992. Spektroskopi Inframerah. Cetakan Pertama. Yogyakarta: Penerbit Liberti.
Silverstein, R.M., G.C.Bassler dan T.C. Morril. 1981. Spectrometric Identification of
Organic Compounds. Fourth Edition. USA : John Wiley and Sons.
Sugiyarto, K.H dan Suyanti, R.D. 2010. Kimia Anorganik Logam. Yogyakarta: Graha Ilmu.
Surya, I., Ginting, M. dan Halimatuddahliana. 2008. Kajian Awal Penggunaan
Palmitamida, Stearamida, dan Oleoamida Sebagai Bahan-bahan Penyerasi pada Penguatan Karet Alam dengan Silika. Laporan Hasil Penelitian Dasar.
Medan: Departemen Teknik Kimia - USU
Syukri, S. 1999. Kimia Dasar Jilid I. Bandung : Penerbit ITB.
Underwood, A.L dan Day, R.A. 2002. Analisis Kimia Kuantitatif. edisi ke-6. Terjemahan dr. Ir. Iis Sopyan, M. Eng. Jakarta: Erlangga.
Lampiran 1. Spektrum FT-IR palmitamida yang diperoleh dari SDBS
Ass
ign. Shift(ppm)
A 5.49
B 2.21
C 1.63
D 1.26