DETEKSI DAN IDENTIFIKASI
Pineapple Mealybug Wilt-associated Virus
PENYEBAB
PENYAKIT LAYU PADA TANAMAN NANAS DI INDONESIA
RENO TRYONO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis DETEKSI DAN IDENTIFIKASI Pineapple mealybug wilt-associated virus PADA TANAMAN NANAS DI INDONESIA adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
RENO TRYONO. Deteksi dan Identifikasi Pineapple mealybug wilt-associated virus Penyebab Penyakit Layu pada Tanaman Nanas di Indonesia. Dibimbing oleh GEDE SUASTIKA dan SOBIR.
Penyakit layu nanas merupakan penyakit penting yang banyak dilaporkan di banyak negara produsen nanas. Penyakit ini melibatkan adanya partikel virus Pineapple mealybug wilt-associated virus-1 (PMWaV-1) dan PMWaV-2, keberadaan vektor (Dysmicoccus brevipes), dan keadaan lingkungan yang mendukung terjadinya penyakit. Meskipun demikian, di Indonesia, penyakit ini relatif baru muncul beberapa tahun terakhir dan belum pernah ada laporan penelitian mengenai virus yang berasosiasi dengan penyakit layu nanas di Indonesia.
Penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi PMWaV yang berasosiasi dengan penyakit layu pada tanaman nanas di Indonesia. Diharapkan penelitian ini dapat memberikan informasi dan laporan pertama mengenai keberadaan PMWaV yang berasosiasi dengan penyakit layu nanas di Indonesia.
Hasil deteksi secara serologi dengan metode Tissue blot immunoassays (TBIA) menggunakan dua antibodi monoklonal spesifik terhadap PMWaV-1 maupun 2 (Agdia Inc., USA) berhasil mendeteksi keberadaan PMWaV-1 dan PMWaV-2 pada jaringan daun tanaman nanas yang menunjukkan maupun dari yang tidak menunjukkan gejala layu. Pendeteksian secara molekuler dengan metode reverse transcription-polymerase chain reaction (RT-PCR) menggunakan dua primer yang spesifik terhadap PMWaV-1 dan PMWaV-2 berhasil mengamplifikasi gen Heat Shock Protein 70 (HSP 70) pada kedua virus. Penemuan ini mengindikasikan bahwa PMWaV-1 dan PMWaV-2 berasosiasi dengan penyakit layu nanas yang terjadi di Indonesia. Analisis protein menggunakan sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) menunjukkan adanya sebuah struktural protein besar dengan perkiraan ukuran sebesar 23 kDa. Keberadaan partikel virus berbentuk batang lentur juga teramati pada preparasi mikroskop elektron yang berasal dari tanaman nanas yang terinfeksi virus. Hasil pengamatan menggunakan mikroskop elektron ini sesuai dengan ciri-ciri virus dari anggota Closterovirus. Analisis parsial genom HSP 70 virus layu nanas isolat Indonesia menunjukkan kisaran homologi sebesar 96 hingga 98% dengan PMWaV-1 dan PMWaV-2. Selain itu, analisis filogenetik menunjukkan bahwa isolat PMWaV Indonesia dan Hawaii merupakan anggota Closterovirus yang ditularkan oleh kutu putih, dan memiliki hubungan kekerabatan yang dekat dengan Grapevine leafroll-associated virus-3 (GLRaV-3).
ABSTRACT
RENO TRYONO. Detection and Identification of Pineapple mealybug wilt-associated virus Causing Wilt Disease on Pineapple in Indonesia. Under supervised of GEDE SUASTIKA and SOBIR.
Field surveys on pineapple wilt disease were conducted on pineapple production areas in Subang, West Java, Indonesia. The disease was characterized by severe tip dieback, downward curling, reddening, and wilting of the leaves which can lead to total collapse of the plant.
The objective of the research is to identify the viruses causing wilt disease on pineapple in Indonesia. Tissue blot immunoassays (TBIAs) using two different antibodies specific to either Pineapple mealybug wilt-associated virus-1 (PMWaV-1) or PMWaV-2 (Agdia Inc., USA) successfully detected the viruses in leaf tissues from both symptomatic and asymptomatic pineapple plants. A reverse transcription-polymerase chain reaction (RT-PCR) assays using oligonucleotide primers specific to HSP 70 gene of PMWaV-1 and PMWaV-2 were also successfully amplified the regions succesfully. These finding indicated that both closteroviruses were associated with wilt disease on pineapple plants in Indonesia. Protein analysis by using sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) revealed that the viruses have a major structural protein with molecular mass of approximately kDa. Flexuous filamentous particles were also observed in electron microscopy preparations from infected plants. These results were in agreement with characteritics of the closteroviruses. Aligments of partial nucleotide sequences of the viral genomes exhibited 96 to 98% homology with that of PMWaV-1 and PMWaV-2 Hawaiian isolates as previously reported by Sether et al. (2001), respectively. Phylogenetic analysis revealed that Indonesian and Hawaiian virus isolates were belong to mealybug-transmitted closterovirus and closely related to Grapevine leafroll-associated virus-3 (GLRaV-3).
© Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
DETEKSI DAN IDENTIFIKASI
Pineapple Mealybug Wilt-associated Virus
PENYEBAB
PENYAKIT LAYU PADA TANAMAN NANAS DI INDONESIA
RENO TRYONO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
associated Virus Penyebab Penyakit Layu pada Tanaman Nanas di Indonesia
Nama : Reno Tryono
NIM : A451040071
Disetujui
Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc. Dr. Ir. Sobir, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Entomologi – Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2005 hingga April 2006 ini adalah deteksi virus tanaman, dengan judul “Deteksi dan Identifikasi pineapple mealybug wilt-associated virus pada Tanaman Nanas di Indonesia”.
Terima kasih penulis ucapkan kepada Dr. Ir. Gede Suastika, M.Sc. dan Dr. Ir. Sobir, M.Si., selaku komisi pembimbing atas bimbingan, saran, dan masukannya, sehingga penulis dapat menyelesaikan penelitian dan tesis ini. Terima kasih juga kepada Pusat Kajian Buah-buahan Tropika IPB yang telah mengalokasikan anggaran dana untuk penelitian ini sebagai bentuk kerjasama penelitian. Terima kasih kepada Dr. Ir. Tri Asmira Damayanti, M.Agr. selaku penguji luar komisi yang telah banyak memberikan masukan dalam penyempurnaan tulisan dalam tesis ini. Terima kasih juga kepada Dekan Sekolah Pascasarjana IPB, Ketua Program Studi Entomologi-Fitopatologi IPB atas kesediaan menerima penulis untuk studi di Sekolah Pascasarjana IPB, dan kepada Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Faperta IPB atas izin penggunaan bahan dan peralatan laboratorium yang digunakan selama penelitian.
Ungkapan terima kasih disampaikan kepada Ayah, Ibu, kakak, adik-adik, serta seluruh keluarga atas segala doa dan kasih sayangnya. Penulis juga mengucapkan banyak terima kasih kepada rekan-rekan mahasiswa Entomologi-Fitopatologi, rekan-rekan mahasiswa di Laboratorium Virologi Tumbuhan Faperta IPB, dan saudari Tuti Legiastuti, S.Si yang telah banyak membantu dalam penelitian ini. Rasa terima kasih yang tulus juga penulis ucapkan kepada Anna Safarrida, S.Si atas dukungan moril yang selalu menjadi motivasi penulis.
Semoga penelitian ini bermanfaat dalam menambah khazanah ilmu pengetahuan.
Bogor, Agustus 2006
Penulis dilahirkan di Jakarta pada tanggal 18 Maret 1982 dari ayah Kaselan dan ibu Titin Sukmawati sebagai putra ketiga dari lima bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan penelitian ... 3
Hipotesis ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Gejala Penyakit Layu Nanas ... 4
Kisaran Inang dan Penularan PMWaV ... 5
Distribusi Geografi PMWaV ... 6
Ciri-ciri PMWaV ... 7
Metode Deteksi PMWaV ... 9
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Metode Penelitian ... 10
Bahan Penelitian ... 10
Tissue Blot Immunoassay (TBIA) ... 10
Reverse Transcriptase - Polymerase Chain Reaction (RT-PCR) 11 Purifikasi Virus ... 12
SDS-PAGE dan Western Blotting ... 13
Mikroskopi Elektron ... 15
Perunutan Nukleotida ... 15
HASIL DAN PEMBAHASAN ... 16
Deteksi PMWaV dengan TBIA ... 16
Pemurnian PMWaV dan Visualisasi Visualisasi Morfologi Partikel PMWaV dengan Mikroskop ... 18
Analisis Protein Selubung PMWaV dengan SDS-PAGE dan Western Blotting ... 21
Deteksi Asam Nukleat PMWaV dengan RT-PCR ... 24
Analisis Runutan dan Hubungan Kekerabatan PMWaV Indonesia dengan Anggota Famili Closterovirus Lainnya ... 25
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31
Saran ... 31
DAFTAR PUSTAKA ... 32
DETEKSI DAN IDENTIFIKASI
Pineapple Mealybug Wilt-associated Virus
PENYEBAB
PENYAKIT LAYU PADA TANAMAN NANAS DI INDONESIA
RENO TRYONO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis DETEKSI DAN IDENTIFIKASI Pineapple mealybug wilt-associated virus PADA TANAMAN NANAS DI INDONESIA adalah karya saya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2006
RENO TRYONO. Deteksi dan Identifikasi Pineapple mealybug wilt-associated virus Penyebab Penyakit Layu pada Tanaman Nanas di Indonesia. Dibimbing oleh GEDE SUASTIKA dan SOBIR.
Penyakit layu nanas merupakan penyakit penting yang banyak dilaporkan di banyak negara produsen nanas. Penyakit ini melibatkan adanya partikel virus Pineapple mealybug wilt-associated virus-1 (PMWaV-1) dan PMWaV-2, keberadaan vektor (Dysmicoccus brevipes), dan keadaan lingkungan yang mendukung terjadinya penyakit. Meskipun demikian, di Indonesia, penyakit ini relatif baru muncul beberapa tahun terakhir dan belum pernah ada laporan penelitian mengenai virus yang berasosiasi dengan penyakit layu nanas di Indonesia.
Penelitian ini bertujuan untuk mendeteksi dan mengidentifikasi PMWaV yang berasosiasi dengan penyakit layu pada tanaman nanas di Indonesia. Diharapkan penelitian ini dapat memberikan informasi dan laporan pertama mengenai keberadaan PMWaV yang berasosiasi dengan penyakit layu nanas di Indonesia.
Hasil deteksi secara serologi dengan metode Tissue blot immunoassays (TBIA) menggunakan dua antibodi monoklonal spesifik terhadap PMWaV-1 maupun 2 (Agdia Inc., USA) berhasil mendeteksi keberadaan PMWaV-1 dan PMWaV-2 pada jaringan daun tanaman nanas yang menunjukkan maupun dari yang tidak menunjukkan gejala layu. Pendeteksian secara molekuler dengan metode reverse transcription-polymerase chain reaction (RT-PCR) menggunakan dua primer yang spesifik terhadap PMWaV-1 dan PMWaV-2 berhasil mengamplifikasi gen Heat Shock Protein 70 (HSP 70) pada kedua virus. Penemuan ini mengindikasikan bahwa PMWaV-1 dan PMWaV-2 berasosiasi dengan penyakit layu nanas yang terjadi di Indonesia. Analisis protein menggunakan sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) menunjukkan adanya sebuah struktural protein besar dengan perkiraan ukuran sebesar 23 kDa. Keberadaan partikel virus berbentuk batang lentur juga teramati pada preparasi mikroskop elektron yang berasal dari tanaman nanas yang terinfeksi virus. Hasil pengamatan menggunakan mikroskop elektron ini sesuai dengan ciri-ciri virus dari anggota Closterovirus. Analisis parsial genom HSP 70 virus layu nanas isolat Indonesia menunjukkan kisaran homologi sebesar 96 hingga 98% dengan PMWaV-1 dan PMWaV-2. Selain itu, analisis filogenetik menunjukkan bahwa isolat PMWaV Indonesia dan Hawaii merupakan anggota Closterovirus yang ditularkan oleh kutu putih, dan memiliki hubungan kekerabatan yang dekat dengan Grapevine leafroll-associated virus-3 (GLRaV-3).
ABSTRACT
RENO TRYONO. Detection and Identification of Pineapple mealybug wilt-associated virus Causing Wilt Disease on Pineapple in Indonesia. Under supervised of GEDE SUASTIKA and SOBIR.
Field surveys on pineapple wilt disease were conducted on pineapple production areas in Subang, West Java, Indonesia. The disease was characterized by severe tip dieback, downward curling, reddening, and wilting of the leaves which can lead to total collapse of the plant.
The objective of the research is to identify the viruses causing wilt disease on pineapple in Indonesia. Tissue blot immunoassays (TBIAs) using two different antibodies specific to either Pineapple mealybug wilt-associated virus-1 (PMWaV-1) or PMWaV-2 (Agdia Inc., USA) successfully detected the viruses in leaf tissues from both symptomatic and asymptomatic pineapple plants. A reverse transcription-polymerase chain reaction (RT-PCR) assays using oligonucleotide primers specific to HSP 70 gene of PMWaV-1 and PMWaV-2 were also successfully amplified the regions succesfully. These finding indicated that both closteroviruses were associated with wilt disease on pineapple plants in Indonesia. Protein analysis by using sodium dodecyl sulphate-polyacrylamide gel electrophoresis (SDS-PAGE) revealed that the viruses have a major structural protein with molecular mass of approximately kDa. Flexuous filamentous particles were also observed in electron microscopy preparations from infected plants. These results were in agreement with characteritics of the closteroviruses. Aligments of partial nucleotide sequences of the viral genomes exhibited 96 to 98% homology with that of PMWaV-1 and PMWaV-2 Hawaiian isolates as previously reported by Sether et al. (2001), respectively. Phylogenetic analysis revealed that Indonesian and Hawaiian virus isolates were belong to mealybug-transmitted closterovirus and closely related to Grapevine leafroll-associated virus-3 (GLRaV-3).
© Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
DETEKSI DAN IDENTIFIKASI
Pineapple Mealybug Wilt-associated Virus
PENYEBAB
PENYAKIT LAYU PADA TANAMAN NANAS DI INDONESIA
RENO TRYONO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
associated Virus Penyebab Penyakit Layu pada Tanaman Nanas di Indonesia
Nama : Reno Tryono
NIM : A451040071
Disetujui
Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc. Dr. Ir. Sobir, M.Si.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Entomologi – Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. Dr. Ir. Khairil Anwar Notodiputro, M.S.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2005 hingga April 2006 ini adalah deteksi virus tanaman, dengan judul “Deteksi dan Identifikasi pineapple mealybug wilt-associated virus pada Tanaman Nanas di Indonesia”.
Terima kasih penulis ucapkan kepada Dr. Ir. Gede Suastika, M.Sc. dan Dr. Ir. Sobir, M.Si., selaku komisi pembimbing atas bimbingan, saran, dan masukannya, sehingga penulis dapat menyelesaikan penelitian dan tesis ini. Terima kasih juga kepada Pusat Kajian Buah-buahan Tropika IPB yang telah mengalokasikan anggaran dana untuk penelitian ini sebagai bentuk kerjasama penelitian. Terima kasih kepada Dr. Ir. Tri Asmira Damayanti, M.Agr. selaku penguji luar komisi yang telah banyak memberikan masukan dalam penyempurnaan tulisan dalam tesis ini. Terima kasih juga kepada Dekan Sekolah Pascasarjana IPB, Ketua Program Studi Entomologi-Fitopatologi IPB atas kesediaan menerima penulis untuk studi di Sekolah Pascasarjana IPB, dan kepada Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Faperta IPB atas izin penggunaan bahan dan peralatan laboratorium yang digunakan selama penelitian.
Ungkapan terima kasih disampaikan kepada Ayah, Ibu, kakak, adik-adik, serta seluruh keluarga atas segala doa dan kasih sayangnya. Penulis juga mengucapkan banyak terima kasih kepada rekan-rekan mahasiswa Entomologi-Fitopatologi, rekan-rekan mahasiswa di Laboratorium Virologi Tumbuhan Faperta IPB, dan saudari Tuti Legiastuti, S.Si yang telah banyak membantu dalam penelitian ini. Rasa terima kasih yang tulus juga penulis ucapkan kepada Anna Safarrida, S.Si atas dukungan moril yang selalu menjadi motivasi penulis.
Semoga penelitian ini bermanfaat dalam menambah khazanah ilmu pengetahuan.
Bogor, Agustus 2006
Penulis dilahirkan di Jakarta pada tanggal 18 Maret 1982 dari ayah Kaselan dan ibu Titin Sukmawati sebagai putra ketiga dari lima bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan penelitian ... 3
Hipotesis ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Gejala Penyakit Layu Nanas ... 4
Kisaran Inang dan Penularan PMWaV ... 5
Distribusi Geografi PMWaV ... 6
Ciri-ciri PMWaV ... 7
Metode Deteksi PMWaV ... 9
BAHAN DAN METODE ... 10
Tempat dan Waktu Penelitian ... 10
Metode Penelitian ... 10
Bahan Penelitian ... 10
Tissue Blot Immunoassay (TBIA) ... 10
Reverse Transcriptase - Polymerase Chain Reaction (RT-PCR) 11 Purifikasi Virus ... 12
SDS-PAGE dan Western Blotting ... 13
Mikroskopi Elektron ... 15
Perunutan Nukleotida ... 15
HASIL DAN PEMBAHASAN ... 16
Deteksi PMWaV dengan TBIA ... 16
Pemurnian PMWaV dan Visualisasi Visualisasi Morfologi Partikel PMWaV dengan Mikroskop ... 18
Analisis Protein Selubung PMWaV dengan SDS-PAGE dan Western Blotting ... 21
Deteksi Asam Nukleat PMWaV dengan RT-PCR ... 24
Analisis Runutan dan Hubungan Kekerabatan PMWaV Indonesia dengan Anggota Famili Closterovirus Lainnya ... 25
KESIMPULAN DAN SARAN ... 31
Kesimpulan ... 31
Saran ... 31
DAFTAR PUSTAKA ... 32
Halaman
1 Distribusi geografik PMWaV di dunia ... 7
2 Sekuen primer, ukuran produk, dan posisi nukleotida pada gen PMWaV-1 dan PMWaV-2 ... 11
3 Deteksi PMWaVpada Jaringan daun nanas dan beberapa gulma serta tanaman pisang yang tumbuh di sekitar pertanaman nanas di Kabupaten Subang ... 16
4 Visualisasi partikel PMWaV dengan mikroskop elektron hasil dari
DAFTAR GAMBAR
Halaman
1 Gejala PMWaV pada tanaman nanas. A. Gejala layu nanas diambil dari CABI (2005). B. Gejala layu nanas di Kabupaten Subang, Jawa Barat; atas: tanaman nanas sehat, bawah: tanaman nanas sakit ... 5
2 Partikel PMWaV pada mikroskop elektron ... 8
3 Tissue blot dari potongan daun nanas. Kiri: daun nanas sehat (1,2), *) reaksi tidak spesifik, daun nanas terinfeksi PMWaV-1 (3). Kanan: daun nanas sehat (1,2,5), daun nanas terinfeksi PMWaV-2 (3,4) ... 18
4 Hasil separasi protein virus dengan SDS-PAGE. Lajur M, low mixture molecular-weight marker; 1, fraksi 1 pemurnian PMWaV; 2, fraksi 2 pemurnian PMWaV; 3, fraksi 3 pemurnian PMWaV; K, kontrol larutan penyangga ... 22
5 Analisis Western Blot terhadap protein selubung PMWaV. Elektroforesis protein yang telah didenaturasi dilakukan pada 10% SDS-PAGE. (A). Pita protein yang terdeteksi dengan antibodi PMWaV-1. (B). Pita protein yang terdeteksi dengan antibodi PMWaV-2. Lajur 1-5 pada gambar A dan B berturut-turut mewakili
fraksi 1 sampai 5 dari hasil pemurnian virus ... 23
6 Deteksi dan diferensiasi PMWaV-1 dan PMWaV-2 menggunakan RT-PCR. Lajur 1, 100 bp DNA ladder; lajur 2, tanaman terinfeksi PMWaV-1; lajur 3, tanaman terinfeksi PMWaV-2, lajur 4, 1 kb plus DNA ladder; lajur 5 dan 6, tanaman sehat ... 24
7 Alignment antara genom HSP 70 PMWaV Indonesia dengan genom PMWaV yang terdapat pada Gen Bank (www.ncbi.nlm.nih.gov). (A)
PMWaV-1, (B) PMWaV-2. ( | ) basa antara kedua sekuen sama, ( )
basa antara kedua sekuen tidak sama, ( - ) delesi/tidak ada basa ... 27
Latar Belakang
Indonesia merupakan salah satu negara penghasil nanas di Asia Tenggara.
Produksi nanas Indonesia pada tahun 2002 tercatat mencapai 300.000 ton yang
menempati posisi tertinggi ketiga setelah Thailand dan Filipina (CABI 2005).
Beberapa tahun terakhir, industri nanas di Indonesia dihadapkan pada suatu
permasalahan penting yaitu munculnya penyakit layu pada tanaman nanas yang
belum pernah dilaporankan sebelumnya. Berdasarkan laporan petani nanas,
penyakit layu nanas muncul di beberapa daerah sentra produksi nanas di Indonesia
seperti Jawa Barat, Jawa Timur, Lampung, dan Sumatera Utara.
Tanaman nanas yang terserang penyakit ini menunjukkan gejala berupa
warna daun tanaman yang terserang menjadi berwarna kuning sampai kemerahan,
daun menggulung ke bawah, pada ujung daun nekrotik, dan tanaman menjadi
layu. Pada keadaan yang sudah parah, tanaman nanas menjadi kerdil dan dapat
roboh akibat terhambatnya perkembangan perakaran tanaman. Penyakit ini juga
dapat menyebabkan kegagalan dalam menghasilkan buah, atau mampu
menghasilkan buah tetapi berukuran lebih kecil dari yang sehat.
Penyakit layu nanas merupakan salah satu penyakit penting pada industri
nanas di dunia. Gejala penyakit layu pada tanaman nanas di Indonesia mirip
dengan gejala penyakit layu tanaman nanas yang telah banyak dilaporkan di
negara-negara produsen nanas. Tanaman yang terserang penyakit ini
menunjukkan gejala mati pucuk daun yang parah, penggulungan tepi daun ke
bawah, warna daun yang memerah, dan pelayuan daun yang dapat mengarah pada
robohnya seluruh tanaman. Hawaii, sebagai salah satu daerah penghasil nanas
terbesar di dunia, telah banyak mempublikasikan laporan mengenai penyakit layu
pada tanaman nanas, yang dikenal dengan nama mealybug wilt of pineapple
disease (MWP) yang disebabkan oleh pineapple mealybug wilt-associated virus
(PMWaV) (Sether & Hu 2002). Sebelumnya, penyakit layu juga telah menjadi
faktor pembatas penting terhadap produksi nanas di Hawaii pada awal tahun
Di Malaysia, penyakit layu nanas menyebabkan tanaman yang terinfeksi
menghasilkan buah yang tidak sesuai kriteria pasar dan buah menjadi tidak cocok
untuk dikalengkan. Selain itu, kejadian penyakit layu nanas pada varietas
Masmerah di Malaysia mencapai antara 0,4% sampai 7,6% (Lim 1985). Di
Hawaii, Sether dan Hu (2002) melaporkan kehilangan hasil nanas sebesar 35%
pada tanaman nanas yang menunjukkan gejala layu nanas yang diketahui
terinfeksi PMWaV-2.
Beberapa penelitian yang telah dilakukan terhadap penyakit ini melaporkan
bahwa penyakit layu nanas merupakan suatu penyakit yang melibatkan adanya
partikel virus, serangga vektor, dan keadaan lingkungan yang mendukung
munculnya gejala pada tanaman. Partikel virus Pineapple mealybug
wilt-associated virus-1 (PMWaV-1) dan PMWaV-2 dilaporkan berhasil diekstrak dari
tanaman nanas yang menunjukkan maupun yang tidak menunjukan gejala
penyakit layu nanas (Sether et al. 2001). Dua spesies kutu putih yaitu
Dysmicoccus brevipes (pink mealybug) (Hemiptera: Pseudococcidae), dan D.
neobrevipes (grey mealybug) (Hemiptera: Pseudococcidae), dilaporkan berperan
sebagai vektor PMWaV-1 dan PMWaV-2 di lapang (Sether et al. 1998 ).
Penyakit layu pada tanaman nanas di Indonesia merupakan penyakit baru
yang belum pernah dilaporkan dan dikarakterisasi mengenai dugaan keberadaan
partikel virus penyebab penyakit ini di Indonesia. Deteksi dan identifikasi virus
penyebab penyakit layu nanas merupakan hal penting bagi penentuan strategi
pengendalian penyakit layu nanas. Oleh karena itu, perlu dilakukan penelitian
yang dapat mengungkapkan identitas virus yang berasosiasi dengan penyakit layu
yang banyak ditemukan pada tanaman nanas di Indonesia dengan metode deteksi
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendeteksi dan mengidentifikasi
partikel virus yang berasosiasi dengan penyakit layu pada tanaman nanas cv.
Smooth Cayenne di Kabupaten Subang, Jawa Barat, Indonesia.
Hipotesis
PMWaV-1 dan PMWaV-2 berasosiasi dengan gejala penyakit layu pada
tanaman nanas cv. Smooth Cayenne di Indonesia. Isolat PMWaV Indonesia
memiliki ciri-ciri biomolekuler dan runutan nukleotida yang berkerabat dekat
dengan PMWaV asal Hawaii.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat dalam memberikan
informasi mengenai keberadaan PMWaV di Indonesia yang dapat digunakan
sebagai dasar keilmuan bagi Badan Karantina Indonesia untuk menyusun ulang
daftar Organisme Pengganggu Tumbuhan (OPT) Karantina, sehingga aturan
mengenai lalu lintas bahan tanaman dengan negara lain atau antar daerah di
TINJAUAN PUSTAKA
Nanas merupakan tanaman tropis yang dapat dibudidayakan di kisaran
wilayah 25° LU sampai 25° LS. Nanas memiliki banyak varietas yang berbeda
dalam ukuran tanaman dan buah, warna dan rasa daging buah, serta pola duri pada
tepi daunnya (CABI 2005).
Dalam prakteknya, budi daya nanas memiliki beberapa kendala yang salah
satunya adalah serangan hama dan penyakit. Dysmicoccus brevipes merupakan
hama tanaman nanas yang paling serius di dunia. Serangga ini sangat umum di
daerah tropis dan berperan dalam menyebabkan gejala layu nanas pada varietas
Smooth Cayenne dan Masmerah, namun varietas Singapore Spanish menunjukkan
sifat tahan terhadap hama ini (CABI 2005). Selain kerusakan akibat aktivitas
makan, serangga ini juga diketahui berperan sebagai vektor PMWaV yang dapat
menyebabkan penyakit layu pada tanaman nanas (Sether et al. 1998). Tanaman
terinfeksi menjadi merah kekuningan hingga merah terang pada ujung daun yang
segera menjalar ke daun lainnya, tanaman menjadi layu, dan buah yang dihasilkan
kecil. Meskipun demikian, timbulnya gejala penyakit merupakan fenomena
kompleks yang melibatkan adanya partikel virus, D. brevipes, dan faktor
lingkungan yang mendukung terjadinya penyakit (Sether et al. 1998). Penyakit ini
kemudian dikenal dengan nama penyakit layu nanas.
Gejala Penyakit Layu Nanas
Infeksi awal biasanya muncul pada tanaman-tanaman nanas yang berada di
pinggir lahan kemudian menyebar ke tanaman-tanaman di bagian dalam lahan.
Penyakit ini dicirikan dengan adanya gejala mati ujung daun dan kemerahan di
sepanjang daun, diikuti dengan terjadinya perkembangan perubahan warna daun
dari merah ke merah muda, kehilangan kebugaran daun, dan pada akhirnya daun
Gambar 1 Gejala PMWaV pada tanaman nanas. A. Gejala layu nanas diambil dari CABI (2005). B. Gejala layu nanas di Kabupaten Subang, Jawa Barat; atas: tanaman nanas sehat, bawah: tanaman nanas sakit.
Tanaman yang terinfeksi pada fase awal pertumbuhan tidak membentuk
buah, atau hanya menghasilkan buah yang kecil. Beberapa tanaman, bahkan yang
terlihat sangat layu, dapat pulih selama daun yang bergejala layu pada ujungnya
telah gugur dan daun yang tumbuh baru tumbuh secara normal. Penyakit ini juga
menghambat pertumbuhan akar dan menyebabkan tanaman menjadi layu
(Samson, 1986).
Kisaran Inang dan Penularan PMWaV
Nanas merupakan satu-satunya tanaman yang diketahui sebagai inang
PMWaV. Meskipun demikian, rumput liar yang tumbuh disekitar tanaman nanas
seperti Andropogon insularis dan Paspalum urvillei diduga dapat menjadi inang
alternatif dari PMWaV (Gunasinghe 1989). Penyakit layu nanas dilaporkan dapat
ditularkan melalui perbanyakan vegetatif tanaman nanas dan melalui vektornya
yaitu D. brevipes. Rohrbach et al. (1988) melaporkan bahwa D. brevipes
merupakan hama kosmopolitan pada tanaman nanas dan merupakan vektor bagi
virus penyebab penyakit layu nanas. Selain itu, D. brevipes bersifat polifagus
dengan kisaran inang lebih dari 100 genus dari 53 famili tanaman, termasuk
beberapa gulma yang tumbuh di sekitar tanaman nanas seperti A. insularis dan P.
Meskipun demikian, hasil berbeda dilaporkan oleh Sether et al. (1998) yang
mendapatkan bahwa tidak ditemukan adanya infeksi PMWaV pada sampel
tanaman yang dikumpulkan dari lapang, yaitu gulma, tumbuhan semak, dan
pohon yang tumbuh disekitar lahan nanas. Sether et al. (1998) juga melaporkan
tidak ada infeksi PMWaV pada Agave, pisang, ketela pohon, Chenopodium,
tembakau, dan rumput-rumputan, dimana tanaman nanasnya sendiri menjadi
terinfeksi setelah diinokulasi dengan D. brevipes yang viruliferous, meskipun
beberapa dari tanaman non-nanas ini dapat dijadikan inang oleh D. brevipes.
Penyakit layu nanas dapat ditularkan oleh dua spesies kutu putih yang
menjadi vektor PMWaV, yaitu D. brevipes (pink mealybug), dan D. neobrevipes
(grey mealybug). Kedua serangga ini mampu menularkan PMWaV secara semi
persisten, meskipun kemampuan menularkannya akan berkurang setelah beberapa
hari setelah akuisisi. Sether et al. (1998) melaporkan adanya korelasi antara
kehadiran semut dengan tingkat penyebaran penyebaran penyakit layu nanas di
lapang. Hal yang sama juga dilaporkan oleh Lim (1985) yang melaporkan bahwa
populasi D. brevipes biasanya berasosiasi dengan semut. Semut akan melindungi
dan memelihara D. brevipes dari predasi dan memanen embun madu yang
dihasilkan oleh D. brevipes.
Distribusi Geografi PMWaV
Berikut adalah laporan mengenai keberadaan PMWaV yang berhasil
dideteksi penyebarannya di dunia (Tabel 1). Carter (1933) dalam laporannya
menyebutkan keberadaan vektor penyakit layu nanas yaitu D. brevipes di
Indonesia (pulau Jawa) yang telah menyebar luas. Setelah itu, hingga saat ini
belum ada laporan detail yang menyebutkan tentang penyebaran penyakit layu
nanas di Indonesia. Meskipun demikian, berdasarkan pengamatan di lapang,
gejala penyakit layu nanas ditemukan di beberapa daerah sentra produksi nanas di
Indonesia seperti di Kabupaten Subang Jawa Barat, Lampung, Jawa Timur, dan
Sumatera Utara (Arta 2006, Komunikasi pribadi). Diduga penyakit layu nanas
telah menyebar luas di beberapa wilayah di Indonesia, mengingat bibit yang
sebelumnya telah terinfeksi PMWaV. Di dunia, penyakit layu nanas telah banyak
dilaporkan di berbagai negara sentra produksi nanas (Tabel 1).
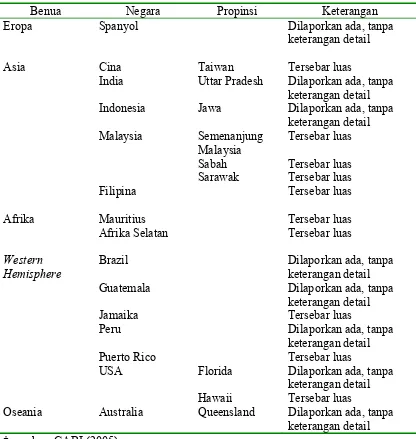
Tabel 1 Distribusi geografik PMWaV di dunia*
Benua Negara Propinsi Keterangan
Eropa Spanyol Dilaporkan ada, tanpa
keterangan detail
Asia Cina Taiwan Tersebar luas
India Uttar Pradesh Dilaporkan ada, tanpa keterangan detail
Indonesia Jawa Dilaporkan ada, tanpa
keterangan detail
Malaysia Semenanjung
Malaysia
Tersebar luas
Sabah Tersebar luas
Sarawak Tersebar luas
Filipina Tersebar luas
Afrika Mauritius Tersebar luas
Afrika Selatan Tersebar luas
Western Hemisphere
Brazil Dilaporkan ada, tanpa
keterangan detail
Guatemala Dilaporkan ada, tanpa
keterangan detail
Jamaika Tersebar luas
Peru Dilaporkan ada, tanpa
keterangan detail
Puerto Rico Tersebar luas
USA Florida Dilaporkan ada, tanpa
keterangan detail
Hawaii Tersebar luas
Oseania Australia Queensland Dilaporkan ada, tanpa
keterangan detail
* sumber: CABI (2005)
Ciri-ciri PMWaV
Kepadatan partikel PMWaV dalam caesium sulphate adalah 1,5 g/cm3.
tunggalnya (single stranded RNA/ssRNA) bersifat linear dalam satu bagian
(monopartit). Ukuran RNA utas gandanya (double stranded RNA/dsRNA) adalah
8,35 x 106 Da (Gunasinghe & German 1989).
Pada tahun 1986, dsRNA berhasil diisolasi dari tanaman nanas terinfeksi di
Hawaii (Gunasinghe & German 1989) dan menyimpulkan bahwa virus dengan
RNA utas tunggal berasosiasi dengan penyakit layu nanas. Pada tahun 1987, suatu
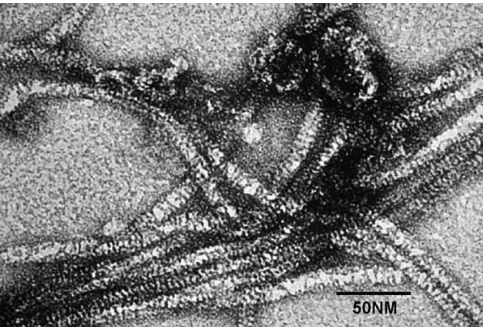
virus berhasil diisolasi dari tanaman terinfeksi. Virus ini berbentuk batang lentur,
tidak beramplop, dan memiliki panjang 1200-1500 nm. Partikel virus, ketika
diwarnai dengan uranyl formate jenuh dalam methanol, menunjukkan suatu
struktur lubang pada sub unit selubung protein yang merupakan karakteristik
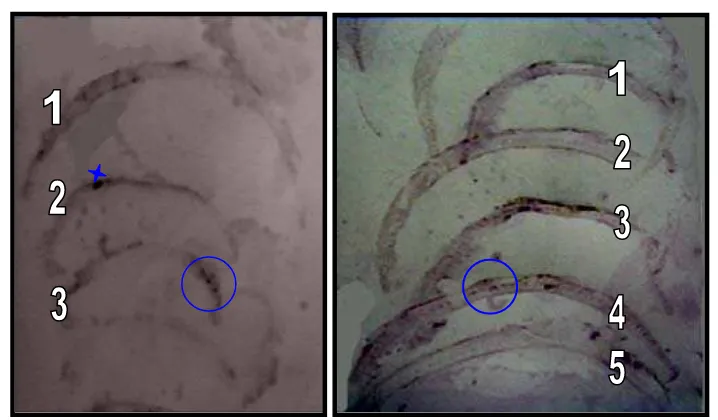
[image:30.595.196.439.353.517.2]closterovirus (Gunasinghe & German 1989) (Gambar 2).
Gambar 2 Partikel PMWaV dibawah Mikroskop Elektron (CABI 2005).
Metode Deteksi PMWaV
Cara terbaik untuk mendeteksi PMWaV adalah dengan mengisolasi
dsRNA yang diikuti dengan seperasi RNA pada gel elektroforesis (Gunasinghe &
German 1989). Metode serologi seperti Enzyme Linked Immunosorbent Assay
(ELISA) atau Serological Specific Electron Microscopy (SSEM) dapat digunakan
jika tersedia antiserum (Gunasinghe dan German 1989), tetapi hasil deteksi
serologi yang lebih baik didapatkan dengan menggunakan metode Tissue Blot
menggunakan presipitasi polyethyleneglycol (PEG) yang diikuti dengan cesium
sulphate gradient centrifugation menggunakan metode yang digunakan oleh
Gunasinghe dan German (1989). Ullman et al. (1989) berhasil menghasilkan
antiserum terhadap partikel mirip Closterovirus yang berasosiasi dengan penyakit
layu nanas. Hasil positif didapatkan dari tanaman yang terinfeksi virus
menggunnakan deteksi secara serologi dengan uji difusi ganda Ouchterloney,
ELISA, dan Serological Specific Electron Microscopy (SSEM).
Metode pendeteksian secara molekuler dengan reverse transcriptase
polymerase chain reaction (RT-PCR) juga dapat digunakan untuk mendeteksi
PMWaV dari tanaman nanas yang terinfeksi. Amplikon genom HSP 70 dari
PMWaV-1 dan PMWaV-2 berhasil dideteksi dari tanaman nanas yang terinfeksi
oleh PMWaV menggunakan primer yang spesifik terhadap PMWaV-1 dan
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan, Departemen
Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, mulai bulan
Agustus 2005 sampai April 2006.
Metode Penelitian Bahan Penelitian
Bahan penelitian yang digunakan adalah sampel daun nanas cv. Smooth
Cayenne yang berasal dari pertanaman nanas di Kabupaten Subang Jawa Barat.
Sampel daun nanas di ambil dari lahan perkebunan nanas secara acak terhadap
tanaman nanas yang menunjukkan gejala layu nanas, serta sampel tanaman nanas
sehat. Beberapa tumbuhan selain nanas yang tumbuh di sekitar areal penanaman
nanas juga diambil untuk dianalisis.
Tissue Blot Immunoassay (TBIA)
Deteksi PMWaV secara serologi pada tanaman nanas dilakukan dengan
menggunakan metode TBIA seperti yang dilaporkan oleh Hu et al. (1997). Daun
dari tanaman nanas yang menunjukkan gejala maupun yang tidak bergejala layu,
digunakan sebagai sampel yang akan dideteksi. Sampel daun dipotong melintang
pada bagian dasar daun yang masih putih untuk membuat tepi potongan yang rata.
Potongan ini kemudian ditempelkan pada 0,45 µm Nitro ME nitrocelulose
membrane (Amersham Pharmacia Biotech, USA) selama 3-5 detik. Pola jaringan
pembuluh daun akan menempel dan tertinggal pada membran. Membran
kemudian disimpan kering diantara lipatan kertas saring pada suhu ruang sampai
siap dianalisis.
Membran yang telah diblot ditempatkan dalam wadah plastik dan
diblocking dengan 2% (wt/vol) susu skim yang dilarutkan dalam larutan
penyangga tris buffer saline (TBS) (50 mM Tris-HCl, 50 mM NaCl, pH 7,5)
wadah plastik yang baru atau kantung plastik segel dengan antibodi monoklonal
PMWaV (Agdia Inc., USA) dengan pengenceran 1:10 dalam TBS pada suhu
ruang selama 1-2 jam, atau pada suhu 4°C selama 1 malam. Membran kemudian
dicuci dengan TBST (TBS + 0,5% Tween 20) selama 10 menit sebanyak 3 kali
pada suhu ruang. Setelah pencucian, membran kemudian diinkubasikan dengan
konjugat alkaline phosphatase (Sigma Chemical Co. St. Louise, USA) pada
pengenceran 1:1000 dalam TBS selama 2-3 jam pada suhu ruang. Membran
kemudian dicuci sebagaimana di atas, dan diwarnai dengan substrat
5-bromo-4-chloro-3-Indolyl Phosphate/Nitro Blue Tetrazolium (BCIP/NBT) (Sigma
Chemical Co., USA) menggunakan satu tablet BCIP/NBT yang dilarutkan dalam
10 ml larutan penyangga Alkaline Phosphate (AP). Pewarnaan dilakukan pada
suhu ruang hingga terjadi perubahan warna pada membran. Reaksi pewarnaan
dihentikan dengan mencuci membran dengan air mengalir dan dikeringanginkan.
Reverse Trancriptase - Polymerase Chain Reaction (RT-PCR)
Total RNA diekstrak dari 100 mg jaringan daun tanaman nanas
menggunakan Rneasy Plant Mini Kits (Qiagen Inc., Chatsworth, CA., USA).
Sampel RNA yang telah dimurnikan diresuspensikan dengan 40 µl air bebas
RNase, kemudian disimpan pada suhu -80°C sampai akan digunakan. Amplifikasi
sebagian genom PMWaV-1 dan PMWaV-2 dilakukan menggunakan sepasang
primer 223 dan 224 untuk PMWaV-2 dan 225 dan 226 untuk PMWaV-1 (Tabel
[image:33.595.114.511.617.696.2]2).
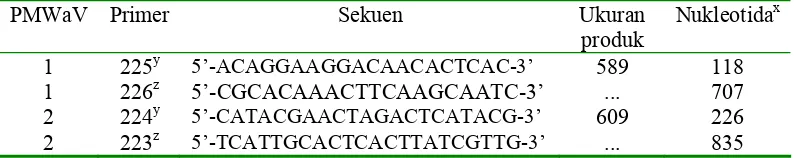
Tabel 2 Sekuen primer, ukuran produk, dan posisi nukleotida pada gen PMWaV-1 dan PMWaV-2 (Sether et al. 200PMWaV-1)
PMWaV Primer Sekuen Ukuran
produk
Nukleotidax
1 225y 5’-ACAGGAAGGACAACACTCAC-3’ 589 118 1 226z 5’-CGCACAAACTTCAAGCAATC-3’ ... 707 2 224y 5’-CATACGAACTAGACTCATACG-3’ 609 226 2 223z 5’-TCATTGCACTCACTTATCGTTG-3’ ... 835
x
Lokasi primer (posisi nukleotida dari awal) gen homolog HSP70 PMWaV y
Forward primer z
Reaksi RT dilakukan pada volume 20 µl terdiri dari 3 µl RNA hasil
ekstraksi, 0,75 pmol primer, 500 mM dNTPs, 5 mM MgCl2, 4 µl bufer RT (250
mM Tris-HCl, pH 8,3, 375 mM KC, 15 mM MgCl2, 50 mM DTT), 20 unit
RNAsin Ribonuclease inhibitor (Promega, Madison, WI, USA), dan 65 unit
MMLV reverse transcriptase (Promega, Madison, WI, USA). Reaksi RT
dilakukan pada kondisi 25 °C selama 5 menit, 42 °C selama 60 menit, diikuti
dengan inaktivasi pada 72 °C selama 15 menit.
Reaksi PCR dilakukan pada volume 50 µl terdiri dari 0,75 pmol forward
primer (224 untuk PMWaV-2 dan 226 untuk PMWaV-1) dan reverse primer (223
untuk PMWaV-2 dan 225 untuk PMWaV-1) (Tabel 2), 3 µl bufer reaksi (500 mM
KCl, 100 mM Tris-HCl [pH 9,0 pada 25°C], 1,0% [vol/vol] triton X-100), dan 0,5
µl taq DNA polimerase (Promega, Madison, USA). Kondisi PCR awalnya adalah
denaturasi pada suhu 94°C selama 4 menit, kemudian dilanjutkan dengan 45
siklus pada 94 °C selama 1 menit, 50 °C selama 1 menit, dan 72 °C selama 1
menit, dan diikuti dengan perpanjangan pada 72 °C selama 10 menit pada mesin
PCR (Perkin Elmer 9700 thermocycler).
Separasi DNA produk RT-PCR dilakukan pada gel agarose 1% dalam
larutan penyangga TBE (54 gr Tris base, 27,5 gr Asam Borat, 20 ml EDTA 0,5 M,
pH 8,0 dalam 1000 ml air) pada kondisi 70 V selama 2 jam. Amplicon
divisualisasi dengan 2 µg/ml ethidium bromida dalam larutan penyangga TBE
untuk elektroforesis. Setelah pewarnaan, gel kemudian difoto di atas cahaya ultra
violet (310 nm) menggunakan kamera polaroid Direct Screen DS34 dan film
polaroid FP-3000B SS.
Purifikasi Virus
Seratus gram jaringan tanaman sakit dibekukan dengan nitrogen cair,
ditumbuk hingga halus dengan mortar, dan dicairkan dengan bufer ekstraksi EB
(500 mM Tris-Cl, pH 8,4, 4% Triton-X 100, 0,2% 2-mercaptoethanol) sebanyak 2
ml/g jaringan. Hasil gerusan dihomogenisasi menggunakan pengaduk selama satu
jam pada suhu 4°C dan disaring menggunakan kain kasa, dan hasil saringan
Supernatan yang didapatkan kemudian disentrifugasi pada 44.500 rpm selama 60
menit pada rotor P70AT, dan peletnya dilarutkan dalam bufer TM (100 mM
Tris-Cl, pH 8,5, dan 10 mM MgCl2) menggunakan 1/8 volume bufer ekstraksi.
Suspensi ini diklarifikasi dengan sentrifugasi pada 7.500 rpm selama 15 menit
pada rotor P70AT, dan supernatan yang didapatkan dilapiskan diatas 5 ml 0,48
molal Cs2SO4 dalam bufer TM dan disentrifugasi pada 46.000 rpm selama 16 jam
dalam rotor P80AT pada suhu 8°C. Pelet yang dihasilkan dilarutkan dalam 200 µl
bufer TM (Gunasinghe & German 1989).
Sodium Dodecyl Sulphate – Polyacrylamide Gel Electrophoresis (SDS-PAGE) dan Western Blotting
Berat molekul protein selubung PMWaV dianalisis dengan menggunakan
metode SDS-PAGE. Analisis dilakukan terhadap fraksi-fraksi hasil pemurnian
virus, tanaman terinfeksi virus gemini, dan tanaman terinfeksi TMV sebagai
pembanding. Fraksi hasil pemurnian virus dihomogenisasi dengan 200 µl larutan
penyangga (62 mM Tris-HCl, pH 6,7, 2% SDS, 5% 2-mercaphtoethanol, 10%
glycerol, dan 0.004% bromophenolblue), kemudian dipanaskan sampai mendidih
(100 °C) selama 10 menit, dan disentrifugasi 13.000 rpm (rotor Tomy MRX-151)
selama 10 menit. Supernatan dapat langsung digunakan atau disimpan pada suhu
-20 °C.
Analisis SDS-PAGE membutuhkan dua jenis gel yang berbeda yaitu
separating gel (gel pemisah) dan stacking gel.Gel pemisah dibuat dengan cara
mencampur acrylamide 10% (1,8 ml) dengan bis-acrylamide 0,25% (1,5 ml),
Tris-HCl 0,375 M pH 8,8 (2,5 ml), SDS 0,1% (0,005 ml), TEMED 0,025% (0,006
ml), APS (amonium persulphate) 0,025% (0,17 ml), dan 4 ml air. Setelah
bahan-bahan tercampur rata kemudian dimasukkan ke dalam pelat gelas ukuran 10 x 7,2
cm yang telah dipasang pada gel stand. Permukaan atas gel diratakan dengan
menambah air di atas lapisan gel sekaligus untuk mempercepat pembekuan gel.
Air dapat dibuang setelah terlihat batas tegas antara air dan gel yang membeku.
Stacking gel dibuat dengan cara mencampur acrylamide 3% (0,06 ml) dengan
ml), TEMED 0,025% (0,006 ml), APS 0,025% (0,1 ml), dan 6,3 ml air.
Campuran tersebut selanjutnya dituang di atas gel pemisah, kemudian dipasang
sisir (comb), dan setelah gel membeku comb dapat dicabut dan gel siap
digunakan.
Sampel selubung protein virus yang berasal dari pemurnian virus,
didenaturasikan dengan cara memanaskan protein selubung virus pada suhu 100
°C selama 10 menit di dalam water bath. Setelah itu, sebanyak 15 µl
masing-masing sampel protein dimasukkan ke dalam lubang gel poliakrilamid 10% yang
dibuat sebagaimana disebutkan di atas, dalam penyangga 10 ml Tris-HCl pH 8,3
yang mengandung 3.2 ml glisin 0,2 M dan 2 ml SDS 10%. Elektroforesis
dilakukan pada suhu ruang (24 °C) pada 80 volt selama 120-180 menit. Selubung
protein PMWaV dibandingkan dengan berat molekul penanda seperti
phosphorilase b (97 kDa), albumin (66 kDa), ovalbumin (45 kDa), carbonic anhydrase (30 kDa), trypsin inhibitor (20,1 kDa), α-lactabumin (14,4 kDa), yang
terdapat dalam satu ladder (Amersham Bioscience, UK).
Setelah dielektroforesis, protein divisualisasi dengan pewarnaan
Coomassie Blue (Bio-Rad Laboratories, USA). Gel direndam dalam asam asetat
glasial 12,5% selama 5 menit kemudian direndam dalam larutan Coomassie blue
0,25% dan diinkubasi selama 12 jam di atas shaker. Gel dicuci menggunakan
larutan penghilang warna yang terdiri atas metanol 50% dan larutan asam asetat
10% sebanyak 3 x 10 menit.
Analisis protein dengan Western Blotting dilakukan untuk mengkonfirmasi
keberadaan protein selubung PMWaV dengan menggunakan metode He et al.
(1997). Protein murni virus dielektroforesis pada 10% gel SDS-PAGE, kemudian
ditransfer ke 0,45 µm Nitro ME nitrocelulose membrane (Amersham Pharmacia
Biotech, USA). Membran kemudian diinkubasi dalam antibodi monoklonal
PMWaV (Agdia Inc., USA) dengan pengenceran 1:10 dalam TBS pada suhu
ruang selama 1-2 jam, atau pada suhu 4°C selama 1 malam. Membran kemudian
dicuci dengan TBST (TBS + 0,5% Tween 20) selama 10 menit sebanyak 3 kali
pada suhu ruang. Setelah pencucian, membran kemudian diinkubasi dalam
1:1000 dalam TBS selama 2-3 jam pada suhu ruang. Membran kemudian dicuci
sebagaimana di atas, dan diwarnai dengan substrat tablet BCIP/NBT yang
dilarutkan dalam 10 ml larutan penyangga AP per 1 tablet (Sigma Chemical Co.,
USA) pada suhu ruang hingga terjadi perubahan warna. Reaksi pewarnaan
dihentikan dengan mencuci membran dengan air mengalir dan dikeringanginkan.
Analisis Partikel Virus
Partikel virus diamati dibawah mikroskop elektron. Virus hasil pemurnian
dengan gradien cesium sulfat masing-masing fraksi dipisahkan untuk diamati
dengan mikroskop elektron transmisi model JEOL 1010 yang dioperasikan pada
80 kV. Preparat disiapkan dengan mencampur satu tetes sampel dengan satu tetes
amonium persulphate (PTA), kemudian grid berukuran 400 mesh yang telah
dilapisi colodion dan dikarbonisasi ditempelkan pada preparat tersebut selama 1-2
menit. Diharapkan partikel virus yang ada pada preparat sampel akan menempel
pada grid. Pengamatan partikel virus dilakukan dengan pembesaran 15.000 –
30.000 kali.
Perunutan Nukleotida
Perunutan sebagian genom PMWaV dilakukan dengan merunut nukleotida
gen HSP 70 PMWaV dari hasil PCR dengan menggunakan sepasang primer 223
dan 224 untuk PMWaV-2 serta 225 dan 226 untuk PMWaV-1 (Tabel 2).
Perunutan nukleotida dilakukan di Laboratorium Research and Development
Centre PT. Charoen Pokhpand, Jakarta Indonesia dengan menggunakan mesin
sequencer ABI-Prism 3100-Avant Genetic Analyzer (ABI PRISM 3100 version
3.7). Hasil runutan kemudian dianalisis menggunakan software Wu-Blastn
(www.ebi.ac.uk) yang terdapat dalam situs The European Bioinformatic Institute
(EBI). Sekuen DNA untuk Closterovirus lainnya didapatkan dari bank gen
(www.NCBI.nml.nih.gov) dan hubungan filogenetik didapatkan melalui program
HASIL DAN PEMBAHASAN
Deteksi PMWaV dengan TBIA
Deteksi PMWaV menggunakan TBIA menunjukkan hasil yang beragam
antar sampel tanaman. Dari total 126 sampel daun nanas yang diuji, 86 sampel
menunjukkan reaksi positif terinfeksi PMWaV-1 dan PMWaV-2. Reaksi positif
lebih banyak didapatkan dari sampel tanaman yang bergejala dibandingkan
dengan yang tidak. Dari sampel tanaman nanas yang bergejala, reaksi positif
tanaman nanas terinfeksi PMWaV-2 lebih banyak dibandingkan dengan yang
[image:38.595.115.509.375.573.2]terinfeksi oleh PMWaV-1 (Tabel 3).
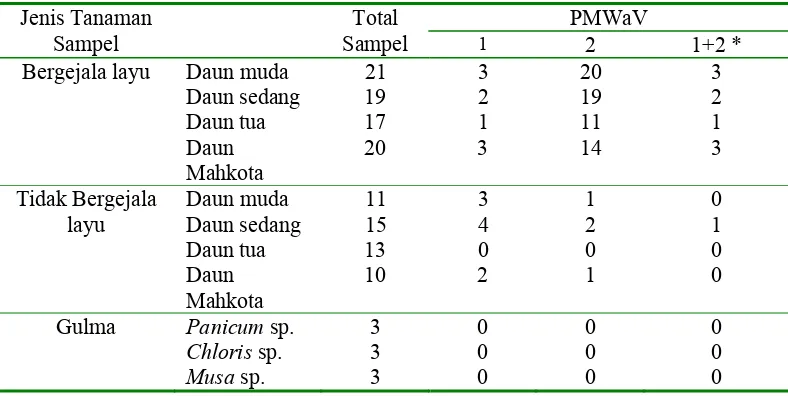
Tabel 3 Deteksi PMWaV pada jaringan daun nanas dan beberapa gulma dan tanaman pisang yang tumbuh disekitar pertanaman nanas di Kabupaten Subang
PMWaV Jenis Tanaman
Sampel
Total
Sampel 1 2 1+2 *
Bergejala layu Daun muda 21 3 20 3
Daun sedang 19 2 19 2
Daun tua 17 1 11 1
Daun Mahkota
20 3 14 3
Tidak Bergejala Daun muda 11 3 1 0
layu Daun sedang 15 4 2 1
Daun tua 13 0 0 0
Daun Mahkota
10 2 1 0
Gulma Panicum sp. 3 0 0 0
Chloris sp. 3 0 0 0
Musa sp. 3 0 0 0
*) Satu sampel daun nanas ada yang terinfeksi PMWaV-1 sekaligus PMWaV-2, sehingga jumlahnya adalah irisan dari kedua infeksi. Untuk itu, jumlah infeksi dapat melebihi jumlah total sampel yang diuji.
Hasil deteksi TBIA pada sampel tanaman yang bergejala maupun yang tidak
bergejala menunjukkan adanya variasi infeksi PMWaV-1 dan PMWaV-2 di
lapangan. Meskipun demikian, pada sampel yang menunjukkan gejala layu, lebih
pada sampel yang tidak menunjukkan gejala layu di lapangan, relatif lebih banyak
dideteksi keberadaan PMWaV-1 daripada PMWaV-2. Hal ini menunjukkan
bahwa tanaman yang tidak menunjukkan gejala layu tidak menjamin bahwa
tanaman tersebut bebas dari PMWaV, dan mengindikasikan bahwa PMWaV-1
dapat menyebabkan infeksi dengan gejala laten di lapangan. Hasil ini bersesuaian
dengan penelitian Sether et al. (2001) yang melaporkan bahwa tanaman nanas
yang tidak bergejala layu umumnya terinfeksi oleh PMWaV-1, dan pada nanas
yang bergejala layu umumnya terinfeksi oleh PMWaV-2 (Tabel 3).
Uji serologi TBIA juga dilakukan terhadap tumbuhan yang berada disekitar
pertanaman nanas. Dua jenis gulma berbeda yaitu Panicum sp. dan Chloris sp.,
dan beberapa tanaman pisang (Musa spp.), merupakan tumbuhan-tumbuhan yang
ditemukan berada di sekitar pertanaman nanas di kabupaten Subang. Hasil uji
serologi TBIA terhadap Panicum sp., Chloris sp., dan Musa spp. menunjukkan
hasil yang negatif terhadap adanya infeksi PMWaV. Tidak ditemukan adanya D.
brevipes pada tanaman-tanaman selain nanas ini, diduga ada kaitannya dengan
hasil negatif PMWaV menggunakan uji TBIA. D. brevipes merupakan vektor
penting bagi penyebaran PMWaV di lapang. Keberadaannya dilaporkan
berpengaruh terhadap infeksi PMWaV pada tanaman yang diinfestasinya karena
berperan dalam perkembangan gejala layu tanaman nanas. Inokulasi tanaman
Agave, pisang, Cassia, Chenopodium, tembakau, dan nanas sebagai kontrol,
dengan D. brevipes yang mengandung virus, dilaporkan bahwa hanya tanaman
nanas saja yang posistif terinfeksi PMWaV berdasarkan deteksi secara serologi
dengan TBIA (Sether et al. 2001).
Antibodi monoklonal spesifik PMWaV-1 dan PMWaV-2 yang digunakan
dalam uji TBIA menunjukkan reaksi kuat terhadap antigen PMWaV, dan tidak
terdapat reaksi silang terhadap tanaman sehat pada blot membran. Hasil
pewarnaan dengan BCIP/NBT terhadap antigen yang ditunjukkan dengan warna
ungu, terlihat jelas terletak pada jaringan pembuluh daun tanaman yang terinfeksi
Gambar 3 Tissue blot dari potongan daun nanas. Kiri: daun nanas sehat (1,2), *) reaksi tidak spesifik, daun nanas terinfeksi PMWaV-1 (3). Kanan: daun nanas sehat (1,2,5), daun nanas terinfeksi PMWaV-2 (3,4).
Hasil penelitian ini menunjukkan bahwa distribusi PMWaV pada jaringan
tanaman nampaknya terlokalisir pada jaringan tertentu pada tanaman nanas yaitu
jaringan pembuluh. Hasil ini mendukung laporan sebelumnya yang dipublikasikan
oleh Hu et al. (1997) yang melaporkan bahwa antigen PMWaV terdeteksi dengan
TBIA pada daun muda dan daun berumur sedang, sebagaimana juga pada akar,
tetapi tidak pada daun tua. Dalam setiap individu daun yang diuji, virus terdapat
pada green leaf lamina, basal white tissue, dan pertengahan antara kedua jaringan
tersebut. Bagian basal white tissue daun adalah yang paling sering digunakan
untuk uji TBIA terhadap PMWaV. Bagi tanaman yang telah menghasilkan buah,
deteksi PMWaV dengan TBIA lebih baik dengan menggunakan daun dari
mahkota (Hu et al. 1997).
Pemurnian PMWaV dan Visualisasi Morfologi Partikel PMWaV Menggunakan Mikroskop Elektron
Pemurnian PMWaV menggunakan diferensial sentrifugasi yang diikuti
partikel virus yang bervariasi antar fraksi. Analisis spektrofotometri terhadap hasil
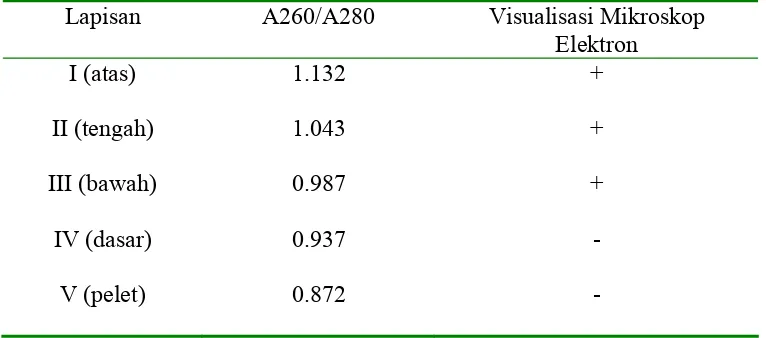
purifikasi PMWaV memberikan nilai Nilai A260/A280 dari setiap lapisan fraksi
pemurnian berkisar antara 0,872 sampai 1,132 (lampiran). Hasil ini lebih kecil
dari hasil yang didapatkan oleh CABI (2003) yang melaporkan data A260/A280
pada hasil purifikasi PMWaV sebesar 1,8 dan sebesasar 1.21 untuk Apple
Mealybug-Transmitted Little Cherry Virus yang juga merupakan anggota dari
Closterovirus (Eastwell & Bernady 2001). Rendahnya hasil nilai A260/A280 yang
didapatkan pada penelitian ini diduga karena rendahnya konsentrasi virus yang
terdapat dalam sampel tanaman dan sulitnya memurnikan virus untuk kelompok
Closterovirus karena umumnya virus ini menginfeksi jenis tanaman “keras”.
Namun demikian, dari hasil penelitian ini dapat dikatakan bahwa sentrifugasi
diferensial dengan cesium sulfat merupakan metode yang cukup baik digunakan
untuk purifikasi PMWaV dari tanaman nanas, karena hasil purifikasi dapat
terdeteksi secara serologi dan partikel dapat terlihat dibawah mikroskop elektron
(Tabel 4).
Fraksi-fraksi hasil pemurnian dengan gradien cesium sulfat kemudian
divisualisasi dengan mikroskop elektron. Berdasarkan pengamatan menggunakan
mikroskop elektron, partikel PMWaV yang teramati berbentuk batang lentur
dengan ukuran panjang yang tidak seragam. Visualisasi partikel PMWaV secara
utuh tidak didapatkan pada penelitian ini dikarenakan ukuran partikel PMWaV
yang panjang. Hal ini tidaklah mengherankan mengingat anggota-anggota virus
tanaman yang tergolong dalam famili Closteroviridae termasuk PMWaV,
memiliki ukuran terpanjang diantara anggota-anggota famili dari kelompok virus
tumbuhan lainnya. Hull (2002) mengungkapkan bahwa Beet Yellows Virus (BYV)
yang merupakan salah satu anggota Closterovirus memiliki ukuran panjang
1250-2000 nm, dibandingkan dengan ukuran potato virus Y (PVY) yang tergolong
dalam famili Potyviridae yang memiliki panjang 680-900 nm.
Gunasinghe dan German (1989) berhasil mengisolasi dan memvisualisasi
partikel PMWaV dari tanaman terinfeksi. Secara morfologi, virus ini berbentuk
batang lentur, tidak beramplop, dan memiliki panjang 1200-1500 nm. Partikel
suatu struktur lubang pada sub unit selubung protein yang merupakan
karakteristik Closterovirus.
Selain kendala ukuran PMWaV yang panjang sehingga sulit untuk
divisualisasi secara utuh, morfologi partikel PMWaV yang panjang juga rentan
terhadap perlakuan fisik yang akan memudahkan partikel-partikel virus ini patah
menjadi beberapa bagian. Banyak faktor yang dapat menyebabkan partikel
Closterovirus menjadi patah, tetapi perlakuan pada saat purifikasi diduga menjadi
faktor yang menentukan untuk dapat menghasilkan partikel PMWaV yang utuh.
Tingginya kecepatan saat sentrifugasi yang mencapai 46000 rpm selama 16 jam
diduga dapat menyebabkan partikel-partikel PMWaV menjadi patah. Sulitnya
mendapatkan partikel utuh Closterovirus untuk divisualisasi dengan mikroskop
elektron, juga sulit dilakukan terhadap pengamatan partikel tomato chlorosis virus
(ToCV) yang infeksinya terbatas pada jaringan phloem sehingga sulit untuk
mengisolasi partikel virus tanpa mematahkan partikel virusnya (Wisler et al.
1998).
Deteksi partikel PMWaV menggunakan mikroskop elektron dari beberapa
fraksi hasil pemurnian virus menunjukkan hasil yang bervariasi. Dari lima fraksi
yang didapatkan dari hasil pemurnian virus, hanya tiga fraksi teratas yang
mengandung partikel virus yaitu fraksi 1, 2, dan fraksi 3, sedangkan dua fraksi
paling bawah (fraksi 4 dan 5) tidak mengandung partikel virus (Tabel 4 dan
Lampiran). Hasil positif yang didapatkan pada fraksi 1 sampai 3 dan hasil negatif
pada fraksi 4 dan 5, diduga disebabkan oleh adanya gaya perbedaan berat massa
antara partikel virus dengan lapisan cesium sulfat saat dilakukan sentrifugasi
kecepatan tinggi dalam waktu yang lama. Hal ini menyebabkan partikel yang
memiliki berat massa lebih tinggi akan mampu menembus lapisan cesium sulfat
dan akan mengendap di lapisan bawah.
Secara umum, partikel virus berada pada fraksi ketiga, sedangkan sisa-sisa
jaringan tanaman yang masih terikut saat proses fraksinasi virus memiliki berat
massa yang lebih besar daripada partikel virus sehingga mampu menembus
cesium sulfat dan menjadi pelet pada akhir sentrifugasi. Namun dalam penelitian
bahwa pada fraksi 1 dan 2 kemungkinan merupakan “patahan” partikel PMWaV
dengan berat masa yang lebih ringan. Steere (1964) menyatakan bahwa jika
sampel larutan virus disentrifugasi dengan gradien Cs2SO4, molekul garam
berukuran berat akan bergerak ke arah dasar tabung dan kerapatan akan menjadi
stabil selama sentrifugasi. Partikel dalam larutan dengan kerapatan lebih besar
dan lebih kecil akan mengapung pada kerapatan yang sesuai dengan kondisi
[image:43.595.112.495.313.482.2]kerapatan fraksi.
Tabel 4 Visualisasi partikel PMWaV dengan mikroskop elektron hasil dari fraksi-fraksi pemurnian virus
Lapisan A260/A280 Visualisasi Mikroskop
Elektron
I (atas) 1.132 +
II (tengah) 1.043 +
III (bawah) 0.987 +
IV (dasar) 0.937 -
V (pelet) 0.872 -
+) partikel PMWaV terlihat dengan mikroskop elektron -) partikel PMWaV tidak terlihat dengan mikroskop elektron
Analisis Protein Selubung PMWaV dengan SDS-PAGE dan Western Blotting
Protein selubung PMWaV dianalisis menggunakan metode SDS-PAGE.
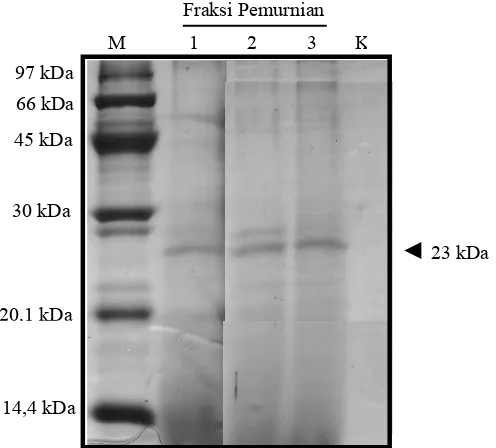
Hasil analisis menunjukkan adanya sebuah protein dari sampel hasil pemurnian
virus nanas berukuran sekitar 23 kDa (Gambar 4). Hasil ini sama dengan hasil
yang telah dilaporkan sebelumnya oleh Gunasinghe dan German (1989) pada
[image:44.595.196.444.122.346.2]
Gambar 4 Hasil separasi protein virus dengan SDS-PAGE. Lajur M, low mixture molecular-weight marker; 1, fraksi 1 pemurnian PMWaV; 2, fraksi 2 pemurnian PMWaV; 3, fraksi 3 pemurnian PMWaV; K, kontrol larutan penyangga.
Gunasinghe dan German (1989) melaporkan bahwa adanya sebagian
preparasi murnian virus terdapat satu protein besar dan beberapa protein yang
memiliki komponen berat molekul yang lebih rendah dalam virus murni. Analisis
elektroforesis fraksi dari hasil purifikasi dimulai dengan sampel yang tidak
terinfeksi menunjukkan sejumlah protein minor dengan berat molekul yang
beragam tetapi tanpa pita yang dominan. Pita protein yang dominan ditunjukkan
pada gambar 4 lajur 1, 2, dan 43, sedangkan lajur K merupakan kontrol larutan
penyangga sebagai pembanding. Analisis regresi log berat molekuler terhadap
mobilitas digunakan untuk mendapatkan persamaan yang dapat digunakan untuk
memperkirakan berat molekul protein selubung PMWaV yaitu sebesar 23,8 kDa.
Protein dengan ukuran sebesar ini konsisten dengan protein selubung
partikel virus dari famili Closterovirus yang berkisar antara 20-35 kDa. Eastwell
dan Bernardy (2001) melaporkan ukuran protein selubung Little cherry virus yang
juga merupakan anggota Closterovirus adalah sebesar 21,6 kDa. Ukuran protein
M 1 2 3 K
14,4 kDa 20,1 kDa
30 kDa
◄23 kDa 45 kDa
66 kDa 97 kDa
selubung sebesar 35 kDa dilaporkan oleh Ling et al. (1998) yang bekerja dengan
protein selubung Grapevine Leafroll-associated Virus -3.
Hasil separasi protein dengan SDS-PAGE kemudian dikonfirmasi dengan
menganalisis protein menggunakan antibodi monoklonal spesifik untuk
PMWaV-1 dan PMWaV-2 dengan metode Western Blotting. Hasil analisis menunjukkan
adanya pita tunggal pada lajur sampel fraksi pemurnian virus. Antibodi
monoklonal PMWaV-1 mampu mendeteksi protein selubung dari sampel
pemurnian virus yang mengandung PMWaV-1 (Gambar 5A). Hasil serupa juga
didapatkan pada PMWaV-2 yang dapat mendeteksi protein selubung PMWaV-2
pada analisis Western Blot (Gambar 5B). Hasil ini menunjukkan bahwa bahan
tanaman yang digunakan untuk pemurnia virus telah terinfeksi ganda oleh
[image:45.595.127.533.383.568.2]PMWaV-1 dan PMWaV-2.
Gambar 5 Analisis Western Blotting terhadap protein selubung PMWaV. Elektroforesis protein yang telah didenaturasi dilakukan pada 10% SDS-PAGE. (A). Pita protein yang terdeteksi dengan antibodi PMWaV-1. (B). Pita protein yang terdeteksi dengan antibodi PMWaV-2. Lajur 1-5 pada gambar A dan B berturut-turut mewakili fraksi 1 sampai 5 dari hasil pemurnian virus.
1 2 3 4 5
23 kDa ► ◄ 23 kDa
1 2 3 4 5
Deteksi Asam Nukleat PMWaV dengan RT-PCR
Deteksi asam nukleat PMWaV dilakukan dengan RT-PCR menggunakan
primer spesifik PMWaV-1 (225 dan 226) dan PMWaV-2 (223 dan 224) dari
genom HSP 70, menghasilkan ukuran amplikon yang berbeda antara PMWaV-1
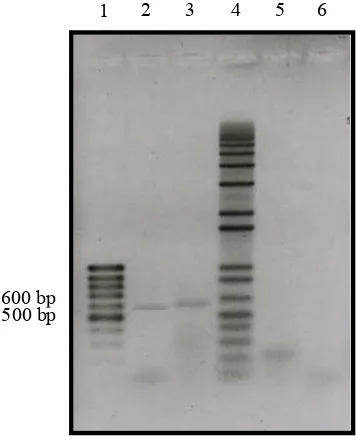
dan PMWaV-2. Produk DNA RT-PCR diseparasi pada 1,2% gel agarose TBE
menunjukkan amplikon berukuran 589 bp yang dihasilkan oleh sepasang primer
225 (forward) dan 226 (reverse) yang dapat mendeteksi keberadaan PMWaV-1,
dan Amplikon RT-PCR sebesar >609 bp dihasilkan oleh sepasang primer 223
[image:46.595.208.386.321.541.2](forward) dan 224 (reverse) yang mendeteksi PMWaV-2 (Gambar 6).
Gambar 6 Deteksi dan diferensiasi PMWaV-1 dan PMWaV-2 menggunakan RT-PCR. Lajur 1, 100 bp DNA ladder; lajur 2, tanaman terinfeksi PMWaV-1; lajur 3, tanaman terinfeksi PMWaV-2, lajur 4, 1 kb plus DNA ladder; lajur 5 dan 6, tanaman sehat.
Penggunaan primer spesifik PMWaV 223/224 dan 225/226 mampu
membedakan infeksi PMWaV-1 dan PMWaV-2 (Sether et al. 2001). Amplikon
berukuran 589 bp yang diproduksi oleh pasangan primer spesifik 225/226
(PMWaV-1) mampu mendeteksi infeksi tunggal PMWaV-1 dan infeksi ganda
PMWaV-1 dan PMWaV-2 secara bersamaan. Hasil yang sama juga didapatkan
pada deteksi dengan RT-PCR menggunakan pasangan primer spesifik 223/224
600 bp 500 bp
yang mampu mendeteksi infeksi PMWaV-2 baik infeksi tunggal maupun infeksi
ganda dengan PMWaV-1. Sether et al. (2001) juga mampu mendeteksi PMWaV
dengan RT-PCR menggunakan primer spesifik tersebut pada organ bunga nanas.
Organ bunga yang merupakan bagian yang sulit dideteksi PMWaV bila hanya
menggunakan uji TBIA.
Analisis Runutan dan Hubungan Kekerabatan PMWaV Indonesia dengan Anggota Famili Closterovirus Lainnya
Perunutan DNA PMWaV hasil RT-PCR menggunakan sepasang primer
223 dan 224 untuk PMWaV-2 serta 225 dan 226 untuk PMWaV-1 dianalisis
menggunakan software Wu-Blastn (www.ebi.ac.uk). Hasil perunutan menunjukkan
homologi yang tinggi antara PMWaV isolat Indonesia dengan yang ada pada Gen
Bank. Runutan nukleotida PMWaV-1 Indonesia memiliki homologi sebesar 96%
dengan runutan nukleotida PMWaV-1 yang ada pada Gen Bank (accession
number AF414119). PMWaV-2 Indonesia memiliki homologi sebesar 98%
dengan runutan nukleotida PMWaV-2 yang ada pada Gene Bank (accession
number AF283103).
Melzer et al. (2001) melaporkan organisasi genom PMWaV-2 secara
keseluruhan dan mengungkapkan bahwa PMWaV-2 memiliki 10 open reading
frame (ORF) yaitu ORF 1a mengkode Helicase, 1b mengkode RNA-dependent
RNA polymerase (RdRp), ORF 2 mengkode protein p5, ORF 3 mengkode Heat
Shock Protein 70 homologue (HSP 70), ORF 4 mengkode p46, ORF 5 mengkode
protein selubung, ORF 6 mengkode duplikat protein selubung, ORF 7 mengkode
protein p20, ORF 8 mengkode protein p22, dan ORF 9 mengkode protein p6.
Runutan nukleotida PMWaV-1 Indonesia dengan PMWaV-1 Hawaii
memperlihatkan adanya 9 basa yang tidak sama (mismatch), 1 basa yang tidak ada
(delesi), dan 3 basa yang bertambah (insersi). Urutan basa yang tidak sama yaitu
T6112C, T6115C, A6149C, A6151C, A6242G, T6316C, T6374A, A6389G,
T6414C, sedangkan basa delesi yaitu A6229-, dan basa-basa insersi yaitu -6427A,
Runutan nukleotida PMWaV-2 Indonesia dengan PMWaV-2 Hawaii
memperlihatkan adanya 6 basa yang tidak sama (mismatch), dan 1 basa yang tidak
ada (delesi). Basa-basa yang tidak sama yaitu C8197A, A8378C, G8391A,
A8647G, A8772T, C8789G, sedangkan basa-basa yang tidak ada yaitu C8509-,
A8654-, dan G8855- (Gambar 7).
(A)
PMWaV1_Ina: 1 ACAGGAAGGACAACACTCACGCCATAGGTTTGGGGGCACTGTTGGAAAAAGACTTAGAGG 60 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| PMWaV1_Haw: 5958 ACAGGAAGGACAACACTCACGCCATAGGTTTGGGGGCACTGTTGGAAAAAGACTTAGAGG 6017
PMWaV1_Ina: 61 TTTATCGTGATATAAAAAGGTATTTCGGACTCAACAAGTTCAACAAAGATGTGTATCTCG 120 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| PMWaV1_Haw: 6018 TTTATCGTGATATAAAAAGGTATTTCGGACTCAACAAGTTCAACAAAGATGTGTATCTCG 6077
PMWaV1_Ina: 121 ATAAATTGAAACCCACAATCGAGGTAGTGATTGATGATTGGGGTTGTCCTATAGGACCAG 180 |||||||||||||||||||||||||||||||||| || |||||||||||||||||||||| PMWaV1_Haw: 6078 ATAAATTGAAACCCACAATCGAGGTAGTGATTGACGACTGGGGTTGTCCTATAGGACCAG 6137
PMWaV1_Ina: 181 TAGACGGTGCGAGAGGGAAAGCCAAATCAGTTCTCACTTTAGCCTCTGATTTTATAACGG 240 ||||||||||| | |||||||||||||||||||||||||||||||||||||||||||||| PMWaV1_Haw: 6138 TAGACGGTGCGCGCGGGAAAGCCAAATCAGTTCTCACTTTAGCCTCTGATTTTATAACGG 6197
PMWaV1_Ina: 241 GATTGGTACAACTAGCGATCA-GATGACGAATCAACAAGTATCTGTATCTGTTTGTTCAG 299 ||||||||||||||||||||| |||||||||||||||||||||||| ||||||||||||| PMWaV1_Haw: 6198 GATTGGTACAACTAGCGATCAAGATGACGAATCAACAAGTATCTGTGTCTGTTTGTTCAG 6257
PMWaV1_Ina: 300 TACCAGCAGCTTACAATTCTTATCAAAGGGGTTTTATTTTTGAAAGTTGTAAGTTGAGTT 359 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||| | PMWaV1_Haw: 6258 TACCAGCAGCTTACAATTCTTATCAAAGGGGTTTTATTTTTGAAAGTTGTAAGTTGAGCT 6317
PMWaV1_Ina: 360 CTATAGATGTGCAGGCGGTAGTAAACGAACCGACCGCAGCTGGATTGAGTGCTTTCTTAA 419 |||||||||||||||||||||||||||||||||||||||||||||||||||||||| ||| PMWaV1_Haw: 6318 CTATAGATGTGCAGGCGGTAGTAAACGAACCGACCGCAGCTGGATTGAGTGCTTTCATAA 6377
PMWaV1_Ina: 420 CTACCCCGAAAACTTCTGTGAATTATTTGTTAGTCTATGATTTCGGAGGAAGGCACTTTT 479 ||||||||||| ||||||||||||||||||||||||| |||||||||||| ||||||||| PMWaV1_Haw: 6378 CTACCCCGAAAGCTTCTGTGAATTATTTGTTAGTCTACGATTTCGGAGGA-GGCACTTTT 6436
PMWaV1_Ina: 480 GATAGTTCCTTACTCGTGGTTGGGGGTGCGTTACGTGGGGAGTACTGGATTCGATGGGAG 539 ||||||||||||||||||||||||||||||| ||||||| |||||||||||||||||||| PMWaV1_Haw: 6437 GATAGTTCCTTACTCGTGGTTGGGGGTGCGT-ACGTGGG-AGTACTGGATTCGATGGGAG 6494
PMWaV1_Ina: 540 ATAACTATCTGGGAGGCAGGGACGTAGATAACAGATTGCTTGAAGTTTGTGCG 592 ||||||||||||||||||||||||||||||||||||||||||||||||||||| PMWaV1_Haw: 6495 ATAACTATCTGGGAGGCAGGGACGTAGATAACAGATTGCTTGAAGTTTGTGCG 6547
(B)
PMWaV2_Ina 1 CATACGAACTAGACTCATACGTGCTAAAATTAAAACCAGTGCGCAGAGTG 50 |||||||||||||||||||||||||||||||||||||||||| |||||||
PMWaV2_Haw 8155 CATACGAACTAGACTCATACGTGCTAAAATTAAAACCAGTGCACAGAGTG 8204
PMWaV2_Ina 51 GAAGTGTTCAAGGACGGGTCGGTAATGCTAGGGGGTATTGGTGAAGGCCC 100 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Ina 101 TGATAGGACGGTCTCTGTAACGGATATCATATCCCTTGTTTCTAAAGGAC 150 ||||||||||||||||||||||||||||||||||||| ||||||||| ||
PMWaV2_Haw 8255 TGATAGGACGGTCTCTGTAACGGATATCATATCCCTTTTTTCTAAAGCAC 8304
PMWaV2_Ina 151 TTATAAAGGAAGCGGAACAGTCTACTGGACTACGCGTAACGGGTGCGGTG 200 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8305 TTATAAAGGAAGCGGAACAGTCTACTGGACTACGCGTAACGGGTGCGGTG 8354
PMWaV2_Ina 201 GTAACGGTACCAGCCGACTACAAATCTTTTAAACGTGGTTTTATAACTAA 250 ||||||||||||||||||||||| |||||||||||| |||||||||||||
PMWaV2_Haw 8355 GTAACGGTACCAGCCGACTACAACTCTTTTAAACGTAGTTTTATAACTAA 8404
PMWaV2_Ina 251 CTGCATGAAAGACTTGGGTATTCCAGTAAGGGCTATAGTAAATGAACCGA 300 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8405 CTGCATGAAAGACTTGGGTATTCCAGTAAGGGCTATAGTAAATGAACCGA 8454
PMWaV2_Ina 301 CCCCGGCAGCGTTATATTCTTTATCTATATTACAAGAAAAGGATTTATTT 350 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8455 CCCCGGCAGCGTTATATTCTTTATCTATATTACAAGAAAAGGATTTATTT 8504
PMWaV2_Ina 351 CTGT-GGCTTTTGACTTTGGTGGAGGGACGTTTGATGTGTCTTTTGTTAG 400 |||| |||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8505 CTGTCGGCTTTTGACTTTGGTGGAGGGACGTTTGATGTGTCTTTTGTTAG 8554
PMWaV2_Ina 401 AAAACTCGG-GATGTGGTATGCGTACTGCTTAGCGTTGGCGATAACTTTT 449 ||||||||| ||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8555 AAAACTCGGAGATGTGGTATGCGTACTGCTTAGCGTTGGCGATAACTTTT 8604
PMWaV2_Ina 450 TAGGGGCAAGGGATATCGACAGGGCGGTAGCAGCTGAGGTGAAAGCAAGA 499 ||||||||||||||||||||||||||||||||||||||||||| ||||||
PMWaV2_Haw 8605 TAGGGGCAAGGGATATCGACAGGGCGGTAGCAGCTGAGGTGAAGGCAAGA 8654
PMWaV2_Ina 500 GTGGGCGAATCTATCGATACAGCTACATTGTCATTATTTGCAGCGTCTAT 549 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8655 GTGGGCGAATCTATCGATACAGCTACATTGTCATTATTTGCAGCGTCTAT 8704
PMWaV2_Ina 550 TAAAGAGGAGGTAACTAATGAGCCGAGGGCAAAGACGCACGTAGTAAAAT 599 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8705 TAAAGAGGAGGTAACTAATGAGCCGAGGGCAAAGACGCACGTAGTAAAAT 8754
PMWaV2_Ina 600 TGGTGGATGGCGTGAAACATATAACTTTCACGTCTCAAGACTTAAATGAT 649 |||||||||||||||||| |||||||||||||||| ||||||||||||||
PMWaV2_Haw 8755 TGGTGGATGGCGTGAAACTTATAACTTTCACGTCTGAAGACTTAAATGAT 8804
PMWaV2_Ina 650 ATAGTTCGTCCGTTTGCCGCTAGGGCGCTACACATATATGAGCAGGCGGC 699 ||||||||||||||||||||||||||||||||||||||||||||||||||
PMWaV2_Haw 8805 ATAGTTCGTCCGTTTGCCGCTAGGGCGCTACACATATATGAGCAGGCGGC 8854
PMWaV2_Ina 700 -CAACGATACCATCCTGAAACGT 722 ||||||||||||||||||||||
[image:49.595.115.504.113.642.2]PMWAV2_Haw 8855 GCAACGATACCATCCTGAAACGT 8877
Gambar 7 Alignment antara genom HSP 70 PMWaV Indonesia dengan genom PMWaV yang terdapat pada Gen Bank (www.ncbi.nlm.nih.gov). (A)
Hasil alignment antara isolat PMWaV Indonesia dengan isolat PMWaV
Hawaii yang menunju