EVALUASI FISIKOKIMIA BUNGKIL INTI SAWIT
TERFERMENTASI OLEH KOKTAIL MIKROBA
TIURMA PASARIBU
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOBOR
PERNYATAAN MENGENAI TESIS
Dengan ini saya menyatakan bahwa tesis “Evaluasi Fisikokimia
Bungkil Inti Sawit Terfermentasi Oleh Koktail Mikroba” adalah karya saya dengan arahan dari komisi pembimbing dan bukan hasil jiplakan atau tiruan serta belum diajukan dalam bentuk apapun kepada perguruan tinggi lain manapun.Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.ABSTRACT
TIURMA PASARIBU. Physicochemical Evaluation of Palm Kernel Meal Fermented by Microbes Cocktail. Under direction by Erika B. Laconi and I.P. Kompiang.
Utilization of palm kernel meal as a feed ingredient is limited by the high fiber and low protein. The aim of this research is to improve the nutritive value of palm kernel meal with fermentation technology by using Bacillus amyloliquefacien, Trichoderma harzianum, and cocktail microbes (combination of Bacillus amyloliquefacien and Trichoderma harzianum). Bacillus amyloliquefaciens was produced as Wizna et al. (2005). The source of Trichoderma harzianum was from Balitnak. Three kinds of microbes were used with 3 replicates, i.e. T1 (Bacillus amyloliqueyfacien), T2 (Trichoderma harzianum), T3 (cocktail mikrobes) as a treatment and incubation period as a second factor i.e P1 (0 day), P2 (3 days), P3 (5 days), and P4 (7 days). Parameter were crude protein and crude fiber for all treatment, and the lowest fiber analysis would continue with NDF, ADF, crude fat, organic matter, amino acid, and cellulase, mannanase activity. Result showed that the three of microbes grew on palm kernel meal in third incubation and grew on and in the substrat at 7 days. Cocktail microbes better enhanced protein and reduced crude fiber than Bacillus amyloliqueyfacien andTrichoderma harzianum. Cocktail microbes enhanced amino acid such as methionin, arginin and glutamic acid, also neutral detergent fiber, but reduced acid detergent fiber,and hemicellulase. Cellulase and mannanase activity were increasing after fermentation. It is concluded that cocktail microbes decreased crude fiber and improved crude protein in 7 days incubation.
RINGKASAN
TIURMA PASARIBU. 2010. Evaluasi Fisikokimia Bungkil Inti Sawit Terfermentasi oleh Koktail Mikroba. Dibimbing oleh ERIKA B. LACONI dan I. P. KOMPIANG.
Bungkil inti sawit (palm kernel cake/meal) merupakan hasil ikutan pada proses pemisahan minyak inti sawit yang diperoleh secara kimiawi atau dengan proses fisik. Bungkil inti sawit (BIS) mengandung kadar protein 15,73-17,19% lemak 9,5-10,5%, dan serat kasar 12-18 %. (Chong et al., 1998) lebih rendah bila dibandingkan dengan kadar protein kasar bungkil kedele yang memiliki: 42 – 50 % serta bungkil kacang tanah mengandung 45 – 50 %. Dengan komposisi nutrien tersebut BIS berpotensi sebagai bahan pakan, baik untuk non-ruminan maupun ruminansia. Pemberian BIS pada ruminansia tidak menjadi masalah namun pada non-ruminan seperti ayam menjadi suatu masalah karena kandungan seratnya yang tinggi. Tingginya kandungan serat kasar dan kandungan protein menengah menyebabkan nilai nutrisinya menjadi rendah karena ternak non ruminan tidak mampu mencerna bahan pakan dengan kandungan serat yang tinggi. Untuk memperbaiki nilai nutrisi bungkil inti sawit tersebut dilakukan suatu upaya yaitu dengan teknologi fermentasi dengan menggunakan koktail mikroba (kombinasi antara bakteri Bacillus amyloliquifacien
dan kapang Trichoderma harzianum). Penelitian ini bertujuan untuk mengevaluasi fisikokimia bahan pakan bungkil inti sawit melalui teknologi fermentasi dengan menggunakan koktail Penelitian Ternak Ciawi Bogor mulai Desember 2009 hingga Mei 2010. Mikroba yang digunakan adalah Bacillus amyloliquefaciens diperoleh dari kultur pemurnian yang diambil dari serasah hutan, dengan CFU 18,7x1016 dan
Trichoderma harzianum siap pakai yang diperoleh dari Balitnak dengan CFU 3,3x102
Perbanyakan Bacillus amyloliquefaciens dilakukan menurut Kompiang. Teknik fermentasi dilakukan dengan mencampurkan Bacillus amyloliquefaciens atau
Trichoderma harzianum ke dalam bungkil inti sawit dengan perbandingan 1:1. Koktail mikroba dilakukan dengan mencampurkan B. amyloliquefaciens dan T. harzianum ke dalam bungkil inti sawit dengan perbandingan 1:1:2 (L/kg), yang diinkubasi selama 7 hari pada suhu +30
. Penghitungan jumlah mikroorganisme dengan cara viable count (standard plate count/SPC), didasarkan pada asumsi bahwa setiap sel mikroorganisme hidup dalam suspensi akan tumbuh menjadi satu koloni setelah diinkubasi dalam media biakan. Setelah inkubasi, semua koloni yang terbentuk dihitung pada kisaran 30-300 koloni dan dicatat pada tiap dilusi yang berbeda.
o
Rancangan acak lengkap pola faktorial dengan 3 macam mikroba (T1=Bacillus amyloliquefacien T2= Trichoderma harzianum; T3= koktail mikroba (kombinasi
Bacillus amyloliquefacien dan Trichoderma harzianum) dan 4 jenis lama inkubasi (P1 = 0 hari; P2= 3 hari; P3=5 hari;P4=7 hari) sebanyak 3 ulangan. Bila uji ANOVA terdapat perbedaan yang nyata maka analisis dilanjutkan dengan uji lanjut orthogonal comparison (Steel dan Torrie, 1995). Analisis regresi dilakukan pada masing-masing mikroba..
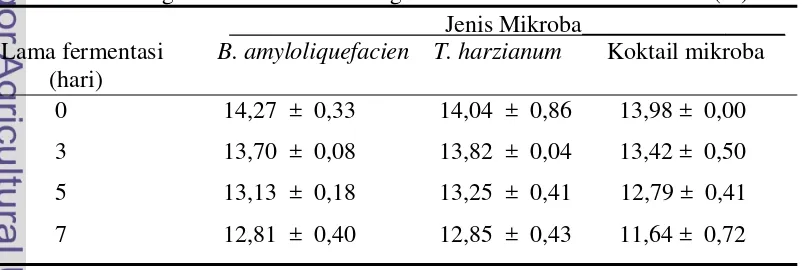
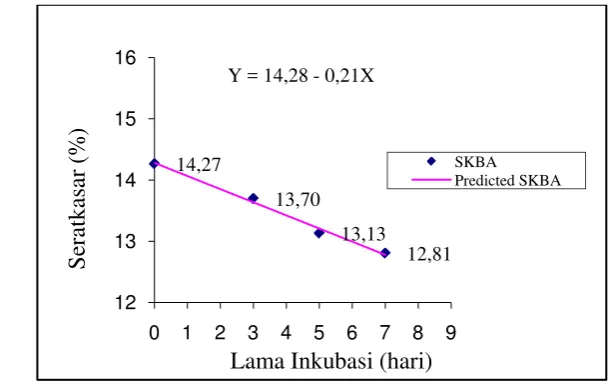
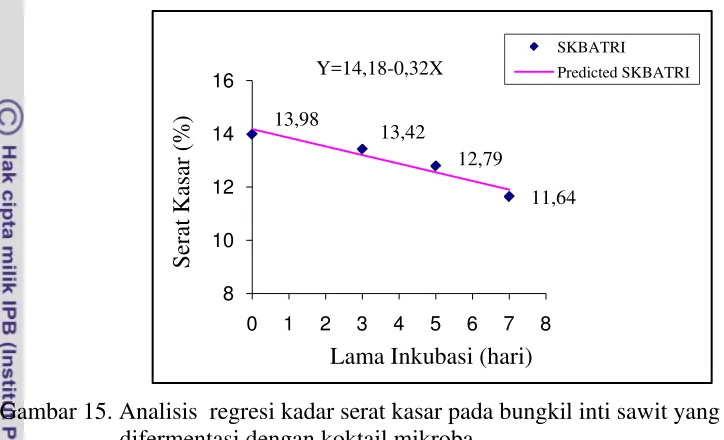
Hasil penelitian menunjukkan pada inkubasi ke tujuh pertumbuhan B. amyloliquifacien, T. harzianum, dan koktail mikroba mencapai 100% di permukaan hingga tumbuh ke dalam substrat. Kehilangan bahan kering bungkil inti sawit selama fermentasi, pada perlakuan B. amyloliquifacien tertinggi (16,28 +3.79%), kedua T. harzianum (11.85+ 4.27%) dan perlakuan terendah diantara ketiganya ditunjukkan oleh koktail mikroba (8,90+2.83%). Selama fermentasi menunjukkan penurunan kadar serat kasar, dan tidak terdapat interaksi antara perlakuan mikroba dengan lama inkubasi. Perlakuan dengan T. harzianum menunjukkan penurunan lebih kecil (12.85 ± 0.43) dibandingkan B. amyloliquifacien (12.81 ± 0.40) dan koktail mikroba (11.64 ± 0.72). Analisis statistik regresi untuk kadar serat kasar yang difermentasi oleh ketiga perlakuan nyata (P<0,05) menunjukkan penurunan yang bersifat linear, masing-masing B. amyloliquifacien dengan persamaan Y=14,28-0,21X dan koefisien korelasi 0.99, T. harzianum dengan persamaan Y=14,15-0,18X dengan koefisien korelasi 0.94, dan koktail mikroba dengan persamaan Y=14,18-0,32X dengan koefisien korelasi 0.93.
Secara statistik dengan rancangan acak lengkap pola faktorial inkubasi 7 hari tidak ada perbedaan diantara perlakuan mikroba. Namun lamanya fermentasi (0-7 hari) mempunyai pengaruh yang nyata (P<0,05) terhadap peningkatan protein dari 21,95 menjadi 28,54 % pada B. amyloliquefaciens, dari 23,00 menjadi 28,54 % pada
T. harzianum, serta dari 21,66 % menjadi 28,68 % pada koktail mikroba.
Komposisi kimia bungkil inti sawit setelah difermentasi dengan koktail mikroba menunjukkan peningkatan protein kasar (21,66 menjadi 28,68 %) dan serat deterjen asam (ADF) (42,21 menjadi 45,95 g/100g), sedangkan kadar serat menurun dari 13,98 menjadi 11,64%, serat deterjen netral (NDF) (dari 62,99 menjadi 56,39 g/100g), hemiselulosa (dari 20,78 menjadi 10,44 g/100g), serta lemak kasar (12,23 menjadi 11,46 g/100g) dan abu menurun dari 6,81 menjadi 4,34 g/100g. Demikian juga kandungan asam amino terjadi peningkatan pada methionin (dari 0,71 menjadi 0,73 %), asam glutamat (dari 2,62 menjadi 3,08), dan arginin dari (1,88 menjadi 2,41 %), sedangkan asam amino lainnya tidak mengalami peningkatan. Selama fermentasi terjadi kenaikan aktivitas enzim selulase (dari 0,025 menjadi 0,468 BK (µ/ml) dan mananase (dari 0,027 menjadi BK (µ/ml). Disimpulkan bahwa fermentasi dengan koktail mikroba (kombinasi pertumbuhan B. Amyloliquefaciens dan T. harzianum) dapat menurunkan kadar serat kasar dan meningkatkan kadar protein bungkil inti sawit.
@ Hak Cipta milik IPB, tahun 2010 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
EVALUASI FISIKOKIMIA BUNGKIL INTI SAWIT
TERFERMENTASI OLEH KOKTAIL MIKROBA
TIURMA PASARIBU
Tesis
Sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Mayor Ilmu Nutrisi dan Pakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOBOR
Judul Tesis : Evaluasi Fisikokimia Bungkil Inti Sawit Terfermentasi oleh Koktail Mikroba
Nama : Tiurma Pasaribu
NRP : D152080071
Program Studi/Mayor : Ilmu Nutrisi dan Pakan
Disetujui Komisi Pembimbing
Dr. Ir. Erika B. Laconi, M.S.
Ketua Anggota
Prof. Ris. Dr. I. Putu Kompiang
Diketahui
Ketua Departemen Dekan Sekolah Pascasarjana IPB
Ilmu Nutrisi dan Teknologi Pakan
Dr. Ir. Idat Galih Permana, M.Sc. Agr. Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Terima kasih dan kemuliaan bagi Tuhan Maha Pengasih dan Penyayang atas segala berkat yang diberikan-Nya selama proses pelaksanaan mulai dari pembuatan proposal, penelitian hingga penulis dapat menyelesaikan karya tesis ini. Tesis disusun berdasarkan hasil penelitian yang dilakukan di Balai Penelitian Ternak Ciawi Bogor mulai Desember 2009 hingga Mei 2010 dengan judul “Evaluasi Fisikokimia Bungkil Inti Sawit Terfermentasi oleh Koktail Mikroba”.
Pada kesempatan ini penulis mengucapkan terimakasih yang tulus dan setinggi-tingginya kepada Dr. Ir. Erika B. Laconi MS dan Prof. Dr. I.P. Kompiang selaku pembimbing atas kesabaran, penyediaan waktu dan masukan selama proses pembimbingan. Ucapan terima kasih kepada Dr. Ir. Ahmad Darobin Lubis, M.Sc. selaku dosen penguji dan Dr. Ir. Dwierra Evvyernie A. MS. M.Sc. yang telah banyak memberikan masukan dan saran untuk kesempurnaan tesis ini. Terima kasih kepada Dr. Luki Abdullah, M.Sc selaku Dekan Fakultas Peternakan Institut Pertanian Bogor serta Dr. Ir. Idat Galih Permana, M.Sc. Agr. selaku Ketua Departemen yang telah memberi saran pada saat pembuatan proposal. Terima kasih kepada Dr. Sofjan Iskandar yang telah memberi peluang dan Bapak kepala Balai Penelitian Ternak Prof. Ir. Bambang Sudaryanto MS yang selalu mendukung pendidikan. Kepada para peneliti, Dr. A.P. Sinurat, Ir. I.A.K. Bintang, MS, Dr. T. Purwadaria, yang telah memberikan masukan dalam penulisan ini. Kepada Helmi Hamid, Emi Sujatmika, Emma Frederick, dan rekan lainnya yang telah meluangkan waktunya untuk membantu pelaksanaan penelitian di laboratorim Balai Penelitian Ternak. Kepada Dr.Wizna yang telah memberikan inokulum B. amyloliquefacien. Terimakasih untuk E. Tobing yang mungkin terabaikan selama penelitian. Ucapan kasih sayang yang tak pernah berhenti untuk anakku Samantha J. Blandina dan Rachel Daniella, serta keluarga besarku, Tuhan memberkati kita semua. Amin
RIWAYAT HIDUP
Penulis dilahirkan di Parsoburan (TAPUT) pada tanggal 11 Desember 1962 dari Bapak D. Pasaribu dan Ibu T.K. Pardosi (almarhum). Penulis merupakan anak kelima dari sepuluh bersaudara.
DAFTAR ISI
2.1 Potensi Bungkil Inti Sawit sebagai Bahan Pakan Unggas 2.2 Fermentasi ... 5
2.4 Selulosa sebagai Komponen Serat Kasar Tanaman ... 12
2.5 Enzin Selulase ... 13
3.5 Kehilangan Bahan Kering ... 22
Halaman
3.7 Penentuan Protein Kasar ... 24
3.8 Penentuan Serat Kasar ... 23
3.9 Penentuan Serat Deterjen Netral (NDF) ... 23
3.10 Penentuan Serat Deterjen Asam (ADF) ... 25
3.11 Penentuan Asam Amino Esensial ... 26
3.12 Uji Aktivitas Enzim Selulase ... 27
3.13 Uji Aktivitas Enzim Mananase ... 28
3.14 Rancangan Percobaan ... 29
4 HASIL DAN PEMBAHASAN ... 31
4.1 Pertumbuhan 4.2 B. amyloliquifacien pada Substrat Bungkil Inti Sawit ... 31
Kehilangan Bahan Kering Selama Proses Fermentasi Bungkil Inti Sawit 4.3 Pengaruh Fermentasi terhadap Kandungan Serat Kasar Bungkil ... 34
Inti Sawit ... 36
4.3.1 Pengaruh Lama Fermentasi Terhadap Kandungan Serat Kasar Bungkil Inti Sawit oleh B. amyloliquifacien ... 37
4.3.2 Pengaruh Lama Fermentasi Terhadap Kandungan Serat Kasar Bungkil Inti Sawit oleh T. harzianum ... 39
4.3.3 Pengaruh Lama Fermentasi Terhadap Kandungan Serat Kasar Bungkil Inti Sawit yang Difermentasi oleh Koktail Mikroba ... 40
4.4 Pengaruh Fermentasi terhadap Kandungan Protein Kasar Bungkil Inti Inti Sawit ... 41
4.4.1 Kasar Bungkil Inti Sawit oleh B. amyloliquifacien... 43
Pengaruh Lama Fermentasi Terhadap Kandungan Protein 4.4.2 Kasar Bungkil Inti Sawit oleh T. harzianum ... 44
Pengaruh Lama Fermentasi Terhadap Kandungan Protein 4.4.3 Kasar Bungkil Inti Sawit oleh Koktail Mikroba ... 45
Pengaruh Lama Fermentasi Terhadap Kandungan Protein 4.5 Perubahan Komposisi Kimia Bungkil Inti Sawit yang Difermentasi dengan Koktail Mikroba ... 46
4.6 Perubahan Asam Amino Setelah Fermentasi dengan Koktail Mikroba ... 48
4.7 Aktivitas Selulase dan Mananase Setelah Fermentasi ... 49
5 KESIMPULAN DAN SARAN ... 52
DAFTAR PUSTAKA ... 53
DAFTAR TABEL
Halaman 1. Produksi minyak kelapa sawit (crude palm oil) dan inti sawit (palm kernel)
perkebunan besar di Indonesia Tahun 2004-2008 ... 4
2. Pertumbuhan selama fermentasi aerobik (7 hari) ... 31
3. Kehilangan bahan kering bungkil inti sawit selama fermentasi (%) ... 34
4. Kandungan kadar serat kasar dari bungkil inti sawit setelah fermentasi ... 36
5. Analisis regresi kadar serat kasar yang difermentasi dengan mikroba selama masa inkubasi ... 37
6. Kandungan kadar protein kasar bungkil inti sawit selama fermentasi ... 42
7. Analisis regresi kadar protein kasar yang difermentasi dengan mikroba selama masa inkubasi ... 43
8. Komposisi protein, serat kasar, NDF, ADF, lemak, dan abu bungkil inti sawit sebelum dan sesudah fermentasi oleh koktail mikroba ... 47
9. Komposisi asam Amino esensial (AAE) bungkil inti sawit sebelum dan sesudah fermentasi oleh koktail mikroba ... 48
DAFTAR GAMBAR
Halaman
1. Pohon industri kelapa sawit ... 5
2. Bacillus amyloliquefaciens ... 8
3. Trichoderma harzianum 4. Skema rangkaian selulosa ... 12
... 10
5. Diagram dinding sel tanaman ... 12
6. Skema rangkaian selulolisis ... 13
7. Cara penghitungan jumlah mikroorganisme hidup ... 18
8. Alur pengenceran pada penghitungan mikroba ... 19
9. Skema Fermentasi ... 21
10. Pertumbuhan B. amyloliquefaciens pada substrat bungkil inti sawit ... 32
11. Pertumbuhan T. harzianum pada substrat bungkil inti sawit ... 33
12. Pertumbuhan koktail mikroba pada substrat bungkil inti sawit ... 33
13. Analisis regresi kadar serat kasar pada bungkil inti sawit yang difermentasi dengan B. amyloliquefaciens ... 38
14. Analisis regresi kadar serat kasar pada bungkil inti sawit yang difermentasi dengan T. harzianum ... 39
15. Analisis regresi kadar serat kasar pada bungkil inti sawit yang difermentasi dengan koktail mikroba ... 41
16. Analisis regresi kadar protein pada bungkil inti sawit yang difermentasi dengan B. amyloliquefaciens ... 44
17. Analisis regresi kadar protein pada bungkil inti sawit yang difermentasi dengan T. harzianum ... 45
DAFTAR LAMPIRAN
Halaman 1. Analisis ragam kadar serat kasar bungkil inti sawit terfermentasi ... 61 2. Analisis regresi kadar serat kasar bungkil inti sawit terfermentasi oleh
B. amyloliquefaciens ... 62 3. Analisis regresi kadar serat kasar bungkil inti sawit terfermentasi oleh
T. harzianum ... 63 4. Analisis regresi kadar serat kasar bungkil inti sawit terfermentasi oleh
1
I PENDAHULUAN
1.1 Latar Belakang
Indonesia, Malaysia, dan Nigeria merupakan 3 negara di dunia yang
memproduksi 84% minyak kelapa sawit. Indonesia merupakan negara terbesar
dalam menghasilkan kelapa sawit. Luas areal perkebunan kelapa sawit di Indonesia pada
tahun 2005 sekitar 5.000.000 hektar dengan total produksi crude palm oil (CPO) sekitar 14.500.000 ton (LRPI 2006).
Dari kelapa sawit diperoleh 2 jenis minyak yaitu minyak kelapa sawit
(CPO) dan minyak inti sawit (PKO/palm kernel oil). Pada pengolahan CPO
diperoleh hasil ikutan berupa serat buah sekitar 1,5-3,5 ton/ha tanaman/tahun dan
lumpur minyak sawit sekitar 3-6 ton/ha tanaman/tahun. Pada pengolahan PKO
diperoleh bungkil inti sawit sekitar 0,3-0,6 ton/ha tanaman/tahun, (Sindu 1999)
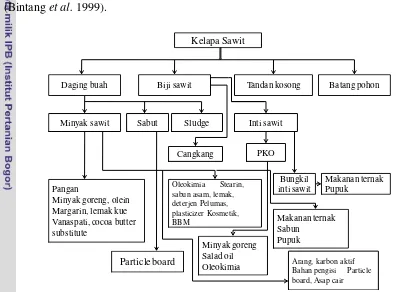
(Gambar 1).
Bungkil inti sawit (palm kernel cake/meal) merupakan hasil ikutan pada proses pemisahan minyak inti sawit yang diperoleh secara kimiawi (ekstraksi) atau dengan proses
fisik (expeller). Bungkil inti sawit (BIS) mengandung kadar protein 15,73-17,19%
lemak 9,5-10,5%, dan serat kasar 12-18 % (Chong et al. 1998; Mathius et al. 2005). Dengan komposisi nutrien tersebut BIS berpotensi sebagai bahan pakan,
baik untuk ruminansia karena mempunyai rumen, sehingga mampu mendegradasi
serat. Sedangkan untuk monogastrik seperti ayam menjadi suatu masalah karena
kandungan serat kasarnya yang tinggi. Bagi monogastrik untuk memperbaiki nilai
nutrisi bungkil inti sawit tersebut kadar serat kasar diturunkan dan kadar protein
ditingkatkan. Fermentasi dengan menggunakan koktail mikroba (kombinasi antara
bakteri
Fermentasi merupakan proses pemecaha
Bacillus amyloliquefaciens dan kapang Trichoderma harzianum) merupakan salah satu upaya untuk memperbaiki nilai nutrisi bungkil inti sawit.
Supriyati et al. (1998) melaporkan peningkatan kadar protein terjadi pada bungkil inti sawit dari 14,19 menjadi 25,06% setelah difermentasi dengan menggunakan
A. niger NRRL 337.
senyawa yang lebih sederhana yang melibatka baik kapang
pada substrat limbah agroindustri. Pada substrat lumpur sawit protein meningkat
setelah fermentasi dari 11,94 menjadi 22,59% dengan menggunakan Aspergillus niger sebagai inokulum (Pasaribu et al. 1998). Selain A. niger kemungkinan penggunaan mikroba lain seperti Bacillus amyloliquifacien dan Trichoderma harzianum atau koktail mikroba bisa dimanfaatkan untuk mendegradasi dan meningkatkan protein.
Koktail mikroba adalah campuran beberapa mikroba yang diramu menjadi
satu (Schwan 1998), dalam penelitian ini yang dicampur adalah
Penelitian ini bertujuan untuk mengevaluasi fisikokimia bahan pakan
bungkil inti sawit yang difermentasi dengan menggunakan koktail mikroba
(kombinasi antara Bacillus amyloliquefaciens dan Trichoderma harzianum). Bacillus amyloliquifacien dan Trichoderma harzianum. Penggabungan dua mikroba ini didasarkan atas peran enzim Ekso-beta-glukanase dari Bacillus amyloliquefaciens
yang memotong rantai luar polisakarida dan enzim Endo-beta-glukanase pada
Trichoderma harzianum yang memotong rantai dalam polisakarida (Wizna et al. 2005). Diharapkan teknologi fermentasi dengan menggunakan koktail mikroba
dapat menurunkan kadar serat kasar dan meningkatkan protein bungkil inti sawit.
Sehingga produknya dapat dimanfaatkan sebagai bahan pakan alternatif pada
unggas.
3
II TINJAUAN PUSTAKA
2.1 Potensi Bungkil Inti Sawit sebagai
Bungkil inti sawit (palm kernel cake/meal) merupakan hasil ikutan pada proses pemisahan minyak inti sawit dengan biomassa 45-46% dari inti sawit
Bahan Pakan Unggas
Pembangunan perkebunan kelapa sawit, baik yang dilakukan oleh
perkebunan besar maupun oleh masyarakat berkembang dengan sangat pesat.
Awal tahun 1968, areal kelapa sawit hanya terbatas di tiga wilayah (Sumatera
Utara, Aceh dan Lampung) saat ini sudah berkembang di 22 daerah Provinsi. Luas
areal tahun 1968 seluas 105.808 ha dengan produksi 167.669 ton, pada tahun
2007 telah meningkat menjadi 6,6 juta ha dengan produksi sekitar 17,3 juta ton
CPO (Ditjenbun 2008).
Kelapa sawit mempunyai peranan penting dalam perekonomian nasional.
Disamping sebagai bahan baku industri dalam negeri, juga komoditas ekspor
utama. Pada tahun 2007 total ekspor CPO Indonesia sebesar 11,08 juta ton (BPS
2009) dengan nilai US $ 7,8 milyar. Mampu menyerap tenaga kerja langsung
sebesar 3,3 juta kepala keluarga. Pengembangan kelapa sawit juga mendorong
pengembangan wilayah.
Prospek pengembangan kelapa sawit ke depan sangat bagus, tidak saja untuk
bahan baku minyak makan, oleokimia, tapi juga digunakan sebagai bahan baku
energi (bio-fuel) dan limbahnya dapat dimanfaatkan sebagai bahan pakan ternak. Melihat prospek yang bagus tersebut, pemerintah akan terus mendorong
pengembangan kelapa sawit dengan menerapkan prinsip pembangunan
berkelanjutan.
Saat ini Indonesia merupakan negara produsen kelapa sawit terbesar di
dunia. Pada tahun 2008 memiliki luas areal perkebunan 6.611 ribu ha dengan
produksi CPO 17.109 ribu ton (Ditjenbun 2008). Produksi minyak kelapa sawit
(CPO) setiap tahunnya meningkat disarikan pada Tabel 2, pada tahun 2004 sekitar 8.479,3
ribu ton dan tahun 2008 menjadi 11.406,5 ribu ton (BPS 2009). Demikian pula produksi inti
sawit menunjukkan peningkatan, dimana pada tahun 2004 sekitar 1.862,0 dan pada tahun
2008 produksinya 2.281,2 ribu-ton masing-masing setara dengan 837,9 dan
1026,5 ribu-ton bungkil inti sawit (BPS 2009).
dari bobot tandan sawit.
Bungkil inti sawit menga
Bungkil inti sawit yang merupakan bagian dari buah segar
kelapa sawit yang digunakan sebagai bahan pakan ternak dapat dilihat pada Gambar
1.
diperoleh secara kimiawi (ekstraksi) atau dengan proses fisik (expeller)
et al. 1998 melaporkan bungkil inti sawit (BIS) mengandung kadar protein yang cukup tinggi yaitu antara 14,19% sampai 17,19%, lemak 9,5-10,5%,
dan serat kasar 12-18 %. Variasi ini kemungkinan disebabkan perbedaan cara
proses pengolahan PKO, jenis sawit, kematangan buah dan lokasi tumbuhnya
kelapa sawit.
Tabel 1. Produksi minyak kelapa sawit (crude palm oil) dan inti sawit (palm kernel) perkebunan besar di Indonesia tahun 2004-2008.
Selain kandungan protein yang cukup tinggi, bungkil inti sawit memiliki
kandungan serat kasar yang tinggi pula. Bungkil inti sawit (BIS) mengandung kadar
serat kasar 12-18% (Chong et al. 1998; Mathius et al. (2005), 21,08% (Nuraini & Trisna, 2006). Walaupun kandungan serat kasarnya tinggi masih dapat
dimanfaatkan sebagai bahan pakan ternak unggas karena mempunyai kadar
protein yang cukup tinggi,
Tingginya kandungan serat kasar merupakan kendala sebagai bahan pakan
unggas karena tidak dapat dicerna, sehingga dibutuhkan teknik untuk
mendegradasi serat ke molekul yang lebih sederhana agar bisa dicerna. Salah satu dan setelah fermentasi pemanfaatan dapat lebih tinggi
teknik untuk mendegradasi serat adalah teknologi fermentasi dengan
menggunakan mikroba, baik kapang atau bakteri.
Pemanfaatan produk fermentasi untuk unggas menunjukkan pengaruh
yang positif. Bungkil kelapa terfermentasi dapat digunakan dalam ransum anak
itik jantan hingga 20% (Sinurat et al. 1996). Pada itik petelur bungkil kelapa terfermentasi dapat diberikan hingga 30% tanpa mempengaruhi produksi telur
(Sinurat et al. 1998). Pemberian bungkil inti sawit terfermentasi dengan
Aspergillus niger pada itik sedang tumbuh dapat diberikan hingga hingga 15 % (Bintang et al. 1999).
Kelapa Sawit
Daging buah Biji sawit Tandan kosong Batang pohon
Makanan ternak
Gambar 1. Pohon industri kelapa sawit
Sumbe industri-kelapa-sawit/
2.2 Fermentasi
Fermentasi adalah segala macam proses metabolik dengan bantuan enzim
dari mikroba (jasad renik) untuk melakukan oksidasi, reduksi, hidrolisa dan reaksi
kimia lainnya, sehingga terjadi perubahan kimia pada suatu substrat organik
menjadi asam amino, lemak terurai menjadi asam lemak, sehingga mempunyai
daya cerna yang lebih tinggi dan meningkatnya kandungan vitamin, terutama
golongan vitamin B. Disamping menghasilkan hidrolisat siap serap, fermentasi
juga menghasilkan biomasa mikroba yang bernilai tinggi (Buckle et al. 1987; Muchtadi 1989). Menurut jenis medianya proses fermentasi dibagi menjadi tiga
yaitu fermentasi medium padat, dimana mediumnya tidak larut (bentuk padat),
tapi cukup lembab untuk kebutuhan hidup mikroba dengan kadar air 12 –60%).
Fermentasi medium semi padat merupakan medium yang tidak larut, kelembaban
cukup dengan kadar air 65 –80%. Fermentasi medium cair adalah medium cair
dengan substrat larut dan atau tidak larut dengan kadar air >80% (Stansbury et al. 1997
Komposisi media dan kondisi lingkungan merupakan faktor yang sangat
penting untuk proses fermentasi. Jenis media ada yang komplek dan sintetik
(media mineral), dimana sekecil apapun modifikasi media dapat merubah
stabilitas sel, kualitas produk, dan proses fermentasi. Secara umum dalam media
fermentasi mengandung makronutrien berupa karbon (C), hidrogen (H), nitrogen
(N), Sulfur (S), dan Fosfat (P) , dan magnesium (Mg) yang berasal dari air,
gula-gula, lemak, asam amino, dan garam mineral. Sedangkan mikronutrien yang
dibutuhkan adalah trace element (FeSO4.7H2O; CuSO4.5H2O; H3BO3; MnSO4.4H2O; ZnSO4.7H2O; Na2MoO4; CaCl.2H2O; CoCl2.6H2O) dan vitamin. Makro dan mikronutrien dibutuhkan mikroorganisme untuk memperoleh energi,
pertumbuhan, perkembangan, dan biosintesa produk-produk metabolisme (
).
2.2.1 Media Fermentasi
Klein
et al. 2004). Demikian juga bakteri Bacillus amyloliquifacien dan kapang
Trichoderma harzianum membutuhkan media yang mengandung makro dan mikronutrien. Dilihat dari komposisi kimia, bungkil inti sawit bisa menjadi
substrat untuk Bacillus amyloliquifacien dan Trichoderma harzianum karena mengandung karbohidrat sebagai sumber karbon dan protein sebagai sumber
2.2.2 Fermentasi Media Padat
Fermentasi media padat merupakan proses fermentasi dimana medium
yang digunakan tidak larut tetapi cukup mengandung air untuk keperluan
mikroorganisme sedangkan fermentasi medium cair adalah proses yang
substratnya larut atau tersuspensi di dalam fase cair (Klein et al. 2004).
Basillus dapat hidup secara obligat aerob atau fakultatif anaerob dan
positif mempunyai enzim katalase (
Dalam
melakukan fermentasi pada prinsipnya adalah pengaturan kondisi pertumbuhan
optimum mikroorganisme, sehingga dapat mencapai dan menghasilkan laju
pertumbuhan yang maksimal. Faktor yang perlu diperhatikan dalam proses
fermentasi adalah jenis substrat, mikroorganisme, dan kondisi fisik pertumbuhan.
Ketiga faktor tersebut berpengaruh terhadap massa dan komposisi sel
(Tannenbaum 1985). Keuntungan penggunaan medium padat antara lain: 1) tidak
memerlukan tambahan lain kecuali air, 2) persiapan inokulum lebih sederhana, 3)
dapat menghasilkan produk dengan kepekatan tinggi; 4) kontrol terhadap
kontaminan lebih mudah, 5) kondisi medium mendekati keadaan tempat tumbuh
alamiah, 6) produktifitas tinggi, 7) aerasi optimum, 8) tidak diperlukan kontrol pH
maupun suhu yang teliti. Dalam menyiapkan proses fermentasi medium padat
perlu memperhatikan beberapa faktor yaitu : sifat substrat terutama yang
berhubungan dengan derajat kristalisarasi dan derajat polimerisasi, sifat
mikroorganisme karena masing-masing mikroorganisme mempunyai kemampuan
yang berbeda dalam memecah komponen substrat untuk keperluan
metabolismenya, kinetika metabolisme dan kinetika enzim. Bungkil inti sawit
termasuk substrat atau media padat yang memiliki partikel dengan permukaan
sempit, sehingga mudah untuk dimasuki air maupun oksigen. Dengan fisik
tersebut maka tidak sulit untuk menjadi media pertumbuhan kapang maupun
bakteri disamping kandungan nutrient bungkil yang sudah tersedia.
2.3 Koktail Mikroba
2.3.1 Bacillus amyloliquefaciens
Chelikani et al. 2004). Genus Basillus dapat dijumpai dimana saja walaupun kondisi lingkungan kritis, karena sel Basillus bisa
menghindari lingkungan ekstrim, namun demikian tidak semua spesies Bacillus
bisa memproduksi endosperm (Madigan & Martinko 2005). Basillus terdiri dari
banyak jenis, salah satu jenis basillus yang digunakan dalam dunia industri
adalah
Gambar 2. Bacillus amyloliquefaciens
(Sumber: Fukumoto 1943)
Klasifikasi Bacillus amyloliquefaciens
Domain: Bacteria
Bacillus amyloliquefaciens. B. amyloliquefaciens diklasifikasikan ke dalam domain bakteri, devisi firmikutes (kuat dan langsing), kelas basili, ordo basilale,
familii basilaseae, dan genus basilus.
Division:
Class: Bacilli
Orde
Fam
Genus:
Species: Bacillus amyloliquefaciens
Bacillus amyloliquefaciens
dalam tanah oleh peneliti Jepang bernama Fukumoto pada tahun 1943 yang
memberikan nama tersebut karena bakteri tersebut memproduksi cairan amilase,
yaitu enzim yang mendegradasi tepung menjadi gula (Fukumoto 1943). Selain
amilase, B. amyloliquefaciens juga memproduksi lipase, protease, peptidase, sukrase, dan memproduksi Iturins yang bermanfaat untuk menghambat
pertumbuhan kapang (Antifungal Agent) seperti Fusarium, Collectotricum, Rhizoctonia, Aspergillus, dan Phytopthera. Enzim yang telah diproduksi dari B. amyloliquefaciens secara komersil adalah α-amilase, alfa-asetolaktase, dekarboksilase, beta-glukanase, hemiselulase, maltogenik amilase, protease, dan
xilanase (Gupta et al. 2003); Kandra (2003). Alpha amilase yang digunakan dalam hidrolisis pati, subtilisin protease digunakan dalam deterjen, dan enzim
restriksi BamH1 digunakan dalam penelitian DNA (
Dalam dunia industri,
Graumann 2007).
sebagai sumber
antibiotik alam, berupa barnase. Barnase adalah protein bakteri yang mengandung
110 macam asam amino dan mempunyai aktivitas ribonuklease (Hartley &
Smeaton 1973).
2.3.2 Trichoderma harzianum
Trichoderma adalah salah satu jamur tanah yang tersebar luas yang dapat ditemui di lahan-lahan pertanian dan perkebunan (Harman 2006). Trichoderma
bersifat saprofit pada tanah, kayu. Beberapa jenis Trichoderma dapat digunakan sebagai biofungisida, dimana Trichoderma mempunyai kemampuan untuk menghambat pertumbuhan beberapa jamur penyebab penyakit pada tanaman
antara lain Rigidiforus lignosus, Fusarium oxysporum, Rizoctonia solani,
Sclerotium rolfsii, dan lain-lain (Etebarian 2000; Eziashi et al. 2006 ;Harman 2006
Pada proses fermentasi, Trichoderma memproduksi enzim selulase yang berperan dalam mendegradasi selulosa menjadi glukosa. Beberapa strain
Trichoderma telah dikembangkan sebagai agen biokontrol (Well, 1986)
). Spesies Trichoderma disamping sebagai mikroorganisme pengurai (Beare
et al. 1992) dapat pula berfungsi sebagai agen hayati dan stimulator pertumbuhan tanaman.
, seperti T.
pertanian. Biakan jamur Trichoderma dalam media aplikatif seperti dedak dapat diberikan ke areal pertanaman dan berlaku sebagai biodekomposer, yaitu dapat
mendekomposisi limbah organik (rontokan dedaunan dan ranting tua) menjadi
kompos yang berkualitas.
Saat ini, Trichoderma merupakan salah satu mikroorganisme fungsional yang dikenal luas sebagai pupuk biologis tanah. Menurut Ramada (2008) pupuk
biologis Trichoderma dapat dibuat dengan inokulasi biakan murni pada media aplikatif, misalnya dedak. Sedangkan biakan murni diisolasi dari tanah sekitar
perakaran tanaman, serta dapat diperbanyak dan diremajakan kembali pada media
PDA (Potato Dextrose Agar).
Gambar 3. Trichoderma harzianum
(Sumber: Harman 2006)
Klasifikasi Kingdom:
Trichoderma harzianum: Division:
Subdivision: Class: Orde
Family:
Genus:
Species: T. harzianum
Trichoderma bersifat saprofit, dimana dapat beradaptasi dengan situasi
yang beragam memproduksi berbagai macam enzim. Kapang ini dapat tumbuh
pada pH 3 – 7 dengan suhu 30o
Beberapa strain tertentu memproduksi enzim utama yang dikultur dalam
suspensi untuk memproduksi enzim pada skala industri. Misalnya
C, dan tumbuh optimal pada pH 5 (Isil & Nulifer
2005).
dimanfaatkan untuk memproduksi selulase dan hemiselulase (Sim & Oh 1993)
et al. 2007), da
adalah jenisT. viride and T. hamatum, dimana pada umumnya
tumbuh disekitar permukaan perakaran. Salah satu fungisida produk bioteknologi
komersil kapang ini adalah 3Tac (berisi 3 jenis Trichoderma dengan tahap
pertumbuhan vegetative yang berbeda) yang digunakan untuk
perlakuaPenicillium sp.
Taksonomi Trichoderma secara umum dibagi berdasarkan karakter morfologi seperti konidia, bentuk, warna dan ornamentasi, bentuk percabangan
dengan cabang pendek disamping, short inflated phialides, dan formasi panjangnya hipa steril atau fertil dari konidia. T. harzianum (Gambar 3) termasuk jenis agregat, yang dibagi kedalam tiga ,empat, atau lima subspecies, tergantung
dari strainnya (Bissett 1991). Trichoderma harzianum termasuk ke dalam
klasifikasi kerajaan jamur (fungi), devisi
kelas
genusTrichoderma harzianum.
Trichoderma harzianum merupakan salah satu kapang yang digunakan sebagai fungisida, misalnya untuk perlakuan bibit dan tanah untuk membebaskan
beberapa penyakit yang disebabkan kapang patogen. T.harzianum positif berasosiasi dengan populasi bakteri (Eastburn & Butler 2002). Misalnya kapang
T.harzianum menyediakan selulase untuk mendegradasi selulosa berasosiasi dengan bakteri obligat anaerobik Clostridium butyricum yang berperan menyediakan nitrogenase. Selulosa dimanfaatkan sebagai sumber karbon untuk
fiksasi nitrogen (N2), hal ini meningkatkan laju dekomposisi dibandingkan bila
2.4
Selulosa merupakan komponen struktural utama dari
Selulosa sebagai Komponen Serat Kasar Tanaman
dapat
berantai panja
homopolimer linear yang dibangun unit-unit D-glukosa dengan ikatan β-1,4
glikosida dengan rumus molekul )n dan struktur kimia (gambar 4)
(
Gambar 4. Skema rangkaian selulosa ( Crawford 1981).
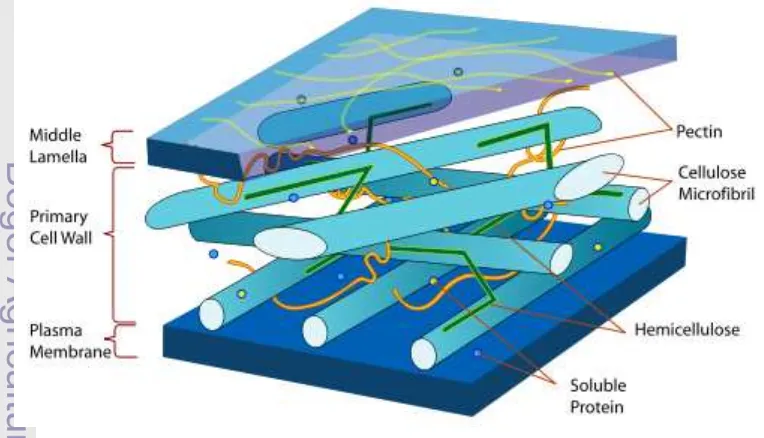
Gambar 5. Diagram dinding sel tanaman
(http://en.wikipedia.org/wiki/File:Plant_cell_wall_diagram.svg) Crawford 1981).
Selulosa merupakan susunan umum dinding sel tanaman (Gambar 5),
namun selulosa juga dimiliki beberapa bakteri. Walaupun selulosa cukup stabil
namun rentan bila dihidrolisis dengan asam maupun basa. Hidrolisis dengan pH
tinggi biasanya lebih kuat memotong rantai 1-4-glikosida daripada kondisi pH
rendah. Selain dapat didegradasi secara kimia, selulosa juga bisa di degradasi oleh
2.5 Enzim Selulase
Enzim selulase termasuk ke dalam enzim hidrolase yang dapat
mengkatalisis reaksi hidrolisis pemutusan ikatan beta-1,4 glikosida yang terdapat
dalam molekul selulosa
lainnya (Dwidjoseputro 1982; Nishiyama et al. 2002).
Selulase tidak dimiliki oleh manusia dan monogastrik, karena it
tidak dapat menguraikan selulosa (Crawford 1981). Tetapi hal ini dapat dilakukan
oleh beberapa hewan seperti
dalam sistem pencernaannya mengandun
menghasilkan enzim selulase yang akan m
1,4 glikosida.
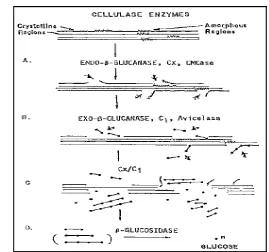
Gambar 6. Skema rangkaian selulolisis (Spano 1975)
Selulosa merupakan nama umum atau trivialnya, sedangkan nama
sistematiknya adalah beta-1,4-glukan-4-glukanohidrolase. Enzim selulase
merupakan enzim komplek yang terdiri dari 3 komponen utama, yaitu
endo-beta-glukanase (EC 3.2.1.4), ekso-beta-endo-beta-glukanase (EC 3.2.1.91), dan beta-glukosidase
(EC 3.2.1.21), yang bekerja secara bertahap atau bersama-sama menguraikan
Spano (1975) melaporkan enzim endo-β-glukanase, 1,4-β-D-glukan
glukanohidrolase, CMCase, Cx memutus secara random rantai selulosa yang
terdiri dari glukosa dan selo-oligosakarida. Sedangkan Ekso-β-glukanase, 1,4- β
-D-glukan selobiohidrolase, aviselase, dan C1 menyerang bagian luar selulosa
pada ujung non-reduksi dengan selobiosa sebagai struktur utama. Kemudian β
-glukosidase, selobiase menghidrolisis selobiosa menjadi glukosa (Gambar 6).
2.6 Manan
Manan tersusun dari 1-4 polimer gula manosa. Manan yang dihirolisa
menghasilkan manno-oligosaccharida, namun yang paling sering diproduksi
adalah mannobiose dan mannotriose, dan manosa merupakan produk yang paling
baik. Produksi utama hidrolisis manan adalah manno-oligosaccharida, yang paling
sering digunakan adalah mannotriosa dan mannobiosa (Kensch 2008).
Manan dan heteromanan merupakan bagian dari fraksi hemiselulosa pada
dinding sel tanaman. Struktur dinding sel tanaman sebagian besar terdiri dari
susunan polisakarida berupa selulosa, hemiselulosa, dan lignin (Dekker 1985)
(Gambar 5). Hemiselulosa merupakan polisakarida linier atau bercabang yang
banyak ditemukan sebagai heteroglikan pada tumbuhan tingkat tinggi. Dua jenis
hemiselulosa yang penting dalam industri ialah hetero-1,4-D-manan dan hetero -
1,4-D-xilan (Hilge et al. 1998).
Manan dan heteromanan tersebar luas di alam sebagai bagian dari fraksi
hemiselulosa dalam kayu keras dan kayu lunak (Capoe et al. 2000), biji tanaman leguminosa dan kacang-kacangan (Handford et al. 2003). Manan adalah salah satu bentuk dari polisakarida tanaman yang merupakan polimer dari gula manosa
(Nishiyama et al. 2002). Manan tersusun dari polimer 1 sampai 4 rangkaian gula sederhana manosa dan banyak dijumpai di alam, misalnya pada biji tanaman
antara lain kelapa sawit, kelapa, kopi, kacang, guar gum, dan locust bean gum. Manan (polimer manosa) yang diselingi dengan galaktosa, dikenal sebagai
galaktomanan (Lehninger 1982). Galaktomanan umumnya ditemukan pada
tanaman legum sebagai penyusun biji namun juga pada tanaman lain seperti pada
enzim endo β-mannanase (1,4-β-D-mannan mannanohydrolase [EC 3.2.1.78]) dan
exoβ-manosidase (β-D-mannanopyranoside hydrolase [EC 3.2.1.25]) (Puls dan
Scuseill, 1993). Produksi utama hidrolisis manan adalah manno-oligosaccharida,
yang paling sering digunakan adalah mannotriosa dan mannobiosa, dan manosa
merupakan produk yang paling baik. (Kensch 2008).
2.7. Enzim Mananase
Mananase adalah enzim yang menghidrolisis manan. Enzim mananase
terutama dimanfaatkan untuk mendegradasi serat dari biomassa tanaman kelapa,
dan bungkil inti sawit. Dalam dunia industri enzim mananase digunakan dalam
prosesing makanan dan pengeboran minyak. Pada bidang pertanian, enzim
mananase digunakan untuk meningkatkan hasil minyak dari kelapa sawit atau
kelapa, dan pada pengolahan limbah kopi digunakan untuk mengekstraksi nilai
komponen yang lebih tinggi. Enzim mananase juga digiunakan untuk
memproduksi manno-oligosakarida sebagai prebiotik dan feed aditif (Kensch
2008).
Mananase berada dimana-mana dialam yang pada umumnya diproduksi
oleh mikroorganisme, namun juga diproduksi dari tumbuhan dan hewan.
Sumbernya beraneka ragam seperti bakteri, aktinomisetes, ragi, dan kapang yang
dikenal pendegradasi manan (Puchart et al. 2004).
Enzim mananase dari bakteri kebanyakan terdapat pada ekstraselluler dan
dapat beraktivitas pada range pH dan temperature yang luas, meskipun pada
umumnya optimal pada kondisi asam dan netral (Dhawan & Kaur 2007).
Penggunaan enzim mananase sebagai feed additive menunjukkan beberapa
keuntungan, hal ini terlihat bila enzim tersebut dicampur ke dalam bahan pakan
ternak seperti bungkil kelapa, bungkil kedelai, dan tanaman laiinya yang dominan
mengandung manan. Robbins et al. (1999) melaporkan, pemberian β-mannanase yang dicampur dengan pakan jenis jagung, kedelai, dan lemak menunjukkan
peningkatan kecernaan protein, lisin, dan asam amino lainnya dengan
menggunakan babi (45-75 kg) dengan protein kasar pada 16% atau 12% dan 3500 Endo-β
-mannanase adalah enzim yang menghidrolisis manan yang merupakan bagian dari
kcal/kg ME. Tujuan pemberian mananase tersebut untuk memperbaiki nutrien dan
pertambahan bobot badan. Untuk monogastrik seperti unggas dan babi, manan
tersebut sulit dicerna sehingga akan berperan sebagai antinutrisi (Odetallah et al.
17
III METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilakukan di Balai Penelitian Ternak Ciawi Bogor mulai
Desember 2009 hingga Mei 2010.
3.2 Mikroba.
3.2.1 Bacillus amyloliquefaciens
Biakan Bacillus amyloliquefaciens diperoleh dari kultur pemurnian Wizna
et al. (2005), kemudian diperbanyak dengan metode Kompiang (komunikasi pribadi). Dalam penelitian ini mengandung CFU 18,7x1016.
3.2.2 Trichoderma harzianum
Biakan siap pakai Trichoderma harzianum diperoleh dari Balitnak dengan CFU 3,3x102
Syarat koloni yang ditentukan untuk dihitung adalah sebagai berikut: satu
koloni dihitung 1 koloni, dua koloni yang bertumpuk dihitung 1 koloni, beberapa
koloni yang berhubungan dihitung 1 koloni, dua koloni yang berhimpitan dan
masih bdapat dibedakan dihitung 2 koloni, koloni yang terlalu besar (lebih besar .
3.2.3 Penghitungan Jumlah Mikroorganisme
Penghitungan jumlah mikroorganisme dengan cara viable count atau disebut juga sebagai standard plate count (SPC) didasarkan pada asumsi bahwa setiap sel mikroorganisme hidup dalam suspensi akan tumbuh menjadi satu koloni
setelah diinkubasi dalam media biakan dan lingkungan yang sesuai. Setelah masa
inkubasi, jumlah koloni yang tumbuh dihitung dan merupakan perkiraan atau
dugaan dari jumlah mikroorganisme dalam suspensi tersebut. Berdasarkan hal
tersebut digunakan istilah colony forming units (CFU/ ml). Koloni yang tumbuh berasal dari suspensi yang diperoleh menggunakan pengenceran bertingkat dari
dari setengah luas cawan) tidak dihitung, koloni yang besarnya kurang dari
setengah luas cawan dihitung 1 koloni.
Penghitungan jumlah mikroorganisme hidup (viable count) adalah jumlah minimum mikroorganisme. Hal ini disebabkan koloni yang tumbuh pada
lempengan agar merupakan gambaran mikroorganisme yang dapat tumbuh dan
berbiak dalam media dan suhu inkubasi tertentu seperti pada gambar dibawah ini.
Gambar 7. Cara penghitungan jumlah mikroorganisme hidup
Teknik dilusi (pengenceran)
Teknik dilusi sangat penting di dalam analisa mikrobiologi. Karena hampir
semua metode perhitungan jumlah sel mikroba mempergunakan teknik ini, seperti
TPC (Total Plate Count). Bahan yang digunakan adalah, PCA (Plate Count Agar), BPW (Buffer Pepton Water), aquades Steril (NaCl fisiologis), alkohol 70 %, NaCl. Peralatan yang dipakai terdiri dari: Petri Dish, autoclaf, tabung reaksi,
inkubator, erlenmeyer, pipet ukur, bunsen Burner, dan laminar air flow.
Metodenya adalah sebagai berikut: Larutan kultur diambil 1 ml dan
dimasukkan ke dalam 9 ml NaCl fisiologis atau larutan buffer pepton untuk
memperoleh pengenceran1/10 bagian. Dari larutan pengenceran 1/10 diambil 1 ml
dan dimasukkan ke dalam 9 ml aquades atau larutan buffer pepton untuk
memperoleh dilusi 1/100 bagian. Dari larutan pengenceran 1/100 diambil 1 ml
dan dimasukkan ke dalam 9 ml NaCl fisiologis atau larutan buffer pepton untuk
memperoleh dilusi 1/1000 bagian. Demikian seterusnya hingga pengenceran yang
dihitung pada kisaran 30-300 koloni. Jumlah sel mikroba dapat diketahui dengan
cara menghitung sel relatif / CFU per ml:
CFU/ ml = jumlah koloni x faktor pengenceran
dimana :
Jumlah koloni = jumlah koloni mikroba yang tumbuh pada media agar
faktor pengenceran= larutan pengenceran (misalnya 1/100)
Gambar 8. Alur pengenceran pada penghitungan mikroba
Setelah inkubasi, dihitung semua koloni yang terbentuk yang berada pada
kisaran 30-300 koloni dan dicatat pada tiap dilusi yang berbeda. Hanya plate yang
berjumlah 30-300 koloni yang countable (dapat dihitung). Hal ini dikarenakan jumlah koloni yang kurang dari 30 dianggap negatif karena akan memberikan
dalam penghitungan. Jumlah koloni yang lebih dari 300 tidak dapat dihitung
karena saling menumpuknya koloni sehingga perhitungan menjadi tidak akurat.
3.2.4 Perbanyakan B. amyloliquefaciens
3.2.4.1 Bahan Perbanyakan B. amyloliquefaciens
Bahan yang digunakan dalam perbanyakan Bacillus amyloliquefaciens
adalah media nutrien agar, media cair Paul Marjonoff (PM) yang terdiri dari :
{(MgSO4.7H2O 2% 15 ml, ZnSO4.7H2O 0,01% 25 ml, (NH4)2SO4 50 ml, trace
elemens (terdiri dari: FeSO4.7H2O 0,500; CuSO4.5H2O 0,010; H3BO3 0,007; MnSO4.4H2O 0,050; ZnSO4.7H2O 0,050; Na2MoO4 0,010; CaCl.2H2O 1,324;
CoCl2.6H2O 0,010 dalam g/liter) 10 ml, buffer fosfat pH 7,2 50 ml, yeast extract 0,05% 7,5 mg, dan bactopepton 0,075% 1,875 mg)}, gula pasir, dan garam halus.
Sedangkan peralatan terdiri dari fermentor, Petri dish,dan aerator.
3.2.4.2 Metode Perbanyakan Bacillus amyloliquefaciens
Perbanyakan Bacillus amyloliquefaciens dilakukan menurut Kompiang (Komunikasi pribadi, 8 Desember 2009). Biakan Bacillus amyloliquefaciens
ditanam pada media nutrien agar, kemudian diinkubasi selama 2 hari. Setelah dua
hari biakan Bacillus amyloliquefaciens diambil 2 plate ditanam ke dalam media cair Paul Marjonoff (PM) 1 liter, kemudian diinkubasi selama 3 hari dalam
fermentor. Pada hari kedua media PM ditambahkan 100 gram gula pasir dan 10
gram garam halus per liter, dan inkubasi dilanjutkan hingga 3 hari. Adanya
pertumbuhan ditandai dengan berubahnya warna media dari coklat bening
menjadi coklat keruh. Setelah 3 hari B. amyloliquefaciens siap untuk digunakan dan ditanam ke substrat bungkil inti sawit padat.
3.2.5 Fermentasi
3.2.5.1 Bahan Fermentasi
Bahan-bahan yang dipergunakan dalam penelitian adalah, bungkil inti
sawit (BIS) yang diperoleh dari Bengkulu, mikroba Bacillus amyloliquefaciens
3.2.5.2 Metode fermentasi
Metode fermentasi secara skematik disarikan pada Gambar 9. Sebanyak
500 ml Bacillus amyloliquefaciens dicampurkan ke dalam 500 gram bungkil inti sawit, kemudian diaduk hingga homogen dan diinkubasi hingga 7 hari. Demikian
juga untuk Trichoderma harzianum dilakukan hal yang sama sedangkan untuk koktail mikroba dilakukan dengan mencampurkan 500 g BIS dengan 250 ml
Bacillus amyloliquefaciens dan 250 ml Trichoderma harzianum (2:1:1), kemudian diaduk sampai rata dan diinkubasi dalam tray plastik selama 7 hari. Inkubasi
Kimiawi: kehilangan BK, dan kehilangan BO, PK, SK. sedangkan Lemak, ADF, NDF, Abu, AAE, dan uji aktivitas enzim selulase dan mananase dilakukan pada inkubasi 0 dan 7 hari
Gambar 9. Skema Fermentasi
Keterangan: Ba= Bacillus amyloliquefaciens; Th= Trichoderma harzianum
BIS=bungkil inti sawit; BK=berat kering; BO=bahan organik; PK=protein kasar; SK=serat kasar; ADF=acid detergent fiber; NDF=neutral detergent fiber; AAE=asam amino esensial
dilakukan pada suhu +30oC, dengan pengamatan dilakukan pada hari ke 0, 3, 5,
dan 7. Peubah yang diukur adalah pertumbuhan mikroba secara visualisasi secara
deskriptif selama fermentasi, dan kualitas nutrien (Bahan kering, kehilangan
bahan kering, dan kehilangan bahan organik, protein kasar, lemak kasar, serat
lemak, abu, ADF, NDF, AAE serta uji aktivitas enzim dilakukan berdasarkan
hasil serat kasar terendah pada inkubasi 3, 5, dan 7 hari.
3.3 Pertumbuhan Mikroba
Pertumbuhan mikroba secara visualisasi dilihat secara deskriptif dengan
nilai + (pertumbuhan miselium belum ada); ++ (pertumbuhan miselium sudah
mulai terlihat (25%)); +++ (pertumbuhan miselium sudah merata (50%); ++++
(pertumbuhan miselium merata dipermukaan dan di dalam substrat (100%)),
selama inkubasi (0, 3, 5, dan 7 hari).
3.4 Bahan Kering
Kadar air diukur dengan menimbang sampel 4-5 g kemudian dikeringkan
dalam oven 105 oC selama 4-6 jam (AOAC, 1980). Setelah 6 jam diangkat dan
dimasukkan ke dalam desikator lalu ditimbang.
Bobot sampel basah-bobot sampel kering
Kadar Air = --- X 100% Bobot sampel basah
3. 5 Kehilangan Bahan Kering
Kehilangan bahan kering merupakan jumlah bahan kering yang hilang
selama proses fermentasi. Besaran kehilangan bahan kering ditentukan dengan
pengurangan berat bahan sebelum fermentasi dengan berat bahan setelah
fermentasi (dalam gram). Sedangkan persentasi kehilangan bahan kering
ditentukan dengan pengurangan berat bahan sebelum fermentasi dikalikan kadar
kering dengan berat bahan setelah fermentasi kali bahan dikalikan kadar kering
(dalam %).
Kehilangan BK (g) = (A x BKs) – (B x BKf)
(A x BKs) – (B x BKf)
A = berat sampel sebelum fermentasi (g)
B = berat sampel setelah fermentasi (g)
BKs = bahan kering sebelum fermentasi (%)
BKf = bahan kering setelah fermentasi (%)
3.6 Kehilangan Bahan Organik
Kehilangan bahan organik ditentukan dengan menimbang bahan sebelum
fermentasi dan setelah fermentasi, kemudian nilai bahan organik didapatkan dari
100 - abu (%). Besaran kehilangan bahan organik dihitung dengan formula
sebagai berikut :
Kehilangan BO (g) = (A x BKs x BOs) – (B x BKf x BOf)
(A x BKs x BOs) – (B x BKf x BOf)
Kehilangan BO (%) = --- x 100% (A x BKs x BOs)
A = berat sampel sebelum fermentasi (g)
B = berat sampel setelah fermentasi (g)
BKs = bahan kering sebelum fermentasi (%)
BOs = bahan organik sebelum fermentasi (%)
BKf = bahan kering setelah fermentasi (%)
BOf = bahan organik setelah fermentasi (%)
3.7 Penentuan Protein Kasar
Diukur dengan menggunakan metoda Kjeldahl (AOAC 1980). Sampel ditimbang
0,3 g kemudian ditambahkan katalis selenium 1,5 gram, lalu dimasukkan ke dalam tabung
Kjehdal dan ditambahkan H2SO4 pekat 20 ml. Selanjutnya didestruksi hingga warnanya
hijau kekuningan jernih, dan dinginkan selama 15 menit baru ditambahkan 300 ml
aquadest, dan didinginkan kembali. Setelah dingin ditambahkan NaOH 40% (teknis)
100ml, kemudian didestilasi. Hasil destilasi ditampung dengan 10ml H2SO4 0,1 N yang
sudah ditambahkan 3 tetes indikator campuran Methylen Blue dan Methylen Red.
Selanjutnya dititrasi dengan NaOH 0,1 N hingga terjadi perubahan dari warna ungu
menjadi biru-kehijauan. Penetapan blanko dengan cara: 10 ml H2SO4 0,1 N ditambah
16% Nitrogen, maka 100% : 16% = 6,25 dipakai untuk mendapatkan nilai protein
Penentuan serat kasar dilakukan dengan analisis proksimat. Sample ditimbang
sebanyak 1 gram (x), dimasukkan dalam gelas piala, kemudian dimasukkan ke
dalam Heater Extract. Lalu ditambahkan 50 ml H2SO4 0,3 N dan dimasak selama
30 menit, kemudian ditambahkan 25 ml NaOH 15 N dan dimasak kembali selama
30 menit. Selanjutnya kertas saring disiapkan yang telah dipanaskan terlebih
dahulu dalam oven pada suhu 105oC selama 1 jam (a). Kemudian cairan disaring
dengan menggunakan kertas saring (a) yang diletakkan dalam corong Buchner.
Penyaringan dilakukan dengan labu pengisap yang dihubungkan dengan pompa
vacum. Kemudian dicuci berturut-turut menggunakan air panas 50 ml, H2SO4 0,3
N 50 ml, air panas 50 ml, dan terakhir aseton 25 ml. Setelah selesai kertas saring
beserta isi dimasukkan ke dalam cawan porselen selanjutnya dikeringkan dalam
oven 105oC selama 1 jam. Kemudian diangkat dan didinginkan dalam desikator
lalu ditimbang (Y), selanjutnya dimasukkan ke dalam tanur 600o
Serat Deterjen Netral (NDF) ditentukan dengan Van Soest (1963).
Penetapan ini untuk memisahkan fraksi yang larut dalam pereaksi NDF dan yang
tidak larut. Serat NDF merupakan fraksi yang tidak larut. Fraksi yang tidak larut
tidak dapat dihidrolisis oleh pereaksi NDF, sehingga serat akan terpisah dan dapat
ditentukan kadarnya dengan disaring, dikeringkan, kemudian ditimbang.
C selama 6 jam.
Selanjutnya diangkat dan dinginkan dalam desikator dan ditimbang (Z) .
Perhitungan:
Y – Z – a
% Serat Kasar = --- x 100% X
Metodenya diuraikan berikut ini, sebanyak 0,5 g sampel ditambah 60 ml
larutan NDF dimasukkan ke dalam gelas piala ukuran 600 ml. Selanjutnya
dipanaskan dalam penangas listrik sampai mendidih. Kemudian didestruksi
selama 60 menit pada suhu 2200C. Campuran dituang ke dalam cawan masir yang
sudah diketahui bobotnya (W1). Sampel disaring dan dicuci dengan air panas
sampai tidak berbusa lagi lalu dibilas dengan aseton. Cawan dikeringkan dalam
oven dengan suhu 1050C selama satu malam. Cawan didinginkan dalam desikator
dan ditimbang sebagai W2.
c-b
% NDF = --- x 100% a
3.10 Penentuan Serat Deterjen Asam (ADF)
Serat Deterjen Asam (ADF) dilakukan dengan menggunakan metode Van
Soest (1963). Bagian dinding sel tanaman atau serat detergen netral yang tidak
dapat larut dalam larutan detergen asam dengan komposit utama CTAB (Cetyl
trimethyl ammonium bromide) pada pemanasan selama satu jam.
Bahan yang digunakan pada analisis ADF terdiri dari: Larutan detergent
asam atau acid detergent solution (ADS) dibuat dengan melarutkan CTAB 20 gram dalam asam sulfat 1 N, Dekalin, Aceton. Sedangkan alat yang dipakai sama
dengan untuk penentuan NDF, yaitu: pendingin yang sesuai dengan mulut gelas
piala, pemanas listrik, pompa vakum, lemari pengirim, tanur, desikator, cawan
kaca masir, corong buchner, dan penjepit
Metode yang digunakan sama dengan penentuan NDF. Kurang lebih satu
gram contoh (a gram) dimasukkan dalam gelas piala 600 ml, kemudian ditambah
100 ml ADS dan 2 ml dekalin. Selanjutnya diekstraksi selama satu jam setelah
mendidih disaring dengan cawan penyaring yang telah diketahui beratnya (b
gram), penyaringan dilakukan dengan pompa vakum. Residu dan kertas saring
dicuci dengan air panas beberapa kali dan akhirnya dengan aceton, lalu
Perhitungan:
Penentuan asam amino dilakukan dengan Amino Acid Analizer. Bahan yang digunakan pada analisis asam amino adalah : larutan HCl 6 N dan 0,1 N;
larutan penyangga trisodium sitrat 2H2O dengan tiga variasi pH, yaitu pH 3,25
(0,2 N Na+ + 1% propanol), pH 3,95 (0,4 N Na-), dan pH 6,4 (1 N Na-); larutan
lithium asetat terdiri dari 168 g Li(OH3), 600 ml asam asetat glasial, dan 400 mlair
bebas ion; larutan ninhidrin terdiri atas 200 ml larutan ’Dimethyl Sulfokside’,
66,66 ml larutan lithium asetat; 5,32 g larutan ninhidrin, 0,22 g hidridantin, dan
gas N2 murni; larutan standar asam amino buatan Beckman yang mengandung
0,25 umol/ml; contoh bungkil inti sawit tanpa dan sudah fermentasi dikeringkan
dalam freeze dry dan digiling halus, etanol absolut dan es kering. Sedangkan alat yang digunakan meliputi amino acid analyzer Beckman tipe CL 119, neraca analitik 5 desimal.
Metode: 1. Hidrolisis protein
Sebanyak 50 gram contoh di masukkan ke dalam tabung pyrex 10 ml yang
bertutup, selanjutnya dimasukkan 5 ml HCl 6 N dan dialiri gas nitrogen murni
(Nitrogen Hp) kemudian tabung ditutup dan diletakkan dalam ovenµ dengan suhu
105 – 110 o
Hasil analisis yang sudah kering dilarutkan kembali dengan HCl 0,1 N hingga
volume 3 ml, diaduk dengan vortex hingga homogen, lalu disaring dengan
penyaring dengan ukuran 0,22 um. Kemudian hasil saringan diambil 100 µm dan
diinjeksikan pada alat spektrofotometri, kemudian pencatatan yang digunakan C selama 24 jam. Kemudian hasil hidrolisis dikeluarkan dari oven dan
dibiarkan hingga suhu ruang, kemudian disaring dengan ketas saring Whatman no
41. Kemudian diambil 1 ml larutan ke dalam tabung 10 ml, lalu dibekukan dengan
es kering dan selanjutnya dikeringkan dengan pengering vakum.
secara manual, sehingga perhitungan dilakukan dengan mengukur tinggi
khromatogram standar dan tinggi khromatogram contoh dalam satuan cm.
Perhitungan:
t spl = tinggi puncak khromatogram contoh
t std = tinggi puncak khromatogram standar
0,250 µmol/ml = konsentrasi standar
3 ml = volume akhir contoh
BM AA = bobot molekul masing-masing asam amino
df = faktor pengenceran
Total asam amino adalah total asam amino yang diperoleh dari hasil analisis
contoh.
3.12 Uji Aktivitas Enzim Selulase
Pengujian aktivitas enzim selulase dilakukan dengan metode DNS
(dinitrosalicylic acid) (Miller 1959). Bungkil inti sawit yang telah diinkubasi
dengan isolat dipindahkan ke tabung propylene. Selanjutnya ditambahkan 25ml
buffer sitrat dengan pH 6,0, 50 mM, lalu diaduk dengan menggunakan vortex 15
menit dan disentrifus selama 15 pada 3500 rpm, suhu 4-5oC. Selanjutnya
sebanyak 0,75 ml supernatan enzim dicampur 0,75 ml 1% CMCase (enzim
selulase) dalam buffer sitar dengan pH 6,0. Kemudian diinkubasi pada suhu
kamar selama 30 menit, kemudian ditambahkan 1,5 ml dinitrosalicylic acid.
Selanjutnya dipanaskan selama 15 menit dan didinginkan selama 20 menit dan
dibaca dengan menggunakan spektrofotometer 575 nM. Perhitungan aktivitas
enzim selulase dapat dilakukan dengan rumus sebagai berikut,
kadar glukosa x pengenceran Aktivitas enzim = ---
Keterangan:
Satu unit aktivitas selulase adalah jumlah enzim yang melepaskan µmol glukosa
dalam satu menit pada kondisi pengujian.
Faktor pengenceran = 1
Berat molekul glukosa 180
Waktu inkubasi 30 menit.
3.13 Uji Aktivitas Enzim Mananase
Uji aktivitas enzim mananase dilakukan berdasarkan metode Purwadaria et al. (1988). Aktivitas mananase dianalisis dengan menggunakan gum locust bean
(0,5% dalam buffer asetat dengan pH 4,8 dan suhu optimum 40oC). Filtrat enzim,
buffer dan substrat diinkubasi selama 5 menit pada suhu 40oC. Sampel berisi 1 ml
filtrat enzim ditambah 1 ml substrat di vorteks dan diinkubasi selama 30 menit
pada suhun optimum. Selanjutnya DNS ditambahkan 3 ml, divorteks, dan
dididihkan pada penangas air selama 15 menit. Kontrol dibuat dengan
menambahkan 3 ml DNS (dinitrosalicylic acid) dan 1 ml substrat ke dalam 1 ml
filtrat enzim tanpa inkubasi. Blanko terdiri dari 1 ml buffer, 3 ml DNS dan 1 ml
substrat. Kontrol dan blanko dididihkan selama 15 menit, kemudian aktivitas
mananase ditentukan dengan pengukuran absorban pada panjang gelombang 575
nm. Kemudian standar dibuat dengan 1 ml manosa dengan deret konsentrasi
0-450 µg/ml dari larutan induk 1000 µg/ml dalam air, diencerkan dengan buffer,
kemudian ditambahkan 1 ml substrat dan 3 ml DNS, selanjutnya dididihkan 15
menit. Setelah absorban dingin, diukur pada panjang gelombang 575 nm. Kurva
standar dibuat dengan menghubungkan konsentrasi manosa dan absorban. Satu
unit aktivitas enzim adalah banyaknya enzim yang dapat memproduksi 1 µmol
manosa per menit pada kondisi percobaan dengan formula sebagai berikut :
Aktivitas Mananase (µ/ml) = [glukosa]sampel – [glukosa] kontrol (µg/ml) x Fp
Waktu inkubasi x BM manosa
Keterangan:
3.14 Rancangan Percobaan
Pertama, data dianalisis dengan menggunakan dalam Rancangan Acak
Lengkap pola Faktorial dengan 3 macam mikroba x 4 lama inkubasi x 3 ulangan =
36 unit percobaan. Bila uji ANOVA terdapat perbedaan yang nyata maka analisis
dilanjutkan dengan uji lanjut orthogonal comparison (Steel & Torrie 1995).
Mikroba fermentasi terdiri dari:
T1 = Bacillus amyloliquefaciens
T2 = Trichoderma harzianum
T3 = koktail mikroba (kombinasi Bacillus amyloliquefaciens dan Trichoderma harzianum
Lama inkubasi (proses fermentasi) terdiri dari:
P1 = 0 hari
P2 = 3 hari
P3 = 5 hari
P4 = 7 hari
Model linier Rancangan Acak Lengkap pola Faktorial adalah :
Yijk = μ + αi+βj + (αβ) ij + εijk dimana :
Yijk = nilai pengamatan bungkil inti sawit pada faktor jenis
mikroba taraf ke-i dan lama inkubasi fermentasi taraf ke-j
dan ulangan ke-k
μ = Rataan umum
αi = Pengaruh jenis mikroba faktor αke-i
βj = Pengaruh lama inkubasi fermentasi bungkil inti sawit faktor β ke-j
(αβ) ij = Pengaruh interaksi faktor αke-i dan faktor
β ke-j
Kedua, data dianalisis dengan menggunakan Model Regresi Linier Sederhana, yaitu hubungan antara X dan Y dinyatakan dalam fungsi linier/ordo 1 dan perubahan Y diasumsikan karena adanya perubahan X.
Model Regresi Linier Sederhana adalah :
Y = βo + β1x + ε
dimana :
β0 dan β1 adalah parameter regresi
ε adalah sisaan/galat/eror (peubah acak)
Y adalah jenis mikroba peubah tak bebas (peubah acak)
X adalah lama inkubasi (peubah bebas) yang nilainya diketahui
31
4.1 Pertumbuhan Mikroba pada Substrat Bungkil Inti Sawit
Setiap mikroorganisme mempunyai kurva pertumbuhan. Mikroba
memiliki kemampuan untuk menggandakan diri secara eksponensial karena
sistem reproduksinya merupakan pembelahan biner melintang, dimana tiap sel
membelah diri menjadi dua sel. Selang waktu yang dibutuhkan sel untuk
membelah diri disebut dengan waktu generasi.
Selama fermentasi aerobik dilakukan pengamatan secara visual terhadap
pertumbuhan bakteri B. amyloliquefaciens, kapang T. harzianum, dan koktail mikroba yang disarikan pada Tabel 2. Inkubasi pada 0 hingga 2 hari belum
terlihat ada pertumbuhan, hal ini mengindikasikan pada inkubasi 0-2 hari
merupakan fase lag (lambat). Pada saat fase lag tidak terjadi pertumbuhan
Lama inkubasi
mikroba, sel sedang mengalami perubahan komposisi kimiawi, bertambahnya
ukuran serta substansi intraseluler, sehingga siap untuk membelah diri.
Tabel 2. Pertumbuhan selama fermentasi aerobik (7 hari).
B. amyloliquefaciens T. harzianum Koktail mikroba
0 hari Inokulasi Inokulasi Inokulasi
Pada hari ketiga B. amyloliquefaciens, T. harzianum, dan koktail mikroba sudah menutupi substrat hingga 25%. Hari kelima pertumbuhan mencapai 50%,
harzianum, dan koktail mikroba mencapai 100% di permukaan hingga tumbuh ke dalam substrat, disarikan pada Tabel 2 dan Gambar 10, 11, dan 12. Pada
inkubasi 3, 5 dan 7 hari diindikasikan berada pada kurva pertumbuhan fase
logaritma atau fase eksponensial, karena sel membela diri dengan laju yang
konstan, massa menjadi dua kali lipat. Pada fase ini merupakan fase perbanyakan
jumlah sel yang sangat banyak, aktivitas sel meningkat, dan fase yang penting
bagi kehidupan mikroorganisme. Pertumbuhan ditandai dengan adanya warna
putih di permukaan substrat pada ketiga perlakuan mikroba. Pertumbuhan terjadi
karena tersedianya nutrien pada substrat bungkil inti sawit, air yang cukup, dan
temperatur yang sesuai dengan yang dibutuhkan.
Gambar 11. Pertumbuhan T. harzianum pada substrat bungkil inti sawit.
4.2 Kehilangan Bahan Kering Selama Proses Fermentasi Bungkil Inti Sawit
Selama fermentasi terjadi kehilangan bahan kering yang disarikan pada
Tabel 3. Pada saat fermentasi mikroba akan mendegradasi selulosa dan
hemiselulosa serta manan menjadi gula-gula sederhana. Selama fermentasi terjadi
proses respirasi anaerob (pembebasan energi tanpa oksigen), mikroba memecah
komponen substrat untuk keperluan metabolisme, kinetika metabolisme dan
kinetika enzim dan pertumbuhan.yang menyebabkan kehilangan bahan kering.
Tabel 3. Kehilangan bahan kering bungkil inti sawit selama fermentasi (%) Jenis Mikroba
Sementara itu tidak ada interaksi antara jenis mikroba dengan lama
fermentasi terhadap kehilangan bahan kering. Selama pertumbuhan, mikroba akan
menggunakan sumber karbon dan diubah menjadi karbon dioksida, air, dan
energi. Sebagian energi digunakan untuk pertumbuhan. Kehilangan bahan kering + 0,72
Keterangan: Superskrip yang berbeda pada lajur yang sama menunjukkan perbedaan yang nyata (P<0,05)
Kehilangan bahan kering pada fermentasi 3 hari berbeda nyata (P<0,05)
diantara ketiga perlakuan (Tabel 3), dimana perlakuan koktail mikroba
menunjukkan kehilangan bahan kering terendah (7,40+0,00%), disusul T. harzianum (9,20+3,12), selanjutnya B. amyloliquefacien (13,50+0,00). Setelah inkubasi 5 hari kehilangan bahan kering tidak berbeda nyata antara perlakuan
B. amyloliquefaciens dengan T. harzianum, namun berbeda nyata (P<0,05) dengan perlakuan koktail mikroba (6,67 + 0,00%). Pada inkubasi 7 hari
selama proses fermentasi disebabkan oleh mikroorganisme menggunakan substrat
untuk berkembang biak dan menghasilkan air dan karbon dioksida sebagai sisa
metabolisme. Oleh karena itu, kehilangan bahan kering dapat digunakan sebagai
indikator pertumbuhan mikroorganisme dalam substrat. Pada fermentasi bungkil
inti sawit dengan A. niger menunjukkan kehilangan bahan kering sebesar 18,74% (Mathius 2008). Pada penelitian ini, kehilangan bahan kering tertinggi selama
fermentasi terdapat pada perlakuan B. amyloliquefaciens (20,80%) dan terendah pada bungkil inti sawit yang difermentasi dengan koktail mikroba (12,62%).
Kehilangan bahan organik hanya dianalisis pada fermentasi dengan
perlakuan koktail mikroba yaitu 10,3% setelah inkubasi 7 hari. Seperti diketahui
bahwa pada proses fermentasi terjadi perubahan zat-zat organik sebagai akibat
dari reaksi biokimia yang ditimbulkan oleh kapang maupun bakteri. Enzim-enzim
yang dihasilkan oleh kapang T. harzianum seperti selulase, protease, dan lipase (Harman 2006) dan Bacillus amyloliquefaciens mempunyai aktivitas enzim protease dan amilase yang sangat baik dan aktivitas lipase dan selulase yang baik.
Baik kapang maupun bakteri akan merombak zat-zat organik seperti selulosa,
protein dan lemak menjadi molekul yang lebih sederhana, sehingga dalam proses
perombakan tersebut akan terjadi kehilangan sebagian bahan kering karena zat-zat
organik tadi bisa berubah menjadi CO2 dan H2O (Sulaiman 1988; Murray et al. 2000). Selanjutnya beliau menjelaskan bahwa selama proses fermentasi terjadi
peningkatan kadar air karena perombakan bahan organik oleh enzim-enzim yang
dihasilkan mikroba. Fardiaz (1988) mengemukakan bahwa mikroba
menggunakan karbohidrat sebagai sumber energi dengan jalan memecahnya
menjadi gula yang lebih sederhana seperti glukosa, dan selanjutnya pemecahan
glukosa menjadi CO2 dan H2O melalui jalur glikolisis dan siklus Krebs untuk
menghasilkan energi. Perubahan yang terjadi pada bahan organik diikuti dengan
perubahan atau kehilangan bahan kering karena bahan kering suatu bahan
makanan terdiri atas bahan organik dan bahan an-organik (McDonald et al. 1981). Pertumbuhan kapang akan lebih banyak menyesuaikan diri dengan ketersediaan
makronutrien dan mikronutrien dalam substrat. Jumlah mikroba yang banyak akan
menyebabkan produksi enzim-enzim semakin tinggi, sehingga jumlah zat-zat