AKTINOMISET FILOSFER PENGHASIL SENYAWA BIOAKTIF
SEBAGAI AGENS HAYATI PENGENDALI PENYAKIT
BLAS DAUN PADI
WIWIEK HARSONOWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aktinomiset Filosfer Penghasil Senyawa Bioaktif sebagai Agens Hayati Pengendali Penyakit Blas Daun Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Wiwiek Harsonowati
RINGKASAN
WIWIEK HARSONOWATI. Aktinomiset Filosfer Penghasil Senyawa Bioaktif sebagai Agens Hayati Pengendali Penyakit Blas Daun Padi. Dibimbing oleh ARIS TRI WAHYUDI dan RIKA INDRI ASTUTI.
Permasalahan utama produksi padi di Indonesia antara lain penyakit yang menyerang tanaman padi yang mengakibatkan penurunan jumlah produksi baik kualitas maupun kuantitas. Penyakit utama pada tanaman padi salah satunya disebabkan oleh cendawan patogen daun Pyricularia oryzae Cav. penyebab penyakit blas. P. oryzae menyerang tanaman padi mulai dari fase vegetatif sampai stadia pembentukan malai atau fase generatif. Serangan blas yang berat dapat mengakibatkan penurunan produksi hingga mencapai 70%. Semakin tinggi dan meluasnya daerah persebaran penyakit blas pada tanaman padi, mendorong dilakukannya berbagai upaya untuk mengendalikan penyakit tersebut, salah satu diantaranya adalah penggunaan senyawa kimia sintetik yang terkendala dari jumlah biaya produksi, keamanan, dan tidak ramah lingkungan. Penggunaan aktinomiset filosfer sebagai agens hayati pengendali penyakit blas daun pada padi masih belum dilakukan. Oleh karena itu penelitian ini bertujuan untuk mendapatkan aktinomiset asal filosfer sebagai agens hayati dalam mengendalikan penyakit blas skala rumah kaca.
Sampel daun padi yang sehat diperoleh dari wilayah persawahan yang terserang penyakit blas di Situgede, Sukabumi dan Jasinga, Jawa Barat. Sebanyak 75 isolat aktinomiset telah berhasil diisolasi dari filosfer tanaman padi. Diperoleh 38 isolat mampu menghambat pertumbuhan P. oryzae secara in vitro
menggunakan metode kultur ganda, dan 27 isolat diantaranya termasuk kelompok aktinomiset non-patogen melalui uji hemolitik, hipersensitivitas dan patogenisitas. Analisa sekuen gen 16S rRNA terhadap 22 isolat terpilih menunjukkan bahwa isolat tersebut termasuk dalam genus Streptomyces (15 isolat), Micromonospora
(2 isolat), Lentzea (2 isolat), Saccharothrix (2 isolat), dan Gordonia (1 isolat). Deteksi gen penyandi enzim yang berperan untuk biosintesis senyawa bioaktif nonribosomal peptida sintase (NRPS) dan poliketida sintase (PKS-I) menunjukkan bahwa 21 isolat (95.45%) memiliki gen NRPS dan 14 isolat (63.6%) memiliki PKS-I.
Sebelas isolat aktinomiset dengan karakteristik pertumbuhan yang tidak membentuk agregat pada media cair selanjutnya diuji in planta untuk mengendalikan serangan penyakit blas di rumah kaca. Pengujian secara in planta
menunjukkan aplikasi aktinomiset filosfer mampu menekan penyakit blas sebesar 77 sampai 88%. Isolat JSN1.9, SKB2.14, dan SKB2.3 merupakan tiga isolat terbaik dalam menekan gejala penyakit blas pada aplikasi di rumah kaca dan ketiga isolat tersebut teridentifikasi sebagai Gordonia terrae, Streptomyces griseus, dan Streptomyces albolongus. Hasil penelitian ini menunjukkan persen penghambatan penyakit blas tertinggi di rumah kaca dibandingkan aplikasi bakteri tanah dan rizosfer. Oleh karena itu, aktinomiset filosfer lebih berpotensi untuk dimanfaatkan sebagai agens hayati pengendali penyakit blas daun padi.
SUMMARY
WIWIEK HARSONOWATI. Phyllosphere Actinomycetes Producing Bioactive Compounds as Biological Control Agents of Rice Fungal Leaf Blast. Supervised by ARIS TRI WAHYUDI and RIKA INDRI ASTUTI.
The main problem of rice production in Indonesia is caused by plant diseases which results in productivity losses every year. Fungal leaf blast, caused by Pyricularia oryzae Cav., is a devastating disease of rice plant. This disease infects the rice plant from vegetative stage to panicle formation stage or the generative phase. Severe blast infection may result in production losses up to 70%. Biological agents to control plant diseases are known for not causing health problems (no side effects), prevent pathogens resistance and no environmental contamination. To date, application of phyllosphere actinomycetes as biological control of rice blast disease is still limited. Therefore, this study was aimed to obtain rice-phyllosphere actinomycetes as biocontrol agents to reduce blast disease in a greenhouse experiment.
Healthy rice leaf samples were obtained from rice-fields known as endemic area of blast disease in Situgede, Jasinga and Sukabumi, West Java. A total of 75 isolates of actinomycetes were isolated from rice plants phyllosphere. A total of 38 out of 75 isolates were able to inhibit the growth of P. oryzae by using dual culture method in vitro. A total of 27 isolates was observed as non-pathogenic actinomycetes group through hemolityc, hipersensitivity and pathogenicity assays. Analysis of the 16S rRNA gene sequences of the 22 selected isolates showed that these isolates belong to the genus Streptomyces (15 isolates),
Micromonospora (2 isolates), Lentzea (2 isolates), Saccharothrix (2 isolates), and
Gordonia (1 isolate). The potential bioactive compound-producing isolates were successfully observed amongst selected isolates, as 21 isolates (95.45%) and 14 isolates (63.6%) were detected to have domain marker of nonribosomal peptide synthetases (NRPS) and type-I polyketide synthase (PKS) genes, respectively, in their corresponding genome.
Eleven isolates out of 22 isolates were selected for in planta assay to control leaf blast disease. Three isolates JSN1.9, SKB2.14, and SKB2.3 exhibited remarkable disease suppression for approximately 88%. These tree isolates were identified based on 16S rRNA gene sequences as Gordonia terrae, Streptomyces griseus and Streptomyces albolongus, respectively. To our knowledge, this result was the highest leaf blast disease suppression activity has ever been exhibited by actinomycetes in greenhouse experiments. Thus, these findings have escalated the potential application of phyllosphere actinomycetes as a supreme biocontrol agent against fungal leaf blast disease.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
AKTINOMISET FILOSFER PENGHASIL SENYAWA BIOAKTIF
SEBAGAI AGENS HAYATI PENGENDALI PENYAKIT
BLAS DAUN PADI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2015 sampai Juni 2016 dengan judul Aktinomiset Filosfer Penghasil Senyawa Bioaktif sebagai Agens Hayati Pengendali Penyakit Blas Daun Padi.
Terima kasih penulis ucapkan kepada Bapak Prof Dr Aris Tri Wahyudi, MSi selaku ketua komisi pembimbing dan Ibu Dr Rika Indri Astuti, MSi selaku anggota komisi pembimbing, yang telah memberikan motivasi, waktu untuk konsultasi dan diskusi serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian, kemudian saran dan masukan dalam penyusunan dan perbaikan karya ilmiah ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi pembimbing Ibu Dr Ir Utut Widyastuti, MSi dan Ibu Prof Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB, yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Terima kasih atas dana penelitian program Kerjasama Kemitraan Penelitian dan Pengembangan Pertanian Nasional (KKP3N) dari Kementerian Pertanian Indonesia yang diberikan kepada Prof Aris Tri Wahyudi tahun 2014-2016, sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik. Sebagian hasil penelitian ini telah dipublikasikan di jurnal internasional Journal of General Plant Pathology terindeks Scopus (Impact Factor 1.12) dengan judul “Leaf Blast Disease Reduction by Rice-Phyllosphere Actinomycetes Producing Bioactive Compounds”.
Penulis juga mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku staf Laboratorium Mikrobiologi IPB, kepada Ibu Retnowati selaku staf Laboratorium Terpadu Biologi IPB, Ibu Dr Anggiani Nasution dari Balai Besar Padi KP Muara yang telah memberikan isolat Pyricularia oryzae dan Bapak Ir Yadi Suryadi, Msc dari Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian yang telah memberikan izin penggunaan
Laboratorium Mikrobiologi dan rumah kaca “Moisture chamber for blast disease”,
seluruh teman-teman di Lab. Mikrobiologi IPB dan teman-teman Pascasarjana prodi Mikrobiologi angkatan 2014 atas dukungan, motivasi, kebersamaan dan bantuannya selama penelitian, serta kebersamaan dari teman-teman penghuni wisma Dwi Regina. Ucapan terima kasih sebesar-besarnya kepada Bapak Muanam Harsono (alm.) dan Ibu Supartini serta kakak dan adik ku tercinta atas doa, dukungan, kasih sayang dan semangat yang diberikan. Ucapan terimakasih kepada pemerintah Jepang yang telah memberikan beasiswa Monbukagakusho (MEXT) 2016 untuk program S3 kepada penulis, sehingga penulis termotivasi untuk menyelesaikan penelitian dan studi program magister tepat waktu.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Penyakit Blas Daun oleh Cendawan Pyricularia oryzae 3
Aktinomiset Filosfer 5
Gen Penyandi Senyawa Bioaktif 6
Mekanisme Pengendalian Hayati 8
3 METODE 9
Kerangka Penelitian 9
Waktu dan Tempat 10
Bahan dan Alat 10
Prosedur Penelitian 10
Isolasi Aktinomiset Filosfer Padi 10
Skrining Aktivitas Antifungi terhadap P. oryzae 10
Uji Reaksi Hemolisis 11
Uji Respon Hipersensitivitas dan Patogenisitas 11
Isolasi DNA Genom Aktinomiset 11
Amplifikasi Gen 16S rRNA, Domain A dan KS 11 Kloning, Sekuensing dan Analisis Bioinformatika Domain A dan KS 12 Persiapan Aplikasi Agens Hayati terhadap Penyakit Blas di Rumah
Kaca 12
Rancangan Percobaan Aplikasi Agens Hayati di Rumah Kaca 13
4 HASIL DAN PEMBAHASAN 15
Isolasi Aktinomiset Filosfer Padi 15
Skrining Aktivitas Antifungi dan Uji Patogenisitas 17
Amplifikasi Gen 16S rRNA, Domain A dan KS 21
Kloning dan Analisis Bioinformatika Domain A dan KS 25 Aplikasi Agens Hayati terhadap Penyakit Blas Daun di Rumah Kaca 28
5 SIMPULAN DAN SARAN 32
Simpulan 32
Saran 32
DAFTAR PUSTAKA 32
DAFTAR TABEL
1 Skala skor penyakit blas daun tanaman padi (IRRI 2002) 14 2 Skrining primer isolat aktinomiset filosfer padi non-patogen dengan
aktivitas anti-P. oryzae menggunakan metode kultur ganda pada media
PDA 21
3 Identifikasi molekuler isolat aktinomiset terpilih berdasarkan sekuen gen 16S rRNA menggunakan program BLASTN dan deteksi gen NRPS
dan PKS-I dengan PCR 23
4 Analisa bioinformatika sekuen asam amino gen penyandi domain A (NRPS) dan domain KS (PKS-I) hasil subklon menggunakan program
BLASTX 26
5 Respon tanaman padi varietas Ciherang pada 21 hari setelah diinokulasi
P. oryzae 29
DAFTAR GAMBAR
1 Gejala serangan blas pada daun padi fase vegetatif dan generatif di
daerah Sukabumi, Jawa Barat 4
2 Siklus hidup P. oryzae penyebab penyakit blas daun (leaf blast) yang dipengaruhi oleh faktor suhu dan kelembaban udara 5 3 Organisasi setiap domain pada sistem modul enzim NRPS dan PKS 7
4 Diagram alur penelitian 9
5 Koloni aktinomiset hasil isolasi dari sampel daun (tanda panah) pada
tiga jenis media isolasi 15
6 Morfologi koloni aktinomiset filosfer padi umur ± 10 hari pada media
ISP2 16
7 Koloni aktinomiset filosfer padi yang mampu menghambat
pertumbuhan P.oryzae pada media PDA 18
8 Aktivitas hemolitik isolat aktinomiset pada media agar darah yang
diinkubasi pada suhu ruang selama 48-72 jam 19
9 Respon hipersensitivitas (HR) pada daun tembakau dan gejala nekrosis
setelah inokulasi isolat aktinomiset 19
10 Respon patogenisitas isolat aktinomiset pada daun padi IR64 20 11 Elektroforesis gel agarosa 0.8% yang menunjukkan pita-pita DNA hasil
amplifikasi gen 16S rRNA dari 6 isolat aktinomiset filosfer padi dengan
ukuran amplikon 1300 pb 22
12 Elektroforesis fragmen DNA penyandi domain A dan KS pada gel
agarosa 0.8% 22
13 Pohon filogenetik gen 16S rRNA (neighbour joining tree) menggunakan Tamura- 3 parameter model (bootstrap 1000x) 24 14 Pohon filogenetik berdasarkan sekuen asam amino domain KS
(ketosintase) yang dikonstruksi menggunakan metode Neighbor-Joining dengan nilai bootstrap 1000 ulangan 27 15 Pohon filogenetik berdasarkan sekuen asam amino domain A
(adenilase) yang dikonstruksi menggunakan metode Neighbor-Joining
16 Morfologi tanaman padi varietas Ciherang pada uji aplikasi in planta
agens hayati di rumah kaca 30
DAFTAR LAMPIRAN
1 Komposisi media pertumbuhan aktinomiset dan cendawan P. oryzae 37 2 Persentase penghambatan (inhibisi) pertumbuhan miselium P. oryzae
oleh isolat aktinomiset filosfer padi asal Situgede (STG), Sukabumi
(SKB) dan Jasinga (JSN) 39
3 Skala penilaian intensitas blas daun skala 0-9 40 4 Penilaian pengaruh aplikasi agens hayati terhadap penyakit blas daun di
rumah kaca berdasarkan IRRI (2002) 41
5 Respon tanaman padi varietas Ciherang pada uji in planta sebelum
diinokulasi P. oryzae (21 hst) 43
6 Kromatogram sekuen gen 16S rRNA dan hasil BLASTN tiga isolat aktinomiset filosfer padi terbaik hasil aplikasi in planta 44 7 Kromatogram sekuen domain A dan KS hasil subklon dan hasil
1
PENDAHULUAN
Latar Belakang
Padi (Oryza sativa L.) merupakan salah satu tanaman pangan utama di dunia dan merupakan sumber makanan pokok bagi hampir seluruh masyarakat Indonesia (Susanto et al. 2003). Pada tahun 2007, Indonesia merupakan negara swasembada beras dengan kenaikan produksi padi nasional sebesar 4.96%. Namun, perkembangan beberapa tahun terakhir produksi padi nasional cenderung mengalami penurunan. Total produksi padi pada tahun 2014 yaitu sebesar 70.83 juta ton Gabah Kering Giling (GKG) atau mengalami penurunan sebesar 0.45 juta ton (0.63%) dibandingkan tahun 2013 (BPS 2015). Berdasarkan data dari BPS, produktivitas padi nasional mengalami penurunan sebanyak 1.08 juta ton (1.63%) per tahun. Pada tahun 2012 Indonesia masih harus mengimpor beras sebanyak 1.81 juta ton untuk memenuhi kebutuhan pangan nasional. Penurunan produktivitas beras nasional disebabkan oleh beberapa faktor beberapa diantaranya defisiensi unsur hara, cekaman lingkungan, serangan hama dan penyakit tanaman padi.
Permasalahan utama penurunan produksi padi di Indonesia antara lain disebabkan oleh penyakit yang menyerang tanaman padi, seperti penyakit blas oleh cendawan patogen Pyricularia oryzae (Prayudi 2000). Penyakit blas dikenal sebagai penyakit demam pada padi (rice fever disease) di Cina pada awal tahun 1637, dilaporkan sebagai Imochi-byo di Jepang pada tahun 1704, dan disebut sebagai brusone di Itali pada tahun 1828 (Shafaullah et al. 2011). Penyakit blas dianggap sebagai penyakit paling penting karena penyebarannya yang luas dan menyebabkan kehilangan hasil yang parah. P.oryzae dapat menyerang pada seluruh fase pertumbuhan tanaman padi dan mampu menurunkan produksi padi dalam jumlah
besar. Cendawan ini menginfeksi tanaman padi bagian daun (leaf blast), buku (node
blast), leher malai (neck blast), bulir padi (spikelet blast) dan daun pelepah (collar
rot) (Scardaci et al. 1997). Penyakit blas pada tanaman padi bersifat kosmopolit,
yaitu menyerang tanaman padi di seluruh dunia. Akibat dari serangan cendawan penyebab penyakit blas ini produksi padi dapat menurun secara signifikan, yaitu sekitar 30-50% atau bahkan dapat mencapai 70% (Munoz et al. 2007). Penyakit blas telah menurunkan hasil tanaman padi di Asia Tenggara dan Amerika Selatan sekitar 30-50% dan mengakibatkan kerugian jutaan dolar Amerika. Di Indonesia serangan penyakit blas dapat mencapai seluas 1.285 juta hektar atau sekitar 12% dari luas total pertanaman padi di Indonesia. Daerah endemik penyakit blas di Indonesia adalah Lampung, Sumatera Selatan, Jambi, Sumatera Barat, Sulawesi Tengah, Sulawesi Tenggara, dan Jawa Barat (Sukabumi) (Direktorat Perlindungan Tanaman Pangan 2013).
antagonis. Penggunaan mikrob filosfer sebagai agens hayati dalam pengendalian penyakit tanaman masih belum banyak dilakukan. Pemakaian aktinomiset filosfer sebagai agens hayati tidak menimbulkan masalah kesehatan, resistensi terhadap patogen dan kontaminasi lingkungan. Aktinomiset filosfer merupakan mikroorganisme kelompok bakteri Gram positif yang habitatnya di permukaan daun dan memiliki kemampuan sintesis berbagai macam senyawa bioaktif sebagai antibakteri dan antifungi (Hasegawa et al. 2006) yang mampu menekan kolonisasi patogen daun secara langsung. Berbeda dengan mikrob rizosfer dan mikrob tanah, perbedaan habitat dengan patogen daun mengakibatkan aplikasi mikrob tersebut menjadi kurang efektif untuk pengendalian penyakit blas. Dengan demikian, aktinomiset filosfer memiliki potensi untuk dikembangkan sebagai agens hayati dalam pengendalian penyakit blas pada daun tanaman padi. Namun informasi terkait penggunaan mikrob antagonis yaitu aktinomiset filosfer sebagai agens hayati pengendali penyakit blas pada padi masih sangat terbatas. Oleh karena itu, informasi terkait eksplorasi aktinomiset filosfer yang menghasilkan senyawa bioaktif sangat penting dilakukan untuk mendapatkan aktinomiset potensial sebagai agens hayati pengendali penyakit blas yang disebabkan oleh P. oryzae.
Tujuan Penelitian
Penelitian ini bertujuan memperoleh isolat aktinomiset filosfer padi yang berpotensi sebagai agens hayati pengendali penyakit blas daun, mengidentifikasi isolat aktinomiset berdasarkan sekuens gen 16S rRNA, serta menganalisa gen yang berperan dalam biosintesis senyawa antifungi. Selanjutnya mengaplikasikan isolat aktinomiset filosfer terpilih di rumah kaca untuk mengendalikan penyakit blas daun pada padi.
Manfaat Penelitian
2
TINJAUAN PUSTAKA
Penyakit Blas Daun oleh Cendawan Pyricularia oryzae
Permasalahan utama produksi padi di Indonesia antara lain penyakit yang menyerang tanaman padi yang mengakibatkan penurunan jumlah produksi baik kualitas maupun kuantitas. Penyakit tanaman padi yang disebabkan oleh cendawan patogen antara lain penyakit blas (Pyricularia oryzae), bercak daun cokelat (Helminthosporium oryzae), busuk batang (Helminthosporium sigmoideum), dan hawar pelepah daun (Rhizoctonia solani). Penyakit utama pada tanaman padi salah satunya disebabkan oleh cendawan Pyricularia oryzae Cav. penyebab penyakit blas (Prayudi 2000). Penyakit blas dapat menyerang semua bagian tanaman padi dari persemaian, stadia vegetatif dengan menyerang daun, dan stadia generatif dengan menyerang leher dan cabang malai, dan bulir. Varietas tanaman padi yang rentan dan kondisi lingkungan yang mendukung penyakit ini dapat menyebabkan petani gagal panen atau puso.
Karakteristik P. oryzae
Cendawan P. oryzae (teleomorph: Magnaporthe oryzae) merupakan kelompok cendawan kelas Ascomycota. Secara morfologi, cendawan P. oryzae
memiliki konidia berbentuk bulat, lonjong, tembus cahaya, dan bersekat dua (3 ruangan). Konidia P. oryzae mempunyai panjang kurang lebih 19-27 x 8-10 μm (Ou 1985) (Gambar 1). Reproduksi seksual P. oryzae tidak ditemukan di alam tetapi hanya ada di laboratorium yakni Magnaporthe grisea (Hebert) Harr (Agrios 2005). Cendawan P. oryzae adalah penyebab penyakit blas, yang merupakan salah satu penyakit paling penting dan merusak pada tanaman padi (Rossman et al. 1990). Ou (1985) mengungkapkan bahwa munculnya gejala blas pada permukaan daun padi terjadi karena tiga faktor yaitu daya menginfeksi patogen yang cukup kuat, kerentanan tanaman dan faktor lingkungan terutama suhu dan kelembaban yang mendukung perkembangan penyakit.
Cendawan P. oryzae menyerang tanaman padi mulai dari fase vegetatif sampai stadia pembentukan malai atau fase generatif. Serangan blas yang berat dapat menimbulkan puso dan atau menggagalkan panen (Santika dan Sunaryo 2008). Penyakit blas merupakan salah satu kendala utama dalam budidaya padi karena bila terserang cendawan P. oryzae sejak dini, akan mengakibatkan penurunan produksi hingga 70% (Ou 1985).
Gejala Penyakit Blas
sebelum masa pengisian bulir, maka dapat terjadi kehampaan pada bulir. Batang tanaman padi dapat terinfeksi akibat penularan dari pelepah daun, sehingga batang membusuk dan mudah rebah. Satu daur penyakit blas dimulai ketika spora cendawan menginfeksi dan rnenghasilkan suatu bercak pada tanaman padi dan berakhir ketika cendawan bersporulasi dan rnenyebarkan spora baru rnelalui udara. Apabila kondisi lingkungan menguntungkan, satu daur dapat terjadi dalam waktusekitar 1 minggu. Selanjutnya dari satu bercak dapat rnenghasilkan ratusan sampai ribuan spora dalam satu malam dan dapat terus rnenghasilkan spora selama lebih dari 20 hari. Pada kondisi kelembaban dan suhu yang mendukung, cendawan blas dapat mengalami banyak daur penyakit dan menghasilkan kelimpahan spora yang tinggi pada akhir musim. Tingkat inokulum yang tinggi ini sangat berbahaya bagi tanaman padi yang rentan (Scardaci et al. 1997).
Gambar 1 Gejala serangan blas pada daun padi fase vegetatif dan generatif di daerah Sukabumi, Jawa Barat. (a) serangan blas menyebabkan tanaman puso, (b) gejala bercak blas berbentuk belah ketupat (tanda panah hitam), (c) koloni P. oryzae pada media potato dextrose agar
(PDA), (d) struktur mikroskopis spora aseksual (konidia) P. oryzae
dengan skala pada bar 20 µm. (Sumber : dokumentasi pribadi)
Siklus Hidup P. oryzae
melanin yang ada pada dinding appresoria. Proses penetrasi appresoriapada kondisi optimum berlangsung 8-10 jam. Hifa yang terus berkembang dan menginfeksi akan menimbulkan bercak sebagai tanda sel dan jaringan mengalami nekrosis. Pada kelembapan yang tinggi, bercak pada tanaman yang rentan menghasilkan konidia selama 3-4 hari. Konidia ini sangat mudah tersebar dan merupakan inokulum untuk infeksi selanjutnya (Leung dan Shi 1994).
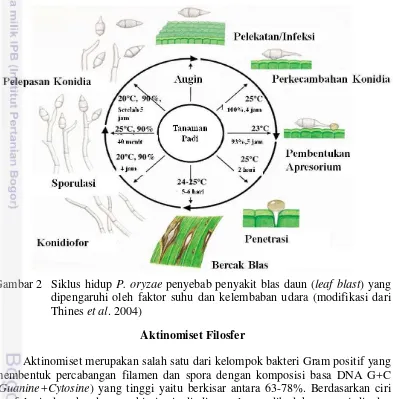
Daur hidup P.oryzae pada tanaman padi diawali dengan proses infeksi atau pelekatan spora (konidia) pada saat daun padi dalam keadaan basah dan pada kondisi lingkungan yang mendukung. Perkecambahan akan terjadi setelah 3 jam pelekatan. Bercak pertama akan muncul 5-6 hari setelah inokulasi pada suhu 24-25oC. Perkembangan dari bercak kecil menjadi bercak besar akan berlangsung cepat pada suhu 32oC selama 8 hari. Sporulasi terjadi ketika kelembaban di atas 90%, konidiofor dibentuk selama 4-6 jam dengan rata-rata pembentukan 1 konidia selama 40 menit. Sporulasi maksimum terjadi pada 7–12 hari setelah inokulasi dan berlanjut hingga 60 hari (Gambar 2).
Gambar 2 Siklus hidup P. oryzae penyebab penyakit blas daun (leaf blast) yang dipengaruhi oleh faktor suhu dan kelembaban udara (modifikasi dari Thines et al. 2004)
Aktinomiset Filosfer
kait, spiral, atau heliks (Miyadoh 1997). Adanya perbedaan pembentukan miselia dan struktur rantai spora tersebut menunjukkan karakter unik yang dimiliki oleh
Streptomyces. Aktinomiset yang tidak membentuk miselia aerial atau hanya membentuk miselia dalam substrat tergolong ke dalam kelompok
non-Streptomyces. Aktinomiset diklasifikasikan sebagai berikut (Stackebrandt et al.
1997):
Domain : Bacteria Filum : Actinobacteria Kelas : Actinobacteria Subkelas : Actinobacteridae Ordo : Actinomycetales
Aktinomiset diketahui mampu menghasilkan beragam senyawa bioaktif, yaitu sekitar 70% dari total senyawa bioaktif yang diperoleh dari bakteri. Senyawa bioaktif ini telah dimanfaatkan di bidang kesehatan, pertanian dan industri.
Aktinomiset mampu menghasilkan beragam metabolit sekunder dengan beragam fungsi biologi seperti antimikrob, inhibitor enzim dan enzim pendegradasi bahan
organik. Berbagai senyawa antimikrob yang dihasilkan oleh aktiomiset, khususnya
Streptomyces spp. berupa tetrasiklin, streptomisin, eritromisin, kloramfenikol, ivermektin, dan rifampisin (Takahashi 2004).
Salah satu agens hayati yang mempunyai kemampuan menghambat aktivitas patogen daun yaitu mikrob filosfer (habitat di permukaan daun), termasuk diantaranya kelompok aktinomiset. Keberadaannya dalam komunitas yang sama dengan patogen lebih mampu menghambat pertumbuhan patogen daun melalui kompetisi ruang, nutrisi, maupun sintesis senyawa bioaktif yang mempunyai aktivitas anti-patogen. Kompetisi diantara mikrob tersebut memegang peranan penting terhadap kerapatan populasi pada daun atau filosfer, serta pada terjadinya proses infeksi dari patogen (Lindow dan Brandl 2003).
Penapisan mikrob yang potensial untuk digunakan sebagai agens hayati pengendali patogen tanaman telah banyak dilakukan. Namun, setelah diaplikasikan kemampuan pengendaliannya secara in planta, hanya sedikit dari mikrob yang potensial secara in vitro berhasil diaplikasikan di lapang. Salah satu alasan atas kegagalan ini adalah kurang tepatnya prosedur penapisan dalam menseleksi mikrob yang cocok dalam mengendalikan penyakit yang disebabkan oleh patogen target (Pliego et al. 2011). Sampai saat ini, potensi pengendalian serangan penyakit blas pada tanaman padi dengan menggunakan mikrob belum banyak dikaji, khususnya penggunaan aktinomiset filosfer yang diharapkan merupakan terobosan baru pengendalian penyakit blas pada tanaman padi.
Gen Penyandi Senyawa Bioaktif
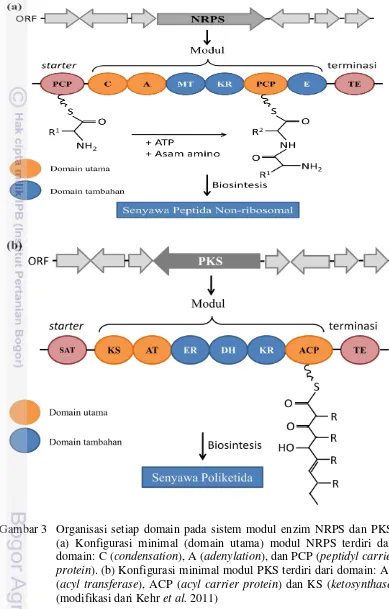
2001). Peptida non-ribosomal merupakan senyawa bioaktif yang dibentuk dari monomer asam amino yang sederhana. Peptida non-ribosomal disintesis oleh gen NRPS yang terdiri dari multimodular dan protein multifungsional (Gambar 3).
Pada kelompok aktinomiset, sistem modul enzim NRPS dan PKS disusun oleh tiga domain utama yaitu dua domain berfungsi sebagai katalitik dan satu domain sebagai pembawa (carrier). Domain utama pada NRPS terdiri dari domain kondensasi (C), adenilasi (A) dengan jumlah pasang basa 700-800 pb, dan
peptidyl carrier protein (PCP), sedangkan domain utama pada PKS antara lain, ketosintase (KS) dengan jumlah pasang basa 1200-1400 pb, acyl tranferase (AT), dan acyl carrier protein (ACP) (Ayuso-Sacido dan Genilloud 2004). Enzim NRPS dan PKS memiliki ukuran yang besar sekitar 200 sampai 2000 kDa sebagai enzim mutifungsional yang memiliki modul-modul yang berperan dalam sintesis suatu senyawa bioaktif.
Penggunaan domain KS dan A dalam studi keragaman gen PKS dan NRPS disebabkan domain ketosintase (KS) dan domain adenilasi (A) merupakan domain yang ada dalam tiap modul dan memperlihatkan derajat konservasi yang tinggi di antara domain lainnya. Mikroorganisme yang berpotensi menghasilkan senyawa bioaktif dicirikan dengan adanya gen penyandi enzim PKS dan NRPS melalui analisis fragmen DNA penyandi domain ketosintase (KS) dan domain adenilase (A) (Moffit dan Neilan 2003).
Beberapa produk senyawa bioaktif poliketida dan peptida non-ribosomal yang dihasilkan oleh aktinomiset telah dimanfaatkan dalam bidang pertanian. Di China, dua produk fungisida komersial yaitu Jinggangmycin dan MycostopTM telah digunakan untuk mengendalikan mikrob patogen, sedangkan di Jepang,
Phytomycin dengan bahan aktifnya streptomisin telah digunakan untuk mengendalikan mikrob patogen. Senyawa antifungi yang dihasilkan oleh isolat aktinomiset PM5, yaitu senyawa alifatik dengan dua unit lakton dan keton karbonil dapat menghambat pertumbuhan miselia Pyricularia oryzae dan
Rhizoctonia solani pada tanaman padi (Prabavathy et al. 2006).
Mekanisme Pengendalian Hayati
Mekanisme kerja pengendalian penyakit tanaman secara hayati yang menggunakan mikrob dapat terjadi secara langsung maupun tidak langsung. Pengedalian mikrob patogen tanaman secara langsung melalui aktivitas antibiosis, kemampuan berkompetisi (nutrisi dan spasial), dan lisis sel mikrob patogen melalui aktivitas enzim pendegradasi. Antibiosis terjadi ketika agens hayati mengkolonisasi jaringan tanaman dan menghasilkan satu atau lebih senyawa bioaktif yang menghambat pertumbuhan bahkan membunuh patogen. Beberapa jenis aktinomiset telah dilaporkan sebagai agens hayati dengan aktivitas antibiosis terhadap patogen tanaman, yaitu Streptomyces spp. yang mampu mengendalikan serangan Rhizoctonia solani pada pembibitan tomat (Cao et al. 2004).
Pengendalian patogen tanaman oleh agens hayati dapat terjadi secara tidak langsung melalui induksi pertahanan tanaman (induced systemic resistance) dan produksi senyawa pemacu pertumbuhan tanaman (Berg dan Hallman 2006).
Kondisi tersebut dapat meningkatkan kesehatan dan pertahanan tanaman sehingga secara tidak langsung dapat menekan serangan patogen. Penapisan mikrob sebagai agens hayati pengendali suatu jenis penyakit telah banyak dilakukan. Pendekatan
yang umum dilakukan ialah melalui penapisan in vitro dilanjutkan dengan pengujian
efektivitas mikrob terpilih secara in planta. Sampai saat ini, kajian peran biologi
Penelitian ini bertujuan mengkaji potensi aktinomiset filosfer dalam
mengendalikan penyakit blas daun yang disebabkan P. oryzae pada tanaman padi
melalui uji efektivitas pengendalian blas in planta. Hasil yang diperoleh diharapkan
dapat dikembangkan untuk mengendalikan blas pada tanaman padi, sehingga produksinya meningkat melalui aplikasi teknologi yang ramah lingkungan.
3
METODE
Kerangka Penelitian
Kerangka penelitian meliputi isolasi aktinomiset filosfer padi kemudian dilanjutkan dengan uji aktivitas antifungi isolat aktinomiset terhadap P. oryzae
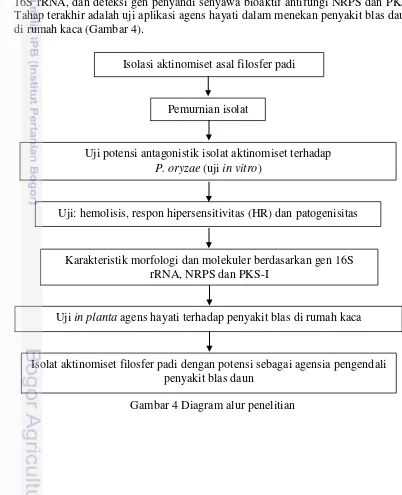
secara in vitro. Isolat terpilih diuji reaksi hemolitik, hipersensitivitas tembakau dan uji patogenisitas terhadap padi. Isolat terpilih diidentifikasi berdasarkan gen 16S rRNA, dan deteksi gen penyandi senyawa bioaktif antifungi NRPS dan PKS. Tahap terakhir adalah uji aplikasi agens hayati dalam menekan penyakit blas daun di rumah kaca (Gambar 4).
Gambar 4 Diagram alur penelitian
Uji potensi antagonistik isolat aktinomiset terhadap
P. oryzae (uji in vitro) Pemurnian isolat
Isolasi aktinomiset asal filosfer padi
Karakteristik morfologi dan molekuler berdasarkan gen 16S rRNA, NRPS dan PKS-I
Uji in planta agens hayati terhadap penyakit blasdi rumah kaca Uji: hemolisis, respon hipersensitivitas (HR) dan patogenisitas
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Agustus 2015 sampai Juni 2016 bertempat di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Uji aplikasi in planta dilaksanakan di Rumah Kaca Balai Besar Bioteknologi dan Sumberdaya Genetika Pertanian (BB-Biogen), Bogor.
Bahan dan Alat
Bahan yang digunakan adalah isolat patogen P. oryzae ras 173 yang diperoleh dari Balai Besar Padi, Unit Kebun Percobaan Muara, Bogor. Benih padi varietas Ciherang, bakteri E.coli DH5α, enzim restriksi EcoRI. Media isolasi aktinomiset yaitu Humic-acid Vitamine agar (HV-A), Actinomycete Isolation Agar (AIA), dan Starch Caseine Agar (SCA). Media kultivasi Potato Dextrose Agar (PDA), International Streptomyces Project No. 2 (ISP2), media sporulasi
Oat Meal Agar (OMA), Luria Bertani (LB), Luria Bertani Agar (LA). Kit isolasi DNA genom dan ekstraksi plasmid dari Genenaid. Alat yang digunakan adalah
Laminar Air Flow (LAF), sentrifugator, vortex, Thermal cycler, mesin elektroforesis, inkubator bergoyang serta alat-alat yang umum digunakan dalam percobaan mikrobiologi.
Prosedur Penelitian
Isolasi Aktinomiset Filosfer Padi
Pengambilan sampel daun dilakukan di area persawahan yang terserang penyakit blas yaitu Sukabumi, Situgede dan Jasinga, Jawa Barat. Sampel daun diambil dari tanaman padi varietas Ciherang. Metode isolasi aktinomiset filosfer dilakukan dengan metode pencucian (Jacques dan Morris 1995). Sebanyak 10 g sampel daun padi dimasukkan ke dalam oven suhu 70oC selama 15 menit untuk
pre-treatmentheat shock. Sampel kemudian dimasukkan ke dalam botol berisi 90 mL garam fisiologis 0.85% steril. Sampel dihomogenkan dengan digoyang 150 rpm selama 1 jam pada suhu ruang. Suspensi yang diperoleh kemudian dilakukan pengenceran bertingkat 10-1, 10-2, hingga 10-3, kemudian 0,1 mL dari masing-masing seri pengenceran disebar ke cawan Petri masing-masing-masing-masing berisi 3 jenis media isolasi yaitu media HVA (Humic-Acid Vitamin Agar), SCA (Starch Casein Agar) dan AIA (Actinomycetes Isolation Agar) (Lampiran 1). Isolat aktinomiset yang diperoleh dari hasil isolasi kemudian dimurnikan dan dipindahkan ke media ISP2 (International Streptomyces Project No. 2).
Skrining Aktivitas Antifungi terhadap P. oryzae
Skrining aktivitas antagonistik isolat aktinomiset terhadap patogen tanaman padi penyebab penyakit blas daun P. oryzae menggunakan metode dual culture (Khare et al. 2010). Isolat aktinomiset digores pada media Potato Dextrose Agar (PDA) dengan jarak 3 cm dari koloni P. oryzae. Koloni P. oryzae
inkubasi pada suhu 28oC. Persentase penghambatan pertumbuhan P. oryzae
diukur menggunakan persamaan :
– %
Keterangan : D1 = diameter koloni P. oryzae pada kelompok kontrol, D2 = diameter koloni P. oryzae pada kelompok perlakuan isolat aktinomiset.
Uji Reaksi Hemolisis
Isolat aktinomiset digoreskan pada media Sheep Blood Agar (5% darah domba dan 2.5% NaCl) dan diinkubasi selama 1-3 hari pada suhu ruang. Jika terbentuk lisis darah (zona bening di sekitar koloni) menunjukkan adanya aktivitas hemolitik (produksi hemolisin), yang mengindikasikan bahwa aktinomiset tersebut diduga patogen pada manusia maupun hewan (Bernal et al. 2015).
Uji Respon Hipersensitivitas dan Patogenisitas
Isolat aktinomiset filosfer dilakukan uji respon hipersensitivitas (HR) menggunakan tanaman tembakau (dikotil) berumur 2 bulan (Zou 2006). Masing-masing isolat aktinomiset dengan kerapatan ±108 sel/mL dalam kultur ISP2 cair diinjeksikan ke daun tanaman tembakau menggunakan syringe steril 1 mL (tanpa jarum). Pengamatan respon hipersensitivitas dilakukan hingga 3-5 hari setelah injeksi. HR positif ditunjukkan dengan adanya nekrotik pada jaringan daun tanaman di area injeksi. Percobaan dilakukan tiga kali ulangan untuk setiap isolat aktinomiset.
Uji patogenisitas terhadap tanaman padi dilakukan menggunakan benih padi IR64 (14 hst) sebagai model untuk tanaman padi (monokotil). Bagian ujung daun digunting secara aseptik dan kemudian dicelupkan ke dalam suspensi isolat uji selama ± 10 detik. Pengamatan gejala penyakit yang timbul dilakukan pada 14 hari setelah inokulasi. Uji patogenisitas negatif apabila isolat aktinomiset tidak menimbulkan gejala penyakit (nekrotik).
Isolasi DNA Genom Aktinomiset
Isolasi DNA genom isolat aktinomiset terpilih pada penelitian ini menggunakan Genomic DNA Mini Kit (Blood/Cultured Cell) (Geneaid, Taiwan). Prosedur yang digunakan sesuai dengan manual yang disediakan oleh produsen, dengan modifikasi yaitu pada tahap pre-lisis sel dan waktu inkubasi tahap lisis. Tahap pre-lisis yaitu dengan penambahan 200 μL 20 mM Tris-HCl, 2 mM EDTA, dan 1% Triton X-100. Tahap akhir pre-lisis yaitu dengan penambahan 200 μL bufer lisozim (20 mg/mL lisozim, 20 mM Tris-HCl, 2 mM EDTA, 1% Triton X-100, pH 8.0) dan glass beads, lalu tabung mikro dikocok dengan vorteks hingga pelet terlihat lisis (±20 menit). Tahap isolasi DNA dilanjutkan dengan mengikuti prosedur Geneaid. Kuantifikasi konsentrasi DNA hasil isolasi dengan menggunakan alat nanodrop (Thermo Scientific, USA).
Amplifikasi Gen 16S rRNA, Domain A dan KS
template, 12.5 µl GoTaq Green Mastermix 2x (Promega, Madison, USA), 1.5 µL (10 pmol) masing-masing primer 63F dan 1387R (Marchesi et al. 1998), dan 6.5 µL nuclease free water (NFW). Kondisi PCR terdiri atas pre-denaturasi (95ºC, 2 menit), denaturasi (95ºC, 30 detik), annealing (55ºC, 30 detik), elongasi (72ºC, 1 menit), dan elongasi akhir (72ºC, 7 menit).
Amplifikasi gen penyandi domain KS dan domain A dilakukan dengan menggunakan primer degeneratif K1F (5’-TSAAGTCSAACATCGGBCA-3’) dan M6R (5’-CGCAGGTTSCSGTACCAGTA-3’) untuk amplifikasi domain KS dan A3F (5’-GCSTACSYSATSTACACSTCSGG-3’), A7R (5’- SASGTCVCCSGTS- CGGTAS-3’) untuk amplifikasi domain A (Ayuso-Sacido dan Genilloud 2004). PCR mix dengan total reaksi 25 µL terdiri dari 0.25 µL LA Taq polimerase (TaKaRa, Bio Inc, US), 2.5 µL 10x LA PCR bufer II (dengan Mg2+), 4 µL dNTP
mix (masing-masing 2.5 mM), 4 µL DNA template (< 500 ng), 1.5 µL (10 pmol) masing-masing primer F dan R, dan 11.25 µL NFW. Kondisi PCR mengikuti metode Ayuso-Sacido dan Genilloud (2004). Amplikon fragmen DNA penyandi gen 16S rRNA, domain KS dan domain A divisualisasi menggunakan elektroforesis dengan gel agarosa 1% (b/v), pewarnaan molekul DNA dilakukan menggunakan etidium bromida. Isolat yang mempunyai gen penyandi domain KS menunjukkan terbentuknya pita DNA berukuran 1200-1400 pb dan domain A berukuran 700-800 pb.
Kloning, Sekuensing dan Analisis Bioinformatika Domain A dan KS
Produk PCR domain A dan KS disub-klon menggunakan TA cloning kit
(Invitrogen, USA) ke dalam vektor kloning pGEMT-Easy (Promega, USA) sesuai dengan prosedur dari produsen. Vektor pGEMT-Easy yang telah disisipi fragmen DNA domain KS dan A kemudian ditransformasi ke dalam sel kompeten E. coli
DH5α dengan metode heat shock. Seleksi biru-putih dilakukan untuk seleksi
E.coli rekombinan. Verifikasi hasil kloning menggunakan PCR koloni dan enzim restriksi EcoRI berdasarkan Sambrook dan Russel (2001). Visualisasi hasil restriksi dilakukan dengan elektroforesis menggunakan gel agarosa 1% (b/v).
Plasmid rekombinan yang merupakan produk hasil kloning disekuensing untuk pembacaan sekuen DNA di perusahaan jasa sekuensing First Base Co.
Primer yang digunakan untuk sekuensing plasmid rekombinan yaitu primer universal M13F dan M13R. Hasil sekuensing dibandingkan dengan data GenBank
yang terdapat di NCBI (www.ncbi.nlm.nih.gov) melalui program Basic Local Alignment Search Tool Nucleotida (BLAST-N) untuk gen 16S rRNA dan BLAST-X untuk gen NRPS dan PKS. Untuk pensejajaran serta konstruksi pohon filogenetik gen 16S rRNA, domain KS (PKS) dan domain A (NRPS) dilakukan dengan software MEGA 5 (Tamura et al. 2011) berdasarkan neighbor-joining tree
(NJT) (Saitou dan Nei 1987), dan mengacu pada best model TN93+G (Tamura-3 parameter) dengan nilai bootstrap 1000x.
Persiapan Aplikasi Agens Hayati terhadap Penyakit Blas di Rumah Kaca
diinkubasi dalam inkubator bercahaya neon 10 volt selama 2 x 24 jam untuk menginduksi sporulasi. Pemanenan spora dilakukan dengan penambahan akuades steril yang mengandung 0.1% tween 80 (v/v) ke permukaan koloni P. oryzae. Spora P. oryzae dipanen dengan cara menggosok-gosok permukaan cendawan dengan menggunakan kuas steril. Suspensi spora kemudian disaring dan ditampung dalam Erlenmeyer steril. Kerapatan konidia yang akan digunakan sebagai inokulum adalah 2 x 105 konidia/mL (IRRI 2002), sesuai SOP BB Padi (Anggiani 2012). Penghitungan kerapatan konidia dilakukan dengan menggunakan hemasitometer Neubauer di bawah mikroskop cahaya dengan perbesaran 400X. Infeksi spora P. oryzae ke daun tanaman padi dilakukan dengan penyemprotan.
Formulasi yang digunakan pada aplikasi di rumah kaca yaitu kultur suspensi agens hayati dengan konsentrasi 1 x 105 sel/mL. Suspensi dipersiapkan dengan kultivasi 11 isolat aktinomiset terpilih pada 100 mL media ISP2 cair dengan inkubator goyang 120 rpm, suhu ruang selama 7 hari. Aplikasi agens hayati dilakukan dengan cara penyemprotan kultur suspensi 30 mL/pot dengan masing-masing pot berisi 5 tanaman.
Aplikasi agens hayati untuk penekanan keparahan penyakit blas pada padi sawah menggunakan benih padi varietas Ciherang yang merupakan varietas rentan blas. Sebanyak 20 g benih padi varietas Ciherang direndam dalam natrium hipoklorit 2%, kemudian dikocok selama 2 menit untuk sterilisasi permukaan. Benih dibilas dengan akuades steril selama 2 menit dengan 3 kali pengulangan kemudian benih direndam dengan akuades steril semalam. Benih dipindahkan ke atas kapas lembab steril dan diinkubasi 2 x 24 jam. Benih yang berkecambah kemudian dipindahkan ke dalam ember plastik (diameter 25 cm, tinggi 25 cm) berisi campuran tanah persawahan 3 kg dan pupuk kandang sebanyak 300 g. Setiap ember plastik berisi 5 tanaman.
Rancangan Percobaan Aplikasi Agens Hayati di Rumah Kaca
Rancangan percobaan yang digunakan untuk uji blas daun adalah Rancangan Acak Lengkap (RAL) faktorial dengan 4 ulangan. Aplikasi formula agens hayati dengan penyemprotan 30 mL suspensi/pot dan dilakukan saat tanaman padi umur 7 dan 14 hari setelah tanam (HST). Inokulasi spora P. oryzae
tanaman diberi penilaian penyakit blas bedasarkan SES IRRI (2002) (Tabel 1), kemudian intensitas blas dan penghambatan relatif (reduksi penyakit blas) dihitung dengan menggunakan rumus:
Intensitas serangan penyakit blas daun dapat dihitung dengan persamaan :
∑
IB = Intensitas serangan penyakit blas (%) n = Jumlah daun tanaman yang terserang blas v = Nilai skor serangan
N = Jumlah seluruh daun yang diamati Z = Nilai skor serangan tertinggi
engham atan relatif ontrol atogen ontrol atogen ejala erlakuan x 100
Tingkat serangan blas dinilai menggunakan Standar Evaluation for Blast Disease dari IRRI (2002) (Tabel 1). Pengamatan dilakukan pada jumlah daun terserang dan besar bercak pada setiap daun terserang. Kriteria tingkat serangan blas daun padi sebagai berikut:
Tabel 1 Skala skor penyakit blas daun tanaman padi (IRRI 2002) Skor Sifat Gejala
0 T Tidak ada bercak
1 T Bercak sebesar ujung jarum dan berwarna coklat, tidak ada pusat sporulasi
2 T Bercak lebih besar dari ujung jarum
3 T Bercak nekrotik, abu-abu bundar, sedikit memanjang ±1-2 mm tepi coklat
4 MT Bercak khas blas (belah ketupat) ukuran 3 mm, luas daun terserang <2%
5 MT Bercak khas blas, luas daun terserang 2-10% 6 R Bercak khas blas, luas daun terserang 11-25% 7 R Bercak khas blas, luas daun terserang 26-50%
8 R Bercak khas blas, luas daun terserang 51-75%, beberapa daun mulai mati
9 R Lebih dari 75% luas daun terserang atau semua daun mati T: tahan, MT: medium tahan, R: rentan
Data seluruh hasil percobaan dianalisis dengan menggunakan analisis ragam pada taraf kepercayaan 95% (ANOVA), jika menunjukkan pengaruh nyata maka selanjutnya dilakukan uji perbandingan nilai tengah dengan menggunakan
4
HASIL DAN PEMBAHASAN
Isolasi Aktinomiset Filosfer Padi
Sampel daun padi yang digunakan pada penelitian ini diperoleh dari area persawahan yang terserang penyakit blas yang disebabkan oleh cendawan patogen
P. oryzae. Area persawahan yang menjadi lokasi pengambilan sampel daun padi yaitu Situgede, Sukabumi dan Jasinga, Jawa Barat. Daun padi yang diambil adalah daun yang berasal dari tanaman padi varietas Ciherang yang sehat (fase anakan produktif, fase berbunga, dan fase pembentukan bulir) pada area yang terinfeksi blas. Kejadian dan keparahan penyakit blas di Sukabumi adalah paling parah dibandingkan dengan di daerah Jasinga dan Situgede. Penyakit blas paling mendominasi di daerah Sukabumi. Semua stadia umur padi terserang penyakit blas, namun pada fase generatif gejala terlihat lebih jelas dan bila sudah parah terdapat blas leher malai yang mengakibatkan gagal panen. Aktinomiset filosfer diisolasi menggunakan tiga jenis media yaitu media HV-A, AIA, dan SCA dengan tujuan untuk memperoleh beragam isolat aktinomiset (Gambar 5).
Gambar 5 Koloni aktinomiset hasil isolasi dari sampel daun (tanda panah) pada tiga jenis media isolasi : (a) HV-A, (b) AIA, (c) SCA, yang diinkubasi pada suhu ruang, selama 3 – 4 minggu
Koloni aktinomiset dari genus Streptomyces tumbuh sebagai miselia filamen pada media ISP2. Koloni Streptomyces terdiri dari dua tipe miselia, yaitu substrat (vegetatif) miselium dan miselium udara (aerial mycelium). Sedangkan untuk isolat aktinomiset genus non-Streptomyces hanya terdiri dari miselia substrat (Gambar 7.i). Media isolasi yang digunakan yaitu media HV-A yang merupakan media selektif yang mengandung asam humat dan digunakan secara luas untuk memacu pertumbuhan aktinomiset dari tanah dan air serta menekan pertumbuhan kontaminan seperti bakteri dan cendawan (Hayakawa dan Nonomura 1987; Khanna et al. 2011). Media AIA dengan komposisi sodium kasein sebagai sumber nitrogen dan asparagin sebagai sumber asam amino dan nitrogen sangat baik digunakan sebagai media pertumbuhan aktinomiset (Eaton et al. 2005). Media SCA dengan komposisi pati sebagai sumber karbohidrat kompleks dan kasein berfungsi sebagai sumber nitrogen umum digunakan sebagai media pertumbuhan aktinomiset penghasil senyawa bioaktif (Wellington dan Cross 1983). Perlakuan pemanasan kering sampel daun sebelum proses isolasi aktinomiset bertujuan untuk menekan pertumbuhan bakteri atau mikrob non-target dan spora aktinomiset akan terpacu untuk tumbuh (Hayakawa 2008).
Skrining Aktivitas Antifungi dan Uji Patogenisitas
Gambar 7 Koloni aktinomiset filosfer padi yang mampu menghambat pertumbuhan P.oryzae pada media PDA, yang diinkubasi pada suhu ruang selama 7 hari. (a) Kontrol P. oryzae. Isolat aktinomiset : (b) SKB2.3, (c) SKB2.4 (d), STG 24, (e) SKB2.14, (f) JSN2.11
Isolat antagonis dapat menekan pertumbuhan patogen P. oryzae melalui beberapa mekanisme seperti produksi senyawa bioaktif (antibiosis), kompetisi ruang, nutrisi dan parasitisme (Fravel 1988). Uji aktivitas penghambatan pertumbuhan P. oryzae secara in vitro bertujuan untuk menyeleksi isolat aktinomiset yang memiliki aktivitas antibiosis dengan menghasilkan senyawa bioaktif antifungi. Antibiosis merupakan salah satu mekanisme potensial isolat antagonis yang dapat berperan terhadap perlindungan tanaman inang terhadap patogen (Herre et al. 2007).
Uji respon hemolisis dilakukan terhadap 38 isolat aktinomiset dengan aktivitas anti-P. oryzae. Diperoleh 34 isolat menunjukkan hasil negatif dan empat isolat positif hemolitik. Respon hemolitik positif ditunjukkan dengan terbentuknya zona bening disekitar koloni aktinomiset (Gambar 8). Aktinomiset positif hemolitik menunjukkan bahwa isolat tersebut memproduksi hemolisin, yaitu suatu senyawa yang dapat melisiskan sel darah merah. Aktinomiset negatif hemolitik mengindikasikan bahwa isolat tersebut tidak patogen pada manusia dan hewan. Isolat dengan respon negatif hemolitik dilanjutkan dengan uji respon hipersensitivitas.
(a) (b) (c)
Gambar 8 Aktivitas hemolitik isolat aktinomiset pada media agar darah yang diinkubasi pada suhu ruang selama 48-72 jam. (a) koloni aktinomiset, (b) respon hemolisis negatif, dan (c) respon hemolisis positif (ditandai dengan terbentuknya zona bening disekitar koloni aktinomiset) Uji respon hipersensitivitas (HR) dilakukan terhadap 34 isolat aktinomiset dengan respon hemolisis negatif. Sebanyak 31 isolat menunjukkan respon negatif terhadap uji hipersensitivitas pada daun tembakau (tidak menyebabkan nekrosis), dan 3 isolat HR positif. Hal ini menunjukkan bahwa 31 isolat aktinomiset ini tidak bersifat patogen bagi tanaman kelompok dikotil (Gambar 9).
Gambar 9 Respon hipersensitivitas (HR) pada daun tembakau dan gejala nekrosis setelah inokulasi isolat aktinomiset. (a) Xanthomonas oryzae
sebagai kontrol HR positif, (b) E.coli DH5α se agai kontrol HR
negatif, (c) HR negatif isolat STG1.39, dan (d) HR positif isolat SKB2.11. Tanda lingkaran merupakan area penyuntikan isolat dengan gejala nekrosis pada daun tembakau menunjukkan HR positif
Gambar 10 Respon patogenisitas isolat aktinomiset pada daun padi IR64. (a) akuades sebagai kontrol patogenisitas negatif, (b) X. oryzae sebagai kontrol patogenisitas positif, (c) isolat SKB3.1 respon patogenisitas negatif, (d) isolat SKB2.8 respon patogenisitas positif
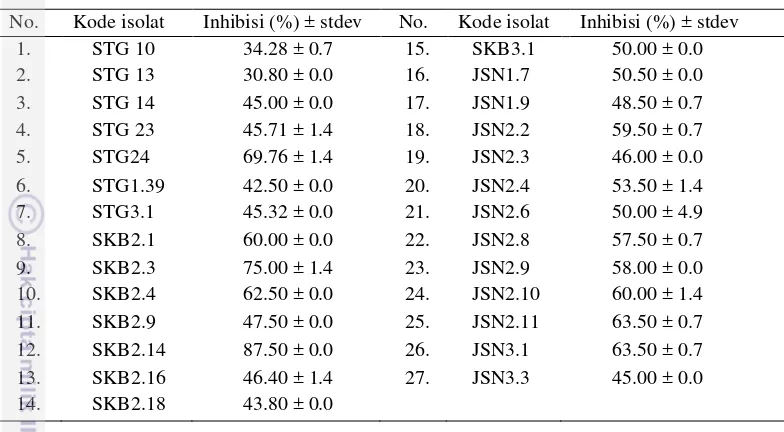
Sebanyak 27 isolat aktinomiset dengan aktivitas anti-P. oryzae telah diketahui memiliki respon negatif terhadap uji hemolisis, hipersensitivitas dan patogenisitas. Nilai persen penghambatan 27 isolat aktinomiset non-patogen disajikan pada Tabel 2. Nilai persen penghambatan yang diperoleh yaitu berkisar 30.80 – 87.50% dengan nilai persen penghambatan tertinggi yaitu 87.50 dan 75% oleh isolat SKB2.14 dan SKB2.3. Pada penelitian ini, isolat aktinomiset yang diisolasi dari Sukabumi memiliki aktivitas persen penghambatan paling tinggi dibandingkan dengan isolat yang diisolasi dari Jasinga dan Situgede karena Sukabumi merupakan area endemik blas dengan tingkat serangan terparah di Jawa Barat. Kondisi yang ekstrim di daerah Sukabumi ini diduga sebagai faktor penentu tingginya aktivitas antifungi isolat atinomiset yang ada pada filosfer padi di daerah tersebut. Sebanyak 27 isolat aktinomiset non-patogen, selanjutnya dipilih 22 isolat dengan persen penghambatan terhadap P. oryzae tertinggi dari masing-masing lokasi pengambilan sampel, yaitu Situgede (kode isolat STG), Sukabumi (SKB) dan Jasinga (JSN) untuk dianalisa secara molekuler berdasarkan gen 16S rRNA, NRPS dan PKS-I.
Tabel 2 Skrining primer isolat aktinomiset filosfer padi non-patogen dengan aktivitas anti-P. oryzae menggunakan metode kultur ganda pada media PDA
No. Kode isolat Inhibisi (%) ± stdev No. Kode isolat Inhibisi (%) ± stdev
1. STG 10 34.28 ± 0.7 15. SKB3.1 50.00 ± 0.0
2. STG 13 30.80 ± 0.0 16. JSN1.7 50.50 ± 0.0
3. STG 14 45.00 ± 0.0 17. JSN1.9 48.50 ± 0.7
4. STG 23 45.71 ± 1.4 18. JSN2.2 59.50 ± 0.7
5. STG24 69.76 ± 1.4 19. JSN2.3 46.00 ± 0.0
6. STG1.39 42.50 ± 0.0 20. JSN2.4 53.50 ± 1.4
7. STG3.1 45.32 ± 0.0 21. JSN2.6 50.00 ± 4.9
8. SKB2.1 60.00 ± 0.0 22. JSN2.8 57.50 ± 0.7
9. SKB2.3 75.00 ± 1.4 23. JSN2.9 58.00 ± 0.0
10. SKB2.4 62.50 ± 0.0 24. JSN2.10 60.00 ± 1.4
11. SKB2.9 47.50 ± 0.0 25. JSN2.11 63.50 ± 0.7
12. SKB2.14 87.50 ± 0.0 26. JSN3.1 63.50 ± 0.7
13. SKB2.16 46.40 ± 1.4 27. JSN3.3 45.00 ± 0.0
14. SKB2.18 43.80 ± 0.0
Amplifikasi Gen 16S rRNA, Domain A dan KS
Hasil amplifikasi gen 16S rRNA dari 22 isolat aktinomiset terpilih menunjukkan panjang fragmen DNA ~1300pb (Gambar 11). Hasil pensejajaran sekuen parsial gen 16S rRNA 22 isolat aktinomiset dengan strain pembanding di
GenBank menggunakan program BLASTN menunjukkan bahwa isolat-isolat tersebut memiliki kemiripan dengan genus Streptomyces (15 isolat), Lentzea (2 isolat), Saccharothrix (2 isolat), Micromonospora (2 isolat) dan Gordonia (1 isolat) (Tabel 3). Pada penelitian ini diperoleh 4 isolat (JSN2.4, JSN2.10, SKB2.4 dan STG13) dengan nilai identitas strain pembanding pada GenBank <98%. Hal ini menunjukkan empat isolat tersebut berpotensi sebagai isolat strain baru. Pada penelitian ini, isolat aktinomiset dari daerah Situgede didominasi oleh kelompok non-Streptomyces, sedangkan dari daerah Jasinga dan Sukabumi didominasi oleh kelompok Streptomyces. Tingkat keragaman yang tinggi berdasarkan sekuen gen 16S rRNA diduga disebabkan oleh faktor biotik dan abiotik. Perbedaan letak geografis pengambilan sampel dan tingkat keparahan penyakit yang ada pada masing-masing lokasi pengambilan sampel diduga mengakibatkan perbedaan komunitas aktinomiset filosfer yang ada pada permukaan daun padi. Menurut Lindow dan Brandl (2003), keragaman spesies mikroba filosfer ditentukan oleh faktor geografis lingkungan.
Gen hibrid NRPS-PKS dapat menghasilkan senyawa bioaktif jenis baru dengan struktur hibrid (Ansari et al. 2004; Zhu et al. 2009).
Gambar 11 Elektroforesis gel agarosa 0.8% yang menunjukkan pita-pita DNA hasil amplifikasi gen 16S rRNA dari 6 isolat aktinomiset filosfer padi dengan ukuran amplikon 1300 pb. Marker 1 Kb ladder
Hasil amplifikasi fragmen DNA penyandi domain A dan domain KS pada isolat aktinomiset menunjukkan isolat-isolat tersebut memiliki gen penyandi kedua domain tersebut dengan ukuran untuk domain A yaitu 700 pb dan domain KS 1200 pb (Gambar 12).
Hasil konstruksi pohon filogenetik dilakukan untuk melihat hubungan kekerabatan antar spesies aktinomiset berdasarkan sekuen gen 16S rRNA (Gambar 13). Pemilihan strain pembanding untuk konstruksi pohon filogenetik mengacu pada strain-strain yang menghasilkan senyawa bioaktif antimikrob atau strain dengan aktivitas antimikrob.
Tabel 3 Identifikasi molekuler isolat aktinomiset terpilih berdasarkan sekuen gen 16S rRNA menggunakan program BLASTN dan deteksi gen NRPS dan PKS-I dengan PCR
No. Isolat Strain pembanding (homologi)
1. JSN2.2 Streptomyces thermocarboxydus
99 0.0 99 AB894408 +/+
2. JSN2.6 Streptomyces thermocarboxydus
99 0.0 99 KJ018992 +/-
3. JSN2.4 Streptomyces thermocarboxydus
91 0.0 81 KT163792 +/+
4. JSN2.8 Streptomyces
thermocarboxydus strain AS13Y
99 0.0 98 AB894406 +/-
5. JSN2.10 Streptomyces thermocarboxydus
97 0.0 99 KT163795 -/+
6. JSN2.11 Streptomyces thermocarboxydus
99 0.0 99 KT163791 +/-
7. SKB2.1 Streptomyces cavourensis
strain A15
99 0.0 96 KF703725 +/+
8. SKB2.3 Streptomyces albolongus
strain BC-32
99 0.0 99 JN609385 +/+
9. SKB2.4 Streptomyces cavourensis 93 0.0 92 KP718519 +/+
10. SKB2.9 Streptomyces
roseochromogenus strain
14. STG3.1 Streptomyces drozdowiczii
isolate PhyCEm-1349
98 0.0 95 AM921646 +/+
15. STG1.39 Streptomyces drozdowiczii
strain NRRL B-24297
19. STG23 Saccharothrix saharensis
Sa152
99 0.0 100 NR108320 +/+
20. STG24 Saccharothrix texasensis
strain 17389
Gambar 13 Pohon filogenetik gen 16S rRNA (neighbour joining tree) menggunakan Tamura- 3 parameter model (bootstrap 1000x). Angka 0.02 menunjukkan skala jarak kekerabatan (distance scale).
Xanthomonas oryzae sebagai out group
Genus
Streptomyces
Genus
Hasil konstruksi pohon filogenetik berdasarkan gen 16S rRNA diperoleh dua grup aktinomiset yaitu genus Streptomyces dan genus non-Streptomyces. Dari pohon filogenetik dapat dilihat hubungan kekerabatan antar isolat aktinomiset yang berasal dari 3 lokasi pengambilan sampel yaitu Situgede (STG), Jasinga (JSN) dan Sukabumi (SKB). Pada pohon filogenetik, seluruh isolat pada lokasi yang berbeda terletak pada clade yang berbeda yang menunjukkan perbedaan sekuens DNA gen 16S rRNA antar isolat terhadap strain pembanding. Semakin panjang batang (branch) menunjukkan hubungan kekerabatan yang jauh dan isolat tersebut berpotensi sebagai isolat strain baru. Isolat STG13, JSN2.4, JSN2.10 dan SKB2.4 dari hasil konstruksi pohon filogenetik memiliki jarak kekerabatan yang jauh dibandingkan isolat-isolat lainnya hal ini menunjukkan bahwa isolat-isolat tersebut merupakan strain baru hal ini didukung dengan nilai bootstrap yang tinggi yaitu 59-99%. Semakin tinggi nilai bootstrap menunjukkan semakin kuatnya pohon filogenetik untuk menunjukkan hubungan kekerabatan. Dari konstruksi pohon filogenetik menunjukkan bahwa antar isolat dari lokasi berbeda membentuk cluster yang berbeda, sehingga dapat ditarik kesimpulan bahwa pada lokasi yang berbeda terdapat keragaman aktinomiset filosfer. Jika dibandingkan dengan out group, kedua grup aktinomiset baik grup Streptomyces maupun
non-Streptomyces tampak jelas terpisah jauh dari Xanthomonas oryzae yang merupakan bakteri Gram negatif. Pemakaian out group dalam pohon filogenetik sebagai parameter untuk mengetahui ketepatan dan kesesuaian dalam konstruksi pohon filogenetik isolat-isolat berdasarkan kemiripan sekuens gen 16S rRNA.
Kloning dan Analisis Bioinformatika Domain A dan KS
Pada penelitian ini deteksi gen NRPS dan PKS-I isolat aktinomiset dengan aktivitas antifungi dilakukan menggunakan teknik PCR (Tabel 3). Kloning domain KS dan A selanjutnya dilakukan untuk tujuan verifikasi bahwa fragmen DNA domain KS dan A yang teramplifikasi pada proses PCR merupakan domain dari enzim PKS-I dan NRPS. Plasmid rekombinan hasil subklon selanjutnya disekuensing dan dilakukan pensejajaran sekuen domain KS dan A menggunakan program BLASTX di GenBank NCBI. Untuk kloning domain KS dan A, dipilih secara random masing-masing empat isolat aktinomiset dari 22 isolat potensial dengan aktivitas antifungi yang memiliki nilai persen penghambatan > 45%. Hasil pensejajaran fragmen DNA domain KS dan A pada GenBank menunjukkan nilai identitas yang rendah untuk domain KS dan A pada data GenBank yaitu 63-87% dan 93-98%, secara berurutan (Tabel 4). Nilai identitas gen PKS-I dan NRPS yang rendah dari hasil BLASTX menunjukkan bahwa isolat-isolat tersebut berpotensi sebagai penghasil senyawa antifungi kelas peptida dan poliketida jenis baru (Claviere dan Notredame 2003). Nilai probabilitas atau peluang yang terhitung secara statistik dalam kesamaan sekuen antara gen penyandi domain KS dan A isolat aktinomiset dengan GenBank digambarkan dengan nilai Expectation value (E-value). Pada analisis menggunakan BLAST, E-value signifikan apabila nilainya 1x10-10 atau lebih kecil (Altschul et al. 1990).
Sekuen DNA domain A dan KS dari hasil BLASTX pada empat isolat aktinomiset representatif menunjukkan bahwa domain KS dan A merupakan domain yang ada pada sistem modular enzim PKS-I dan NRPS dari genus
penghasil berbagai jenis senyawa bioaktif dengan aktivitas antifungi dan antibakteri (Usha et al. 2011; Reddy et al. 2011; Atta dan Ahmad 2009; Khucharoenphaisan et al. 2012). Sebanyak 10,000 jenis antibiotik yang dihasil oleh aktinomiset, 80% merupakan produk dari genus Streptomyces (Arifuzzaman
et al. 2010).
Tabel 4 Analisa bioinformatika sekuen asam amino gen penyandi domain A (NRPS) dan domain KS (PKS-I) hasil subklon menggunakan program BLASTX
Isolat Strain pembanding (homologi) Identitas
(%) E-value
Query
cover No. Akses
SKB2.3 Type I polyketide synthase;
Streptomyces sp. CFMR7
87% 5e-159 97% WP_053558281
JSN3.1 Type I polyketide synthase;
Streptomycescorchorusii
63% 2e-136 91% WP_059263335
SKB2.14 Polyketide synthase;
Streptomyces sp. SolWspMP-sol2th
76% 0.0 96% WP_028419137
STG3.1 Type I polyketide synthase,
Streptomyces sp. KhCrAH-244
77% 0.0 95% WP_018522874
JSN2.2 Non-ribosomal peptide synthetase; Gordonia alkanivorans
98% 6e-144 92% WP_006360236
SKB2.1 Non-ribosomal peptide synthase; Streptomyces albidus
97% 1e-160 92% BAH68627
SKB2.14 Non-ribosomal peptide synthetase; Streptomyces sp. CcaIMP-W
98% 5e-138 99% WP_018487432
SKB2.16 Non-ribosomal peptide synthetase; Streptomyces sp. Pol013
93% 2e-140 99% AEW23428
Konstruksi pohon filogenetik gen penyandi domain KS dari PKS-I dan domain A dari NRPS dilakukan untuk mengetahui kemiripan dan hubungan kekerabatan sekuen asam amino antar isolat aktinomiset dengan strain pembanding dari GenBank. Hubungan kekerabatan domain KS dan domain A hasil konstruksi pohon filogenetik menunjukkan bahwa tujuh dari delapan isolat memiliki domain KS (PKS-I) dan A (NRPS) yang sekerabat dengan genus
Gambar 14 Pohon filogenetik berdasarkan sekuen asam amino domain KS (ketosintase) yang dikonstruksi menggunakan metode Neighbor-Joining dengan nilai bootstrap 1000 ulangan. Angka 0.5 menunjukkan skala jarak kekerabatan (distance scale)
Gambar 15 Pohon filogenetik berdasarkan sekuen asam amino domain A (adenilase) yang dikonstruksi menggunakan metode Neighbor-Joining dengan nilai bootstrap 1000 ulangan. Angka 0.2 menunjukkan skala jarak kekerabatan (distance scale)
KS STG3.1
Type I polyketide synthase Streptomyces sp. KhCrAH-244
Polyketide synthase Kitasatospora azatica Type I polyketide synthase Streptomyces prasinus
KS SKB2.3
Type I polyketide synthase Kitasatospora griseola Type I polyketide synthase Streptomyces sp. CFMR 7
Polyketide synthase Streptomyces tsukubensis KS JSN3.1
Type I polyketide synthase Streptomyces pratensis
Type I polyketide synthase Streptomyces reticuli Type I polyketide synthase Streptomyces corchorusii
Type I polyketide synthase Streptomyces hygroscopicus Type I polyketide synthase Streptomyces sp. NTK 937
Polyketide synthase Streptomyces sp. CNB091
KS SKB2.14
Polyketide synthase Streptomyces sp. SolWspMP-sol2th 58
60 54
58
65 50
0.5
NRPS Streptomyces cyaneofuscatus NRPS Streptomyces flavovirens
A SKB2.14 A SKB2 16
NRPS Streptomyces luridiscabiei
Hybrid NRPS/type I PKS Hyalangium minutum Hybrid NRPS/type I PKS Myxococcus stipitatus
A JSN2 2 NRPS Gordonia terrae
Putative NRPS Gordonia soli NBRC 108243 A-SKB2.1 75
83 56
0.2
NRPS Streptomyces alboviridis NRPS Streptomyces sp. CFMR 7
Aplikasi Agens Hayati terhadap Penyakit Blas Daun di Rumah Kaca
Uji aplikasi in planta pada penelitian ini dilakukan dengan menggunakan metode penyemprotan agens hayati, karena itu dipilih isolat aktinomiset dengan karakteristik pertumbuhan yang tidak membentuk agregat pada media ISP2 cair. Penyemprotan agens hayati dilakukan sebelum inokulasi P. oryzae dengan tujuan untuk meningkatkan ketahanan tanaman padi terhadap serangan penyakit blas atau penanggulangan blas secara preventif. Hasil aplikasi 11 isolat aktinomiset terpilih menunjukkan bahwa seluruh isolat secara signifikan mampu menekan keparahan penyakit blas daun dibandingkan dengan kontrol patogen P. oryzae. Penghambatan relatif tertinggi yaitu sebesar 88.11% (IB = 7.16%), 88.02% (IB = 7.21%) dan 87.6% (IB = 7.46) oleh isolat JSN1.9, SKB2.14 dan SKB2.3, berurutan (Tabel 5). Morfologi tanaman pada kelompok perlakuan agens hayati dengan nilai penghambatan (reduksi) blas tertinggi dan kontrol patogen P. oryzae
disajikan pada Gambar 16.
Keberhasilan aplikasi agens hayati ditandai dengan rendahnya gejala atau intensitas penyakit blas pada tanaman padi yang diberi perlakuan formulasi sebelum diinokulasikan P. oryzae, jika dibandingkan dengan tanaman kontrol yang hanya diinokulasi patogen P. oryzae. Pengamatan dilakukan pada 21 hari setelah inokulasi P. oryzae atau 42 hari setelah tanam berupa intensitas gejala blas, tinggi tanaman, dan jumlah rumpun. Pengukuruan persentase intensitas blas dan penghambatan relatif (reduksi penyakit) dilakukan dengan penilaian skala 0-9 (Lampiran 3 dan 4). Berdasarkan analisa statistik, perlakuan patogen P. oryzae
dapat mengakibatkan terhambatnya pertumbuhan dan produktivitas tanaman padi dilihat dari parameter agronomi tinggi tanaman dan jumlah rumpun yang berbeda signifikan antara kelompok perlakuan P. oryzae (kontrol positif) dengan kelompok akuades (kontrol negatif) dan agens hayati (Tabel 5) setelah diinokulasikan P. oryzae dibandingkan dengan pada saat sebelum diinokulasikan