POTENSI BAKTERI PENGHASIL SENYAWA BIOAKTIF
ANTICENDAWAN UNTUK PENGENDALIAN
PENYAKIT HAWAR PELEPAH PADI
R U S T A M
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi Potensi Bakteri Penghasil Senyawa Bioaktif Anticendawan Untuk Pengendalian Penyakit Hawar Pelepah Padi adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2012
ABSTRACT
RUSTAM. The Potency of Antifungal Bioactive Compound Producing Bacteria to Control Rice Sheath Blight Disease. Under direction of GIYANTO, SURYO WIYONO, DWI ANDREAS SANTOSA, and SLAMET SUSANTO.
The objectives of this research were to (i) screen some potential bacteria as biological control agents of the sheath blight disease caused by R. solani, (ii) identify character of the selected bacteria strains as biological control agents, and (iii) characterize the antifungal activities of the antifungal bioactive compound produced by the selected strains against R. solani. The antagonist bacteria were isolated from rhizospheric soil, rice plant, and pond water collected from several locations. Screening of bacteria strains on the growth inhibition of R. solani was conducted in the laboratory, while the selection of bacteria for their effectiveness to suppress sheath blight disease were done in the screen house. The result of this research showed that there are three bacterial isolates which antifungal activity significantly suppressed the rice sheath blight disease, i.e. TT47, SS19, and BR2 with suppression ability of 79,6, 56,4, and 49,47%, respectively. Molecular analysis of partial sequence of 16S rRNA showed that SS19, TT47, and BR2 isolates were Serratia marcescens, Ralstonia pickettii, and Bacillus subtilis, respectively. These biocontrol agents are not phythotoxic, produce siderophore, and phosphate-solubilizing. S. marcescens SS19 and R. pickettii TT47 were chitin-degrading bacteria but B. subtilis BR2 was not. The filtrate from fermentation broth of the R. pickettii TT47 and B. subtilis BR2 inhibited the growth of R. solani. The antifungal bioactive compound was relatively stable on pH range from acidic to basic (pH 4, pH 7, and pH 10). The optimum activity of antifungal bioactive compound was at room temperature (25-27 0C) and tend to decrease at higher temperature (60, 80. 100, and 121 0
Key words: The rice sheath blight, antifungal bioactive compounds, Serratia marcescens, Ralstonia pickettii, Bacillus subtilis.
RINGKASAN
RUSTAM. Potensi Bakteri Penghasil Senyawa Bioaktif Anticendawan untuk Pengendalian Penyakit Hawar Pelepah Padi. Dibimbing oleh GIYANTO, SURYO WIYONO, DWI ANDREAS SANTOSA, dan SLAMET SUSANTO.
Padi merupakan komoditas strategis nasional. Lebih dari 90% penduduk Indonesia menjadikan padi sebagai sumber makanan pokok. Untuk itu upaya peningkatan produksi perlu terus dilakukan agar kebutuhan penduduk yang jumlahnya terus meningkat dapat terpenuhi. Namun tantangan peningkatan produksi di masa yang akan datang diprediksi juga makin meningkat terkait dengan perubahan iklim dan ancaman serangan hama atau patogen tanaman.
Penyakit hawar pelepah yang disebabkan oleh cendawan R. solani merupakan salah satu penyakit penting pada tanaman padi. Infeksi patogen menyebabkan gejala bercak berukuran besar pada pelepah dan daun bahkan dapat menyebabkan kematian pada seluruh bagian daun. Patogen memiliki kisaran inang yang luas dan hingga saat ini belum tersedia varietas tanaman padi yang benar-benar tahan. Patogen mampu bertahan dalam tanah dan sisa-sisa tanaman dalam bentuk sklerotia atau miselium. Untuk itu pengendalian dengan menggunakan agens hayati perlu dikembangkan.
Penelitian ini bertujuan (i) mendapatkan isolat bakteri sebagai agens hayati yang dapat mengendalikan penyakit hawar pelepah padi yang disebabkan oleh R. solani, (ii) mengarakterisasi sifat unggul agens hayati dan mengidentifikasi isolat bakteri terpilih, (iii) menentukan karakteristik senyawa bioaktif anticendawan yang dihasilkan isolat bakteri terpilih.
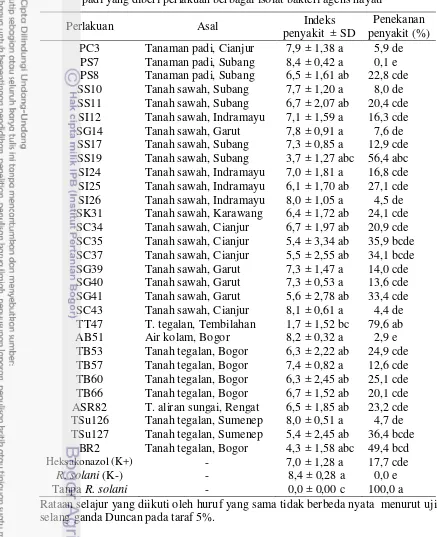
sebanyak 144 isolat. Setelah diuji potensi antibiosisnya diperoleh 30 isolat bakteri yang mampu menekan pertumbuhan R. solani. Kemudian hasil pengujian secara in vivo, didapatkan 3 isolat yang menunjukkan penekanan yang signifikan terhadap keparahan penyakit hawar pelepah padi. Penekanan penyakit hawar pelepah oleh ketiga isolat tersebut adalah 79,6% (TT47), 56,4% (SS19), dan 49,4% (BR2). Indeks penyakit pada perlakuan isolat TT47, SS19, dan BR2 berturut-turut sebesar 1,7, 3,7, dan 4,3.
Hasil karakterisasi terhadap 3 isolat bakteri terpilih diketahui bahwa ketiga isolat tidak bersifat fitotoksik, memproduksi siderofor, dan mampu melarutkan fosfat. Isolat bakteri SS19 dan TT47 menghasilkan enzim kitinase sedangkan isolat bakteri BR2 tidak menghasilkan enzim kitinase. Hasil identifikasi parsial gen 16S rRNA diketahui bahwa isolat SS19, TT47, dan BR2 secara berturut-turut identik dengan Serratia marcescens (96%), Ralstonia pickettii (98%), dan Bacillus subtilis (99%).
Hasil pengujian aktivitas anticendawan dari filtrat biakan R. pickettii TT47 dan B. subtilis BR2 menunjukkan bahwa terjadi penghambatan pertumbuhan R. solani hingga mencapai 100% pada konsentrasi filtrat. Dengan demikian di dalam biakan cair kedua isolat terkandung senyawa bioaktif anticendawan. Aktivitas anticendawan dari filtrat kedua biakan berkorelasi dengan pertumbuhan selnya. Senyawa anticendawan yang aktif dalam filtrat biakan relatif stabil pada kondisi asam (pH 4), netral (pH 7), dan basa (pH 10), dengan aktivitas anticendawan 41,5-45,6% (TT47) dan 21,1-28,3% (BR2). Aktivitas anticendawan tersebut optimum pada suhu ruang (25-27 0C) tetapi cenderung menurun pada suhu yang lebih tinggi (60, 80, 100, dan 1210
Dari hasil penelitian ini dapat disimpulkan bahwa isolat bakteri S. marcescens SS19, R. pickettii TT47, dan B. subtilis BR2 berpotensi dikembangkan sebagai agens hayati untuk pengendalian penyakit hawar pelepah padi, baik dalam bentuk kultur sel hidup maupun dalam bentuk filtrat biakan yang mengandung senyawa bioaktif antifungal. Perlu dilakukan penelitian lanjutan untuk mengetahui jenis senyawa yang dihasilkan isolat-isolat tersebut.
C). Senyawa bioaktif anticendawan dalam biakan cair R. pickettii TT47 dapat diekstraksi menggunakan pelarut heksan atau butanol sedangkan pada biakan cair B. subtilis BR2 dapat diekstrasi menggunakan pelarut etil asetat. Ekstrak heksan R. pickettii TT47 dan ekstrak etil asetat B. subtilis BR2 menunjukkan persentase penghambatan tertinggi terhadap pertumbuhan R. solani, dibandingkan dengan persentase penghambatan yang ditunjukkan oleh filtrat biakan bakteri kering beku (freeze dry) ataupun fungisida heksakonazol, dengan persentase penghambatan secara berturut-turut 86,3% dan 77,8%.
© Hak Cipta milik Institut Pertanian Bogor, tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
POTENSI BAKTERI PENGHASIL SENYAWA BIOAKTIF
ANTICENDAWAN UNTUK PENGENDALIAN
PENYAKIT HAWAR PELEPAH PADI
RUSTAM
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup : Dr. Ir. I Nyoman Widiarta, M.Sc Dr. Ir. Kikin Hamzah Mutaqin, M.Si
Untuk Pengendalian Penyakit Hawar Pelepah Padi
Nama : Rustam
NIM : A362080021
Program Studi Fitopatologi
Disetujui
Komisi Pembimbing
Ketua
Dr. Ir. Giyanto, M.Si
Anggota
Dr. Ir. Suryo Wiyono, M.Sc, Agr
Anggota
Dr. Ir. Dwi Andreas Santosa, M.Sc
Anggota
Prof. Dr. Ir. Slamet Susanto, M.Agr
Mengetahui,
Ketua Program Studi Fitopatologi Dekan Sekolah Pascasarjana IPB
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc
Dr. Ir. Dahrul Syah, M.Sc.Agr
Puji syukur penulis ucapkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2009 ini adalah pengendalian hayati, dengan judul Potensi Bakteri Penghasil Senyawa Bioaktif Anticendawan Untuk Pengendalian Penyakit Hawar Pelepah Padi
Pada kesempatan ini, penulis menyampaikan penghargaan dan terima kasih kepada Dr. Ir. Giyanto, M.Si selaku ketua komisi pembimbing, Dr. Ir. Suryo Wiyono, M.Sc, Agr, Dr. Ir. Dwi Andreas Santosa, M.Sc, dan Prof. Dr. Ir. Slamet Susanto, M.Agr selaku anggota komisi pembimbing atas arahan dan bimbingan mulai dari perencanaan, pelaksanaan penelitian hingga penyusunan disertasi ini.
Terima kasih disampaikan kepada Pimpinan Badan Litbang Pertanian beserta Jajaran atas penunjukan diri saya sebagai petugas belajar dan biaya yang diberikan. Terima kasih disampaikan kepada Pimpinan dan seluruh Staf Departemen Proteksi Tanaman, Progam Studi Fitopatologi, Laboratorium Bakteriologi Tanaman dan Laboratorium Fisiologi dan Toksikologi Serangga Fakultas Pertanian IPB atas segala bantuan fasilitas dan penggunaan alat. Terima kasih juga kepada teman-teman seperjuangan di Forum Wacana Entomologi/Fitopatologi, teman-teman-teman-teman di Forum Komunikasi Petugas Belajar Badan Litbang Pertanian-IPB, dan teman-teman mahasiswa atas kerjasama dan dukungannya kepada penulis.
Terima kasih disampaikan kepada Bapak Dr. Ir. I Nyoman Widiarta, M.Sc (Staf Peneliti di Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor) dan Dr. Ir. Kikin Hamzah Mutaqin, M.Si (Staf Pengajar di Departemen Proteksi Tanaman, Fakultas Pertanian, IPB) yang telah bersedia menjadi penguji luar komisi pada saat ujian tertutup studi Doktor. Begitu juga kepada Bapak Dr. Ir. Budi Tjahjono, M.Agr (Staf PT. Riau Andalan Pulp and Paper, Pelalawan), dan Dr. Aris Tri Wahyudi, M.Si (Staf Pengajar di Departemen Biologi, FMIPA, IPB) yang telah bersedia menjadi penguji luar komisi untuk ujian akhir studi Doktor. Beliau telah memberikan saran dan koreksi yang cukup berarti pada naskah disertasi ini.
Terima kasih yang setulusnya kepada Bapak dan Ibu kandung, Bapak dan Ibu mertua, serta keluarga besar yang telah memberikan perhatian dan dukungan. Terima kasih kepada istri, Merry Bahar, dan Ananda Wily Rustam, Michelia Cempaka dan Latifah Dika Rainy yang telah mendampingi dan berjuang bersama-sama dalam mencapai keberhasilan ini.
Akhirnya, penulis berharap semoga karya ilmiah ini memberikan manfaat bagi kita semua.
Bogor, Januari 2012
Penulis dilahirkan di Padang pada tanggal 7 Juni 1969 sebagai anak ketiga dari Bapak Rusli (alm) dan Ibu Dalima. Tahun 2008, penulis menikah dengan Merry Bahar dan dikaruniai satu orang putra (Wily Rustam) dan dua orang putri (Michelia Cempaka dan Latifah Dika Rainy). Pendidikan sarjana ditempuh di Jurusan Hama dan Penyakit Tanaman, Fakultas Pertanian Universitas Andalas, lulus pada tahun 1993. Pada tahun 2003, penulis diterima di Program Studi Fitopatologi pada Sekolah Pascasarjana IPB dan menamatkannya pada tahun 2005. Kesempatan untuk melanjutkan ke program doktor pada program studi dan perguruan tinggi yang sama diperoleh tahun 2008. Biaya pendidikan pascasarjana diperoleh dari Badan Penelitian dan Pengembangan Pertanian, Kementerian Pertanian Republik Indonesia.
Tahun 1994-1997 penulis bekerja sebagai staf teknis di Balai Proteksi Tanaman Pangan dan Hortikultura Wilayah II Pekanbaru, Provinsi Riau. Kemudian sejak tahun 1997 sampai sekarang penulis bekerja sebagai staf peneliti di Balai Pengkajian Teknologi Pertanian Riau. Bidang penelitian yang menjadi tanggung jawab penulis adalah hama dan penyakit tanaman.
Halaman
Penyakit Hawar Pelepah Padi ... Pengendalian Penyakit Tanaman dengan Bakteri Agens Hayati... Pengendalian Penyakit Tanaman dengan Senyawa Bioaktif Anticendawan ...
7 10 12 RESPON VARIETAS PADI DAN SELEKSI BAKTERI AGENS HAYATI TERHADAP PENYEBAB PENYAKIT HAWAR PELEPAH PADI
Abstrak ... KARAKTERISASI DAN IDENTIFIKASI BAKTERI AGENS HAYATI UNTUK PENGENDALIAN PENYAKIT HAWAR PELEPAH PADI
Abstrak ... AKTIVITAS SENYAWA BIOAKTIF ANTICENDAWAN DARI Ralstonia pickettii TT47 DAN Bacillus subtilis BR2 TERHADAP Rhizoctonia solani PENYEBAB PENYAKIT HAWAR PELEPAH PADI
SIMPULAN UMUM DAN SARAN ... DAFTAR PUSTAKA ... LAMPIRAN ...
DAFTAR TABEL
Halaman
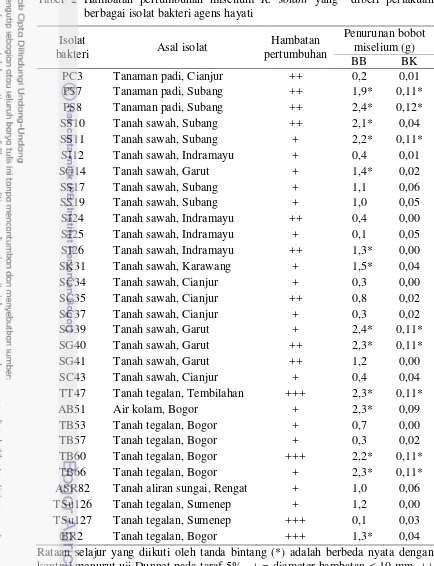
1 Indeks penyakit dan kejadian penyakit hawar pelepah padi pada berbagai varietas padi serta penggolongan tingkat ketahanan varietas padi... 28 2 Hambatan pertumbuhan miselium R. solani yang diberi perlakuan
berbagai isolat bakteri agens hayati ... 32 3 Indeks penyakit dan penekanan penyakit hawar pelepah pada tanaman
padi yang diberi perlakuan berbagai isolat bakteri agens hayati ... 34 4 Daya kecambah, panjang akar, dan panjang batang bibit padi setelah
diberi perlakuan isolat bakteri agens hayati ... 47 5 Identifikasi secara parsial sekuen gen 16S rRNA dari isolat bakteri
SS19, TT47, dan BR2 menggunakan program BLAST... 50 6 Karakter morfologi, biokimia, dan pertumbuhan isolat bakteri SS19,
TT47, dan BR2... 52 7 Daya hambat senyawa bioaktif anticendawan dari filtrat biakan isolat
bakteri TT47 dan BR2 setelah pasteurisasi .……….. 64 8 Aktivitas senyawa bioaktif anticendawan dari R. pickettii TT47 dan B.
subtilis BR2 hasil ekstraksi dengan masing-masing pelarut organik terhadap pertumbuhan miselium R. solani ... 68 9 Aktivitas senyawa bioaktif anticendawan dari ekstrak heksan R. pickettii
TT47 dan ekstrak etil asetat B. subtilis BR2 terhadap R. solani pada beberapa tingkatan konsentrasi ……….. 69 10 Daya kecambah, panjang akar, dan panjang batang bibit padi setelah
diberi perlakuan ekstrak senyawa bioaktif anticendawan dari isolat bakteri TT47 dan BR2... 69 11 Pengaruh konsentrasi senyawa bioaktif anticendawan dari isolat R.
pickettii TT47 terhadap pertumbuhan R. solani ... 70 12 Pengaruh konsentrasi senyawa bioaktif anticendawan dari B. subtilis
DAFTAR GAMBAR
Halaman
1 Diagram alir penelitian potensi bakteri penghasil senyawa bioaktif anticendawan untuk pengendalian penyakit hawar pelepah padi …... 6 2 Sasaran utama beberapa agens anticendawan pada sel cendawan (Groll
dan Korve 2004) ……… 13
3 Rhizoctonia solani penyebab penyakit hawar pelepah pada tanaman padi: biakan murni pada medium PDA (A); miselium (B)... 21 4 Inokulasi R. solani ke bagian pangkal batang tanaman padi (A) dan
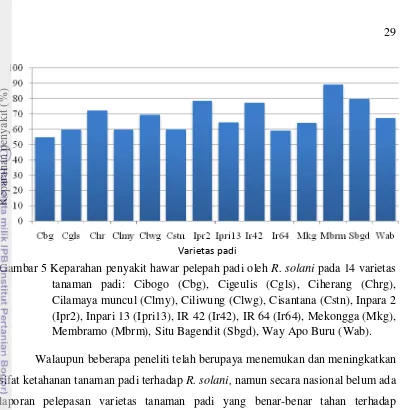
pemasangan micro-chamber (B)... 22 5 Keparahan penyakit hawar pelepah padi oleh R. solani pada 14 varietas
tanaman padi: Cibogo (Cbg), Cigeulis (Cgls), Ciherang (Chrg), Cilamaya muncul (Clmy), Ciliwung (Clwg), Cisantana (Cstn), Inpara 2 (Ipr2), Inpari 13 (Ipri13), IR 42 (Ir42), IR 64 (Ir64), Mekongga (Mkg), Membramo (Mbrm), Situ Bagendit (Sbgd), Way Apo Buru (Wab)... 29 6 Zona hambatan pertumbuhan R. solani yang terbentuk setelah diberi
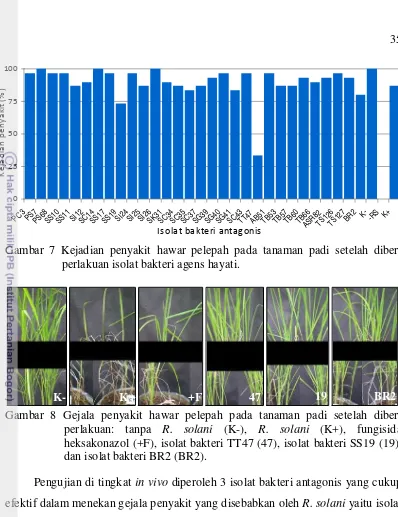
perlakuan isolat bakteri agens hayati: isolat bakteri TT47 (A), isolat bakteri BR2 (B)... 31 7 Kejadian penyakit hawar pelepah pada tanaman padi setelah diberi
perlakuan isolat bakteri agens hayati ... 35 8 Gejala penyakit hawar pelepah pada tanaman padi setelah diberi
perlakuan: tanpa R. solani (K-), R. solani (K+), fungisida heksakonazol (+F), isolat bakteri TT47 (47), isolat bakteri SS19 (19), dan isolat bakteri BR2 (BR2)... 35 9 Morfologi koloni isolat bakteri agens hayati: SS19 koloni berbentuk
sirkular, pinggiran rata, berwarna putih bening; TT47 koloni berbentuk sirkular, pinggiran rata, berwarna kuning; dan BR2 koloni berbentuk tidak beraturan, pinggiran berombak, berwarna putih susu…………... 46 10 Kecambah benih padi setelah diberi perlakuan bakteri agens hayati:
isolat SS19 (A), isolat TT47 (B), isolat BR2 (C), dan tanpa perlakuan isolat bakteri (D)... 47 11 Elektroforesis gel agaros 1% hasil amplifikasi gen 16S rRNA dari
genom isolat bakteri agens hayati. Marker DNA (M), isolat SS19 (1), isolat TT47 (2), dan isolat BR2 (3) ……… 50 12 Uji produksi asam dari gula manitol terhadap isolat bakteri SS19, TT47,
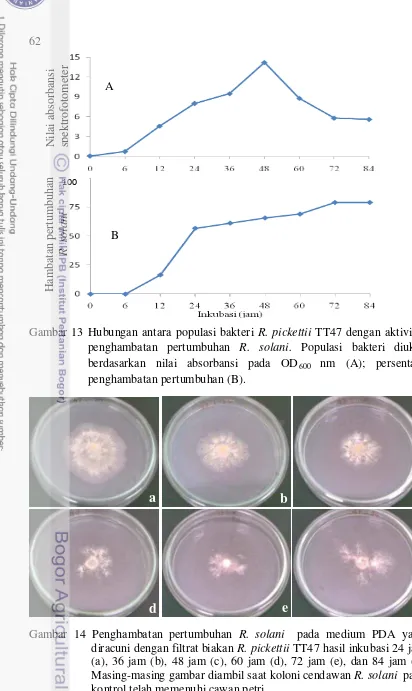
13 Hubungan antara populasi bakteri R. pickettii TT47 dengan aktivitas penghambatan pertumbuhan R. solani. Populasi bakteri diukur berdasarkan nilai absorbansi pada OD600 nm (A); persentase
penghambatan pertumbuhan (B)... 62 14 Penghambatan pertumbuhan R. solani pada medium PDA yang diracuni
dengan filtrat biakan R. pickettii TT47 hasil inkubasi 24 jam (a), 36 jam (b), 48 jam (c), 60 jam (d), 72 jam (e), dan 84 jam (f). Masing-masing gambar diambil saat koloni cendawan R. solani pada kontrol telah memenuhi cawan petri... 62 15 Hubungan antara populasi bakteri B. subtilis BR2 dengan aktivitas
penghambatan pertumbuhan R. solani. Populasi bakteri diukur berdasarkan nilai absorbansi pada OD600 nm (A); persentase
penghambatan pertumbuhan (B).………... 63 16 Penghambatan pertumbuhan R. solani pada medium PDA yang
diracuni dengan filtrat biakan B. subtilis BR2 hasil inkubasi 24 jam (a), 36 jam (b), 48 jam (c), 60 jam (d), 72 jam (e), dan 84 jam (f). Masing-masing gambar diambil saat koloni cendawan R. solani pada kontrol telah memenuhi cawan petri... 63 17 Pertumbuhan R. solani pada medium PDA yang diracuni dengan filtrat
biakan hasil pasteurisasi: R. pickettii TT47 (a), B. subtilis BR2 (b), dan tanpa bakteri sebagai kontrol (c)... 64 18 Bubuk kering beku dari campuran senyawa bioaktif anticendawan
dengan biakan R. pickettii TT47 (kiri) dan B. subtilis BR2 (kanan)... 64 19 Persentase hambatan pertumbuhan R. solani pada beberapa tingkat pH
senyawa bioaktif anticendawan dari R. pickettii TT47 dan B. subtilis
BR2……….. 65
20 Persentase hambatan pertumbuhan R. solani pada beberapa tingkat suhu senyawa bioaktif anticendawan dari R. pickettii TT47 dan B. subtilis
BR2……….. 66
21 Ekstrak kasar senyawa bioaktif anticendawan dari R. pickettii TT47 (kiri) dan B. subtilis BR2 (kanan) hasil ekstraksi dengan pelarut: butanol, etil asetat, heksan, dan kloroform... 67 22 Pengaruh senyawa bioaktif anticendawan tiap ekstrak pelarut dari R.
DAFTAR LAMPIRAN
Halaman
1 Daftar isolat bakteri yang diisolasi dari contoh tanah, bagian tanaman, dan air yang berasal dari berbagai lokasi dan ekosistem ... 89 2 Hasil identifikasi secara parsial sekuen gen 16S rRNA dari isolat bakteri
PENDAHULUAN
Latar Belakang
Padi merupakan komoditas strategis nasional. Komoditas ini menjadi makanan pokok bagi sebagian besar penduduk Indonesia. Upaya peningkatan produksi perlu terus dilakukan agar kebutuhan penduduk yang jumlahnya terus
meningkat dapat terpenuhi. Namun tantangan peningkatan produksi di masa yang
akan datang juga makin meningkat terkait dengan perubahan iklim dan ancaman
serangan hama atau patogen tanaman (Susanti et al. 2012).
Penyakit hawar pelepah yang disebabkan oleh cendawan Rhizoctonia solani
Kühn merupakan salah satu penyakit penting pada tanaman padi. Patogen tersebut dapat bertahan dalam tanah, sisa-sisa tanaman dan memiliki kisaran inang yang luas (Ogoshi 1987). Hingga saat ini belum tersedia varietas tanaman padi yang benar-benar tahan terhadap penyakit hawar pelepah. Meskipun data serangan penyakit hawar pelepah jarang sekali dilaporkan namun pengamatan penulis di lapangan menunjukkan tingkat serangan dan kejadian penyakit cenderung meningkat. Tingkat serangan penyakit tersebut berpotensi meningkat mengingat varietas padi yang banyak ditanam petani saat ini umumnya tidak tahan, penggunaan pupuk nitrogen dosis tinggi atau tidak menggunakan pupuk berimbang, dan adanya fenomena perubahan iklim.
Salah satu cara pengendalian penyakit yang banyak dikembangkan saat ini adalah menggunakan bakteri antagonis. Sebagai negara tropik, Indonesia memiliki mikrob beranekaragam yang berpotensi besar dapat dimanfaatkan sebagai agens pengendali hayati penyakit tanaman. Pemanfaatan bakteri antagonis ataupun senyawa anticendawan yang dihasilkannya bersifat ramah lingkungan karena agens tersebut tidak menimbulkan residu. Selain itu aplikasi bakteri antagonis dapat melindungi tanaman dari serangan patogen dan meningkatkan pertumbuhan tanaman melalui beberapa mekanisme. Nagarajkumar et al. (2005) melaporkan bahwa Pseudomonas fluorescens pfMDU2 yang diaplikasikan pada tanaman padi dapat mengendalikan penyakit yang disebabkan oleh R. solani melalui senyawa asam oksalat yang dihasilkannya. Grosch et al. (2005) menggunakan bakteri antagonis P. fluorescens B1, P. fluorescens B2, dan Serratia plymuthica B4 dalam mengendalikan penyakit yang disebabkan oleh R. solani dan dapat mengurangi keparahan penyakit pada tanaman selada hingga 52% dan pada tanaman kentang hingga 37%. Someya et al. (2003) menggunakan bakteri antagonis S. marcescens
strain B2 yang dapat menekan gejala penyakit hawar pelepah padi.
Isolat bakteri antagonis yang akan dikembangkan sebagai kandidat agens pengendali hayati perlu dilakukan serangkaian pengujian di tingkat in vitro dan in vivo. Dalam hal ini pengujian in vivo sangat menentukan mengingat isolat bakteri antagonis yang menunjukkan potensi menekan patogen di tingkat in vitro tidak selalu merefleksikan kemampuannya di tingkat in vivo (Fravel 1988). Pada tingkat
Penekanan pertumbuhan dan perkembangan mikroorgaisme patogen oleh agens hayati terjadi melalui beberapa mekanisme, diantaranya mekanisme antibiosis, kompetisi, parasitisme, induksi ketahanan, dan mekanisme peningkatan pertumbuhan tanaman (Cook dan Baker 1983). Agens hayati yang memiliki mekanisme antibiosis menghasilkan antibiotik, metabolit sekunder atau enzim penglisis sel lainnya untuk mematikan atau menghambat pertumbuhan patogen. Aktinomiset merupakan kelompok bakteri penghasil antibiotik yang sudah lama dimanfaatkan untuk mengendalikan beberapa penyebab penyakit tanaman disamping agens hayati lainnya seperti Pseudomononas sp. yang menghasilkan antibiotik phenazin-1-carboxylic acid, pyocianin, dan 2,4-diacetylphloroglucinol
(Rosales et al. 1995), Bacillus sp. menghasilkan antibiotik iturin A (Leyns et al. 1990), Streptomyces sp. menghasilkan angucyclinone (Fotso et al. 2008b), dan
Micrococcus sp. menghasilkan limazepine A-F, pyrrolo 1,4 benzodiazepine (Fotso
et al. 2009).
Penggunaan senyawa anticendawan yang dihasilkan mikroorganisme, seperti antibiotik untuk pengendalian penyakit tanaman, sudah dimanfaatkan sejak tahun 1950-an. Beberapa antibiotik yang telah digunakan secara luas dalam pengendalian penyakit tanaman diantaranya streptomisin, tetrasiklin, sikloheksamid, dan blastisidin. Streptomisin atau streptomisin sulfat diperdagangkan sebagai agrimisin atau fitomisin. Antibiotik tersebut ternyata dapat mengendalikan beberapa jenis bakteri dan cendawan patogen tanaman dengan berbagai cara aplikasi, seperti penyemprotan, aplikasi ke dalam tanah, dan perlakuan benih (Agrios 2005). Penggunaan senyawa metabolit anticendawan dalam pengendalian penyakit tanaman selain dapat menekan kehilangan hasil dan meningkatkan kualitas hasil tanaman juga dapat menjadi teknologi pengendalian penyakit tanaman yang ramah lingkungan.
Berdasarkan informasi di atas, penulis tertarik melakukan penelitian tentang potensi bakteri agens hayati penghasil senyawa bioaktif anticendawan untuk mengendalikan penyakit hawar pelepah padi yang disebabkan oleh R. solani.
Dalam hal ini, potensi bakteri agens hayati pengahasil senyawa bioaktif diteliti dalam dua aspek, yaitu aspek sel hidup bakteri agens hayati dan aspek filtrat biakan yang mengandung senyawa bioaktif anticendawan yang digunakan untuk menekan pertumbuhan patogen hawar pelepah padi.
Tujuan Penelitian
Penelitian ini memiliki beberapa tujuan:
a. Mendapatkan isolat bakteri agens hayati yang dapat mengendalikan penyakit hawar pelepah padi yang disebabkan oleh R. solani,
b. Mengidentifikasi isolat bakteri terpilih dan mengarakterisasi sifat unggul isolat bakteri tersebut sebagai agens hayati,
c. Menentukan sifat-sifat penting penting senyawa anticendawan ang dihasilkan isolat bakteri agens hayati.
Hipotesis
Dalam pengkajian ini diajukan beberapa hipotesis, antara lain:
a. Keragaman ekologis dan sumber isolat bakteri memiliki keefektifan berbeda dalam menekan perkembangan penyakit hawar pelepah padi, b. Keefektifan bakteri agens hayati menekan pertumbuhan R. solani
ditentukan oleh beberapa sifat unggul bakteri terpilih,
c. Karakter senyawa bioaktif anticendawan dari metabolit yang dihasilkan oleh isolat bakteri terpilih berpotensi dimanfaatkan untuk menekan pertumbuhan R. solani,
Manfaat Penelitian
ketahanan varietas tersebut cukup penting dalam keberhasilan berusaha tani padi khususnya dalam mengatasi serangan penyakit hawar pelepah padi. Selain itu, bakteri antagonis terpilih dan senyawa metabolit anticendawan yang dihasilkannya dapat dikembangkan sebagai agens hayati untuk mengendalikan penyakit hawar pelepah padi yang disebabkan oleh R. solani. Pengembangan bakteri antagonis dan senyawa metabolit anticendawan yang dihasilkannya untuk mengendalikan penyakit tanaman cukup penting dalam mendukung upaya mengurangi ketergantungan pada fungisida sintetik yang selama ini dikenal memiliki banyak dampak negatif terhadap lingkungan dan sebagian besar fungisida tersebut juga merupakan produk impor.
Ruang Lingkup Penelitian
Gambar 1 Diagram alir penelitian potensi bakteri penghasil senyawa bioaktif anticendawan untuk pengendalian penyakit hawar pelepah padi.
Seleksi in vitro
Penentuan jenis pelarut yang dapat mengekstraksi SBA. Penentuan sifat-sifat penting SBA terhadap R. solani. Stabilitas SBA terhadap pH & suhu. Identifikasi & karakterisasi isolat
bakteri terpilih
TINJAUAN PUSTAKA
Penyakit Hawar Pelepah Padi
Penyakit hawar pelepah padi pertama kali dilaporkan oleh Miyake tahun
1910 di Jepang. Pada waktu itu penyebab penyakitnya dinamakan Sclerotium
irregulare. Kemudian penyakit yang sama dilaporkan di Filipina, Sri Langka,
Cina dan beberapa Negara di Asia yang disebabkan oleh cendawan Rhizoctonia
solani Kühn. Selain itu penyakit ini juga dilaporkan di India dengan penyebab
penyakitnya diidentifikasi sebagai Thanatephorus cucumeris (Frank) Donk
(CABI 2003). Cendawan R. solani (T. cucumeris) diklasifikasikan sebagai
berikut: Kingdom Fungi; Filum Basidiomycota; Kelas Basidiomycetes; Subkelas
Agaricomycetidae; Ordo Ceratobasidiales; Famili Ceratobasidiaceae.
R. solani dapat menyebabkan beberapa macam penyakit pada beberapa jenis
tanaman. Pada tanaman padi, gejala penyakit yang disebabkan R. solani berupa
bercak-bercak pada pelepah daun. Awalnya bercak berbentuk elips atau oval, agak
tidak beraturan, berwarna abu-abu kehijauan, dan ukuran 1-3 cm. Pada bagian
tengah bercak berwarna putih keabu-abuan, dengan penggirannya berwarna
kecoklatan. Pada bercak dapat terbentuk sklerotia kemudian sklerotia yang
terbentuk mudah terlepas. Warna dan ukuran bercak serta pembentukan sklerotia
sangat bergantung pada kondisi lingkungan. Pada kondisi lembab miselium
cendawan dapat tumbuh menutupi permukaan pelepah daun dan dapat menyebar
hingga jarak beberapa sentimeter dalam waktu 24 jam (Ou 1985).
Di Indonesia penyakit hawar pelepah telah menyebabkan kerugian di
beberapa daerah pertanaman padi meskipun belum ada laporan luas kerusakan
atau jumlah kerugian secara terperinci. Hasil pengujian penulis terhadap
ketahanan 14 varietas unggul baru yang sedang dikembangkan dan ditanam oleh
petani saat ini ternyata semua varietas tersebut rentan terhadap penyakit hawar
pelepah. Penyakit ini dapat ditemukan di beberapa daerah pertanaman padi
terutama pada lokasi pertanaman dengan penggunaan pupuk dosis tinggi
R. solani memiliki miselium tidak berwarna ketika masih muda tetapi
menjadi coklat kekuningan ketika makin tua, diameternya 8-12 µ m, dengan septa
jarang-jarang. R. solani memiliki tiga tipe miselium: pertama hifa pendobrak
lurus yang dapat tumbuh sewaktu-waktu, pendek, dan membengkak. Kedua,
miselium yang memiliki banyak cabang atau miselium lobate sebagai tempat
munculnya kapak penetrasi. Miselium lobate menginfeksi jaringan sehingga
terbentuk lesio. Pada batang yang terinfeksi, hifa pendobrak dapat menutupi
sebagaian besar batang tetapi miselium lobate hanya dapat ditemukan pada bagian
lesio. Ketiga, miselium yang terdiri dari sel-sel moniloid yang berperan dalam
pembentukan sklerotia dan biasanya terdapat pada bagian tutup cawan petri atau
pada dinding tabung reaksi saat cendawan dibiakan pada wadah tersebut.
Suhu optimum untuk pertumbuhan R. solani adalah 28-31oC, maksimum
40-42oC, dan sedikit atau tidak terjadi sama sekali pertumbuhan pada suhu 10oC.
PH minimum, optimum, dan maksimum untuk pertumbuhannya berturut-turut
adalah 2.5, 5.4-6.7, dan 7.8. Karbohidrat dalam bentuk monosakarida memberikan
pertumbuhan lebih baik dibandingkan dengan karbohidrat dalam bentuk
disakarida. Nitrogen organik memberikan pertumbuhan lebih baik dibandingkan
dengan nitrogen anorganik. Inositol dan sorbitol merupakan sumber karbon paling
baik bagi pertumbuhan miselium sedangkan arginin, urea, threonin, glysin dan
ammonium sulfat merupakan sumber nitrogen terbaik bagi pertumbuhan
miselium. Perkecambahan sklerotia terjadi pada suhu 16-30oC, dengan suhu
optimum 28-30o
R. solani dari tanaman padi dapat menginfeksi beberapa tanaman lain,
begitu juga dengan R. solani dari tanaman lain dapat menginfeksi tanaman padi.
Ada sekitar 188 spesies tanaman dalam 32 famili dan 20 spesies gulma dalam 11
famili dapat diifeksi oleh R. solani yang berasal dari tanaman padi. R. solani dari
tanaman padi dapat menginfeksi gulma secara alami, seperti Echinochloa spp. dan
Cyperus spp. (Gangopadyay dan Chakrabarti 1982).
C serta kelembaban relatif 95-96% (Ou 1985).
R. solani merupakan cendawan penghuni tanah, dapat hidup sebagai saprofit
pada jaringan tanaman yang sudah mati, dan bertahan dalam bentuk miselium atau
mikroorganisme antagonis, seperti bakteri, cendawan dan mikroba antagonis
lainnya. Inokulum cendawan dapat menyebar bersama partikel tanah yang
terbawa bersama aliran air dan alat-alat pertanian atau bagian tanaman yang
terkontaminasi. Namun demikian, inokulum basidiospora kurang berperan dalam
penyebaran penyakit karena basidiospora jarang sekali dihasilkan.
Perkembangan penyakit hawar pelepah pada tanaman padi dapat berawal
dari kegiatan persiapan lahan. Ketika penggenangan air dilakukan, sklerotia
mengapung dipermukaan air kemudian dapat menempel di permukaan tanaman.
Sklerotia berkecambah, menghasilkan bantalan infeksi, dan hifa masuk ke dalam
jaringan tanaman melalui stomata atau melakukan penetrasi langsung. Dalam
jaringan tanaman, miselium membentuk cabang yang banyak dan dalam waktu
24-48 jam bercak dapat terbentuk. Setelah bercak primer ini terjadi, miselium
tumbuh di bagian luar dan dalam tanaman dengan cepat. Penyakit kemudian
berkembang ke bagian atas tanaman hingga mencapai pelepah dan helaian daun,
dan ke bagian samping tanaman menginfeksi anakan atau tunas yang berdekatan.
Pada kondisi lingkungan yang cocok, sklerotia dapat dihasilkan dan terlepas
kembali ke lahan (CABI 2003). Selain itu, pada kondisi iklim mikro yang cocok
bagi perkembangan pernyakit yakni saat kelembaban dan suhu tinggi, biasanya
dapat terjadi kerusakan yang parah.
Penyakit hawar pelepah lebih banyak berkembang pada tanah atau tanaman
yang dipupuk nitrogen tinggi, varietas rentan, dan lingkungan dengan kondisi
panas dan lembab. Penyakit ini juga dapat berkembang pada lahan yang diberi
pupuk fosfat tinggi, tetapi perkembangan penyakit dapat terhambat dengan
pemberian pupuk kalium. Selain itu penyakit ini dapat berkurang dengan
pemberian garam 0.01-1%, aplikasi fungsida, dan antibiotik. Namun demikian,
perkembangan penyakit selanjutnya sangat ditentukan oleh kondisi lingkungan
Pengendalian Penyakit Tanaman dengan Bakteri Agens Hayati
Menurut Peraturan Menteri Pertanian Nomor 411 tahun 1995, pengertian
agens hayati adalah setiap organism yang meliputi spesies, subspecies, varietas,
semua jenis serangga, nematode, protozoa, cendawan (fungi), bakteri, virus,
mikoplasma, serta organisme lainnya dalam semua tahap perkembangannya yang
dapat dipergunakan untuk keperluan pengendalian hama dan penyakit atau
organism pengganggu, proses produksi, pengolahan hasil pertanian, dan berbagai
keperluan lainnya (Menteri Pertanian RI 1995). Pengertian tersebut memiliki
makna lebih luas dibandingkan dengan pengertian agens hayati menurut FAO
yang hanya membatasi pada mikroorganisme, yaitu mikroorganisme alami seperti
bakteri, cendawan, virus dan protozoa, dan mikroorganisme hasil rekayasa
genetika yang digunakan untuk mengendalikan organisme pengganggu tanaman
(FAO 1988).
Agens hayati yang berasal dari mikroorganisme sudah banyak dimanfaatkan
untuk pengendalian hayati penyakit tanaman. Agens hayati tersebut umumnya
merupakan mikroorganisme alami, baik yang hidup sebagai saprofit di dalam
tanah, sekitar perakaran tanaman, air, filosfir, dan bahan organik, maupun yang
hidup di dalam jaringan tanaman (endofit) yang bersifat menghambat
pertumbuhan dan berkompetisi dalam ruang dan nutrisi dengan patogen sasaran,
atau bersifat menginduksi ketahanan tanaman. Beberapa contoh agens hayati yang
sudah dikembangkan sebagai pestisida hayati, diantaranya Bacillus, Pseudomonas
kelompok fluoresen, Aktinomiset, dan Trychoderma (Supriadi 2006).
Pestisida hayati (biopesticide) dikembangkan dalam rangka mendukung
sistem pertanian ramah lingkungan yang berkelanjutan. Pestisida hayati
diharapkan dapat menekan kehilangan hasil sekaligus meningkatkan kualitas hasil
tanaman, serta dapat menjadi teknologi pengendalian penyakit tanaman yang
ramah lingkungan. Untuk itu Kementerian Negara Riset dan Teknologi (2006)
telah menjadikan pengembangan pestisida hayati menjadi salah satu riset yang
mendukung kebijakan untuk menjamin ketersediaan pangan seperti yang
tercantum dalam buku putih penelitian, pengembangan, dan penerapan iptek
Pestisida hayati dapat diformulasi dari biakan agens hayati (sel hidup) atau
produk metabolisme sekundernya (tanpa sel hidup) yang bersifat menghambat
atau mematikan mikroorganisme penyebab penyakit tanaman. Formulasi agens
hayati sebagai pestisida hayati pada prinsipnya adalah mencampurkan agens
hayati yang diformulasikan dalam bahan pembawa yang dilengkapi dengan bahan
tambahan untuk memaksimalkan kemampuan bertahan hidup agens hayati saat
penyimpanan, mengoptimalkan aplikasi pada sasaran, dan melindungi agens
hayati setelah aplikasi. Formulasi agens hayati memiliki beberapa tujuan,
diantaranya: (i) untuk menjaga kestabilan agens hayati di lapangan, (ii) menjaga
tetap tingginya keefektifan kemampuan agens hayati, (iii) menjaga dan
melindungi agens hayati dari kondisi ekstrim, (iv) memudahkan dalam distribusi
dan penyimpanan, (v) memudahkan pengaplikasian di lapangan, dan (vi) agens
hayati dapat bertahan hidup dan berkembang di areal yang diintroduksikan.
Sementara itu faktor utama yang sangat menentukan keberhasilan pengembangan
agens hayati untuk pengendalian patogen tanaman adalah ketepatan dalam
pemilihan jenis dan sumber agens hayati yang akan dikembangkan.
Vidhyasekaran dan Muthamilan (1999) membuat formulasi P. fluorescens
Pf1 dalam bentuk tepung untuk diperlakukan ke benih, tanah, perakaran, dan
daun. Hasil penelitian menunjukkan bahwa bakteri pada formulasi tepung yang
diaplikasikan sebagai perlakuan benih mampu berkembang baik di rizosfer
tanaman padi. Manjula et al. (2004) menemukan bahwa formulasi berbasis sel
dari Bacillus subtilis AF1 lebih efektif dibandingkan dengan formulasi berbasis
tanpa sel ataupun formulasi berbasis enzim kitinase dalam mengendalikan
beberapa penyakit tanaman. Sementara itu Chumthong et al. (2008) membuat
formulasi endospora B. megaterium dalam bentuk granular dengan sodium
alginat, laktosa, dan polyvinylpyrrolidone menggunakan teknik granula kering
ternyata memberikan sifat fisik yang baik, seperti kelarutannya dalam air dan
memiliki visikositas yang optimal ketika diaplikasikan melalui penyemprotan.
Selain itu populasi bakteri dalam formulasi granular tersebut masih tetap tinggi
(109 cfu/g) setelah disimpan pada suhu kamar selama 2 tahun, dengan aktivitas
Pengendalian Penyakit Tanaman dengan Senyawa Bioaktif Anticendawan
Senyawa antimikrob merupakan suatu subtansi yang dapat mematikan atau
menghambat pertumbuhan suatu mikroorganisme, seperti bakteri, cendawan, atau
protozoa (http://en.wikipedia.org/wiki/Antimicrobial#Antifungals). Senyawa
antimikrob yang hanya dapat mematikan atau menghambat pertumbuhan
cendawan dikenal dengan istilah senyawa anticendawan. Senyawa antimikrob
atau anticendawan tersebut dapat dihasilkan oleh tumbuhan tingkat tinggi,
mikroorganisme, dan beberapa hewan tertentu.
Senyawa bioaktif anticendawan yang dihasilkan organisme hidup
merupakan produk dari metabolisme sekunder. Metabolit sekunder tersebut
dihasilkan organisme untuk merespon keterbatasan nutrisi. Metabolit sekunder
yang bersifat antimikrob atau anticendawan hanya dapat dihasilkan oleh
organisme tertentu sehingga organisme (mikroorganisme) yang dapat
menghasilkan produk tersebut menjadi ciri khas bagi spesies tersebut.
Mikroorganisme biasanya menghasilkan senyawa tersebut setelah memasuki fase
pertumbuhan sel, diakhir fase log, dan dalam fase stationer pada medium biakan
cair. Metabolit sekunder yang dihasilkan mikroorganisme memiliki peranan
penting bagi manusia, terutama berpengaruh terhadap kesehatan, nutrisi, dan
sosial ekonomi. Beberapa produk metabolit yang dihasilkan mikroorganisme
diantaranya antibiotik, reseptor antagonis, efektor, feromon, pestisida, enzim
inhibitor, agens anticendawan, obat-obatan, toksin, dan hormon pertumbuhan
hewan dan tanaman (Okafor 2007).
Antibiotik merupakan molekul yang dapat menghambat atau mematikan
mikroorganisme baik dari jenis bakteri ataupun cendawan. Antibiotik yang dapat
menghambat pertumbuhan bakteri dikenal dengan istilah bakteriostatik, seperti
klorampenikol, sedangkan antibiotik yang dapat menyebabkan kematian bakteri
dikenal dengan bakterisida, seperti penisilin. Selain itu beberapa antibiotik dapat
menunjukkan aktivitas bakteriostatik dalam kondisi tertentu dan aktivitas
bakterisida dalam kondisi lain (Walsh 2003).
Antibiotik dapat berupa produk alami atau dibuat secara sintetik untuk
alami yang memiliki aktivitas antibiotik hampir semuanya berasal dari metabolit
sekunder. Antibiotik yang dihasilkan oleh mikroorganisme diatur secara genetik
oleh suatu sistem pengatur yang kompleks. Gen yang mengkode antibiotik
diaktifkan ketika bakteri memasuki fase stationer dalam fase pertumbuhannya dan
saat berkompetisi dalam mendapatkan nutrisi atau ruang. Walsh et al. (2001)
membagi mekanisme kerja antibiotik dalam empat cara yaitu (i) penghambatan
biosintesis dinding sel, (ii) penghambatan sintesis protein, (iii) penghambatan
sintesis DNA/RNA, dan (iv) penghambatan sintesis prekusor DNA/RNA. Sasaran
utama beberapa agens anticendawan pada sel cendawan disajikan pada Gambar 2.
Gambar 2 Sasaran utama beberapa agens anticendawan pada sel cendawan (Groll dan Korve 2004).
Sampai saat ini sudah banyak dikenal mikroorganisme, khususnya bakteri
penghasil antibiotik, diantaranya Streptomyces, Bacillus, Pseudomonas,
Micrococcus, dan amycolatopsis. Namun demikian, Streptomyces merupakan
bakteri penghasil antibiotik yang utama karena lebih dari 55% jenis antibiotik
yang dikomersialkan di dunia saat ini dihasilkan oleh kelompok bakteri yang
tergolong bakteri gram positif dan berfilamen ini. Beberapa mikroorganisme yang
dieksplorasi dari wilayah Indonesia telah ditemukan beberapa jenis antibiotik baru
seperti 7-O-malonyl macrolactin A yang dihasilkan oleh Bacillus subtilis (Tabarez
et al. 2006), angucyclinone (Fotso et al 2008a), panglimycine A-F (Fotso et al.
2008b), phenazine dan pyrone (Fotso 2010) yang dihasilkan oleh Streptomyces
spp. serta antibiotik limazepine A-F yang dihasilkan Micrococcus sp. (Fotso et al.
2009).
Beberapa contoh antibiotik yang telah digunakan secara luas dalam
pengendalian penyakit tanaman adalah streptomisin, tetrasiklin, sikloheksamid,
dan blastidin. Contoh antibiotik lain dengan beberapa spesies bakteri yang
menghasilkannya adalah pyrrolnitrin, phenazine, dan pyocianin. Pyrrolnitrin
dihasilkan oleh berbagai spesies Pseudomonas yang dapat menghambat
pertumbuhan cendawan dan bakteri namun tidak mematikannya. Antibiotik
tersebut disintesis dari asam amino tryptopan. Beberapa spesies yang sudah
diketahui menghasilkan pyrolnitrin adalah P. pyrrocina, P. fluorescens BL915,
dan P. fluorescens Pf-5 (Pierson 1998). Di Jepang, antibiotik yang banyak
dikembangkan untuk menekan perkembangan Rizoctonia adalah Validamycin dan
Polyoxin sedangkan di Cina yaitu Chingfengmeisu, Jinggangmycin, Hymexazol,
dan Bleomycin (Ou 1985).
Beberapa jenis enzim dan substansi lain yang dihasilkan mikroorganisme
juga berkaitan langsung dengan potensi antagonis suatu mikroorganisme, seperti
enzim kitinase, glukanase, siderofor, asam salisilat, hidrogen sianida, dan
sejenisnya. Enzim kitinase secara spesifik dapat menghidrolisis kitin pada ikatan β-1,4 glikosida yang terdapat pada dinding sel cendawan dan organisme lainnya (Adams 2004). Degradasi polimer kitin akan membentuk kitin oligosakarida atau
monomer N-asetilglukosamin. Hasil hidrolisis polimer kitin digunakan oleh
mikroorganisme kitinolitik sebagai sumber karbon, energi, dan nitrogen (Gooday
1994).
Enzim merupakan senyawa organik yang mengkatalisis semua reaksi kimia
dalam sel hidup tanaman, hewan dan mikroorganisme. Enzim-enzim yang
diekresikan atau diekstraksi dari organisme penghasil enzim dapat berkerja secara
independen diluar pengaruh organisme yang memproduksinya. Enzim terutama
mengandung protein, namun demikian beberapa jenis enzim dapat mengandung
komponen non-protein (Okafor 2007).
Enzim dan senyawa metabolit sekunder yang dihasilkan mikroorganisme
senyawa hasil ekstraksi dapat diaplikasikan untuk mengendalikan mikroorganisme
patogen, seperti cendawan R. solani. Kemampuan suatu bakteri menghasilkan
produk metabolisme tersebut berkorelasi positif dengan potensi antagonistiknya
terhadap cendawan patogen (Nagarajkumar et al. 2004).
Sebagian besar enzim bekerja secara khas, yang artinya setiap jenis enzim
hanya dapat bekerja pada satu macam senyawa atau reaksi kimia. Kerja enzim
dipengaruhi oleh beberapa faktor, terutama adalah substrat, suhu, pH (keasaman),
kofaktor, dan inhibitor. Tiap enzim memerlukan suhu dan tingkat keasaman
optimum yang berbeda-beda karena enzim adalah protein yang dapat mengalami
perubahan bentuk jika suhu dan keasaman berubah. Di luar suhu atau pH yang
sesuai, enzim tidak dapat bekerja secara optimal atau strukturnya akan mengalami
kerusakan. Hal ini akan menyebabkan enzim kehilangan fungsinya sama sekali
TERHADAP PENYEBAB PENYAKIT HAWAR PELEPAH PADI
(Response of Rice Varieties and Screening of Bacterial Biological Control Agents Againts The Rice Sheath Blight Pathogen)
ABSTRAK
Penggunaan varietas tahan dan agens hayati merupakan cara yang efektif untuk pengendalian penyakit tanaman. Penelitian ini bertujuan: (i) mengetahui respon beberapa varietas padi terhadap penyebab penyakit hawar pelepah padi (Rhizoctonia solani Kühn) dan (ii) menapis isolat bakteri yang berpotensi dalam mengendalikan penyakit hawar pelepah padi. Respon varietas padi diuji
menggunakan metode micro-chamber screening di rumah kaca dengan varietas
padi sebagai perlakuan. Penapisan isolat bakteri dilakukan di laboratorium dan di rumah kaca. Hasil penelitian menunjukkan bahwa seluruh varietas padi yang diuji dapat diinfeksi oleh R. solani. Berdasarkan kriteria ketahanan penyakit ternyata belum ditemukan varietas padi yang tergolong pada varietas tahan penyakit hawar pelepah. Varietas agak tahan hanya ditunjukkan oleh varietas Cibogo (indeks penyakit 4,9), sedangkan varietas IR64, Cilamaya, Cigeulis, Cisantana, Mekongga, Inpari 13, Way Apo Buru, Ciliwung, Ciherang, dan IR 42 tergolong pada varietas agak rentan (indeks penyakit 5,2 - 6,9), dan varietas Inpara 2, Situ Bagendit, dan Membramo termasuk dalam kelompok varietas rentan (indeks pennyakit 7,1-7,9). Dari 144 isolat bakteri yang ditapis, 30 isolat diantaranya bersifat antibiosis terhadap R. solani di tingkat in vitro, dengan indikasi terbentuknya zona hambatan pada uji di medium PDA dan penurunan bobot basah (0,1-2,4 g) dan bobot kering (0,0-0,12 g) miselium R. solani pada uji di medium PDB. Hasil pengujian di tingkat in vivo, diperoleh 3 isolat bakteri yang menunjukkan penekanan yang signifikan terhadap keparahan penyakit hawar pelepah padi, yaitu isolat TT47 (79,6%), SS19 (56,4%), dan BR2 (49,47%). Dengan demikian 3 isolat bakteri tersebut dapat menjadi kandidat untuk dikembangkan sebagai agens pengendali hayati penyakit hawar pelepah pada tanaman padi yang disebabkan oleh R. solani.
Kata kunci: Varietas padi, bakteri agens hayati, Rhizoctonia solani, hawar pelepah padi.
ABSTRACT
showed that all of evaluated rice varieties were able to be infected by R. solani. Based on the resistant criteria none of the varieties tested showed resistant response. Moderately resistant varieties is only indicated by Cibogo (disease index 4.9), somewhat susceptible varieties demonstrated by the variety IR64, Cilamaya, Cigeulis, Cisantana, Mekongga, Inpari 13, Way Apo Buru, Ciliwung, Ciherang, and IR 42 (disease index 5,2 - 6,9), and susceptible varieties shown by varieties Inpara 2, Situ Bagendit, and Membramo (disease index 7,1 - 7,9). Of the 144 bacterial isolates screened, 30 isolates of which were antibiosis against R. solani in vitro, with an indication of the formation of inhibition zones on PDA medium and a decrease in wet weight (0,1 - 2,4 g) and dry weight (0,0 - 0,12 g) of R. solani mycelium on PDB medium. Furthermore, in vivo test obtained three bacterial isolates with a significant suppression of the severity of the rice sheath blight disease, i.e. isolates TT47 (79,6%), SS19 (56,4%), and BR2 (
Keywords: The rice variety, bacteria biological control, Rhizoctonia solani, the rice sheath blight.
49,47%). Therefore, they are candidates as the biological control agents for controlling the rice sheath blight caused by R. solani.
PENDAHULUAN
Penyakit hawar pelepah yang disebabkan oleh cendawan Rhizoctonia solani
Kühn merupakan salah satu penyakit penting pada tanaman padi. Patogen tersebut
dapat bertahan dalam tanah, sisa-sisa tanaman dan memiliki kisaran inang yang
luas sehingga sulit dikendalikan. Serangan oleh penyebab penyakit hawar pelepah
dapat mengurangi hasil hingga 40% pada varietas tanaman yang rentan (Groth
2008). Bahkan epidemi penyakit dapat saja terjadi mengingat semakin intensifnya
praktek produksi padi dilakukan melalui pengembangan varietas unggul baru
(VUB), penggunaan pupuk nitrogen berdosis tinggi atau tidak menggunakan
pupuk berimbang, dan adanya fenomena perubahan iklim.
Pelepasan varietas padi baru terus dilakukan setiap tahunnya. Di antara
banyak varietas padi sawah yang dilepas dalam beberapa tahun terakhir, varietas
yang lebih disukai oleh petani dan konsumen selain IR64 adalah Ciherang,
Ciliwung, Way Apo Buru, dan Memberamo. VUB ini telah berkembang dan
mulai menggeser dominasi IR64. Menurut Puslitbang Tanaman Pangan (2011),
persentase adopsi VUB tersebut oleh petani saat ini adalah Ciherang 47,63%, IR
64 10,50%, Cigeulis 5,17%, Ciliwung 4,38%, Cibogo 3,56%, Cilamaya muncul
ada laporan tentang ketahanan varietas tersebut terhadap penyakit hawar pelepah.
Untuk itu perlu dilakukan pengujian ketahanan beberapa varietas unggul yang
ditanam petani saat ini terhadap penyakit hawar pelepah.
Untuk mengetahui ketahanan suatu varietas secara cepat dan akurat
terhadap patogen hawar pelepah padi di bawah kondisi rumah kaca, dapat
digunakan metode micro-chamberscreening yang dikembangkan Jia et al. (2007).
Penggunaan metode tersebut dapat mempercepat proses seleksi untuk
meningkatkan ketahanan tanaman terhadap patogen R. solani. Metode ini
menggunakan tanaman muda (umur 3 minggu), potongan miselium biakan
cendawan R. solani dalam medium potato dextrose agar (PDA), botol plastik
bening sebagai pembentuk kondisi lembab. Teknik penghitungan indeks penyakit
yang digunakan dalam metode tersebut relatif mudah dibandingkan dengan teknik
yang dikembangkan oleh Park et al. (2008). Selain itu, akurasi hasil pengujian
dengan menggunakan metode tersebut pada kondisi rumah kaca sama dengan
hasil pengujian konvensional dengan menggunakan tanaman dewasa yang
dilakukan di lapangan (Jia et al. 2007).
Sementara itu, upaya pencarian teknik pengendalian penyakit hawar pelepah
padi perlu terus dilakukan. Penggunaan varietas tahan belum dapat dilakukan
karena varietas tahan penyakit hawar pelepah belum tersedia. Untuk mendapatkan
varietas tahan memerlukan waktu relatif lama. Petani biasanya menggunakan
fungisida sintetik untuk menekan berkembangnya penyakit hawar pelepah di
lapangan. Akan tetapi penggunaan fungisida sintetik secara intensif meninggalkan
residu yang sulit terdegradasi oleh mikroorganisme sehingga berdampak negatif
terhadap kesehatan manusia, hewan, dan organisme hidup lainnya serta
lingkungan (Pingali et al. 1995). Selain itu bahan aktif fungisida dan pestisida
sintetik umumnya merupakan produk impor sehingga pengurangan penggunaan
fungisida sintetik untuk pengendalian penyakit tanaman ikut mendukung program
kemandirian bangsa yang dicanangkan oleh pemerintah.
Salah satu cara pengendalian penyakit yang banyak dikembangkan saat ini
adalah penggunaan bakteri agens hayati. Sebagai negara tropik, Indonesia
agens pengendali hayati penyakit tanaman. Pemanfaatan bakteri agens hayati
ataupun produk metabolit sekunder yang dihasilkannya bersifat ramah
lingkungan. Selain itu aplikasi agens hayati dapat melindungi tanaman dari
serangan penyakit dan meningkatkan pertumbuhan tanaman melalui beberapa
mekanisme. Nagarajkumar et al. (2005) melaporkan bahwa Pseudomonas
fluorescens pfMDU2yang diaplikasikan pada tanaman padi dapat mengendalikan
penyakit yang disebabkan oleh R. solani. Grosch et al. (2005) menggunakan
bakteri P. fluorescens B1, P. fluorescens B2, dan Serratia plymuthica B4 untuk
mengendalikan penyakit yang disebabkan oleh R. solani dan dapat mengurangi
keparahan penyakit pada tanaman selada hingga 52% dan pada tanaman kentang
hingga 37%. Begitu juga dengan Someya et al. (2003) menggunakan bakteri
Serratia marcescens strain B2 ternyata dapat menekan gejala penyakit hawar
pelepah pada tanaman padi.
Isolat bakteri agens hayati yang akan dikembangkan sebagai kandidat agens
pengendali hayati perlu dilakukan serangkaian pengujian, mulai dari pengujian in
vitro, in planta dan in vivo. Beberapa bakteri agens hayati yang berpotensi untuk
pengendalian penyakit hawar pelepah di tingkat in vitro telah dilaporkan Sudir
dan Suparyono (2000) tetapi belum diketahui jenis bakteri dan kemampuannya di
tingkat in vivo. Pada hal potensi menekan patogen di tingkat in vitro tidak selalu
merefleksikan kemampuannya di tingkat in vivo (Fravel 1988). Penelitian Rustam
et al. (2005) menunjukkan bahwa isolat bakteri BRA61 dan ES32 yang cukup
efektif menekan penyebab penyakit tanaman pisang di tingkat in vitro tidak
mampu menekan gejala penyakit pada tanaman pisang di tingkat in vivo.
Penelitian ini bertujuan (i) mengetahui tingkat ketahanan beberapa varietas
padi unggul baru terhadap penyebab penyakit hawar pelepah (R. solani)
menggunakan metode micro-chamber screening (ii) menapis isolat bakteri yang
berpotensi sebagai agens hayati untuk menekan perkembangan penyakit hawar
BAHAN DAN METODE
Penelitian dilakukan di Laboratorium Bakteriologi Tumbuhan dan di Rumah
Kaca, Departemen Proteksi Tanaman, IPB, Bogor. Penelitian dilaksanakan sejak
bulan Agustus 2009 sampai dengan Februari 2011.
Respon Varietas Padi terhadap R. solani
Penyediaan patogen (R. solani). Cendawan R. solani diisolasi dari
tanaman padi yang menunjukkan gejala penyakit hawar pelepah di daerah
Cikarawang, Bogor. Isolasi menggunakan medium Potato Dextrose Agar (PDA),
dengan komposisi: ekstrak kentang 200 g/l, 20 g/l dekstros, dan15 g/l agar.
Sebelum digunakan dalam pengujian, R. solani yang diperoleh diidentifikasi
secara visual dan mikroskopis serta diuji patogenisitasnya pada tanaman padi.
Biakan murni dan miselium R. solani yang digunakan dalam penelitian di sajikan
pada Gambar 3.
Gambar 3 Rhizoctonia solani penyebab penyakit hawar pelepah pada tanaman padi: biakan murni pada medium PDA (A); miselium (B).
Uji patogenisitas dilakukan dengan cara menginokulasikan potongan
miselium (diameter 0,5 cm) cendawan R. solani ke bagian pangkal batang
tanaman padi umur 3 minggu yang telah dipersiapkan sebelumnya. Untuk
membentuk kondisi lembab, tanaman yang telah diinokulasi disungkup dengan
kantong plastik. Setelah diinkubasi selama 7 hari, gejala berupa bercak-bercak
besar dengan bagian tengah berwarna putih pucat terlihat di sepanjang pelepah
daun yang diinokulasi. Hal ini mengindikasikan bahwa isolat cendawan yang diuji
bersifat patogenik terhadap tanaman padi.
B
Pengujian respon varietas padi. Pengujian respon varietas padi terhadap
penyakit hawar pelepah menggunakan metode skrining micro-chamber (Jia et al.
2007). Empat belas varietas padi yang digunakan merupakan kelas benih dasar
(foundation seed) yang diperoleh dari Unit Penyediaan Benih Sumber, Balai
Besar Penelitian Tanaman Padi Sukamandi. Varietas padi tersebut adalah Cibogo,
Cigeulis, Ciherang, Cilamaya Muncul, Ciliwung, Cisantana, Inpara 2, Inpari 13,
IR 42, IR 64, Mekongga, Membramo, Situ Bagendit, dan Way Apo Buru.
Sebelum dilakukan penanaman, disiapkan kantong plastik bening (ukuran 30 x 60
cm) dengan seperempat bagiannya berisi tanah steril. Bagian kantong berisi tanah
ditempatkan ke dalam pot (diameter 15 cm, tinggi 15 cm) sedangkan tiga per
empat bagiannya yang tidak berisi tanah difungsikan sebagai micro-chamber.
Bibit padi tiap varietas yang akan diuji disemai dalam bak persemaian yang
sudah disiapkan. Kemudian dipilih bibit yang menunjukkan pertumbuhan seragam
dan ditanam sebanyak 5 bibit/pot, dengan ulangan 4 kali. Setelah tanaman
berumur 3 minggu (3-4 helai daun), tiap tanaman diinokulasi dengan
menempelkan 1 potongan miselium biakan cendawan R. solani (diameter 0,5 cm)
umur 3 hari ke bagian pangkal batang tanaman. Setelah itu bagian kantong plastik
bening yang tidak diisi tanah diselimutkan menutupi tanaman padi dengan bagian
ujungnya direkat dengan stapler agar terbentuk kondisi lembab. Kondisi lembab
tersebut dipertahankan hingga terlihat ada tanaman mati yang disebabkan oleh R.
solani yang diinokulasikan. Penyiraman dilakukan melalui bagian ujung kantong
plastik yang terbuka dekat perekatan stapler (Gambar 4).
Gambar 4 Inokulasi R. solani ke bagian pangkal batang tanaman padi (A) dan pemasangan micro-chamber (B).
Pengamatan dilakukan terhadap indeks penyakit, keparahan penyakit, dan
kejadian penyakit. Indeks penyakit dihitung berdasarkan rumus sebagai berikut
(Jia et al. 2007):
Indeks penyakit = x 9
Keterangan: 9 = skor tertinggi gejala penyakit hawar pelepah padi menurut sistem evaluasi standar IRRI (http://www.knowledgebank. irri.org/extension/index.php/crop-damage-diseases/sheath-blight-shb
Keparahan penyakit dan keberadan penyakit dihitung berdasarkan rumus berikut: ).
Kriteria ketahanan varietas dikelompokan sebagai berikut: indeks penyakit
<3 = tahan, 3-5 = agak tahan, >5-7 = agak rentan, dan >7-9 = rentan. Data yang
diperoleh dianalisis dengan sidik ragam dan uji lanjut selang ganda Duncan pada
taraf 5%.
Eksplorasi dan Seleksi Bakteri Agens Hayati
Penyediaan bakteri agens hayati. Bakteri diisolasi dari contoh tanah
sawah, tanah tegalan, tanah aliran sungai, air, dan bagian tanaman padi yang
berasal dari beberapa lokasi dan ekosistem. Isolasi bakteri menggunakan metode
pengenceran berseri. Sebanyak 10 g contoh tanah, bagian tanaman, atau air,
masing-masing diencerkan dengan 90 ml air steril yang mengandung 0,85% NaCl
dalam tabung Erlenmeyer 250 ml. Campuran dalam setiap tabung Erlenmeyer
dikocok hingga merata, kemudian dibuat pengenceran 10x secara berseri hingga
10-3. Selanjutnya, 0,1 ml masing-masing enceran 10-3 disebar ke dalam cawan
petri yang berisi medium King’s B agar (KBA) (20 g protease pepton, 1,5 g
yeast and malt extract (YM) selektif (4 g glukosa, 10 g malt extract, dan 4 g yeast
extract dalam 1 l akuades, serta 20 mg trimethoprim, 50 mg griseofulvin, dan 50
mg nystatin dalam 1 l medium) (Fotso et al. 2008). Sedangkan untuk
mendapatkan isolat bakteri yang membentuk spora, suspensi pengenceran 10-3
dipanaskan dalam penangas air pada suhu 80 o
Sediaan diinkubasi pada suhu ruang hingga berbagai macam bentuk koloni
bakteri tumbuh. Koloni bakteri yang tumbuh pada medium KBA dicek di bawah
lampu ultraviolet untuk membedakan kelompok bakteri Pseudomonas
berfluoresensi dengan bakteri lainnya. Koloni Pseudomonas berfluoresensi
(memendarkan warna hijau kekuningan) dan koloni bakteri lainnya dengan
karakter berbeda dipindahkan pada medium KBA baru hingga diperoleh biakan
murni. Sementara itu, koloni bakteri yang tumbuh pada medium YM dipindahkan
pada medium YM baru hingga murni. Kemudian tiap koloni yang diperoleh
diperiksa di bawah mikroskop binokuler untuk membedakan kelompok
aktinomiset dengan bakteri lainnya. Koloni bakteri dengan karakter berbeda yang
tumbuh pada medium TSA dipindahkan pada medium TSA baru hingga diperoleh
biakan murni. Biakan murni tiap isolat dibiakan dalam medium LB selama 24
jam, kemudian 1 ml biakan dipindahkan ke dalam tabung ependorf yang telah
berisi 1 ml gliserol 40%. Selanjutnya sediaan disimpan pada suhu -20
C selama 30 menit (Kim et al.
1997). Setelah dingin, 0,1 ml suspensi disebar ke dalam cawan petri yang telah
berisi medium triptic soy agar (TSA) (17 g pancreatic digest of casein, 15 g agar,
5 g NaCI, 3 g papaic digest of soybean meal, 2,5 g K2 HPO4, dan 2,5 g glukosa
dalam 1 l akuades) (Kim et al. 1997).
0
Seleksi in vitro. Seluruh isolat bakteri yang telah diperoleh diseleksi
berdasarkan hasil uji potensi antagonismenya terhadap R. solani yang telah
disediakan. Pengujian dilakukan menggunakan supernatan biakan tiap isolat
bakteri. Supernatan dibuat dengan cara: isolat yang diduga kelompok
Pseudomonas berfluoresensi, Bacillus, atau aktinomiset dibiakan masing-masing
dalam tabung Erlenmeyer 100 ml yang berisi 10 ml medium Luria broth (LB) (0,1
g casein, 0,05 g yeast exstract, dan 0,05 g NaCI dalam 10 ml akuades), medium C untuk
triptic soy broth (TSB), atau medium M2 (0,04 g glukosa, 0,04 g yeast ekstrak,
dan 0,1 g malt ekstrak dalam 10 ml akuades). Inkubasi dilakukan di atas inkubator
bergoyang (150 rpm) pada suhu ruang selama 4 hari. Kemudian biakan
disentrifugasi (7840 g, suhu 40
Pengujian potensi antagonis (anticendawan) dari supernatan tiap isolat pada
medium padat dilakukan dengan memindahkan 10 µl supernatan dari tiap isolat
pada permukaan medium PDA dalam cawan petri. Sebelumnya potongan
miselium biakan R. solani berukuran diameter 0,5 cm ditempatkan dipermukaan
medium PDA pada bagian tengah. Tiap pengujian diulang tiga kali. Sediaan
diinkubasikan pada suhu ruang selama 3-4 hari. Supernatan dari isolat bakteri
yang menunjukkan potensi anticendawan diindikasikan oleh adanya zona
hambatan yang terbentuk di sekitar tempat supernatan isolat bakteri tersebut. C, selama 10 menit) dan diambil supernatannya
untuk diuji potensi antagonismenya terhadap cendawan R. solani pada medium
padat dan medium cair.
Metode pengujian yang hampir sama dilakukan pada medium cair. Ke dalam
tabung Erlenmeyer 250 ml yang berisi 50 ml medium PDB (1 g dekstrosa, 50 ml
air rebusan 10 g kentang), diinokulasi dengan satu potongan miselium cendawan
uji berdiameter 0,5 cm. Kemudian tiap sediaan diberi perlakuan 1 ml supernatan
isolat bakteri sedangkan untuk kontrol ditambahkan 1 ml medium PDB steril.
Tiap perlakuan diulang lima kali. Sediaan diinkubasi dalam suhu ruang selama 10
hari. Potensi anticendawan diamati dengan mengukur bobot basah dan bobot
kering miselium cendawan uji dihari terakhir inkubasi. Data yang diperoleh
dianalisis dengan sidik ragam dan uji lanjut Dunnet pada taraf 5%.
Seleksi in vivo. Seluruh isolat bakteri yang menunjukkan potensi
anticendawan pada hasil uji in vitro diuji secara in vivo pada tanaman padi
varietas Mekongga yang agak rentan terhadap penyebab penyakit hawar pelepah
padi. Biakan tiap isolat bakteri yang diuji disiapkan dengan cara membiakan isolat
tersebut dalam tabung yang berisi 5 ml medium LB, diinkubasi di atas inkubator
bergoyang dengan kecepatan 150 rpm selama 24 jam suhu ruang. Perlakuan isolat
bakteri diberikan sebanyak dua kali, yaitu pada saat perendaman benih dan saat
Perendaman benih dilakukan selama 24 jam dengan biakan isolat bakteri,
fungisida heksakonazol 1 ml/l (kontrol positif), atau dengan air steril (kontrol
negatif). Sementara itu disiapkan polibag plastik bening (30 x 60 cm) dengan
seperempat bagiannya berisi tanah steril. Bagian polibag berisi tanah ditempatkan
ke dalam pot plastik (diameter 15 cm, tinggi 15 cm), sedangkan tiga per empat
bagiannya yang tidak berisi tanah difungsikan sebagai micro-chamber. Benih
yang telah direndam kemudian ditanam (25 benih/pot), dengan ulangan 3 kali.
Tanaman yang berumur 3 minggu (3-4 helai daun) dijarangkan, disisakan 10
tanaman/pot kemudian tiap tanaman diinokulasi dengan 1 potongan miselium
biakan R. solani (diameter 0,5 cm) yang telah dibiakan dalam medium PDA (3
hari) ke bagian pangkal batang tanaman.
Perlakuan bakteri diberikan kembali dengan cara meneteskan sebanyak 0,1
ml biakan isolat bakteri ke tiap potongan miselium patogen yang baru saja
diinokulasikan. Setelah itu bagian polibag yang tidak diisi tanah diselimutkan
menutupi tanaman padi dengan beberapa tempat pada bagian ujungnya direkat
dengan stapler agar terbentuk kondisi lembab. Kondisi lembab dipertahankan
hingga tanaman pada kontrol mati karena diinfeksi R. solani. Penyiram dilakukan
melalui bagian ujung polibag plastik yang tidak direkatkan.
Pengamatan dilakukan terhadap indeks penyakit, keparahan penyakit,
kejadian penyakit, dan penekanan penyakit. Indeks penyakit, keparahan penyakit,
dan kejadian penyakit dihitung berdasarkan rumus yang telah diuraikan
sebelumnya, sedangkan penekanan penyakit dihitung menurut rumus:
Penekanan penyakit = x 100%
Keterangan: P = Penekanan penyakit (%)
a = Keparahan penyakit pada kontrol
b = Keparahan penyakit pada perlakuan
Data yang diperoleh dianalisis dengan sidik ragam dan uji lanjut selang
HASIL DAN PEMBAHASAN
Respon Varietas terhadap R. solani
Hasil penelitian menunjukkan bahwa empat belas varietas tanaman padi
yang diuji menggunakan metode micro-chamber screening ternyata semuanya
dapat diinfeksi oleh R. solani dan menyebabkan gejala penyakit hawar pelepah
dengan kejadian penyakit 100% dan keparahan penyakit lebih dari 50%. Di antara
varietas yang diuji, varietas Membramo merupakan varietas yang menunjukkan
indeks penyakit tertinggi (7,9), dengan nilai keparahan penyakit hampir 90%.
Sebaliknya varietas Cibogo merupakan varietas yang menunjukkan indeks
penyakit terendah (4,9) dibandingkan dengan seluruh varietas yang diuji (Tabel 1
dan Gambar 5).
Berdasarkan pada kriteria ketahanan varietas terhadap penyakit hawar
pelepah, maka dari sejumlah varietas padi yang diuji tidak ada varietas yang
tergolong pada varietas tahan, sedangkan varietas agak tahan hanya ditunjukkan
oleh varietas Cibogo. Sementara itu varietas Inpara 2, Situ Bagendit, dan
Membramo merupakan varietas yang tergolong rentan dengan indeks penyakit
berturut-turut 7,1, 7,2, dan 7,9. Varietas lainnya yaitu varietas IR 42, Ciherang,
Ciliwung, Way Apo Buru, Inpari 13, Mekongga, Cisantana, Cigeulis, Cilamaya,
dan IR 64 adalah tergolong agak rentan dengan indeks penyakit berkisar 5,2 – 6,9
(Tabel 1).
Seluruh varietas tanaman padi yang diuji dapat diinfeksi oleh penyebab
penyakit hawar pelepah (R. solani) dan tidak satupun dari varietas tersebut yang
tergolong tahan terhadap penyakit hawar pelepah. Hal ini menunjukkan bahwa
seluruh varietas yang digunakan dalam pengujian tidak ada yang tahan terhadap
penyakit hawar pelepah. Perakitan varietas tahan penyakit biasanya masih terbatas
pada penyakit tungro, hawar daun bakteri, dan blas (Suprihatno et al. 2010).
Sebagai contoh, varietas Membramo dirakit untuk lebih tahan terhadap penyakit
hawar daun bakteri dan tungro, sedangkan varietas Inpara 6 dirakit dari IR 64