PEMBUNGAAN BUGENVIL BUNGA PUTIH DENGAN
REKAYASA ZAT PENGHAMBAT TUMBUH DAN MEDIA
TANAM PADA LINGKUNGAN BERPOLUSI UDARA
MUHAMMAD ILHAM ALIF
DEPARTEMEN ARSITEKTUR LANSKAP FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pembungaan Bugenvil Bunga Putih dengan Rekayasa Zat Penghambat Tumbuh dan Media Tanam pada Lingkungan Berpolusi Udara adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Muhammad Ilham Alif
ABSTRAK
MUHAMMAD ILHAM ALIF. Pembungaan Bugenvil Bunga Putih dengan Rekayasa Zat Penghambat Tumbuh dan Media Tanam pada Lingkungan Berpolusi Udara. Dibimbing oleh NIZAR NASRULLAH.
Bugenvil (Bougainvillea spectabilis Willd) atau yang lebih dikenal dengan sebutan bunga kertas merupakan salah satu jenis tanaman tropis yang sudah sangat popular di Indonesia. Penelitian ini bertujuan untuk mengetahui ketebalan lapisan media penghambat pertumbuhan akar dan konsentrasi zat penghambat tumbuh yang paling efektif untuk menstimulasi pembungaan pada tanaman bugenvil. Rancangan percobaan yang digunakan adalah Rancangan Acak Kelompok faktorial terdiri dari dua faktor yaitu ketebalan kerikil sebagai media penghambat pertumbuhan akar 0 cm, 5 cm dan 10 cm , serta konsentrasi paclobutrazol 0 ppm, 50 ppm, 100 ppm, 200 ppm. Hasil yang didapat dari penelitian ini menunjukkan bahwa penanaman bugenvil di tepi jalan ataupun median jalan yang paling cepat dan banyak menghasilkan bunga menggunakan media penghambat setebal 10 cm dan diberi zat penghambat tumbuh (paclobutrazol) dengan konsentrasi 200 ppm, walaupun demikian pengaruh 200 ppm tidak berbeda nyata dengan perlakuan 100 ppm, sehingga disarankan penggunaan media 10 cm dan 100 ppm paclobutrazol untuk menstimulasi pembungaan.
Kata kunci: bugenvil, polusi udara, media, paclobutrazol
ABSTRACT
MUHAMMAD ILHAM ALIF. Flowering stimulation of White Flower Bougainvillea through Utilization of Growth Retardant Substance and Root Inhibiting Panting Media in Air Polluted Enviroment. Supervised by NIZAR NASRULLAH.
Bougainvillea (Bougainvillea spectabilis Willd) or better known as the
“Bunga Kertas” is one kind of tropical ornamental plant that has been very popular in Indonesia. This study aims to determine the thickness of root growth inhibiting media and concentration of growth retardant that the most effective to stimulating the flowering of bougainvillea. The experimental design was a factorial randomized block design that consisted of two factors: thickness of the gravels as root inhibiting media 0 cm, 5 cm and 10 cm, and the paclobutrazol concentration of 0 ppm, 50 ppm, 100 ppm, 200 ppm. The results of this study showed that bougainvillea planted in the median of the road, which is the fastest and generate a lot of flower obtained in the inhibitor media as thick as 10 cm and paclobutrazol 200 ppm, However the effect of 200 ppm is not significantly different from the treatment of 100 ppm , so it is recommended to use root inhibiting media 10 cm and 100 ppm paclobutrazol to stimulate flowering .
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Arsitektur Lanskap
PEMBUNGAAN BUGENVIL BUNGA PUTIH DENGAN
REKAYASA ZAT PENGHAMBAT TUMBUH DAN MEDIA
TANAM PADA LINGKUNGAN BERPOLUSI UDARA
MUHAMMAD ILHAM ALIF
DEPARTEMEN ARSITEKTUR LANSKAP FAKULTAS PERTANIAN
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya tulis ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB.
Judul Skripsi : Pembungaan Bugenvil Bunga Putih dengan Rekayasa Zat Penghambat Tumbuh dan Media Tanam pada Lingkungan Berpolusi Udara
Nama : Muhammad Ilham Alif
NIM : A44100018
Disetujui oleh
Dr. Ir. Nizar Nasrullah M. Agr Pembimbing Skripsi
Diketahui oleh
Dr. Ir. Bambang Sulistyantara M. Agr Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi ini berhasil diselesaikan. Lingkup kegiatan yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2015 hingga Juli 2015 ini ialah tanaman lanskap, dengan judul Pembungaan Bugenvil Bunga Putih dengan Rekayasa Zat Penghambat Tumbuh dan Media Tanam pada Lingkungan Berpolusi Udara.
Terima kasih penulis ucapkan kepada pihak-pihak yang terlibat dan berkontribusi dalam proses penelitian serta penyelesaian penulisan skripsi ini, yaitu kepada:
1. Mustarrozi dan Herlin Syahrini selaku orangtua yang telah mendidik dan mendukung saya dengan penuh perhatian dan kasih sayang.
2. Semua keluarga besar saya yang tiada hentinya mendukung dan memberikan doa agar penelitian saya berhasil.
3. Dr. Ir. Nizar Nasrullah M. Agr selaku dosen pembimbing skripsi yang selalu mendukung dalam pembuatan skripsi ini.
4. PT. Jasamarga cabang Jagorawi yang telah memberikan izin kepada saya untuk melakukan penelitian ini.
5. Rani, Gerry, Reza, Dilfan, Fadil, Abi yang telah membantu dalam selesainya penelitian ini.
6. Teman-teman Lanskap 47, yang selalu memberikan dukungan dan semangat kepada saya dalam pengerjaan skripsi.
Semoga karya ilmiah ini bermanfaat bagi semua pihak yang membutuhkan serta bermanfaat sebagai referensi dalam penelitian selanjutnya.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Manfaat 2
Hipotesis 2
Kerangka Pikir 3
TINJAUAN PUSTAKA 4
Bugenvil (Bougainvillea spectabilis) 4
Syarat Tumbuh 4
Pembungaan 4
Flower Forcing 5
Retardan 5
Media Tanam 6
Polusi Udara 6
METODE 7
Lokasi dan Waktu penelitian 7
Batasan Penelitian 7
Alat dan Bahan 7
Metode 7
Persiapan Stek, Penanaman dan pemeliharaan 8
Pemberian Retardan 9
Pengamatan 9
HASIL DAN PEMBAHASAN 10
Kondisi Umum 10
Tinggi Tanaman 10
Pertambahan Cabang Primer 13
Jumlah Cabang Tersier 16
Jumlah Daun 17
Jumlah Bunga Non Cluster 18
Jumlah Cluster 21
Jumlah Bunga Total 24
Panjang dan Bobot Akar 26
SIMPULAN DAN SARAN 27
Simpulan 27
Saran 27
DAFTAR TABEL
1. Tinggi tanaman pada minggu ke-1 sampai 15 MST 12 2. Pertambahan cabang primer dari minggu ke-1 sampai 6 MST 13 3. Jumlah cabang sekunder dari minggu ke-1 hingga 6 MST 15 4. Jumlah cabang tersier dari minggu ke-1 hingga 7 MST 17
5. Jumlah daun dari minggu ke-1 sampai 15 MST 19
6. Jumlah bunga non cluster dari minggu ke-9 hingga 15 MST 20 7. Jumlah cluster dari minggu ke-9 hingga 15 MST 22
8. Jumlah bunga dari minggu ke-9 hingga 15 MST 24
9. Panjang dan bobot akar pada akhir penelitian 27
DAFTAR GAMBAR
1. Kerangka pikir penelitian 3
2. Tinggi tanaman pada beberapa perlakuan ketebalan media 10 3. Tinggi tanaman pada beberapa perlakuan konsentrasi zat penghambat
tumbuh 11
4. Pertambahan cabang primer pada beberapa perlakuan ketebalan media 14 5. Pertambahan cabang primer pada beberapa perlakuan konsentrasi zat
penghambat tumbuh 14
6. Jumlah cabang sekunder pada beberapa perlakuan ketebalan media 15 7. Jumlah cabang sekunder paa beberapa perlakuan konsentrasi zat penghambat
tumbuh 16
8. Jumlah cabang tersier pada beberapa perlakuan ketebalan media 18 9. Jumlah cabang tersier pada beberapa perlakuan konsentrasi zat penghambat
tumbuh 18
10.Jumlah bunga non cluster pada beberapa perlakuan ketebalan media 20 11.Jumlah bunga non cluster pada beberapa perlakuan konsentrasi zat
penghambat tumbuh 21
12.Penampakan bunga pada perlakuan K2P2 21 13.Penampakan bunga pada perlakuan K1P3 22 14.Jumlah cluster pada beberapa perlakuan ketebalan media 23 15.Jumlah cluster pada beberapa perlakuan konsentrasi zat penghambat tumbuh
24 16.Jumlah bunga pada beberapa perlakuan ketebalan media 25 17.Jumlah bunga pada beberapa perlakuan konsentrasi zat penghambat tumbuh 26
DAFTAR LAMPIRAN
1. Uji sidik ragam pengaruh K, P, dan KxP terhadap tinggi tanaman pada
pengamatan minggu ke-1 sampai ke-15 30
2. Uji sidik ragam pengaruh K, P, dan KxP terhadap pertambahan cabang primer
3. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang sekunder
pada pengamatan minggu ke-1 sampai ke-7 34
4. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang tersier pada
pengamatan minggu ke-1 sampai ke-7 36
5. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah daun pada
pengamatan minggu ke-1 sampai ke-15 38
6. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga non cluster
pada pengamatan minggu ke-9 sampai ke-15 41
7. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cluster pada
pengamatan minggu ke-9 sampai ke-15 43
8. Uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga pada
pengamatan minggu ke-9 sampai ke-15 45
9. Uji sidik ragam pengaruh K, P, dan KxP terhadap panjang akar dan bobot
akar 47
10. Kualitas udara pada lokasi penelitian 47
11. Denah percobaan 48
PENDAHULUAN
Latar Belakang
Bugenvil (Bougainvillea spectabilis Willd) atau yang lebih dikenal dengan sebutan bunga kertas merupakan salah satu jenis tanaman tropis yang sudah sangat popular di Indonesia. Tanaman yang termasuk ke dalam family Nyctaginaceae ini memiliki keindahan yang berasal dari seludang bunganya yang berwarna cerah dan menarik perhatian karena tumbuh dengan rimbunnya. Tanaman ini termasuk tanaman perdu tegak, dengan sistem perakaran tunggang dengan akar akar cabang yang melebar ke semua arah dengan kedalaman 40 cm -80 cm. Pada waktu tanaman ini berbunga tanaman ini memiliki kebiasaan merontokkan beberapa daunnya.
Batang tanaman ini agak keras dan mempunyai duri yang tajam dan bercabang-cabang. Perbanyakan tanaman ini juga dapat dilakukan dengan stek batang, cangkok, okulasi atau biji. Untuk media tanam diperlukan tanah gembur berpasir dengan tempat terbuka yang selalu terkena sinar matahari.
Di Indonesia tanaman ini sering digunakan sebagai salah satu tanaman yang ditanam di tepi ataupun median jalan. Hal ini disebabkan oleh sifat tanaman ini yang tahan akan stress air, tidak membutuhkan naungan dan juga dapat beradaptasi dengan baik pada daerah berpolusi udara, dan juga menurut Tata Cara Perencanaan teknik Lanskap Jalan No. 033/T/BM/1996 Direktorat Jenderal Bina Marga, Departemen Pekerjaan Umum, bugenvil merupakan salah satu tanaman yang dianjurkan untuk penanaman pada jalur tanaman tepi dan median jalan.
Bugenvil yang ditanam pada tepi ataupun median jalan juga memiliki berbagai fungsi selain dari segi estetika yakni sebagai penyerap polusi udara, penjerap debu, peredam kebisingan yang ditimbulkan oleh kendaraan, penahan silau lampu kendaraan. Hal ini dibuktikan dengan penelitian (Pandey,1994) terhadap 7 tanaman tahunan berkayu di daerah berpolusi udara yaitu Mangifera indica Linnaeus, Eugenia javanica Lam., Delonix regia Raf., Peltophorum pterocarpum (DC.) K. Heyne, Dalbergia sissoo DC.dan Bougainvillea spectabilis
Willd. Dari penelitian tersebut diperoleh hasil bahwa bugenvil memeliki luas daun, kandungan klorofil, asam askorbat, total N lebih tinggi dibandingkan dengan keenam tanaman lainnya.
Sebagai tanaman di median jalan dan tepi jalan, pertumbuhan dan perkembangan bugenvil dapat dipengaruhi oleh gas dan partikel yang terkandung dalam polusi udara. Semakin tinggi kadar polutan yang ada di udara, akan semakin terhambat pertumbuhan dan perkembangan tanaman (Laccase dan Treshow, 1978). Tentu saja dengan adanya pengaruh dari gas dan partikel yang terkandung dalam udara juga akan mempengaruhi kualitas estetika yang ditampilkan oleh tanaman tersebut, seperti warna bunga yang kurang cerah.
dominan, sehingga hanya jumlah daun yang akan bertambah banyak. Maka dibutuhkan pemecahan masalah bagaimana agar bugenvil dapat berbunga pada penanaman langsung pada tanahh dan daerah berpolusi udara seperti di tepi jalan ataupun median jalan.
Pembungaan pada bugenvil akan terjadi pada saat tanaman tersebut mengalami kekurangan air. Salah satu faktor yang dapat memicu pembungaan bugenvil adalah dengan menghambat perkembangan akarnya. Menghambat perkembangan akar dapat dilakukan dengan memberikan rintangan kepada akar sehingga laju perkembangan akarnya dapat terhambat. Penghambatan perkembangan akar dapat dilakukan dengan cara meletakkan batu kerikil dengan ketebalan tertentu dibawah permukaan tanaman sehingga akar tidak leluasa untuk tumbuh. Perbedaan ketebalan yang diberikan tentu saja akan memberikan hasil yang berbeda pada kecepatan tanaman tersebut untuk berbunga. Karena apabila rintangan yang diberikan kepada akar terlalu tebal ditakutkan tumbuhan tersebut menjadi mati.
Perlakuan lainnya untuk memicu pembungaan pada bugenvil adalah dengan memberikan zat penghambat tumbuh. Zat penghambat tumbuh merupakan suatu tipe senyawa organik yang menghambat perpanjangan batang, meningkatkan warna hijau dari daun dan secara tidak langsung menstimulasi pembungaan tanpa menyebabkan pertumbuhan yang abnormal (Cathey, 1975). Zat penghambat tumbuh yang digunakan pada penelitian ini adalah paclobutrazol, hal ini dikarekan paclobutrazol secara visual, penampakan bnga yang dihasilkan lebih kompak dan roset dibandingkan perlakuan daminozide dan chlormequate (Wati, 2000). Perbedaan konsentrasi zat penghambat tumbuh yang diberikan tentu saja akan memberikan hasil yang berbeda dalam kecepatan pembungaan bugenvil tersebut.
Dengan demikian diharapkan ketebalan lapisan penghambat pertumbuhan akar yang tepat dan konsentrasi zat penghambat tumbuh yang paling tepat dapat memecahkan permasalahan pembungaan pada bugenvil yang ditanam langsung pada tanah di daerah berpolusi udara.
Tujuan
Penelitian ini bertujuan untuk mengetahui ketebalan lapisan penghambat pertumbuhan akar dan konsentrasi zat penghambat tumbuh yang paling efektif untuk menstimulasi pembungaan pada tanaman bugenvil pada area terkena polusi udara.
Manfaat
Hasil penelitian dapat dijadikan panduan dalam penanaman bugenvil pada badan jalan sehingga bugenvil masih dapat berbunga walaupun berada pada daerah berpolusi udara.
Hipotesis
1. Semakin tebal gravel penghambat yang diberikan maka akan semakin efektif memicu pembungaan.
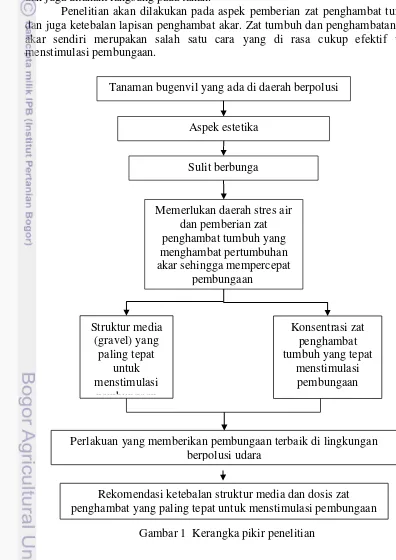
Kerangka Pikir
Penanaman tanaman bugenvil di median ataupun tepi jalan adalah satu pemilihan tanaman yang tepat, karena bugenvil termasuk tanaman yang memenuhi syarat untuk ditanaman di median ataupun tepi jalan. Akan tetapi Bugenvil akan sulit untuk berbunga jika ditanam di daerah yang berpolusi udara dan ditanam langsung pada tanah. Oleh karena itu dibutuhkan penelitian lebih lanjut bagaimana cara agar bugenvil tetap berbunga walaupun ditanam di daerah yang berpolusi udara dan juga ditanam langsung pada tanah.
Penelitian akan dilakukan pada aspek pemberian zat penghambat tumbuh dan juga ketebalan lapisan penghambat akar. Zat tumbuh dan penghambatan pada akar sendiri merupakan salah satu cara yang di rasa cukup efektif untuk menstimulasi pembungaan.
Gambar 1 Kerangka pikir penelitian Tanaman bugenvil yang ada di daerah berpolusi
Aspek estetika
Perlakuan yang memberikan pembungaan terbaik di lingkungan berpolusi udara
Rekomendasi ketebalan struktur media dan dosis zat penghambat yang paling tepat untuk menstimulasi pembungaan
TINJAUAN PUSTAKA
Bugenvil (Bougainvillea spectabilis)
Bugenvil merupakan tanaman tropis yang termasuk dalam family Nyctaginaceae. Bugenvil termasuk jenis tanaman perdu, batang atau pohonnya kokoh, memanjat, berduri pada ketiak daun yang letaknya menjauhi batang, membengkok, panjang 5-15 m, ranting dan karangan bunga kerap kali berambut jingga. Duduk daun tersebar sampai berhadapan, bertangkai, berbentuk bulat telur atau bulat telur memanjang, meruncing, panjang 4-10 cm dan lebar 2-6 cm. Tepi daun kerap kali rata. Bunganya majemuk campuran tersusun dalam malai anak payung yang bertangkai (Suryowinoto, 1997).
Struktur batang merupakan pohon yang berkayu keras penampangnya bulat, bercabang dan beranting banyak, sehingga tanaman ini diabaikan tumbuh alami dapat mencapai ketinggian 15 cm. Daun-daun tumbuh rimbun secara tunggal, bentuknya mirip jantung hati yang dasarnya agak bulat (bundar) dengan warna hijau tua namun ada pula yang belang-belang (variegata) antara hijau dengan putih atau hijau bercampur kekuning-kuningan (Rukmana, 1995).
Bunga tanaman ini dibedakan atas dua macam yaitu bunga asli dan palsu (Bractea). Bunga asli tentunya seperti tabung, berukuran kecil dan panjangnya sekitar 2 cm, serta berwarna putih. Sedangkan bunga palsu tampak cantik, tersusun dalam tangkai yang lebat dan menjuntai, berwarna putih, merah, jingga, merah hati, ungu ataupun kombinasi dari warna-warni tersebut. Bunga palsu ini sebenarnya adalah daun penumpu yang berfungsi sebagai perhiasan bunga (Rukmana, 1995). Tanaman bugenvil terdiri dari 5 spesies yaitu B. x buttiana (B. peruviana x glabra), B. glabra, B. peruviana, B. spectabilis dan B. spectoglabra.
Syarat Tumbuh
Dapat tumbuh dengan baik didataran rendah ataupun tinggi, hingga ketinggian 1.400 meter diatas permukaan laut. Tanaman hias ini membutuhkan cahaya matahari penuh untuk proses pembungaannya. Untuk didaerah yang tergolong subur dengan curah hujan cukup tinggi, media tanah yang digunakan biasanya dicampur dengan media berupa puing-puing bangunan (Endah, 2002).
Pada fase awal pertumbuhan, Bugenvil membutuhkan curah hujan atau air tanah yang memadai. Namun setelah memasuki fase reproduktif berbunga justru lebih menyerangi keadaan iklim kering. Disamping itu, Bugenvil menghendaki sinar matahari yang langsung dan insensitasnya panjang sehingga cocok ditanam ditempat terbuka atau tanaman luar ruangan. Mencermati sifat pertumbuhan Bugenvil secara alami menunjukkan bahwa pada musim hujan tidak berbunga atau hanya tumbuh daun dan pucuk-pucuknya saja, kemudian pada musim kemarau berbunga lebat. Sesuai massa pembungaannya, tanaman ini akan mengalami massa istirahat pertumbuhan selama kurang lebih 2 bulan, dan berikutnya akan berbunga kembali (Rukmana, 1995).
Pembungaan
reproduktif (Noggle dan Fritz, 1986). Peralihan fase ini dapat dipengaruhi oleh faktor dari luar maupun faktor dari dalam. Faktor dari dalam contohnya genotip, faktor dari luar contohnya suhu, cahaya, air, pupuk dan lain sebagainya. Tanaman akan berbunga setelah tanaman tersebut telah melewati masa vegetatif dimana terjadi pertambahan besar berat dan menimbun zat cadangan lebih banyak, terutama karbohidrat sebagai bahan utama pembentukan bunga.
Pembungaan bugenvil digambarkan sebagai kesatuan 3 bunga kecil berbentuk pipa, dimana setiap bunga tersebut menempel pada permukaan braktea yang berwarna merah muda atau merah cerah. Seluruh pembungaan dibentuk oleh 2 pembungaan braktea. Pada tahap perkembangan awal, 2 braktea tersebut hamper seluruhnya menutupi ujung pembungaan. Meskipun demikian, braktea tersebut sangat kecil dan setelah dewasa menjadi tidak menarik dan kadang-kadang berganti menjadi daun. Braktea terbentuk dengan cepat setelah inisiasi ujung pembungaan. Selama bagian ujung membesar, 3 braktea primordia terbentuk dalam rangkaian yang mengelilingi ujung pembungaan (Sattler dan Louise, 1982).
Flower Forcing
Flower forcing merupakan suatu cara untuk merangsang pembungaan tanaman dengan manipulasi kondisi lingkungan pada tanaman yang telah mencapai kondisi dewasa agar tanaman dapat berbunga di luar musim. Teknik ini dapat dilakukan dengan 2 cara yaitu cara fisik dan kimia.
Cara fisik untuk merangsang pembungaan dapat dilakukan dengan pemangkasan akar, stress air, pelukaan pada kulit batang dang menggunakan media tumbuh yang sesuai untuk pembungaan. Untuk merangsang pembungaan secara kimia dapat digunakan zat penghambat tumbuh atau retardan.
Retardan
Zat penghambat tumbuh atau ZPT pada tanaman adalah senyawa organik yang tidak termasuk unsur hara mineral. Ada lima kelompok ZPT yang terdapat dalam tanaman, yaitu auksin, giberelin, cytokinin, ethylene dan inhibitor. Setiap jenis ZPT tersebut memiliki cara kerja dan pengaruh yang berlainan. ZPT dibutuhkan tanamna dalam jumlkah yang sedikit dan keadaannya dapat m,endukung, menghambat, atau mengubah proses fisiologi tanaman. ZPT dibentuk secara alami oleh tanamn untuk menunjang proses fisiologinya, tetapi seiring dengan perkembangan teknologi saat ini telah dibuat tiruannya. Pengaruh dan efektivitas kerjanya sama dengan ZPT alami (Endah, 2002). Zat penghambat tumbuh yang dihasilkan oleh tanaman disebut zat penghambat tumbuh endogen sedangkan yang sintetik disebut zat penghambat tumbuh eksogen.
Retardan merupakan zat penghambat tumbuh eksogen, yang dapat menghambat perpanjangan batang, meningkatkan warna hijau daun dan secara tidak langsung mempercepat pembungaan tanpa menyebabkan pertumbuhan yang abnormal.
Media Tanam
Setiap tanaman tentulah membutuhkan media yang berbeda-beda untuk dapat tumbuh secara optimal, oleh karena itu diperlukan ketepatan dalam memilih media tanam untuk tanaman itu sendiri, agar tanaman tersebut dapat tumbuh secara optimal dan memberikan hasil seperti yang diharapkan.
Media tanam dapat berupa tanah saja atau campuran antara tanah dengan media yang lain. Media tanam yang digunakan hanya terdiri dari tanah saja pada umumnya kurang memenuhi syarat sebagai media tanam yang baik. Oleh karena itu, media tanah perlu ditambah dengan media yang lain (Harjadi, 1989).
Tanaman Bugenvil memerlukan kondisi kering untuk dapat berbunga. Oleh karena itu, untuk mencapai kondisi tersebut dapat dilakukan manipulasi lingkungan tumbuh Bugenvil. Pasir merupakan salah satu campuran media tumbuh yang dapat menciptakan kondisi kering bagi tanaman.
Pasir memiliki drainase yang sangat baik dan mampu menciptakan ruang yang besar sehingga dapat meneruskan infiltrasi air dengan cepat. Oleh karena itu pasir dapat dicampur dengan media tanah agar dapat menghasilkan lingkunga tumbuh yang kering yang dapat menstimulasi pembungaan bugenvil. Tetapi tanah yang terlalu berpasir dapat mengakibatkan run off, sehingga dapat menghilangkan unsur-unsur yang dibutuhkan secara cepat.
Ada beberapa macam tanah yang bisa digunakan dalam media tanam untuk tanaman hias, antara lain tanah pasir, tanah lempung, dan tanah geluh. Untuk tanah geluh ini mempunyai sifat diantara, tanah pasir dan tanah lempung. Sehingga sangat baik untuk digunakan dalam media tanaman hias. Pada umumnya campuran yang digunakan adalah bila tanaman yang suka keadaan kering maka ½ bagian pasir, ½ bagian pupuk kandang 1 lapis pecahan batu merah di dasar pot (Wianta, 1983).
Polusi Udara
Menurut Keputusan Menteri Negara Kependudukan dan Lingkungan Hidup No. 02/MENKLH/1988, yang dimaksud dengan polusi udara adalah masuk atau dimasukkannya makhluk hidup, zat, energy atau komponen lain ke dalam udara atau berubahnya tatanan udara oleh kegiatan manusia atau oleh proses alam, sehingga kualitas udara turun sampai ke tingkat tertentu yang menyebabkan udara menjadi kurang atau tidak datap berfungsi lagi sesuai dengan peruntukannya.
Polutan-polutan udara yang banyak terdapat di jalan adalah karbon monoksida, nitrogen oksida, ozon, peroksiasetilnitrat, Sox dan partikel Pb dan Zn. Polusi udara yang meningkat sampai pada tingkat tertentu dapat mengganggu tanaman, sehingga tanaman menjadi stress. Tetapi, tidak semua polutan udara dapat menyebabkan kerusakan pada tanaman.
METODE
Lokasi dan Waktu penelitian
Penelitian dilakukan di Tol Jagorawi, pada segmen antara gerbang tol bogor dan Terminal Baranang Siang. Lokasi ini dipilih karena lokasi ini memiliki tingkat polutan udara yang sangat tinggi karena jumlah lalu lintas yang sangat padat baik pagi, siang ataupun malam hari. Penelitian ini dilakukan pada bulan Januari - Juni 2015.
Batasan Penelitian
Penelitian ini dibatasi sampai dengan hasil berupa didapatkannya struktur media tanam dan juga didapatkannya konsentrasi zat penghambat tumbuh (Paclobutrazol) yang paling tepat untuk menstimulasi pembungaan tanaman bugenvil.
Alat dan Bahan
Penelitian ini menggunakan beberapa alat dan bahan yaitu: 1. Alat yang digunakan dalam penelitian ini adalah:
a. Cangkul b. Kored
c. Penyiram tanaman d. Ajir
e. Tali
f. Alat tulis untuk mencatat g. Laptop dan Software h. Timbangan
i. Alat ukur
2. Bahan yang digunakan dalam penelitian ini adalah: a. Pupuk kandang (Kotoran Sapi)
b. Pupuk NPK (15-15-15)
c. Zat penghambat tumbuh (Paclobutrazol) d. Batu gravel untuk lapisan penghambat akar e. Polybag 30cmx30 cm
Metode
Faktor I struktur media yang digunakan dibedakan menjadi 3 taraf, yaitu: K0 = Ketebalan 0 cm
K1 = Ketebalan 5 cm K2 = Ketebalan 10 cm
Faktor II konsentrasi zat penghambat tumbuh dibedakan menjadi 4 taraf, yaitu: P0 = Konsentrasi 0 ppm
P1 = Konsentrasi 50 ppm P2 = Konsentrasi 100 ppm P3 = Konsentrasi 200 ppm
Diperoleh 12 perlakuan, dimana setiap perlakuan dilakukan ulangan sebanyak 3 kali, sehingga dalam penelitian ini terdapat 36 unit tanaman. Layout penelitian dapat dilihat pada lampiran 11.
K0P0 K1P0 K2P0 K0P1 K1P1 K2P1
K0P2 K1P2 K2P2 K0P3 K1P3 K2P3
Data hasil penelitian dianalisis dengan sidik ragam dengan model linier sebagai berikut:
Yijk = µ + pi + i + j + ij + eijk Dimana:
Yijk = Hasil pengamatan perlakuan ZPT pada taraf ke-i dan ketebalan media penghambat pada taraf ke-j
µ = Nilai tengah ρi = Efek blok ke-i
αi = Pengaruh ZPT pada taraf ke-i
βj = Pengaruh ketebalan media pada taraf ke-j
(αβ)ij = Pengaruh interaksi ZPT pada taraf i dan ketebalan media pada taraf ke-j
eijk = Pengaruh galat yang disebabkan perlakuan ZPT pada taraf ke-i dan ketebalan media pada taraf ke-j pada ulangan ke-k
Data hasil penelitian pada perlakuan yang berpengaruh nyata dilanjutkan dengan uji Duncan Multiple Range Test taraf alpha (α) 5%.
Persiapan Stek, Penanaman dan pemeliharaan
Stek diambil dari batang bugenvil yang telah dewasa. Panjang stek yang digunakan 15 cm dengan diameter 1,5 cm. Stek ditanam pada polibag terlebih dahulu, setelah tanaman dinilai cukup dewasa (30 cm) barulah tanaman dipindahkan ke daerah berpolusi udara dengan cara ditanam langsung pada tanah.
Gravel atau kerikil diletakkan pada dasar lubang dengan ketebalan sesuai dengan masing-masing perlakuan. Perbandingan pupuk kandang dengan tanah yang diberikan adalah 1:3
Selama penelitian tanaman disiram sebanyak dua hari sekali, pada pagi hari. Sedangkan pemberian pupuk NPK sebanyak 20 gram/lubang dilakukan sebanyak satu bulan sekali.
Pemberian Retardan
Pemberian retardan atau zat penghambat tumbuh dilakukan pada 4 dan 8 minggu setelah tanam.
Retardan yang dipakai pada penelitian kali ini menggunakan paclobutrazol yang cara pemberiannya dengan cara disiram ke permukaan tanah. Pemberian pertama dilakukan pada pada tanggal 22 Februari 2015 pukul 07.00 WIB dan pemberian kedua pada pukul 16.00 WIB. Dengan masing-masing volume yang diberikan sebanyak 50 ml.
Pengamatan dilakukan seminggu sekali pada pertumbuhan tanaman yang meliputi tinggi tanaman, pertumbuhan cabang primer, petumbuhan cabang sekunder, pertumbuhan cabang tersier, jumlah bunga dalam cluster, jumlah bunga non cluster.
Pengamatan Pertumbuhan dan Perkembangan Tanaman
Pengamatan dilakukan tiap satu minggu sekali pada pertumbuhan vegetatif dan genereatif tanaman, yang meliputi:
1. Tinggi tanaman. Pengukuran dilakukan dengan cara mengukur tinggi tanaman dari pangkal, tepat diatas permukaan tanah sampai ke pucuk. Pengukuran dilakukan sebanyak 15 kali.
2. Pertambahan cabang primer. Pengamatan dilakukan dengan sebanyak 15 kali, jumlah cabang yang dihitung adalah cabang yang tumbuh setelah penanaman.
3. Jumlah cabang sekunder. Pengamatan jumlah cabang sekunder dilakukan dengan cara menghituung banyaknya cabang yang tumbuh pada cabang primer.
4. Jumlah cabang tersier. Pengamatan jumlah cabang tersier dilakukan dengan cara menghitung banyaknya cabang yang tumbuh pada cabang sekunder. 5. Jumlah bunga total. Pengamatan dilakukan setelah tanaman mulai berbunga.
Bunga yang dihitung adalah bunga yang telah mekar penuh, baik itu bunga cluster maupun bunga non cluster.
6. Jumlah bunga non cluster. Bunga yang dihitung adalah bunga yang tidak bergerombol atau berjumlah satu pada satu tangkai.
7. Jumlah cluster. Perhitungan jumlah cluster dilakukan pada tangkai bunga yang memiliki bunga lebih dari satu.
8. Jumlah daun. Pengamatan jumlah daaun pada setiap tanaman di setiap minggunya.
Pengamatan Polusi Udara dan Unsur Iklim
Pengamatan dilakukan satu kali pada lokasi penelitian yang meliputi: 1. Gas Nitrogen Dioksida (NO2), dengan metode analisis Saltzman. 2. Gas Sulfur Dioksida (SO2), dengan metode analisis Pararosanilin. 3. Partikel debu, dengan metode Gravimetrik.
4. Kecepatan angin dengan Velocity Meter
HASIL DAN PEMBAHASAN
Kondisi Umum
Selama pengamatan berlangsung tidak ditemukan serangan hama ataupun penyakit terhadap tanaman. Akan tetapi pada minggu ke-5 penelitian tedapat satu tanaman yang rebah akibat terpaan angin ketika hujan.
Curah hujan selama peneltian ini berlangsung cukup mendukung untuk penyiraman, karena hujan lebih banyak terjadi pada sore hari.
Tinggi Tanaman
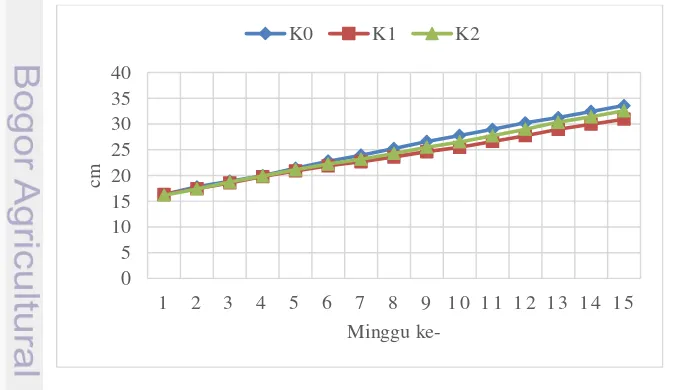
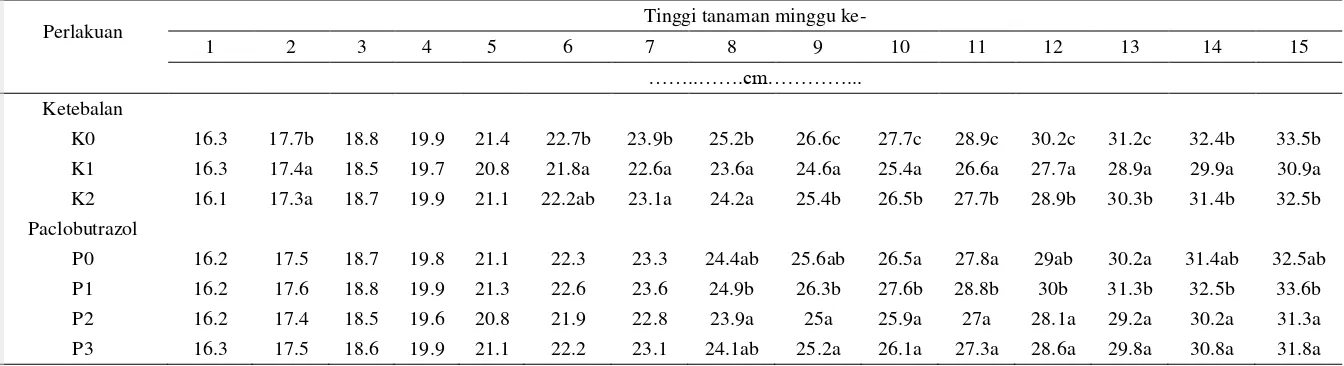
Tabel 1 menunjukkan tinggi tanaman dari minggu ke-1 sampai 12, sedangkan hasil analisis sidik ragam pertambahan tinggi tanaman dari minggu ke-1 sampai ke-12 MST pada Tabel Lampiran ke-1. Sidik ragam menunjukkan bahwa interaksi perlakuan ketebalan media dan zat penghambat tumbuh (KxP) tidak berpengaruh nyata terhadap pertambahan tinggi tanaman. Perlakuan ketebalan media penghambat berpengaruh nyata pada minggu ke-2 dan berpengaruh sangat nyata sejak minggu ke-6 sampai 15 MST, sedangkan perlakuan konsentrasi zat penghambat tumbuh berpengaruh nyata pada minggu ke-8 sampai 15 MST.
Perlakuan kontrol (K0) secara nyata berbeda dengan perlakuan K1 dan K2 pada minggu ke-2 dan minggu ke-6 sampai 8 MST. Pada minggu ke-9 hingga 13 MST semua perlakuan berbeda nyata satu sama lain. Perlakuan ketebalan media penghambat 5 cm (K1) berpengaruh nyata pada minggu ke-14 dan 15 MST.
Pada minggu ke-1 MST, K1 memiliki tinggi tanaman tertinggi dibandingkan 2 perlakuan lainnya, sedangkan K2 memiliki tinggi tanaman terendah. Pada minggu ke-2 hingga 15 MST, K0 memiliki tinggi tanaman tertinggi, dengan tinggi 33.6 cm pada miggu ke-15. Perlakuan K2 memiliki tinggi tanaman terendah pada minggu ke-2. Perlakuan K1 memiliki tinggi tanaman terendah pada minggu ke-3 hingga 15 MST, dengan tinggi 30.9 cm, dimana dari minggu ke-9 hingga 15 MST perlakuan K1 berbeda nyata dengan perlakuan lainnya (Gambar 2).
Ketiga jenis perlakuan memiliki tingggi tanaman yang terus meningkat hingga minggu ke-15, namun perlakuan K1 memiliki tingkat pertumbuhan tinggi yang paling rendah dibandingkan dua perlakuan lainnya. Dari hasil ini dapat terlihat bahwa ketebalan media penghambat yang paling efektif dalam menghambat pertumbuhan tinggi tanaman adalah ketebalan 5 cm (K1).
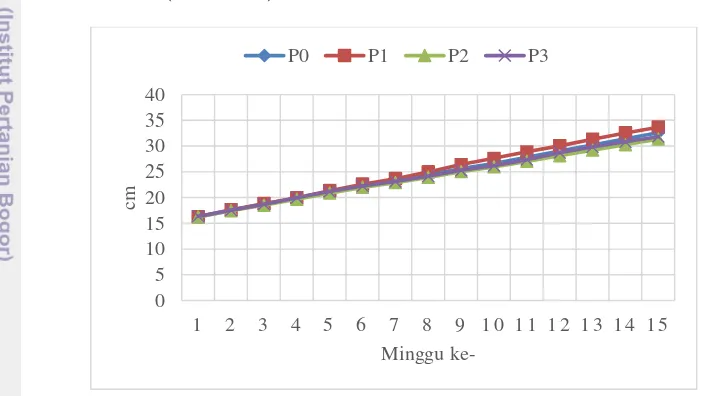
Pemberian zat penghambat tumbuh dengan konsentrasi 50 ppm (P1) secara nyata berbeda dengan perlakuan lainnya pada minggu ke-8 hingga 15 MST. Perlakuan P1 memiliki tinnggi tanaman tertinggi dari minggu ke-8 hingga 15. Tinggi tanaman tertinggi pada minggu ke-8 yaitu 24.9 cm dan pada minggu ke-15 sebesar 33.7 cm. (Gambar 3).
Gambar 3 Tinggi tanaman pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Dari hasil ini dapat terlihat bahwa P1 memiliki tinggi tanaman tertinggi dan memiliki hasil yang berbeda nyata pada minggu ke-8 hingga 15 MST. Dapat diartikan bahwa P1 tidak efektif dalam menghambat laju pertumbuhan tinggi tanaman. Pada minggu ke-15 P0 memiliki tinggi tanaman sebesar 32.6 cm, sedangkan P3 memiliki tinggi tanaman sebesar 31.8 cm, sedangkan P2 cenderung memiliki ketinggian terendah dibandingkan perlakuan lainnya, yaitu sebesar 31.4 cm.
Tabel 1 Tinggi tanaman pada minggu ke-1 sampai 15 MST
Perlakuan Tinggi tanaman minggu ke-
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
……..…….cm…………...
Ketebalan
K0 16.3 17.7b 18.8 19.9 21.4 22.7b 23.9b 25.2b 26.6c 27.7c 28.9c 30.2c 31.2c 32.4b 33.5b K1 16.3 17.4a 18.5 19.7 20.8 21.8a 22.6a 23.6a 24.6a 25.4a 26.6a 27.7a 28.9a 29.9a 30.9a K2 16.1 17.3a 18.7 19.9 21.1 22.2ab 23.1a 24.2a 25.4b 26.5b 27.7b 28.9b 30.3b 31.4b 32.5b Paclobutrazol
P0 16.2 17.5 18.7 19.8 21.1 22.3 23.3 24.4ab 25.6ab 26.5a 27.8a 29ab 30.2a 31.4ab 32.5ab P1 16.2 17.6 18.8 19.9 21.3 22.6 23.6 24.9b 26.3b 27.6b 28.8b 30b 31.3b 32.5b 33.6b P2 16.2 17.4 18.5 19.6 20.8 21.9 22.8 23.9a 25a 25.9a 27a 28.1a 29.2a 30.2a 31.3a P3 16.3 17.5 18.6 19.9 21.1 22.2 23.1 24.1ab 25.2a 26.1a 27.3a 28.6a 29.8a 30.8a 31.8a
Pertambahan Cabang Primer
Pertumbuhan cabang primer hanya terjadi dari minggu ke-1 hingga 5 MST. Tabel 2 menunjukkan pertambahan jumlah cabang primer dari minggu ke-1 hingga 5 MST. Tabel lampiran 2 menunjukkan hasil analisis sidik ragam pertambahan cabang primer dari minggu ke-1 hingga 5 MST, pada tabel tersebut dapat dilihat bahwa interaksi antara dua perlakuan (KxP) tidak berbeda nyata terhadap pertambahan cabang primer. Perlakuan ketebalan media penghambat (K) dan konsentrasi zat penghambat tumbuh (P) berpengaruh nyata pada minggu ke-3. Tabel 2 Pertambahan cabang primer dari minggu ke-1 sampai 6 MST
Perlakuan Minggu ke- Total
1 2 3 4 5
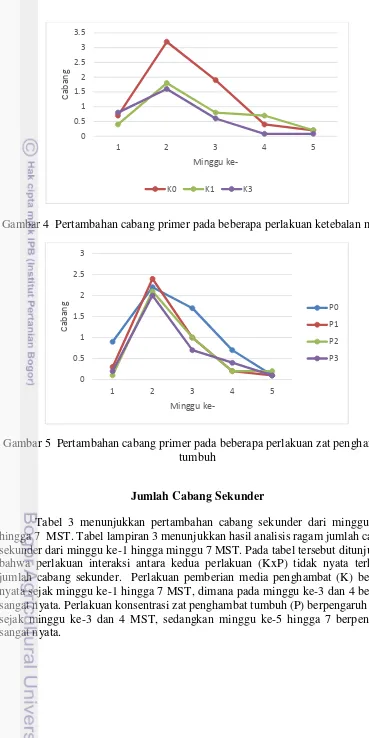
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Setelah minggu ke-6 tidak ada lagi pertambahan cabang primer. Dari tabel diatas dapat diketahui bahwa perlakuan K2 memiliki pertambahan cabang terbanyak pada minggu ke-1 MST dengan 4.1 cabang. Pada minggu ke-2 dan 3 perlakuan K0 memiliki pertambahan cabang primer terbanyak dengan jumlah 3.2 cabang dan 1.9 cabang, dimana pada minggu ke-3 K0 berbeda nyata dengan perlakuan lainnya, Pada minggu ke 4 K1 memiliki pertambahan cabang terbanyak dengan 0.7 cabang.
Sementara itu pertumbuhan cabang primer terendah pada minggu pertama adalah K0, pada minggu ke-1 K1 memiliki pertumbuhan terendah. K2 memiliki pertambahan cabang terendah pada minggu ke-2 hingga 5 MST. K1 dan K2 memiliki pertumbuhan cabang primer lebih rendah dibandingkan K0, akan tetapi K2 cenderung memiliki pertambahan cabang primer yang lebih rendah.
Gambar 4 Pertambahan cabang primer pada beberapa perlakuan ketebalan media
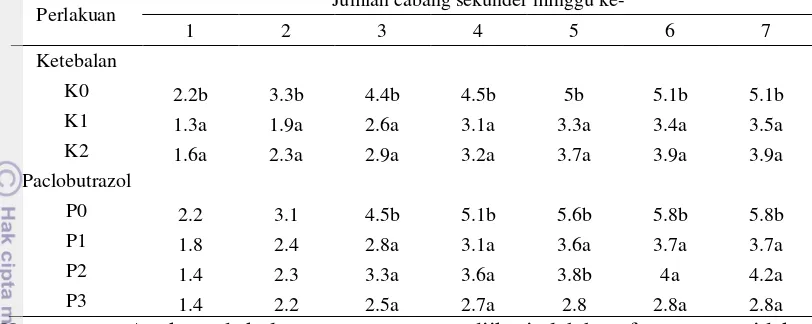
Gambar 5 Pertambahan cabang primer pada beberapa perlakuan zat penghambat tumbuh
Jumlah Cabang Sekunder
Tabel 3 Jumlah cabang sekunder dari minggu ke-1 hingga 6 MST
Perlakuan Jumlah cabang sekunder minggu ke-
1 2 3 4 5 6 7
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
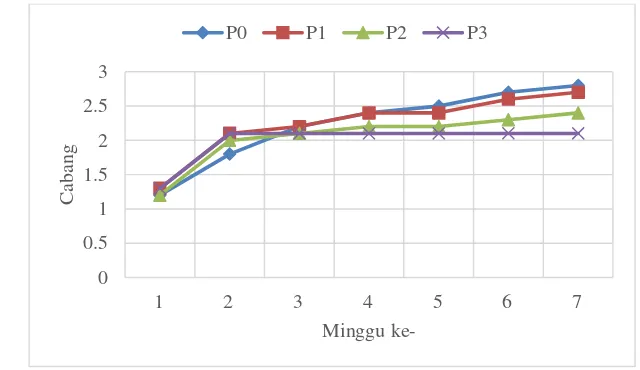
Sejak minggu pertama hingga minggu ke-7 perlakuan K0 berbeda nyata dengan perlakuan lainnya. Dimana perlakuan K0 selalu memiliki jumlah cabang sekunder terbanyak tiap minggunya. Perlakuan K1 cenderung memiliki jumlah cabang terendah dibandingkan K2 dari minggu pertama hingga minggu ke-7, dengan jumlah cabang sekunder pada minggu ke-7 sebesar 3.5 cabang (Gambar 6). Hal ini dapat disebabkan karena pada awal penanaman hambatan dengan berbagai ketebalan tidak terlalu berpengaruh, Karena kerja akar yang belum terlalu optimal. Tanaman K1 memiliki jumlah cabang sekunder yang lebih sedikit dari perlakuan lainnya karena kerikil yang ada pada dasar lubang tanam menghalangi pertumbuhan akar, hal ini menyebabkan kekuatan akar untuk mengabsorpsi unsur hara dan mineral pada tanah menjadi berkurang, sehingga tanaman menjadi stres air. Stres air mengakibatkan hasil fotosintesi berupa fotosintat dari daun dan cabang tanaman tidak dapat ditransportasikan ke bagian lain (Endah, 2002). Hal ini lah yang membuat laju percabangan menjadi rendah.
Pada minggu ke-3 hingga 7 MST pelakuan kontrol (P0) berbeda nyata dengan perlakuan lainnya. Perlakuan kontrol juga memiliki jumlah cabang sekunder terbanyak diantar ketiga perlakuan lainnya, yakni sebesar 5.8 cabang pada minggu ke-7. Perlakuan P1, P2 dan P3 memiliki jumlah cabang sekunder yang tidak berbeda jauh satu sama lain, akan tetapi P3 cenderung memiliki jumlah cabang sekunder yang lebih rendah dibandingkan P1 dan P2, dengan jumlah 2.8 cabang pada minggu ke-7, sedangkan P1 dan P2 secara berurutan memiliki 3.7 dan 4.2 cabang pada minggu ke-7 (Gambar 7). Jadi pemberian paclobtrazol dengan berbagai konsentrasi dapat menghambat pertumbuhan cabang. Paclobutrazol merupakan zat penghambat tumbuh yang efektif menghambat pertumbuhan vegetatif tanaman, melalui penghambatan giberilin. Biosintesis giberelin yang terhambat membuat tanaman meningkatkan biosisntesi asam absitik (Watimena, 1987). Asam absitik dapat menyebabkan dormansi pada tunas tanaman (Weaver, 1972).
Gambar 7 Jumlah cabang sekunder pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Jumlah Cabang Tersier
Tabel 4 menunjukkan jumlah cabang tersier dari minggu ke-1 hingga 7 MST. Tabel lampiran 4 menunjukkan hasil analisis ragam jumlah cabang tersier dari minggu ke-1 hingga 7 MST. Pada tabel tersebut ditunjukkan bahwa perlakuan interaksi antara kedua perlakuan (KxP) tidak berbeda nyata terhadap jumlah cabang tersier. Perlakuan pemberian media penghambat (K) berbeda nyata sejak minggu ke-1 hingga 3 MST dan juga minggu ke-5 dan 7 MST, dimana pada minggu ke-2 dan 3 perlakuan K0 berbeda sangat nyata.. Perlakuan konsentrasi zat penghambat tumbuh (P) tidak berpengaruh nyata terhadap jumlah cabang tersier.
Gambar 8 Jumlah cabang tersier pada beberapa perlakuan ketebalan media Tabel 4 Jumlah cabang tersier dari minggu ke-1 hingga 7 MST
Perlakuan Jumlah cabang tersier minggu ke-
1 2 3 4 5 6 7
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Mulai dari minggu pertama hingga minggu ke-7 perlakuan kontrol (K0) memiliki jumlah cabang tersier terbanyak dan berbeda nyata dengan perlakuan lainnya, kecuali di minggu ke-4 dan 6 MST perlakuan kontrol tidak berbeda nyata. Sementara itu K1 memiliki cabang tersier yang lebih banyak dibandingkan dengan K2, pada minggu ke-7. (Gambar 9).
Jumlah Daun
Gambar 9 Jumlah cabang tersier pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Perlakuan K dengan rata rata jumlah daun tertinggi dimiliki oleh K0 dengan jumlah daun 133.61 daun, sedangkan K1 dan K2 masing-masing memiliki jumlah daun sebanyak 133.5 dan 133.08 daun. Perlakuan ketebalan media penghambat tidak mempunyai dampak terhadap jumlah daun pada tanaman.
Perlakuan P berbeda nyata pada minggu ke-3, 5 6, dan 11 MST. Pada minggu ke-3, perlakuan kontrol memiliki jumlah daun terbanyak dengan jumlah 117 daun, berbeda nyata dengan semua perlakuan. Pada minggu ke-5 perlakuan P1 memiliki jumlah daun terbanyak dengan jumlah daun sebanyak 119.2 daun. Pada minggu ke-6 jumlah daun terbanyak dimiliki oleh perlakuan P2 dengan total 120.6 daun. Sedangkan pada minggu ke 11 P1 memiliki jumlah daun terbanyak dengan jumlah 159 daun.
Jumlah Bunga Non Cluster
Jumlah bunga non cluster sangat berfluktuasi karena selain adanya pertambahan bunga, jumlah bunga juga berkurang seiring dengan gugurnya bunga. Tabel 6 menunjukkan jumlah cabang tersier dari minggu ke-9 hingga 15 MST. Tabel lampiran 6 menunjukkan hasil analisis ragam jumlah bunga non cluster dari minggu ke-9 hingga 15 MST. Dapat dilihat juga bahwa interaksi antar kedua faktor (KxP) tidak berpengaruh nyata terhadap jumlah cluster. Perlakuan ketebalan media penghambat berpengaruh nyata terhadap jumlah bunga non cluster pada minggu ke-9 hingga 15 MST, sedangkan perlakuan konsentrasi zat penghambat tumbuh berpengaruh nyata pada minggu ke-9 hingga 11, dan juga minggu ke-15.
Tabel 5 Jumlah daun dari minggu ke-1 sampai 15 MST
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Perlakuan Jumlah daun minggu ke- Rata-rata
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Ketebalan
K0 98.9 108 112.2 110.5 115.1 119.2 125.8 130.3 134.3 140.9 151.6 161 164 165.9 166.5 133.61 K1 102.6 107 110.4 110.8 114.1 117.6 125.3 129.6 134.5 132.2 155.1 161.5 162 168 171.8 133.50 K2 100.7 110.3 114 113.7 114.7 113 119.6 124.1 134 131.3 155.4 163 164.1 168.3 170 133.08 Paclobutrazol
Tabel 6 Jumlah bunga non cluster dari minggu ke-9 hingga 15 MST
Perlakuan Jumlah bunga non cluster minggu ke- Rata-rata
9 10 11 12 13 14 15
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Pada minggu ke-9 perlakuan dengan ketebalan media penghambat 10 cm (K2) berbeda nyata dengan dua pengaruh lainnya, yakni memiliki bunga non cluster sebanyak 1 bunga. Pada minggu ke-10 hingga 15 MST perlakuan kontrol berbeda nyata dengan perlakuan lainnya dengan bunga terendah hingga minggu ke-15 yakni sebesar 4.4 bunga. Pada minggu ke-9 hingga minggu ke-12 K2 memiliki jumlah bunga non cluster tertinggi, yakni sebesar 4.2 bunga. Namun mulai dari minggu ke-13 hingga 15 MST K1 memiliki jumlah bunga tertinggi, yakni sebesar 7.2 bunga. (Gambar 10).
Perlakuan dengan konsentrasi zat penghambat tumbuh 100 ppm (P2) berbeda nyata dengan perlakuan lainnya pada minggu ke-9 hingga 11 MST. Sedangkan P3 berbeda nyata dengan perlakuan lainnya pada minggu ke-15. Pada minggu ke-9 dan 10 P1 memiliki jumlah bunga terendah, yakni sebesar 0.7 bunga pada minggu ke-10. Pada mingggu ke-11 hingga 13 MST perlakuan P0 memiliki jumlah bunga terendah, yakni sebesar 4.6 pada minggu ke-14 sedangkan pada minggu ke-15 P1 memiliki jumlah bunga non cluster terendah, yakni sebesar 4.8 bunga.
Jumlah bunga non cluster tertinggi dimiliki oleh perlakuan P2 mulai dari minggu 9 hingga 13 MST, yakni sebesar 4.7 bunga. Sedangkan pada minggu ke-14 dan 15 MST P3 memiliki jumlah bunga non cluster tertinggi dengan 7.7 bunga pada minggu ke-15. (Gambar 11).
Gambar 11 Jumlah bunga non cluster pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Jumlah Cluster
Tabel 7 menunjukkan jumlah cluster dari minggu ke-9 hingga 15 MST. Tabel lampiran 7 menunjukkan hasil analisis ragam jumlah cluster dari minggu ke-9 hingga 15 MST. Dapat dilihat juga bahwa interaksi antar kedua faktor (KxP) tidak berpengaruh nyata terhadap jumlah cluster. Perlakuan ketebalan media penghambat berpengaruh nyata pada minggu ke-11 dan 12 MST, sedangkan perlakuan konsentrasi zat penghambat tumbuh berpengaruh nyata pada minggu ke-11 hingga 15 MST.
Gambar 12 Penampakan bunga pada perlakuan K2P2 0
2 4 6 8 10
9 1 0 1 1 1 2 1 3 1 4 1 5
B
u
n
g
a
Minggu
Gambar 13 Penampakan bunga pada perlakuan K1P3
Perlakuan kontrol memiliki jumlah cluster terendah dengan 6.9 cluster pada minggu ke-15, berbeda nyata dengan perlakuan lainnya pada minggu ke-11 dan 12 MST. K2 memiliki jumlah cluster terbanyak dengan 12.4 cluster. Begitupun dengan jumlah rata-rata cluster, K2 memiliki rata-rata luster terbanyak dengan 6.92 cluster, sedangkan K0 memiliki rata-rata terendah dengan 3.28 cabang. Dari ketiga percobaan, jumlah cluster terus bertambah setiap minggunya.
Tabel 7 Jumlah cluster dari minggu ke-9 hingga 15 MST
Perlakuan Jumlah cluster minggu ke- Rata-rata
9 10 11 12 13 14 15
Ketebalan
K0 0.1 0.1 1.1a 3.8a 5 6 6.9 3.28 K1 1 1.4 3.9b 7b 7.9 8.8 10 5.71 K2 0.7 1.9 4.7b 8.4b 9.5 10.9 12.4 6.92 Paclobutrazol
P0 0.4 1.5 3.8ab 5.3ab 6.1ab 6.5a 6.6a 4.31 P1 0.2 0.4 1.8a 4.2a 5.3a 6.2a 7.1a 3.6 P2 1.4 2.1 5.2b 7.8ab 8.6ab 9.7ab 12b 6.68 P3 0.5 0.5 2.1a 8.2b 9.8b 11.7b 13.3b 6.58 Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak
berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Tanaman mulai berbunga pada minggu ke-9.
cluster tertinggi. Jumlah cluster pada perlakuan kontrol lebih sedikit dibandingkan K1 pada setiap minggu nya, sehingga dapat disimpulkan bahwa pemberian media penghambat pada penananaman bugenvil dapat mempercepat terbentuknya cluster bunga. (Gambar 14)
Adanya penghambat pada dasar lubang tanam membuat pertumbuhan akar menjadi terganggu. Hal ini dapat menyebabkan menurunnya kekuatan akar untuk mengabsorpsi hara mineral. Berkurangnya absorpsi hara terutama nitrogen akan meningkatkan nisbah C/N pada bagian pucuk. Stres air, penurunan giberelin dan peningkatan nisbah C/N pada pucuk dapat menginduksi pembungaan (Yamanishi dan Hasegawa, 1995).
Gambar 14 Jumlah cluster pada beberapa perlakuan ketebalan media Pada minggu ke-11, P2 berbeda nyata dengan perlakuan lainnya dan memiliki jumlah cluster tertinggi dengan 5.2 cluster. Sedangkan P1 tidak berbeda nyata dengan P3 dengan jumlah cluster 1.8 dan P3 memiliki jumlah cluster 2.1 cluster, namun perlakuan ini berbeda nyata dengan P0 dengan jumlah cluster 3.8 cluster. Pada minggu ke-12 hingga 15 MST, P3 berbeda nyata dengan perlakuan lainnya, dimana pada selang waktu tersebut P3 selalu memiliki jumlah cluster terbanyak, yakni sebesar 13.3 cluster pada minggu ke-15. Jumlah cluster terendah pada minggu ke-15 dimiliki oleh perlakuan kontrol dengan jumlah cluster sebanyak 4.3. Namun dalam rata-rata pengamatan P1 memiliki rata-rata jumlah cluster terendah dengan 3.6 cluster. (Gambar 15).
Gambar 15 Jumlah cluster pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Jumlah Bunga Total
Jumlah total bunga, sama halnya dengan jumlah bunga non cluster dan jumlah cluster, sangatlah fluktuatif. Hal ini disebabkan karena adanya bunga yang gugur di setiap minggu nya. Tabel 8 menunjukkan jumlah bunga total dari minggu ke-9 hingga 15 MST. Tabel lampiran 8 menunjukkan analisis ragam dari minggu ke-9 hingga 15 MST. Dari tabel tersebut, dapat diketahui bahwa interaksi antara kedua perlakuan (KxP) tidak berpengaruh nyata terhadap jumlah bunga total. Perlakuan ketebalan media penghambat berpengaruh nyata padda minggu ke-10, 12 dan 15 MST. Sedangkan perlakuan konsentrasi zat penghambat tumbuh berpengaruh nyata pada minggu ke-9, 10, 12, 14 dan 15 MST.
Pada minggu ke-10 semua perlakuan berbeda nyata satu sama lain. Pada minggu ke-12 K2 berbeda nyata dibandingkan perlakuan kontrol, namun tidak berbeda nyata dengan K1. Pada minggu ke-15 K2 berbeda nyata dengan perlakuan lainnya dengan jumlah bunga terbanyak, yakni sebesar 12 bunga.
Tabel 8 Jumlah bunga dari minggu ke-9 hingga 15 MST
Perlakuan Bunga total minggu ke- Rata-rata
9 10 11 12 13 14 15 Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak
berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Tanaman mulai berbunga pada minggu ke-9.
Pada minggu ke-9 K2 memiliki jumlah bunga terbanyak, yakni sebesar 2.6 bunga, K1 dan K0 secara berurutan memiliki jumlah bunga 2.5 dan 0.9. Selanjutnya dari minggu ke-10 hingga minggu ke-15 K2 selalu memiliki jumlah bunga terbanyak dibandingkandua perlakuan lainnya. Pada minggu ke-15 K2 memiliki jumlah bunga sebanyak 12 bunga, sedangkan jumlah bunga terendah dimiliki oleh perlakuan kontrol dengan 8 bunga. Begitu juga dengan rata-rata jumlah bunga, K2 menjadi perlakuan yang memiliki jumlah bunga terbanyak sebesar 9.6 bunga (Gambar 16).
Pada minggu ke-9 P2 berbeda nyata dibandingkan perlakuan lainnya, sedangkan pada minggu ke-10 semua perlakuan berbeda nyata satu sama lain, dengan P2 yang memiliki jumlah bunga terbanyak. Pada minggu ke-12 dan 14 MST perlakuan P3 berbeda nyata dengan perlakuan lainnya. Pada minggu ke-15 P0 dan P1 tidak berbeda nyata satu sama lain, namun berbeda nyata dengan P2 dan P3, sedangkan P2 tidak berbeda nyata dengan P3.
Gambar 16 Jumlah bunga pada beberapa perlakuan ketebalan media Sejak minggu ke-9 hingga 11 P2 memiliki jumlah bunga terbanyak dibandingkan perlakuan lainnya. Sedangkan P1 tidak memiliki bunga pada minggu ke-9. Pada minggu ke-12 hingga 14 P3 memiliki jumlah bunga terbanyak dibandingkan perlakuan lainnya, yakni sebesar 13.5 bunga pada minggu ke-14. Pada minggu ke-15 P2 memiliki jumlah bunga terbanyak dengan 15.1 bunga, sedangkan jumlah bunga terendah dimiliki oleh perlakuan kontrol. Begitu juga dengan rata-rata jumlah bunga P3 memiliki rata-rata jumlah bunga yang paling banyak dengan 10 bunga, sedangkan P0 memiliki rata-rata jumlah bunga yang terkecil yakni sebesar 5.7 bunga (Gambar 17).
Gambar 17 Jumlah bunga pada beberapa perlakuan konsentrasi zat penghambat tumbuh
Gambar 17 Penampakan bunga pada perlakuan K2P2 Panjang dan Bobot Akar
Perlakuan K0 memiliki nilai panjang akar terbesar dan berbeda nyata dengan perlakuan ketebalan media penghambat lainnya, yakni sebesar 23.8 cm. Sedangkan K1 dan K2 tidak berbeda nyata satu sama lain, yakni sebesar 17.3 cm dan 16.2 cm.
K2 cenderung memiliki panjang akar terkecil dibandingkan K1. Hal ini membuktikan bahwa pemberian media penghambat pada akar tanaman memiliki pengaruh yang nyata pada pertumbuhan akar.
Perlakuan P0 memiliki panjang akar terbesar dan berbeda nyata dengan perlakuan konsentrasi zat lainnya, yakni sebesar 23.7 cm. P1 memiliki panjang akar sebesar 20.3 cm berbeda nyata dengan P2 dan P3 yang hanya memiliki panjang akar sebesar 16.1 cm dan 16.3 cm. Hal ini membuktikan bahwa pemberian zat penghambat pada konsentrasi tertentu memiliki pengaruh yang nyata pada pertumbuhan akar.
0 5 10 15 20 25
9 1 0 1 1 1 2 1 3 1 4 1 5
B
u
n
g
a
Minggu
Tabel 9. Panjang dan bobot akar pada akhir penelitian
Keterangan: Angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan).
Perlakuan ketebalan media penghambat tidak berbeda nyata dalam bobot kering akar tanaman, namun K1 dan K2 cenderung memiliki bobot yang lebih kecil dibandingkan K0 yakni sebesar 1.1 gram sedangkan K0 memiliki bobot kering akar sebesar 1.2 gram. Hal ini memperlihatkan bahwa pemberian media penghambat pada akar tidak berpengaruh dalam hal bobot akar tanaman.
Perlakuan konsentrasi zat penghambat tidak berbeda nyata dalam hal bobot kering akar tanaman, P3 cenderung memiliki bobot akar yang lebih rendah dibandingkan perlakuan lainnya, yakni sebesar 0.9 gram. P1, P2 dan P3 secara berurutan memiliki bobot akar sebesar 1.4 gram, 1.2 gram dan 1.2 gram. Hal ini memperlihatkan bahwa pemberian zat penghambat pada konsentrasi tertentu cenderung memiliki efek pada bobot akar. (Tabel 9).
SIMPULAN DAN SARAN
Simpulan
Dari hasil penelitian yang telah dilakukan dapat diketahui bahwa semakin tebal lapisan media penghambat yang diberikan maka akan semakin mempercepat pembungaan, hal ini dibuktikan dengan terhambatnya pertambahan tinggi tanaman, pertambahan cabang primer, pertambahan cabang tersier, panjang dan bobot akar. Jumlah bunga non cluster, jumlah cluster dan jumlah bunga total tertinggi juga dihasilkan oleh lapisan penghambat akar yang paling tebal. Akan tetapi perlakuan ini tidak berpengaruh nyata pada pertambahan cabang sekunder dan jumlah daun.
perlakuan tinggi tanaman, jumlah bunga non cluster dan jumlah cluster, karena hasil dari pengamatan memperlihatkan bahwa tidak ada perbedaan yang nyata antara 100 ppm dan 200 ppm pada beberapa faktor tersebut.
Saran
Penanaman bugenvil di tepi jalan ataupun median jalan, disarankan menggunakan media penghambat setebal 10 cm dan diberi zat penghambat tumbuh (paclobutrazol) dengan konsentrasi 100 ppm.
Untuk membungakan bugenvil akan lebih baik dilakukan pada saat musim kemarau. Namun apabila hal ini akan dilakukan pada saat musim hujan, pemberian zat penghambat tumbuh lebih baik diberikan pada awal musim hujan.
DAFTAR PUSTAKA
Cathey, H. M. 1964. Physiology of growth. Retarding chemicals, P 272-292. In Leonard M and W. R. Briggs, (eds). Annual review of plant physiology. Vol. 15. Annual Reviews, Inc. California.
Crater, G. D. 1992. Chrysanthemum pot. In Lanrson R. A. (ed). Introduction to Floriculture Academic Pres Inc. p 2882-283.
Dicks, J.W. 1979. Mode of action of growth retardant. In Dr Clifford and J.R. Lenton (eds). Recent developments in the use of plant growth retardants. British Plant Growth Retardaants. British Plant Growth Regulator Group London. 97p.
Endah, H.J, 2002. Membuat Tanaman Hias Rajin Berbunga. Agromedia Pustaka, Jakarta.
Griffiths, M. 1986. Manual of climbers and wall plants. The new royal horticultural society dictionary. Macmillan.
Harjadi, S.S. 1989. Dasar-dasar Hortikultura Jurusan Budidaya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor.
Laccase, N. L., and M. Treshlow. 1978. Diagnosing vegetation Injury caused by air pollution. Valencia 476p.
Noggle, G. R. and G. J. fritz. 1982. Introductory plant physiology. Prentice-Hall., Inc. Englewoodd clifts, New Jersey. 627 hal.
Pandey, J. 1994. Evaluation of air pollution phytoxicity in a seasonally dry tropical urban environment. enviromental monitoring and assessment. 33(3): 195-213.
Rukmana, R., 1995, Bougenville, Kanisius, Jakarta.
Sattler, R and L. Perlin. 1982. Floral development of Bougainvillea spectabillis
Willd, Boerhavia diffusa L and Mirabilis jalapa L (Nyctaginaceae). Botanical journal of the linnean society. 84: 161-182.
Suryowinoto, S.M. 1997. Flora Eksotika, Tanaman Hias Berbunga. Kanisius. Yogyakarta.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. PAU. Institut Pertanian Bogor.
Weaver, R.J. 1972. Plant Growth Substances in Agriculture. W.H. Freeman and Co. San Fransisco. 594p.
Wianta, F.K, 1983. Tanaman Hias Ruangan, Kanisius, Jakarta.
Lampiran 1 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap tinggi tanaman pada pengamatan minggu ke-1 sampai ke-15
Lampiran 1 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap tinggi tanaman pada pengamatan minggu ke-1 sampai ke-15 (lanjutan)
Lampiran 1 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap tinggi tanaman pada pengamatan minggu ke-1 sampai ke-15 (lanjutan)
Lampiran 2 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap pertambahan cabang primer pada pengamatan minggu ke-1 sampai ke- 5
Lampiran 3 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang sekunder pada pengamatan minggu ke-1 sampai ke-7
Lampiran 3 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang sekunder pada pengamatan minggu ke-1 sampai ke-7 (lanjutan) Sumber Derajat
bebas Jumlah kuadrat
Kuadrat
tengah F-hitung Sig 6 MST
Ketebalan 2 17.56 8.78 5.30 0.01
Konsentrasi 3 42.97 14.32 8.65 0.00
Blok 2 13.56 6.78 4.09 0.03
KxP 6 25.78 4.30 2.59 0.05
Galat 22 36.44 1.66
Total 35 136.31
7 MST
Ketebalan 2 14.89 7.44 4.34 0.03
Konsentrasi 3 42.75 14.25 8.30 0.00
Blok 2 10.89 5.44 3.17 0.06
KxP 6 21.33 3.56 2.07 0.10
Galat 22 37.78 1.72
Lampiran 4 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang tersier pada pengamatan minggu ke-1 sampai ke-7
Lampiran 4 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cabang tersier pada pengamatan minggu ke-1 sampai ke-7 (lanjutan)
Sumber Derajat bebas
Jumlah kuadrat
Kuadrat
tengah F-hitung Sig 6 MST
Ketebalan 2 5.06 2.53 2.39 0.12
Konsentrasi 3 2.53 0.84 0.80 0.51
Blok 2 2.06 1.03 0.97 0.39
KxP 6 12.06 2.01 1.90 0.13
Galat 22 23.28 1.06
Total 35 44.97
7 MST
Ketebalan 2 6.89 3.44 3.86 0.04
Konsentrasi 3 3.33 1.11 1.25 0.32
Blok 2 1.72 0.86 0.97 0.40
KxP 6 11.33 1.89 2.12 0.09
Galat 22 19.61 0.89
Lampiran 5 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah daun pada pengamatan minggu ke-1 sampai ke-15
Lampiran 5 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah daun pada pengamatan minggu ke-1 sampai ke-15 (lanjutan)
Lampiran 5 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah daun pada pengamatan minggu ke-1 sampai ke-15 (lanjutan)
Lampiran 6 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga non cluster pada pengamatan minggu ke-9 sampai ke-15
Lampiran 6 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga non cluster pada pengamatan minggu ke-9 sampai ke-15 (lanjutan) Sumber Derajat
bebas
Jumlah kuadrat
Kuadrat
tengah F-hitung Sig 14 MST
Ketebalan 2 41.17 20.58 0.59 0.56
Konsentrasi 3 53.42 17.81 0.51 0.68
Blok 2 165.50 82.75 2.38 0.12
KxP 6 252.83 42.14 1.21 0.34
Galat 22 763.83 34.72
Total 35 1276.75
15 MST
Ketebalan 2 178.67 89.33 2.68 0.09
Konsentrasi 3 56.33 18.78 0.56 0.64
Blok 2 268.67 134.33 4.04 0.03
KxP 6 231.33 38.56 1.16 0.36
Galat 22 732.00 33.27
Lampiran 7 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cluster pada pengamatan minggu ke-9 sampai ke-15
Lampiran 7 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah cluster pada pengamatan minggu ke-9 sampai ke-15 (lanjutan)
Sumber Derajat bebas
Jumlah kuadrat
Kuadrat
tengah F-hitung Sig 14 MST
Ketebalan 2 146.17 73.08 3.76 0.04
Konsentrasi 3 191.86 63.95 3.29 0.04
Blok 2 13.17 6.58 0.34 0.72
KxP 6 172.06 28.68 1.48 0.23
Galat 22 427.50 19.43
Total 35 950.75
15 MST
Ketebalan 2 182.39 91.19 4.30 0.03
Konsentrasi 3 309.33 103.11 4.86 0.01
Blok 2 8.22 4.11 0.19 0.83
KxP 6 181.83 30.31 1.43 0.25
Galat 22 466.44 21.20
Lampiran 8 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga pada pengamatan minggu ke-9 sampai ke-15
Lampiran 8 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap jumlah bunga pada pengamatan minggu ke-9 sampai ke-15 (lanjutan)
Sumber Derajat bebas
Jumlah kuadrat
Kuadrat
tengah F-hitung Sig 14 MST
Ketebalan 2 71.17 35.58 1.67 0.21
Konsentrasi 3 249.86 83.29 3.91 0.02
Blok 2 21.17 10.58 0.50 0.62
KxP 6 227.72 37.95 1.78 0.15
Galat 22 468.83 21.31
Total 35 1038.75
15 MST
Ketebalan 2 120.17 60.08 3.60 0.04
Konsentrasi 3 560.89 186.96 11.20 0.00
Blok 2 31.50 15.75 0.94 0.40
KxP 6 38.28 6.38 0.38 0.88
Galat 22 367.17 16.69
Lampiran 9 Tabel uji sidik ragam pengaruh K, P, dan KxP terhadap panjang akar dan bobot akar
Sumber Derajat bebas
Jumlah kuadrat
Kuadrat
tengah F-hitung Sig Panjang akar
Ketebalan 2 409.56 204.78 8.55 0.00
Konsentrasi 3 353.47 117.82 4.92 0.01
Blok 2 126.93 63.47 2.65 0.09
KxP 6 252.72 42.12 1.76 0.15
Galat 22 526.74 23.94
Total 35 1669.41
Bobot akar
Ketebalan 2 0.15 0.07 0.23 0.80
Konsentrasi 3 1.14 0.38 1.17 0.34
Blok 2 0.24 0.12 0.37 0.70
KxP 6 0.89 0.15 0.46 0.83
Galat 22 7.13 0.32
Lampiran 10. Kualitas udara pada lokasi penelitian
No Parameter Hasil
Analisa
Baku Mutu Satuan
1 Sulfur Dioksida (SO2) 15.93 900 µg/m3
2 Nitrogen Dioksida (NO2) 1.36 400 µg/m3
3 TSP 180.31 230 µg/m3
4 Kecepatan Angin 1.52 m/detik
Keterangan : Data diambil pada 27 Juni 2015
RIWAYAT HIDUP
Penulis dilahirkan di Prabumulih, 9 Desember 1992, anak pertama dari tiga bersaudara dari pasangan Bapak Mustarrozi dan Ibu Herlin Syahrini.
Penulis menempuh pendidikan di Taman Kanak-kanak Bustanul Athfal 1 Kota Prabumulih, kemudian dilanjukan ke Sekolah Dasar negeri 6 Kota Prabumulih hingga lulus pada tahun 2004. Selanjutnya penulis meneruskan pendidikan di SMP N 1 Kota Prabumulih dan lulus pada tahun 2007, kemudian penulis melanjutkan pendidikan ke SMA N 1 Kota Prabumulih, dimana penulis sempat menjadi Ketua OSIS pada tahun 2008-2009.
Pada tahun 2010 penulis diterima sebagai salah satu mahasiswa Institut Pertanian Bogor angkatan 47, di Departemen Arsitektur Lanskap melalui jalur USMI.