KERENTANAN STRAIN IKAN NILA TERHADAP
INFEKSI
Streptococcus agalactiae
PENYEBAB PENYAKIT
STREPTOCOCCOSIS
ERRY PURWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kerentanan Strain Ikan Nila Terhadap Infeksi Streptococcus agalactiae Penyebab Penyakit Streptococcosis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2015
RINGKASAN
ERRY PURWATI. Kerentanan Strain Ikan Nila terhadap Infeksi Streptococcus agalactiae Penyebab Penyakit Streptococcosis. Dibimbing oleh SUKENDA dan DINAMELLA WAHJUNINGRUM.
Strain ikan nila (Oreochromis niloticus) unggulan hasil pemuliaan telah banyak dilepas untuk meningkatkan produksi perikanan budidaya di Indonesia. Namun ada kendala yang dihadapi yaitu kasus kematian ikan akibat penyakit Streptococcosis yang dikhawatirkan akan menjadi penghambat keberhasilan budidaya ikan nila. Penyakit ini disebabkan oleh infeksi bakteri Streptococcus agalactiae. Penanganan yang kurang baik, padat tebar yang tinggi, lingkungan pemeliharaan yang buruk, manajemen pemberian pakan yang kurang baik menyebabkan terjadinya ketidakseimbangan lingkungan dan akhirnya ketahanan tubuh ikan menjadi menurun sehingga rentan terhadap serangan penyakit.
Bakteri S. agalactiae memiliki kisaran inang (host range) yang luas dan kemampuan adaptasi lingkungan yang cukup baik. Berdasarkan potensi infeksi S. agalactiae yang cukup tinggi dan potensial inang yang besar, maka diperlukan informasi mengenai kerentanan antar strain ikan nila unggulan dan variasi respon imun antara ikan nila (cichlidae) dan ikan mas (non-cichlidae).
Pertama, melakukan uji kerentanan empat strain ikan nila terhadap infeksi S. agalactiae NK1. Strain ikan nila yang dipergunakan adalah ikan Nila Srikandi, ikan Nila Nirwana, ikan Nila BEST dan ikan Nila Sultana. Keempat strain nila diinfeksi dengan S. agalactiae NK1 pada dosis kepadatan bakteri 103, 104, 105, 106 CFU/ekor dan satu kontrol yang diinjeksi dengan PBS, masing-masing 2 kali ulangan. Nilai LD50 yang diperoleh berkisar antara 103,20-103,45 CFU/ekor .
Kedua, melakukan analisis parameter imunologis strain ikan nila dan ikan mas terhadap infeksi S. agalactiae NK1. Dipergunakan ikan Nila Srikandi yang memiliki nilai LD50 tertinggi dan ikan mas yang mewakili kelompok
SUMMARY
ERRY PURWATI. Susceptibility of tilapia strains against Streptococcus agalactiae infection causing Streptococcosis. Supervised by SUKENDA and DINAMELLA WAHJUNINGRUM.
The featured strains of tilapia from selective breeding have been released to enhance aquaculture production in Indonesia. On the other hand, there is a problem about mortality cases caused by Streptococcosis disease which suspected would be the success of tilapia culture obstacle. This disease is caused by Streptococcus agalactiae infection. The stressful handling, high culture density, poor environment, poor feeding management cause the occurrence environmental imbalance and then the fish immunity will decrease, so that it will susceptible to disease outbreaks.
S. agalactiae has wide host range and good environmental adaptation. Based on the high infection potency of S. agalactiae and wide host potential, then the necessary information about the susceptibility of tilapia strains and the variation of immune responses between tilapia (cichlidae) and common carp (non-cichlidae) against S. agalactiae is need to be studied.
The first, there was susceptibility test of four strains of tilapia to S. agalactiae NK1 infection. The strains of tilapia used in this study were tilapia Srikandi, Nirwana, BEST and Sultana. These four tilapia strains were infected by S. agalactiae NK1 at a dose of 103, 104, 105, 106 CFU/fish and a control which injected by PBS, each treatment got two replication. The LD50 value ranged from
103,20-103,45 CFU/fish.
The second, immunological parameters analysis between the tilapian strain and carp to S. agalactiae NK1 infection. This study used tilapia Srikandi which has the highest LD50 valueand dan common carp which represented non-cichlidae
group (as the control). The fish were infected by S. agalactiae NK1 used dose of 103 CFU/fish. The results of this study showed that tilapia showed the changes of swimming pattern (idle in the bottom, swim in irregular ways and whirling), the macroscopic anatomy changes (pigmentation, exophthalmia, purulens, clear operculum, hemorrhage at the base of fin), and tilapia also faced loss of appetite. The survival rate of tilapia Srikandi was 50% and common carp was 100% during 15 days of rearing period. The common carp did not show the swimming pattern, and anatomy changes. The fastest mortality occurred in tilapia Srikandi that was 96 hours post-infection. Lysozyme activity showed significant differences between tilapia Srikandi and carp. Based on the histopathological slides observation noted that tilapia brain which infected by S. agalactiae showed meningoencephalitis, while in the common carp just showed meningitis. Streptococcus agalactiae is a specific pathogen in tilapia, it was proven with the survival rate of common carp that reached 100%.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
KERENTANAN STRAIN IKAN NILA TERHADAP
INFEKSI
Streptococcus agalactiae
PENYEBAB PENYAKIT
STREPTOCOCCOSIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari – Juni 2014 ini ialah Penyakit Streptococcosis, dengan judul Kerentanan Strain Ikan Nila Terhadap Infeksi Streptococcus agalactiae Penyebab Penyakit Streptococcosis.
Terima kasih penulis ucapkan kepada Dr Ir Sukenda, MSc dan Dr Dinamella Wahjuningrum, SSi MSi selaku pembimbing atas waktu dan bimbingannya.
Terima kasih penulis sampaikan kepada Dr Munti Yuhana, SPi MSi selaku dosen penguji luar komisi pembimbing dan Dr Ir Widanarni, MSi atas saran dan masukan untuk perbaikan tesis ini.
Terima kasih penulis sampaikan kepada Kepala Badan Pengembangan Sumberdaya Manusia Kementerian Kelautan dan Perikanan, Kepala Badan Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan, Kepala Pusat Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan, serta Kepala Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas II Cirebon atas izin tugas belajar dan beasiswa yang telah diberikan.
Penghargaan penulis sampaikan kepada Bapak Ranta dari Laboratorium Kesehatan Ikan Budidaya Perairan IPB, Ibu Sellyn dari Laboratorium Penyakit Hewan Fakultas Kedokteran Hewan, keluarga besar Pasca AKU 2012, rekan-rekan di Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas II Cirebon, rekan-rekan di Balai Besar Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas II Tanjung Emas Semarang, Kenidas Lukman Taufik dan keluarga, serta semua pihak yang telah membantu selama pelaksanaan penelitian.
Ungkapan terima kasih juga disampaikan kepada suami tercinta Fauzan Bahri, ananda Muhammad Haidar Bahri, ananda Muhammad Zaydan Bahri, ananda Almira Athiyya Bahri, ayah Samsiono, ibu Subariningrum, ibu Rubiah, bibi Samiah serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2015
DAFTAR ISI
Nile tilapia (Oreochromis niloticus) 3
Penyakit streptococcosis 3
Bakteri Streptococcus agalactiae 4
Imunologi ikan 4
3 METODE 5
Materi Uji 5
Prosedur penelitian 6
Tahap pertama : uji kerentanan empat strain ikan nila terhadap
infeksi S. agalactiae NK1 6
Tahap kedua : analisis parameter imunologis strain ikan nila (cichlidae) dan ikan mas (non-cichlidae) terhadap infeksi
S. agalactiae NK1 7
Parameter yang diamati 8
Perubahan pola berenang 8
Perubahan anatomi organ 8
Sintasan 8
Parameter kualitas air 10
Analisis data 11
4 HASIL DAN PEMBAHASAN 11
Hasil 11
Uji Konfirmasi Bakteri 11
Uji kerentanan empat strain ikan nila terhadap infeksi
S. agalactiae NK1 12
Analisis parameter imunologis strain ikan Nila Srikandi (cichlidae) dan ikan mas (non-cichlidae) terhadap infeksi
S. agalactiae NK1 13
Perubahan pola renang 13
Perubahan anatomi organ secara makroskopis 15
Sintasan 16
Kematian kumulatif 16
Parameter hematologi 17
Kadar hematokrit 17
Kadar hemoglobin 17
Total leukosit 18
Aktifitas fagositik 18
Respiratory Burst 19
Aktifitas lisozim 20
Histopatologi organ otak 20
Parameter kualitas air 22
Pembahasan 22
5 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 31
DAFTAR TABEL
1 Hasil pengujian Postulat Koch 12
2 Hasil pengujian LD50 terhadap empat strain ikan nila 13
3 Perubahan pola renang 14
4 Perubahan anatomi organ luar 15
5 Data kualitas air media pemeliharaan 22
DAFTAR GAMBAR
1 Perubahan pola renang yang terjadi: (A) ikan berenang lemah di permukaan air/gasping, (B) ikan berenang berulang, berputar dan tidak
beraturan/whirling 14
2 Perubahan patologi anatomi yang terjadi pada permukaan organ luar secara makroskopis: (A) pendarahan pada pangkal sirip, mata keruh; (B) clear operkulum, (C) bentuk tubuh seperti huruf “C”, dan (D) mata
terlepas pasca mengalami eksoptalmi 15
3 Sintasan pada ikan Nila Srikandi (A) dan ikan mas (B) setelah diinfeksi
dengan S. agalactiae NK1 16
4 Kematian kumulatif pada ikan Nila Srikandi ( ) dan ikan mas ( )
setelah diinfeksi dengan S. agalactiae NK1 16
5 Persentase hematokrit darah pada ikan Nila Srikandi (A) dan ikan mas (B) setelah diinfeksi dengan S. agalactiae NK1 17 6 Persentase hemoglobin darah pada ikan Nila Srikandi (A) dan ikan mas
(B) setelah diinfeksi dengan S. agalactiae NK1 18 7 Total leukosit darah pada ikan Nila Srikandi (A) dan ikan mas (B)
setelah diinfeksi dengan S. agalactiae NK1 18
8 Aktifitas fagositik pada ikan Nila Srikandi (A) dan ikan mas (B) setelah
diinfeksi dengan S. agalactiae NK1 19
9 Respiratory Burst pada ikan Nila Srikandi (A) dan ikan mas (B) setelah
diinfeksi dengan S. agalactiae NK1 19
10 Aktifitas lisozim pada ikan Nila Srikandi (A) dan ikan mas (B) setelah
diinfeksi dengan S. agalactiae NK1 20
11 Histopatologi organ otak ikan Nila Srikandi setelah diinfeksi dengan S.
agalactiae NK1 21
12 Histopatologi organ otak ikan mas setelah diinfeksi dengan S.
DAFTAR LAMPIRAN
1 Hasil pengujian isolat bakteri S. agalactiae NK1 dengan metode SNI
7545.3 : 2009 32
2 Metode Polymerase Chain Reaction (PCR) untuk pengujian isolat
bakteri S. agalactiae NK1 33
3 Pembuatan preparat histopatologi 35
4 Hasil pengujian isolat bakteri S. agalactiae NK1 dengan kit API 20
STREP 36
5 Hasil konfirmasi awal isolat S. agalactiae NK1 dengan metode PCR 37 6 Hasil konfirmasi akhir isolat S. agalactiae NK1 dengan metode PCR 38 7 Perhitungan LD50 dengan metode Reed & Muench (1938) 39
1
PENDAHULUAN
Latar Belakang
Berbagai strain ikan nila (Oreochromis niloticus) hasil pemuliaan telah dilepas di Indonesia dalam rangka lebih memperkaya jenis dan varietas ikan nila yang beredar di masyarakat guna menunjang peningkatan produksi perikanan budidaya dan pendapatan serta kesejahteraan pembudidaya ikan. Beberapa diantaranya adalah ikan Nila Nirwana (nila ras Wanayasa), Nila BEST (Bogor Enhanched Strain Tilapia), Nila Srikandi (salinity resistent improvement from Sukamandi) dan Nila Sultana (seleksi unggul Selabintana). Namun upaya peningkatan produksi ikan nila tersebut masih belum optimal karena adanya penyakit yang belum dapat diatasi dengan baik. Bakteri patogen Streptococcus agalactiae menyebabkan penyakit Streptococcosis pada ikan Nila (Hernandez et al. 2009).
Streptococcus agalactiae merupakan bakteri gram positif yang menjadi patogen utama pada budidaya ikan nila di Indonesia. Menurut Sheehan et al. (2009) S. agalactiae yang menyebabkan Streptococcosis pada budidaya ikan nila terdiri dari dua macam yaitu tipe β-hemolitik dan tipe non hemolitik. Kedua tipe bakteri ini secara umum menunjukkan gejala klinis yang sama yaitu abnormalitas pada mata (eksoptalmia dan kekeruhan mata), kehilangan keseimbangan saat berenang (whirling disease), bentuk badan seperti huruf “C”, nafsu makan menurun, warna tubuh menjadi lebih gelap, timbulnya bercak merah, asites dan pada kondisi akut dapat menyebabkan ikan kehilangan cairan pada saluran pencernaan serta tidak berfungsinya sebagian organ (Hardi, 2011).
Sebagai bakteri yang patogen, S. agalactiae memiliki faktor virulensi untuk menginfeksi inang. Salah satu faktor virulensinya adalah kandungan toksin yang merupakan hasil metabolisme atau disebut juga extracellular product (ECP). Sebagai eksotoksin ECP bersifat imunogenik dengan target biokimia dari toksin tersebut terletak pada proses intraseluler, komponen membran atau neurotransmitter. Eksotoksin biasanya disekresikan oleh bakteri hidup selama fase pertumbuhan eksponensial. Umumnya, strain bakteri yang patogen menghasilkan toksin yang virulen. Pada penelitiannya, Dwinanti (2011) menyatakan bahwa ECP bakteri S. agalactiae bersifat toksik pada ikan nila dengan nilai LD50 untuk isolat
3 adalah 633,9 µg/Kg dan isolat 5 adalah 685,4 µg/Kg. Gejala klinis yang ditimbulkan akibat infeksi ECP pada ikan nila hampir sama dengan gejala klinis yang ditimbulkan akibat infeksi langsung dari bakteri. Kelainan organ mata, kehilangan keseimbangan berenang dan penurunan nafsu makan terjadi setelah injeksi yang dilakukan secara intraperitoneal pada ikan nila.
Dinyatakan oleh Evans et al. (2006) bahwa lebih dari 50 spesies pada 29 famili ikan air tawar, payau dan air laut yang dilaporkan rentan terhadap S. agalactiae maupun S. iniae, hal ini mengindikasikan luasnya kisaran inang (host range) dan adaptasi lingkungan dari organisme ini. Pada ikan air tawar, famili ikan yang terserang antara lain Cichlidae, Centrarchidae, Cyprinidae, Moronidae, Mugilidae, Plecoglossidae, Salmonidae, Terapontidae dan Ictaluridae.
2
air tawar dan ikan air laut. Penyakit ini dapat timbul antara lain karena lingkungan pemeliharaan yang buruk, manajemen pemberian pakan yang kurang baik sehingga terjadi ketidakseimbangan lingkungan dan akhirnya ketahanan tubuh ikan menjadi menurun sehingga rentan terhadap serangan penyakit.
Pada perairan umum misalnya waduk, sistem budidaya dilakukan secara polikultur dan sesuai dengan trophic level misalnya ikan mas dengan ikan nila. Potensi penyebaran penyakit maupun transmisi penyakit pada polikultur menjadi sangat tinggi. Hal ini dibuktikan dengan hasil identifikasi pada kegiatan pemantauan Hama Penyakit Ikan Karantina bahwa telah terdeteksi adanya ikan mas (Cyprinus carpio) yang terinfeksi S. agalactiae di waduk Saguling. Selain itu teridentifikasi juga adanya S. agalactiae yang menginfeksi ikan koi (Cyprinus carpio) di Semarang (BKIPM, 2013).
Berdasarkan potensi infeksi S. agalactiae yang sangat tinggi dan potensial inang yang cukup besar, maka diperlukan informasi mengenai kerentanan antar strain ikan nila unggulan dan variasi respon imun antara ikan nila (cichlidae) dan ikan mas (non-cichlidae). Sehingga informasi tersebut dapat digunakan dalam upaya pengembangan strain ikan nila untuk budidaya.
Perumusan Masalah
Strain ikan nila unggulan telah banyak dikembangkan di Indonesia, namun masih ada kendala yang dihadapi berupa ancaman penyakit Streptococcosis yang menimbulkan kematian dan kerugian yang sangat besar. Adanya indikasi luasnya kisaran inang penyakit ini dapat berpengaruh terhadap budidaya yang dilakukan secara polikultur di Indonesia. Sehingga perlu dikaji mengenai kerentanan strain ikan nila dan ikan mas (non-cichlidae/non-tilapia) terhadap penyakit Streptococcosis.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menganalisis kerentanan strain ikan nila terhadap infeksi Streptococcus agalactiae, mengetahui variasi respon imun antara strain ikan nila (cichlidae) dan dibandingkan dengan ikan mas (non-cichlidae) terhadap infeksi Streptococcus agalactiae
Manfaat Penelitian
3
2
TINJAUAN PUSTAKA
Nile tilapia (Oreochromis niloticus)
Tilapia merupakan ikan air tawar yang termasuk kedalam famili Cichlidae, berasal dari Afrika dan Timur Tengah (Trewaves 1983). Ikan nila memiliki tubuh yang pipih ke arah vertikal (compress). Posisi mulutnya terletak diujung hidung (terminal) dan dapat disembulkan.
Nile tilapia merupakan salah satu spesies ikan yang pertama dibudidayakan di dunia (Amal dan Zamri-Saad 2011). Tilapia memiliki karakteristik yang baik untuk budidaya dan telah didomestikasi sehingga ikan ini mendapat julukan
“aquatic chicken”. Tilapia memiliki pertumbuhan yang cepat, daging berwarna
putih, mampu bertahan hidup pada kondisi perairan yang kurang baik, memiliki kisaran luas pada tipe makanannya, dan mudah berkembang biak tanpa membutuhkan teknologi pembenihan khusus. Lingkungan ekologis ikan nila merupakan bentopelagik yang hidup di perairan tawar maupun perairan payau. Di daerah tropis ikan tilapia tahan pada temperatur 8-42 C.
Pada awalnya ikan nila dianggap lebih tahan terhadap infeksi penyakit bakteri, parasit, jamur dan virus dibanding spesies ikan budidaya lainnya. Namun saat ini tilapia dinyatakan rentan terhadap infeksi bakteri dan parasit. Patogen yang umum menyerang ikan nila diantaranya adalah Streptococcus sp., Flavobacterium columnare, Aeromonas hydrophila, Edwardsiella tarda, Ichthyopthirius multifiliis, Trichodina sp., dan Gyrodactylus niloticus (Klesius et al. 2008). Merupakan suatu catatan yang penting bahwa infeksi streptococcal telah menjadi masalah utama pada budidaya ikan nila dan berkontribusi terhadap kerugian ekonomi yang hebat (Shoemaker dan Klesius, 1997)
Penyakit Streptococcosis
Streptococcosis telah diakui sebagai salah satu penyakit bakterial yang sangat penting pada budidaya tilapia. Dua spesies Streptococcus, Streptococcus agalactiae dan Streptococcus iniae secara umum dianggap sebagai agen terpenting penyakit Streptococcus pada tilapia. Menurut Evans et al. (2006) ikan yang terinfeksi S. agalactiae menunjukkan tingkah laku yang abnormal seperti berenang berputar maupun berenang tak tentu arah, berenang menggantung dengan kepala diatas atau ekor diatas. Infeksi Streptococcal ditandai dengan bentuk tubuh yang melengkung menyerupai huruf “C”. Kelainan yang terjadi pada mata antara lain pendarahan pada peri-orbital dan intraocular, kekeruhan dan eksoptalmi pada infeksi kronis.
4
Bakteri Streptococcus agalactiae
Streptococcus agalactiae merupakan bakteri gram positif, katalase negatif, berbentuk kokus yang berpasangan maupun berantai. Bersifat non-motil, peka terhadap vancomycin, bereaksi negatif pada media VP (Voges-Proskauer), memproduksi asam pada sorbitol, tumbuh pada media cair yang mangandung NaCl 6,5% (namun beberapa strain menunjukkan pertumbuhan yang lambat). S. agalactiae ada yang bersifat hemolitik dan non hemolitik (Sheehan et al. 2009). Sedangkan dalam SNI 7545.3:2009 disebutkan bahwa karakteristik bakteri S.
agalactiae yaitu motilitas negatif, oksidatif-fermentatif positif, katalase negatif,
mampu tumbuh dalam media bile salt 40% dan NaCl 6.5%. Streptococcus agalactiae
tidak mampu menghidrolisis esculin dan D-mannitol sedangkan S. iniae mampu menghidrolisis gula-gula tersebut.
Imunologi Ikan
Sistem imun dibagi menjadi dua yaitu sistem imun bawaan (non-spesifik) dan sistem imun adaptif (spesifik). Namun semakin banyak bukti, dari imunologi ikan maupun mamalia yang menyatakan bahwa imunologi merupakan sistem kombinasi. Respon imun bawaan umumnya mendahului respon imun adaptif, mengaktifkan dan menentukan sistem imun adaptif dan bersama-sama mempertahankan homeostasis (Magnadottir 2005). Komponen penyusun sistem imun non-spesifik umumnya terbagi menjadi parameter fisik (sisik, mukus pada permukaan kulit dan insang, jaringan epidermis), seluler (sel-sel fagosit (granulosit (neutrofil) dan monosit/makrofag; sel-sel sitotoksik non-spesifik), faktor humoral (transferin, interferon, lisozim). Parameter imun bawaan/non-spesifik seperti fagositik, lisozim dan aktifitas hemolitik spontan, telah digunakan sebagai indikator pengaruh yang melekat maupun faktor eksternal pada sistem imun dan resistensi ikan terhadap penyakit. Sistem imun non-spesifik didukung oleh dua komponen utama yaitu respon seluler dan respon humoral (Irianto 2005). Respon selular imun non-spesifik meliputi beberapa tipe mekanisme: inflamasi, fagositosis, fagositosis sebagai penyaji antigen (antigen presenting cells) dan non specific citotoxic cells. Inflamasi merupakan upaya proteksi reaksi restoratif dari tubuh sejak ikan berusaha menjaga kondisi kestabilan sistem dari pengaruh lingkungan yang kurang baik (Tizard 1988). Inflamasi ditandai dengan rasa sakit, pembengkakan, kulit memerah atau peradangan, suhu tubuh naik atau kehilangan fungsi-fungsi fisiologis. Hal tersebut merupakan respon protektif awal tubuh dalam upaya menghalangi patogen dan menghancurkannya (Irianto 2005). Susunan darah ikan merupakan faktor diagnostik penting, sehingga perubahan gambaran darah banyak digunakan untuk menilai status kesehatan ikan (Amrullah 2004).
5 sebuah potensi aktivitas bakteriosidal atau bakteriolitik tinggi terhadap bakteri gram-positif dan gram-negatif.
Fagositosis merupakan pertahanan pertama dari respon selular yang dilakukan oleh monosit (makrofag) dan granulosit (netrofil). Proses fagositosis meliputi tahap kemotaksis, tahap pelekatan, tahap penelanan dan tahap pencernaan. Tahap kemotaksis yaitu pergerakan sel fagosit yang terarah dibawah pengaruh rangsangan kimiawi eksternal (berbagai produk patogen yang menginfeksi ataupun sel yang rusak akibat infeksi patogen) (Tizard 1988).
3
METODE
Penelitian ini dilaksanakan pada bulan Januari - Juni 2014 di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan-Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Laboratorium Penyakit Hewan-Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Materi Uji
Ikan uji yang dipergunakan adalah ikan nila (Oreochromis niloticus) yang terdiri dari 4 (empat) strain nila yaitu ikan Nila Nirwana (nila ras Wanayasa) (KEP. 45/MEN/2006, tanggal 4 Desember 2006), ikan Nila BEST (Bogor Enhanched Strain Tilapia) (KEP. 77/MEN/2009, tanggal 23 Oktober 2009), ikan Nila Srikandi (salinity resistent improvement from Sukamandi) (KEP.09/MEN/2012, tanggal 1 Mei 2012 dan ikan Nila Sultana (seleksi unggul Selabintana) (KEP. 28/MEN/2012, tanggal 7 Juni 2012) serta ikan mas (Cyprinus carpio) dengan ukuran 14,97±0,816 gr/ekor. Sampel ikan Nila Nirwana dan ikan
Nila Srikandi diperoleh dari Loka Riset Pemuliaan dan Teknologi Budidaya Perikanan Air Tawar-Sukamandi; ikan Nila Sultana dan ikan mas dari Balai Besar Pengembangan Budidaya Air Tawar-Sukabumi, sedangkan ikan Nila BEST diperoleh dari Balai Riset Perikanan Air Tawar-Bogor. Sebelum dilakukan pengujian, ikan diaklimatisasi terlebih dahulu selama 14 hari. Ikan uji yang dipergunakan adalah ikan yang dalam masa karantina tidak menunjukkan gejala terinfeksi Streptococcosis (seperti warna tubuh yang menghitam, eksoptalmi, keruh pada mata dan ikan berenang berputar/whirling) berdasarkan diagnosa dan pengujian mikrobiologi berdasarkan SNI 7545.3:2009. Pengujian dilakukan terhadap sampel organ ginjal dan otak (Lampiran 1).
Ikan dipelihara dalam akuarium berukuran 60x40x30 cm3 dengan suhu air berkisar pada 29±2°C. Ikan diberi makan dua kali sehari secara at satiation menggunakan pakan komersial dengan kandungan protein kasar 35%. Pergantian air dilakukan dua hari sekali sebanyak 50% untuk membuang sisa pakan dan sisa metabolisme tubuh.
6
bakteri yang dipergunakan dengan menggunakan kit API 20 STREP, kemudian diperkuat dengan uji konfirmasi menggunakan metode Polymerase Chain Reaction (PCR) yang dilakukan pada awal dan akhir penelitian (Lampiran 2).
Persiapan isolat stok S. agalactiae untuk meningkatkan virulensinya diawali dengan pasase (menyegarkan kultur) dengan cara menggoreskan isolat pada media agar Brain Heart Infusion Agar/ BHIA (Merck) sebanyak 2 kali. Kemudian disiapkan inokulum bakteri dengan cara mengkultur bakteri S. agalactiae kedalam media cair Brain Heart Infusion Broth/ BHIB (Merck). Satu ose penuh biakan bakteri dari media agar lalu dikultur dalam 10 ml medium BHIB, diinkubasi dalam inkubator bergoyang (waterbath shaker) pada 140 rpm, suhu 29-30°C selama 24 jam. Kemudian setelah 24 jam, diambil 1 ml biakan media yang telah dikultur dan dimasukkan kedalam 9 ml medium BHIB. Dilakukan inkubasi pada inkubator bergoyang (waterbath shaker) pada 140 rpm, suhu 29-30°C selama 24 jam. Setelah itu bakteri siap untuk dipergunakan.
Pengujian Postulat Koch dilakukan untuk memperoleh bakteri S. agalactiae NK1 yang paling patogen terhadap ikan uji sehingga siap digunakan untuk uji tantang. Ikan nila yang dipergunakan pada uji Postulat Koch adalah ikan Nila BEST. Ikan nila dimasukkan kedalam dua akuarium, yaitu akuarium pertama untuk ikan nila yang diinjeksi dengan bakteri NK1 dan akuarium kedua digunakan untuk ikan nila kontrol (diinjeksi dengan PBS steril) dengan padat tebar ikan uji 5 ekor per akuarium. Ikan diamati setiap hari sampai menunjukkan gejala klinis dan kematian. Kemudian ikan diambil untuk diisolasi bakterinya dari organ ginjal, mata dan otak. Bakteri diinokulasi dengan metode penggoresan (streak method) pada media Brain Heart Infusion Agar/ BHIA. Koloni yang tumbuh lalu diamati morfologi koloni, karakteristik biokimia dan sifat gram, untuk memastikan bakteri tersebut adalah spesies bakteri patogen yang diinfeksikan pada Postulat Koch. Kemudian bakteri tersebut digores diatas agar miring dan dilakukan kultur cair (seperti yang dilakukan diatas) untuk Postulat Koch kembali yang dilakukan sebanyak 3 kali. Pengulangan ini bertujuan agar diperoleh bakteri yang paling patogen bagi ikan nila.
Prosedur Penelitian
Penelitian ini dilaksanakan dalam dua tahap yaitu tahap pertama yaitu uji kerentanan empat strain ikan nila terhadap infeksi S. agalactiae NK1; dan tahap kedua yaitu analisis parameter imunologis strain ikan nila dan ikan mas (sebagai pembanding/ kontrol) terhadap infeksi S. agalactiae.
Tahap Pertama : Uji kerentanan empat strain ikan nila terhadap infeksi
S. agalactiae NK1
Pengujian kerentanan strain ikan nila terhadap infeksi S. agalactiae dilakukan dengan pengujian LD50, untuk mengetahui dosis maksimum yang dapat
7 kontrol yang diinjeksi dengan PBS, masing-masing 2 kali ulangan. Setiap perlakuan terdiri dari 10 ekor ikan, yang masing-masing diinjeksi sebanyak 0,1 ml suspensi bakteri per ekor ikan melalui intra peritoneal. Kemudian ikan dipelihara selama 15 hari dan diberi makan secara at satiation. Pergantian air dilakukan setiap dua hari sekali sebanyak 50% sedangkan penyiponan dilakukan setiap hari sebanyak 10% untuk membuang feses dan sisa makanan yang mengendap di dasar akuarium. Suhu air selama perlakuan dipertahankan pada kisaran 29±2 C.
Pada pengujian tahap pertama ini, parameter yang diamati adalah mortalitas dan LD50. Mortalitas dicatat dan dihitung menggunakan rumus sebagai berikut :
Sedangkan penentuan LD50 dilakukan dengan menggunakan metode Reed &
Muench (1938) :
Keterangan :
A = Kematian diatas 50% B = Kematian dibawah 50%
Log negatif LD50 = Log negatif konsentrasi diatas 50% + selang proporsi
Tahap kedua : Analisis parameter imunologis strain ikan nila (cichlidae) dan ikan mas (non-cichlidae) terhadap infeksi S. agalactiae
NK1
Analisis imunologis ini dilakukan untuk melihat respon imun pada ikan nila (cichlidae) dan imun ikan mas (non-cichlidae)-sebagai pembanding/ kontrol, terhadap infeksi S. agalactiae NK1. Infeksi dilakukan setelah diperoleh dosis LD50 pada pengujian tahap pertama. Pengujian infeksi ini bertujuan untuk
mengamati respon imun dan perubahan patologis pada organ otak ikan nila serta ikan mas.
Disiapkan masing-masing sebanyak 10 ekor ikan dari strain nila yang memiliki nilai LD50 tertinggi dan ikan mas (non-cichlidae). Setiap ekor ikan
disuntik dengan 0,1 ml suspensi bakteri S. agalactiae NK1 dengan dosis sesuai dengan dosis LD50 tertinggi. Setelah bakteri diinjeksikan kedalam tubuh ikan
8
Parameter yang Diamati
Perubahan pola berenang
Perubahan pola berenang yang diamati mengacu kepada Hardi (2011) yaitu berupa: perubahan gerakan pada kolom air (berenang di permukaan, melayang atau di dasar akuarium), perpindahan badan (lemah atau agresif), dan cara berenang (berulang, berputar dan tidak beraturan). Pengamatan dilakukan terhadap populasi ikan dalam setiap akuarium yang berjumlah 10 ekor selama 5 menit.
Perubahan anatomi organ
Perubahan yang diamati yaitu pada kondisi mata (kekeruhan dan eksoptalmi), warna tubuh (ada tidaknya pigmentasi), pendarahan, dan perubahan warna pada operkulum.
Sintasan
Sintasan atau survival rate (SR) ikan dapat diketahui dari jumlah ikan pada akhir perlakuan dibagi dengan jumlah ikan awal dan dapat dirumuskan sebagai berikut :
Keterangan :
SR : sintasan (%)
Nt : Jumlah ikan pada akhir pemeliharaan (ekor) No : Jumlah ikan pada awal pemeliharaan (ekor)
Parameter Hematologi
Kadar Hematokrit
9 Kadar Hemoglobin
Kadar hemoglobin diukur menurut metode Sahli (Wedenmeyer dan Yasutake, 1977) yaitu dengan menggunakan Sahlinometer. Kadar hemoglobin dinyatakan dalam g % yang berarti banyaknya hemoglobin dalam gram per 100 ml darah. Hemoglobin merupakan metaloprotein (Protein yang mengandung zat besi) didalam sel darah merah yang berfungsi sebagai pengangkut oksigen.
Total Leukosit
Perhitungan total leukosit dilakukan berdasarkan metode Blaxhall dan Daisley (1973) dengan cara sampel darah dihisap dengan menggunakan pipet khusus pengukuran leukosit berskala sampai batas 0,5. Selanjutnya darah tersebut dicampur dengan larutan Turk’s sampai skala 11. Campuran tersebut dihomogenkan selama kurang lebih 3 menit. Tetesan pertama yang ada di pipet dibuang terlebih dahulu, berikutnya diteteskan kedalam hemasitometer dan ditutup dengan kaca penutup. Perhitungan jumlah leukosit dilakukan pada 5 kotak besar hemasitometer.
Jumlah leukosit = jumlah sel leukosit terhitung x 50 sel/mm3
Aktifitas Fagositik
Perhitungan aktifitas fagositik mengacu kepada metode Anderson dan Siwicki (1995). Sampel darah diambil sebanyak 50 µl lalu diasukkan kedalam microplate dan ditambahkan 50 µl bakteri Staphylococcus aureus 107 CFU/ml. Sebelumnya dilakukan pencucian bakteri dari media sebanyak satu kali. Kemudian diinkubasi selama 20 menit dalam inkubator suhu ruang. Kemudian sebanyak 10 µl campuran tersebut dibuat preparat ulas dan dikeringanginkan. Selanjutnya difiksasi dan direndam dalam larutan giemsa selama 15 menit, lalu dibilas dengan air mengalir dan dikeringanginkan. Pengamatan aktifitas fagositik dilakukan dibawah mikroskop dengan perbesaran 400x. Aktifitas fagositik dihitung menggunakan rumus :
Aktifitas fagositik =
Respiratory Burst
10
dikeringanginkan. Setelah itu ditambahkan 60 µl 2N pottasium hydroxide dan 70 µl dimethyl sulphoxide kedalam masing-masing sumuran. Pembacaan Optical Density (OD) dilakukan dengan alat Microplate Reader (Benchmark, BIO-RAD) pada panjang gelombang 540 nm.
Aktifitas Lisozim
Pengukuran lisozim dilakukan dengan metode Ellis (1990) yang dimodifikasi oleh Sahoo et al. (2005). Plasma sebanyak 10 µl ditambahkan suspensi cair Micrococcus lysodeicticus (Sigma) sebanyak 190 µl (0,2 mg/ml dalam 0,05 M NaH2PO4 pada 25°C). Kemudian dilakukan dua kali pembacaan
adsorpsi pada panjang gelombang 540 nm di spektrofotometer setelah 30 detik pencampuran dan 30 menit pencampuran. Secara matematis aktifitas lisozim dapat dirumuskan sebagai berikut :
Aktifitas lisozim (UI/ml/menit) = [(OD30s - OD30m) x1000] x(1/(t x p))
Keterangan :
1000 = Konversi hasil absorbansi (OD) menjadi unit internasional (UI) t = waktu (menit)
p = jumlah plasma (ml)
OD 30s = pembacaan densitas optikal detik ke – 30
OD 30m = pembacaan densitas optikal menit ke – 30
Histopatologi
Perubahan histopatologi organ internal yang diamati yaitu pada hepatopankreas, ginjal dan otak. Pengambilan ikan untuk pengamatan dilakukan secara acak dan diutamakan ikan yang akan mati atau memperlihatkan gejala klinis sakit. Setelah dinekropsi, otak ikan dimasukkan kedalam larutan Neutral Buffer Formalin (BNF) 10%. Setelah difiksasi kemudian dibuat preparat histopatologi dan diwarnai dengan Hematoksilin-Eosin. Setelah itu dilakukan pengamatan preparat dibawah mikroskop dengan perbesaran 200-400 kali. Metode selengkapnya diuraikan pada Lampiran 3.
Parameter Kualitas Air
11 Analisis Data
Analisis untuk data sintasan, parameter hematologi (kadar hematokrit, kadar hemoglobin, total leukosit), Respiratory Burst, aktifitas lisozim dan aktifitas fagositosis dilakukan dengan analisis varian (ANOVA), jika ditemukan berbeda nyata (p<0,05) maka dilakukan uji lanjut Duncan dengan menggunakan SPSS 17. Perubahan histopatologi dianalisis secara deskriptif.
4
HASIL DAN PEMBAHASAN
HASIL
Uji Konfirmasi Bakteri
Isolat bakteri yang dipergunakan pada penelitian ini dilakukan uji konfirmasi terlebih dahulu untuk memastikan kebenaran isolat yang dipergunakan. Berdasarkan pengujian dengan menggunakan kit API 20 STREP, diketahui bahwa karakteristik yang dimiliki oleh isolat NK1 ini teridentifikasi 99,3% sebagai Streptococcus agalactiae (Lampiran 4). Isolat ini juga bersifat non-hemolitik berdasarkan pengujian hemolisis menggunakan media agar darah/ blood agar. Pengujian aktifitas hemolitik bertujuan untuk mengetahui kemampuan bakteri melisis eritrosit yang diwakili oleh darah domba. Hasil ini sesuai dengan penelitian yang dilakukan oleh Hardi (2011) bahwa isolat 5 atau S. agalactiae NK1 bersifat non-hemolitik. Hasil uji konfirmasi ini juga diperkuat dengan pengujian menggunakan metode PCR pada awal serta akhir penelitian, dan diperoleh hasil positif Streptococcus agalactiae (Lampiran 5 dan 6).
Pengujian Postulat Koch
12
Tabel 1 Hasil pengujian Postulat Koch
Hari ke- Ulangan-1 Ulangan-2 Ulangan-3
1 Ikan tampak normal Ikan tampak normal Ikan berdiam di dasar
akuarium
2 Garis vertikal tubuh
gelap
Garis vertikal tubuh gelap Garis vertikal tubuh gelap
3 Garis vertikal tubuh
gelap, sirip punggung
4 Garis vertikal tubuh
gelap, sirip punggung
5 Garis vertikal tubuh
gelap, sirip gripis
6 Garis vertikal tubuh
gelap, sirip gripis
7 Garis vertikal tubuh
gelap, sirip gripis,
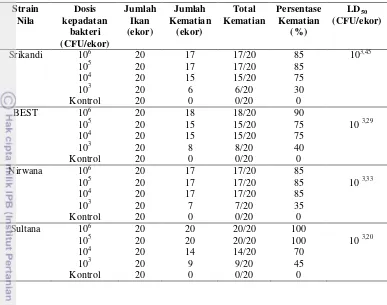
Uji kerentanan empat strain ikan nila terhadap infeksi S. agalactiae NK1 Pengujian kerentanan dilakukan untuk mengetahui tingkat kerentanan strain ikan nila terhadap infeksi. Pada tahap ini, dipergunakan 4 (empat) strain nila yaitu ikan Nila Nirwana, ikan Nila Sultana, ikan Nila Srikandi dan dan ikan Nila BEST. Setiap strain ikan nila diinjeksi dengan PBS steril (sebagai kontrol) dan empat tingkat kepadatan bakteri 103, 104, 105, dan 106 CFU/ekor sehingga diperoleh nilai LD50 nya. Masing-masing kontrol dan tingkat kepadatan bakteri diinjeksikan
kepada 10 ekor ikan untuk setiap strain ikan nila.
Berdasarkan pengamatan yang dilakukan selama 15 hari dengan dua kali ulangan diperoleh hasil seperti yang tertera pada Tabel 2. Kemudian dilakukan pengujian terhadap nilai tengah LD50 dari keempat strain nila yang diujikan, dan
diperoleh hasil bahwa nilai tengah LD50 dari keempat strain ikan nila yang
13 Tabel 2 Hasil pengujian LD50 terhadap empat strain ikan nila
Strain
Analisis parameter imunologis ikan Nila Srikandi (cichlidae) dan ikan mas (non-cichlidae) terhadap infeksi S. agalactiae NK1
Berdasarkan pengujian sebelumnya, diketahui bahwa nilai LD50 antar strain
ikan nila tidak berbeda secara signifikan, sehingga tidak dapat disebutkan strain yang tahan maupun strain yang rentan. Oleh sebab itu untuk pelaksanaan penelitian tahap kedua dipilih strain ikan nila yang memiliki nilai LD50 tertinggi
yaitu ikan Nila Srikandi. Sedangkan untuk dosis kepadatan bakteri yang akan dipergunakan pada uji tantang tahap kedua dipilih dosis LD50 tertinggi yaitu 103,45
(CFU/ekor) yang merupakan dosis LD50 ikan Nila Srikandi dan disetarakan
sebagai 103 (CFU/ekor). Dosis LD50 merupakan dosis maksimum yang
menyebabkan kematian 50% sampel ikan uji, sehingga dosis ini dipergunakan pada pengujian utama untuk melihat gambaran imunologis ikan yang terinfeksi. Ikan yang dipergunakan pada uji utama ini adalah ikan nila Srikandi (kode A) dan ikan mas-sebagai pembanding dari golongan non-cichlidae (kode B).
Perubahan pola renang
14
menampakkan gejalanya mulai jam ke 48 dan nampak berenang whirling pada jam ke-168 yang ditampilkan pada Gambar 1 dibawah ini.
Keterangan : NA = Not Applicable
Gambar 1 Perubahan pola renang yang terjadi pada ikan nila: (A) ikan berenang lemah di permukaan air/gasping, (B) ikan berenang berulang, berputar dan tidak beraturan/ whirling
Tabel 3 Perubahan pola renang
Perubahan pola renang Waktu pertama kali terjadi perubahan pola renang pasca infeksi (jam)
Ikan Nila Srikandi (A) Ikan Mas (B) Ikan berenang di
permukaan, kolom dan dasar akuarium
6 NA
Respon ikan lemah dan tidak agresif
48 NA
Ikan berdiam di dasar akuarium
72 NA
Ikan berenang di
permukaan air (gasping)
168 NA
Ikan berenang berulang, berputar dan tidak beraturan (whirling)
15 Perubahan anatomi organ secara makroskopis
Ikan nila yang diinfeksi dengan isolat bakteri S. agalactiae NK1 menunjukkan perubahan anatomi pada organ luarnya, sedangkan pada ikan mas tidak menunjukkan perubahan. Perubahan anatomi yang timbul pada ikan Nila Srikandi ditampilkan pada Tabel 4. Garis vertikal tubuh tampak mulai menghitam pada jam ke 6. Eksoptalmi dan purulens (kekeruhan pada mata) terjadi pada jam ke 72 (Gambar 2).
Keterangan : NA = Not Applicable
Gambar 2 Perubahan patologi anatomi yang terjadi pada permukaan organ luar secara makroskopis (A) pendarahan pada pangkal sirip, mata keruh. (B) operkulum jernih, (C) bentuk tubuh seperti huruf “C” dan (D) mata terlepas pasca mengalami eksoptalmi
Tabel 4 Perubahan anatomi organ luar
Patologi anatomi organ luar secara makroskopis
Waktu pertama kali terbentuknya gejala klinis pasca infeksi (jam)
Ikan Nila Srikandi (A) Ikan Mas (B)
Garis vertikal tubuh menghitam 6 NA
Operkulum jernih 72 NA
Eksoptalmia dan purulens 72 NA
Pendarahan pada pangkal sirip 72 NA
Bentuk tubuh menyerupai huruf
16
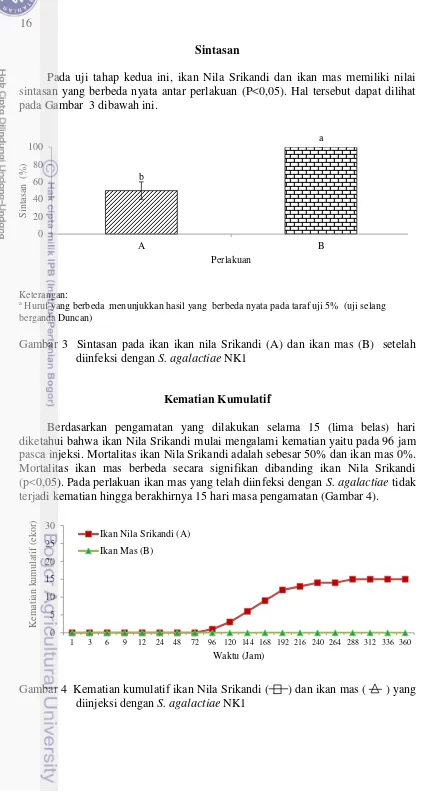
Sintasan
Pada uji tahap kedua ini, ikan Nila Srikandi dan ikan mas memiliki nilai sintasan yang berbeda nyata antar perlakuan (P<0,05). Hal tersebut dapat dilihat pada Gambar 3 dibawah ini.
Keterangan: a
Huruf yang berbeda menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 3 Sintasan pada ikan ikan nila Srikandi (A) dan ikan mas (B) setelah diinfeksi dengan S. agalactiae NK1
Kematian Kumulatif
Berdasarkan pengamatan yang dilakukan selama 15 (lima belas) hari diketahui bahwa ikan Nila Srikandi mulai mengalami kematian yaitu pada 96 jam pasca injeksi. Mortalitas ikan Nila Srikandi adalah sebesar 50% dan ikan mas 0%. Mortalitas ikan mas berbeda secara signifikan dibanding ikan Nila Srikandi (p<0,05). Pada perlakuan ikan mas yang telah diinfeksi dengan S. agalactiae tidak terjadi kematian hingga berakhirnya 15 hari masa pengamatan (Gambar 4).
Gambar 4 Kematian kumulatif ikan Nila Srikandi ( ) dan ikan mas ( ) yang diinjeksi dengan S. agalactiae NK1
17 Parameter Hematologi
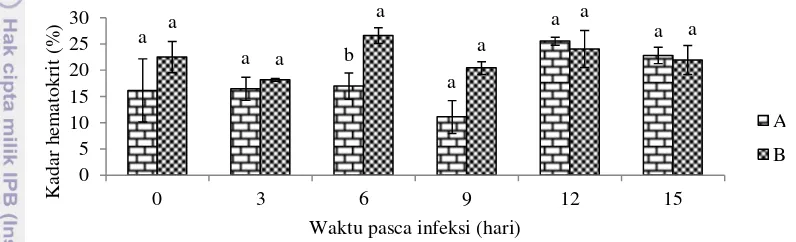
Kadar Hematokrit
Hematokrit merupakan gambaran persentase volume eritrosit dalam darah ikan, bila hematokrit 20 (20%) artinya darah terdiri atas 20% eritrosit dan 80% plasma. Pada pengamatan di hari ke-6, kadar hematokrit antar perlakuan tampak berbeda nyata (P<0,05) (Gambar 5).
Keterangan: a
Huruf yang berbeda pada periode waktu yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 5 Persentase hematokrit darah ikan nila Srikandi (A) dan ikan mas (B), sebelum dan sesudah diinfeksi dengan S. agalactiae NK1
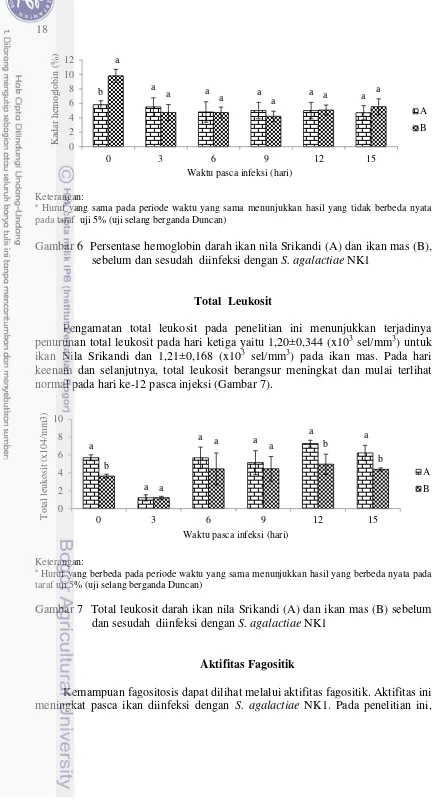
Kadar Hemoglobin
18
Keterangan: a
Huruf yang sama pada periode waktu yang sama menunjukkan hasil yang tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 6 Persentase hemoglobin darah ikan nila Srikandi (A) dan ikan mas (B), sebelum dan sesudah diinfeksi dengan S. agalactiae NK1
Total Leukosit
Pengamatan total leukosit pada penelitian ini menunjukkan terjadinya penurunan total leukosit pada hari ketiga yaitu 1,20±0,344 (x103 sel/mm3) untuk ikan Nila Srikandi dan 1,21±0,168 (x103 sel/mm3) pada ikan mas. Pada hari keenam dan selanjutnya, total leukosit berangsur meningkat dan mulai terlihat normal pada hari ke-12 pasca injeksi (Gambar 7).
Keterangan: a
Huruf yang berbeda pada periode waktu yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 7 Total leukosit darah ikan nila Srikandi (A) dan ikan mas (B) sebelum dan sesudah diinfeksi dengan S. agalactiae NK1
Aktifitas Fagositik
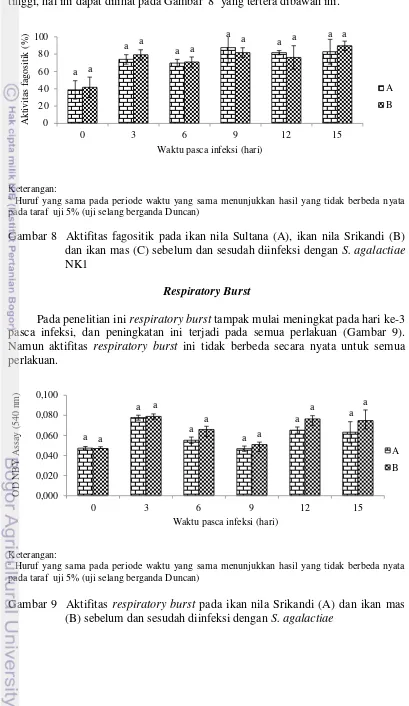
19 tidak ada perbedaan aktifitas fagositik yang signifikan antar pelakuan (P>0,05). Selama 15 hari masa pengamatan persentase aktifitas fagositik (AF) masih cukup tinggi, hal ini dapat dilihat pada Gambar 8 yang tertera dibawah ini.
Keterangan: a
Huruf yang sama pada periode waktu yang sama menunjukkan hasil yang tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 8 Aktifitas fagositik pada ikan nila Sultana (A), ikan nila Srikandi (B) dan ikan mas (C) sebelum dan sesudah diinfeksi dengan S. agalactiae NK1
Respiratory Burst
Pada penelitian ini respiratory burst tampak mulai meningkat pada hari ke-3 pasca infeksi, dan peningkatan ini terjadi pada semua perlakuan (Gambar 9). Namun aktifitas respiratory burst ini tidak berbeda secara nyata untuk semua perlakuan.
Keterangan: a
Huruf yang sama pada periode waktu yang sama menunjukkan hasil yang tidak berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 9 Aktifitas respiratory burst pada ikan nila Srikandi (A) dan ikan mas (B) sebelum dan sesudah diinfeksi dengan S. agalactiae
20
Aktifitas Lisozim
Lisozim adalah enzim yang sangat penting dalam darah karena mampu melisis bakteri. Aktifitas lisozim pada plasma darah mulai meningkat pada hari ke-3 pasca infeksi. Terlihat aktifitas lisozim pada ikan Nila Srikandu lebih tinggi dibanding ikan mas (Gambar 10). Aktifitas lisozim pada semua perlakuan memiliki perbedaan yang signifikan (P<0,05). Anderson dan Siwicki (1995) menyatakan bahwa kadar lisozim antar spesies ikan sangat berbeda.
Keterangan: a
Huruf yang berbeda pada periode waktu yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan)
Gambar 10 Aktifitas lisozim pada ikan Nila Srikandi (A) dan ikan mas (B) sebelum dan sesudah diinfeksi dengan S. agalactiae NK1
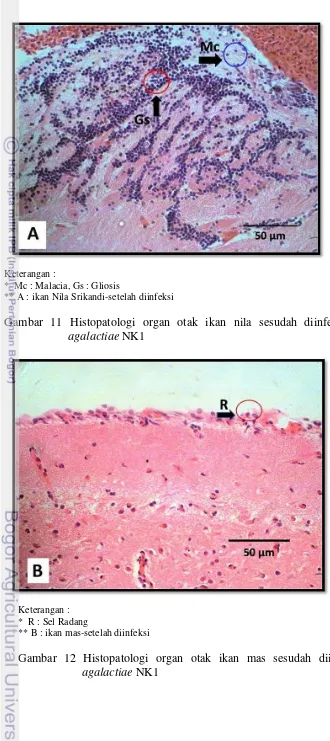
Histopatologi organ otak
Pemeriksaan histopatologi dilakukan untuk mengetahui adanya kerusakan jaringan akibat infeksi S. agalactiae NK1 terhadap organ otak. Hasil pengamatan histopatologi ditampilkan pada Gambar 11 dan 12.
21
Keterangan :
* Mc : Malacia, Gs : Gliosis
** A : ikan Nila Srikandi-setelah diinfeksi
Gambar 11 Histopatologi organ otak ikan nila sesudah diinfeksi dengan S. agalactiae NK1
Keterangan : * R : Sel Radang
** B : ikan mas-setelah diinfeksi
22
Parameter Kualitas Air
Pemeliharaan ikan dilakukan dalam akuarium yang terkontrol. Pergantian air dilakukan setiap 2 hari sekali sebanyak 50% dari total volume. Parameter kualitas air pemeliharaan berada pada kisaran normal dan sesuai untuk pemeliharaan ikan nila dan mas, dengan mengacu kepada Standar Nasional Indonesia untuk budidaya kedua komoditas tersebut (Tabel 5). Hal ini menunjukkan bahwa hasil penelitian yang diperoleh hanya dipengaruhi oleh perlakuan dan bukan karena pengaruh kualitas air.
Tabel 5 Data kualitas air media pemeliharaan
PEMBAHASAN
Pada penelitian tahap pertama, dari empat strain nila yang dipergunakan yaitu nila Nirwana, Nila Srikandi, Nila BEST dan nila Sultana diperoleh hasil
Pemberian injeksi S. agalactiae NK1 secara intraperitoneal memberikan pengaruh terhadap pola berenang ikan nila. Perubahan pola berenang yang timbul yaitu ikan berenang dengan sirip punggung yang berdiri tegak, ikan berenang lemah, berdiam diri didasar akuarium dan adapula yang berenang menggantung di permukaan air (gasping). Perubahan ini mulai terjadi pada jam ke-48 pasca injeksi yaitu ikan terlihat berenang tidak beraturan, soliter dan refleks berkurang. Patogen S. agalactiae NK1 yang digolongkan sebagai stressor biologis menyebabkan kondisi fisiologis dalam tubuh ikan terganggu. Infeksi ini berakibat pada peningkatan respirasi dan tekanan darah. Cadangan sel-sel darah merah akan dibebaskan ke sirkulasi. Pada kondisi ini, sel-sel darah cenderung belum sempurna sebagai akibatnya maka kemampuan hemoglobin dalam mengikat oksigen belum optimal, sehingga ikan cenderung kekurangan oksigen. Ikan akan
23 menyesuaikan diri terhadap kondisi tersebut dengan berenang menggantung di permukaan air agar lebih mudah memperoleh oksigen. Hal yang berbeda ditunjukkan oleh ikan mas, dimana setelah ikan mas diinjeksi dengan S. agalactiae NK1 tidak tampak adanya perubahan pola berenang sama sekali sejak awal ikan diinjeksi hingga berakhirnya masa pengamatan selama 15 hari. Ikan mas berenang teratur, berkelompok dan memperlihatkan refleks yang baik terhadap rangsangan. Ikan Nila Srikandi mulai menunjukkan gejala berenang berputar “whirling” pada jam ke-168. Semua gejala klinis yang tampak pada ikan nila tersebut sesuai dengan yang dijelaskan oleh Evans et al. (2006) pada ikan nila yang terinfeksi S. agalactiae sebelum mati yaitu berenang lemah dan berada di dasar akuarium, respon terhadap pakan lemah, berenang “whirling” dan tubuh membentuk huruf “C”.
Strain ikan nila yang terinfeksi S. agalactiae NK1 menunjukkan gejala pigmentasi pada kulit, pendarahan pada pangkal sirip, purulens dan eksoptalmi pada mata pasca diinfeksi dengan S. agalactiae. Sedangkan pada ikan mas tidak tampak gejala abnormal pada tubuhnya. Gejala pigmentasi pada kulit diduga karena sel-sel pigmen (kromatofor) pada dermis memiliki kemampuan berubah untuk menyesuaikan diri dengan lingkungan dan serangan penyakit. Kemampuan ini juga diinduksi oleh modulasi yang terkontrol melalui kemampuan absorptif dan reflektif dari kromatofora (Irianto 2004). Dinyatakan oleh Hardi (2011) ikan yang mengalami eksoptalmi baik lateral maupun bilateral disebabkan oleh eksotoksin yang menyebar langsung melalui darah dan menyebabkan hiperplasia pada bagian choroid mata.
Sistem kekebalan pada tubuh ikan terdiri atas dua macam yaitu kekebalan bawaan (non-spesifik) dan kekebalan dapatan (spesifik). Sistem kekebalan non spesifik merupakan mekanisme pertahanan yang paling pertama pada ikan. Secara alami akan melawan semua infeksi patogen atau benda asing yang tidak dikenali. Sistem pertahanan non-spesifik terbagi menjadi sistem pertahanan pertama yaitu pertahanan fisik (misalnya sisik dan mukus) dan pertahanan kedua yaitu mekanisme pertahanan humoral bersifat plasmatik seperti lisozim, interferon dan lainnya (Uribe et al. 2011). Dinyatakan oleh Sahoo (2005) bahwa parameter imun non-spesifik sangat berguna untuk menentukan status kesehatan ikan dan mengevaluasi bahan-bahan immunomodulator untuk budidaya ikan sebagai penanda pencemaran dan resistensi penyakit.
24
memenuhi kebutuhan oksigen, ikan nila meningkatkan frekwensi bukaan operkulum, dan berenang menggantung di permukaan air.
Hematokrit merupakan perbandingan antara plasma dan sel darah. Dapat digunakan untuk menentukan apakah ikan mengalami anemia atau masih normal. Kadar hematokrit pada perlakuan secara umum tidak menunjukkan perbedaan yang signifikan. Namun pada hari 6 terlihat bahwa strain ikan Nila Srikandi mengalami penurunan kadar hematokrit yang signifikan dibanding ikan mas. Sejalan dengan hal tersebut kadar hemoglobinnya juga mengalami penurunan. Faktor penyebab penurunan hematokrit diduga berkaitan dengan penurunan hemoglobin. Perubahan jumlah sel darah akan menyebabkan perubahan persentase sel darah dibanding plasma. Penurunan ini terkait dengan hemoragi pada pangkal sirip dan pendarahan di otak. Dinyatakan oleh Fujaya (2004) bahwa ada korelasi yang kuat antara hematokrit dan jumlah hemoglobin darah, semakin rendah jumlah sel-sel darah merah maka semakin rendah pula kandungan hemoglobin dalam darah.
Leukosit merupakan komponen sistem pertahanan tubuh yang dapat mengalami perubahan jumlah (monosit, limfosit, neutrofil) diakibatkan oleh kehadiran benda asing di dalam tubuh. Nuryati (2011) menyatakan bahwa secara umum tren penurunan jumlah leukosit pada ikan perlakuan maupun ikan kontrol setelah uji tantang menunjukkan bahwa leukosit tersebut diduga aktif dan keluar dari pembuluh darah menuju jaringan yang terinfeksi. Jumlah dan persentase komposisi leukosit secara signifikan tergantung pada beberapa faktor seperti status kesehatan, infeksi patogen dan faktor stress (Homatowska et al. 2002).
Sel-sel fagositik merupakan komponen seluler yang terpenting pada sistem imun non spesifik (innate imunity) ikan. Neumann et al. 2001 menyatakan bahwa aktifitas fagositik merupakan mekanisme pertahanan yang paling awal adanya dan merupakan karakteristik yang penting pada pertahanan non-spesifik. Pada penelitian ini aktifitas fagositik pasca infeksi terlihat meningkat dibanding dengan sebelum ikan diinfeksi (H-0). Hal ini terjadi pada semua perlakuan.
Sel fagosit memproduksi oksigen toksik (dalam bentuk peroksida dan anion superoksida) selama proses yang disebut dengan respiratory burst. Pada penelitian ini aktifitas respiratory burst terlihat meningkat mulai hari ke-3 pasca infeksi dengan S. agalactiae NK1. Namun aktifitas respiratory burst ini tidak berbeda secara nyata untuk semua perlakuan ikan Nila Srikandi dan ikan mas. Hal ini sejalan dengan Marsden (1996) yang menyatakan bahwa aktifitas respiratory burst tidak berbeda secara signifikan antara famili salmon atlantik yang memiliki resistensi yang tinggi maupun rendah terhadap infeksi Aeromonas salmonicida. Dan didukung oleh pernyataan Ardó et al. (2010) bahwa sifat aktifitas respiratory burst ini tidak dapat digunakan sebagai marker seleksi resistensi terhadap Aeromonas hydrophila.
25 1-4 N-acetylmuramic acid dan N-acetylglucosamine pada lapisan peptidoglikan dinding sel bakteri. Jumlah enzim ini sangat tinggi dalam serum, mukosa dan kulit. Peningkatan enzim ini dalam serum sejalan dengan produk mikroba yang diinjeksikan, respon terhadap infeksi bakteri maupun pakan yang diperkaya dengan probiotik (Nikoskelainen et al. 2003). Kadar lisozim antar spesies ikan sangat bervariasi (Anderson dan Siwicki 1995). Sebagaimana yang diperoleh pada penelitian Sahoo et al. (2005) bahwa Chirrinus mrigala dan Labeo rohita menunjukkan aktifitas lisozim yang lebih tinggi dibandingkan Catla catla.
Selama 15 hari masa pengamatan, nilai aktifitas lisozim berkorelasi negatif dengan hematokrit pada semua perlakuan. Caruso (2002) menyatakan bahwa kedua parameter ini dipergunakan secara luas sebagai indikator status kesehatan ikan. Penurunan nilai hematokrit sejalan dengan penelitian Sheatfish yang diinfeksi dengan Edwardsiella tarda. Saurabh dan Sahoo (2008) menyatakan bahwa peningkatan level enzim dapat mencerminkan perubahan dalam populasi sel darah putih selama perkembangan respon imun. Dengan demikian infeksi, yang membawa perubahan dalam jumlah leukosit, dapat mempengaruhi konsentrasi lisozim, dan estimasi lisozim dapat menjadi nilai diagnostik untuk menentukan status penyakit ikan.
Pengamatan histopatologi terhadap jaringan otak ikan Nila Srikandi memperlihatkan bahwa jaringan tersebut mengalami kerusakan terparah (kompleks malacia yang cukup luas, pendarahan pada otak/ ensefalitisdan selaput otak/ meningitis serta gliosis). Pada ikan mas hanya ditemukan adanya radang pada selaput otak/ meningen (meningitis). Menurut Cheville (1999) malacia adalah perubahan patologi fokal nekrosis berupa pelunakan jaringan (liquefative) sebagai akibat reaksi enzimatis yang terjadi karena masuknya toksin. Selain itu dinyatakan juga oleh Timothy dalam Gyles & Charles (1993) bahwa kemampuan kelompok bakteri Streptococcus menyebabkan lesi dipengaruhi oleh faktor virulensi yang dimiliki yaitu asam hyaluronic, protein M dan molekul pada permukaan dinding sel yaitu Streptolisin, toksin leukosidal, dan Streptokinase. Sedangkan gliosis terjadi pada saat jaringan otak mengalami lesi nekrosis. Pada awalnya terjadi respon eksudatif dengan aktivasi mikroglia lokal dan pengerahan monosit fagositik untuk memfagositosis jaringan yang mati (Stevens et al. 2002).
Kerusakan pada organ otak ditemukan pada ikan nila yang mengalami abnormalitas dalam berenang (berenang miring bahkan whirling) pasca diinjeksi dengan S. agalactiae. Pada ikan Nila Srikandi, gerakan berenang berputar(whirling) terjadi pada hari ke-7. Menurut Hardi (2011) kerusakan jaringan otak yang disebabkan ECP S. agalactiae menyebar lebih cepat karena toksin cepat menyebar melalui darah menuju ke otak dan seluruh tubuh.
26
Berdasarkan hasil yang diperoleh pada penelitian ini, terlihat bahwa sintasan pada ikan mas adalah sebesar 100% dan berbeda nyata terhadap strain ikan nila. Tidak semua ikan akan mengalami sakit manakala terjadi serangan patogen. Beragam faktor mempengaruhi masing-masing individu dalam menanggapi suatu patogen potensial. Pertama, patogen harus dapat menembus sistem imun ikan untuk dapat menimbulkan penyakit. Kedua, daya tahan alami memungkinkan suatu hewan menjadi terbebas dari serangan patogen karena tidak adanya jaringan spesifik atau reseptor seluler bagi kolonisasi patogen, atau tidak mampu mendukung syarat-syarat optimum baik dari sisi kecukupan nutrien maupun lingkungan bagi pertumbuhan patogen. Dan yang ketiga adalah, masing-masing individu hewan memiliki daya tahan individu yang antara lain ditentukan oleh umur, jenis kelamin, status nutrien dan ada atau tidaknya stress (Irianto 2004).
SIMPULAN DAN SARAN
SIMPULAN
Kerentanan antar strain ikan nila yang terinfeksi S. agalactiae tidak menunjukkan perbedaan yang signifikan, dengan gejala klinis berupa pigmentasi, eksoptalmi, kekeruhan pada mata, operkulum jernih, dan ikan berenang berputar sampai pada kematian. Namun gejala klinis ini tidak tampak pada ikan mas sebagai pembanding. Ikan nila merupakan inang spesifik bagi S. agalactiae.
SARAN
Perlu dilakukan penelitian kohabitasi ikan nila dengan ikan mas yang terinfeksi laten Streptococcus agalactiae
DAFTAR PUSTAKA
Amal MNA, Zamri-Saad M. 2011. Streptococcosis in tilapia : A review. Pertanika J Trop Agric Sci. 34 (2): 195-206.
Aryanto EW. 2011. Patogenisitas Streptococcus agalactiae pada ikan nila (Oreochromis niloticus) [skripsi]. Bogor (ID): Institut Pertanian Bogor. Anderson DP, Siwicki AK. 1995. Basic Hematology and Serology for Fish Health
Programs. Didalam : Shariff M, Arthur JR, Subasinghe RP, editor. Fish Health Section. Asia Fisheries society (eds), Disease in Asian Aquaculture II. Manila, Philippines. p 185-202.
27
Ardó L, Zsigmond J, Alexandra A, Galina J. 2010. Immune responses of resistant and sensitive commoncarp families following experimental challenge with Aeromonas hydrophila. Fish & Shellfish Immunology. 29:111-116.
BKIPM. 2013. Peta daerah sebar Hama dan Penyakit Ikan Karantina (HPIK) Tahun 2012. Pusat Karantina Ikan. Badan Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan. Kementerian Kelautan dan Perikanan. Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with
fish blood. J Fish Biol. 5: 771-781.
Caruso D, O Schlumberger, C Dahm, J-P Proteau. 2002. Plasma lysozyme levels in shetafish Silurus glanis (L.) subjected to stress and experimental infection with Edwardsiella tarda. Aquaculture Research. 33: 999-1008.
Cheville NF. 1999. Introduction to Veterinary Pathology. Second Edition. Iowa State. Univesity Press/AMES. p 5 – 27.
Dwinanti SH. 2011. Toksisitas dan imunogenitas produk ekstraseluler Streptococcus agalactiae tipe non hemolitik pada ikan nila [tesis]. Bogor (ID): Institut Pertanian Bogor.
Eldar A, Bejerano Y, Horovitcz A, Bercovier H. 1995. Experimental streptococcal meningo-encephalitis in cultured fish. Vet Microbiol. 43: 33-40.
Evans JJ, Klesius PH, Glibert PM, Shoemaker CA, Al Sarawi MA, Landsberg J, Duremdez R, Al Marzouk A, Al Zenki S. 2002a. Characterisation of beta-haemolytic group B Streptococcus agalactiae in cultured sea bream, Sparus auratus L. and Wild Mullet, Liza klunzingeri (Day), in Kuwait. Journal of Fish Diseases 25. p 505-513.
Evans JJ, Klesius PH, Shoemaker CA. 2006. An overview of streptococcus in warm-water fish. Aquaculture Health International. 7: 10-14.
Evans JJ, Arias CR. 2009. Use of modified live vaccine in aquaculture. Journal Of The World Society. 40(5) : 573-585.
Fujaya Y. 2004. Fisiologi Ikan Dasar Pengembangan Teknologi Perikanan. Jakarta (ID): Penerbit Rineka Cipta.
Gan Z, Wang B, Lu Y, Cai S, Jian JC, Wu Z. 2014. Molecular haracterization and expression of CD2BP2 in Nile Tilapia (Oreochromis niloticus) in response to Streptococcus agalactiae Stimulus. Gene. 548 (2014) : 126-133.
28
Hardi EH. 2011. Kandidat vaksin potensial Streptococcus agalactiae untuk pencegahan penyakit Streptococcosis pada ikan nila (Oreochromis niloticus) [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Hernandez E, Figueroa J, Iregui C. 2009. Streptococcosis on a red tilapia, Oreochromis sp., Farm : A case study. Journal of Fish Diseases. 32: 247-252.
Homatowska A, Wajtaszek J, Adamowicz A. 2002. Haematological indices and circulating blood picture in The Sunbleak, Leucaspius delineatus (Heckel, 1843). Zoological poloniae. 47: 57-68.
Irianto A. 2004. Patologi Ikan Teleostei. Jogjakarta (ID): Gadjah Mada University Press. 256 p.
Kawamura Y et al. 2005. High genetic similarity of Streptococcus agalactiae and
Streptococcus difficilis : S. difficilis Elder et al. 1995 is a later synonim of S.
agalactiae Lehmann and Neumann 1896 (Approved List 1980). Int J Syst Evol
Microbiol. 55: 961-965.
Klesius PH, Shoemaker CA, Evans JJ. 2008. Streptococcus : A worldwide fish health problem. 8th International symposium on Tilapia in aquaculture. Cairo. p 83-107.
Marsden MJ, Freeman LC, Cox D, Secombes CJ. 1996. Non-specific immune responses in families of Atlantic Salmon, Salmo Salar, exhibiting differential resistance to furunculosis. Aquaculture. 146:1-16.
Maryadi H. 2009. Studi perkembangan gejala klinis dan patologi pada ikan Kerapu Macan (Epinephelus fuscoguttatus) yang diinfeksi dengan Streptococcus iniae [tesis]. Bogor (ID) : Institut Pertanian Bogor.
Magnadottir B. 2005. Innate imunity of fish (overview). Fish and Shellfish Immunology. 20 : 137-151.
Neumann NF, Stafford JL, Barreda D, Ainsworth AJ, Belosevic M. 2001. Antimicrobial mechanism of fish phagocites and their role in host defence. Developmental and Comparative Immunology. 25: 807-25.
Nikoskelainen S, Ouwehand AC, Bylund G, Salminen S, Lilius EM. 2003. Immune enhancement in rainbow trout (Onchorynchus Mykiss) by potential probiotic bacteria (Lactobacillus rhamnosus). Fish And Shellfish Immunology. 15: 443-452.
29 Reed LJ., Muench H. 1938. A simple method of estimating fifty percent endpoints.
The American Journal Of Hygiene. 27: 493-497.
Robert JR. 2001. Fish Pathology 3 rd Edition. Bailere, Tyndall, Cadar, England. p 300 – 316.
Sahoo PK, J Kumari, BK Mishra. 2005. Non-specific immune responses in juveniles Of indian major carps. J Appl Ichthyol. 21: 151-155.
Saurabh S, Sahoo PK. 2008. Lysozyme : an important defence molecule of fish innate immune system. Aquaculture Research. 39: 223-239.
Singh SK, Tiwari VK, Chadha NK, Prakash C, Sukham M, Das P, Mandal SC, dan Chanu TI. Effect of Bacillus circulans and fructooligosaccaride supplementation on growth and haemato-immunological function of Labeo rohita (Hamilton, 1822) fingerlings exposed to sub-lethal nitrite stress. The Israel Journal of Aquaculture – Bamidgeh. 64: 1-11.
Sheehan B, Labrie L, Lee YS, Wong FS, Chan J, Komar C, Wendover N, Grisez L. 2009. Streptococcosis in Tilapia : Vaccination Effective Against Main Strep Species. Global Aquaculture Advocate. p 72-74.
Shoemaker CA, Klesius PH. 1997. Streptococcal disease problem and control : A review. Tilapia aquaculture Ithaca, NY, USA. Northwest Regional Aquaculture Engineering Service.
Standar Nasional Indonesia (SNI). 2000. Pembesaran ikan mas (Cyprinus carpio L.) di karamba jaring apung. Badan Standardisasi Nasional. SNI 01-6494.1-2000.
Standar Nasional Indonesia (SNI). 2009. Produksi ikan nila (Oreochromis niloticus Bleeker) kelas pembesaran di kolam air tenang. Badan Standardisasi Nasional. SNI 7550 : 2009
Standar Nasional Indonesia (SNI). 2009. Metode Identifikasi Bakteri pada Ikan secara Konvensional Bagian 3 : Streptococcus iniae dan Streptococcus agalactiae. Badan Standardisasi Nasional/BSN. SNI 7545.3: 2009.
Stevens A, JS. Lowe, B Young. 2002. Weather Basic Histopathology, A Color Atlas and Text. Fourth Edition. Churcill Livingstone. Edinburgh.
Tizard I. 1988. Pengantar Imunologi Veteriner. Edisi ke-2. Partodirejo M, Hardjosworo S, penerjemah; Surabaya : Airlangga University Press. Terjemahan dari : An Introduction to Veterinary Immunology.
30
Uribe C, Folch H, Enriquez R, Moran G. 2011. Innate and adaptive immunity in teleost fish. Veterinarni Medicina. 5 (10): 486-503.
31
32
Lampiran 1 Hasil pengujian isolat bakteri S. agalactiae NK1 dengan metode SNI 7545.3 : 2009
Pengujian Hasil SNI
Pewarnaan gram + +
Hemolisis Non hemolitik β-hemolitik
Katalase - -
Oksidase - -
OF - -
Motilitas Non motil -
Hidrolisis Aesculin - -
NaCl 6,5% - +
Bile salt agar 40% - +
33 Lampiran 2 Metode Polymerase Chain Reaction (PCR) untuk pengujian
isolat S. agalactiae NK1 1. Ekstraksi DNA dari kultur bakteri
Dimasukkan sebanyak 1 ml kultur bakteri umur 24 jam pada media cair/ broth (BHIB) kedalam 1,5 ml mikrotube. Kemudian disentrifugasi pada 13.000 g selama 5 menit untuk menghasilkan pellet. Lalu pellet disuspensikan kembali dalam 0,6 ml lysis buffer. Ekstraksi DNA bakteri dilakukan dengan menggunakan TE-Phenol. Setelah itu disentrifugasi pada 13.000 g selama 5 menit, dan diambil bagian supernatannya. Proses ekstraksi diulangi sebanyak 2-3 kali. Presipitasi DNA dilakukan dengan menambahkan isopropanol. Pellet DNA dibilas 2 kali dengan etanol 70%. DNA dilarutkan dalam 20-100 μl TE buffer setelah ethanol menguap.
2. Amplifikasi
Disiapkan mastermix terlebih dahulu dengan komposisi sebagai berikut :
Komponen Volume (μl)
Nuclease Fee Water
10x PCR buffer + MgCl2 (15mM*)
Primer F (1 pmol/μl*) mikrotube tersendiri dengan volume sesuai banyaknya sampel uji (termasuk positif dan negatif kontrol). Mikrotube yang telah berisi PCR mastermix lalu dimasukkan kedalam mesin PCR (thermal cycler) yang telah diprogram sesuai dengan pengaturan suhu dan siklus thermal cycler.
Sekuens primer yang digunakan untuk amplifikasi PCR dan ukuran amplikon yang diharapkan (Mata et al. 2004) adalah :