KARAKTERISASI SISTEM IMUN DAN ANALISIS GENETIK
LIMA STRAIN NILA,
Oreochromis niloticus
TERHADAP
INFEKSI
Streptococcus agalactiae
EVI ALFIAH TAUKHID
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Sistem Imun dan Analisis Genetik Lima Strain Nila, Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Evi Alfiah Taukhid
RINGKASAN
EVI ALFIAH TAUKHID. Karakterisasi Sistem Imun dan Analisis Genetik Lima Strain Nila, Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae. Dibimbing oleh ACHMAD FARAJALLAH dan ANGELA MARIANA LUSIASTUTI.
Ikan nila tergolong famili Cichlidae, dikenal sebagai Oreochromis niloticus. Ikan nila diintroduksi ke Indonesia pada tahun 1969 dari Taiwan. Indukan nila unggul yang telah dirilis di Indonesia sebagai ikan budidaya, yaitu BEST (Bogor Enhancement Strain of Tilapia), GIFT (Genetic Improvement for Farmed Tilapia), Nirwana (Nila Ras Wanayasa), Red-NIFI, dan Srikandi (Nila Ras Sukamandi).
Untuk mengoptimalkan upaya pencegahan dan pengobatan streptococcosis, serta peningkatan hasil budidaya perlu diketahui terlebih dahulu informasi mengenai karakterisasi sistem imun pada ikan nila yang dilakukan dengan uji tantang terhadap bakteri S. agalactiae. Perbedaan yang signifikan pada ketahanan penyakit dari strain yang berbeda kemungkinan besar disebabkan karena latar belakang genetik dapat mempengaruhi pembentukan sistem kekebalan tubuhnya.
Sampel nila BEST, Nirwana, Red-NIFI, Srikandi, dan GIFT diuji tantang selama 21 hari terhadap bakteri S. agalactiae. Parameter yang diamati terdiri dari diferensiasi leukosit, aktivitas lisozim, titer antibodi, dan tingkat kelangsungan hidup. Analisis genetik dilakukan dengan metode Random Amplified Polymorphic DNA (RAPD) dan
Amplified Fragment Length Polymorphism (AFLP). Teknik RAPD menggunakan primer OPA-11, OPA-15, OPA-16, dan OPA-20. Teknik AFLP menggunakan dua enzim yang berbeda, yaitu EcoRI dan MseI.
Secara umum tidak ditemukan adanya perbedaan jumlah komponen leukosit secara signifikan pada lima strain nila di hari 7 pasca uji tantang. Variasi pada hari ke-14, penurunan limfosit terjadi pada Nirwana dan Srikandi, penurunan monosit dan neutrofil terjadi pada BEST, Red-NIFI, dan GIFT. Proporsi leukosit pada hari ke-21 cenderung kembali pada kondisi awal, kecuali untuk Red-NIFI.
Penurunan aktivitas lisozim terjadi di hari ke-7 dan 14, kecuali pada strain BEST di hari ke-14. Hari ke-21 terlihat nilai yang selaras pada kelima strain nila. Tingkat titer antibodi tertinggi di hari ke-7 pada strain BEST dan Srikandi. Titer antibodi tertinggi di hari ke-14 pada Red-NIFI, dan titer antibodi terendah pada BEST. Titer antibodi tertinggi di hari ke-21 pada Red-NIFI dan GIFT, dan titer antibodi terendah pada Nirwana. Tingkat kelangsungan hidup dengan nilai tertinggi ditemukan pada Red-NIFI dan GIFT (60%), diikuti Srikandi (50%). Nilai terendah ditemukan pada BEST dan Nirwana (0%).
Berdasarkan parameter uji tantang, secara umum menunjukkan bahwa strain yang resisten terhadap infeksi penyakit S. agalactiae adalah Red-NIFI, selanjutnya diikuti oleh GIFT dan Srikandi. Sementara BEST dan Nirwana merupakan strain yang rentan terhadap agen infeksi, terutama bakteri S. agalactiae. Keterkaitan antara karakteristik sistem imun dan analisis genetik ikan nila menunjukkan korelasi yang positif. Strain nila yang rentan, BEST dan Nirwana memiliki fragmen alel spesifik pada posisi yang sama, dan memiliki hubungan kekerabatan yang paling erat berdasarkan jarak genetiknya.
SUMMARY
EVI ALFIAH TAUKHID. Characterization immune system and genetic analyses of five different tilapia, Oreochromis niloticus against Streptococcus agalactiae infection. Supervised by ACHMAD FARAJALLAH and ANGELA MARIANA LUSIASTUTI.
Tilapia is a member of the family Cichlidae, known as species of Oreochromis niloticus. Tilapia was introduced to Indonesia in 1969 from Taiwan. Some advanced tilapia variety releasing in Indonesia as fish culture, namely: BEST (Bogor Enhancement Strain of Tilapia), Nirwana (Nila Ras Wanayasa), Red-NIFI, Srikandi (Nila Ras Sukamandi), and GIFT (Genetic Improvement for Farmed Tilapia).
In order to optimal prevention and curing efforts, and to increase culture production, it requires information on immune system characterization at tilapia that conducted by a challenge test towards bacteria S. agalactiae. A significant difference of disease immune from various strains might be caused by genetic background influencing its body immune system establishment.
Tilapia samples BEST, Nirwana, Red-NIFI, Srikandi, and GIFT were challenge test for 21 days towards bacteria S. agalactiae. Parameters observed consist of differential leucocytes, lysozyme activity, antibody titer, and life survival level. Genetic analyses was conducted by Random Amplified Polymorphic DNA (RAPD) and Amplified Fragment Length Polymorphism (AFLP) methods. RAPD technique used primary random OPA-11, OPA-15, OPA-16, and OPA-20. AFLP technique used two different enzymes, i.e. EcoRI and MseI.
Generally, there is no significant change in the number of leucocytes component at five tilapia strains in the 7th day after challenge test. Variation at 14th day, lymphocyte
decreasing happened in Nirwana and Srikandi, monocyte and neutrofil decreasing happened in BEST, Red-NIFI, and GIFT. Leucocytes proportion at 21st day found that
trends to return to before challenge test, except for Red-NIFI.
The decrease of lysozyme activity at 7th and 14th day, except in BEST strain at the
14th day. At the 21st day it has seen that homogenous value at five tilapia strains. Highest
level of antibody titer at the 7th day in BEST and Srikandi strains. Highest level of
antibody titer at the 14th day in Red-NIFI and lower antibody titer in BEST. Highest level
of antibody titer at the 21st day in Red-NIFI and GIFT and lower antibody titer in
Nirwana. Life survival level produced value with variation at five tilapia strains. Lower value was found in BEST and Nirwana (0%). Highest value was found in Red-NIFI and GIFT (60%) and followed by Srikandi (50%).
Based on challenge test parameters, it generally shown that strain resistant to infectious disease of S. agalactiae is Red-NIFI, and followed by GIFT and Srikandi. Meanwhile, BEST and Nirwana are vulnerable strains to infectious agent, particularly bakteria S. agalactiae. Relationship between immune system characterization and tilapia genetic analyses indicated a positive correlation. Vulnerable tilapia strains, BEST and Nirwana have fragment specific allele at the same position, and a closest relationship based on their genetic distance.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biosains Hewan
KARAKTERISASI SISTEM IMUN DAN ANALISIS GENETIK
LIMA STRAIN NILA,
Oreochromis niloticus
TERHADAP
INFEKSI
Streptococcus agalactiae
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Karakterisasi Sistem Imun dan Analisis Genetik Lima Strain Nila, Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae
Nama : Evi Alfiah Taukhid NIM : G352110141
Disetujui oleh Komisi Pembimbing
Dr. Achmad Farajallah Ketua
Dr.drh. Angela Mariana L, M.Si Anggota
Diketahui oleh
Ketua Program Studi Biosains Hewan
Dr. R.R. Dyah Perwitasari
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei-Desember 2013 ini ialah sistem imun dan analisis genetik, dengan judul Karakterisasi Sistem Imun dan Analisis Genetik Lima Strain Nila,
Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Achmad Farajallah, M.Si dan Ibu Dr. drh. Angela Mariana Lusiastuti, M.Si selaku pembimbing, Ibu Dr. Ir. Nurlisa A Butet, M.Sc selaku penguji sidang tesis, serta Bapak Ahmad Wahyudi dan Bapak Edy Farid yang telah banyak membantu selama penelitian di Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor.
Ungkapan terima kasih juga disampaikan kepada orang tua, suami, anak, adik, serta seluruh keluarga dan teman-teman, atas segala doa, dukungan, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat bagi pengembangan ilmu pengetahuan.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
METODE 4
Waktu dan Tempat 4
Ikan Uji 4
Tahapan Penelitian 4
Uji Tantang 4
Parameter 5
Analisis DNA 6
HASIL DAN PEMBAHASAN 8
Diferensiasi Leukosit 8
Aktivitas Lisozim 9
Titer Antibodi 11
Tingkat Kelangsungan Hidup 12
Variasi dan Jarak Genetik Lima Strain Ikan Nila 13 Keterkaitan Karakteristik Respon Imun dan Analisis Genetik 20
SIMPULAN 21
DAFTAR PUSTAKA 21
DAFTAR TABEL
1 Primer-primer yang diujicobakan pada sampel DNA 7 2 Titer antibodi lima strain Ikan Nila pada pra uji tantang, hari ke-7, 14, dan
21 pasca uji tantang bakteri S. agalactiae-N14G 11
3 Primer AFLP yang digunakan dan profil pita dari lima strain ikan nila 16
4 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) menggunakan primer OPA-11 16
5 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) menggunakan primer OPA-15 17
6 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) menggunakan primer OPA-16 17
7 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) menggunakan primer OPA-20 17
8 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) dengan kombinasi primer EcoRI-ACG dan MseI-CTG 18
9 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik
(diagonal bawah) dengan kombinasi primer EcoRI-ACC dan MseI-CTT 18
DAFTAR GAMBAR
1 Diferensiasi leukosit lima strain ikan nila yang diuji tantang bakteri
S. agalactiae-N14G 8
2 Aktivitas lisozim lima strain nila yang diuji tantang bakteri S. agalactiae-
N14G 10
3 Rata-rata tingkat kelangsungan hidup lima strain Ikan Nila selama 21 hari uji tantang terhadap infeksi bakteri S. agalactiae-N14G 12
4 Gejala klinis ikan nila yang terinfeksi bakteri patogen
dengan kombinasi primer EcoRI-ACG dan MseI-CTG 20
12 Dendogram analisis cluster jarak genetik (UPGMA) data AFLP
PENDAHULUAN
Latar Belakang
Ikan nila merupakan ikan air tawar yang tergolong dalam famili Cichlidae, genus Oreochromis, dengan nama spesies Oreochromis niloticus
(Trewavas 1983). Pada awalnya O. niloticus berasal dari hulu Sungai Nil di Uganda, kemudian menyebar luas ke seluruh dunia untuk tujuan budidaya (DJPB 2011). Di Indonesia, ikan nila pertama diimpor secara resmi dari Taiwan untuk tujuan penelitian dan budidaya pada tahun 1969 oleh Balai Penelitian Perikanan Budidaya Air Tawar Bogor (Gustiano et al. 2008).
Ikan nila merupakan jenis ikan yang mempunyai nilai ekonomis tinggi dan merupakan komoditas unggulan dalam bisnis ikan air tawar dunia, serta terus berkembang dengan prospek baik di Indonesia (Putra 2010). Kebutuhan benih ikan ini dari tahun ke tahun terus meningkat seiring dengan permintaan yang tinggi. Dalam upaya memenuhi kebutuhan masyarakat ini dapat dilakukan dengan intensifikasi budidaya. Perkembangan budidaya ikan yang baik harus ditunjang dengan peningkatan kualitas bibit yang dilakukan melalui seleksi dan mendatangkan strain baru yang berasal dari Filipina, Taiwan, dan Thailand; dan menghasilkan strain nila unggulan.
Dalam rangka menemukan strain nila unggulan, lembaga penelitian dan riset perguruan tinggi berusaha untuk meningkatkan kualitas genetik ikan nila. Saat ini telah dirilis beberapa strain nila oleh Kementerian Kelautan dan Perikanan untuk tujuan budidaya. BEST (Bogor Enhanced
Strain Tilapia) berhasil dikembangkan oleh Balai Penelitian Perikanan
Budidaya Air Tawar, Bogor. Nirwana (Nila Ras Wanayasa) telah dikembangkan oleh Balai Pengembangan Benih Ikan Air Tawar (BPBIAT), Wanayasa. Red-NIFI (National Inland Fishery Institute) diperoleh dari hasil persilangan beberapa spesies yang termasuk genus Oreochromis dan dikembangkan oleh Filipina. Srikandi (Nila Ras Sukamandi) telah dikembangkan oleh Balai Penelitian Pemuliaan Ikan (BPPI), Sukamandi. GIFT (Genetic Improvement for Farmed Tilapia) didapatkan dari hasil persilangan jenis nila yang dipilih dari Taiwan, Mesir, Thailand, Ghana, Singapura, Israel, Senegal, dan Kenya yang dikembangkan oleh
International Center for Living Aquatic Resources Management (ICLARM)
(DJPB 2011).
Potensi ikan nila sangat besar karena memiliki beberapa kelebihan antara lain: (i) mudah dipelihara, (ii) pertumbuhan yang relatif cepat, dan (iii) toleran terhadap kondisi perubahan air (Stickney 2000). Karakteristik-karakteristik inilah yang menjadikan ikan nila sebagai model ikan yang menarik untuk studi biologi perkembangan, termasuk yang terkait dengan biologi reproduksi (Lacerda et al. 2006).
2
tidak diimbangi dengan ketersediaannya, baik dari sisi kualitas maupun kuantitas. Hal ini menyebabkan populasinya terlalu padat dan memunculkan penyakit infeksi oleh bakteri yang dikenal dengan streptococcosis. Streptococcosis yang paling dominan disebabkan oleh bakteri Streptococcus
agalactiae. Jenis bakteri ini dapat menimbulkan kematian pada ikan nila
yang tinggi dalam berbagai ukuran, termasuk pada stadia benih (Taukhid et al. 2009). Streptococcosis menyebabkan 90% kematian dalam enam hari pasca injeksi. Gejala klinis pada ikan nila yang mengalami streptococcosis, pada saat sebelum mati terlihat seperti berenang lemah di dasar akuarium, berenang tidak beraturan, respon terhadap pakan lemah, perubahan warna
tubuh, tubuh membentuk huruf “C”, eksoptalmia pada mata, dan bukaan
operkulum lebih cepat (Eldar et al. 1995; Evans et al. 2002; Lusiastuti et al.
2010). Hasil penelitian yang dilakukan Taukhid dan Purwaningsih (2009) menemukan bahwa angka kematian dari streptococcosis pada dua strain nila (BEST dan Larasati) bervariasi antara 30-90% pada 14 hari pasca infeksi.
Ikan memiliki sistem imun yang sederhana dan berbeda dari vertebrata yang lebih tinggi. Sistem pertahanan ikan bersifat non-spesifik terdiri atas pertahanan humoral dan seluler. Sistem ini meliputi pertahanan mekanik dan kimiawi (mukus, kulit, sisik, dan insang) dan pertahanan seluler (sel makrofag, leukosit: monosit, netrofil, eosinofil, dan basofil). Mekanisme kekebalan non-spesifik merupakan kekebalan alamiah (innate
immunity) berupa pertahanan inang yang responnya tidak tergantung kontak
antigen tertentu. Sistem kekebalan spesifik (humoral dan seluler) tergantung pada kontak inang dengan antigen sebelumnya (adaptive immunity). Sistem pertahanan ikan akan terbentuk sempurna setelah ikan dewasa. Pada benih, sistem kekebalan tubuh ikan sudah terbentuk tetapi belum berfungsi dengan optimal. Namun demikian, tersedia sedikit atau mungkin tidak ada informasi dalam upaya untuk memperbaiki resistensi terhadap penyakit secara genetik pada pengembangan strain nila. Dengan kata lain, ada peluang terkait alasan mengapa genetik sistem imun pada beberapa strain nila terhadap infeksi bakteri berbeda-beda. Hal ini kemungkinan besar disebabkan karena berbagai latar belakang genetik strain nila yang berbeda dapat mempengaruhi pembentukan sistem imunnya.
Latar belakang genetik yang berbeda pada strain nila dapat mempengaruhi pembentukan sistem imun tersebut. Kisaran inang bakteri S.
agalactiae yang luas menuntut pentingnya informasi untuk mengetahui
mengenai latar belakang genetik munculnya sistem imun pada ikan nila.
Perumusan Masalah
3
Streptococcus agalactiae? Bagaimanakah keterkaitan antara sistem imun
dengan analisis genetik pada kelima strain nila tersebut?
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan karakterisasi sistem imun pada lima strain nila yang berbeda, yaitu BEST, Nirwana, Red-NIFI, Srikandi, dan GIFT dengan uji tantang terhadap bakteri patogen
Streptococcus agalactiae-N14G, serta melihat keterkaitan antara sistem
imun dengan analisis genetiknya.
Lima strain nila
Intensifikasi budidaya dan kepadatan populasi
Infeksi bakteri
Streptococcus agalactiae
Non-spesifik
Perbaikan mutu
Analisis genetik Spesifik
4
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada Bulan Mei-Desember 2013 di Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor dan di Laboratorium Fungsi Hayati dan Perilaku Hewan Departemen Biologi FMIPA, IPB.
Ikan Uji
Lima strain nila yang digunakan adalah BEST, Nirwana, Red-NIFI, Srikandi, dan GIFT. Ukuran berat rata-rata ikan ± 15 gram/ekor. Semua strain nila diasumsikan bebas patogen khusus (specific pathogen free-SPF) terhadap patogen yang ditargetkan, berdasarkan pada hasil diagnosis bakteriologi dan titer antibodi sampel yang dilakukan secara acak dari masing-masing strain nila sebelum penelitian dilakukan. Ikan diberi makan tiga kali per hari menggunakan pakan komersial dengan kandungan protein kasar sekitar ± 28%. Pergantian air dilakukan setiap hari untuk membuang sisa pakan dan limbah metabolisme ikan.
Tahapan Penelitian
Ikan nila diaklimatisasikan selama empat belas hari dengan perlakuan yang sama. Hari pertama sebelum perlakuan uji tantang, dilakukan pengambilan sampel jaringan untuk analisis molekular dan sampel darah untuk pemeriksaan hematologi. Uji tantang dilakukan selama 21 hari dan pemeriksaan hematologi dari sampel darah dilakukan empat kali selama uji tantang, yaitu pada hari ke-0, 7, 14, dan 21.
Uji Tantang
5 dengan menginjeksikan bakteri aktif pada intra peritoneal (IP) sesuai dengan dosis lethal-50 (LD50) dari isolat. Menurut Taukhid dan Purwaningsih (2009) LD50 dari isolat S. agalactiae-N14G ditentukan dengan konsentrasi bakteri sebesar 103 cfu/ml.
Periode pengamatan uji tantang dilakukan selama 21 hari. Pengamatan perilaku, gejala klinis, dan persentase kematian dilakukan sampai masa akhir uji tantang. Sampling untuk parameter (diferensiasi leukosit, aktivitas lisozim, dan titer antibodi) dilakukan secara mingguan, pada pra-uji tantang, hari ke-7, 14, dan 21 setelah infeksi buatan.
Parameter
Parameter yang diukur dan diamati dalam penelitian ini terdiri dari (i) diferensiasi leukosit, (ii) aktivitas lisozim, (iii) titer antibodi, dan (iv) tingkat kelangsungan hidup dengan detail penjelesannya sebagaimana berikut:
Diferensiasi Leukosit
Diferensiasi leukosit merupakan salah satu indikator yang umum digunakan sebagai profil hematologi dalam kaitannya dengan sistem imun non-spesifik pada ikan. Sampel darah diambil dari vena caudalis
menggunakan jarum no. 25 non-heparinized dan diteteskan ke permukaan kaca objek, dan dibuat preparat ulas. Preparat ulas difiksasi dengan metanol 95 % selama 10 menit. Preparat diwarnai dengan merendamnya dalam Giemsa selama 30 menit. Jumlah limfosit, monosit, dan neutrofil dihitung dalam bidang pandang mikroskop sampai berjumlah total 100 sel.
Aktivitas Lisozim
Lisozim adalah konstituen umum dari jaringan biologis dan sekresi, yang banyak ditemukan dalam serum ikan, dan merupakan indikator umum yang digunakan sebagai uji untuk sistem imun non-spesifik pada ikan (Uribe
et al. 2011). Setelah darah diambil dari ikan, darah disimpan pada suhu
ruang selama dua jam, kemudian pada lemari es (4°C) selama 24 jam. Serum kemudian dimurnikan melalui sentrifugasi pada 5000 rpm (rotation
per minute) selama tiga menit. Uji aktivitas lisozim dilakukan dengan
6
Titer Antibodi
Titer antibodi adalah pengukuran antibodi ikan yang mengenali antigen tertentu. Titer antibodi dinyatakan dengan kebalikan dari pengenceran terbesar yang masih memberikan hasil positif. Teknik aglutinasi langsung (direct agglutination) digunakan untuk mengukur titer antibodi yang hasilnya dapat dibaca secara visual. Sebanyak 0.1 ml serum ikan dimasukkan ke dalam sumur pertama, seri pengenceran dilakukan ke dalam 12 sumur menggunakan larutan phosphate buffered saline (PBS). Kemudian 20 µl bakteri S. agalactiae ditambahkan ke dalam semua sumur. Serum dan antigen dicampurkan secara merata (homogenisasi) dengan perlahan-lahan, kemudian diinkubasi pada suhu 37°C selama dua jam dan disimpan dalam lemari es selama 24 jam. Aglutinasi (reaksi antigen antibodi) diamati menggunakan mikroskop dengan pembesaran 100-400 dengan mengamati ada/tidaknya “agglutinins” yang ditandai dengan penggumpalan serum sebagai indikator bahwa serum tersebut mengandung antibodi terhadap S. agalactiae.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup atau tingkat kematian adalah istilah yang digunakan untuk menunjukkan kemampuan ikan bertahan hidup atau mati dalam suatu populasi karena suatu kejadian. Dalam penelitian ini, tingkat kelangsungan hidup diamati setiap hari, kemudian dijumlahkan pada akhir periode uji tantang.
Analisis DNA
Ekstraksi DNA
Isolasi DNA menggunakan metode phenol chloroform dengan cara jaringan sebanyak 5-10 mg dalam alkohol, dicuci dengan menambahkan tris-EDTA (pH 8) 0.5 ml kemudian dipisahkan melalui proses sentrifugasi pada kecepatan 5000 rpm selama 5 menit sebanyak dua kali ulangan. Penghancuran jaringan dilakukan dengan menambahkan bufer salt tris
EDTA (pH 8) 0.3 ml sambil digerus. Penghancuran protein dilakukan dengan menambahkan enzim Proteinase K 10 µl dan 10% sodium duodesil
sulfat 50 µl, kemudian diinkubasi pada suhu 55°C selama satu jam. Material
7 Molekul DNA disuspensikan dalam bufer 80% tris-EDTA (pH 8) 0.1 ml dan disimpan dalam suhu 4ºC untuk digunakan lebih lanjut.
Amplifikasi DNA
Amplifikasi DNA dilakukan dengan menggunakan metode Random
Amplified Polymorphic DNA (RAPD), primer yang digunakan adalah
OPA-11, OPA-15, OPA-16, dan OPA-20 (Tabel 1). Proses amplifikasi menggunakan komposisi reaksi: DNA 1 µl, primer 1 µl, PCR Master Mix
12.5 µl, dan H2O 10.5 µl; dengan total volume 25 µl. selanjutnya dimasukkan dalam thermocycler dengan satu siklus denaturasi 94ºC selama 1 menit, annealing pada suhu 36ºC selama 1 menit, elongasi pada suhu 72ºC selama 2.5 menit, dan elongasi akhir pada suhu 72ºC selama 7 menit.
Tabel 1 Primer-primer yang diujicobakan pada sampel DNA Nama Primer Urutan Nukleotida (5’→ 3’)
OPA-11 CAA TCG CCG T
OPA-15 TTC CGA ACC C
OPA-16 AGC CAG CGA A
OPA-20 GTT GCG ATC C
Amplifikasi DNA dilakukan dengan menggunakan metode Amplified
Fragment Length Polymorphism (AFLP) mengikuti protokol baku yang
dilakukan oleh Vos et al. (1995). Pemotongan ruas DNA menggunakan dua enzim restriksi, yaitu EcoRI yang mengenali AATTC dan MseI yang mengenali TAA. Genom DNA sebanyak 10 µl ditambahkan EcoRI 1 µl, buffer EcoRI 1,1 µl, MseI 1 µl, dan buffer MseI 1,2 µl, kemudian diinkubasi pada suhu 37ºC selama 24 jam. Hasil pemotongan sebanyak 5 µl diligasi dengan T4 ligase sebanyak 0,2 µl ke adaptor EcoRI (5’ -CTCGTAGACTGCGTACC dan CATCTGACGCATGGTTAA-5’) dan adaptor MseI (5’-GACGATGAGTCCTGAG dan
TACTCAGGACTCAT-5’) masing-masing 2 µl yang sebelumnya dipanaskan hingga suhu 95ºC. Sebagai upaya praseleksi untuk amplifikasi awal, digunakan adaptor dengan
menambahkan satu nukleotida di ujung 3’.
Visualisasi Perbanyakan ruas DNA
Produk PCR sebanyak 2 µl kemudian dimigrasikan dalam
polyacrylamide gel electrophoresis (PAGE) 8% menggunakan bufer 1x tris
8
HASIL DAN PEMBAHASAN
Diferensiasi Leukosit
Diferensiasi leukosit merupakan salah satu indikator yang umum digunakan sebagai profil hematologi dalam kaitannya dengan sistem imun non-spesifik pada ikan. Hasil penelitian menunjukkan bahwa masing-masing strain nila menunjukkan variabilitas dalam proporsi leukosit (limfosit, monosit, dan neutrofil).
Peningkatan atau penurunan jumlah komponen leukosit tidak ditemukan adanya perbedaan yang signifikan pada strain nila yang berbeda. Namun, secara umum menunjukkan bahwa penurunan jumlah limfosit ditemukan pada semua strain nila di hari ke-7 pasca uji tantang, di sisi lain, peningkatan jumlah terjadi pada kedua komponen, monosit dan neutrofil. Pada hari ke-14 pasca uji tantang, penurunan jumlah komponen limfosit terjadi pada Nirwana dan Srikandi; Namun, kondisi terbalik di BEST, Red-NIFI, dan GIFT diamati pada komponen monosit. Pada akhir periode pengamatan (hari ke-21 pasca uji tantang); pengecualian untuk Red-Nifi, proporsi leukosit cenderung kembali pada kondisi normal, sebagaimana pra uji tantang (Gambar 1).
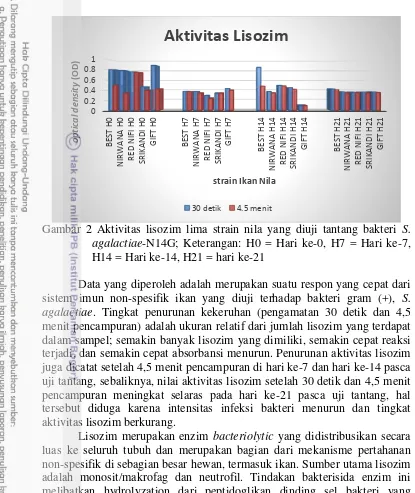
Gambar 1 Diferensiasi leukosit lima strain ikan nila yang diuji tantang bakteri S. agalactiae-N14G; Keterangan: H0 = Hari ke-0, H7 = Hari ke-7, H14 = Hari ke-14, H21 = hari ke-21
Penurunan jumlah limfosit pada hari ke-7 pasca uji tantang kemungkinan terjadi karena akting dari sel-sel limfosit pada tahap awal infeksi, dan proliferasi sel menjadi limfosit B dan limfosit T. Hal ini sebagai jenis mekanisme bawaan yang muncul sebelum aktivitas limfosit T spesifik dan pembentukan antibodi. Jumlah dan persentase komposisi leukosit dalam
9 sirkulasi darah ikan secara signifikan tergantung pada beberapa faktor seperti kondisi kesehatan, infeksi patogen, dan faktor stres (Homatowska et al. 2002). Sel yang terlibat dalam sistem kekebalan tubuh terdiri dari dua jenis limfosit, yaitu limfosit B dan limfosit T. Aktivitas tertentu dari sel T pada ikan belum diketahui dengan jelas namun peran utamanya adalah pada sel imunitas. Sel B berperan dalam produksi imunoglobulin melalui stimulasi antigen spesifik dan immunoglobulin yang diproduksi oleh limpa (Uribe et al. 2011).
Proporsi komponen monosit secara dramatis meningkat pada hari ke-7 pasca uji tantang, dan sedikit menurun pada hari ke-14 dan ke-21 pasca uji tantang, dengan pengecualian untuk BEST di hari ke-14 pasca uji tantang. Hal ini menjelaskan bahwa semua strain nila tidak menunjukkan kecenderungan secara signifikan terhadap proporsi monosit selama pengamatan. Peningkatan jumlah monosit pada tahap awal infeksi diduga terkait dengan fungsi utama dari sel-sel ini sebagai sel fagosit. Monosit adalah sel makrofag dan berfungsi sebagai fagosit "memakan" benda asing dan menginformasikan kepada sistem kekebalan tubuh untuk bertindak lebih lanjut. Proporsi monosit ikan sekitar 0,1% pada leukosit, dengan pengecualian jika ada benda asing dalam darah atau sirkulasi (Roberts 2001). Oleh karena itu, peningkatan persentase monosit jelas sebagai akibat infeksi
S. agalactiae.
Pada saat aktivasi, kapasitas fagositik monosit lebih kuat daripada sel-sel granulosit lain, dan itu akan menjadi aktor dari komponen penting dalam pertahanan tuan rumah melalui serangkaian proses fagositosis. Sel neutrofil adalah jenis leukosit yang meninggalkan kapiler darah selama infeksi akut dan peradangan (Ferguson et al. 1995). Jumlah persentase neutrofil kecil dibandingkan dengan limfosit dan sel-sel monosit, hal ini mungkin terjadi karena migrasi besar-besaran dari sel ke situs infeksi.
Sel darah putih (leukosit) merupakan komponen penting dalam sistem kekebalan tubuh ikan, terdapat dua jenis leukosit, yaitu granulosit dan agranulosit. Granulosit terdiri dari eosinofil, neutrofil, dan basofil; dan agranulosit terdiri dari limfosit, monosit, dan trombosit (Chinabut et al.
1991).
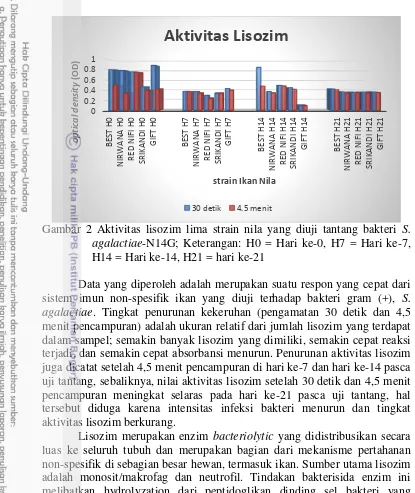
Aktivitas Lisozim
10
Gambar 2 Aktivitas lisozim lima strain nila yang diuji tantang bakteri S.
agalactiae-N14G; Keterangan: H0 = Hari ke-0, H7 = Hari ke-7,
H14 = Hari ke-14, H21 = hari ke-21
Data yang diperoleh adalah merupakan suatu respon yang cepat dari sistem imun non-spesifik ikan yang diuji terhadap bakteri gram (+), S.
agalactiae. Tingkat penurunan kekeruhan (pengamatan 30 detik dan 4,5
menit pencampuran) adalah ukuran relatif dari jumlah lisozim yang terdapat dalam sampel; semakin banyak lisozim yang dimiliki, semakin cepat reaksi terjadi, dan semakin cepat absorbansi menurun. Penurunan aktivitas lisozim juga dicatat setelah 4,5 menit pencampuran di hari ke-7 dan hari ke-14 pasca uji tantang, sebaliknya, nilai aktivitas lisozim setelah 30 detik dan 4,5 menit pencampuran meningkat selaras pada hari ke-21 pasca uji tantang, hal tersebut diduga karena intensitas infeksi bakteri menurun dan tingkat aktivitas lisozim berkurang.
Lisozim merupakan enzim bacteriolytic yang didistribusikan secara luas ke seluruh tubuh dan merupakan bagian dari mekanisme pertahanan non-spesifik di sebagian besar hewan, termasuk ikan. Sumber utama lisozim adalah monosit/makrofag dan neutrofil. Tindakan bakterisida enzim ini melibatkan hydrolyzation dari peptidoglikan dinding sel bakteri yang mengakibatkan lisis sel. Secara khusus, lisozim menambahkan air (menghidrolisis) ke ikatan glikosidik antara N-acetylmuramic acid (NAM) dan N-asetilglukosamin (NAG). Hal ini disebabkan oleh enzim hidrolitik yang mampu memotong dinding sel gram (+) dan beberapa gram (-) bakteri. Lisozim adalah konstituen umum dari jaringan biologi dan sekresi, telah ditemukan dalam serum ikan, dan merupakan indikator yang digunakan sebagai uji untuk sistem imun non-spesifik pada ikan (Uribe et al. 2011). Aktivitas tinggi dari lisozim menunjukkan bahwa sistem kekebalan tubuh non-spesifik ikan telah diaktifkan, terutama dalam hal terdapat infeksi bakteri. Hasil uji aktivitas lisozim selama pengamatan menunjukkan masing-masing strain memiliki variabilitas dalam aktivitas lisozim.
11 Titer Antibodi
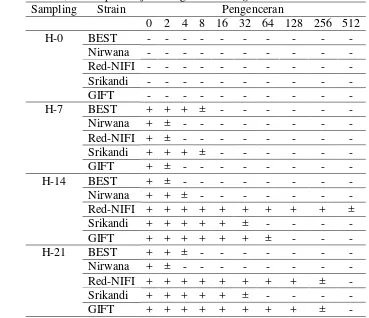
Antibodi merupakan hasil dari sistem imun yang bertujuan untuk melawan benda asing (antigen) yang masuk pada tubuh ikan. Antibodi adalah sistem imun spesifik terhadap antigen tertentu. Level tertinggi titer antibodi adalah pengenceran 1:512 pada hari ke-14 pasca uji tantang pada Red-NIFI (Tabel 2).
Tabel 2 Titer antibodi lima strain Ikan Nila pada pra uji tantang, hari ke-7, 14, dan 21 pasca uji tantang bakteri S. agalactiae-N14G
Sampling Strain Pengenceran
Keterangan: (+) = terjadi aglutinasi, (±) = aglutinasi rendah, (-) = tidak terjadi aglutinasi
Dengan pengecualian untuk Red-NIFI; tingkat titer antibodi tertinggi pada setiap strain nila terjadi: (i) pada pengenceran 1:8 untuk BEST dan Srikandi pada hari ke-7 pasca uji tantang, (ii) pengenceran 1:64 untuk GIFT pada hari ke-14 pasca uji tantang, pengenceran 1:32 untuk Srikandi pada hari ke-14 dan 21 pasca uji tantang, dan (iii) pengenceran 1:256 untuk GIFT pada hari ke-21 pasca uji tantang. Titer antibodi merupakan indikator untuk mengukur tingkat reaksi antigen-antibodi. Nilai titer antibodi merupakan indikator bahwa ikan terinfeksi dengan jenis antigen tertentu.
12
Tingkat Kelangsungan Hidup
Rata-rata tingkat kelangsungan hidup pada akhir studi lima jenis yang berbeda dari ikan nila berkisar antara 0-60% (Gambar 3).
Gambar 3 Rata-rata tingkat kelangsungan hidup lima strain Ikan Nila selama 21 hari uji tantang terhadap infeksi bakteri S. agalactiae-N14G Tingkat kelangsungan hidup terendah (0%) ditemukan pada strain BEST dan Nirwana. Tingkat kelangsungan hidup tertinggi (60%) ditemukan pada strain Red-NIFI dan GIFT, Srikandi (50%).
Jenis infeksi S. agalactiae pada ikan nila adalah sub-akut dengan masa inkubasi tiga minggu. Gejala klinis streptococcosis pada ikan nila menunjukkan seperti berenang lemah dan berada di dasar akuarium, berenang tidak beraturan, respon terhadap pakan lemah, perubahan warna
tubuh, tubuh membentuk huruf “C”, eksoptalmia pada mata, dan bukaan
13
Gambar 4 Gejala klinis ikan nila yang terinfeksi bakteri patogen
Streptococcus agalactiae-N14G
Variasi dan Jarak Genetik Lima Strain Ikan Nila
14
15
Gambar 6 Produk PCR-AFLP hasil running pada PAGE 8% lima strain nila; Keterangan: B = BEST, N = Nirwana, RN = Red-NIFI, S = Srikandi, G = GIFT
16
Tabel 3 Primer AFLP yang digunakan dan profil pita dari lima strain ikan nila polimorf. Pada hasil elektroforesis RAPD menggunakan primer OPA-20 ditemukan adanya alel spesifik yang berada pada posisi yang sama antara lokus strain Red-NIFI, Srikandi, dan GIFT, tetapi tidak ditemukan pada strain BEST dan Nirwana. Pada hasil elektroforesis AFLP menggunakan kombinasi primer EcoRI-ACG+MseI-CTG ditemukan alel spesifik yang berada pada posisi yang sama pada lokus strain BEST dan Nirwana, tetapi tidak ditemukan pada Red-NIFI, Srikandi, dan GIFT.
Dengan perkembangan marka molekular, kesamaan posisi alel pada beberapa strain dapat dikaji lebih lanjut sebagai keterpautan antara gen. Keterepautan tersebut dapat berfungsi untuk mendeteksi dan mengkarakterisasi lokus yang mengendalikan sifat kuantitatif ke dalam faktor genetik yang terkait (Paterson et al. 1988). Adanya kesamaan posisi alel pada strain-strain tertentu mungkin mengekspresikan suatu sifat tertentu yang berkaitan dengan sistem imun.
Jarak genetik merupakan tingkat perbedaan gen antara dua populasi yang biasa dihitung berdasarkan fungsi dari frekuensi alel. Jarak genetik dapat digunakan untuk memperkirakan waktu terjadinya pemisahan antar populasi dan dapat juga digunakan dalam membangun pohon filogenetik (Nei 1987). Berdasarkan hasil analisis RAPD, dengan menggunakan primer OPA-11 menunjukkan jarak genetik terdekat terjadi pada strain nila BEST dengan Nirwana dan BEST dengan GIFT yang memiliki jarak genetik sebesar 0.111 (Tabel 4).
Tabel 4 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik (diagonal bawah) menggunakan primer OPA-11
BEST Nirwana Red-NIFI Srikandi GIFT
BEST *** 0.889 0.848 0.788 0.889
Nirwana 0.111 *** 0.727 0.727 0.833
Red-NIFI 0.152 0.273 *** 0.800 0.848
Srikandi 0.212 0.273 0.200 *** 0.848
GIFT 0.111 0.167 0.152 0.152 ***
17 Tabel 5 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak
genetik (diagonal bawah) menggunakan primer OPA-15
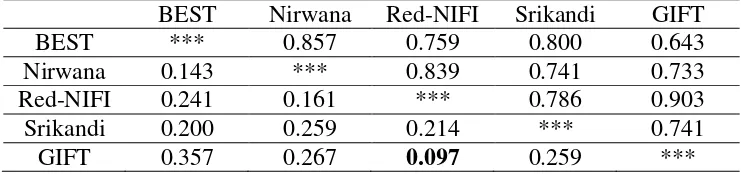
BEST Nirwana Red-NIFI Srikandi GIFT
BEST *** 0.857 0.759 0.800 0.643
Nirwana 0.143 *** 0.839 0.741 0.733
Red-NIFI 0.241 0.161 *** 0.786 0.903
Srikandi 0.200 0.259 0.214 *** 0.741
GIFT 0.357 0.267 0.097 0.259 ***
Analisis menggunakan primer OPA-16 menunjukkan jarak genetik terdekat terjadi pada strain nila BEST dengan Nirwana yang memiliki jarak genetik sebesar 0.130 (Tabel 6).
Tabel 6 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik (diagonal bawah) menggunakan primer OPA-16
BEST Nirwana Red-NIFI Srikandi GIFT
BEST *** 0.870 0.750 0.833 0.688
Nirwana 0.130 *** 0.696 0.783 0.645
Red-NIFI 0.250 0.304 *** 0.833 0.625
Srikandi 0.167 0.217 0.167 *** 0.688
GIFT 0.312 0.355 0.375 0.312 ***
Analisis menggunakan primer OPA-16 menunjukkan jarak genetik terdekat terjadi pada strain nila BEST dengan Nirwana yang memiliki jarak genetik sebesar 0.000 (Tabel 7).
Tabel 7 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik (diagonal bawah) menggunakan primer OPA-20
BEST Nirwana Red-NIFI Srikandi GIFT
18
Tabel 8 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik (diagonal bawah) dengan kombinasi primer EcoRI-ACG dan MseI-CTG
BEST Nirwana Red-NIFI Srikandi GIFT BEST *** 0.914 0.811 0.882 0.857 Nirwana 0.086 *** 0.895 0.857 0.833 Red-NIFI 0.189 0.105 *** 0.811 0.789 Srikandi 0.118 0.143 0.189 *** 0.914 GIFT 0.143 0.167 0.211 0.086 ***
Kombinasi primer EcoRI-ACC dan MseI-CTT menunjukkan jarak genetik terdekat terjadi pada strain nila BEST dengan Nirwana dengan nilai jarak genetik sebesar 0.000 (Tabel 9).
Tabel 9 Tingkat kemiripan genetik kelima sampel (diagonal atas) dan jarak genetik (diagonal bawah) dengan kombinasi primer EcoRI-ACC dan MseI-CTT
BEST Nirwana Red-NIFI Srikandi GIFT BEST *** 1.000 0.917 0.958 0.979 Nirwana 0.000 *** 0.917 0.958 0.979 Red-NIFI 0.083 0.083 *** 0.958 0.936 Srikandi 0.042 0.042 0.042 *** 0.979 GIFT 0.021 0.021 0.064 0.021 ***
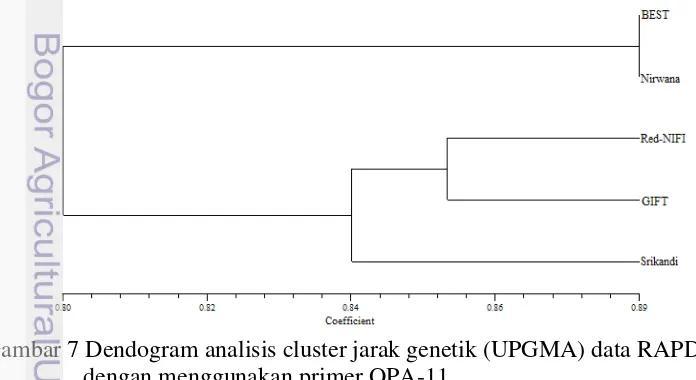
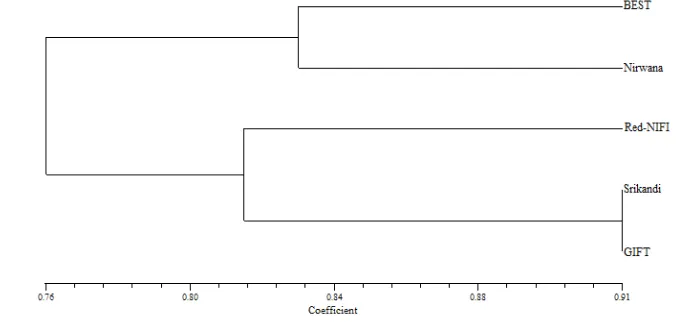
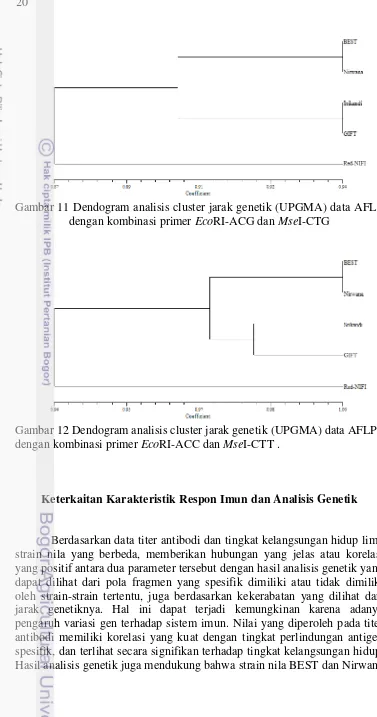
Berdasarkan hasil analisis jarak genetik menggunakan metode RAPD dan AFLP, diperoleh dendogram pohon filogeni yang menunjukkan kekerabatan dari kelima strain nila (Gambar 7-12). Hasil analisis RAPD terjadi variasi nilai jarak genetik dan posisi pada pohon filogeni dari kelima strain nila. Dendogram dari kedua metode tersebut menunjukkan bahwa strain BEST selalu berada pada klaster yang sama dengan Nirwana. Hasil analisis AFLP, menunjukkan bahwa strain BEST memiliki kekerabatan yang dekat dengan Nirwana, begitu pula dengan strain Srikandi yang berkerabat dekat dengan GIFT. Sedangkan strain Red-NIFI terpisah dari keempat strain nila lainnya karena memiliki nilai jarak genetik yang jauh.
19
Gambar 8 Dendogram analisis cluster jarak genetik (UPGMA) data RAPD dengan menggunakan primer OPA-15
Gambar 9 Dendogram analisis cluster jarak genetik (UPGMA) data RAPD dengan menggunakan primer OPA-16
20
Gambar 11 Dendogram analisis cluster jarak genetik (UPGMA) data AFLP dengan kombinasi primer EcoRI-ACG dan MseI-CTG
Gambar 12 Dendogram analisis cluster jarak genetik (UPGMA) data AFLP dengan kombinasi primer EcoRI-ACC dan MseI-CTT .
Keterkaitan Karakteristik Respon Imun dan Analisis Genetik
21 yang berada pada satu klaster memiliki sistem ketahanan tubuh yang rendah terhadap infeksi bakteri patogen, S. agalactiae.
SIMPULAN
Strain Red-NIFI memiliki ketahanan yang tinggi dalam hal resisten terhadap infeksi penyakit S. agalactiae, kemudian diikuti oleh GIFT dan Srikandi. Sementara dua strain lainnya, BEST dan Nirwana memiliki ketahanan yang rendah terhadap bakteri S. agalactiae. Eksplorasi dan integrasi parameter, yaitu diferensiasi leukosit, aktivitas lisozim, titer antibodi, dan tingkat kelangsungan hidup dalam penelitian ini mengungkapkan bahwa parameter tersebut dapat digunakan untuk membedakan sistem imun spesifik dan non-spesifik pada ikan nila. Korelasi yang kuat antara strain yang tahan maupun yang rentan terhadap infeksi bakteri S. agalactiae ditemukan pada hasil uji tantang dan kekerabatan analisis genetik berdasarkan alel spesifik dan jarak genetik.
DAFTAR PUSTAKA
Byun SO, Fang Q, Zhou H, Hickford JGH. 2009. An effective mothod for silver-staining DNA in large numbers of polyacrylamide gels. Anal
Biochem 385: 174-175.
Chinabut S, Limsuwan C, Kitsawat P. 1991. Histology of Walking Catfish,
Clarias batrachus. Thailand: AAHRI.
[DJPB] Direktorat Perikanan Budidaya. 2011. Ikan nila indukan unggulan. [terhubung berkala] http://www.perikanan-budidaya.kkp.go.id/ [28 Desember 2013].
Eldar A, Shapiro O, Bejerano Y, Bercovier H. 1995. Vaccination with whole-cell vaccine and bacterial protein extracts protects tilapia against Streptococcus difficile meningoencephalitis. Vaccine 13: 867– 870.
Evans JJ, Klesius PH, Glibert PM, Shoemaker CA, Sarawi AMA, Landsberg J, Duremdez R, Marzouk AA, Zenki AS. 2002. Characterization of beta-haemolytic Group B Streptococcus agalactiae
in cultured seabream, Sparus auratus (L.) and wild mullet, Liza
klunzingeri (Day), in Kuwait. Journal of Fish Diseases 25: 505–513.
Ferguson AJ, Taggart B, Prodohl PA, Meel OM, Thompson C, Stone C, McGinnity P, Hynes RA. 1995. The application of molecular markers to the study and conservation of fish population, with special reference to Salmo. J. Fish Biol. 47: 103-126.
Gustiano R, Arifin OZ, Nugroho E. 2008. Perbaikan pertumbuhan ikan nila
22
Homatowska A, Wajtaszek J, Adamowicz A. 2002. Haematological indices and circulating blood picture in the sunbleak, Leucaspius delineatus
(Heckel, 1843). Zoologica Poloniae 47:57-68.
Lacerda SMSN, Batlouni SR, Silva SBG, Homem CSP, Franca LR. 2006. Germ cells transplantation in fish: the Nile-tilapia model. Anim. Reprod. 3: 146-159.
Lusiastuti AM, Purwaningsih U, Sumiati T. 2010. Isolasi bakteriofaga anti
Streptococcus agalactiae dari ikan nila (Oreochromis niloticus).
Jurnal Riset Akuakultur 5:237-243.
Mulyasari. 2007. Beberapa teknik penentuan variasi genetik pada ikan untuk proses pemuliaan. Media Aquaculture 2: 37-40.
Nei M, Li W. 1979. Mathematical model for studying genetic variation in terms of restriction endonucleases. Proc. Natl. Acad. Sci. USA. 76: 5269-5273.
Paterson AH, Lander ES, Hewitt JD, Peterson S, Lincoln SE, Tanksley SD. 1988. Resolution of quantitative traits into Mendelian factors by using a complete linkage map of restriction fragment length polymorphisms.
Nature 335: 721-726.
Putra AN. 2010. Kajian Probiotik, Prebiotik dan Sinbiotik untuk Meningkatkan Kinerja Pertumbuhan Ikan Nila (Oreochromis niloticus) [tesis]. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Roberts RJ. 2001. Fish Pathology. London: W.B Sounders.
Stickney RR. 2000. Tilapia Culture: Encyclopedia of Aquaculture. New York: John Wiley & Sons.
Taukhid, Purwaningsih U. 2009. Penapisan isolat bakteri Streptococcus spp. sebagai kandidat antigen dalam pembuatan vaksin, serta efikasinya untuk pencegahan penyakit streptococciasis pada ikan nila,
Oreochromis niloticus. Jurnal Riset Akuakultur 6:103-118.
Tizard IR. 1987. Immunology: An Introduction. Philadelphia: Saunders College Pub.
Trewavas E. 1983. Tilapiine Fishes of the Genera Sarotherodon,
Oreochromis and Danakilia. London: British Museum.
Uribe C, Folch H, Enriquez R, Moran G. 2011. Innate and adaptive immunity in teleost fish. Veterinarni Medicina 56:486–503.
Vos P et al. 1995. AFLP: A New Technique for DNA Fingerprinting.
23
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 4 September 1988, merupakan putri pertama dari dua bersaudara pasangan Bapak Ir. H. Taukhid, M.Sc dan Ibu Hj. Kesih Mulyatin. Tahun 2006 penulis lulus dari SMA Negeri 5 Bogor dan melanjutkan pendidikan di Institut Pertanian Bogor, Fakultas Matematika dan Ilmu Pengetahuan Alam, Departemen Biologi melalui jalur penerimaan Undangan Seleksi Masuk IPB (USMI) dan lulus pada tahun 2011, dengan skripsi berjudul “Variasi Gen Cyt b Mitokondria pada Ikan
PENDAHULUAN
Latar Belakang
Ikan nila merupakan ikan air tawar yang tergolong dalam famili Cichlidae, genus Oreochromis, dengan nama spesies Oreochromis niloticus
(Trewavas 1983). Pada awalnya O. niloticus berasal dari hulu Sungai Nil di Uganda, kemudian menyebar luas ke seluruh dunia untuk tujuan budidaya (DJPB 2011). Di Indonesia, ikan nila pertama diimpor secara resmi dari Taiwan untuk tujuan penelitian dan budidaya pada tahun 1969 oleh Balai Penelitian Perikanan Budidaya Air Tawar Bogor (Gustiano et al. 2008).
Ikan nila merupakan jenis ikan yang mempunyai nilai ekonomis tinggi dan merupakan komoditas unggulan dalam bisnis ikan air tawar dunia, serta terus berkembang dengan prospek baik di Indonesia (Putra 2010). Kebutuhan benih ikan ini dari tahun ke tahun terus meningkat seiring dengan permintaan yang tinggi. Dalam upaya memenuhi kebutuhan masyarakat ini dapat dilakukan dengan intensifikasi budidaya. Perkembangan budidaya ikan yang baik harus ditunjang dengan peningkatan kualitas bibit yang dilakukan melalui seleksi dan mendatangkan strain baru yang berasal dari Filipina, Taiwan, dan Thailand; dan menghasilkan strain nila unggulan.
Dalam rangka menemukan strain nila unggulan, lembaga penelitian dan riset perguruan tinggi berusaha untuk meningkatkan kualitas genetik ikan nila. Saat ini telah dirilis beberapa strain nila oleh Kementerian Kelautan dan Perikanan untuk tujuan budidaya. BEST (Bogor Enhanced
Strain Tilapia) berhasil dikembangkan oleh Balai Penelitian Perikanan
Budidaya Air Tawar, Bogor. Nirwana (Nila Ras Wanayasa) telah dikembangkan oleh Balai Pengembangan Benih Ikan Air Tawar (BPBIAT), Wanayasa. Red-NIFI (National Inland Fishery Institute) diperoleh dari hasil persilangan beberapa spesies yang termasuk genus Oreochromis dan dikembangkan oleh Filipina. Srikandi (Nila Ras Sukamandi) telah dikembangkan oleh Balai Penelitian Pemuliaan Ikan (BPPI), Sukamandi. GIFT (Genetic Improvement for Farmed Tilapia) didapatkan dari hasil persilangan jenis nila yang dipilih dari Taiwan, Mesir, Thailand, Ghana, Singapura, Israel, Senegal, dan Kenya yang dikembangkan oleh
International Center for Living Aquatic Resources Management (ICLARM)
(DJPB 2011).
Potensi ikan nila sangat besar karena memiliki beberapa kelebihan antara lain: (i) mudah dipelihara, (ii) pertumbuhan yang relatif cepat, dan (iii) toleran terhadap kondisi perubahan air (Stickney 2000). Karakteristik-karakteristik inilah yang menjadikan ikan nila sebagai model ikan yang menarik untuk studi biologi perkembangan, termasuk yang terkait dengan biologi reproduksi (Lacerda et al. 2006).
2
tidak diimbangi dengan ketersediaannya, baik dari sisi kualitas maupun kuantitas. Hal ini menyebabkan populasinya terlalu padat dan memunculkan penyakit infeksi oleh bakteri yang dikenal dengan streptococcosis. Streptococcosis yang paling dominan disebabkan oleh bakteri Streptococcus
agalactiae. Jenis bakteri ini dapat menimbulkan kematian pada ikan nila
yang tinggi dalam berbagai ukuran, termasuk pada stadia benih (Taukhid et al. 2009). Streptococcosis menyebabkan 90% kematian dalam enam hari pasca injeksi. Gejala klinis pada ikan nila yang mengalami streptococcosis, pada saat sebelum mati terlihat seperti berenang lemah di dasar akuarium, berenang tidak beraturan, respon terhadap pakan lemah, perubahan warna
tubuh, tubuh membentuk huruf “C”, eksoptalmia pada mata, dan bukaan
operkulum lebih cepat (Eldar et al. 1995; Evans et al. 2002; Lusiastuti et al.
2010). Hasil penelitian yang dilakukan Taukhid dan Purwaningsih (2009) menemukan bahwa angka kematian dari streptococcosis pada dua strain nila (BEST dan Larasati) bervariasi antara 30-90% pada 14 hari pasca infeksi.
Ikan memiliki sistem imun yang sederhana dan berbeda dari vertebrata yang lebih tinggi. Sistem pertahanan ikan bersifat non-spesifik terdiri atas pertahanan humoral dan seluler. Sistem ini meliputi pertahanan mekanik dan kimiawi (mukus, kulit, sisik, dan insang) dan pertahanan seluler (sel makrofag, leukosit: monosit, netrofil, eosinofil, dan basofil). Mekanisme kekebalan non-spesifik merupakan kekebalan alamiah (innate
immunity) berupa pertahanan inang yang responnya tidak tergantung kontak
antigen tertentu. Sistem kekebalan spesifik (humoral dan seluler) tergantung pada kontak inang dengan antigen sebelumnya (adaptive immunity). Sistem pertahanan ikan akan terbentuk sempurna setelah ikan dewasa. Pada benih, sistem kekebalan tubuh ikan sudah terbentuk tetapi belum berfungsi dengan optimal. Namun demikian, tersedia sedikit atau mungkin tidak ada informasi dalam upaya untuk memperbaiki resistensi terhadap penyakit secara genetik pada pengembangan strain nila. Dengan kata lain, ada peluang terkait alasan mengapa genetik sistem imun pada beberapa strain nila terhadap infeksi bakteri berbeda-beda. Hal ini kemungkinan besar disebabkan karena berbagai latar belakang genetik strain nila yang berbeda dapat mempengaruhi pembentukan sistem imunnya.
Latar belakang genetik yang berbeda pada strain nila dapat mempengaruhi pembentukan sistem imun tersebut. Kisaran inang bakteri S.
agalactiae yang luas menuntut pentingnya informasi untuk mengetahui
mengenai latar belakang genetik munculnya sistem imun pada ikan nila.
Perumusan Masalah
3
Streptococcus agalactiae? Bagaimanakah keterkaitan antara sistem imun
dengan analisis genetik pada kelima strain nila tersebut?
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan karakterisasi sistem imun pada lima strain nila yang berbeda, yaitu BEST, Nirwana, Red-NIFI, Srikandi, dan GIFT dengan uji tantang terhadap bakteri patogen
Streptococcus agalactiae-N14G, serta melihat keterkaitan antara sistem
imun dengan analisis genetiknya.
Lima strain nila
Intensifikasi budidaya dan kepadatan populasi
Infeksi bakteri
Streptococcus agalactiae
Non-spesifik
Perbaikan mutu
Analisis genetik Spesifik
4
METODE
Waktu dan Tempat
Penelitian dilaksanakan pada Bulan Mei-Desember 2013 di Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor dan di Laboratorium Fungsi Hayati dan Perilaku Hewan Departemen Biologi FMIPA, IPB.
Ikan Uji
Lima strain nila yang digunakan adalah BEST, Nirwana, Red-NIFI, Srikandi, dan GIFT. Ukuran berat rata-rata ikan ± 15 gram/ekor. Semua strain nila diasumsikan bebas patogen khusus (specific pathogen free-SPF) terhadap patogen yang ditargetkan, berdasarkan pada hasil diagnosis bakteriologi dan titer antibodi sampel yang dilakukan secara acak dari masing-masing strain nila sebelum penelitian dilakukan. Ikan diberi makan tiga kali per hari menggunakan pakan komersial dengan kandungan protein kasar sekitar ± 28%. Pergantian air dilakukan setiap hari untuk membuang sisa pakan dan limbah metabolisme ikan.
Tahapan Penelitian
Ikan nila diaklimatisasikan selama empat belas hari dengan perlakuan yang sama. Hari pertama sebelum perlakuan uji tantang, dilakukan pengambilan sampel jaringan untuk analisis molekular dan sampel darah untuk pemeriksaan hematologi. Uji tantang dilakukan selama 21 hari dan pemeriksaan hematologi dari sampel darah dilakukan empat kali selama uji tantang, yaitu pada hari ke-0, 7, 14, dan 21.
Uji Tantang
5 dengan menginjeksikan bakteri aktif pada intra peritoneal (IP) sesuai dengan dosis lethal-50 (LD50) dari isolat. Menurut Taukhid dan Purwaningsih (2009) LD50 dari isolat S. agalactiae-N14G ditentukan dengan konsentrasi bakteri sebesar 103 cfu/ml.
Periode pengamatan uji tantang dilakukan selama 21 hari. Pengamatan perilaku, gejala klinis, dan persentase kematian dilakukan sampai masa akhir uji tantang. Sampling untuk parameter (diferensiasi leukosit, aktivitas lisozim, dan titer antibodi) dilakukan secara mingguan, pada pra-uji tantang, hari ke-7, 14, dan 21 setelah infeksi buatan.
Parameter
Parameter yang diukur dan diamati dalam penelitian ini terdiri dari (i) diferensiasi leukosit, (ii) aktivitas lisozim, (iii) titer antibodi, dan (iv) tingkat kelangsungan hidup dengan detail penjelesannya sebagaimana berikut:
Diferensiasi Leukosit
Diferensiasi leukosit merupakan salah satu indikator yang umum digunakan sebagai profil hematologi dalam kaitannya dengan sistem imun non-spesifik pada ikan. Sampel darah diambil dari vena caudalis
menggunakan jarum no. 25 non-heparinized dan diteteskan ke permukaan kaca objek, dan dibuat preparat ulas. Preparat ulas difiksasi dengan metanol 95 % selama 10 menit. Preparat diwarnai dengan merendamnya dalam Giemsa selama 30 menit. Jumlah limfosit, monosit, dan neutrofil dihitung dalam bidang pandang mikroskop sampai berjumlah total 100 sel.
Aktivitas Lisozim
Lisozim adalah konstituen umum dari jaringan biologis dan sekresi, yang banyak ditemukan dalam serum ikan, dan merupakan indikator umum yang digunakan sebagai uji untuk sistem imun non-spesifik pada ikan (Uribe
et al. 2011). Setelah darah diambil dari ikan, darah disimpan pada suhu
ruang selama dua jam, kemudian pada lemari es (4°C) selama 24 jam. Serum kemudian dimurnikan melalui sentrifugasi pada 5000 rpm (rotation
per minute) selama tiga menit. Uji aktivitas lisozim dilakukan dengan
6
Titer Antibodi
Titer antibodi adalah pengukuran antibodi ikan yang mengenali antigen tertentu. Titer antibodi dinyatakan dengan kebalikan dari pengenceran terbesar yang masih memberikan hasil positif. Teknik aglutinasi langsung (direct agglutination) digunakan untuk mengukur titer antibodi yang hasilnya dapat dibaca secara visual. Sebanyak 0.1 ml serum ikan dimasukkan ke dalam sumur pertama, seri pengenceran dilakukan ke dalam 12 sumur menggunakan larutan phosphate buffered saline (PBS). Kemudian 20 µl bakteri S. agalactiae ditambahkan ke dalam semua sumur. Serum dan antigen dicampurkan secara merata (homogenisasi) dengan perlahan-lahan, kemudian diinkubasi pada suhu 37°C selama dua jam dan disimpan dalam lemari es selama 24 jam. Aglutinasi (reaksi antigen antibodi) diamati menggunakan mikroskop dengan pembesaran 100-400 dengan mengamati ada/tidaknya “agglutinins” yang ditandai dengan penggumpalan serum sebagai indikator bahwa serum tersebut mengandung antibodi terhadap S. agalactiae.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup atau tingkat kematian adalah istilah yang digunakan untuk menunjukkan kemampuan ikan bertahan hidup atau mati dalam suatu populasi karena suatu kejadian. Dalam penelitian ini, tingkat kelangsungan hidup diamati setiap hari, kemudian dijumlahkan pada akhir periode uji tantang.
Analisis DNA
Ekstraksi DNA
Isolasi DNA menggunakan metode phenol chloroform dengan cara jaringan sebanyak 5-10 mg dalam alkohol, dicuci dengan menambahkan tris-EDTA (pH 8) 0.5 ml kemudian dipisahkan melalui proses sentrifugasi pada kecepatan 5000 rpm selama 5 menit sebanyak dua kali ulangan. Penghancuran jaringan dilakukan dengan menambahkan bufer salt tris
EDTA (pH 8) 0.3 ml sambil digerus. Penghancuran protein dilakukan dengan menambahkan enzim Proteinase K 10 µl dan 10% sodium duodesil
sulfat 50 µl, kemudian diinkubasi pada suhu 55°C selama satu jam. Material
7 Molekul DNA disuspensikan dalam bufer 80% tris-EDTA (pH 8) 0.1 ml dan disimpan dalam suhu 4ºC untuk digunakan lebih lanjut.
Amplifikasi DNA
Amplifikasi DNA dilakukan dengan menggunakan metode Random
Amplified Polymorphic DNA (RAPD), primer yang digunakan adalah
OPA-11, OPA-15, OPA-16, dan OPA-20 (Tabel 1). Proses amplifikasi menggunakan komposisi reaksi: DNA 1 µl, primer 1 µl, PCR Master Mix
12.5 µl, dan H2O 10.5 µl; dengan total volume 25 µl. selanjutnya dimasukkan dalam thermocycler dengan satu siklus denaturasi 94ºC selama 1 menit, annealing pada suhu 36ºC selama 1 menit, elongasi pada suhu 72ºC selama 2.5 menit, dan elongasi akhir pada suhu 72ºC selama 7 menit.
Tabel 1 Primer-primer yang diujicobakan pada sampel DNA Nama Primer Urutan Nukleotida (5’→ 3’)
OPA-11 CAA TCG CCG T
OPA-15 TTC CGA ACC C
OPA-16 AGC CAG CGA A
OPA-20 GTT GCG ATC C
Amplifikasi DNA dilakukan dengan menggunakan metode Amplified
Fragment Length Polymorphism (AFLP) mengikuti protokol baku yang
dilakukan oleh Vos et al. (1995). Pemotongan ruas DNA menggunakan dua enzim restriksi, yaitu EcoRI yang mengenali AATTC dan MseI yang mengenali TAA. Genom DNA sebanyak 10 µl ditambahkan EcoRI 1 µl, buffer EcoRI 1,1 µl, MseI 1 µl, dan buffer MseI 1,2 µl, kemudian diinkubasi pada suhu 37ºC selama 24 jam. Hasil pemotongan sebanyak 5 µl diligasi dengan T4 ligase sebanyak 0,2 µl ke adaptor EcoRI (5’ -CTCGTAGACTGCGTACC dan CATCTGACGCATGGTTAA-5’) dan adaptor MseI (5’-GACGATGAGTCCTGAG dan
TACTCAGGACTCAT-5’) masing-masing 2 µl yang sebelumnya dipanaskan hingga suhu 95ºC. Sebagai upaya praseleksi untuk amplifikasi awal, digunakan adaptor dengan
menambahkan satu nukleotida di ujung 3’.
Visualisasi Perbanyakan ruas DNA
Produk PCR sebanyak 2 µl kemudian dimigrasikan dalam
polyacrylamide gel electrophoresis (PAGE) 8% menggunakan bufer 1x tris
8
HASIL DAN PEMBAHASAN
Diferensiasi Leukosit
Diferensiasi leukosit merupakan salah satu indikator yang umum digunakan sebagai profil hematologi dalam kaitannya dengan sistem imun non-spesifik pada ikan. Hasil penelitian menunjukkan bahwa masing-masing strain nila menunjukkan variabilitas dalam proporsi leukosit (limfosit, monosit, dan neutrofil).
Peningkatan atau penurunan jumlah komponen leukosit tidak ditemukan adanya perbedaan yang signifikan pada strain nila yang berbeda. Namun, secara umum menunjukkan bahwa penurunan jumlah limfosit ditemukan pada semua strain nila di hari ke-7 pasca uji tantang, di sisi lain, peningkatan jumlah terjadi pada kedua komponen, monosit dan neutrofil. Pada hari ke-14 pasca uji tantang, penurunan jumlah komponen limfosit terjadi pada Nirwana dan Srikandi; Namun, kondisi terbalik di BEST, Red-NIFI, dan GIFT diamati pada komponen monosit. Pada akhir periode pengamatan (hari ke-21 pasca uji tantang); pengecualian untuk Red-Nifi, proporsi leukosit cenderung kembali pada kondisi normal, sebagaimana pra uji tantang (Gambar 1).
Gambar 1 Diferensiasi leukosit lima strain ikan nila yang diuji tantang bakteri S. agalactiae-N14G; Keterangan: H0 = Hari ke-0, H7 = Hari ke-7, H14 = Hari ke-14, H21 = hari ke-21
Penurunan jumlah limfosit pada hari ke-7 pasca uji tantang kemungkinan terjadi karena akting dari sel-sel limfosit pada tahap awal infeksi, dan proliferasi sel menjadi limfosit B dan limfosit T. Hal ini sebagai jenis mekanisme bawaan yang muncul sebelum aktivitas limfosit T spesifik dan pembentukan antibodi. Jumlah dan persentase komposisi leukosit dalam
9 sirkulasi darah ikan secara signifikan tergantung pada beberapa faktor seperti kondisi kesehatan, infeksi patogen, dan faktor stres (Homatowska et al. 2002). Sel yang terlibat dalam sistem kekebalan tubuh terdiri dari dua jenis limfosit, yaitu limfosit B dan limfosit T. Aktivitas tertentu dari sel T pada ikan belum diketahui dengan jelas namun peran utamanya adalah pada sel imunitas. Sel B berperan dalam produksi imunoglobulin melalui stimulasi antigen spesifik dan immunoglobulin yang diproduksi oleh limpa (Uribe et al. 2011).
Proporsi komponen monosit secara dramatis meningkat pada hari ke-7 pasca uji tantang, dan sedikit menurun pada hari ke-14 dan ke-21 pasca uji tantang, dengan pengecualian untuk BEST di hari ke-14 pasca uji tantang. Hal ini menjelaskan bahwa semua strain nila tidak menunjukkan kecenderungan secara signifikan terhadap proporsi monosit selama pengamatan. Peningkatan jumlah monosit pada tahap awal infeksi diduga terkait dengan fungsi utama dari sel-sel ini sebagai sel fagosit. Monosit adalah sel makrofag dan berfungsi sebagai fagosit "memakan" benda asing dan menginformasikan kepada sistem kekebalan tubuh untuk bertindak lebih lanjut. Proporsi monosit ikan sekitar 0,1% pada leukosit, dengan pengecualian jika ada benda asing dalam darah atau sirkulasi (Roberts 2001). Oleh karena itu, peningkatan persentase monosit jelas sebagai akibat infeksi
S. agalactiae.
Pada saat aktivasi, kapasitas fagositik monosit lebih kuat daripada sel-sel granulosit lain, dan itu akan menjadi aktor dari komponen penting dalam pertahanan tuan rumah melalui serangkaian proses fagositosis. Sel neutrofil adalah jenis leukosit yang meninggalkan kapiler darah selama infeksi akut dan peradangan (Ferguson et al. 1995). Jumlah persentase neutrofil kecil dibandingkan dengan limfosit dan sel-sel monosit, hal ini mungkin terjadi karena migrasi besar-besaran dari sel ke situs infeksi.
Sel darah putih (leukosit) merupakan komponen penting dalam sistem kekebalan tubuh ikan, terdapat dua jenis leukosit, yaitu granulosit dan agranulosit. Granulosit terdiri dari eosinofil, neutrofil, dan basofil; dan agranulosit terdiri dari limfosit, monosit, dan trombosit (Chinabut et al.
1991).
Aktivitas Lisozim
10
Gambar 2 Aktivitas lisozim lima strain nila yang diuji tantang bakteri S.
agalactiae-N14G; Keterangan: H0 = Hari ke-0, H7 = Hari ke-7,
H14 = Hari ke-14, H21 = hari ke-21
Data yang diperoleh adalah merupakan suatu respon yang cepat dari sistem imun non-spesifik ikan yang diuji terhadap bakteri gram (+), S.
agalactiae. Tingkat penurunan kekeruhan (pengamatan 30 detik dan 4,5
menit pencampuran) adalah ukuran relatif dari jumlah lisozim yang terdapat dalam sampel; semakin banyak lisozim yang dimiliki, semakin cepat reaksi terjadi, dan semakin cepat absorbansi menurun. Penurunan aktivitas lisozim juga dicatat setelah 4,5 menit pencampuran di hari ke-7 dan hari ke-14 pasca uji tantang, sebaliknya, nilai aktivitas lisozim setelah 30 detik dan 4,5 menit pencampuran meningkat selaras pada hari ke-21 pasca uji tantang, hal tersebut diduga karena intensitas infeksi bakteri menurun dan tingkat aktivitas lisozim berkurang.
Lisozim merupakan enzim bacteriolytic yang didistribusikan secara luas ke seluruh tubuh dan merupakan bagian dari mekanisme pertahanan non-spesifik di sebagian besar hewan, termasuk ikan. Sumber utama lisozim adalah monosit/makrofag dan neutrofil. Tindakan bakterisida enzim ini melibatkan hydrolyzation dari peptidoglikan dinding sel bakteri yang mengakibatkan lisis sel. Secara khusus, lisozim menambahkan air (menghidrolisis) ke ikatan glikosidik antara N-acetylmuramic acid (NAM) dan N-asetilglukosamin (NAG). Hal ini disebabkan oleh enzim hidrolitik yang mampu memotong dinding sel gram (+) dan beberapa gram (-) bakteri. Lisozim adalah konstituen umum dari jaringan biologi dan sekresi, telah ditemukan dalam serum ikan, dan merupakan indikator yang digunakan sebagai uji untuk sistem imun non-spesifik pada ikan (Uribe et al. 2011). Aktivitas tinggi dari lisozim menunjukkan bahwa sistem kekebalan tubuh non-spesifik ikan telah diaktifkan, terutama dalam hal terdapat infeksi bakteri. Hasil uji aktivitas lisozim selama pengamatan menunjukkan masing-masing strain memiliki variabilitas dalam aktivitas lisozim.
11 Titer Antibodi
Antibodi merupakan hasil dari sistem imun yang bertujuan untuk melawan benda asing (antigen) yang masuk pada tubuh ikan. Antibodi adalah sistem imun spesifik terhadap antigen tertentu. Level tertinggi titer antibodi adalah pengenceran 1:512 pada hari ke-14 pasca uji tantang pada Red-NIFI (Tabel 2).
Tabel 2 Titer antibodi lima strain Ikan Nila pada pra uji tantang, hari ke-7, 14, dan 21 pasca uji tantang bakteri S. agalactiae-N14G
Sampling Strain Pengenceran
Keterangan: (+) = terjadi aglutinasi, (±) = aglutinasi rendah, (-) = tidak terjadi aglutinasi
Dengan pengecualian untuk Red-NIFI; tingkat titer antibodi tertinggi pada setiap strain nila terjadi: (i) pada pengenceran 1:8 untuk BEST dan Srikandi pada hari ke-7 pasca uji tantang, (ii) pengenceran 1:64 untuk GIFT pada hari ke-14 pasca uji tantang, pengenceran 1:32 untuk Srikandi pada hari ke-14 dan 21 pasca uji tantang, dan (iii) pengenceran 1:256 untuk GIFT pada hari ke-21 pasca uji tantang. Titer antibodi merupakan indikator untuk mengukur tingkat reaksi antigen-antibodi. Nilai titer antibodi merupakan indikator bahwa ikan terinfeksi dengan jenis antigen tertentu.
12
Tingkat Kelangsungan Hidup
Rata-rata tingkat kelangsungan hidup pada akhir studi lima jenis yang berbeda dari ikan nila berkisar antara 0-60% (Gambar 3).
Gambar 3 Rata-rata tingkat kelangsungan hidup lima strain Ikan Nila selama 21 hari uji tantang terhadap infeksi bakteri S. agalactiae-N14G Tingkat kelangsungan hidup terendah (0%) ditemukan pada strain BEST dan Nirwana. Tingkat kelangsungan hidup tertinggi (60%) ditemukan pada strain Red-NIFI dan GIFT, Srikandi (50%).
Jenis infeksi S. agalactiae pada ikan nila adalah sub-akut dengan masa inkubasi tiga minggu. Gejala klinis streptococcosis pada ikan nila menunjukkan seperti berenang lemah dan berada di dasar akuarium, berenang tidak beraturan, respon terhadap pakan lemah, perubahan warna
tubuh, tubuh membentuk huruf “C”, eksoptalmia pada mata, dan bukaan
13
Gambar 4 Gejala klinis ikan nila yang terinfeksi bakteri patogen
Streptococcus agalactiae-N14G
Variasi dan Jarak Genetik Lima Strain Ikan Nila
14
15
Gambar 6 Produk PCR-AFLP hasil running pada PAGE 8% lima strain nila; Keterangan: B = BEST, N = Nirwana, RN = Red-NIFI, S = Srikandi, G = GIFT