MEKANISME ANTIMIKROBA PLANTARISIN DARI
Lactobacillus plantarum IIA-1A5 TERHADAP Escherichia coli
DAN APLIKASINYA SEBAGAI PENGAWET BAKSO
KRISTOFORUS WILSON KIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Mekanisme Antimikroba Plantarisin dari Lactobacillus plantarum IIA-1A5 Terhadap E. coli dan Aplikasinya Sebagai Pengawet Bakso adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
KRISTOFORUS WILSON KIA. Aktivitas Antimikroba Plantarisin dari Lactobacillus plantarum IIA-1A5 Terhadap Escherichia coli dan Aplikasinya Sebagai Pengawet Bakso. Dibimbing oleh IRMA ISNAFIA ARIEF, CAHYO BUDIMAN, dan CECE SUMANTRI.
Plantarisin IIA-1A5 adalah senyawa peptida yang dihasilkan oleh bakteri asam laktat (BAL) Lactobacillus plantarum IIA-1A5 yang memiliki aktivitas antimikroba. Tujuan dari penelitian ini adalah untuk menganalisis aktivitas antibakteri plantarisin IIA-1A5 terhadap Escherichia coli dan aplikasi sebagai preservatif dalam bakso. SDS-PAGE menunjukkan bobot molekul plantarisin IIA-1A5 adalah 6.41 kDa.
Berdasarkan uji antagonis menggunakan metode kertas cakram, plantarisin IIA-1A5 menunjukkan kemampuan untuk menghambat E. coli. Penghambatan disebabkan kemampuan plantarisin IIA-1A5 untuk mengganggu membran sel yang sebanding dengan butanol, tapi lebih baik daripada etanol, kloroform, metanol, heksana, dan SDS. Hasil ini didukung oleh uji kebocoran sel yang menunjukkan terjadinya pelepasan materi protein dan genetik dari E. coli yang diberi perlakukan plantarisin IIA-1A5.
Pengujian mikrobiologi bakso menunjukkan bahwa penggunaan plantarisin dari L. plantarum IIA-1A5 mampu menghambat pertumbuhan bakteri patogen E. coli, S. aureus dan Salmonella. Penghambatan mungkin disebabkan oleh keberadaan plantarisin yang dihasilkan oleh L. plantarum IIA-1A5. Kualitas mikrobiologi bakso hingga penyimpanan 20 jam dalam suhu ruang, masih sesuai dengan Standar Nasional Indonesia (SNI 01-3818-1995) untuk bakso.
SUMMARY
KRISTOFORUS WILSON KIA. Antibacterial activity of Plantaricin from Lactobacillus plantarum IIA-1A5 Against Escherichia coli and Its Application In Meatballs As Preservatives Agent. Supervised by IRMA ISNAFIA ARIEF, CAHYO BUDIMAN and CECE SUMANTRI.
Plantaricin IIA-1A5 is a peptide compounds produced by lactic acid bacteria (LAB) Lactobacillus plantarum IIA-1A5 exhibiting antimicrobial activity. The purpose of this study is to analyze the antibacterial activity of plantaricin IIA-1A5 against Escherichia coli and its aplication as presertvative in meat ball. 15% SDS-PAGE showed the molecular site of plantaricin IIA-1A5 was 6.41 kDa.
Based on the antagonistic test using paper disc method, plantaricin IIA-1A5 demonstrated remarkable ability to inhibit E. coli. Inhibition might be due to ability of plantaricin IIA-1A5 to distrupt cell membrane which is comparable to that of butanol, but better than that of ethanol, chloroform, methanol, hexana, and SDS. This result is supported by cell leakage test that demonstrated releasing of proteinaceous and genetic materials from E. coli treated by plantaricin IIA-1A5.
Meatballs microbial test showed that introduction of L. plantarum could inhibit the growth of pathogenic bacteria E. coli, S. aureus and Salmonella. The inhibition might be caused by the pressence of plantaricin produced by L. plantarum IIA-1A5. Addition plantaricin in the meatball products also affect the physical properties of meatballs and according to Indonesian National Standard (SNI 01-3818-1995) for meatballs.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Produksi dan Teknologi Peternakan
MEKANISME ANTIMIKROBA PLANTARISIN DARI
Lactobacillus plantarum IIA-1A5 TERHADAP Escherichia coli
DAN APLIKASINYA SEBAGAI PENGAWET BAKSO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Mekanisme Antimikroba Plantarisin dari Lactobacillus plantarum IIA-1A5 Terhadap Escherichia coli dan Aplikasinya Sebagai Pengawet Bakso
Nama : Kristoforus Wilson Kia NIM : D151110161
Disetujui oleh Komisi Pembimbing
Dr Irma Isnafia Arief, SPt Msi Ketua
Cahyo Budiman, SPt MEng PhD Anggota
Prof Dr Ir Cece Sumatri, MAgr Sc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Produksi dan Teknologi Peternakan
Dr Ir Salundik, Msi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2012 ini ialah antimikroba, dengan judul Mekanisme Antimikroba Plantarisin dari Lactobacillus plantarum IIA-1A5 Terhadap E. coli dan Aplikasinya Sebagai Pengawet Bakso.
Terima kasih penulis ucapkan kepada Dr. Irma Isnafia Arief S.Pt M.Si, Cahyo Budiman, SPt MEng PhD dan Prof Dr Ir Cece Sumantri, MAgr Sc selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada Dwi Febriantini selaku Analis di Laboratorium Terpadu Fakultas Peternakan IPB, yang telah membantu selama pelaksanaan penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 4
2 METODE 4
Bahan 4
Alat 4
Prosedur Analisis Data 4
3 HASIL DAN PEMBAHASAN 8
Purifikasi Plantarisin IIA-1A5 8
Analisis Kerusakan Sel E. coli Oleh Plantarisin IIA-1A5 10 Uji Antagonistik Plantarisin Terhadap Bakteri E. coli 10 Efek Deterjen dan Pelarut Organik Serta Plantarisin IIA-1A5 terhadap
Kerusakan Sel E. coli 10
Hasil Pengujian N-acetyl glucosamine 10
Hasil Pengujian Asam Lipoteikoat 11
Analisis Perubahan Morfologi Sel E. coli Menggunakan Scanning Elctron
Microscope 11
Mekanisme Kerja Plantarisin IIA-1A5 12
Analisis Kualitas Mikrobiologi dan Fisik Bakso yang Ditambahkan
Plantarisin IIA-1A5 15
Kualitas Mikrobiologi Bakso Selama Penyimpanan 15
Kualitas Fisik Bakso Selama Penyimpanan 17
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 22
DAFTAR TABEL
1 Diameter zona hambat plantarisin terhadap bakteri E. coli 10 2 Efek deterjen, pelarut organik dan plantarisin terhadap kerusakan
dinding sel E. coli 11
3 Kualitas Mikrobiologi Bakso Daging menggunakan Bahan Pengawet
Berbeda Selama Penyimpanan Suhu Kamar 16
4 Efek deterjen, pelarut organik dan plantarisin terhadap kerusakan
dinding sel E. coli 17
DAFTAR GAMBAR
1 Dendogram pohon filogenik BAL 3
2 Profil SDS PAGE plantarisin IIA-1A5 9
3 Perubahan morfologi sel E. coli yang diberikan plantarisin 12 4 Mekanisme bakteriosin menempel pada membran sel bakteri 13 5 Mekanisme plantarisin merusak dinding sel bakteri dengan model
„barrel-stave‟ 14
6 Mekanisme plantarisin merusak dinding sel bakteri dengan model
1
PENDAHULUAN
Latar Belakang
Seiring dengan berkembangnya industri pangan, bakteri asam laktat (BAL) telah dimanfaatkan secara luas sebagai kultur starter untuk berbagai ragam fermentasi daging, susu, dan sayuran. Cleveland et al. (2001) menyatakan bahwa BAL telah digunakan sebagai kultur starter untuk memproduksi bermacam-macam produk susu dan aman untuk dikonsumsi, GRAS (Generally Recognized as Safe). Pada awalnya penggunaan BAL pada produk pangan bertujuan untuk memberikan citarasa pada suatu produk, tetapi ternyata BAL juga mempunyai efek pengawetan pada produk yang dihasilkan, sehingga saat ini berkembang penerapan BAL dan senyawa yang dihasilkan oleh BAL, dengan tujuan pengawetan baik pada produk fermentasi maupun pada produk non fermentasi. Kemampuan BAL sebagai pengawet disebabkan karena BAL mampu menghasilkan senyawa antimikroba yang dapat menghambat pertumbuhan berbagai mikroba.
Fardiaz (1992) menjelaskan bahwa senyawa antimikroba adalah senyawa kimiawi atau biologis yang dapat menghambat pertumbuhan dan aktivitas mikroba. Keberadaan antimikroba dalam bahan pangan dapat terjadi secara alamiah di dalam bahan pangan, ditambahkan secara sengaja ke dalam makanan, dan terbentuk selama pengolahan atau hasil sintesis mikroorganisme yang tumbuh selama fermentasi pangan. Selain itu dijelaskan juga, bahwa senyawa antimikroba dapat bersifat bakteriosidal (membunuh bakteri), bakteriostatik (menghambat pertumbuhan bakteri) dan germisidal (menghambat germinasi spora bakteri). Produk metabolit dari BAL yang bersifat antimikroba antara lain asam organik, hidrogen peroksida, karbondioksida, diasetil, dan bakteriosin.
Bakteriosin merupakan suatu senyawa protein yang memiliki sifat bakterisidal terhadap bakteri Gram positif dan Gram negatif. Pada awalnya bakteriosin diketahui hanya menghambat pertumbuhan bakteri yang berkerabat dekat dengan sel produser (filogenik), tetapi pada saat ini beberapa jenis bakeriosin menunjukkan spektrum yang lebih luas. Bakteriosin yang dihasilkan oleh BAL sangat menguntungkan bagi industri pangan karena aktivitasnya mampu menghambat pertumbuhan bakteri pembawa penyakit yang biasanya terdapat pada makanan (Gonzales et al. 1996). Menurut Cotter et al. (2005) bakteriosin merupakan peptida ribosomal yang diproduksi oleh satu strain bakteri, yang mempunyai sifat antagonistik terhadap strain bakteri lain, tetapi strain penghasil bakteriosin itu sendiri dilindungi dari aktivitas bakteriosin tersebut.
Galvez et al. (2007) menyatakan bahwa bakteriosin merupakan ribosomal peptida atau protein antimikroba hasil translasi dari satu atau lebih gen pengkode peptida tersebut.
2
bakteri antagonis yang heterogen, mulai dari ukuran molekul beberapa ribu Dalton sampai pada struktur protein kompleks yang mungkin mengandung gugus karbohidrat atau lipid.
Salah satu jenis bakteriosin adalah plantarisin yang secara spesifik disintesis oleh kelompok bakteri gram positif Lactobacillus plantarum dan mempunyai kemampuan untuk menghambat pertumbuhan dan membunuh kelompok bakteri gram negatif yang bersifat patogen (Gong et al. 2010; Abo-Amer, 2007). Beberapa karakteristik yang dimiliki plantarisin yaitu umumnya berukuran kecil, termostabil, dan bersifat kationik atau hidrofobik (Holo et al. 2001). Hata et al. (2010) juga menyatakan bahwa senyawa antimikroba ini bersifat tidak toksik bagi manusia, mudah didegradasi oleh enzim proteolitik, dan tidak membahayakan mikroflora usus karena mudah dicerna oleh enzim-enzim pencernaan, serta stabil terhadap perubahan pH dan suhu.
Arief et al. (2011) telah berhasil mengisolasi beberapa strain L. plantarum baru yang dinotasikan sebagai L. plantarum 1A5, 1B1, 2B2, dan 2C12 (Gambar 1). Kelima strain L. plantarum menunjukkan kemampuan penghambatan terhadap kelompok bakteri patogen. Kemampuan ini diduga berasal dari antimikroba plantarisin yang disintesis oleh L. plantarum tersebut. Strain 1A5 telah dilaporkan sebagai isolat indegenus dari daging sapi di Indonesia (Arief et al. 2012,) sehingga plantarisin terduga (putative plantaricin) yang disintesis dari strain 1A5, dinotasikan sebagai plantarisin IIA-1A5, bisa dikategorikan sebagai plantarisin indigenus. Plantarisin IIA-1A5 mempunyai kemampuan dalam menghambat pertumbuhan bakteri patogen seperti Escherichia coli, Staphylococcus aureus, Bacillus cereus, dan Salmonella typhimurium. Hasil tersebut membuktikan bahwa plantarisin IIA-1A5 memiliki karakteristik yang baik sebagai antimikroba dan potensial untuk dikembangkan ketahap aplikasi (Arief et al. 2012). Pemanfaatan bakteriosin seperti plantarisin IIA-1A5 sebagai biopreservatif alami yang mengandung senyawa antimikroba diharapkan dapat merusak atau menghambat pertumbuhan bakteri patogen, sehingga dapat memperpanjang masa simpan suatu prodak makanan.
Perumusan Masalah
3 selama ini sudah tersedia dan terpublikasikan akan digunakan sebagai pembanding dalam studi ini.
Gambar 1 Dendogram pohon filogenik isolat BAL dengan bootstrap dan disejajarkan dengan sekuens yang sudah terdapat di Genbank (Arief, 2011).
Tujuan Penelitian
4
Manfaat Penelitian
Sebagai informasi mengenai jenis bakteriosin yang dihasilkan oleh bakteri indigenus Indonesia, yaitu plantarisin yang dihasilkan oleh L. Plantarum. Selain itu sebgai sumber informasi mengenai alternatif bahan pengawet alami yang dapat digunakan pada produk bakso yang bersifat aman untuk dikonsumsi.
2
METODE
Bahan
Bahan-bahan yang digunakan dalam penelitian ini diantaranya adalah isolat Lactobacillus plantarum IIA-1A5 dan bakteri indikator, yaitu E. coli ATCC 25923. Mueller Hinton Agar (MHA), NaOH 1 N, bufer potassium phosphate, etanol 20%, akrilamida, 1.5 M Tris-HCl pH 8.8, 1.5 M Tris HCl pH 6.8, 10% SDS, 10% ammonium persulfate (APS), tetramethylethylenediamine (TEMED), low molecular weight marker proteins, loading dye, comassie briliant blue (CBB), dan asam asetat 10 % (v/v).
Alat
Alat yang digunakan dalam penelitian ini meliputi alat-alat gelas, ose, timbangan analitik, mikro pipet, laminar air flow, Heidolph VV micro evaporator, spektrofotometer UV-VIS, mikroskop, pH meter, vortex, oven, membran dialisis, bunsen, sudip, Bio-Rad mini-protean dan Bio-Rad power supply, minitube, kolom kromatografi pertukaran kation HiTrap SP XL 5 mL (GE Healthcare UK), SEM (merk JEOL model JSM-5310LV).
Purifikasi Plantarisin
Purifikasi parsial dengan menggunakan amonium sulfat (Hata et al. 2010) Sebanyak 1 L media MRSB ditambahkan yeast extract 3% yang telah diinokulasi dengan 10% kultur L. plantarum IIA-1A5, diinkubasi, dan disimpan pada refrigerator selanjutnya disentrifugasi. Sentrifugasi dilakukan dengan
kecepatan 10000 rpm selama 20 menit pada suhu 4˚C untuk mendapatkan
supernatan bebas sel (SBS). Pada masing-masing ulangan supernatan ditambah amonium sulfat sambil dihomogenkan perlahan-lahan sampai penjenuhan 90%
pada suhu 4˚C.
Dialisis (Hata et al. 2010)
Presipitat bakteriosin yang telah didapat selanjutnya didialisis dengan menggunakan membran dialisis berdiameter 20 µm dan konsentrasi bufer potasium fosfat selama 12 jam untuk menghilangkan amonium sulfat yang
5 Konsentrasi protein dari plantarisin hasil dialisis diamati menggunakan spektofotometer UV-VIS pada panjang gelombang 280 nm.
Purifikasi menggunakan kromatografi kolom (Hata et al. 2010)
Kolom HiTrap SP XL 5 mL dipasang pada penjepit kaki tiga. Kolom dibilas dengan aquabidest dan bufer potasium fosfat pH 6.8 masing-masing tiga kali volume kolom untuk membersihakn kolom. Sampel plantarisin hasil dialisis dimasukkan ke dalam kolom dan dibagian bawah ditampung dalam tabung steril masing-masing 5 mL. Larutan elusi dimasukkan untuk mengambil protein yang terikat pada gel dan bagian yang ditampung atau dikoleksi adalah plantarisin murni. Konsentrasi plantarisin hasil kromatografi diukur dengan menggunakan spektofotometer UV-VIS pada panjang gelombang 280 nm.
Elektroforesis sodium dodecyl sulfatePoly Acrilamid Gel(SDS PAGE) (Hata
et al. 2010)
Elektroforesis dilakukan untuk mengetahui protein plantarisin murni hasil fraksinasi dengan melihat massa molekul protein dari tiap-tiap fraksi. Elektroforesis SDS PAGE ini menggunakan konsentrasi polyacrilamide 5% pada stacking gel (gel penggertak) dan 15% pada resolving gel (gel pemisah). Pita yang muncul dibandingkan dengan marker dan diukur sehingga diketahui bobot molekul protein dan fraksi yang mengandung plantarisin murni.
Analisis Kerusakan Sel Bakteri oleh Plantarisin IIA-1A5
Uji antagonistik plantarisin terhadap bakteri Escherichia coli ATCC 25922 (Harimurti et al. 2007)
Bakteri E. coli disegarkan pada NB sebanyak tiga kali ulangan (triplo) dan diinkubasi selama 24 jam. Kultur selanjutnya diinokulasi dalam media nutrient agar (NA) sehingga konsentrasinya menjadi 108 cfu mL-1 (dibandingkan dengan larutan standar McFarlan). Kultur dipipet sebanyak 0.5 mL dan diencerkan dengan 4.5 mL NaCl 0.85% sehingga konsentrasinya menjadi 107 cfu mL-1. Sebanyak 100 µL kultur disebarkan pada media muller hilton agar (MHA). Sampel pada fraksi yang mengandung plantarisin murni diteteskan pada paper disc steril sebanyak 50 µL lalu diletakkan di atas inikulan mikroba uji (E. coli).
Efek deterjen dan pelarut organik serta plantarisin IIA-1A5 terhadap kerusakan sel E. coli (Atrih et al. 2001)
6
nilai absorbansi awal dan akhir dinilai sebagai protein sel E. coli yang keluar dari dalam sel akibat kerusakan membran sel.
Pengaruh adanya asam lipoteikoat terhadap penyerapan plantarisin (Atrih et al. 2001)
Asam lipoteikoat yang telah dipurifikasi (2 mg) dibuat dari S. aureus, ditambahkan 2.6 mL suspensi sel E. coli (108 cfu mL-1). Plantarisin ditambahkan pada konsentrasi akhir sebesar 160 AU mL-1 diinkubasikan selama 40 menit pada
suhu 30˚C. Setelah itu sentrifugasi (15000X g, selama 10 menit), cairan supernatan diukur menggunakan spektrofotometer pada panjang gelombang 550 nm. Hasil pengukuran dinilai sebagai sisa plantarisin yang tidak terabsorbsi. Analisis N-acetyl-glucosamine (Atrih et al. 2001)
Pelet L. plantarum disiapkan sebanyak 250 mg, larutan plantarisin dibuat dengan konsentrasi 40 ug mL-1 dalam total volume 3 mL. Pelet diresuspensi dengan 3 mL cairan plantarum, dilarutkan kemudian diinkubasi pada suhu 37 selama 1 jam, sentrifugasi pada kecepatan 7000 rpm suhu 4˚ C selama 10 menit, lalu dipisahkan pelet dan supernatan dan didapat P1 (pelet1) dan S1 (supernatan 1). Setelah pelet didapat, 3 mL H2O destilasi yangg steril ditambahkan ke pelet, kemudian diresuspensi dengan pipeting hingga larut, disentrifugasi 7000 rpm,
pada suhu 4˚ C, selama 10 menit, kemudian dipisahkan pelet dan supernatan dan
didapat P2 (pelet2) dan S2 (supernatan 2). Absorbansi supernatan diukur padapanjang gelombang 550 nm. Untuk kontrol tidak digunakan plantarisin tetapi buffer. Perhitungan level akumulasi sebagai berikut:
N-acetyl glukosaamine = absorbansi S2 - absorbansi 550
Analisis perubahan morfologi sel bakteri dengan menggunakan scanning electron microscope (SEM)
7 Aplikasi Bakteriosin Plantarisin IIA-1A5 pada Produk Bakso
(Arief et al. 2012) kantong steril, dan disimpan pada suhu kamar, kemudian dilakukan analisis terhadap kualitas mikrobiologis pada 0, 5, 10, 15, dan 20 jam.
Analisis mikrobiologis bakso
Lima gram sampel bakso disuspensikan ke dalam 45 ml NaCl 0.85% (w/v) steril. Analisis mikrobiologi dilakukan dengan pour plate method menggunakan eosyn methylen blue agar (EMBA) untuk uji E. coli, baird-parker agar (BPA) untuk S. aureus, dan media xylose-lisine-deoxycholate (XLD) agar untuk Salmonella. Digunakan pengenceran 10-1 sampai 10-3 pada semua pengujian.
Sampel diinkubasi selama 24 jam pada suhu 37˚C (AOAC 2005).
Analisis kualitas fisik bakso
Sampel bakso sebanyak 5 g diambil lalu diukur pH menggunakan pH-meter dengan cara menusukkan elektroda pH-meter ke dalam sampel selama beberapa detik, kemudian nilai pH sampel dicatat. (AOAC, 2005). Aktivitas air diukur menggunakan aw-meter Novasine.
Analisis Data
Rancangan dan Analisis Data (Mattjik dan Sumertajaya 2002)
Rancangan yang digunakan dalam analisis efek pelarut organik, detergen dan plantarisin IIA-1A5 terhadap kerusakan sel E. coli penelitian ini adalah rancangan acak lengkap (RAL)
Yij = µ +
τ
i + εijKeterangan :
Yij : Rata-rata hasil diantar perlakuan dari parameter pada perlakuan ke-i dengan ulangan ke-j.
µ : Rata-rata pengamatan.
τ
i : Pengaruh perlakuan ke-iεij : Galat percobaan pada perlakuan ke-i dan ulangan ke-j
Pada pengujian kualitas mikrobiologi bakso rancangan yang digunakan dalam analisi adalah RAL faktorial.
8
Keterangan :
Yij : Variabel respon akibat perlakuan penambahan pengawet ke-i (Nitrit, plantarisin IIA-1A5 dan kontrol) dan lama penyimpanan ke-j (0, 5, 10, 15, dan 20 jam) pada ulangan ke-k (1, 2, 3).
CPijk : Pengaruh interaksi antara penambahan pengawet ke-i (Nitrit, plantarisin IIA-1A5, dan kontrol) dan lama penyimpanan ke-j (0, 5, 10, 15, dan 20 jam), pada ulangan ke-k (1,2,3).
Eijk : Pengaruh galat penambahan pengawet ke-i (Nitrit, plantarisin IIA-1A5, dan kontrol) dan lama penyimpanan ke-j (0, 5, 10, 15, dan 20 jam) paa ulangan ke-k (1,2,3).
Pengujian antagonistik plantarisin terhadap E. coli menggunakan uji t.
3
HASIL DAN PEMBAHASAN
Purifikasi Plantarisin IIA-1A5
Plantarisin IIA-1A5 dipurufikasi dari 1L kultur cair L. plantarum IIA-1A5
yang ditumbuhkan pada suhu suhu 30˚C selama 24 jam. Supernatan bebas sel
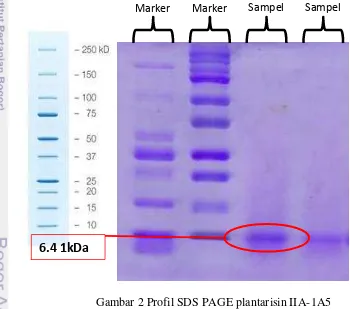
9 Tahap purifikasi berikutnya menggunakan kromatografi pertukaran ion. Pemisahan komponen dengan kromatografi dilakukan dalam suatu kolom yang diisi dengan fase stasioner dan cairan sebagai fase gerak untuk mengetahui banyaknya komponen sampel yang keluar sehingga didapatkan plantarisin murni dengan konsentrasi protein yang berbeda. Elektroforesis SDS-PAGE dilakukan untuk mengetahui bobot molekul plantarisin IIA-1A5. Protein yang terdenaturasi sempurna akan mengikat SDS dalam jumlah yang setara dengan berat molekul protein. Denaturasi protein dilakukan dengan merebus sampel dalam bufer yang mengandung -merkapetanol (berfungsi untuk mereduksi ikatan disulfida), gliserol, dan SDS (Wilson dan Walker 2000). SDS akan mengikat protein dan menambah muatan negatif semua protein dalam sampel meskipun sampel protein berada dalam titik isoelektrik (Suzuki dan Terada 1988). Bobot molekul plantarisin IIA-1A5 yang diperoleh berdasarkan elektroforesis SDS-PAGE adalah 6.41 kDa (Gambar 1). Berdasarkan bobot molekulnya plantarisin IIA-1A5 termasuk jenis bakteriosin kelas IIa. Bakteriosin kelas II berukuran kecil (<10 kDa) dan bersifat relatif stabil terhadap panas (Zacharof dan Lovitt 2012).
Gambar 2 Profil SDS PAGE plantarisin IIA-1A5
Marker Marker Sampel Sampel
10
Analisis Kerusakan Sel Bakteri oleh Plantarisin IIA-1A5
Uji antagonistik plantarisin terhadap bakteri E.coli
Pengujian aktivitas antimikroba ini dilakukan dengan mengukur diameter zona hambat plantarisin terhadap pertumbuhan E. coli menggunakan metode cakram. Plantarisin IIA-1A5 memiliki zona hambat yang besar terhadap pertumbuhan E. coli (Tabel 1).
Tabel 1 Diameter zona hambat plantarisin terhadap bakteri E. coli
Perlakuan Diameter zona hambat (mm)
Kontrol 0.00±0.00a
Ampisilin 14.82±0.82c
Plantarisin 10.25±1.80b
Keterangan : angka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%
Aktivitas antimikroba bakteriosin ditunjukkan dengan terbentuknya zona hambat bening dan zona yang berbeda dari area cawan sekitar cawan yang ditumbuhi oleh bakteri indikator yang digunakan (Sapatnekar et al. 2010). Besarnya diameter zona hambat plantarisin IIA-1A5 terhadap E. coli berkisar antara 7.34 sampai 13.84 mm.
Efek deterjen dan pelarut organik serta plantarisin IIA-1A5 terhadap kerusakan sel E. coli
Kemampuan larutan organik, deterjen serta plantarisin IIA-1A5 dalam merusak dinding sel E. coli dapat dilihat pada Tabel 2. Kemampuan perusakan dinding dilihat pada besarnya nilai absorbansi yang mengindikasikan adanya kekeruhan sebagai akibat keluarnya materi sel bakteri.
Tabel 2 Efek deterjen, pelarut organik dan plantarisin terhadap kerusakan dinding sel E. coli
Pelarut Absorbansi λ 280 Absorbansi λ 260
Buffer fosfat 1.02 ± 0.01d 1.55 ± 0.02s
Plantarisin IIA-1A5 12.69 ± 0.85c 13.11 ± 1.44r
Keterangan : angka-angka pada kolom yang sama diikuti oleh huruf yang berbeda menunjukkan beda nyata pada taraf uji 5%.
11 serta lebih baik daripada deterjen, yaitu SDS. Hasil absorbansi plantarisin IIA-1A5 pada 260 nm lebih besar dibandingkan dengan absorbansi 280 nm. Hal ini berarti lebih banyak materi genetik yang keluar dari sel dibandingkan dengan protein dan hal serupa juga terjadi pada aseton, butanol dan kloroform. Plantarisin IIA-1A5 mempunyai mekanisme yang sama dengan pelarut organik seperti aseton, butanol dan kloroform tetapi berbeda dengan larutan deterjen Triton X-100.
Hasil Pengujian N-acetyl glucosamine
Pengujian N-acetyl glucosamine menggunakan bakteri indikator S. aureus menunjukkan hasil yang positif dimana semakin tinggi nilainya maka semakin banyak N-acetyl glucosamine yang terlepas ke supernatan. Perbandingan kedua bakteri menunjukkan bahwa perbedaan jumlah glucosamine pada S. aureus (Gram positif) lebih banyak daripada jumlah N-acetyl glucosamine pada E. coli (Gram negatif). Jumlah N-acetyl glucosamine pada pengujian menggunakan E. coli dapat dikatakan tidak terdeteksi, hal ini karena jumlahnya yang terlalu sedikit. Selain itu juga daya hambat plantarisin terhadap kedua jenis bakteri berbeda, Daya hambat plantarisin pada S. aureus lebih baik dibandingkan dengan E. coli.
Penempelan plantarisin pada S. aureus lebih bagus disebabkan oleh adanya reseptor asam lipoteikoat (ALT) yang banyak terdapat pada bakteri Gram positif, sehingga penempelan plantarisin ke S. aureus lebih baik dibandingkan E. coli yang tidak mempunyai ALT sehingga kemungkinan penempelan plantarisin pada sel E. coli kecil. Bakteri Gram positif mempunyai lapisan peptidoglikan yang tebal yang secara domianan tersusun oleh asam lipoteikoat. ALT merupakan target spesifik yang memudahkan bakteriosin terserap ke dalam dinding sel bakteri Gram positif (Kjos et al. 2011).
Hasil Pengujian asam lipoteikoat
Pada pengujian S. aureus tanpa menggunakan ALT hasil pengukuran jumlah plantarisin yang berada pada supernatan sebanyak 60%. Hal ini menunjukkan bahwa 40% plantarisin terserap ke dinding sel S.aureus secara alami tanpa adanya ALT. Hasil pengujian penyerapan plantarisin ke dinding sel S. aureus dengan adanya ALT menunjukkan sisa plantarisin pada supernatan sebanyak 50%. Hal ini berarti ALT meningkatkan penyerapan plantarisin ke dinding sel S. aureus menjadi 60%. Hasil pengujian terhadap bakteri E. coli menunjukkan bahwa tanpa adanya ALT sisa plantarisin di supernatan sebesar 75%. Dengan demikian plantarisin yang terserap hanya sebesar 25% dan pada pengujian menggunakan ALT sisa plantarisin yang berada di supernatan sebanyak 23% dan plantarisin yang terserap sebanyak 77%.
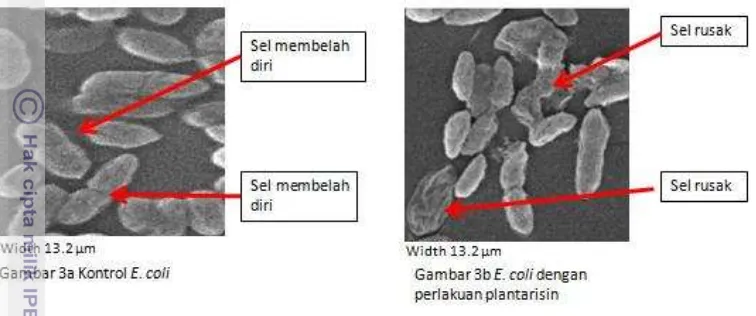
Perubahan morfologi sel bakteri menggunakan scanning electron microscope
(SEM)
12
plantarisin ke dalam dinding sel yang mengakibatkan terjadinya tekanan dari dalam sel yang menyebabkan terjadi kerusakan sel.
Gambar 3. Perubahan morfologi sel E. coli yang diberikan plantarisin.
Hasil penelitian serupa juga ditemukan oleh Ultee et al. (2002) yang mengamati efek sinergi dari carvacrol (asam lemah) dan cymene (senyawa non polar) terhadap Bacillus cereus, menurutnya kerusakan sel bakteri oleh senyawa antibakteri menyebabkan pembengkakan sel akibat adanya akumulasi dari senyawa antibakteri lalu diikuti dengan kebocoran dan kematian sel. Jawetz et al. (1996) menyatakan kerusakan pada dinding sel atau terhambatnya sintesis dinding sel oleh antibakteri mengakibatkan lissi pada sel. Pada lingkungan hipertonik kerusakan dinding sel mengakibatkan terbentuknya protoplast (bakteri Gram positif) atau sferoplast (bakteri Gram negatif). Kondisi ini menyebabkan sel membengkak, membran terdesak ke arah dinding sel dan mengakibatkan sel pecah.
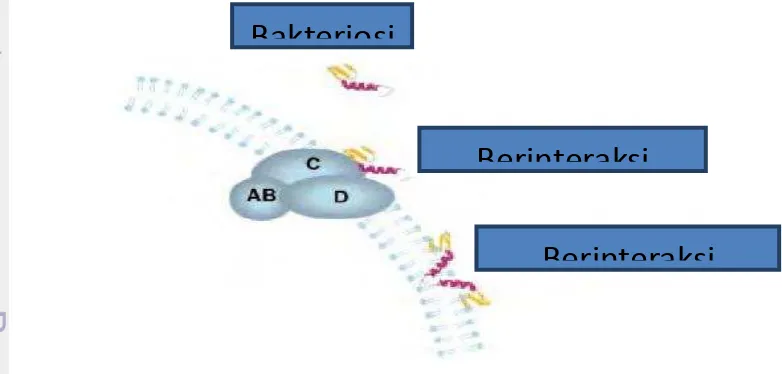
Mekanisme Kerja Plantarisin IIA-1A5
13 terganggu maka substansi yang terdapat di dalam sel akan lolos dari sel sehingga menimbulkan kerusakan atau kematian sel (Drider et al. 2006).
Langkah awal dari kerja plantarisin adalah penempelan molekul plantarisin pada membran spesifik (reseptor) atau membran non spesifik (Gambar 4). Ketika membran sel bakteri telah rusak maka akan menyebabkan keluarnya materi protein dan genetik. Kerusakan sel bakteri akibat penggunaan senyawa antibakteri dapat pula diakibatkan oleh rusaknya ikatan hidrofobik komponen penyusun membran sel, seperti protein, fosfolipid serta larutnya komponen-komponen yang berikatan secara hidrofilik dan hidrofobik (Kim et al. 1995). Keadaan ini meningkatkan permeabilitas membran sel, sehingga memudahkan masuknya komponen antibakteri ke dalam sel serta keluarnya substansi sel seperti protein dan asam nukleat yang menyebabkan kerusakan sel (Yuk et al. 2005).
Bakteriosin memiliki efek yang berbeda terhadap bakteri uji, seperti penggunaan leukonosin S (Lewus et al. 1992) dan plantarisin C19 (Atrih et al. 2001) yang memiliki efek bakteriostatik. Sifat bakteriostatik pada bakteriosin ditunjukkan berdasarkan pengamatan menggunakan absorbansi-UV tidak terdeteksi adanya pelepasan materi sel (Atrih et al. 2001). Beberapa bakteriosin dilaporkan memiliki aktivitas bakterisidal seperti bakteriosin PsVP-10 (Padilla et al. 2002), plantarisin C dari L. plantarum LL441 (Gonzalez et al. 1994), dan plantarisin L-1 (Zhou et al. 2007). Pada efek bakterisidal bakteriosin akan membentuk pori-pori nonselektif pada membran sel yang dapat mengakibatkan keluarnya materi atau isi sel, sehingga mengakibatkan kematian pada sel tersebut.
Gambar 4 Mekanisme bakteriosin menempel pada membran sel bakteri (Drider et al. 2006)
Secara umum bakteriosin asal BAL memiliki kemampuan melawan bakteri lain dengan efek bakterisidal. Mekanisme aktivitas bakterisidal beberapa bakteriosin secara umum sebagai berikut : (1) molekul bakteriosin mengalami kontak langsung dengan membran sel, (2) proses kontak ini mampu mengganggu potensial membran berupa destabilitas membran sitoplasma sehingga sel menjadi tidak kuat, (3) ketidakstabilan membran mampu memberikan dampak
Berinteraksi
Bakteriosi
14
pembentukan lubang atau pori pada membran sel melalui proses gangguan terhadap PMF (Proton Motive Force) (Gonzalez et al. 1996).
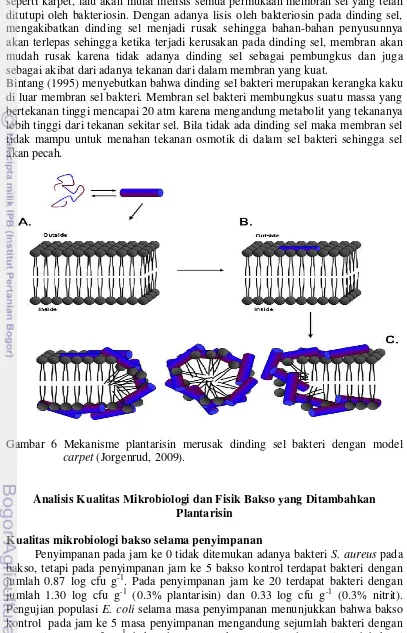
Pemberian plantarisin-IIA1A5 menunjukkan adanya efek bakterisidal yang ditunjukkan oleh hasil pengamatan melalui absorbansi-UV, dimana terjadi kekeruhan sebagai akibat adanya materi sel (ion, protein dan materi genetik) dari dalam membran (Tabel 1). Kemampuan plantarisin dalam merusak membran sel dapat ditunjukkan melalui dua mekanisme yaitu model barrel-stave (Gambar 5) dan model karpet (Gambar 6).
Mekanisme plantarisin dalam merusak membran sel bakteri dengan model
„Barrel-stave‟ dimulai dengan menyerap struktur heliks dari bakteriosin ke membran sel melalui daerah hidrofobik, sementara daerah hidrofilik secara bebas berinteraksi dengan pelarut. Setelah bakteriosin mencapai batas konsentrasi, bakteriosin akan membentuk pori-pori pada membran dengan permukaan hidrofobik yang menghadap ke luar dan permukaan hidrofilik yang menghadap ke dalam, yang mengakibatkan kebocoran pada sel. Pada awal penempelan bakteriosin ke permukaan membran, bakteriosin akan membentuk pori kecil, setelah itu pori akan semakin membesar sebagai akibat adanya bakteriosin yang masuk ke dalam sel sehingga yang dapat mengakibatkan keluarnya materi sel dari dalam membran dan terjadi kematian pada sel.
Gambar 5 Mekanisme plantarisin merusak dinding sel bakteri dengan model barrel-stave (Jorgenrud, 2009).
Drider et al. (2006) menyatakan bahwa kebocoran yang terjadi akibat pembentukan lubang pada membran sitoplasma ditunjukkan oleh adanya aktivtas keluar masuknya molekul-molekul seluler. Kebocoran yang terjadi berdampak pada penurunan gradient pH seluler. Secara umum, pengaruh pembentukan lubang sitoplasma sebagai dampak adanya bakteriosin, menyebabkan terjadinya perubahan gradient potensial membran dan pelepasan melekul intraseluler maupun masuknya substansi ekstraseluler (lingkungan). Efeknya menyebabkan pertumbuhan sel terhambat dan menghasilkan proses kematian pada sel yang sensitif terhadap bakteriosin.
15 seperti karpet, lalu akan mulai melisis semua permukaan membran sel yang telah ditutupi oleh bakteriosin. Dengan adanya lisis oleh bakteriosin pada dinding sel, mengakibatkan dinding sel menjadi rusak sehingga bahan-bahan penyusunnya akan terlepas sehingga ketika terjadi kerusakan pada dinding sel, membran akan mudah rusak karena tidak adanya dinding sel sebagai pembungkus dan juga sebagai akibat dari adanya tekanan dari dalam membran yang kuat.
Bintang (1995) menyebutkan bahwa dinding sel bakteri merupakan kerangka kaku di luar membran sel bakteri. Membran sel bakteri membungkus suatu massa yang bertekanan tinggi mencapai 20 atm karena mengandung metabolit yang tekananya lebih tinggi dari tekanan sekitar sel. Bila tidak ada dinding sel maka membran sel tidak mampu untuk menahan tekanan osmotik di dalam sel bakteri sehingga sel akan pecah.
Gambar 6 Mekanisme plantarisin merusak dinding sel bakteri dengan model carpet (Jorgenrud, 2009).
Analisis Kualitas Mikrobiologi dan Fisik Bakso yang Ditambahkan Plantarisin
Kualitas mikrobiologi bakso selama penyimpanan
16
diberi perlakuan plantarisin jumlah populasi E. coli 1.31 log cfu g-1 pada penyimpanan jam ke 20.
Abdelbasset (2008) menyatakan bahwa bakteriosin yang diproduksi dari bakteri asam laktat menunjukkan aktivitas anti mikroba yang dapat menghambat pertumbuhan bakteri Gram negatif E. coli. Analisis populasi Salmonella sp. pada bakso selama penyimpanan 20 jam dalam suhu ruang menunjukkan hasil yang negatif. Kemampuan plantarisin IIA-1A5 dalam menghambat pertumbuhan E. coli sesuai dengan penelitian Abdelbasset (2008), Arief et al. (2012), dan Arief et al. (2013). E. coli telah dikenal sebagai bakteri pembusuk makanan, termasuk bakso (Gunes et al. 2012).
Tabel 3 Kualitas mikrobiologi bakso daging menggunakan bahan pengawet berbeda selama penyimpanan suhu kamar
E. coli Kontrol 0.00+0.00f 2.41+0.10d 2.82+0.10c 3.49+0.10b 4.19+0.10a (log cfu/g) Nitrit 0.3% 0.00+0.00f 0.00+0.00f 0.00+0.00f 0.00+0.00f 0.33+0.10e Plantarisin 0.3% 0.00+0.00f 0.00+0.00f 0.00+0.00f 0.30+0.01e 1.31+0.10e
Salmonella Kontrol Negatif Negatif Negatif Negatif Negatif
(log cfu/g) Nitrit 0.3% Negatif Negatif Negatif Negatif Negatif Plantarisin 0.3% Negatif Negatif Negatif Negatif Negatif
Keterangan : angka-angka pada kolom yang sama diikuti oleh huruf yang sama tidak berbeda nyata pada taraf uji 5%.
Keberadaan Salmonella pada daging sapi cendurung tinggi (Erol, 1999; Heredia et al, 2001; Zhao et al, 2002; Siriken, 2004). Namun, dalam penelitian ini, Salmonella tidak terdeteksi (negatif) pada bakso hingga penyimpanan selama 20 jam di suhu ruang, baik dengan adanya bahan pengawet (nitrit dan plantarisin) maupun pada bakso yang tidak diberikan pengawet (kontrol). Salmonella pada produk daging sapi biasanya berasal dari kontaminasi silang dari sumber eksternal (pekerja, lingkungan, peralatan, dan sebagainya) (Siriken et al. 2009). Hasil negatif Salmonella dalam percobaan ini mungkin disebabkan oleh sanitasi persiapan bakso yang bebas dari Salmonella dan dipengaruhi oleh proses perebusan bakso.
17 Secara keseluruhan analisis mikrobiologi bakso menunjukkan kemampuan yang baik dari plantarisin IIA-1A5 dalam menghambat bakteri patogen (E. coli, S. aureus, Salmonella) hingga bakso yang disimpan aman untuk dikonsumsi.
Kualitas fisik bakso selama penyimpanan
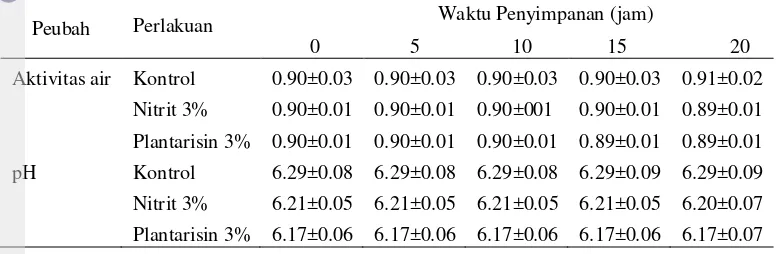
Kandungan air dalam bahan makanan memengaruhi daya tahan bahan makanan terhadap serangan mikroba. Kandungan air tersebut dinyatakan dengan istilah aw (water activity), yaitu jumlah air bebas yang dapat digunakan oleh mikroorganisme untuk pertumbuhannya. Aktivitas air pada bakso ditunjukkan pada Tabel 3. Pada penelitian ini bakso yang ditambahkan plantarisin memiliki aktivitas air yang rendah pada jam ke 15 dan jam ke 20 masa penyimpanan, sedangkan penambahan nitrit pada bakso menunjukkan penurunan aktivitas air pada penyimpanan jam ke 20.
Ray (2010) menyatakan bahwa dengan adanya penurunan aktivitas air merupakan kondisi yang baik untuk menghambat pertumbuhan bakteri dalam makanan. Penurunan aktivitas air pada bahan makanan dapat dilakukan dengan cara menambahkan padatan, ion, koloid hidrofilik, pembekuan dan pengeringan. Tabel 3 menunjukkan pH pada bakso selama masa penyimpanan setelah diberikan perlakuan berbeda. Setelah 20 jam penyimpanan, nilai pH pada semua perlakuan stabil dan relatif sama, dengan kisaran nilai pH antara 6.17 samapi 6.29. Bakso yang ditambahkan plantarisin mengalami penurunan nilai aw pada jam ke 15 dari 0.90 menjadi 0.89, sedangkan penambahan nitrit pada bakso menunjukkan penurunan aktivitas air pada penyimpanan jam ke 20.
Tabel 4 Kualitas Fisik Bakso Daging menggunakan Bahan Pengawet Berbeda Selama Penyimpanan Suhu Kamar
Peubah Perlakuan Waktu Penyimpanan (jam)
0 5 10 15 20
Aktivitas air Kontrol 0.90±0.03 0.90±0.03 0.90±0.03 0.90±0.03 0.91±0.02
Nitrit 3% 0.90±0.01 0.90±0.01 0.90±001 0.90±0.01 0.89±0.01
Plantarisin 3% 0.90±0.01 0.90±0.01 0.90±0.01 0.89±0.01 0.89±0.01
pH Kontrol 6.29±0.08 6.29±0.08 6.29±0.08 6.29±0.09 6.29±0.09
Nitrit 3% 6.21±0.05 6.21±0.05 6.21±0.05 6.21±0.05 6.20±0.07
Plantarisin 3% 6.17±0.06 6.17±0.06 6.17±0.06 6.17±0.06 6.17±0.07
Hasil pengujian kualiatas mikrobiologi dan fisik dapat dilihat bahwa plantarisin IIA-1A5 dapat digunakan sebagai bahan tambahan pada produk bakso sebagai pengawet. Plantarisin IIA-1A5 yang dihasilkan oleh bakteri asam laktat dapat mengalami degradasi oleh enzim proteolitik dalam pencernaan manusia sehingga tidak membahayakan bagi kesehatan manusia. Selain itu plantarisin
IIA-1A5 memiliki kestabilan terhadap pengaruh suhu pasteurisasi (80˚C selama 30 menit) dan sterilisasi (121˚C selama 15 menit) (Arief et al. 2013).
18
jika digunakan pada industri yang melibatkan kondisi panas maupun dingin pada proses produksinya sehingga dapat digunakan dalam proses di industri pangan yang biasanya melibatkan pengaturan suhu dan pH.
4
SIMPULAN DAN SARAN
Simpulan
Purifikasi plantarisin IIA-1A5 menghasilkan peptida dengan ukuran berat molekul 6.41 kDa. Plantarisin IIA-1A5 mempunyai aktivitas antimikroba terhadap E. coli dengan mekanisme merusak permeabilitas membran sel yang mengakibatkan materi protein dan genetik keluar dari sel. Plantarisin IIA-1A5 menunjukkan aktivitas bakterisidal dengan spektrum yang luas. Penggunaan plantarisin efektif sebagai pengawet pada bakso daging sapi
Saran
19
DAFTAR PUSTAKA
Abdelbassed, Mechai, Djamila K. 2008. Antimicrobial Activity of Autochthonous Lactic Acid Bacteria Isolated From Algerian Traditional Fermented Milk
„Raib‟. African J. of Biotech. 7: 2908-2914.
Abo-Amer AE. 2007. Characterization of a bacteriosin-like inhibitory subtance produced by Lactobacillus plantarum isolated from egyptian home-made yogurt. J. Sci. Asia 33: 313-319.
[AOAC] Association of Official Analytical Chemists. 2005. Official Methods of Analysis of AOAC International. 18th ed. Assoc. Off. Anal. Chem, Arlington.
Arief II. 2011. Karakteristik Bakteri Asam Laktat Indigenus Asal Daging Sapi sebagai Probiotik dan Identifikasinya dengan Analisis Urutan Basa Gen 16S rRNA. (disertasi). Bogor (ID): Institut Pertanian Bogor.
Arief II, Jenie BSL, Suryati T, Ayuningtias G, Fuziawan A. 2012. Antimicrobial activity of bacteriocin from indigenous Lactobacillus plantarum 2c12 and its application on beef meatball as biopreservative J.Indonesian trop.anim.agric. 37 : 90-96.
Arief II, Jakaria, Suryati T, Wulandari Z, Andreas E. 2013. Isolation and Characterization of Plantaricin Produced by Lactobacillus plantarum Strains (IIA-1A5, IIA-1B1, IIA-2B2). Bogor (ID). J Med Petern. 36: 91-100.
Atrih A, Rekhif N, Moir AJG, Lebrihi A, Lefebvre G. 2001. Mode of Action, Purification and Amino Acid Sequence of Plantaricin C19, and Anti-Listeria Bacteriocin Produced by Lactobacillus plantarum C19. Sheffield (GB). IJF Microbiol. 86: 93-104.
Bintang, M. 1995. Studi Antimikroba dari Streptococcus Lactis [disertasi]. Bandung : Institut Teknologi Bandung.
[BSN] Bandan Standarisasi Nasional. 1995. Standar Nasional Indonesia 01-3818-1995. Bakso Daging. Jakarta.
Chandra AB. 2013. Isolasi dan Karakterisasi Plantarisin Dari Lactobacillus plantarum S34 Sebagai Inhibitor RNA Helikase Virus Hepatitis C. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Cleveland J, Montville TJ, Nes IF, Chikindas ML. 2001. Bacteriocins : Safe, Natural Antimicrobials for Food Preservation. Inter J. of Food Microb. 71: 1-20.
Cotter PD, Hill C, Ross RP (2005). Batceriocins: Developing innate immunity for food. Nat. Rev. Microbiol. 3:777-788.
Davidson PM, Branen AL. 1993. Antimicrobial in Food. 2nd Edition. Resised and Expanded. Marcel Dekker Inc., New York.
Delves-Broughton, J. 1990. Nisin and its uses as a food preservative. Food Technol. 100–112.
Drider D, Fimland G, Hechard Y, McMullen H, Prevost. 2006. The continuing Story of Class IIa Bacteriosins. Microbiology and molecilar Biology Reviews : 562-582.
20
Fardiaz, S. 1992. Mikrobiologi Pangan. Jakata, Gramedia.
Fuller R. 1992. Probiotics The Scientific Basic. Tokyo: Chapman & Hall.
Galvez A, Abrio H, Lopez RL, Omar NB. 2007. Bacteriocin based strategis for food biopreservation. International Journal of Food Microbiology 120 (2007): 51-70.
Gong HS, Meng XC, Wang H. 2010. Plantaricin MG active againts Gram-negative bacteria produced by Lactobacillus plantarum KLDS1.0391
isolated from “Jiaoke”, a traditional fermented cream from China. Food
Control. 21: 89-96.
Gonzales B, Arca P, Mayo B, Suares JE. 1994. Detection, purification and characterization of plantaricin C, a bacteriocin produced by a Lactobacillus plantarum strain of dairy origin. App. Environ. Microbiol. 60: 2158-2163.
Gunes H. and Schuller B. 2012. Dimensional and Continuous Analysis of Emotions for Multimedia Applications: a Tutorial Overview. In Proceedings of the 20th ACM International Conference on Multimedia, MM 2012, Nara, Japan. ACM, ACM.
Gonzales BE, Glaasker E, Kunji ERS, Driessen AJM, Suarez JE, Onings WN.K. 1996. Bactericidal mode of Action of Plantaricin S. Appl Environ Microbiol 62 : 2701-2709.
Harimurti S, Rahayu AS, Nasroedin, Kurniasih. 2007. Lactic Acid Bacteria Isolated from the Gastro-Intestinal Tract of Chicken: Potential Use as Probiotic. Yogyakarta (ID). J Anml Product. 9: 82-91.
Hata T, Rie T, Sadahiro O. 2010. Isolation and Characterization of Plantaricin ASM 1 : A New Bacteriocin Produced by Lactobacillus plantarum A-1. Tokyo (JP). IJF Microbiol 137:94-99.
Hatsu M, Tanaka M, Utama A, Shimizu H, Takamizawa K. 2002. A Japanese Enchepalitis Virus NS3 Inhibitor Produced by A Streptomyces sp. Actinomycetol 16: 6-8.
Heredia N, Garcia S, Rojas G, Salazar L. 2001. Microbiological condition of ground meat retailed in Monterrey, Mexico. J. Food Prot. 64: 1249-1251. Holo H, Jeknic Z, Daeschel M, Stevanovic S, Nes IF. 2001. Plantaricin W from
Lactobacillus plantarum belongs to new family of two-peptide lantibiotics. Microbiiology 147:643-651.
Jawetz E, Melnick J, Adelberg E. 1996. Medical Microbiology. Appleton and Lange. San Fransisco.
Jimėnez-Diaz R, Ruiz-Barba JL, Cathcart DP, Holo H, Nes IF, Sletten KH. and Warner PJ. 1995. Purification and Partial Amino Acid Sequence of Plantaricin S, a Bacteriocin Produced by Lactobacillus plantarum LPCO10, the Activity of Which Depends on the Complementary Action of Two Peptides. Applied and Environmental Microbiology 59: 1416-1424. Jorgenrud BM. 2009. Construction of a heterologous expression vector for
plantaricin F one of the peptides constituting the two peptides bacteriocin plantaricin EF. [Thesis]. Oslo (NO). University of Oslo.
21 Kjos T, Lützow-Holm C, Christensen OB. 2002. Treatment of panniculitis associated with alpha-1-antitrypsin deficiency with alpha-1-protease inhibitor. Br J Dermatol, 147: 1258-1261.
Lewus CB, Sun S, Montville TJ. 1992. Production of an a-amylase-sensitive bacterioci by an atypical Leuconostoc paramesenteroides strain. Appl. Environ. Microbiol. 58: 143-149.
Mattjik AA dan Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. Edisi ke-2. Bogor : IPB Press.
Padilla JE and Yeates T. 2002. Designing Supramolecular Protein. Asemblies. Curr.Opin. Struct. Biol. 12: 464-470.
Pelczar MJ and Chan ESC. Dasar-dasar Mikrobiologi 2. Teja Imas et al. Penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
Ray B. 2010. Fundamental Food Microbilogy 3rd Edition. CRC Press, Boca Raton, London, New York, Washington DC.
Sapatnekar NM, Patil SN, Aglave BA. 2010. Extraction of Bacteriocin and Study of Its Antagonistic Assay. IJ Biotech Biochem. 6: 865-870.
Serkedjieva J, Danova S, Ivanova I. 2000. Antiinfluenza Virus Activity of a Bacteriocin Produced by Lactobacillus delbrueckii. Apllied Biochemistry and Biotehcnology 88: 285-298.
Siriken B, Carirci O, Inat G, and Pamuk S. 2009. Microbiological Examination of Meatball, Cream Cake and Turkish Delight (Lokum). J. of Animal and Vet. Advances 8: 2049-2054.
Subijanto MS and Rahuh R. 2005. Probiotic in Healthy and Sick Children. Continuing Education Ilmu Kesehatan Anak XXV.1-17.
Suzuki H and Terada T. 1988. Removal of Dodecyl Sulfate from Protein Solution. Anal Biochem. 172: 259-63.
Ultee A, Bennik MH, Moezelaar R. 2002. The Phenolic Hydroxyl Group of Carvacrol is Essential for Action Against the Food-borne Pathogen Bacillus cereus. J. App. And Environ. Microbiol. 58: 624-629.
Van Belkum MJ and Stiles ME. 2000. Nonlantibiotic antibacterial peptides from lactic acid bacteria. Nat. Prod. Rep. 17: 323-335.
Venema, Abee KT, Haandrikman AJ, Leenhout KJ, Kok J, Koningsand WN, Venema G. 1993. Mode of Action of Lactococcin B, a Thoil Activated Bacteriocin from Lactococcus lactis. Appl Environ Microbiol 59: 1041-1048.
Wilson K and Walker J. 2010. Principles and Techniques of Practical Biochemistry: Chromatographic techniques 5th Edition. Cambridge University Press, Cambridge.
Xie Y, An H, Hao Y, Qin Q, Huang Y, Inoue N, Montville TJ. 2005. Characterization of An Anti-Listeria Bacteriocin Produced by Lactobacillus plantarum LB-BI Issolated from Koumiss, A Traditionaly Fermented Dairy Product from China. Food Control 22: 1027-1031. Yuk HG and Marshall DL. 2005. Influence of acetic, citric and lactic acids on
22
Zacharof MP and Lovitt RW. 2012. Bacteriocins Produced by Lactic Acid Bacteria. Bangkok (TH). Procedia APCBEE. 2: 50-56.
Zhou W, Liu GR, Li PL, Dai YQ, Zhaou K. 2007. Mode of action of plantaricin L-1, an antilisteria bacteriocin produced by Lactobacillus plantarum. Wei Sheng Wu Xue Bao, 47: 260- 264.