OPTIMISASI ADSORPSI BIRU METILENA OLEH ALOFAN
DAN NANOKOMPOSIT ALOFAN-TiO
2SERTA UJI
FOTOKATALISISNYA
ENDY JERI SUSWONO
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ENDY JERI SUSWONO. Optimisasi Adsorpsi Biru Metilena oleh Alofan dan Nanokomposit Alofan-TiO2 serta Uji Fotokatalisisnya. Dibimbing oleh SRI SUGIARTI dan AHMAD SJAHRIZA.
Alofan merupakan mineral alam yang memiliki daya jerap tinggi. Mineral ini banyak di temukan dalam tanah vulkanik. Indonesia merupakan negara yang memiliki banyak gunung berapi sehingga besar kemungkinan banyak ditemukan mineral ini. Untuk meningkatkan karakternya, mineral alofan dibuat nanokomposit alofan-TiO2 sehingga bisa menghasilkan material baru yang memiliki sifat adsorpsi-fotokatalisis. Pada penelitian ini dilakukan optimisasi adsorpsi biru metilena oleh alofan dan nanokomposit dengan parameter waktu agitasi dan bobot adsorben. Waktu agitasi optimum adsorpsi biru metilena oleh alofan dan nanokomposit adalah 1.5 jam. Sampel alofan dan nanokomposit menunjukkan adsorpsi optimum dengan bobot masing-masing adalah 80 mg dan 60 mg. Nanokomposit yang telah disintesis memiliki kemampuan adsorpsi-fotokatalisis karena mampu mendegradasi biru metilena di bawah sinar ultraviolet.
ABSTRACT
ENDY JERI SUSWONO. Optimization of Methylene Blue Adsorption by Allophane and Nanocomposite Allophane-TiO2 and Their Photocatalytic Activity. Supervised by SRI SUGIARTI dan AHMAD SJAHRIZA.
OPTIMISASI ADSORPSI BIRU METILENA OLEH ALOFAN
DAN NANOKOMPOSIT ALOFAN-TiO
2SERTA UJI
FOTOKATALISISNYA
ENDY JERI SUSWONO
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Optimisasi Adsorpsi Biru Metilena oleh Alofan dan
Nanokomposit Alofan-TiO
2serta Uji Fotokatalisisnya
Nama
: Endy Jeri Suswono
NIM
: G44070002
Disetujui,
Pembimbing I
Pembimbing II
Sri Sugiarti, PhD
Drs Ahmad Sjahriza
NIP 19701225 199512 2 001
NIP 19620406 198903 1 002
Diketahui,
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 1976032 002
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT sehingga
penulis bisa menyelesaikan karya ilmiah ini. Penelitian ini dimulai dari bulan Mei
2011 sampai Januari 2012 bertempat di Laboratorium Kimia Anorganik,
Laboratorium Kimia Fisik, dan Laboratorium Bersama, Departemen Kimia,
Fakultas Matematika dan Ilmu pengetahuan Alam, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Ibu Sri Sugiarti, Ph.D selaku
pembimbing satu dan Bapak Drs. Ahmad Sjahriza selaku pembimbing dua atas
dukungan dan masukan yang senantiasa diberikan kepada penulis selama
penelitian dan penyusunan karya ilmiah ini. Ucapan terima kasih kepada Bapak
Dr. Ir. Untung Sudadi, M.Sc yang telah membantu dalam penyediaan sampel
tanah vulkanik. Ucapan terima kasih juga disampaikan kepada Pak Syawal, Nurul,
Pak Wawan, Pak Arya dan Pak Mail selaku laboran yang telah banyak membantu
penulis dalam pengerjaan penelitian.
Ucapan terima kasih kepada Zona Gozali, Fachrurrazie, dan Tobing Des
Marlianto yang telah meluangkan waktunya untuk menemani penulis ketika harus
mengerjakan penelitian di malam hari. Ucapan terima kasih kepada Putri M
Sinuhaji, Gina Pragustiana, dan Doni Rahmad Pranoto atas kerja samanya untuk
analisis microskop elektron payar
(SEM) di LIPI, Serpong. Ucapan terima kasih
kepada Amran Adri yang telah memberikan masukan mengenai teknik penulisan
dalam penulisan karya tulis ini.
Bogor, Febuari 2012
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 6 Januari 1990 dari
pasangan Bapak Amron dan Ibu Eni. Penulis merupakan anak pertama dari dua
bersaudara. Pada tahun 2007, penulis lulus dari SMA Negeri 3 Kayuagung dan
diterima menjadi mahasiswa Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI) di Departemen Kimia Fakultas Matematika
dan Ilmu Pengetahuan Alam (FMIPA).
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
METODE ... 1
Bahan dan alat ... 1
Lingkup kerja ... 1
HASIL DAN PEMBAHASAN ... 3
Ekstraksi alofan ... 3
Karakterisasi ... 3
optimisasi adsorpsi ... 4
Isoterm adsorpsi ... 5
Uji fotodegradasi ... 5
SIMPULAN DAN SARAN ... 6
Simpulan ... 6
Saran ... 6
DAFTAR PUSTAKA ... 6
DAFTAR GAMBAR
Halaman
1 Morfologi alofan dan nanokomposit. ... 3
2 Difraktogram XRD alofan dan nanokomposit .. ... 4
3 Optimisasi waktu agitasi adsorpsi pada alofan dan nanokomposit.. ... 4
4 Optimisasi bobot adsorben untuk adsorpsi oleh alofan dan nanokomposit.. ... 5
5 Spektrum UV filtrat nanokomposit dengan dan tanpa penyinaran UV.. ... 6
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian.. ... 9
2 Optimisasi waktu agitasi .. ... 10
3 Optimisasi bobot adsorben .. ... 11
4 Isoterm adsorpsi biru metilena oleh alofan dan nanokomposit .. ... 12
5 Uji fotokatalisis . ... 17
PENDAHULUAN
Pencemaran lingkungan menjadi perhatian pemerintah dan masyarakat. Salah satu yang menjadi perhatian adalah pencemaran air. Aktivitas industri yang tidak bertanggung jawab merupakan salah satu penyebab utama pencemaran ini. Limbah industri, khususnya limbah cair memberikan kontribusi yang cukup besar terhadap pencemaran lingkungan. Seperti halnya industri teksil, beberapa industri yang tidak bertanggung jawab memilih membuang limah zat warnanya ke perairan karena rumitnya proses penanganannya.
Limbah zat warna dari industri tekstil, selain sulit terurai hayati juga bersifat toksik (Miguel et al. 2002). Oksidasi secara biologi dan koagulasi menggunakan garam besi (Fe) dan garam aluminium (Al) belum cukup untuk mengatasinya. Oksidasi menggunakan ozon dan hipoklorit merupakan metode yang efisien untuk menghilangkan zat warna. Namun, diperlukan biaya yang cukup mahal untuk aplikasinya (Alfano et al. 2000; Hoffmann et al. 1995; Lisebigier et al. 1995).
Metode adsorpsi juga dapat digunakan dalam proses pengolahan limbah zat warna. Namun, metode ini masih memiliki kelemahan, yaitu selektivitasnya yang rendah dan proses regenerasinya yang sulit. Dalam prakteknya, adsorben yang digunakan hanya dapat menjerap zat warna, tetapi tidak dapat menguraikannya sehingga masih memerlukan langkah-langkah lanjut sampai limbah benar-benar aman untuk dilepas ke lingkungan. Kelemahan tersebut dapat diatasi dengan mengubah karekter adsorbennya, yaitu selain
mampu menjerap juga mampu
mendegradsinya. Salah satu adsorben yang dapat digunakan adalah alofan.
Alofan merupakan mineral alam yang memiliki daya jerap tinggi. Mineral ini merupakan hasil pelapukan bahan induk abu vulkanik dan banyak ditemukan di tanah pegunungan. Morfologi alofan berbentuk hallow spherical dengan ukuran 3.5–5.0 nm dan pori 0.3–0.5 nm. Dinding hallow spherical alofan terdiri dari gugus silanol (Si-OH) dan gugus aluminol (Al-(Si-OH). Alofan memiliki luas permukaan berkisar 1000–1200 m2 setiap gramnya. Nilai ini tiga kali lebih besar jika dibandingkan dengan mineral lainnya seperti montmorillonit (Abidin et al. 2008; Nishiokori et al. 2009; Tamad & Hanudin 2008).
Namun, alofan tidak memiliki ketahanan termal. Pada suhu tinggi, alofan akan
membentuk agregrat sehingga luas permukaannya akan menurun (Abidin et al. 2008). Sifat ketidaktahanan termal alofan ini dapat dimanfaatkan untuk mengubahnya menjadi nanokomposit dengan menyisipkan (menginterkalasi) senyawa titanium dioksida (TiO2) di antara struktur agrerat alofan (Sugiarti et al. 2010). Nanokomposit yang terbentuk akan memiliki sifat fisikokimia yang lebih baik dibandingkan mineral alofan sebelum dimodifikasi.
Titanium dioksida diketahui dapat mendegradasi limbah organik menjadi senyawa-senyawa yang lebih ramah lingkungan, seperti H2O dan O2 (Hagfeld & Gratzel 1995). Senyawa organik didegradasi melalui oksidasi fotokatalisis dengan bantuan sinar ultraviolet (UV). Dengan demikian, nanokomposit alofan-TiO2 yang disintesis diharapkan akan memiliki kemampuan adsorpsi dan fotodegradasi.
Penelitian sebelumnya, Widiyanti (2011) berhasil mensintesis nanokomposit alofan-TiO2 dan terbukti memiliki kemampuan adsorpsi dan fotodegradasi terhadap zat warna biru metilena. Selain itu, nanokomposit yang dihasilkan tersebut memiliki daya jerap yang lebih besar daripada mineral alofan aslinya.
Pada penelitian ini dilakukan optimisasi adsorpsi dan karakterisasi baik alofan maupun nanokomposit alofan-TiO2. optimisasi adsorpsi dilakukan terhadap parameter waktu agitasi dan bobot adsorben. Selain itu, penelitian ini juga mempelajari proses adsorpsi yang terjadi. Adanya aktivitas fotokatalisis pada sampel nanokomposit diketahui melalui uji fotodegradasi.
METODE
Bahan dan Alat
Alat yang digunakan adalah spektrofotometer UV-tampak, SEM, Difraktometer sinar-X, shaker, sentrifuga, lampu UV, neraca analitik, oven, dan peralatan kaca.
Bahan-bahan yang digunakan ialah tanah vulkanik dari Gunung Lawu (Tawangmangu), akuades, serbuk titanium oksida anatase P 25, AgNO3, NaOH, kertas pH, membran dialisis, dan biru metilena.
Lingkup Kerja
2
optimisasi adsorpsi dan karakterisasi alofan. Tahap ketiga, sintesis nanokomposit alofan-TiO2. Tahap keempat, optimisasi adsorpsi dan karakterisasi nanokomposit alofan-TiO2. Dan tahap kelima adalah uji fotodegradasi alofan dan nanokompositnya.
Ekstraksi Alofan dari Tanah Vulkanik (Henmi & Wada 1976)
Sampel tanah vulkanik dikeringudarakan terlebih dahulu sampai kering. Setelah itu, sampel dihaluskan sehingga diperoleh ukuran 200 mesh. Setelah itu, sampel sebanyak 10 gram ditambahkan dengan akuades dan dikondisikan pH-nya untuk mendapatkan larutan yang terdispersi, dengan kisaran pH 4 sampai 10. Untuk pH 4 ditambahkan dengan HCl dan pH 10 dengan NaOH.
Sampel kemudian ditempatkan pada tabung silinder 1 L dan dienaptuangkan selama 10-20 jam sesuai dengan keadaan suhu ruangan. Fraksi lempung atas (< 2 µm) dipersiapkan dengan mengambil larutan koloid tersebut dengan jarak 10 cm dari permukaan larutan. Fraksi ini ditampung dan diflokulasikan dengan penambahan NaCl.
Setelah fraksi terflokulasi, larutan bagian atas dibuang dan endapan dikumpulkan. Endapan kemudian dimasukkan ke dalam membran dialisis. Membran kemudian direndam dengan akuades sampai endapan bebas NaCl. Endapan yang bebas NaCl diketahui dengan menggunakan AgNO3 sampai tidak ada endapan putih. Setelah itu, larutan disentrifugasi 3500 rpm selama 20 menit dan diambil endapannya (alofan). Endapan yang diperoleh kemudian dikeringudarakan.
Analisis Mikroskop Elektron Payaran (SEM)
Sebelum dilakukan pemayaran, sampel terlebih dahulu dilapisi dengan emas (Au). Setelah itu, dilakukan pemayaran menggunakan sinar-X. Pemayaran objek sampel diamati dengan perbesaran tertentu untuk melihat morfologi permukaan sampel. Analisis Difraktometer Sinar-X (XRD)
Sampel diletakkan dan dimampatkan pada lempeng aluminium. Selanjutnya, lempeng yang telah ditempatkan sampel dilakukkan pemayaran dengan sinar-X. Derajat kristalinitas sampel ditentukan dengan metode Gaussian berdasarkan luas area di bawah spektrum sampel.
Sintesis Nanokomposit Alofan-TiO2 (Widiyanti 2010)
Sintesis nanokomposit dilakukan dengan membuat sistem koloid yang stabil antara alofan dan TiO2. Alofan dan titanium dioksida dengan komposisi 9:1 dicampurkan dengan penambahan air suling. Setelah itu ditambahkan NaOH sampai pH 8 agar sistem koloid tetap stabil. Campuran kemudian didiamkan selama 24 jam kemudian dipanaskan pada suhu 100 oC. Nanokomposit yang diperoleh dicirikan dengan XRD dan SEM.
Penentuan Waktu Agitasi Optimum untuk Adsorpsi
Sebanyak 50 mg sampel alofan ditambahkan larutan biru metilena 200 ppm sebanyak 10 mL. Setelah itu, larutan diagitasi dengan variasi waktu 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 4.0, dan 6 jam. Setelah itu, larutan disentrifugasi selama 20 menit dengan kecepatan 3500 rpm untuk memisahkan endapan. Campuran kemudian diukur absorbannya menggunakan spektrofotometer UV-Vis pada panjang gelombang 664 nm. Kapasitas adsorpsi dihitung dengan menggunakan persamaan berikut:
Q =
Keterangan:
Q = Kapasitas adsorpsi V = Volume larutan (mL) Co = Konsentrasi awal (ppm) Ca = Konsentrasi akhir (ppm) M = Massa adsorben (g)
Penentuan waktu optimum juga dilakukan pada sampel nanokomposit alofan-TiO2 dengan perlakuan yang sama seperti alofan. Penentuan Bobot Adsorben Optimum untuk Adsorpsi
3
Uji Fotodegradasi Senyawa Biru Metilena
Sebanyak 70 mg nanokomposit alofan-TiO2 ditambahkan 15 mL larutan biru metilena dengan konsentrasi 12.5 ppm. Larutan kemudian disinari dengan sinar UV pada panjang gelombang 365 nm selam 6 jam. Setelah itu, diambil filtratnya dan dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 200–700 nm.
Uji fotodegradasi juga dilakukan pada sampel alofan, TiO2, dan biru metilena sebagai pembanding. Setelah itu, hasilnya dibandingkan dengan perlakuan tanpa sinar UV.
HASIL DAN PEMBAHASAN
Ekstraksi Alofan
Mineral alofan memiliki sifat permukaan yang khas yaitu muatan yang bervariasi berdasarkan nilai pH kondisinya (Elsheikh et al. 2008). Alofan yang bermuatan positif akan terdispersi pada pH asam sedangkan yang bermuatan negatif pada pH basa. Alofan yang diekstraksi dari tanah vulkanik Gunung Lawu terdispersi stabil pada pH 10. Hal ini menunjukkan mineral alofan yang terkandung dalam tanah vulkanik cenderung bermuatan negatif. Terbentuknya muatan negatif dapat disebakan melalui mekanisme deprotonisasi pada gugus silanol dan aluminol sehingga kation dan logam berat mudah terikat (Abidin et al. 2005).
Mineral alofan diketahui memiliki beragam nisbah mol Si/Al dengan kisaran antara 0.6 sampai 1.2. Keragaman ini dapat disebabkan oleh faktor curah hujan dan suhu lingkungan yang mempengaruhi laju pelarutan silikon dari suatu proses pelapukan batuan dasar pada lingkungan tersebut. Perbedaan nisbah Si/Al juga berpengaruh terhadap muatan alofan. Alofan yang memiliki nisbah Si yang lebih besar cenderung bermuatan negatif dan akan cenderung bermuatan positif jika nisbah Al yang lebih besar. Namun, pada dasarnya alofan memiliki struktur dasar yang sama dan yang membedakan adalah gugus silika yang terikat pada bagian pori alofan (Abidin et al. 2008). Dengan demikian, alofan yang diekstraksi dari sumber tanah vulkanik yang berbeda kemungkinan akan memiliki karakter yang juga berbeda.
Karakterisasi
Gambar 1 Morfologi A) alofan, dan B) nonokomposit.
Hasil penampakan melalui SEM hanya mampu menunjukkan ukuran granula sampel, yaitu dengan perbesaran maksimal 20 000 kali. Granula alofan memiliki morfologi bulat tidak beraturan dengan berbagai macam variasi ukuran, berwarna agak gelap, dan penyebarannya merata. Nanokompositnya memiliki morfologi bulat tidak beraturan dengan ukuran yang relatif lebih besar, memiliki warna yang lebih terang, dan penyebarannya merata (Gambar 1). Ukuran granula keduanya sekitar 250-300 nm. Nishikiori (2011) berhasil menunjukkan bahwa ukuran satu partikel alofan berkisar antara 5-10 nm.
Ukuran granula yang lebih besar pada sampel nanokomposit dapat disebabkan karena adanya pembentukan agregrat molekul alofan saat pemanasan pada proses sintesisnya. Sedangkan, warna yang lebih terang kemungkinan disebabkan karena keberadaan molekul TiO2 yang berwarna putih dengan ukuran yang lebih kecil, yaitu sekitar 7 nm.
A
4
Pola difraksi sinar-X dari alofan dan nanokomposit alofan-TiO2 ditampilkan pada difraktogram Gambar 2. Refleksi spesifik baik mineral alofan maupun nanokomposit menunjukkan intensitas tertinggi pada 2 = 20.24o. Pergeseran sudut 2 ke kiri dan munculnya puncak 2 = 25.24o pada difraktogram nanokomposit adalah akibat adanya titanium dioksida yang terperangkap dalam agragat alofan. Hal ini menunjukkan proses interkalasi titanium dioksida ke dalam struktur agregat alofan telah berhasil dilakukan.
Menurut West (1984), refleksi intensitas difraksi sinar-X mengindikasikan kesempurnaan kristal dan kerapatan atom dalam kristal. Semakin ramping refleksi intensitas suatu material maka kristalinitasnya semakin baik dengan susunan atom semakin rapat.
Abidin (2008) menunjukkan bahwa difraktogram mineral alofan hampir tidak ada puncak atau bersifat amorf (kristalinitas < 50%). Namun, hasil pengukuran menunjukkan difraktogram alofan dan nanokomposit masih memiliki beberapa puncak dengan intensitas cukup kuat dan memiliki nilai kristalinitas yang cukup tinggi, yaitu masing-masing 76.55% dan 67.87%. Tingginya nilai kristalinitas ini dapat disebabkan karena masih adanya pengotor pada sampel. Pengotornya dapat berupa gibsit, feldspar, kaolin, dan monmorilonit (Heraldy et al.2004).
Optimisasi Adsorpsi
Pada penelitian ini dilakukan optimisasi terhadap dua parameter adsorpsi, yaitu waktu agitasi dan bobot adsorben. Sebelumnya, telah dilakukan optimisasi terhadap konsentrasi biru metilena sebagai adsorbat yang diketahui
memiliki konsentrasi optimum adsorpsi sebesar 200 ppm (Widiyanti 2011).
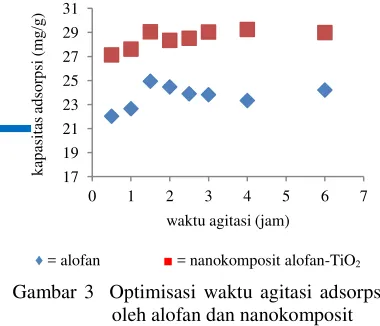
Hasil pengujian menunjukkan adsorpsi biru metilena oleh alofan dan nanokomposit mencapai kondisi optimum dengan waktu agitasi selama 1.5 jam (Gambar 3, Lampiran 2). Ini disebabkan pada waktu agitasi yang lebih lama dari 1.5 jam, nilai kapasitas adsorpsinya cenderung datar.
Gambar 3 Optimisasi waktu agitasi adsorpsi oleh alofan dan nanokomposit Waktu agitasi yang lebih lama tidak selalu diikuti dengan kenaikan kapasitas adsorpsi. Hal ini disebabkan agitasi yang berlebih dapat menyebabkan molekul adsorbat yang terikat pada adsorben terlepas kembali sehingga bisa menurunkan efektivitas adsorpsi. Fenomena ini biasa terjadi pada jenis adsorpsi fisik (fisisorpsi).
Waktu agitasi optimum yang diperoleh digunakan sebagai waktu agitasi dalam penentuan bobot optimum absorben dalam menjerap biru metilena. Hasil pengukuran sampel alofan dan nanokomposit menunjukkan adsorpsi mencapai optimum dengan bobot masing-masing sebesar 80 dan 60 mg (Gambar 4, Lampiran 3). Kenaikan bobot setelah 80 mg untuk alofan dan 60 mg
17 19 21 23 25 27 29 31
0 1 2 3 4 5 6 7
k ap asi ta s ad so rp si ( mg /g )
waktu agitasi (jam)
♦ = alofan ■ = nanokomposit alofan-TiO2
[image:12.595.142.473.75.242.2]= alofan = nanokomposit alofan-TiO2
[image:12.595.317.507.391.554.2]5
untuk nanokomposit sudah tidak diikuti dengan kenaikan persentase adsorpsi.
Gambar 4 Optimisasi bobot adsorben untuk adsorpsi pada alofan dan nanokomposit.
Nanokomposit memiliki daya jerap yang lebih besar daripada alofan. Hal ini dapat disebabkan karena molekul titanium dioksida dapat menyelinap di antara struktur agregrat alofan membentuk rongga baru sehingga permukaan sisi aktifnya lebih besar.
Isoterm Adsorpsi
Isoterm adsorpsi adalah hubungan yang menunjukkan distribusi adsorben antara fase teradsorpsi pada permukaan adsorben dengan fase ruah saat kesetimbangan pada temperatur tertentu. Pada penelitian ini, adsorpsi biru metilena oleh alofan dan nanokomposit diuji dengan tiga persamaan, yaitu persamaan Freundlich, Langmuir, dan Dubinin-Raduskevich. Berdasarkan nilai linearitas tertinggi, adsorpsi biru metilena oleh alofan dan nanokomposit mengikuti persamaan Langmuir (Tabel 1). Dengan demikian, dapat diasumsikan bahwa adsorben memiliki permukaan yang homogen sehingga proses adsorbsi terjadi melalui mekanisme yang sama dan membentuk satu lapisan tunggal saat adsorpsi maksimum.
Tabel 1 Nilai linearitas isoterm adsorpsi biru metilena oleh alofan dan nanokomposit.
Sampel Isoterm % linearitas Alofan Freundlich 94.0
Langmuir 97.7 Dubinin-Radushkevich 71.2 Nanokomposit Freundlich 94.3 Langmuir 98.8 Dubinin-Radushkevich 72.8
Mekanisme adsorpsi biru metilena oleh alofan dan nanokomposit dapat diketahui menggunakan persamaan Dubinin-Raduskevich dengan menentukkan Energi bebas rata-rata adsorpsi (Ea). Berdasarkan nilai Ea yang didapat, ada dua asumsi terhadap jenis adsorpsi. Jika Ea kurang dari 8 kJ/mol maka proses adsorpsi yang terjadi merupakan adsorpsi fisika (fisisorpsi). Jika nilai Ea yang didapat lebih dari 8 kJ/mol maka proses adasorpsi yang terjadi merupakan adsorpsi kimia (kimisorpsi). Selain itu, jika nilai Ea berkisar 8–16 kJ/mol, maka adsorpsi kimia tersebut terjadi melalui pertukaran ion (Chen et al. 2011; Guney et al. 2007).
Hasil perhitungan menunjukkan bahwa energi bebas rata-rata adsorbsi biru metilena oleh alofan dan nanokomposit secara berturut-turut adalah 2.96 kJ/mol dan 4.30 kJ/mol (Lampiran 4). Hal ini menunjukkan adsorpsi biru metilena oleh kedua sampel terjadi secara fisisorpsi. Jenis adsorpsi ini cocok untuk proses adsorpsi yang membutuhkan proses regenerasi karena zat yang terjerap hanya terikat lemah pada permukaan adsorben.
Uji Fotodegradasi
Fotodegradasi merupakan proses penguraian senyawa organik dengan bantuan energi cahaya (foton) melalui reaksi fotokatalisis. Oksida logam TiO2 dapat dijadikan katalis dalam reaksi fotokatalisis. TiO2 dapat digunakan sebagai fotokatalis karena merupakan semikonduktor yang mampu mengadsorpsi radiasi elektromagnetik pada daerah ultraviolet.
Mekanisme fotodegradasi diawali dengan adanya loncatan elektron dari pita valensi ke vita konduksi pada logam semikonduktor, jika dikenai energi foton. Loncatan elektron ini menyebabkan timbulnya hole (lubang elektron) yang dapat berinteraksi dengan air membentuk radikal hidroksida (•OH) yang merupakan oksidator kuat. Elektron pada pita konduksi akan bereaksi dengan oksigen di lingkungan menghasilkan radikal superoksida (•O2-) yang bersifat sebagai reduktor. Radikal bersifat aktif dan dapat terus terbentuk sehingga bereaksi dan menguraikan senyawa organik target (Fatimah & Wijaya 2005).
Nanokomposit alofan-TiO2 dapat berperan sebagai fotokatalis dalam reaksi fotokatalisis dengan bantuan sinar UV. Hal ini dapat dibuktikan dengan membandingkan perlakuan dengan dan tanpa penyinaran UV. Nanokomposit yang telah disinari UV selama 6 jam terbukti mampu mendegradasi zat
90 92 94 96 98 100 102
0,020 0,040 0,060 0,080 0,100
% A d so rp si Bobot (g)
6
warna biru metilena. Ini ditunjukkan dengan hilangnya warna biru pada sampel nanokomposit (Lampiran 5). Pada sampel yang tidak disinari UV, tidak terjadi proses fotodegradasi melainkan hanya proses adsorpsi.
Adanya aktivitas fotokatalisis juga dapat dilihat dengan membandingkan spektrum sinar UV filtrat nanokomposit yang diberi perlakuan dengan dan tanpa penyinaran sinar UV (Gambar 5, Lampiran 6). Spektrum filtrat nanokomposit tanpa perlakuan penyinaran masih menunjukkan adanya spektrum adsorpsi biru metilena dengan persentase adsorpsi sebesar 85.19%. Sedangkan spektrum filtrat nanokomposit dengan penyinaran UV sudah tidak menunjukkan adanya spektrum adsorpsi biru metilena dengan persentase adsorpsi sebesar 99.05%. Terlihat bahwa telah terjadi penurunan konsentrasi biru metilena setelah disinari UV selama 6 jam. Hal ini menunjukkan bahwa nanokomposit alofan-TiO2 yang disintesi terbukti mampu menjerap dan memfotodegradasi senyawa biru metilena dengan bantuan sinar UV.
Gambar 5 Spektrum UV filtrat nanokomposit dengan dan tanpa penyinaran UV.
SIMPULAN DAN SARAN
Simpulan
Nanokomposit alofan-TiO2 telah berhasil disintesis dan terbukti selain mampu menjerap juga mampu menfotodegradasi zat warna biru metilena. optimisasi Adsorpsi biru metilena oleh alofan dan nanokomposit diperoleh waktu agitasi optimum selama 1.5 jam untuk kedua sampel. Sedangkan bobot optimumnya masing-masing adalah 80 dan 60 mg. Adsorpsi oleh kedua sampel mengikuti isoterm Langmuir dan terjadi secara fisisorpsi.
Saran
Perlu dilakukan optimisasi komposisi dalam pembuatan nanokomposit alofan-TiO2 sehingga diperoleh material dengan daya jerap dan aktivitas fotokatalisis yang lebih baik. Selain itu, perlu juga dilakukan uji kemampuan regenerasinya sebagai adsorben.
DAFTAR PUSTAKA
Abidin Z, Matsue N, Henmi T. 2008. Structure of nano-ball allophone and its surface properties. Clay and clay minerals 28: 285-294.
Alfano OM, Bahnemann D, Cassano AE, Dillert R, Goslich R. 2000. Photocatalysis in water environments using artificial and solar light. Catal. Today 58:199–230. Chen CY, Yang CY, Chen AH. 2011.
Biosorption of Cu(II), Zn(II), Ni(II) and Pb(II) ions by cross-linked mental-imprinted chitosans with epichlorohydrin. J. Env. Man. 92:796-802.
Elsheikh MA, Matsue N, Henmi T. 2008. Competitive adsorption of oxalate and phosphate on allophane at low concentration. Clay Science 13:213-222. Fatimah I & Wijaya K. 2005. Sintesis TiO2
-zeolit sebagai fotokatalis pada pengolahan limbah cair industri tapioka secara adsorpsi-fotodegradasi. TEKNOIN 10:4. Güney A, Arslankaya E, Tosun İ. 2007. Lead
removal from aqueous solution by natural and pretreated clinoptilolite: Adsorption equilibrium and kinetics. J. Haz. Mat. 146:362-371.
Hagfeldt A, Gratzel M. 1995. Light induced redox reactions in nanocrystalline systems. Chem. Rev. 95:49–68.
Hanudin E, Matsue N, Henmi T. 2002. Reactions of some short-range ordered aluminosilicate with selected organic ligands. Clays and clays minerals 28: 319-332.
Henmi T, Wada K. 1976. Morphology and composition of Allophane. American Mineralogist 61: 379-390.
7
Heraldy E, Pranoto, Dini P. 2004. Studi Karakterisasi dan Aktivasi Alofan Alam serta Aplikasinya sebagai Adsorben Logam Zn menggunakan Metode Kolom. Alchemy 3: 32-42.
Hoffmann MR, Martin ST, Choi W, Bahnemann DW. 1995. Environmental applications of semiconductor photocatalysis. Chem. Rev. 95:69–96.
Lisebigier AL, Lu GQ, Yates JT. 1995. Photocatalysis on TiO2 surface: principles, mechanisms, and selected results. Chem. Rev 95: 735-758.
Miguel R, Victor S, Santiago E, Cesar P. 2002. Photo-Fenton treatment of a biorecalcitrant wastewater generated in textile activities: biodegradability of the photo-treated solution. J. Photochem. Photobiol. A: Chem. 151:129–135.
Nishikiori H, Furukawa M, Fujii S, Tanaka. 2011. Degradation of Trichloroethilene Using Highly Adsorptive Allophane-TiO2 nanocomposite. Applied Catalysis B: Environmental 102:470-474.
Nishikiori H,Kobayashi K, Kubota S, Tanaka N, Fujii T. 2009. Removal of detergen and Fats from waste water using allophane. Applied Clay Science 47:325-329.
Sugiarti S, Abidin Z, Sudadi U, Henmi T. 2010. Formulasi dan Fabrikasi Nanokomposit Nano-Ball Allophane/TiO2 sebagai Fotokatalis untuk Penguraian Senyawa Organik Berbahaya. Laporan Hibah Kompetitif Penelitian untuk Publikasi Internasional. Kemdiknas. Tamad dan Hanudin E. 2008. Kompetisi
Anion Organik dan Anorganik dalam Membentuk Kompleks dengan Allofan dalam Upaya Perbaikan Ketersediaan Fosfat pada Andisol. Jurnal Ilmu Tanah dan Lingkungan 8:126-137.
West AR. 1984. Solid State Chemistry and Its Applications. New York: John Wiley & Sons Ltd.
9
Lampiran 1 Diagram alir penelitian
Ekstraksi alofan dari tanah vulkanik
Alofan
Karakterisasi XRD dan SEM
Uji fotodegradasi Sintesis nanokomposit
Alofan-TiO2
Karakterisasi XRD dan SEM
Nanokomposit Alofan-TiO2 optimisasi adsorpsi
biru metilena
10
Lampiran 2 optimisasi waktu agitasi adsorpsi biru metilena a. Alofan
waktu agitasi (jam)
Massa
(g) Absorban
Faktor pengenceran konsentrasi awal (ppm) konsentrasi akhir (ppm) kosentrasi terjerap (ppm) Q (mg/g) Q rata-rata (mg/g)
0.5 0.0501 0.484 50 200 126.4645 73.5355 22.0166
22.0275
0.0504 0.482 50 200 125.9511 74.0489 22.0384
1 0.0500 0.478 50 200 124.9243 75.0757 22.5227
22.6540
0.0501 0.474 50 200 123.8974 76.1026 22.7852
1.5 0.0505 0.450 50 202 117.7363 84.2637 25.0288
24.9397
0.0495 0.451 50 200 117.9930 82.0070 24.8506
2 0.0497 0.455 50 200 119.0199 80.9801 24.4407
24.4644
0.0502 0.459 50 202 120.0467 81.9533 24.4880
2.5 0.0503 0.465 50 202 121.5870 80.4130 23.9800
23.8948
0.0494 0.465 50 200 121.5870 78.4130 23.8096
3 0.0497 0.463 50 200 121.0736 78.9264 23.8209
23.8173
0.0502 0.460 50 200 120.3034 79.6966 23.8137
4 0.0501 0.471 50 200 123.1273 76.8727 23.0158
23.3300
0.0502 0.470 50 202 122.8706 79.1294 23.6443
6 0.0498 0.469 50 202 122.6139 79.3861 23.9115
24.2043
0.0499 0.453 50 200 118.5064 81.4936 24.4971
Persamaan garis kurva standar biru metilena: y= 0.19477x - 0.00863 R2 = 0.99913 b. Nanokomposit
Persamaan garis kurva standar biru metilena: y= 0.18872x - 0.00182 R2= 0.99895 waktu
agitasi (jam)
Massa
(g) Absorban
Faktor pengenceran konsentrasi awal (ppm) konsentrasi akhir (ppm) kosentrasi terjerap (ppm) Q (mg/g) Q rata-rata (mg/g)
0.5 0.0503 0.238 50 200 63.5386 136.4614 27.1295 27.1270
0.0507 0.234 50 200 62.4788 137.5212 27.1245
1 0.0499 0.233 50 200 62.2139 137.7861 27.6125 27.6102
0.0501 0.231 50 200 61.6840 138.3160 27.6080
1.5 0.0504 0.201 50 200 53.7357 146.2643 29.0207 29.0495
0.0503 0.201 50 200 53.7357 146.2643 29.0784
2 0.0505 0.215 50 200 57.4449 142.5551 28.2287 28.3356
0.0504 0.212 50 200 56.6501 143.3499 28.4424
2.5 0.0507 0.208 50 200 55.5903 144.4097 28.4832 28.5133
0.0505 0.209 50 200 55.8552 144.1448 28.5435
3 0.0501 0.204 50 200 54.5305 145.4695 29.0358 29.0333
0.0502 0.203 50 200 54.2656 145.7344 29.0308
4 0.0502 0.198 50 200 52.9409 147.0591 29.2946 29.2446
0.0501 0.201 50 200 53.7357 146.2643 29.1945
6 0.0500 0.208 50 200 55.5903 144.4097 28.8819 28.9853
11
Lanjutan Lampiran 2 Contoh perhitungan: Kapasitas adsorpsi (Q)
Q =
Keterangan:
Q = Kapasitas adsorpsi V = Volume larutan (ml) Co = Konsentrasi awal (ppm) Ca = Konsentrasi akhir (ppm) M = Massa adsorben (g)
Lampiran 3 optimisasi bobot adsorben terhadap adsorpsi biru metilena a. Alofan
Massa
(g) Absorban
konsentrasi awal (ppm)
konsentrasi akhir (ppm)
konsentrasi terjerap (ppm)
% Adsorpsi
Kapasitas Adsorpsi (Q)
(mg/g)
0,0399 1.406 100 7.3997 92.6003 92.600 23.2081
0,0403 1.724 100 9.0734 90.9266 90.927 22.5624
0,0499 0.916 100 4.8208 95.1792 95.179 19.0740
0,0505 1.004 100 5.2839 94.7161 94.716 18.7557
0,0600 0.507 100 2.6682 97.3318 97.332 16.2220
0,0604 0.591 100 3.1103 96.8897 96.890 16.0413
0,0705 0.263 100 1.3839 98.6161 98.616 13.9881
0,0701 0.286 100 1.5050 98.4950 98.495 14.0506
0,0801 0.084 100 0.4418 99.5582 99.558 12.4292
0,0800 0.087 100 0.4576 99.5424 99.542 12.4428
0,0900 0.080 100 0.4208 99.5792 99.579 11.0644
0,0900 0.098 100 0.5155 99.4845 99.484 11.0538
Persamaan garis kurva standar biru metilena: y=0.19000x + 0,00005 R2 = 0.99980
90 92 94 96 98 100 102
0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,10
%
a
d
so
rp
si
12
Lanjutan Lampiran 3
b. Nanokomposit alofan/TiO2
Massa
(g) Absorban
konsentrasi awal (ppm)
konsentrasi akhir (ppm)
konsentrasi terjerap
(ppm)
% Adsorpsi
Kapasitas Adsorpsi (Q) (mg/g)
0.0308 1.118 100 5.8839 94.1161 94.116 30.5572
0.0307 1.686 100 8.8734 91.1266 91.127 29.6829
0.0401 0.729 100 3.8366 96.1634 96.163 23.9809
0.0403 0.500 100 2.6313 97.3687 97.369 24.1610
0.0499 0.274 100 1.4418 98.5582 98.558 19.7511
0.0503 0.180 100 0.9471 99.0529 99.053 19.6924
0.0599 0.079 100 0.4155 99.5845 99.584 16.6251
0.0602 0.059 100 0.3103 99.6897 99.690 16.5598
0.0799 0.051 100 0.2682 99.7318 99.732 12.4821
0.0800 0.023 100 0.1208 99.8792 99.879 12.4849
Persamaan garis kurva standar biru metilena: y=0.19000x + 0,00005 R2 = 0.99980
90 91 92 93 94 95 96 97 98 99 100 101
0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,10
%
ad
sor
p
si
13
Lampiran 4 Isoterm adsorpsi biru metilena oleh alofan dan nanokomposit a. alofan
C awal (mg/L)
C akhir (mg/L)
C teradsorpsi (mg/L)
Massa (g)
Isoterm Langmuir Isoterm Freundlich
ln Q ɛ2 X* (g) x/m
(mg/g)
c/(x/m)
(g/L) log c log x/m
100 7.3997 92.6003 0.0399 0.0009 23.2081 0.3188 0.8692 1.3656 3.1445 0.0985 100 9.0734 90.9266 0.0403 0.0009 22.5624 0.4021 0.9578 1.3534 3.1163 0.0670 100 4.8208 95.1792 0.0499 0.0010 19.0740 0.2527 0.6831 1.2804 2.9483 0.2179 100 5.2839 94.7161 0.0505 0.0009 18.7557 0.2817 0.7230 1.2731 2.9315 0.1842 100 2.6682 97.3318 0.0600 0.0010 16.2220 0.1645 0.4262 1.2101 2.7864 0.6213 100 3.1103 96.8897 0.0604 0.0010 16.0413 0.1939 0.4928 1.2052 2.7752 0.4766 100 1.3839 98.6161 0.0705 0.0010 13.9881 0.0989 0.1411 1.1458 2.6382 1.8136 100 1.5050 98.4950 0.0701 0.0010 14.0506 0.1071 0.1775 1.1477 2.6427 1.5919 100 0.4418 99.5582 0.0801 0.0010 12.4292 0.0355 -0.3547 1.0944 2.5201 8.5784 100 0.4576 99.5424 0.0800 0.0010 12.4428 0.0368 -0.3395 1.0949 2.5211 8.2307 100 0.4208 99.5792 0.0900 0.0010 11.0644 0.0380 -0.3759 1.0439 2.4037 9.0804 100 0.5155 99.4845 0.0900 0.0010 11.0538 0.0466 -0.2877 1.0435 2.4028 7.1309
Nilai x = Cteradsorpsi (ppm) x Volume larutan (L) x
ɛ
=RT ln (1 + 1/Ce)
keterangan:ɛ
=Potensial polanyi
R = Konstanta gas ideal (J/K.mol)
T = Suhu kontak (
0K)
Isoterm Freunlich
y = 0.2154x + 1.1323 R² = 0.9405
0,00 0,20 0,40 0,60 0,80 1,00 1,20 1,40 1,60
-0,60 -0,10 0,40 0,90 1,40
lo
g
x/m
14
Lanjutan Lampiran 4 Isoterm Langmuir
Isoterm Dubinin-Radushkevich
Penentuan nilai Energi bebas rata-rata adsorpsi (Ea) (kJ/mol) pada suhu kontak (T) 29 oC. lnQ = Kɛ2
+ lnQDR (persamaan Dubinin-Radushkevich)
Ea = (-2K)-0,5 Ea = (-2(-0.057))-0.5 = 2.96 kJ/mol Keterangan:
Ea = Energi bebas rata-rata adsorpsi (kJ/mol) Q = Kapasitas adsorpsi (mg/g)
QDR = Kapasitas adsorpsi maksimum pada persamaan Dubinin-Radushkevich (mg/g) K = intersep dari persamaan Dubinin-Radushkevich
y = 0.0421x + 0.0347 R² = 0.9773
0,00 0,10 0,20 0,30 0,40 0,50
0,00 2,00 4,00 6,00 8,00 10,00
c/
(x/m
)
(g
/L)
C (mg/L)
y = -0.057x + 2.9169 R² = 0.7125
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50
0,00 2,00 4,00 6,00 8,00 10,00
Ln
Q
15
Lanjutan Lampiran 4
b. Nanokomposit alofan TiO2
C awal (mg/L)
C akhir (mg/L)
C teradsorpsi
(mg/L)
massa (g)
Isoterm Langmuir Isoterm Freundlich
Ln Q ɛ
X* (g) x/m (mg/g)
c/(x/m)
(g/L) log c log x/m
100 5.8839 94.1161 0.0308 0.0009 30.5572 0.1926 0.7697 1.4851 3.4196 0.1511 100 8.8734 91.1266 0.0307 0.0009 29.6829 0.2989 0.9481 1.4725 3.3906 0.0699 100 3.8366 96.1634 0.0401 0.0010 23.9809 0.1600 0.5839 1.3799 3.1773 0.3290 100 2.6313 97.3687 0.0403 0.0010 24.1610 0.1089 0.4202 1.3831 3.1847 0.6363 100 1.4418 98.5582 0.0499 0.0010 19.7511 0.0730 0.1589 1.2956 2.9832 1.7021 100 0.9471 99.0529 0.0503 0.0010 19.6924 0.0481 -0.0236 1.2943 2.9802 3.1852 100 0.4155 99.5845 0.0599 0.0010 16.6251 0.0250 -0.3814 1.2208 2.8109 9.2134 100 0.3103 99.6897 0.0602 0.0010 16.5598 0.0187 -0.5083 1.2191 2.8070 12.7264 100 0.2682 99.7318 0.0799 0.0010 12.4821 0.0215 -0.5716 1.0963 2.5243 14.8047 100 0.1208 99.8792 0.0800 0.0010 12.4849 0.0097 -0.9180 1.0964 2.5245 30.4348
Nilai x = Cteradsorpsi (ppm) x Volume larutan (L) x
ɛ
=RT ln (1 + 1/Ce)
keterangan:
ɛ
=Potensial polanyi
R = Konstanta gas ideal (J/K.mol)
T = Suhu kontak (
0K)
Isoterm Freunluich
y = 0.2132x + 1.2841 R² = 0.9432
0,00 0,50 1,00 1,50 2,00
-1,50 -1,00 -0,50 0,00 0,50 1,00 1,50
lo
g
x/m
16
Lanjutan Lampiran 4 Isoterm Langmuir
Isoterm Dubinin-Radushkevich
Penentuan nilai Energi bebas rata-rata adsorpsi (Ea) (kJ/mol) pada suhu kontak (T) 29 oC. lnQ = Kɛ2
+ lnQDR (persamaan Dubinin-Radushkevich)
Ea = (-2K)-0.5 Ea = (-2(-0.0277))-0.5 = 4.30 kJ/mol Keterangan:
Ea = Energi bebas rata-rata adsorpsi (kJ/mol) Q = Kapasitas adsorpsi (mg/g)
QDR = Kapasitas adsorpsi maksimum pada persamaan Dubinin-Radushkevich (mg/g) K = intersep dari persamaan Dubinin-Radushkevich
y = 0.0323x + 0.0157 R² = 0.9883
0,000 0,100 0,200 0,300 0,400
0,00 2,00 4,00 6,00 8,00 10,00
c/
(x/
m
)
(g/L)
C (mg/L)
y = -0.0277x + 3.1832 R² = 0.7285
0,00 0,50 1,00 1,50 2,00 2,50 3,00 3,50 4,00
0 5 10 15 20 25 30 35
Ln
Q
17
Lampairan 5 Uji fotokatalisis a. Tanpa Penyinaran UV
Alofan TiO2 Nanokomposit
b. Penyinaran UV selama 6 jam
18
Lampiran 6 Spektrum UV filtrat sampel A) Tanpa Penyinaran UV
B) Penyinaran UV selama 6 jam Nanokomposit
TiO2, Fb 20 kali Biru metilena, Fp 20 kali
Alofan
Biru metilena, Fp 20 kali TiO2