PENGARUH PEMATAHAN DORMANSI SECARA FISIK DAN KIMIA TERHADAP KEMAMPUAN BERKECAMBAH BENIH MUCUNA (Mucuna bracteata D.C)
SKRIPSI
OLEH:
RETNO PUJI ASTARI 090301197
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
PENGARUH PEMATAHAN DORMANSI SECARA FISIK DAN KIMIA TERHADAP KEMAMPUAN BERKECAMBAH BENIH MUCUNA (Mucuna bracteata D.C)
SKRIPSI
OLEH:
RETNO PUJI ASTARI
090301197/PEMULIAAN TANAMAN
Skripsi sebagai salah satu syarat untuk dapat memperoleh
gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Skripsi : Pengaruh Pematahan dormansi Secara fisik dan kimia terhadap kemampuan berkecambah benih Mucuna (Mucuna bracteata D.C.)
Nama : Retno Puji Astari
NIM : 090301197
Program Studi : Agroekoteknologi
Minat : Pemuliaan Tanaman
Disetujui oleh, Komisi Pembimbing :
Prof. Dr. Ir. Rosmayati, MS. Ir. Eva Sartini Bayu, MP. Ketua Komisi Pembimbing Anggota Komisi Pembimbing
Mengetahui,
ABSTRACT
RETNO PUJI ASTARI: Dormancy breaking effect by Physical and Chemical
Means on Germination Ability of seeds of Mucuna bracteata DC, supervised by ROSMAYATI and EVA SARTINI BAYU
Generative propagation of mucuna produces low germination percentage and requires a long time to germinate due to seed dormancy which is caused by hard skin that inhibits water and gas into the seed. Therefore, a study has been carried out at the Laboratory of Plant Breeding Association and proceeded to the greenhouse at Agriculture Faculty of University of Sumatera Utara (USU) (± 25 m asl) in May-July 2013 using randomized block design with 8 treatments and 3 replications. Treatment consists of A1 (without treatment), A2 (the seed coat cutting and water submersion for 30 minutes), A3 (submersion in 1% of H2SO4 for 10 minutes), A4 (submersion in 1% of H2SO4 for 15 minutes), A5 (submersion in 1% of KNO3 for 12 hours), A6 (submersion in 1% of KNO3 for 24 hours), A7 (submersion in 300ppm of GA3 for 5 hours), and A8 (submersion in 300ppm of GA3 for 3 hours). The parameters measured were moisture content (%), germination ability (%), seed growth rate (% / etmal), dormancy intensity (%), length of shoots (cm) and number of leaves (strands).
The results showed that dormancy breaking by cuttiry the tip seed and submersion in KNO3 1%, H2SO4 1%, GA3 300ppm means significantly affected all parameters except the number of leaves (strands). The best treatment used to break seed dormancy of mucuna is the treatment of A6 (submersion in 1% of KNO3 for 24 hours).
ABSTRAK
RETNO PUJI ASTARI: Pengaruh Pematahan Dormansi dengan Cara Fisik dan Kimia terhadap Kemampuan Berkecambah Benih Mucuna bracteata D.C., dibimbing oleh ROSMAYATI dan EVA SARTINI BAYU
Perbanyakan mucuna secara generatif menghasilkan persentase perkecambahan rendah dan memerlukan waktu yang lama berkecambahan, akibat adanya dormansi yang disebabkan kulit biji keras yang menghambat air dan gas masuk ke dalam biji. Untuk itu suatu penelitian telah dilakukan di Laboratorium Dasar Pemuliaan Tanaman dan dilanjutkan ke rumah kasa Fakultas Pertanian USU (± 25 m dpl) pada Mei-Juli 2013 menggunakan rancangan acak kelompok dengan 8 perlakuan dan 3 ulangan. Terdiri dari perlakuan A1 (tanpa perlakuan), A2 (pengguntingan kulit biji dan perendaman air 30 menit), A3 (perendaman H2SO4 1% selama 10 menit), A4 (perendaman H2SO4 1% selama 15 menit), A5
(perendaman KNO3 1% selama 12 jam), A6 (perendaman KNO3 1% selama 24
jam), A7 (perendaman GA3 300ppm selama 5 jam), dan A8 (perendaman GA3
300ppm selama 3 jam). Peubah amatan yang diamati adalah kadar air (%), daya berkecambah (%), kecepatan tumbuh benih (%/etmal), intensitas dormansi (%), panjang sulur (cm) dan jumlah daun (helai).
Hasil penelitian menunjukkan pematahan dormansi dengan pengguntingan kulit biji dan perendaman KNO3 1%, H2SO4 1%, GA3 300ppm berpengaruh nyata
terhadap semua parameter kecuali jumlah daun(helai). Perlakuan yang terbaik digunakan untuk mematahkan dormansi biji mucuna adalah dengan perlakuan A6 (perendaman KNO3 1% selama 24 jam).
DAFTAR RIWAYAT HIDUP
Retno Puji Astari, lahir pada tanggal 09 Maret 1991 di Binjai, Sumatera Utara yang merupakan anak ketiga dari tiga bersaudara, putri dari Bapak Alm. Sahroni dan Ibu Budiati.
Tahun 2009 penulis lulus dari SMA Negeri 1 Binjai dan pada tahun yang sama masuk Fakultas Pertanian USU melalui jalur tertulis Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN). Penulis memilih Program Studi Agroekoteknologi. Selama perkuliahan penulis mendapatkan beasiswa peningkatan prestasi akademik (PPA) pada tahun 2010 sampai 2012.
Selama mengikuti perkuliahan, penulis aktif sebagai asisten Laboratorium Morfologi dan Taksonomi Tumbuhan (2010-2013), asisten Laboratorium Anatomi Tumbuhan (2010-2012), asisten Laboratorium perbanyakan vegetatif tanaman (2011), asisten Laboratorium Dasar Pemuliaan tanaman (2012-2013) asisten Laboratorium Bioteknologi Pertanian (2012-2013), asisten Laboratorium Genetika dan Populasi Tanaman (2012-2013), dan asisten Laboratorium sitogenetika tanaman (2012-2013). Penulis adalah anggota biasa Himpunan Mahasiswa Islam (HmI) Komisariat FP USU, anggota Himpunan Mahasiswa Agroekoteknologi (HIMAGROTEK) dan anggota Ikatan Senat Mahasiswa Pertanian Indonesia (ISMPI). Selama masa perkuliahan penulis pernah menjabat sebagai Bendahara Umum HmI komisariat FP USU periode 2011-2012, Menjabat sebagai anggota Majelis Permusyawaratan Universitas (MPMU) USU, dan sebagai Bendahara Umum PEMA FP USU periode 2012-2013.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Allah SWT, Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Pematahan Dormansi Secara Fisik dan Kimia Terhadap Kemampuan Berkecambah Benih Mucuna (Mucuna bracteata D.C.) ”
Pada kesempatan ini, penulis menghanturkan terima kasih yang sebesar-besarnya kepada kedua orang tua penulis yang telah berjuang membesarkan, merawat, dan mendidik penulis selama ini. Penulis juga mengucapkan terima kasih kepada Ibu Prof. Dr. Ir. Rosmayati, MS., selaku ketua komisi pembimbing dan Ibu Ir. Eva Sartini Bayu, MP., selaku anggota komisi pembimbing yang telah membimbing dan memberikan berbagai saran yang berharga kepada penulis mulai dari penetapan judul, melakukan penelitian sampai ujian akhir mengelar sarjana.
Disamping itu, penulis juga mengucapkan terima kasih kepada Bapak Ir. Rusdi Yunus Harahap yang telah membantu dalam menyediakan biji Mucuna bracteata D.C. seta ucapaan terima kasih saya kepada semua staf pengajar dan pegawai di Program Studi Agroekoteknologi, semua teman-teman angkatan 2009 serta adik-adik angkatan 2012 Program Studi Agroekoteknologi yang tidak dapat disebutkan namanya satu per satu yang telah banyak membantu penulis dalam menyelesaikan skripsi ini.
Akhir kata penulis mengucapkan terima kasih. Semoga skripsi ini dapat menjadi bahan informasi yang bermanfaat bagi pihak yang membutuhkan.
Medan, Agustus 2013
DAFTAR ISI
Perendaman kalium nitrat (KNO3)... 12
Perendaman giberelin (GA3) ... 15
Persiapan bak kerkecambahan ... 24
Persiapan media perkecambahan ... 24
Seleksi benih ... 24
Pengenceran larutan kimia ... 24
Pengguntingan kulit ... 25
Perendaman biji ... 25
Perkecambahan biji... 25
Pembuatan naungan ... 26
Persiapan media pembibitan ... 26
Pemindahan bibit ... 26
Kecepatan tumbuh benih (%/etmal)... 28
Intensitas dormansi (%) ... 28
Kecepatan tumbuh benih (%/etmal)... 31
DAFTAR TABEL
No. Hal.
1. Rataan kadar air (%) dengan pematahan dormansi secara fisik dan kimia... 30 2. Rataan daya berkecambah (%) dengan pematahan dormansi secara
fisik dan kimia... 31 3. Rataan kecepatan tumbuh benih (etmal/%) dengan pematahan dormansi
secara fisik dan kimia... 32 4. Rataan intensitas dormansi (%) dengan pematahan dormansi secara
DAFTAR GAMBAR
No. Hal.
1. Kurva pertumbuhan panjang sulur pada 2, 4, 6 MSPT dari pengaruh
perlakuan pematahan dormansi dengan cara fisik dan kimia ... 33 2. Kurva pertumbuhan jumlah daun pada 2, 4, 6 MSPT dari pengaruh
DAFTAR LAMPIRAN
No. Hal.
1. Bagan penelitian di laboratorium ... 47
2. Bagan penelitian di rumah kasa ... 48
3. Bagan jarak tanam dalam plot di rumah kasa ... 48
4. Jadwal pelaksaan penelitian ... 49
5. Ukuran biji Mucuna bracteata D.C ... 50
6. Penampang melintang biji Mucuna bracteata D.C... 50
7. Foto penelitian di laboratorium ... 51
8. Foto benih Mucuna bracteata D.C siap pindah tanam ke rumah kasa ... 51
9. Foto penelitian di rumah kasa ... 52
10. Foto tanaman pada akhir pengamatan 6 MSPT ... 52
11. Foto supervisi dengan komisi ketua pembimbing... 53
12. Foto supervisi dengan komisi anggota pembimbing... 53
13. Data pengamatan kadar air biji (%)... 54
14. Data sidik ragam kadar air biji (%) ... 54
15. Data pengamatan daya berkecambah (%) ... 54
16. Data sidik ragam daya berkecambah (%)... 55
17. Data pengamatan kecepatan tumbuh benih (%/etmal) ... 55
18. Data sidik ragam kecepatan tumbuh benih (%/etmal) ... 55
19. Data pengamatan intensitas dormansi (%) ... 56
20.Data sidik ragam intensitas dormansi biji (%) ... 56
21. Data pengamatan panjang sulur 2 MSPT ... 56
23.Data pengamatan panjang sulur 4 MSPT ... 57
24. Data sidik ragam panjang sulur 4 MSPT ... 57
25.Data pengamatan panjang sulur 6 MSPT ... 58
26. Data sidik ragam panjang sulur 6 MSPT ... 58
27.Data pengamatan jumlah daun 2 MSPT... 58
28. Data sidik ragam jumlah daun 2 MSPT ... 59
29.Data pengamatan jumlah daun 4 MSPT... 59
30. Data sidik ragam jumlah daun 4 MSPT ... 59
31.Data pengamatan jumlah daun 6 MSPT... 60
ABSTRACT
RETNO PUJI ASTARI: Dormancy breaking effect by Physical and Chemical
Means on Germination Ability of seeds of Mucuna bracteata DC, supervised by ROSMAYATI and EVA SARTINI BAYU
Generative propagation of mucuna produces low germination percentage and requires a long time to germinate due to seed dormancy which is caused by hard skin that inhibits water and gas into the seed. Therefore, a study has been carried out at the Laboratory of Plant Breeding Association and proceeded to the greenhouse at Agriculture Faculty of University of Sumatera Utara (USU) (± 25 m asl) in May-July 2013 using randomized block design with 8 treatments and 3 replications. Treatment consists of A1 (without treatment), A2 (the seed coat cutting and water submersion for 30 minutes), A3 (submersion in 1% of H2SO4 for 10 minutes), A4 (submersion in 1% of H2SO4 for 15 minutes), A5 (submersion in 1% of KNO3 for 12 hours), A6 (submersion in 1% of KNO3 for 24 hours), A7 (submersion in 300ppm of GA3 for 5 hours), and A8 (submersion in 300ppm of GA3 for 3 hours). The parameters measured were moisture content (%), germination ability (%), seed growth rate (% / etmal), dormancy intensity (%), length of shoots (cm) and number of leaves (strands).
The results showed that dormancy breaking by cuttiry the tip seed and submersion in KNO3 1%, H2SO4 1%, GA3 300ppm means significantly affected all parameters except the number of leaves (strands). The best treatment used to break seed dormancy of mucuna is the treatment of A6 (submersion in 1% of KNO3 for 24 hours).
ABSTRAK
RETNO PUJI ASTARI: Pengaruh Pematahan Dormansi dengan Cara Fisik dan Kimia terhadap Kemampuan Berkecambah Benih Mucuna bracteata D.C., dibimbing oleh ROSMAYATI dan EVA SARTINI BAYU
Perbanyakan mucuna secara generatif menghasilkan persentase perkecambahan rendah dan memerlukan waktu yang lama berkecambahan, akibat adanya dormansi yang disebabkan kulit biji keras yang menghambat air dan gas masuk ke dalam biji. Untuk itu suatu penelitian telah dilakukan di Laboratorium Dasar Pemuliaan Tanaman dan dilanjutkan ke rumah kasa Fakultas Pertanian USU (± 25 m dpl) pada Mei-Juli 2013 menggunakan rancangan acak kelompok dengan 8 perlakuan dan 3 ulangan. Terdiri dari perlakuan A1 (tanpa perlakuan), A2 (pengguntingan kulit biji dan perendaman air 30 menit), A3 (perendaman H2SO4 1% selama 10 menit), A4 (perendaman H2SO4 1% selama 15 menit), A5
(perendaman KNO3 1% selama 12 jam), A6 (perendaman KNO3 1% selama 24
jam), A7 (perendaman GA3 300ppm selama 5 jam), dan A8 (perendaman GA3
300ppm selama 3 jam). Peubah amatan yang diamati adalah kadar air (%), daya berkecambah (%), kecepatan tumbuh benih (%/etmal), intensitas dormansi (%), panjang sulur (cm) dan jumlah daun (helai).
Hasil penelitian menunjukkan pematahan dormansi dengan pengguntingan kulit biji dan perendaman KNO3 1%, H2SO4 1%, GA3 300ppm berpengaruh nyata
terhadap semua parameter kecuali jumlah daun(helai). Perlakuan yang terbaik digunakan untuk mematahkan dormansi biji mucuna adalah dengan perlakuan A6 (perendaman KNO3 1% selama 24 jam).
PENDAHULUAN
Latar Belakang
Mucuna bracteata merupakan tanaman penutup tanah yang banyak digunakan di areal perkebunan. Tanaman penutup tanah ini pada mulanya banyak dijumpai di negara bagian Tripura India Utara, yang di introduksi oleh Golden Hope dari Malaysia pada 1991. Mucuna bracteata sebagai penutup tanah berguna untuk memberikan cadangan unsur hara dengan menambat N bebas dari udara, memperbaiki sifat hara, memperbaiki sifat fisik tanah, mencegah erosi dan menekan pertumbuhan gulma (Harahap dan Subronto, 2004).
Tanaman Mucuna bracteata termasuk salah satu tanaman kacangan penutup tanah yang dominan dan sangat bermanfaat bagi perkebunan kelapa sawit. Karakteristik mucuna sebagai tanaman penutup tanah lebih menguntungkan bila dibandingkan dengan jenis penutup tanah lainnya, dinilai relatif lebih mampu menekan pertumbuhan gulma pesaing. Selain itu memiliki keunggulan lainnya yaitu pertumbuhan yang cepat serta menghasilkan biomassa yang tinggi, mudah ditanam dengan input yang rendah, tidak disukai ternak karena daunnya mengandung fenol yang tinggi sehingga tanaman kacangan ini lebih banyak digunakan pada perkebunan (Subronto, 2002)
hampir tidak menyesuaikan waktu tanam dan mempunyai perakaran yang cukup baik sehingga pemindahan bibit ke lapangan dapat tumbuh dengan baik, namun kelemahan perbanyakan generatif menghasilkan daya kecambah sangat rendah (Sebayang et al., 2002).
Biji Mucuna bracteata adalah salah satu tanaman dari famili leguminosae yang memiliki masa dormansi yang cukup lama. Dormansi ini disebabkan oleh keadaan fisik dari kulit biji. Lapisan kulit yang keras menghambat penyerapan air dan gas ke dalam biji sehingga proses perkecambahan tidak terjadi. Selain itu, kulit benih juga menjadi penghalang munculnya kecambah pada proses perkecambahan (Subronto, 2002).
Menurut Vademecum kelapa sawit PTP. Nusantara II (Persero) tahun 2011, kebutuhan biji Mucuna bracteata sebagai penutup tanah di perkebunan kelapa sawit ± 0,13 kg/ha. Namun dilihat dari rendahnya daya kecambah mucuna tersebut dapat meningkatkan kebutuhan biji per hektar menjadi ± 0,43 kg. Hal ini menyebabkan kerugian yang sangat besar. Oleh sebab itu sangat diperlukannya perlakuan pematahan dormansi untuk meningkatkan daya kecambah mucuna tersebut.
Menurut Siregar (2010) perkecambahan biji Mucuna bracteata tanpa diberikan perlakuan pematahan dormansi hanya sebesar 18,33%. Dan menurut Sari (2012) persentase daya kecambah Mucuna bracteata tanpa perlakuan pematahan dormansi sebesar 0,91%.
potassium nitrat serta menggunakan hormon pertumbuhan seperti giberelin untuk memacu perkecambahan biji (Kartasapoetra, 2003).
Biji-biji yang berkulit keras akan menjadi permeabel terhadap air bila biji-biji tersebut dikikir. Selain itu perlakuan dengan menggunakan bahan kimia sering digunakan untuk memecah dormansi pada benih. Tujuannya adalah menjadikan kulit benih lebih mudah menyerap air sehingga membantu proses imbibisi. Selain itu hormon tumbuh biasa juga dipakai untuk mematahkan dormansi biji antara lain sitokinin, giberelin dan auksin (Sutopo, 2004).
Salah satu efek pemberian GA3 pada benih dapat mendorong pemanjangan
sel, sehingga radikula dapat menembus endosperma, kulit biji yang membatasi pertumbuhannya (Salisbury dan Ross, 1995).
Harjadi (1994) mengemukakan bahwa bahan kimia berupa persenyawaan sederhana seperti KNO3 dapat memecahkan dormansi. KNO3 dengan konsentrasi
tertentu dapat merangsang pertumbuhan. Sejalan dengan hasil penelitian Sulaiman dkk (2004) perendaman H2SO4, KNO3, dan asam giberelin merupakan perlakuan
kimia dalam pematahan dormansi benih. Kulit benih yang keras bersifat impermeabel terhadap air dan udara sehingga menghalangi proses perkecambahan benih.
Menurut Lensari (2009) perlakuan pematahan dormansi pada benih Angsana dengan perendaman H2SO4 1% selama 10 menit dan perendaman dengan
KNO3 1% selama 24 jam mampu meningkatkan daya perkecambahan biji
Berdasarkan permasalahan diatas peneliti tertarik untuk melakukan pematahan dormansi biji Mucuna bracteata dengan perlakuan pengguntingan kulit dan perendaman menggunakan H2SO4 1%, KNO3 1%, serta asam giberelat (GA3)
sehingga diharapkan mampu meningkatkan perkecambahan biji.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji pengaruh pematahan dormansi terhadap kemampuan perkecambahan serta mengetahui perlakuan pematahan dormansi yang terbaik untuk benih Mucuna (Mucuna bracteata D.C.).
Hipotesis Penelitian
Ada pengaruh nyata pematahan dormansi dengan pengguntingan kulit, perendaman dengan H2SO4 1%, KNO3 1%, serta giberelin (GA3) 300 ppm
terhadap kemampuan berkecambah benih Mucuna (Mucuna bracteata D.C.).
Kegunaan Penelitian
- Sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Botani Tanaman
Sistematika tanaman Mucuna bracteata adalah sebagai berikut ini : Kingdom: Plantae; Divisio: Spermatophyta; Subdivisio: Angiospermae; Ordo: Fabales; Family: Fabaceae; Genus: Mucuna; Species: Mucuna bracteata D.C. (Harahap, dkk, 2008).
Mucuna bracteata memiliki perakaran tunggang berwarna putih kecoklatan, dan memilki bintil akar berwarna merah muda segar dan sangat banyak, pada nodul dewasa terdapat kandungan leghaemoglobin. Laju pertumbuhan akar relatif cepat pada umur tiga tahun panjang akar dapat mencapai 3 m kedalam tanah (Harahap dan Subronto, 2004).
Batang tanaman ini berwarna hijau kecoklatan umumnya batang tumbuh menjalar, merambat dan membelit diameter batang dewasa dapat mencapai 0,4 - 1,5 cm dan pada umumnya memilki buku-buku dengan panjang dapat mencapai 25 - 35 cm. Batang mucuna pada umumnya tidak berbulu, bertekstur cukup lunak, lentur dan mengandung serat dan berair. Batang yang telah tua akan mengeluarkan binti-bintil kecil berwarna putih yang bila bersinggungan dengan tanah akan berdiferensiasi menjadi akar baru (Mugnisjah dan Setiawan, 1991).
Daun berbentuk oval pada setiap tangkai daun terdapat 3 helai anak daun berwarna hijau dan muncul disetiap ruas batang. Ukuran daun dewasa dapat mencapai 15 x 10 cm. Jika suhu meningkat maka helaian daun dapat menutup sehingga mengurangi respirasi pada permukaan daun (Harahap, dkk, 2008).
monoceous. Bunga berwarna biru terong dan dapat mengeluarkan bau yang
menyengat sehingga dapat menarik perhatian kumbang penyerbuk (Harahap dan Subronto, 2004).
Polong Mucuna pada awalnya berwarna hijau dengan bulu-bulu kecoklatan yang dapat menyebabkan gatal pada kulit, polong yang siap di panen adalah polong yang sudah berubah menjadi coklat tua. Polong siap dipanen sekitar 50 hari setelah terbentuk dari bakal polong (Edy et al., 2007).
Biji berbentuk bulat oval berwarna hitam dan pada umumya memiliki kulit biji yang tebal sehingga perbanyakan melalui biji dapat dilakukan dengan perlakuan benih melalui skarifikasi dan penggunaan larutan kimia. Bobot biji dapat mencapai 0,5 - 1 g/biji (Purwanto, 2007).
Syarat Tumbuh Iklim
Tanaman Mucuna bracteata dapat tumbuh baik di berbagai daerah baik dataran tinggi maupun dataran rendah. Tetapi untuk dapat melakukan
pertumbuhan generatif atau berbunga tanaman ini memerlukan ketinggian > 1000 m dpl, jika berada di bawah 1000 m dpl maka pertumbuhan akan jagur
tetapi tidak dapat terjadi pembentukan bunga (Harahap dan Subronto, 2004). Kelembaban Mucuna bracteata menghendaki areal yang tinggi dari permukaan laut untuk dapat memasuki fase generatif. Tanaman ini tidak menyukai kelembaban udara terlalu tinggi. Jika kelembaban udara terlalu tinggi, maka bunga-bunga yang telah terbentuk akan busuk, layu dan kering.
Untuk dapat melakukan pembungaan tanaman ini memerlukan suhu harian berkisar antara 12oC – 23oC. Apabila suhu berada diatas 18oC maka pembungaan
akan sulit terjadi (Mugnisjah dan Setiawan, 1991).
Curah hujan yang dibutuhkan agar pertumbuhan tanaman mucuna baik berkisar antara 1000 - 2500 mm/thn dan 3 - 10 merupakan hari hujan setiap bulannya. Sedangkan untuk kelembaban tanaman ini adalah 80%. Jika
kelembaban terlalu tinggi akan berakibat bunga busuk, layu dan kering. Untuk panjang penyinaran, Mucuna bracteata membutuhkan lama penyinaran penuh
antara 6 - 7 jam/hari (Harahap dan Subronto, 2004).
Kacangan penutup tanah ini termasuk ke dalam tanaman berhari pendek dan hanya membutuhkan 6 - 7 jam penyinaran matahari penuh untuk setiap harinya. Jika ditanam di daerah panas dengan penyinaran matahari panjang maka Mucuna bracteata akan merundukkan daun dan batangnya untuk mengurangi penguapan yang umum terjadi di siang hari (Harahap, dkk, 2008).
Tanah
Mucuna bracteata dapat tumbuh baik hampir setiap jenis tanah, pertumbuhan akan lebih baik apabila tanah mengandung bahan organik yang cukup tinggi, gembur dan tidak jenuh. Apabila mucuna ditanam pada tanah yang tergenang akan mengakibatkan pertumbuhan vegetatif terganggu. Untuk pertumbuhan Mucuna bracteata secara umum dapat tumbuh baik pada kisaran pH 4,5 - 6,5 (Harahap dan Subronto, 2004).
mampu menghasilkan bahan organik dari sisa-sisa tanaman sebesar 1,75 ton/ha (Setiawan, 2008).
Dormansi Biji
Dormansi adalah suatu keadaan dimana benih tidak dapat melakukan perkecambahan meskipun dalam keadaan yang optimum. Dormansi benih dapat disebabkan antara lain adanya impermeabilitas kulit biji terhadap air dan gas (oksigen), embrio yang belum tumbuh secara sempurna, hambatan mekanis kulit benih terhadap pertumbuhan embrio, belum terbentuknya zat pengatur tumbuh atau karena ketidakseimbangan antara zat penghambat dengan zat pengatur tumbuh di dalam embrio (Hartmann,et. al, 2002; Villiers, 1972).
Secara alamiah dormansi benih merupakan suatu mekanisme pengaturan perkecambahan sebagai adaptasi untuk ketahanan alami spesies yang bersangkutan terhadap kondisi lingkungan yang tidak sesuai untuk perkecambahan (Sahupala, 2007).
Dormansi pada benih dapat disebabkan oleh karena keadaan fisik dari kulit biji, keadaan fisiologis dari embrio atau kombinasi kedua keadaan tersebut. sebagai contoh: kulit biji yang impermeabel terhadap air dan gas sering dijumpai pada benih-benih dari famili Leguminosae. Pada benih wortel yang dormansinya diakibatkan oleh immaturity pada embrionya (Sutopo, 2004).
kulit biji, yang akan bersaing dengan embrio dalam mendapatkan oksigen (Mayer and Mayber, 1975).
Menurut Silvertown (1999) dalam Mistiani (2012) dormansi terbagi atas beberapa tipe yaitu tipe endogenus, berhubungan dengan keadaan embrio, dan tipe eksogenus, berhubungan dengan endosperm atau jaringan-jaringan lain pada benih atau buah.
Dormansi pada benih Mucuna bracteata disebabkan oleh keadaan fisik dari kulit biji. Lapisan kulit yang keras menghambat penyerapan air dan gas ke dalam biji sehingga proses perkecambahan tidak terjadi. Dormansi dari jenis leguminosae sangat beragam, untuk jenis mucuna masa dormansi benih berkisar antara dua sampai enam bulan (Purwanto, 2007).
Perkembangan impermeable seed coats berpengaruh secara langsung terhadap fase istirahat. Impermeable seed coats bagi biji yang sedang mengalami dormansi, dapat mereduksi kandungan oksigen yang ada di dalam biji, sehingga dalam keadaan anaerobik, terjadi sintesa zat penghambat tumbuh (growth inhibiting subtance). Fase akhir dari dormansi adalah fase berkecambah. Setelah fase istirahat berakhir, maka aktivitas metabolisme meningkat dengan disertai meningkatnnya aktivitas enzim dan respirasi (respiration rate) (Abidin, 1983).
Pematahan Dormansi Biji
kulit biji dengan kertas empelas, melubangi kulit biji dengan pisau, pembakaran dengan bantuan pisau, jarum, kikir, pembakar, kertas gosok atau perlakuan impaction (goncangan) untuk benih-benih yang memiliki sumbat gabus. Dimana semuanya bertujuan agar kulit biji lebih permeabel terhadap air dan gas oksigen (O2) (Utomo, 2006; Jain, 2008; Kramer and Kozlowski, 1960; Sutopo, 2004; Devlin and Witham, 2002).
Skarifikasi
Pengguntingan kulit biji dilakukan dengan cara menggunting salah satu sisi biji dengan gunting kuku sehingga kulit terkupas dan air dapat dengan mudah masuk ke dalam biji. Pengguntingan ini harus dilakukan dengan hati-hati jangan sampai merusak embrio biji. Persentase perkecambahan dengan cara ini lebih tinggi dibandingkan dengan cara skarifikasi yaitu mencapai 95%, namun pengerjaannya lebih sulit dibandingkan dengan perlakuan yang pertama (Gardner et. al, 1991).
Skarifikasi pada biji seperti palem tidak meningkatkan perkecambahan, tetapi skarifikasi pada bagian pangkal biji dekat dengan embrio menyebabkan air lebih mudah menembus kulit biji sehingga mempercepat perkecambahan dan skarifikasi juga dapat dilakukan dengan penipisan kulit endokarp pada seluruh permukaan biji sampai kelihatan endosperm biji yang menghalangi masuknya air ke dalam benih. Skarifikasi pada bagian pangkal biji harus dilakukan dengan hati-hati jangan sampai embrio rusak (Meerow, 2004).
biji baik terhadap air atau gas, resistensi mekanis kulit perkecambahan yang terdapat pada kulit biji (Sutopo, 2004).
Penelitian tentang pematahan dormansi telah dilakukan. Hasil penelitian Sulaiman dkk (2008) dengan merendam biji mucuna dalam air panas 85oC
menghasilkan perkecambahan sebesar 66% pada minggu kedua setelah semai. Siregar (2010) juga melaporkan bahwa benih mucuna dengan pengguntingan kulit biji menghasilkan 70% perkecambahan.
Perendaman asam sulfat (H2SO4)
Asam sulfat (H2SO4) merupakan salah satu zat kimia yang mampu
meningkatkan persentase perkecambahan pada benih yang memiliki dormansi kulit benih yang keras . Hal ini disebabkan oleh H2SO4 memfasilitasi kandungan
lignin pada benih sehingga benih berlubang. Hal ini menyebabkan air mudah masuk sehingga benih mudah berkecambah. Hasil penelitian tentang penggunaan larutan H2SO4 untuk pematahan dormansi kulit dapat digambarkan pada Jati
(Tectona grandis Linn. F.). Penelitian Hidayat (2005) tentang pematahan dormansi Jati dengan perendaman dalam larutan Accu Zurr 10% selama 0, 5, 6, 7, 8, dan 9 menit. Perendaman dalam larutan Accu Zurr selama 9 menit memberikan pengaruh yang sangat nyata terhadap daya kecambah, nilai perkecamahan, dan kecepatan tumbuh benih jati.
digunakan dengan konsentrasi yang bervariasi sampai pekat tergantung jenis benih yang diperlakukan, sehingga kulit biji menjadi lunak.
Disamping itu pula larutan kimia yang digunakan dapat pula membunuh cendawan atau bakteri yang dapat membuat benih dorman. Sadjad et al. (1975) menyatakan bahwa perlakuan kimia (biasanya asam kuat) yang digunakan dapat membebaskan koloid hidrofil sehingga tekanan imbibisi meningkat dan akan meningkatkan metabolisme benih. Sagala (1991) mengatakan bahwa perlakuan dengan menggunakan H2SO4 pada benih biasanya bertujuan untuk merusak kulit
benih, akan tetapi apabila terlalu berlebihan dalam hal konsentrasi atau lama waktu perlakuan dapat menyebabkan kerusakan pada embrio. Dalam hal ini benih tersebut akan rusak dan tidak dapat tumbuh.
Menurut Sadjad et al. (1975) perlakuan kimia seperti H2SO4 pada
prinsipnya adalah membuang lapisan lignin pada kulit biji yang keras dan tebal sehingga biji kehilangan lapisan yang permiabel terhadap gas dan air sehingga metabolisme dapat berjalan dengan baik. Achmad et al. (1992) mengatakan bahwa perlakuan pendahuluan untuk benih Cendana (Satalum album) adalah dengan perendaman dalam larutan H2SO4 pekat selama 50-60 menit. Dan menurut
Muharni (2002) dalam Rozi (2003) dalam penelitiannya mengatakan bahwa larutan H2SO4 memberikan pengaruh yang paling baik terhadap benih dan
pertumbuhan semai Kayu Kuku. Perendaman kalium nitrat (KNO3)
Kaliun nitrat (KNO3) merupakan salah satu perangsang perkecambahan
terutama embrio yang belum masak fisiologis. KNO3 mempunyai pengaruhyang
kuat terhadap persentase perkecambahaan dan vigor pada perlakuan pendahuluan asam benih Acacia nilotica (Schmidth, 2002).
Pematahan dormansi dengan KNO3 diduga berhubungan dengan aktifitas
lintasan pentosa fospat, ketersediaan O2 yang terbatas mengakibatkan lintasan
pentosa fospat menjadi non aktif, karena O2 digunakan untuk aktifitas respirasi
melalui lintasan lain. Perlakuan benih dengan aseptor hidrogen seperti nitrat, nitrit dan methylene blue diduga dapat membantu proses reoksidasi NADPH sehingga mengaktifkan kembali lintasan pentosa fospat. NADH dan NADPH merupakan koenzim yang penting untuk beberapa lintasan metabolisme yang diperlukan untuk perkecambahan benih, perkembangan bibit dan organ penyimpanan. Koenzim tersebut diantaranya berperan dalam proses respirasi, reaksi kimia, sintesis deoxynukleotida dan katabolisme asam lemak (Athiyah, 2008).
Metode pematahan dormansi sendiri dapat dilakukan dengan berbagai cara antara lain dengan cara mekanis, fisis maupun kimia. Metode kimia dapat dikatakan metode yang paling praktis karena hanya dilakukan dengan mencampurkan cairan kimia dengan biji. Larutan kimia yang terkenal murah dan tersedia banyak di pasaran adalah KNO3. KNO3 juga sudah teruji efektif
mematahkan dormansi beberapa benih tanaman, antara lain padi dan aren. KNO3
berfungsi untuk meningkatkan aktifitas hormon pertumbuhan pada benih. Pengaruh KNO3 yang ditimbulkan ditentukan oleh besar kecil konsentrasinya.
Perlakuan awal dengan larutan KNO3 berperan merangsang perkecambahan pada
juga dapat mengaktifkan metabolisme sel dan mempercepat perkecambahan (Faustina, dkk, 2011).
Menurut hasil penelitian sebelumnya, Cempaka (2011) mengatakan bahwa teknik pematahan dormansi menggunakan perendaman benih dalam larutan KNO3
1% selama 24 jam merupakan teknik pematahan dormansi yang efektif untuk varietas Bah Butong.
Pada konsentrasi 1% perkecambahan meningkat dari 37% (kontrol) menjadi 79% dan pada konsentrasi 2% meningkat menjadi 85%. Pada Casuariana equiaetifolia perkecambahan meningkat dari 46% dalam kontrol menjadi 65% setelah perendaman dalam 1,5% KNO3 selama 36 jam. Pada percobaan ini,
konsentrasi tertinggi dan terendah dan lamanya waktu perendaman yang sangat singkat memperlihatkan perkecambahan yang sangat rendah. konsentrasi dan lamanya waktu perendaman mempengaruhi tingkat kerusakan pada biji. Semakin tinggi dan semakin lama waktu perendaman maka kerusakan biji juga semakin tinggi (Schmidth, 2002).
Penelitian Ellis et al. (1983) menyatakan nitrit atau nitrat yang berasal dari larutan KNO3 diketahui memiliki stimulatory effect terhadap perkecambahan
benih melalui perannya sebaga ion penerima elektron. Hasanah (1989) menyatakan meningkatnya daya berkecambah benih padi diduga karena pematahan dormansi oleh impermeabilitas kulit benih terhadap oksigen dapat diatasi dengan perendaman dalam larutan KNO3 3%. Nugraha dan Soejadi (2001)
melaporkan perendaman benih padi dalam larutan KNO3 3% selama dua hari
Pematahan dormansi dengan KNO3 diduga berhubungan dengan aktivitas
lintasan pentose fosfat, oksigen yang terbatas mengakibatkan lintasan pentose fosfat menjadi inaktif karena oksigen digunakan untuk aktivitas respirasi melalui lintasan lain (Bewley & Black 1985). Perendaman dalam larutan KNO3 dapat
meningkatkan daya berkecambah benih yang diduga karena impermeabilitas kulit benih terhadap air dan oksigen (Hasanah, 1989). Ilyas & Diarni (2007) melaporkan bahwa perlakuan perendaman dalam KNO3 1% selama 48 jam
merupakan pematahan dormansi yang paling efektif pada benih padi gogo varietas Kalimutu, Way Rarem dan Gajah Mungkur pada 0 MSP (masa sesudah panen). Perendaman giberelin (GA3)
Giberelin adalah hormon tanaman yang terlibat dalam pertumbuhan dan perkembangan tanaman, perpanjangan batang, pembungaan dan perkecambahan biji. Giberelin mempunyai peran dalam mendukung perpanjangan sel, aktifitas kambium dan mendukung pembentukan RNA baru serta sintesis protein, sehingga mampu mempercepat perkembangan sel (Abidin, 1983).
memecahkan amilim dan gula yang kemudian ditransportasikan ke embrio yang sedang berkembang (Davies, 2004).
Giberelin dapat memecahkan dormansi biji dan tunas pada sejumlah tanaman. Giberelin menginisiasi sintesa amilase, enzim pencerna, dalam sel - sel aleuron, lapisan sel-sel paling luar dari endosperm. Giberelin juga terlibat dalam pengaktifan sintesa protease dan enzim - enzim hidrolitik lainnya. Senyawa-senyawa gula dan asam-asam amino, zat - zat dapat larut yang dihasilkan oleh aktivitas amilase dan protease, ditransfer ke embrio, dan di sini zat - zat ini mendukung perkembangan embrio dan munculnya kecambah. pengaruh pemberian giberelin terhadap pembesaran sel yaitu tumbuh tunas lateral pada bagian tanaman, dan juga mampu meningkatkan besar daun beberapa jenis tumbuhan (Heddy, 1989).
Penelitian menggunaan giberelin dalam mematahkan dormansi banyak dilakukan menurut Sormin (2010) juga melaporkan bahwa biji mucuna yang direndam dalam zat pengatur tumbuh GA3 300 ppm mampu menghasilkan
perkecambahan sebesar 66%. Dan menurut Indrawati (1999) dalam penelitiannya mengatakan bahwa pematahan dormansi dengan perendaman GA3 300 ppm
selama 24 jam mampu meningkatkan perkecambahan benih aren sebesar 70%.
Perkecambahan Biji
dari protoplasma. Tahap kedua dimulai dengan kegiatan-kegiatan sel dan enzim-enzim serta naiknya tingkat respirasi benih. Tahap ketiga merupakan tahap dimana terjadi penguraian bahan-bahan seperti karbohidrat, lemak, dan protein menjadi bentuk-bentuk yang melarut dan ditranslokasikan ke titik-titik tumbuh. Tahap keempat adalah asimilasi dari bahan-bahan yang telah diuraikan tadi di daerah meristematik untuk menghasilkan energi bagi kegiatan pembentukan komponen dan pertumbuhan sel-sel baru. Tahap kelima adalah pertumbuhan dari kecambah melalui proses pembelahan, pembesaran dan pembagian sel-sel pada titik-titik tumbuh dari akar, kemudian diikuti oleh ujung-ujung tumbuh tunas (Bewley and Black, 1986; kamil, 1979; Sutopo,2002).
Perkecambahan merupakan suatu proses di mana radikula (akar embrionik) memanjang ke luar menembus kulit biji. Di balik gejala morfologi dengan pemunculan radikula tersebut, terjadi proses fisiologi-biokemis yang kompleks, dikenal sebagai proses perkecambahan fisiologis (Salisbury dan Ross, 1995).
Benih yang mengalami kekurangan atau kerusakan giberelin endogen akan terhambat perkecambahannya dan hal ini dapat diatasi dengan pemberian giberelin eksogen. Giberelin eksogen yang kini banyak digunkan antara lain adalah GA3 (Kusumardhani, 1997).
tinggi dapat merusak enzim. Pertumbuhan umumnya berlangsung baik dalam keadaan gelap. Perkecambahan memerlukan hormon auksin dan hormon ini mudah mengalami kerusakan pada intensitas cahaya yang tinggi. Karena itu di tempat gelap kecambah tumbuh lebih panjang daripada di tempat terang (Kartasapoetra, 2003).
Dalam penelitian yang Lensari (2009) menyatakan bahwa biji yang berkecambah > 80% merupakan biji yang mempunyai vigor yang baik. Benih yang berkecambah setelah batas 80% biasanya pertumbuhan semainya kurang baik, kerdil dan bahkan mati.
Dalam tahap perkecambahan benih dapat tumbuh normal apabila benih tersebut dalam keadaan sehat. Menurut Sutopo (2004) benih dikatakan sehat apabila benih tersebut bebas dari patogen, baik berupa bakteri, cendawan, virus maupun nematoda. Sedangkan patogenisitas adalah kemampuan relatif dari suatu patogen untuk menyebabkan kematian. penyakit yang ditimbulkannya kemungkinan dapat terjadi pada kecambah, tanaman muda ataupun tanaman yang telah dewasa. Selain itu kesehatan benih juga dapat menurun akibat karena kerusakan-kerusakan fisik pada benih yang menudahkan patogen-patogen tertentu dapat berkembang dan menurunkan kualitas benih.
ditumbuhi cendawan atau bila dipijat terasa lembek, berarti benih tersebut mati (Saenong et al., 1989).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Dasar Pemuliaaan Tanaman dan dilanjutkan ke rumah kasa Fakultas Pertanian Universitas Sumatera Utara, Medan dengan ketinggian ± 25 m di atas permukaan laut. Penelitian ini dilaksanakan pada Bulan Mei 2013 sampai dengan Juli 2013.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah biji Mucuna bracteata yang telah diseleksi sebagai bahan percobaan, asam sulfat 1 %, KNO3 1 % dan
giberelin (GA3) 300 ppm sebagai bahan untuk perlakuan pematahan dormansi,
aquadest sebagai bahan pelarut dan merendam biji, baby polibag sebagai wadah pembibitan serta top soil, kompos dan pasir sebagai media perkecambahan, label digunakan untuk memberi tanda setia perlakuan.
Alat yang digunakan dalam penelitian ini adalah bak kecambah plastik (seed bag) digunakan sebagai wadah media perkecambahan biji, gunting kuku sebagai alat memotong ujung biji, cawan petridish sebagai wadah biji yang telah diseleksi, beaker glass sebagai wadah untuk perendaman biji, gelas ukur untuk mengukur kebutuhan pelarut dan bahan kimia yang digunakan, batang pengaduk yang digunakan untuk mengaduk larutan kimia yang diencerkan, timbangan analitik untuk menimbang giberelin (GA3) yang digunakan dalam percobaan,
Metode Penelitian
Penelitian ini dilakukan di dua lokasi penelitian yaitu di laboratorium dan dilanjutkan ke rumah kasa.
a. Di laboratorium
Penelitian di Laboratorium menggunakan metode Rancangan Acak Kelompok (RAK) dengan 8 perlakuan yaitu:
A1 = Tidak diberi perlakuan (kontrol)
A2 =Pengguntingan kulit kemudian perendaman air 30 menit
A3 = Perendaman H2SO4 1 % selama 10 menit
A4 = Perendaman H2SO4 1 % selama 15 menit
A5 = Perendaman KNO3 1 % selama 12 jam
A6 = Perendaman KNO3 1 % selama 24 jam
A7 = Perendaman giberelin (GA3) 300 ppm selama 3 jam
A8 = Perendaman giberelin (GA3) 300 ppm selama 5 jam
Jumlah ulangan = 3 ulangan
Jumlah unit percobaan = 24 unit percobaan Jumlah biji/unit percobaan = 20 biji
Jumlah biji seluruhnya = 480 biji
Perlakuan yang dilanjutkan ke rumah kasa dengan kriteria persentase
b. Di rumah kasa
Berdasarkan hasil penelitian di laboratorium, Perlakuan yang dilanjutkan ke rumah kasa sebanyak 5 perlakuan yaitu A2, A3, A6, A7, A8. Maka Penelitian dirumah kasa menggunakan metode Rancangan Acak Kelompok (RAK) 5 perlakuan yaitu:
A2 =Pengguntingan kulit kemudian perendaman air 30 menit
A3 = Perendaman H2SO4 1 % selama 10 menit
A6 = Perendaman KNO3 1 % selama 24 jam
A7 = Perendaman giberelin (GA3) 300 ppm selama 3 jam
A8 = Perendaman giberelin (GA3) 300 ppm selama 5 jam
Jumlah ulangan = 3 ulangan
Jumlah tanaman/unit percobaan = 6 tanaman Jumlah sampel/unit percobaan = 3 tanaman Jumlah seluruh sampel = 45 tanaman Jumlah tanaman seluruhnya = 90 tanaman
Metode Analisis Data
Data hasil penelitian dianalisa dengan menggunakan sidik ragam berdasarkan model linier : Yij = + Ti+ Bj + ij
Yij = Respon atau nilai pengamatan dari perlakuan ke-i dan ulangan ke-j
= Nilai tengah umum
Ti = Pengaruh perlakuan ke-i.
Bj = Pengaruh blok ke-j.
PELAKSANAAN PENELITIAN
a. Di Laboratorium
Persiapan wadah perkecambahan
Wadah perkecambahan yang digunakan dalam penelitian ini adalah bak kecambah plastik yang berukuran sedang yaitu 30 x 22 cm sebanyak 24 bak
kecambah (seed bag). Bak perkecambahan yang digunakan dibersihan dari kotoran.
Persiapan media perkecambahan
Media perkecambahan yang digunakan adalah pasir steril. Pasir yang digunakan terlebih dahulu disterilkan dengan cara digonseng. Setelah itu dimasukkan kedalam wadah perkecambahan dengan ketebalan ± 5 cm.
Seleksi biji
Seleksi biji dilakukan sebelum perendaman biji dengan memasukkan benih ke dalam air, benih yang tenggelam yang digunakan dalam penelitian, sedangkan benih yang mengapung disingkirkan. Benih yang baik umumnya mempunyai warna yang kilat, bebas dari hama dan penyakit, tidak pecah kulitnya, tidak kisut dan tidak berjamur.
Pengenceran larutan kimia
Pembuatan larutan kimia yang digunakan untuk perendaman benih dilakukan dengan cara:
a. H2SO4 1 % diperoleh dengan cara melarutkan 5 ml H2SO4 dalam 500 ml
aquadest.
b. KNO3 1 % diperoleh dengan cara melarutkan 5 ml KNO3 dalam 500 ml
c. Giberelin (GA3) 300 ppm diperoleh dengan cara melarutkan 0,3 g dalam 1 liter
aquadest.
Pengguntingan kulit
Perlakuan pengguntingan kulit biji dilakukan pada ujung kulit biji dengan menggunakan gunting kuku yaitu memotong pada sisi punggung biji. Pemotongan kulit biji dilakukan tidak sampai melukai embrio biji tersebut.
Perendaman biji
Perlakuan perendaman benih dilakukan dengan merendam biji yang telah diseleksi. Perendaman dilakukan dengan cara:
a. Perendaman dengan air selama 30 menit
b. Perendaman biji dengan H2SO4 1 % selama 10 menit.
c. Perendaman biji dengan H2SO4 1 % selama 15 menit.
d. Perendaman biji dengan KNO3 1 % selama 12 jam.
e. Perendaman biji dengan KNO3 1 % selama 24 jam.
f. Perendaman dengan giberelin (GA3) 300 ppm selama 3 jam
g. Perendaman dengan giberelin (GA3) 300 ppm selama 5 jam
Perkecambahan biji
b. Di rumah kasa Pembuatan naungan
Naungan dibuat dari tiang bambu dengan atap plastik agar cahaya matahari tetap masuk. Ukurangan naungan yang digunakan dengan panjang 700 cm dan lebar 300 cm dengan arah naungan mengahadap ke Utara-Selatan.
Persiapan wadah pembibitan
Wadah persemaian bibit yang digunakan adalah baby polibag. Dengan ukuran baby polibag sebesar 15 cm x 22 cm x 0,09 mm.
Persiapan media tanam
Media tanam yang digunakan untuk pembibitan adalah top soil dan kompos dengan perbandingan 2:1. Sebelum kecambah dipindahkan kedalam baby polibag, media tanam disiram dengan air terlebih dahulu.
Pemindahan bibit
Pemindahan bibit dilakukan dengan memindahkan kecambah normal ke dalam baby polibag dan dipelihara di rumah kasa. Pemindahan bibit ke baby polibag dilakukan setelah kecambah tumbuh baik dengan kriteria :
a. Kecambah tumbuh normal yaitu lengkap seluruh bagiannya. b. Kotiledon biji telah lepas.
c. Pada kecambah telah muncul 2 daun.
Pemindahan bibit dilakukan pada waktu tidak yang sama yaitu perlakuan: -A2 pindah tanam pada 8 hari setelah perkecambahan.
Pemeliharaan Penyiraman
Penyiraman air dilakukan pada saat biji dikecambahkan sampai
dipindahkan ke baby polibag. Waktu penyiraman dikondisikan dengan keadaan media tanam. Apabila masih dalam keadaan lembab maka tidak perlu
dilakukan penyiraman. Penyiangan
Penyiangan dilakukan dengan cara mencabut gulma yang tumbuh pada media perkecambahan dan pembibit yang dipelihara dirumah kasa. Penyiangan gulma dilakukan secara manual dilakukan sesuai kondisi lapang.
Pengendalian hama dan penyakit
Peubah Amatan Di Laboratorium
Pertambahan kadar air biji (%)
Pertambahan kadar air biji dilakukan untuk mengetahui kadar air yang dapat diserap oleh biji yang akan digunakan untuk proses perkecambahan. Dengan rumus perhitungan kadar air:
� � � = Berat biji akhir − Berat biji awalBerat biji awal × %
(Kartasapoetra, 2003). Daya berkecambah (%)
Penentuan daya berkecambah berdasarkan jumlah kecambah normal yang tumbuh yang dihitung sampai jangka 30 hari setelah tanam. Rumus daya berkecambahan adalah sebagai berikut:
� � � � = ∑ kecambah normal yang ditumbuh∑ benih yang dikecambahkan × %
(Sutopo, 2005).
Kecepatan tumbuh benih (%/etmal)
Pengamatan ini dihitung tiap satuan percobaan berdasarkan persentase kecambah normal per etmal (hari) pada kurun waktu berkecambah dalam kondisi optimum berkecambah.
Intensitas dormansi (%)
dengan menggunakan tetrazolium untuk mengetahui kondisi kesehatan biji. Persentase intensitas dormansi dihitung dengan rumus:
�� = ∑ benih segar yang tidak tumbuh ∑ benih yang ditanam × %
(Sadjad, 1993).
Di rumah kasa Panjang sulur (cm)
Pengamanatan panjang sulur dilakukan pada 2, 4 dan 6 minggu setelah pindah tanam (MSPT). Dengan mengukur panjang sulur mulai pangkal sampai bagian tanaman ujung sulur dengan menggunakan meteran.
Jumlah daun bibit (helai)
HASIL DAN PEMBAHASAN
Hasil
Di Laboratorium
Berdasarkan hasil pengamatan dan analisis sidik ragam penelitian menunjukkan bahwa pematahan dormansi dengan cara fisik dan kimia berpengaruh nyata terhadap seluruh parameter yang diamati selama Laboratorium yaitu kadar air biji (%), daya berkecambah (%), kecepatan tumbuh benih (%/etmal), dan intensitas dormansi (%). Hasil pengamatan dan analisis sidik ragam dapat di lihat pada Lampiran 13 sampai 20.
Kadar air biji (%)
Berdasarkan hasil pengamatan dan analisis sidik ragam parameter kadar air biji (%) pada Lampiran 13 dan 14 menunjukkan bahwa perlakuan pematahan
Keterangan : Angka-angka yang diikuti notasi yang sama pada setiap baris menunjukkan tidak berbeda nyata dengan uji beda rata-rata duncan pada taraf 5 %.
Dari Tabel 1. dapat dilihat bahwa kadar air tertinggi pada perlakuan perendaman dengan KNO3 1 % selama 24 jam (A6) sebesar 38,06 % dan kadar air
Daya berkecambah (%)
Berdasarkan hasil pengamatan dan analisis sidik ragam daya berkecambah biji (%) menunjukkan bahwa perlakuan pematahan dormansi dengan cara
Perlakuan Rataan daya berkecambah (%)
A3 = perendaman H2SO4 10 menit 91,67 a
Keterangan : Angka-angka yang diikuti notasi yang sama pada setiap baris menunjukkan tidak berbeda nyata dengan uji beda rata-rata duncan pada taraf 5 %.
Dari Tabel 2. dapat dilihat daya berkecambah tertinggi pada perlakuan A3 dan perlakuan A6 sebesar 91,67 %, daya berkecambah terendah pada perlakuan A1 sebesar 5 %.
Kecepatan tumbuh benih (%/etmal)
Tabel 3. Rataan kecepatan tumbuh benih (%/etmal) dengan pematahan dormansi secara fisik dan kimia
Perlakuan Rataan kecepatan tumbuh benih (%/etmal)
A2 = pengguntingan biji 13,50 a
Keterangan : Angka-angka yang diikuti notasi yang sama pada setiap baris menunjukkan tidak berbeda nyata dengan uji beda rata-rata duncan pada taraf 5 %.
Dari Tabel 3. dapat diketahui bahwa kecepatan tumbuh tertinggi pada perlakuan A2 sebesar 13,50%/etmal dan kecepatan tumbuh terendah pada perlakuan A1 (kontrol) sebesar 0,20 %/etmal.
Intensitas dormansi (%)
Dari hasil pengamatan dan analisis sidik ragam pada Lampiran 19 dan 20 menunjukkan bahwa perlakuan pematahan dormansi dengan cara fisik dan kimia berpengaruh nyata terhadap intensitas dormansi (%). Rataan intensitas dormansi (%)dan notasi hasil uji lanjut duncan pada taraf 5 dapat di lihat pada Tabel 4. Tabel 4. Rataan intensitas dormansi (%) dengan pematahan dormansi secara fisik
dan kimia
Perlakuan Rataan intensitas dormansi (%)
A2 = Pengguntingan biji 0,00 f
Keterangan : Angka-angka yang diikuti notasi yang sama pada setiap baris menunjukkan tidak berbeda nyata dengan uji beda rata-rata duncan pada taraf 5 %.
Di Rumah Kasa
Hasil penelitian yang dilanjutkan ke rumah kasa menunjukkan bahwa perlakuan pematahan dormansi dengan cara fisik dan kimia tidak berpengaruh nyata pada semua parameter yaitu panjang sulur (cm) dan jumlah daun (helai). Panjang sulur (cm)
Berdasarkan hasil pengamatan dan analisis sidik ragam panjang sulur (cm) pada 2, 4, dan 6 MSPT menunjukkan bahwa perlakuan pematahan dormansi dengan cara fisik dan kimia berpengaruh tidak nyata terhadap parameter tersebut. Hasil pengamatan dan analisis sidik ragam dapat di lihat pada Lampiran 21 sampai 26.
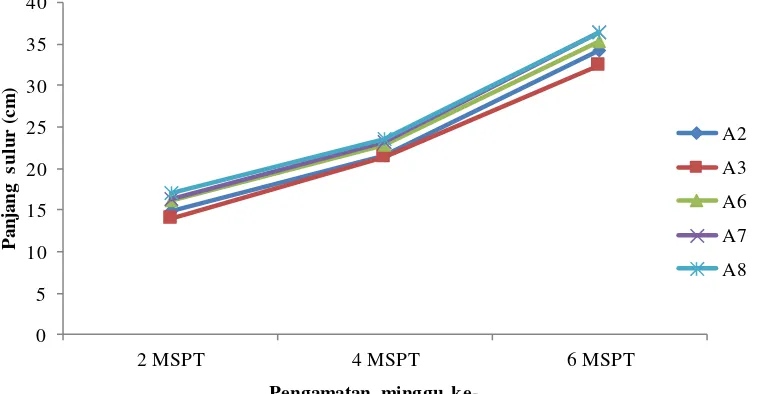
Kurva pertumbuhan panjang sulur 2, 4 dan 6 MSPT dengan perlakuan berbagai pematahan dormansi dapat dilihat pada Gambar 1.
selama 5 jam) yaitu sebesar 36,4 cm dan panjang sulur terendah pada perlakuan A3 (perendaman dengan H2SO4 1% selama 10 menit) yaitu sebesar 32,47cm.
Jumlah daun (helai)
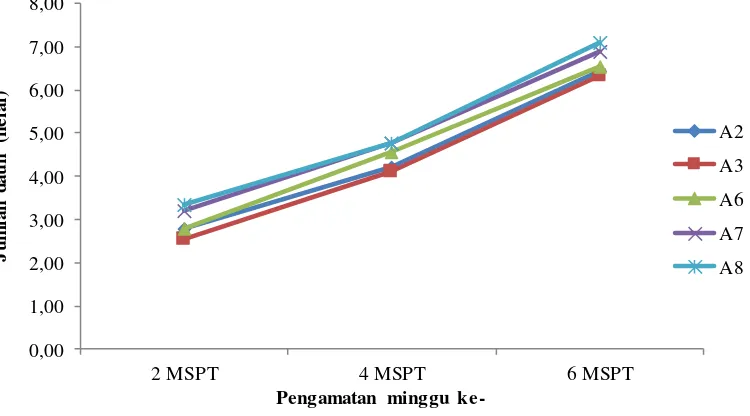
Berdasarkan hasil pengamatan dan analisis sidik ragam parameter jumlah daun (helai) menunjukkan bahwa perlakuan pematahan dormansi dengan cara fisik dan kimia tidak berpengaruh nyata terhadap jumlah daun pada 2, 4 dan 6 MSPT. Hasil pengamatan dan analisis sidik ragam jumlah daun (helai) 2, 4 dan 6 MSPT dapat dilihat pada Lampiran 27 sampai 32.
Kurva pertumbuhan jumlah daun (helai) 2, 4 dan 6 MSPT dari pengaruh pematahan dormansi dengan cara fisik dan kimia dapat dilihat pada Gambar 2.
Pembahasan
Berdasarkan penelitian yang dilakukan perlakuan yang paling baik terhadap kemampuan berkecambah biji Mucuna bracteata D.C. adalah perlakuan A3 (perendaman dengan H2SO4 1% selama 10 menit), A6 (perendaman KNO3 1%
selama 24 jam), dan A8 (perendaman dengan GA3 300 ppm selama 5 jam) karena
menghasilkan daya berkecambah > 80% dengan masing-masing daya berkecambah sebesar 91,67% dan 86,67%. Menurut Lensari (2009) menyatakan bahwa biji yang berkecambah > 80% merupakan biji yang mempunyai vigor yang baik. Namun apabila kita lihat dari segi lamanya waktu pengerjaan pada perlakuan A3 lebih baik dibandingkan A6 dan A8 yang hanya membutuhkan waktu perendaman selama 10 menit saja, sehingga memudahkan pengerjaan dalam skala besar. Tetapi dari segi ekonomis perlakuan A6 lebih baik digunakan dibandingkan perlakuan A3 dan A8 karena harga KNO3 yang lebih murah dari pada kedua
bahan kimia tersebut. Oleh karena itu tidak harus mengeluarkan biaya yang tinggi, sehingga dalam pengerjaan skala yang besar pengerjaan sederhana dan biaya yang dikeluarkan untuk perlakuan awal biji tidak terlalu tinggi.
Pada perlakuan A6 (perendaman KNO3 1% selama 24 jam) menghasilkan
daya berkecambah tinggi sebesar 91,67% dikarenakan KNO3 merupakan senyawa
yang dapat mengaktifkan metabolisme sel dan mempercepat perkecambahan. Menurut Ellis et.al. (1983) menyatakan bahwa nitrit atau nitrat yang berasal dari larutan KNO3 diketahui memiliki stimulatory effect terhadap perkecambahan
benih melalui perannya sebagai ion penerima elektron. Pematahan dormansi dengan KNO3 diduga berhubungan dengan aktivitas lintasan pentosa fosfat,
karena oksigen digunakan untuk aktivitas respirasi melalui lintasan lain (Bewley & Black 1985). Dan menurut Hasanah (1989) perendaman dalam larutan KNO3
dapat meningkatkan daya berkecambah benih yang diduga karena impermeabilitas kulit benih terhadap air dan oksigen sejalan dengan Ilyas dan Diarni (2007) melaporkan bahwa perlakuan perendaman dalam KNO3 1% selama 48 jam
merupakan pematahan dormansi yang paling efektif pada benih padi gogo varietas Kalimutu, Way Rarem dan Gajah Mungkur pada 0 MSP (masa sesudah panen).
Sedangkan pada perlakuan yang menggunakan KNO3 juga namun dengan
waktu perendaman yang lebih singkat yaitu perlakuan A5 (perendaman KNO3 1%
selama 12 jam) diperoleh daya berkecambah dan kecepatan tumbuh yang lebih rendah dibandingkan perlakuan A6 (perendaman KNO3 1% selama 24 jam)
dengan daya berkecambang A5 sebesar 48,33% dan A6 sebesar 91,67%. Rataan kecepatan tumbuh pada perlakuan A5 sebesar 3,09%/etmal dan A6 sebesar 8,75%/etmal. Dari data tersebut diketahui bahwa perlakuan A6 lebih baik dibandingkan A5. Hal tersebut didukung juga dari hasil intensitas dormansi perlakuan A6 sebesar 3,33% yang lebih rendah dari perlakuan A5 sebesar 46,67%. Hal tersebut menunjukkan pada perlakuan A5 waktu perendaman yang kurang lama. Schmidth (2002) menyatakan bahwa Pada konsentrasi 1% perkecambahan meningkat dari 37% (kontrol) menjadi 79% dan pada konsentrasi 2% meningkat menjadi 85%. Pada Casuariana equiaetifolia perkecambahan meningkat dari 46% dalam kontrol menjadi 65% setelah perendaman dalam 1,5% KNO3 selama 36 jam. Pada percobaan ini, konsentrasi tertinggi dan terendah dan
tingkat kerusakan pada biji. Semakin tinggi dan semakin lama waktu perendaman maka kerusakan biji juga semakin tinggi. Menurut Faustina, dkk (2011) menyatakan bahwa Pengaruh KNO3 yang ditimbulkan ditentukan oleh besar kecil
konsentrasinya. Perlakuan awal dengan larutan KNO3 berperan merangsang
perkecambahan pada hampir seluruh jenis biji.
Pada perlakuan A3 (perendaman H2SO4 1% selama 10 menit) juga
menghasilkan daya berkecambah tinggi yaitu sebesar 91,67%. Hasil tersebut di duga karena pemberian H2SO4 yang mampu melunakkan kulit keras biji mucuna
sehingga dapat melakukan proses imbibisi. Menurut Sadjad et al. (1975) perlakuan kimia seperti H2SO4 pada prinsipnya adalah membuang lapisan lignin
pada kulit biji yang keras dan tebal sehingga biji kehilangan lapisan yang permiabel terhadap gas dan air sehingga metabolisme dapat berjalan dengan baik. Achmad et al. (1992) mengatakan bahwa perlakuan pendahuluan untuk benih Cendana (Satalum album) adalah dengan perendaman dalam larutan H2SO4 pekat
selama 50-60 menit. Dan menurut Muharni (2002) dalam Rozi (2003) dalam penelitiannya mengatakan bahwa larutan H2SO4 memberikan pengaruh yang
paling baik terhadap benih dan pertumbuhan semai Kayu Kuku.
Pada perlakuan A4 (perendaman H2SO4 1 % selama 15 menit) diperoleh
rataan kadar air lebih tinggi daripada A3 (perendaman H2SO4 1 % selama 10
jauh lebih tinggi sebesar 91,67%. Dari hasil tersebut di duga bahwa kadar air yang tinggi belum tentu menghasilkan daya kecambah yang tinggi pula. Rendahnya daya kecambah pada perlakuan A4 diduga dengan kadar air tinggi menyerap senyawa asam sulfat tersebut lebih tinggi pula. Sehingga dapat disimpulkan bahwa pada perlakuan A4 waktu perendaman biji terlalu lama sehingga senyawa kimia tersebut merusak embrio biji. Hal ini didukung dengan hasil uji tetrazolium biji yang menunjukkan bahwa biji pada perlakuan A4 lebih banyak yang tidak bewarna yang mengartikan biji telah rusak. Menurut Sagala (1991) menyatakan bahwa perlakuan dengan menggunakan H2SO4 pada benih bertujuan untuk
melunakkan kulit benih, akan tetapi apabila terlalu berlebihan dalam hal konsentrasi atau lama waktu perlakuan dapat menyebabkan kerusakan embrio, sehingga benih tidak berkecambah.
Pada perlakuan A8 (perendaman dengan GA3 300 ppm selama 5 jam)
masih termasuk perlakuan yang mempunyai daya berkecambah baik yaitu 86,67%. Hal ini menunjukkan bahwa penggunaan giberelin mampu mematahkan dormansi pada biji mucuna dikarenakan giberelin merupakan hormon yang mampu mempercepat perkecambahan. Menurut Davies (2004) menyatakan bahwa cara kerja giberelin dalam perkecambahan biji diawali dengan terjadinya imbibisi air merangsang sintesis giberelin, lalu giberelin tersebut berdifusi ke lapisan aleuron dan merangsang sintesis enzim. Selanjutnya enzim memecahkan amilim dan gula yang kemudian ditransportasikan ke embrio yang sedang berkembang. Sejalan dengan hasil penelitian menurut Sormin (2010) bahwa biji mucuna yang direndam dalam zat pengatur tumbuh GA3 300 ppm mampu menghasilkan
menyatakan bahwa pematahan dormansi dengan perendaman GA3 300 ppm
selama 24 jam mampu meningkatkan perkecambahan benih aren sebesar 70%. Pada perlakuan A8 (perendaman GA3 300ppm selama 5 jam)
menunjukkan rataan kadar air sebesar 28,59% yang lebih tinggi dibandingkan perlakuan A7 (perendaman GA3 300ppm selama 3 jam) yaitu sebesar 16,23%.
Apabila kita hubungkan rataan kadar air dengan rataan daya berkecambah pada perlakuan A8 menghasilkan rataan daya kecambah yang lebih tinggi juga yaitu sebesar 86,67% dan pada perlakuan A7 rataan daya berkecambah sebesar 65%. Dengan rataan kecepatan tumbuh benih perlakuan A8 sebesar 8,68% dan perlakuan A7 sebesar 6,16%. Dari hasil tersebut menjelaskan bahwa penggunaan GA3 300ppm lebih baik pada perendaman 5 jam dibandingkan 3 jam. Di duga
penggunaan giberelin mampu mematahkan dormansi pada biji Mucuna bracteata D.C. Hal ini sesuai dengan literatur Abidin (1983) yang menyatakan bahwa Giberelin adalah hormon tanaman yang terlibat dalam pertumbuhan dan perkembangan tanaman, perpanjangan batang, pembungaan dan perkecambahan biji. Sejalan dengan literatur Davies (2004) yang menyatakan bahwa Pada perkecambahan giberelin diperlukan pada tahapan pengaktifan pertumbuhan vegetatif embrio, pelunakan (pembelahan) endosperm, mobilisasi cadangan tersimpan dalam endosperm.
literatur Gardner et.al (1991) yang menyatakan bahwa Pengguntingan kulit biji dilakukan dengan cara menggunting salah satu sisi biji dengan gunting kuku sehingga kulit terkupas dan air dapat dengan mudah masuk ke dalam biji. Dan sejalan dengan Sutopo (2004) yang menyatakan bahwa Perlakuan mekanis umumnya digunakan dalam pematahan dormansi biji untuk memecahkan dormansi benih yang disebabkan oleh impermeabilitas kulit biji baik terhadap air atau gas, resistensi mekanis kulit perkecambahan yang terdapat pada kulit biji. Namun apabila kita lihat dari segi pengerjaan, pada perlakuan A2 lebih membutuhkan tenaga kerja yang banyak untuk skala besar dan pengerjaannya kurang sederhana dibandingkan dengan perlakuan kimia. Hal ini yang membuat perlakuan kimia lebih baik digunakan karena pengerjaan lebih sederhana dan tidak memerlukan biaya yang tinggi untuk upah tenaga kerja, sehingga pengerjaan lebih efektif dan efisien.
mudah menembus kulit biji sehingga mempercepat perkecambahan dan skarifikasi juga dapat dilakukan dengan penipisan kulit endokarp pada seluruh permukaan biji sampai kelihatan endosperm biji yang menghalangi masuknya air ke dalam benih.
Perlakuan yang dilanjutkan ke rumah kasa yaitu A2 (pengguntingan kulit kemudian perendaman air 30 menit), A3 (perendaman H2SO4 1 % selama 10
menit), A6 (Perendaman KNO3 1 % selama 24 jam), A7 (perendaman GA3 300
ppm selama 3 jam) dan A8 (perendaman GA3 300 ppm selama 5 jam) tidak
KESIMPULAN DAN SARAN
Kesimpulan
Pematahan dormansi pada benih mucuna (Mucuna bracteata D.C) dapat dilakukan dengan perendaman H2SO4 1% selama 10 menit (A3), perendaman
KNO3 1% selama 24 jam (A6) dan perendaman GA3 selama 5 jam (A8) dengan
masing- masing daya berkecambah sebesar 91,67 % dan 86,67 %. Saran
Dari hasil penelitian, peneliti menyarankan untuk pematahkan dormansi pada biji Mucuna bracteata D.C. menggunakan KNO3 1% selama 24 jam, karena
pekerjaan yang dilakukan lebih sederhana dan harga KNO3 yang lebih murah
DAFTAR PUSTAKA
Abidin, Z., 1983. Dasar-dasar Pengetahuan Tentang Zat Pengatur Tumbuh. Angkasa. Bandung. Hal:53-54.
Achmad, S. S., M. Zanzibar dan Dj. Iriantono. 1992. Teknik Penanganan dan Pengujian Mutu Benih beberapa Jenis Pohon Prioritas HTI. Balai Teknologi Perbenihan. Balitbang Kehutanan. Bogor.
Athiyah Z. 2008. Studi dormansi, kadar air kritikal dan peningkatan kecepatan perkecambahan benih Kenanga (Cananga odorata Lam.Hook. F&Thoms.). Skripsi. Fakultas Pertanian. Institut Pertanian Bogor. Bogor
Bewley JD, Black M. 1985. Seeds: Physiology of Development and Germination. Plenum Press. New York.
Davies, P.J., 2004. Plant Hormones. Physiology, Biochemistry, and Molecular Biology. KluwerAcademic Publishers dengan perendaman dalam larutan Accu Zurr. Skripsi. Institut Pertanian Bogor. Bogor.
Devlin, R.M. and Witham, F.H., 2002. Plant Physiology Fourth Edition.CBS Publisher & Distributors New Delhi.pp 483-487.
Edy, P. R., Sriwijaya, A., Susanto, I. Y. Harahap, G. Simangunsong, A. F. Lubis,A. E. Prasetyo, A. P. Dongoran. 2007. Mucuna bracteata sebagai tanaman pengendali gulma. Pusat Penelitian Kelapa Sawit. Medan. Seri Buku Saku 27. Hal 11.
Ellis, R. H., Hong, T. D., Robert, E. H., 1983. Procedure for the safe removal of dormancy in rice seed. Seed Sci & Technol 11:77-112.
Faustina, E., Prapto, Y. dan Rohmanti R., 2011. Pengaruh Cara Pelepasan Aril dan Konsentrasi KNO3 Terhadap Pematahan Dormansi Benih Pepaya
(Carica papaya). Jurnal Fakultas Pertanian UGM. Yogyakarta.
Gardner, F.P., Pearce, R.B., and Mitchell, R.L., 1991. Fisiologi Tanaman Budidaya. Penerbit Universitas Indonesia. Jakarta.
Harahap, I.Y. dan Subronto. 2004. Penggunaan Kacangan Penutup Tanah Mucuna bracteata Pada Pertanaman Kelapa Sawit. Medan. Warta Vol 10. Hal 1-6 Harahap,I.Y, Taufiq. C, Hidayat. Dan G. Simangunsong. 2008. Mucucna
Bracteata. Pusat Penelitian Kelapa Sawit. Medan.