DAYA KECAMBAH DAN PERTUMBUHAN Mucuna bracteata
MELALUI PEMATAHAN DORMANSI DAN PEMBERIAN
ZAT PENGATUR TUMBUH GIBERELIN (GA3)
SKRIPSI
Oleh :
HARDIANTI PUTRI SARI 080301017 / BDP-AGRONOMI
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
DAYA KECAMBAH DAN PERTUMBUHAN Mucuna bracteata
MELALUI PEMATAHAN DORMANSI DAN PEMBERIAN
ZAT PENGATUR TUMBUH GIBERELIN (GA3)
SKRIPSI
Oleh :
HARDIANTI PUTRI SARI 080301017 / BDP-AGRONOMI
Skripsi sebagai salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
Judul Skripsi : Daya Kecambah dan Pertumbuhan Mucuna bracteata Melalui Pematahan Dormansi Dan Pemberian Zat Pengatur Tumbuh Giberelin (GA3)
Nama : Hardianti Putri Sari NIM : 080301017
Program Studi : Agroekoteknologi Minat : Agronomi
Disetujui Oleh Komisi Pembimbing
(Dr. Dra. Ir. Chairani Hanum, MS.) (Ir. Charloq, MP.) Ketua Anggota
Mengetahui,
ABSTRAK
HARDIANTI PUTRI SARI: Daya Kecambah dan Pertumbuhan Mucuna bracteata Melalui Pematahan Dormansi dan Pemberian Zat Pengatur
Tumbuh Giberelin (GA3), dibimbing oleh CHAIRANI HANUM dan CHARLOQ. Perbanyakan Mucuna bracteata secara generatif sangat sulit dilakukan dan memerlukan perlakuan khusus untuk berkecambah. Pematahan dormansi pada biji mucuna bertujuan untuk meningkatkan daya berkecambah. Penelitian dilakukan di lahan masyarakat jalan Tanjung Selamat, Kabupaten Deli Serdang, mulai bulan November 2012 sampai Februari 2013, menggunakan Rancangan Acak Kelompok faktorial dengan 2 faktor. Faktor pertama adalah pematahan dormansi (kontrol, pengguntingan kulit benih, penggosokan menggunakan kertas amplas dan perendaman air panas) sedangkan faktor kedua adalah zat pengatur tumbuh giberelin (GA3) (0, 150, 300, 450 ppm). Parameter yang diamati adalah daya perkecambahan, tinggi tanaman, jumlah daun, bobot basah tajuk, bobot kering tajuk, bobot basah akar, bobot kering akar, shoot root ratio.
Hasil penelitian diperoleh bahwa perlakuan pematahan dormansi berpengaruh nyata terhadap semua parameter. Pemberian zat pengatur tumbuh berpengaruh nyata pada daya perkecambahan, bobot basah tajuk dan bobot kering tajuk. Sedangkan interaksi antara pematahan dormansi dan zat pengatur tumbuh berpengaruh nyata pada daya perkecambahan, bobot basah tajuk dan bobot kering tajuk.
ABSTRACT
HARDIANTI PUTRI SARI : Germination and Growth of Mucuna bracteata by Dormancy Fracturing and Giving Growing Regulatory Substances of Gibberellins (GA3), supervised by CHAIRANI HANUM and CHARLOQ.
The generative propagation of Mucuna bracteata is very difficult and requires special treatment to germinate. Dormancy fracturing in hard seed of Mucuna purpose to enhance germination. The research was conducted at the public land, Tanjung Selamat, Deli Serdang from November 2012 to February 2013, using a randomized block design with 2 factors and 3replications. The first factor was the dormancy fracturing (control, cutting the seed coat, polished with sand paper, and hot water soaking) and the second factor was gibberellin (GA3) (0, 150, 300 and 450 ppm). The parameters observed were the germination, plant height, number of leaves, fresh weight shoot, dry weight shoot, fresh weight root, dry weight root, shoot root ratio.
The result showed that the dormancy fracturing significantly affected to all parameters. Giving of Gibberellins (GA3) significantly affected to the germination, fresh weight shoot and dry weight shoot. Interaction between dormancy fracturing and Gibberellins significantly affected to the germination, fresh weight shoot and dry weight shoot.
RIWAYAT HIDUP
Hardianti Putri Sari dilahirkan di Medan pada tanggal 27 September 1990 dari ayahanda Khairadi, SE dan Ibunda Hartati Rosa Nasution. Penulis merupakan anak ke 2 dari 3 bersaudara.
Tahun 2008 penulis lulus dari SMA Harapan 3 Medan dan pada tahun yang sama masuk ke Fakultas Pertanian USU melalui jalur PMP (Pemanduan Minat dan Prestasi). Penulis memilih Program Studi Agronomi jurusan Budidaya Pertanian.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmatNya penulis dapat menyelesaikan skripsi yang berjudul “Daya Kecambah dan Pertumbuhan Mucuna bracteata Melalui Pematahan
Dormansi dan Pemberian Zat Pengatur Tumbuh Giberelin (GA3)” yang
merupakan salah satu syarat untuk dapat memperoleh gelar sarjana di Fakultas Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ibu Dr. Dra. Ir. Chairani Hanum, MP selaku ketua dan Ibu Ir. Charloq, MP selaku
anggota komisi pembimbing yang telah banyak memberikan bimbingan dalam pembuatan skripsi ini. Penulis menyampaikan ucapan terima kasih kepada kedua orang tua penulis yang telah membesarkan dan mendidik penulis selama ini.
Disamping itu, penulis juga mengucapkan terima kasih kepada semua staf pengajar di Program Studi Agroekoteknologi, serta semua rekan mahasiswa yang tidak dapat disebutkan satu per satu disini yang telah banyak membantu penulis dalam menyelesaikan skripsi ini. Semoga skripsi ini bermanfaat.
Medan, Februari 2013
DAFTAR ISI
Perlakuan Pematahan Dormansi ... 10
Perlakuan Mekanis ... 10
Pelaksanaan Percobaan ... 17
Persiapan Media Tanam ... 17
Pembuatan Bak Perkecambahan ... 17
Pemeliharaan Tanaman ... 19
Pengajiran... 19
Penyiraman... 19
Penyiangan ... 19
Pengamatan Parameter ... 19
Daya Perkecambahan (%) ... 19
Panjang Sulur (cm)... 20
Jumlah Daun (Helai) ... 20
Bobot Basah Tajuk (g) ... 20
Bobot Kering Tajuk (g) ... 20
Bobot Basah Akar (g) ... 20
Bobot Kering Akar (g) ... 20
Shoot Ratio ... 20
HASIL DAN PEMBAHASAN Hasil ... 21
Pembahasan ... 21
KESIMPULAN DAN SARAN Kesimpulan ... 64
Saran ... 64 DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal.
1. Rataan panjang sulur terhadap perlakuan pematahan dormansi dan
pemberian GA3 pada 1 – 10 MSPT ... 28 2. Rataan jumlah daun terhadap perlakuan pematahan dormansi dan
pemberian GA3 pada 1 – 10 MSPT ... 33 3. Rataan bobot basah tajuk terhadap perlakuan pematahan dormansi
dan pemberian GA3 pada 10 MSPT ... 36 4 Rataan bobot kering tajuk terhadap perlakuan pematahan dormansi
dan pemberian GA3 pada 10 MSPT ... 42 5. Rataan bobot basah akar terhadap perlakuan pematahan dormansi
dan pemberian GA3 pada 10 MSPT ... 49 6. Rataan bobot kering akar terhadap perlakuan pematahan dormansi
dan pemberian GA3 pada 10 MSPT ... 53 7. Rataan shoot root ratio terhadap perlakuan pematahan dormansi
DAFTAR GAMBAR
No. Hal.
1. Hubungan persentase daya perkecambahan terhadap pematahan
dormansi pada 3 – 7 HST ... 21 2. Hubungan persentase daya perkecambahan terhadap konsentrasi
giberelin pada 3 – 7 HST ... 25 3. Hubungan panjang sulur terhadap pematahan dormansi pada
10 MSPT ... 29 4. Hubungan panjang sulur terhadap zat pengatur tumbuh GA3 pada
10 MSPT ... 31 5. Hubungan jumlah daun terhadap pematahan dormansi pada
10 MSPT ... 34 6. Hubungan jumlah daun terhadap zat pengatur tumbuh GA3 pada
10 MSPT ... 35 7. Hubungan bobot basah tajuk terhadap pematahan dormansi pada
10 MSPT ... 38 8. Hubungan bobot basah tajuk terhadap pemberian GA3 pada 10 MSPT ... 39 9. Hubungan bobot basah tajuk dengan interaksi antara pematahan
dormansi dan GA3 pada 10 MSPT ... 41 10. Hubungan bobot kering tajuk terhadap pematahan dormansi pada
10 MSPT ... 44 11. Hubungan bobot kering tajuk terhadap pemberian GA3 pada
10 MSPT ... 45 12. Hubungan bobot kering tajuk dengan interaksi antara pematahan
dormansi dan GA3 pada 10 MSPT ... 47 13. Hubungan bobot basah akar terhadap pematahan dormansi pada
10 MSPT ... 50 14. Hubungan bobot basah akar terhadap pemberian GA3 pada
10 MSPT ... 52 15. Hubungan bobot kering akar terhadap pematahan dormansi pada
16. Hubungan bobot kering akar terhadap pemberian GA3 pada
10 MSPT ... 56 17. Hubungan shoot root ratio terhadap pematahan dormansi pada
10 MSPT ... 58 18. Hubungan shoot root ratio terhadap pemberian GA3 pada
10 MSPT ... 60 19. Hubungan shoot root ratio dengan interaksi antara pematahan
DAFTAR LAMPIRAN
No. Hal.
1. Data daya perkecambahan 3 HST ... 69
2. Data panjang sulur 1 MSPT ... 69
3. Data transformasi panjang sulur 1 MSPT √X + 0,5 ... 70
4. Sidik ragam data transformasi panjang sulur 1 MSPT √X + 0,5 ... 70
5. Data panjang sulur 2 MSPT ... 71
6. Data transformasi panjang sulur 2 MSPT √X ... 71
7. Sidik ragam data transformasi panjang sulur 2 MSPT √X ... 72
8. Data panjang sulur 3 MSPT ... 72
9. Data transformasi panjang sulur 3 MSPT √X ... 73
10. Sidik ragam data transformasi panjang sulur 3 MSPT √X ... 73
11. Data panjang sulur 4 MSPT ... 74
12. Data transformasi panjang sulur 4 MSPT √X ... 74
13. Sidik ragam data transformasi panjang sulur 4 MSPT √X ... 75
14. Data panjang sulur 5 MSPT ... 75
15. Data transformasi panjang sulur 5 MSPT √X ... 76
16. Sidik ragam data transformasi panjang sulur 5 MSPT √X ... 76
17. Data panjang sulur 6 MSPT ... 77
18. Data transformasi panjang sulur 6 MSPT √X ... 77
19. Sidik ragam data transformasi panjang sulur 6 MSPT √X ... 78
20. Data panjang sulur 7 MSPT ... 78
35. Data transformasi panjang sulur 7 MSPT √X ... 79
37. Data panjang sulur 8 MSPT ... 80
38. Data transformasi panjang sulur 8 MSPT √X ... 80
39. Sidik ragam data transformasi panjang sulur 8 MSPT √X ... 81
40. Data panjang sulur 9 MSPT ... 81
41. Data transformasi panjang sulur 9 MSPT √X ... 82
42. Sidik ragam data transformasi panjang sulur 9 MSPT √X ... 82
43. Data panjang sulur 10 MSPT ... 83
44. Data transformasi panjang sulur 10 MSPT √X ... 83
45. Sidik ragam data transformasi panjang sulur 10 MSPT √X ... 84
46. Data jumlah daun 2 MSPT ... 84
47. Data transformasi jumlah daun 2 MSPT √X + 0,5 ... 85
48. Sidik ragam data transformasi jumlah daun 2 MSPT √X + 0,5 ... 85
49. Data jumlah daun 3 MSPT ... 86
50. Data transformasi jumlah daun 3 MSPT √X + 0,5 ... 86
51. Sidik ragam data transformasi jumlah daun 3 MSPT √X + 0,5 ... 87
52. Data jumlah daun 4 MSPT ... 87
53. Data transformasi jumlah daun 4 MSPT √X + 0,5 ... 88
54. Sidik ragam data transformasi jumlah daun 4 MSPT √X + 0,5 ... 88
55. Data jumlah daun 5 MSPT ... 89
56. Data transformasi jumlah daun 5 MSPT √X + 0,5 ... 89
57. Sidik ragam data transformasi jumlah daun 5 MSPT √X + 0,5 ... 90
58. Data jumlah daun 6 MSPT ... 90
59. Data transformasi jumlah daun 6 MSPT √X + 0,5 ... 91
61. Data jumlah daun 7 MSPT ... 92
62. Data transformasi jumlah daun 7 MSPT √X + 0,5 ... 92
63. Sidik ragam data transformasi jumlah daun 7 MSPT √X + 0,5 ... 93
64. Data jumlah daun 8 MSPT ... 93
65. Data transformasi jumlah daun 8 MSPT √X + 0,5 ... 94
66. Sidik ragam data transformasi jumlah daun 8 MSPT √X + 0,5 ... 94
67. Data jumlah daun 9 MSPT ... 95
68. Data transformasi jumlah daun 9 MSPT √X + 0,5 ... 95
69. Sidik ragam data transformasi jumlah daun 9 MSPT √X + 0,5 ... 96
70. Data jumlah daun 10 MSPT ... 96
71. Data transformasi jumlah daun 10 MSPT √X + 0,5 ... 97
72. Sidik ragam data transformasi jumlah daun 10 MSPT √X + 0,5 ... 97
73. Data bobot basah tajuk 10 MSPT ... 98
74. Data transformasi bobot basah tajuk 10 MSPT √X ... 98
75. Sidik ragam data transformasi bobot basah tajuk 10 MSPT √X ... 99
76. Data bobot kering tajuk 10 MSPT ... 99
77. Data transformasi bobot kering tajuk 10 MSPT √X ... 100
78. Sidik ragam data transformasi bobot kering tajuk 10 MSPT √X ... 100
79. Data bobot basah akar 10 MSPT ... 101
80. Data transformasi bobot basah akar 10 MSPT √X + 0,5 ... 101
81. Sidik ragam data transformasi bobot basah akar 10 MSPT √X + 0,5 ... 102
82. Data bobot kering akar 10 MSPT ... 102
84. Sidik ragam data transformasi bobot kering akar 10 MSPT
√X + 0,5 ... 103
85. Data shoot root ratio 10 MSPT ... 104
86. Data transformasi shoot root ratio 10 MSPT √X ... 104
87. Sidik ragam data transformasi shoot root ratio 10 MSPT √X ... 105
88. Bagan penanaman pada plot ... 106
89. Bagan plot penelitian ... 107
90. Jadwal kegiatan pelaksanaan penelitian ... 108
91. Zat pengatur tumbuh giberelin ... 109
92. Perlakuan perendaman ZPT giberelin ... 109
93. Perendaman dengan air panas ... 109
94. Lahan Penelitian ... 110
ABSTRAK
HARDIANTI PUTRI SARI: Daya Kecambah dan Pertumbuhan Mucuna bracteata Melalui Pematahan Dormansi dan Pemberian Zat Pengatur
Tumbuh Giberelin (GA3), dibimbing oleh CHAIRANI HANUM dan CHARLOQ. Perbanyakan Mucuna bracteata secara generatif sangat sulit dilakukan dan memerlukan perlakuan khusus untuk berkecambah. Pematahan dormansi pada biji mucuna bertujuan untuk meningkatkan daya berkecambah. Penelitian dilakukan di lahan masyarakat jalan Tanjung Selamat, Kabupaten Deli Serdang, mulai bulan November 2012 sampai Februari 2013, menggunakan Rancangan Acak Kelompok faktorial dengan 2 faktor. Faktor pertama adalah pematahan dormansi (kontrol, pengguntingan kulit benih, penggosokan menggunakan kertas amplas dan perendaman air panas) sedangkan faktor kedua adalah zat pengatur tumbuh giberelin (GA3) (0, 150, 300, 450 ppm). Parameter yang diamati adalah daya perkecambahan, tinggi tanaman, jumlah daun, bobot basah tajuk, bobot kering tajuk, bobot basah akar, bobot kering akar, shoot root ratio.
Hasil penelitian diperoleh bahwa perlakuan pematahan dormansi berpengaruh nyata terhadap semua parameter. Pemberian zat pengatur tumbuh berpengaruh nyata pada daya perkecambahan, bobot basah tajuk dan bobot kering tajuk. Sedangkan interaksi antara pematahan dormansi dan zat pengatur tumbuh berpengaruh nyata pada daya perkecambahan, bobot basah tajuk dan bobot kering tajuk.
ABSTRACT
HARDIANTI PUTRI SARI : Germination and Growth of Mucuna bracteata by Dormancy Fracturing and Giving Growing Regulatory Substances of Gibberellins (GA3), supervised by CHAIRANI HANUM and CHARLOQ.
The generative propagation of Mucuna bracteata is very difficult and requires special treatment to germinate. Dormancy fracturing in hard seed of Mucuna purpose to enhance germination. The research was conducted at the public land, Tanjung Selamat, Deli Serdang from November 2012 to February 2013, using a randomized block design with 2 factors and 3replications. The first factor was the dormancy fracturing (control, cutting the seed coat, polished with sand paper, and hot water soaking) and the second factor was gibberellin (GA3) (0, 150, 300 and 450 ppm). The parameters observed were the germination, plant height, number of leaves, fresh weight shoot, dry weight shoot, fresh weight root, dry weight root, shoot root ratio.
The result showed that the dormancy fracturing significantly affected to all parameters. Giving of Gibberellins (GA3) significantly affected to the germination, fresh weight shoot and dry weight shoot. Interaction between dormancy fracturing and Gibberellins significantly affected to the germination, fresh weight shoot and dry weight shoot.
PENDAHULUAN
Latar Belakang
Mucuna bracteata adalah salah satu jenis Leguminosae Cover Crop (LCC) yang merambat dan ditemukan pertama di areal hutan Tri Pura, India Utara dan sudah meluas sebagai penutup tanah di perkebunan karet di Kerala India Selatan. Mucuna bracteata ini juga banyak digunakan di perkebunan di Indonesia, legum ini memiliki biomassa yang tinggi dibandingkan dengan penutup tanah lainnya. Perkebunan kelapa sawit dan perkebunan karet selalu menggunakan legum penutup tanah ini pada areal peremajaan (Siagian, 2003).
Penanaman penutup tanah kacangan di perkebunan karet beralih dari LCC konvensional (campuran dari Pueraria javanica, Calopogonium caeruleum, dan Centrosema pubescens) ke LCC Mucuna bracteata. LCC konvensional yang selama ini banyak ditanam di perkebunan karet, mempunyai kelemahan antara lain kurang mampu berkompetisi dengan gulma terutama Mikania, Asystasia, dan rumput lainnya. Mucuna bracteata nyata lebih unggul dibandingkan dengan LCC konvensional. Penanaman mucuna tersebut di perkebunan besar, baik karet maupun kelapa sawit, cukup pesat (Siagian dan Tistama, 2005).
menambat N bebas dari udara (Harahap dkk., 2008). Mucuna bracteata kurang disukai ternak, penyebabnya adalah senyawa kandungan fenolik yang tinggi (Vissoh dkk., 2005) tetapi mucuna sudah digunakan sebagai tanaman pakan ternak dengan pengolahan menjadi bentuk tepung (melalui penjemuran dan penggilingan) (Sirait dkk., 2009).
Karakteristik benih Mucuna bracteata memiliki kulit yang keras dan liat sehingga sulit untuk berkecambah. Perlakuan menghilangkan kulit benih (testa) dan membuang sebagian testa bertujuan agar embrio dapat segera tumbuh tanpa hambatan. Namun, pelaksanaan percobaan ini tidak mudah dilakukan terutama karena ukuran benihnya yang kecil, kulit keras, dan liat. Sutopo (2002) menyatakan bahwa kulit biji yang keras dan kedap menjadi penghalang mekanis terhadap masuknya air dan gas. Pengambilan air terhalang kulit biji yang mempunyai struktur terdiri dari lapisan sel-sel serupa palisade berdinding tebal terutama dipermukaan paling luar dan bagian dalamnya mempunyai lapisan lilin dari bahan kutikula.
Permasalahan yang timbul dalam usaha perbanyakan Mucuna bracteata
melalui biji adalah persentase daya kecambah yang sangat rendah. Perbanyakan Mucuna bracteata secara generatif sangat sulit dikarenakan kulit keras dan untuk
berkecambah perlu dilakukan skarifikasi pada bijinya dan jika dilakukan
perkembangbiakan kecambah, persentase kecambahnya hanya 12%
(Siagian dan Tistama, 2005).
Mucuna bracteata dapat disebabkan karena mutunya kurang baik, disimpan oleh suplier terlalu lama dan adanya infeksi penyakit dan hama
(Karyudi dan Siagian, 2001).
Keragaman daya kecambah Mucuna bracteata diduga juga disebabkan oleh tingkat kematangan benih yang berbeda dari sumber benihnya. Tingkat kematangan benih akan memberikan perbedaan indeks vigor, waktu yang digunakan untuk mulai berkecambah dan persentase perkecambahan. Penyerapan air pada benih yang telah matang penuh lebih cepat dari pada benih belum matang. Semakin cepat air terserap, maka proses biokimia dalam benih akan lebih cepat dimulai sehingga embrio lebih cepat berkembang dan benih dapat cepat berkecambah (Sutopo, 2002).
Usaha mempercepat dan meningkatkan daya berkecambah memerlukan perlakuan-perlakuan yang sesuai dengan kondisi atau sifat benih mucuna. Beberapa upaya mengatasi kulit biji yang keras telah dilakukan seperti pengguntingan kulit biji (skarifikasi), perendaman dengan air panas dan asam sulfat pekat dengan konsentrasi 85% selama 30 menit (Sebayang dkk., 2004).
Pengaruh giberelin terhadap biji dapat mendorong pemanjangan sel
sehingga radikula dapat menembus endosperm kulit biji yang membatasi pertumbuhannya. Efek fisiologis giberelin antara lain adalah mendorong aktivitas enzim-enzim hidrolitik dan pembentukan amilase serta
enzim yang mengubah lipid menjadi sukrosa pada proses perkecambahan (Salisbury dan Ross, 1995 dalam Murni, 2008).
ataupun menggores kulit benih agar dapat menyerap air dan udara (Kartasapoetra, 2003).
Berdasarkan hal ini maka perlu dilakukan pematahan dormansi mucuna dengan kombinasi secara kimia dan fisik dengan cara pengguntingan kulit benih, skarifikasi dengan menggosok menggunakan kertas amplas, perendaman dengan air panas (suhu 850C) dan pemberian zat pengatur tumbuh giberelin (GA3) sehingga diharapkan dapat memecahkan dormansi benih pada biji mucuna serta pertumbuhan dan daya berkecambah mucuna dapat meningkat.
Tujuan Percobaan
Untuk mendapatkan pematahan dormansi yang tepat dan pemberian zat pengatur tumbuh giberelin (GA3) yang optimal terhadap pertumbuhan dan daya kecambah Mucuna bracteata.
Hipotesis Penelitian
Ada perbedaan respons pertumbuhan dan daya kecambah mucuna akibat perlakuan pematahan dormansi dan pemberian zat pengatur tumbuh giberelin (GA3) serta interaksi kedua faktor tersebut.
Kegunaan Penelitian
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Fakultas Pertanian Universitas Sumatera Utara, Medan dan untuk mendapatkan
TINJAUAN PUSTAKA
Botani Tanaman
Mucuna bracteata memiliki perakaran tunggang yang berwarna putih kecoklatan, dan memiliki bintil akar berwarna merah muda segar dan sangat banyak, pada nodul dewasa terdapat kandungan leghaemoglobin yaitu hemeprotein monomerik yang terdapat pada bintil akar leguminosae yang terinfeksi oleh bakteri Rhizobium. Laju pertumbuhan akar relatif cepat pada umur di atas tiga tahun dimana pertumbuhan akar utamanya dapat mencapai 3 meter ke dalam tanah (Harahap dan Subronto, 2004).
Batang tanaman ini berwarna hijau kecoklatan umumnya batang tumbuh
menjalar, merambat dan membelit. Diameter batang dewasa dapat mencapai 0,4 - 1,5 cm dan pada umumnya memiliki buku-buku dengan panjang dapat
mencapai 25 - 35 cm. Batang Mucuna bracteata pada umumnya tidak berbulu,
bertekstur cukup lunak, lentur dan mengandung serat dan berair (Mugnisjah dan Setiawan, 2001).
Daun berbentuk oval berwarna hijau dan muncul di setiap ruas batang. Jika suhu meningkat maka helaian daun dapat menutup sehingga mengurangi respirasi pada permukaan daun (Harahap dkk., 2008).
Bunga tanaman Mucuna bracteata berbentuk tandan menyerupai anggur. Panjang tangkai bunga dapat mencapai 20 - 35 cm dan termasuk ke dalam jenis monoceous. Bunga berwarna biru terong dan dapat mengeluarkan bau yang
Biji berbentuk bulat oval berwarna hitam dan pada umumya memiliki kulit biji yang tebal sehingga perbanyakan melalui biji dapat dilakukan dengan perlakuan benih melalui skarifikasi dan penggunaan larutan kimia. Bobot biji dapat mencapai 0,5 - 1 g/biji (Harahap dan Subronto, 2004).
Syarat Tumbuh
Iklim
Mucuna bracteata dapat tumbuh di berbagai daerah baik dataran tinggi maupun dataran rendah. Tetapi untuk dapat melakukan pertumbuhan generatif atau berbunga tanaman ini memerlukan ketinggian di atas 1000 m dpl, jika berada di bawah 1000 m dpl maka pertumbuhan akan jagur tetapi tidak dapat terjadi pembentukan bunga (Harahap dan Subronto, 2004).
Untuk dapat melakukan pembungaan tanaman ini memerlukan suhu harian berkisar antara 120C - 180C. Apabila suhu berada diatas 180C maka pembungaan akan sulit terjadi (Mugnisjah dan Setiawan, 2001).
Curah hujan yang dibutuhkan agar pertumbuhan tanaman Mucuna bracteata dapat tumbuh dengan baik berkisar antara 1000 – 2500
mm/tahun dan 3 - 10 merupakan hari hujan setiap bulannya dengan kelembaban tanaman ini adalah 80%. Jika kelembaban terlalu tinggi akan berakibat bunga menjadi busuk. Untuk panjang penyinaran, mucuna membutuhkan lama penyinaran antara 6 - 7 jam/hari (Harahap dan Subronto, 2004).
Tanah
tergenang akan mengakibatkan pertumbuhan vegetatif terganggu. Untuk pertumbuhan Mucuna bracteata secara umum dapat tumbuh baik pada kisaran pH 4,5 - 6,5 (Harahap dan Subronto, 2004).
Mucuna bracteata mampu tumbuh dengan baik pada kondisi tanah asam (pH 5) sampai basa (pH 8), dengan kondisi tanah yang miskin hara tanaman ini mampu menghasilkan bahan organik dari sisa-sisa tanaman sebesar 1,75 ton/ha (Setiawan, 2008).
Perkecambahan Biji
Perkecambahan benih secara fisiologi adalah muncul dan berkembangnya struktur-struktur penting dari embrio benih dengan akar menembus kulit benih. Proses metabolisme perkecambahan benih sampai ditentukan oleh faktor genetik dan lingkungan. Faktor genetik yang berpengaruh terhadap perkecambahan benih adalah sifat dormansi dan komposisi kimia benih. Faktor lingkungan yang berpengaruh terhadap perkecambahan benih adalah air, gas, suhu dan cahaya (Copeland dan Mc Donald, 2001).
Tahap suatu perkecambahan benih dimulai dengan proses penyerapan air oleh benih, melunaknya kulit benih dan hidrasi dari protoplasma. Tahap kedua dimulai dengan kegiatan-kegiatan sel dan enzim-enzim serta naiknya tingkat respirasi benih. Tahap ketiga merupakan tahap dimana terjadi penguraian bahan-bahan seperti karbohidrat, lemak dan protein menjadi bentuk-bentuk yang melarut dan ditranslokasikan ke titik-titik tumbuh. Tahap keempat adalah asimilasi dari bahan-bahan yang telah diuraikan tadi di daerah meristem untuk menghasilkan energi bagi kegiatan pembentukan komponen dan pertumbuhan sel-sel baru.
pembelahan, pembesaran dan pembagian sel-sel pada titik-titik tumbuh (Copeland dan McDonald, 1985; Sutopo, 1998 dalam Haryati 2002).
Proses perkecambahan benih dipengaruhi oleh faktor genetik dan lingkungan. Faktor genetik yang berpengaruh adalah susunan kimiawi benih yang berhubungan dengan daya hidup benih. Sifat ketahanan ini meliputi masalah kadar air benih, aktivitas enzim dalam benih dan sifat fisik atau biokimiawi dari kulit benih. Sedangkan faktor lingkungan yang sangat berpengaruh adalah air, gas dan suhu (Bewley and Black, 1982 dalam Miranda, 2005).
Proses-proses perkecambahan sangat dipengaruhi oleh ketersediaan faktor-faktor lingkungan seperti air, oksigen, cahaya dan suhu. Air berperan dalam melunakkan kulit biji, memfasilitasi masuknya oksigen, pengenceran protoplasma untuk aktivasi fungsi, dan alat transportasi makanan. Suhu berperan dalam pematahan dormansi, aplikasi fluktuasi yang tinggi berhasil mematahkan dormansi pada banyak spesies, terutama yang mengalami termodormansi. Aplikasi fluktuasi suhu ini dapat berupa chilling/alternating temperatur maupun pembakaran permukaan. Oksigen dibutuhkan pada proses oksidasi untuk membentuk energi perkecambahan. Cahaya mempengaruhi perkecambahan melalui tiga macam bentuk yaitu intensitas cahaya, panjang gelombang dan fotoperiodisitas (Sutopo, 2004).
dengan keadaan sebelum dikecambahkan maka benih dalam keadaan dorman (Saenong dkk., 1989).
Dormansi
Dormansi benih pada umumnya diartikan sebagai benih yang tidak berkecambah walaupun kondisi lingkungan optimum untuk proses perkecambahan. Schimdt (2000) menyatakan bahwa dormansi adalah suatu strategi menunda proses perkecambahan pada kondisi optimum dimana benih tidak mati.
Bewley dan Black (1982) membagi dormansi menjadi dua jenis, yaitu dormansi embrio dan dormansi kulit. Dormansi embrio adalah jenis dormansi yang pengendaliannya berada dalam embrio benih. Dormansi kulit adalah dormansi yang disebabkan oleh struktur yang melindungi embrio. Kulit benih menghalangi embrio untuk tumbuh karena mengganggu proses pengambilan air dan pertukaran gas, mengandung zat penghambat pertumbuhan, berperan sebagai penghalang keluarnya zat penghambat tumbuh embrio, dan membatasi cahaya mencapai embrio.
Benih dalam keadaan normal belum tentu mati, karena benih tersebut dapat dirangsang untuk berkecambah dengan berbagai perlakuan. Benih yang dorman dan benih yang mati dapat diketahui melalui uji perkecambahan. Bila
volume benih pada akhir perkecambahan sama dengan keadaan sebelum dikecambahkan maka benih dalam keadaan dorman. Sebaliknya, volume benih menunjukkan perubahan, misalnya mengecil, ditumbuhi
Beberapa jenis benih tetap dorman disebabkan oleh kulit benihnya yang cukup kuat untuk menghalangi pertumbuhan dari embrio. Kulit benih tidak dapat dilalui air atau udara karena keras atau tertutup oleh gabus maupun lilin. Jika kulit benih dihilangkan maka akan terjadi perkecambahan. (Schmidt, 2000).
Hambatan perkecambahan benih dapat terjadi karena kulit benih dan dapat pula karena kandungan bahan kimia. Bahan kimia tersebut dapat menciptakan suasana osmotik yang tidak menguntungkan pertumbuhan, dapat pula merangsang pembentukan zat-zat penghambat pertumbuhan yang membatasi pertumbuhan, atau dapat mengadakan sistem-sistem biokemis lebih kompleks yang berhubungan dengan kepekaan benih terhadap cahaya (Purba, 2000).
Perlakuan Pematahan Dormansi
Perlakuan Mekanis
Beberapa cara perlakuan mekanis untuk memecahkan dormansi benih yang disebabkan oleh impermiabilitas kulit biji baik terhadap air atau gas yaitu: 1. Skarifikasi
Skarifikasi dapat dilakukan dengan aberasi yaitu menggosok kulit benih dengan benda yang kasar atau kikir dan kertas pasir. Tujuan untuk menipiskan
kulit biji yang keras sehingga lebih permiabel terhadap air atau gas (Salisbury dan Ross, 1995).
2. Perendaman Air Panas
panas dapat mengurangi biji yang keras dan pemberian panas 100°C selama 5-20 detik dapat menyebabkan terbukanya pleurogram dan menghasilkan perkecambahan 95-100% (Olvera dkk, 1982 dalam Gardner dkk, 1991).
Hasil penelitian menunjukan perlakuan perendaman air panas 85°C merupakan perlakuan yang lebih baik dan menghasilkan daya kecambah yang tertinggi dibandingkan perlakuan lainnya yang memungkinkan bahwa suhu 85°C ideal untuk pematahan dormansi benih mucuna yang secara fisik memiliki seed coat yang tebal. Adapun untuk perlakuan air biasa dan perendaman bahan kimiawi lainnya dapat menjadi bahan penelitian lanjutan untuk mencari konsentrat dan lama perendaman yang ideal untuk pematahan dormansi benih mucuna (Sulaiman dkk., 2009).
3. Pengguntingan Kulit Biji
Pengguntingan kulit biji dilakukan dengan cara menggunting salah satu sisi biji dengan gunting kuku sehingga kulit terkupas dan air dapat dengan mudah masuk ke dalam biji. Pengguntingan ini harus dilakukan dengan hati-hati jangan sampai merusak embrio biji. Persentase perkecambahan dengan cara ini lebih tinggi dibandingkan dengan cara skarifikasi yaitu mencapai 95%, namun
pengerjaannya lebih sulit dibandingkan dengan perlakuan yang pertama (Harahap dkk., 2008).
Perlakuan Kimia
Zat Pengatur Tumbuh Giberelin (GA3)
Hormon tumbuh yang biasa dipakai untuk mematahkan dormansi antara lain: sitokinin, giberelin dan auksin (Sutopo, 2004).
Hormon tumbuh ada yang bersifat alami dan ada yang bersifat sintesis. Giberelin merupakan hormon tumbuh pada tanaman yang bersifat sintesis dan berperan mempercepat perkecambahan. Penggunaan giberelin untuk mempercepat
perkecambahan telah banyak dilakukan (Bey dkk., 2006). Penelitian Murniati dan Zuhri (2002) mengungkapkan bahwa giberelin mampu mempercepat perkecambahan kopi.
Asam giberelat dapat mempengaruhi membran sel dengan naiknya permeabilitas sel, sehingga tekanan osmotik naik dan sel menjadi mengembang
dan memanjang. Proses ini sangat dipengaruhi oleh enzim ɑ-amilase,
sehingga akan mempengaruhi membran sel untuk merangsang RNA dan sintesa protein sampai terjadi proses pembelahan dan pemanjangan sel (Krishnamoorthy, 1981 dalam Widiastoety, 1990).
Asam giberelat merupakan hormon tanaman yang mempunyai efek fisiologis, dapat mempengaruhi diferensiasi kambium dalam proses pembentukan berkas pengankut. Pemberian GA dapat meningkatkan jumlah floem yang terbentuk. Selulosa dan lignin sebagai penyusun dinding sel akan meningkat jumlahnya seiring peningkatan jumlah floemnya. Selulosa dan lignin merupakan penentu kualitas serat. Hormon ini juga dapat memacu pertumbuhan dan
Kucera dkk. (2005) melaporkan bahwa ada dua fungsi giberelin selama perkecambahan benih, pertama giberelin diperlukan untuk meningkatkan potensi tumbuh dari embrio dan sebagai promotor perkecambahan, dan kedua diperlukan untuk mengatasi hambatan mekanik oleh lapisan penutup benih karena terdapatnya jaringan di sekeliling radikula.
Giberelin aktif menunjukkan banyak efek fisiologi, masing-masing tergantung pada tipe giberelin dan juga spesies tanaman. Beberapa proses fisiologi yang dipengaruhi oleh giberelin adalah merangsang pemanjangan batang dengan merangsang pembelahan sel dan pemanjangan, merangsang pembungaan pada hari panjang, memecah dormansi pada beberapa tanaman yang menghendaki
cahaya untuk merangsang perkecambahan, merangsang produksi enzim (ɑ-amilase) dalam mengecambahkan tanaman sereal untuk mobilisasi cadangan
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di lahan masyarakat Jl. Tj. Selamat, Kabupaten Deli Serdang dengan ketinggian ± 57 meter di atas permukaan laut. Penelitian ini dilaksanakan pada bulan November 2012 sampai dengan Februari 2013.
Bahan dan Alat
Bahan dalam penelitian ini adalah biji Mucuna bracteata, air panas, Zat Pengatur Tumbuh Giberelin (GA3), top soil, pasir, alkohol, pupuk rock
phospat (RP) dan polibeg ukuran 20 x 30 cm.
Alat-alat yang digunakan dalam penelitian ini adalah kertas pasir (waterproof abrasive paper No 120), gunting kuku, termometer, cangkul, beacker glass, gembor, meteran, gunting/cutter, pacak sampel, timbangan analitik, amplop, oven dan alat tulis.
Metode Penelitian
Adapun rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Kelompok (RAK) Faktorial dengan 2 faktor perlakuan, yaitu:
Faktor I: Pematahan dormansi dengan 4 taraf, yaitu: M0 = Tidak diberi perlakuan (Kontrol) M1 = Pengguntingan Kulit Benih
M2 = Skarifikasi dengan menggosok menggunakan kertas amplas
Faktor II: Konsentrasi ZPT Giberelin (GA3) dengan 4 taraf, yaitu: G0 = 0 ppm
G1 = 150 ppm G2 = 300 ppm G3 = 450 ppm
Sehingga diperoleh kombinasi perlakuan sebagai berikut :
M0G0 M1G0 M2G0 M3G0
M0G1 M1G1 M2G1 M3G1
M0G2 M1G2 M2G2 M3G2
M0G3 M1G3 M2G3 M3G3
Jumlah Ulangan : 3
Junlah Plot : 48
Jumlah Polibag/plot : 6 tanaman Jumlah Sampel/plot : 4 tanaman Jumlah Total Sampel : 192 tanaman Jumlah Tanaman Seluruhnya : 288 tanaman
Ukuran Plot : 120 cm x 80 cm
Jarak Antar Plot : 30 cm
Jarak Antar Blok : 50 cm
Jarak Antar Polibag : 40 cm
Jarak Pinggir : 50 cm
Data hasil penelitian dianalisa dengan menggunakan sidik ragam berdasarkan model linier sebagai berikut :
Yijk= μ +ρi+ αj+ βk + (αβ)jk+ εijk
i = 1,2,3 j = 1,2,3 k = 1, 2, 3, 4
Yijk = Hasil pengamatan pada blok ke-i dengan perlakuan pematahan dormansi pada taraf ke-j dan zat pengatur tumbuh pada taraf ke-k μ = Nilai tengah umum
ρi = Pengaruh blok ke-i
αj = Pengaruh perlakuan pematahan dormansi pada taraf ke-j βk = Pengaruh perlakuan zat pengatur tumbuh pada taraf ke-k
(αβ)jk = Pengaruh interaksi antara perlakuan pematahan dormansi pada taraf
ke-j dan zat pengatur tumbuh pada taraf ke-k
εijk = Pengaruh galat pada blok ke-i yang mendapat perlakuan pematahan
dormansi pada taraf ke-j dan zat pengatur tumbuh pada taraf ke-k Pengolahan sidik ragam untuk hasil pengamatan 0 (tidak ada yang berkecambah atau belum berkecambah) dilakukan transformasi √X + 0,5 dan √X.
Hasil penelitian yang menunjukkan pengaruh nyata akan dilanjutkan
Pelaksanaan Penelitian
Persiapan Media Tanam
Media tanam yang digunakan adalah pasir pada saat perkecambahan. Pasir terlebih dahulu disterilisasi dengan cara digongseng dan ditaburkan dengan insektisida (Sevin dengan bahan aktif Karbaril 85%) dan fungisida (Antracol 70 WP dengan bahan aktif Propineb 70%). Top soil sebagai media tanam di lapangan yang diisi ke dalam polibeg berukuran 20 x 30 cm dan dilakukan pada minggu pertama.
Pembuatan Bak Perkecambahan
Bak perkecambahan yang digunakan adalah kotak yang terbuat dari kayu sebagai dinding dengan ketinggian 3 inchi dan triplek dengan ketebalan 4 mm sebagai dasar bak. Panjang dan lebar bak adalah 180 cm x 80 cm.
Seleksi Biji
Seleksi biji dilakukan dengan memilih biji yang bebas dari hama dan penyakit, tidak pecah kulitnya, tidak berjamur. Seleksi biji dilakukan pada minggu pertama.
Perlakuan Benih
a. Pengguntingan kulit biji dilakukan dengan menggunakan gunting kuku dengan cara memotong sisi biji. Pemotongan kulit biji dilakukan pada minggu pertama.
b. Penggosokan benih dilakukan dengan menggunakan kertas pasir. Penggosokan benih dilakukan pada minggu pertama.
Perendaman ZPT Giberelin (GA3)
Aplikasi GA3 dilakukan setelah skarifikasi dengan merendam biji dalam zat pengatur tumbuh asam giberelat (GA3) sesuai dengan perlakuan selama 2 jam. Setelah itu biji ditanam pada bak perkecambahan dan dilakukan pada minggu pertama.
Persemaian
Persemaian dilakukan dengan menggunakan bak kecambah dengan ukuran 24 x 30 cm dan media yang digunakan adalah pasir. Persemaian dilakukan pada minggu pertama.
Persiapan Naungan
Naungan dibuat dari bambu sebagai tiang dan daun nipah sebagai atap memanjang utara-selatan dengan tinggi 1,5 m di sebelah timur dan 1,2 m di sebelah barat dengan panjang areal naungan 19 m dan lebar 6 m.
Pengisian Media Tanam ke Polibag
Media tanam yang digunakan adalah tanah top soil dan kompos (3:1). Setelah satu minggu berkecambah bibit di pindahkan ke polibag ukuran 20 x 35 cm dan dilakukan pada minggu pertama.
Pemupukan
Pemupukan dilakukan sebelum penanaman (5 – 7 hari sebelum tanam) dengan menggunakan pupuk rock phospat (RP) sebanyak 20 gr/polibeg. Pemupukan dilakukan pada minggu pertama.
Penanaman
tanam dengan kedalaman ± 3 cm, kemudian menutup lubang tanam dengan top soil. Penanaman dilakukan pada minggu kedua.
Pemeliharaan Tanaman
Pengajiran
Mucuna mempunyai sulur yang menjalar dengan cepat. Oleh karena itu, diperlukan ajir agar tanaman tidak menjalar ke tanaman lainnya. Pemberian ajir dilakukan pada saat tanaman berumur 2 minggu setelah tanam.
Penyiraman
Penyiraman dilakukan segera setelah tanam. Penyiraman dilakukan 2 kali setiap pagi dan sore hari untuk menjaga kelembaban tanah. Penyiraman disesuaikan dengan kondisi lingkungan.
Penyiangan
Penyiangan dilakukan apabila ada gulma yang tumbuh di polibag/plot perlakuan dan sekitar areal percobaan. Penyiangan pada polibag/plot perlakuan dilakukan secara manual dan penyiangan pada areal sekitar lahan percobaan dilakukan dengan menggunakan cangkul.
Pengamatan Parameter
Daya Perkecambahan (%)
Persentase perkecambahan diketahui dengan menghitung jumlah benih yang tumbuh dari keseluruhan jumlah benih yang ditanam pada bak perkecambahan. Persentase perkecambahan dihitung pada 3 – 7 hari setelah persemaian biji. Dengan rumus:
Persentase Perkecambahan
=
JumlahbenihyangberkecambahPanjang Sulur (cm)
Panjang sulur diukur dari titik tumbuh sulur hingga ujung sulur dengan menggunakan meteran yang dilaksanakan pada minggu pertama setelah pindah tanam (1 MSPT) sampai 10 MSPT.
Jumlah Daun (Helai)
Jumlah daun dihitung pada 2 MSPT sampai 10 MSPT.
Bobot Basah Tajuk (g)
Bobot basah tajuk dihitung pada akhir penelitian dengan menggunakan timbangan analitik yaitu pada 10 MSPT.
Bobot Kering Tajuk (g)
Bobot kering tajuk dihitung dengan menggunakan timbangan analitik yang dilaksanakan pada 10 MSPT yang sebelumnya telah dikering ovenkan dengan suhu 70°C selama ± 24 jam.
Bobot Basah Akar (g)
Bobot basah akar dihitung dengan menggunakan timbangan analitik yang dilakukan pada 10 MSPT.
Bobot Kering Akar (g)
Bobot kering akar dihitung dengan menggunakan timbangan analitik yang dilakukan pada 10 MSPT yang sebelumnya telah dikering ovenkan dengan suhu 70°C selama ± 24 jam.
Shoot Root Ratio
HASIL DAN PEMBAHASAN
Hasil
Daya Perkecambahan (%)
Data pengamatan daya perkecambahan benih Mucuna bracteata umur 3 – 7 HST pada berbagai pematahan dormansi dapat dilihat pada Lampiran 1 dan
Gambar 1.
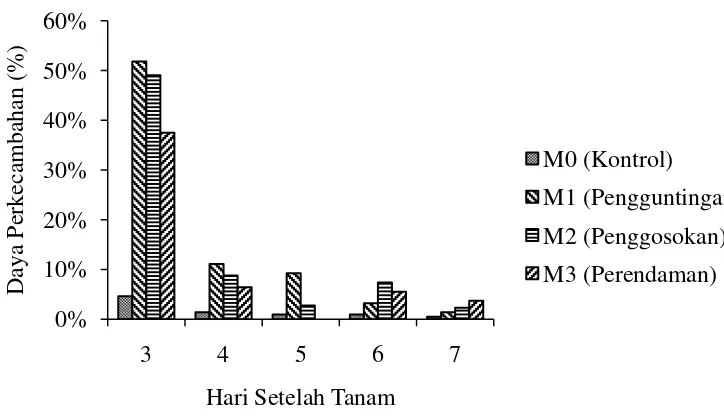
Gambar 1. Persentase daya perkecambahan (%) Mucuna bracteata pada beberapa perlakuan pematahan dormansi umur 3 – 7 hari setelah tanam.
Gambar 1 menunjukkan pada umur 3 – 5 HST daya kecambah tertinggi terdapat pada perlakuan pengguntingan (M1) yaitu 51,82%, 11,08% dan 9,23%, diikuti oleh penggosokan (M2) yaitu 49,03%, 8,77% dan 2,77% dan perlakuan perendaman air panas (M3) yaitu 37,48%, 6,46% tetapi pada umur 5 HST perlakuan perendaman air panas tidak ada yang berkecambah dan daya kecambah terendah terdapat pada perlakuan tanpa pematahan dormansi (M0) yaitu 4,60%, 1,38% dan 0,93%. Pada umur 6 HST daya kecambah tertinggi terdapat pada perlakuan penggosokan (M2) yaitu 7,38% diikuti oleh perendaman air panas (M3) yaitu 5,53%, pengguntingan (M1) yaitu 3,23% dan terendah tanpa pematahan
dormansi (M0) yaitu 0,92% sedangkan pada umur 7 HST perlakuan perendaman air panas (M3) memiliki daya kecambah tertinggi yaitu 3,70%, diikuti oleh penggosokan (M2) yaitu 2,29%, pengguntingan (M1) yaitu 1,38% dan terendah tanpa pematahan dormansi (M0) yaitu 0,46%.
Perlakuan pengguntingan kulit biji, penggosokan benih pada kertas amplas dan perendaman air panas memberikan efek pada perbedaan laju perkecambahan mucuna (Gambar 1). Meskipun beberapa cara perlakuan mekanis untuk memecahkan dormansi telah dilakukan pada biji mucuna, masing-masing perlakuan memiliki perbedaan dalam daya serap air dan udara yang masuk ke dalam benih sehingga respon terhadap daya perkecambahan juga berbeda. Tujuan dari beberapa cara perlakuan mekanis yang dilakukan yaitu untuk menghilangkan atau menipiskan jaringan kulit benih mucuna yang keras sehingga dapat mempersingkat waktu yang dibutuhkan untuk air dan udara menembus kulit biji hingga biji mampu berkecambah. Juhanda dkk (2013) menjelaskan bahwa dengan proses metabolisme yang baik akan menghasilkan perkecambahan yang baik karena benih yang berkecambah dapat memanfaatkan cadangan makanan dalam benih dengan baik. Dengan adanya air, oksigen akan masuk ke dalam benih dan mengurai cadangan makanan yang digunakan sebagai sumber energi untuk pertumbuhan kecambah normal dalam waktu yang cepat dan serentak.
sehingga dapat mempersingkat waktu perkecambahan benih. Hal ini sesuai dengan Schimdt (2000) bahwa beberapa jenis benih tetap dorman disebabkan oleh kulit benihnya yang cukup kuat untuk menghalangi pertumbuhan dari embrio. Kulit benih tidak dapat dilalui air atau udara karena keras atau tertutup oleh gabus maupun lilin. Jika kulit benih dihilangkan maka akan terjadi perkecambahan. Dormansi juga dapat disebabkan keadaan fisiologi dari embrio antara lain akibat embrio yang rudimenter atau secara fisiologis belum masak, maksudnya belum mampu membentuk zat-zat yang diperlukan untuk perkecambahan misalnya zat tumbuh seperti giberelin.
Perlakuan pengguntingan kulit biji (M1) memiliki daya berkecambah lebih
tinggi dibandingkan pada penggosokan benih dan perendaman air panas (M2 dan M3). Persentase daya perkecambahan pada pengamatan 3 hari setelah
tanam pada perlakuan pengguntingan kulit biji (M1) yaitu 51,82%. Hal ini diduga bahwa pengguntingan kulit benih akan mengakibatkan terbukanya akses benih untuk mendapatkan air dan oksigen yang masuk ke dalam benih. Pengguntingan kulit biji dapat dilakukan dengan cara menggunting salah satu sisi biji dengan gunting kuku sehingga kulit terkupas dan air dapat dengan mudah masuk ke dalam biji (Harahap dkk, 2008).
permeabilitas kulit benih sehingga laju imbibisi benih tinggi. Dengan laju imbibisi yang baik menyebabkan kebutuhan air untuk benih terpenuhi sehingga proses metabolisme benih dapat berjalan dengan baik. Proses metabolisme benih yang baik menyebabkan terjadinya perkecambahan yang baik.
Biji mucuna dengan perlakuan tanpa pematahan dormansi sampai hari ke tujuh (akhir pengamatan) juga tidak mampu berkecambah. Hal ini dikarenakan benih mucuna yang keras tidak mendapat perlakuan benih sehingga air dan oksigen yang dibutuhkan untuk perkecambahan tidak dapat masuk ke benih sehingga benih tidak dapat berkecambah. Hal ini sesuai dengan pernyataan Schmidt (2000) bahwa benih tanaman legum pada umumnya mengalami
dormansi fisik yang disebabkan oleh morfologis kulit benih yang menyebabkan kulit benih bersifat impermeabel. Hal ini didukung oleh pernyataan Maryani dan Irfandri (2008) menyatakan benih yang diskarifikasi memberikan
persentase kecambah yang lebih tinggi dibandingkan dengan perlakuan tanpa skarifikasi. Hal ini disebabkan karena benih yang diskarifikasi mempunyai celah yang lebih dalam sehingga air langsung menuju tempat dimana terjadinya pengaktifan reaksi-reaksi untuk perkecambahan.
Data pengamatan daya perkecambahan benih Mucuna bracteata umur 3 – 7 HST pada beberapa konsentrasi zat pengatur tumbuh giberelin dapat dilihat
pada Gambar 2.
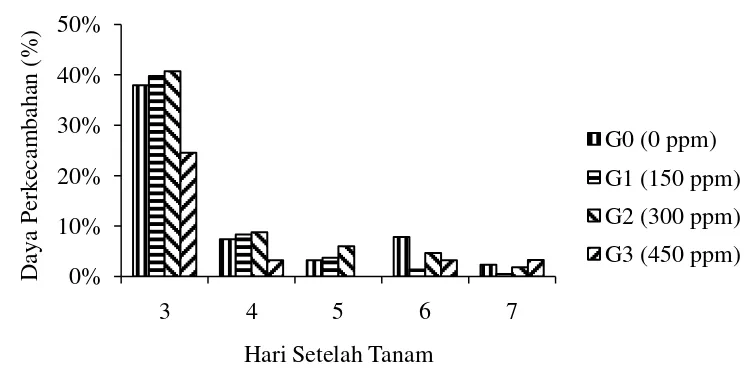
Gambar 2. Persentase daya perkecambahan (%) Mucuna bracteata pada beberapa konsentrasi giberelin umur 3 – 7 hari setalah tanam.
Gambar 2 menunjukkan daya kecambah tertinggi pada 3 – 5 HST diperoleh pada konsentrasi 300 ppm (G2) yaitu 40,70%, 8,76% dan 6,01%, diikuti oleh konsentrasi 150 ppm (G1) yaitu 39,78%, 8,32% dan 3,69% dan tanpa pemberian giberelin (G0) yaitu 37,93%, 7,38% dan 3,23% dan daya kecambah terendah pada konsentrasi 450 ppm (G3) yaitu 24,52%, 3,23% dan 0%. Tanpa pemberian giberelin (G0) memiliki daya kecambah tertinggi pada umur 6 HST yaitu 7,83%, diikuti oleh konsentrasi 300 ppm (G2) yaitu 4,61%, konsentrasi 450 ppm (G3) yaitu 3,23% dan terendah pada konsentrasi 150 ppm (G1) yaitu 1,38%. Pada umur 7 HST diperoleh daya kecambah tertinggi pada konsentrasi 450 ppm (G3) yaitu 3,23%, diikuti oleh perlakuan tanpa pemberian giberelin (G0) yaitu 2,30% dan konsentrasi 300 ppm (G2) yaitu 1,83% dan terendah pada konsentrasi 150 ppm (G1) yaitu 0,46%.
GA3 konsentrasi 450 ppm, mempunyai daya tumbuh dan perkecambahan yang
lebih rendah. Hal ini dikarenakan terlalu tinggi kepekatan/konsentrasi larutan GA3 yang diberikan akan menjadi penghambat atau inhibitor. Copeland dan Mc Donald (2001) menyatakan bahwa zat tumbuh yang termasuk di
dalam giberelin, auksin, sitokinin dan beberapa herbisida, selain berfungsi sebagai perangsang pertumbuhan (promotor) juga dapat berfungsi sebagai penghambat (inhibitor) dalam proses perkecambahan bila konsentrasi larutannya tinggi.
pada perendaman bahan kimia juga tidak sebesar pada perlakuan pengguntingan benih.
Panjang Sulur (cm)
Data analisis sidik ragam panjang sulur Mucuna bracteata 1 – 10 MSPT pada beberapa perlakuan pematahan dormansi dan zat pengatur tumbuh dapat dilihat pada Lampiran 2 – 31, yang menunjukkan perlakuan pematahan dormansi berpengaruh nyata. Sedangkan perlakuan zat pengatur tumbuh dan interaksi antar perlakuan berpengaruh tidak nyata.
Data panjang sulur Mucuna bracteata pada umur 1 – 10 MSPT akibat
perlakuan pematahan dormansi dan zat pengatur tumbuh dapat dilihat pada Tabel 1.
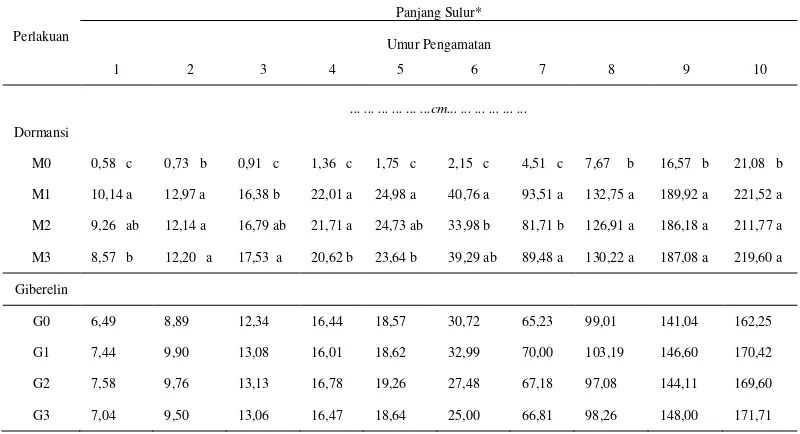
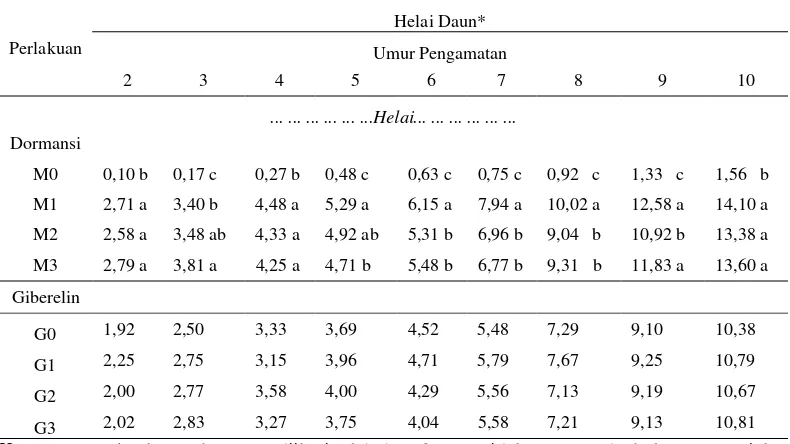
Tabel 1. Panjang sulur Mucuna bracteata (cm) pada berbagai pematahan dormansi dan zat pengatur tumbuh umur 1 – 10 MSPT
Perlakuan
Keterangan: Angka-angka yang diikuti oleh huruf yang tidak sama pada kolom menunjukan berbeda nyata menurut Uji Duncan pada taraf uji 5%.
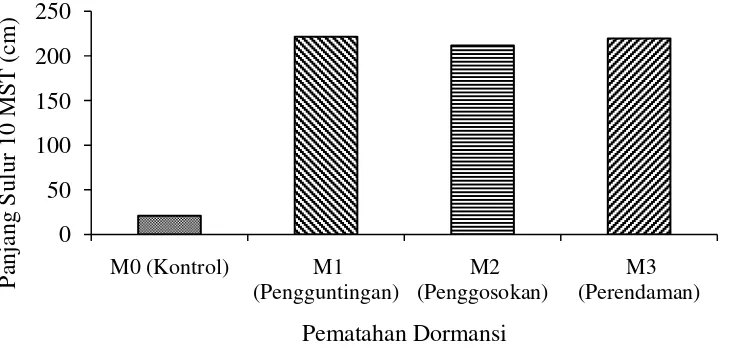
Tabel 1 menunjukkan bahwa perlakuan pematahan dormansi pada 1 – 10 MSPT memberikan pengaruh nyata terhadap panjang sulur. Pertumbuhan sulur tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 221,52 cm, diikuti oleh perendaman air panas (M3) yaitu 219,60 cm, penggosokan benih (M2) yaitu 211,77 cm dan terendah tanpa pematahan dormansi (M0) yaitu 21,08 cm. Pada 10 MSPT perlakuan pengguntingan (M1) berbeda tidak nyata dengan perendaman air panas (M3) dan berbeda tidak nyata dengan penggosokan (M2), tetapi berbeda nyata dengan perlakuan tanpa pematahan dormansi (M0).
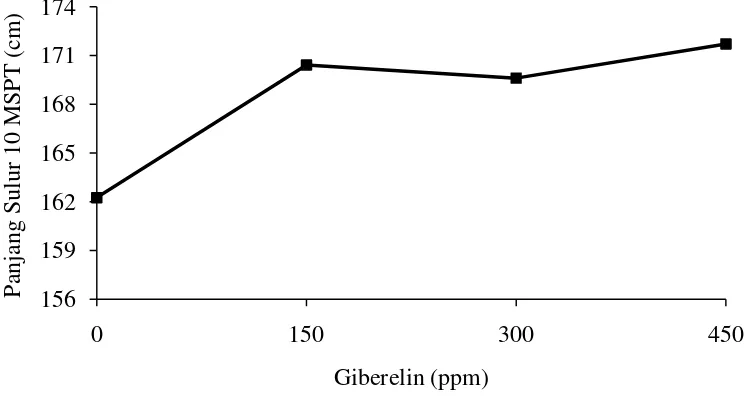
Tabel 1 menunjukkan bahwa perlakuan giberelin pada 1 – 10 MSPT memberikan pengaruh tidak nyata terhadap panjang sulur. Pertumbuhan sulur terpanjang terdapat pada perlakuan giberelin 450 ppm (G3) yaitu 171,71 cm, diikuti oleh 150 ppm (G1) yaitu 170,42 cm, 300 ppm (G2) yaitu 169,60 cm dan terendah tanpa giberelin (G0) yaitu 162,25 cm.
Hubungan panjang sulur Mucuna bracteata 10 MSPT dengan pematahan dormansi dapat dilihat pada Gambar 3.
metabolisme benih dapat berjalan dengan baik. Dengan adanya air, oksigen akan masuk ke dalam benih dan mengurai cadangan makanan yang digunakan sebagai sumber energi untuk pertumbuhan dalam waktu yang cepat dan serentak (Juhanda dkk., 2013).
Hubungan panjang sulur Mucuna bracteata 10 MSPT pada berbagai konsentrasi giberelin dapat dilihat pada Gambar 4.
Gambar 4. Hubungan panjang sulur dengan zat pengatur tumbuh GA3 umur 10 MSPT
Gambar 4 dapat dilihat bahwa perlakuan zat pengatur tumbuh GA3 berpengaruh tidak nyata terhadap pertumbuhan panjang sulur. Perlakuan pemberian GA3 tertinggi terdapat pada konsentrasi 450 ppm (G3) yaitu 171,71 cm, diikuti oleh 150 ppm (G1) yaitu 170,42 cm, 300 ppm (G2) yaitu 169,60 cm dan terendah tanpa giberelin (G0) yaitu 162,25 cm. Efek GA3 yaitu dapat memacu peningkatan tinggi tanaman, dapat memacu induksi pembungaan dan pematahan dormansi. Pada penelitian ini pemberian beberapa konsentrasi zat pengatur tumbuh giberelin memberikan pengaruh tidak nyata terhadap pertumbuhan panjang sulur. Hal ini diduga karena konsentrasi giberelin yang belum sesuai
sehingga tanaman tidak respon terhadap panjang sulur tanaman. Hal ini sesuai dengan pernyataan Weaver (1972) dalam Mubarok (2003) menyatakan bahwa aktivitas GA3 dalam hal pemanjangan batang tidak lepas dari aktivitas hormon lainnya yaitu auksin, dimana dengan pemberian GA3 pada konsentrasi yang sesuai
mampu meningkatkan kandungan auksin pada tanaman itu khususnya di daerah pucuk bagian atas tanaman. Hal ini juga sesuai dengan pernyataan Sutater dan Sanjaya (1996) yang menyatakan bahwa peningkatan tinggi tanaman
akibat pemberian GA3 pada konsentrasi yang sesuai disebabkan oleh peningkatan kandungan auksin di daerah pucuk bagian atas tanaman. Hal ini didukung penelitian Ginting (2013) bahwa pemberian beberapa konsentrasi giberelin terhadap tanaman kentang belum mampu berpengaruh nyata terhadap tinggi tanaman.
Jumlah Daun (Helai)
Data analisis sidik ragam jumlah daun Mucuna bracteata 2 – 10 MSPT pada beberapa perlakuan pematahan dormansi dan zat pengatur tumbuh dapat dilihat pada Lampiran 32 – 58, yang menunjukkan perlakuan pematahan dormansi berpengaruh nyata. Sedangkan perlakuan zat pengatur tumbuh dan interaksi antar perlakuan berpengaruh tidak nyata.
Data jumlah daun Mucuna bracteata pada umur 2 – 10 MSPT akibat
Tabel 2. Jumlah daun (helai) Mucuna bracteata pada berbagai pematahan dormansi dan zat pengatur tumbuh umur 2 – 10 MSPT
Perlakuan
Keterangan: Angka-angka yang diikuti oleh huruf yang tidak sama pada kolom menunjukan berbeda nyata menurut Uji Duncan pada taraf uji 5%.
* data ditransformasi √X + 0,5
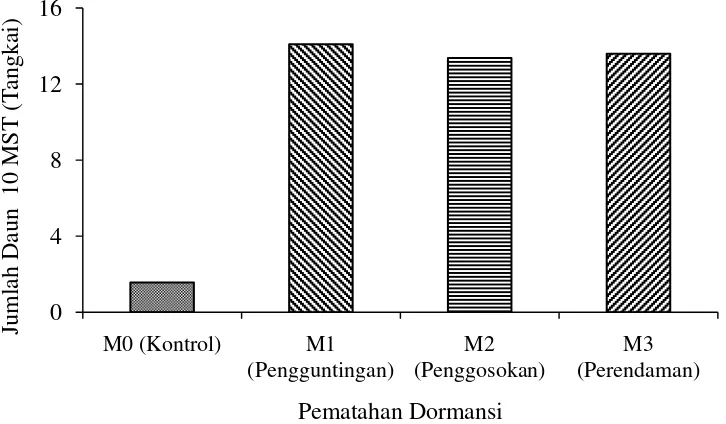
Tabel 2 menunjukkan bahwa perlakuan pematahan dormansi pada 2 – 10 MSPT memberikan pengaruh nyata terhadap jumlah daun. Jumlah daun tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 14,10 helai, diikuti oleh perendaman air panas (M3) yaitu 13,60 helai, penggosokan benih (M2) yaitu 13,38 helai dan terendah tanpa pematahan dormansi (M0) yaitu 1,56 helai. Pada 10 MSPT perlakuan pengguntingan (M1) berbeda tidak nyata dengan perendaman air panas (M3) dan berbeda tidak nyata dengan penggosokan (M2), tetapi berbeda nyata dengan tanpa pematahan dormansi (M0).
Hubungan jumlah daun Mucuna bracteata 10 MSPT dengan pematahan dormansi dapat dilihat pada Gambar 5.
Gambar 5. Hubungan jumlah daun dengan pematahan dormansi umur 10 MSPT Gambar 5 menunjukkan bahwa perlakuan pematahan dormansi berpengaruh nyata terhadap jumlah daun. Jumlah daun tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 14,10 helai, diikuti oleh perendaman air panas (M3) yaitu 13,60 helai, penggosokan benih (M2) yaitu 13,38 helai dan terendah tanpa pematahan dormansi (M0) yaitu 1,56 helai. Hal ini dikarenakan perlakuan skarifikasi berpengaruh terhadap pertumbuhan panjang sulur sehingga pertumbuhan vegetatif tangkai daun menjadi lebih cepat terbentuk. Menurut Haryati (2002) menyatakan bahwa pertambahan daun seiring dengan pertambahan tinggi tanaman. Berdasarkan hasil penelitian Ani (2006) menyatakan bahwa perlakuan skarifikasi menunjukan pengaruh yang sangat nyata pada tinggi tanaman, jumlah daun dan panjang akar.
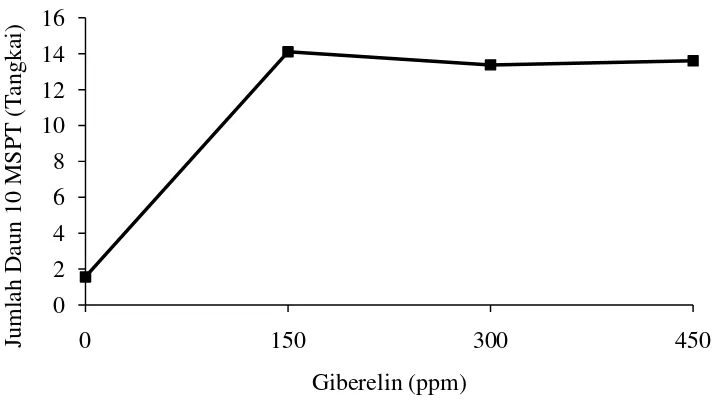
Hubungan jumlah daun Mucuna bracteata 10 MSPT pada berbagai konsentrasi giberelin dapat dilihat pada Gambar 6.
Gambar 6. Hubungan jumlah daun dengan zat pengatur tumbuh GA3 umur 10 MSPT
Gambar 6 menunjukkan bahwa perlakuan giberelin berpengaruh tidak nyata terhadap jumlah daun. Jumlah daun tertinggi terdapat pada perlakuan giberelin 450 ppm (G3) yaitu 10,81 helai, diikuti oleh 150 ppm (G1) yaitu 10,79 helai, 300 ppm (G2) yaitu 10,67 helai dan terendah tanpa giberelin (G0) yaitu 10,38 helai. Jumlah daun dipengaruhi oleh faktor genetik (genotip) dan lingkungan. Hal ini menunjukan bahwa tanaman yang berada pada lingkungan dengan penyinaran yang kurang baik akan menghasilkan jumlah daun yang sedikit. Hal ini sesuai dengan pernyataan Mudyantini (2008) yang menyatakan bahwa salah satu faktor lingkungan adalah cahaya. Tanaman yang berada pada lingkungan dengan penyinaran yang baik bisa menghasilkan jumlah daun yang lebih banyak sebagai akibat dari proses fotosintesis yang berjalan lancar sehingga fotosintat yang dihasilkan banyak. Adanya fotosintat yang banyak salah satunya digunakan untuk meningkatkan aktivitas meristematis pada pembentukan primordia daun. Hal ini sesuai dengan penelitian Peni (2004) yang menyatakan bahwa jumlah dan ukuran daun dipengaruhi oleh faktor genetik dan lingkungan.
Jumlah daun Acalypha indica menunjukkan bahwa pemberian beberapa konsentrasi GA3 tidak memberikan pengaruh nyata terhadap jumlah daun. Hal ini juga diduga karena hasil fotosintesis lebih banyak digunakan untuk pertambahan tinggi tanaman. Hal ini sesuai dengan pernyataan Lakitan (1996) menyatakan bahwa pertumbuhan tidak berlangsung secara seragam pada seluruh bagian tanaman. Pertumbuhan dimungkinkan terfokus pada jaringan meristem batang sehingga pembesaran sel yang dihasilkan dari pembelahan sel tersebut yang menyebabkan pertambahan ukuran tanaman.
Bobot Basah Tajuk (g)
Data analisis sidik ragam dari bobot basah tajuk Mucuna bracteata dapat dilihat pada Lampiran 59 – 61, yang menunjukkan perlakuan pematahan dormansi dan zat pengatur tumbuh serta interaksi berpengaruh nyata terhadap bobot basah tajuk.
Data bobot basah tajuk 10 MSPT akibat perlakuan pematahan dormansi dan zat pengatur tumbuh dapat dilihat pada Tabel 3.
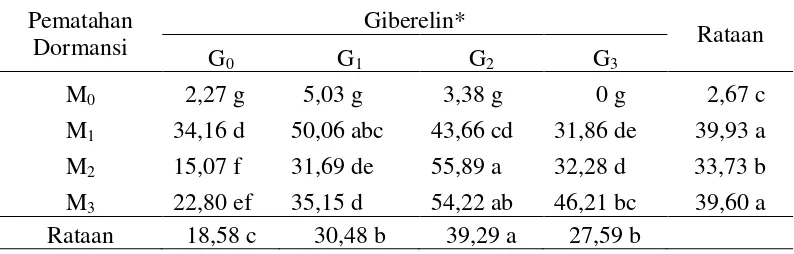
Tabel 3. Bobot basah tajuk Mucuna bracteata (g) pada berbagai pematahan dormansi dan zat pengatur tumbuh umur 10 MSPT
Pematahan Keterangan: Angka-angka yang diikuti oleh huruf yang tidak sama pada kolom menunjukan
berbeda nyata menurut Uji Duncan pada taraf uji 5%. * data ditransformasi √X
pada perlakuan pengguntingan kulit biji (M1) yaitu 39,93 gram, diikuti oleh perendaman air panas (M3) yaitu 39,60 gram, penggosokan benih (M2) yaitu 33,73 gram dan terendah tanpa pematahan dormansi (M0) yaitu 2,67 gram. Perlakuan pengguntingan (M1) berbeda tidak nyata dengan perendaman air panas (M3). Perlakuan pengguntingan (M1) berbeda nyata dengan penggosokan (M2) dan tanpa pematahan dormansi (M0).
Tabel 3 menunjukkan bahwa perlakuan giberelin memberikan pengaruh nyata terhadap bobot basah tajuk. Bobot basah tajuk tertinggi terdapat pada perlakuan giberelin 300 ppm (G2) yaitu 39,29 gram, diikuti oleh 150 ppm (G1) yaitu 30,48 gram, 450 ppm (G3) yaitu 27,59 gram dan terendah tanpa giberelin (G0) yaitu 18,58 gram. Perlakuan giberelin 300 ppm (G2) berpengaruh nyata dengan giberelin 150 ppm (G1), 450 ppm (G3) dan tanpa giberelin (G0). Perlakuan giberelin 150 ppm (G1) berpengaruh tidak nyata dengan giberelin 450 ppm (G3). Perlakuan giberelin 150 ppm (G1) berpengaruh nyata dengan giberelin 300 ppm (G2) dan tanpa giberelin (G0).
Tabel 3 menunjukkan bahwa interaksi pematahan dormansi dan zat pengatur tumbuh GA3 memberikan pengaruh nyata terhadap bobot basah tajuk. Bobot basah tajuk tertinggi terdapat pada perlakuan penggosokan dan giberelin 300 ppm (M2G2) yaitu 55,89 gram dan terendah pada perlakuan tanpa pematahan dormansi dan tanpa giberelin (M0G0) yaitu 0 gram. Perlakuan penggosokan dan GA3 300 ppm (M2G2) tidak berbeda nyata dengan perlakuan perendaman air panas dan GA3 300 ppm (M3G2).
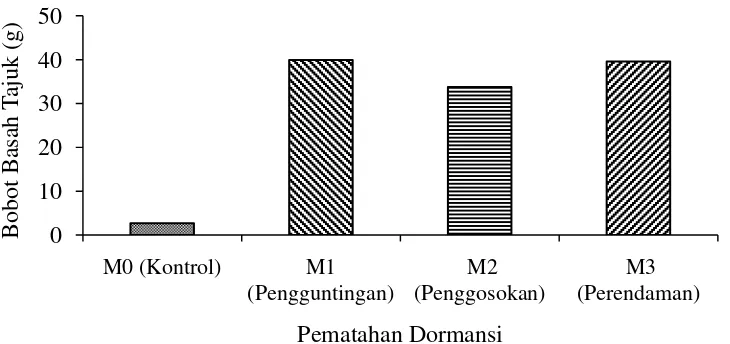
Gambar 7. Hubungan bobot basah tajuk dengan pematahan dormansi umur 10 MSPT
Gambar 7 menunjukkan perlakuan pematahan dormansi berpengaruh nyata terhadap bobot basah tajuk. Bobot basah tajuk tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 39,93 gram, diikuti oleh perendaman air panas (M3) yaitu 39,60 gram, penggosokan benih (M2) yaitu 33,73 gram dan terendah tanpa pematahan dormansi (M0) yaitu 2,67 gram. Hal ini dikarenakan dengan proses metabolisme yang baik akan menghasilkan perkecambahan yang baik karena benih yang berkecambah dapat memanfaatkan cadangan makanan dalam benih dengan baik. Dengan adanya skarifikasi, air dan oksigen akan masuk dengan mudah ke dalam benih dan mengurai cadangan makanan yang digunakan sebagai sumber energi untuk perkecambahan dan pertumbuhan tanaman dalam waktu yang cepat dan serentak. Hal ini sesuai dengan pernyataan Sutopo (2004) menyatakan bahwa perkecambahan benih merupakan suatu rangkaian kompleks dari perubahan-perubahan morfologi, fisiologi dan biokimia. Metabolisme sel-sel embrio benih dimulai setelah menyerap air, yang meliputi reaksi-reaksi perombakan (katabolisme) dan sintesa komponen-komponen sel untuk pertumbuhan (anabolisme). Proses metabolisme
ini akan berlangsung terus dan merupakan pendukung dari pertumbuhan kecambah hingga tanaman dewasa. Dengan demikian pertumbuhan kecambah sangat tergantung pada persediaan makanan yang ada dalam biji. Menurut Prawiranata dkk (1991) menyatakan bahwa proses metabolisme tanaman yang relatif lebih sempurna dalam pertumbuhan tanaman akan dapat meningkatkan pertumbuhan tanaman yang lebih baik, di antaranya peningkatan tinggi tanaman yang mempengaruhi berat tanaman.
Hubungan bobot basah tajuk pada berbagai konsentrasi giberelin dapat dilihat pada Gambar 8.
Gambar 8. Hubungan bobot basah tajuk dengan zat pengatur tumbuh GA3 umur 10 MSPT
Perlakuan pemberian giberelin berpengaruh nyata terhadap parameter bobot basah tajuk. Bobot basah tajuk tertinggi terdapat pada perlakuan giberelin 300 ppm (G2) yaitu 39,29 gram, diikuti oleh 150 ppm (G1) yaitu 30,48 gram, 450 ppm (G3) yaitu 27,59 gram dan terendah tanpa giberelin (G0) yaitu 18,58 gram. Hal ini dikarenakan pemberian giberelin mempengaruhi pembesaran sel dan mengakibatkan pertambahan ukuran sel yang menghasilkan pertambahan ukuran
jaringan dan akhirnya meningkatkan ukuran tubuh tanaman. Hal ini didukung Salisbury dan Ross (1995) yang menyatakan bahwa giberelin mempengaruhi pembesaran sel (peningkatan ukuran) dan mempengaruhi pembelahan sel (peningkatan jumlah). Adanya pembesaran sel mengakibatkan ukuran sel (peningkatan jumlah). Adanya pembesaran sel mengakibatkan ukuran sel yang baru lebih besar dari sel induk. Pertambahan ukuran sel menghasilkan pertambahan ukuran jaringan, organ dan akhirnya meningkatkan ukuran tubuh tanaman secara keseluruhan maupun berat tanaman tersebut. Peningkatan pembelahan sel menghasilkan jumlah sel yang lebih banyak. Jumlah sel yang
meningkat, termasuk di dalam jaringan pada daun, memungkinkan
terjadinya peningkatan fotosintesis penghasil karbohidrat, yang dapat mempengaruhi bobot tanaman. Hal ini sesuai dengan pernyataan
Sitompul dan Guritno (1995) dalam Lestari dkk (2008) menyatakan bahwa bobot basah tanaman menunjukkan besarnya kandungan air dalam jaringan atau organ tumbuhan selain bahan organik.
Gambar 9. Hubungan bobot basah tajuk dengan pematahan dormansi pada berbagai konsentrasi zat pengatur tumbuh GA3
Hasil analisis data secara statistik menunjukkan bahwa interaksi pematahan dormansi dan konsentrasi giberelin (GA3) berpengaruh nyata terhadap parameter bobot basah tajuk. Kombinasi perlakuan yang terbaik diperoleh pada perlakuan pematahan dormansi penggosokan benih dan pemberian GA3 300 ppm (M2G2). Hal ini disebabkan karena dengan dilakukannya skarifikasi pada benih menyebabkan kulit benih menipis sehingga permeabilitas biji dan membran berubah, sehingga akan memudahkan masuknya giberelin ke dalam biji yang menyebabkan pelebaran dan perluasan pada dinding sel yang menghasilkan pertambahan ukuran jaringan dan akhirnya meningkatkan ukuran tubuh tanaman. Peningkatan bobot basah tajuk dipengaruhi kandungan air yang tinggi pada jaringan atau organ tanaman. Hal ini sesuai dengan pernyataan Haryani (2005) tujuan dari skarifikasi ialah untuk melunakkan endokarp dan membuang zat
penghambat. Giberelin memacu pembentangan sel melalui stimulasi enzim dinding sel yang dapat memutuskan ikatan-ikatan pada molekul pembentuk dinding sel yaitu hemiselulose yang menyebabkan komponen dinding yang lain yakni mikrofibril selulose berpindah tempat, sehingga menyebabkan pelebaran atau perluasan pada dinding sel dan ini memungkinkan pertambahan dalam pelebaran sel yang menyebabkan bobot tajuk menjadi meningkat (Dengler, 2008). Menurut Salisbury dan Ross (1995) juga menyebutkan bahwa bobot basah tanaman menunjukkan aktivitas metabolisme tanaman dan nilai bobot basah ini dipengaruhi oleh kadar air jaringan, unsur hara dan hasil metabolisme.
Bobot Kering Tajuk (g)
Data analisis sidik ragam dari bobot kering tajuk Mucuna bracteata dapat dilihat pada Lampiran 62 – 64, yang menunjukkan perlakuan pematahan dormansi dan zat pengatur tumbuh serta interaksi berpengaruh nyata terhadap bobot kering tajuk.
Data bobot kering tajuk 10 MSPT akibat perlakuan pematahan dormansi dan zat pengatur tumbuh dapat dilihat pada Tabel 4.
Tabel 4. Bobot kering tajuk Mucuna bracteata (g) pada berbagai pematahan dormansi dan zat pengatur tumbuh umur 10 MSPT
Pematahan
Keterangan: Angka-angka yang diikuti oleh huruf yang tidak sama pada kolom menunjukan berbeda nyata menurut Uji Duncan pada taraf uji 5%.
Tabel 4 menunjukkan bahwa perlakuan pematahan dormansi memberikan pengaruh nyata terhadap bobot kering tajuk. Bobot kering tajuk tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 11,12 gram, diikuti oleh perendaman air panas (M3) yaitu 10,01 gram, penggosokan benih (M2) yaitu 8,86 gram dan terendah tanpa pematahan dormansi (M0) yaitu 0,71 gram. Perlakuan pengguntingan (M1) berbeda tidak nyata dengan perendaman air panas (M3). Perlakuan pengguntingan (M1) berbeda nyata dengan penggosokan (M2) dan tanpa pematahan dormansi (M0).
Tabel 4 menunjukkan bahwa perlakuan giberelin memberikan pengaruh nyata terhadap bobot kering tajuk. Bobot kering tajuk tertinggi terdapat pada perlakuan giberelin 300 ppm (G2) yaitu 10,09 gram, diikuti oleh 150 ppm (G1) yaitu 8,44 gram, 450 ppm (G3) yaitu 7,42 gram dan terendah tanpa giberelin (G0) yaitu 4,76 gram. Perlakuan giberelin 300 ppm (G2) berpengaruh nyata dengan giberelin 150 ppm (G1), 450 ppm (G3) dan tanpa giberelin (G0). Perlakuan giberelin 150 ppm (G1) berpengaruh tidak nyata dengan giberelin 450 ppm (G3). Perlakuan giberelin 150 ppm (G1) berpengaruh nyata dengan giberelin 300 ppm (G2) dan tanpa giberelin (G0).
Hubungan bobot kering tajuk Mucuna bracteata 10 MSPT dengan pematahan dormansi dapat dilihat pada Gambar 10.
Gambar 10. Hubungan bobot kering tajuk dengan pematahan dormansi umur 10 MST
Gambar 10 menunjukkan bahwa perlakuan pematahan dormansi berpengaruh nyata terhadap parameter bobot kering tajuk. Bobot kering tajuk tertinggi terdapat pada perlakuan pengguntingan kulit biji (M1) yaitu 11,12 gram, diikuti oleh perendaman air panas (M3) yaitu 10,01 gram, penggosokan benih (M2) yaitu 8,86 gram dan terendah tanpa pematahan dormansi (M0) yaitu 0,71 gram. Hal ini dikarenakan perlakuan pengguntingan kulit biji (skarifikasi) terlebih dahulu pada benih dapat membuat permeabilitas kulit benih terhadap air dan gas. Dengan bertambahnya air yang masuk maka proses perubahan zat-zat makro menjadi asam amino, nukleosida, dan protein-protein lain yang mendorong perkecambahan akan bertambah pula. Selain itu hasil-hasil perombakan ini dapat dimanfaatkan oleh embrio guna mempercepat perkecambahan dan mendorong terbentuknya bagian-bagian penting untuk pertumbuhan tanaman seperti daun, batang dan akar. Menurut Gardner dkk (1991) menyatakan bahwa pertumbuhan
dapat didefinisikan sebagai pembelahan dan pembesaran sel akibat adanya interaksi antara berbagai faktor internal dan faktor eksternal. Faktor internal antara lain laju fotosintesis, respirasi, pembagian hasil asimilasi dan nitrogen, tipe letak meristem, kapasitas penyimpanan cadangan makanan, diferensiasi, aktivitas enzim dan lain-lain. Menurut Harjadi (1991) pertumbuhan dapat dinyatakan dengan pertambahan ukuran dan berat kering yang tidak dapat balik. Pertambahan ukuran dan berat kering dari suatu organisme mencerminkan bertambahnya protoplasma yang mungkin terjadi, baik karena ukuran maupun sel yang bertambah. Hal ini juga dikarenakan tanaman mucuna memiliki keunggulan yaitu pertumbuhan dan perkembangan yang cepat. Hal ini sesuai dengan Sebayang dkk (2004) bahwa Mucuna bracteata memiliki keunggulan lainnya dibandingkan dengan LCC konvensional lainnya diantaranya adalah pertumbuhan yang cepat dan menghasilkan biomassa yang tinggi.
Hubungan bobot kering tajuk pada berbagai konsentrasi giberelin dapat dilihat pada Gambar 11.
Hasil analisis data secara statistik menunjukkan bahwa perlakuan pemberian giberelin berpengaruh nyata terhadap parameter bobot kering tajuk. Bobot kering tajuk tertinggi terdapat pada perlakuan giberelin 300 ppm (G2) yaitu 10,09 gram, diikuti oleh 150 ppm (G1) yaitu 8,44 gram, 450 ppm (G3) yaitu 7,42 gram dan terendah tanpa giberelin (G0) yaitu 4,76 gram. Hal ini dikarenakan penggunaan giberelin dapat meningkatkan pertambahan panjang tanaman. Pertambahan panjang tanaman disebabkan karena giberelin dapat meningkatkan aktifitas pembelahan sel di bawah meristem pucuk. Pemanjangan batang terjadi melalui dua proses yaitu pembelahan sel dan pembesaran sel. Sel membesar dan mencapai ukuran maksimum, selanjutnya diikuti oleh pembelahan sel. Pemberian giberelin selain menambah tinggi tanaman, juga menambah luas daun dan berat kering atau berat basah tanaman. Pertambahan berat ini merupakan hasil
peningkatan aktifitas fotosintesis. Hal ini sesuai dengan pernyataan Eid dan Abouleila (2006) menyatakan bahwa GA3 secara fisiologis berperan
biasanya lebih akurat dinyatakan dengan ukuran berat kering dari pada dengan berat basah, karena berat basah sangat dipengaruhi oleh kondisi kelembaban. Hasil berat kering merupakan keseimbangan antara fotosintesis dan respirasi. Fotosintesis mengakibatkan peningkatan berat kering tanaman karena pengambilan CO2 sedangkan respirasi mengakibatkan penurunan berat kering karena pengeluaran CO2 (Gardner dkk, 1991 dalam Lestari dkk, 2008).
Hubungan bobot kering tajuk Mucuna bracteata 10 MSPT dengan pematahan dormansi pada berbagai konsentrasi zat pengatur tumbuh dapat dilihat pada Gambar 12.
Gambar 12. Hubungan bobot kering tajuk dengan pematahan dormansi pada berbagai konsentrasi zat pengatur tumbuh GA3
Hasil analisis data secara statistik menunjukkan bahwa interaksi pematahan dormansi dan konsentrasi giberelin (GA3) berpengaruh nyata terhadap parameter bobot kering tajuk. Kombinasi perlakuan yang terbaik diperoleh pada perlakuan pematahan dormansi pengguntingan kulit benih dan pemberian GA3 300 ppm (M1G2). Hal ini diduga karena perlakuan skarifikasi akan menyebabkan