WIWIN IMRO’ATUN KHOIRIYAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
iii
Dengan ini saya menyatakan bahwa tesis ‘Overekspresi Gen Kitinase
pada Trichoderma harzianum Lokal’ adalah benar-benar merupakan hasil karya sendiri dan belum pernah digunakan untuk memperoleh gelar sejenis. Semua
sumber data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Mei 2006
ii
WIWIN IMRO’ATUN K. Overekspresi Gen Kitinase pada Trichoderma harzianum Lokal. Dibimbing oleh MAGGY T. SUHARTONO dan AGUS PURWANTARA.
Kemampuan Trichoderma harzianum untuk menghambat pertumbuhan cendawan lain memungkinkannya efektif sebagai agen biokontrol cendawan
patogen pada tanaman. Ganoderma sp., yang menyebabkan busuk pangkal batang pada tanaman kelapa sawit merupakan salah satu patogen target penting
yang perlu dikendalikan. Ekspresi gen kitinase pada Trichoderma diketahui memegang peranan penting selama periode kontak awal pada proses mikoparasitik. Gen penyandi kitinase pada T. harzianum juga diketahui sebagai
gen dengan kopi tunggal. Tujuan penelitian ini adalah melakukan transformasi gen kitinase yang diklon dari T. harzianum isolat lokal DT41 ke T. harzianum
DT38 dan ekspresi gen kitinase pada transformannya. Konstruk gen kitinase disisipkan ke dalam Agrobacterium tumefaciens dengan membuat vektor biner pPK2trpChi yang membawa gen higromisin B phosphotransferase dari bakteri sebagai marker seleksi dan dikendalikan oleh promoter Aspergillus nidulans trpC.
Vektor ini kemudian ditransformasikan ke dalam T. harzianum DT38 menghasilkan beberapa transforman. Uji dengan PCR mengkonfirmasi keberadaan kaset gen di dalam genom transforman, tetapi uji Southern blotting
tidak berhasil mengkonfirmasi. Semua transforman yang diuji stabil secara mitotis, menunjukkan ketahanan terhadap hygromycin B setelah beberapa
generasi. Namun demikian, hanya satu transforman yang memperlihatkan peningkatan aktifitas kitinasenya (9.6 uM pNP/mg protein/jam jika dibandingkan
iv
Trichoderma harzianum LOKAL
WIWIN IMRO’ATUN KHOIRIYAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSITUT PERTANIAN BOGOR
v Nama : Wiwin Imro’atun Khoiriyah NIM : P055020011
Disetujui Komisi Pembimbing
Prof. Dr. Maggy T. Suhartono Dr. Agus Purwantara, APU
Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Muhammad Jusuf Prof. Dr. Syafrida Manuwoto, MSc.
vi
Penulis dilahirkan di Klaten, Jawa Tengah pada tanggal 24 Januari 1976 sebagai anak kedua dari pasangan Ayahanda H. Sihadi Abdul Ghofur dan Ibunda Sri Supeni.
Pendidikan dasar di SDN Jiwo, lulus tahun 1988. Pendidikan menengah
di SMPN 1 Wedi, lulus pada tahun 1991 dan pada tahun 1994 penulis lulus dari SMAN 1 Klaten. Pendidikan sarjana ditempuh di Fakultas Biologi, Universitas Jenderal Soedirman, di Purwokerto lulus 1999. Pada tahun 2002 melanjutkan studi di Program Studi Bioteknologi Sekolah Pasca Sarjana, Institut Pertanian
vii
Puji dan syukur penulis panjatkan pada Allah SWT atas segala karunia- Nya sehingga penelitian dan penulisan tesis yang merupakan salah satu syarat untuk meraih gelar Magister Sains di Sekolah Pasca Sarjana, Institut Pertanian Bogor dapat diselesaikan. Penelitian ini dilaksanakan mulai bulan Mei 2004 sampai dengan Juli 2005, dengan judul “Overekspresi Gen Kitinase pada
Trichoderma harzianum Lokal ”.
Penulis menyampaikan terima kasih dan penghargaan yang sebesar-besarnya kepada Prof. Dr. Maggy T. Suhartono selaku ketua komisi pembimbing dan Dr. Agus Purwantara, APU selaku pembimbing anggota atas dorongan dan bimbingan selama penulis menyelesaikan penelitian dan penulisan tesis. Penulis
juga menyampaikan terima kasih kepada Dr. Darmono Taniwiryono selaku Pimpinan Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) yang telah memberi ijin untuk melakukan penelitian di Laboratorium Biologi Molekuler dan aboratorium Mikroba BPBPI. Terima kasih kepada Dr. Siswanto,
Dr. Asmini, Dr. Djoko Santoso dan Dr. Tetty atas pengarahan dan kepedulian terhadap penulis selama menyelesaikan pendidikan pascasarjana di IPB. Kepada teman-teman teknisi Bu Endang, Topan, Niyyah, Herti dan Arif terima kasih atas kerjasama dan bantuannya. Tidak lupa terima kasih buat rekan-rekan seperjuangan Biotek 2002 (Diana, Berty, Roberdi, , Mbak Anik, Kusuma, Bang
Molah), Ilyas Jamil, MSi dan Kiki atas bantuan, motivasi dan diskusi dengan penulis selama penelitian dan perkuliahan di IPB.
Penulis juga mengungkapkan terima kasih yang setulus-tulusnya serta syukur atas kesabaran dan doa Ayahanda H. Sihadi Abdul Ghofur dan Ibunda Sri
Supeni, kakak-kakak dan adik-adikku tersayang, terima kasih untuk doa dan kasih sayang sehingga penulis dapat menyelesaikan studi dan penelitian. Untuk Mas Afdan Irvandy atas cinta dan kasih sayangnya selama menyelesaikan studi di IPB yang telah mencari dan memberi yang terbaik buatku.
Bogor, Mei 2006
viii
Halaman
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Penyakit Busuk Pangkal Batang Kelapa Sawit ... 5
Pengendalian Hayati Penyakit ... 5
Enzim Kitinase T. harzianum... 7
Konstruksi, Transformasi dan Overekspresi Gen Kitinase ... 9
BAHAN DAN METODE ... 12
Tempat dan Waktu Penelitian ... 12
Bahan dan Alat ... 12
Metode Pelaksanaan... 12
Alur Penelitian ... 12
Transformasi Gen Kitinase pada T. harzianum... 13
Triparental mating ... 14
Uji Konsentrasi Antibiotik untuk Seleksi Transformasi ... 14
Transformasi T. harzianum melalui A. tumefaciens... 15
Analisis Transforman ... 16
Isolasi DNA Genomik ... 16
Pelaksanaan PCR ... 16
Southern Blot ... 17
Sintesis Probe ... 18
Penentuan Efisiensi Pelabelan ... 18
Digesti DNA Genomik dan Blotting ke dalam Membran .... 19
Hibridisasi ... 19
Ekstraksi Enzim Kitinase ... 19
HASIL DAN PEMBAHASAN ... 21
Transformasi Gen Kitinase pada T. harzianum... 21
Triparental mating ... 21
Uji Konsentrasi Antibiotik untuk Seleksi Transformasi ... 22
ix
Pelaksanaan PCR ... 26
Southern Blot ... 27
Uji Aktivitas Kitinase T. harzianum transforman ... 30
SIMPULAN DAN SARAN ... 34
DAFTAR PUSTAKA ... 35
x
Halaman
Tabel 1 Pertumbuhan Trichoderma harzianum wildtype pada media PDA yang mengandung higromisin... 23
xi
Halaman Gambar 1 Mekanisme mikoparasitisme Trichodermaharzianum pada patogen
tanaman Pythium sp. ... 6
Gambar 2 Peta plasmid biner pPK2-Trp-Chi... 11
Gambar 3 Alur kegiatan penelitian ... 13
Gambar 4 PCR pada koloni hasil Triparental mating dengan primer nptII ... 22
Gambar 5 (A) Hasil seleksi transformasi pada media PDA + higromisin 300 µg/mL setelah 7 hari, (B) subkultur transforman pada media PDA+ higromisin 300 ug/mL berumur 2 hari... 25
Gambar 6 Morfologi koloni Trichoderma harzianum DT38 pada media PDA... 25
Gambar 7 Hasil amplifikasi dengan primer hph... 27
Gambar 8 Hasil isolasi fragmen gen chi... 28
Gambar 9 Efisiensi pelabelan probe chi... 29
Gambar 10 Hasil Southern Blot ... 30
xii
Latar Belakang
Tanaman kelapa sawit merupakan komoditas perkebunan penting bagi Indonesia. Selain untuk memenuhi kebutuhan minyak goreng dalam negeri, kelapa sawit juga merupakan komoditas andalan ekspor non-migas dari sektor pertanian. Devisa yang diperoleh dari ekspor minyak dan inti minyak pada tahun 1993 mencapai US$ 692.817 juta (Direktorat Jenderal Perkebunan 1994). Selain itu perkebunan kelapa sawit juga mempunyai arti sosial yang penting, karena perkebunan ini merupakan penyerap tenaga kerja yang cukup besar. Menurut Asmono et al. (1999) areal perkebunan kelapa sawit di Indonesia pada tahun 1998 mencapai 2,6 juta hektar yang menghasilkan lebih kurang 5,9 juta ton minyak sawit mentah (CPO). Dari jumlah tersebut 3 juta ton diantaranya diekspor dengan nilai 1,5 juta miliar USD.
Perkebunan kelapa sawit mempunyai arti sosial yang penting karena dapat menyerap tenaga kerja yang cukup besar. Menurut Asmono et al. (1999), areal perkebunan kelapa sawit di Indonesia pada tahun 1998 mencapai 2,6 juta hektar dengan sekitar 34 % areal merupakan perkebunan rakyat dan sisanya diusahakan oleh pemerintah dan swasta. Pemerintah mentargetkan peningkatan produksi kelapa sawit secara nasional dan menjadikan Indonesia sebagai Negara pengekspor minyak sawit terbesar di dunia pada tahun 2010. Untuk itu berbagai upaya pendukung peningkatan produktivitasnya digalakkan dan salah satunya dengan mengendalikan hama dan penyakit pada areal perkebunan kelapa sawit.
Sekarang ini kebanyakan petani masih menggunakan pestisida kimiawi untuk menanggulangi serangan hama dan penyakit pada tanaman budidaya, meskipun dapat menimbulkan dampak merugikan terhadap kesehatan, keamanan produk pertanian maupun resiko lingkungan yang lain (Purwantara 2003). Metode lain yang dapat dikembangkan adalah perakitan tanaman transgenik yang mampu mengekspresikan gen penyandi enzim antipatogen. Dalam usaha perakitan tanaman transgenik diperlukan sumber gen antipatogen yang diintroduksikan melalui transformasi ke dalam tanaman dengan menggunakan teknik kultur jaringan. Proses ini lebih rumit dan diperkirakan kemampuan beberapa generasi tanaman transgenik tersebut akan mudah patah, baik karena ketidakstabilan gen terintroduksi dalam genomnya maupun adanya mutasi dari patogen untuk mempertahankan diri. Dengan demikian pengembangan pengendalian hayati (biokontrol) patogen menggunakan organisme yang antagonis merupakan mekanisme pengendalian terhadap penyakit tanaman non kimia yang potensial.
Aplikasi Streptomyces anulatus yang mempunyai aktivitas kitinase, efektif mengendalikan patogen layu Fusarium pada tanaman tomat dan strawberi. Demikian juga aplikasi Kurthia zopfii terhadap penyakit embun tepung (Erysiphe graminis f. sp. Hordei) pada gandum-barlei, serta aplikasi Serratia marcescens terhadap Rhizoctonia
solani pada tanaman kapas dan Sclerotium rolfsii pada tanaman kacang. Bahkan
efektivitas aplikasi klon Escherichia coli pembawa gen kitinase dari K. zopfii tidak berbeda nyata dengan K. zopfii-nya sendiri (Priyatno et al. 1997). Cendawan T.
harzianum mampu menghambat berbagai cendawan patogen pada tanaman perkebunan
antara lain Ganoderma sp. pada akar kelapa sawit, penyakit akar putih pada tanaman karet dan Phytopthora sp. pada tanaman kakao.
diketahui memiliki aktivitas kitinase dan tingkat virulensi yang tinggi terhadap cendawan patogen Ganoderma sp. Ketika dikulturkan, isolat DT38 menghasilkan spora yang lebih banyak daripada isolat DT41, tetapi isolat DT38 mempunnyai aktivitas kitinase yang lebih rendah. Salah satu kriteria pengembangan mikroba sebagai pengendali hayati adalah kemampuannya untuk ditumbuhkan dengan baik (spora yang dihasilkan banyak), maka isolat T. harzianum DT38 merupakan isolat asal Indonesia yang telah dikembangkan secara komersial sebagai biofungisida. Isolat tersebut di lapangan telah terbukti memiliki kemampuan yang cukup besar dalam menghambat pertumbuhan beberapa cendawan patogen termasuk Ganodermaboninense.
Dalam rangka pengembangan biofungisida T. harzianum sebagai pengendali hayati patogen G. boninense dilakukan studi awal untuk mentransformasi gen kitinase asal T. harzianum DT41 ke dalam genom T. harzianum DT38. Sebagai upaya peningkatan resistensi tanaman kelapa sawit terhadap patogen, gen kitinase asal T.
harzianum isolat lokal DT41 terklon juga dapat menjadi sumber gen untuk kegiatan
transformasi ke tanaman kelapa sawit.
Kloning gen kitinase dari Trichoderma harzianum galur DT41 isolat lokal telah berhasil dilakukan dengan metode PCR menggunakan primer spesifik dari sekuen gen penyandi endochitinase 42 dari Hayes et al. 1994. Amplikon berukuran sekitar 1.5 kb disubkloning dan hasil sekuensing memperlihatkan homologi yang tinggi dengan gen kitinase pada database (Purwantara 2003). Fragmen gen chi terklon disubkloning ke dalam plasmid pPK2-Trp-Chi yang digunakan untuk transformasi ke dalam T. harzianum
lokal DT38 dengan bantuan A. tumefaciens strain AGLO.
Tujuan penelitian
Penelitian ini bertujuan untuk 1). melakukan transformasi gen kitinase ke dalam
T. harzianum DT38 melalui A. tumefaciens, 2). menguji stabilitas kaset gen terintroduksi pada genom transforman dan 3). menguji ekspresi gen kitinase T. harzianum
transforman.
Manfaat penelitian
Aplikasi penegendali hayati menggunakan mikroba telah banyak dilaporkan baik oleh penelitian internasional maupun penelitian di Indonesia. Demikian pula Balai Penelitian Bioteknologi Perkebunan Indonesia telah memproduksi beberapa pupuk hayati berbasis mikroba. Penelitian ini diharapkan dapat memberikan peningkatan kemampuan
T. harzianum sebagai pengendali hayati terhadap patogen G. boninense pada kelapa
TINJAUAN PUSTAKA
Penyakit busuk pangkal batang kelapa sawit
Usaha peningkatan produktivitas perkebunan kelapa sawit menghadapi berbagai kendala, salah satunya adalah gangguan penyakit busuk pangkal batang yang disebabkan oleh Ganoderma boninense. Penyakit busuk pangkal batang merupakan penyakit penting di perkebunan kelapa sawit di Indonesia dan Malaysia (Susanto et al. 2002), telah menyebabkan kerugian yang cukup besar dimana tingkat kematian tanaman akibat serangan penyakit tersebut sebesar 50% atau lebih (Turner 1981).
Infeksi terjadi pada pangkal batang, dan penularan penyakit pada umumnya terjadi melalui kontak akar atau bagian pangkal batang dengan sumber inokulum yang berada di tanah. Setelah infeksi, perkembangan penyakit pada jaringan tanaman relatif lambat. Hasil penelitian di rumah kaca menunjukkan bahwa gejala sakit mulai tampak 6 - 12 bulan setelah inokulasi dilakukan pada tanaman berumur satu tahun di dalam kantong plastik (Darmono et al. 1997).
Sekarang ini pengendalian penyakit Ganoderma difokuskan pada penggunaan agen pengendalian hayati dan tanaman yang resisten. Berbagai kegiatan telah dilakukan antara lain dengan mencari agen hayati dari rhizosphere tanaman kelapa sawit. Beberapa agen hayati yang diisolasi yang terpenting yaitu T. harzianum, T. viride, Gliocladium
viride, Pseudomonas fluorescens, dan Bacillus sp. Percobaan di rumah kaca dan di
lapang menunjukkan bahwa perlakuan dengan T. harzianum dan G. viride lebih baik dibanding dengan Bacillus sp. Selanjutnya pengujian pada skala yang luas memperlihatkan bahwa kejadian penyakit lebih rendah di lahan yang diberi perlakuan agen hayati dibanding dengan yang tidak diberikan perlakuan (Susanto 2002).
Pengendalian Hayati Penyakit
Pengendalian hayati patogen tanah pada tanaman dengan mikroorganisme antagonis merupakan teknik non kimiawi dalam mengendalikan penyakit tanaman.
T. harzianum adalah mikroba parasit yang aktif dan dapat digunakan sebagai agen hayati.
Trichoderma spp. dapat menekan berbagai cendawan patogen pada kebanyakan penyakit
digolongkan ke dalam cendawan imperfekti. Genus ini tergolong ke dalam divisi Amastigomycota, subdivisi Deuteromycotyna, kelas Deuteromycetes, subkelas Hypomycetidae, ordo Moniliales, famili Moniliaceae (Alexopuolus dan Mims 1979). Cendawan ini membentuk koloni berwarna putih dan apabila telah terbentuk spora berubah menjadi hijau kekuningan dan hijau. Trichoderma spp. umumnya hidup sebagai saprofit di tanah atau kayu. Akan tetapi banyak pula ditemukan pada permukaan akar tanaman dan pada propagul cendawan lain. Cendawan ini menghasilkan zat antibiotik, bersifat hiperparasit dan mempunyai sifat kompetisi yang tinggi terhadap patogen lain. Sifat antagonistik Trichoderma terlihat dari kemampuannya melilit dan menembus (penetrasi) hifa cendawan lawan yang lisis, serta menghasilkan enzim perusak dinding sel hifa lawan, seperti kitinase, pektinase dan silanase (Dennis & Webster 1971 dalam Minarsih et al. 2000). Gambar 1 memperlihatkan mekanisme mikoparasitisme hifa
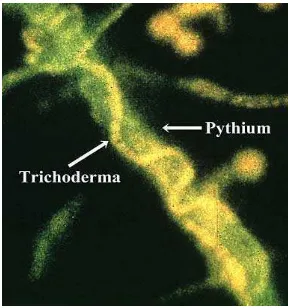
Trichoderma harzianum di sekeliling patogen Pythium sp. (Harman 1993).
Gambar 1. Mekanisme mikoparasitisme Trichoderma harzianum pada patogen tanaman Pythium sp. (Harman 1993)
dimurnikan menunjukkan aktivitas penghambatan pada perkecambahan dan perpanjangan hifa Botrytis cinerea (Lorito et al. 1993).
Enzim kitinase T. harzianum
Kitin merupakan salah satu senyawa utama penyusun dinding sel miselia cendawan. Dalam perkembangan teknologi pengendalian cendawan patogen, senyawa tersebut menjadi sasaran utama yang harus didegradasi atau dihambat sintesanya sehingga cendawan menjadi lemah atau mati (Priyatno et al. 1997). Pemanfaatan mikroba antagonistik penghasil kitinase telah terbukti efektif untuk mengendalikan beberapa cendawan patogen tanaman.
Kitinase termasuk kelompok enzim hidrolase pendegradasi kitin yang banyak dihasilkan oleh mikroorganisme baik secara intra maupun ekstraseluler. Enzim ini diperlukan oleh mikroorganisme untuk mendegradasi bahan-bahan mengandung kitin yang merupakan sumber nutrisinya. Mikroorganisme prokariot penghasil kitinase berasal dari kelompok Pseudomonas, Vibrio, Photobacterium, bakteri enteric, actinomycetes, bacilli dan clostridia. Enzim ini juga dihasilkan oleh organisme eukariot seperti myxomycetes, zygomycetes, deuteromycetes, ascomycetes dan basidiomycetes (Gooday 1990).
Berdasarkan nomenklatur yang ada, enzim kitinase dikelompokkan menjadi 3 tipe utama (Broadway et al. 1995) yaitu : a) N-acetyl-ß-D-glucosaminidase (EC 3.2.1.30) disingkat glucosaminidase yang memotong unit monomer pada ujung terminal dari kitin; b) exochitinase atau 1,4-ß-chitobiosidase disingkat chitobiosidase yang memotong unit dimmer pada ujung terminal dari kitin; c) endokitinase (EC 3.2.1.14) yang memotong secara random molekul kitin di bagian internal.
transgenik yang mengekspresikan gen penyandi kitinase dan ß-1,3-glucanase terbukti lebih tahan terhadap cendawan Botrytis cinerea, Sclerotinia sclerotiorum serta R. solani. Ekspresi gen tersebut pada varietas gandum juga dilaporkan memberikan ketahanan terhadap penyakit karat daun serta cendawan R. solani (Broglie et al. 1991).
Menurut Lorito et al. (1998), gen endokitinase T. harzianum lebih efektif dalam pengendalian penyakit dibandingkan gen kitinase tanaman. Terdapat beberapa nama yang diberikan pada gen endokitinase antara lain ech42 dan ThEn-42 yang semuanya berasal dari Trichoderma spp. (Garcia et al. 1994; Hayes et al. 1994) yang menyandi endochitinase berukuran 42-kDa. Sebenarnya gen ech-42 tersebut sebelumnya diberi nama ThEn-42 (Carsolio et al. 1994). Gen penyandi endochitinase merupakan gen dengan kopi tunggal (Garcia et al. 1994; Lora et al. 1995) dan biosintesis enzimnya terutama dikendalikan pada level transkripsi (Garcia et al. 1994; de la Cruz et al. 1995).
Mekanisme antagonis utama oleh T. harzianum terhadap fungi patogen melalui pengeluaran enzim, termasuk β-1,4 glukanase, kitinase dan proteinase (Elad et al. 1982).
T. harzianum memproduksi berbagai enzim kitinolitik termasuk N-acetyl-β
-D-glukosaminode, 1,4-β kitobiosidase dan endokitinase (Harman et al. 1993). Ekspresi kitinase pada mekanisme mikoparasit T. harzianum secara in situ dimonitor dengan mengkonstruksi suatu galur yang mengandung fusi ”green fluorescent protein” (GFP) pada sekuen 5’ regulator dari gen ech42. Hasil menunjukkan bahwa gen ech42 diekspresikan sebelum kontak dengan R. solani dan diinduksi oleh kitooligosakarida terlarut yang dihasilkan oleh aktivitas konstitutif Chit42 (Zeilinger et al. 1999). Ekspresi gen ech42 dilaporkan konsisten terjadi pada konfrontasi antara T. atroviride dan R. Solani
(Kullnig et al. 2000).
Ekspresi ech-42 meningkat sangat kuat selama interaksi langsung mikoparasit T.
harzianum dengan cendawan patogenik apabila dikonfrontir secara in vitro dan dengan
ditumbuhkan dalam media minimal yang mengandung kitin sebagai sumber karbon tunggal (Carsolio et al. 1994). Namun demikian pada studi ekspresi dua gen utama kitinase yaitu nag1 (penyandi CHIT73, N-acetyl-β-D-glucosaminidase) dan ech42
(penyandi CHIT42, endochitinase) dari Trichoderma atroviride (T. harzianum P1) menunjukkan bahwa mekanisme regulasi nag1 dan ech42 sangat berbeda. Gen nag1
kataboliknya sendiri, sedangkan ekspresi ech42 nampaknya tidak langsung diinduksi oleh kitin murni atau kitooligosakarida tetapi oleh keterbatasan karbon dan kondisi stres yang terdapat dalam media tumbuhnya (Mach et al. 1999).
Konstruksi, Transformasi dan Overekspresi Gen Kitinase
Perkembangan bioteknologi telah memungkinkan dilakukannya upaya-upaya peningkatan aktivitas biologis pada organisme melalui teknik kloning gen. Kloning gen yang dilakukan dengan teknologi DNA rekombinan yang merupakan bagian dari sejumlah percobaan untuk mentransfer informasi genetik (DNA) dari satu organisme ke organisme yang lain. Percobaan DNA rekombinan meliputi : (i) isolasi DNA yang berfungsi sebagai DNA donor, DNA terklon, DNA tersisip maupun DNA asing; (ii) pemotongan dan penyambungan secara enzimatis ke dalam DNA vektor membentuk molekul DNA rekombinan; (iii) transfer hasil konstruksi vektor-DNA sisipan ke dalam suatu sel inang; (iv) identifikasi sel-sel inang yang menangkap dan membawa konstruksi gen sisipan (Glick dan Pasternak 1994).
Vektor sebagai wahana dalam teknik transfer gen harus mempunyai karakteristik tertentu diantaranya yaitu memiliki origin of replication (ori), memiliki penanda seleksi yang biasanya merupakan gen-gen penyandi resistensi terhadap senyawa antibiotik dan tersedianya situs-situs endonuklease restriksi untuk situs kloning sisipan DNA (Brown 1990). Penanda seleksi yang dominan penting dalam pelaksanaan transformasi, dimana sistem tersebut dapat digunakan secara langsung dalam strain liar, tanpa harus terjadi mutasi pada strain liar tersebut. Sistem transformasi berdasarkan seleksi resistensi terhadap higromisin B menggunakan sekuen regulator heterologus telah banyak dilaporkan dalam cendawan fitopatogen seperti Ascomycetes seperti Fulvia fulva, R. secalis. Sekuen regulator dari Aspergillus nidulans yang digunakan dalam transformasi beberapa basidiomycetes jarang dilakukan dan penggunaan sekuen homologus terbukti lebih efisien.
Sistem transformasi melalui Agrobacterium memiliki beberapa kelebihan dibanding sistem transformasi lainnya. Dengan menggunakan satu plasmid Ti dari
Agrobacterium, maka multiple transgen dapat digabung dan ditempatkan di antara batas
dalam proses transformasi melalui A. tumefaciens ini adalah transfer T-DNA ke inti tanaman target, integrasi T-DNA tersebut kedalam genom tanaman target yang diinduksi oleh ekspresi gen-gen vir serta ekspresi gen-gen yang tertransformasi (Chang et al. 1992). Selain itu, integrasi T-DNA yang membawa transgen ke dalam genom resipien, akan mengalami sedikit pengaturan kembali secara intra dan intermolekuler, untuk memulihkan sistem transkripsi dan translasi genom tanaman resipiennya. Transformasi melalui Agrobacterium lebih menjamin kestabilan genom tanaman resipien (Sheng dan Citovsky 1996).
Peningkatan efisiensi biokontrol dari Trichoderma spp. telah berhasil dilakukan dengan membuat transformasi gen penyandi protease (Flores et al. 1997) maupun gen penyandi glukanase (Miggeli et al. 1998). Strategi peningkatan jumlah kopi gen penyandi endochitinase diharapkan dapat pula meningkatkan produksi enzim kitinasenya dan selanjutnya akan menambah aktivitas penghambatan terhadap patogen target. Produksi enzim ektraselular seperti ß-1,3 glukanase, kitinase dan proteinase merupakan mekanisme antagonistik T. harzianum terhadap cendawan patogen (Kullnig et al. 2000). Peningkatan aktivitas biokontrol Trichoderma sp. dapat dilakukan dengan mengintroduksikan gen asing ke dalam genomnya. Introduksi gen kitinase dipilih karena kitin merupakan komponen utama dinding sel dari berbagai cendawan patogen (Haran et al. 1993) sehingga mudah dirombak oleh enzim kitinase.
Pengembangan T. harzianum sebagai agen pengendali hayati yang lebih efektif telah dilakukan dengan mentransformasi gen kitinase yang berasal dari berbagai sumber. Salah satunya berasal dari Serratia marcescens, bakteri tanah yang diketahui mempunyai aktivitas kitinolitik yang kuat. Dua transforman menunjukkan aktivitas kitinase yang meningkat dan pengujian aktivitas antagonis terhadap patogen Sclerotium rolfsii
menunjukkan zona litik yang lebih luas dibanding non transforman (Haran et al. 1993). Overekspresi β-1,6-endoglukanase pada T. longibrachiatum meningkatkan kemampuannya untuk mengendalikan Pythium ultimum (Migheli et al. 1998).
database (Purwantara 2003). Gen kitinase 1.5 kb (chi) yang berasal dari T. harzianum
isolat lokal DT41 ini mempunyai homologi yang tinggi dengan gen kitinase yang berasal dari T. harzianum isolat DT38 (Lusitawati 2005). Kedua sekuen gen kitinase yang berasal dari T. harzianum DT38 dan DT41 masing-masing terdapat 3 bagian intron dengan posisi yang sedikit berbeda dan bagian eksonnya menyandikan 424 asam amino.
Gen kitinase 1.5 kb (chi) yang berasal dari T. harzianum isolat lokal DT41 diklon di antara promoter glyceraldehydes-3-phosphate dehydrogenase (gpd) dan terminator transkripsi tryptophan synthetase (trpC) dari A. nidulans pada situs EcoRV dan BamHI dalam pTrpCPT yang dikonstruksi oleh D. Gardiner, Universitas Melbourne, Australia (Purwantara 2003). Selanjutnya kaset gen dalam pTrpCPT diklon ke dalam vektor biner pPK2 (Gambar 2).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Mikroba dan Laboratorium Biologi Molekuler, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) Bogor, mulai bulan Juli 2004 sampai dengan Juli 2005.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini diperoleh dari koleksi laboratorium mikroba BPBPI Bogor, yang meliputi konstruk pPK2-Trp-Chi dalam E. coli DH5α, A.
tumefaciens AGLO, T. harzianum DT38 . Media tumbuh adalah media Luria Bertani
(LB), potato dextrose agar (PDA), potato dextrose broth (PDB). Bahan kimia lain meliputi antibiotik, bahan untuk ekstraksi DNA, kit PCR dari Invitrogen, kit High Prime DNA labelling dari Roche, bahan ektraksi protein dan pengukuran aktivitas enzim.
Peralatan yang dipakai adalah peralatan gelas untuk kultur dan transformasi bakteri dan cendawan, sentrifus, mesin PCR, spektrofotometer dan alat pendukung lainnya.
Metode Pelaksanaan
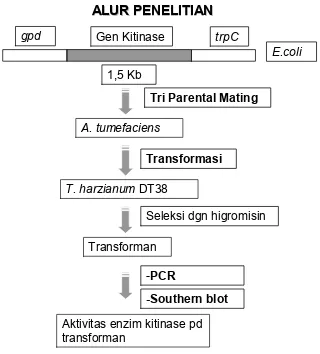
Alur Penelitian
Gambar 3. Alur kegiatan penelitian
1. Transformasi Gen Kitinase pada Trichoderma harzianum
Kultur T. harzianum
Media yang digunakan untuk kultur T. harzianum yaitu : (1) PDB (Potato Dextrose
Broth) dibuat dari 200 g kentang dan 20 g gula yang dilarutkan dalam 1 L dH2O, (2)
media PDA (Potato Dextrose Agar) dibuat dengan bahan yang sama dengan PDB dan ditambah dengan 15 g Bacto agar. Media disterilkan di dalam autoklaf selama 15 menit pada tekanan 1 atm dan suhu 1210C.
Cendawan T. harzianum dikulturkan dalam media PDB yang diinkubasi di atas
shaker dengan kecepatan 150 rpm pada suhu ruang. Setelah 5 - 7 hari, miselium dipanen
dengan penyaringan, kemudian dibilas dengan Phosphate Buffer Saline (8,00 g NaCl; A. tumefaciens
T. harzianum DT38
Transformasi
Seleksi dgn higromisin
Transforman
Aktivitas enzim kitinase pd transforman
-PCR
-Southern blot
E.coli Gen Kitinase
1,5 Kb
trpC gpd
A
A
L
L
U
U
R
R
P
P
E
E
N
N
E
E
L
L
I
I
T
T
I
I
A
A
N
N
0,20 g KCl; 1,44 g Na2HPO4.H2O; 0,24 g KH2PO4 pH 7,4 dan dilarutkan dalam 1 liter
akuades). Miselium disimpan untuk analisis selanjutnya.
Triparental Mating
Bakteri E. coli pembawa konstruk pPK2-Trp-Chi, E. coli helper PRK, dan A.
tumefaciens AGLO masing-masing ditumbuhkan pada media LB agar selama semalam.
Ketiga bakteri dikulturkan bersama pada media LB agar tanpa antibiotik dengan inokulasi saling timpa dengan jarum ose secara berurutan dimulai dari E. coli pembawa konstruk pPK2-Trp-Chi, E. coli helper PRK dan A. tumefaciens. Hasil mating diinkubasi pada 27oC selama 8 jam, kemudian kultur sebanyak 1 ose dipindahkan ke media LB agar yang mengandung rifampisin 25 µg/mL dan kanamisin 50 µg/mL atau higromisin B 50 µg/mL. Kultur diinkubasi semalam pada 270C (Chaidamsari et al. 1999). Selanjutnya koloni A.
tumefaciens hasil seleksi dikonfirmasi dengan metode PCR menggunakan pasangan
primer nptII-F : 5’ gca tac ggt tga tcc ggc tac c 3’ dan nptII-R : 5’ tga tat tcg gca agc agg cat 3’. Metode yang digunakan untuk mengamplifikasi fragmen DNA dengan teknik PCR mengikuti cara baku menggunakan kit dari Invitrogen dengan menggunakan pasangan primer nptII-F dan nptII-R. Campuran reaksi terdiri atas 1 koloni tunggal A.
tumefaciens disuspensi dalam 17,6 µl ddH2O; 1,5 µl MgCl2 25 mM; 0,5 µl dNTP 10 mM;
0,1 µl (1 unit) enzim Taq DNA polimerase; 2,5 µl buffer 10x PCR; masing-masing 1 µl primer nptII-Fdan nptII-R dengan konsentrasi 25 pmol. Volume total 25 µl.
PCR dilakukan menggunakan mesin geneAmpPCR system 2400 dengan program: pradenaturasi 94°C selama 5 menit, denaturasi pada 94°C selama 1 menit, penempelan primer (annealing) pada 55°C selama 1 menit, pemanjangan utas (extension) pada 72°C selama 1.5 menit. Setelah mencapai 35 siklus PCR diakhiri dengan post-extension pada 72°C selama 5 menit. Hasil PCR dielektroforesis pada gel agarose 1 % (b/v) + EtBr dengan buffer TBE 0,5x dan hasil elektroforesis dilihat pada UV transluminator.
Uji konsentrasi antibiotik untuk seleksi transformasi
pada kultur yang berumur 10 hari untuk menetapkan konsentrasi higromisin yang dapat menghambat atau mematikan T. harzianum tipe liar.
Transformasi T. harzianum melalui A. tumefaciens
Konstruk gen kitinase 1.5 kb (chi42) dengan promoter glyceraldehydes-3-phosphate dehydrogenase (gpd) dan terminator transkripsi tryptophan synthetase (trpC) dari Aspergillus nidulans telah diklonke dalam vector biner pPK2. Plasmid ini kemudian digunakan untuk transformasi ke dalam T. harzianum DT38 menggunakan A. tumefaciens
strain AGLO.
Kegiatan transformasi dimulai dengan menumbuhkan T. harzianum DT38 pada media PDA 2 % selama 4 - 5 hari. Spora yang telah tumbuh dengan baik tanpa kontaminasi dipanen dengan spatula steril. Spora disuspensi dengan dH2O steril dan
disentrifugasi, kemudian diresuspensi dalam dH2O sampai konsentrasi 106-107 spora/mL.
Bakteri A. tumefaciens dikulturkan 2 hari sebelum kegiatan transformasi dilakukan. Satu koloni dari stok bakteri pada media agar diambil dan dikulturkan dalam media LB + kanamisin 50 µg/mL dan diinkubasi pada suhu 28°C dalam shaker dengan kecepatan 150 rpm selama sehari semalam. Kultur yang tumbuh disentrifugasi dan pellet sel bakteri diresuspensi dengan media induksi bakteri. Kultur ini diinkubasi dalam shaker lagi selama 3 jam.
Suspensi spora dicampur dengan volume yang sama dengan kultur A.
tumefaciens. Selanjutnya sebanyak 400 uL campuran ditebar di atas kertas filter,
kemudian diletakkan pada media induksi agar. Setelah dua hari di atas kertas filter, dituangkan media PDA yang mengandung 300 µg/mL cefotaxim untuk membunuh A.
tumefaciens dan 300 µg/mL higromisin B untuk seleksi (Purwantara 2003). Transforman
2. Analisis Transforman
Isolasi DNA Genomik
Isolasi DNA genomik T. harzianum dilakukan dengan metode Orosco-Castillo (1994). Sebanyak 0,2 g miselium digerus dengan mortar dan menambahkan Polyvinylpirolidone (PVP) sebanyak 20 mg dan N2 cair. Serbuk halus dimasukkan ke
dalam tabung Eppendorf 2 mL, kemudian ditambah 750 µl buffer ekstraksi N-Cetyl-N,N,N-trimethyl-ammonium bromide (CTAB) yang telah dipanaskan dan diberi 1% merkaptoetanol. Komposisi beberapa pereaksi dapat dilihat pada Lampiran 1. Campuran dibalik beberapa kali dan diinkubasi 30 menit pada suhu 65oC dalam water bath. Setelah itu didinginkan dan ditambah 1 ml larutan khloroform : isoamil alkohol (24:1) dan dibalik beberapa kali. Campuran disentrifugasi pada kecepatan 11.000 rpm selama 10 menit kemudian diambil supernatannya dan dipindahkan ke dalam tabung baru. Perlakuan dengan kloroform+isoamilalkohol diulang sebanyak 2 kali.
Supernatan ditambah isopropanol 1 x volume dan dikocok perlahan hingga homogen kemudian disimpan dalam freezer selama 30 menit, dan disentrifugasi pada kecepatan 11.000 rpm selama 10 menit. Cairan dibuang dan pellet DNA dikeringkan kemudian dilarutkan dalam 200 µl buffer TE dan ditambahkan CH3COONa 3M, pH 5,2
sebanyak 1/10 volume serta etanol absolut dingin 2,5 volume. Campuran dikocok hingga homogen dan disimpan dalam freezer selama 30 menit. Campuran disentrifugasi pada kecepatan 12.000 rpm selama 10 menit. Supernatan dibuang dan pellet DNA dicuci dengan 200 µl etanol dingin 70% kemudian disentrifugasi pada kecepatan 5.000 rpm selama 5 menit. Supernatan dibuang dan pellet DNA dikeringkan dengan speed vacuum. DNA kering dilarutkan dalam 100 µl buffer TE/dH2O.
Pelaksanaan PCR
teknik PCR mengikuti cara baku menggunakan kit dari Invitrogen dengan menggunakan pasangan primer hphF dan hphR. Campuran reaksi terdiri atas 1 µl DNA sampel, 17,6 µl ddH2O; 1,5 µl MgCl2 25 mM; 0,5 µl dNTP 10 mM; 0,1 µl (1 unit) enzim Taq DNA
polimerase; 2,5 µl buffer 10x PCR; masing-masing 1 µl primer hphF dan hphR konsentrasi 25 pmol. Volume total 25 µl.
PCR dilakukan menggunakan mesin geneAmpPCR system 2400 dengan program: pradenaturasi 94°C selama 5 menit, denaturasi pada 94°C selama 1 menit, penempelan primer (annealing) pada 55°C selama 1 menit, pemanjangan utas (extension) pada 72°C selama 1.5 menit. Setelah mencapai 35 siklus PCR diakhiri dengan post-extension pada 72°C selama 5 menit. Hasil PCR dielektroforesis pada gel agarose 1 % (w/v) + EtBr dengan buffer TBE 0,5x dan hasil elektroforesis dilihat pada UV transluminator.
Southern blot
Pada sintesis probe digunakan fragmen gen chi dalam pTOPO sebagai template. Sebelumnya DNA pTOPO-chi dipotong menggunakan enzim EcoR1 sehingga diperoleh DNA vektor pTOPO dan DNA sisipan (gen chi). Campuran reaksi digesti adalah DNA pTOPO-chi sebanyak 100 uL, buffer H sebanyak 15 uL, BSA sebanyak 15 uL, enzim
EcoR1 sebanyak 5 uL dan ditambahkan ddH2O sampai volume total 140 uL. Campuran
ditambahkan ke dalam kolom dan disentrifugasi kembali selama 1 menit. Kolom dicuci dengan 0,75 ml Buffer PE dan disentrifugasi 1 menit. Supernatan dibuang dan kolom disentrifugasi kembali untuk menghilangkan buffer yang tersisa. Kolom ditempatkan ke dalam tabung 1,5 ml yang baru. Buffer elusi sebanyak 50 µl dimasukkan ke dalam kolom dan disentrifugasi 13.000 rpm selama 1 menit untuk mengelusi DNA yang terikat di dalamnya. Hasil elusi dicek dengan elektroforesis pada gel agarose 1 %.
Sintesis Probe
Probe disintesis menggunakan DIG High Prime DNA Labelling and Detection Starter Kit I dari Roche. Sebanyak 1 µg template DNA chi (5 µl) ditambah ddH2O steril
hingga volume menjadi 16 µL. DNA didenaturasi dengan mendidihkannya selama 10 menit dan langsung didinginkan di dalam es. DIG High Prime (vial 1) sebanyak 4 µl ditambahkan ke dalam campuran reaksi dan disentrifugasi sebentar untuk menghomogenkan. Campuran reaksi diinkubasi semalam pada 37oC. Reaksi pelabelan probe dihentikan dengan menambahkan 2 µl 0,2 M EDTA pH 8,0.
Penentuan efisiensi pelabelan
Untuk memperoleh hasil deteksi dengan probe yang telah dibuat, terlebih dahulu dilakukan penentuan konsentrasi probe yang ditambahkan. Probe dan kontrol probe sebanyak 1 µl diteteskan (di-dot blot) pada membran dengan berbagai konsentrasi. Membran difiksasi dalam oven 120oC selama 30 menit. Membran ditransfer ke dalam kontainer plastik dan direndam dengan 20 ml Buffer Maleic Acid selama 2 menit sambil digoyang. Selanjutnya berturut-turut pereaksi diganti dengan inkubasi 30 menit dalam 10 ml Blocking Solution, inkubasi 30 menit dalam 10 ml Antibody Solution dan dilakukan pencucian 2 x 15 menit dalam Washing Buffer. Membran dideteksi dalam 10 ml Detection Buffer selama 2 - 5 menit dan diwarnai dengan 2 ml Color Substrate Solution yang baru dibuat (fresh) dan diinkubasi di tempat gelap selama 15-30 menit. Reaksi pewarnaan dihentikan jika spot sudah nampak berwarna dengan mencuci membran dalam 50 ml ddH2O steril atau buffer TE. Selanjutnya membran dikeringanginkan dan dapat
Digesti DNA genomik dan blotting ke dalam membran
DNA genomik T. harzianum transforman dan non transforman didigesti dengan enzim EcoRI. Komposisi campuran reaksi digesti yaitu : sebanyak 10 µl DNA sampel, 2,0 µl enzim EcoRI, 4,0 µl Buffer digesti, 4,0 µl BSA dengan total volume 20 µl. Campuran reaksi tersebut diinkubasi dalam water bath pada suhu 37oC selama semalam. Hasil digesti diteteskan sebanyak 10 uL pada membran dan difiksasi dalam oven pada suhu 120°C selama 30 menit. Membran dapat langsung dihibridisasi ataupun disimpan terlebih dahulu.
Hibridisasi
Larutan DIG Easy Hyb dipanaskan terlebih dahulu pada temperatur hibridisasi (40oC). Pre hibridisasi membran yang telah di-dot blot dengan DNA genomik hasil pemotongan dengan enzim EcoR1, selama 30 menit dengan pengocokan konstan pada suhu 40oC. Probe DNA chi didenaturasi dalam air mendidih selama 5 menit dan langsung didinginkan di dalam es selama 2 menit. Probe DNA chi sebanyak 15 µl dimasukkan ke dalam larutan hibridisasi. Kemudian membran dihibridisasi pada suhu 40oC semalam dengan pengocokan konstan. Membran dicuci dalam 2x SSC + 0,1 % SDS pada suhu 15 – 25oC selama 2 x 5 menit sambil dikocok konstan. Selanjutnya membran dicuci dalam 0,5x SSC + 0,1 % SDS pada suhu 68oC selama 2 x 15 menit sambil dikocok konstan. Membran siap untuk dideteksi dan diwarnai seperti prosedur pada efisiensi pelabelan.
Ekstraksi enzim kitinase
Sebanyak 1 g miselium T. harzianum ditambah nitrogen cair dan digerus dengan mortar sampai halus. Selanjutnya serbuk dimasukkan ke tabung yang mengandung 1 ml buffer fosfat 50 mM pH 6,5 (1,36 g KH2PO4; 2,28 g K2HPO4) dan 1% merkaptoetanol.
Sentrifugasi dilakukan pada kecepatan 5.000 rpm selama 10 menit kemudian supernatan diambil untuk diuji protein totalnya menggunakan metode Lowry dan untuk menetapkan aktivitas kitinasenya (Siswanto 2002).
Campuran diinkubasi selama 0 dan 3 jam pada suhu 37oC, dan reaksi dihentikan dengan menambahkan 125 µl TCA 20 %. Supernatan dipisahkan dengan cara sentrifugasi pada kecepatan 10.000 rpm selama 10 menit. Sebanyak 0,3 mL supernatan ditambah 0,7 mL NaOH 0,5 M dan setelah 30 menit diukur absorbansinya pada λ 405 nm. Aktivitas kitinase ditentukan berdasarkan kurva standar pengukuran aktivitas enzim kitinase murni (Sigma) dengan kondisi pengukuran yang sama (Siswanto 2002).
Pengukuran kadar protein dengan metode Lowry menggunakan pereaksi A
(Na-2CO3 6% dalam 0,2 M NaOH), pereaksi B (1,5% CuSO4 dalam 3% sodium sitrat),
HASIL DAN PEMBAHASAN
1. Transformasi Gen Kitinase pada T. harzianum
Triparental Mating
Triparental mating telah dilakukan dengan mengkulturkan secara bersama E. coli
yang mengandung plasmid PK2trp-chi, E. coli helper PRK dan A. tumefaciens AGL0 pada media LA tanpa antibiotik. Setelah inkubasi selama 8 jam, hasil triparental mating diseleksi pada media LA yang mengandung higromisin 25 ug/mL dan rifampisin 25 ug/mL. Tahap seleksi ini menghasilkan beberapa koloni. Koloni yang tumbuh dengan baik pada media LA yang mengandung higromisin dan rifampisin masing-masing dengan konsentrasi 25 ug/ml dan suhu 28oC adalah Agrobacterium yang membawa konstruk pPK2Trp1-chi. Sedangkan Agrobacterium yang tidak tertransformasi akan mati pada media yang mengandung higromisin. E. coli tidak tumbuh pada media yang mengandung rifampisin dan suhu 28oC. Koloni yang diperoleh diperiksa kembali dengan teknik PCR untuk mengetahui kestabilan transformannya. Pelaksanaan PCR menggunakan primer spesifik penyandi resistensi kanamisin (npt II) untuk mengamplifikasi fragmen KanR yang terdapat pada bagian plasmid pPK2 yang telah dimasukkan ke dalam A. tumefaciens.
Konstruksi gen kitinase asal T. harzianum di bawah promoter glyseraldehid 3 phospat (gpd) dari Aspergillus nidulans (TrpC-chi) disisipkan pada situs KpnI dan NotI pada vektor biner pPK2. Rekombinasi ini menghasilkan plasmid yang mempunyai ukuran 13,39 kb. Secara umum promoter dari gen gliseraldehid-3-phospat (gpd) telah banyak digunakan untuk melakukan transformasi pada cendawan, baik yang termasuk ascomycetes seperti Magnaporthe grisea (Leung et al. 1990), Rhisoctonia secalis (Rohe
et al. 1996) maupun pada basidiomycetes seperti transformasi gen Mn(II) peroksidase
pada Phanerochaete chrysosporium (Mayfield et al. 1994), gen β-1,4-endoglukanase pada Trichoderma longibrachiatum (Migheli et al. 1998).
bahwa gen chi ditransformasi dengan baik pada E. coli maupun Agrobacterium yang dibuktikan dengan munculnya pita pada ke dua klon yang mengandung konstruk pPK2-Trp-Chi. Sebaliknya pada isolat yang sama tetapi tidak mengandung konstruk pPK2-Trp-Chi tidak muncul pita pada gel. Teknik yang sama juga telah berhasil dilakukan untuk transformasi gen chi yang berasal dari padi ke dalam A. tumefaciens
LBA 4404 (Chaidamsari 1998). Hal ini menunjukkan bahwa percobaan dengan menggunakan A. tumefaciens yang positif membawa konstruk gen chi pada penelitian ini dapat digunakan untuk transformasi pada T. harzianum.
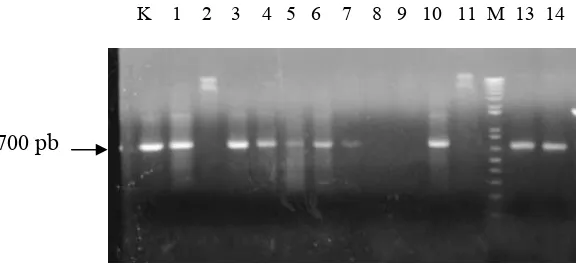
[image:34.612.126.414.246.378.2]
Gambar 4. PCR pada koloni dengan primer nptII.(K) kontrol pPK2-Trp-Chi; (1-14) koloni hasil mating A. tumefaciens; (M) marker 1 kb Ladder
Uji Konsentrasi Antibiotik untuk Seleksi Transformasi
Kegiatan pengujian dimulai dengan penyediaan media PDA tanpa antibiotik dan yang mengandung higromisin 100, 200, 300 dan 400 ppm. Pada percobaan awal T.
harzianum secara langsung dikultur pada media PDA yang mengandung antibiotik,
namun tidak satupun kultur yang mampu tumbuh pada media yang mengandung antibiotik. Hal ini kemungkinan disebabkan cendawan belum mampu beradaptasi langsung. Pada percobaan selanjutnya T. harzianum terlebih dahulu dikulturkan pada media yang tidak mengandung antibiotik selama 2 hari. Setelah tumbuh miselium, media yang mengandung antibiotik kemudian dituangkan di bagian atasnya. Hal ini akan memberi kesempatan miselium muda untuk berinteraksi dan beradaptasi dengan antibiotik yang ditambahkan.
K 1 2 3 4 5 6 7 8 9 10 11 M 13 14
Hasil uji resistensi higromisin menunjukkan bahwa T. harzianum wildtype masih mampu tumbuh dengan menembus ke bagian atas media yang mengandung 100 µg/mL namun tidak tumbuh pada konsentrasi ≥ 200 µg/mL (Tabel 1). Oleh karena itu untuk seleksi hasil transformasi T. harzianum DT38 digunakan media yang mengandung higromisin 300 µg/mL. Konsentrasi tersebut diambil dari nilai tengah antara 200 dan 400
[image:35.612.100.515.304.393.2]µg/mL dan diharapkan mencukupi untuk menyeleksi transforman. Konsentrasi antibiotik yang tepat akan mampu menyeleksi transforman dan diharapkan tidak mengganggu pertumbuhannya.
Tabel 1. Pertumbuhan Trichoderma harzianum wildtype pada media PDA yang mengandung higromisin
Konsentrasi higromisin (µg/mL) Umur
kultur
(hari) 0 100 200 300 400
2 +++ + - - - 3 +++ ++ - - - 5 +++ ++ - - -
Keterangan : - hifa tidak tumbuh, + hifa tumbuh sedikit, ++ hifa tumbuh sedang, +++ hifa tumbuh banyak
Salah satu tahapan penting sebelum melakukan transformasi adalah mengetahui efektivitas media penyeleksi yang akan digunakan. Pada penelitian ini digunakan antibiotika sebagai penyeleksi transforman. Konsentrasi higromisin sebagai antibiotik seleksi yang tepat dan efektif dapat menghambat T. harzianum wildtype atau yang tidak tertransformasi konstruk gen kitinase, tetapi tidak mematikan transforman yang dimaksud. Pengujian ini penting untuk lebih meyakinkan bahwa T. harzianum yang tumbuh pada media seleksi adalah hasil dari transformasi.
menggunakan higromisin sebagai antibotik seleksi sudah banyak digunakan, salah satu yang telah rutin dikerjakan yaitu transformasi gen kitinase yang berasal dari padi ke dalam tanaman kopi (Siswanto 2002).
Transformasi T. harzianum melalui A. tumefaciens
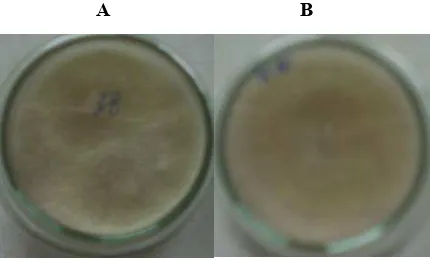
Spora T. harzianum DT38 ditransformasi dengan kultur A. tumefaciens pembawa pPK2trp-chi. Kokultivasi dilakukan selama 2 hari pada kertas saring steril yang diletakkan di atas media PDA tanpa antibiotik. Kegiatan ini dimaksudkan untuk memberi waktu spora tumbuh menjadi miselia sebelum diseleksi dengan media yang mengandung higromisin. Hasil seleksi mulai terlihat setelah 7 hari ditumbuhkan pada media seleksi (Gambar 5a), dan selanjutnya transforman disubkultur ke media baru tanpa antibiotik. Transforman yang disubkultur pada media yang mengandung higromisin masih mampu menembus/tumbuh di bagian atas media (Gambar 5b), meskipun pertumbuhannya terhambat. T. harzianum transforman pada media tanpa antibiotik terlihat tidak berbeda dengan non transforman (Gambar 6). Menurut Migheli et al (1998), kestabilan meiotik dan mitotik dari DNA terintroduksi dalam suatu modifikasi genetik pada agen biokontrol merupakan syarat dasar awal sebelum individu transforman tersebut dilepas ke lingkungannya.
Kegiatan transformasi ini dilakukan sebanyak 3 kali dengan media induksi yang mengandung asetosiringone. Asetosiringone digunakan pada media kultur bakteri dan media PDA. Asetosiringone ini memiliki kemampuan menginduksi virulensi A.
tumefaciens sehingga diharapkan transformasi berlangsung lebih baik, meskipun belum
secara pasti diketahui persamaan mekanisme transformasi yang diinduksi asetosiringone pada tanaman dan cendawan (de Groot et al. 1998). Hasil penelitian sebelumnya (Purwantara 2003) menunjukkan tidak ada perbedaan jumlah transforman pada media tanpa asetosiringone dan yang mengandung asetosiringone.
pada berbagai jenis tanaman, seperti kegiatan transformasi tembakau, kopi dan kakao yang rutin dikerjakan di laboratorium kultur jaringan BPBPI.
Kegiatan transformasi pada tanaman sering menghasilkan transforman yang abnormal, namun secara umum kegiatan transformasi pada cendawan berhasil dengan baik dengan transforman bisa hidup normal. Kegiatan transformasi pada Trichoderma telah banyak dilakukan dan tidak menyebabkan perubahan secara morfologis pada transformannya (de Groot et al. 1998, Migheli et al.1998, Purwantara 2003).
A B
Gambar 5. (A) Hasil seleksi transformasi pada media PDA + higromisin 300
µg/mL setelah 7 hari, (B) subkultur transforman pada media PDA+ higromisin 300 ug/mL berumur 2 hari
[image:37.612.180.398.241.349.2]A B
[image:37.612.180.395.433.564.2]2. Analisis Transforman
Isolasi DNA genomik
Transforman ditumbuhkan pada media PDB tanpa antibiotik. Setelah 7 hari miselium dipanen dengan pencucian menggunakan buffer fosfat. DNA diisolasi dari miselium dengan metode Orosco-Castillo (1994) dan hasilnya dielektroforesis pada gel agarose 0.8 % (data tidak ditampilkan). DNA genomik yang diperoleh diukur konsentrasinya dan juga dilakukan pemurnian ulang dari kontaminan sehingga diperoleh DNA murni dengan perbandingan rata-rata absorbansi 260/280 sekitar 1,74. Menurut Sambrook et al. (1989) angka tersebut menunjukkan DNA mempunyai kemurnian yang cukup untuk kegiatan molekuler. Selanjutnya DNA genomik tersebut digunakan sebagai template pada pelaksanaan PCR dan Southern blot untuk konfirmasi gen kitinase yang telah diintroduksikan ke dalam genom T. harzianum transforman.
Pelaksanaan PCR
Pelaksanaan PCR didahului dengan disain primer. Perancangan primer spesifik untuk gen hph yang menyandikan gen resistensi higromisin didasarkan pada sekuen gen
hph yang diperoleh dari peta plasmid pCAMBIA 1301. Karena tingkat homologi yang tinggi di antara gen penyandi kitinase pada T. harzianum yang diintroduksikan dengan gen chitinase pada T. harzianum inangnya, situs penyandi resistensi higromisin yang merupakan konstruk yang ditransformasi ke dalam T. harzianum akhirnya dipilih sebagai template untuk disain primer. Sekuen gen penyandi resistensi higromisin diambil dari sekuen gen resistensi asal bakteri yang telah banyak dipakai dalam vektor-vektor kloning komersial.
Fragmen 500 bp merupakan bagian gen penyandi resistensi higromisin dari konstruk gen pPK2-Trp-Chi yang ditransformasi ke dalam T. harzianum.
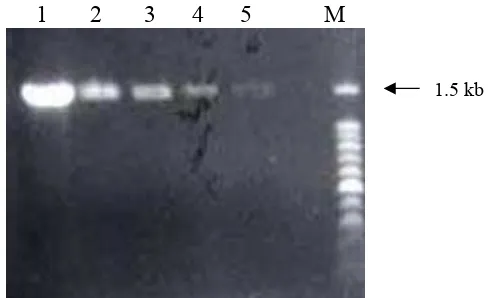
Hasil PCR ini menunjukkan bahwa beberapa koleksi transforman dapat teramplifikasi dengan cukup baik (Gambar 7). Dari 13 transforman, sebanyak 4 transforman menghasilkan amplikon positif. Transforman yang teramplifikasi dengan baik menunjukkan konstruk gen kitinase telah terintroduksi ke dalam genom T.
harzianum. Transforman yang diuji dengan hasil PCR positif selanjutnya dikultur untuk
mengetahui aktivitas kitinasenya.
[image:39.612.104.400.269.388.2]
Gambar 7. Hasil amplifikasi dengan primer hph (1) pCAMBIA 1301 (2) T. harzianum wildtype DT38, (3) pPK2trp-chi, (4) T. harzianum
wildtype DT41, (5 - 16) T. harzianum transforman
Southern Blot
Untuk memastikan kestabilan gen kitinase yang telah terintegrasi ke dalam T.
harzianum dilakukan pengujian dengan teknik Southern blot menggunakan probe
berlabel DIG. Probe disintesis dengan menggunakan template fragmen gen chi terklon pada pTOPO-Trp-Chi (5,4 kb) yang dipotong dengan enzim EcoR1, sehingga diperoleh vektor pTOPO (3,9 kb) dan fragmen gen chi sebesar ± 1,5 kb (Gambar 8). Selanjutnya fragmen hasil pemotongan diisolasi dari gel agarose dan hasilnya dicek kembali untuk melihat konsentrasi DNA terelusi yang diperoleh (Gambar 9). Fragmen gen chi dengan konsentrasi ± 1 µg digunakan untuk sintesis probe yang dilabel DIG.
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
M1 1 2
[image:40.612.105.324.72.220.2]
Gambar 8. Isolasi fragmen gen chi (M1) marker 1kb DNA ladder (1,2) hasil pemotongan fragmen gen chi dari pTOPO,
1 2 3 4 5 M
Gambar 9. (1-5) hasil elusi fragmen gen chi berbagai konsentrasi, (M) marker 100 bp DNA ladder.
Penentuan efisiensi pelabelan penting dilakukan sebelum proses hibridisasi pada sampel, hal ini dimaksudkan untuk memperoleh kondisi probe dan kondisi hibridisasi yang baik. Apabila probe yang digunakan terlalu tinggi konsentrasinya dapat menyebabkan terbentuknya background, namun bila probe terlalu rendah konsentrasinya maka signal yang diperoleh terlalu lemah. Pada percobaan ini berbagai konsentrasi probe tersintesis dibandingkan dengan probe kontrol yang telah diketahui konsentrasinya (Gambar 10). Intensitas terbentuknya warna yang cukup jelas dipilih sebagai konsentrasi probe dalam hibridisasi sampel.
Hasil percobaan menunjukkan spot ke-4 dari probe chi (T4) memiliki intensitas yang sama dengan spot ke-2 dari probe kontrol (K2), sehingga diasumsikan keduanya mempunyai konsentrasi yang sama (Gambar 10). Konsentrasi spot kontrol ke-1 (K1)
3.9 kb
1.5 kb
[image:40.612.150.394.275.424.2]diketahui sebanyak 5 ng/µl dan pada spot ke-2 (K2) telah diencerkan sebanyak 100x. Ini berarti spot ke-2 kontrol (K2) dan spot probe chi ke-4 (T4) memiliki konsentrasi sebanyak 50 pg/ul.
Berdasarkan intensitas warna yang terbentuk spot ke-3 dari probe chi (T3) terlihat membentuk intensitas yang cukup sebagai konsentrasi probe yang digunakan dalam hibridisasi. Spot ke-3 (T3) ini memiliki konsentrasi sebanyak 10 x T4 yaitu sebanyak 500 pg/ul. Probe T3 telah diencerkan sebanyak 330x dari probe T1, sehingga probe T1 mempunyai konsentrasi sebesar 165000 pg/ul = 165 ng/ul. Dalam kegiatan hibridisasi, probe telah disintesis (T1) dapat diencerkan sesuai petunjuk manufaktur yang menyebutkan bahwa untuk menghindari terbentuknya background maka maksimal probe yang digunakan dalam hibridisasi adalah 25 ng/ml larutan hibridisasi.
Setelah pengujian ini diketahui probe chi terlabel DIG telah teruji dengan baik dalam membentuk intensitas warna pada membran nilon.
K1 T1 K2 T2 T3 K3 K4 T4 T5 K5
[image:41.612.182.387.328.495.2]K6 T6
Gambar 10. Efisiensi pelabelan probe chi:(K) kontrol probe dari kit, (T) hasil sintesis probe chi
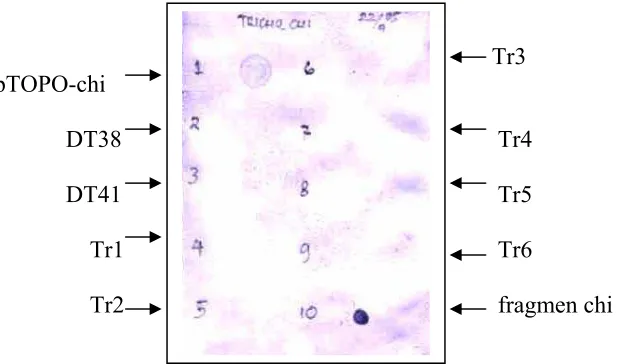
Hasil Southern bloting pada Gambar 11 menunjukkan bahwa hanya fragmen gen
tidak mampu menghibrid sampel yang tidak murni, ataupun konsentrasi probe dan waktu inkubasi hibridisasi kurang.
Banyak penelitian terdahulu yang melakukan Southern blot pada transforman cendawan (Migheli et al. 1998, Rho et al. 2001, Purwantara 2003) dengan hasil yang bagus. Probe yang digunakan terlabel dengan bahan radioaktif yang mempunyai sensitivitas tinggi. Pada penelitian ini digunakan kit DIG DNA Labelling dengan pertimbangan relatif murah dan aman. Namun hasil yang diperoleh belum bagus dan masih perlu optimasi pada setiap tahap hibridisasi secara detail.
Tr3 pTOPO-chi
DT38 Tr4 DT41 Tr5 Tr1 Tr6
[image:42.612.153.463.258.440.2]Tr2 fragmen chi
Gambar 11. Hasil Southern Blot. (1) kontrol positif pTOPO-chi, (2 ,3) T. harzianum non transforman (4 - 9) T. harzianum transforman, (10) kontrol positif fragmen gen chi
Uji Aktivitas Kitinase T. harzianum Transforman
aktivitas kitinase ekstraseluler. Miselia dicuci dengan Phosphate Buffer Saline (PBS) dan ditiriskan.
[image:43.612.109.487.274.417.2]Pada saat panen dipisahkan antara filtrat media dan miseliumnya. Filtrat media digunakan untuk pengukuran aktivitas kitinase ekstraseluler dan ekstraksi miselium digunakan untuk pengukuran aktivitas enzim kitinase intraseluler. Pemilihan substrat yang spesifik untuk kitinase asal Trichoderma telah dilakukan dan aktivitas kitinase tertinggi diperoleh pada substrat dimmer (Siswanto 2002).
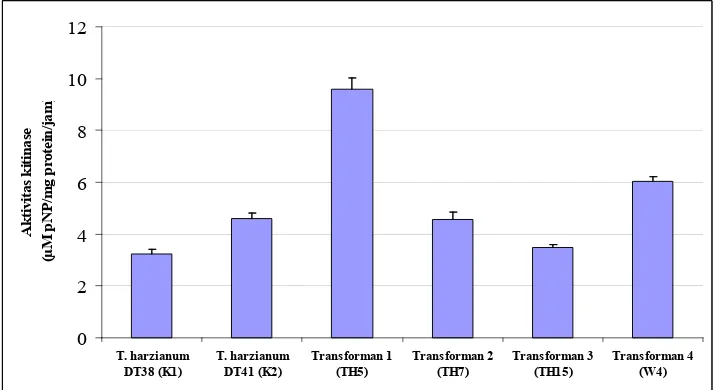
Tabel 2. Aktivitas kitinase total isolat Trichoderma harzianum
Aktivitas kitinase (µM pNP/mg protein/jam)
Aktivitas kitinase (µM pNP/mg
protein/jam) Isolat
Ekstrasel Intrasel Rata-rata SD
T. harzianum DT38 (K1) 1.81 1.41 3.22 0.18
T. harzianum DT41 (K2) 3.35 1.25 4.61 0.20
Transforman 1 (TH5) 5.80 3.81 9.61 0.42 Transforman 2 (TH7) 3.25 1.32 4.57 0.29 Transforman 3 (TH15) 2.52 0.97 3.49 0.10
Transforman 4 (W4) 5.20 0.85 6.05 0.15
0 2 4 6 8 10 12 T. harzianum DT38 (K1) T. harzianum DT41 (K2) Transforman 1 (TH5) Transforman 2 (TH7) Transforman 3 (TH15) Transforman 4 (W4) A k tiv ita s kitin a se (µ M pN P /m g p rote in/j a m )
[image:43.612.127.486.460.655.2]Pengujian untuk membandingkan aktivitas kitinase antara T. harzianum DT38 transforman dan non transforman juga dilakukan. Hasil pengukuran aktivitas kitinase menunjukkan bahwa T. harzianum transforman memiliki aktivitas yang lebih tinggi dibandingkan kontrol. Dari Tabel 2 terlihat bahwa transforman TH5 memiliki nilai aktivitas total tertinggi sebesar 9.687 uM pNP/mg protein/jam, diikuti transforman W4 sebesar 6.607 uM pNP/mg protein/jam, dan terendah pada non transforman T. harzianum
DT38 (sebagai kontrol wildtype) sebesar 3.245 uM pNP/mg protein/jam. Dua transforman putative tersebut menunjukkan peningkatan aktivitas kitinase sebesar 3 dan 2 kali dibanding non transforman.
Hasil transformasi gen chi asal Serratia marcescens pada T. harzianum
meningkatkan aktivitas kitinase transformannya sebesar 5 dan 11 kali (Haran et al. 1993). Pada transformasi T. longibranchiatum aktivitas glukanasenya meningkat sebesar 2 sampai dengan 3 kali dibanding non transforman (Migheli et al. 1998). Carsolio et al. (1999) telah mempelajari peran endochitinase T. harzianum dalam mikoparasit melalui manipulasi genetik pada gen penyandi ECH42 (ech42) dengan mengkonstruksi beberapa strain T. harzianum transgenik yang membawa multi kopi ech42 dan gen yang telah dimutasi dengan delesi. Hampir tidak ada aktivitas kitinase pada gen yang telah dirusak (mutasi), sedangkan yang transforman memperlihatkan tingkat aktivitas kitinase lebih tinggi dibanding tipe liarnya. Tingkat aktivitas endokitinase ekstraselluler T. harzianum
yang ditumbuhkan pada kondisi terinduksi akan meningkat sampai 42 kali pada strain multi kopi bila dibandingkan dengan tipe liarnya.
T. harzianum transforman yang diperoleh dalam penelitian ini memerlukan
pengujian lanjut untuk mengetahui kemampuannya menghambat patogen dibandingkan dengan T. harzianum tipe liarnya. Haran et al. (1993) mengungkapkan bahwa pengujian kontak langsung T. harzianum transforman terhadap patogen Sclerotium rolfsii secara in
vitro membentuk zona litik yang lebih luas dibanding non transforman. Migheli et al.
(1998) meneliti overekspresi gen egl1 dengan menggunakan promoter konstitutif gpdA dan promoter indusibel asli dari T. longibranchiatum. Penggunaan promoter konstitutif
kitinase pada transforman dapat mencegah perkecambahan spora patogen, dimana ekspresi kitinase konstitutif akan menghasilkan kitinase ektraseluler pada tahap-tahap awal kontak dan enzim indusibel dihasilkan setelah transforman berinteraksi dengan patogen target.
SIMPULAN DAN SARAN
Simpulan
Transformasi konstruk gen chi ke dalam T. harzianum DT38 melalui
A. tumefaciens strain AGL0 telah berhasil dilakukan dan transformannya memiliki
aktivitas kitinase 2 sampai 3 kali lebih tinggi dibandingkan non transforman. Transforman TH5 mempunyai aktivitas kitinase total paling tinggi sebesar 9.687 µM pNP/mg protein/jam dibanding non transforman T. harzianum DT38 dan T. harzianum
DT41.
Saran
Berdasarkan hasil yang diperoleh pada penelitian ini, maka dapat dikemukakan beberapa saran untuk kelanjutan penelitian ini, yaitu :
1. penelitian untuk mempelajari aktivitas dan karakteristik enzim kitinase pada T.
harzianum transforman dan tipe liarnya sebagai pembanding
DAFTAR PUSTAKA
Asmono D, Ikwan M, Suprianto E, Pamin K. 1999. Oil palm breeding in Indonesia towards 21st century : achievement and prospect. Proc. Seminar Towards Sustainable Agriculture in Humid Tropics Facing 21st Century : 125-132. Bandar Lampung Indonesia, Sept 1999.
Broadway RM, Williams DL, Kain WC, Harman GE, Lorito M & Labeda DP. 1995. Partial characterization of chitinolytic enzymes from Streptomyces albidoflavus. Letters in Appl. Microbiol. 20 : 271-276.
Broglie K, Chet I, M Holliday, R Cressman, Biddle P, S Knowlton, CJ Mauvanis, R Broglie. 1991. Transgenic plants with enhanced resistance to the fungal pathogen Rhizoctonia solani. Science 254 : 1194-1197.
Brown. 1990. Pengantar kloning gen. Soemiati A, Penerjemah. Penerbit Yayasan Essentia Medika, Yogyakarta.
Carsolio C, Gutierrez A, Jimenez B, van Montagu M, Herrera-Estrella A. 1994. Characterization of ech-42, a Trichoderma harzianum endochitinase gene expressed during mycoparasitism. Proc. Natl. Acad. Sci. USA. 91 : 10903-10907. Carsolio C, Benhamou N, Haran S, Corte’s C, Gutie’rrez A, Chet I, Herrera-Estrella.
1999. Role of the Trichoderma harzianum Endochitinase Gene, ech42, in Mycoparasitism. Appl.Environ. Microbiol. 65 (3) : 929-935.
Chaidamsari T, Suwanto A, Winata L, Santoso D. 1999. Transformasi dan ekspresi gen GUS pada beberapa jaringan kakao. J. Biotek. Pertanian 4 : 28-39.
Chaidamsari T, Santoso D. 1999. Expression of gus gene in tobacco (Nicotiana tabacum
L.) by insertion of an enhancer. Menara Perkebunan 67 (2) : 17-25.
Chang NL, Xiou QL dan Gelvin SB. 1992. Multiple copies of VirG enhance the transient transformation of celery, carrot and rice tissue by Agrobacterium tumefaciens. Plant Mol. Biol. 20 : 1071-1087.
Covert SF, Kapoor P, Lee M, Briley A, Naim CJ. 2001. Agrobacterium tumefaciens -mediated transformation of Fusarium circinatum. Mycol. Res. 105 : 259-264. Darmono TW, Siswanto, Suharyanto, Hartani ES, Sutedjo H. 1997. Analisis keragaman
de Groot MJA, Bundock P, Hooykaas PJJ, Beijersbergen AGM. 1998. Agrobacterium tumefaciens-mediated transformation of filamentous fungi. Nature-Biotechnol. 16 : 839-842.
de la Cruz J, et al. 1992. Isolation and characterization of three chitinases from
Trichoderma harzianum. Eur. J. Biochem. 206(3):859-867
de la Cruz J, Pintor-Toro JA, Benitez T, Llobell A, Romero LC. 1995. A novel endo-ß-1,3-glucanase, BGN 13.1, involved in the mycoparasitism of Trichoderma harzianum. J. Bacteriol. 177 : 6937-6945.
Departemen Pertanian, Dirjen Bina Produksi Perkebunan. 1994. Statistik Perkebunan Indonesia 1992-1994. Jakarta.
Elad Y, Chet I, Henis Y. 1982. Degradation of plant pathogenic fungi by Trichoderma harzianum. Can. J. Microbiol. 28 : 719-725.
Fekete C, Weszely T, Hornok L. 1996. Assigment of a PCR-amplified chitinase sequence cloned from Trichoderma harzianum to resolved chromosomes of potential biocontrol species of Trichoderma. FEMS Microbiol Letters145 : 385-391.
Flores A, Chet I, Herrera-Estrella A. 1997. Improved biocontrol activity of Trichoderma
harzianum by overexpression of the proteinase-encoding gene prb1. Current
Genetics31 : 30-37.
Garcia I, Lora JM, de la Cruz J, Benitez T, Llobell A, Pintor-Toro JA. 1994. Cloning and characterization of a chitinase (Chit42) cDNA from the mycoparasitic fungus
Trichoderma harzianum. Current Genetics27 : 83-89.
Glick BR , Pasternak JJ. 1994. Molecular biotechnology. Washington DC: ASM Press. Gooday GW. The ecology of chitin degradation. Adv. Microbiol. Ecol. 11 : 378-430. Haran SH, Schickler S, Pe’er S, Logemann A, Oppenheim, Chet I. 1993. Increased
constitutive chitinase activity in transformed Trichoderma harzianum. Biological Control3 : 101-108.
Harman GE, et al. 1993. Chitinolytic enzymes of Trichoderma harzianum : Purification of chitobiosidase and endochitinase. Phytophatology83 : 313-318.
Harman GE. 1993. Trichoderma spp., including T. harzianum, T. viride, T. koningii, T.
hamatum and other spp. Deuteromycetes, Moniliales (asexual classification
Hayes CK, et al. 1994. Isolation and sequence of an endochitinase-encoding gene from cDNA library of Trichoderma harzianum. Gene 138 : 143-148.
Kullnig C, March RL, Lorito M, Kubicek CP. 2000. Enzyme diffusion from Trichoderma
atroviride (T. harzianum P1) to Rhizoctonia solani is a prerequisitic for triggering of
Trichoderma ech47 gene expression before mycoparasitic contact. Appl.Environ. Microbiol. 66(5):2232-2234.
Leung H, et al. 1990. Transformation of rice blast fungus Magnaporthe grises to hygromycin B resistance. Current Genetics 17 : 409 – 411.
Lora JM, de la Cruz J, Benitez T, Pintor-Toro JA. 1995. Molecular characterization and heterologus expression of an endo-ß-1,6-glucanase gene from the mycoparasitic fungus Trichoderma harzianum. Molecular General Genetics247 : 639-645.
Lorito M, et al. 1993. Chitinolytic enzymes produced by Trichoderma harzianum : Antifungal activity of purified endochitinase and chitobiosidase. Phytopathology 83 : 302 – 307.
Lusitawati. 2005. Identifikasi dan karakterisasi gen kitinase pada Trichoderma harzianum.[Tesis]. Bogor: Institut Pertanian Bogor.
Mach RL, et al. 1999. Expression of two major chitinase genes of Trichoderma
atroviride (Trichoderma harzianum P1) is triggered by different regulatory
signals. App. and Env. Microbiology 65 : 1858-1863.
Mayfield MB, Katsuyuki K, Margaret A, MH Gold. 1994. Homologous expression of recombinant manganese peroxidase in Phanerochaete chrysosporium. Appl. Envir. Microbiology. 60 (12) : 4303-4309.
Migheli Q, Gonzales-Candelas L, Dealessi L, Camponogara A, Ramon-Vidal D. 1998. Transformants of Trichoderma longibrachiatum overexpressing the ß-1,6-endoglucanase gene egl1 show enhanced biocontrol of Pythium ultimum on cucumber. Phytopathology88 : 673-677.
Minarsih H, Santoso D dan Siswanto. 2000. Identifikasi dan kloning gen antifungal: Aktivitas enzim kitinase, pola pertumbuhan dan sintesis RNA dari Trichoderma
harzianum. Prosiding Seminar Hasil Penelitian dan Pengembangan Bioteknologi
III, Cibinong.
Priyatno TB, Sudjadi M, Chaerani S, Nugroho YE dan Sutoyo. 1997. Aktivitas kitinase mikroba antagonistik penyebab lisis miselia Phakopsora pachyrhisi Syd. Prosiding Kongres Nasional XIV dan Seminar Ilmiah Perhimpunan Fitopatologi Indonesia. Palembang.
Purwantara A. 2003. Genetic engineering of Trichoderma harzianum for improved
biological control activity. Final Report on Visiting Scientist Program at the University of Melbourne, Australia.
Rho H, Seogchan K, Yong-Hwan L. 2001. Agrobacterium tumefaciens-mediated transformation of the plant pathogenic fungus, Magnaporthe grisea. Molecules and Cells. 12 (3) : 407-411.
Rohe M, Searle J, Newton AC, Knogge W. 1996. Transformation of plant pathogenic fungus, Rhynchosporium secalis. Current Genetics 29 : 587 – 590.
Santoso D et al. 2000. Rekombinasi konstruk EPE dengan gen kitinase dan pengaruhnya terhadap bakteri pembawanya. Makalah Seminar Nasional II Perhimpunan Bioteknologi Pertanian, Yogyakarta.
Sheng, J. and Chitovsky, V. 1996. Agrobacterium–plant cell DNA transport: have virulence protein, will travel. The Plant Cell 8: 1699-1710.
Siswanto. 2002. Perakitan tanaman transgenik kopi arabika tahan terhadap penyakit karat daun. Laporan akhir Riset Unggulan Terpadu VII, Bogor.
Susanto A. 2002. Kajian pengendalian hayati Ganoderma boninense Pat. penyebab penyakit busuk pangkal batang kelapa sawit. [Disertasi]. Bogor: Institut Pertanian Bogor.
Terakawa T, N Takaya, H Horiuchi, M Koike. 1997. A fungal chitinase gene from
Rhizopus oligosporus confers antifungal activity to transgenic tobacco. Plant Cell Rep. 16 : 439-443.
Verburg JG, QK Huynh. 1991. Purification and characterization of an antifungal chitinase from Arabidopsis thaliana. Plant Physiol. 95 : 450-455.
Zeilinger S et al. 1999. Chitinase gene expression during mycoparasitic interaction of
Lampiran 1.
Komposisi beberapa pereaksi untuk isolasi DNA
Larutan Pereaksi :
1. Larutan CTAB 10 % : NaCl 4,1 gram; CTAB 10 gram, dilarutkan dengan akuades hingga 100 ml.
2. Buffer Tris-HCl 1 M pH 8.0 : Tris-base 12,11 gram; HCl p.a 4,2 ml; akuades 80 ml, atur pH larutan hingga pH 8.0, tepatkan volume hingga 100 ml.
3. Larutan EDTA 0,5 M pH 8.0 : EDTA 18,61 gram; NaOH 2 gram; akuades 80 ml, atur pH hingga pH8.0, tepatkan volume hingga 100 ml.
4. NaCl 5 M : NaCl 29,22 gram, larutkan dengan akuades hingga 100 ml. 5. Ethanol 70 %
6. Isopropanol dingin 7. Ethanol absolut dingin
8. Chloroform : Isoamilalkohol (24 : 1)
9. Natrium Asetat 3 M pH 5.2 : CH3COONa 24,609 gram; akuades 80 ml, atur pH
larutan hingga 5.2, larutkan dengan akuades hingga 100 ml. 10.Loading Buffer : Bromophenol blue 2,5 %; Sukrosa 40 % 11.Ethidium Bromida 1 % (w/v)
Buffer Ekstraksi Castillo (50 ml) : [ ] akhir
CTAB 10 % : 10 ml 2 %
EDTA 0,5 M pH 8.0 : 2 ml 20 mM
Tris-HCl 1 M pH 8.0 : 5 ml 100 mM
NaCl 5 M : 12,6 ml 1,26 M
Akuades steril : 20,4 ml Buffer TE (Tris-HCl : EDTA) :
Tris-HCl 1 M pH 8.0 : 1 ml EDTA 0,5 M pH 8.0 : 0,2 ml
Larutkan dengan akuades hingga 100 ml Buffer TBE 50X (500 ml) :
Tris-base : 27 gram Boric Acid : 13,75 gram EDTA 0,5 M pH 8.0 : 10 ml