KERAGAMAN GENETIK DAN VIRULENSI
ISOLAT
Phytophthora palmivora
ASAL KELAPA
DAN ASAL KAKAO
HIASINTA FRANSISCA JAQUELINE MOTULO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi berjudul Keragaman Genetik dan Virulensi Isolat Phytophthora palmivora Asal Kelapa dan Asal Kakao adalah hasil penelitian saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka disertasi ini.
Bogor, Januari 2008
RINGKASAN
Hiasinta F.J. MOTULO, Keragaman Genetik dan Virulensi Isolat Phytophthora palmivora Asal Kelapa dan Asal Kakao. Dibimbing oleh Meity
SURADJI SINAGA, Alex HARTANA, Gede SUASTIKA, dan Hajrial
ASWIDINNOOR.
Untuk memaksimalkan potensi lahan dan meningkatkan pendapatan petani maka dilakukan diversifikasi tanaman kelapa dengan memanfaatkan lahan di bawah kelapa dengan tanaman kakao. Ditinjau dari aspek penyakit tanaman, hal ini mengkuatirkan karena tanaman kelapa dan kakao memiliki penyakit penting yang disebabkan oleh patogen yang sama Phytophthora palmivora. Patogen tersebut patogen menyebabkan penyakit gugur buah pada tanaman kelapa dan penyakit busuk buah pada tanaman kakaoyang sangat merugikan. Berdasarkan analisis morfologi, molekuler, dan virulensi serta inokulasi silang antara kedua isolat tersebut diketahui bahwa P. palmivora asal kelapa dan P. palmivora asal kakao berbeda. Bentuk sporangium antara P. palmivora asal kelapa dan asal kakao tidak berbeda, tetapi panjang dan lebar sporangium P. palmivora berbeda. Isolat asal kelapa lebih lebar dan lebih panjang dari isolat asal kakao. Semua isolat P. palmivora hasil koleksi memiliki sporangium dengan pedikel pendek, papila, percabangan miselium simpel simpodium, dan bersifat caducous. Tipe kawin A1 telah ditemukan pada isolat P. palmivora asal kakao, sehingga dua tipe kawin A1 dan A2 telah didapatkan dari isolat P. palmivora asal kakao. Isolat P. palmivora asal kelapa juga mempunyai tipe kawin A1 dan A2. Keragaman tipe koloni isolat P. palmivora asal kelapa tidak berbeda dengan isolat asal kakao. Terdapat tiga tipe koloni pada isolat asal kelapa dan asal kakao yaitu, stelate, cottony, dan rosaceous. Diameter koloni isolat P. palmivora asal kelapa berbeda dengan isolat P. palmivora asal kakao. Diameter koloni P. palmivora asal kelapa lebih lebar dari koloni isolat asal kakao. Fragmen DNA P. palmivora baik isolat P. palmivora asal kelapa maupun isolat asal kakao berukuran 900 bp. Berdasarkan perunutan fragmen ITS-DNA isolat P. palmivora asal kelapa berbeda dengan isolat P. palmivora asal kakao. Isolat P. palmivora dari Jawa Timur dan Sulawesi Utara berbeda dengan isolat P. palmivora yang berasal dari Taiwan, Puerto Rico, Ghana, dan Costa Rica. Berdasarkan analisis RAPD dengan lima primer OPA2, OPA-11, OPA16, OPB-1, OPB-5 nampak isolat P. palmivora asal kelapa dan asal kakao sangat beragam dengan kemiripan genetik yang rendah yaitu 54% dan 56%. Jumlah pita polimorfik isolat P. palmivora asal kakao dan asal kelapa sebesar 52 dari 56 pita atau 92.8%. Umumnya isolat P. palmivora yang berasal dari kelapa lebih tinggi virulensinya pada buah kelapa dibandingkan dengan buah kakao. Hal yang sama terjadi pada isolat P. palmivora asal kakao virulensinya lebih tinggi pada buah kakao sendiri dibandingkan dengan buah kelapa. Inokulasi silang isolat P. palmivora asal kelapa bisa terjadi pada buah kakao dan sebaliknya isolat P. palmivora asal kakao pada buah kelapa.
ABSTRACT
HIASINTA FJ MOTULO. Genetic Diversity and Virulence of Phytophthora palmivora Isolates from Coconut and Cocoa. Under direction of Meity
SURADJI SINAGA, Alex HARTANA, Gede SUASTIKA, dan Hajrial
ASWIDINNOOR.
Phytophthora palmivora as the causal of coconut nutfall and cacao black pod is the potentially destructive diseases. This study was conducted to differentiate the isolates of P. palmivora from coconut and cocoa pod based on morphology and molecular characters, diversity, virulence and cross inoculation. Comparative morphological : diameter of colony, length and width of sporangium, l/w ratio , type of colony and sequence ITS-DNA tests showed that all isolates of Phytophthora isolated from coconut and cocoa in Indonesia are Phytophthora palmivora. Morphological characters of pathogen isolated from cocoa were smaller and significantly different in length, width, length/width ratio of sporangium and diameter of colony compared to isolates from coconut. Sporangia of 22 isolates were caducous with short pedicel, but were variable in shape and size. The culture produce ovoid, limoniform, obturbinate, ellipsoid dan globose sporangia, average 40-62 µm in length and 28-43 µm in width. The colony type were stelate, cottony and rossaceous with average diameter of P. palmivora coconut’s isolates 54.8 cm and P. palmivora cocoa’s isolates 43.4 cm. New mating type A1 was found on P. palmivora isolates from cocoa. There are two mating types on P. palmivora isolates from cocoa were namely A1 and A2 mating types. P. palmivora isolates from coconut and cocoa have a amphigynous antheridium. Specific fragment of 900 bp was successfully amplify from coconut P. palmivora isolates and cocoa P. palmivora isolates. The DNA sequence analysis of the nuclear ribosomal internal transcribed spacer (ITS) region showed that the coconut isolates were not in the same cluster with the cocoa isolates. Based on sequence analysis, the P. palmivora isolates from Indonesia different were cluster from those of Taiwan, Ghana, Puerto Rico and Costa Rica isolates. The polimorphic band on P. palmivora isolates from coconut and cocoa was 92.8%. Isolates of P. palmivora from coconut and cocoa in the field have a high diversity. The genetic diversity analysis of all isolates employing RAPD showed that genetic similarity on isolates P. palmivora from coconut were 54% and on isolates P. palmivora from cocoa were 56%. There was a cross inoculation between isolate P. palmivora from coconut to cocoa pod and isolate P. palmivora from cocoa to coconut. The isolates showed different virulence on coconut and cocoa pod. Generally isolates P. palmivora from coconut were more virulence toward coconut than cocoa, and isolates P. palmivora from cocoa were more virulence in cocoa pod than coconut.
©Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau
KERAGAMAN GENETIK DAN VIRULENSI
ISOLAT
Phytophthora palmivora
ASAL KELAPA
DAN ASAL KAKAO
HIASINTA FRANSISCA JAQUELINE MOTULO
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi dan Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada ujian tertutup : Dr. Ir. Suryowiyono M.Sc.
Penguji pada ujian terbuka : Dr. Ir. Giyanto M.Si
Judul Disertasi : Keragaman Genetik Dan Virulensi Isolat Phytophthora palmivora Asal Kelapa dan Asal Kakao
Nama : Hiasinta Fransisca Jaqueline Motulo
NIM : A 426014011
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. Prof. Dr. Ir. Alex Hartana Ketua Anggota
Dr. Ir. Gede Suastika, M.Sc. Dr. Ir. Hajrial Aswidinnoor, M.Sc. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Entomologi dan Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat M.Sc Prof. Dr. Ir. Khairil Anwar Notodiputro M.S
PRAKATA
Puji dan syukur kepada Allah Bapa di Surga Tuhan Yang Maha Kuasa dipersembahkan penulis atas semua berkat dan kasihNya sehingga karya ilmiah ini dapat dirampungkan. Karya ini merupakan hasil penelitian yang penulis kerjakan berdasarkan penelaahan lapangan dan laboratorium di daerah Jawa Timur dan Sulawesi Utara sejak Februari 2005 sampai Februari 2007. Subjek yang disajikan adalah keragaman P. palmivora asal kelapa dan asal kakao berdasarkan morfologi, molekuler, dan virulensinya pada lokasi tumpangsari kelapa-kakao dan monokultur kelapa atau kakao.
Penulis mengucapkan terima kasih kepada Prof. Dr. Ir. Meity Suradji-Sinaga M.Sc, Prof. Dr. Ir. Alex Hartana, Dr. Ir. Gede Suastika M.Sc, dan Dr. Ir. Hajrial Aswidinnoor selaku komisi pembimbing yang telah mengarahkan dan membantu menyelesaikan karya ilmiah ini. Di samping itu kepada Jean Marc Thevenin dan Dr. Panabiere penulis berterima kasih atas kesediaan mengirimkan artikel yang berkenaan dengan patogen P. palmivora. Demikian pula kepada Dr. Ir. Suryowiyono, penulis mengucapkan terima kasih atas kritik dan saran yang diajukan selama ujian tertutup. Kepada Dr. Ir. Dyah Manohara M.Si dan Dr. Ir. Giyanto M.Si yang juga berkontribusi dalam ujian terbuka, penulis menyampaikan terima kasih.
Selama penelitian lapangan dan laboratorium penulis dimudahkan atas kesediaan waktu membantu dari Dr. Ir. Dwinita, Ir. Firul, Tuti Legiastuti, Dadang, Ir. Jeanet Kumaunang M.Sc, Ir. Donata Pandin M.Si, Meity Kodong, Agus Palit, Anne Palit, Ir. Rizal M.Si, Ir. Rai MS, Dr. Ir. Siti Hapsa, Ir. Hasnia, dan Trasman. Bersama dengan teman-teman seprogram studi Dr. Ir. Eliza Rusli, Dr. Ir. Noor Aidawati, Dr. Ir. Lisnawita, Dr. Ir. Mohammad Taufik, Dr. Ir. Andi Khaeruni, Ir. Yunik Istikoma MS dan teman-teman seasrama di Bogor Baru II, penulis mengucapkan terima kasih. Selanjutnya kepada Ir. Joice Rimper M.Si , Ir. Josephine Saerang MS dan Ir. Ingerid Moniaga penulis mengucapkan terima kasih atas dukungan doa dan kebersamaan dalam suka dan duka.
Kelapa dan Palma Lainnya, pengurus Asosiasi Perguruan Tinggi Katolik Indonesia (APTIK), dan Pemerintah Daerah Sulawesi Utara.
Rasa hormat dan terima kasih penulis ucapkan kepada kedua orang tua, papi Ferdinand Raymond Motulo dan mami Maria Josephine Leyley atas kasih sayang, bimbingan dan doa serta perhatian untuk anak dan suamiku selama mengikuti pendidikan S3. Terima kasih juga penulis ucapkan kepada adik-adikku Meydi, Boy, Sandra, Anne, Reyfi, dan Frandy atas dukungan doa dan bantuan morilnya. Kepada mami dan papi mertua, kakak, dan adik-adik ipar penulis ucapkan terima kasih atas bantuannya.
Selama mengikuti program S3 penulis mendapat pengertian yang dalam dari suami Ir. Benedictus Brahmaputra dan anak Brigitta Louise Brahmaputra. Kepada kedua orang yang dicintai tersebut, penulis mengucapkan terima kasih yang sedalam-dalamnya atas cinta dan pengorbanan, kekuatan doa dan dorongan semangat.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang tidak dapat disebutkan satu persatu, dengan harapan semoga Tuhan Yang Maha Kuasa memberkati Bapak dan Ibu. Sebagai suatu hasil dari proses belajar, penulis menyadari karya ilmiah ini tidak lepas dari kekurangan dan keterbatasannya. Walaupun demikian penulis berharap semoga karya ini bermanfaat setidaknya dalam mendiskusikan dan mempertimbangkan kegiatan-kegiatan terpaut selanjutnya.
RIWAYAT HIDUP
Penulis lahir di Manado pada 31 Maret 1964, sebagai anak sulung dari tujuh bersaudara dari ibu Maria Josephine Leyley dan ayah Ferdinand Raymond Motulo. Setelah menyelesaikan pendidikan dasar dan menengah pada tahun 1982 di Manado, penulis menempuh pendidikan sarjana di Jurusan Agronomi, Fakultas Pertanian Universitas Sam Ratulangi Manado dan lulus tahun 1987. Pada tahun 1997, penulis diterima di Program Studi Fitopatologi pada Program Pascasarjana Institut Pertanian Bogor dan menamatkannya pada tahun 2000. Kesempatan untuk melanjutkan ke program doktor pada program studi dan perguruan tinggi yang sama diperoleh pada tahun ajaran 2002.
Penulis bekerja sebagai peneliti di Balai Penelitian Tanaman Kelapa dan Palma Lainnya di Manado sejak tahun 1988. Bidang penelitian yang menjadi tanggung jawab penulis adalah penyakit tanaman. Pendidikan dan pelatihan dalam bidang penyakit tanaman pernah dilakukan di Southeast Asian Regional Centre for Tropical Biology (SEAMEO-BIOTROP) Bogor-Indonesia pada tahun 1991 dan di Département des Culture Pérennes- Centre de Coopération Internationale en Recherche Agronomique pour le Développement (CIRAD-CP) Montpellier-Perancis pada tahun 1993.
Penulis menikah dengan Ir Benedictus Brahmaputra pada tahun 1993 dan dikaruniai seorang putri. Suami bekerja sebagai geologis pada Dinas Pertambangan Provinsi Sulawesi Utara. Anak, Brigitta Louise Brahmaputra berstatus pelajar pada SMP Rajawali di Makassar.
DAFTAR ISI
Halaman
DAFTAR TABEL ……… xiii
DAFTAR GAMBAR ……….. xvi
I. PENDAHULUAN ………..…..………. 1
Latar belakang ………..…….……… 1
Tujuan Penelitian ………..………..……….. 6
II. TINJAUAN PUSTAKA ……….……….. 7
Penyakit pada tanaman kelapa ... 7
Penyakit pada tanaman kakao ….……….……..……….. 8
Pola tanam tumpangsari kelapa–kakao .…...……… 10
Sistimatika Phytophthora spp……… .………...………. 11
Identifikasi Phytophthora .. ….…………..………. 12
Biologi P. palmivora ………….………..………. 13
Keragaman antar spesies Phytophthora ... ………...……… 15
Identifikasi P. palmivora dengan teknik molekular runutan DNA ……. 17
Struktur DNA ribosom ………..………... 18
Random Amplified Polymorphic DNA …..……….. 19
Penggunaan PCR untuk mendeteksi Phytophthora ..……….. 20
Patogenisitas P. palmivora ..………. 21
III. METODOLOGI PENELITIAN ………….……….. 23
Tempat dan waktu ………..……….. 24
Survey penyakit gugur buah kelapa dan busuk buah kakao ………. 24
Isolasi dan koleksi P. palmivora ………..………… 24
Isolasi zoospora tunggal ……….……… 26
Karakterisasi morfologi P. palmivora ………..……… 27
Identifikasi P. palmivora berdasarkan tipe kawin ………..……… 29
Identifikasi P. palmivora secara molekuler ………….………. 30
Amplifikasi sekuen ITS-DNA ………….………. 31
Perunutan ruas ITS-DNA ………. 32
Analisis filogenetik ……….……… 34
Analisis keragaman genetik berdasarkan RAPD ……….…………. 34
Amplifikasi DNA menggunakan primer acak …………..……… 34
Persiapan inokulum ……….. 35
Metode inokulasi pada buah kelapa dan kakao ……… 35
IV. HASIL PENELITIAN Survey penyakit gugur buah dan busuk buah pada kelapa dan kakao …. 39 Isolasi P. palmivora ……….. 40
Morfologi P. palmivora ………..……… 42
Sporangium……….. 42
Klamidospora ……… 46
Koloni ………... 47
Tipe kawin ……… 49
Karakter molekuler isolat P. palmivora asal kelapa dan asal kakao …… 51
Amplifikasi ruas ITS-DNA ……….. 51
Perunutan DNA ITS P. palmivora ……… 51
Keragaman genetik isolat P. palmivora berdasarkan ruas ITS-DNA … 55 Keragaman Genetik isolat P. palmivora berdasarkan RAPD ………… 56
Analisis filogenetik isolat P. palmivora asal kelapa dan asal kakao … 58 Virulensi dan patogenisitas ……….. 60
V PEMBAHASAN ………. 64
VI SIMPULAN DAN SARAN ………. 75
DAFTAR TABEL
Halaman
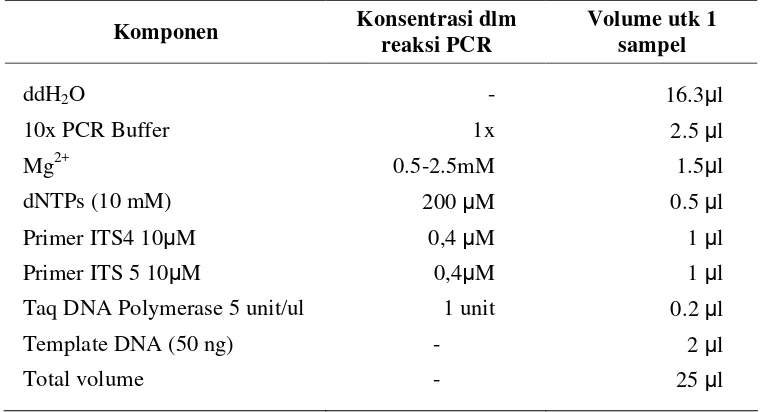
1 Campuran reaksi amplifikasi ITS-DNAdengan teknik PC……….. 31
2 Nomor asesi, inang, lokasi geografi dan kode isolat sekuen DNA- ITS P. palmivora pada GeneBank dan koleksi isolat dalam penelitian... 33
3 Jenis primer dan susunan basa yang digunakan dalam reaksi implifikasi (Invitrogen Live Technologies) ... 34
4 Kriteria penentuan tingkat virulensi isolat P. Palmivora pada penyakit gugur buah kelapa dan busuk buah kakao ... 38
5 Gugur buah kelapa dan busuk buah kakao pada beberapa lokasi
perkebunan ………... 40
6 Koleksi Isolat P. Palmivora asal kelapa dan asal kakao yang digunakan dalam penelitian ………. 41
7 Bentuk sporangium, papila, pedikel, caducous, dan percabangan sporangium P. palmivora ... 44
8 Ukuran panjang, lebar, dan rasio P/L sporangium, dan diameter koloni isolat P. palmivora asal kelapa dan asal kakao ... 45
9 Tipe kawin isolat P. palmivora asal kelapa dan asal kakao ... 50
10 Jenis primer, susunan basa, total pita dan pita polimorfik isolat P. palmivora asal kelapa dan asal kakao ………... 57
11 Rataan periode laten, keparahan Penyakit dan laju perkembangan penyakit Isolat P. palmivora asal kelapa dan asal kakao pada kelapa tahan (GSK), kelapa rentan (GKN) dan kakao ……… 61
DAFTAR GAMBAR
Halaman
1 Konidiosporangium dari Phytophthora……… 4
2 Penyakit busuk buah (black pod) pada kakao : di pohon (A) , di tanah (B)………..…….………...
9
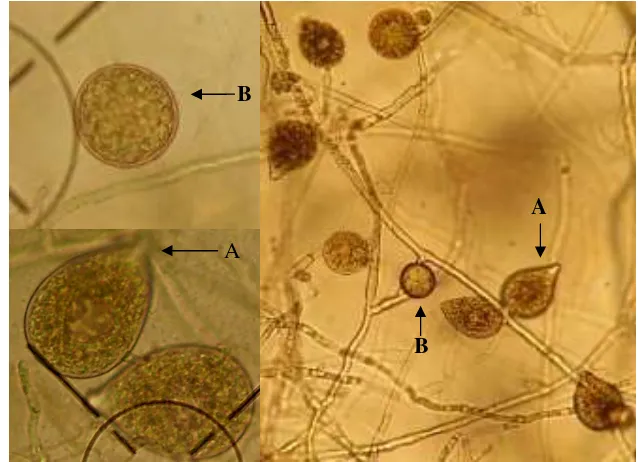
3 P. palmivora : Sporangium (A) dan klamidospora (B) .………….…… 14
4 Anteridium paragynous dari Phytium (A), anteridium amphigynous dari P. cambivora (B)………...
15
5 Siklus hidup P. palmivora ….………....…….. 16
6 Gen yang mengkode subunit ribosomal RNA... 19
7 Alur penelitian keragaman genetik dan virulensi P. palmivora asal kelapa dan asal kakao ………...
24
8 Buah kelapa yang diduga terserang penyakit gugur buah (A) dan buah kakao yang terserang penyakit busuk buah (B) ..……….
25
9 Koloni P. palmivora yang diisolasi dari jaringan sakit ………... 25
10 Metode pemancingan P. palmivora buah kelapa GKN sehat (A), wadah berisi tanah (B), buah yang terinfeksi (C) ………...
26
11 Proses produksi zoospora tunggal P. palmivora……… 27
12 Cara menentukan titik panjang dan lebar sporangium P. palmivora…. 28
13 Pengamatan tipe kawin P. palmivora... 29
14 Buah kelapa dan kakao yang diinokulasi dengan inokulum P. palmivora……….
35
15 Cara pengukuran luas bercak……… 36
16 Bentuk sporangium P. palmivora isolat asal kelapa dan asal kakao : (1) globose, (2) obturbinate, (3) ovoid, (4) ellipsoid, (5) limoniform ...
43
17 Bentuk sporangium P. palmivora dengan papila yang menonjol... 43
18 Rata-rata panjang dan lebar sporangium isolat P. palmivora populasi asal kelapa dan populasi asal kakao ...
20 Tipe Koloni P. palmivora : Rossaceous (A),.(1-5) P05KoKlwgJT, P02KoKlTgJT, P19KoPglSU, P06KoKlwgJT, P09KoKlkptJT, Cottony (B), (6-7) P44KpByASU, P46KpByASU, Stelate (C) (8-22) P35KpMrwSU,
P34KpMrwSU, P04KoTrbslJT, P61KoSLorJT, P40KoMpySU,
P22KoMrwSU, P53KpTuSU, P58KpSdkSU, P42KpHbGrto, P43KpKdGrto,
P51KpSkjtiJT, P41KpHbGrto, P52KpTuSU, P12KpMpgSU,
P13KpMpgSU………..…… 47
21 Rata-rata diameter koloni populasi isolat P. palmivora asal kelapa dan asal kakao .... ... 49
22 Oogonium globose (A), oospora (B) dan anteridium amphigynous P.
palmivora……….. 50
23 Hasil amplifikasi ruas ITS-DNA beberapa isolat P. palmivora menggunakan sepasang primer ITS 4F dan ITS 5R. Lajur 1 Penanda DNA 1 kb DNA ladder (Invitrogen), lajur 2 isolat kakao (P22KoMrwSU) , lajur 3 isolat kakao (P40KoMpySU), lajur 4 isolat kelapa (P44KpByASU) dan lajur 5 isolat kelapa (P53KpTuSU) ... 51
24 Perbandingan hasil perunutan DNA P. palmivora isolat asal kelapa (P53KpTuSU) dan dua isolat asal kakao (P22KoMrwSU, dan P40KoMpySU ) dari Indonesia dan P. palmivora dari GeneBank... 52
25 Dendrogram isolat-isolat P. palmivora asal Indonesia (P53KpTuSU, P22KoMrwSU, P40KoMpySU) terhadap isolat P. palmivora dari lokasi geografi lain yang ada di GeneBank (Ghana, Taiwan, Puerto Rico, dan Costa Rica) berdasarkan analisis urutan ITS-DNA menggunakan program
ClustalW 1.83……….…… 55 26 Pola pita isolat P. palmivora asal kelapa dan asal kakao hasil
amplifikasi menggunakan primer OPA-11. 1) Marker 1 kb (Invitrogen), 2-23) isolat P. palmivora asal kelapa dan asal kakao…………... 57
27 Dendrogram isolat P. palmivora asal kelapa berdasarkan RAPD……... 58
28 Dendrogram isolat P. palmivora asal kakao berdasarkan RAPD……… 59
29 Dendrogram isolat P. palmivora asal kelapa dan kakao………... 60
I. PENDAHULUAN
Latar Belakang
Tanaman kelapa dan kakao memiliki arti ekonomi yang sangat penting karena merupakan sumber pendapatan bagi sebagian masyarakat Indonesia. Data statistik perkebunan tahun 2006 menunjukkan bahwa sampai dengan tahun 2005 luas pertanaman kelapa di Indonesia sekitar 3.8 juta ha dengan produksi 3.096.845 ton. Dari luas pertanaman kelapa tersebut, sekitar 97% diusahakan sebagai perkebunan rakyat yang tersebar di seluruh Indonesia dengan melibatkan 7 404 284
keluarga tani (Direktorat Jenderal Perkebunan 2006a), sedangkan luas pertanaman kakao sebesar 1.167.046 ha dengan produksi kakao mencapai 748 827 ton (Direktorat Jenderal Perkebunan 2006b).
Di Sulawesi Utara, tanaman kelapa merupakan tanaman andalan dalam sektor perkebunan. Banyak petani menjadikan tanaman ini sebagai sumber pendapatan utama keluarga.
Dalam upaya meningkatkan pendapatan petani di Sulawesi Utara, maka tahun 1993 pemerintah melalui Direktorat Jenderal Perkebunan melakukan diversifikasi lahan dengan tumpangsari kakao di bawah kelapa. Hal ini dimungkinkan karena di dalam budidayanya kakao membutuhkan naungan. Disamping itu umumnya tanaman kelapa di Sulawesi Utara adalah kelapa Dalam yang telah berumur di atas 25 tahun dengan rata-rata tinggi tanaman telah mencapai 10-27 m dari permukaan tanah, sehingga dengan jarak tanam 7 m x 7 m memungkinkan ditumpangsarikan dengan kakao.
untuk pertanaman kakao dinilai sangat tepat. Kebijakan tersebut dapat mendatangkan keuntungan yang berlipat ganda karena dapat melakukan intensifikasi lahan sehingga sekaligus memperoleh tambahan keuntungan ekonomi yang lebih besar dibandingkan dengan hasil tanaman monokultur kelapa atau kakao. Namun dari sudut pandang epidemik penyakit, tumpang sari kakao di bawah tanaman kelapa mungkin akan terhambat oleh adanya penyakit penting yang disebabkan oleh patogen yang sama yang menyerang baik pada tanaman kelapa maupun tanaman kakao, yaitu Phytophthora spp.
Pada tanaman kelapa P. palmivora menyebabkan penyakit gugur buah dan busuk pucuk sedangkan pada tanaman kakao patogen yang sama menyebabkan penyakit busuk buah, kanker batang, dan bercak daun. Penyakit tersebut merupakan penyakit yang sangat merugikan bagi tanaman kelapa maupun tanaman kakao. Satu pertanyaan muncul : patogen P. palmivora menyerang terlebih dahulu tanaman kelapa atau tanaman kakao. Di Indonesia, tanaman kelapa pertama kali ditemukan oleh Marcopolo pada tahun 1292, namun adanya budidaya tanaman kelapa baru dilaporkan pada tahun 1880 di Minahasa (Sulawesi Utara) (Reyne 1948). Serangan penyakit gugur buah pada tanaman kelapa tidak pernah dilaporkan hingga masuknya kelapa Hibrida PB121 ke Indonesia. Pada tahun 1984 dilaporkan adanya epidemik penyakit busuk pucuk yang diikuti dengan gugur buah yang terjadi di lokasi demonstrasi plot kelapa Hibrida PB 121 di Desa Pandu (Sulawesi Utara). Di tahun yang sama juga dilaporkan epidemik penyakit gugur buah pada populasi Kelapa Genjah Kuning Nias (GKN) di kebun Percobaan Balitka Desa Paniki (Sulawesi Utara) (Bennett et al. 1985).
Tanaman kakao diperkenalkan oleh bangsa Spanyol pada tahun 1560 di Minahasa (Sulawesi Utara) (Pusat Penelitian Kopi dan Kakao 2004). Di Sumatera Utara, pada tahun 1940-1970 merupakan areal pertanaman kakao. Pada masa itu belum pernah ada laporan mengenai epidemik penyakit busuk buah. Penyakit busuk buah mulai dilaporkan sebagai masalah pada budidaya kakao pada tahun 1971 setelah masuknya kakao lindak (Uper Amazone Hybrid) (Parnata 1983).
terjadinya epidemik penyakit gugur buah yang disebabkan oleh P. palmivora pada tanaman kelapa populasi Genjah Kuning Nias (GKN) di Kebun Induk Paniki, Sulawesi Utara. Hall dan Warokka (1992) melaporkan P. katsurae sebagai patogen gugur buah kelapa di Pantai Gading (Cote-d’Ivoire) sedangkan Garcia dan Blaha (1992) melaporkan P. nicotianae dan P. arecae penyebab penyakit gugur buah kelapa di Indonesia. Kedua peneliti ini, membedakan isolat P. palmivora tipe lambat (slow type) berdasarkan pola pita enzim phosphoglucose isomerase (PGI). Pada tanaman kakao dilaporkan P. megakarya merupakan spesies yang paling agresif di Afrika Barat (Griffin 1977), sedangkan P. capsici merupakan spesies yang dominan di Amerika Selatan, Amerika Tengah dan Caribbean, dan P. citrophthora dominan di Brazil (Campello & Luz 1981) dan di India (Chowdappa
& ChandraMohanan 1996).
Franquevielle & Kouassi (1992) melaporkan bahwa di Pantai Gading, Afrika Barat penyakit gugur buah pada tanaman kelapa menyebabkan kehilangan hasil sebesar 30-40%. Di kebun koleksi Mapanget Sulawesi Utara, penyakit ini menyebabkan kehilangan hasil sebesar 23.6 - 25% pada populasi kelapa Genjah Kuning Nias (GKN) (Mangindaan et al. 1992). Sedangkan pada tanaman kakao di areal pertumbuhan yang beriklim basah dan lahan basah, penyakit busuk buah dapat menyebabkan kehilangan hasil sebesar 10 - 90% (Opeke & Gorenz 1974). Di Papua New Guinea, penyakit ini dapat menyebabkan kehilangan produksi kakao hingga 40% per tahun (Hicks 1975).
Keberadaan beberapa spesies Phytophthora pada kelapa dan kakao dapat menimbulkan epidemik penyakit yang sangat merugikan. Epidemik penyakit akan meluas dengan cepat karena beberapa spesies Phytophthora dapat melakukan kariogami antar spesies, sehingga dikuatirkan akan menyebabkan muculnya genotipe baru yang lebih virulen dari spesies asalnya. Fenomena terjadinya kariogami antar spesies Phytophthora di laboratorium melalui fusi zoospora dari P. capsici dan P. nicotianae telah dilaporkan oleh Silvar et al. (2006).
Pengendalian penyakit gugur buah kelapa dan busuk buah kakao semakin sulit karena patogen merupakan patogen tular tanah yang dapat disebarkan melalui angin, percikan air hujan dan dapat terbawa oleh serangga atau alat pertanian. Selain itu, kestabilan genetik Phytophthora diketahui sangat labil karena kemungkinan terjadinya variasi genetik sangat tinggi sehingga tingkat virulensi patogen sangat beragam di areal pertanaman kelapa dan kakao.
Berdasarkan hasil analisis RAPD, Motulo et al. (2004) melaporkan bahwa kemiripan genetik isolat P. palmivora asal kelapa mencapai 40.6% dengan virulensi dari avirulen hingga virulen. Sumber variasi genetik dapat terjadi melalui mutasi, rekombinasi mitotik, paraseksual, interspesifik, dan persilangan antar ras (Whissom et al. (1994), Goodwin (1997)).
Penyebaran penyakit selain didukung oleh kondisi iklim, juga ditentukan oleh karakter struktur morfologi patogen seperti miselium, sporangium, klamidospora, zoospora, dan oospora. Miselium P. palmivora yang mengandung banyak sporangium ditemukan pada permukaan kulit buah. Sporangium patogen ini dapat langsung berkecambah membentuk hifa, oleh karena itu kemudian dinamakan konidiosporangium (Gambar 1).
Gambar 1 Konidiosporangium dari Phytophthora (Hefler et al. (2002). Keterangan : tanda panah adalah kecambah sporangium
terinfeksi dan masih berada di pohon merupakan sumber inokulum yang berkesinambungan.
Patogen ini dapat membentuk struktur klamidospora yang mampu bertahan sampai puluhan tahun. Selama periode musim hujan klamidospora di dalam tanah akan berkecambah untuk menghasilkan miselium, sporangium dan melepaskan zoospora. Zoospora dapat tersebar ke udara dengan bantuan percikan air hujan, dan dapat bertahan 15 menit sampai 24 jam dalam percikan air hujan sambil disebarkan oleh angin sehingga dapat menjadi sumber inokulum untuk buah yang sehat (Anonimous 2007b).
Selain klamidospora dan sporangium P. palmivora menghasilkan spora seksual (oospora) karena mampu membentuk anteridium (gamet jantan) dan oogonium (gamet betina), sehingga fusi antara keduanya akan menghasilkan oospora. Keberadaan dua tipe kawin tersebut dalam satu area bukan saja dapat membentuk struktur bertahan tetapi juga dapat menciptakan genotipe rekombinan baru yang lebih virulen, spesifik inang atau tahan terhadap fungisida (Legard et al. 1995 ; Gisi & Cohen 1995; Goodwin et al. 1995).
Di Indonesia tipe kawin A1 dan A2 dari isolat-isolat P. palmivora pada tanaman kelapa ditemukan pada buah kelapa yang terserang gugur buah, busuk pucuk, dan sampel tanah di bawah pohon kelapa (Warokka & Thevenin 1992). Sedangkan pada tanaman kakao kedua tipe kawin A1 dan A2 ditemukan pada buah yang terserang penyakit busuk buah yang didominasi oleh tipe A2 (Zentmyer et al. 1968). Selama ini di lapangan belum pernah ditemukan oospora pada
tanaman kelapa maupun kakao, meskipun pada percobaan in vitro dengan memasangkan koloni tipe A1 dan A2 di laboratorium bisa menghasilkan oospora.
Dengan adanya karakter P. palmivora yang berpotensi membentuk keragaman genetik yang tinggi maka kekuatiran akan terjadinya epidemik gugur buah kelapa dan busuk buah kakao tentunya tidak berlebihan. Oleh karena itu, perlu dilakukan identifikasi spesies dari isolat P. palmivora asal kelapa dan asal kakao di sentra produksi. Selain itu perlu dikaji keragaman isolat, virulensi, dan inokulasi silang antar isolat pada sentra produksi kelapa dan kakao serta tumpangsarinya.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menganalisis perbedaan karakter morfologi, dan runutan ITS-DNA isolat P. palmivora asal kelapa dan asal kakao pada pola tanam monokultur
kelapa dan monokultur kakao serta tumpangsari kelapa-kakao.
2. Menganalisis keragaman DNA isolat P. palmivora asal kelapa dan asal kakao berdasarkan Random Amplified Polymorphic DNA (RAPD)
3. Menganalisis virulensi dan terjadinya inokulasi silang antar isolat P. palmivora asal kelapa ke buah kakao atau dari isolat P. palmivora asal
II. TINJAUAN PUSTAKA
Penyakit pada tanaman kelapa
Beberapa penyakit penting yang menyebabkan penurunan produksi kelapa di Indonesia adalah penyakit busuk pucuk, gugur buah, bercak daun pendarahan batang, dan berbagai penyakit layu yang disebabkan oleh fitoplasma (Bennett et al. 1985 ; Warokka et al. 2006). Penyakit busuk pucuk dan gugur buah merupakan
penyakit yang sampai saat ini masih meresahkan petani kelapa.
Di Indonesia, penyakit ini disebabkan oleh beberapa spesies Phytophthora yaitu P. palmivora, P. nicotianae, dan P. arecae (Bennett et al. 1986 ; Hall & Warokka 1992). P. palmivora, dan P. arecae dapat diisolasi dari bagian pucuk tanaman dan buah kelapa di atas pohon. Sedangkan P. nicotianae umumnya dijumpai pada isolat-isolat dari tanah atau buah yang jatuh di tanah (Hall & Warokka 1992). Di Pantai Gading (Afrika Barat) penyakit yang sama disebabkan oleh P. heveae ( Quillec et al. 1984), di Jamaica, Philipines dan Hawaii penyakit ini disebabkan oleh P. katsurae, (Steer & Coates-Beckford 1990 ; Uchida & Aragaki 1992).
Pada pertanaman kelapa di Indonesia, penyakit busuk pucuk dan gugur buah menyerang tanaman kelapa hibrida PB121 dan kelapa induk GKN. Bahkan di Sulawesi Utara saat ini penyakit telah menyerang kelapa Dalam Lokal, yang sebelumnya varietas tersebut tergolong tahan terhadap penyakit busuk pucuk. Di Pantai Gading (Afrika Barat) kedua penyakit ini menyerang kelapa West African Tall (WAT) dan kelapa Hibrida PB 121 (Malayan Yellow Dwarf X West African Tall) (Quillec & Renard (1984). Di Filipina, penyakit ini menyerang kelapa Hibrida MAWA (Malayan Yellow Dwarf X West African Tall) (Concibido 2004). Kehilangan tanaman yang mati akibat penyakit busuk pucuk pada kultivar kelapa yang rentan dapat mencapai 50% setiap tahun. Sedangkan penyakit gugur buah menyebabkan kehilangan produksi 15-30% per pohon dan dapat mencapai 75% pada musim hujan (Renard 1992). Penyakit gugur buah menyerang buah kelapa umur 3-4 bulan (Kharie et al. 1992) dan kehilangan hasil dapat mencapai 4.2-34.4% pada kultivar kelapa hibrida PB 121(Renard & Darwis 1992).
kecoklatan. Selanjutnya daun tombak akan mengering yang diikuti oleh daun-daun di bagian bawah. Apabila tanaman ditebang dan diamati bagian pucuknya akan terlihat jaringan bagian pucuk yang lembek dan berbau busuk yang sangat tajam. Pada gejala lanjut daun tombak akan mengering yang diikuti dengan layunya seluruh daun dalam waktu 10-12 bulan. Gejala serangan pada buah yang terserang penyakit gugur buah dimulai dengan terlihatnya warna coklat yang dibatasi oleh warna hijau kekuningan pada bagian epikarp. Dalam beberapa hari bercak akan meluas dan permukaan buah akan ditutupi dengan miselium yang berwarna putih. Miselium tersebut mengandung sporangium dan zoospora. Jika ada air, sporangium dapat pecah dan melepaskan zoospora yang merupakan inokulum baru yang berpotensi untuk menginfeksi buah-buah lainnya. Bercak pada buah terus berkembang sampai pada daerah basal dan apikal buah kelapa. Pada serangan yang parah tanaman membentuk lapisan absisi pada bagian pangkal buah sehingga buah lepas dari tangkainya (Thevenin et al. 1992).
Patogen dapat menyebar melalui percikan air hujan atau angin, serangga dan alat-alat pertanian. Hasil penelitian Thevenin (1992) menunjukkan bahwa percikan air hujan dari tanah sampai ketinggian 75 cm masih mengandung propagul P. palmivora. Jumlah propagul P. palmivora lebih banyak pada percikan air hujan dengan ketinggian 25 cm dibandingkan 50 cm dan 75 cm. Patogen juga dapat menyebar dengan bantuan hama tanaman kelapa Oryctes rhinocerous dan Plesispa sp. O. rhinocerous dan Plesispa sp. yang dikurung dalam cawan petri
yang mengandung miselium dan sporangium P. palmivora kemudian dipindahkan ke permukaan buah kelapa sehat maka buah tersebut akan terinfeksi dengan P. palmivora (Thevenin 1994).
Penyakit pada tanaman kakao
Gambar 2 Penyakit busuk buah (black pod) pada kakao : di pohon (A), di tanah (B) (Anonimous 2007a). Keterangan:tanda panah menunjukkan busuk buah.
Secara umum penyakit ini menyebabkan penurunan hasil sebesar 20-30% pada pertanaman kakao dunia. Di Samoa Barat, penyakit busuk buah menyebabkan kehilangan hasil sebesar 60-80% terutama pada tahun-tahun yang curah hujannya tinggi (Keane 1992), di Papua New Guinea menyebabkan kehilangan hasil sebesar 17% (Holderness 1992) dan di Mexico menyebabkan kehilangan hasil hingga 80% (Rochas 1965).
Penyakit busuk buah kakao pertama kali dilaporkan tahun 1833 di Sri Lanka. Penyakit ini sebelumnya diketahui disebabkan oleh P. omnivora (Masse 1899), kemudian diketahui disebabkan oleh Pythium palmivorum (Butler 1907). Selanjutnya patogen tersebut diganti namanya oleh Butler (1919) menjadi P. palmivora (Butler). P. palmivora mempunyai kisaran inang yang sangat luas.
Beberapa spesies Phytophthora telah diisolasi dari buah kakao yang terserang penyakit busuk buah. Spesies-spesies tersebut adalah P. megakarya di Nigeria, P. capsici di Mexico, Venezuela dan Kamerun, serta P. megasperma di Venezuela (Zentmeyer 1987). Umumnya patogen yang menyerang kakao adalah P. palmivora dan sebagian lagi P. megakarya dan P. citrophthora (Brasier dan
Griffin 1979). Selanjutnya isolat P. palmivora yang berasal dari Afrika Barat diidentifikasi mempunyai tiga bentuk morfologi yaitu : morphological form (MF)-1 adalah P. palmivora (Waterhouse 1974), MF3 P. megakarya (Griffin 1977, Brasier & Griffin 1979), dan MF-4 P. capsici (Tsao & Alizadeh 1988). Pengelompokkan menurut morphological form (MF)1, MF3, dan MF4 berdasarkan panjang pedikel (Zentmyer et al. 1977) , ukuran dan jumlah kromosom (Sansome et al. 1975) serta bentuk morfologi sporangium dan oogonium (Brasier et al. 1981).
Buah kakao merupakan bagian yang sangat rentan terhadap penyakit busuk buah terutama pada buah yang belum matang. Patogen dapat menginfeksi semua bagian permukaan buah, tetapi yang paling rentan adalah bagian pangkal buah. Jika buah sudah terinfeksi P. palmivora maka permukaan buah akan menunjukkan warna coklat kehitaman dan akan menyebar menutupi permukaan buah. Jika kelembaban sesuai maka seluruh permukaan buah akan ditutupi miselium yang berwarna putih dan mengandung sporangium.
Sumber inokulum P. palmivora dapat berasal dari akar, batang, dan alat-alat pertanian yang digunakan dalam proses panen. Pada akar dan batang yang terinfeksi dengan P. palmivora dalam keadaan tersedia air akan membentuk sporangium yang mengandung zoospora dan merupakan sumber inokulum yang potensial. Alat-alat pertanian seperti parang dan gunting stek yang digunakan pada tanaman yang terserang penyakit busuk buah dapat menyebarkan propagul P. palmivora jika digunakan pada tanaman sehat. Hujan yang disertai dengan angin
dapat juga menjadi perantara bagi penyebaran penyakit busuk buah kakao pada tanaman kakao lainnya. Penyebaran inokulum dapat mencapai ketinggian empat meter. Semut dan tikus dapat menyebarkan sporangium, miselium, dan zoospora dari P. palmivora. Hasil penelitian di laboratorium menunjukkan bahwa semut (Anoplolepsis longipes) dapat menyebarkan inokulum tetapi di lapangan tidak menunjukkan adanya peningkatan kejadian penyakit busuk buah kakao. Di Papua New Guinea golongan rayap (Technomyrmex albipes) dapat menyebarkan inokulum dan juga meningkatkan jumlah buah yang terserang penyakit busuk buah (McGregor & Moxon 1985).
Pola tanam tumpangsari kelapa-kakao
Karakteristik tanaman kelapa yang memiliki tinggi tanaman 10-27 meter ternyata berpotensi sebagai tanaman penaung pada tanaman kakao. Kajian agronomis dan ekonomis dari pemanfaatan tanaman kelapa sebagai penaung tanaman kakao ternyata dapat meningkatkan pendapatan petani dibandingkan dengan pola monokultur tanaman kelapa atau kakao.
butir/tahun atau mencapai harga sekitar Rp 5 667 900 dan bila dipanen nira dengan sistim bagi hasil 1:1, hasil gula yang menjadi bagian pekebun sekitar 13.759 kg gula/ha/tahun atau senilai Rp 28 659 997. Dengan demikian pola tanam kelapa-kakao jauh lebih menguntungkan dari pada pola monokultur kelapa-kakao (Prawoto et al. (2001). Menurut Osei-Bonsu et al. (2002) tanaman kakao yang menggunakan penaung Gliricidia sepium mengalami stres kelembaban lebih tinggi dibandingkan dengan penaung kelapa sehingga produksi buah kakao lebih rendah pada kakao berpenaung G. sepium dari pada berpenaung kelapa. Hasil panen kelapa maupun kakao lebih menguntungkan pada pola tanam tumpangsari kelapa-kakao dari pada G. sepium –kakao.
Persaingan unsur hara pada pola tanam tumpangsari kelapa-kakao tidak mempengaruhi produksi asalkan jarak tanam kelapa 9 m x 9 m dan jarak tanam kakao diantara kelapa sebesar 3 m x 3 m. Jarak tanam kelapa 9 m x 9 m dan umur tanaman lebih dari 20 tahun, akar tanaman terkonsentrasi pada radius 2 m. Sedangkan dengan jarak tanam kakao 3 m x 3 m pada umur tanaman 13, tahun akar tanaman terkonsentrasi pada radius 2,1 m. Dengan jarak tanam tersebut tidak terjadi persaingan unsur hara.
Sistematika Phytophthora spp.
cendawan mengandung kitin. Krista mitokondria Oomycetes berbentuk silinder sedangkan cendawan berbentuk datar. Selanjutnya kelas Oomycetes memiliki zoospora dengan dua flagela yaitu: tinsel dan whiplash sedangkan cendawan, jika memiliki flagela hanya terdiri dari whiplash flagella. Menurut Alexopoulos et al. (1996) sistematika P. palmivora adalah :
Kingdom : Stramenopila Filum : Heterokontophyta Class : Oomycetes Ordo : Peronosporales Famili : Pythiaceae Genus : Phytophthora Spesies : P. palmivora
Identifikasi Phytophthora
Identifikasi spesies P. palmivora adalah salah satu langkah awal yang harus dilakukan untuk mendapatkan metode pengendalian. Sampai saat ini identifikasi secara konvensional seperti pengamatan morfologi masih digunakan. Waterhouse (1963) mengidentifikasikan Phytophthora berdasarkan karakter morfologi sebagai berikut :
1. Tipe anteridium : amphygenous atau paragynous, dan pembentukkan oospora secara homotalik atau heterotalik.
2. Bentuk, ukuran, dan rasio panjang/lebar dari sporangium. Ada atau tidak ada papila pada sporangium.
3. Ada atau tidak ada sifat sporangium yang mudah lepas dari tangkai sporangium (caducity) dan panjang pedikel.
4. Proliferasi sporangium. 5. Tipe percabangan.
6. Ada atau tidak ada klamidospora. 7. Ada atau tidak ada pembengkakan hifa. 8. Suhu maksimum untuk pertumbuhan.
Identifikasi dan karakterisasi Phytophthora terutama menggunakan karakter morfologi seringkali bersifat subjektif dan sangat ditentukan oleh pengetahuan dan pengalaman seseorang, karena beberapa karakter saling tumpang tindih antar spesies. Identifikasi Phytophthora sampai pada tingkat spesies masih mungkin dilakukan melalui aspek-aspek morfologi. Tetapi kaitannya dengan perbedaan ras dan virulensi selain dilihat dengan kemampuan menginfeksi juga lebih akurat dengan menggunakan teknologi molekuler seperti penanda RFLP dan hibridisasi DNA. Pendekatan secara molekuler menyediakan metode yang akurat untuk mengidentifikasi dan mendeteksi suatu patogen, serta mendeteksi terjadinya variasi antar spesies pada tingkat perubahan satu basa (Schlik et al. 1994). Dalam kunci identifikasi Stamp et al. (1990) P. nicotianae var. parasitica berbeda secara morfologi dengan P. nicotianae var. nicotianae namun berdasarkan penanda DNA dan isozim diketahui kedua ras P. nicotianae tidak berbeda (Panabieres et al. 1989). Oleh karena itu penanda molekuler dikembangkan untuk menganalisis variasi dalam populasi ataupun mengidentifikasi isolat. Variasi molekuler di dalam spesies banyak dilaporkan oleh ahli-ahli fitopatologi (Sreenivasaprasad et al. 1992; Silvar et al. 2006).
Biologi P. palmivora
Secara umum Phytophthora spp. mempunyai ciri-ciri yang istimewa dibandingkan dengan cendawan tingkat tinggi. Seluruh kehidupan Phytophthora adalah diploid, dinding selnya terdiri atas selulosa dan β 1,3-glucan (Barnicki-Garcia & Wang 1983). Phytophthora spp. tidak menghasilkan sterol tetapi memerlukan β-hidroksi sterol untuk sporulasinya (Elliot 1983). Selain itu organisme ini tahan terhadap antibiotik seperti pimaricin. Menurut Stamps et al. (1990) P. palmivora dikelompokan ke dalam kelompok II yang telah dideskripsikan secara lebih rinci oleh Waterhouse (1970) dan Stamps (1985).
berukuran 5 µm. Panjang sporangium berkisar 40-60 µm dan lebar 25-40 µm serta ratio panjang lebar adalah 1.4-2 (Holiday 1980). Bentuk sporangium, klamidospora dan miselium P. palmivora ditampilkan dalam Gambar 3.
Satu sporangium mengandung 10-40 zoospora yang berflagela dan akan dilepaskan apabila diinkubasikan dalam air (Holliday 1980). Kemudian zoospora akan melepaskan flagela yang berubah menjadi kista dan berkecambah membentuk tabung kecambah. Zoospora merupakan salah satu inokulum penting bagi penyebaran penyakit. Selain zoospora dan sporangium Phytophthora juga membentuk klamidospora yang terletak di ujung atau di tengah miselium. Klamidospora berbentuk globose sampai ke subglobose, terletak interkalari pada miselium dengan diameter berukuran 32-42 µm (Mchau & Coffey 1994).
P. palmivora membentuk oogonium dan anteridium secara alami atau
buatan. Oogonium dibentuk secara lateral atau terminal berdinding tipis dan tidak berwarna waktu masih muda. Setelah matang oogonium akan berdinding tebal dan berwarna coklat keemasan. Anteridium juga dibentuk secara lateral atau terminal, berdinding tipis, tidak berwarna pada waktu muda tetapi akan berwarna kuning hingga coklat keemasan apabila telah matang. Pada kelas Oomycetes terdapat dua tipe anteridiun yaitu amphigynous dan paragynous . Jika posisi anteridum berada
Gambar 3 P. palmivora : Sporangium (A) dan klamidospora (B) (Koleksi foto pribadi).
B
B
A
disamping oogonium dinamakan paragynous anteridium dan jika posisi anteridium terlihat mengapit pada bagian basal oogonium disebut amphigynous anteridium (Gambar 4).
Gambar 4 Anteridium paragynous dari Phytium (A), anteridium amphigynous dari P. cambivora (B) (Hefler et al. 2002). Keterangan : tanda panah menunjukkan anteridium.
Apabila oogonium dan anteridium dari P. palmivora berpasangan maka terjadi fertilisasi antara kedua tipe kawin tersebut sehingga terbentuk oospora (Brassier & Griffin 1979). Secara in vitro oospora dibentuk pada suhu rendah (20oC) dalam keadaan gelap dan nutrisi yang sesuai. Pada keadaan alami, oospora dibentuk pada jaringan berkayu atau sisa-sisa tanaman yang terhindar dari cahaya Perkembangan siklus hidup asexual maupun sexual P. palmivora ditampilkan dalam Gambar 5.
Keragaman antar spesies Phytophthora
P. palmivora tipe A2 biasanya diisolasi dari buah kakao, sedangkan tipe A1 diisolasi dari pucuk kelapa dan batang karet. Pada kakao kedua tipe kawin A1 dan A2 ditemukan, dengan A2 merupakan isolat yang dominan. Di Afrika Barat P. megakarya tipe A1 yang menjadi predominan pada buah kakao, sedangkan tipe
A2 sejauh ini hanya ditemukan pada buah kakao di Kamerun. Dari 70 isolat P. palmivora yang dikoleksi oleh Appiah et al. (2003) dari pertanaman kakao di
seluruh dunia hanya 16 isolat tipe A1 sedangkan yang lainnya adalah tipe A2. Sebaliknya P. palmivora yang dikoleksi dari inang di luar kakao terdapat 19 tipe A1 dari 29 isolat. Oospora hampir belum pernah ditemukan di lapang, namun oospora bisa didapatkan jika tipe kawin A1 dan A2 dipasangkan secara in vitro pada media V8.
Gambar 5 Siklus hidup Phytophthora palmivora (Alexopoulos et al. 1996)
Turner (1960) mendapatkan koleksi isolat P.palmivora dunia yang mempunyai karakter morfologi yang seragam. Brasier dan Griffin (1979) juga melaporkan karakter morfologi dari isolat P. palmivora yang ada di International Collection relatif seragam.
Penelitian tentang keragaman DNA dan virulensi antar spesies maupun antar isolat sudah dilakukan pada beberapa spesies Phytophthora, misalnya P. infestans (Gotoh et al. 2005), dan P. cinnamomi (Chang et al. 1996). Analisis
variasi isolat menggunakan karakter morfologi dan bentuk koloni sudah biasa dilakukan. Menurut Appiah et al. (1999) karaker morfologi yang dapat
Perkecambahan sporangium
Percabangan sporangium
Sporangium
Perkecambahan sporangium
Zoospora Zoospora
Oospora
Pembentukan kista Pembentukan kista
Percabangan sporangium
Kariogami
Plasmogami
Oogonium
Anteridium
Meiosis
Anteridium
Oogonium
Perkecambahan Perkecambahan
Miselium Miselium
Gametangium
membedakan spesies adalah bentuk koloni. Selanjutnya Appiah membedakan spesies Phytophthora antara P megakarya yang bentuk koloninya seperti kapas (cottony), P. palmivora yang berbentuk stelate dan P capsici yang berbentuk rosette.
Analisis genetik dengan penanda RFLP dan isozim dapat memberikan pemahaman tentang struktur populasi dan evolusi yang terjadi pada beberapa spesies Phytophthora (Fry et al. 1993). Goodwin et al. 1994 mengemukakan sebelum tahun 1980 isolat-isolat dari klon tunggal tipe A1 dan US-1 didominasi oleh P. infestans. Isolat US-1 merupakan isolat hasil propagasi asexual dari strain-strain P. infestans yang masuk pada tahun 1980 dari Mexico ke Amerika Utara dan menyebar ke seluruh dunia (Goodwin 1997). Tooley et al. (1986) telah membandingkan variasi genetik berdasarkan penanda isozim dan molekuler pada isolat asexual Phytophthora spp. dari Amerika Utara dan Mexico. Teridentifikasi bahwa terdapat 15 kelompok genotipe pada populasi Phytophthora dari Mexico yang mempunyai rekombinasi genetik yang tinggi. Sebaliknya pada tipe asexual dari Amerika Utara hanya terdapat empat kelompok genotipe dan tidak terdapat rekombinasi genetik.
Identifikasi P. palmivora dengan teknik molekuler runutan DNA
Fungsi-fungsi gen sering dapat diturunkan dari sekuen nukleotidanya, misalnya dalam membandingkan sekuen sampel dengan sekuen gen yang telah diketahui fungsinya. Informasi sekuen nukleotida sangat penting dalam bidang kloning molekuler sebab dengan mengetahui sekuen DNA maka dapat ditentukan situs enzim restriksi spesifik atau dapat memprediksi open reading frame (ORF) sekuen DNA yang bersangkutan.
diinkubasi dengan DNA polimerase I, primer dan dNTP dengan melibatkan penanda radioaktif pada salah satu dNTPnya (Voot et al. 1999).
Saat ini perkembangan perunutan DNA dimudahkan dengan adanya bantuan komputer dalam menganalisis ruas basa-basa DNA secara otomatis. Metode ini merupakan satu variasi dari metode terminasi rantai dimana primer yang digunakan dalam reaksi perpanjangan rantai masing-masing dihubungkan dengan warna pendaran yang berbeda (Voot et al. 1999).
Analisis perunutan DNA hanya dilakukan pada sekuen DNA tertentu, dalam banyak analisis terutama dilakukan pada ruas ITS-DNA (Tan et al. 1996) dan ruas 5.8S rDNA (Bailey et al. 1996). Analisis ruas ITS-DNA dari RNA ribosom telah dilakukan untuk mendeterminasi keragaman di dalam spesies Phytophthora (Cook et al. 1996). Perbedaan runutan DNA telah digunakan untuk
membedakan antar spesies Phytophthora (Ristaino et al. 1998). Runutan ruas DNA ITS telah digunakan untuk mempelajari hubungan kekerabatan dari banyak spesies Phytophthora (Lee & Taylor 1992). Berbagai teknik analisis DNA telah digunakan
untuk mengetahui variasi di dalam dan antar spesies Phytophthora seperti analisis DNA mitokondria dan nukleus dengan teknik RFLP (Förster et al. 1987) dan analisis perunutan (sequencing) ribosom RNA (rRNA).
Struktur DNA ribosom
Ribosom sitoplasmik pada eukariot mengandung empat jenis rRNA. Identifikasi biasanya dilakukan berdasarkan perbedaan laju sedimentasi pada saat sentrifugasi yang diberi nilai S (Svedber value). Sekuen DNA yang menyandi rRNA banyak digunakan untuk studi hubungan taksonomi dan variasi genetik pada cendawan (Bruns et al. 1992). Kluster gen rRNA ditemukan dalam inti dan mitokondria, terdiri dari daerah yang sangat konservatif dan beragam yang meliputi gen-gen untuk pembentukkan rRNA berukuran kecil (5.8 S) dan besar (18 S) (White et al. 1990).
transcribed spacer (ITS) (Mitchel et al. 1995). Ruas yang memisahkan unit rRNA
sepanjang kromosom dinamakan ruas non-transcribed spacer (NTS). Pada unit 18S terdapat ruas pendek yang dinamakan externally transcribed spacer (ETS) dan bersama-sama dengan NTS membentuk ruas intergenic spacer (Mitchel et al. 1995). Keragaman banyak terjadi pada ruas ITS diikuti oleh ruas NTS, meskipun yang paling banyak terjadi keragaman pada ruas intergenic transcribed spacer (Henson & French 1993). Pada ruas-ruas rRNA : gen struktural, transcribed spacer dan non transcribed spacer dapat dilakukan perunutan DNA untuk membedakan taxa pada tingkat yang berbeda (Sherriff et al. 1994). Gen struktural sangat stabil sehingga dapat digunakan untuk membedakan ordo (Mitchel et al. 1995).
Gambar 6 Gen yang mengkode subunit ribosomal RNA. (Anonimous 2006). Keterangan : 18S, 5.8S, 28S adalah ukuran rRNA ; ITS4 dan ITS6 adalah
nama primer.
Random Amplified Polymorphic DNA (RAPD)
Metode RAPD merupakan suatu cara untuk menganalisis keragaman genetik melalui amplifikasi DNA genom hanya dengan menggunakan satu primer acak tunggal 6-10 basa (Foster et al. 1993). Keragaman genetik suatu organisme dapat dilihat berdasarkan polimorfisme urutan nukleotida dari pita DNA hasil amplifikasi PCR. Dalam reaksi tersebut satu jenis primer tunggal akan berikatan dengan pasangan sekuen komplemennya didua tempat yang berbeda pada dua utas
Subunit susunan Tandem RNA
Salah satu subunit 11kb
Posisi primer
Produk amplifikasi 1300 bp
yang berlawanan dari DNA genom yang sebelumnya telah didenaturasi. Jika tempat penempelan primer yang satu dengan yang lainnya berada dalam jarak yang dapat diamplifikasi dan tersedia enzim polimerase, dNTP dan larutan penyangga maka produk PCR akan diperoleh berupa pita DNA.
Pita DNA hasil amplifikasi mempunyai homologi dengan urutan nukleotida pada DNA genom dan primer oligonukleotida. Rata-rata setiap primer akan secara bersamaan mengamplifikasi beberapa lokus yang diskrit dalam DNA genom, sehingga ini merupakan cara yang efisien untuk memeriksa polimorfis dari urutan nukleotida setiap individu.
Penggunaan PCR untuk mendeteksi Phytophthora
Dewasa ini untuk mengkarakterisasi maupun mendeteksi cendawan telah dikembangkan teknik molekuler Polymerase Chain Reaction (PCR). Teknik ini merupakan metode in vitro untuk mensintesis asam nukleat atau nukleotida dengan cara satu bagian DNA dapat diperbanyak dalam waktu singkat.
Pada dasarnya amplifikasi DNA dalam mesin PCR mengikuti pola sintesis DNA di dalam sel. Di dalam sel proses sintesis DNA meliputi penguraian utas ganda DNA menjadi utas tunggal yang disebut denaturasi. Kemudian sintesis rantai DNA baru dengan menggunakan utasan tunggal sebagai model atau cetakan. Sintesis DNA dimulai dengan penempelan primer pada utas tunggal DNA cetakan, dilanjutkan dengan pemanjangan rantai DNA dan pembentukan utas ganda kembali. Sintesis DNA mempunyai arah pertumbuhan 5 – 3 , yaitu dua nukleotida digabungkan satu dengan lainnya dengan cara merangkaikan karbon gula kelima (C5) yang mengandung fosfat dari satu nukleotida kepada karbon gula ketiga (C3) yang mengandung OH dari nukleotida lain membentuk ikatan fosfodiester.
Seperti halnya sintesis DNA di dalam sel, amplifikasi DNA pada mesin PCR secara in vitro membutuhkan enzim DNA polimerase, primer, basa
kofaktor enzim serta H₂O. Reaksi PCR melibatkan pengaturan suhu pada mesin
PCR selama pengulangan siklus. Setiap siklus terdiri atas tiga tahap : 1) Denaturasi dengan pemisahan DNA untai ganda menjadi untai tunggal pada suhu 94ºC, 2) Penempelan primer (anealing) dilakukan dengan menurunkan suhu reaksi sehingga primer dapat menempel pada DNA target sesuai dengan ruas komplemennya. Suhu annealing berkisar antara 50-60 ºC. 3) Sintesis DNA pada suhu 72 ºC sehingga
memungkinkan enzim DNA polimerase bekerja lebih aktif. Selanjutnya primer secara langsung diperpanjang dengan bantuan DNA polimerase untuk mensintesis untai komplemen dari DNA target dengan adanya dNTP (Voot et al. 1999). Ketiga tahapan tersebut dilakukan dalam satu siklus, namun untuk memperoleh jumlah DNA yang banyak maka siklus PCR diulang 30-40 kali.
Penggunaan teknik PCR untuk deteksi dan analisis keragaman Phytophthora banyak dilakukan. Förster et al. (2000) telah mempelajari hubungan
filogenetik beberapa spesies Phytophthora berdasarkan analisis ruas daerah ITS rRNA dengan membandingkan kelompok morfologi V dan VI dari Waterhouse. Hibridisasi secara alami antara P. nicotianae dan P. cactorum telah dideteksi melalui PCR-RAPD oleh Willem et al. (1998).
Salah satu faktor penting yang mempengaruhi kualitas PCR ialah
konsentrasi komponen reaksi (MgCl₂, buffer, enzim, DNA cetakan, primer,
pemanjangan primer, jumlah siklus, serta keutuhan dan kemurnian DNA cetakan (Halden et al. 1996).
Patogenisitas P. palmivora
Satu spesies Phytophthora dapat menyebabkan beberapa penyakit pada tanaman yang sama maupun yang berbeda. P. infestans dapat menyebabkan penyakit hawar daun pada tanaman kentang dan tomat. Berdasarkan karakterisasi DNA mitokondria, tipe isoenzim dan kepekaan terhadap metalaksil diketahui P. infestans asal kentang berbeda dengan P. infestans asal tomat (Wangsomboodee et
al. (2002).
Pengujian patogenisitas 26 isolat P. palmivora asal durian pada tanaman durian, karet, dan lada menunjukkan dapat menyebabkan bercak coklat pada tanaman lada dan karet meskipun pada tanaman durian patogenisitasnya lebih tinggi (Pongpisutta & Sangchote (2004). Patogenisitas isolat P. palmivora asal kakao dapat menginfeksi bibit tanaman karet sehingga menyebabkan penyakit pada daun dan pucuk tanaman setelah 7-8 hari, sedangkan isolat P. palmivora asal karet tidak dapat menginfeksi tanaman kakao (Orellana 1959).
Kharie et al. (1992) melakukan pengujian patogenisitas P. palmivora, P. arecae dan P. nicotianae pada kelapa GKN. Hasil pengujian patogenisitas yang
paling tinggi adalah P. palmivora. Berdasarkan hal ini di dalam penelitian ini penulis menggunakan P. palmivora sebagai penyebab penyakit gugur buah pada kelapa dan busuk buah pada kakao, meskipun kedua patogen P. arecae dan P. nicotianae dilaporkan juga sebagai penyebab penyakit gugur buah pada kelapa dan
busuk buah pada kakao (Quillec et al. 1984).
Kellam dan Zentmyer (1981) telah mempelajari patogenisitas P. palmivora, P. citrophthora dan P. capsici pada bibit kakao. Tidak ada satupun bibit yang mati
III. METODE PENELITIAN
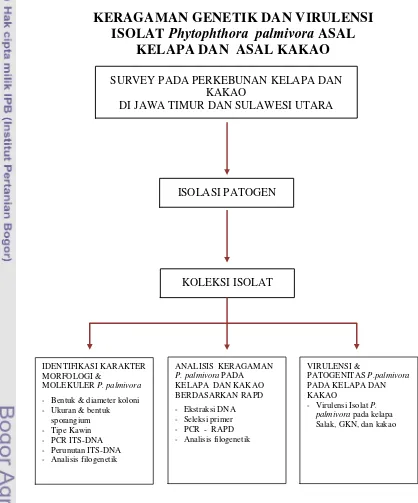
Sesuai tujuan, serangkaian kegiatan penelitian telah dilaksanakan. Kerangka pelaksanaan penelitian dalam upaya mencapai tujuan yang ditetapkan, secara ringkas diilustrasikan dalam Gambar 7.
KERAGAMAN GENETIK DAN VIRULENSI
ISOLAT
Phytophthora palmivora
ASAL
KELAPA DAN ASAL KAKAO
Tempat dan Waktu
Pengambilan sampel dilakukan di pertanaman kelapa dan kakao di Provinsi Jawa Timur dan Sulawesi Utara. Sedangkan pengujian laboratorium dilakukan di Laboratorium Mikologi dan Laboratorium Virologi, Departemen Proteksi Tanaman Fakultas Pertanian, IPB serta Laboratorium Hama dan Penyakit Balai Penelitian Tanaman Kelapa dan Palma Lainnya di Manado. Penelitian dilaksanakan mulai dari Februari 2005 sampai dengan Februari 2007
Survey penyakit gugur buah kelapa dan busuk buah kakao
Survey penyakit gugur buah kelapa dan busuk buah kakao dilakukan pada bulan Februari 2005 di Propinsi Sulawesi Utara dan bulan April 2005 di Provinsi Jawa Timur. Survey dilakukan di Perusahaan Swasta, PT Perkebunan dan perkebunan rakyat di Kabupaten Banyuwangi dan Jember (Jawa Timur), Kabupaten Minahasa dan Bolaang Mongondow (Sulawesi Utara). Pada masing-masing lokasi dipilih tiga tempat yang berbeda yaitu monokultur kelapa, monokultur kakao dan tumpangsari kelapa-kakao. Pengamatan dilakukan terhadap kejadian penyakit gugur buah kelapa dan busuk buah kakao. Kejadian penyakit dihitung dengan menggunakan rumus:
KjP = Kejadian penyakit (%)
n = Jumlah pohon yang menunjukkan gejala penyakit. N = Jumlah pohon yang diamati.
Isolasi dan koleksi P. palmivora
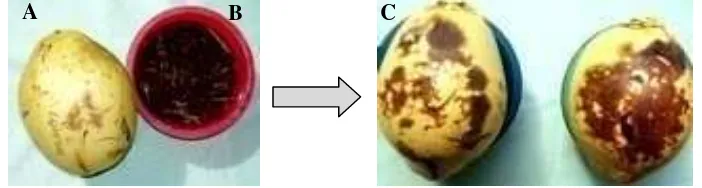
Gambar 8 Buah kelapa yang diduga terserang penyakit gugur buah (A) dan buah kakao yang terserang penyakit busuk buah (B).
Isolasi dilakukan dengan mengambil bagian buah yang menunjukkan infeksi aktif seluas 3 x 3 mm2 lalu disterilkan dengan alkohol 70% selama 30 detik. Selanjutnya potongan-potongan tersebut diinokulasi pada media selektif V8 (Agar Bacto 15 gr, V8 Juice 200 ml yang telah dimurnikan dengan CaCO3 3 gr,
dan akuades steril sampai satu liter) (Miller 1955) yang ditambah antibiotik (Pimaricin 10 ppm, Ampicilin 250 ppm, Rifampicin 10 ppm, Pentachloronitrobenzen 100 ppm) (Papavizas et al. 1981) serta hymexazol 25 ppm (Masago et al. 1977 ; Tsao & Guy 1977). Cawan yang telah berisi potongan jaringan sakit kemudian diinkubasi selama tiga hari pada suhu kamar. Isolat P. palmivora yang tumbuh diisolasi hingga didapat biakan murni. Selanjutnya isolat
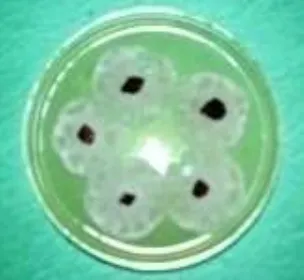
diidentifikasi. Isolat yang telah diidentifikasi akan digunakan dalam pengujian-pengujian lebih lanjut (Gambar 9).
Gambar 9 Koloni P. palmivora yang diisolasi dari jaringan sakit.
A
Pada lokasi pertanaman kelapa atau kakao yang tidak menunjukkan adanya gejala penyakit gugur buah atau busuk buah, diambil sebanyak 500 gr sampel tanah yang berada di bawah kanopi tanaman kelapa atau kakao. Isolat P. palmivora dari tanah diisolasi dengan cara menggenangi sampel tanah dengan air steril, kemudian buah kelapa sehat yang umur enam bulan diletakkan di atas tanah tersebut (Gambar 10). Spora P. palmivora akan berenang menuju ke permukaan kulit buah pada batas permukaan air. Buah yang terserang P. palmivora akan menampakkan bercak berwarna coklat. Jaringan yang sakit tersebut kemudian diisolasi dan ditumbuhkan pada media selektif V8. Isolat P. palmivora yang tumbuh kemudian diisolasi dan dipindahkan ke medium V8 baru yang tidak mengandung antibiotik dan diinkubasi pada suhu ruang selama 7 hari. Semua isolat yang telah murni dipindahkan ke media miring V8dalam tabung reaksi, dalam botol yang berisi minyak parafin (20 ml) dan botol yang berisi air steril (20 ml). Setelah itu, isolat yang ditumbuhkan pada media miring V8 disimpan pada inkubator dengan suhu ruang sedangkan isolat yang ditumbuhkan pada minyak parafin dan air steril disimpan pada inkubator suhu 18oC.
Gambar 10 Metode pemancingan P. palmivora. Buah kelapa GKN sehat (A), wadah berisi tanah (B), buah yang terinfeksi (C).
Isolasi zoospora tunggal
Isolat P. palmivora yang dikulturkan dalam media V8 berumur 6-10 hari digenangi dengan air steril sebanyak 15 ml, lalu diinkubasi selama delapan jam untuk merangsang pertumbuhan sporangium. Setelah itu, inokulum dimasukkan ke dalam lemari pendingin dengan suhu 4oC selama 30 menit, kemudian dipindahkan ke suhu kamar selama 5 menit. Perlakuan dari suhu rendah ke suhu kamar akan merangsang pecahnya sporangium sehingga zoospora akan keluar dan berenang
dalam air. Air yang mengandung zoopora diambil sebanyak 1 ml dan ditambahkan dengan 9 ml air steril. Proses pengenceran ini dilakukan sampai 10-4 (Gambar 11). Pada tingkat konsentrasi 10-4 ini diambil 0.1 ml suspensi zoospora dan disebar secara merata pada media agar 1.5% (Bacto Agar 15 gr, akuades 1000 ml). Sepuluh sampai 12 jam akan terlihat zoospora P. palmivora berkecambah membentuk hifa. Kemudian hifa diambil dengan jarum dengan bantuan mikroskop stereo, kemudian diinokulasi pada media V8. Setelah dua hari inkubasi di suhu ruang, hifa asal zoospora tunggal akan membentuk koloni. Kemudian dari koloni zoospora tunggal dipindahkan lagi ke media V8 dan diinkubasi selama 7-10 hari. Selanjutnya koloni asal zoospora tunggal siap digunakan dalam analisis karakter morfologi, molekuler, dan uji virulensi serta patogenisitas.
Gambar 11 Proses produksi zoospora tunggal P. palmivora
Karakterisasi morfologi P. palmivora
Identifikasi Phytophthora secara morfologi dilakukan berdasarkan bentuk dan ukuran sporangium, diameter koloni, tipe koloni, papila dan pedikel, caducity, tipe anteridium, tipe percabangan miselium, dan tipe kawin menurut petunjuk identifikasi Waterhouse et al. (1983) dan Stamp et al. (1990). Identifikasi spesies berdasarkan morfometri hanya dilakukan pada sporangium dan diameter koloni, sedangkan pedikel tidak diukur karena sangat pendek.
Pengukuran diameter koloni dilakukan dengan cara menentukan dua titik yang berlawanan pada permukaan koloni P. palmivora yang ditumbuhkan pada media V8 di dalam cawan petri. Kedua titik tersebut dihubungkan dengan
Koloni tunggal
10 10-1 10-2 10-3 10-4
1ml
penggaris untuk mengetahui jarak kedua titik tersebut. Pengamatan sporangium didapatkan dari kultur berumur 6-10 hari yang ditumbuhkan dalam media agar V8. Dari tiap isolat diambil lima potongan agar (diameter 5 mm) sehingga total sporangium yang diamati pada setiap isolat berjumlah 25 sampel.
Setiap potongan diamati dengan mengambil 5-7 gambar sporangium di bawah mikroskop Olympus BX 51 perbesaran 200 x (10x20) dengan menggunakan kamera digital mikroskop Olympus DP 11. Foto ditransfer ke komputer dengan menggunakan program morfometri tpsdig (Bennet & Hoffman 1998). Digitasi dilakukan pada setiap gambar sporangium dengan menentukan secara konsisten titik-titik panjang dan lebar. Pada proses ini ditentukan titik panjang mulai dari papila (1) sampai pangkal sporangium (2), titik lebar sebelah kiri (3) dan kanan (4) (Gambar 12).
Gambar 12 Cara menentukan titik panjang dan lebar sporangium P. palmivora
Setiap titik dari gambar pemotretan digitasi diubah dalam kordinat x dan y sehingga dapat diketahui jarak antar titiknya, kemudian dimasukkan dalam persamaan jarak menggunakan program Microsof Exel untuk memperoleh jarak yang sesungguhnya, yaitu :
DV(mm)= (persamaan jarak -1)
DS(mm) = DV/DP (persamaan jarak -2)
DV(mm) = Jarak Vektor
DS(mm) = Jarak sesungguhnya
DP = Jarak pembesaran mikroskop
1
2 3