KERAGAMAN DAN LAJU KINETIKA AKTIVITAS
ISOLAT NITRIFIKASI ASAL PERKEBUNAN KARET
DAN KELAPA SAWIT JAMBI
NUR ANTRIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman dan Laju Kinetika Aktivitas Isolat Nitrifikasi Asal Perkebunan Karet dan Kelapa Sawit Jambi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NUR ANTRIANA. Keragaman dan Laju Kinetika Aktivitas Isolat Nitrifikasi Asal Perkebunan Karet dan Kelapa Sawit Jambi. Dibimbing oleh IMAN RUSMANA dan NISA RACHMANIA MUBARIK.
Nitrifikasi merupakan salah satu proses penting dalam siklus nitrogen. Nitrifikasi dilakukan oleh dua kelompok bakteri yaitu bakteri pengoksidasi amonium (nitritasi) dan bakteri pengoksidasi nitrit (nitratasi). Bakteri nitritasi mengoksidasi amonium menjadi nitrit sedangkan bakteri nitratasi mengoksidasi nitrit menjadi nitrat. Perubahan penggunaan lahan hutan menjadi perkebunan kelapa sawit dan perkebunan karet akan mempengaruhi komunitas bakteri. Tujuan penelitian ini ialah untuk mengetahui keragaman bakteri nitritasi pada sampel tanah kelapa sawit dan perkebunan karet dan untuk mengukur kinetika aktivitas isolate bakteri nitrifikasi.
Penelitian ini diawali dengan pengambilan sampel tanah secara vertical pada dua strata kedalaman tanah asal perkebunan kelapa sawit dan karet yaitu kedalam 0-5 cm dan 5-10 cm. Selanjutnya tanah tersebut diisiolasi menggunakan metode pengenceran bertingkat dan dilakukan penanaman pada media nitritasi dan nitratasi menggunakan metode sebar. Isolat yang diperoleh dari hasil isolasi kemudian dihitung jumlah koloni tiap sampel tanah dan penampakan morfologi bakteri yang berbeda kemudian dimurnikan menggunakan metode kuadran. Isolat murni yang diperoleh kemudian dilakukan pengecekan morfologi koloni dan morfologi sel dilihat menggunakan pewarnaan Gram. Selanjutnya isolat tersebut diuji aktivitas oksidasi amonium untuk bakteri nitritasi dan nitrit untuk bakteri nitratasi. Isolat yang memiliki kemampuan aktivitas oksidasi tertinggi selanjutnya dilakukan aktivitas kinetika enzim, identifikasi biokimia dengan menggunakan API Kit 20NE, dan dilakukan pula identifikasi molekular 16S rRNA.
Hasil penelitian menunjukkan kelimpahan bakteri nitritasi dan nitratasi tertinggi terdapat pada sampel tanah asal perkebunan kelapa sawit. Sebanyak 74 bakteri nitritasi dan 72 nitratasi diisolasi dari tanah perkebunan karet dan kelapa sawit. Dari 74 bakteri nitritasi, satu isolat dengan kode C4.7 memiliki kemampuan
aktivitas oksidasi amonium tertinggi, sebesar 230.7 μM.hari-1
. Sedangkan dari 72 bakteri nitratasi, satu isolat C14.14 memiliki aktivitas oksidasi nitrit tertinggi,
sebesar 42.2 μM.hari-1
. Laju kinetika aktivitas nitrifikasi pada penelitian ini dihitung dengan menggunakan plot Lineweaver-Burk. Kecepatan oksidasi
maksimum (Vmax) amonium isolat C4.7 sebesar 24.3 μM.mL-1
.h-1 dengan Km
adalah 161.8 μM. The Vmax dari axidation nitrit dari isolat C14.14 adalah 5.1
μM.mL-1
.h-1 dengan Km adalah 100 μM. Hasil identifikasi biokimia menggunakan API Kit 20 NE untuk isolat C4.7 diperoleh isolat Pseudomonas fluorescens 97% sedangkan untuk isolat C14.14 diperoleh Rhizobium radiobacter 95%. Hasil identifikasi molekular 16S rRNA untuk isolat C4.7 diperoleh Acinetobacter radioresistens dengan kemiripan 99% sedangkan untuk isolat C14.14 diperoleh Frateuria sp. dengan kemiripan 98%.
SUMMARY
NUR ANTRIANA. Diversity and Kinetics Rate of Nitrification Isolate Activity from Rubber and Oil Palm Plantation in Jambi. Supervised by IMAN RUSMANA and NISA RACHMANIA MUBARIK.
Nitrification is one of the important process in the nitrogen cycle. Nitrification is done by two groups of bacteria i.e. ammonium oxidizing bacteria (AOB) that catalyze oxidation of ammonium (NH4+) to nitrite (NO2-), the process
is called nitritation and NO2- oxidizing bacteria (NOB) that catalyze oxidation of
NO2- to nitrate (NO3-), the process is called nitratation. Land use change of forest
to oil palm and rubber plantation would affect bacterial community. The aims of this study was to determine the diversity of nitrifiers in soil samples of oil palm and rubber plantation and to measure the kinetics of the nitrification rate activity of the isolates.
The study was began by taking soil samples from oil palm and rubber plantation in two strata of soil depth i.e 0-5 dan 5-10 cm. Isolation process of nitrifying bacteria was conducted by serial dilution and direct spread plate method using AOB and NOB media. Number of bacterial cells were calculated using total plate count. Each separated colony with different appearance was purified using AOB and NOB media to obtain isolate. Isolate was stained with Gram staining. Oxidation activity of pure isolate was calculated from decreasing of ammonium concentration for AOB and decreasing of nitrite concentration for NOB. Isolates with the highest ammonium and nitrite oxidation activities were examined for nitrification kinetics. Identification of the isolates was conducted based on biochemical characteristics by using API Kit 20 NE, and sequence of 16S rRNA gene.
The highest abundance of AOB and NOB was found in soil sample from oil palm plantations. A total of 74 AOB and 72 NOB was isolated from soil sample of rubber and oil palm plantations. From 74 AOB, one isolate C4.7 had the highest ammonium oxidation activity, it was up to 230.7 μM.day-1. While from 72 NOB, one isolate C14.14 had the highest nitrite oxidation, it was up to 42.2
μM.day-1
. The kinetics of Vmax and Km values were calculated using Lineweaver-Burk plots. The Vmax of ammonium oxidation of isolates C4.7 was
of 24.3 μM.mL-1
.hr-1 with the Km was 161.8 μM. The Vmax of nitrite axidation
of isolates C14.14 was of 5.1 μM.mL -1
.h-1 with the Km was 100 μM. The results of biochemical identification indicated that C4.7 isolate was Pseudomonas fluorescens 97% and C14.14 isolate was Rhizobium radiobacter 95%. However 16S rRNA molecular identification showed up C4.7 isolate was Acinetobacter radioresistens with 99% similarity and C14.14 isolate was Frateuria sp. with 98% similarity.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Mikrobiologi
KERAGAMAN DAN LAJU KINETIKA AKTIVITAS
ISOLAT NITRIFIKASI ASAL PERKEBUNAN KARET
DAN KELAPA SAWIT JAMBI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Mikrobiologi
Judul Tesis :
Keragaman dan Laju Kinetika Aktivitas Isolat Nitrifikasi Asal Perkebunan Karet dan Kelapa Sawit Jambi
Nama : Nur Antriana NIM : G351120181
Disetujui oleh Komisi Pembimbing
Dr Ir Iman Rusmana, MSi Ketua
Dr Nisa Rachmania M, MSi Anggota
Diketahui oleh
Ketua Program Studi
Prof Dr Anja Meryandini,MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 hingga Juli 2014 ini ialah bakteri nitrifikasi, dengan judul Keragaman dan Laju Kinetika Aktivitas Isolat Nitrifikasi Asal Perkebunan Karet dan Kelapa Sawit Jambi
Terima kasih penulis ucapkan kepada Bapak Dr Ir Iman Rusmana, MSi dan Ibu Dr Nisa Rachmania Mubarik, MSi selaku pembimbing, serta Bapak Dr Tri Widiyanto, MSi selaku penguji yang telah banyak memberi saran. Ungkapan terima kasih juga penulis sampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Terima kasih juga penulis ucapkan kepada rekan rekan Mikrobiologi 2011 dan 2012, rekan-rekan Lab Mikrobiologi, IR CREW atas dukungan, saran dan bantuan sehingga saya dapat menyelesaikan karya ilmiah ini.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
Kinetika Aktivitas Oksidasi Amonium dan Nitrit Analisis Kadar Amonium
Analisis Kadar Nitrit
Identifikasi Biokimia dengan Metode Analytical Profile Index API Kit 20NE Isolasi DNA Bakteri Nitrifikasi
Amplifikasi dan Purifikasi DNA Genom Bakteri Nitrifikasi Analisis Sekuen DNA Genom Bakteri Nitrifikasi
DAFTAR TABEL
Kelimpahan rata-rata bakteri nitritasi pada tanah asal lahan perkebunan kelapa sawit dan karet
Kelimpahan rata-rata bakteri nitratasi pada tanah asal lahan perkebunan kelapa sawit dan karet
Hasil isolasi bakteri nitritasi dan nitratasi pada tanah asal lahan perkebunan kelapa sawit dan karet
Penurunan konsentrasi amonium pada bakteri nitritasi dan penurunan konsentrasi nitrit pada bakteri nitratasi pada lahan perkebunan kelapa sawit dan karet
Lima isolat bakteri nitritasi asal lahan perkebunan kelapa sawit dan karet dengan aktivitas penurunan konsentrasi amonium tertinggi Lima isolat bakteri nitratasi asal lahan perkebunan kelapa sawit dan karet dengan aktivitas penurunan konsentrasi nitrit tertinggi
Karakteristik morfologi koloni bakteri nitritasi dan nitratasi Kesamaan sekuen isolat C4.7 dan C14.14 dengan spesies pembanding pada gen bank database NCBI BLAST-N
11
Oksidasi amonia dan aliran elektron pada bakteri pengoksidasi amonia
Oksidasi nitrit menjadi nitrat oleh bakteri nitratasi dengan menggunakan nitrit oksidoreduktase (NOR)
Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzim Grafik pemetaan kebalikan ganda Michaelis-Menten (Lineweaver-Burk plot)
Hasil pewarnaan Gram isolat C4.7 dan C14.14 dengan perbesaran 1000 X
Hubungan antara konsentrasi substrat yang berbeda dengan laju penurunan konsentrasi amonium pada isolat C4.7 dan laju penurunan konsentrasi nitrit pada isolat C14.14 setelah 12 jam inkubasi
Hasil amplifikasi gen 16S rRNA dengan primer 63f/1387f pada gel agarosa 1%
Pohon filogeni dari sekuen isolat C4.7 dan C14.14
DAFTAR LAMPIRAN
1 2 3 4 5 6 7
Isolat C4.7 dan komposisi media nitritasi Isolat C14.14 dan komposisi media nitratasi
Hasil penurunan senyawa amonium pada bakteri nitritasi setelah inkubasi selama dua hari
Hasil penurunan senyawa nitrit pada bakteri nitratasi setelah inkubasi selama dua hari
Kurva standar aktivitas penurunan konsentrasi amonium dan nitrit Hasil uji identifikasi biokimia API Kit 20NE
Runutan basa dan hasil BLAST-N
PENDAHULUAN
Latar Belakang
Luas hutan Indonesia menempati peringkat ketiga (sesudah Brazil dan Zaire) (Sunderlin dan Resosudarmo 1997), namun luas hutan Indonesia tersebut terus menurun sejalan dengan waktu. Sejak 1996, deforestasi yang terjadi di Indonesia menempati urutan tertinggi di dunia, luas hutan yang rusak diperkirakan mencapai 2 juta ha per tahun. Seperti halnya daerah-daerah lain di Indonesia, Jambi juga memiliki hutan yang sangat luas, hutan Jambi mencapai 2.1 juta hektar (Dephut 2011). Hanya saja luasan tersebut termasuk kawasan hutan yang sudah dikonversi menjadi lahan perkebunan. Artinya fungsi hutan sebenarnya sudah berubah karena sudah ada izin pengolahan lahannya. Dewasa ini, perkebunan di Provinsi Jambi meningkat sangat signifikan ke arah pembukaan lahan perkebunan kelapa sawit dan karet sehingga banyak sekali membuka areal hutan (Ajidirman 2006).
Perkebunan kelapa sawit di Indonesia menghasilkan 44% minyak sawit di seluruh dunia pada tahun 2011 dan menunjukkan potensi untuk memperluas perkebunan kelapa sawit dari 9,7 juta ha pada tahun 2009 menjadi 18 juta hektar pada tahun 2020 (Fan 2014). Sementara itu, pembukaan perkebunan karet di Indonesia juga meningkat dari tahun 2001 sampai 2005 mencapai 8.7% (Peramune dan Budiman 2007). Karet dan kelapa sawit sebagai tanaman perkebunan merupakan komoditi ekspor yang mampu memberikan kontribusi dalam peningkatan devisa Indonesia (BPS 2011), meskipun perkebunan kelapa sawit dan karet menyebabkan peningkatan devisa negara namun peningkatan tersebut sejalan dengan perubahan lingkungan yang semakin memburuk. Pembukaan perkebunan kelapa sawit dan karet berdampak besar pada lingkungan antara lain deforestasi dan menurunnya keanekaragaman hayati karena fragmentasi, adanya gangguan dan pengrusakan habitat alami (Germer dan Sauerborn 2007; Koh dan Wilcove 2008). Peningkatan produksi perkebunan menyebabkan terjadinya pembukaan lahan yang semakin meningkat setiap tahunnya. Fu et al. (2001) melaporkan bahwa alih guna lahan telah menurunkan unsur-unsur seperti N, P, dan K tersedia secara drastis sesaat setelah lahan hutan ditebang. Larisa et al. (2013) melaporkan bahwa terjadi perubahan komposisi komunitas bakteri pada lahan hutan yang mengalami perubahan menjadi lahan perkebunan kelapa sawit. Handayani dan Prawito (2002) juga melaporkan bahwa keragaman dan populasi mikroflora tanah (bakteri, fungi, dan Actinomicetes) lebih tinggi pada lahan hutan dibandingkan dengan lahan yang telah mengalami deforestasi. Perubahan fungsi lahan hutan menjadi kebun kelapa sawit menunjukkan terjadinya perubahan sifat kimia tanah antara lain, pH, C-organik, kapasitas tukar kation, N total, dan bahan organik (Oksana et al. 2012).
2
nitrit (NO2-), prosesnya disebut nitritasi dan bakteri pengoksidasi NO2- yang
mengkatalisis pengoksidasian NO2- menjadi nitrat (NO3-), prosesnya disebut nitratasi
(Dollhopf et al. 2005). Bakteri nitrifikasi secara umum merupakan kemolitotrof obligat dan bakteri ini menfiksasi CO2 sebagai sumber karbon (Veuger et al. 2013).
Hadianta (2013) dan Masrukhin (2013) telah mempelajari bagaimana kelimpahan dan laju kinetika nitrifikasi, denitrifikasi, dan DNRA pada lahan yang mengalami alih guna lahan pada hutan Jambi namun mereka tidak menngunakan kultur isolat murni sehingga hal tersebut menjadi menarik untuk dipelajari.
Perumusan Masalah
Proses nitrifikasi di alam merupakan salah satu proses penting dalam siklus nitrogen. Salah satu bakteri yang berperan dalam proses tersebut adalah bakteri nitrifikasi yang terdiri atas bakteri pengoksidasi amonium (nitritasi) dan bakteri pengoksidasi nitrit (nitratasi). Perubahan lahan hutan menjadi perkebunan kelapa sawit dan karet akan mempengaruhi komunitas kedua bakteri tersebut. Oleh karena itu, keragaman isolat dan laju nitrifikasi isolat dengan potensi nitrifikasi tertinggi pada lahan perkebunan kelapa sawit dan karet perlu dikaji lebih dalam.
Tujuan Penelitian
Tujuan dari penelitian ini ialah menganalisis keragaman isolat pada lahan yang telah mengalami alih guna lahan menjadi perkebunan kelapa sawit dan karet serta mengukur aktivitas laju kinetika nitrifikasi pada isolat yang memiliki aktivitas nitrifikasi tertinggi.
Manfaat Penelitian
3 TINJAUAN PUSTAKA
Nitrifikasi
Nitrogen merupakan unsur yang banyak terkandung di alam. Unsur ini menjadi unsur esensial bagi semua organisme. Kebutuhan yang tinggi akan nitrogen disebabkan nitrogen menjadi dasar struktur dan proses biokimia yang menentukan kehidupan, penyusun komponen integral dari banyak senyawa termasuk klorofil, enzim esensial, asam nukleat, dan nukleotida (Capone et al. 2006). Unsur N di alam terjadi dari beberapa proses dan setiap proses menghasilkan transformasi unsur N ke dalam bentuk kimia tertentu serta secara cepat dikonversi oleh mikroorganisme yang berada baik di laut maupun di darat (Francis et al. 2007). Salah satu proses dalam transformasi nitrogen adalah proses nitrifikasi. Nitrifikasi merupakan proses oksidasi senyawa amonium menjadi nitrit dan nitrat. Proses nitrifikasi terjadi pada kondisi pertumbuhan autotrof maupun heterotrof (Bock et al. 1992; Atlas dan Bartha 1998). Senyawa anorganik yang biasa digunakan sebagai donor elektron ialah ammonia (NH3) dan nitrit (NO2-) (Van Loosdrecht dan Jetten 1998).
4
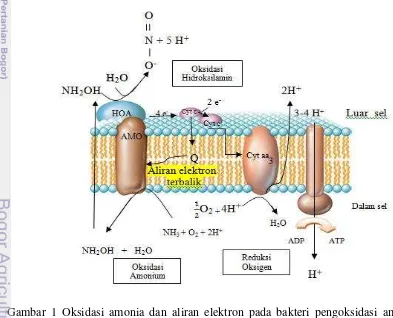
Proses ini diawali dengan pengoksidasian amonium menjadi nitrit selanjutnya nitrit dioksidasi lebih lanjut menjadi nitrat. Pada proses nitrifikasi terdapat tiga enzim kunci, pada bakteri nitritasi yaitu enzim AMO (Amonia monooksigenase) dan HAO (hidroksilamin oksidoreduktase) serta pada bakteri nitratasi yaitu enzim NOR (Nitrit oksidoreduktase). Bakteri nitritasi mengoksidasi NH3 dengan bantuan enzim AMO
menghasilkan NH2OH (hidroksilamin) dan H2O lalu HAO mengoksidasi NH2OH
menjadi NO2- menyingkirkan 4 elektron dari proses. AMO merupakan protein
membran integral sedangkan HAO berada di periplasma (Gambar 1). Reaksi yang dikatalisis AMO ialah NH3 + O2+ 2 H+ NH2OH + H2O, memerlukan
masing-masing dua elektron dan satu proton eksogenos yang mereduksi satu oksigen menjadi air. Elektron berasal dari HAO melalui sitokrom c dan ubiquinon dan diberikan pada AMO. Tiap empat elektron yang dihasilkan dari oksidasi NH3 menjadi NO2-, hanya
dua yang sampai ke oksidase terminal (sitokrom aa3) (Kowalchuk dan Stephen 2001).
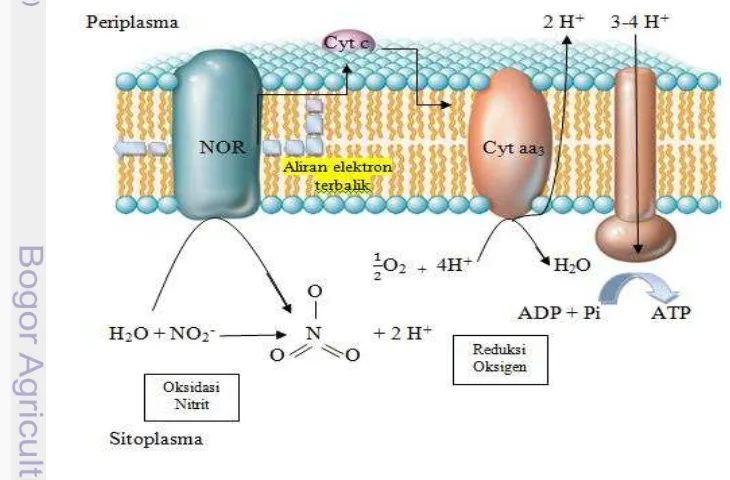
Bakteri nitratasi menggunakan enzim nitrit oksidoreduktase untuk mengoksidasi nitrit menjadi nitrat melalui rantai transport elektron yang pendek (karena potensial reduksi NO3- / NO2- yang tinggi) ke oksidase terminal (Gambar 2). Sitokrom a dan c
pada rantai transfer elektron mengoksidasi nitrit dan menghasilkan pembentukan daya gerak proton (mendorong sintesis ATP) melalui aktivitas sitokrom aa3. Bakteri
nitrifikasi aerobik menggunakan siklus Calvin untuk menambat CO2. Kebutuhan akan
ATP dan tenaga pereduksi dibebankan pada sistem penghasil energi yang rendah (NADH) untuk menjalankan siklus Calvin dibentuk dari arus elektron terbalik (Madigan et al. 2012).
5
Nitrifikasi dipengaruhi oleh beberapa faktor lingkungan antara lain ketersediaan amonium, kandungan bahan organik, aerasi, dan pH tanah yang mempengaruhi keberadaan dari bakteri serta laju nitrifikasi (De Boer dan Kowalchuk 2001; Kowalchuk dan Stephen 2001).
Bakteri Nitrifikasi
Bakteri nitrifikasi banyak dijumpai di tanah dan perairan. Bakteri nitrifikasi terdiri atas dua kelompok utama yaitu bakteri pengoksidasi nitrit (nitritasi) dan bakteri pengoksidasi nitrat (nitratasi). Bakteri nitritasi termasuk ke dalam gamma proteobacteria dan beta proteobakter. Contoh bakteri nitritasi yang termasuk ke dalam gamma-proteobacteria ialah Nitrococcus oceanus dan Nitrosococcus briensis, sedangkan yang termasuk ke dalam beta proteobakteria, antara lain: Nitrosospira, Nitrosomonas europaea/Nitrosococcus mobilis, Nitrosomonas communis, Nitrosomonas marina, Nitrosomonas oligotropha, Nitrosomonas cryotolerans, dan Nitrosomonas sp. Selain dari genus Nitrosomonas dan Nitrosococcus, bakteri pengoksidasi amonium yang lain berasal dari genus Nitrosospira (Nitrosospira briensis, Nitrosospira multiformis, Nitrosospira tenuis), genus Nitrosolobus (Nitrosolobus multiformis), dan genus Nitrosovibrio (Nitrosovibrio tenius) (Prosser 2005).
Nitrosomonas sp. adalah bakteri aerob kemolitotrof obligat yang memperoleh energi dari oksidasi senyawa amonium dan menggunakan CO2 sebagai sumber utama
karbon di dalam sintesis biomassanya. Secara morfologi, bakteri ini berbentuk batang pendek, kadang-kadang bentuk sel elips, motil dan nonmotil, terdapat dalam bentuk konsorsium, berpasangan sebagai rantai pendek maupun sendiri. Bakteri ini adalah bakteri Gram negatif dan memiliki sitomembran. Sel tumbuh bebas pada medium dan membentuk matriks tipis. Bakteri ini dapat tumbuh optimum pada suhu 5-30oC dan pH optimum 5.8-8.5, serta hidup pada habitat air laut, air tawar, dan tanah (Holt et al. 1994). Nitrosococcus sp. bentuk selnya sferik sampai ellipsoidal, Gram negatif, bersifat motil dengan satu atau dua flagella, mampu tumbuh pada suhu sekitar 15-30
o
C dengan pH 6.5-8.0, dan habitatnya di air tawar atau air laut. Bakteri yang berasal dari genus Nitrospira sp. bentuk selnya spiral, Gram negatif, mempunyai sitomembran yang tidak merata, kadang-kadang membentuk seperti membran plasma, nonmotil dan motil dengan menggunakan flagella peritrikus, dan memiliki habitat di air tawar (Holt et al. 1994).
Bakteri nitratasi diklasifikan ke dalam empat genus di dalam proteobakteria yaitu: Nitrobacter (alfa proteobakter), Nitrococcus (gamma proteobakteria), Nitrospira (teta proteobakteria), dan Nitrospina (membentuk divisi tersendiri) Spieck dan Bock 2005). Habitat kelompok bakteri ini tersebar pada air tawar, air laut, serta tanah. Sel Nitrobacter sp. berbentuk batang pendek, pleomorfik, seringkali berbentuk seperti buah pir, Gram negatif, dan biasanya nonmotil (Holt et al. 1994).
6
pH yang terlalu tinggi di atas pH optimum, aktivitas bakteri Nitrobacter berkurang sehingga terjadi penumpukan NO2- karena konversi ke NO3- tertekan. Tetapi
sebaliknya pada pH 7.0, kecepatan konversi NO2- ke NO3- melebihi kecepatan
konversi NH4+ ke NO3-. Nitrospina sp. memiliki bentuk sel batang panjang, Gram
negatif, bersifat nonmotil, memiliki habitat di air laut, dan tumbuh baik pada kondisi lingkungan yang mengandung senyawa organik.
Meskipun bakteri nitrifikasi bersifat aerob mutlak, namun bila tumbuh pada substrat tereduksi maka ammonia dapat dioksidasi pada lingkungan anoksik. Proses ini dikenal dengan anamoks (oksidasi ammonia anoksik), sangat eksergonik, dan bergandeng dengan metabolisme energi. Anamox merupakan oksidasi amonia dengan nitrit sebagai akseptor elektron menghasilkan gas nitrogen. Organisme yang mengkatalisis anamoks (Brocadia anammoxidans) secara filogenetika berbeda dengan Plancktomiset filum Bakteria. Plancktomiset merupakan bakteri unik yang tidak mempunyai peptidoglikan tetapi mempunyai kompartemen terbungkus membran di dalam sel serupa struktur analog nukleus sel eukariot (Jetten et al. 2001; Damste´ et al. 2004). Nitrifikasi tidak hanya terbatas pada mikroorganisme kemolitoautotrof tetapi nitrifikasi juga dapat dilakukan oleh beberapa jenis cendawan dan bakteri heterotrof yang memiliki kemampuan dalam mengoksidasi berbagai senyawa N. Beberapa bakteri heterotrof yang dapat melakukan nitrifikasi antara lain Alcaligens sp. (Castignetti dan Gunner 1981) dan Pseudomonas sp. (Castignetti dan Hollocher 1983).
Kinetika Reaksi Enzim
Enzim merupakan senyawa protein yang dapat mengkatalisis seluruh reaksi kimia dalam sistem biologis. Semua enzim murni yang telah diamati sampai saat ini adalah protein. Aktivitas katalitiknya bergantung kepada integritas strukturnya sebagai protein. Enzim dapat mempercepat reaksi biologis, dari reaksi yang sederhana, sampai ke reaksi yang sangat rumit. Enzim bekerja dengan cara menempel pada permukaan molekul zat-zat yang bereaksi sehingga mempercepat proses reaksi. Percepatan reaksi terjadi karena enzim menurunkan energi pengaktifan yang dengan sendirinya akan mempermudah terjadinya reaksi. Enzim mengikat molekul substrat membentuk kompleks enzim substrat yang bersifat sementara dan lalu terurai membentuk enzim bebas dan produknya (Lehninger 1982).
Pemanfaatan enzim secara optimal dan efisien, baik untuk kepentingan penelitian maupun pemanfaatan industri, dapat dilakukan dengan mengetahui nilai Km dan Vmaks enzim tersebut. Kedua hal tersebut memengaruhi kemampuan katalisis suatu enzim sehingga menyebabkan aktivitas enzim menjadi maksimum jika konsentrasi substrat dan enzim konstan (Lehninger 1982).
7
dapat bertambah lagi dengan bertambahnya [S] disebut kecepatan maksimum (Vmaks) (Gambar 3). Vmaks merupakan salah satu parameter kinetika enzim (Wiesman 1989). Kejenuhan terhadap subsrat dapat terjadi karena seiring dengan meningkatnya konsentrasi substrat, semakin banyak enzim bebas yang diubah menjadi kompleks substrat enzim (ES). Pada kelajuan yang maksimum (Vmax), semua sisi aktif enzim akan berikatan dengan substrat, dan jumlah kompleks ES adalah sama dengan jumlah total enzim yang ada.
Gambar 3 Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzim (White 2007)
Parameter kinetika enzim yang lain ialah konstanta Michaelis-Menten, yang lebih dikenal dengan Km. Km merupakan konsentrasi substrat yang separuh dari lokasi aktifnya telah terisi, yaitu bila kecepatan reaksi enzim telah mencapai ½ Vmaks (White 2007). Nilai Km dapat digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), yang merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai Km kecil berarti kompleks E-S mantap, afinitas enzim tinggi terhadap substrat, sedangkan bila Km besar berlaku kebalikannya.
8
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Juli 2013 sampai Juli 2014 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Isolasi Bakteri Nitrifikasi
Sampel tanah berasal dari Desa Lubuk Kepayang, Kecamatan Air Hitam, Kabupaten Sarolangun dengan kode LK dan Desa Bungku, Kecamatan Bajubang, Kabupaten Batanghari dengan kode Bungku, Jambi. Proses isolasi bakteri nitrifikasi menggunakan metode langsung cawan sebar menggunakan media nitritasi dan nitratasi (Bhaskar dan Charyulu 2005) (Lampiran 1 dan 2). Bakteri diinkubasi selama 6 hari pada suhu 31oC. Kemudian setelah 6 hari, dilakukan perhitungan jumlah koloni menggunakan metode TPC pada cawan yang mengandung jumlah koloni antara 30-300 cfu g-1.
Setiap koloni yang terpisah dengan penampilan yang berbeda dimurnikan dengan metode kuadran pada medium nitritasi dan nitratasi sampai diperoleh koloni tunggal yang murni. Koloni tunggal yang murni kemudian dilakukan uji pewarnaan Gram.
Seleksi Aktivitas Bakteri Nitrifikasi
Seleksi bakteri nitritasi dan nitratasi dilakukan dengan menyiapkan isolat berumur dua hari pada media nitritasi dan nitratasi cair. Kultur media cair disentrifugasi pada kecepatan 12000 rpm rotor 12 x 1.5/2 mL Microcentrifuge MiniSpin® selama 15 menit untuk memperoleh supernatan. Selanjutnya supernatan sampel kemudian diukur konsentrasi amonium dan nitrit menggunakan metode Eaton et al. (2005). Isolat dengan penurunan konsentrasi amonium dan nitrit tertinggi selanjutnya akan dilakukan uji kinetika aktivitas nitrifikasi.
Kinetika Aktivitas Oksidasi Amonium dan Nitrit
Inokulum untuk pengujian disiapkan dengan menumbuhkan isolat pada 50 mL medium nitritasi dan nitratasi cair kemudian diinkubasi di atas inkubator berpenggoyang pada kecepatan 80 rpm dan suhu 31oC selama 6 hari. Kultur bakteri dibuat pelet dengan cara sentrifugasi pada kecepatan 12000 rpm selama 15 menit. Pelet dipisahkan dan diresuspensi dengan medium nitritasi tanpa amonium dan nitratasi tanpa nitrit. Sebanyak 2 mL kultur bakteri diinokulasikan ke dalam 50 mL medium nitritasi dengan konsentrasi amonium 500, 1000, 1500, dan 2000
μM dan nitratasi dengan konsentrasi nitrit 100, 500, 1000, dan 1500 μM (Novita
9
oksidasi amonium dan nitrit dilakukan dengan persamaan kinetika Michaelis-Menten menggunakan plot Lineweaver Burk (White 2007).
Analisis Kadar Amonium
Kadar amonium ditentukan dengan metode spektrofotometri. Kultur media cair disentrifugasi pada kecepatan 12000 rpm selama 10 menit untuk memperoleh supernatant. Sebanyak 2 mL supernatan ditambah dengan 0.08 mL fenol alkohol 11.1%, 0.08 mL nitroprusid 0.5%, dan 0.2 mL campuran hipoklorit teknis dan alkalin sitrat 20% (1:4), kemudian didiamkan selama 1 jam pada ruang gelap. Setiap setelah pemberian pereaksi dilakukan pengadukan menggunakan vortex. Pemberian pereaksi akan menghasilkan warna biru. Warna yang terbentuk dibaca serapannya pada panjang gelombang 640 nm (Eaton et al. 2005). Nilai absorbansi yang diperoleh dikonversi menggunakan kurva standar (Lampiran 5) hingga
diperoleh satuan dalam konsentrasi (μM).
Analisis Kadar Nitrit
Sebanyak 2 mL sampel yang telah disentrifugasi pada kecepatan 12000 rpm selama 10 menit ditambah dengan reagen nitrit 0.08 mL kemudian didiamkan selama 10 menit. Setelah pemberian pereaksi dilakukan pengadukan menggunakan vortex. Pemberian pereaksi akan menghasilkan warna merah muda hingga keunguan. Warna yang terbentuk dibaca serapannya pada panjang gelombang 540 nm (Eaton et al. 2005). Nilai absorbansi yang diperoleh dikonversi menggunakan kurva standar (Lampiran 5) hingga diperoleh satuan
dalam konsentrasi (μM).
Identifikasi Biokimia dengan Metode Analytical Profile Index (API) 20NE
Uji biokimia isolat bakteri dilakukan dengan menggunakan API Kit 20NE. Prinsip metode ini yaitu dengan menginokulasikan suspensi bakteri murni yang berumur 24 jam pada 20 well yang masing-masing berisi substrat atau media untuk uji biokimia. Inkubasi dilakukan selama 24 sampai 48 jam pada suhu 31oC. Bakteri akan melakukan metabolisme yang dapat menyebabkan perubahan warna media. Hasil reaksi tersebut dilakukan pembacaan berdasarkan tabel baca API Kit 20NE dan digunakan program (software) API Kit 20NE untuk mengetahui spesies bakteri.
Isolasi DNA Bakteri Nitrifikasi
Ekstraksi dan isolasi DNA bakteri nitritasi dan nitratasi kultur 24 jam pada media NB dilakukan mengikuti protocol dari Genomic DNA Mini Kit Bacteria (Blood Culture Cell).
10 (EtBr) selama 15 menit. Gel divisualisasi dengan meletakkan gel di atas UV eluminator untuk melihat ada tidaknya pita DNA genom.
Amplifikasi dan Purifikasi DNA Genom Bakteri Nitrifikasi
DNA genom yang terlihat digunakan sebagai template untuk amplifikasi gen penyandi bakteri nitritasi dan nitratasi dengan menggunakan primer, primer yang digunakan untuk amplifikasi bakteri nitritasi dan nitratasi yaitu forward primer 63f (59-CAG GCC TAA CAC ATG CAA GTC-39) and reverse primer 1387r (59-GGG CGG WGT GTA CAA GGC-39) (Marchesi et al. 1998). Gradien suhu yang digunakan yaitu initial denaturation (94ºC selama 5 menit), denaturation (94ºC selama 30 detik), annealing primer (55ºC selama 30 detik), extension primer 72ºC selama 1 menit), dan final extension (72ºC selama 20 menit), 25 siklus. PCR dilakukan dengan mereaksikan 6.5 µl akuabides steril, 12.5 µl 2x PCR Master Mix (Qiagen Kit), 2.5 µl forward primer (10 pmol/µl, konsentrasi akhir 0.25 pmol/µl), 2.5 µl reverse primer (10 pmol/µl, konsentrasi akhir 0.25 pmol/µl) dan 1 µl ekstrak DNA.
Produk Polymerase Chain Reaction (PCR) dapat dilihat melalui elektroforesis yaitu dengan menambahkan 5 µl produk PCR pada 1% gel agarose. DNA ladder 1 kb digunakan sebagai marker. Elektroforesis dilakukan selama 45 menit pada 80 V dengan buffer TAE sebagai running buffer. Hasil migrasi kemudian diwarnai dengan Ethidium bromide 0.1% selama 15 menit kemudian dilihat dibawah UV Transiluminator.
Analisis Sekuen DNA Genom Bakteri Nitrifikasi
HASIL DAN PEMBAHASAN
Hasil
Kelimpahan bakteri nitritasi
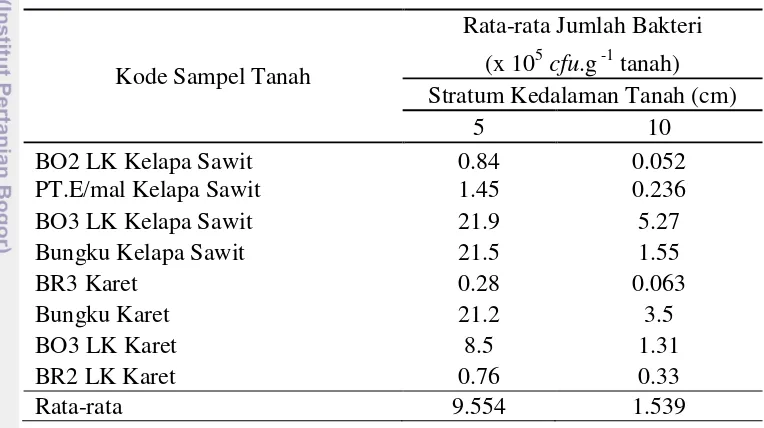
Kelimpahan bakteri nitritasi pada lahan perkebunan kelapa sawit dan karet dibagi menjadi dua strata kedalaman tanah yaitu stratum 5 cm dan stratum 10 cm (Tabel 1). Secara umum pada semua sampel tanah, kelimpahan bakteri nitritasi yang lebih tinggi pada stratum 5 cm dibandingkan dengan stratum 10 cm. Kelimpahan bakteri nitritasi tertinggi pada statum 5 cm berasal dari sampel tanah Bungku Karet sedangkan pada stratum 10 cm berasal dari sampel tanah BO3 LK Kelapa Sawit. Rata-rata kelimpahan bakteri nitritasi pada tanah asal perkebunan kelapa sawit lebih tinggi dibandingkan tanah asal perkebunan karet (Tabel 1). Tabel 1 Kelimpahan rata-rata bakteri nitritasi pada tanah asal lahan perkebunan
kelapa sawit dan karet
Kode Sampel Tanah
PT.E/mal Kelapa Sawit 1.45 0.236
BO3 LK Kelapa Sawit 21.9 5.27
12 Tabel 2 Kelimpahan rata-rata bakteri nitratasi pada tanah asal lahan perkebunan
kelapa sawit dan karet
Kode Sampel Tanah
PT.E/mal Kelapa Sawit 3.190 0.302
BO3 LK Kelapa Sawit 5.930 5.230
Bungku Kelapa Sawit 11.600 4.510
BR3 Karet 0.099 0.040
Bungku Karet 11.800 2.580
BO3 LK Karet 8.700 2.350
BR2 LK Karet 0.399 0.170
Rata-rata 5.256 1.939
Karakteristik morfologi serta aktivitas oksidasi isolat bakteri nitritasi dan nitratasi hasil isolasi
Sebanyak 146 isolat yang berasal dari perkebunan karet dan kelapa sawit berhasil diisolasi, terdiri atas 74 bakteri nitritasi dan 72 bakteri nitratasi. Jumlah isolat yang mewakili setiap strata kedalaman tanah beragam berasal dari tiap sampel tanah (Tabel 3). Pada tanah asal Bungku Karet stratum 5 cm dan BO3 LK Karet stratum 10 cm isolat bakteri nitritasi tidak tumbuh serta pada tanah asal BR2 LK Karet stratum 5 dan 10 cm isolat bakteri nitratasi juga tidak tumbuh.
Tabel 3 Hasil isolasi bakteri nitritasi dan nitratasi pada tanah asal lahan perkebunan kelapa sawit dan karet
13 Seleksi bakteri nitrifikasi dilakukan dengan mengukur penurunan konsentrasi amonium pada bakteri nitritasi (Lampiran 3) dan penurunan konsentrasi nitrit (Lampiran 4) pada bakteri nitratasi. Hasil seleksi menunjukkan aktivitas penurunan konsentrasi amonium dan nitrit yang beragam bergantung jumlah isolat setiap sampel tanah (Tabel 4). Penurunan konsentrasi amonium tertinggi pada BO3 LK Karet stratum 5 cm sebesar 108 µM.hari-1 dan Bungku Kelapa Sawit stratum 10 cm sebesar 125.7 µM.hari-1. Penurunan konsentrasi nitrit tertinggi pada BO3 LK Kelapa Sawit stratum 5 cm sebesar 36.9 µM.hari-1 dan asal dan Bungku Kelapa Sawit stratum 10 cm sebesar 36.7 µM.hari-1 .
Tabel 4 Penurunan konsentrasi amonium pada bakteri nitritasi dan penurunan konsentrasi nitrit pada bakteri nitratasi pada lahan perkebunan kelapa sawit dan karet
No
Kode Sampel Tanah
Rata-rata Aktivitas Penurunan (µM.hari-1) Amonium
1 Bungku Karet 0 37.7 35.6 32.7
2 BO2 LK Kelapa Sawit 79.4 64.5 34.7 35.4
3 PT.E/mal Kelapa Sawit 69.7 34.6 32.8 33.1
4 BO3 LK Kelapa Sawit 7.9 26.6 36.9 33.4
5 Bungku Kelapa Sawit 5.7 125.7 33.7 36.7
6 BR3 Karet 21.8 56.3 33.0 36.5
7 BO3 LK Karet 108 0 35.9 29.1
8 BR2 LK Karet 1.4 40.5 0 0
Rata-rata 41.99 55.13 34.66 33.84
Berdasarkan hasil penurunan konsentrasi amonium, terdapat satu isolat yang memiliki aktivitas penurunan amonium tertinggi sebesar 230.7 μM hari-1 dengan kode isolat C4.7 asal BO3 LK Karet stratum 5 cm (Tabel 5).
Tabel 5 Lima isolat bakteri nitritasi asal lahan perkebunan kelapa sawit dan karet dengan aktivitas penurunan konsentrasi amonium tertinggi
No. Kode Sampel Tanah Kode Isolat Aktivitas Penurunan Amonium (µM.hari-1)
1 BR2 LK Karet 10 C3.8 185.0
2 BO3 LK Karet 5 C4.7 230.7
3 BO2 LK Kelapa Sawit 5 C4.9 157. 9
4 PT.E/mal Kelapa Sawit 5 C9.6 230.0
5 BO3 LK Karet 5 C9.10 184.3
Berdasarkan hasil penurunan konsentrasi nitrit, terdapat satu isolat yang
memiliki aktivitas penurunan nitrit tertinggi sebesar 42.2 μM hari-1
14
Tabel 6 Lima isolat bakteri nitratasi asal lahan perkebunan kelapa sawit dan karet dengan aktivitas penurunan konsentrasi nitrit tertinggi
No. Kode Sampel Tanah Kode
Isolat
Aktivitas Penurunan Nitrit (µM.hari-1)
1 BO3 LK Karet 10 C10.1 41.0
2 BO2 LK Kelapa Sawit 5 C10.3 41.0
3 PT.E/mal Kelapa Sawit 10 C11.3 41.4
4 BO3 LK Karet 5 C11.6 40.6
5 Bungku Karet10 C14.14 42.2
Berdasarkan aktivitas penurunan konsentrasi amonium dan nitrit tertinggi (Lampiran 3 dan 4) didapatkan satu isolat yang diduga bakteri nitritasi dan satu isolat yang diduga bakteri nitratasi. Isolat dengan aktivitas penurunan konsentrasi amonium dan nitrit tertinggi selanjutnya dilakukan karakterisasi morfologi koloni dan morfologi sel menggunakan pewarnaan Gram (Tabel 7 dan Gambar 5).
Tabel 7 Karakteristik morfologi koloni bakteri nitritasi dan nitratasi Kode nitratasi C14.14 dengan perbesaran 1000 x
Kinetika aktivitas oksidasi amonium dan nitrit
Berdasarkan analisis kinetika menggunakan plot Lineweaver-Burk, bakteri nitritasi isolat C4.7 diperoleh nilai laju penurunan senyawa amonium maksimum
(Vmax) sebesar 24.3 μM mL-1
jam-1 dengan Km sebesar 161.8 μM. Sedangkan analisis kinetika bakteri nitratasi isolat C14.14 diperoleh nilai laju penurunan
senyawa nitrit maksimum (Vmax) sebesar 5.1 μM mL-1
jam-1 dengan Km sebesar
15
(A) (B)
Gambar 6 Hubungan antara konsentrasi substrat yang berbeda dengan laju penurunan konsentrasi amonium pada isolat C4.7 dan laju penurunan konsentrasi nitrit pada isolat C14.14 setelah 12 jam inkubasi
Identifikasi biokimia isolat terpilih hasil isolasi
Deskripsi spesies berdasarkan identifikasi biokimia API Kit 20NE pada isolat C4.7 menunjukkan kemiripan fisiologis 97% dengan Pseudomonas fluorescens dan isolat C14.14 menunjukkan kemiripan fisiologis 95.4% dengan Rhizobium radiobacter (Lampiran 6).
Identifikasi Molekular Berdasarkan Sekuen 16S rRNA
Amplifikasi DNA isolat bakteri nitrifikasi
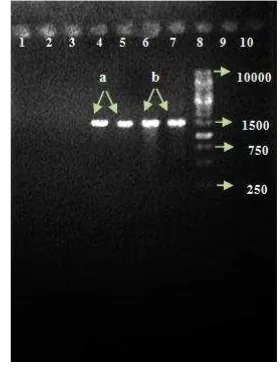
Pita hasil isolasi genom DNA isolat C4.7 dan C14.14 diamplifikasi dengan primer 63f dan 1387r, Hasil amplifikasi DNA isolat C4.7 dan C14.14 diperoleh pita dengan panjang ~1500 pb, pita tersebut kemudian divisualisasi dengan UV transluminator (Gambar 7).
1 2 3 4 5
16 Pita hasil amplifikasi dengan primer 63f/1387r (Marchesi et al. 1998) kemudian dikirim ke jasa sekuens sehingga diperoleh runutan basa isolat C4.7 dan C14.14 (Lampiran 7 dan 8). Hasil pensejajaran sekuen menggunakan NCBI BLAST-N (Tabel 8) kemudian dikonstruksi pohon filogeninya menggunakan program software Mega 5. Berdasarkan hasil konstruksi pohon filogeni diperoleh isolat C4.7 yang memiliki kekerabatan dekat dengan Acinetobacter radioresistens dan isolat C14.14 yang memiliki kekerabatan dekat dengan Frauteria sp.
Tabel 8. Kesamaan sekuen isolat C4.7 dan C14.14 dengan spesies pembanding pada gen bank database NCBI BLAST-N
Pita Deskripsi Query dibuat dengan metode Neighbour Joining, model Tamura-Nei dengan nilai bootstrap 1000X
Pembahasan
Kelimpahan bakteri nitrifikasi
17 terhadap penurunan tutupan kanopi, tumbuhan bawah, masukan serasah, dan diversitas perakaran tanaman serta mikrob. Tanah-tanah di Jambi umumnya didominasi oleh Ultisol yang memiliki sifat kesuburan rendah, dicirikan oleh pH masam (3.1-5), kejenuhan basa <35%, kapasitas tukar kation rendah (<16 cmol/kg), dan kejenuhan Al yang tinggi berkisar 37-78% sangat rentan akan terjadinya kehilangan N karena pencucian (Utami et al. 2013).
Kelimpahan bakteri nitritasi dan nitratasi pada tiap sampel tanah (Tabel 1 dan 2) dibagi ke dalam 2 strata kedalaman yaitu kedalaman 5 dan 10 cm. Kelimpahan bakteri baik nitritasi maupun nitratasi pada tiap sampel tanah berbeda-beda, secara umum kedalaman 5 cm pada tiap sampel tanah lebih tinggi jika dibandingkan pada kedalaman 10 cm. Hal ini didukung oleh penelitian Hadianta (2013) dan Masrukhin (2013) yang melaporkan bahwa kelimpahan bakteri nitrifikasi pada lahan perkebunan kelapa sawit dan karet Jambi dengan menggunakan metode MPN lebih tinggi pada kedalaman tanah 0-5 cm. Ketersediaan oksigen diduga sebagai salah satu penyebab kelimpahan tersebut. Bakteri nitrifikasi menggunakan amonia/amonium dan nitrit sebagai donor elektron dan oksigen sebagai akseptor elektron terakhir (Rittmann et al. 1999) sehingga keberadaan oksigen menjadi salah satu prasyarat bagi pertumbuhan optimum pada bakteri nitrifikasi.
Kelimpahan bakteri tertinggi diperoleh pada sampel tanah asal kebun sawit baik untuk kelimpahan bakteri nitritasi maupun bakteri nitratasi. pH tanah diduga berpengaruh terhadap aktivitas bakteri nitrifikasi. pH tanah di bawah 6.5 menyebabkan aktivitas nitrifikasi berlangsung lambat (Prosser 2005). Agustiyani et al. (2004) juga melaporkan bahwa bakteri pengoksidasi amonium memiliki aktivitas pertumbuhan yang optimum antara 7-8. Hutan karet dan kebun karet asal Jambi memiliki reaksi tanah yang lebih masam dibandingkan dengan hutan. Namun tanah pada lahan kelapa sawit memiliki pH lebih tinggi dibandingkan lahan yang ditanami karet, bahkan dibandingkan hutan. Hal ini kemungkinan karena pencucian basa yang relatif rendah, dan tindakan pengapuran yang lebih intensif (Utami et al. 2013). Selain itu kurang melimpahnya bakteri nitrifikasi juga dapat disebabkan oleh beberapa faktor antara lain senyawa yang berasal dari eksudat perakaran dan zat yang terlarut dalam tanah seperti nitrapyrin, acetylene, chlorate, cycloheximide yang dapat menghambat pertumbuhan bakteri nitrifikasi (De Boer dan Kowalchuk 2001; Weidenhamer dan Callaway 2010). Tanaman karet dapat menghasilkan monoterpen sebagai hasil metabolisme sekunder (Yong-Feng et al. 2007). Sebagai salah satu kelompok terpen, monoterpen dapat mempengaruhi interaksi antara organism termasuk organisme tanah (Asensio et al. 2008). Monoterpen dapat menghambat laju mineralisasi nitrogen dan laju nitrifikasi (White 1988). Minyak neem yang diekstrak dari daun Azadirachta indica juga dapat menghambat proses nitrifikasi (Arora dan Srivastava 2014).
Karakteristik isolat terpilih
Terdapat 74 bakteri nitritasi dan 72 bakteri nitratasi yang berhasil diisolasi dari tanah kebun karet dan kelapa sawit. Dari 74 bakteri nitritasi terdapat satu isolat dengan kode isolat C4.7 yang memiliki kemampuan oksidasi amonium
tertinggi, sebesar 230.7 μM.hari-1
18
tertinggi sebesar 42.2 μM.hari-1
dari total nitrit yang ditambahkan pada media. Kemampuan oksidasi amonium dan nitrit yang rendah dapat disebabkan oleh substrat yang terbatas pada lahan yang telah mengalami alih guna lahan.
Penggunaan lahan yang berubah cenderung menurunkan kandungan bahan organik. Kandungan bahan organik total secara berturut-turut menurun dari hutan, menjadi hutan karet, kebun karet, dan yang paling rendah ialah kelapa sawit (Utami et al. 2013). Selain itu, Cesylia (2009) juga melaporkan bahwa cadangan karbon pada hutan monokultur karet cenderung lebih rendah dibandingkan dengan hutan alam. Perubahan kandungan bahan organik ini sangat nyata terutama pada lapisan tanah teratas (0-10 cm). Degradasi bahan organik tanah setelah 4 tahun pada kebun karet dan kelapa sawit masing-masing sebesar 0-30% untuk kebun karet dan kebun kelapa sawit sebesar 0-40% (Bruun et al. 2009).
Morfologi mikroskopis isolat C4.7 setelah dilakukan pewarnaan Gram merupakan Gram negatif berbentuk batang pendek. Bakteri pengoksidasi amonia tergolong Gram negatif yang memiliki bentuk sel batang (panjang 0.6-4 μm), ellipsoid, sferikal, dan spiral. Sel tidak motil dan motil dengan flagela polar sampai subpolar atau peritrik. Semua spesies aktivitasnya berjalan pada kondisi aerobik, temperatur pertumbuhan optimum 25-30ºC, tidak aktif pada suhu 4ºC dan pH optimum berkisar 7.5-8.0, berkoloni pada media seperti kerikil, pasir, dan media sintetik lain, memerlukan oksigen untuk mengkonversi senyawa anorganik sebagai sumber energinya, dan memerlukan CO2 sebagai sumber karbon. Rasio
reproduksi sangat lambat (waktu generasi 20-40 jam) (Holt et al. 1994), sedangkan untuk isolat C14.14 merupakan gram negatif berbentuk batang. Bakteri pengoksidasi nitrit berbentuk batang pendek, pleomorfik, Gram negatif, dan biasanya non motil (Holt et al. 1994). Pertumbuhan bakteri pengoksidasi nitrit lambat, waktu generasi bervariasi dari 8 jam sampai beberapa hari. Tingkat pertumbuhan dikendalikan oleh konsentrasi substrat, suhu, pH, cahaya, dan konsentrasi oksigen. Kebanyakan bakteri pengoksidasi nitrit tumbuh baik pada konsentrasi nitrit antara 2-30 mM pada pH 7.5-8.0 dan pada suhu 25-30ºC (Spieck dan Bock 2005).
Kinetika aktivitas nitrifikasi
Aktivitas nitrifikasi yang dilakukan oleh bakteri nitritasi dan nitratasi tidak lepas dari peranan enzim yang mengkatalis aktivitas tersebut. Bakteri nitritasi memiliki 2 enzim kunci yaitu amonium monooksigenase (AMO), terdapat di membran integral, mengoksidasi NH4+/NH3 menjadi NH2OH (hidrosilamin).
Selanjutnya terdapat enzim hidroksilamin oksidoreduktase (HOA), berada di membran periplasma, mengubah NH2OH menjadi NO2-, sedangkan bakteri
nitratasi menggunakan enzim nitrit oksidoreduktase untuk mengoksidasi NO2
-menjadi NO3- (Madigan 2012). Ketiga enzim tersebut dapat mengkatalisis reaksi
dengan kelajuan mencapai jutaan reaksi per detik. Laju reaksi bergantung pada kondisi larutan dan konsentrasi substrat. Peningkatan konsentrasi substrat cenderung meningkatkan aktivitasnya. Untuk menentukan kelajuan maksimum suatu reaksi enzimatik, konsentrasi substrat ditingkatkan sampai laju pembentukan produk yang terpantau menjadi konstan.
19 substrat. Persamaan Michaelis-Menten memperlihatkan hubungan antara kecepatan awal reaksi [V] dengan konsentrasi substrat [S]. Nilai Km dapat digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S (Putra 2009). Nilai Km kecil berarti kompleks E-S mantap, afinitas enzim tinggi terhadap substrat, sedangkan bila Km besar berlaku kebalikannya. Nilai Km enzim sangat bervariasi tergantung dari jenis substrat, keadaan lingkungan dan kekuatan ion (Wiseman 1989).
Vmax isolat C4.7 sebesar 24.3 μM.mL-1
.jam-1 artinya pada kondisi optimum enzim AMO dan HOA dapat mengubah substrat NH4+ menjadi NO2- sebesar 24.3
µM.mL-1 tiap jamnya. Sedangkan Vmax pada isolat C14.14 sebesar 5.1 μM.mL-1 jam-1 artinya pada kondisi optimum enzim nitrit oksidoreduktase dapat mengubah substrat NO2- menjadi NO3- sebesar 5.1 µM.mL-1 tiap jamnya. Vmax isolat C4.7
nitritasi lebih besar dibandingkan isolat C14.14 sehingga jika kedua isolat ini dikulturkan dalam satu lingkungan yang sama maka akan terjadi akumulasi nitrit karena keseimbangan antara kedua proses tersebut tidak terjadi. Apabila terjadi akumulasi nitrit maka ion nitrit diserap masuk ke dalam darah, dan bila terjadi kontak dengan eritrosit, nitrit akan mengoksidasi Fe+2 dalam haemoglobin (Hb)
menjadi Fe3+ membentuk methaemoglobin (MetHb). Kandungan MetHb dalam
darah 30−40% dapat menimbulkan gejala klinis, dan bila kandungannya mencapai
80−90% akan menyebabkan kematian pada ternak, ikan, dan juga manusia
(Cammack et al. 1998). Selain itu nitrit yang masuk ke dalam tubuh manusia
dapat menyebabkan terbentuknya senyawa N-nitrosamin dapat menyebabkan kanker pada saluran pencernaan (Anjana et al. 2007).
Km merupakan konsentrasi substrat yang diperlukan oleh suatu enzim untuk mencapai setengah kelajuan maksimumnya. Setiap enzim memiliki nilai Km yang berbeda-beda untuk tiap subtrat, dan ini dapat menunjukkan seberapa kuat pengikatan substrat ke enzim. Nilai Km yang diperoleh untuk isolat C4.7 dan
C14.14 pada penelitian ini sebesar 161.8 μM dan 100 μM. Pada isolat C4.7 dan
C14.14, enzim nitrit oksidoreduktase, AMO, dan HOA memiliki afinitas enzim yang rendah terhadap substrat NO2- sehingga kesetimbangan reaksi lebih ke arah
pembentukan kompleks substrat enzim sehingga produk yang diperoleh mempunyai rendemen yang rendah.
Hasil identifikasi isolat terpilih
Hasil deskripsi isolat berdasarkan uji identifikasi biokimia API Kit 20NE menunjukkan hasil yang berbeda dengan hasil deskripsi identifikasi molekular 16S rRNA. Hasil identifikasi biokimia isolat C4.7 ialah Pseudomonas fluorescens dengan tingkat kepercayaan 97% (Lampiran 3), sedangkan hasil identifikasi molekular 16S rRNA menunjukkan isolat tersebut memiliki kemiripan sekuen dengan Acinetobacter radioresistens dengan persentase identitas sebesar 99%. Hasil identifikasi biokimia isolat C14.14 ialah Rhizobium radiobacter dengan tingkat kepercayaan 95.4% (Lampiran 3) sedangkan hasil identifikasi molekular 16S rRNA menunjukkan isolat tersebut memiliki kemiripan sekuen dengan Frauteria sp dengan persentase identitas sebesar 98%.
C4.7 yang diduga sebagai bakteri nitritasi dengan kemampuan oksidasi
senyawa amonium sebesar 230.7 μM hari-1
20 radioresistens dengan persentase kemiripan sebesar 99%. A. radioresistens merupakan Gram negatif berbentuk batang pendek, tidak membentuk endospora, tidak berkapsul, tidak motil, jika ditumbuhkan pada media NA memiliki morfologi tipe koloni halus, cembung, berkilau, dan berwarna putih kekuningan (kuning pucat) (Yukimasa et al. 1988).
C14.14 yang diduga sebagai bakteri nitratasi dengan kemampuan oksidasi
senyawa nitrit sebesar 42.2 μM hari-1
setelah dilakukan analisis identifikasi molekular 16S rRNA menunjukkan kemiripan dengan Frateuria sp. dengan persentase kemiripan sebesar 98%. Frateuria sp. merupakan Gram negatif, aerob obligat, kemoorganotrof, oksidase negatif, H2S positif, asam dihasilkan dari
SIMPULAN DAN SARAN
Simpulan
Kelimpahan tertinggi bakteri nitritasi dan nitratasi pada lahan yang telah mengalami perubahan penggunaan lahan berasal dari perkebunan kelapa sawit pada stratum kedalaman 5 cm dari permukaan tanah. Sebanyak 74 bakteri nitritasi dan 72 bakteri nitratasi berhasil diisolasi dari perkebunan karet dan kelapa sawit. satu isolat bakteri nitritasi kode C4.7 memiliki kemampuan oksidasi amonium tertinggi sebesar 230.7 μM.hari-1. Satu isolat bakteri nitratasi kode C14.14 memiliki kemampuan dalam mengoksidasi nitrit tertinggi yaitu sebesar 42.2 μM hari-1. Laju maksimum (Vmax) isolat C4.7 sebesar 24.3 μM.mL-1.jam-1 dengan
Km sebesar 161.8 μM sedangkan laju maksimum (Vmax) Isolat C14.14 sebesar
5.1 μM.mL-1
.jam-1 dan Km sebesar 100 μM. Isolat C4.7 memiliki kemiripan dengan Acinetobacter radioresistens persentase kemiripan 99% sedangkan isolat C14.14 menunjukkan kemiripan dengan Frateuria sp. dengan persentase kemiripan sebesar 98%.
Saran
21 DAFTAR PUSTAKA
Ajidirman. 2006. Kajian restorasi C-organik tanah dan hubungannya dengan kesuburan fisik di bawah vegetasi sawit. J Agron Indones. 10(2):81-84.
Agustiyani D, Imamuddin H, Faridah EN, Oedjijono. 2004. Pengaruh pH dan substrat organik terhadap pertumbuhan dan aktivitas bakteri pengoksidasi ammonia. Biodiversitas.5(2):43-47.
Anjana, Umar S, Iqbal M. 2007. Nitrate accumulation in plants, factors affecting the process, and human health implications: a review. Agron Sustain Dev. 27(1):45–57.
Arora K, Srivastava A. 2014. Variation in nitrification inhibition activity of neem leaves collected from different locations of lucknow (India). IJPSS. 3(5):457-466.
Asensio D, Owen SM, Llusia` J, Penuelas J. 2008. The distribution of volatile isoprenoids in the soil horizons around pinus halepensis trees. J Soil Biol Biochem. 40(12): 2937–2947.
Atlas RM, Bartha R. 1998. Microbial Ecology: Fundamentals and Applications. Edisi ke-4. California (US): Benjamin Cumming Sciences Publishing.
Bhaskar KV, Charyulu PBBN. 2005. Effect of environmental factors on nitrifying bacteria isolated from the rhizosphere of Setaria italica (L.) Beauv. Afr J Biotechnol. 4(10):1145-1146.
[BPS] Badan Pusat Statistik. 2011. Statistik Karet Indonesia. [Internet]. Jakarta (ID): BPS. [diunduh 15 Januari 2013]. Tersedia pada: http://www.bps.go.id.
Bock E, Koops HP, Ahlers B, Harms H. 1992. Oxidation of inorganic compounds as Energy Sources. Di dalam Balows A, Truper GH, Dworkin M, Harder W, Schleifer KZ, editor. The Prokaryotes. A Hand Book on the Biology of Bacteria. New York (US): Springer-Verlag. hlm 414-430.
Bruun TB, Neergaard A, Lawrence D, Ziegler AD. 2009. Environmental consequences of the demise in swidden cultivation in Southeast Asia: carbon storage and soil quality. J Hum Ecol. 37(3): 375–388.
Cammack R, Joannou CL, Xiao-Yuan C, Martinez CT, Maraj SR, Hughes MN. 1998. Nitrite and nitrosyl compounds in food preservation. J BBA. 1411(2-3): 475-488.
Capone DG, Popa R, Flood B, Nealson KH. 2006. Follow the nitrogen. Science. 312(5774): 708–709.
Castignetti D, Gunner HB. 1981. Nitrite and nitrate synthesis from pyruvic-oximeby an Alcaligenes sp. Curr Microbiol. 5(6): 379-384.
Castignetti D, Hollocher TC. 1983. Heterotrophic nitrification among denitrifiers. Appl Environ Microbiol. 47(4): 620-623.
22 Damste´ JSS, Rijpstra IC , Schouten S. Fuerst JA, Jetten MSM, Strous M. 2004. The occurrence of hopanoids in planctomycetes: implications for the sedimentary biomarker record. Organic Geochem. 35(5): 561–566.
De Boer W, Kowalchuk GA. 2001. Nitrification in acid soils: microorganisms mechanisms. J Soil Biol Biochem. 33(7-8): 853-866.
[Dephut] Departemen Kehutanan. 2011. Luas Kawasan Hutan dan Kawasan Konservasi Perairan Indonesia Berdasarkan SK Menteri Kehutanan [Internet]. Jakarta (ID): Dephut. [diunduh 15 Januari 2012]. Tersedia pada:
http://www.dephut.go.id.
Dollhopf SL, Hyun JH, Smith AC, Adams HJ, Sean O, Kostka JE. 2005.Quantification of ammonia-oxidizing bacteria and factors controlling nitrification in salt marsh sediments. Appl Environ Microbiol. 71(1):240-246. Eaton AD, Clesceri LS, Greenberg AE, Rice EW. 2005. Standard Method for
Examination of Water and Wastewater. Edisi ke-21. Washington D.C. (US): APHA-AWWA-WPCF.
Fan Y, Roupsard O, Bernoux M, Le Maire G, Panferov O, Knohl A. 2014. Quantifying the Effects of Land Use Changes in Indonesia on Carbon, Water and Energy Fluxes to the Atmosphere Using the CLM Land Surface Model in the Annual Conference of the Society for Tropical Ecology: Tropical Ecosystems – Between Protection and Production. 2014 Februari 25-28; Freising-Weihenstephan (DE): University of Goettingen. hlm 989.
Francis CA, Beman JM, Kuypers MM. 2007. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation. ISME J. 1(1): 19–27.
Fu BJ, Guo XD, Chen LD, Ma KM, Li JR. 2001. Soil nutrient changes due to land use changes in Northern China: a case study in Zunhua country, Hebei province. Soil Use Manage. 17:294-296.
Germer J, Sauerborn J, 2007. Estimation of the impact of oil palm plantation establishment on greenhouse gas balance. Environ Dev Sustain. 10(6): 697– 716.
Hadianta 2013. Laju potensial nitrifikasi, denitrifikasi, DNRA (dissimilative nitrate reduction to ammonium), dan kelimpahan bakteri di lahan perkebunan sawit Jambi [skripsi]. Bogor(ID): Institut Pertanian Bogor.
Handayani IP, Prawito. 2002. Lahan paska deforestasi di Bengkulu, Sumatra: i. kajian mikroflora tanah dan evolusi karbondioksida. JIPI. 4(1):1-9.
Holt JG, Noel RK, Peter HAS, Stanley JT. 1994. Bergeys Manual of Determinate Bacteriology. Edisi ke-9. Maryland (US): Williams and Wilkins.
Jetten MSM, Wagner M, Fuerst J, Loosdrecht MV, Kuenen G, Strous M. 2001. Microbiology and application of the anaerobic ammonium oxidation
(‘anammox’) process. Curr Opin Biotechnol. 12(3): 283-288.
Koh LP, Wilcove DS. 2008. Is oil palm agriculture really destroying tropical biodiversity?. Conserv Lett. 1(2): 60–64.
23 Larisa LC, Edwards DP, Tripathi BM, Adams JM. 2013. The impact of logging and forest conversion to oil palm on soil bacterial communities in Borneo. Appl Environ Microbiol. 79(23):7290-7297.
Lehninger AL. 1982. Dasar-dasar Biokimia. Thenawijaya M, penerjemah. Jakarta(ID): Penerbit Erlangga. Terjemahan dari: Lehninger Principles of Biochemistry.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2012. Brock Biology of Microorganism. Edisi ke-13. San Francisco(US): Benjamin Cummings.
Marchesi JR, Takuichi S, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade W. 1998. Design and evaluation of useful bacterium-specific pcr primers that amplify genes coding for bacterial 16S rRNA. Appl Environ Microbiol. 64(2): 795-799.
Masrukhin 2013. Laju potensial dan kelimpahan bakteri nitrifikasi, denitrifikasi, dan disimilatory nitrate reduction to ammonium pada lahan perkebunan karet di Jambi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Novita L. 2006. Aktivitas oksidasi amonium dan reduksi nitrat Pseudomonas stutzeri ASLT2 pada sumber karbon yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Oksana, Irfan M, Huda MU. 2012. Pengaruh alih fungsi lahan hutan menjadi perkebunan kelapa sawit terhadap sifat kimia tanah. J Agroteknol. 3(1):29-34. Peramune MR, Budiman AFS. 2007. A Value Chain Assessment of the Rubber
Industry in Indonesia. Agency for International Development Raise (USAID); 2007 Januari 4-22. Jakarta (ID): Amarta. Hlm: 1-45.
Prosser JI. 2005. The Encyclopedia of Soils in the Environment: Nitrification. New York (US): Elsevier Ltd.
Putra GPG. 2009. Penentuan kinetika enzim poligalakturonase (PG) endogenous dari pulp biji kakao. J Biol. 13(1):21 -24.
Rittmann BE, Laspidou CS, Flax J, Stahl DA, Urbain V, Harduin H, van der Waarde JJ, Geurkink B, Henssen MJC, Brouwer H. 1999. Molecular and modeling analyses of the structure and function of nitrifying activated sludge. Water Sci Technol. 39(1):51–59.
Saitou N, Nei M. 1987. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol Biol Rev. 4(4):406-425.
Situmorang AW, Nababan A, Kartodihardjo H, Khatarina J, Santosa MA, Safitri M, Soeprihanto P, Effendi S, Sunaryo. 2013. Participatory Governance Assessment: The 2012 Indonesia Forest, Land And Redd+ Governance Index. Jakarta (ID): UNDP Indonesia Press.
Spieck E, Bock E. 2005. Bergeys manual of determinate bacteriology, volume two: the proteobacteria, part a introductory essays (Internet). Germany (DE): Springer press. [diunduh tanggal 10 Mei 2013]. Tersedia pada:
http://www.springer.com/978-0-387-24143-2.
Sunderlin WD, Resosudarmo IAP. 1997. Laju dan penyebab deforestasi di Indonesia: penelaahan kerancuan dan penyelesaiannya [Internet]. Bogor (ID): CIFOR.
[diunduh 1 Desember 2012]. Tersedia pada:
24 Utami SR, Kusuma Z, Kurniawan S. 2013. Dampak alih guna hutan menjadi kebun karet dan kelapa sawit terhadap cadangan C dan N tanah, serta pencucian nitrogen [laporan tahunan penelitian unggulan perguruan tinggi]. Malang (ID): Faperta UB.
Van Loosdrecht MCM, Jetten MSM. 1998. Microbiologycal conversions in nitrogen removal. Wat Sci Tech. 38(1): 1-7.
Veuger B, Pitcher A, Schouten S, Damst´e JSS, Middelburg JJ. 2013. Nitrification and growth of autotrophic nitrifying bacteria and thaumarchaeota in The Coastal North Sea. Biogeosciences. 10(3): 1775–1785.
Weidenhamer JF, Callaway RM. 2010. Direct and indirect effects of invasive plants on soil chemistry and ecosystem function. J Chem Ecol. 36(1): 59–69.
White D. 2007. The Physiology and Biochemistry of Procaryotes. Ed ke-3. New York (US): Oxford University Press.
White CS. 1988. Nitrification inhibition by monoterpenoids: theoretical mode of action based on molecular structures. Ecology. 69(5): 1631–1633.
Wiseman A. 1989. Handbook of Enzymes Biotechnology. Ed ke-2. New York (US): Ellis Howard.
Yong-Feng W, Owen SM, Qing-Jun L, Peneulas J. 2007. Monoterpene emissions from rubber trees (Hevea Brasiliensis) in a changing landscape and climate: chemical speciation and environmental control. Global Change Biol. 13(11): 2270–2282.
Lampiran 1 Isolat C4.7 dan komposisi media nitritasi (Bashkar dan Charyulu 2005)
Komposisi Media Nitritasi (g.L-1)
(NH4)SO4 0.235
KH2PO4 0.2
CaCl2..2H2O 0.04
MgSO4.7H2O 0.04
FeSO4.7H2O 0.005
CaCO3 0.5
Bacto agar 15
Lampiran 2 Isolat C14.14 dan komposisi media nitratasi (Bashkar dan Charyulu 2005)
Komposisi Media Nitratasi (g.L-1)
NaNO2 0,2470
KH2PO4 0.2
CaCl2..2H2O 0.04
MgSO4.7H2O 0.04
FeSO4.7H2O 0.005
CaCO3 0.5
Bacto agar 15
Lampiran 3 Hasil penurunan senyawa amonium pada bakteri nitritasi setelah inkubasi
Kontrol 0.617 0.618 0.618 1775.7 0 0
C1.1 0.558 0.559 0.559 1607.1 168.557 84.279
C1.2 0.574 0.575 0.575 1652.9 122.843 61.4
C1.3 0.609 0.61 0.610 1752.9 22.843 11.4
C1.4 0.574 0.575 0.575 1652.9 122.843 61.4
C1.5 0.513 0.514 0.514 1478.6 297.129 148.6
C1.6 0.572 0.573 0.573 1647.1 128.557 64.3
C1.7 0.593 0.594 0.594 1707.1 68.557 34.3
C1.8 0.603 0.604 0.604 1735.7 39.986 20.0
C1.9 0.542 0.543 0.543 1561.4 214.271 107.1
C2.1 0.563 0.565 0.564 1622.9 152.843 76.4
C2.2 0.591 0.592 0.592 1701.4 74.271 37.1
C2.3 0.545 0.546 0.546 1570.0 205.700 102.9
C2.4 0.617 0.615 0.616 1771.4 4.271 2.1
C2.5 0.6 0.601 0.601 1727.1 48.557 24.3
C2.6 0.615 0.612 0.614 1764.3 11.414 5.7
C2.7 0.59 0.591 0.591 1698.6 77.129 38.6
C2.8 0.617 0.612 0.615 1767.1 8.557 4.3
C2.9 0.582 0.585 0.584 1678.6 97.129 48.6
C3.1 0.523 0.524 0.524 1507.1 268.557 134.3
C3.2 0.52 0.521 0.521 1498.6 277.129 138.6
C3.3 0.554 0.557 0.556 1598.6 177.129 88.6
Lanjutan
C3.5 0.576 0.577 0.577 1658.6 117.129 58.6
C3.6 0.606 0.607 0.607 1744.3 31.414 15.7
C3.7 0.524 0.524 0.524 1508.6 267.129 133.6
C3.8 0.49 0.486 0.488 1405.7 369.986 185.0
C3.9 0.571 0.571 0.571 1642.9 132.843 66.4
C3.10 0.617 0.614 0.616 1770.0 5.700 2.9
C3.11 0.6 0.602 0.601 1728.6 47.129 23.6
C4.1 0.609 0.61 0.610 1752.9 22.843 11.4
C4.2 0.556 0.558 0.557 1602.9 172.843 86.4
C4.3 0.607 0.608 0.608 1747.1 28.557 14.3
C4.4 0.532 0.532 0.532 1531.4 244.271 122.1
C4.5 0.614 0.613 0.614 1764.3 11.414 5.7
C4.6 0.616 0.617 0.617 1772.9 2.843 1.4
C4.7 0.456 0.456 0.456 1314.3 461.414 230.7
C4.8 0.612 0.613 0.613 1761.4 14.271 7.1
C4.9 0.507 0.507 0.507 1460.0 315.700 157.9
C4.10 0.534 0.535 0.535 1538.6 237.129 118.6
C4.11 0.617 0.616 0.617 1772.9 2.843 1.4
C5.1 0.617 0.615 0.616 1771.4 4.271 2.1
C5.2 0.604 0.605 0.6045 1738.6 37.129 18.6
C5.3 0.562 0.562 0.562 1617.1 158.557 79.3
C5.4 0.617 0.615 0.616 1771.4 4.271 2.1
C5.5 0.617 0.614 0.6155 1770.0 5.700 2.9
C5.6 0.594 0.596 0.595 1711.4 64.271 32.1
C5.7 0.617 0.614 0.6155 1770.0 5.700 2.9
C6.1 0.6 0.601 0.6005 1727.1 48.557 24.3
C6.3 0.615 0.617 0.616 1771.4 4.271 2.1
C6.5 0.614 0.615 0.6145 1767.1 8.557 4.3
C7.1 0.617 0.616 0.6165 1772.9 2.843 1.4
C7.2 0.615 0.613 0.614 1765.7 9.986 5.0
C7.3 0.611 0.612 0.6115 1758.6 17.129 8.6
C7.4 0.614 0.615 0.6145 1767.1 8.557 4.3
C7.5 0.613 0.614 0.6135 1764.3 11.414 5.7
C7.6 0.614 0.612 0.613 1762.9 12.843 6.4
Lanjutan
C8.1 0.615 0.616 0.6155 1770.0 5.700 2.9
C8.2 0.606 0.608 0.607 1745.7 29.986 15.0
C8.3 0.608 0.609 0.6085 1750.0 25.700 12.9
C8.4 0.617 0.617 0.617 1774.3 1.414 0.7
C9.1 0.518 0.517 0.5175 1490.0 285.700 142.9
C9.2 0.617 0.616 0.6165 1772.9 2.843 1.4
C9.3 0.589 0.59 0.5895 1695.7 79.986 40.0
C9.4 0.595 0.596 0.5955 1712.9 62.843 31.4
C9.5 0.551 0.552 0.5515 1587.1 188.557 94.3
C9.6 0.457 0.456 0.4565 1315.7 459.986 230.0
C9.7 0.527 0.53 0.5285 1521.4 254.271 127.1
C9.8 0.617 0.614 0.6155 1770.0 5.700 2.9
C9.9 0.524 0.53 0.527 1517.1 258.557 129.3
C9.10 0.487 0.49 0.4885 1407.1 368.557 184.3
Lampiran 4 Hasil penurunan senyawa amonium pada bakteri nitratasi setelah inkubasi
C11.7 0.055 0.056 0.055 100.8 67.2 33.6
Lanjutan
C12.1 0.058 0.057 0.057 104.1 63.9 32.0
C12.2 0.054 0.055 0.0545 99.2 68.8 34.4
C12.3 0.055 0.055 0.055 100.0 68.0 34.0
C12.4 0.054 0.053 0.0535 97.5 70.5 35.2
C12.5 0.055 0.056 0.0555 100.8 67.2 33.6
C12.6 0.054 0.053 0.0535 97.5 70.5 35.2
C12.7 0.056 0.057 0.0565 102.5 65.5 32.8
C12.8 0.053 0.054 0.0535 97.5 70.5 35.2
C12.9 0.055 0.055 0.055 100.0 68.0 34.0
C12.10 0.055 0.056 0.0555 100.8 67.2 33.6
C13.1 0.054 0.053 0.0535 97.5 70.5 35.2
C13.2 0.052 0.05 0.051 93.4 74.6 37.3
C13.3 0.056 0.053 0.0545 99.2 68.8 34.4
C13.4 0.055 0.056 0.0555 100.8 67.2 33.6
C13.5 0.052 0.053 0.0525 95.9 72.1 36.0
C13.6 0.05 0.051 0.0505 92.6 75.4 37.7
C13.7 0.053 0.052 0.0525 95.9 72.1 36.0
C13.8 0.054 0.055 0.0545 99.2 68.8 34.4
C13.12 0.053 0.054 0.0535 97.5 70.5 35.2
Kontrol
media 0.089 0.088 0.0885 154.9 0.0 0.0
C14.1 0.048 0.05 0.049 90.2 64.7 32.4
C14.2 0.05 0.05 0.05 91.8 63.1 31.5
C14.3 0.051 0.051 0.051 93.4 61.5 30.7
C14.4 0.049 0.05 0.0495 91.0 63.9 32.0
C14.5 0.052 0.051 0.0515 94.3 60.6 30.3
C14.6 0.05 0.048 0.049 90.2 64.7 32.4
C14.7 0.05 0.05 0.05 91.8 63.1 31.5
C14.8 0.054 0.053 0.0535 97.5 57.4 28.7
C14.9 0.049 0.049 0.049 90.2 64.7 32.4
C14.10 0.053 0.053 0.053 96.7 58.2 29.1
C14.11 0.053 0.054 0.0535 97.5 57.4 28.7
C14.12 0.054 0.051 0.0525 95.9 59.0 29.5
C14.13 0.051 0.05 0.0505 92.6 62.3 31.1
C14.14 0.037 0.037 0.037 70.5 84.4 42.2
C14.15 0.054 0.054 0.054 98.4 56.5 28.3
C14.16 0.047 0.046 0.0465 86.1 68.8 34.4
Lanjutan
C15.2 0.052 0.052 0.052 95.1 59.8 29.9
C15.5 0.05 0.052 0.051 93.4 61.5 30.7
C15.6 0.048 0.048 0.048 88.5 66.4 33.2
C15.7 0.053 0.053 0.053 96.7 58.2 29.1
C15.8 0.051 0.053 0.052 95.1 59.8 29.9
C15.9 0.054 0.053 0.0535 97.5 57.4 28.7
C15.10 0.052 0.049 0.0505 92.6 62.3 31.1
C15.11 0.05 0.053 0.0515 94.3 60.6 30.3
C15.12 0.053 0.049 0.051 93.4 61.5 30.7
C16.1 0.048 0.048 0.048 88.5 66.4 33.2
C16.2 0.047 0.047 0.047 86.9 68.0 34.0
C16.3 0.047 0.048 0.0475 87.7 67.2 33.6
C16.4 0.045 0.045 0.045 83.6 71.3 35.6
C16.5 0.047 0.048 0.0475 87.7 67.2 33.6
C16.6 0.048 0.048 0.048 88.5 66.4 33.2
C16.7 0.049 0.049 0.049 90.2 64.7 32.4
C16.8 0.051 0.051 0.051 93.4 61.5 30.7
C16.9 0.052 0.052 0.052 95.1 59.8 29.9
Lampiran 6 Hasil uji identifikasi biokimia API Kit 20NE Isolat C4.7
NO3 = Reduksi nitrat ke nitrit MNE = Penggunaan manosa
TRP = Produksi indol (triptofan) MAN = Penggunaan manitol
GLU = Fermentasi glukosa NAG = Penggunaan N-asetil glukosamin ADH = Dihidrolase arginin MAL = Penggunaan maltosa
URE = Urease GNT = Penggunaan potassium glukonat ESC = Hidrolisi β-glukosidase CAP = Penggunaan asam kaprik
GEL = Hidrolisis protease ADI = Penggunaan asam adipik PNG = β-galaktosidase (4- MLT = Penggunaan malat
nitrofenil-βD- CIT = Penggunaan trisodium sitrat galaktopiranosida) PAC = Penggunaan asam fenilasetat GLU = Penggunaan glukosa OX = Sitokrom oksidase