KARAKTERISTIK PROSES PEMBENTUKAN DAN PRODUK
XILANASE DARI ISOLAT
Streptomyces
sp. TERPILIH
MENGGUNAKAN SUBSTRAT LIMBAH PERTANIAN
SITI ZAKIYATUL KHAMIDAH
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Karakteristik Proses Pembentukan dan Produk Xilanase dari Isolat Streptomyces sp. Terpilih Menggunakan Substrat Limbah Pertanian adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh Pusat Penelitian Bioteknologi LIPI (Laboratorium Biokatalis dan Biofermentasi). Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Januari 2014
ABSTRAK
SITI ZAKIYATUL KHAMIDAH. Karakteristik Proses Pembentukan dan Produk Xilanase dari Isolat Streptomyces sp. Terpilih Menggunakan Substrat Limbah Pertanian. Dibimbing oleh EDY DJAUHARI P dan YOPI.
Tandan kosong kelapa sawit (TKKS) dan bagas merupakan limbah lignoselulosa kaya akan xilan dan belum termanfaatkan secara maksimal. Xilanase dapat menjadi salah satu alternatif pendegradasi xilan. Penelitian ini bertujuan untuk mencari dan memperoleh isolat Streptomyces sp. yang unggul dalam menghasilkan xilanase serta mendapatkan beberapa karakter dari proses pembentukan dan produk xilanase yang diperoleh pada fermentasi substrat limbah pertanian berupa TKKS dan bagas. Parameter yang diukur meliputi waktu inkubasi, tipe, serta bobot molekulnya. Penapisan dilakukan dengan membandingkan indeks xilanolitik keenam isolat Streptomyces sp. Karakterisasi xilanase dilakukan dengan parameter waktu inkubasi, berat molekul dan tipe enzim atau pola hidrolisisnya. Isolat Streptomyces sp. (P3CCA13) adalah isolat terpilih dengan nilai indeks xilanolitik 0.818 (beechwood xylan), 0.500 (TKKS) dan 0.384 (bagas). Aktivitas puncak ketiga substrat tersebut berturut-turut pada waktu inkubasi ke-120 jam (7.5092 U/mL) untuk TKKS, ke-144 jam (5.9831 U/mL) untuk beechwood xylan, dan 192 jam (5.6660 U/mL) untuk substrat bagas. Berdasarkan kromatogram KLT pada produk yang dihasilkannya, xilanase ini diprediksi termasuk dalam endoxilanase dengan Rf=0.7143. Estimasi berat molekul xilanase berada antara 16-47 kDa.
Kata kunci: Streptomyces sp. (P3CCA13), xilanase, xilan, TKKS, bagas
ABSTRACT
SITI ZAKIYATUL KHAMIDAH. Characteristics of Formation Process and Product of Xylanase from Selected Streptomyces sp. Isolate Using Agricultural Waste Substrates. Supervised by EDY DJAUHARI P dan YOPI.
Empty Fruit Bunch (EFB) and bagasse are lignocellulosic waste which rich of xylan. It has not been utilized optimally. Xylanase is alternative of xylan degrading agent. The aim of this research was to find and get the excellent of xylanase producing isolate and get some of the characters from the formation process and product of xylanase obtained on the fermentation of agricultural wastes substrate such as EFB and bagasse. The screening was done by comparing the xylanolytic index of six Streptomyces sp. isolates. Crude xylanase was analyzed by many parameters (incubation time, molecular weight, and type). Streptomyces sp. (P3CCA13) isolate was selected isolates with an xylanolitic index 0.818 (beechwood xylan), 0.500 (EFB) and 0.384 (bagasse). The highest xylanase activity on EFB, beechwood xylan and bagasse substrates are at incubation time 120 hours (7.5092 U/mL), 144 hours (5.9831 U/mL), and 192 hours (5.6660 U/mL). Based on TLC chromatogram of its products, this xylanase was predicted as endoxylanase (Rf=0.7143). The molecular weight of this xylanase was estimated between 16 to 47 kDa.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
SITI ZAKIYATUL KHAMIDAH
KARAKTERISTIK PROSES PEMBENTUKAN DAN PRODUK
XILANASE DARI ISOLAT
Streptomyces
sp. TERPILIH
Judul Skripsi : Karakteristik Proses Pembentukan dan Produk Xilanase dari Isolat Streptomyces sp. Terpilih Menggunakan Substrat Limbah Pertanian
Nama : Siti Zakiyatul Khamidah NIM : G84090042
Disetujui oleh
Drs Edy Djauhari P, MSi Pembimbing I
Dr Yopi, MEng Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wata’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan Februari 2013 ini adalah Karakteristik Proses Pembentukan dan Produk Xilanase dari Isolat Streptomyces sp. Terpilih Menggunakan Substrat Limbah Pertanian.
Terima kasih penulis ucapkan kepada Drs Edy Djauhari P, MSi dan Dr Yopi, MEng selaku pembimbing, serta mba Nanik Rahmani yang telah banyak memberi saran. Rasa terima kasih penulis sampaikan kepada semua staf dan keluarga di Laboratorium Biokatalis dan Biofermentasi dan semua pihak di bidang Bioteknologi LIPI yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada abah, ibu, kakak, keluarga di Brebes, seluruh keluarga besar di Biokimia, Al Hurriyyah, Tsabat Arsy, Program Kakak Asuh (ProKA), Al iffah, RQ dan FLP atas segala doa dan kasih sayangnya. Semoga karya ilmiah ini bermanfaat, terutama untuk pengembangan ilmu biokimia.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR GAMBAR Vi
DAFTAR LAMPIRAN Vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Prosedur Analisis Data 2
HASIL DAN PEMBAHASAN 5
Hasil 5
Pembahasan 8
SIMPULAN DAN SARAN 11
Simpulan 11
Saran 11
DAFTAR PUSTAKA 11
LAMPIRAN 14
DAFTAR GAMBAR
1 Pembentukan zona bening Isolat Streptomyces sp. (P3CCA13) 5 2 Pengaruh waktu inkubasi terhadap pertumbuhan sel dan aktivitas
ekstrak kasar xilanase pada fermentasi substrat (a) beechwood xylan (b) TKKS (c) bagas
6 3 Profil Elektroforegram ekstrak kasar xilanase 7 4 Profil Kromatogram produk ekstrak kasar xilanase 7
DAFTAR LAMPIRAN
1 Diagram alir penelitian 14
PENDAHULUAN
Sektor pertanian merupakan sektor yang mempunyai peranan strategis dalam struktur pembangunan perekonomian nasional. Indonesia sebagai negara tropis dengan biodiversitas yang tinggi memiliki potensi yang kuat di sektor pertanian. Adanya peningkatan dalam sektor ini tidak luput dari limbah yang dihasilkannya. Sebagian besar limbah pertanian merupakan limbah berlignoselulosa yang banyak disusun oleh xilan. Xilan merupakan polisakarida yang termasuk hemiselulosa penyusun dinding sel tanaman. Sebagian besar xilan terdiri atas 2-4 heteroglikan. Heteroglikan yang umum dijumpai adalah arabino-D-xilan, L-arabino-arabino-D-xilan, 4-o-metil-D-glukorono-arabino-D-xilan, L-arabino-arabino-D-xilan, D-gluko-D-mannan, D-galakto-D-gluko-D-mannan, dan L-arabino-D-galaktan. Biomassa TKKS dan bagas (ampas tebu) merupakan biomassa yang memiliki banyak keunggulan. Hal ini tercermin dalam kandungan hemiselulosa yang cukup tinggi yaitu lebih dari 20%, harga yang sangat ekonomis dengan ketersediaan yang melimpah serta bersifat ramah lingkungan sehingga berpotensi tinggi untuk dikembangkan dalam skala yang lebih besar sebagai sumber xilan (Saha 2003; Omi 2011).
Degradasi sempurna xilan merupakan proses multi tahap yang melibatkan aktivitas beberapa enzim hidrolitik yang bekerja secara sinergis, yaitu; endo -1.4-xilanase, -1.4-xilosidase, α-L-arabinofuranosidase, α-glukuronidase dan asetil esterase (Yang et al. 2006). Aplikasi bioteknologi xilanase semakin berkembang pesat seperti dalam industri pulp dan kertas. Xilanase dapat mereduksi penggunaan alkalin dan klorin yang digunakan sebagai agen pemutih kertas. Sedangkan di industri makanan, enzim ini digunakan untuk mempercepat proses pemanggangan kue, roti dan makanan lainnya dengan membantu pemecahan polisakarida dalam adonan (Subramaniyan dan Prema 2002). Xilanase digunakan untuk menurunkan viskositas pada pakan sehingga meningkatkan kecernaan ternak (Breccia et al. 1998). Selain itu hasil hidrolisis xilan juga digunakan dalam pembuatan tablet, pemanis buatan rendah kalori (Kulkarni et al. 1999).
Beberapa kelompok mikroorganisme telah diketahui sangat berpotensi menghasilkan xilanase, diantaranya kelompok aktinomisetes, khususnya dari genus Streptomyces sp. (Sunna dan Antranikian 1997). Pusat pengembangan mikrobiologi Indonesia Culture Collection (InaCC) memiliki banyak koleksi aktinomisetes genus Streptomyces sp. (LIPI 2013). Penelitian ini menggunakan enam isolat dari koleksi InaCC yang berkode ID05-108, P5CCA2, P3CCA6, P5CCA5, P3CCA11, dan P3CCA13 untuk dilakukan penapisan sebagai isolat penghasil xilanase yang unggul dan dikarakterisasi enzimnya.
2
pemanfaatan TKKS dan bagas. Selain itu juga diharapkan dapat meningkatkan nilai ekonomi dari kedua biomassa ini, serta dapat memberikan khazanah baru untuk penelitian-penelitian selanjutnya terkait xilanase, mikroba penghasil xilanase dan pengembangan substrat xilan dari biomassa lainya.
METODE
Bahan
Bahan yang digunakan adalah isolat Streptomyces sp. (ID05-108, P5CCA2, P3CCA6, P5CCA2, P3CCA11, P3CCA13), ekstrak malt 1%, ekstrak khamir
pekat, fenol, n-butanol, larutan pewarna gula. Alat
Alat-alat yang digunakan adalah autoklaf, magnetic stirer, neraca analitik, ice maker, inkubator goyang, lemari pendingin, waterbath, oven, laminar air flow, sentrifugator, UV-Vis spektrofotometer (Spectronic 21D, USA), hotplate, tabung vial (Eppendorf), pipet mikro, labu takar, tabung reaksi, gelas beker, labu Erlenmeyer, vortex, pH meter JENWAY, perangkat Kromatografi Lapis Tipis (KLT) dan perangkat elektroforesis SDS-PAGE (BIO RAD).
Prosedur Analisis Data Penapisan Isolat Streptomyces sp. Penghasil Xilanase
Keenam isolat Streptomyces sp. (ID05-108, P5CCA2, P3CCA6, P5CCA2, P3CCA11, dan P3CCA13) dilakukan penapisan dengan pengujian zona bening menggunakan congo red sebagai parameter kualitatif. Langkah-langkahnya adalah isolat yang sudah ditumbuhkan dalam media ISP2 (ekstrak malt 1%, ekstrak khamir 0.4%, glukosa 0.4%, agar 1.5% dan akuades) padat mengandung beechwood xylan 0.5% kemudian disiram dengan larutan congo red 0.2% pada suhu ruang selama 15 menit, lalu dibilas dengan larutan NaCl 0.5% selama 10 menit. Adanya zona bening di sekitar isolat menandakan bahwa isolat dapat menghasilkan xilanase. Setelah itu, isolat yang menghasilkan zona bening terbaik dilakukan pengujian zona bening dengan ditumbuhkan pada media ISP2 padat mengandung substrat kasar TKKS dan bagas 0.5% serta karakterisasi lebih lanjut. Penentuan Waktu Tertinggi Produksi dan Aktivitas Xilanase
3 diinokulasikan dalam 5 mL media ISP2 cair mengandung 0.5% masing-masing substrat (beechwood xylan, TKKS, dan bagas) sebagai prekultur, difermentasi dengan kondisi suhu 27 oC dengan kecepatan 150 rpm selama 24 jam. Lalu dipindahkan ke dalam 95 mL media ISP2 cair sebagai kultur, difermentasi dengan kondisi suhu 27 oC dengan kecepatan 150 rpm, kemudian dilakukan pengambilan sampel pada waktu inkubasi 24, 48, 72, 96, 120, 144, 168 dan 192 jam. Sampel diukur Optical Density (OD)-nya untuk membuat kurva pertumbuhan dengan mengukurnya pada panjang gelombang ( ) 660 nm pada pengenceran 10x. Ekstrak kasar xilanase diisolasi dari hasil pengambilan sampel dengan teknik sentrifugasi pada kecepatan 15000 rpm 15 menit 4 oC sebanyak 2 kali sampai tidak ada endapan. Supernatan diambil sebagai filtrat enzim. Selanjutnya sampel diukur aktivitasnya untuk menentukan waktu produksi xilanase terbaik.
Setelah itu dilakukan pengukuran aktivitas ekstrak kasar xilanase menggunakan metode DNS (Miller 1959). Analisis aktivitas xilanase dapat dilakukan dengan dua tahap, yaitu pembuatan kurva standar xilosa dan penentuan aktivitas xilanase sampel. Langkah-langkah pembuatan kurva standar xilosa adalah sebagai berikut: Larutan standar xilosa dibuat dari rentang 0-300 ppm dengan selang 20 ppm. Langkah pembuatanya diawali dengan pembuatan larutan stok 1000 ppm dengan melarutkan 0.01 g xilosa ke dalam 10 mL mili pure. Kemudian larutan stok diencerkan menjadi beberapa variasi konsentrasi (0, 20, 40, 60, 80, 100, 120, 140, 160, 180, 200, 220, 240, 260, 280, 300) ppm. Selanjutnya masing-masing larutan diambil sebanyak 500 L dan ditambahkan 750 L DNS lalu dipanaskan pada suhu 100 oC selama 15-20 menit, didinginkan, divortex kembali dan diukur pada 540 nm.
Langkah selanjutnya adalah penentuan aktivitas xilanase sampel. Analisis ini dilakukan menggunakan substrat xilan komersil (beechwood xylan). Langkah-langkah yang harus dilakukan adalah dengan mempersiapkan substrat, sampel, kontrol, pengenceran enzim dan blanko. Sebanyak 0.1 g beechwood xylan dilarutkan dalam 20 mL buffer fosfat pH 7.0 kemudian diaduk dengan magnetic stirrer sampai homogen. Sampel disiapkan dengan mengisi β50 L substrat lalu
ditambahkan β50 L ekstrak kasar enzim yang sudah diencerkan 100x lalu divortex hingga homogen. Total reaksi substrat dan enzim adalah 30 menit,
kemudian ditambahkan 750 L Dinitrocalycilic acid (DNS) dan divortex hingga homogen. Reaksi antara substrat, enzim, dan DNS harus dilakukan di suhu ruang, demikian pula dengan waktu penambahan enzim dan DNS harus seragam pada semua sampel. Enzim harus selalu dalam keadaan dingin (suhu dibawah 0 oC) untuk mencegah kerusakan. Selanjutnya sampel dipanaskan dalam waterbath suhu 100 oC selama 20 menit, didinginkan dan diukur pada spektrofotometer dengan 540 nm.
Langkah pembuatan kontrol dilakukan sebagai berikut. Sebanyak β50 L substrat pada tabung reaksi lalu ditambahkan 750 L DNS, divortex hingga homogen. Kemudian ditambahkan β50 L ekstrak kasar enzim yang sudah diencerkan. Penambahan DNS sebelum enzim bertujuan untuk menghalangi enzim berikatan dengan substrat. Setelah itu dilakukan pemanasan dalam waterbath suhu 100 oC selama 20 menit, hal ini bertujuan untuk menginaktivasi enzim sesegera mungkin saat bereaksi dengan komplek substrat-DNS. Kemudian
didinginkan dan diukur pada spektrofotometer dengan 540 nm. Blanko
4
divortex hingga homogen, setelah itu dipanaskan dalam waterbath suhu 100 oC
selama β0 menit, didinginkan dan diukur pada spektrofotometer dengan 540 nm.
Hasil pengukuran aktivitas xilanase dan laju pertumbuhan sel digabungkan untuk dibuat grafik hubungan diantara keduanya.
Penentuan Berat Molekul dengan SDS-PAGE
Analisis ini berdasarkan Rawashdeh et al. (2005). Sampel terlebih dahulu dilakukan presipitasi dengan TCA. Hal ini bertujuan untuk memekatkan sampel sehingga dapat memunculkan pita pada SDS-PAGE. Langkah-langkah dilakukan
adalah sebagai berikutμ Sebanyak 1 mL sampel ditambahkan β50 L TCA 100%.
Kemudian diinkubasi pada suhu 4 oC selama 10 menit. Sampel lalu disentrifus dengan kecepatan 5000 rpm, suhu 4 oC selama 5 menit sebanyak 3 kali. Setiap kali sentrifus, supernatan harus dibuang dan pelet harus ditambahkan β00 L aseton dingin. Selanjutnya pada hasil sentrifus yang ke-3, pelet ditambahkan 30
L bufer sampel dan diinkubasi pada suhu 95 oC selama 10 menit.
Gel yang digunakan terdiri atas dua bagian, yaitu gel atas (stacking gel) dan gel bawah (running gel). Proses pembuatan running gel dilakukan dengan cara mencampurkan 4.74 mL akuades, 2.5 mL tris HCl pH 8.8, 0.1 mL SDS 10%, dan 2.5 mL bis-akrilamida. Kemudian ditambah 0.15 mL APS 10%, dan 0.015 mL TEMED sambil digoyang perlahan. Running gel yang masih cair tersebut dimasukkan ke dalam kaca cetakan setinggi batas atas. Selanjutnya, bagian atas kaca cetakan yang kosong diisi dengan stacking gel yang dibuat dengan cara mencampurkan 3.1 mL akuades, 1.26 mL tris HCl pH 6.8, 0.05 mL SDS 10%, dan 0.5 mL bis-akrilamida. Setelah itu, ditambahkan 0.075 mL APS 10% dan 0.015 mL TEMED.
Kemudian sisiran pembuat sumur dimasukkan ke dalam cetakan. Gel dibiarkan sampai membeku. Setelah sisiran diangkat, sumur-sumur tercetak sesuai dengan jumlah gerigi pada sisiran sebagai tempat sampel, yang selanjutnya dipasang pada alat elektroforesis. Selanjutnya sampel dimasukan ke dalam sumur. Marker protein yang digunakan adalah protein rekombinan (10-250 kDa) dari produk Bio-Rad. Bufer elektrode lalu dimasukkan ke dalam alat elektroforesis dan dirunning dengan tegangan 10 mAmp selama 1 jam dan 20 mAmp selama 2 jam. Lalu dihentikan setelah sampel sampai kurang lebih pada ujung gel. Setelah itu, gel dilepaskan dari cetakan dan dilakukan pewarnaan dengan merendam gel ke dalam larutan staining selama sejam. Larutan ini dibuat dengan melarutkan 0.5 g Coomasie Briliant Blue (CBB), 150 mL metanol, 50 mL asam asetat glasial ke dalam 300 mL akuades. Setelah itu gel dibilas sampai bening dengan larutan destaining yang dibuat dengan melarutkan 150 mL metanol, 50 mL asam asetat glasial ke dalam 300 mL akuades. Gel yang sudah bersih diawetkan dalam lemari es. Penghitungan berat molekul dilakukan dengan membandingkan antara berat molekul sampel dan marker.
Analisis Kromatografi Lapis Tipis (KLT)
5 Jarak penandaan antar sampel adalah 0.3 cm. Kemudian sebanyak 1 L sampel ditotolkan pada plat KLT menggunakan pipet mikro sebanyak 4 kali. Eluen yang digunakan adalah campuran n-butanol, asam asetat, dan akuades dengan perbandingan 2:1:1. Eluen dijenuhkan selama 60 menit. Setelah penandaan selesai, plat KLT dimasukkan ke dalam chamber yang berisi eluen jenuh dan proses elusi dimulai hingga mencapai garis finish. Setelah elusi selesai, plat KLT diangkat dan dikeringkan menggunakan hair dryer dalam lemari asam. Plat KLT disemprot dengan larutan pewarna gula yaitu campuran 0.β g α-difenilamin, 10 mL aseton, 1.5 mL asam fosfat, dan 0.2 mL anilin. Setelah kering, plat KLT dimasukkan ke dalam oven dengan suhu 120 oC sampai spot terlihat di permukaan plat, spot yang terbentuk diamati. Waktu retensi atau Retention factor (Rf) dapat dihitung dengan cara sebagai berikut:
Rf =
HASIL DAN PEMBAHASAN
Hasil
Xilanase dari Isolat Terpilih (Streptomyces sp. (P3CCA13))
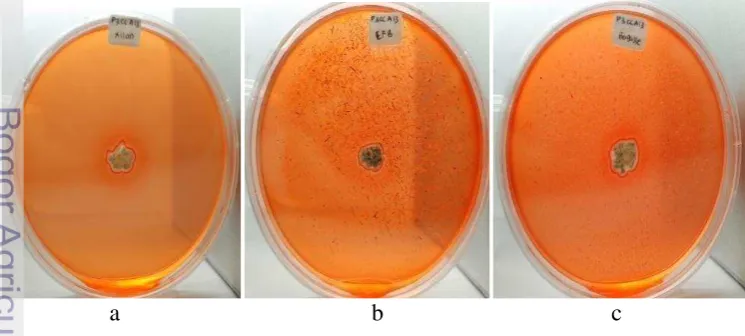
Hasil penapisan keenam isolat Streptomyces sp. diperoleh isolat Streptomyces sp. (P3CCA13) sebagai isolat terpilih penghasil xilanase. Hal ini dibuktikan dari pembentukan zona bening dengan indeks xilanolitik terbesar dari keenam isolat (0.818). Isolat Streptomyces sp. (P3CCA13) ini juga dapat menghasilkan zona bening di dua jenis substrat kasar (TKKS dan bagas) dengan indeks xilanolitik 0.500 (TKKS) dan 0.384 (bagas). Zona bening terlihat membentuk gradasi dari warna merah ke jingga terang. Isolat yang ditumbuhkan pada media yang mengandung substrat beechwood xylan terlihat membentuk zona bening bergradasi merah-jingga yang lebih jelas dibandingkan pada substrat TKKS dan bagas (Gambar 1).
a b c
6
Waktu Produksi dan Aktivitas Tertinggi Ekstrak Kasar Xilanase
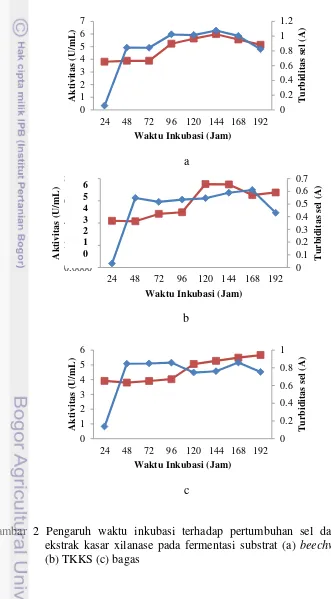
Produksi xilanase oleh isolat Streptomyces sp. (P3CCA13) pada ketiga jenis substrat (beechwood xylan, TKKS dan bagas) memiliki waktu produksi tertinggi yang berbeda-beda. Aktivitas tertinggi xilanase pada substrat beechwood xylan tercapai saat umur kultur 144 jam (5.9831 U/mL). Selanjutnya pada substrat TKKS tercapai saat umuur kultur 120 jam (7.5092 U/mL), sedangkan pada substrat bagas tercapai pada saat umur kultur 192 jam (5.6661 U/mL) (Gambar 2).
a
b
c
7 Profil Elektroforegram Ekstrak Kasar Xilanase
Ekstrak kasar xilanase tampak memiliki 5 pita protein (estimasi 73, 60, 45, 35, dan 30 kDa) pada substrat beechwood xylan, 4 pita (estimasi 72, 60, 42, dan 28 kDa) pada substrat TKKS, dan 6 pita (estimasi 250, 60, 47, 32, 25, dan 16 kDa) pada substrat bagas (Gambar 3).
a b c d
Gambar 3 Elektroforegram ekstrak kasar xilanase dengan presipitasi TCA (a) substrat Beechwood xylan (b) substrat TKKS (c) substrat bagas (d) marker
Profil Kromatogram Produk Ekstrak Kasar Xilanase
Kromatogram produk dari ekstrak kasar xilanase ini menampilkan adanya kesejajaran spot antara sampel dengan substrat (beechwood xylan, TKKS, bagas) dan standar (xilosa) (Gambar 4). Nilai Rf ketiga sampel sama dengan standar yaitu 0.7143.
a b c d
Gambar 4 Kromatogram produk ekstrak kasar xilanase dari berbagai substrat (a) standar xilosa (b) bagas (c) TKKS (d) beechwood xylan
8
Pembahasan
Penapisan Isolat Streptomyces sp. Penghasil Xilanase dan Isolat Terpilih (Streptomyces sp. (P3CCA13))
Penapisan isolat Streptomyces sp. sebagai penghasil xilanase dilakukan dengan menggunakan pengujian zona bening. Zona bening merupakan hasil dari reaksi kromogenik antara aktivitas enzim dan zat pewarna (dye) (Woo et al. 2009). Adanya zona bening yang tampak terlihat di sekitar isolat, hal ini membuktikan bahwa isolat ini mampu mendegradasi substrat dalam media berupa xilan. Akan tetapi masing-masing isolat menghasilkan zona bening dengan luas yang berbeda-beda. Isolat Streptomyces sp. (P3CCA13) menghasilkan zona bening yang terluas dengan nilai indeks xilanolitik 0.818. Isolat terpilih ini juga dapat menghasilkan zona bening pada media dengan substrat kasar TKKS dan bagas.
Mekanisme kerja congo red adalah mengikat polisakarida. Saat isolat mengeluarkan enzim untuk mendegradasi polisakarida dalam substrat, maka akan terbentuk monomer atau oligomer penyusunnya seperti xilosa dan xilooligosakarida sehingga zona bening akan terbentuk di media sekitar isolat karena congo red tidak berikatan lagi dengan polisakarida (Kurrataa’yun β01γ).
Berdasarkan Gambar 1, menurut Yoon et al. (2007), gradasi warna tersebut membuktikan bahwa Streptomyces sp. (P3CCA13) ini menghasilkan lebih dari satu enzim. Warna zona bening yang semakin terang menunjukkan degradasi xilan yang semakin sempurna dan diduga memiliki xilosidase. Perbedaan warna juga menunjukkan adanya perubahan pH pada media. Warna biru menunjukkan pH 3.0, warna merah-ungu menunjukkan pH 5.0, dan warna jingga menunjukkan pH 7.0-8.0. Sebagai contoh yaitu pada kasus fungi, selulosa didegradasi pertama kali menjadi selobiosa kemudian menjadi glukosa dan pada akhirnya glukosa dimetabolisme menjadi asam-asam organik. Asam-asam ini disekresi oleh fungi pada pH media yang rendah sehingga media congo red berubah warna dari merah-orange ke abu-abu cerah, dengan ungu cerah atau biru cerah (Sik et al. 2009). Berdasarkan hasil tersebut, dapat diketahui bahwa pH media relatif normal.
Waktu Produksi dan Aktivitas Tertinggi Ekstrak Kasar Xilanase
Waktu produksi dan aktivitas tertinggi xilanase merupakan waktu saat aktivitas xilanase mencapai puncak tertinggi. Saat kultur berumur 24 jam (memasuki fase eksponensial), xilanase sudah menunjukkan nilai aktivitas yang tinggi di ketiga jenis substrat yaitu 3.8064 U/mL (beechwood xylan), 4.2064 (TKKS), dan 3.9164 (bagas). Hal ini diduga xilanase sudah diinduksi pada saat fermentasi tahap pre kultur. Xilanase tergolong sebagai metabolit primer karena dibutuhkan dalam pemecahan sumber karbon xilan pada substratnya untuk kebutuhan pertumbuhannya, sehingga diproduksi sejak awal pertumbuhannya (fase lag)
(Kurrataa’yun β01γ).
9 itu aktivitas mengalami penurunan seiring dengan sel memasuki fase kematian. Lain hal nya dengan substrat beechwood xylan dan bagas, aktivitas xilanase pada kedua substrat ini memiliki nilai yang mirip. Aktivitas pada substrat beechwood xylan tampak mulai mengalami kenaikan pada inkubasi ke-48 jam yaitu fase stasioner, dan pada puncaknya yaitu inkubasi ke-120 jam (5.9831 U/mL). Pada substrat bagas, aktivitas tampak mulai mengalami kenaikan pada inkubasi ke-72 jam (fase stasioner) dan terus mengalami kenaikan sampai pada akhir inkubasi (5.6660 U/mL).
Secara umum aktivitas xilanase pada substrat TKKS menunjukkan nilai yang lebih tinggi dibandingkan dengan substrat lainnya di setiap waktu inkubasi walaupun kandungan xilannya relatif lebih rendah dari beechwood xylan. Hal ini dimungkinkan karena faktor lingkungan (media) dan ukuran partikel substrat. Isolat dengan mudah mendegradasi xilan murni menggunakan xilanase tanpa gangguan yang berarti. Pada TKKS, biomassa ini memiliki struktur yang kompleks sehingga memicu produksi xilanase lebih banyak. Sedangkan pada bagas, walaupun substrat ini memiliki kandungan hemiselulosa yang mirip dengan TKKS (23-24%) akan tetapi kemungkinan kandungan xilannya lebih sedikit dari TKKS sehingga aktivitas xilanasenya lebih mirip dengan aktivitas xilanase pada beechwood xylan. Beberapa xilanase memiliki waktu inkubasi optimum yang berbeda, seperti xilanase dari Streptomyces sp. (234P-16) dengan waktu inkubasi optimum 96 jam (0.423 U/mL), 168 jam (0.917 U/mL) pada Streptomyces sp. (45I-3), dan 216 jam (1.000 U/mL) pada Streptomyces sp. (SKK1-8) (Hendarwin 2005). Berdasarkan data-data ini dapat dikatakan bahwa isolat Streptomyces sp. (P3CCA13) mampu menghasilkan ekstrak kasar xilanase dengan aktivitas yang tinggi.
Komposisi Protein Ekstrak Kasar Xilanase Selama Proses Hidrolisis
Analisis Sodium dodecyl sulphates-polyacrylamide gel electrophoresis (SDS-PAGE) merupakan metode yang banyak digunakan untuk analisis sampel biologis, karena kemampuannya dalam memisahkan campuran protein yang kompleks (Mikkelsen dan Corton 2004). Penggunaan SDS-PAGE dalam analisis ini memungkinkan pendugaan keberadaan xilanase dari berat molekulnya. Hasil visualisasi SDS-PAGE (Gambar 3) secara umum menunjukkan adanya kemunculan pita dan komposisi protein pada semua substrat dengan berat molekul beragam selama proses hidrolisis xilan walaupun penampakanya kurang jelas. Kemunculan pita tersebut belum dapat menentukan jenis protein di dalamnya. Pengujian lebih lanjut seperti analisis zimografi perlu dilakukan untuk mengetahui secara spesifik jenis protein yang muncul didalam sampel.
Ekstrak kasar xilanase pada substrat beechwood xylan dan TKKS tampak memiliki pita-pita protein yang tipis dengan persebaran yang cukup merata. Sedangkan pada substrat bagas pita-pita protein tampak lebih tebal dan menyebar acak. Perbedaan sebaran pita ini diduga disebabkan oleh komponen protein yang terlalu beragam, baik protein enzim seperti selulase dan berbagai macam hemiselulase maupun protein lainnya seperti protein yang terkandung dalam media.
10
berat molekul beberapa isolat penghasil xilanase, diantaranya Streptomyces sp. (21-50 kDa), Aeromonas sp. (22-58 kDa), Clostridium sp. (29-72 kDa), Trichoderma sp. (1.8-32 kDa), dan Aureobasidium sp. (20-25 kDa). Wateewuthajarn dan Pairoh (2000) menyatakan dua xilanase asal Streptomyces sp. PC22 diestimasikan memiliki berat molekul 5 dan 30 kDa. Selain itu, Ratna dewi et al. (2007) juga mengatakan bahwa enzim endoxilanasenya yang berasal dari bakteri sistem intestinal rayap memiliki berat molekul berkisar antara 45-66.2 KDa. Berdasarkan data ini, xilanase dalam ketiga sampel diduga berada pada pita protein dengan berat molekul antara 16-47 kDa.
Mekanisme Hidrolisis Xilan oleh Ekstrak Kasar Xilanase
Berdasarkan kromatogram produk xilanase (Gambar 4), hal ini menggambarkan mekanisme hidrolisis xilan oleh ekstrak kasar xilanase. Ketiga sampel dengan substrat masing-masing (beechwood xylan, TKKS dan bagas) memperlihatkan adanya tiga spot berurutan yang saling sejajar. Spot pertama (dihitung dari titik penotolan) tampak lebih jelas dan tegas dibandingkan dengan kedua spot berikutnya. Spot ketiga menunjukkan adanya kesejajaran dengan standar (xilosa) sehingga nilai Rf ketiganya sama yaitu 0.7143. Hal ini membuktikan bahwa di dalam media sudah terdapat xilosa yang merupakan produk dari degradasi xilan oleh ekstrak kasar xilanase. Sedangkan spot lainnya diduga adalah gula-gula lain yang terdapat dalam sampel seperti xilooligosakarida yang berat molekulnya lebih tinggi dibandingkan xilosa.
Pratiwi (2006) menyebutkan bahwa Rf xilosa yang dihasilkannya berkisar antara 0.73-0.81. Adapun produk xilanase dari beberapa isolat (234P-16, SKK1-8, 45I- 3) baik menggunakan oat spelt xylan ataupun xilan tongkol jagung memiliki nilai Rf 0.64-0.65 pada hampir seluruh waktu inkubasi (jam ke 0-5). Sehingga dapat dikatakan produk xilanase isolat Streptomyces sp. (P3CCA13) memiliki Rf yang baik, karena sejajar pada spot xilosa walaupun tidak begitu jelas. Hal ini disebabkan oleh konsentrasi xilosa yang kecil di dalam sampel.
11 SIMPULAN DAN SARAN
Simpulan
Isolat Streptomyces sp. (P3CCA13) adalah isolat yang unggul dibandingkan kelima isolat lainnya dalam menghasilkan xilanase. Isolat ini mengalami fase lag diduga saat fermentasi tahap pre kultur. Xilanase sudah menunjukkan nilai aktivitas yang tinggi di ketiga jenis substrat pada saat kultur berumur 24 jam. Secara umum aktivitas xilanase pada substrat TKKS menunjukkan nilai yang lebih tinggi dibandingkan dengan substrat lainnya ditiap waktu inkubasi. Aktivitas puncak pada ketiga substrat tersebut adalah inkubasi ke- 120 jam (7.5092 U/mL) untuk TKKS, inkubasi ke-144 jam (5.9831 U/mL) untuk substrat beechwood xylan, dan akhir inkubasi yaitu 192 jam (5.6660 U/mL) untuk substrat bagas. Xilanase ini diprediksi termasuk dalam tipe endoxilanase, dengan pola hidrolisis acak dari bagian dalam molekul xilan. Estimasi berat molekul xilanase berada antara 16-47 kDa.
Saran
Hal-hal yang disarankan untuk dilakukan pada penelitian ini diantaranya adalah pemurnian ekstrak kasar enzim agar didapatkan xilanase yang murni. Kemudian penambahan parameter karakterisasi seperti pH dan suhu optimum, stabilitas terhadap waktu pemanasan, pengaruh ion logam dan senyawa inhibitor untuk mendapatkan ciri yang lebih spesifik terhadap xilanase jenis ini. Selanjutnya analisis zimografi dan SDS-PAGE spesifisitas substrat juga perlu dilakukan untuk lebih memastikan bobot xilanase yang terdapat didalam sampel serta mengetahui jenis dari xilanase serta keragaman substratnya. Terakhir yaitu studi mengenai pengaplikasian enzim xilanase juga untuk melihat potensinya dalam kehidupan sehari-hari khususnya di dunia industri.
DAFTAR PUSTAKA
Breccia JD, Mattiasson B, Sineriz F. 1998. Separation of bacterial xylanase by precipitation using eudragit S100. J Biotechnol. 61: 219-223.
Chen CC, Adolphson R, Dean JFD, Erikson KEL, Adam MWE, Westpheling j. 1997. Release of lignin from kraft pulp by a hyperthermophilic from kraft pulp by a hyperthermophilic xylanase from Thermotoga maritime. Enz Microb Technol. 20: 39-45.
Eisenthal R, Peterson ME, Daniel RM, Danson MJ. 2006. The thermal behaviour of enzymes: implications for biotechnology. Trends Biotechnol. 24(7):289-292. doi:10.1016/j.tibtech.2006.05.04.
Gandjar I. 2006.Mikologi Dasar dan Terapan. Jakarta : Yayasan Obor Indonesia. Hanson LE, Howell CR. 2004. Elicitors of plant defense responses from
biocontrol strains of Trichoderma virens. Phytopathology. 94: 171-176.
12
Kulkarni N, Abhay S, Mala R. 1999. Molecular and biotechnological aspects of xylanases. FEMS Microbiol Rev. 23(4):411-456.
Kurrataa’yun. β01γ. Isolasi dan karakterisasi xilanase dari bakteri asal tanah hutan
taman nasional Bukit Dua belas, Jambi, Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Lin X, Inglis GD, Yanke LJ, Cheng KJ. 1999. Selection and characterization of feather degrading bacteria from canola meal compost. J Indust Microbiol and biotech. 23 (2): 149-153.
Lehninger AL. 1982. Dasar-Dasar Biokimia. Jilid ke-2. Thenawijaya M, Penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: Biochemsitry 2nd edition. [LIPI]. 2013. Pengembangan fasilitas koleksi biakan mikroorganisme InaCC.
[Internet]. [16 Maret 2013]. Tersedia pada:
http://www.biotek.lipi.go.id/index.php/research-a-development/137-research- 2009/694-pengembangan-fasilitas-koleksi-biakan-mikroorganisme-inacc--dipa-2009.
Mikkelsen dan Corton. 2004. Bioanalytical Chemistry. New Jersey (US) : J Wiley. Miller GL. 1959. Using of dinitrocalicylic acid reagent for determination of
reducing sugar. Anal Chem. 31: 426-428.
Muawanah A. 2006. Produksi enzim xilanase termostabil dari Thermomyces lanuginosus IFO 150 pada substrat bagas tebu [tesis]. Bogor (ID): Institut Pertanian Bogor.
Oakley AJ, Heinrich T, Thompson CA, Wilce MC. 2003. Characterization of a family 11 xylanase from Bacillus subtilis B230 used for paper bleaching. Acta Crystallogr. 4:627-636.
Omi N. 2011. Biomassa tandan kosong kelapa sawit (TKKS) sebagai adsorben ion logam Cd2+[skripsi]. Depok(ID): Universitas Indonesia.
Pelczar MJ Jr, Chan ECS. 2006. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, Penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology. p 323.
Ponambalan AS, Deepthi RS, Gosh AR. 2011. Qualitative display and measurement of enzyme activity of isolated cellulolytic bacteria, Biotechnol Bioinf Bioeng. 1(1): 33-37.
Pratiwi FMR. 2006. Produksi xilanase dari Streptomyces sp. pada substrat xilan tongkol jagung [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rawashdeh R, Ismail S, Amjad M. 2005. Effect of cultural conditions on xylanase production by Streptomyces sp. (strain Ib 24D) and its potential toutilize tomato pomace. African J Biotechnol. 4 (3): 251-255.
Ratnadewi I, Wuryanti H, Ni Nyoman TP. 2007. Produksi dan karakterisasi enzim -endoxilanase dari bakteri sistem intestinal rayap. J Ilmu Dasar. 8(2) : 110-117.
Richana N. 2002. Produksi dan prospek enzim xilanase dalam pengembangan bioindustri di Indonesia. Buletin Agrobio. 5(1): 29-36.
Sadikin M. 2002. Biokimia Enzim. Jakarta: Widya Medika.
Saha B. 2003. Hemicellulose bioconversion. J Ind Microbiol Biotechnol. 30:279-291.
13 Sidik A, Linar ZU, Safri I. 2011. Produksi poli- -asam glutamat dari Bacillus subtillis B112 dengan variasi konsentrasi ammonium sulfat sebagai sumber nitrogen dalam media fermentasi. Sains dan Terapan Kimia. 5 (1): 45-55. Sik JW, Soon HB, Doo HC, So DP, Young BY dan Seung CP. 2009. Optimal
medium condition for the detection of cellulolytic activity in Ganodema lucidum. J Micobiol. 37(4): 313–316.
Subramaniyan S, Prema P. 2002. Biotechnology of microbial xylanases: enzymology, molecular biology and application. Crit Rev Biotechnol. 22(1): 33-46.
Sunna A, Antranikian G. 1997. Xylanolytic enzyme from fungi and bacteria. Crit Rev in Biotechnol. 17 (1): 39-67.
Wateewuthajarn K, Pairoh P. 2000. Purification and characterization of xylanases from Streptomyces sp. PC22. J Sci Res Chula Univ. 25(2):245-258.
Yang R, Xu S, Wang Z, dan Wang W. 2005. Aqueous extraction of corncob xylan and production of xylooligosaccharides. Swiss Soc Food Sc Technol. 38:677-682.
Yang Y, Biedendieck R, Wang W, Gamer M, Malten M, Jahn D, Deckwer. 2006. High yield recombinant penicillin G amidase production and export into the growth medium using Bacillus megaterium. Microb Cell Fact. 20(10):1-8.doi:10.1186/1475-2859-10-20.
14
Lampiran 1 Diagram alir penelitian
Penentuan waktu produksi dan aktivitas tertinggi xilanase
Enam isolat Streptomyces sp.
Analisis kromatografi lapis tipis (KLT) Penentuan berat molekul menggunakan SDS-PAGE
Penapisan isolat Streptomyces sp. dengan membandingkan indeks xilanolitik
15 Lampiran 2 Hasil penapisan kelima isolat Streptomyces sp.
1 2 3
4 5 No Nama isolat Diameter
zona bening (cm)
Diameter isolat (cm)
Indeks xilanolitik
1 ID05-108 0.50 0.35 0.428
2 P5CCA2 0.60 0.45 0.333
3 P3CCA6 1.25 1.10 0.136
4 P5CCA5 0.65 0.40 0.625
5 P3CCA11 1.00 0.80 0.250
Contoh perhitungan Isolat ID05-108
Indeks xilanolitik =
=
18
120 Bagas 1 0.607 6.07 7.613300 1.3937121
Bagas 2 0.799 7.99
Bagas 3 0.878 8.78
144 Bagas 1 0.876 8.76 8.600000 0.2433105
Bagas 2 0.832 8.32
Bagas 3 0.872 8.72
168 Bagas 1 0.701 7.01 7.536600 0.8187999
Bagas 2 0.848 8.48
Bagas 3 0.712 7.12
Contoh perhitungan :
Substrat bagas (inkubasi 168 jam) Absorbansi = 0.701
Abs riil = (Absorbansi x 10) = 0.701 x 10
= 7.01
20
48 Xilan 1 0.2130 0.2510 0.2180 0.2140 0.2240 0.2273 0.2190 0.0083 43.4433 0.0434 3.8539 0.0249 3.8802
Xilan 2 0.2630 0.2670 0.2570 0.2590 0.2470 0.2623 0.2530 0.0093 43.7767 0.0438 3.8835 Xilan 3 0.3070 0.3160 0.3430 0.3120 0.3120 0.3220 0.3120 0.0100 44.0000 0.0440 3.9033
72 Xilan 1 0.2550 0.2310 0.2690 0.2260 0.2210 0.2517 0.2235 0.0282 50.0567 0.0501 4.4406 1.8487 5.2307
Xilan 2 0.3680 0.3800 0.3810 0.2490 0.2510 0.3763 0.2500 0.1263 82.7767 0.0828 7.3432 Xilan 3 0.2820 0.2930 0.3000 0.2860 0.2770 0.2917 0.2815 0.0102 44.0567 0.0441 3.9083
96 Xilan 1 0.2630 0.2280 0.2080 0.2160 0.2110 0.2330 0.2135 0.0195 47.1667 0.0472 4.1842 2.3590 5.6315
Xilan 2 0.4260 0.3910 0.4010 0.2480 0.2430 0.4060 0.2455 0.1605 94.1667 0.0942 8.3537 Xilan 3 0.2940 0.3040 0.3120 0.2860 0.2700 0.3033 0.2780 0.0253 49.1100 0.0491 4.3566
120 Xilan 1 0.2430 0.2570 0.2380 0.2410 0.2150 0.2460 0.2280 0.0180 46.6667 0.0467 4.1399 3.1841 5.9831
Xilan 2 0.4550 0.4600 0.4700 0.2820 0.2320 0.4617 0.2570 0.2047 108.8900 0.1089 9.6598 Xilan 3 0.3000 0.2980 0.2970 0.2920 0.2680 0.2983 0.2800 0.0183 46.7767 0.0468 4.1496
Xilan 1 0.2360 0.2470 0.2780 0.2400 0.2100 0.2537 0.2250 0.0287
144 40.6667 0.0407 3.6076 3.0909 5.5642
Xilan 2 0.4450 0.4310 0.4040 0.2580 0.2220 0.4267 0.2400 0.1867 102.8900 0.1029 9.1275 Xilan 3 0.2900 0.2890 0.3100 0.3000 0.2690 0.2963 0.2845 0.0118 44.6100 0.0446 3.9574
168 Xilan 1 0.2380 0.2540 0.2480 0.2350 0.2240 0.2467 0.2295 0.0172 46.3900 0.0464 4.1153 1.7770 5.1388
Xilan 2 0.3400 0.3340 0.3270 0.2280 0.1970 0.3337 0.2125 0.1212 81.0567 0.0811 7.1907
21
c. Substrat TKKS Jam
ke- Substrat U1 U2 U3 K1 K2
Rerata U
Rerata
K U-K ppm mg/mL U/mL St Dev
Rerata U/mL
0 TKKS 1 0.3600 0.3700 0.3510 0.3810 0.2930 0.3603 0.3370 0.0233 48.4433 0.0484 4.2975 0.1288 4.2064
TKKS 2 0.3900 0.3810 0.3620 0.3670 0.3540 0.3777 0.3605 0.0172 46.3900 0.0464 4.1153
24 TKKS 1 0.2770 0.2480 0.2750 0.2700 0.2570 0.2667 0.2635 0.0032 41.7233 0.0417 3.7013 0.6482 4.1597
TKKS 2 0.2860 0.2860 0.3030 0.2740 0.2410 0.2917 0.2575 0.0342 52.0567 0.0521 4.6180
48 TKKS 1 0.2090 0.2090 0.2290 0.1950 0.1930 0.2157 0.1940 0.0217 47.8900 0.0479 4.2484 0.8958 4.8283
TKKS 2 0.2220 0.2250 0.2160 0.2260 0.1640 0.2210 0.1950 0.0260 49.3333 0.0493 4.3764
TKKS 3 0.2150 0.2310 0.3390 0.2120 0.1590 0.2617 0.1855 0.0762 66.0567 0.0661 5.8600
72 TKKS 1 0.2460 0.2460 0.2480 0.1910 0.1920 0.2467 0.1915 0.0552 59.0567 0.0591 5.2390 0.5174 4.9728
TKKS 2 0.2200 0.2210 0.2190 0.1950 0.1930 0.2200 0.1940 0.0260 49.3333 0.0493 4.3764
TKKS 3 0.2480 0.2490 0.2390 0.1790 0.1970 0.2453 0.1880 0.0573 59.7767 0.0598 5.3029
96 TKKS 1 0.2830 0.2650 0.2620 0.1780 0.1760 0.2700 0.1770 0.0930 71.6667 0.0717 6.3577 2.7844 7.5092
TKKS 2 0.4210 0.4180 0.4340 0.1870 0.1830 0.4243 0.1850 0.2393 120.4433 0.1204 10.6847
TKKS 3 0.2520 0.2510 0.2500 0.1880 0.1870 0.2510 0.1875 0.0635 61.8333 0.0618 5.4853
120 TKKS 1 0.2690 0.2530 0.2680 0.1820 0.1710 0.2633 0.1765 0.0868 69.6100 0.0696 6.1752 2.2266 7.4780
TKKS 2 0.3920 0.4000 0.4030 0.1800 0.1810 0.3983 0.1805 0.2178 113.2767 0.1133 10.0489
TKKS 3 0.2700 0.2740 0.0000 0.1900 0.1780 0.2720 0.1840 0.0880 70.0000 0.0700 6.2098
144 TKKS 1 0.2850 0.2760 0.2820 0.2170 0.2100 0.2810 0.2135 0.0675 63.1667 0.0632 5.6036 1.8955 6.5235
22
TKKS 3 0.2770 0.2660 0.2760 0.2140 0.2200 0.2730 0.2170 0.0560 59.3333 0.0593 5.2635
168 TKKS 1 0.2830 0.2680 0.2900 0.2070 0.2020 0.2803 0.2045 0.0758 65.9433 0.0659 5.8499 1.3025 6.7518
TKKS 2 0.3750 0.3670 0.3630 0.2130 0.2100 0.3683 0.2115 0.1568 92.9433 0.0929 8.2451
TKKS 3 0.2770 0.2640 0.2640 0.1550 0.2090 0.2683 0.1820 0.0863 69.4433 0.0694 6.1604
d. substrat bagas
jam ke- Sampel U1 U2 U3 K1 K2
Rerata U
Rerata
K U-K ppm mg/mL U/mL St Dev
Rerata U/mL
0 Bagas 1 0.3440 0.3070 0.3160 0.3220 0.2990 0.3223 0.3105 0.0118 44.6100 0.0446 3.9574 0.1212 3.9164
Bagas 2 0.3120 0.3170 0.3180 0.2980 0.3060 0.3157 0.3020 0.0137 45.2233 0.0452 4.0118 Bagas 3 0.3160 0.3140 0.3220 0.3140 0.3090 0.3173 0.3115 0.0058 42.6100 0.0426 3.7800
24 Bagas 1 0.2220 0.2280 0.2320 0.2220 0.2090 0.2273 0.2155 0.0118 44.6100 0.0446 3.9574 0.2264 3.7973
Bagas 2 0.2240 0.2200 0.2190 0.2170 0.2230 0.2210 0.2200 0.0010 41.0000 0.0410 3.6372
48 Bagas 1 0.1730 0.1700 0.1640 0.1670 0.1690 0.1690 0.1680 0.0010 41.0000 0.0410 3.6372 0.2384 3.9066
Bagas 2 0.1650 0.1690 0.1640 0.1590 0.1470 0.1660 0.1530 0.0130 45.0000 0.0450 3.9920 Bagas 3 0.1670 0.1610 0.1740 0.1490 0.1530 0.1673 0.1510 0.0163 46.1100 0.0461 4.0905
72 Bagas 1 0.1400 0.1530 0.1580 0.1430 0.1450 0.1503 0.1440 0.0063 42.7767 0.0428 3.7948 0.2851 4.0298
Bagas 2 0.1500 0.1530 0.1590 0.1330 0.1520 0.1540 0.1425 0.0115 44.5000 0.0445 3.9477
Bagas 3 0.1570 0.1580 0.1590 0.1190 0.1470 0.1580 0.1330 0.0250 49.0000 0.0490 4.3469
96 Bagas 1 0.1850 0.1850 0.1770 0.1460 0.1380 0.1823 0.1420 0.0403 54.1100 0.0541 4.8002 0.6070 5.0581
23
Bagas 3 0.2080 0.2140 0.2110 0.1320 0.1450 0.2110 0.1385 0.0725 64.8333 0.0648 5.7515
120 Bagas 1 0.2430 0.2300 0.2270 0.1730 0.1620 0.2333 0.1675 0.0658 62.6100 0.0626 5.5542 0.9917 5.2717
Bagas 2 0.2250 0.2180 0.2200 0.1900 0.2140 0.2210 0.2020 0.0190 47.0000 0.0470 4.1694 Bagas 3 0.2690 0.2580 0.2590 0.1810 0.1750 0.2620 0.1780 0.0840 68.6667 0.0687 6.0915
144 Bagas 1 0.2510 0.2460 0.2480 0.1880 0.1900 0.2483 0.1890 0.0593 60.4433 0.0604 5.3620 0.9603 5.4919
Bagas 2 0.2330 0.2360 0.2320 0.1920 0.2080 0.2337 0.2000 0.0337 51.8900 0.0519 4.6032 Bagas 3 0.2810 0.2790 0.2760 0.1770 0.1840 0.2787 0.1805 0.0982 73.3900 0.0734 6.5105
168 Bagas 1 0.2780 0.2480 0.2650 0.1760 0.1840 0.2637 0.1800 0.0837 68.5567 0.0686 6.0818 0.9872 5.6661
Bagas 2 0.2320 0.2320 0.2320 0.2040 0.1970 0.2320 0.2005 0.0315 51.1667 0.0512 4.5391
Bagas 3 0.2820 0.2870 0.2790 0.1990 0.1790 0.2827 0.1890 0.0937 71.8900 0.0719 6.3775
Contoh perhitungan
Penentuan aktivitas xilanase pada substrat bagas (inkubasi 168 jam)
Diketahui :
Rerata Ulangan (U) = 0.2637
Rerata Kontrol (K) = 0.1800
U-K = 0.2637- 0.1800
24
ppm = ((U-K)+0.122)/0.003 dari persamaan garis standar xilosa = (0.08367 + 0.122)/0.003
= 68.5567
mg/mL = (
=
= 0.0686 mg/mL
U/mL =
= (0.0686 x 4 x 100 x 1000)/(30 x 150.3) = 6.0818 U/mL
keterangan
C = [Gula pereduksi] (mg/mL)
Fp = Faktor pengenceran
t = waktu reaksi (menit)
25
RIWAYAT HIDUP
Penulis dilahirkan di Brebes pada tanggal 22 Januari 1993 dari ayah H. Masruri dan ibu Hj. Masruroh. Penulis merupakan putri bungsu dari tiga bersaudara. Tahun 2009 penulis lulus dari MA PPMI Assalaam Sukoharjo-Solo dan pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB. Penulis diterima di Program Studi Biokimia, Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Selama mengikuti program S1 di IPB penulis pernah bergabung dengan organisasi LDK Al Hurriyyah, Forum Lingkar Pena (FLP) Bogor, Keluarga Pelajar Mahasiswa Daerah Brebes (KPMDB), Program Kakak Asuh (Pro KA), Rumah Qur’an (RQ) Bogor serta beberapa kepanitiaan intra dan ekstra kampus. Penulis juga pernah menjadi asisten praktikum untuk mata kuliah Biokimia Umum dan Pendidikan Agama Islam di TPB-IPB, dan pernah menjadi peserta di Aceh Development International Conference (ADIC) Malaysia (2012) dengan tema paper tentang Mathmagic. Penulis merupakan penerima beasiswa dari Bank Permata Syariah pada tahun 2012, penerima dana Dikti untuk Program Kreativitas Mahasiswa (PKM) bidang Pengabdian Masyarakat (2011), bidang Penelitian (2012), dan beberapa prestasi non akademik lainnya. Pada tahun 2012 penulis melaksanakan praktik lapangan di Laboratorium Pusat Biomedis dan Teknologi Dasar Kesehatan, Bogor dengan judul ‘Studi In vivo Tingkat Kecerdasan Tikus Kurang Gizi dengan Penambahan Suplemen Omega-γ’.