PROKSIMAT, MINERAL DAN STRUKTUR JARINGAN
DAGING JUVENIL IKAN NILA (Oreochromis niloticus)
PADA UMUR PANEN YANG BERBEDA
LIA MAULINAH ANGRIANI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Proksimat, Mineral dan Struktur Jaringan Daging Juvenil Ikan Nila (Oreochromis niloticus) pada Umur Panen yang Berbeda” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Lia Maulinah Angriani
iv
ABSTRAK
LIA MAULINAH ANGRIANI. Proksimat, Mineral dan Struktur Jaringan Daging Juvenil Ikan nila (Oreochromis niloticus) pada Umur Panen yang Berbeda. Dibimbing oleh AGOES M. JACOEB dan NURJANAH.
Juvenil ikan nila banyak dikonsumsi oleh masyarakat Jawa Barat dalam berbagai bentuk olahan, namun informasi komposisi kimia mengenai baby fish nila segar belum tersedia. Tujuan penelitian ini adalah menentukan perbedaan proksimat, kandungan mineral dan jaringan daging juvenil ikan nila berdasarkan umur panen, yaitu dua, tiga, dan empat minggu. Metode yang digunakan untuk analisis proksimat berdasarkan SNI 1992-01-2891, mineral dengan menggunakan (Atomatic Absorption Spectrophotometer) AAS dan analisis jaringan menggunakan metode parafin. Berat badan, panjang total dan tinggi, serta kadar abu meningkat dengan meningkatnya umur panen, tetapi kandungan protein total tidak berubah. Fe meningkat pada umur panen 4 minggu. Evaluasi mikroskopis menunjukkan, struktur miomer yang kompak pada umur panen 4 minggu dan miosepta berkembang.
Kata kunci : juvenil ikan nila, jaringan, mineral, proksimat, umur panen.
ABSTRACT
LIA MAULINAH ANGGRAINI. Proximate, Mineral and Network Structure Meat Juvenil Tilapia (Oreochromis niloticus) in Different Harvest Time. Supervised by AGOES M. JACOEB and NURJANAH.
Juvenile of tilapia mostly consumed by people of west java in various processed forms, however still luck in chemical information. The purpose of this study was to determine the differences of morphometric value, proximate and mineral content, as well as its flesh tissue structure based on the harvest age at two, three and four weeks. Proximate was determined with method based on SNI 1992-01-2891, mineral was evaluated using (Atomic Absorption Spectrophotometer) AAS and flesh tissue structure using paraffin method. Body weight, total length and height, as well as ash content increased with the increasing of harvest age, but did not change in total protein content. Fe increased in harvest age of 4 weeks. Microscopic evaluation showed compact structure of myomere at harvest age four week and its myosepta developed more at this time.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
PROKSIMAT, MINERAL DAN STRUKTUR JARINGAN
DAGING JUVENIL IKAN NILA (Oreochromis niloticus) PADA
UMUR PANEN YANG BERBEDA
LIA MAULINAH ANGRIANI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Proksimat, Mineral dan Struktur Jaringan Daging Juvenil Ikan Nila (Oreochromis niloticus) pada Umur Panen yang Berbeda Nama : Lia Maulinah Angriani
NIM : C34100019
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Ir Agoes Mardiono Jacoeb, Dipl-Biol Prof Dr Ir Nurjanah, MS Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Segala Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan penelitian ini dengan baik. Penelitian ini dilaksanakan pada Juli hingga Agustus 2014 dengan judul
“Proksimat, Mineral dan Struktur Jaringan Daging Juvenil Ikan Nila (Oreochromis niloticus) pada Umur Panen yang Berbeda”. Skripsi ini disusun sebagai salah satu syarat untuk mendapat Gelar Sarjana di Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Dalam kesempatan ini, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada:
1 Dr Ir Agoes Mardiono Jacoeb Dipl-Biol selaku dosen pembimbing I dan Prof Dr Ir Nurjanah MS selaku dosen pembimbing II, atas segala bimbingan dan pengarahan yang diberikan kepada penulis.
2 Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen, Dr Ir Wini Trilaksani, MSc Selaku Penguji dan Desniar, SPi, MSi Selaku GKM/Komdik atas saran dan pengarahan yang diberikan kepada penulis. 3 Staf dosen dan administrasi Departemen Teknologi Hasil Perairan.
4 Ayahanda dan Ibunda kami tercinta, serta kakak dan adik, yang telah memberikan doa dan dukungan kepada penulis.
5 Ibu Dian dari Laboratorium Ilmu Nutrisi dan Teknologi Pakan, Departemen Ilmu Nutrisi dan Teknologi Ilmu Pakan, Fakultas Peternakan yang telah bersedia memberikan bantuan dan menyediakan tempat untuk pengujian mineral.
6 Sahabat, yaitu Susi susanti, Ratna Oktavia, Santiara Pramestia, Rieska Ayu wulandari, Astrini Agustin, Dewi Rachmawati, Kartika Chandra
K
irana, Chicilia, T. W, Sri Wahyuningsih, dan Hifriend, Rika Mustika, Annisa Khoirunika, Casselia Ajeng. P atas dukungan, tempat berkeluh kesah, dan bantuannya selama ini.7 Tim baby fish 47, Arif Yanuar Ridwan, Santoso Darmo Atmojo, Bianca Benning, Laurensius Sitanggang, dan Siti Mayang Sari yang telah memberikan dorongan dan kerja samanya.
8 Keluarga besar THP 47 atas segala bantuan, doa, semangat, dan dukungan yang telah diberikan.
Penulis menyadari bahwa masih ada kekurangan dalam penulisan skripsi ini, oleh karena itu penulis sangat mengharapkan kritik dan saran yang membangun dalam perbaikan skripsi ini. Demikian skripsi ini disusun, semoga bermanfaat.
Bogor, 17 Februari 2016
ii
DAFTAR ISI
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 1
Tujuan Penelitian ... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 2
Waktu dan Tempat ... 2
Bahan dan Alat Penelitian ... 2
Prosedur Penelitian ... 3
Pengambilan dan Preparasi Sampel ... 4
Pengukuran Morfometrik ... 4
Prosedur Analisis ... 4
Analisis Histologis (mengacu pada Angka et al. 1990) ... 4
Analisis Mineral (AOAC 2005) ... 5
Analisis Proksimat ... 6
Analisis Data ... 7
HASIL DAN PEMBAHASAN ... 8
Morfometrik Juvenil Ikan Nila ... 8
Komposisi Kimia Juvenil Ikan Nila ... 9
Kadar Air ... 9
Kadar Abu ... 10
Kadar Protein ... 10
Kadar Lemak ... 10
Komposisi Mineral Juvenil Nila (O. niloticus) ... 11
Struktur Jaringan Otot Juvenil Ikan Nila (O. niloticus) ... 12
KESIMPULAN DAN SARAN ... 14
Kesimpulan ... 14
Saran ... 14
DAFTAR PUSTAKA ... 15
DAFTAR TABEL
1 Bobot dan morfometrik juvenil ikan nila dari berbagai umur Panen (n=30) ... 8 2 Komposisi kimia juvenil ikan nila pada berbagai umur panen ... 9 3 Mineral juvenil ikan nila (O. niloticus) ... 11
DAFTAR GAMBAR
1 Diagram alir metode penelitian ... 3 2 Morfometrik juvenil ikan nila pada umur panen ... 8 3 Penampang melintang otot juvenil ikan nila dengan perbesaran
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan salah satu ikan air tawar yang banyak dikonsumsi oleh masyarakat dan menjadi target produksi perikanan nasional. Berdasarkan KKP (2013) permintaan ikan nila dari tahun 2010 hingga 2013 mengalami peningkatan produksi yaitu 26,36% dengan jumlah produksi ikan nila pada tahun 2013 sebesar 1,105,000 ton. Menurut data yang diperoleh dari Dinas Peternakan dan Perikanan Kabupaten Bogor, produksi ikan nila pada tahun 2010 mencapai 2 073.36 ton dengan pertumbuhan produksi 12,55%. Potensi yang cukup besar yang dimiliki oleh sektor perikanan Kabupaten Bogor dalam menghasilkan peluang usaha baru untuk memaksimalkan potensi yang ada, khususnya dalam bidang pengolahan produk perikanan.
Ikan nila adalah salah satu ikan air tawar yang digemari oleh masyarakat untuk dikonsumsi dengan berbagai ukuran. Ukuran konsumsi ikan nila pada umumnya dengan bobot 200 gram pada umur panen 3-6 bulan, selain itu trend saat ini masyarakat juga menggemari juvenil ikan untuk dikonsumsi. Tua et al. (2012) menyatakan ikan dikelompokkan menjadi 3 kelompok berdasarkan berat badan, yaitu kecil 50-150 g, sedang 150-250 g, dan besar 250-350 g. Juvenil ikan banyak dijadikan produk olahan keripik, karena lebih mudah diolah tanpa disiangi. Menurut Ozyurt et al. (2008) juvenil ikan mengandung protein, kalsium, mineral dan omega 3 yang cukup tinggi. Hal ini membuat produk olahan tersebut populer di kalangan masyarakat.
Juvenil ikan banyak mengandung komponen yang penting untuk pertumbuhan anak maupun orang dewasa. Komponen yang terdapat pada juvenil ikan salah satunya adalah mineral. Kandungan mineral pada ikan berfungsi untuk mempertahankan keseimbangan osmosis antara cairan tubuh dengan cairan di sekitarnya. Meskipun dibutuhkan dalam jumlah relatif kecil, namun mineral memiliki peran yang sangat penting dalam menjaga kelangsungan hidup, karena mineral sangat dibutuhkan dalam beberapa proses yang berlangsung di dalam tubuh ikan. Ikan dapat mengabsorbsi beberapa mineral, tidak hanya mineral yang berasal dari pakan tetapi juga berasal dari lingkungan aquatic. Perubahan kandungan mineral dan jaringan individu diduga terkait dengan perkembangan ontogeni individu tersebut. Pertambahan umur panen juvenil ikan nila diduga berpengaruh terhadap kandungan mineral dan struktur jaringan dagingnya. Informasi tersebut hingga kini belum tersedia, untuk itu kiranya perlu dilakukan penelitian untuk menyediakan informasi tersebut.
Rumusan Masalah
2
Tujuan Penelitian
Penelitian ini bertujuan menentukan perbedaan kandungan proksimat, mineral, dan struktur jaringan daging juvenil ikan nila pada umur panen 2, 3, dan 4 minggu.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai komposisi kimia, profil mineral dan perkembangan jaringan daging juvenil ikan nila pada umur panen dua, tiga dan empat minggu.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan sampel, analisis proksimat, analisis mineral, analisis jaringan daging juvenil ikan nila dan pengolahan data serta penulisan laporan.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksakan pada Juli 2014 sampai September 2014. Sampel berasal dari tambak nila di Kampung Kaum, Desa Pabuaran, Kemang, Kabupaten Bogor. Preparasi bahan baku dan analisis morfometrik dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis jaringan dilakukan di Laboratorium Histologi, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Uji proksimat dilakukan di Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Lembaga Penelitian dan Pengabdian Kepada Masyarakat, Institut Pertanian Bogor, Kementrian Pendidikan dan Kebudayaan. Analisis mineral dilakukan di Laboratorium Pengujian Nutrisi Pakan, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Bahan dan Alat Penelitian
Bahan
etanol, larutan seri Johansen. Bahan yang digunakan untuk analisis mineral adalah Aquades, kertas saring Whatman, asam nitrat (HNO3 65%), asam perkhlorat (HClO4 70%), H2SO4 pekat, dan HCl.
Alat
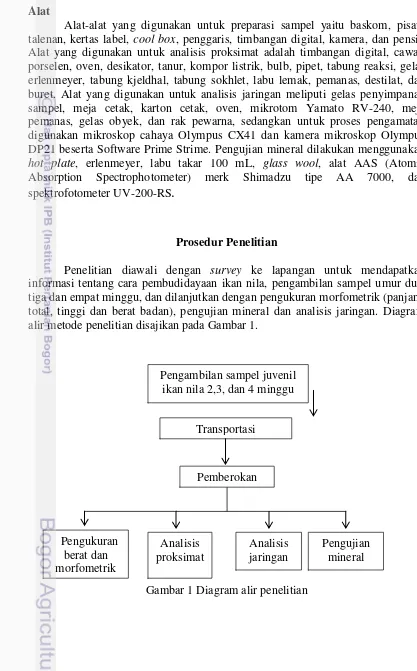
Alat-alat yang digunakan untuk preparasi sampel yaitu baskom, pisau, talenan, kertas label, cool box, penggaris, timbangan digital, kamera, dan pensil. Alat yang digunakan untuk analisis proksimat adalah timbangan digital, cawan porselen, oven, desikator, tanur, kompor listrik, bulb, pipet, tabung reaksi, gelas erlenmeyer, tabung kjeldhal, tabung sokhlet, labu lemak, pemanas, destilat, dan buret. Alat yang digunakan untuk analisis jaringan meliputi gelas penyimpanan sampel, meja cetak, karton cetak, oven, mikrotom Yamato RV-240, meja pemanas, gelas obyek, dan rak pewarna, sedangkan untuk proses pengamatan digunakan mikroskop cahaya Olympus CX41 dan kamera mikroskop Olympus DP21 beserta Software Prime Strime. Pengujian mineral dilakukan menggunakan hot plate, erlenmeyer, labu takar 100 mL, glass wool, alat AAS (Atomic Absorption Spectrophotometer) merk Shimadzu tipe AA 7000, dan spektrofotometer UV-200-RS.
Prosedur Penelitian
Penelitian diawali dengan survey ke lapangan untuk mendapatkan informasi tentang cara pembudidayaan ikan nila, pengambilan sampel umur dua, tiga dan empat minggu, dan dilanjutkan dengan pengukuran morfometrik (panjang total, tinggi dan berat badan), pengujian mineral dan analisis jaringan. Diagram alir metode penelitian disajikan pada Gambar 1.
4
Pengambilan dan Preparasi Sampel
Ikan nila yang digunakan dalam penelitian ini termasuk jenis nila bastard. Ikan nila berasal dari tambak nila di Kampung kaum, Desa Pabuaran, Kemang, Kabupaten Bogor. Sampel juvenil ikan dengan umur panen 2 minggu (2000 ekor), 3 minggu (1500 ekor), dan 4 minggu (1000 ekor) diangkut dari Kampung Kaum ke Laboratorium Karakteristik Bahan Baku hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor menggunakan kantong plastik dan diangkut menggunakan motor pada pagi hari. Sampel yang telah dipanen, diberok terlebih dahulu selama 2 jam di dalam akuarium sebelum dipreparasi, agar sisa makanan dan feses keluar dari sistem pencernaan, mengurangi metabolisme pencernaan dan mempengaruhi bobot pada sampel. Preparasi yang dilakukan yaitu dengan memisahkan benda asing dan mencuci bersih juvenile ikan nila tersebut.
Pengukuran Morfometrik
Awal Pengukuran morfometrik dilakukan dengan mengambil sampel secara acak sebanyak 30 ekor juvenil ikan. Pengukuran morfometrik sampel meliputi panjang total, tinggi dan berat ikan per-ekor. Panjang total diukur dari ujung bagian kepala sampai dengan ujung sirip ekor. Tinggi badan diukur dari jarak tertinggi antara dorsal dan ventral. Pengukuran panjang total dan tinggi badan dengan menggunakan penggaris dengan satuan minimum millimeter. Berat ikan diukur menggunakan neraca digital.
Prosedur Analisis
Analisis yang dilakukan pada penelitian ini, meliputi analisis histologis atau struktur jaringan otot, analisis mineral, analisis proksimat.
Analisis Histologis (mengacu pada Angka et al. 1990)
Analisis jaringan daging juvenil ikan nila diawali dengan pembuatan preparat dengan metode parafin. Tahap pembuatan preparat meliputi fiksasi, dehidrasi, clearing, impregnasi, embedding, blocking, trimming, pemotongan jaringan, pewarnaan, serta perekatan jaringan menggunakan mounting agent.
Fiksasi dilakukan dalam larutan Buffer Normal Formalin (BNF) 10% selama lebih dari 36 jam, kemudian larutan fiksasi dibuang dan didehidrasi melalui perendaman sampel pada suhu ruang dengan alkohol 70% selama 24 jam, 80% selama 2 jam, 90% selama 2 jam, 95% selama 2 jam, 95% selama 2 jam, 95% selama 2 jam, 100% selama 12 jam. Proses clearing dimulai dari perendaman sampel dalam clearing agent. Sampel direndam dalam alkohol:xilol (1:1) selama 30 menit yang dilanjutkan dengan tahap impregnasi dan embedding. Tahap Impregnasi adalah perendaman sampel ke dalam xilol:parafin (1:1) dalam gelas piala selama 45 menit. Embedding adalah perendaman sampel di dalam parafin cair selama 45 menit. Kedua proses ini berlangsung di dalam oven pada suhu 60 oC.
(2x2x2) cm3. Parafin cair dituangkan ke dalam cetakan hingga memenuhi sekitar 1/8 bagian cetakan dan dibiarkan hingga sedikit membeku. Sampel kemudian disusun dalam cetakan dan dituangi parafin cair hingga terendam, serta dibiarkan membeku dalam suhu ruang selama 24 jam. Setelah parafin beku dengan sempurna, blok parafin dikeluarkan dari cetakan lalu dilakukan trimming menggunakan silet.
Jaringan dipotong dengan mikrotom putar setebal 4 μm dan pita-pita parafin direkatkan pada gelas obyek. Selanjutnya proses pewarnaan dilakukan menggunakan hematoksilin dan eosin. Pewarnaan diawali dengan perendamaan gelas obyek ke dalam xilol I dan xilol II masing-masing selama 2 menit, dilanjutkan perendaman dalam alkohol absolut 100%, 95%, 90%, 80%, 70%, dan 50% masing-masing selama 2 menit. Setelah itu, obyek dibilas dengan akuades selama 2 menit. Kemudian obyek dimasukkan ke dalam pewarna hematoksilin selama 7 menit dan dicuci dengan air mengalir untuk menghilangkan kelebihan zat warna yang tidak diserap. Obyek direndam kembali dalam pewarna eosin selama 3 menit dan dicuci kembali dengan akuades. Preparat jaringan kemudian direndam dalam alkohol 50%, 70%, 85%, 90%, 100%, 100%, xilol I, xilol II masing-masing selama 2 menit.
Proses selanjutnya adalah penutupan gelas obyek dengan pemberian mounting agent atau Canada Balsam pada gelas obyek, kemudian dikeringkan selama 24 jam. Pengamatan preparat awetan dilakukan dengan mikroskop cahaya Olympus CX41 dengan perbesaran hingga 400x. Proses pengambilan gambar dilakukan dengan kamera Olympus DP21. selama 4-6 jam dengan temperatur rendah selama 4-6 jam di dalam ruang asam. Sampel kemudian ditutup dan dibiarkan semalam. Setelah itu, ditambah 0,4 mL H2SO4 dan dipanaskan di atas hot plate sampai larutan berkurang atau lebih pekat (biasanya ± 1 jam). Campuran tersebut kemudian ditambah 2-3 tetes larutan campuran HCl dan HNO3 dengan perbandingan 2:1. Sampel tersebut tetap diletakkan di atas hot plate dan pemanasan tetap dilanjutkan hingga campuran berubah warna dari cokelat ke kuning tua dan berubah menjadi kuning muda. Setelah ada perubahan warna, pemanasan masih dilanjutkan selama 10-15 menit. Selanjutnya sampel dipindahkan, lalu didinginkan dan ditambah 2 mL aquades dan 0,6 mL HCl. Campuran tersebut dipanaskan kembali selama ±15 menit agar dapat larut, kemudian dimasukkan ke dalam labu takar 100 mL. Apabila terdapat endapan, dilakukan penyaringan dengan glass wool. Hasil pengabuan basah ini selanjutnya dianalisis dengan AAS atau spektrofotometer.
6
seng dengan 213,9 nm; dan tembaga dengan 324,7 nm. Setelah diperoleh absorbansi standar, dihubungkan antara konsentrasi standar (sebagai sumbu X) dengan absorban standar (sebagai sumbu Y) sehingga diperoleh kurva standar mineral dengan persamaan garis linier y=ax+b yang digunakan untuk perhitungan konsentrasi larutan sampel.
keterangan: FP = Faktor pengenceran
Analisis Proksimat
Analisis proksimat yang dilakukan terhadap sampel Juvenil ikan nila meliputi kadar air, abu, lemak, dan protein.
1) Analisis kadar air (SNI 1992-01-2891)
Tahap pertama yang dilakukan pada analisis kadar air adalah dengan mengeringkan cawan porselen dalam oven pada suhu 105 oC selama 30 menit. Cawan tersebut kemudian diletakkan ke dalam desikator selama 15 menit dan dibiarkan sampai suhu ruang kemudian ditimbang. Sampel sebanyak 2 g ditimbang setelah terlebih dahulu dihaluskan dengan mortar. Cawan yang telah diisi sampel dikeringkan dalam oven pada suhu 105oC selama 3 jam. Cawan beserta isinya kemudian didinginkan sampai suhu ruang dalam desikator (30 menit) kemudian ditimbang. Perhitungan kadar air dapat dilihat sebagai berikut:
Kadar air (%) = Keterangan :
A = berat cawan kosong (g)
B = berat cawan dengan sampel awal (g)
C = berat cawan dengan sampel setelah dikeringkan (g) 2) Analisis kadar abu (SNI 1992-01-2891)
Analisis kadar abu yaitu untuk mengetahui jumlah bahan anorganik yang terdapat pada suatu bahan terkait dengan mineral dari bahan yang dianalisis. Cawan pengabuan dibersihkan dan dikeringkan di dalam oven selama satu jam pada suhu 105oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang. Sampel yang telah ditimbang sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukka ke dalam tanur pengabuan dengan suhu 600oC selama satu jam, didinginkan sampai suhu ruang kemudiaan ditmbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus :
Kadar abu (%) = Keterangan :
A = berat cawan abu porselen kosong (g) B = berat cawan abu dengan sampel (g)
3) Analisis kadar protein (SNI 1992-01-2891)
Analisis protein dilakukan untuk mengetahui kandungan protein kasar (crude protein) pada suatu bahan. Analisis protein terdiri dari tiga tahap, yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikrokjeldahl. Sampel ditimbang sebanyak 1 g, kemudian dimasukkan ke dalam labu kjeldahl 100 mL, lalu ditambah 0,25 g selenium dan 3 mL H2SO4 pekat. Contoh didestruksi pada suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan pada suhu ruang. Setelah itu, ke dalam labu kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian didestilasi dengan suhu destilator 100oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat lalu dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
N(%) = (S-B) x NHCl x 14 x 100% W x 1.000
Keterangan:
S = Volume titran sampel (mL) B = Volume titran blanko (mL) W = Bobot sampel kering (mg)
% Kadar Protein: % Nitrogen x faktor konversi
Keterangan :Protein mengandung rata-rata 16% nitrogen. Faktor konversi =
4) Kadar lemak (SNI 1992-01-2891)
Sebanyak 2 g sampel disebar di atas kapas yang beralas kertas saring dan digulung membentuk thimble, kemudian dimasukkan ke dalam labu soxhlet. Sampel diekstraksi selama 6 jam dengan pelarut lemak berupa heksan sebanyak 150 mL. Lemak yang terekstrak dikeringkan dalam oven pada suhu 100oC selama 1 jam. Kadar lemak dihitung dengan rumus:
8
HASIL DAN PEMBAHASAN
Morfometrik Juvenil Ikan Nila
Ikan nila umur panen 2, 3, dan 4 minggu dapat dilihat pada Gambar 2.
Gambar 2 Morfometrik juvenil ikan nila pada umur panen 2 minggu (a), 3 minggu (b), dan 4 minggu (c).
Morfometrik juvenil ikan nila yang terlihat pada Gambar 2 menunjukkan semakin bertambah umur panen maka semakin meningkat ukuran tubuhnya. Ciri-ciri fisik juvenil ikan nila tidak jauh berbeda dengan ikan nila dewasa. Menurut Effendi (2004) ciri-ciri ikan nila agak memanjang dan pipih ke samping, warna putih kehitaman dan warnanya semakin terang ke arah bagian ventral atau perut. Pada sirip ekor juvenil ikan nila terdapat delapan buah garis-garis melintang yang ujungnya berwarna kemerah-merahan, sedangkan pada tubuh terdapat garis-garis vertikal berwarna hijau kebiruan. Mata tampak menonjol agak besar dan di tepinya berwarna hijau.
Pengukuran morfometrik dilakukan untuk mengukur bagian tubuh yang penting pada hewan, agar diketahui kisaran ukurannya, di setiap fase pertumbuhan pada masing-masing jenis-spesies hewan, sehingga informasi untuk determinasi taksa menjadi lebih lengkap dan akurat. Nilai penting yang terkandung dalam morfometrik yaitu mengenal lebih mendalam tentang jenis-spesies, melakukan estimasi umur dan jenis kelamin serta mengetahui berat dan ukuran tubuh. Hasil pengukuran bobot dan ciri morfometrik juvenil ikan nila menggunakan sampel yang diambil secara acak sebanyak 30 ekor disajikan dalam Tabel 1.
Tabel 1 Bobot dan morfometrik juvenil ikan nila dari berbagai umur panen (n=30)
Parameter Umur panen mengalami peningkatan pada setiap umur panen, begitu juga dengan ukuran panjang total dan tinggi badan ukuran selalu bertambah pada setiap umur panennya. Menurut Sarkar et al. (2013) perbedaan ukuran dan bobot suatu spesies tertentu disebabkan oleh keadaan kematangan seksual, tingkat ketersediaan sumber makanan, usia, jenis kelamin, dan sistem lingkungan. Pertambahan ukuran panjang atau berat dalam suatu waktu merupakan tanda dari adanya pertumbuhan.
b
c
Effendie (2002) menyatakan pertumbuhan ikan dipengaruhi oleh faktor dalam dan faktor luar. Faktor dalam biasanya adalah faktor yang sulit dikontrol misal keturunan, umur, jenis kelamin, dan penyakit. Faktor-faktor luar yang turut mempengaruhi pertumbuhan ikan, yaitu suhu air, kandungan oksigen terlarut, ammonia, salinitas, serta makanan.
Komposisi Kimia Juvenil Ikan Nila
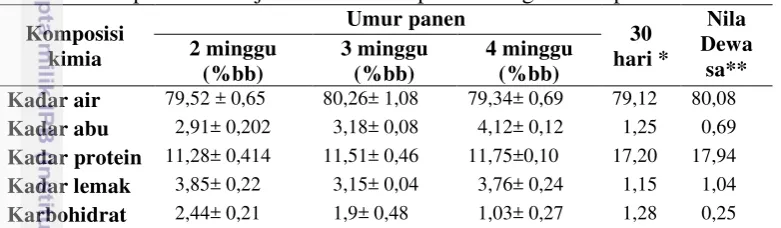
Komposisi kimia suatu bahan dapat diketahui dengan analisis proksimat. Komposisi kimia juvenil ikan nila meliputi kadar air, abu, protein dan lemak yang dihitung secara by difference. Analisis dilakukan berdasarkan ikan nila utuh dan hasilnya dicantumkan pada Tabel 2.
Tabel 2 Komposisi kimia juvenil ikan nila pada berbagai umur panen Komposisi
Keterangan: **Chaijan (2011);*Justi et al. (2003).
10
Kadar Abu
Kadar abu mengalami peningkatan pada juvenil ikan nila berumur panen 2 minggu ke 3 dan 4 minggu. Hal ini diduga karena pada umur panen 2-4 minggu terjadinya pembentukan tulang dan ini didukung oleh hasil riset Rasmussen dan Ostenfeld (2000) yang menyatakan bahwa kadar abu yang tinggi pada juvenil ikan rainbow trout (Oncorhynchus mykiss) disebabkan oleh adanya laju pertumbuhan tulang yang cepat, sedangkan pada ikan dewasa pertumbuhan jaringan lain terjadi lebih cepat dibandingkan dengan pertumbuhan tulang.
Hewan air membutuhkan mineral untuk membentuk tulang belakang, jari-jari sirip, penyampaian impuls dari syaraf pusat dan berperan dalam osmoregulasi tubuh, membentuk bagian eksoskeleton dan haemoglobin. Aslianti dan Priyono (2009) menyatakan mineral berperan untuk meningkatkan kerja syaraf dalam menyampaikan impuls, memperlancar osmoregulasi dan sebagai kofaktor dalam memperlancar kerja enzim dalam tubuh hewan air.
Kadar Protein
Kadar protein pada ketiga umur panen berturut-turut sebesar 11,28%, 11,51% dan 11,75%. Hasil ini lebih rendah dibandingkan dengan yang diperoleh Lugo et al. (2003), yaitu 17, 00% dan Chaijan (2011) sebesar 17,94%. Terjadinya perbedaan kadar protein diduga dipengaruhi oleh aktivitas metabolik setiap umur panen ikan. Rubbi et al. (1984) menyatakan juvenil ikan mengandung lebih banyak protein tetapi lebih sedikit lemak daripada ikan dewasa. Menurut Ramseyer (2002) kandungan protein sebagian besar ikan meningkat secara perlahan, atau kurang lebih tetap dengan meningkatnya berat tubuh ikan. Berdasarkan Tabel 1 dan 2, terlihat bahwa meningkatnya panjang, bobot dan tinggi ikan tidak berakibat meningkatkan kadar protein ikan tersebut.
Kadar protein pada juvenil ikan nila dipengaruhi oleh faktor biologis dan faktor lingkungan. Pramono et al. (2007) menyatakan bahwa kandungan protein sangat dipengaruhi oleh jenis ikan, umur, ukuran ikan, kualitas protein pakan, kecernaan pakan dan kondisi lingkungan.
Kadar Lemak
Hasil analisis menunjukkan bahwa kadar lemak relatif tinggi, yakni 3,85%; 3,15%; dan 3,77% untuk ikan nila berumur 2, 3, dan 4 minggu. Tingginya kadar lemak diduga sebagai sumber energi utama untuk pergerakan, mengingat pencernaan belum sempurna sehingga belum bisa menyerap karbohidrat untuk keperluan tersebut. Salam et al. (2001) menyatakan kadar lemak merupakan salah satu bahan organik penyusun tubuh yang seharusnya meningkat seiring dengan pertambahan ukuran tubuh ikan.
Karbohidrat
Kadar karbohidrat diperoleh dari hasil perhitungan secara by difference, sehingga nilai yang didapat merupakan proporsi dari hasil pengurangan keseluruhan proksimat. Kadar karbohidrat juvenil ikan nila dalam penelitian ini menunjukkan penurunan dari setiap umur panennya. Hasil tersebut berbeda dengan hasil penelitian Justi et al. (2003) yang sebesar 1,28%.
Perbedaan nilai karbohidrat diduga akibat perkembangan otot ikan pada setiap umur panen. Ikan dewasa cenderung memiliki kadar karbohidrat yang lebih tinggi dari juvenil ikan. Santos et al. (2012) menyatakan karbohidrat ditemukan pada ikan dalam bentuk glikogen otot, semakin dewasa ikan, semakin banyak glikogen yang terkandung dalam otot ikan, karena jaringan otot semakin membesar.
Komposisi Mineral Juvenil Nila (O. niloticus)
Mineral merupakan salah satu nutrisi yang dibutuhkan oleh tubuh selain vitamin. Mineral dibedakan menjadi mineral makro dan mikro. Mineral makro adalah mineral yang terdapat dalam jumlah banyak untuk membentuk komponen organ di dalam tubuh, sedangkan mineral mikro yaitu mineral yang diperlukan dalam jumlah sangat sedikit dan umumnya terdapat dalam jaringan dengan konsentrasi sangat kecil. Mineral makro meliputi Ca, P, K, Na, Cl, S, dan Mg. Mineral mikro yaitu Fe, Mo, Cu, Zn, Mn, Co, I, dan Se (Arifin 2008). Mineral yang dianalisis yaitu natrium, kalsium, magnesium, besi, seng, dan tembaga. Komposisi mineral baby fish nila disajikan pada Tabel 3.
Tabel 3 Mineral juvenil ikan nila (O. niloticus)
Komposisi Mineral bk (ppm)
Umur Panen (Minggu)
2 3 4
Mineral Makro
12
Natrium mengalami penurunan di umur panen minggu ke-4 diduga disebabkan oleh hilangnya Na bersama cairan ekstraseluler ikan. Natrium terutama terdapat dalam cairan ekstraseluler bersama-sama dengan klorida dan bikarbonat. Jika cairan di dalam daging hilang, maka unsur utama yang hilang yaitu natrium (deMan 1997). Natrium merupakan ion monovalen cairan ekstraseluler dan merupakan ion terbanyak (93%) dalam cairan darah yang mengalir (Nawal. 2008).
Natrium bertugas menjaga kesetimbangan elektrolit cairan tubuh (Chatterjee et al. 2006). Magnesium merupakan bagian penting tulang keras dan tulang rawan ikan serta kulit krustase (Reigh et al. 1991; Sivaperumal et al. 2007).
Kadar besi juvenil ikan nila mengalami peningkatan dari umur panen 2 minggu hingga 4 minggu, sedangkan seng dan tembaga menurun di umur panen minggu ke-4. Menurut Harjono et al. (1996) ikan juvenil memerlukan mineral besi lebih banyak dibandingkan dengan ikan dewasa, hal ini terkait dengan fungsi besi dalam sistem respirasi untuk transportasi oksigen ke jaringan (hemoglobin) dan mekanisme oksidasi selular untuk menunjang metabolisme yang tinggi pada masa pertumbuhan sehingga kandungan besi juvenil ikan nila tinggi. Selanjutnya Wiramiharja et al. (2007) menyatakan komposisi mineral besi yang rendah pada ikan dapat menghambat pertumbuhan. Tembaga berperan dalam beberapa kegiatan enzim pernapasan sebagai kofaktor bagi enzim tirosinase dan sitokhrom oksidase, dan diperlukan dalam proses pertumbuhan sel-sel darah merah yang masih muda(Winarno 2008). Nurjanah et al. (2005) menyatakan bahwa peran tembaga sebagai kofaktor maupun sebagai pengatur enzim SOD cukup besar. Jika tubuh kekurangan tembaga maka akan terjadi peningkatan peroksida lipid. Absorpsi seng dalam tubuh dipengaruhi oleh status seng tubuh, jenis makanan, kelebihan tembaga, dan nilai albumin serta transferin yang rendah. Bila konsumsi seng tinggi, di dalam sel dinding saluran cerna sebagian diubah menjadi metalotionein sebagai simpanan, sehingga absorpsi seng berkurang. Menurut Almatsier (2001) bentuk simpanan kemudian dibuang bersama sel-sel dinding usus halus yang umurnya adalah 2-5 hari. Stanek et al. (2005) menyatakan bahwa seng memiliki kecenderungan terakumulasi dalam otot ikan. Kandungan seng yang tinggi pada hewan kemungkinan akibat kadar seng di perairan yang juga tinggi.
Struktur Jaringan Otot Juvenil Ikan Nila (O. niloticus)
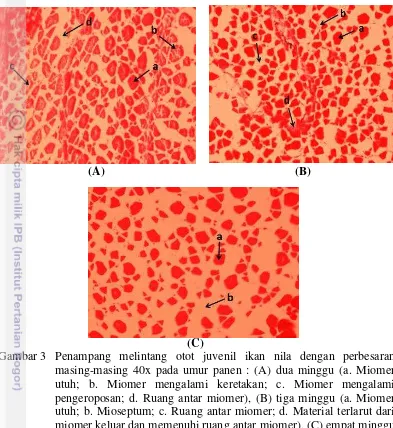
Berdasarkan Gambar 3A jaringan daging belum menunjukkan jaringan yang kompak. Miomer masih berukuran kecil dan dalam preparasi mengalami pengerutan, sehingga terjadi ruang antar miomer. Mioseptum secara mikroskopis belum bisa diamati. Mulai terjadi kerusakan pada beberapa miomer dalam bentuk retaknya serta pengeroposan miomer. Material akibat rusaknya miomer keluar dan memenuhi ruang antar miomer dalam bentuk seperti kabut.
Hasil analisis mikroskopis jaringan daging juvenil ikan nila dicantumkan pada Gambar 3.
(A) (B)
(C)
Gambar 3 Penampang melintang otot juvenil ikan nila dengan perbesaran masing-masing 40x pada umur panen : (A) dua minggu (a. Miomer utuh; b. Miomer mengalami keretakan; c. Miomer mengalami pengeroposan; d. Ruang antar miomer), (B) tiga minggu (a. Miomer utuh; b. Mioseptum; c. Ruang antar miomer; d. Material terlarut dari miomer keluar dan memenuhi ruang antar miomer), (C) empat minggu (a. Miomer utuh; b. ruang antar miomer).
14
mioseptum. Ketebalan mioseptum bervariasi sepanjang tubuh, disektiar kulit mioseptum lebih tebal. Jumlah dan ukuran miotom bervariasi tergantung pada filogeni, ontogeni, morfologi tubuh, dan gaya bergerak ikan tersebut. Hasil pengamatan histologi juvenil ikan nila disajikan dalam Gambar 3.
KESIMPULAN DAN SARAN
Kesimpulan
Pertambahan panjang total, tinggi dan bobot juvenil ikan pada umur panen 2, 3 dan 4 minggu tidak menyebabkan pertambahan kadar air dan protein. Kadar lemak menurun pada umur panen 3 minggu dan meningkat kembali pada umur panen 4 minggu. Kadar abu mengalami peningkatan pada umur 3 dan 4 minggu. Karbohidrat mengalami penurunan pada umur 3 dan 4 minggu. Kadar mineral secara umum meningkat pada umur panen 4 minggu dan hanya kandungan Fe meningkat tajam di minggu keempat. Struktur miomer lebih kompak dan mioseptum berkembang dengan bertambahnya umur panen. Peningkatan umur panen 2, 3, dan 4 minggu menyebabkan miomer lebih kompak dan mioseptum lebih jelas.
Saran
DAFTAR PUSTAKA
Aberoumand A. 2012. Proximate composition of less known some processed and fresh fish species for determination of the nutritive values in Iran. Journal of Agricultural Technology 8(3): 917-922.
Adebola BAK, Kayode SJ. 20013. Effects of lead and zinc on the proximate composition of post juvenile clarias gariepinus. International Journal of Nutrition and Food Sciences 2(2): 8-14.
Almatsier S. 2001. Prinsip Dasar Ilmu Gizi. Jakarta (ID): Gramedia Pustaka Utama. hlm 77-78:100:103-104.
Angka SL, Mokoginta I, Hamid H. 1990. Anatomi dan Histologi Banding beberapa Ikan Air Tawar yang Dibudidayakan di Indonesia. Bogor (ID): Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Institut Pertanian Bogor. hlm 17-27.
[AOAC] Association of Official Analytical Chemyst. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, (USA): Association of Official Analytical Chemist, Inc.
Arifin Z. 2008. Beberapa unsur mineral esensial mikro dalam sistem biologi dan metode analisisnya. Jurnal Litbang Pertanian 27 (3): 99-105.
Aslianti T, Priono A, 2009. Increasing vitality and survival rate of range spotted grouper, Epinephelus coioides seed fed vitamin c and calcium fortified diet Torani Jurnal Ilmu Kelautan dan Perikanan 19(1): 74-81.
Chaijan M. 2011. Physicochemical changes of tilapia (Oreochromis niloticus) muscle during salting. Food Chemistry 129: 1201–1210.
Chatterje S, Chattopadhyay B, Mukhopadhyay SK. 2006. Trace metal Distribution in tissues of Cichlids ( Oreochromis niloticus and O. mossambicus) collected from waste water fed fish pond in East Calcutta Wetlands, a Ramsar site. Acta Ichtyological Piscatoria 36 (2): 119-125. deMan JM. 1997. Kimia Makanan. Penerjemah: Padmawinata K. Bandung (ID):
ITB. Hlm 455.
Dempson IB, Schwarz CJ, Shears M, Furey G. 2004. Comparative proximate body composition of Atlantic salmon with emphasis on parr from fluvial and lacustrine habitats. Journal of Fish Biology 64:1257-1271.
[DJPB Kementrian Kelautan dan Perikanan] Direktorat Jenderal Perikanan Budidaya. 2013. Statistik menakar target ikan air tawar tahun 2013 [internet]. [diacu 2014 Maret 27]. Tersedia dari : http:www.djpb.kkp.go.id/berita.php?id=847.
Effendi, R. 2004. Pengantar Akuakultur. Jakarta (ID): Penebar Swadaya. Hal 121-123
16
Harjono RM, Oswari J, Ronardy DH, Santoso K, Setio M, Soenarno, Widianto G, Wijaya C, Winata I. 1996. Kamus Kedokteran Doeland. Jakarta (ID): Penerbit Buku Kedokteran EGC. Hal 113-115
Jacoeb AM, Cakti NW, Nurjanah. 2008. Perubahan komposisi protein dan asam amino daging udang ronggeng (Harpiosquilla raphidea) akibat perebusan. Buletin Teknologi Hasil Perairan 11(1):1-20.
Jeyasanta KI, Patterson J. 2014. Nutritive evaluation of trash fishes in Tuticorin (India). World Journal of Fish and Marine Sciences 6 (3): 275-288. Johnston IA, Bower NI, Macqueen DJ. 2011. Growth and regulation of myotomal
muscle mass in teleost fish. The Journal of Experimental Biology. 214:
[KKP] Kementerian Kelautan dan Perikanan 2013. Pemerintah Optimis Swasembada Ikan. www.kkp.go.id. [16 november 2014]
Lonergan EH. 2012. Water holding capacity of fresh meat. American Meat Science Association Fact Sheet: 1-8.
Lugo MG, Alvarez IG, Novoal MO, cordova GM. 2003. Comparison of growth, fillet yield and proximate composition between Stirling Nile tilapia (wild type) (Oreochromis niloticus, Linnaeus) and red hybrid tilapia (Florida red tilapia x Stirling red O. niloticus) males. Aquaculture Research 34: 1023-1028.
Mattjik AA, Sumertajaya IM. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I Edisi Kedua. Bogor (ID): IPB Press. Hlm 63-72.
Mayangsari, S. 2014. Profil Mineral baby fish ikan mas (Cyprinus carpio) pada berbagai umur panen. [Skripsi]. Bogor (ID): Institut Peratanian Bogor. Nawal AB. 2008. Heavy metal levels in most common available fish species in
Saudi market. Journal of Food Technology 6(4): 173-177.
NRC (National Research Council). 1993. Nutrient Requirements of Fish. Washington, DC. National Academic Press,
Nurjanah, Zulhamsyah, Kustiyariyah. 2005. Kandungan mineral dan proksimat kerang darah (Anadara granosa) yang diambil dari Kabupaten Boalemo, Gorontalo. Buletin Teknologi Hasil Perikanan 8(2): 15-24.
Penha-Lopez G, Rhyne A, Lin J, Narciso L. 2005. The larva rearing of the marine ornamental crab. Aquacult. Res. 36: 1313-1321
Prasath DP, Arivoli S. (2008). Biochemical study of freshwater fish Catla catla with reference to mercury chloride. Iranian Journal of Environmental Health, Science and Engineering. 5(2): 109-116.
Ramseyer LJ. 2002. Predicting whole-fish nitrogen content from fishwetweight using regression analysis. N. Am. J. Aquac. 64: 195–204.
Rasmussen RS, Ostenfeld TH. 2000. Effect of growth rate on quality traits and feed utilisation of rainbow trout (Oncorhynchus mykiss) and brook trout (Salvelinus fontinalis). Aquaculture. 184:327-337.
Reigh RC, Robinson EH, Brown PB, 1991. Effects of dietary magnesium on growth and mineral content of muscle, scale and bone of blue tilapia, Oreochromis aureus. J. World Aquacult. Soc 22(3): 192-200.
Rubbi SF, Muslemmudin M, Begum M, Jahan SS. 1984. Handing of six species of Bangladesh, Di dalam: Reilly A, editor. Spoilage of tropical fish and product development. Proceedings of Fish Technology and Marketing Symposium; 1984 Octobet 23-26; Royal Melbourne Institute of Technology, Melbourne, Australia.
Salam A, Ali M, Anas M. 2001. Body composition of Oreochromis mossambicus in relation to body size and condition factor. Journal of Research (Science), Bahauddin Zakariya University, Multan, Pakistan. 12(1);89-96.
Santos VB, Martins TR, Freitas FT. 2012. Body composition of nile tilapias (Oreochromis niloticus) in different length classes. Ci. Anim. Bras. Goiânia. 13(4): 396-405.
Sarkar UK, Khan GE, Dabas A, Pathak AK, Mir JI, Rebello SC, Pal A, Singh SP. 2013. Lenght weight relationship and condition factor of selected freshwater fish species found in River Ganga, Gomti and Rapti, India. Journal of Enviromental Biology. 34:951-956.
Sheridan MA. 1988. Lipid dynamics in fish : Aspects of absorption, transportation, deposition and mobilization. Comp. Biochem. Physiol. 90B(4): 679 – 690.
Stanek M, Janicki B, Kupcewicz C. 2005. Content of selected heavy metals in the organs of fish from Znin Duze Lake. Folia Biologica (Krakow) 53: 115-119. Sivaperumal P, Sankar TV, Viswanathan N. 2007. Heavy metal concentration in fish, selfish and fish products from internal markets of India vis-à-vis International standards. Food Chemistry 102: 612-620.
[SNI] Standar Nasional Indonesia.1992. SNI 01-2891-1992: Cara Uji Makanan dan Minuman. Jakarta (ID): Dewan Standardisasi Nasional.
Suwandi R, Nurjanah, Winem, M. 2014. Proporsi bagian tubuh dan kadar proksimat ikan gabus pada berbagai ukuran. Jurnal Pengolahan Hasil Perairan 17(1):24-26.
18
Winarno FG. 2008. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia Pustaka Utama. Hal 143-146
Wiramiharja Y, Hernawati R, Harahap IM, Yukiyasu N. 2007. Nutrisi dan Bahan Pakan Ikan Budidaya. Jambi: Balai Budidaya Ikan Tawar.
RIWAYAT HIDUP
Penulis bernama lengkap Lia Maulinah Angriani. Penulis dilahirkan di DKI Jakarta, 10 September 1992 sebagai anak kedua dari tiga bersaudara dari pasangan Bapak H. Drs. L. Syarifuddin, HMY. SH dan Ibu Hj. Siti Nurhasanah, SH, MH. Penulis memulai jenjang pendidikan formal di Sekolah Dasar Negeri 05 Pulo gebang pagi, Jakarta timur pada tahun 1998 dan lulus tahun 2004, kemudian penulis melanjutkan Sekolah Menengah Pertama di SMP Negeri 172 Jakarta timur dan lulus pada tahun 2007. Penulis menamatkan Sekolah Menengah Atas di SMA Negeri 89 Jakarta dan lulus pada tahun 2010.
Pada tahun 2010 penulis diterima di IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI) di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.