PROFIL ASAM AMINO DAN JARINGAN
BABY FISH
NILA
(
Oreochromis niloticus
) PADA UMUR PANEN YANG BERBEDA
ARIF YANUAR RIDWAN
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Profil Asam Amino dan Jaringan Baby fish Nila (Oreochromis niloticus) pada Umur Panen yang Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Arif Yanuar Ridwan
ABSTRAK
ARIF YANUAR RIDWAN. Profil Asam Amino dan Jaringan Baby Fish Nila pada Umur Panen yang Berbeda. Dibimbing oleh AGOES M. JACOEB dan NURJANAH.
Baby fish nila merupakan ikan yang mudah didapatkan dan menjadi trend olahan pangan saat ini. Tujuan penelitian ini adalah menentukan komposisi kimia, asam amino serta pengamatan jaringan baby fish nila segar dengan perbedaan umur panen 2 hingga 4 minggu. Metode analisis asam amino menggunakan HPLC dan analisis jaringan dengan metode parafin. Komposisi kimia baby fish nila pada setiap umur panen cenderung identik, pada kadar abu dan karbohidrat naik secara signifikan (p<0,05). Asam glutamat merupakan asam amino dengan jumlah tertinggi pada
baby fish nila (7,75%; 7,17%; 6,7%). Asam amino esensial tertinggi pada berbagai umur panen yakni leusin (3,97%; 3,65%; 3,42%). Pengamatan jaringan menunjukkan bahwa struktur jaringan otot baby fish segar terdiri atas epitel,
myomere, notochord, dan myoseptum. Myomere umur panen 2 minggu relatif berukuran kecil dan lebih sedikit dibanding umur panen 3 minggu dan 4 minggu. Villi dan sel-sel mukus pada umur panen 2 minggu sudah berkembang, namun
enterocyte cell belum nampak pada pengamatan.
Kata kunci: asam amino, baby fish nila, jaringan, proksimat, umur panen.
ABSTRACT
ARIF YANUAR RIDWAN. Amino Acid and Tissue Profile’s of Baby Tilapia Fish by Different Age. Supervised by AGOES M. JACOEB and NURJANAH.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
PROFIL ASAM AMINO DAN JARINGAN
BABY FISH
NILA
(
Oreochromis niloticus
) PADA UMUR PANEN YANG BERBEDA
Judul Skripsi : Profil Asam Amino dan Jaringan Baby Fish Nila (Orechromis niloticus) pada Umur Panen yang Berbeda
Nama : Arif Yanuar Ridwan NIM : C34100034
Program studi : Teknologi Hasil Perairan
Disetujui oleh,
Dr Ir Agoes Mardiono Jacoeb, Dipl-Biol Prof Dr Ir Nurjanah, MS Pembimbing I Pembimbing II
Diketahui oleh,
Prof Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan November 2013 dengan judul skripsi Profil Asam Amino dan Jaringan Baby Fish Nila (Orechromis niloticus) pada Umur Panen yang Berbeda.
Dalam kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan penelitian ini, yaitu:
1. Dr Ir Agoes Mardiono Jacoeb Dipl-Biol dan Prof Dr Ir Nurjanah, MS selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini.
2. Dr Ir Djoko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan. 3. Seluruh dosen, pegawai, dan staf TU Departemen Teknologi Hasil Perairan
atas bantuannya selama ini.
4. Ayah dan Ibu tercinta yang telah memberikan semangat, dukungan moril dan materi serta cinta yang luar biasa kepada penulis.
5. Sri Wahyuningsih, Bianca, Santos, Laurensius, Mayang yang telah membantu selama penelitian.
6. Teman-teman THP 47 untuk kebersamaan dan kerjasama selama menempuh studi di THP.
Semoga karya ilmiah ini bermanfaat.
Bogor, 06 Mei 2014
DAFTAR ISI
DAFTAR TABEL
1 Morfometrik ikan nila pada berbagai umur panen ... 9 2 Komposisi kimia ikan nila pada berbagai umur panen (bb) ... 9
DAFTAR GAMBAR
1 Diagram alir kerangka penelitian ... 3 2 Diagram alir pembuatan preparat metode parafin ... 7 3 Baby fish nila (O. niloticus) ... 8 4 Kandungan asam amino non essensial baby fish ikan nila ... 12 5 Kandungan asam amino essensial baby fish ikan nila ... 13 6 Penampang melintang pencernaan baby fish nila umur 2 minggu ... 15 7 Penampang melintang otot baby fish nila umur 2.minggu ... 16 8 Penampang melintang otot baby fish nila ... 17
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Ikan merupakan salah satu bahan pangan yang mudah didapatkan, terjangkau, dan mampu bersaing dengan komoditas daging lainnya untuk memenuhi gizi masyarakat Indonesia. Hal ini didukung oleh produksi ikan pada tahun 2013 yang mencapai 15 juta ton dan meningkatnya konsumsi ikan masyarakat Indonesia pada tahun 2012 sebesar 33 kg per kapita (KKP 2013). Berbagai spesies ikan air tawar dan air laut sudah dimanfaatkan masyarakat untuk dikonsumsi, salah satunya ialah ikan nila (Oreochromis niloticus). Ikan nila banyak diminati masyarakat karena rasa daging yang gurih dan tekstur daging menyerupai ikan kakap. Permintaan ikan nila terus meningkat pada tahun 2010 hingga 2013 dengan kenaikan rata-rata 26,36% dan pada tahun 2013 produksi ikan nila sebesar 1,105,000 ton (KKP 2013).
Ikan nila merupakan sumber protein hewani yang mudah untuk didapatkan oleh berbagai kalangan masyarakat. Protein hewani mempunyai nilai biologis lebih tinggi dibandingkan dengan protein nabati, karena protein hewani memiliki komposisi dan kadar asam amino yang lebih lengkap. Asam amino dapat dikelompokkan ke dalam dua golongan utama, yaitu asam amino esensial dan asam amino non esensial. Asam amino esensial merupakan asam amino yang tidak dapat dibuat oleh tubuh dan harus diperoleh dari makanan sumber protein. Asam amino non esensial adalah asam amino yang dapat dibuat oleh tubuh manusia (Winarno.2008).
Akhir-akhir ini masyarakat cenderung mengonsumsi ikan dengan ukuran yang lebih kecil atau dikenal dengan baby fish. Baby fish, merupakan ikan yang masih dalam tahap juvenile dengan umur 3-5 minggu, tergantung jenis ikan (Amri dan Khairuman 2007). Baby fish disebut juga fingerling ukurannya sepanjang jari, umumnya memiliki panjang 1,7cm hingga 23,3cm (Guo et al. 2008) Baby fish
digemari karena rasanya lebih enak dan pengolahannya tanpa penyiangan. Jenis olahan baby fish yang populer di Jawa Barat yakni ikan balita goreng dengan bahan baku antara lain ikan mas, ikan nilem, dan ikan nila. Baby fish rasanya gurih dan diduga memiliki kandungan gizi yang lebih tinggi terutama asam amino, asam lemak dan mineral dibandingkan ikan dewasa, oleh karena itu perlu penelitian dan pengembangan mengenai kandungan gizi baby fish nila yang didasari umur panen.
Tujuan Penelitian
2
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat baik bagi pengembangan ipteks dan masyarakat, yaitu:
1. Melengkapi database komposisi kimia dan jaringan ikan nila berdasarkan umur panen dan sebagai acuan dasar penelitian lanjutan.
2. Menerangkan informasi gizi bagi konsumen dan petani baby fish nila. Ruang Lingkup Penelitian
Ruang lingkup penelitian ini meliputi pengambilan sampel, analisis proksimat, analisis asam amino, analisis jaringan, pengolahan data serta penulisan laporan.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2013 sampai Januari 2014. Sampel berasal dari tambak nila di Waduk Jatiluhur, Purwakarta. Uji proksimat dilakukan di Laboratorium Balai Besar Pascapanen Pertanian, Cimanggu, Bogor. Analisis jaringan dilakukan di Laboratorium Histologi Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis asam amino dilakukan di Laboratorium Terpadu IPB, Baranang Siang, Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah baby fish nila dengan umur panen 2 minggu, 3 minggu, dan 4 minggu. Analisis proksimat menggunakan bahan aquades, H2SO4, NaOH, HCl, H3BO4 dan pelarut heksana.
Bahan yang digunakan dalam analisis asam amino adalah natrium hidroksida, asam borat, larutan brij-30 30 %, 2-merkaptoetanol, larutan standar asam amino 0,5 mikromol/mL, Na EDTA, methanol, aquades, Na-asetat, tetrahidrofuran (THF) dan larutan ortoftalaldehid. Bahan-bahan yang dibutuhkan untuk analisis jaringan, larutan FAA (Formaldehida, Asam asetat glasial dan Alkohol), etanol absolut, TBA (Tertier Butil Alkohol), minyak parafin, parafin, xilol, hematoksilin, eosin, etanol, larutan seri Johansen.
karton cetak, oven, mikrotom Yamoto RV-240, meja pemanas, gelas obyek, dan rak pewarna. Sedangkan untuk proses pengamatan digunakan mikroskop cahaya merk Olympus CX41 dan kamera mikroskop merk Olympus DP12.
Metode Analisis
Penelitian diawali dengan pengambilan sampel dalam keadaan hidup. Sampel ditimbang kemudian dilakukan analisis morfometrik baby fish nila pada umur 2, 3, 4 minggu setelah pendederan masing-masing sebanyak 30 ekor, selanjutnya dilakukan analisis proksimat, dan asam amino. Analisis proksimat, dan asam amino dilakukan pada kondisi segar dan utuh dengan umur 2 minggu, 3 minggu, dan 4 minggu. Proses analisis proksimat mengacu pada SNI 1992-01-2891. Komposisi asam amino ditentukan dengan metode HPLC Shimadzu RF 20A yang mengacu pada AOAC 2005. Analisis jaringan menggunakan metode parafin yang mengacu pada Angka et al. (1990).
Gambar 1 Diagram alir kerangka penelitian
Analisis Proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar air, abu, lemak, protein dan abu tak larut asam.
1) Analisis kadar air (SNI 1992-01-2891)
Cawan porselen dikeringkan dalam oven selama 30 menit, lalu cawan didiamkan dalam desikator selama 15 menit. Selanjutnya cawan ditimbang hingga menunjukkan berat yang konstan. Selanjutnya sampel sebanyak 2 gram ditimbang dalam cawan dan dikeringkan dalam oven pada suhu 105oC selama 3 jam atau sampai beratnya konstan. Cawan beserta isinya kemudian didinginkan sampai suhu ruang dalam desikator dan ditimbang hingga diperoleh bobot tetap. Perhitungan kadar air dapat dilihat sebagai berikut:
Kadar air (%) = −
−
�
%
Analisis morfometrik
Baby fish nila 2,3,4 minggu
4
Keterangan :
A = berat cawan kosong (gram)
B = berat cawan + sampel awal (gram) C = berat cawan + sampel kering (gram) 2) Analisis kadar abu (SNI 1992-01-2891)
Cawan pengabuan dikeringkan di dalam oven selama satu jam pada suhu 105.oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel yang telah ditimbang sebanyak 5 g dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 1 jam, selanjutnya dimasukkan ke dalam desikator
hingga suhu ruang, kemudian ditimbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus:
Kadar abu (%) = −
−
�
%
Keterangan :
A = berat cawan porselen kosong (gram) B = berat cawan dengan sampel (gram)
C = berat cawan dengan sampel setelah dikeringkan (gram) 3) Analisis kadar protein (SNI 1992-01-2891)
Tahap analisis protein terdiri dari tiga, yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikrokjeldahl. Sampel ditimbang sebanyak 1 gram, kemudian dimasukkan ke dalam labu kjeldahl 100 mL, lalu ditambah 0,25 gram selenium dan 3 mL H2SO4 pekat. Contoh didestruksi pada
suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu kjeldahl ditambahkan 50 mL akuades dan 20 mL NaOH 40%, kemudian didestilasi dengan suhu destilator 100oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 mL yang berisi campuran 10 mL asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna
merah muda. Setelah volume destilat mencapai 40 mL dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat lalu dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
%N = (S-B)x NHCL x 14 x 100 % w x 1000
Keterangan:
S = Volume titran sampel (mL) B = Volume titran blanko (mL) W = Bobot sampel kering (mg)
% Kadar Protein: % Nitrogen x faktor konversi
Keterangan : Protein mengandung rata-rata 16 % nitrogen. Faktor konversi = 100 %
4) Kadar lemak (SNI 1992-01-2891)
Sebanyak 2 gram sampel disebar di atas kapas yang beralas kertas saring dan digulung membentuk thimble, kemudian dimasukkan ke dalam labu soxhlet. Sampel diekstraksi selama 6 jam dengan pelarut lemak berupa heksan sebanyak 150 mL. Lemak yang terekstrak dikeringkan dalam oven pada suhu 100 oC selama 1
jam. Kadar lemak dihitung dengan rumus:
Kadar lemak = Bobot lemak terekstrak x 100 % Bobot sampel
Analisis Asam Amino (AOAC 2005 dengan modifikasi)
Komposisi asam amino ditentukan menggunakan HPLC. Langkah pertama yang dilakukan adalah membilas perangkat HPLC dengan eluen berupa buffer Na-asetat pH 6,5 dan metanol 95% selama 2-3 jam. Syringe yang akan digunakan juga dibilas dengan akuades. Analisis asam amino dengan HPLC terdiri atas 4 tahap, yaitu (1) tahap pembuatan hidrolisat protein; (2) tahap pengeringan; (3) tahap derivatisasi; dan (4) tahap injeksi serta analisis asam amino.
1) Tahap pembuatan hidrolisat protein
Sampel pertama-tama ditimbang sebanyak 30 mg kemudian dihancurkan. Sampel yang telah hancur dihidrolisis asam menggunakan HCl 6 N sebanyak 2 mL yang kemudian dipanaskan dalam oven pada suhu 110 °C selama 24 jam.
2) Tahap pengeringan
Sampel yang telah dihidrolisis pada suhu kamar dipindahkan isinya ke dalam labu evaporator 50 mL, dibilas dengan 2 mL HCl 0,01 N. Sampel dan cairan bilasan kemudian disaring dengan kaca masir ukuran 2 dan dimasukkan ke dalam labu evaporator. Proses tersebut diulangi 2-3 kali. Sampel selanjutnya dikeringkan menggunakan rotary evaporator selama 15-30 menit pada suhu 70 °C. Sampel yang sudah kering ditambah dengan 5 mL HCl 0,01 N kemudian disaring dengan mikrofilter berukuran 0,45 µm.
3) Tahap derivatisasi
Larutan derivatisasi dibuat dengan menambahkan buffer kalium borat 1 M pH 10,4 pada sampel dengan perbandingan 1:1. Sebanyak 50 μL larutan derivatisasi dimasukkan ke dalam vial kosong yang bersih kemudian ditambah 250 μL pereaksi phthaldialdehid. Larutan pereaksi phthaldialdehid dibuat dengan cara melarutkan 50 mg phthaldialdehid ke dalam 4 mL metanol absolut, kemudian ditambah dengan 0,025 mL merkaptoetanol, larutan brij 30% sebanyak 0,050 mL dan buffer kalium borat 1 M pH 10,4 sebanyak 1 mL.
4) Injeksi ke HPLC
Larutan diinjeksikan sebanyak 5 μL ke dalam HPLC. Pemisahan asam amino dilakukan selama ±30 menit. Perhitungan konsentrasi asam amino yang ada pada bahan dilakukan dengan pembuatan kromatogram standar dengan menggunakan asam amino yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel. Kandungan asam amino dalam 100 gram bahan dapat dihitung dengan rumus :
µmol asam amino = luas area sampel
luas area standar x C x FP
6
FP = Faktor pengenceran (5 mL)
% asam amino = µmol asam amino x Mr asam amino
mg sampel x 100%
Kondisi alat HPLC saat dilakukannya analisis asam amino adalah sebagai berikut:
Temperatur : 27°C (suhu ruang)
Jenis kolom HPLC : Ultra techspere (Coloumb C-18) Kecepatan alir eluen : 1 mL/menit
Tekanan : 3000 psi
Fase gerak : Buffer Na-asetat dan metanol 95% Detektor : Fluoresensi
Panjang gelombang : 254 nm Analisis Histologis (Angka et al. 1990)
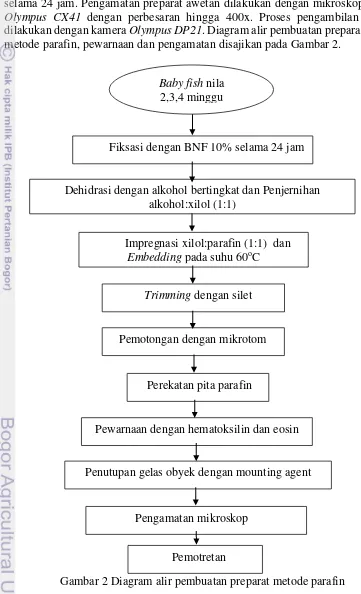
Pengamatan jaringan daging baby fish ikan nila diawali dengan pembuatan preparat dengan metode parafin. Tahap pembuatan preparat meliputi fiksasi, dehidrasi, clearing, impregnasi, embedding, blocking, trimming, pemotongan jaringan, pewarnaan, serta perekatan jaringan menggunakan mounting agent.
Fiksasi dilakukan dalam larutan BNF (Buffer Normal Formalin) selama lebih dari 36 jam, larutan fiksasi dibuang dan didehidrasi melalui perendaman sampel dalam alkohol bertingkat pada suhu ruang dengan alkohol 70% selama 24 jam, 80% selama 2 jam, 90% selama 2 jam, 95% selama 2 jam, 95% selama 2 jam, 95% selama 2 jam, 100% selama 12 jam.
Proses clearing dimulai dari perendaman sampel dalam clearing agent. Sampel direndam dalam alkohol:xilol (1:1) selama 30 menit yang dilanjutkan dengan tahap impregnasi dan embedding. Tahap Impregnasi adalah perendaman sampel ke dalam xilol:parafin (1:1) dalam gelas piala selama 45 menit. Embedding
adalah perendaman sampel di dalam parafin cair selama 45 menit. Kedua proses ini berlangsung di dalam oven pada suhu 60 oC.
Sampel yang telah dilakukan embedding dalam parafin cair lalu di blok (dicetak) dengan parafin cair yang kemudian dibekukan. Proses ini membutuhkan cetakan yang dapat dibuat dari kertas yang kaku, misalnya kertas kalender, dengan ukuran 2x2x2 cm3. Parafin cair dituangkan ke dalam cetakan hingga memenuhi sekitar 1/8 bagian cetakan dan dibiarkan hingga sedikit membeku. Sampel kemudian disusun dalam cetakan dan dituangi parafin cair hingga terendam, serta dibiarkan membeku dalam suhu ruang selama 24 jam. Setelah parafin beku dengan sempurna, blok parafin dikeluarkan dari cetakan lalu dilakukan trimming
menggunakan silet.
direndam kembali dalam pewarna eosin selama 3 menit dan dicuci kembali dengan akuades. Preparat jaringan kemudian direndam dalam alkohol 50%, 70%, 85%, 90%, 100%, 100%, xilol I, xilol II masing-masing selama 2 menit.
Proses selanjutnya adalah penutupan gelas obyek dengan pemberian
mounting agent atau Canada Balsam pada gelas obyek, kemudian dikeringkan selama 24 jam. Pengamatan preparat awetan dilakukan dengan mikroskop cahaya
Olympus CX41 dengan perbesaran hingga 400x. Proses pengambilan gambar dilakukan dengan kamera Olympus DP21. Diagram alir pembuatan preparat dengan metode parafin, pewarnaan dan pengamatan disajikan pada Gambar 2.
Gambar 2 Diagram alir pembuatan preparat metode parafin
Baby fish nila 2,3,4 minggu
Fiksasi dengan BNF 10% selama 24 jam
Dehidrasi dengan alkohol bertingkat dan Penjernihan alkohol:xilol (1:1)
Impregnasi xilol:parafin (1:1) dan
Embedding pada suhu 60oC Trimming dengan silet
Pemotongan dengan mikrotom
Perekatan pita parafin
Pewarnaan dengan hematoksilin dan eosin
Penutupan gelas obyek dengan mounting agent
Pengamatan mikroskop
8
Analisis Data Proksimat dan Asam Amino
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) pola faktorial dengan satu faktor yaitu perbedaan umur panen sebagai faktor perlakuan, dengan tiga kali ulangan. Pengolahan data dilakukan dengan menggunakan analisis data Anova microsoft excel dan perangkat lunak Statistical Package for Social Science (SPSS). Model matematika rancangan acak lengkap pola faktorial menurut Stell dan Torrie (1995) adalah sebagai berikut:
Yijk = μ + αi + εi Keterangan :
Yijk = nilai pengamatan pada satuan percobaan ke-k (k= 1, 2) yang memperoleh kombinasi perlakuan faktor α (frekuensi pencucian) taraf ke-i (i= 1, 2). μ = nilai tengah populasi.
αi = pengaruh faktor umur panen ( 2 minggu, 3 minggu, 4 minggu). εi = pengaruh galat dari satuan percobaan ke-k pada perlakuan i.
HASIL DAN PEMBAHASAN
Morfometrik Baby Fish Nila
Ikan nila yang digunakan pada penelitian berasal dari Waduk Jatiluhur, Purwakarta. Ikan nila ditransportasikan dalam keadaan hidup. Ikan masih dalam bentuk utuh dengan umur 2, 3, 4 minggu dan dapat dilihat pada Gambar.3.
(a) (b)
(c)
Ikan nila yang digunakan dalam penelitian ini memiliki ciri-ciri: bentuk tubuh pipih, ukuran kepala kecil, mata yang cukup besar, serta warna tubuh hitam agak keputihan, sisik sudah terbentuk. Hasil pengukuran morfometrik ikan nila disajikan pada Tabel 1.
Tabel 1 Morfometrik ikan nila pada berbagai umur panen
Parameter Umur panen
2 minggu 3 minggu 4 minggu Panjang total (cm) 1,80 ± 0,38 3,02 ± 0,20 4,80 ± 0,18 Berat (gram) 0,13 ± 0,04 0,49 ± 0,10 3,11 ± 0,54
Data Sampel 30 ekor
Perbedaan ukuran dan berat ikan nila dapat dipengaruhi oleh pertumbuhan. Pertumbuhan adalah perubahan ukuran, baik berat, panjang maupun volume dalam laju perubahan waktu. Pertumbuhan dipengaruhi oleh beberapa faktor yaitu faktor internal dan eksternal. Faktor internal merupakan faktor yang sukar untuk dikontrol, contohnya sifat genetik dan kondisi fisiologi. Sedangkan faktor eksternal merupakan faktor yang dapat dikontrol, di antaranya adalah ketersediaan makanan, ketersediaan oksigen, komposisi kimia air, sisa metabolisme dan suhu (Effendie.1997).
Proksimat Baby Fish Nila
Sifat dari setiap unsur pokok yang terdapat dalam bahan pangan perlu diketahui untuk mengembangkan bahan pangan tersebut. Metode yang lazim dilakukan adalah analisis proksimat. Analisis proksimat dilakukan untuk mengetahui komposisi kimia secara kasar (crude) yang meliputi kadar air, abu, protein, lemak dan karbohidrat. Kandungan karbohidrat dihitung secara by difference. Analisis dilakukan pada ikan nila utuh dengan umur panen 2, 3, 4 minggu setelah pendederan. Contoh perhitungan analisis proksimat dapat dilihat pada Lampiran 1. Komposisi kimia ikan nila pada berbagai umur panen disajikan pada Tabel 2.
Tabel 2 Komposisi kimia ikan nila pada berbagai umur panen (bb)
10
Kadar Air
Ikan nila dengan umur panen 2 minggu memiliki kadar air (81,83%) lebih tinggi dan berbeda nyata (p < 0,05) dibandingkan pada umur panen 3 minggu dan 4 minggu. Hasil ini tidak berbeda jauh dengan hasil penelitian Lugo et al. (2003) yang menunjukkan kadar air ikan nila umur 14 minggu sebesar 79,1% dan Chaijan (2011) sebesar 80,08%. Sanchez et al. (2012) menyatakan kadar air pada ikan nila berkisar 72-80%. Hal ini menunjukkan ikan nila merupakan bahan pangan yang bersifat mudah rusak (high perishable food). Kandungan air dalam bahan makanan ikut menentukan daya terima, kesegaran dan daya simpan bahan tersebut (Winarno 2008).
Kadar Abu
Kadar abu menunjukkan peningkatan dari umur panen 2 minggu sebesar 1,48%, umur panen 3 minggu 2,49% dan 2,60% pada umur panen 3 minggu. Umur panen 2 minggu memiliki kadar abu terendah. Hasil ini lebih besar dibandingkan yang dilakukan oleh Lugo et al. (2003) yang menunjukkan kadar abu nila 14 minggu sebesar 0,63% dan Chaijan (2011) sebesar 0,69%. Trilaksani et al. (2006) menyampaikan bahwa komponen penyusun tulang ialah mineral, sehingga hasil pengujian kadar abu pada umur panen 2-4 minggu menunjukkan peningkatan.
Mineral memiliki peranan yang sangat penting dalam proses pembentukan tulang untuk memacu pertumbuhan. Hewan air membutuhkan mineral untuk membentuk tulang belakang, jari-jari sirip, membentuk bagian eksoskeleton, haemoglobin, penyampaian impuls dari syaraf pusat dan berperan dalam osmoregulasi tubuh. Selain itu mineral juga berperan untuk meningkatkan kerja syaraf dalam menyampaikan impuls, memperlancar osmoregulasi dan sebagai kofaktor dalam memperlancar kerja enzim dalam tubuh hewan air (Aslianti dan.Priyono 2009).
Kadar Protein
Uji kadar protein menunjukkan bahwa baby fish umur panen 2, 3, dan 4 minggu memiliki kadar protein sebesar 13,92%, 13,79% dan 13,30%. Kadar protein umur 4 minggu mengalami penurunan secara signifikan (p<0,05) dibanding umur 2 dan 3 minggu. Hasil ini lebih rendah dibandingkan dengan yang didapatkan oleh Lugo et al. (2003), yakni sebesar 17,00% dan Chaijan (2011) sebesar 17,94%. Ikan nila menurut Sanchez et al. (2012) memiliki kadar protein berkisar 13-25%. Terjadinya perbedaan kadar protein diduga dipengaruhi oleh aktivitas metabolik setiap umur panen ikan. Alemu et al. (2013) memaparkan penurunan protein disebabkan penggunaan substrat organik untuk pertumbuhan.
Kadar Lemak
Kadar lemak menunjukkan umur panen 2 minggu sebesar 2,41%, 2,30% pada umur panen 3 minggu dan hasil terendah sebesar 1,97% pada umur panen 4 minggu. Hasil ini sesuai dengan yang didapatkan Lugo et al. (2003) yakni sebesar 2,07% dan Chaijan (2011) sebesar 1,04%.
Rendahnya kandungan lemak diduga karena umur ikan nila yang 2-4 minggu belum memiliki organ otot dan hati yang belum terbentuk sempurna. Sheridan (1988) memaparkan bahwa lokasi penyimpanan lemak utama dalam tubuh ikan adalah otot dan hati, ada juga yang tersimpan sebagai lemak mesentrik. Kandungan lemak dalam otot ikan sangat bervariasi, hal ini sangat bergantung pada spesies, umur, pemijahan, pakan dan tipe otot (Gehring et al. 2009). Faktor lingkungan misal suhu, salinitas dan cahaya juga mempengaruhi komposisi lipida pada jaringan tubuh larva, dengan demikian kebutuhan asam lemak esensial juga sangat dipengaruhi oleh kondisi lingkungan yang ada (Penha-Lopez et al. 2005).
Lemak didefinisikan sebagai bahan-bahan yang dapat larut dalam eter, kloroform (benzene) dan tidak larut dalam air. Lemak merupakan sumber energi yang lebih efektif dibandingkan karbohidrat dan protein. Satu gram lemak dapat menghasilkan 9 kkal/gram, sedangkan karbohidrat dan protein hanya menghasilkan 4 kkal/gram. Lemak juga berfungsi memberi rasa gurih, sebagai pelarut vitamin A, D, E dan K, melindungi organ-organ tubuh dan memperbaiki tekstur dan cita rasa bahan pangan (Nasoetion et al. 1994).
Kadar Karbohidrat
Hasil perhitungan by difference menunjukkan baby fish nila umur 2,3, dan 4 minggu berbeda secara signifikan (p<0,05) dengan kadar karbohidratnya berturut-turut nilainya 0,29%, 0,63%, dan 1,47%. Hasil ini identik dengan penelitian Lugo
et al. (2003) pada nila 98 hari (by difference) yang memberikan nilai 1,18% dan Chaijan (2011) sebesar 0,25%. Perbedaan nilai karbohidrat diduga akibat perkembangan otot ikan pada setiap umur panen melalui produksi glikogen dalam tubuh. Santos et al. (2012) menyatakan peningkatan masa otot terjadi seiring bertambahnya umur ikan, dalam hal ini berkorelasi dengan peningkatan karbohidrat dalam bentuk glikogen otot.
Karbohidrat yang terdapat dalam seafood tidak mengandung serat, kebanyakan dalam bentuk glikogen (Jacoeb et al. 2008). Glikogen banyak terdapat pada hati dan otot. Glikogen terdapat pada otot-otot hewan, manusia dan ikan. Glikogen juga disimpan dalam hati hewan sebagai cadangan energi yang sewaktu-waktu dapat diubah menjadi glukosa (Winarno 2008). Glikogen disebut juga sebagai pati hewan karena diproduksi dari glukosa di dalam tubuh. Glikogen dipergunakan oleh hewan untuk memasok energi bagi jaringan tubuh pada saat bergerak (Nasoetion et al. 1994).
Profil Asam Amino Baby Fish Nila
12
pada tahap hidrolisis protein, pengeringan dan derivatisasi. Hasil analisis asam amino ikan nila dalam keadaan segar dan perbedaannya dengan umur panen dapat dilihat pada Gambar 4 dan Gambar 5.
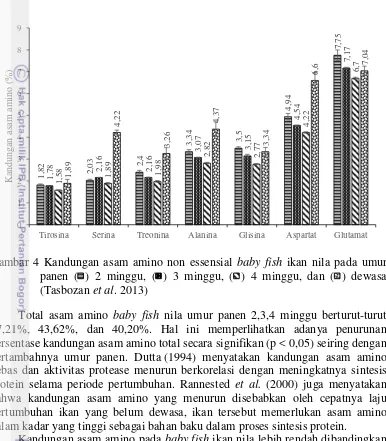
Gambar 4 Kandungan asam amino non essensial baby fish ikan nila pada umur panen ( ) 2 minggu, ( ) 3 minggu, ( ) 4 minggu, dan ( ) dewasa (Tasbozan et al. 2013)
Total asam amino baby fish nila umur panen 2,3,4 minggu berturut-turut 47,21%, 43,62%, dan 40,20%. Hal ini memperlihatkan adanya penurunan persentase kandungan asam amino total secara signifikan (p < 0,05) seiring dengan bertambahnya umur panen. Dutta.(1994) menyatakan kandungan asam amino bebas dan aktivitas protease menurun berkorelasi dengan meningkatnya sintesis protein selama periode pertumbuhan. Rannested et al. (2000) juga menyatakan bahwa kandungan asam amino yang menurun disebabkan oleh cepatnya laju pertumbuhan ikan yang belum dewasa, ikan tersebut memerlukan asam amino dalam kadar yang tinggi sebagai bahan baku dalam proses sintesis protein.
Kandungan asam amino pada baby fish ikan nila lebih rendah dibandingkan penelitian yang dilakukan Adeyeye (2009) yang mendapatkan total asam amino nila dewasa sebesar 59,19%. Tingginya kandungan asam amino pada ikan nila dewasa disebabkan oleh kebutuhan asam amino sudah tidak diutamakan untuk pertumbuhan jika dibandingkan dengan ikan juvenile. Pertumbuhan somatik, pertumbuhan kelenjar reproduksi, perkembangan dan pembangunan jaringan baru ataupun perbaikan jaringan yang rusak selalu membutuhkan protein secara optimal, selalu diperlukan adanya suplai protein (Buwono 2000).
Kandungan asam amino non esensial tertinggi pada nila dewasa yaitu asam glutamat. Kandungan asam glutamat pada baby fish umur panen 2 minggu, 3 minggu, dan 4 minggu cenderung lebih rendah jika dibandingkan hasil penelitian Tasbozan et al. (2013). Sebaliknya terjadi penurunan yang nyata (p<0,05) kandungan glutamat pada rentang umur panen 2-4 minggu.
1
Tirosina Serina Treonina Alanina Glisina Aspartat Glutamat
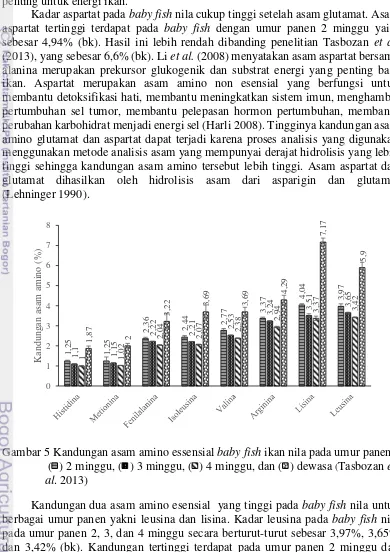
Asam glutamat merupakan asam amino dengan jumlah tertinggi pada baby fish nila. Nilai yang didapatkan pada umur panen 2,3,4 minggu berurutan yaitu 7,75%, 7,17%, dan 6,70% (bk). Asam glutamat termasuk asam amino non esensial yang bermuatan polar. Asam glutamat dapat diproduksi sendiri oleh tubuh manusia. Asam glutamat menimbulkan rasa gurih pada lidah. Li et al. (2008) menyatakan glutamat dapat menstimulasi pembentukan protein otot dan merupakan substrat penting untuk energi ikan.
Kadar aspartat pada baby fish nila cukup tinggi setelah asam glutamat. Asam aspartat tertinggi terdapat pada baby fish dengan umur panen 2 minggu yaitu sebesar 4,94% (bk). Hasil ini lebih rendah dibanding penelitian Tasbozan et al.
(2013), yang sebesar 6,6% (bk). Li et al. (2008) menyatakan asam aspartat bersama alanina merupakan prekursor glukogenik dan substrat energi yang penting bagi ikan. Aspartat merupakan asam amino non esensial yang berfungsi untuk membantu detoksifikasi hati, membantu meningkatkan sistem imun, menghambat pertumbuhan sel tumor, membantu pelepasan hormon pertumbuhan, membantu perubahan karbohidrat menjadi energi sel (Harli 2008). Tingginya kandungan asam amino glutamat dan aspartat dapat terjadi karena proses analisis yang digunakan menggunakan metode analisis asam yang mempunyai derajat hidrolisis yang lebih tinggi sehingga kandungan asam amino tersebut lebih tinggi. Asam aspartat dan glutamat dihasilkan oleh hidrolisis asam dari asparigin dan glutamin (Lehninger.1990).
Gambar 5 Kandungan asam amino essensial baby fish ikan nila pada umur panen .( ) 2 minggu, ( ) 3 minggu, ( ) 4 minggu, dan ( ) dewasa (Tasbozan et al. 2013)
Kandungan dua asam amino esensial yang tinggi pada baby fish nila untuk berbagai umur panen yakni leusina dan lisina. Kadar leusina pada baby fish nila pada umur panen 2, 3, dan 4 minggu secara berturut-turut sebesar 3,97%, 3,65% dan 3,42% (bk). Kandungan tertinggi terdapat pada umur panen 2 minggu dan menurun seiring bertambahnya umur panen. Leusina merupakan asam amino yang paling banyak ditemui pada bahan pangan sumber protein. Leusina dapat memacu
14
fungsi otak, menambah tingkat energi otot, membantu menurunkan kadar gula darah yang berlebihan, membantu penyembuhan tulang, jaringan otot dan kulit (terutama untuk mempercepat penyembuhan luka post-operative) (Harli 2008). Leusina juga berfungsi dalam menjaga sistem imun (Edison 2009).
Lisina merupakan asam amino esensial dominan kandungannya setelah leusina. Kadar lisina pada umur panen 2 minggu sebesar 4,04% (bk), 3,51% (bk) pada umur panen 3 minggu dan 4 minggu sebesar 3,37% (bk). Kadar lisina umur panen 2 minggu berbeda secara signifikan (p<0,05) dengan umur panen 3 dan 4 minggu. Lisina tergolong esensial bagi manusia dan kebutuhan rata-rata per hari adalah (1,0-.1,5) gram. Lisina menjadi kerangka dalam pembentukan niasin (Vitamin B3), bahan dasar antibodi darah, memperkuat sistem sirkulasi, dan mempertahankan pertumbuhan sel-sel normal. Kekurangan lisina menyebabkan mudah lelah, sulit konsentrasi, rambut rontok, anemia, pertumbuhan terhambat dan kelainan reproduksi (Harli 2008).
Tingginya kadar leusina dan lisina pada baby fish nila sesuai dengan hasil penelitian Tasbozan et al. (2013) walaupun nilai yang didapatkan lebih tinggi. Kandungan leusina dan lisina baby fish menurun seiring bertambahnya umur panen. Perbedaan tersebut dapat disebabkan oleh adanya perbedaan umur, musim penangkapan, serta tahapan dalam daur hidup organisme (Litaay 2005).
Beberapa kebutuhan asam amino esensial harian per bobot tubuh yang diperlukan menurut WHO (2007) yakni histidina 10mg/kg, isoleusina 20mg/kg, leusina 39mg/kg, lisina 30mg/kg, metionina 10mg/kg, fenilalanina+tirosina 25mg/kg, treonina 15mg/kg, dan valina 26mg/kg. Berdasarkan hasil penelitian,
Deskripsi Jaringan Baby Fish Nila
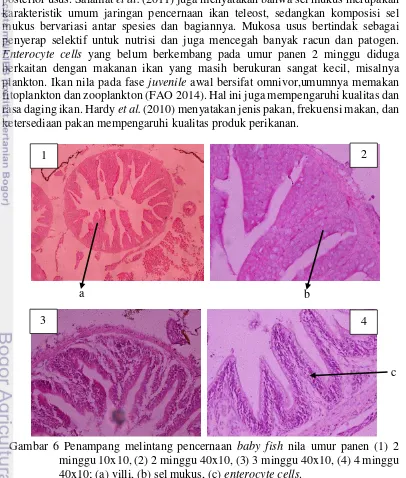
Jaringan intestin nila berumur 2 minggu memperlihatkan adanya vili dan sel mukus yang sudah berkembang, namun belum menunjukkan adanya enterocyte cells (Gambar 6). Enterocyte cells nampak jelas dan kompleks pada umur panen 3 dan 4 minggu. Secara umum, jaringan pencernaan baby fish nila identik dengan jenis ikan lainnya. Penelitian Khojasteh et al. (2009) pada Rainbow trout
menunjukkan vili terdapat pada jaringan intestin dan panjang vili berkurang ke arah posterior usus. Salamat et al. (2011) juga menyatakan bahwa sel mukus merupakan karakteristik umum jaringan pencernaan ikan teleost, sedangkan komposisi sel mukus bervariasi antar spesies dan bagiannya. Mukosa usus bertindak sebagai penyerap selektif untuk nutrisi dan juga mencegah banyak racun dan patogen.
Enterocyte cells yang belum berkembang pada umur panen 2 minggu diduga berkaitan dengan makanan ikan yang masih berukuran sangat kecil, misalnya plankton. Ikan nila pada fase juvenile awal bersifat omnivor,umumnya memakan fitoplankton dan zooplankton (FAO 2014). Hal ini juga mempengaruhi kualitas dan rasa daging ikan. Hardy et al. (2010) menyatakan jenis pakan, frekuensi makan, dan ketersediaan pakan mempengaruhi kualitas produk perikanan.
Gambar 6 Penampang melintang pencernaan baby fish nila umur panen (1) 2 minggu 10x10, (2) 2 minggu 40x10, (3) 3 minggu 40x10, (4) 4 minggu 40x10; (a) villi, (b) sel mukus, (c) enterocyte cells.
a b
1 2
c
16
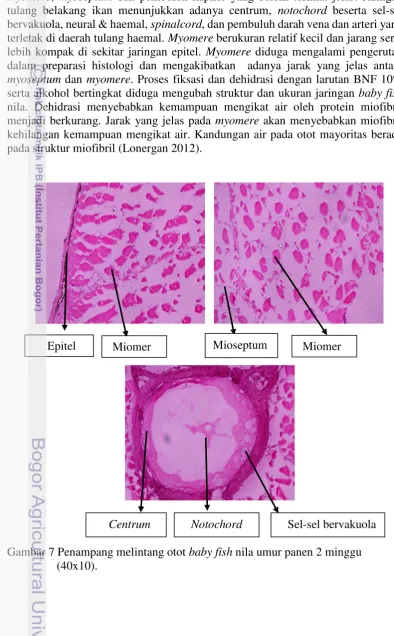
Potongan melintang otot baby fish nila pada umur 2 minggu memperlihatkan adanya musculus lateralis, centrum dan notochord yang memiliki sel-sel bervakuola. (Gambar 7). Musculus lateralis terdiri dari jaringan epidermis,
myomere, myoseptum dan pembuluh kapiler yang belum terlihat jelas. Jaringan tulang belakang ikan menunjukkan adanya centrum, notochord beserta sel-sel bervakuola, neural & haemal, spinalcord, dan pembuluh darah vena dan arteri yang terletak di daerah tulang haemal. Myomere berukuran relatif kecil dan jarang serta lebih kompak di sekitar jaringan epitel. Myomere diduga mengalami pengerutan dalam preparasi histologi dan mengakibatkan adanya jarak yang jelas antara
myoseptum dan myomere. Proses fiksasi dan dehidrasi dengan larutan BNF 10% serta alkohol bertingkat diduga mengubah struktur dan ukuran jaringan baby fish
nila. Dehidrasi menyebabkan kemampuan mengikat air oleh protein miofibril menjadi berkurang. Jarak yang jelas pada myomere akan menyebabkan miofibril kehilangan kemampuan mengikat air. Kandungan air pada otot mayoritas berada pada struktur miofibril (Lonergan.2012).
Gambar 7 Penampang melintang otot baby fish nila umur panen 2 minggu (40x10).
Epitel Miomer Mioseptum Miomer
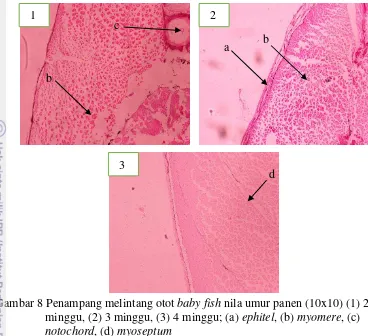
Gambar 8 Penampang melintang otot baby fish nila umur panen (10x10) (1) 2 minggu, (2) 3 minggu, (3) 4 minggu; (a) ephitel, (b) myomere, (c)
notochord, (d) myoseptum
Jaringan epitel pada nila umur panen 2 minggu cenderung lebih tipis dibanding umur panen 3 minggu dan 4 minggu, pada baby fish nila umur panen 2 minggu, epitel terlihat hanya satu lapis, sedangkan pada yang berumur 3 minggu terlihat tiga lapis (Gambar 8). Jumlah myomere pada nila umur 3 minggu cenderung relatif lebih banyak daripada nila umur 2 minggu. Kerapatan myomere umur panen 2 minggu dari daerah pheri-pheri ke bagian dalam daging cenderung homogen, sedangkan pada umur panen 3 minggu, myomere cenderung lebih rapat di daerah pheri-pheri daripada di daerah sebelah dalam, pada umur panen 4 minggu cenderung tidak berbeda dengan umur 3 minggu namun terlihat lebih kompak. Tayel et al. (2013) menyatakan kulit ikan terdiri atas epidermis, dermis, dan lapisan hipodermal. Kulit meliputi lapisan otot yang terutama terdiri dari segmen-segmen
myomere. Setiap myomere dianggap sebagai otot dan serat yang sejajar sumbu panjang tubuh.
Sistem otot merupakan bagian terbesar dari tubuh telestoi. Perkembangan otot yang terjadi berkaitan dengan protein sebagai penyusun otot dan diduga laju perkembangan otot mempengaruhi komposisi protein pada ikan. Chinabut et al. (1991) menyatakan sistem otot pada telestoi terdiri dari sel yang disebut serabut otot, yang elemen utamanya adalah miofibril. Miofibril terdiri dari ratusan protein miofilamen yang terbagi menjadi bagian tipis (aktin) dan bagian tebal (miosin). Jika dilihat secara longitudinal penampakan lurik pada serabut otot adalah akibat susunan aktin dan myosin. Fungsi otot dalam tubuh secara keseluruhan untuk gerak, koordinasi gerak elemen skeletal, memompa darah dan kontraksi peristaltik pada organ visceral dan struktur lainnya (El-Serafy et al. 2005). Ramesh et al. (2013)
a b b
1 2
3 c
18
memaparkan bahwa setiap myomere dibagi menjadi bagian atas (epaksial) dan rendah (hipaksial) sepanjang alur sisi ikan. Miomer dipisahkan oleh partisi jaringan ikat yang berorientasi miring (miosepta). Bagian epaksial dipisahkan dari
hypaxialmyotome oleh septum fibrosa. Pertumbuhan ikan melibatkan perkembangan serat otot. Perkembangan otot sangat penting untuk mencapai ukuran tubuh dewasa. Penambahan jumlah serat otot bervariasi antara spesies dan strain. Hal ini juga dipengaruhi oleh faktor lingkungan termasuk pakan, gerak, cahaya dan suhu (Johnston 1999).
KESIMPULAN DAN SARAN
Kesimpulan
Kadar air baby fish nila menurun secara signifikan pada 2-3 minggu, sedangkan protein menurun signifikan (p<0,05) pada umur panen 4 minggu , serta kadar abu meningkat dengan bertambahnya umur panen. Protein baby fish nila mengandung 15 jenis asam amino yang terdiri atas 6 asam amino non esensial dan 9 asam amino esensial. Asam amino esensial yang memiliki kadar tertinggi pada setiap umur panen adalah leusin sedangkan asam amino non esensial dengan jumlah tertinggi adalah asam glutamat. Komposisi asam amino baby fish pada berbagai umur panen relatif identik, namun cenderung lebih rendah dibanding ikan nila dewasa. Umur panen mempengaruhi komposisi kimia dan asam amino baby fish
nila.
Jaringan intestin semakin lengkap dan kompleks dengan bertambahnya umur. Sel-sel enterocyte berkembang pada umur 4 minggu. Myomere semakin kompak dan berkembang dengan bertambahnya umur panen, terutama pada umur 4 minggu.
Saran
Saran yang dapat diberikan pada penelitian ini yakni :
1. Perlu analisis organ lain, yakni mata dan hati untuk mengetahui komposisi kimia dan jaringannya.
2. Perlu dilakukan metode preparasi histologis dengan bahan fiksasi lain, misal glutaraldehid.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, USA: Association of Official Analytical Chemist, Inc.
Adeyeye IE. 2009. Amino acid composition of three species of Nigerian fish:
Clarias anguillaris, Oreochromis niloticus and Cynoglossus senegalensis.
Food Chemistry 113: 43–46.
Alemu L.A, Malese, AY, Gulelat DH. 2013. Effect of endogenous factors on proximate composition of nile tilapia (Oreochromis Niloticus L.) fillet from Lake Zeway. American Journal of Research Communication, 1(11): 405-410. Angka SL, Mokoginta I, Hamid H. 1990. Anatomi dan Histologi Banding beberapa Ikan Air Tawar yang Dibudidayakan di Indonesia. Bogor (ID): Departemen Pendidikan dan Kebudayaan, Direktorat Jenderal Pendidikan Tinggi, Institut Pertanian Bogor. hlm 17-27.
Aslianti T, Priono A. 2009. Increasing vitality and survival rate of orange spotted grouper, Epinephelus coioides seed fed vitamin c and calcium fortified diet.
Torani Jurnal Ilmu Kelautan dan Perikanan 19(1): 74–81
Buwono ID. 2000. Kebutuhan Asam Amino Esensial dalam Ransum Ikan. Yogyakarta (ID): Kanisius.
Chaijan M. 2011. Physicochemical changes of tilapia (Oreochromis niloticus) muscle during salting. Food Chemistry 129: 1201–1210.
Chinabut S, Limsuwan C, Kitsawat P. 1991. Histology of The Walking Catfish, Clarias Batrachus. Kanada: International Development Research Centre. Dutta H. 1994. Growth in fish. Gerontology 40: 97-112
Edison T. 2009. Amino Acid: Esensial for Our Bodies. http://livewellnaturally.com. [10 Februari 2014].
Effendie MI. 1997. Biologi Perikanan. Bogor (ID): Yayasan Pustaka Nusatama. El-Serafy S, Ibrahim SA, Mahmoud SA. 2005. Biochemical and histopathological
studies on the muscles of the nile tilapia (Oreochromis niloticus) in Egypt. J. Aquat. Biol. & Fish. 9(1): 81-96.
[FAO] Food Agriculture Organization. 2014. Aquaculture Feed and Fertilizer Resources Information System. www.fao.org. [ 14 Mei 2014].
Gehring CK, Davenport PM, Jaczynzki J. 2009. Functional and nutritional quality of protein and lipid recovered from fish processing by-products and underutilized aquatic species using isoelectric solubilization/precipitation. Curr. Nutr. Food Sci. 5: 17 – 39.
Girindra A. 1993. Biokimia I. Jakarta (ID): Gramedia
Guo Z, Xie Y, Zhang X, Wang Y, Zhang D and Sugiyama S. 2008. Review of fishery information and data collection systems in China. FAO Fisheries and Aquaculture, Circular 1029. Rome: FAO
Hardy RW, Lee CS. 2010. Aquaculture feed and seafood quality. Bull. Fish. Agen.(31): 43-50.
20
Jacoeb AM, Hamdani M, Nurjanah. 2008. Perubahan komposisi kimia dan vitamin daging udang ronggeng (Harpiosquilla raphidea) akibat perebusan. Buletin Teknologi Hasil Perikanan.11(2): 76-89.
Johnston IA.1999. Muscle development and growth: potential implications for flesh quality in fish. Aquaculture. 177: 99–115
Khojasteh SM, Sheikhzadeh F, Mohammadnejad D, Azami A. Histological, histochemical, and ultrastructural study of the intestine of Rainbow Trout (Oncorhynchus mykiss). World Appl. Sci. J. 6(11): 1525-1531
[KKP] Kementerian Kelautan dan Perikanan. 2013. Pemerintah Optimis Swasembada Ikan. www.kkp.go.id. [10 Februari 2014].
Lehninger A. 1990. Dasar-dasar Biokimia. Penerjemah: Maggy T. Jakarta (ID): Erlangga.
Lonergan EH. 2012. Water holding capacity of fresh meat. American Meat Science Association Fact Sheet: 1-8.
Li P, Mai K, Trushenski J, Wu G. 2008. New developments in fish amino acid nutrition: towards functional and environmentally oriented aquafeeds.
Springer-Verlag: 1-14.
Litaay M. 2005. Peranan nutrisi dalam siklus reproduksi abalone. Oseana.Vol 3: 1-7.
Lugo MG, Alvarez IG, Novoa1 MO, Cordova GM. 2003. Comparison of growth, fillet yield and proximate composition between Stirling Nile tilapia (wild type) (Oreochromis niloticus, Linnaeus) and red hybrid tilapia (Florida red tilapia x Stirling red O. niloticus) males. Aquaculture Research 34: 1023-1028.
Luo Z, Liu Y, Mai K, Tian L, Yang H, Tan X, Liu D. 2005. Dietary l methionine requirement of juvenile grouper Epinephelus coioides at a constant dietary cystine level. Aquaculture 249 (2005): 409– 418
Nasoetion A, Riyadi H, Mudjajanto ES. 1994. Dasar-dasar Ilmu Gizi. Jakarta (ID): Departemen Pendidikan dan Kebudayaan.
Penha-Lopez G, Rhyne A, Lin J, Narciso L. 2005. The larva rearing of the marine ornamental crab. Aquacult. Res.36: 1313 – 1321.
Pramono TB, Sanjayasari D, Soedibya PHT. 2007. Optimasi pakan dengan level protein dan energi protein untuk pertumbuhan calon induk ikan senggaringan (Mystus nigriceps). Jurnal Protein 15(2): 153-157.
Ramesh F, Nagarajan K. 2013. Histopathological changes in the muscle tissue of the fish Clarias batrachus exposed to untreated and treated sago effluent.
Advances in Bioscience and Bioengineering 1(2): 74-80
Ramseyer LJ. 2002. Predicting whole-fish nitrogen content from fish wet weight using regression analysis.N.Am. J.Aquac. 64: 195–204.
Rannested I, Conceicao LEC, Aragao C, Dinis MT. 2000. Free amino acids are absorbed faster and assimilated more efficiently than protein in postlarval senegal sole (Solea senegalensis). American Society for Nutritional Sciences.
Santos VB, Martins TR, Freitas FT. 2012. Body composition of nile tilapias (Oreochromis niloticus) in different length classes. Ci. Anim. Bras. Goiânia. 13(4): 396-405.
Salamat N, Darbeh R, Majd NE, Safahieh AR. 2011. Histological aspects of gut associated lymphoid tissue in Acanthopagrus latus. Global Veterinaria. 7 (4): 381-385
Sheridan MA. 1988. Lipid dynamics in fish : Aspects of absorption, transportation, deposition and mobilization. Comp. Biochem. Physiol. 90B(4): 679 – 690. [SNI] Standar Nasional Indonesia.1992. SNI 01-2891-1992: Cara Uji Makanan dan
Minuman. Jakarta: Dewan Standarisasi Nasional.
Tasbozan O, Undag E, Ozcan F, Atici AA, Erbas C, Adakli A. 2013. Determination of Proximate and Amino Acid Composition of Five Different Tilapia Species from the Cukurova Region (Turkey). Journal of Applied Biological Sciences.
7(3): 17-22.
Tayel SI, Ibrahim SA, Mahmoud SA. 2013. Histopathological and muscle composition studies on Tilapia zillii in relation to water quality of Lake Qarun, Egypt. Journal of Applied Sciences Research. 9(6): 3857-3872 Trilaksani W, Sallamah E, Nabil M, 2006. Pemanfaatan limbah tulang ikan tuna
(Thunnus sp.) sebagai sumber kalsium dengan metode hidrolisis protein.
Buletin Teknologi Hasil Perikanan. 9(2):34-45.
[WHO] World Health Organization. 2007. Protein and amino acid requirements in human nutrition : report of a joint FAO/WHO/UNU expert consultation. WHO technical report series ; no. 935.
22
Lampiran 1 Contoh perhitungan analisis proksimat Kadar air umur panen 2 minggu
Ulangan Sampel awal Kadar abu umur panen 3 minggu
Ulangan Sampel awal
% Kadar abu ulangan 1 = (21,31-21,25)
2,44 x100% = 2,48% Kadar lemak umur panen 4 minggu
Ulangan Bobot sampel (g) Bobot labu (g) B.labu + sampel (g) B.labu+ lemak (g)
1 2,39 32,67 35,06 32,72
2 2,59 30,17 32,75 30,22
% Kadar lemak = W3-W2
W1 x100% % Kadar abu ulangan 1 = (32,72-32,67)
2,39 x100% = 2,01% Kadar protein umur panen 2 minggu
Ulangan Bobot sampel (g) Vol HCl N HCl
24
Lampiran 2 Contoh perhitungan asam amino umur panen 2 minggu
Area
NO Rumus Bbt Mol Standar
IKAN NILA UL.1
IKAN NILA UL.2
IKAN NILA UL.3
1 Aspartat 133,1 28034348 46039879 46839504 47778525
2 Glutamat 147,1 25475661 59276840 60398855 61706045
3 Serina 105,09 23025457 19540685 20214365 20270828
4 Histidina 155,16 13364238 4766137 4808792 4919135
5 Glysina 75,07 20444176 43153279 44241448 41414213
6 Threonina 119,12 20809188 18414056 18849635 19323455
7 Arginina 174,2 23444880 20255721 20479856 20492244
8 Alanina 89,09 23930179 39548538 40581234 41155728
9 Tyrosina 181,19 24111646 10866175 10823944 10971597
10 Methionina 149,21 26459008 10102439 8461622 11270619
11 Valina 117,15 29819035 31246524 31505686 32482980
12 Fenilalanina 165,19 23388735 14494562 15774251 14874406
13 Ileusina 131,17 30204975 24868548 25386566 25838906
14 Leusina 131,17 26389003 35331883 35867448 36700279
15 Lysina 146,19 14286946 17565084 17995802 17836827
Bobot contoh (ug) 22400 23000 22200
Umol AA = (area AA sampel/area AA standar) x kons. Std x volume area % AA = (umol AA x BM AA x 100)/ug sampel
Contoh perhitungan asam aspartat ulangan 1 Umol AA = (46039879/28034348) x 0,5 x 10 % AA = (8,21 x 133,1 x 100)/22400
Lampiran 3 Contoh perhitungan asam amino umur panen 3 minggu
Area
NO Rumus Bbt Mol Standar
IKAN NILA
UL.1
IKAN NILA
UL.2
IKAN NILA
UL.3
1 Aspartat 133,1 28409121 58475619 58219801 58536239
2 Glutamat 147,1 25567691 75296867 74890898 75335296
3 Serina 105,09 22925576 28251758 28371728 28525491
4 Histidina 155,16 12396010 5292735 5246919 5381576
5 Glysina 75,07 24035391 61528607 59410708 61768527
6 Threonina 119,12 22138116 24187455 24037302 24347960
7 Arginina 174,2 24612476 27769338 27674009 27471475
8 Alanina 89,09 23508293 48749700 48536517 49102157
9 Tyrosina 181,19 23543247 13967972 13892888 13997268
10 Methionina 149,21 25833139 12095289 12066425 12001466
11 Valina 117,15 29197407 37952702 37985332 38216728
12 Fenilalanina 165,19 22149922 17919460 17870336 18096341
13 Ileusina 131,17 29791608 30221423 30100369 30324946
14 Leusina 131,17 25025427 41795551 41768839 42363271
15 Lysina 146,19 14138527 20203330 20143436 21100443
Bobot contoh (ug) 30100 30200 30200
Umol AA = (area AA sampel/area AA standar) x kons. Std x volume area % AA = (umol AA x BM AA x 100)/ug sampel
Contoh perhitungan leusin ulangan 1 Umol AA = (41795551/25025427) x 0,5 x 10 % AA = (8,35 x 131,17 x 100)/30100
26
Lampiran 4 Contoh perhitungan asam amino umur panen 4 minggu
Area
NO Rumus Bbt Mol Standar IKAN
NILA UL.1
IKAN NILA
UL.2
IKAN NILA
UL.3
1 Aspartat 133,1 28409121 61311159 59700323 60343230
2 Glutamat 147,1 25567691 79231151 77122403 78069813
3 Serina 105,09 22925576 27369713 27499176 28237724
4 Histidina 155,16 12396010 5303656 5345556 5475874
5 Glysina 75,07 24035391 59685099 58157598 60534214
6 Threonina 119,12 22138116 24310304 24578678 25103400
7 Arginina 174,2 24612476 27774930 27639176 28101768
8 Alanina 89,09 23508293 49797168 49581375 50597754
9 Tyrosina 181,19 23543247 13829089 13653711 13849159
10 Methionina 149,21 25833139 12012279 11757695 11922812
11 Valina 117,15 29197407 40244266 39291047 39755999
12 Fenilalanina 165,19 22149922 18539911 18156684 18274260
13 Ileusina 131,17 29791608 32009096 31272220 31531648
14 Leusina 131,17 25025427 44415676 43249152 43837387
15 Lysina 146,19 14138527 22876453 20946330 21866019
Bobot contoh (ug) 33900 33000 33800
Umol AA = (area AA sampel/area AA standar) x kons. Std x volume area % AA = (umol AA x BM AA x 100)/ug sampel
Contoh perhitungan asam glutamat ulangan 1 Umol AA = (79231151/25567691) x 0,5 x 10 % AA = (15,49 x 147,1 x 100)/33900
% AA = 6,72%
ANOVA
Sum of
Squares df Mean Square F Sig.
kadar_air Between Groups 2.491 2 1.245 29.756 .001
Within Groups .251 6 .042
Total 2.742 8
kadar_abu Between Groups 1.996 2 .998 142.125 .000
Within Groups .042 6 .007
Total 2.038 8
kadar_protein Between Groups .629 2 .315 24.853 .001
Within Groups .076 6 .013
Total .705 8
kadar_lemak Between Groups .297 2 .149 37.895 .000
Within Groups .024 6 .004
Total .321 8
kadar_karbohidrat Between Groups 2.230 2 1.115 59.146 .000
Within Groups .113 6 .019
Total 2.344 8
kadar_air
Duncana
umur panen N
Subset for alpha = 0.05
1 2
4 minggu 3 80.6567
3 minggu 3 80.7900
2 minggu 3 81.8333
Sig. .455 1.000
Means for groups in homogeneous subsets are
displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
28
Means for groups in homogeneous subsets are
displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
kadar_protein
Means for groups in homogeneous subsets are
displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
kadar_lemak
Means for groups in homogeneous subsets are
displayed.
kadar_karbohidrat
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
2 minggu 3 .2900
3 minggu 3 .6267
4 minggu 3 1.4733
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
30
Lampiran 6 Uji one way ANOVA asam amino baby fish nila.
ANOVA
Sum of
Squares df Mean Square F Sig.
aspartat Between Groups .781 2 .391 49.383 .000
Within Groups .047 6 .008
Total .829 8
glutamat Between Groups 1.669 2 .835 41.478 .000
Within Groups .121 6 .020
Total 1.790 8
serina Between Groups .104 2 .052 45.029 .000
Within Groups .007 6 .001
Total .111 8
histidina Between Groups .092 2 .046 63.738 .000
Within Groups .004 6 .001
Total .096 8
glisina Between Groups .807 2 .404 129.732 .000
Within Groups .019 6 .003
Total .826 8
treonina Between Groups .266 2 .133 47.571 .000
Within Groups .017 6 .003
Total .283 8
arginina Between Groups .298 2 .149 89.960 .000
Within Groups .010 6 .002
Total .308 8
alanina Between Groups .401 2 .200 55.848 .000
Within Groups .022 6 .004
Total .422 8
tirosina Between Groups .097 2 .049 65.388 .000
Within Groups .004 6 .001
metionina Between Groups .075 2 .038 2.941 .129
Within Groups .077 6 .013
Total .152 8
valina Between Groups .232 2 .116 38.747 .000
Within Groups .018 6 .003
Total .250 8
fenilalanina Between Groups .158 2 .079 51.072 .000
Within Groups .009 6 .002
Total .167 8
ileusina Between Groups .215 2 .108 55.730 .000
Within Groups .012 6 .002
Total .227 8
leusina Between Groups .458 2 .229 42.100 .000
Within Groups .033 6 .005
Total .491 8
lisina Between Groups .749 2 .375 48.874 .000
Within Groups .046 6 .008
Total .795 8
total Between Groups 73.722 2 36.861 71.087 .000
Within Groups 3.111 6 .519
Total 76.834 8
aspartat
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 4.2200
3 minggu 3 4.5367
2 minggu 3 4.9400
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
32
glutamat
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 6.6933
3 minggu 3 7.1700
2 minggu 3 7.7467
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
serina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 1.8900
2 minggu 3 2.0267
3 minggu 3 2.1533
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
histidina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 1.0000
3 minggu 3 1.1033
2 minggu 3 1.2467
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
glisina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.7667
3 minggu 3 3.1500
2 minggu 3 3.5000
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
treonina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 1.9767
3 minggu 3 2.1567
2 minggu 3 2.3967
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
arginina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.9333
3 minggu 3 3.2400
2 minggu 3 3.3667
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
34
alanina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.8233
3 minggu 3 3.0667
2 minggu 3 3.3400
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
tirosina
Duncana
umur panen N
Subset for alpha = 0.05
1 2
4 minggu 3 1.5800
3 minggu 3 1.7800
2 minggu 3 1.8167
Sig. 1.000 .151
Means for groups in homogeneous subsets are
displayed.
metionina
Duncana
umur panen N
Subset for alpha
= 0.05
1
4 minggu 3 1.0233
3 minggu 3 1.1533
2 minggu 3 1.2467
Sig. .059
Means for groups in homogeneous subsets
are displayed.
a. Uses Harmonic Mean Sample Size =
3,000.
valina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.3767
3 minggu 3 2.5300
2 minggu 3 2.7667
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
fenilalanina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.0367
3 minggu 3 2.2200
2 minggu 3 2.3600
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
36
ileusina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 2.0733
3 minggu 3 2.2033
2 minggu 3 2.4467
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
leusina
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 3.4200
3 minggu 3 3.6467
2 minggu 3 3.9700
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
lisina
Duncana
umur panen N
Subset for alpha = 0.05
1 2
4 minggu 3 3.3700
3 minggu 3 3.5100
2 minggu 3 4.0400
Sig. .098 1.000
Means for groups in homogeneous subsets are
displayed.
total
Duncana
umur panen N
Subset for alpha = 0.05
1 2 3
4 minggu 3 40.1967
3 minggu 3 43.6233
2 minggu 3 47.2067
Sig. 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed.
38
RIWAYAT HIDUP
Penulis bernama lengkap Arif Yanuar Ridwan dilahirkan pada tanggal 24 Januari 1992 di Karawang. Penulis adalah anak pertama dari pasangan Bapak Ridwan Rachmat dan Ibu Yani Cahriyani. Penulis memulai jenjang pendidikan formal di Sekolah Dasar Negeri Karawang Wetan III tahun 1999-2004. Penulis melanjutkan pendidikan di SMP Negeri1 Karawang tahun 2004-2007. Pendidikan menengah atas ditempuh penulis di SMA Negeri1Karawang tahun 2007-2010.
Penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) dengan program studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor tahun 2010. Selama kuliah penulis aktif dalam kegiatan kemahasiswaan antara lain LDK Al Hurriyah tahun 2010-2011, Forum Keluarga Muslim FPIK (FKM-C) pada tahun 2011-2012, serta anggota Infokom Himasilkan pada tahun 2012.