PEMANFAATAN SELULOSA MIKROKRISTAL SEBAGAI
BAHAN PENGISI TABLET EKSTRAK ETANOL
SABUT BUAH PINANG (Areca catechu L.)
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara gelar Sarja
na Fas Fs Sumatera Utar
OLEH:
NOLA AWAL LUKITA
NIM 121524082
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PEMANFAATAN SELULOSA MIKROKRISTAL SEBAGAI
BAHAN PENGISI TABLET EKSTRAK ETANOL
SABUT BUAH PINANG (Areca catechu L.)
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi Pada Fakultas Farmasi
Universitas Sumatera Utara gelar Sarja
si pada Fakultas Fs Sumatera Utar
OLEH:
NOLA AWAL LUKITA
NIM 121524082
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PEMANFAATAN SELULOSA MIKROKRISTAL SEBAGAI
BAHAN PENGISI TABLET EKSTRAK ETANOL
SABUT BUAH PINANG (Areca catechu L.)
OLEH:NOLA AWAL LUKITA NIM 121524082
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 20 Maret 2015
Pembimbing I,
Prof. Dr. Karsono, Apt. NIP 195409091982011001
Dr. Kasmirul Ramlan Sinaga, M.S.,Apt. NIP 195504241983031003
Drs. Agusmal Dalimunthe, M.S., Apt NIP 195406081983031005
Dr. Panal Sitorus, M.Si., Apt. NIP 195310301980031002
Medan, April 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan 1,
Prof. Dr. Julia Reveny, M.Si., Apt.
KATA PENGANTAR
Puji syukur kehadirat Allah SWT, atas segala limpahan rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan
skripsi yang berjudul “Pemanfaatan Selulosa Mikrokristal Sebagai Bahan Pengisi
Tablet Ekstrak Etanol Sabut Buah Pinang (Areca catechu L.)”. Skripsi ini
diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih yang sebesar-besarnya kepada Bapak
Dr. Kasmirul Ramlan Sinaga, M.S., Apt. dan Ibu Dr. Marline Nainggolan, M.S.,
Apt., selaku pembimbing yang telah membimbing dan memberikan petunjuk serta
saran-saran selama penelitian hingga selesainya skripsi ini. Kepada Bapak Dekan
Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt. dan Ibu Wakil Dekan 1
Prof. Dr. Julia Reveny, M.Si., Apt. yang telah memberikan fasilitas, sehingga
penulis dapat menyelesaikan pendidikan. Kepada Bapak Prof. Dr. Muchlisyam,
M.Si., Apt. selaku Ketua Program Ekstensi Sarjana Farmasi USU Medan. Kepada
Bapak Prof. Dr. Karsono, Apt., Bapak Drs. Agusmal Dalimunthe, M.S., Apt. dan
Bapak Dr. Panal Sitorus, M.Si., Apt. selaku dosen penguji yang telah memberikan
kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini. Kepada
Ibu Dr. Poppy Anjelisa Zaitun Hasibuan, M.Si., Apt. selaku pembimbing
akademik yang telah membimbing selama masa perkuliahan hingga selesai.
Kepada Bapak dan Ibu staff pengajar Fakultas Farmasi USU atas ilmu dan
pendidikan yang telah diberikan. Kepada Ibu Dra. Aswita Hafni, M.Si., Apt.
Ibu Dra. Fat Aminah, M.Sc., Apt. selaku kepala Laboratorium Teknologi Sediaan
Farmasi II Fakultas Farmasi USU yang telah memberikan izin dan fasilitas selama
melakukan penelitian.
Penulis mengucapkan rasa terima kasih serta penghargaan yang tulus dan
tak terhingga kepada kedua orang tua tersayang Bapak Drs. Budhi Parmono dan
Ibu Runaila, S.Pd. serta kedua adikku Nola Dwiayu Adinda dan Nola Tria
Handayani atas doa, motivasi, nasihat dan dukungan baik moril maupun materil.
Penulis juga mengucapkan terima kasih kepada teman-teman Farmasi Ekstensi
2012 dan rekan-rekan penelitian serta semua pihak yang telah membantu
penyelesian skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari
kesempurnaan, oleh karena itu penulis mengharapkan kritik dan saran yang
membangun demi kesempurnaan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini dapat bermanfaat bagi ilmu pengetahuan khususnya di bidang Farmasi.
Medan, Maret 2015 Penulis,
PEMANFAATAN SELULOSA MIKROKRISTAL
SEBAGAI BAHAN PENGISI TABLET EKSTRAK ETANOL SABUT BUAH PINANG (Areca catechu L.)
ABSTRAK
Sabut buah pinang (Areca catechu L.) termasuk limbah yang mengandung selulosa, dapat diisolasi dan dibuat menjadi bentuk kristal. Selulosa mikrokristal merupakan bahan tambahan yang paling sering digunakan dalam pembuatan tablet dengan metode cetak langsung. Zat berkhasiat yang digunakan pada pembuatan tablet adalah ekstrak etanol sabut buah pinang (Areca catechu L.) yang mempunyai efek sebagai antidiare. Tujuan penelitian ini adalah membuat selulosa mikrokristal sabut buah pinang dan mengaplikasikannya sebagai bahan pengisi dalam pembuatan tablet ekstrak etanol sabut buah pinang.
Pembuatan ekstrak etanol sabut buah pinang dilakukan dengan cara maserasi menggunakan etanol 80%, maserat yang diperoleh dipekatkan dengan rotary evaporator. Selulosa mikrokristal sabut buah pinang diperoleh dengan cara memanaskan sabut buah pinang dengan NaOH 4%, diputihkan dengan NaOCl 2,5% dan dipanaskan dengan NaOH 17,5%. Alfa selulosa yang terbentuk dihidrolisis dengan HCl 2,5 N untuk mendapatkan selulosa mikrokristal. Selulosa mikrokristal sabut buah pinang yang diperoleh dikarakterisasi dan dibandingkan dengan Avicel PH 102, selanjutnya dibuat sediaan tablet.
Hasil selulosa mikrokristal sabut buah pinang mempunyai rendemen sebesar 22,92%. Hasil karakterisasi selulosa mikrokristal sabut buah pinang dan Avicel PH 102 untuk uji organoleptik berupa serbuk berwarna putih, tidak berbau dan tidak berasa; pH 6,1 dan 6,3; susut pengeringan 5,38 dan 4,75%; kadar abu total 0,45 dan 0,01%; kelarutan zat dalam air 0,019 dan 0,08%; bobot jenis nyata 0,338 dan 0,41 g/cm3; bobot jenis mampat 0,384 dan 0,48 g/cm3; bobot jenis benar 1,43 dan 1,46 g/cm3; indeks Hausner 1,13 dan 1,15; indeks kompresibilitas 13,6 dan 15,86%; porositas; 76,4 dan 71,51%. Analisis FT-IR selulosa mikrokristal sabut buah pinang dan Avicel PH 102 yaitu menunjukkan spektrum yang sama dan Scanning Electron Microscopy (SEM) menunjukkan bentuk tidak beraturan dengan tekstur permukaan yang tidak rata. Hasil evaluasi tablet ekstrak etanol sabut buah pinang dengan bahan pengisi selulosa mikrokristal sabut buah pinang dan Avicel PH 102 untuk uji kekerasan diperoleh 4,27 dan 4,62 kg; uji friabilitas sebesar 0,77 dan 0,68%; uji waktu hancurnya 3 menit 12 detik dan 2 menit 34 detik. Berdasarkan hasil yang didapat dapat disimpulkan bahwa selulosa mikrokristal dapat dibuat dari sabut buah pinang dan diaplikasikan sebagai bahan pengisi tablet ekstrak etanol sabut buah pinang.
THE UTILIZATION OF MICROCRISTALLINE CELLULOSE AS FILLER OF ARECA NUT HUSK (Areca catechu L)
ETHANOLIC EXTRACT TABLETS
ABSTRACT
Areca nut husk (Areca catechu L.) is a waste containing cellulose that can be isolated and crytallized. Microcrystalline cellulose is the most common used excipient in the preparation of tablets by direct compression. Areca nut husk is used as an active substance in tablets as it has an antidiarrhea effect. The purpose of this research was to prepare microcrystalline from areca nut husk (Areca catechu L.) and apply it as a filler in the preparation of areca nut husk ethanolic extract tablets.
Preparation of extract was done by maceration with ethanol 80%, macerate obtained was concentrated by rotary evaporator and dried by freeze dryer. Microcrystalline cellulose areca nut husk was obtained by heating the areca nut husk powder with 4% NaOH, bleached with 2.5% NaOCl, then heated with 17.5% NaOH. Alfa cellulose obtained was hydrolyzed with 2.5 N HCl. Microcrystalline cellulose areca nut husk obtained were characterized, compared to Avicel PH 102 and prepared to tablets.
The result of microcrystalline cellulose areca nut husk obtained was 22.92%. The results of characterization of microcrystalline cellulose areca nut husk and Avicel PH 102 included organoleptic: both were white, odourless and tasteless; pH 6.1and 6.5; loss on drying 5.38 and 4.75%; level of total ash was 0.45 and 0.01%; solubility in water was 0.019 and 0.08%; bulk density 0.338and 0.41 g/cm3; tap density 0.384 and 0.48 g/cm3, true density 1.43and 1.46 g/cm3; hausner index 1.13 and 1.15; compressibility index 13.6 and 15.86%; porosity 76.4 and 71.51%. FT-IR analysis of microcrystalline cellulose areca nut husk and Avicel PH 102 showed similar spectrum; SEM analysis both showed irregular shapes and uneven surface texture. The result of evaluation of areca nut husk ethanolic extract tablets on hardness were 4.27 and 4.62 kg; friability 0.77 and 0.68%; disintegration time 3 minutes 12 second and 2 minutes 34 second. Microcrystalline cellulose can obtained from areca nut husk and applied as filler of areca nut husk ethanolic extract tablets.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 2
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Tumbuhan Pinang ... 5
2.1.1 Morfologi tumbuhan ... 5
2.1.2 Sinonim dan nama daerah tumbuhan ... 5
2.1.3 Klasifikasi tumbuhan ... 5
2.1.5 Manfaat tumbuhan ... 6
2.2 Ekstraksi ... 7
2.3 Selulosa Mikrokristal ... 8
2.3.1 Rumus empiris dan berat molekul ... 8
2.3.2 Struktur kimia ... 8
2.3.3 Uraian umum selulosa mikrokristal ... 9
2.4 Sediaan Tablet ... 9
2.4.1 Uraian umum ... 9
2.4.2 Bahan tambahan formula tablet ... 11
2.4.3 Metode pembuatan tablet ... 13
2.4.4 Uji preformulasi ... 15
2.4.5 Evaluasi tablet ... 15
BAB III METODE PENELITIAN ... 18
3.1 Alat-alat ... 18
3.2 Bahan-bahan ... 18
3.3 Pengumpulan dan Pengolahan Sampel ... 19
3.3.1 Pengambilan sampel ... 19
3.3.2 Identifikasi sampel ... 19
3.3.3 Pengolahan sampel ... 19
3.4 Pembuatan Ekstrak ... 19
3.5 Pembuatan Pereaksi ... 20
3.5.1 Pereaksi Bouchardat ... 20
3.5.2 Pereaksi Mayer ... 20
3.5.4 Pereaksi Molish ... 20
3.5.5 Larutan asam klorida 2 N ... 21
3.5.6 Larutan asam sulfat 2 N ... 21
3.5.7 Larutan timbal (II) asetat ... 21
3.5.8 Larutan besi (III) klorida ... 21
3.5.9 Larutan natrium hidroksida 4% ... 21
3.5.10 Larutan natrium hidroksida 17,5% ... 21
3.5.11 Larutan HCl 2,5 N ... 21
3.5.12 Pereaksi natrium hipoklorit 2,5% ... 21
3.5.13 Air bebas karbondioksida ... 22
3.6 Karakterisasi Ekstrak ... 22
3.6.1 Penetapan kadar air ... 22
3.6.2 Penetapan kadar abu total ... 23
3.6.3 Penetapan kadar abu yang tidak larut asam ... 23
3.6.4 Penetapan kadar sari yang larut dalam etanol ... 23
3.6.5 Penetapan kadar sari yang larut dalam air ... 23
3.7 Skrining Fitokimia ... 24
3.7.1 Pemeriksaan alkaloid ... 24
3.7.2 Pemeriksaan glikosida ... 24
3.7.3 Pemeriksaan saponin ... 25
3.7.4 Pemeriksaan flavonoid ... 25
3.7.5 Pemeriksaan tanin ... 25
3.7.6 Pemeriksaan steroid/triterpenoid ... 26
3.9 Karakterisasi Selulosa Mikrokristal ... 27
3.9.1 Uji organoleptik ... 27
3.9.2 Penetapan pH ... 27
3.9.3 Kelarutan zat dalam air ... 27
3.9.4 Penetapan kadar abu total ... 27
3.9.5 Susut pengeringan ... 28
3.9.6 Bobot jenis nyata ... 28
3.9.7 Bobot jenis benar ... 28
3.9.8 Bobot jenis mampat ... 29
3.9.9 Indeks kompresibilitas ... 29
3.9.10 Indeks Hausner ... 30
3.9.11 Porositas ... 30
3.9.12 Analisis FT-IR ... 30
3.9.13 Scanning Electron Microscopy ... 31
3.10 Pembuatan Tablet EESBP ... 31
3.11 Uji Preformulasi ... 32
3.11.1 Sudut diam ... 32
3.11.2 Penetapan waktu alir ... 32
3.11.3 Penetapan indeks kompresibilitas ... 32
3.12 Evaluasi Tablet ... 33
3.12.1 Pemeriksaan keseragaman bobot tablet ... 33
3.12.2 Pemeriksaan friabilitas tablet ... 33
3.12.3 Uji kekerasan tablet ... 34
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1 Hasil Karakterisasi Ekstrak Etanol Sabut Buah Pinang (EESBP) ... 35
4.2 Hasil Skrining Fitokimia EESBP ... 36
4.3 Hasil Pembuatan Selulosa Mikrokristal Sabut Buah Pinang (SMSBP) ... 37
4.4 Hasil Karakterisasi SMSBP ... 38
4.5 Hasil Analisis Gugus Fungsi SMSBP ... 40
4.6 Hasil Analisis Morfologi SMSBP ... 42
4.7 Hasil Uji Preformulasi ... 43
4.8 Hasil Evaluasi Tablet EESBP ... 44
4.8.1 Hasil uji keseragaman bobot tablet EESBP ... 44
4.8.2 Hasil uji kekerasan tablet EESBP ... 45
4.8.3 Hasil uji friabilitas tablet EESBP ... 45
4.8.4 Hasil uji waktu hancur tablet EESBP ... 46
BAB V KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 48
DAFTAR PUSTAKA ... 49
DAFTAR TABEL
Tabel Halaman
2.1 Persyaratan keseragaman bobot ... 16
3.1 Persyaratan indeks kompresibilitas ... 30
3.2 Persyaratan indeks Hausner ... 30
3.3 Formula tablet EESBP ... 31
3.4 Persyaratan keseragaman bobot tablet ... 33
4.1 Hasil karakterisasi EESBP ... 35
4.2 Hasil skrining fitokimia dari EESBP ... 36
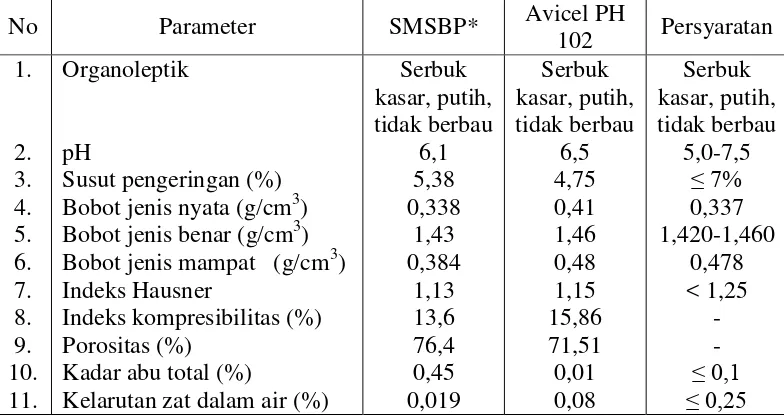
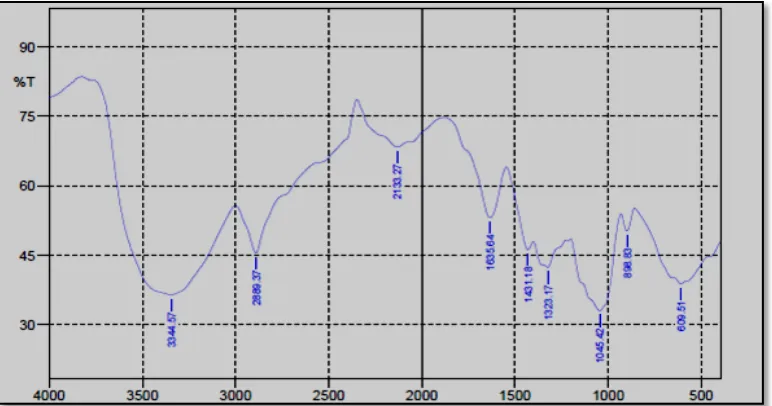
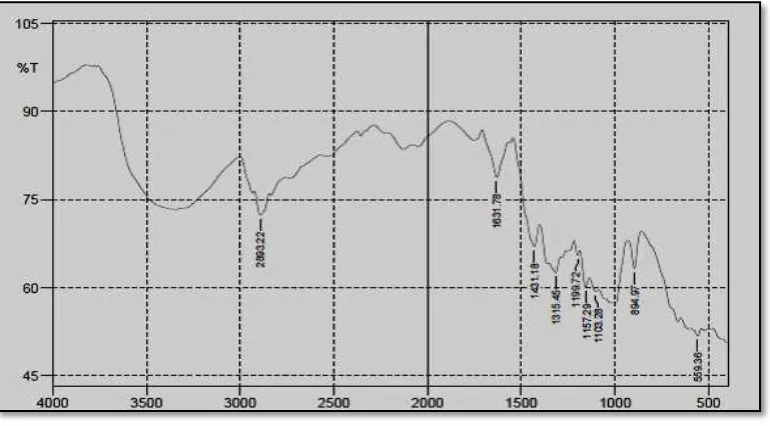
4.3 Data karakteristik SMSBP dan Avicel PH 102 ... 38
4.4 Data uji preformulasi massa granul ... 43
4.5 Data hasil uji keseragaman bobot tablet EESBP ... 44
4.6 Data hasil uji kekerasan tablet EESBP ... 45
4.7 Data hasil uji friabilitas tablet EESBP ... 45
4.8 Data hasil uji waktu hancur tablet EESBP ... 46
DAFTAR GAMBAR
Gambar Halaman
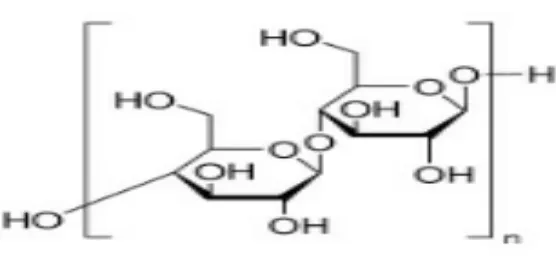
2.1 Struktur selulosa mikrokristal ... 8
4.1 Hasil spektrum IR SMSBP ... 40
4.2 Hasil spektrum IR Avicel PH 102 ... 41
4.3 Hasil SEM SMSBP dan Avicel PH 102 dengan perbesaran
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil identifikasi sampel ... 53
2 Gambar tumbuhan pinang, biji pinang, sabut buah pinang dan simplisia sabut buah pinang ... 54
3 Gambar serbuk, ekstrak etanol, α-selulosa dan selulosa mikrokristal sabut buah pinang (Areca catechu L.) ... 55
4 Flowsheet prosedur kerja ... 56
5 Perhitungan hasil pemeriksaan karakteristik ekstrak etanol sabut buah pinang ... 59
6 Perhitungan rendemen α-selulosa dan SMSBP ... 62
7 Perhitungan hasil karakterisasi selulosa mikrokristal sabut pinang (SMSBP) ... 63
8 Perhitungan konversi dosis ... 68
9 Pembuatan tablet ekstrak etanol sabut buah pinang (EESBP) ... 69
10 Gambar tablet EESBP ... 70
11 Perhitungan hasil preformulasi tablet EESBP ... 71
12 Perhitungan hasil evaluasi tablet EESBP ... 73
13 Gambar alat-alat uji karakteristik SMSBP ... 75
PEMANFAATAN SELULOSA MIKROKRISTAL
SEBAGAI BAHAN PENGISI TABLET EKSTRAK ETANOL SABUT BUAH PINANG (Areca catechu L.)
ABSTRAK
Sabut buah pinang (Areca catechu L.) termasuk limbah yang mengandung selulosa, dapat diisolasi dan dibuat menjadi bentuk kristal. Selulosa mikrokristal merupakan bahan tambahan yang paling sering digunakan dalam pembuatan tablet dengan metode cetak langsung. Zat berkhasiat yang digunakan pada pembuatan tablet adalah ekstrak etanol sabut buah pinang (Areca catechu L.) yang mempunyai efek sebagai antidiare. Tujuan penelitian ini adalah membuat selulosa mikrokristal sabut buah pinang dan mengaplikasikannya sebagai bahan pengisi dalam pembuatan tablet ekstrak etanol sabut buah pinang.
Pembuatan ekstrak etanol sabut buah pinang dilakukan dengan cara maserasi menggunakan etanol 80%, maserat yang diperoleh dipekatkan dengan rotary evaporator. Selulosa mikrokristal sabut buah pinang diperoleh dengan cara memanaskan sabut buah pinang dengan NaOH 4%, diputihkan dengan NaOCl 2,5% dan dipanaskan dengan NaOH 17,5%. Alfa selulosa yang terbentuk dihidrolisis dengan HCl 2,5 N untuk mendapatkan selulosa mikrokristal. Selulosa mikrokristal sabut buah pinang yang diperoleh dikarakterisasi dan dibandingkan dengan Avicel PH 102, selanjutnya dibuat sediaan tablet.
Hasil selulosa mikrokristal sabut buah pinang mempunyai rendemen sebesar 22,92%. Hasil karakterisasi selulosa mikrokristal sabut buah pinang dan Avicel PH 102 untuk uji organoleptik berupa serbuk berwarna putih, tidak berbau dan tidak berasa; pH 6,1 dan 6,3; susut pengeringan 5,38 dan 4,75%; kadar abu total 0,45 dan 0,01%; kelarutan zat dalam air 0,019 dan 0,08%; bobot jenis nyata 0,338 dan 0,41 g/cm3; bobot jenis mampat 0,384 dan 0,48 g/cm3; bobot jenis benar 1,43 dan 1,46 g/cm3; indeks Hausner 1,13 dan 1,15; indeks kompresibilitas 13,6 dan 15,86%; porositas; 76,4 dan 71,51%. Analisis FT-IR selulosa mikrokristal sabut buah pinang dan Avicel PH 102 yaitu menunjukkan spektrum yang sama dan Scanning Electron Microscopy (SEM) menunjukkan bentuk tidak beraturan dengan tekstur permukaan yang tidak rata. Hasil evaluasi tablet ekstrak etanol sabut buah pinang dengan bahan pengisi selulosa mikrokristal sabut buah pinang dan Avicel PH 102 untuk uji kekerasan diperoleh 4,27 dan 4,62 kg; uji friabilitas sebesar 0,77 dan 0,68%; uji waktu hancurnya 3 menit 12 detik dan 2 menit 34 detik. Berdasarkan hasil yang didapat dapat disimpulkan bahwa selulosa mikrokristal dapat dibuat dari sabut buah pinang dan diaplikasikan sebagai bahan pengisi tablet ekstrak etanol sabut buah pinang.
THE UTILIZATION OF MICROCRISTALLINE CELLULOSE AS FILLER OF ARECA NUT HUSK (Areca catechu L)
ETHANOLIC EXTRACT TABLETS
ABSTRACT
Areca nut husk (Areca catechu L.) is a waste containing cellulose that can be isolated and crytallized. Microcrystalline cellulose is the most common used excipient in the preparation of tablets by direct compression. Areca nut husk is used as an active substance in tablets as it has an antidiarrhea effect. The purpose of this research was to prepare microcrystalline from areca nut husk (Areca catechu L.) and apply it as a filler in the preparation of areca nut husk ethanolic extract tablets.
Preparation of extract was done by maceration with ethanol 80%, macerate obtained was concentrated by rotary evaporator and dried by freeze dryer. Microcrystalline cellulose areca nut husk was obtained by heating the areca nut husk powder with 4% NaOH, bleached with 2.5% NaOCl, then heated with 17.5% NaOH. Alfa cellulose obtained was hydrolyzed with 2.5 N HCl. Microcrystalline cellulose areca nut husk obtained were characterized, compared to Avicel PH 102 and prepared to tablets.
The result of microcrystalline cellulose areca nut husk obtained was 22.92%. The results of characterization of microcrystalline cellulose areca nut husk and Avicel PH 102 included organoleptic: both were white, odourless and tasteless; pH 6.1and 6.5; loss on drying 5.38 and 4.75%; level of total ash was 0.45 and 0.01%; solubility in water was 0.019 and 0.08%; bulk density 0.338and 0.41 g/cm3; tap density 0.384 and 0.48 g/cm3, true density 1.43and 1.46 g/cm3; hausner index 1.13 and 1.15; compressibility index 13.6 and 15.86%; porosity 76.4 and 71.51%. FT-IR analysis of microcrystalline cellulose areca nut husk and Avicel PH 102 showed similar spectrum; SEM analysis both showed irregular shapes and uneven surface texture. The result of evaluation of areca nut husk ethanolic extract tablets on hardness were 4.27 and 4.62 kg; friability 0.77 and 0.68%; disintegration time 3 minutes 12 second and 2 minutes 34 second. Microcrystalline cellulose can obtained from areca nut husk and applied as filler of areca nut husk ethanolic extract tablets.
BAB I PENDAHULUAN
1.1Latar Belakang
Selulosa ditemukan pada tahun 1838 oleh Anselme Payne, yang didapat
dari hasil isolasi tanaman dan ditentukan rumus kimianya. Selulosa merupakan
polisakarida yang berbentuk kristal, tidak berasa, tidak berbau dan terdiri
2000-4000 unit glukosa yang dihubungkan oleh ikatan β-1,4 glikosidik (Oyeniyi
dan Itiola, 2011).
Awal tahun 1960-an selulosa mikrokristal diperkenalkan sebagai bahan
eksipien (pengikat, pengisi dan penghancur) dalam pembuatan tablet secara cetak
langsung yang akan menghasilkan tablet dengan kekerasan yang baik, tidak
mudah rapuh dan mempunyai waktu hancur yang singkat serta dapat memperbaiki
sifat aliran granul (Bhimte dan Tayade, 2007; Voigt, 1994). Selulosa mikrokristal
dapat dibuat dengan cara hidrolisis terkontrol dari alfa selulosa dengan larutan
asam encer (Rowe, dkk., 2009).
Salah satu selulosa mikrokristal yang ada di perdagangan dikenal dengan
nama Avicel PH 101 (serbuk) yang kemudian dikembangkan menjadi Avicel
PH 102 (granula). Namun avicel merupakan pengisi yang relatif mahal dan masih
diimport dari luar negeri, sehingga perlu dicari sumber selulosa alami sebagai
alternatif pengganti avicel yang stabil, aman dan inert (Siregar dan Wirakarsa,
2010; Ejikeme, 2007). Sabut buah pinang yang selama ini menjadi limbah dapat
dijadikan sebagai alternatif sumber selulosa mikrokristal. Menurut Panjaitan
sehingga dapat dibuat menjadi selulosa mikrokristal yang akan digunakan sebagai
bahan tambahan dalam pembuatan tablet.
Pinang mudah tumbuh di daerah tropis dan biasa ditanam di pekarangan,
taman, atau dibudidayakan. Pinang memiliki banyak kegunaan mulai dari biji,
sabut, daun, hingga pelepahnya. Sabut pinang dapat digunakan sebagai bahan
pembuat papan dan kain. Sabut buah pinang secara tradisional digunakan untuk
mengobati gangguan pencernaan (dyspepsia), sembelit, edema dan beri-beri
(Dalimartha, 2009). Sabut buah pinang mengandung flavonoid, alkaloid (Cyriac,
dkk.,2012), pektin air, pektin oksalat, hemiselulosa, selulosa dan pektin (Rajan,
dkk., 2005). Dengan adanya kandungan pektin dan flavonoid, maka sabut buah
pinang dapat dimanfaatkan sebagai antidiare. Flavonoid berkerja dengan cara
menghambat motilitas usus dan menghambat pelepasan asetilkolin di saluran
cerna sedangkan pektin bekerja sebagai adsorben di dalam usus (Di Carlo, dkk.,
1993).
Berdasarkan masalah di atas dan karena belum adanya penelitian
mengenai pembuatan selulosa mikrokristal dari sabut buah pinang, maka penulis
tertarik untuk melakukan penelitian mengenai pembuatan tablet ekstrak etanol
sabut buah pinang sebagai obat antidiare yang menggunakan selulosa mikrokristal
yang diisolasi dari sabut buah pinang dengan metode cetak langsung.
1.2Perumusan Masalah
Berdasarkan latar belakang, maka rumusan masalah pada penelitian ini
adalah:
2. apakah hasil karakterisasi dari selulosa mikrokristal sabut buah pinang
mempunyai karakteristik yang sama dengan Avicel PH 102?
3. apakah sediaan tablet antidiare ekstrak etanol sabut buah pinang
menggunakan eksipien selulosa mikrokristal memenuhi persyaratan
preformulasi dan evaluasi tablet?
1.3Hipotesis
Adapun hipotesis pada penelitian ini adalah:
1. selulosa mikrokristal dapat diisolasi dari sabut buah pinang.
2. hasil karakterisasi dari selulosa mikrokristal sabut buah pinang mempunyai
kemiripan karakteristik dengan Avicel PH 102.
3. sediaan tablet antidiare ekstrak etanol sabut buah pinang yang dibuat
menggunakan selulosa mikrokristal memenuhi persyaratan prefomulasi dan
evaluasi tablet.
1.4Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. mengisolasi selulosa mikrokristal dari sabut buah pinang.
2. mengetahui karakteristik selulosa mikrokristal dari sabut buah pinang dan
membandingkannya dengan Avicel PH 102.
3. membuat sediaan tablet antidiare ekstrak etanol sabut buah pinang yang
menggunakan eksipien selulosa mikrokristal memenuhi persyaratan
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah untuk memperoleh selulosa mikrokristal
sabut buah pinang yang baik, stabil dan aman serta dapat diaplikasikan sebagai
bahan tambahan dalam tablet antidiare ekstrak etanol sabut buah pinang dengan
BAB II
TINJAUAN PUSTAKA
2.1 Tumbuhan Pinang 2.1.1 Morfologi tumbuhan
Tumbuhan pinang umumnya ditanam di pekarangan, di taman-taman atau
dibudidayakan, dapat ditemukan tumbuh liar di tepi sungai dan tempat-tempat
lain, dapat tumbuh pada ketinggian 1-1.400 meter di atas permukaan laut. Pohon
berbatang langsing, tumbuh tegak, tinggi 10-30 meter, diameter 15-20 cm, tidak
bercabang dengan bekas daun yang lepas. Daun majemuk menyirip, tumbuh
berkumpul di ujung batang membentuk roset batang. Pelepah daun berbentuk
tabung, panjang 80 cm dan tangkai daun pendek. Panjang helai daun 1-1,8 m,
anak daun mempunyai panjang 85 cm, lebar 5 cm dengan ujung sobek dan
bergigi (Dalimartha, 2009).
Biji buah berwarna kecoklatan sampai coklat kemerahan, agak
berlekuk-lekuk dengan warna yang lebih muda. Bidang irisan biji mempunyai perisperm
berwarna coklat tua dengan lipatan tidak beraturan menembus endosperm yang
berwarna agak keputihan (Depkes RI, 1989).
2.1.2 Sinonim dan nama daerah tumbuhan
Tumbuhan pinang memiliki nama daerah seperti pineng, pineung (Aceh),
pinang (Gayo), batang mayang (Karo), pining (Toba), batang pinang
(Minangkabau), dan jambe (Sunda, Jawa) (Depkes RI, 1989).
2.1.3 Klasifikasi tumbuhan
Kingdom : Plantae
Divisi : Spermatophytha
Sub divisi : Angiospermae
Kelas : Monocotyledonae
Bangsa : Arecales
Suku : Arecaceae/Palmae
Marga : Areca
Jenis : Areca catechu L.
2.1.4 Kandungan kimiatumbuhan
Kandungan kimia yang terdapat pada pinang antara lain pelepah pinang
mengandung selulosa (Kalita, dkk., 2006); biji buah pinang mengandung alkaloid,
tanin, flavan, senyawa fenolik, asam galat, getah dan lignin
(13-26%), pektin dan protopektin (Naveenkumar dan Thippeswamy, 2013; Rajan,
dkk, 2005).
2.1.5 Manfaat tumbuhan
Tumbuhan pinang (Areca catechu L.) telah lama dikenal dan hampir
semua bagian tumbuhan dapat dimanfaatkan. Biji pinang berkhasiat sebagai
antielmintik, penenang, mengobati luka, memperbaiki pencernaan, meluruhkan
dahak dan malaria. Sabut buah pinang dapat digunakan untuk mengatasi
gangguan pencernaan (dispepsia), sulit buang air besar (sembelit), edema dan
beri-beri karena urin sedikit (Dalimartha, 2009). Berbagai penelitian telah
dilakukan untuk menguji manfaat sabut buah pinang, diantaranya sebagai
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia
yang diekstraksi mengandung senyawa aktif yang dapat larut dan senyawa yang
tidak larut seperti serat, karbohidrat, protein, dan lain-lain. Senyawa aktif yang
terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak
atsiri, alkaloida dan flavonoida dan lain-lain. Beberapa metode ekstraksi dengan
menggunakan pelarut antara lain (Ditjen POM, 2000):
1. Maserasi
Maserasi adalah proses pengekstrakan dengan menggunakan pelarut
dengan beberapa kali pengadukan pada temperatur ruangan. Remaserasi berarti
dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan
maserat pertama dan seterusnya.
2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan.
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik.
4. Sokletasi
Sokletasi adalah ekstrak dengan menggunakan pelarut yang selalu baru
yang umumnya dilakukan dengan menggunakan alat khusus sehingga terjadi
5. Digesti
Digesti adalah maserasi kinetik dengan pengadukan kontinu pada
temperatur yang tinggi dari temperatur ruangan yaitu secara umum dilakukan
pada temperatur 40-500 C.
6. Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980 C)
selama waktu tertentu (15-20 menit).
7. Dekoktasi
Dekoktasi adalah infus pada waktu yang lebih lama (≥30 menit) dan
temperatur sampai titik didih air.
2.3 Selulosa Mikrokristal
2.3.1 Rumus empiris dan berat molekul (C6H10O5)n ≈ 36000
Dimana n ≈ 220
2.3.2 Struktur kimia
2.3.3 Uraian umum selulosa mikrokristal
Selulosa mikrokristal adalah selulosa yang dimurnikan dan telah
mengalami depolimerisasi parsial, berwarna putih, tidak berbau, tidak berasa dan
berupa serbuk kristal yang terdiri atas partikel-partikel yang berpori (Gohel dan
Jogani, 2005). Selulosa mikrokristal dapat diproduksi dari beberapa bahan alam
diantaranya tongkol jagung (Ohwoavworhua dan Adelakun, 2005), kulit jeruk
(Ejikeme, 2008) dan buah labu (Achor, dkk., 2014) telah terbukti stabil, aman dan
inert. Selulosa mikrokristal sering digunakan pada industri makanan, kosmetik
dan farmasi sebagai bahan pengemulsi, pendispersi, pengental, pengembang dan
salah satu bahan pengisi terbaik untuk tablet kempa langsung (Achor, dkk., 2014).
Selulosa mikrokristal untuk kempa langsung tersedia dalam beberapa produk,
diantaranya Avicel PH 101. Avicel PH 101 merupakan produk asli, sedangkan
Avicel PH 102 lebih teraglomerasi dan memiliki ukuran partikel yang lebih besar
sehingga alirannya sedikit lebih baik dan tidak ada penurunan ketermampatan
yang signifikan (Siregar dan Wirakarsa, 2010).
2.4 Sediaan Tablet 2.4.1 Uraian umum
Tablet adalah sediaan padat, kompak, dibuat secara kempa cetak dalam
bentuk tabung pipih atau sirkuler, kedua permukaannya rata atau cembung,
mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan (Ditjen
POM, 1979). Kriteria yang harus dipenuhi untuk mendapatkan tablet dengan
kualitas yang baik antara lain:
tetap baik selama pabrikasi/pengemasan dan distribusi ke konsumen.
b. Dapat melepaskan bahan obatnya sampai pada ketersediaan hayatinya.
c. Memenuhi persyaratan keseragaman bobot tablet dan kandungan obatnya.
d. Mempunyai penampilan yang menarik, dari segi bentuk, warna dan rasanya.
Sediaan tablet memiliki banyak keuntungan dibandingkan bentuk sediaan
lain diantaranya (Banker dan Anderson, 1994):
a. Merupakan bentuk sediaan yang utuh dan mempunyai ketepatan ukuran serta
variabilitas kandungan yang paling rendah dari pada bentuk yang lain.
b. Merupakan bentuk sediaan oral yang paling ringan dan kompak.
c. Merupakan bentuk sediaan yang mudah dan murah dalam pembuatan,
pengemasan dan pengiriman.
d. Merupakan sediaan oral yang paling mudah pemakaiannya.
Beberapa kerugian tablet antara lain (Banker dan Anderson, 1994):
a. Beberapa obat tidak dapat dikempa menjadi padat dan kompak tergantung
pada keadaan amorfnya, flokulasinya atau rendahnya berat jenis.
b. Obat yang sukar dibasahkan, lambat melarut, dosisnya cukup atau tinggi,
absorpsi optimumnya tinggi melalui saluran cerna atau setiap kombinasi dari
sifat di atas akan sukar atau tidak mungkin diformulasikan dan dipabrikasi
dalam bentuk tablet yang masih menghasilkan biovaibilitas obat cukup.
c. Obat yang rasanya pahit, obat dengan bau yang tidak dapat dihilangkan atau
obat yang peka terhadap oksigen atau kelembapan udara perlu pengkapsulan
atau penyelubungan dulu sebelum dikempa (bila mungkin) atau memerlukan
2.4.2Bahan tambahan formula tablet
Bahan tambahan adalah komponen lain dari suatu sediaan obat selain
bahan aktif. Bahan tambahan memiliki banyak fungsi antara lain untuk membantu
proses produksi, membantu disolusi, meningkatkan kestabilan, bioavailabilitas,
keamanan dan keefektifan obat (Gangurde, dkk., 2013).
Komposisi tablet umumnya terdiri atas bahan aktif dan eksipien atau
bahan tambahan (ada sejumlah kecil tablet yang dapat dibuat tanpa eksipien).
Eksipien ditambahkan dengan berbagai fungsi dan tujuan spesifik sebagai pengisi,
pengikat, penghancur (disintegrant), pelincir (lubricant), anti lengket (anti
adhesive), pelicin (glidant), pembasah (wetting/surface active agent), zat warna
(colours), peningkat rasa (flavors) dan lain-lain. Pemilihan eksipien untuk
formulasi tablet tergantung pada bahan aktif, tipe tablet, karakteristik yang
dibutuhkan dan proses pembuatan yang akan diaplikasikan (Agoes, 2008).
a. Bahan pengisi
Bahan pengisi adalah suatu zat inert secara farmakologis yang
ditambahkan ke dalam suatu formulasi sediaan tablet bertujuan untuk penyesuaian
bobot, ukuran tablet sesuai yang dipersyaratkan, untuk membantu kemudahan
dalam pembuatan tablet, meningkatkan mutu dan kekuatan mekanis tablet
(Mattsson, 2000; Siregar dan Wirakarsa, 2010). Bahan pengisi dapat juga
ditambahkan untuk memperbaiki daya kohesi, sehingga dapat dikempa langsung
atau untuk memacu aliran. Bahan pengisi yang bisa digunakan antara lain sukrosa,
laktosa, dekstrosa, manitol, sorbitol, selulosa mikrokristal dan bahan lain yang
cocok (Chan dan Chew, 2007). Pemilihan bahan pengisi haruslah berdasarkan
langsung. Persyaratan dasar fungsional adalah dapat dikempa (compaction), sifat
aliran baik (flowability), lubrikasi dan disintegrasi (Gohel dan Jogani, 2005).
b. Bahan pengikat
Bahan pengikat atau adhesif ditambahkan ke dalam formulasi tablet
bertujuan untuk menambah kohesivitas serbuk, sehingga memberi ikatan yang
penting untuk membentuk granul dan apabila dikempa akan membentuk suatu
massa kohesif atau kompak yang disebut tablet (Siregar dan Wirakarsa, 2010).
c. Bahan pelicin
Berdasarkan fungsinya, bahan pelicin dibagi menjadi 3 macam yaitu Chan
dan Chew, 2007):
1) Lubrikan berfungsi untuk mengurangi gesekan yang timbul pada antar
permukaan tablet dan dinding lubang kempa selama pengempaan dan
pengeluaran tablet dari lubang kempa.
2) Glidan berfungsi untuk meningkatkan sifat alir granul dari hopper ke ruang
cetakan (die) untuk menghasilkan keseragaman bobot tablet.
3) Antiadheren berfungsi sebagai pencegah melekatnya tablet pada die dan
permukaan punch.
Bahan pelicin yang sering digunakan adalah talk, amilum, asam stearat,
garam-garam stearat, logam stearat dan lain-lain (Chan dan Chew, 2007).
d. Bahan penghancur
Bahan penghancur berfungsi untuk menghancurkan tablet di dalam tubuh
setelah obat digunakan. Tablet diharapkan dapat segera melepaskan bahan
obatnya, terlarut dan dapat diabsorpsi oleh tubuh untuk mendapatkan efek yang
2.4.3 Metode pembuatan tablet
Tablet dibuat dengan 3 cara yaitu granulasi basah, granulasi kering dan
kempa langsung.
a. Granulasi basah
Granulasi basah adalah proses menambahkan cairan pada suatu serbuk
atau campuran serbuk dalam suatu wadah yang dilengkapi dengan pengadukan
yang akan menghasilkan granul. Pembasahan serbuk ini dapat bertindak sebagai
suatu pembawa bahan tertentu, sehingga meningkatkan karakteristik dan
sifat-sifat granulasi yang baik (Siregar dan Wirakarsa, 2010).
Keuntungan metode granulasi basah yaitu:
1) sifat alir yang lebih baik,
2) meningkatkan kompresibilitas,
3) distribusi zat warna dan zat aktif lebih baik,
4) dapat mencegah pemisahan campuran serbuk.
Kerugian metode granulasi basah yaitu:
1) proses pembuatan yang rumit dan adanya proses validasi,
2) biaya yang cukup tinggi,
3) stabilitas menjadi perhatian untuk zat aktif yang peka lembap (Siregar dan
Wirakarsa, 2010).
b. Granulasi kering
Granulasi kering dilakukan apabila zat aktif tidak mungkin digranulasi
basah, karena tidak stabil atau peka terhadap pemanasan, kelembapan atau
keduanya dan juga tidak mungkin dikempa langsung menjadi tablet, karena zat
dikempa langsung (Banker dan Anderson, 1994).
Keuntungan metode granulasi kering yaitu:
1) peralatan lebih sedikit karena tidak menggunakan larutan pengikat, mesin
pengaduk berat dan pengeringan yang memakan waktu,
2) baik untuk zat aktif yang sensitif terhadap panas dan lembab,
3) mempercepat waktu hancur karena tidak terikat oleh pengikat.
Kekurangan metode granulasi kering yaitu:
1) memerlukan mesin cetak khusus untuk membuat slug,
2) tidak dapat mendistribusi zat warna seragam,
3) proses banyak menghasilkan debu sehingga memungkinkan terjadinya
kontaminasi silang (Andayana, 2009).
c. Kempa langsung
Kempa langsung digunakan untuk menyatakan proses ketika tablet
dikempa langsung dari campuran serbuk zat aktif dan eksipien yang sesuai
(Gangurde, dkk., 2013). Pemilihan eksipien sangat penting dalam memformulasi
tablet kempa langsung. Eksipien kempa langsung harus memiliki sifat
kompresibilitas dan fluiditas yang baik (Siregar dan Wirakarsa, 2010; Gohel dan
Jogani, 2005).
Keuntungan proses kempa langsung yaitu lebih ekonomis, prosesnya
singkat, tenaga dan mesin yang digunakan sedikit, dapat digunakan untuk zat aktif
yang tidak tahan panas dan lembab serta waktu hancur dan disolusi lebih baik
(Gohel dan Jogani, 2005). Kerugian metode kempa langsung yaitu kesulitan
dalam pemilihan eksipien dan biaya eksipien yang lebih mahal (Siregar dan
2.4.4 Uji preformulasi
Uji preformulasi ini menggambarkan sifat massa sewaktu pencetakan
tablet, meliputi waktu alir, sudut diam dan indeks tap. Pengujian waktu alir
dilakukan dengan mengalirkan massa granul melalui corong. Waktu yang
diperlukan tidak lebih dari 10 detik, jika melebihi waktu yang telah ditentukan,
maka akan dijumpai kesulitan dalam hal keseragaman bobot tablet. Hal ini dapat
diatasi dengan penambahan bahan pelicin (Carstensen, 1977).
Pengukuran sudut diam digunakan metode corong tegak, granul dibiarkan
mengalir bebas dari corong ke atas dasar. Serbuk akan membentuk kerucut,
kemudian sudut kemiringannya diukur. Semakin datar kerucut yang dihasilkan
semakin kecil sudut diam, maka semakin baik aliran granul tersebut (Voigt,
1994). Granul yang mempunyai sifat yang baik mempunyai sudut diam lebih kecil
dari 350 (Carstensen, 1977).
Indeks tap adalah uji yang mengamati penurunan volume sejumlah sebuk
atau granul akibat adanya gaya hentakan. Indeks tap dilakukan dengan alat
volumenometer yang terdiri dari gelas ukur yang dapat bergerak secara teratur ke
atas dan ke bawah. Serbuk atau granul yang baik mempunyai indeks tap
kurang dari 20% (Carstensen, 1977).
2.4.5 Evaluasi tablet a. Keseragaman bobot
Keseragaman bobot tablet ditentukan berdasarkan banyaknya
penyimpangan bobot tiap bobot tablet terhadap bobot rata-rata dari sejumlah
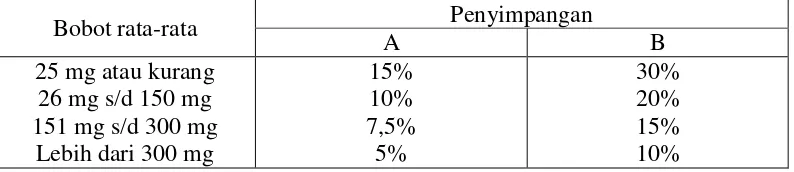
tablet yang masih diperbolehkan menurut syarat yang telah ditentukan. Menurut
dari bobot rata-rata lebih besar dari harga yang ditetapkan dalam kolom A dan
tidak boleh satu pun tablet menyimpang dari bobot rata-rata lebih besar dari harga
yang ditetapkan dalam kolom B.
Persyaratan keseragaman bobot tablet dapat dilihat pada Tabel 2.1 di
bawah ini.
Tabel 2.1 Persyaratan keseragaman bobot
Bobot rata-rata Penyimpangan
A B
Ketahanan tablet terhadap goncangan saat pengangkutan, pengemasan dan
peredaran bergantung pada kekerasan tablet. Kekerasan yang lebih tinggi
menghasilkan tablet yang bagus, tidak rapuh tetapi ini mengakibatkan
berkurangnya porositas dari tablet sehingga sukar dimasuki cairan yang
mengakibatkan lamanya waktu hancur. Kekerasan untuk tablet secara umum yaitu
4-8 kg, tablet hisap 10-20 kg, tablet kunyah 3 kg (Parrot, 1971)
c. Friabilitas
Friabilitas tablet merupakan indikasi kekuatan mekanis dari suatu sediaan
tablet. Pengujian dilakukan pada kecepatan 25 rpm, dengan menjatuhkan tablet
sejauh 6 inci pada setiap putaran, yang dijalankan sebanyak 100 putaran
(Gangurde, dkk., 2013). Kehilangan berat yang dibenarkan yaitu lebih kecil dari
d. Waktu hancur
Waktu hancur yaitu waktu yang dibutuhkan tablet pecah menjadi partikel
kecil atau granul sebelum larut dan diabsorpsi. Waktu hancur menyatakan waktu
yang diperlukan tablet untuk hancur di bawah kondisi yang ditetapkan dan
lewatnya seluruh partikel melalui saringan mesh-10 (Banker dan Anderson,
1994).
Waktu hancurnya tablet dapat dipengaruhi oleh sifat fisik dan kimia bahan
pada saat granulasi, kekerasan tablet dan porositas tablet (Parrot, 1971). Tablet
memenuhi syarat jika waktu hancurnya tidak lebih dari 15 menit (Ditjen POM,
BAB III
METODE PENELITIAN
Penelitian ini menggunakan metode eksperimental yang meliputi
pengambilan sampel, identifikasi sampel, pengolahan sampel, isolasi selulosa
mikrokristal, karakterisasi selulosa mikrokristal, pembuatan ekstrak etanol,
pembuatan sediaan tablet ekstrak etanol , uji preformulasi dan evaluasi tablet.
3.1 Alat-alat
Alat-alat yang digunakan adalah mesin pencetak tablet single punch
(Erweka), Disintegration Tester (Copley), Friabilator (Copley), Strong Cobb
Hardness Tester (Copley), alat uji sudut diam dan waktu alir (Copley), hot plate,
neraca listrik (Sartorius), oven, desikator, Fourier-Transform Infrared
Spectrophotometer (Shimadzu), Scanning Electron Microscopy (TM3000
Hitachi), pH indikator (Merck), pH meter (Hanna), tanur (Noberthem), pompa
vakum, lemari pengering, termometer, ayakan bertingkat dan alat-alat gelas.
3.2 Bahan-bahan
Bahan tumbuhan yang digunakan adalah sabut buah pinang sedangkan
bahan kimia yang digunakan kecuali dinyatakan lain berkualitas pro analisis:
pereaksi Mayer, Dragendorff, Bouchardat, Molish, besi (III) klorida, serbuk Mg,
amil alkohol, natrium hidroksida, akuades, natrium hipoklorit, asam klorida
pekat, asam sulfat, kloroform, etanol, toluen, magnesium stearat, talkum,
3.3 Pengumpulan dan Pengolahan Sampel 3.3.1 Pengambilan sampel
Pengambilan sampel dilakukan secara purposif, artinya tanpa
membandingkan sampel dengan sampel dari daerah lain. Sampel yang digunakan
dalam penelitian ini adalah sabut buah pinang yang diambil dari daerah
Simalingkar B, Kecamatan Medan Johor, Kota Medan, Provinsi Sumatera Utara.
3.3.2 Identifikasi sampel
Identifikasi sampel dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia
(LIPI) Pusat Penelitian dan Pengembangan Biologi Bogor.
3.3.3 Pengolahan sampel
Sampel yang digunakan adalah sabut buah pinang yang telah matang dan
berwarna kuning kemerah-merahan. Kulit beserta sabutnya dilepas dari biji
pinang, kemudian sabut buah pinang dicuci, dikering anginkan dan dimasukkan
ke dalam lemari pengering pada suhu ± 40o C. Sabut buah pinang yang telah
kering ditimbang, lalu digunting kecil-kecil dan diblender hingga diperoleh serbuk
simplisia.
3.4 Pembuatan Ekstrak
Sebanyak 1000 g serbuk simplisia sabut buah pinang dimasukkan ke
dalam wadah kaca berwarna gelap, ditambahkan dengan 8500 ml etanol 80%.
Ditutup dan dibiarkan selama 5 hari terlindung dari cahaya sambil sesekali
diaduk, kemudian disaring. Ampas dipindahkan ke dalam wadah, ditambahkan
dengan 1500 ml etanol 80% dan ditutup, dibiarkan di tempat sejuk, terlindung dari
diuapkan dengan menggunakan rotary evaporator pada temperatur ± 40oC
sampai diperoleh ekstrak kental (Ditjen POM, 1979).
3.5 Pembuatan Pereaksi
Pembuatan larutan pereaksi Bouchardat, Mayer, Dragendorff, Molish,
asam klorida 2 N, asam sulfat 2 N, timbal (II) asetat 0,4 M dan besi (III) klorida
(Depkes RI, 1995).
3.5.1 Pereaksi Bouchardat
Sebanyak 4 gram kalium iodida ditimbang, dilarutkan dalam air suling dan
sebanyak 2 gram iodium ditimbang, dilarutkan dalam larutan kalium iodida dan
dicukupkan hingga 100 ml.
3.5.2 Pereaksi Mayer
Sebanyak 1,359 gram raksa (II) klorida ditimbang, dilarutkan dalam air
suling hingga 60 ml. Pada wadah lain kalium iodida ditimbang sebanyak 5 gram,
dilarutkan dalam 10 ml air suling, kemudian dicampurkan dan ditambahkan air
suling hingga 100 ml.
3.5.3 Pereaksi Dragendorff
Sebanyak 8 gram bismuth (III) nitrat ditimbang, dilarutkan dalam 20 ml
asam nitrat pekat, pada wadah lain dilarutkan 27,2 gram kalium iodida dalam 50
ml air suling, kemudian kedua larutan dicampurkan dan didiamkan memisah.
Larutan yang jernih diambil dan diencerkan dengan air suling hingga 100 ml.
3.5.4 Pereaksi Molish
Sebanyak 3 gram α-naftol diimbang, dilarutkan dalam asam nitrat 0,5 N
3.5.5 Larutan asam klorida 2 N
Sebanyak 7,293 ml asam klorida pekat ditambahkan air suling hingga
100 ml.
3.5.6 Larutan asam sulfat 2 N
Sebanyak 9,808 ml asam sulfat pekat diencerkan dengan air suling
secukupnya hingga volume 100 ml.
3.5.7 Larutan timbal (II) asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat ditimbang, dilarutkan dalam air
suling bebas karbondioksida sehingga diperoleh larutan 100 ml.
3.5.8 Larutan besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida ditimbang, dilarutkan dalam air suling
hingga 100 ml.
3.5.9 Larutan natrium hidroksida 4%
Sebanyak 4 gram natrium hidroksida dilarutkan dalam air bebas
karbondioksida secukupnya hingga 100 ml.
3.5.10 Larutan natrium hidroksida 17,5%
Sebanyak 17,5 gram natrium hidroksida dilarutkan dalam air bebas
karbondioksida secukupnya hingga volume 100 ml.
3.5.11 Larutan HCl 2,5 N
Sebanyak 208,4 ml asam klorida pekat diencerkan dengan air suling
secukupnya hingga volume 1000 ml.
3.5.12 Pereaksi natrium hipoklorit 2,5%
Sebanyak 20,8 ml larutan pekat natrium hipoklorit (12%) diencerkan
3.5.13 Air bebas karbondioksida
Air suling yang telah dididihkan selama 5 menit atau lebih didiamkan
sampai dingin dan tidak boleh menyerap karbondioksida dari udara.
3.6 Karakterisasi Ekstrak
Karakterisasi ekstrak meliputi penetapan kadar air, penetapan kadar abu
total, pemeriksaan kadar abu yang tidak larut dalam asam, penetapan kadar sari
yang larut dalam etanol dan penetapan kadar sari yang larut dalam air (Depkes RI,
1995).
3.6.1 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluen).
Alat terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung
penyambung dan tabung penerima 10 ml.
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu
alas bulat, kemudian didestilasi selama 2 jam. Toluen didinginkan selama 30
menit dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 ml
(volume I). Ekstrak yang telah ditimbang seksama dimasukkan ke dalam labu
alas bulat, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mulai
mendidih, didestilasi dengan kecepatan 2 tetes tiap detik, hingga sebagian besar
air terdestilasi. Kecepatan destilasi ditingkatkan hingga 4 tetes tiap detik setelah 2
jam didestilasi (semua air terdestilasi), kemudian bagian dalam pendingin dibilas
dengan toluen yang telah dijenuhkan. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin sampai suhu kamar. Volume air
dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa.
Kadar air dihitung dalam persen terhadap berat sampel yang telah dikeringkan.
3.6.2 Penetapan kadar abu total
Sebanyak 2 g ekstrak ditimbang seksama, dimasukkan dalam krus platina
atau krus silikat yang telah dipijar dan ditara. Pemijaran dilakukan perlahan-lahan
pada suhu 600°C selama 3 jam sampai arang habis, kemudian didinginkan dan
ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang
telah dikeringkan di udara.
3.6.3Penetapan kadar abu yang tidak larut asam
Abu yang telah diperoleh dalam penetapan abu dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring dengan kertas saring bebas abu, dicuci dengan air panas,
dipijarkan sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu
yang tidak larut dalam asam dihitung terhadap bobot yang dikeringkan di udara
3.6.4Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g ekstrak dilarutkan dengan etanol secukupnya, lalu disaring.
Fitrat sebanyak 20 ml diuapkan sampai kering dalam cawan penguap yang
berdasar rata yang telah ditara. Sisa filtrat dipanaskan pada suhu 105°C hingga
diperoleh bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen
terhadap bahan yang telah dikeringkan di udara.
3.6.5Penetapan kadar sari yang larut dalam air
Sebanyak 5 g ekstrak ditambahkan 100 ml air kloroform (2,5 ml
kloroform dalam air suling 1000 ml), kemudian disaring. Filtrat sebanyak 20 ml
ditara. Sisa dipanaskan pada suhu 105° hingga diperoleh bobot tetap. Kadar sari
yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan
di udara.
3.7 Skrining Fitokimia
Skrining fitokimia ekstrak etanol sabut buah pinang (Areca catechu L.)
berdasarkan Depkes RI (1995) alkaloid, glikosida, saponin; (Ditjen POM, 1979)
tanin; Farnsworth, (1966) flavonoid dan steroid/triterpenoid.
3.7.1 Pemeriksaan alkaloid
Sebanyak 0,5 g ekstrak ditimbang, kemudian ditambahkan 1 ml asam
klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit,
didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
a. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
b. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
c. diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
Alkaloid dinyatakan positif jika terjadi endapan atau kekeruhan paling sedikit
pada 2 tabung reaksi dari percobaan di atas.
3.7.2 Pemeriksaan glikosida
Sebanyak 3 g ekstrak ditimbang, lalu ditambahkan dengan 10 ml asam
klorida 2 N, kemudian direfluks selama 30 menit, didinginkan dan disaring. Filtrat
sebanyak 20 ml ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M,
dikocok selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran 3
bagian kloroform dan 2 bagian isopropanol dan dilakukan berulang sebanyak
dilarutkan dalam 2 ml metanol. Sebanyak 0,1 ml larutan dimasukkan ke dalam
tabung reaksi, diuapkan di penangas air, sisanya dilarutkan dalam 2 ml air suling
dan 5 tetes pereaksi Molish. Secara perlahan-lahan ditambahkan 2 ml asam sulfat
pekat melalui dinding tabung. Glikosida dinyatakan positif jika terbentuk cincin
berwarna ungu.
3.7.3 Pemeriksaan saponin
Sebanyak 0,5 g ekstrak dimasukkan ke dalam tabung reaksi, ditambahkan
10 ml air panas, didinginkan dan kemudian dikocok kuat-kuat selama 10 detik.
Tanin dinyatakan positif jika terbentuk buih yang mantap selama tidak kurang
dari 10 menit, setinggi 1 – 10 cm dan setelah penambahan 1 tetes asam klorida
2 N buih tidak hilang.
3.7.4 Pemeriksaan flavonoid
Sebanyak 5 g ekstrak dilarutkan dengan etanol secukupnya, kemudian
ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam
keadaan panas. Filtrat sebanyak 5 ml lalu ditambahkan 0,1 g serbuk Mg dan 1 ml
asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah.
Flavonoid dinyatakan positif jika terjadi warna merah, kuning, jingga pada lapisan
amil alkohol.
3.7.5 Pemeriksaan tanin
Sebanyak 0,5 g ekstrak ditambahkan dengan 10 ml air suling, lalu
disaring. Filtratnya diencerkan dengan air suling sampai tidak berwarna. Larutan
diambil sebanyak 2 ml, lalu ditambahkan 1- 2 tetes pereaksi besi (III) klorida 1%.
3.7.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g ekstrak ditambahkan 20 ml n-heksana, lalu disaring. Filtrat
diuapkan dalam cawan penguap, sisanya ditambahkan 2 tetes asam asetat
anhidrid dan 1 tetes asam sulfat pekat. Timbulnya warna biru atau hijau
menunjukkan adanya steroid jika timbul warna merah, pink atau ungu
menunjukkan adanya triterpenoid.
3.8 Isolasi Selulosa Mikrokristal
Sebanyak 100 gram sabut buah pinang dimasukkan ke dalam beaker
glass, ditambahkan 1,5 l NaOH 4% dan dipanaskan selama 2 jam pada suhu
100ºC, lalu disaring. Residu dicuci hingga pH netral, kemudian diputihkan
dengan cara direndam dengan natrium hipoklorit 2,5% sebanyak 1 l selama 24
jam pada suhu kamar, lalu disaring. Residu dicuci dengan air suling sampai pH
netral, kemudian dilanjutkan dengan penambahan NaOH 17,5% sebanyak
650 ml, dipanaskan pada suhu 80ºC selama 1 jam, kemudian disaring dan residu
dicuci hingga pH netral. Residu diputihkan kembali dengan natrium hipoklorit
2,5% sebanyak 500 ml dan dipanaskan pada suhu 100ºC selama 5 menit, disaring
dan residu dicuci sampai pH netral. Residu yang telah netral dikeringkan pada
suhu 60ºC. Hasil yang didapat disebut α-selulosa (Herawan, dkk., 2013).
Serbuk α-selulosa dihidrolisis menggunakan asam klorida 2,5 N dengan
cara dididihkan selama 10-15 menit, kemudian disaring. Residu yang diperoleh
dinetralkan dengan akuades, lalu dikeringkan dan dihaluskan secara mekanik.
Selulosa mikrokristal yang dihasilkan diayak dengan ayakan mesh 60 dan 100
3.9 Karakterisasi Selulosa Mikrokristal
Karakterisasi selulosa mikrokristal meliputi uji organoleptik, penetapan
pH, kadar abu total, susut pengeringan, kelarutan zat dalam air, bobot jenis nyata,
bobot jenis benar, bobot jenis mampat, indeks Hausner, indeks kompresibilitas,
porositas, analisis FT-IR dan Scanning Electron Microscopy.
3.9.1 Uji organoleptik
Uji organoleptik meliputi pemeriksaan bau, warna dan rasa dari selulosa
mikrokristal sabut buah pinang yang dibandingkan dengan Avicel PH 102.
3.9.2 Penetapan pH
Penetapan pH dapat dilakukan dengan menggunakan pH meter. Caranya:
alat pH meter dikalibrasi menggunakan larutan dapar pH 7 dan pH 4. Satu gram
zat yang akan diperiksa diencerkan dengan air suling hingga 10 ml. Elektroda pH
meter dicelupkan ke dalam larutan yang diperiksa, jarum pH meter dibiarkan
bergerak sampai menunjukkan posisi tetap, pH yang ditunjukkan jarum pH meter
dicatat (Suardi, dkk., 2008).
3.9.3 Kelarutan zat dalam air
Sebanyak 5 gram sampel dicampur dengan ± 80 ml air selama 10 menit,
disaring dengan vakum melalui kertas saring Whatman 42. Filtrat dipindahkan ke
beaker yang telah ditara, lalu diuapkan hingga kering pada suhu 105o C selama
1 jam, didinginkan dalam desikator dan ditimbang. Perbedaan antara berat residu
dan berat beaker kosong tidak lebih dari 12,5 mg (0,25%) (USP, 2007).
3.9.4 Penetapan kadar abu total
Sebanyak 2 gram sampel yang telah digerus dan ditimbang seksama
diratakan. Pemijaran dilakukan perlahan-lahan sampai arang habis pada suhu
600o C selama 3 jam, kemudian didinginkan dan ditimbang sampai diperoleh
bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan di udara.
3.9.5 S usut pengeringan
Botol timbang dangkal bersumbat kaca dikeringkan di oven selama
30 menit pada suhu 100o-105o C, lalu didinginkan dalam desikator dan ditimbang.
Pekerjaan ini dilakukan sampai diperoleh berat yang konstan. Sebanyak 1 gram
selulosa mikrokristal ditimbang dalam botol timbang kemudian digoyangkan
perlahan hingga rata, kemudian dikeringkan di dalam oven pada suhu 1050 C
selama 1 jam. Pada waktu pemanasan di oven, tutup botol timbang dibuka dan
saat pengambilan botol timbang segera ditutup dan dibiarkan dalam desikator
sampai mencapai suhu kamar, lalu ditimbang. Pekerjaan ini dilakukan sampai
diperoleh berat yang konstan (Ditjen POM, 1995).
3.9.6 Bobot jenis nyata
Sebanyak 100 g zat uji (W) dikeringkan hingga bobotnya konstan,
kemudian dimasukkan ke dalam gelas ukur 200 ml, permukaan zat uji diratakan
dan dicatat volume serbuk (V). Bobot jenis dihitung dengan persamaan (Ben,
dkk., 2007):
Bobot jenis nyata = W
V
3.9.7 Bobot jenis benar
Penentuan bobot jenis benar dilakukan menggunakan piknometer dan
pelarut yang tidak melarutkan sampel yaitu benzen. Piknometer kosong yang telah
ditimbang beratnya (c) (Voigt, 1994).
Bobot jenis benzen dihitung dengan persamaan:
ρ benzen = c-b
a
Serbuk sebanyak 2 g yang telah dikeringkan hingga berat konstan
dimasukkan ke dalam piknometer, ditimbang (d), lalu ditambahkan benzen ke
dalam piknometer sampai jenuh dan ditimbang kembali beratnya (e) (Ben,
dkk.,2007)
Bobot jenis benar = d-b
(d-b)+(c-e) x ρ benzen
3.9.8 Bobot jenis mampat
Sebanyak 100 g zat uji (W) dikeringkan hingga bobotnya konstan, lalu
dimasukkan ke dalam gelas ukur 200 ml, permukaan zat uji diratakan, kemudian
gelas ukur dihentakkan sebanyak 1250 kali, catat volumenya (Vt). Dilakukan
hentakan lagi sebanyak 1250 kali dan dicatat volumenya (Vtl). Jika selisih Vt dan
Vtl tidak lebih dari 2 ml maka dipakai Vt (Ben, dkk., 2007).
Bobot jenis mampat= W Vt
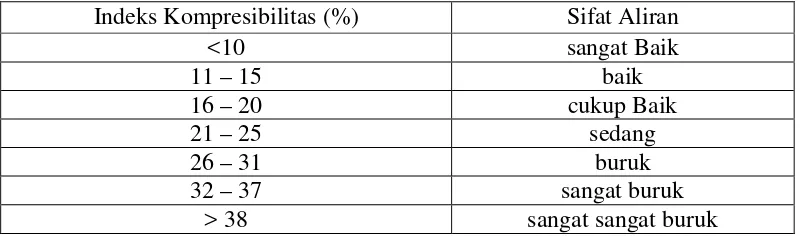
3.9.9 Indeks kompresibilitas
Indeks kompresibilitas zat uji dihitung menggunakan persamaan:
Indeks kompresibilitas= berat jenis mampat-berat jenis nyata
berat jenis nyata x 100%
Adapun persyaratan indeks kompresibilitas dapat dilihat pada Tabel 3.1 di
Tabel 3.1 Persyaratan indeks kompresibilitas
Indeks Kompresibilitas (%) Sifat Aliran
<10 sangat Baik
> 38 sangat sangat buruk
3.9.10 Indeks Hausner
Indeks Hausner dihitung menggunakan data bobot jenis mampat dan
bobot jenis nyata seperti yang diperoleh di atas.
Indeks Hausner= bobot jenis mampat bobot jenis nyata
Adapun persyaratan indeks Hausner dapat dilihat pada Tabel 3.2.
Tabel 3.2 Persyaratan indeks Hausner
Indeks Hausner Sifat Aliran
< 1,25 baik
1,25-1,5 sedang
>1,5 jelek
3.9.11 Porositas
Porositas zat uji dihitung menggunakan persamaan: (Carstensen, 1977).
Persen Porositas=1- berat jenis nyata
berat jenis benar x 100%
3.9.12 Analisis FT-IR
Analisis gugus fungsi dilakukan dengan menggunakan instrumen
spektrofotometer FT-IR (Shimadzu) di Laboratorium Penelitian Fakultas Farmasi
3.9.13 Scanning Electron Microscopy
Analisis morfologi selulosa dilakukan menggunakan Scanning Electron
Microscopy (TM3000 Hitachi) di Laboratorium Terpadu MIPA Universitas
Sumatera Utara.
3.10 Pembuatan Tablet Ekstrak Etanol Sabut Buah Pinang (EESBP)
Pembuatan tablet ekstrak etanol sabut buah pinang dilakukan secara cetak
langsung dengan bobot tablet 650 mg dan diameter 13 mm. Dibuat dua formula
dengan bahan tambahan yaitu selulosa mikrokristal dari sabut buah pinang dan
sebagai pembanding digunakan Avicel PH 102. Formula tablet yang dibuat dapat
dilihat pada Tabel 3.3.
R/ EESBP 0, 200
Aerosil 1%
Mg. Stearat 1%
Talkum 1%
Avicel PH 102/ SMSBP q.s
Tabel 3.3 Formula tablet EESBP
Komposisi F1 F2
EESBP (mg) 200 200
Aerosil (mg) 6,5 6,5
Mg. stearat (mg) 6,5 6,5
Talkum (mg) 6,5 6,5
SMSBP (mg) 430,5 -
Avicel PH 102 (mg) - 430,5
keterangan :
3.11 Uji Preformulasi
Uji preformulasi tablet EESBP meliputi pengujian sudut diam, penetapan
waktu alir dan indeks kompresibilitas.
3.11.1 Sudut diam
Tiap formula dituang pelan-pelan lewat corong, sementara bagian bawah
corong ditutup, kemudian penutup dibuka dan granul dibiarkan mengalir keluar.
Diukur tinggi dan jari-jari kerucut yang terbentuk, kemudian ditentukan sudut
diamnya. Granul yang mempunyai daya alir bebas akan mempunyai sudut
diam antara 20o – 40o (Lachman, dkk., 1994).
tangen θ = 2h D
keterangan: h = tinggi kerucut, D = diameter
3.11.2 Penetapan waktu alir
Granul yang akan dicetak dimasukkan kedalam corong alir, lalu dialirkan
hingga seluruh granul mengalir. Waktu alir ditentukan hingga seluruh formula
mengalir keluar.Syarat waktu alir yang baik adalah kurang dari 10 detik.
3.11.3 Penetapan indeks kompresibilitas
Granul dimasukkan ke dalam gelas ukur 50 ml dan diukur volume
awalnya (V1), lalu dihentakkan sehingga volume akhirnya (V2) konstan. Indeks
tap dihitung dengan rumus: (Carstensen, 1977).
I = V1-V2
V1 x 100%
dimana : VI = volume sebelum hentakan, V2 = volume setelah hentakan
3.12 Evaluasi Tablet
3.12.1 Pemeriksaan keseragaman bobot tablet
Dimasukkan 20 tablet dan dibersihkan dari debu kemudian ditimbang.
Dihitung bobot rata-rata tiap tablet, kemudian ditimbang satu persatu dan diambil
3 berat tablet yang berdeviasi tinggi (Ditjen POM, 1979).
Deviasi= bobot tablet - bobot rata-rata
bobot rata-rata x 100%
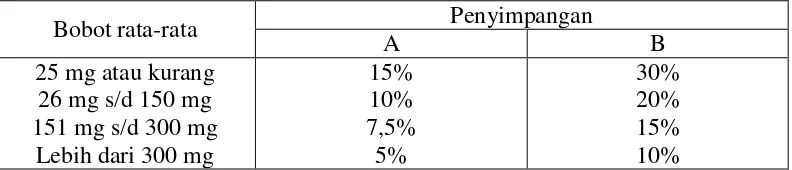
Persyaratan keseragaman bobot tablet dapat dilihat pada Tabel 3.4 di
bawah ini:
Tabel 3.4 Persyaratan keseragaman bobot tablet
Bobot rata-rata Penyimpangan
A B
Persyaratan tidak boleh lebih dari 2 tablet yang masing-masing bobotnya
menyimpang dari bobot rata-rata dari harga yang diterapkan pada kolom A dan
tidak boleh 1 tablet yang menyimpang dari bobot rata-rata dari harga yang
ditetapkan pada kolom B (Ditjen POM, 1979).
3.12.2 Pemeriksaan friabilitas tablet
Sebanyak 20 tablet ditimbang, misalkan beratnya ”a” gram, dimasukkan
ke dalam alat friabilator, lalu tekan tombolnya sehingga alat berputar selama 4
menit (100 kali putaran). Tablet dikeluarkan, dibersihkan dari debu dan ditimbang
beratnya, misalnya ”b” gram. Friabilitas tablet dapat dihitung dengan rumus :
F= a
3.12.3 Uji kekerasan tablet
Alat yang digunakan adalah Strong Cobb Hardness Tester (Copley).
Sebuah tablet diletakkan ditengah besi penahan, kemudian alat dijalankan
sehingga besi penahan menekan tablet. Kekerasan tablet dapat dilihat pada skala
yang muncul di monitor. Pemeriksaan kekerasan tablet dilakukan sebanyak lima
tablet dan dihitung rata-ratanya (Parrot, 1971).
3.12.4 Uji waktu hancur tablet
Alat yang digunakan adalah Disintegration Tester (Copley). Pengujian
dilakukan terhadap enam tablet. Satu buah tablet dimasukkan ke dalam
masing-masing tabung dari keranjang. Dimasukkan satu cakram pada tiap tabung
dan jalankan alat. Digunakan air bersuhu 37o C ± 2o C sebagai media, kemudian
alat dijalankan. Waktu hancur tablet dicatat yaitu sejak tablet dinaikturunkan
sampai tablet hancur. Tablet dinyatakan hancur jika tidak ada bagian tablet yang
tertinggal dikasa. Syarat waktu hancur tablet yaitu tidak boleh lebih dari 15 menit
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi tumbuhan dilakukan oleh Pusat Penelitian dan
Pengembangan Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) adalah
tumbuhan pinang (Areca catechu L.) dari suku Arecaceae. Hasil dapat dilihat pada
Lampiran 1 halaman 53.
Penyarian terhadap sabut buah pinang dilakukan secara maserasi dengan
pelarut etanol 80%, dimana diharapkan senyawa kimia yang terkandung di
dalamnya dapat tersari. Hasil pengumpulan sampel sebanyak 10 kg menghasilkan
1,2 kg simplisia dan dari 1 kg simplisia diperoleh ekstrak etanol sebanyak 85
gram. Rendemen yang didapat sebesar 8,5%.
4.1 Hasil Karakterisasi Ekstrak Etanol Sabut Buah Pinang (EESBP) Hasil pemeriksaan karakterisasi EESBP dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil karakterisasi EESBP
No Karakterisasi ekstrak Hasil
(%)
1 Kadar air 9,30
2 Kadar sari yang larut dalam air 41,79
3 Kadar sari yang larut dalam etanol 42,14
4 Kadar abu total 5,39
5 Kadar abu yang tidak larut dalam asam 2,06
Penetapan kadar air dilakukan untuk memberi batasan atau rentang
besarnya kandungan air di dalam ekstrak, karena apabila tingginya kandungan air
aktifnya (penguraian secara kimia). Penetapan kadar sari larut dalam air dan
etanol untuk mengetahui banyaknya senyawa polar yang larut dalam air dan
etanol. Penetapan kadar abu total dan kadar abu tidak larut asam bertujuan untuk
bertujuan untuk mengetahui kandungan senyawa anorganik dalam simplisia,
misalnya logam K, Ca, Na, Pb, Hg dan silika (Ditjen POM, 2000).
4.2 Hasil Skrining Fitokimia EESBP
Hasil skrining fitokimia terhadap EESBP diperoleh golongan senyawa
kimia seperti yang terlihat pada Tabel 4.2 di bawah ini.
Tabel 4.2 Hasil skrining fitokimia dari EESBP
No Golongan Senyawa Hasil
1. Alkaloid -
2. Flavonoid +
3. Steroid/Triterpenoid -
4. Tanin -
5. Glikosida +
6. Saponin -
keterangan: (+) : mengandung senyawa, (-): tidak mengandung senyawa
Penentuan golongan senyawa kimia terhadap EESBP dilakukan untuk
mendapatkan informasi tentang golongan senyawa metabolit sekunder yang
terdapat di dalamnya. EESBP yang ditambah dengan pereaksi Dragendorff tidak
memberikan endapan warna jingga kecoklatan, dengan pereaksi Bouchardat tidak
memberikan endapan warna kuning kecoklatan dan dengan pereaksi Mayer tidak
terbentuk endapan putih dan kekeruhan, ini menunjukkan bahwa tidak adanya
senyawa alkaloid (Depkes RI, 1995). Flavonoid ditentukan dengan penambahan
serbuk Mg dan HCL 2 N, memberikan warna kuning pada lapisan amil alkohol