49
Lampiran 3. Gambar tumbuhan dan sabut pinang (Areca catechu L.)
Tumbuhan pinang
50
Lampiran 4. Gambar sabut pinang (Areca catechu L.)
51
Lampiran 5. Gambar serbuk simplisia sabut pinang (Areca catechu L.)
52
53 Lampiran 7. Bagan kerja penelitian
Dilepas sabutnya menggunakan rampago
Dipilah sehingga didapat serabut atau sabut pinang
Dikeringkan di lemari pengering pada suhu ± 40ºC
Dihaluskan menggunakan blender menjadi serbuk halus
Disimpan dalam wadah plastik tertutup rapat
Simplisia (1500 g)
Serbuk simplisia
Karakterisasi simplisia, meliputi pemeriksaan: 1.Makroskopik
2.Kadar air
3.Kadar sari larut etanol 4.Kadar sari larut air 5.Kadar abu total 6.Kadar abu tidak larut
asam
Pembuatan ekstrak etanol sabut pinang (EESP) menggunakan metode maserasi dengan pelarut etanol 80%.
Ekstrak etanol sabut pinang (EESP) Uji aktivitass antidiare, tikus setelah diinduksi oleum ricini, diberikan:
1. Suspensi CMC Na 1% b/v
2. Suspensi loperamid HCl 1 mg/kg bb 3. Suspensi EESP
-dosis 25 mg/kg bb konsentrasi 0,75% -dosis 50 mg/kg bb konsentrasi 1,5% -dosis 75 mg/kg bb konsentrasi 2,25% -dosis 100 mg/kg bb konsentrasi 3%
Hasil dianalisis secara Anova dan dilanjutkan dengan uji beda rata-rata Duncan Buah pinang segar
54
Lampiran 8. Bagan kerja pembuatan ekstrak etanol sabut pinang (EESP)
Dimasukkan ke dalam sebuah bejana
Dimasukkan etanol 80% sebanyak 75 bagian, lalu ditutup
Dibiarkan selama 5 hari terlindung dari cahaya sambil sering diaduk Diserkai
Dicuci dengan etanol 80% secukupnya hingga diperoleh 100 bagian
Dipindahkan ke dalam bejana tertutup,
biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari Dienap tuangkan atau saring
Diuapkan dengan rotary evaporator pada suhu 40°C
Dikeringkan dengan freeze dryer pada suhu -40°C Ampas
Ekstrak kental (50 g) Maserat
Ampas
Ekstrak kering
Maserat
55
Lampiran 9. Perhitungan hasil pemeriksaan karakteristik serbuk simplisia dan ekstrak etanol sabut pinang (Areca catechu L.)
1. Perhitungan kadar air
a. Serbuk simplisia
Kadar air I = 100% 3,98%
b. Ekstrak etanol sabut pinang
56 Lampiran 9. (Lanjutan)
2. Perhitungan kadar sari yang larut dalam air terhadap serbuk simplisia
Kadar sari yang larut dalam air I = 100% 9,8%
Rata-rata % kadar sari yang larut dalam air
= 9,95%
3
10,26% 9,79%
9,8%+ + =
3. Perhitungan kadar sari yang larut dalam etanol terhadap serbuk simplisia
No Berat sari (g) Berat sampel (g) Kadar sari (%)
Rata-rata % kadar sari yang larut dalam etanol
57 Lampiran 9. (Lanjutan)
4. Perhitungan kadar abu total
a. Serbuk simplisia
No Berat abu (g) Berat sampel (g) Kadar abu total (%)
b. Ekstrak etanol sabut pinang
58 Lampiran 9. (Lanjutan)
5. Perhitungan kadar abu yang tidak larut dalam asam
a. Serbuk simplisia
No Berat abu (g) Berat sampel (g) Kadar abu tidak larut
Rata-rata % kadar abu tidak larut dalam asam
= 2,20%
3
2,35% 1,79%
2,47%+ + =
b. Ekstrak etanol sabut pinang
No Berat abu (g) Berat sampel (g) Kadar abu tidak larut
Rata-rata % kadar abu tidak larut dalam asam
59
Lampiran 10. Volume maksimum larutan sediaan uji yang dapat diberikan pada hewan uji
Jenis hewan uji Volume maksimum (ml) sesuai jalur pemberin
i.v i.m i.p s.c p.o
Mencit (20-30 g) 0,5 0,05 1,0 0,5-1,0 1,0
Tikus (200 g) 1,0 0,1 2-5 2-5 5,0
Hamster (50 g) - 0,1 1-2 2-5 2,5
Marmut (300 g) - 0,25 2-5 5,0 10,0
Kelinci (2,5 kg) 5-10 0,5 10-20 5-10 20,0
Kucing (3 kg) 5-10 1,0 10-20 5-10 50,0
Anjing (5 kg) 10-20 5,0 20-50 10,0 100,0
60
Lampiran 11. Tabel konversi dosis antara jenis hewan dengan manusia
Mencit 20 g
Tikus 200 g
Marmut 400 g
Kelinci 1,5 kg
Kera 4 kg
Anjing 12 kg
Manusia 70 kg Mencit
20 g 1,0 7,0 12,25 27,8 64,1 124,3 387,9 Tikus
200 g 0,14 1,0 1,74 3,0 9,2 17,8 56,0
Marmut
400 g 0,008 0,57 1,0 2,25 5,2 10,2 31,5
Kelinci
1,5 kg 0,04 0,25 0,44 1,0 2,4 4,5 14,2
Kera
4 kg 0,016 0,11 0,19 0,42 1,0 1,9 6,1
Anjing
12 kg 0,008 0,06 0,10 0,22 0,52 1,0 3,1 Manusia
61
Lampiran 12. Perhitungan konversi dosis loperamid HCl dan ekstrak etanol sabut pinang (EESP)
1. Perhitungan konversi dosis loperamid HCl dari manusia ke tikus :
Dosis loperamid HCl pada manusia dewasa (berat 70 kg) adalah dosis awal 4 mg, tidak melebihi 16 mg/hari, maka dosis loperamid untuk tikus (200 g), yaitu =16 mg × 0,018 = 0,2 mg/200 g bb tikus atau sama dengan 1 mg/kg bb 2. Perhitungan konversi dosis EESP dari tikus ke manusia :
Dosis yang digunakan dalam penelitian adalah : - 25 mg/kg bb atau sama dengan 5 mg/200 g bb - 50 mg/kg bb atau sama dengan 10 mg/200 g bb - 75 mg/kg bb atau sama dengan 15 mg/200 g bb - 100 mg/kg bb atau sama dengan 20 mg/200 g bb
Dosis optimal EESP pada tikus adalah 15 mg/200 g bb. Faktor konversi dosis tikus = 56,0
Dosis manusia = dosis pada tikus x faktor konversi = 15 mg x 56,0
= 840 mg/kg bb
3. Rendemen = 100%
simplisia berat
ekstrak
berat ×
= 100% 5%
g 1000
g
50 × =
62
Lampiran 13. Perhitungan dosis dan volume pemberian suspensi CMC Na 1% b/v
CMC Na 1% b/v = 0,01g/ml 10mg/ml ml
100 g
1 = =
Volume CMC Na 1% b/v yang diberikan sebanyak 0,667 ml/200 g bb tikus CMC yang diberikan tiap tikus = 10mg 6,67mg
ml 1
ml
0,667 × =
63
Lampiran 14. Perhitungan dosis dan volume pemberian suspensi loperamid HCl (tablet Imodium®)
Dosis loperamid yang digunakan dalam penelitian adalah 1 mg/kg bb:
Dosis loperamid HCl pada manusia dewasa (berat 70 kg) adalah dosis awal 4 mg dan tidak melebihi 16 mg/hari, maka dosis loperamid untuk tikus (200 g), yaitu =16 mg × 0,018 = 0,2 mg/200 g bb tikus atau sama dengan 1 mg/kg bb
Konsentrasi loperamid HCl yang digunakan dalam penelitian adalah 0,03%, maka untuk membuat suspensi loperamid HCl dengan konsentrasi 0,03 % sebanyak 50 ml, diperlukan loperamid HCl sebanyak
= 0,03g 0,015g 15mg ml
100 ml
50 × = =
Perhitungan berat serbuk Imodium® yang diambil:
Tablet Imodium® ditimbang sebanyak 20 tablet (berat 2400 mg).
1 tablet Imodium® mengandung 2 mg loperamid HCl, maka 20 tablet Imodium® mengandung 40 mg loperamid HCl.
Loperamid HCl yang diperlukan dalam penelitian sebanyak 15 mg, maka berat serbuk Imodium® yang diambil adalah
= 2400mg 900mg
mg 40
mg 15
= ×
64 Lampiran 14. (Lanjutan)
Volume pemberian suspensi loperamid HCl 1 mg/kg bb (konsentrasi 0,03%): Konsentrasi 0,03% = 0,0003g/ml 0,3mg/ml
ml 100
g
0,03 = =
Jika berat badan tikus 200 g, maka loperamid yang diberikan tiap tikus
sebanyak = 1mg 0,2mg g
1000 g
200 × =
Maka, volume yang diberikan = 1ml 0,667ml/200gbb tikus mg/ml
0,3 mg
65
Lampiran 15. Perhitungan dosis dan volume pemberian suspensi ekstrak etanol sabut pinang (EESP)
a. EESP dosis 25 mg/kg bb
Konsentrasi EESP yang digunakan adalah 0,75%, maka untuk membuat suspensi EESP dengan konsentrasi 0,75 % sebanyak 5 ml, EESP yang diambil sebanyak = 0,75g 0,0375g 37,5mg
ml 100
ml
5 × = =
Volume pemberian suspensi EESP 25 mg/kg bb (konsentrasi 0,75%): Konsentrasi 0,75% = 0,0075g/ml 7,5mg/ml
ml 100
g
0,75 = =
Jika berat badan tikus 200 g, maka EESP yang diberikan tiap tikus
sebanyak = 25mg 5mg
Konsentrasi EESP yang digunakan adalah 1,5%, maka untuk membuat suspensi EESP dengan konsentrasi 1,5 % sebanyak 5 ml, EESP yang diambil sebanyak = 1,5g 0,075g 75mg
ml 100
ml
5 × = =
Volume pemberian suspensi EESP 50 mg/kg bb (konsentrasi 1,5%):
66 Lampiran 15. (Lanjutan)
Jika berat badan tikus 200 g, maka EESP yang diberikan tiap tikus
sebanyak = 50mg 10mg
Konsentrasi EESP yang digunakan adalah 2,25%, maka untuk membuat suspensi EESP dengan konsentrasi 2,25 % sebanyak 5 ml, EESP yang diambil sebanyak = 2,25g 0,1125g 112,5mg
ml 100
ml
5 × = =
Volume pemberian suspensi EESP 50 mg/kg bb (konsentrasi 2,25%):
Konsentrasi 2,25% = 0,0225g/ml 22,5mg/ml
Jika berat badan tikus 200 g, maka EESP yang diberikan tiap tikus
sebanyak = 75mg 15mg g
1000 g
200 × =
Maka volume yang diberikan
67 Lampiran 15. (Lanjutan)
d. EESP dosis 100 mg/kg bb
Konsentrasi EESP yang digunakan adalah 3%, maka untuk membuat suspensi EESP dengan konsentrasi 3 % sebanyak 5 ml, EESP yang diambil sebanyak =
mg
Volume pemberian suspensi EESP 100 mg/kg bb (konsentrasi 3%):
Konsentrasi 3% = 0,03g/ml 30mg/ml
Jika berat badan tikus 200 g, maka EESP yang diberikan tiap tikus
68
Lampiran 16. Gambar tikus dan konsistensi feses
Tikus dalam pengamatan
69
Lampiran 17. Hasil orientasi dosis bahan uji mengenai saat mulai terjadinya diare pada tikus yang telah diinduksi oleum ricini setelah pemberian suspensi CMC Na 1% b/v, suspensi loperamid HCl dan suspensi ekstrak etanol sabut pinang (EESP)
Grafik hasil orientasi dosis EESP
0
Kel Perlakuan Saat mulai terjadinya diare
70
Lampiran 18. Hasil pengamatan saat mulai terjadinya pada tikus yang telah diinduksi oleum ricini setelah pemberian suspensi CMC Na 1% b/v, suspensi loperamid HCl dan suspensi ekstrak etanol sabut pinang (EESP)
Perlakuan Hewan Jumlah Rata-rata
(menit)
1 2 3 4 5
OR + CMC
1% b/v 56 54 60 58 56 284 56,8
OR + Loperamid
HCl 1 mg/kg bb 110 117 117 105 90 539 107,8 OR + EESP 25
mg/kg bb 82 85 85 80 80 412 82,4
OR + EESP 50
mg/kg bb 91 90 97 90 91 459 91,8
OR + EESP 75
mg/kg bb 98 115 119 119 119 570 114
OR + EESP 100
71
Lampiran 19. Hasil pengamatan mengenai hubungan antara dosis, waktu defekasi dan konsistensi feses pada tikus yang telah diinduksi oleum ricini setelah pemberian suspensi CMC Na 1% b/v, suspensi loperamid HCl dan suspensi ekstrak etanol sabut pinang (EESP)
Perlakuan Hewan Menit ke-
72
Lampiran 20. Hasil pengamatan mengenai frekuensi diare dan lama terjadinya diare pada tikus yang telah diinduksi oleum ricini setelah pemberian suspensi CMC Na 1% b/v, suspensi loperamid HCl dan suspensi ekstrak etanol sabut pinang (EESP)
1. Pengamatan frekuensi diare
2. Pengamatan lama terjadinya diare setelah pemberian oleum ricini
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang T1 : waktu mula-mula terjadi diare T2 : waktu akhir terjadi diare Perlakuan (mg/kg bb)
Hewan
Jumlah Rata-rata
73 Lampiran 21. Hasil deskriptif data
1. Saat mulai terjadinya diare
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
2. Konsistensi feses (diameter serapan air, berat feses dan waktu defekasi) a. Diameter serapan air, berat feses dan waktu defekasi berlendir
- Diameter serapan air berlendir
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
- Berat feses berlendir
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
74 Lampiran 21. (Lanjutan)
- Waktu defekasi berlendir
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
b. Diameter serapan air dan berat feses lembek - Diameter serapan air lembek
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
- Berat feses lembek
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
75 Lampiran 21. (Lanjutan)
- Waktu defekasi lembek
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
c. Diameter serapan air dan berat feses normal - Diameter serapan air normal
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
- Berat feses normal
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
76 Lampiran 21. (Lanjutan)
- Waktu defekasi normal
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
3. Frekuensi diare
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
Min. Max.
4. Lama terjadinya diare
Kelompok (mg/kg bb)
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for Mean
77 Lampiran 22. Hasil analisis statistik anova
ANOVA Sum of Squares df
Mean
Square F Sig. Saatmulaiterjadinyadiare Between Groups 15866.267 5 3173.253 57.678 .000
Within Groups 1320.400 24 55.017 Total 17186.667 29
Waktudefekasiberlendir Between Groups 15866.267 5 3173.253 57.678 .000 Within Groups 1320.400 24 55.017
Total 17186.667 29
Waktudefekasilembek Between Groups 42728.400 5 8545.680 124.876 .000 Within Groups 1642.400 24 68.433
Total 44370.800 29
Waktudefekasinormal Between Groups 57441.500 5 11488.300 75.210 .000 Within Groups 3666.000 24 152.750
Dmserapberlendir Between Groups 12.727 5 2.545 155.837 .000 Within Groups .392 24 .016
Frekuensidiare Between Groups 70.967 5 14.193 37.026 .000 Within Groups 9.200 24 .383
Total 80.167 29
Lamaterjadinyadiare Between Groups 128990.700 5 25798.140 498.194 .000 Within Groups 1242.800 24 51.783
78
Lampiran 23. Hasil analisis statistik uji beda rata-rata Duncan 1. Saat mulai terjadinya diare
Kelompok N
2. Konsistensi feses (diameter serapan air, berat feses dan waktu defekasi) a. Diameter serapan air
- Diameter serapan air berlendir
Kelompok N
- Diameter serapan air lembek
79 Lampiran 23. (Lanjutan)
- Diameter serapan air normal
Kelompok N
- Berat feses berlendir
Kelompok N
- Berat feses lembek
80 Lampiran 23. (Lanjutan)
- Berat feses normal
Kelompok N
c. Waktu defekasi
- Waktu defekasi berlendir
Kelompok N
- Waktu defekasi lembek
81 Lampiran 23. (Lanjutan)
- Waktu defekasi normal
Kelompok N
Subset for alpha = 0.05
1 2 3 4
EESP 100 mg/kg bb 5 2.0280E2
EESP 75 mg/kg bb 5 2.2940E2
Loperamid HCl 1 mg/kg bb 5 2.3220E2
EESP 50 mg/kg bb 5 2.6780E2
EESP 25 mg/kg bb 5 2.7340E2
CMC Na 1%b/v 5 3.3940E2
Sig. 1.000 .723 .481 1.000
3. Frekuensi diare
Kelompok N
Subset for alpha = 0.05
1 2 3
EESP 100 mg/kg bb 5 2.4000 Loperamid HCl 1 mg/kg bb 5 3.0000 EESP 75 mg/kg bb 5 3.2000
EESP 50 mg/kg bb 5 4.4000
EESP 25 mg/kg bb 5 5.0000
CMC Na 1%b/v 5 7.0000
Sig. .064 .139 1.000
4. Lama terjadinya diare
Kelompok N
Subset for alpha = 0.05
1 2 3 4 5
EESP 100 mg/kg bb 5 75.6000
Loperamid HCl 1 mg/kg bb 5 1.2440E2 EESP 75 mg/kg bb 5 1.2540E2
EESP 50 mg/kg bb 5 1.7600E2
EESP 25 mg/kg bb 5 1.9100E2
CMC Na 1%b/v 5 2.8260E2
43
DAFTAR PUSTAKA
Ahmadu, A.A., Zezi, A.U., dan Yaro, A.H. (2007). Antidiarrheal Activity of The Leaf Extract of Danielliaoliveri Hutch and Dalz (Fabaceae) and FicussycomurusMiq (Moraceae). African Journal of Traditional, Complementary and Alternative Medicine. 4(4): 524-528.
Anief, M. (2004). Ilmu Meracik Obat, Teori dan Praktik. Cetakan Kesebelas. Yogyakarta: Gadjah Mada University Press. Hal. 110.
Aulanni’am, Muslim, A. dan Rosmaidar. (2007). Efek Antifertilitas Fraksi Air Biji Pinang (Areca catechu) sebagai Agen Apoptosis pada Sel-sel Jaringan Testis Rattus norvegicus. Jurnal Media Kedokteran Hewan. 23(3): 179-183.
Chanakya, H.N. dan Malayil, S. (2011). Sustainable Disposal Of Green-Waste (Banana Leaf, Stem And Arecanut Husk) By Anaerobic Digestion For Recovery Of Fibre, Biogas And Compost. Journal Proceedings of the International Conference on Solid Waste-Moving Towards Sustainable Resource Management. 5(4): 554-557.
Dalimartha, S. (2009). Atlas Tumbuhan Obat Indonesia Jilid 6. Cetakan 1. Jakarta: Pustaka Bunda. Hal. 127-129.
Defrin, D.P., Rahimah, S.B., dan Yuniarti, L. (2010). Efek Antidiare Ekstrak Air Umbi Sarang Semut (Myrmecodia pendens) pada Mencit Putih (Mus musculus). Jurnal Prosiding SNaPP Edisi Eksakta. Hal. 2089-3582.
Departemen Kesehatan dan Kesejahteraan Sosial RI. (2001). Inventaris Tanaman Obat Indonesia 1. Jilid 2. Jakarta: Bakti Husada. Hal. 33-34.
Depkes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 33, 649.
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. XIV, 300-306, 333-337
Ditjen POM. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 7, 503.
44
Ebadi, M. (2008). Desk Reference of Clinical Pharmacology. Boca Raton, Florida: Taylor&Francis Group, LLC. Hal. 395-397.
Enda, W.G. (2010). Uji Efek Antidiare Ekstrak Etanol Kulit Batang Salam (Syzygim polyanthum (Wight) Walp.) Terhadap Mencit Jantan. Medan. Hal. 10-11, 16, 23-25.
Farnsworth, N.R. (1966). Biologycal and Phytochemical Screening of Plants. Journal of Pharmaceutical Science. 55(3): 262-264.
Farokh, N. (2011). Uji Aktivitas Antidiare Ekstrak Etanol Daun Pare (Momordica charantia Linn.) pada Mencit Jantan yang Diinduksi Oleum Ricini. Jember. Hal. VII.
Gutiérrez, S.P., Mendoza, D.P., Munive, A.H., Martinez, A.M., González, C.P. dan Mendoza, E.S. (2013). Antidiarrheal Activity of 19-Deoxyicetexone Isolated from Salvia ballotiflora Benth in Mice and Rats. Journal of Molecules. (18): 8895-8905.
Harborne, J.B. (1984). Phytochemical Methods, A Guide to Modern Techniques of Plant Analysis. Second Edition. London: Chapman & Hall. Hal. 124-125. Hariyati, M.N. (2006). Ekstraksi dan Karakterisasi Pektin dari Limbah Proses
Pengolahan Jeruk Pontianak (Citrus nobilis var microcarpa). Bogor. Hal. 4-5, 10.
Hermiati, E., Mangunwidjaja, D., Sunarti, T.C., Suparno, O. dan Prasetya, B. (2010). Pemanfaatan Biomassa Lignoselulosa Ampas Tebu Untuk Produksi Bioetanol. Jurnal Litbang Pertanian. 29(4): 121-130.
Joshi, M., Gaonkar, K., Mangoankar, S. dan Satarkar, S. (2012). Pharmacological Investigation of Areca catechu Extracts for Evaluation of Learning, Memory and Behavior in Rats. International Current Pharmaceutical Journal. 1(6): 128-132.
Maskromo, I., dan Miftahorrachman. (2007). Keragaman Genetik Plasma Nutfah Pinang (Areca catechu L.) di Propinsi Gorontalo. Jurnal Littri. 13(4): 119-124.
Meite, S., N’Guessan, J.D., Bahi, C., Yapi, H.F., Djaman, A.J., dan Guina, F.G. (2009). Antidiarrheal Activity of The Ethyl Acetate Extract of Morindamorindoides in Rats. Tropical Journal of Pharmaceutical Research. 8(3): 201-207.
45
Mosier, N., Wyman, C., Dale, B., Elander, R., Lee, Y.Y., Holtzapple, M., dan Michael, L. (2005). Features of Promising Technologies for Pretreatment of Lignocellulosic Biomass. Journal of Bioresource Technology. 96(6): 673-686.
Navaneethan, U. dan Gianella, R.A. (2011). Definition, Epidemiology, Pathophysiology, Clinical Classification, and Differential Diagnosis of Dairrhea. London: Springer Science+Business Media, LLC 2011. Hal. 3. Nofriadi, E. (2009). Keragaman Nilai Lignin Terlarut Asam (Acid Soluble Lignin)
Dalam Kayu Reaksi Pinus merkusii Jungh Et de Vriese dan Gnetum gnemon Linn. Bogor. Hal. 4-5.
Redha, A. (2010). Flavonoid: Struktur, Sifat Antioksidatif Dan Peranannya Dalam Sistem Biologis. Jurnal Belian. 9(2): 196-202.
Sanchez de Medina, F., Galvez, J., Gonzalez M., Zarzuelo A., dan Barret, K.E. (1997). Effects of quercetin on Ephitelial Chloride Secretion. Journal of Life Science. 61(20): 2049-2055.
Sari, L.O.R.K. (2006). Pemanfaatan Obat Tradisional dengan Pertimbangan Manfaat dan Keamanannya. Majalah Ilmu Kefarmasian. 3(1): 01-07. Staples, G.W. dan Bevacqua, R.F. (2006). Areca catechu (Betel Nut Palm), ver
I.3. Journal of Species Profile for Pacific Island Agroforestry. Hal. 2 Sugiarto, N.F. (2008). Uji Antidiare Jamu “DNR” Pada Mencit Putih Jantan.
Depok. Hal. 4, 22-23.
Sukumaran, R.K., Singhania, R.R., dan Pandey, A. (2005). Microbial Cellulases-Production, Application and Challenges. Journal of Scientific & Industrial Research. 64: 832-844
Sulastri, T. (2009). Analisis Kadar Tanin Ekstrak Air dan Ekstrak Etanol Pada Biji Pinang Sirih (Areca catechu L.). Jurnal Chemical. 11(1): 59-63.
Tan, H.T., dan Rahardja, K. (2008). OBAT-OBAT PENTING, Khasiat, Penggunaan, dan Efek-efek Sampingnya. Edisi Keenam, Cetakan Pertama. Jakarta: Penerbit PT. Elex Media Komputindo. Hal. 288, 293, 296.
46
Tiwow, D., Bodhi, W. dan Kojong, N.S. (2013). Uji Efek Antelmintik Ekstrak Etanol Biji Pinang (Areca catechu) Terhadap Cacing Ascaris Lumbricoides dan Ascaridia Galli secara In Vitro. Jurnal Ilmiah Farmasi-UNSRAT. 2(2): 76-80.
Wijayakusuma, H.M.H. (2000). Potensi Tumbuhan Obat Asli Indonesia Sebagai Produk Kesehatan. Jurnal Risalah Ilmiah Penelitian dan Pengembangan Teknologi Isotop dan Radiasi. Hal. 25.
World Health Organization. (1998). Quality Control Methods for Medicinal Plant Materials. Switzerland: World Health Organization. Hal. 30-31.
Yajima, T. (1985). Contractile Effect of Short-Chain Fatty Acids on The Isolated Colon of The Rat. Journal Physio. 368: 667-678.
16 BAB III
METODE PENELITIAN
Metode penelitian ini dilakukan secara eksperimental, meliputi pengumpulan dan pengolahan tumbuhan, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak etanol sabut pinang dan percobaan efek antidiare. Data hasil penelitian dianalisis secara analisis variansi (ANOVA) dan dilanjutkan dengan uji beda rata-rata Duncan menggunakan program SPSS (Statistical Product and Service Solution) versi 16. Bagan kerja penelitian dapat dilihat pada lampiran 7, halaman 53.
3.1Alat dan Bahan 3.1.1 Alat-alat
Alat-alat yang digunakan dalam penelitian ini meliputi alat-alat gelas laboratorium, aluminium foil, blender (Philips), cawan porselen, cawan porselen berdasar rata, eksikator, hot plate (Fisons), kertas saring, kandang tikus, krus porselin, lemari pengering, lumpang dan alu, neraca listrik (Vibra AJ), neraca hewan (Presica Geniweigher GW-1500), oral sonde, oven listrik (Fischer Scientific), pot plastik, rampago, seperangkat alat destilasi, spatula, spuit 1ml dan 3 ml (OneMed), timbangan (Tanita) dan tanur (Nabertherm).
3.1.2 Bahan-bahan
17
naftol, amil alkohol, asam asetat anhidrida, asam klorida pekat, asam nitrat pekat, asam sulfat pekat, benzen, besi (III) klorida, bismuth (III) klorida, carboxymethyl cellulose natrium (CMC Na), etanol 96%, isopropanol, kalium iodida, kloroform, loperamid HCl (tablet Imodium®), metanol, n-heksana, natrium hidroksida, natrium sulfat anhidrat, serbuk magnesium, timbal (II) asetat dan toluen.
3.2 Pembuatan Larutan Pereaksi
3.2.1 Larutan pereaksi asam klorida (HCl) 2 N
Sebanyak 17 ml asam klorida P dilarutkan dalam air suling hingga diperoleh larutan 100 ml (Depkes, 1979).
3.2.2 Larutan pereaksi asam sulfat 2 N
Sebanyak 5,556 ml asam sulfat pekat diencerkan dengan air suling secukupnya hingga volume 100 ml (Depkes, 1995).
3.2.3 Larutan pereaksi besi (III) klorida 1% b/v
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling secukupnya hingga 100 ml (Depkes, 1995).
3.2.4 Larutan pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, kemudian dilarutkan dalam air suling bebas karbon dioksida secukupnya hingga 100 ml (Depkes, 1995). 3.2.5 Pereaksi Bouchardat
18 3.2.6 Pereaksi Dragendorff
Sebanyak 8 g bismut nitrat dilarutkan dalam 20 ml asam nitrat pekat, lalu pada wadah lain dilarutkan 27,2 g kalium iodida dalam 50 ml air suling. Kedua larutan dicampur dan didiamkan sampai memisah sempurna. Larutan jernih diambil dan diencerkan dengan air secukupnya hingga 100 ml (Depkes, 1995). 3.2.7 Pereaksi Mayer
Sebanyak 1,359 g raksa (II) klorida dilarutkan dalam air suling hingga 60 ml, pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10 ml air suling. Kedua larutan dicampur kemudian ditambahkan air suling secukupnya hingga 100 ml (Depkes, 1995).
3.2.8 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, kemudian dilarutkan dalam asam nitrat 0,5 N hingga diperoleh larutan 100 ml (Depkes, 1995).
3.3 Pengumpulan dan Pengolahan Bahan Tumbuhan 3.3.1 Pengumpulan bahan tumbuhan
19 3.3.2 Identifikasi bahan tumbuhan
Identifikasi tumbuhan dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bidang Botani Pusat Penelitian Biologi, Bogor.
3.3.3 Pengolahan bahan tumbuhan
Bahan tumbuhan yang digunakan adalah sabut pinang (Areca catechu L.). Sabut dilepas dari buah pinang menggunakan rampago kemudian dipilah, sehingga didapat serabut atau sabut pinang. Beratnya ditimbang sebagai berat basah. Gambar sabut pinang dapat dilihat pada Lampiran 4, halaman 50. Sabut kemudian dikeringkan di lemari pengering pada suhu ± 40°C. Sampel yang telah kering biasanya ditentukan dari kerapuhan dan mudah patahnya bahan tumbuhan yang dikeringkan. Beratnya kemudian ditimbang, lalu dihaluskan dengan menggunakan blender, diayak dengan ayakan, sehingga didapat serbuk simplisia. Gambar serbuk simplisia sabut pinang dapat dilihat pada Lampiran 5, halaman 51. Serbuk simplisia dimasukkan ke dalam wadah plastik yang tertutup rapat dan disimpan pada suhu kamar.
3.4 Pemeriksaan Karakteritik Simplisia 3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan terhadap bahan tumbuhan segar, yaitu sabut pinang (Areca catechu L.) dengan mengamati bentuk, tekstur dan ukuran, serta pemeriksaan organoleptik dengan mengamati warna, rasa dan bau. Pemeriksaan organoleptik terhadap ekstrak etanol sabut pinang juga dilakukan. 3.4.2 Penetapan kadar air
20 a. Penjenuhan toluen
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu berisi toluen yang telah dijenuhkan, kemudian labu dipanaskan hati-hati selama 15 menit, setelah toluen mendidih, kecepatan tetesan diatur 2 tetes per detik sampai sebagian besar air terdestilasi. Kecepatan destilasi dinaikkan sampai 4 tetes tiap detik, setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar, setelah air dan toluen memisah sempurna, lalu volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998). Penetapan kadar air juga dilakukan terhadap ekstrak etanol sabut pinang. Perhitungan kadar air serbuk simplisia dan ekstrak etanol sabut pinang dapat dilihat pada Lampiran 9, halaman 55.
3.4.3 Penetapan kadar sari yang larut dalam air
21
cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995). Perhitungan kadar sari yang larut dalam air terhadap serbuk simplisia dapat dilihat pada Lampiran 9, halaman 56.
3.4.4 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96% di dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, setelah itu disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara sampai kering. Sisa yang diperoleh dipanaskan pada suhu 105ºC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995). Perhitungan kadar sari yang larut dalam etanol terhadap serbuk simplisia dapat dilihat pada Lampiran 9, halaman 56.
3.4.5 Penetapan kadar abu total
22
3.4.6 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu total dididihkan dalam asam klorida encer sebanyak 25 ml selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas, lalu dipijar sampai bobot tetap, kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995). Penetapan kadar abu yang tidak larut dalam asam juga dilakukan terhadap ekstrak etanol sabut pinang. Perhitungan penetapan kadar abu yang tidak larut dalam asam pada serbuk simplisia dan ekstrak etanol sabut pinang dapat dilihat pada Lampiran 9, halaman 58.
3.5 Skrining Fitokimia
Skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol sabut pinang, meliputi pemeriksaan alkaloid, flavonoid, glikosida, saponin, tanin dan steroid/triterpenoid.
3.5.1 Pemeriksaan alkaloid
Sebanyak 0,5 g sampel ditimbang, kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu disaring. Filtrat dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat. Pada tabung I : ditambahkan 2 tetes pereaksi Mayer, terbentuk endapan
menggumpal berwarna putih atau kuning.
23
Pada tabung III : ditambahkan 2 tetes pereaksi Bourchardat, terbentuk endapan berwarna coklat sampai kehitaman.
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada dua atau tiga dari percobaan di atas (Depkes, 1995).
3.5.2 Pemeriksaan flavonoid
Sebanyak 10 g sampel ditimbang, ditambahkan 10 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, ke dalam 5 ml filtrat ditambahkan 0,1 g serbuk magnesium dan 1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok dan dibiarkan memisah. Flavonoid positif jika terjadi warna merah atau kuning atau jingga pada lapisan amil alkohol (Depkes, 1995).
3.5.3 Pemeriksaan glikosida
Sebanyak 3 g sampel ditimbang, lalu disari dengan 30 ml campuran dari 7 bagian etanol 96% dengan 3 bagian air suling (7:3) dan 10 ml asam klorida 2 N, kemudian direfluks selama 10 menit, didinginkan, lalu disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok, didiamkan 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3), perlakuan ini diulangi sebanyak 3 kali. Sari organik dikumpulkan dan ditambahkan Na2SO4 anhidrat, disaring, kemudian diuapkan
24
cincin ungu pada batas kedua cairan, menunjukkan adanya ikatan gula (glikon) atau glikosida (Depkes, 1995).
3.5.4 Pemeriksaan saponin
Sebanyak 0,5 g sampel ditimbang, kemudian dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik. Terbentuk busa setinggi 1 sampai 10 cm yang stabil tidak kurang dari 10 menit dan tidak hilang dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin (Depkes, 1995).
3.5.5 Pemeriksaan tanin
Sebanyak 0,5 g sampel ditimbang, kemudian dididihkan selama 3 menit dalam 100 ml air suling lalu didinginkan dan disaring. Filtrat ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%, jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.5.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1 g sampel dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa penguapan ditambahkan beberapa tetes pereaksi Liebermann-Burchard. Timbulnya warna biru atau biru hijau menunjukkan adanya steroid, sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1984).
3.5.7 Pemeriksaan pektin
25
dilakukan pengendapan dengan menambahkan etanol 95% yang telah diasamkan dengan 2 ml asam klorida pekat per satu liter etanol. Perbandingan filtrat dengan etanol yang ditambahkan adalah 1:1,5. Proses pengendapan dilakukan selama 12 jam, kemudian disaring. Pektin dikatakan positif jika terbentuk endapan seperti gel (Hariyati, 2006).
3.6 Pembuatan Ekstrak Etanol Sabut Pinang (EESP)
Pembuatan EESP dilakukan secara maserasi menggunakan etanol 80%. Prosedur pembuatan ekstrak secara maserasi, yaitu sebanyak 10 bagian serbuk simplisia dimasukkan ke dalam sebuah bejana, tuangi dengan 75 bagian etanol 80%, tutup, biarkan selama 5 hari terlindung dari cahaya sambil sering diaduk, serkai, lalu cuci ampas dengan etanol 80% secukupnya hingga diperoleh 100 bagian. Dipindahkan ke dalam bejana tertutup, biarkan di tempat sejuk, terlindung dari cahaya selama 2 hari. Dienap tuangkan atau disaring (Depkes, 1979). Maserat yang diperoleh diuapkan menggunakan rotary evaporator pada temperatur ± 40oC sampai diperoleh ekstrak kental kemudian dikeringkan menggunakan freeze dryer pada suhu -40°C. Bagan kerja pembuatan ekstrak etanol sabut pinang dapat dilihat pada Lampiran 8, halaman 54.
3.7 Percobaan Efek Antidiare
Pengujian efek antidiare meliputi penyiapan hewan percobaan, penyiapan bahan kontrol negatif, bahan kontrol positif, bahan uji, induktor diare dan pengujian efek antidiare.
3.7.1 Penyiapan hewan percobaan
26
berjenis kelamin jantan dengan berat rata-rata 200 gram sebanyak 30 ekor. Dibagi dalam 6 kelompok dimana setiap kelompok terdiri dari 5 ekor tikus. Tikus diaklimatisasi terlebih dahulu selama 2 minggu sebelum penelitian, kemudian diberi makanan dan minuman secara teratur, serta dijaga kebersihan kandangnya.
Penelitian menggunakan hewan telah mendapat persetujuan etik dari Komite Etik Penelitian Kesehatan FK USU dan Komite Etik Penelitian Hewan FMIPA USU (Animal Research Ethics Committees/AREC), dikenal dengan ethical clearance atau kelayakan etik yang merupakan keterangan tertulis untuk penelitian yang melibatkan mahluk hidup (manusia, hewan dan tumbuhan). Surat ethical clearance dapat dilihat pada Lampiran 2, halaman 48.
3.7.2 Penyiapan bahan
Bahan yang digunakan meliputi suspensi CMC Na sebagai kontrol negatif, suspensi loperamid HCl (Imodium®) sebagai kontrol positif atau pembanding, suspensi ekstrak etanol sabut pinang (EESP) sebagai bahan uji dan oleum ricini sebagai induktor diare.
3.7.2.1Pembuatan suspensi CMC Na 1% b/v
Sebanyak 1 g CMC Na ditaburkan ke dalam lumpang yang berisi air suling panas sebanyak 20 ml, ditutup dan dibiarkan selama 30 menit hingga diperoleh massa yang transparan, digerus lalu diencerkan dengan air suling hingga 100 ml (Anief, 2004). Perhitungan dosis dan volume pemberian suspensi CMC Na 1% b/v dapat dilihat pada Lampiran 13, halaman 62.
3.7.2.2Pembuatan suspensi loperamid HCl dosis 1 mg/kg bb
27
dimasukkan ke dalam lumpang, lalu ditambahkan suspensi CMC Na 1% b/v sedikit demi sedikit sambil digerus sampai homogen. Dicukupkan dengan suspensi CMC Na 1% b/v hingga 50 ml. Perhitungan dosis dan volume pemberian suspensi loperamid HCl dapat dilihat pada Lampiran 14, halaman 63.
3.7.2.3Pembuatan suspensi ekstrak etanol sabut pinang (EESP) dengan konsentrasi 0,75%; 1,5%; 2,25%; dan 3% b/v
Ekstrak ditimbang dengan seksama sesuai dengan konsentrasi masing-masing (0,0375 g; 0,075 g; 0,1125 g; dan 0,15 g) kemudian dimasukkan ke dalam lumpang lalu ditambahkan sedikit suspensi CMC Na 1% b/v diaduk hingga homogen. Dicukupkan dengan suspensi CMC Na 1% b/v hingga 5 ml. Perhitungan dosis dan volume pemberian suspensi ekstrak etanol sabut pinang dapat dilihat pada Lampiran 15, halaman 65.
3.7.3 Pengujian efek antidiare
Dosis EESP ditentukan berdasarkan orientasi pada hewan percobaan terhadap parameternya. Dosis yang digunakan yaitu 25, 50, 75, 100, 125 dan 150 mg/kg bb. Hasil orientasi dipilih variasi dosis sebanyak empat dosis, yaitu 25, 50, 75 dan 100 mg/kg bb. Larutan suspensi dibuat bervariasi agar pemberian dosis EESP terhadap setiap tikus pada masing-masing kelompok seragam yaitu sebesar 0,667 ml/200 g bb tikus.
28
uji diberikan suspensi EESP yang terdiri dari empat dosis yaitu 25, 50, 75 dan 100 mg/kg bb, lalu tikus ditempatkan dalam wadah pengamatan.
Pengamatan dimulai 30 menit setelah perlakuan selama 6 jam. Parameter yang diamati meliputi saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare (Enda, 2010; Sugiarto, 2008).
3.8 Analisis data
29 BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil Identifikasi Sampel
Identifikasi sampel dilakukan oleh Lembaga Ilmu Pengetahuan Indonesia (LIPI), Bidang Botani Pusat Penelitian Biologi, Bogor. Hasilnya menunjukkan sampel yang digunakan adalah pinang (Areca catechu L.). Hasil dapat dilihat pada Lampiran 1, halaman 47.
4.2 Hasil Karakterisasi
4.2.1 Pemeriksaan makroskopik
Hasil pemeriksaan makroskopik simplisia sabut pinang segar menunjukkan bentuk serabut-serabut panjang yang menempel pada kulit buah dengan panjang serabut 6 cm, dengan organoleptik warna kuning kemerahan, bau khas, serta rasa pahit. Pemeriksaan organoleptik ekstrak etanol sabut pinang diperoleh warna coklat kehitaman, bau khas dan rasa pahit. Hasil pemeriksaan makroskopik dapat dilihat pada Lampiran 6, halaman 52.
4.2.2 Pemeriksaan karakteristik serbuk simplisia dan ekstrak etanol sabut pinang
30
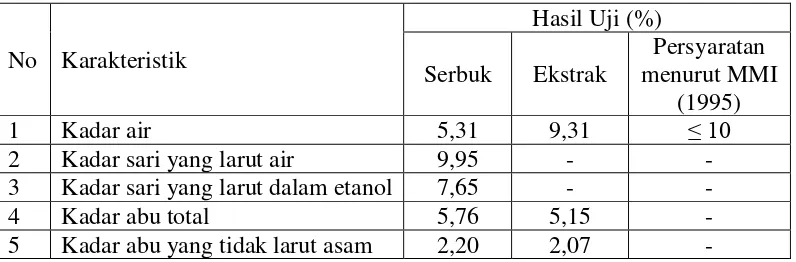
Tabel 4.1 Hasil pemeriksaan karakteristik serbuk simplisia dan ekstrak etanol sabut pinang
Penetapan kadar air dilakukan untuk mengetahui besarnya kandungan air yang terdapat di dalam simplisia. Penetapan kadar sari yang larut dalam air menyatakan jumlah zat yang tersari dalam pelarut air, seperti glikosida, gula, protein, enzim dan zat warna, sedangkan penetapan kadar sari yang larut dalam etanol menyatakan jumlah zat yang tersari dalam pelarut etanol, seperti glikosida, steroid, flavonoid, saponin, tanin (Depkes, 1995). Penetapan kadar abu total menyatakan jumlah kandungan senyawa anorganik dalam simplisia, misalnya Mg, Ca, Na, Zn dan K. Kadar abu tidak larut dalam asam untuk mengetahui kadar senyawa anorganik yang tidak larut dalam asam, misalnya silikat. Perhitungan hasil pemeriksaan karakteristik serbuk simplisia dan ekstrak etanol sabut pinang dapat dilihat pada Lampiran 9, halaman 55.
4.3 Hasil Skrining Fitokimia
Hasil skrining fitokimia terhadap serbuk simplisia dan ekstrak etanol sabut pinang diperoleh keduanya mengandung flavonoid, glikosida dan pektin. Hasil dapat dilihat pada Tabel 4.2.
No Karakteristik
Hasil Uji (%) Serbuk Ekstrak
Persyaratan menurut MMI
(1995)
1 Kadar air 5,31 9,31 ≤ 10
2 Kadar sari yang larut air 9,95 - -
3 Kadar sari yang larut dalam etanol 7,65 - -
4 Kadar abu total 5,76 5,15 -
31
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol sabut pinang
Keterangan: (+) Positif : mengandung golongan senyawa (−) Negatif : tidak mengandung golongan senyawa
Flavonoid dengan penambahan serbuk magnesium (Mg) dan asam klorida pekat menghasilkan larutan berwarna kuning pada lapisan amil alkohol (Farnsworth, 1966), sedangkan glikosida dengan penambahan pereaksi Molish dan asam sulfat pekat membentuk cincin ungu (Depkes, 1995). Pemeriksaan pektin dilakukan dengan cara ekstraksi pada suhu 95°C selama 40 menit, menggunakan air suling yang telah diasamkan dengan asam klorida 1 N. suhu yang tinggi akan membantu difusi pelarut ke dalam jaringan tanaman dan dapat meningkatkan aktivitas pelarut dalam menghidrolisis pectin yang terdapat di dalam dinding sel tanaman. Fungsi asam klorida untuk memutuskan ikatan antara asam pektinat dengan selulosa, menghidrolisa protopektin menjadi molekul yang lebih kecil dan menghidrolisa gugus metil ester pektin. Proses pengendapan dengan etanol mengakibatkan stabilitas koloidal pektin terganggu, sehingga pektin menjadi terkoagulasi (Hariyati, 2006).
4.4 Pengujian Efek Antidiare
Pengujian efek antidiare dari suspensi ekstrak etanol sabut pinang (EESP)
No. Golongan senyawa Hasil
32
diawali dengan melakukan orientasi dosis. Dosis yang digunakan, yaitu 25, 50, 75, 100, 125 dan 150 mg/kg bb. Dosis 25, 50, 75 dan 100 mg/kg bb digunakan dalam penelitian karena menunjukkan efek antidiare, sedangkan dosis 125 dan 150 mg/kg juga menunjukkan efek antidiare, namun efek yang dihasilkan lebih kuat dibandingkan dengan loperamid HCl 1 mg/kg bb, sehingga tidak digunakan dalam penelitian. Hasil orientasi dapat dilihat pada Lampiran 17, halaman 69.
Tikus dipuasakan 18 jam sebelum penelitian, kemudian ditimbang dan ditandai. Tikus diberikan oleum ricini sebanyak 2 ml/200 g bb tikus. Satu jam setelah pemberian oleum ricini, masing-masing kelompok diberi perlakuan, yaitu kelompok kontrol negatif diberikan suspensi CMC dosis 1% b/v, kelompok kontrol positif diberikan suspensi loperamid HCl dosis 1 mg/kg bb dan kelompok bahan uji diberikan suspensi EESP yang masing-masing terdiri dari empat dosis, yaitu 25, 50, 75, 100 mg/kg bb. Penentuan efek antidiare dari ekstrak etanol sabut pinang dilakukan dengan cara mengamati saat mulai terjadinya diare, konsistensi feses, frekuensi diare dan lama terjadinya diare.
4.4.1 Penentuan saat mulai terjadinya diare
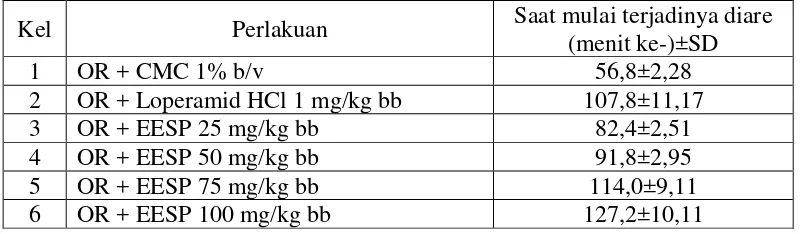
Hasil analisis data saat mulai terjadinya diare dapat dilihat pada Tabel 4.3. Tabel 4.3 Hasil analisis data saat mulai terjadinya diare
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang
Kel Perlakuan Saat mulai terjadinya diare
(menit ke-)±SD
1 OR + CMC 1% b/v 56,8±2,28
2 OR + Loperamid HCl 1 mg/kg bb 107,8±11,17
3 OR + EESP 25 mg/kg bb 82,4±2,51
4 OR + EESP 50 mg/kg bb 91,8±2,95
5 OR + EESP 75 mg/kg bb 114,0±9,11
33
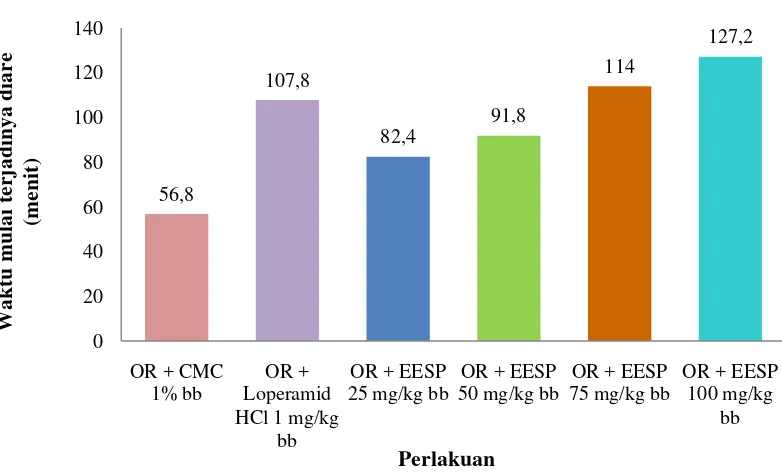
Gambar 4.1 Grafik saat mulai terjadinya diare
34
Pengujian efek antidiare dilakukan dengan metode defekasi. Metode ini telah dilakukan oleh Enda (2010) dan Sugiarto (2008), namun perlakuannya berbeda pada penelitian ini. Oleum ricini diberikan terlebih dahulu kemudian satu jam setelah pemberian oleum ricini, diberikan suspensi yang akan diuji. Sampel uji dinyatakan memiliki aktivitas antidiare, jika waktu mulai terjadi diare yang diperoleh lebih lama daripada kontrol negatif dan semakin cepat terjadinya diare, maka aktivitas antidiare akan semakin lemah.
4.4.2 Penentuan konsistensi feses (diameter serapan air dan berat feses) Penentuan konsistensi feses dilakukan dengan cara melihat bentuk feses yang terjadi, dapat dikategorikan ke dalam kelompok, yaitu konsistensi feses berlendir (BL) dengan diameter serapan air lebih besar dari 2 cm, konsistensi feses lembek (L) dengan diameter serapan air antara 1-2 cm dan konsistensi feses normal (N) dengan diameter serapan air lebih kecil dari 1 cm. Pengamatan terhadap waktu terjadinya dan berat feses (BF) yang terbentuk juga diamati.
Hasil data konsistensi feses dan waktu defekasi yang diperoleh dapat dilihat pada Tabel 4.4, Tabel 4.5 dan Tabel 4.6.
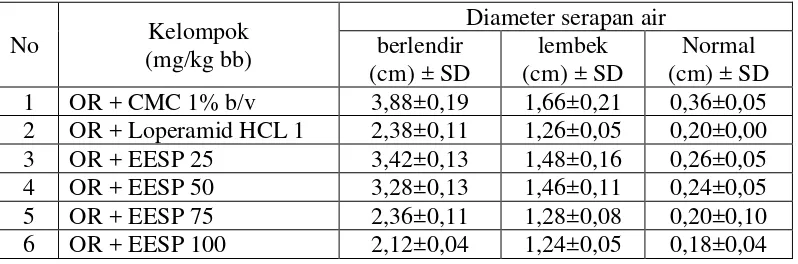
Tabel 4.4 Hasil analisis data konsistensi feses (diameter serapan air)
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang
No Kelompok
(mg/kg bb)
Diameter serapan air berlendir
(cm) ± SD
lembek (cm) ± SD
35
Gambar 4.2 Grafik diameter serapan air
Tabel 4.5 Hasil analisis data konsistensi feses (berat feses)
Keterangan: OR : oleum ricini EESP : ekstrak etanol sabut pinang
Gambar 4.3 Grafik berat feses 0
1,26 1,48 1,46 1,28 1,24
36 Tabel 4.6 Hasil analisis data waktu defekasi
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang
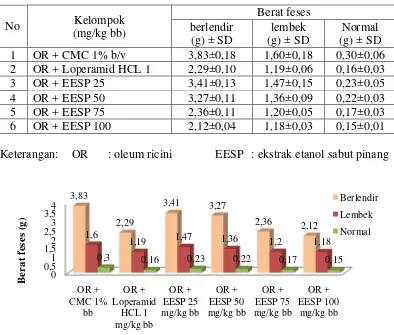
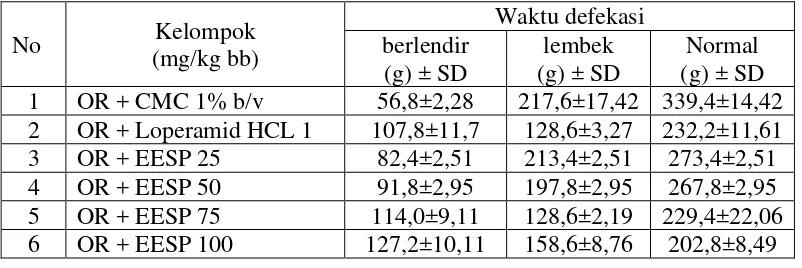
Tabel 4.4 dan Gambar 4.2, Tabel 4.5 dan Gambar 4.3, serta Tabel 4.6 memperlihatkan hubungan antara dosis dengan konsistensi feses. Kelompok kontrol negatif, yaitu suspensi CMC Na 1% b/v terjadinya BL pada menit ke-56,8 dengan BF 3,83 g, L pada menit 217,6 dengan BF 1,60 g dan N pada menit ke-339,4 dengan BF 0,30 g.
Kelompok kontrol positif, yaitu suspensi loperamid HCl 1 mg/kg bb terjadinya BL pada menit ke-107,8 dengan BF 2,29 g, L pada menit ke-126,8 dengan BF 1,19 g dan N pada menit ke-232,2 dengan BF 0,16 g.
Kelompok bahan uji, yaitu suspensi EESP dosis 25 mg/kg bb terjadinya BL pada menit ke-82,4 dengan BF 3,41 g, L pada menit ke-213,4 dengan BF 1,47 dan N pada menit ke-273,4 dengan BF 0,23 g; dosis 50 mg/kg bb terjadinya BL pada menit ke-91,8 dengan BF 3,27 g, L pada menit ke-197,8 dengan BF 1,36 dan N pada menit ke-267,8 dengan BF 0,22 g; dosis 75 mg/kg bb terjadinya BL pada menit ke-114 dengan BF 2,36 g, L pada menit ke-128,6 dengan BF 1,20 dan N pada menit ke-229,4 dengan BF 0,17 g; dan dosis 100 mg/kg bb terjadinya BL pada menit ke-127,2 dengan BF 2,12 g, L pada menit ke-158,6 dengan BF 1,18
No Kelompok
(mg/kg bb)
Waktu defekasi berlendir
(g) ± SD
lembek (g) ± SD
37
dan N pada menit ke-202,8 dengan BF 0,15. Hubungan antara dosis, waktu defekasi dan konsistensi feses dapat dilihat pada Lampiran 19, halaman 71.
Berdasarkan uji anova kemudian dilanjutkan dengan uji beda rata-rata Duncan diperoleh konsistensi feses dengan pemberian suspensi CMC Na 1% b/v menunjukkan perbedaan secara signifikan terhadap masing-masing kelompok. Pemberian suspensi loperamid HCl 1 mg/kg bb dengan suspensi EESP dosis 75 mg/kg bb, tidak memberikan perbedaan secara signifikan, begitu juga dengan kelompok suspensi EESP dosis 25 dengan 50 mg/kg bb tidak berbeda secara signifikan. Kelompok suspensi EESP dosis 100 mg/kg bb memberikan perbedaan secara signifikan terhadap masing-masing kelompok. Hasil analisis uji beda rata-rata Duncan dapat dilihat pada Lampiran 23, halaman 78.
Penentuan konsistensi feses yang dilakukan menunjukkan bahwa semakin cepat terbentuknya konsistensi feses yang berlendir/berair, maka aktivitas antidiare akan semakin lemah dan semakin cepat terjadinya perubahan konsistensi kearah normal, maka aktivitas antidiare semakin kuat.
4.4.3 Penentuan frekuensi diare
Hasil analisis data frekuensi diare dapat dilihat pada Tabel 4.7. Tabel 4.7 Hasil analisis data frekuensi diare
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang
No Kelompok frekuensi ± SD
1 OR + CMC 1% b/v 7,00±0,00
2 OR + Loperamid HCL 1 mg/kg bb 2,80±0,45
3 OR + EESP 25 mg/kg bb 5,00±0,70
4 OR + EESP 50 mg/kg bb 4,40±0,55
5 OR + EESP 75 mg/kg bb 3,20±0,84
38
Gambar 4.4 Grafik frekuensi diare
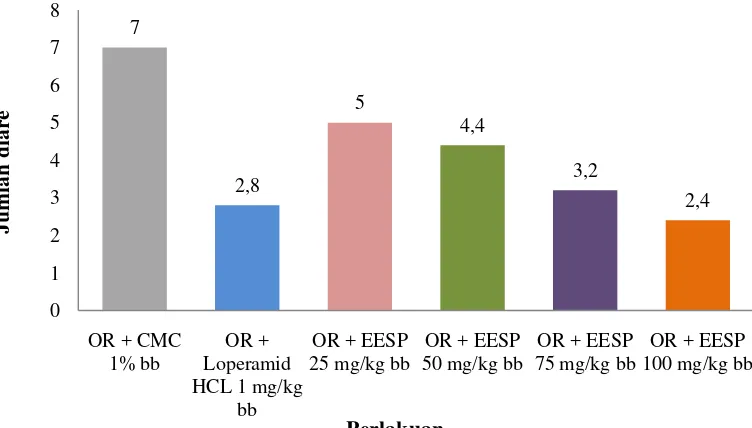
Tabel 4.7 dan Gambar 4.4 memperlihatkan bahwa kelompok pemberian suspensi CMC Na 1% b/v menunjukkan lebih banyak terjadinya diare, yaitu
sebanyak 7 kali, daripada kelompok pemberian suspensi loperamid HCl 1 mg/kg bb (2,8 kali diare), kelompok suspensi EESP dosis 25 mg/kg bb (5 kali diare), dosis 50 mg/kg bb (4,4 kali diare), dosis 75 mg/kg bb (3,2 kali diare) dan dosis 100 mg/kg bb (2,4 kali diare). Hasil pengamatan frekuensi diare dapat dilihat pada Lampiran 20, halaman 72.
Berdasarkan hasil analisis statistik anova dilanjutkan uji beda rata-rata Duncan, menunjukkan hasil kelompok pemberian suspensi CMC Na 1% b/v berbeda secara signifikan terhadap masing-masing kelompok. Efek yang tidak berbeda secara signifikan dihasilkan kelompok pemberian suspensi loperamid HCl 1 mg/kg bb dengan suspensi EESP dosis 75 dan 100 mg/kg bb, juga kelompok pemberian suspensi EESP dosis 25 dengan 50 mg/kg bb. Hasil analisis uji beda rata-rata Duncan dapat dilihat pada Lampiran 23, halaman 81.
39
Penentuan frekuensi diare yang dilakukan menunjukkan bahwa semakin banyak terjadinya diare, maka aktivitas antidiare akan semakin lemah, begitu juga sebaliknya semakin sedikit terjadinya diare, maka aktivitas antidiare akan semakin kuat.
4.4.4 Penentuan lama terjadinya diare
Hasil analisis data lama terjadinya diare dapat dilihat pada Tabel 4.8. Tabel 4.8 Hasil analisis data lama terjadinya diare
Keterangan: OR : oleum ricini
EESP : ekstrak etanol sabut pinang
40
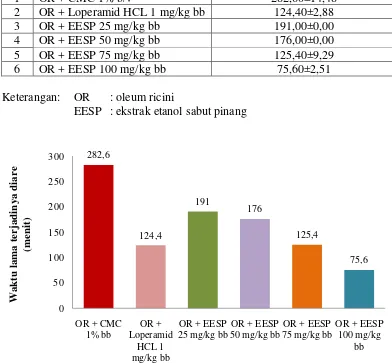
Tabel 4.8 dan Gambar 4.5 memperlihatkan bahwa pemberian suspensi CMC Na 1% b/v menghasilkan waktu lama terjadinya diare paling lama, yaitu pada menit 282,6 . Pemberian suspensi loperamid HCl, yaitu pada menit ke-124,4. Pemberian suspensi EESP dosis 100 mg/kg bb memiliki waktu lama terjadinya diare tersingkat, yaitu pada menit ke-121,8 daripada pemberian suspensi EESP dosis 25 mg/kg bb (191 menit), dosis 50 mg/kg bb (176 menit) dan dosis 75 mg/kg bb (125,4 menit). Hasil pengamatan dapat dilihat pada Lampiran 20, halaman 72.
Berdasarkan uji statistik anova kemudian dilanjutkan uji beda rata-rata Duncan menunjukkan bahwa lama terjadinya diare pada kelompok pemberian suspensi CMC Na 1% b/v berbeda secara signifikan dari masing-masing kelompok yang diuji, begitu juga dengan EESP dosis 25, 50 dan 100 mg/kg bb yang berbeda secara signifikan. Dosis yang tidak menunjukkan perbedaan secara signifikan adalah kelompok pemberian suspensi EESP dosis 75 mg/kg bb dengan kelompok pemberian suspensi loperamid HCl 1 mg/kg bb. Hasil analisis uji beda rata-rata Duncan dapat dilihat pada Lampiran 23, halaman 81. Penentuan lama terjadinya diare yang dilakukan menunjukkan bahwa semakin lamanya terjadinya diare, maka semakin lemah aktivitas antidiare yang dihasilkan.
Parameter yang telah diamati, dapat dikategorikan berdasarkan tingkat aktivitasnya dalam menekan diare sebagai berikut:
1. Lemah, bila aktivitas antidiare diatas aktivitas kelompok kontrol dan dibawah aktivitas kelompok pembanding.
41
3. Kuat, bila aktivitas antidiare diatas aktivitas kelompok pembanding.
Kategori aktivitas antidiare dari masing-masing kelompok bahan uji dapat dikategorikan sebagai berikut: kelompok pemberian suspensi EESP dosis 25 dan 50 mg/kg bb mempunyai aktivitas antidiare yang lemah bila dibandingkan dengan kelompok pemberian suspensi loperamid HCl 1 mg/kg bb. Kelompok pemberian suspensi EESP dosis 75 mg/kg bb mempunyai aktivitas yang sebanding atau sama dengan kelompok pemberian suspensi loperamid HCl dosis 1 mg/kg bb dan kelompok pemberian suspensi EESP dosis 100 mg/kg bb mempunyai aktivitas yang kuat dalam menekan diare dibandingkan dengan kelompok pemberian suspensi loperamid HCl dosis 1 mg/kg bb.
Ekstrak etanol sabut pinang mengandung senyawa pektin dan flavonoid. Pektin seperti diketahui dapat membentuk gumpalan seperti gel saat berikatan dengan cairan, sehingga mengakibatkan feses yang terbentuk menjadi lebih padat. Pektin juga oleh flora normal di usus membentuk suatu lapisan pelindung yang melindungi usus dari iritasi. Pektin seperti flavonoid dapat menghambat motilitas usus. Percobaan secara in vitro dan in vivo telah menunjukkan bahwa flavonoid dapat menghambat respon sekresi usus yang disebabkan oleh prostaglandin E2
(Meite, dkk., 2009), pada kondisi diare prostaglandin E2 menyebabkan
42 BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan hasil penelitian yang dilakukan dapat disimpulkan bahwa: 1. Hasil karakteristik serbuk simplisia diperoleh kadar air 5,31%, kadar sari yang
larut dalam air 9,95%, kadar sari yang larut dalam etanol 7,65%, kadar abu total 5,76% dan kadar abu tidak larut asam 2,20%, sedangkan ekstrak etanol sabut pinang diperoleh kadar air 9,31%, kadar abu total 5,15% dan kadar abu tidak larut asam 2,07%.
2. Hasil skrining fitokimia serbuk simplisia dan ekstrak etanol sabut diperoleh senyawa flavonoid, glikosida dan pektin.
3. Hasil uji aktivitas antidiare ekstrak etanol sabut pinang diperoleh dosis 75 mg/kg bb memiliki aktivitas antidiare yang sebanding dengan loperamid HCl dosis 1 mg/kg bb, sedangkan dosis 25 dan 50 mg/kg bb memiliki aktivitas antidiare yang lemah dan dosis 100 mg/kg bb memiliki aktivitas antidiare yang kuat bila dibandingkan dengan loperamid HCl dosis 1 mg/kg bb.
4.1 Saran
5 BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Pinang (Areca catechu L.) merupakan salah satu tanaman Palmae yang terdapat hampir di seluruh wilayah Indonesia, terutama Pulau Sumatera. Tanaman ini dikenal dengan nama lain, seperti pineng (Sumatera), jambe (Jawa), gahat (Kalimantan), buah jambe (Nusa Tenggara), mamaan (Sulawesi), bua (Maluku) dan kamcu (Irian) (Dalimartha, 2009), dalam bahasa Inggris dikenal dengan nama betel nut, areca atau areca-nut palm, sedangkan nama ilmiahnya adalah Areca catechu Linnaeus (Staples dan Bevacqua, 2006).
2.1.1 Sistematika tumbuhan
Sistematika tata nama pinang adalah sebagai berikut: Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledoneae
Ordo : Arecales
Famili : Arecaceae/Palmae
Genus : Areca
Spesies : Areca catechu L.
6 2.1.2 Morfologi tumbuhan
Pohon pinang berbatang langsing, tumbuh tegak, tinggi 10-30 m, diameter 15-20 cm, tidak bercabang, dengan bekas daun yang lepas. Daun majemuk menyirip, tumbuh berkumpul di ujung batang membentuk roset batang dan panjang helaian daun 1-1,8 m. Pelepah daun berbentuk tabung, panjang sekitar 80 cm dan tangkai daun pendek. Tongkol bunga dengan seludang panjang yang mudah rontok, keluar dari bawah roset daun, panjang sekitar 75 cm, dengan tangkai pendek bercabang rangkap. Bakal buah beruang satu. Buah bentuk bulat telur sungsang memanjang, panjang 3,5-7 cm, dinding buah berserabut, warna merah jingga jika masak. Biji satu, berbentuk seperti kerucut pendek dengan ujung membulat, pangkal agak datar dengan suatu lekukan dangkal, panjang 15-30 mm, permukaan luar berwarna kecoklatan sampai coklat kemerahan (Dalimartha, 2009).
2.1.3 Kandungan sabut pinang
Sabut pinang mengandung pektin 25%, pektin oksalat 2%, hemiselulosa 2%, selulosa 40% dan lignin 18% (Chanakya dan Malayil, 2011), serta mengandung flavonoid 52,57 mg/g (Zhang, dkk., 2009).
a. Pektin
7
memiliki potensi yang baik dalam bidang farmasi. Towel dan Christensen (1973) menyatakan bahwa sejak dahulu pektin digunakan dalam penyembuhan diare dan menurunkan kadar kolesterol darah (Hariyati, 2006). Pektin sebagai antidiare bekerja dengan cara membentuk gumpalan seperti gel, sehingga feses yang terbentuk menjadi lebih padat. Pektin juga bekerja melawan bakteri tertentu yang dapat menyebabkan diare dan oleh flora normal di usus dapat membentuk suatu lapisan yang menutupi bagian usus yang mengalami iritasi, selain itu pektin dapat menghambat motilitas usus (Yajima, 1985).
b. Pektin oksalat
Pektin oksalat merupakan pektin yang tidak larut dalam air yang disebut dengan protopektin (Chanakya dan Malayil, 2011). Protopektin dengan adanya larutan asam akan terhidrolisis menjadi pektin yang mudah larut (Hariyati, 2006). c. Selulosa
8 d. Hemiselulosa
Hemiselulosa adalah polimer glukosa dengan lima monomer yang berbeda, yaitu glukosa, mannosa, galaktosa, xylosa dan arabinosa. Hemiselulosa sangat dekat hubungannya dengan selulosa dalam dinding sel tanaman. Rantai molekul hemiselulosa jauh lebih pendek bila dibandingkan dengan selulosa (Hermiati, dkk., 2010).
e. Lignin
Lignin atau zat kayu adalah polimer terbanyak kedua setelah selulosa yang terdapat di antara sel-sel dan di dalam dinding sel. Lignin berfungsi sebagai pengikat antar sel dan menguatkan dinding sel, sehingga tumbuhan yang besar seperti pohon yang tingginya lebih dari 15 m tetap dapat kokoh berdiri. Struktur molekul lignin sangat berbeda dengan polisakarida karena terdiri atas sistem aromatik yang tersusun atas unit-unit fenilpropana. Lignin sangat stabil dan sukar dipisahkan dan mempunyai bentuk yang bermacam-macam, sehingga susunan lignin yang pasti di dalam suatu tanaman tidak menentu. (Nofriadi, 2009).
f. Flavonoid
Flavonoid merupakan salah satu kelompok senyawa metabolit sekunder yang paling banyak ditemukan di dalam jaringan tanaman. Flavonoid termasuk dalam golongan senyawa fenolik dengan struktur kimia C6-C3-C6 (Redha, 2010).
Flavonoid dapat mengobati diare dengan cara menghambat produksi prostaglandin E2 (Meite, dkk., 2009) karena pada kondisi diare prostaglandin E2
9
yang dikeluarkan terlalu banyak, serta menambah frekuensi defekasi (Sanchez de Medina, dkk., 1997).
2.1.4 Manfaat tumbuhan
Tanaman pinang memiliki banyak manfaat, misalnya daun pinang sebagai obat antidiabetes (Mondal, dkk., 2012), bijinya sebagai obat antifertilitas (Aulanni’am, dkk., 2007), antelmintik (Tiwow, dkk., 2013), antibakteri, antivirus (Joshi, dkk., 2012), antioksidan (Zhang, dkk., 2009) dan lain-lain. Batang pinang dapat digunakan sebagai bahan bangunan, jembatan dan saluran air, sedangkan serabut buah secara tradisional digunakan sebagai obat gangguan pencernaan, edema dan beri- beri, serta dapat dijadikan sebagai bahan baku pembuatan kuas gambar atau kuas alis mata (Dalimartha, 2009).
2.2Simplisia dan Ekstrak 2.2.1 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, berupa bahan yang telah dikeringkan. Simplisia dibedakan simplisia nabati, simplisia hewani dan simplisia pelikan (mineral). Simplisia nabati adalah simplisia berupa tumbuhan utuh, bagian tumbuhan atau eksudat tumbuhan yang dipergunakan sebagai obat yang belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain berupa bahan yang telah dikeringkan (Ditjen POM, 2000).
2.2.2 Ekstrak
10
sesuai, kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian, sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut, sehingga terpisah dari bahan yang tidak larut dengan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan minyak atsiri, alkaloid, flavonoid dan lain-lain. Senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat (Ditjen POM, 2000).
Metode ekstraksi dengan menggunakan pelarut dapat dibagi ke dalam dua cara, yaitu:
1. Cara dingin, yaitu:
a. Maserasi adalah proses penyarian simplisia dengan menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan (kamar).
Maserasi kinetik berarti dilakukan pengadukan yang kontinu (terus menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyarian maserat pertama dan seterusnya.
11 2. Cara panas, yaitu:
a. Refluks adalah proses penyarian simplisia dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Proses pengulangan umumnya dilakukan pada residu pertama sampai 3-5 kali, sehingga termasuk proses ekstraksi sempurna.
b. Sokletasi adalah proses penyarian simplisia menggunakan pelarut yang selalu baru yang umumnya dilakukan dengan alat soklet, sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti adalah proses penyarian simplisia dengan pengadukan kontinu pada temperatur yang lebih tinggi dari temperatur ruangan (kamar), yaitu secara umum dilakukan pada temperatur 40-50°C.
d. Infundasi adalah proses penyarian simplisia dengan pelarut air pada temperatur penangas air (bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-98°C) selama waktu tertentu (15-20 menit).
e. Dekoktasi adalah proses penyarian simplisia dengan pelarut air pada waktu yang lebih lama (≥30 menit) dan temperatur sampai titik didih air (Ditjen POM, 2000).
2.3Diare
12
berulang-ulang yang disertai adanya perubahan bentuk dan konsistensi feses menjadi lembek atau cair tergantung dari individu (Sugiarto, 2008). Peningkatan frekuensi didefinisikan oleh tiga atau lebih buang air besar per hari. Berat feses normal pada orang yang mengkonsumsi makanan tinggi lemak dan gula, bervariasi dari 100 sampai 200 g/hari, sehingga berat feses >200 g/hari dianggap diare, namun beberapa orang yang mengkonsumsi serat memiliki berat feses 300 g/hari atau lebih dengan konsistensi feses normal, tidak berarti diare. Kombinasi frekuensi, konsistensi feses, dan berat feses harus diperhitungkan untuk menentukan diare (Navaneethan dan Giannella, 2011).
Makanan yang terdapat di dalam lambung, secara normal dicerna menjadi bubur (kimus), kemudian diteruskan ke usus halus untuk diuraikan lebih lanjut oleh enzim-enzim pencernaan. Sisa kimus yang terdiri dari 90% air dan sisa-sisa makanan yang sukar dicerna, diteruskan ke usus besar (colon). Bakteri-bakteri yang biasanya selalu berada di usus besar mencerna lagi sisa-sisa (serat-serat) tersebut, sehingga sebagian besar dari sisa-sisa tersebut dapat diserap pula selama perjalanan melalui usus besar. Air juga diresorpsi kembali sehingga lambat laun isi usus menjadi lebih padat dan dikeluarkan dari tubuh menjadi tinja (feses), namun pada diare terjadi peningkatan peristaltik usus, sehingga pelintasan kimus sangat dipercepat dan masih mengandung banyak air pada saat meninggalkan tubuh sebagai tinja. Penyebab utamanya adalah bertumpuknya cairan di usus akibat terganggunya resorpsi air dan atau terjadinya hipersekresi (Tan dan Rahardja, 2008).
2.3.1Klasifikasi diare
13 1. Berdasarkan adanya infeksi, dibagi atas:
a. Diare infeksi enteral, yaitu diare karena infeksi di usus, misalnya infeksi bakteri (Vibrio cholera, Eschericia coli, Salmonella dan Shigella), infeksi virus (Rotavirus dan Enterovirus) dan infeksi parasit (cacing, protozoa dan jamur)
b. Diare infeksi parenteral, yaitu diare karena infeksi di luar usus, misalnya infeksi saluran pernapasan.
2. Berdasarkan lamanya diare, dibagi atas:
a. Diare akut, yaitu diare yang terjadi secara mendadak yang segera berangsur sembuh pada seseorang yang sebelumnya sehat. Diare akut biasanya berlangsung dalam waktu kurang dari 2 minggu.
b. Diare kronis, yaitu diare yang timbul perlahan-lahan berlangsung 2 minggu atau lebih, baik menetap atau menahun atau bertambah hebat 3. Berdasarkan penyebab terjadinya diare, dibagi atas:
a. Diare spesifik, yaitu diare yang disebabkan oleh adanya infeksi, misalnya infeksi yang disebabkan oleh virus, bakteri, parasit dan enterotoksin. b. Diare non spesifik, yaitu diare yang tidak disebabkan oleh adanya infeksi
misalnya alergi makanan atau minuman, gangguan gizi, kekurangan enzim dan efek samping obat (Enda, 2010).
2.3.2 Obat-obat diare
Kelompok obat yang sering sekali digunakan pada diare adalah:
14
2. Obstipansia untuk terapi simtomatis, yang dapat menghentikan diare dengan beberapa cara, yakni:
a. Zat-zat penekan peristaltik sehingga lebih banyak waktu untuk resorpsi air dan elektrolit oleh mukosa usus, yakni derivat petidin (loperamid) dan antikolinergik (atropin dan ekstrak beladon).
b. Adstringensia, yang menciutkan selaput lendir usus, misalnya asam samak (tanin), tanalbumin, garam-garam bismut dan aluminium.
c. Adsorbensia, misalnya karbo adsorbens (pada permukaannya dapat menyerap zat-zat beracun yang dihasilkan oleh bakteri atau adakalanya berasal dari makanan, seperti udang atau ikan), mucilagines (zat-zat lendir yang menutupi selaput lendir usus dan luka-lukanya dengan suatu lapisan pelindung, seperti kaolin, pektin, garam-garam bismuth dan aluminium). 3. Spasmolitik, yakni zat-zat yang dapat melepaskan kejang-kejang otot yang
sering kali menyebabkan nyeri perut pada diare, misalnya papaverin (Tan dan Rahardja, 2008).
2.4Loperamid Hidroklorida
Loperamid hidroklorida (4-(p-Klorofenil)-4-hidroksi-N,N-dimetil-α,α -difenil-1-piperidina butiramida monohidroklorida) mempunyai rumus kimia C29H33ClN2O2.HCl dengan berat molekul 513,51. Pemerian berupa serbuk putih
15
Loperamid (dosis awal 4 mg dan tidak melebihi 16 mg/hari) merupakan turunan sintesis pethidine yang dapat menghambat motilitas usus dan juga mengurangi sekresi gastrointestinal. Loperamid diyakini bekerja dengan cara mengganggu mekanisme kolinergik dan non-kolinergik yang terlibat dalam reflek peristaltik, menurunkan aktivitas otot sirkular dan longitudinal pada usus (Ebadi, 2008). Loperamid tidak bekerja pada susunan saraf pusat, sehingga tidak mengakibatkan ketergantungan. Zat ini mampu menormalkan keseimbangan resorpsi-sekresi dari sel mukosa, yaitu memulihkan sel-sel yang berada dalam keadaan hipersekresi ke keadaan resorpsi normal kembali (Tan dan Rahardja, 2008).
2.5Oleum Ricini
1 BAB I PENDAHULUAN
1.1Latar belakang
Sejak zaman dahulu masyarakat Indonesia mengenal dan memanfaatkan tanaman berkhasiat obat sebagai salah satu upaya dalam penanggulangan masalah kesehatan yang dihadapinya. Pengetahuan tentang pemanfaatan tanaman ini merupakan warisan budaya bangsa berdasarkan pengalaman, pengetahuan dan keterampilan yang secara turun temurun diwariskan kepada generasi berikutnya, termasuk generasi saat ini (Wijayakusuma, 2000). Penggunaan obat tradisional secara umum dinilai lebih aman daripada penggunaan obat modern. Hal ini disebabkan karena obat tradisional memiliki efek samping yang relatif lebih sedikit daripada obat modern (Sari, 2006).