KAJIAN RESIDU BETA LAKTAM DALAM SUSU
PASTEURISASI IMPOR DARI AUSTRALIA MELALUI
PELABUHAN UDARA SOEKARNO-HATTA
TRIFERA MELANINGRUM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Kajian Residu Beta Laktam dalam Susu Pasteurisasi Impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta adalah karya saya sendiri dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2012
ABSTRACT
TRIFERA MELANINGRUM. Study on Beta-lactam Residue in Imported Pasteurized Milk from Australia through Soekarno-Hatta Airport. Under direction of MIRNAWATI SUDARWANTO and HADRI LATIF.
Beta-lactam antibiotic residue occurs in pasteurization milk due to application of beta-lactam antibiotic in dairy cattle treatment. The residue does not only create problems in dairy industry but also have impact on public health. The aims of the study were to determine the presence and the amount of beta-lactam antibiotic in imported pasteurization milk. Sample size was calculated using the formula to detect disease according Canon and Roe (1982) cited by Martin et al. (1987). The sixty samples of imported pasteurized milk from Australia were used in this study. The bioassay (screening test) was used and followed by confirmation test used high performance liquid chromatography (HPLC). Both of the tests showed negative result. It means all of the samples did not contain beta-lactam antibiotic.
RINGKASAN
TRIFERA MELANINGRUM. Kajian Residu Beta Laktam dalam Susu Pasteurisasi Impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta. Dibimbing oleh MIRNAWATI SUDARWANTO dan HADRI LATIF.
Susu merupakan bahan pangan asal hewan yang mempunyai nilai gizi baik dan seimbang. Konsumsi susu di Indonesia semakin meningkat seiring dengan kenaikan jumlah penduduk, peningkatan kesejahteraan, dan kesadaran masyarakat akan pentingnya sumber protein hewani. Susu berkualitas baik haruslah aman, dan layak dikonsumsi. Keberadaan residu antibiotika dalam susu menjadikan susu tidak aman dikonsumsi karena dapat menimbulkan gangguan kesehatan.
Antibiotika telah digunakan secara luas, baik dalam lingkup kesehatan manusia maupun kesehatan hewan. Masalah residu antibiotika dalam pangan asal hewan berkaitan dengan praktek yang kurang baik dalam penggunaan di lapangan. Penggunaan antibiotika di peternakan antara lain untuk pengobatan penyakit, pencegahan dan sebagai pemacu pertumbuhan (feed additive).
Beta laktam adalah antibiotika yang sering digunakan pada hewan karena mampu menghambat pertumbuhan bakteri Gram positif dengan cara merusak dinding sel bakteri serta dapat digunakan untuk meningkatkan efisiensi pakan dan pertumbuhan hewan ternak. Beta laktam sangat umum digunakan di peternakan sapi perah, terutama untuk pengobatan mastitis. Penggunaan antibiotika, termasuk beta laktam yang tidak memperhatikan waktu henti obat (withdrawal time) akan menimbulkan residu antibiotika pada produk hewan (Donkor et al. 2011).
Produk susu olahan, temasuk susu pasteurisasi dapat beresiko mengandung residu antibiotika. Menurut hasil penelitian Sudarwanto et al. (1992) bahwa 32.52% susu pasteurisasi dan 31.10% susu segar di wilayah Jakarta, Bogor, dan Bandung mengandung residu antibiotika dalam jumlah yang cukup tinggi. Oleh karena itu perlu dilakukan pengujian adanya residu antibiotika untuk memperoleh susu pasteurisasi yang aman dikonsumsi.
Tujuan dari penelitian ini adalah untuk mengetahui tingkat residu beta laktam dalam susu pasteurisasi impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta dan menyediakan data bagi Karantina Pertanian dalam upaya penetapan kebijakan terkait pentingnya pengujian residu beta laktam sebagai tindakan karantina di tempat pemasukan.
Penelitian ini dilakukan terhadap 60 sampel susu pasteurisasi impor setelah dilakukan penghitungan dengan rumus deteksi penyakit menurut Canon dan Roe (1982) yang dikutip Martin et. al. (1987). Pengambilan sampel dilakukan secara bertahap dengan menggunakan random sampling sebanyak 12 kemasan/ kedatangan.
Seluruh sampel diuji dengan menggunakan metode bioassay secara triplo. Sampel yang menunjukkan hasil positif pada bioassay dikonfirmasi dengan metode HPLC. Penyajian data pada kedua uji dilakukan secara diskriptif.
memperlihatkan tidak ditemukannya zona terang disekitar cakram steril yang telah diteteskan sampel susu pasteurisasi. Pada grafik kromatogram HPLC, pada menit ke-5.94 tidak terdapat puncak yang sesuai dengan kromatogram pada kontrol.
Hasil penelitian ini dapat disimpulkan bahwa susu pasteurisasi impor dari Australia yang melalui pelabuhan udara Soekarno Hatta tidak mengandung residu antibiotika beta laktam. Penelitian ini dapat dipergunakan sebagai bahan pertimbangan dalam melakukan tindakan karantina bagi petugas karantina dan Badan Karantina Pertanian untuk menetapkan aturan pemasukan produk susu. Selain itu perlu dilakukan penelitian lebih lanjut terhadap residu antibiotika dari golongan antibiotika selain beta laktam.
©Hak cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KAJIAN RESIDU BETA LAKTAM DALAM SUSU
PASTEURISASI IMPOR DARI AUSTRALIA MELALUI
PELABUHAN UDARA SOEKARNO-HATTA
TRIFERA MELANINGRUM
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kesehatan Masyarakat Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Residu Beta Laktam dalam Susu Pasteurisasi Impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta
Nama : Trifera Melaningrum NIM : B251100104
Disetujui
Komisi Pembimbing
Diketahui
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr. drh. Denny Widaya Lukman, M.Si.
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc.Agr.
Tanggal Ujian : 07 Juni 2012 Tanggal Lulus : 23 Januari 2009 Prof. Dr. drh. Hj. Mirnawati B Sudarwanto
Ketua
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan hidayah-Nya, sehingga karya ilmiah ini berhasil diselesaikan. Salawat dan salam kita sampaikan kepada Junjungan kita Nabi Besar Muhammad SAW yang membawa kita kedalam alam rahmah dan cahaya iman dan Islam. Amien. Penelitian ini berjudul “Kajian Residu Beta Laktam dalam Susu Pasteurisasi Impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta” yang dilaksanakan sejak bulan Januari sampai April 2012.
Ucapan terima kasih penulis ucapkan kepada Bapak Ir. Hari Priyono, M.Si. dan Ibu Ir. Banun Harpini M.Sc., yang memberikan dukungan moril dan kesempatan untuk melanjutkan pendidikan Pascasarjana. Terima kasih dan penghargaan yang sebesar-besarnya juga penulis tujukan kepada Prof. Dr. drh. Hj. Mirnawati B Sudarwanto dan Dr. drh. Hadri Latif, M.Si., selaku dosen pembimbing yang dengan ketulusan dan kebesaran hati telah meluangkan waktu, tenaga dan pikirannya sebagai pembimbing, ibu/bapak, dan sekaligus sahabat dalam mendidik, mengarahkan dan memberikan masukan kepada penulis dari awal hingga selesainya tesis ini. Penghargaan dan terima kasih penulis tujukan pada Dr. drh. Denny W. Lukman, M.Si. selaku ketua program studi Kesehatan Masyarakat Veteriner dan segenap staf pengajar program studi Kesmavet FKH IPB atas bimbingan dan ilmu yang diberikan selama kami menyelesaikan pendidikan di program studi Kesehatan Masyarakat Veteriner Pascasarjana, Institut Pertanian Bogor. Ucapan terima kasih juga penulis sampaikan kepada Dr. Ir. Eti Riyani yang bertindak sebagai moderator pada seminar hasil penelitian dan Dr. drh. Trioso Purnawarman, MSi. yang bertindak sebagai penguji luar komisi pada ujian tesis. Ucapan yang sama penulis tujukan pada bapak Agus Haryanto, SE. yang telah membantu kelancaran selama studi, bapak Yuhendra dan bapak Rahmat yang telah membantu dalam pengujian sampel penelitian.
Demikian juga atas dukungan fasilitas, kemudahan, dan sarana yang telah diberikan maka tak lupa saya juga mengucapkan terima kasih kepada Bapak Dr. Ir. Antarjo Dikin, M.Sc. beserta staf di Laboratorium Balai Besar Uji Terap Teknik dan Metode Karantina Pertanian Bekasi yang telah membantu dalam pengujian sampel, Dr. Ir. Musyaffak Fauzi, SH, M.Si. dan segenap staf Balai Besar Karantina Pertanian Soekarno Hatta yang telah membantu selama pengumpulan sampel, drh. Agus Sunanto, MP. beserta staf Laboratorium di Balai Besar Karantina Tanjung Priok atas ijin dan dukungannya kepada penulis selama masa perkuliahan, serta drh. Adi Mardin dan segenap rekan kerja di Stasiun Karantina Pertanian Kelas I Cilacap atas dukungannya kepada penulis selama masa perkuliahan. Selain itu, ucapan terima kasih juga disampaikan pada drh. Uti Ratnasari Herdiana, M.Si., drh. Arum kusnila Dewi, M.Si., drh. Anjar Maryati, drh. Nuryani Triwijayanti, Riska Desitania S.Si., Dr. R. Widyastuti, Yuningsih dan Yessi Anastasia, A.Md. yang membantu proses penelitian.
banyak lagi rekan-rekan yang telah turut membantu tapi tidak dapat penulis sebutkan satu persatu.
Ungkapan syukur dan hormat juga penulis sampaikan kepada Papa dan Mama di Pati, Bapak (alm) dan Ibu Mertua di Kebumen, kakakku Wati, adikku Anis, serta keluarga besar eyang Soebakri atas semua dukungan selama menyelesaikan kuliah ini. Ucapan terima kasih yang tak terhingga penulis sampaikan kepada suamiku tercinta Amir atas dukungan, perhatian, kesabaran, cinta dan kasih sayangnya, juga kepada kedua buah hatiku Fahrun Imana dan Faros Abdillah, kalian bertiga adalah penyemangat hidupku.
Atas segala kebaikan yang telah penulis terima, semoga Tuhan Yang Maha Esa melimpahkan rahmat dan karunia-Nya kepada kita semua. Harapan penulis semoga hasil penelitian ini dapat bermanfaat bagi Badan Karantina serta masyarakat veteriner Indonesia.
Bogor, Juni i2012
RIWAYAT HIDUP
Penulis dilahirkan di Pati Jawa Tengah pada tanggal 30 Mei 1974 sebagai anak ke-2 dari 3 (tiga) bersaudara dari ayah Sungkowo dan ibu Isniyati. Bersama kedua saudara dididik dan dibesarkan dengan penuh kehangatan dan kasih sayang. Penulis menempuh pendidikan Taman Kanak Kanak di Pertiwi Pati tahun 1980, Sekolah Dasar Negeri diselesaikan tahun 1986 di SD Pati Kidul I Pati, Sekolah Menengah Pertama Negeri 2 Pati tahun 1989, Sekolah Menengah Atas Negeri 2 Pati tahun 1992, Lulus Sarjana Kedokteran Hewan Universitas Gadjah Mada tahun 1998 dan menjadi Dokter Hewan pada bulan Agustus 1999 di Universitas yang sama. Pada tahun 2010 mendapat kesempatan untuk melanjutkan studi S2 (Magister) di program studi Kesehatan Masyarakat Veteriner Sekolah Pascasarjana Institut Pertanian Bogor dengan dukungan biaya perkuliahan dari DIPA Badan Karantina Pertanian, Kementrian Pertanian.
Setelah lulus dokter hewan, penulis diterima sebagai Pegawai Negeri Sipil di Stasiun Karantina Hewan Semarang dari tahun 2000 sampai dengan 2008. Pada pertengahan tahun 2008 dipindah ke Stasiun Karantina Hewan Kelas I Cilacap hingga saat ini.
xvii
Penggunaan Antibiotika di Peternakan ... 9
Residu Antibiotika dalam Susu ... 11
Dampak Residu Antibiotika ... 12
Metode Pengujian Residu Antibiotika ... 13
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 15
Alat dan Bahan ... 15
Rancangan Penelitian ... 16
Metode Penelitian ... 16
Gambaran Residu Beta laktam dalam Susu Pasteurisasi………... 26
SIMPULAN DAN SARAN ... 29
Simpulan ... 29
Saran ... 29
xix
DAFTAR TABEL
Halaman
1. Suhu dan waktu pada proses pasteurisasi ... 4
2. Perbandingan komposisi susu segar dan pasteurisasi ... 4
3. Syarat mutu susu segar ... 5
4. Spektrum aktifitas antibiotika ... 6
5. Aktifitas beberapa antibiotika ... 7
6. Waktu henti obat beberapa jenis antibiotika ... 12
7. Batas maksimum residu antibiotika dalam susu ... 12
xxi
DAFTAR GAMBAR
Halaman
1. Struktur kimia penisilin (ampisilin dan amoksilin) dan cephalosporin
PENDAHULUAN
Latar Belakang
Susu merupakan bahan pangan asal hewan yang mempunyai nilai gizi baik dan seimbang. Susu berkualitas baik haruslah aman, dan layak dikonsumsi. Keberadaan residu antibiotika dalam susu menjadikan susu tidak aman dikonsumsi karena dapat menimbulkan gangguan kesehatan.
Antibiotika telah digunakan secara luas, baik dalam lingkup kesehatan manusia maupun kesehatan hewan. Masalah residu antibiotika dalam pangan asal hewan berkaitan dengan penggunaan antibiotika yang tidak benar di lapangan. Penggunaan antibiotika di peternakan antara lain untuk pengobatan, pencegahan penyakit, dan sebagai pemacu pertumbuhan (growth promotor dalam pakan).
Beta laktam adalah antibiotika yang sering digunakan pada hewan karena mampu menghambat pertumbuhan bakteri Gram positif dengan cara merusak dinding sel bakteri dan dapat digunakan untuk meningkatkan efisiensi pakan serta pertumbuhan hewan ternak. Beta laktam sangat umum digunakan di peternakan sapi perah, terutama untuk pengobatan mastitis. Penggunaan antibiotika, termasuk beta laktam yang tidak memperhatikan waktu henti obat (withdrawal time) akan menyebabkan residu antibiotika pada produk hewan (Donkor et al. 2011).
Produk susu olahan, temasuk susu pasteurisasi mempunyai resiko mengandung residu antibiotika. Resiko tersebut karena suhu pemanasan yang digunakan dalam proses pengolahan tidak/ belum cukup untuk mengurangi residu antibiotika dalam susu. Menurut hasil penelitian Sudarwanto et al. (1992) bahwa 32.52% susu pasteurisasi dan 31.10% susu segar di wilayah Jakarta, Bogor, dan Bandung mengandung residu antibiotika dalam jumlah yang cukup tinggi, oleh karena itu perlu dilakukan pengujian adanya residu antibiotika dalam susu pasteurisasi agar aman dikonsumsi.
2
impor dari Australia menjadikan pengujian residu beta laktam perlu menjadi prioritas untuk tindakan karantina terhadap produk olahan susu tersebut.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan data keberadaan residu beta laktam dalam susu pasteurisasi impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah tersedianya data keberadaan residu beta laktam pada susu pasteurisasi impor dari Australia yang dapat dijadikan informasi ilmiah yang berguna bagi institusi terkait (Badan Karantina Pertanian) dalam upaya penetapan kebijakan terkait pentingnya pengujian residu beta laktam sebagai bagian tindakan karantina di tempat pemasukan.
Hipotesis Penelitian
Dalam penelitian ini disusun hipotesis sebagai berikut:
H0 = Susu pasteurisasi impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta mengandung residu antibiotika beta laktam.
TINJAUAN PUSTAKA
Susu Pasteurisasi
Susu pasteurisasi merupakan minuman bergizi tinggi, khususnya karena mengandung protein tinggi serta mempunyai aroma yang spesifik susu. Aroma dan cita rasa susu sangat dipengaruhi oleh kadar laktosa susu (Syarief dan Halid 1997). Susu merupakan hasil utama pada usaha budidaya ternak perah. Hidayat (2010) menyatakan, susu yang dihasilkan harus memenuhi syarat aman, sehat, utuh, dan halal (ASUH). Untuk mendapatkan susu yang ASUH dibutuhkan penanganan susu yang khusus karena zat gizi yang terkandung dalam susu mendukung pertumbuhan mikroorganisme patogen dan apatogen. Akibat tercemarnya oleh mikroorganisme, maka susu mudah rusak dan menjadi sumber terjadinya foodborne disease. Foodborne disease adalah penyakit yang disebabkan karena mengkonsumsi makanan atau minuman yang tercemar oleh mikroorganisme atau bahan kimia termasuk antibiotika (Gustiani 2009).
Susu pasteurisasi adalah susu yang telah mengalami proses pemanasan sehingga mempunyai daya simpan lebih lama dibanding susu mentah disertai musnahnya mikroorganisme patogen yang dapat mengganggu kesehatan konsumen. Proses pasteurisasi berdasarkan rekomendasi Public Health Services (PHS) Amerika Serikat tahun 1978 adalah proses pemanasan pada suhu dan waktu tertentu seperti terlihat pada Tabel 1.
4
Tabel 1 Suhu dan waktu pada proses pasteurisasi (Hubbert dan Hagstad 1991)
high temperature short time (HTST)
ultra high temperatur (UHT)
Tujuan pasteurisasi selain untuk membunuh bakteri patogen dan non patogen (Hobbs dan Robert 1987; Fardiaz 1989; Gaman dan Sherrington 1992), juga untuk memperpanjang daya simpan susu. Kay (1962) menyatakan bahwa penggunaan panas pada pasteurisasi tidak begitu menimbulkan perubahan pada komposisi dan rasa susu sehingga masih seperti susu segar. Perbandingan komposisi antara susu segar dan susu pasteurisasi dapat dilihat pada Tabel 2.
Tabel 2 Perbandingan komposisi susu segar dan susu pasteurisasi (Muchtadi dan Sugiyono 1992)
Komposisi Susu segar (%) Susu pasteurisasi (%)
Air
5
pemanasan pada temperatur 63 oC – 66 oC selama 30 menit atau pada pemanasan 72 oC minimum selama 15 detik, kemudian segera didinginkan sampai 10 oC, selanjutnya diperlakukan secara aseptis dan disimpan pada suhu maksimum 4 oC. Tabel 3 memperlihatkan persyaratan susu segar berdasarkan Standar Nasional Indonesia (SNI) nomor 3141.1:2011.
Tabel 3 Syarat mutu susu segar berdasarkan SNI 3141.1:2011
No. Karakteristik Syarat
1.
Berat jenis (pada suhu 27.5 °C) minimum
Kadar lemak minimum
Kadar bahan kering tanpa lemak minimum
Kadar protein minimum
Warna, bau, rasa dan kekentalan
Derajat asam
Residu antibiotika (golongan laktam, tetrasiklin, aminoglikosida, makrolida)
6
Keberadaan residu antibiotika dalam produk hewan perlu mendapat perhatian karena dapat menyebabkan terjadinya resistensi antibiotika (Bahri et al. 2002).
Antibiotika
Antibiotika merupakan suatu bahan atau zat yang diproduksi oleh bakteri atau cendawan tertentu yang dapat digunakan untuk pengobatan terhadap infeksi mikroorganisme terutama yang disebabkan oleh bakteri. Senyawa ini mampu menghentikan proses pertumbuhan dari bakteri bahkan dapat membunuh bakteri yang secara umum dikenal sebagai efek bakteriostatik dan bakterisidal (Bezoen et al. 2000). Menurut Giguere (2006) antibiotika merupakan hasil intermediet atau hasil akhir dari metabolisme mikroba. Antibiotika dapat diklasifikasikan atas beberapa kategori. Secara umum dapat dibagi berdasarkan empat kategori yaitu berdasarkan target mikroorganisme, aktifitas bakteri, kemampuan bakterisidal atau bakteriostatik, serta waktu dan konsentrasi obat.
1) Target mikroorganisme
Antibiotika digambarkan sebagai spektrum sempit jika hanya menghambat bakteri saja atau dikatakan berspektrum luas jika dapat menghambat mikoplasma, riketsia dan klamidia. Spektrum aktifitas terhadap target mikroorganisme dijelaskan pada Tabel 4.
Tabel 4 Spektrum aktifitas antibiotika (Giguere 2006)
Antibiotika Kelas Mikroorganisme
7
2) Aktifitas antibakteri
Beberapa antibiotika dapat menghambat bakteri Gram negatif atau Gram positif saja sehingga disebut memiliki aktifitas yang sempit, sedangkan antibiotika dengan aktifitas spektrum luas memiliki kemampuan menghambat atau bekerja pada bakteri Gram negatif dan positif. Definisi ini tidak sepenuhnya mutlak karena beberapa jenis antibiotika dapat bekerja terhadap kedua kelompok bakteri baik Gram positif maupun Gram negatif tetapi hanya menghambat beberapa jenis bakteri dari keduanya. Aktifitas beberapa jenis antibiotika terhadap kelompok dijelaskan dalam Tabel 5.
Tabel 5 Aktifitas beberapa antibiotika (Giguere 2006)
Spektrum Bakteri aerob Bakteri anaerob
Contoh
generasi ke 3 dan ke 4 sefalosporin generasi ke 2 sefalosporin
ampisilin, amoksisilin, generasi 1 sephalosporin
ampisilin, linkosamid, glikopeptida, streptogramin, oksazolidion
+ aktifitas sangat baik (+) aktifitas cukup +/- aktifitas terbatas
- tidak ada aktifitas atau diabaikan
3) Kemampuan bakterisidal dan bakteriostatik
Beberapa jenis antibiotika menghambat pertumbuhan bakteri pada suatu
konsentrasi, atau disebut konsentrasi penghambatan minimun ‘minimum
inhibitory concentration’ (MIC), namun membutuhkan konsentrasi yang lebih
tinggi untuk membunuh atau konsentrasi pembunuh minimum ‘minimum
8
bakteriostatik dan bakteriosidal. Bakteriostatik adalah antibiotika yang dapat menghambat pertumbuhan bakteri (kloramfenikol, tetrasiklin), sedangkan bakteriostatik adalah antibiotika yang dapat membunuh bakteri (beta laktam, aminoglikosida), hal ini tidak berlaku mutlak karena tergantung juga pada konsentrasi obat dan jenis mikroba target. Salah satu contohnya adalah bennzyl penicillin dari kelompok bakterisidal namun pada konsentrasi rendah bekerja sebagai bakteriostatik.
4) Waktu dan konsentrasi obat
Antibiotika sering diklasifikasikan berdasarkan waktu aktifitas dan konsentrasi obat yang tergantung pada farmakodinamika. Farmakodinamika obat menggambarkan efek obat terhadap mikroorganisme. Farmakokinetika obat menggambarkan konsentrasi obat dalam serum setelah proses absorbsi, distribusi, metabolisme, dan eliminasi. Ketika digabungkan dengan nilai MIC dapat diprediksi kemungkinan pemusnahan bakteri dan keberhasilan pengobatan. Beberapa jenis antibiotika mampu meningkatkan efek bakterisidal jika dilakukan penambahan konsentrasi. Beberapa jenis antibiotika juga membutuhkan waktu cukup lama dan konsentrasi tinggi untuk dapat bekerja efektif seperti fluoroquinolon dan aminoglikosida.
Gambar 1 Struktur kimia penisilin (ampisilin dan amoksisilin) dan sefalosporin (sefadroxil).
9
Beta laktam adalah antibiotika tertua dan banyak digunakan di masyarakat (Ghinidi et al. 2002). Antibiotika beta laktam seperti penisilin dan sefalosporin banyak digunakan di lapangan (Shammipur et al. 2002), seperti pengobatan mastitis (Riediker et al. 2004). Gambar 1 memperlihatkan cincin beta laktam dari penisilin dan sefalosporin (Fagerquist dan Lightfield 2003).
Penisillin merupakan antibiotika yang efektif untuk bakteri Gram positif. Senyawa ini sering digunakan sebagai obat pilihan utama untuk semua jenis infeksi karena tidak menimbulkan efek samping yang toksik dan bersifat bakterisidal (Olsom 2003). Menurut Gustavsson et al. (2002) walaupun terdapat banyak jenis antibiotika dan kemoterapi yang digunakan untuk pengobatan infeksi pada sapi perah, namun masalah utama industri susu adalah penisilin. Penisilin tidak beracun tetapi untuk individu yang sensitif dapat menyebabkan alergi (Grunwald dan Petz 2003).
Menurut Admin (2007), absorbsi penisilin bisa melalui peroral, intramuskular, intravena, intratrakheal, intrauteri dan intramammari. Pada keadaan normal penisilin didistribusikan dengan cepat dari plasma darah ke dalam jaringan tubuh. Pengukuran presentasi volume distribusi (apparent volume distribution/ AVD) sebesar 50% memperlihatkan cepat dan mudahnya distribusi penisilin ke dalam jaringan. Melalui ginjal, penisilin diekskresikan dengan cepat yaitu mencapai 60-80% dari obat yang dikonsumsi, sedangkan ekskresi melalui kelenjar susu 16% dari yang ada di dalam plasma, hal ini menunjukkan bahwa penisilin lebih banyak dieliminasi tubuh melalui ginjal daripada melalui susu.
Penggunaaan Antibiotika di Peternakan
10
tersebut dapat memicu terjadinya residu antibiotika dalam susu (Mitchell et al. 1998). Sampai sekarang masih terdapat dilema, di satu sisi penggunaan antibiotika sangat perlu akan tetapi di sisi lain berakibat buruk bagi kesehatan masyarakat (Crawford dan Franco 1996).
Antibiotika sebagai obat yang paling banyak digunakan dalam peternakan, secara umum diketahui mempunyai dua target tujuan dalam penggunaannya yaitu sebagai agen terapeutik dan sebagai agen subterapeutik. Penggunaan antibiotika sebagai agen terapeutik berfungsi untuk melakukan terapi terhadap kejadian penyakit sedangkan penggunaan sebagai subterapeutik bertujuan untuk meningkatkan produksi ternak dengan cara meningkatkan efisiensi makanan untuk pertumbuhan dan melakukan modifikasi terhadap komposisi nutrisi dari produk yang dihasilkan oleh ternak tersebut (CDUFA 1999).
Penggunaan antibiotika pada sapi laktasi akan menghasilkan residu di dalam susu (NRA 2000). Antibiotika secara komersial banyak digunakan dalam industri peternakan sebagai zat yang ditambahkan pada pakan hewan yang bertindak sebagai agents growth promotors (AGPs) dan juga sebagai suatu zat yang digunakan untuk kontrol dan pencegahan terjadinya penyakit. Cara kerja dari AGPs ini belum diketahui secara pasti, akan tetapi secara umum diketahui bahwa antibiotika yang berfungsi sebagai AGPs akan mengurangi keberadaan organisme patogen dan mengurangi jumlah mikroorganisme yang bersaing dengan inang dalam mendapatkan nutrisi. Fungsi lain antibiotika sebagai AGPs ialah merangsang atau menghambat secara selektif pertumbuhan dari mikroorganisme yang banyak menggunakan nutrisi inang untuk pertumbuhannya, namun menurut Bambeke et al. (2000) penggunaan antibiotika sebagai bahan tambahan pakan atau pangan akan menghasilkan masalah yang sulit dikendalikan.
11
Residu Antibiotika dalam Susu
Residu antibiotika adalah senyawa asal dan/atau metabolitnya yang terdapat dalam jaringan produk hewani dan termasuk residu hasil uraian lainnya dari antibiotika tersebut. Residu dalam bahan pangan meliputi senyawa asal yang tidak berubah, metabolit dan/atau konjugat lain. Beberapa metabolit obat diketahui bersifat kurang atau tidak toksik dibandingkan dengan senyawa asalnya, namun beberapa metabolit bersifat lebih toksik (Lukman 2010).
Menurut Rahayu (2010), senyawa yang masuk ke dalam tubuh, akan mengalami berbagai proses yang terdiri dari penyerapan (absorbsi), distribusi, metabolisme, dan eliminasi. Kecepatan proses biologis tersebut tergantung pada jenis, bentuk, cara masuk, dan metabolisme dari senyawa tersebut. Penyerapan terjadi di dalam saluran pencernaan yang sebagian besar dilakukan oleh usus, apabila bahan tersebut masuk melalui mulut. Senyawa asli maupun hasil metabolismenya akan dibawa oleh darah dan akan didistribusikan ke seluruh bagian tubuh setelah terjadi penyerapan. Metabolisme akan terjadi di dalam organ-organ tubuh, kemudian dieliminasi oleh alat-alat ekskresi, terutama ginjal dalam bentuk urin dan usus dalam bentuk feses.
Senyawa-senyawa dalam bentuk murni maupun metabolitnya akan tertinggal atau tertahan di dalam jaringan untuk waktu tertentu tergantung pada waktu henti senyawa tersebut atau metabolitnya. Kecepatan eliminasi obat pada ternak yang sehat akan jauh lebih cepat daripada pada ternak yang sakit. Saat keadaan tubuh lemah atau terdapat gangguan metabolisme, maka proses eliminasi obat akan terganggu. Timbunan senyawa atau metabolitnya di dalam tubuh akan terjadi apabila senyawa-senyawa tersebut diberikan dalam waktu yang lama (Rahayu 2010).
12
antibiotika tersebut. Waktu henti obat beberapa antibiotika disajikan dalam Tabel 6.
Tabel 6 Waktu henti obat beberapa jenis antibiotika (Bishop 2005) Jenis antibiotika Withdrawal time (jam)
Penisilin G menyebabkan masalah kesehatan dalam tubuh manusia antara lain dapat menimbulkan reaksi baik yang bersifat akut atau kronis (CDUFA 1999). Residu antibiotika dalam pangan dapat menimbulkan dampak terhadap kesehatan masyarakat bila dikonsumsi dalam waktu yang lama. Dampak tersebut dapat berupa toksikologis (residu antibiotika bersifat racun terhadap hati, ginjal dan pusat pembentukan darah), mikrobiologis (residu antibiotika akan mengganggu keseimbangan mikroflora didalam saluran pencernaan sehingga dapat mengganggu metabolisme tubuh), imunopatologis (yaitu residu antibiotika dapat menjadi faktor pemicu timbulnya reaksi alergi dari yang bersifat ringan sampai dengan berat dan bersifat fatal), dan menimbulkan gangguan pada sistem syaraf serta kerusakan jaringan (Donkor et al. 2011). Batas maksimum residu antibiotika dalam susu menurut SNI 01-6366-2000 (BSN 2000) disajikan dalam Tabel 7.
Tabel 7 Batas maksimum residu antibiotika dalam susu (SNI 01-6366-2000) Jenis antibiotika Batas maksimum residu
13
Metode Pengujian Residu Antibiotika
Metode pengujian residu antibiotika dapat berupa uji cepat (rapid test kit), uji tapis/ screening test (bioassay dan ELISA) dan uji konfirmasi (HPLC). Begitu banyak jenis uji yang ada, namun tidak ada satupun uji yang menjamin hasilnya paling baik (Wehr dan Frank 2004).
Uji cepat merupakan metode pengujian residu antibiotika yang tidak memakan waktu banyak dan mudah penggunaannya. Uji tapis pada umumnya merupakan uji kualitatif dan semi kuantitatif yang berfungsi untuk mengidentifikasi adanya residu antibiotika dengan cepat, mudah digunakan, dan relatif tidak mahal.
Bioassay merupakan pengujian yang menggunakan mikroorganisme untuk mendeteksi senyawa antibiotika yang masih aktif (BSN 2008). Menurut Eenennaam et al. (1993), spesifisitas bioassay ditunjukkan dari tipe golongan antibiotika yang dapat dideteksi dengan melihat hambatan pertumbuhan bakteri.
Enzyme linked immunosorbent assay (ELISA) merupakan uji tapis yang memiliki sensitifitas tinggi, sederhana, dan mampu menguji banyak sampel hanya dengan volume sampel yang sedikit (Wang et al. 2009).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian diawali dengan pengambilan sampel susu pasteurisasi impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta. Pengujian dilakukan di Balai Uji Terap Teknik dan Metode Karantina Pertanian (BUTTMKP), Balai Pengujian Mutu Produk Peternakan (BPMPP), dan Balai Besar Penelitian Veteriner (BBalitvet).
Penelitian dilaksanakan pada bulan Januari sampai dengan April 2012.
Alat dan Bahan
Pengujian Pendahuluan
Bahan yang digunakan adalah susu pasteurisasi impor, H2O2 0.5%, HCl paraphenilin diamine 2%, amonium sulfat jenuh (NH4)2SO4. Peralatan yang diperlukan adalah tabung reaksi, rak tabung reaksi, timbangan, tabung erlenmeyer.
Pengujian Bioassay
Bahan yang digunakan adalah susu pasteurisasi impor, mikroorganisme (Spora Bacillus stearothermophilus ATCC 7953), peptone (Difco 211677), yeast extract (Difco 212750), bacto agar (Difco 214010), dextrose (Difco 215530), natrium penisilin (Sigma P-7794), K2HPO4 (Merck 1.047831.000), Na2HPO4 (Merck 1.065860.500),aquadest, kertas cakram steril (diameter 8 mm). Peralatan yang diperlukan adalah cawan petri, tabung reaksi, tabung sentrifus, labu ukur, gelas ukur, erlenmeyer, pipet volumetrik, pengocok tabung, magnet pengaduk, pH meter, mikro pipet, jangka sorong, ose, dan pinset.
Pengujian HPLC
16
colum agilent ZORBAX Eclips Plus, 2.1 mm x 100 mm, 3.5 μm (p/n 59793-902), dan HPLC dengan diode array detector (Agilent Technologies, Inc, USA).
Rancangan Penelitian
Sampel yang diuji adalah susu pasteurisasi impor dari Australia melalui Pelabuhan Udara Soekarno-Hatta. Jumlah sampel yang diambil, dihitung dengan menggunakan rumus deteksi penyakit (detect disease) (Martin et al. 1987).
n = [1- (1-a) 1/D] [N-(D-1)/2] Keterangan :
N = Jumlah populasi n = Ukuran sampel
a = Tingkat kepercayaan (95%)
D = Nilai dugaan populasi yang sakit (D=PxN, dengan asumsi P:5%)
Seluruh sampel diuji dengan menggunakan metode bioassay secara triplo. Sampel yang menunjukkan hasil positif pada bioassay, dikonfirmasi dengan metode HPLC.
Metode Penelitian
Pengumpulan Sampel
Pengambilan sampel untuk penelitian ini dilakukan dengan cara mengambil susu pasteurisasi secara acak sederhana. Susu pasteurisasi impor setiap kedatangan diambil sebanyak 12 sampel, hingga jumlah sampel terpenuhi. Sebelum diuji, sampel disimpan dalam lemari pendingin suhu -20 °C.
Uji Pendahuluan
17
Uji Aschaffenburg atau uji kekeruhan dilakukan untuk mengetahui apakah susu telah mengalami proses pemanasan yang melebihi suhu pasteurisasi. Pada 20 mL sampel susu pasteurisasi ditambahkan 4 g amonium sulfat jenuh (NH4)2SO4 dan dikocok. Kemudian campuran tersebut disaring ke dalam tabung reaksi dan filtratnya dimasukkan dalam penangas air (mendidih) selama 5 menit. Filtrat yang jernih menyatakan tidak ada albumin dalam susu dan susu tersebut telah dipanaskan diatas titik didih susu (>100.16°C).
Uji Bioasay
Uji tapis untuk mendeteksi residu beta laktam dalam susu dilakukan dengan menggunakan metode bioassay. Uji ini untuk mendeteksi adanya residu antibiotika dengan cepat, mudah digunakan, dan relatif tidak mahal. Secara umum, tahapan pengujiannya terdiri dari persiapan, pengujian, dan pembacaan hasil. Persiapan, meliputi persiapan media agar, kultur media, larutan dapar, dan larutan baku.
Persiapan media agar, sebanyak 5 g peptone, 12 g yeast extract, 15-18 g bacto agar, 1 g dextrose, dilarutkan dalam 1000 mL aquadest, kemudian diukur pada pH 5.7±0.1 dan dididihkan. Media disterilisasi menggunakan autoklaf pada suhu 121 °C dengan tekanan 15 psi (pound per square inchi) selama 15 menit.
18
Pembuatan larutan dapar fosfat. Sebanyak 7 g K2HPO4, 6 g Na2HPO4, dilarutkan dalam 1000 mL aquadest, kemudian larutan disterilisasi menggunakan autoklaf pada suhu 121°C dengan tekanan 15 psi selama 15 menit.
Larutan baku untuk kontrol antibiotika. Standar penicillin ditimbang kemudian diencerkan dengan larutan dapar dari konsentrasi 1 000 IU/mL hingga 0.01 IU/mL. Larutan dengan konsentrasi 0.01 IU/mL digunakan sebagai larutan standar kerja.
Pengujian dengan bioassay. Sebanyak 10 mL sampel dimasukkan dalam tabung reaksi. Sementara itu, kultur media disiapkan dengan menuangkan 8 mL pada setiap cawan petri. Selanjutnya kertas cakram steril diletakkan di atas permukaan kultur media. Tiap cawan petri berisi 5 buah kertas cakram, yang terdiri dari 3 buah cakram yang masing-masing ditetesi 75 μL sampel yang akan
dianalisa, satu kertas ditetesi 75 μL larutan baku antibiotika 0.01 IU/mL sebagai
kontrol positif, dan satu kertas lagi ditetesi larutan dapar fosfat sebagai kontrol negatif. Cawan petri ditutup dan diinkubasi pada suhu 55 °C selama 16-18 jam. Pengujian sampel dilakukan dengan tiga kali pengulangan untuk mendapatkan data yang akurat.
Pembacaan hasil dilakukan dengan mengamati dan mengukur diameter zona hambatan yang terbentuk disekeliling kertas cakram menggunakan jangka sorong. Sampel dinyatakan positif mengandung antibiotika apabila zona hambat yang terbentuk ≥ 2 mm dari tepi kertas cakram. Sampel dinyatakan negatif apabila zona hambat yang terbentuk 0 – 2 mm. Karena zona hambat yang terbentuk < 2 mm dianggap akibat adanya natural inhibitor. Diameter zona hambatan pada kontrol positif sebesar 20 ± 1 mm, sedangkan kontrol negatif tidak membentuk zona hambat (SNI 2008).
Uji Konfirmasi (HPLC)
19
0.8 mL/menit, fase gerak (A: aquades/10 mM amonium asetat dan B: asetonitril), run time 12 menit, jeda 3 menit, suhu 180 °C, injeksi 50 μL.
Tahap persiapan: 5 mL susu dimasukkan dalam tabung sentrifus yang mempunyai tutup, ditambahkan 25 mL aquadest dan 4 mL H2SO4 0.17 M serta 4 mL Sodium Tungstad 5%, dihomogenkan selama 2 menit kemudian disentrifus dengan kecepatan 3.000 rpm selama 10 menit. Larutan supernatant dipisahkan dari residunya kemudian ditambahkan 10 mL NaCl 20% pada filtratnya.
Tahap pemurnian, yaitu ke dalam kartrid C18 dialirkan perlahan-lahan 10 mL metanol, 10 mL aquades, 10 mL NaCl 2%. Kemudian dialirkan sampel. Bilas kartrid C18 dengan mengalirkan 10 mL NaCl 2% dan 10 mL aquades.
Selanjutnya sampel di-elusi dengan 3 mL bufer fosfat 0.2 M dalam asetonitril (pelarut elusi penisilin). Hasil elutan kemudian dipindahkan ke dalam aliran gas nitrogen sampai kering. Residu disuspensikan kembali dengan 10 mL fase gerak (asetonitril 0.1%), kemudian divortex selama 2 menit dan dipindahkan ke dalam vial 2 mL untuk dimasukkan dalam alat HPLC.
Hasil dari pengujian dengan HPLC ditampilkan dalam bentuk kromatogram. Waktu dan volume retensi pada setiap senyawa ditunjukkan dengan munculnya beberapa puncak. Uji kualitatif dilakukan dengan mencocokkan waktu retensi masing-masing puncak pada kromatogram sampel dengan waktu retensi senyawa standar. Lebar dan tinggi puncak digunakan untuk menentukan besarnya konsentrasi diukur secara otomatis oleh alat pengolah data.
Analissis Data
HASIL DAN PEMBAHASAN
Perhitungan sampel berdasarkan jumlah susu pasteurisasi yang diimpor dari Australia pada tahun 2011 yaitu 39 570.90 kg, sehingga jumlah sampel yang diuji dalam penelitian ini sebanyak 59 dan digenapkan menjadi 60. Pengambilan sampel diperoleh secara bertahap yaitu 12 sampel pada setiap importasi/ kedatangan. Sebelum diuji, setiap sampel susu dibagi menjadi 3 bagian untuk selanjutnya disimpan dalam suhu beku -20 °C. Pembagian sampel menjadi 3 bagian diperuntukkan 2 jenis pengujian yaitu uji bioassay dan HPLC serta 1 bagian sebagai arsip. Sebelum dilakukan pengujian residu antibiotika, sampel susu terlebih dahulu diuji kesempurnaan pasteurisasi (uji Storch) dan diuji terhadap pemanasan sterilisasi (uji Aschaffenburg). Uji pendahuluan ini untuk memastikan bahwa susu yang diperiksa adalah susu pasteurisasi dan jenis pasteurisasinya.
Uji Pendahuluan
22
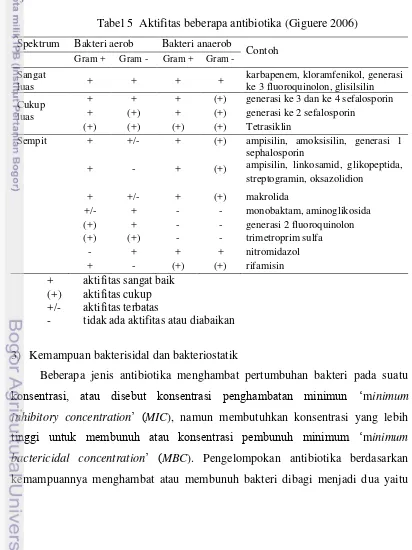
Gambar 2 Uji peroksidase, susu sterilisasi (A) warna putih, susu mentah (B) warna biru, dan susu pasteurisasi/ sampel (C) warna putih.
Uji Aschaffenburg merupakan uji kesempurnaan pemanasan proses sterilisasi ditandai dengan adanya warna jernih pada susu sterilisasi. Pengujian ini dimaksudkan untuk mengetahui keberadaan albumin dalam susu. Susu yang sudah disterilisasi dengan sempurna tidak lagi mengandung albumin dan akan menunjukkan warna jernih. Apabila proses sterilisasinya tidak sempurna, masih mengandung albumin dan warna yang ditunjukkan adalah keruh. Pada susu yang mengalami proses pemanasan melebihi suhu 81 oC akan mengalami kerusakan albumin yang merupakan bagian dari protein whey dan terkoagulasi oleh proses pemanasan tinggi (Buckle et al. 1987). Uji ini dilakukan untuk membuktikan apnck
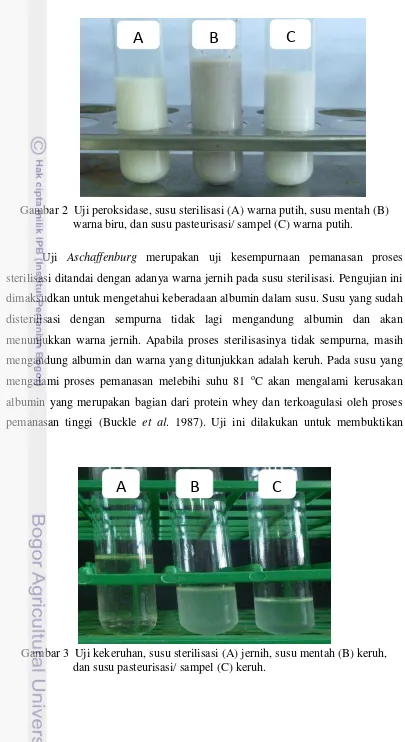
Gambar 3 Uji kekeruhan, susu sterilisasi (A) jernih, susu mentah (B) keruh, dan susu pasteurisasi/ sampel (C) keruh.
A
B
C
23
apakah sampel susu yang digunakan benar-benar susu pasteurisasi dan bukan susu sterilisasi. Hasil uji menunjukkan seluruh sampel berwarna keruh, hal ini menunjukkan bahwa susu yang digunakan tidak mengalami proses pemanasan di atas titik didih susu atau susu tersebut adalah susu pasteurisasi (Gambar 3).
Susu pasteurisasi adalah susu yang telah mengalami proses pemanasan sehingga mempunyai daya simpan lebih panjang dari susu mentah disertai musnahnya mikroorganisme patogen yang dapat mengganggu kesehatan konsumen (Hubbert dan Hagstad 1991). Penggunaan panas pada pasteurisasi tidak banyak menimbulkan perubahan pada komposisi dan rasa susu sehingga masih seperti susu segar (Kay 1962). Proses pasteurisasi yang diikuti langsung dengan pendinginan menjadikan daya simpan produk akan lebih lama dengan mutu yang lebih baik (Frazier dan Westhoff 1988). Pemanasan 72 °C selama 15 detik dengan suhu penyimpanan 1 sampai 2 °C mempunyai daya simpan mencapai 3 minggu, sedangkan pada suhu penyimpanan 4 sampai 7 °C daya simpan susu pasteurisasi hanya sampai 1 sampai 2 minggu. Kedua uji pendahuluan ini dilakukan untuk memastikan sampel susu yang digunakan dalam penelitian adalah benar-benar susu pasteurisasi dan bukan susu sterilisasi.
Bioassay
24
menggunakan jangka sorong yang dilakukan dengan mengukur diameter dari lingkaran zona tersebut pada setiap kertas cakram sampel. Suatu sampel dinyatakan positif apabila menunjukkan zona terang lebih besar atau sama dengan 2 mm dari diameter kertas cakram yang digunakan (setidaknya pada 2 cawan petri). Diameter kertas cakram adalah 8 mm, sehingga sampel dinyatakan positif apabila mempunyai diameter zona terang sebesar 10 mm.
Gambar 4 Hasil pengujian bioassay, kontrol positif (a), kontrol negatif (b), dan lainnya adalah sampel.
Uji residu antibiotika beta laktam dengan menggunakan uji bioassay menunjukkan tidak terbentuknya zona terang pada semua sampel. Hal ini menunjukkan bahwa tidak adanya kandungan antibiotika beta laktam dalam sampel susu pasteurisasi tersebut atau paling tidak konsentrasinya dibawah dari limit deteksi uji. Hasil pengujian residu antibiotika pada sampel dapat dilihat pada Gambar 4 dan Tabel 8.
Tabel 8 Hasil pemeriksaan residu antibiotika beta laktam dengan metode bioassay
Jml sampel Hasil pemeriksaan
60 (-) negative
Menurut Eenennaam et al. (1993), spesifitas dari metoda bioassay dapat ditunjukkan dari tipe golongan antibiotika yang dapat dideteksi dengan melihat hambatan pertumbuhan bakteri (B. stearothermophilus untuk golongan beta laktam) pada media agar. Limit deteksi bioassay terhadap golongan beta laktam
25
adalah 0.003 ppm. Limit deteksi ini masih dibawah batas maksimum residu yang telah ditetapkan oleh SNI 01-6366-2000 tentang batas cemaran dan residu antibiotika (0.1 ppm), hal ini menunjukkan bahwa metode bioassay dapat diandalkan untuk mendeteksi residu antibiotika dari golongan beta laktam.
Uji Konfirmasi (HPLC)
Uji konfirmasi dengan menggunakan metode HPLC dimaksudkan untuk mengkonfirmasi hasil dari pengujian bioassay. Dalam penelitian ini, meskipun hasil pengujian dengan bioassay seluruh sampel menunjukkan hasil negatif, akan tetapi tetap dilakukan peneguhan dengan uji HPLC untuk memastikan bahwa hasil nkknk
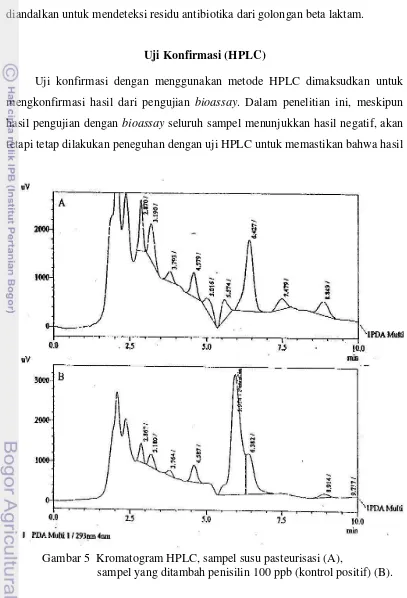
Gambar 5 Kromatogram HPLC, sampel susu pasteurisasi (A),
26
negatif dari uji bioassay benar-benar negatif. Hasil yang terlihat pada kromatogram HPLC pada sampel setelah dibandingkan dengan kromatogram pada standar (sampel yang ditambahkan penisilin) menunjukkan tidak adanya antibiotika penisilin (golongan beta laktam) pada sampel yang diuji (Gambar 5).
Gambaran Residu Beta Laktam dalam Susu Pasteurisasi
Susu pasteurisasi yang diuji kandungan residu beta laktam dengan metode bioassay dan HPLC menunjukkan hasil yang sama. Kedua metoda tidak menunjukkan adanya residu beta laktam pada susu pasteurisasi yang diimpor dari Australia atau dimungkinkan konsentrasi residu antibiotika pada sampel berada di bawah limit deteksi uji.Limit deteksi uji dari bioassaydan HPLC adalah sebesar 0.005 µg/mL, dimana angka ini masih berada dibawah batas maksimum residu antibiotika yang ditetapkan oleh pemerintah dalam SNI No. 01-6366-2000 yaitu sebesar 0.100 µg/mL.
Penentuan metoda uji untuk keperluan uji screening adalah uji yang mempunyai sensitifitas tinggi, karena semakin tinggi sensitiitas maka semakin kecil kemungkinan hasil negati palsu (Salman 2008). Screening test menggunakan bioassay dapat menjadi pilihan untuk penerapan di lapangan, karena mempunyai keunggulan yaitu mudah diaplikasikan, biayanya tidak terlalu mahal, pengerjaannya membutuhkan waktu yang tidak lama, sensitifitas dan spesifitasnya baik (Reig dan Toldra 2008).
27
terjadinya residu penisilin dalam susu. Harus diberikan perhatian khusus pada pengobatan dengan menggunakan antibiotika selama periode laktasi untuk meminimalkan resiko antibiotika dalam susu atau produknya.
Produk susu olahan temasuk susu pasteurisasi mempunyai resiko mengandung residu antibiotika. Menurut hasil penelitian Sudarwanto et al. (1992) bahwa 32.52% susu pasteurisasi dan 31.10% susu segar di wilayah Jakarta, Bogor, dan Bandung mengandung residu antibiotika dalam jumlah yang cukup tinggi. Tidak ditemukannya residu antibiotika dalam susu pasteurisasi yang diimpor dari Australia dalam penelitian ini menunjukkan bahwa sapi yang memproduksi susu tersebut dipelihara dengan memperhatikan good farming practice, termasuk prosedur dan dosis antibiotika yang digunakan untuk pengobatan serta diperhatikannya waktu henti obat dalam memproduksi susu untuk diproses menjadi susu pasteurisasi.
Haagsma (1988) menyatakan keberadaan residu antibiotika dalam bahan makanan yang berasal dari hewan berkaitan dengan aspek kesehatan masyarakat, aspek teknologi, dan aspek lingkungan. Ditinjau dari aspek teknologi, keberadaan residu antibiotik dalam bahan makanan dapat mengganggu atau menggagalkan proses fermentasi. Ditinjau dari aspek lingkungan, penggunaan obat pada ternak akan mencemari lingkungan karena senyawa asal obat atau metabolit akan diekskresikan melalui urin dan feses. Kemungkinan ancaman residu obat dalam bahan makanan terhadap kesehatan masyarakat adalah mutagenik, karsinogenik, dan imunosupresif.
Masalah keamanan pangan meliputi berbagai aspek mulai dari pangan dihasilkan hingga dikonsumsi. Masyarakat berhak mendapatkan pangan yang aman, sehat, utuh, dan halal (ASUH). Pangan dikatakan aman jika tidak ada bahan berbahaya dalam kandungannya, termasuk adanya residu beta laktam. Jaminan keamanan pangan di Indonesia menjadi tanggung jawab semua pihak dan tertuang dalam undang-undang no 7 tahun 1997 tentang Pangan.
28
SIMPULAN DAN SARAN
Simpulan
Tidak ditemukan adanya residu beta laktam pada seluruh sampel (n=60) susu pasteurisasi import dari Australia, baik dengan uji tapis (bioassay) maupun pada uji konfirmasi (HPLC). Terdapat kesesuaian hasil antara pengujian dengan uji tapis dan uji konfirmasi.
Saran
DAFTAR PUSTAKA
Abadi FSA, Lees P. 2000. Antibiotic treatment for animals: effect on bacterial population and dosage regimen optimization. Int J Antimicrob Agents 14: 307-313.
Admin. 2007. Penisilin dan penggunaannya dalam dunia veteriner. http:www.vet-indo.com [18 Februari 2011].
[BSN] Badan Standardisasi Nasional. 1995. SNI No. 01-3951-1995 tentang Susu pasteurisasi. Jakarta: Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. 2000. SNI No. 01-6366-2000 tentang batas maksimum cemaran mikroba dan batas maksimun residu dalam bahan makanan asal hewan. Jakarta: Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. 2008. SNI 7424. Tentang metode uji tapis (Screening Test) residu antibiotika pada daging, telur dan susu Secara Bioassay. Jakarta: Badan Standardisasi Nasional.
[BSN] Badan Standardisasi Nasional. 2011. SNI 3141.1. Susu Segar-bagian1: Sapi. Jakarta. Jakarta: Badan Standardisasi Nasional.
Bahri S, Indraningsih, Widiastuti R, Murdiati TB, Maryam R. 2002. Keamanan pangan asal ternak: suatu tuntutan di era perdagangan bebas. Wartazoa 12: 47-64.
Bambeke FV, Balzi E, Tulkens PM. 2000. Antibiotic Efflux Pumps. Biochem Pharmacol 60: 457-470.
Bezoen A, Haren WV, Hanekamp JC. 2000. Emergence of a Debate : AGPs and Public Health. Amsterdam: Heidelberg Appeal Nederland Foundation. p:19-75.
Bishop MY. 2005. The Veterinary Formula. Ed ke-6. Cambridge: Great Britain University Pr.
[CDUFA] Committee on Drug Use in Food Animals. 1999. The Use of Drugs in Food Animals: Benefits and Risk. Washington: CABI Publishing.
Buckle KA, Edward LA, Fleet GH, Wooton M. 1987. Ilmu Pangan. Edisi ke-2. terjemahan Purnomo & Adiono. Jakarta: UI Pr.
32
Donkor ES, Newman MJ, Tay SCK, Dayie NTKD, Bannerman E, Olu-Taiwo M. 2011. Investigation into the risk of exposure to antibiotics residu contaminating meat and egg in Ghana. Food Cont 22: 869-873.
Eenennaam ALV, Cullor JS, Perani L, Gardner IA, Smith WL, Dellinger J, Guterbock WM. 1993.Evaluation of milk antibiotic residue screening test in cattle with naturally occurring clinical mastitis. J Dairy Sci 76: 3041-3053.
[FDA] Food and Drug Administration. 2011. Pasteurization Marketing Ordinance (PMO) 2007 revisi. Washington DC.
Fagerquist KC, Lightfield AR. 2003. Confirmatory analysis of Beta-lactam antibiotics in kidney tissue by liquid chromatography/electrospray ionization selective reaction monitoring ion trap tandem mass spectrometry. Rapid Commu. Mass Spectrom 17: 660-671.
Fardiaz S. 1989. Mikrobiologi Pengolahan Pangan. Bogor: PAU Pangan dan Gizi, Institut Pertanian Bogor. Bogor.
Frazier WC, Westhoff DC. 1988. Food Microbiology. 4th ed. Singapore: Mc. Graw-Hill.
Gaman PM, Sherrington KB. 1992. Ilmu Pangan (Pengantar Ilmu Pangan, Nutrisi dan Mikrobiologi). Edisi ke-2. terjemahan Gardjito M, Narula S, Murdiati A, dan Surjono. Yogyakarta: Universitas Gadjah Mada Press.
Ghidini S, Zanardi E, Varisco G, Chizzolini R. 2002. Prevalence of molecules of Beta-lactam antibiotics in bovine milk in Lombardia and Emilia Romagna (Italy). Ann Fac Medic Vet di Parma 22: 245-252.
Giguere S. 2006. Antimicrobial Therapy in Veterinary Medicine. Iowa: Blackwell.
Gustiani E. 2009. Pengendalian Cemaran mikroba pada bahan pangan asal ternak (daging dan susu) mulai dari peternakan sampai dihidangkan. Jakarta: Litbang Pertanian 28: 96-100.
Gratzfeld-Hüsgen A, Schuster R. 2001. HPLC for Food Analysis. Berlin: Agilent Technologies Company.
Grunwald L, Petz M. 2003. Food processing effects on residues: penicillins in milk and yogurt. Analytica Chimica Acta 483: 73-79.
33
Haagsma N. 1988. Control of veterinary drug residurs in meat-a contribution to the development of analytical procedures. University of Utrecht. Netherlands.
Hidayat A. 2010. Manajemen Kesehatan Pemerahan. Bandung: Dinas Peternakan Bandung. Bandung.
Hobbs BC, Robert D. 1987. Food Poisoning and Food Hygiene. 5th ed. London: Edward Arnold.
Hubbert WT, Hagstad HV. 1991. Food Safety and Quality Assurance (Food of Animal Origin). Iowa: Iowa State University Press.
Kay HD. 1962. Pasteurization: Outlone of Procedure and Control. 27-267. In: Milk Hygiene. Genewa: World Hygiene Organization.
Lukman DW. 2010. Residu antibiotika dalam air susu sapi dan peternakan di Jakarta. http://Penelitian Kesehatan Masyarakat Veteriner/
residu-antibiotika-dalam-pangan-asal-hewan_16.html.[16 Juli 2010].
Martin SW, Meek AH, Willeberg P. 1987. Veterinary Epidemiology: Principles and Methods. Iowa: Iowa State University Pr.
Mitchell JM, Griffiths MW, McEwen SA, McNab WB, Yee AJ. 1998. Antimicrobial drug residues in milk and meat : causes, concerns, prevalence, regulations, tests and performance. J Food Prot 6: 742-756.
Muchtadi TR, Sugiono. 1992. Ilmu Pengetahuan bahan Pangan. Petunjuk Laboratorium. Bogor: PAU Pangan dan Gizi. Institut Pertanian Bogor.
Mutschler E. 1991. Dinamika Obat. Bandung: Penerbit ITB.
[NRA] National Registration Authority. 2000. Residues in Milk – antimicrobials. Australia.
Olsom J. 2003. Clinical Pharmacology Made Ridiculously Simple. Jakarta: EGC.
Pikkemat MG, Rapallini MLBA, Dijk SOV, Elferink JWA. 2009. Comparisson of three microbial screening methods for antibiotics using routine monitoring samples. Anal Chem Acta 637: 298-304
Rahayu ID. 2010. Jawa Barat pemasok susu terbesar nasional. Republika. http://www.republika.co.id [26 Mei 2011].
34
Reig M, Toldra F. 2008. Veterinary drug residue in meat: concern and rapid method for detection. Meat Sci 78: 60-67.
Riediker S, Rytz A, Richard S. 2004. Cold-temperature stability of five-lactam antibiotics in bovine milk and milk extracts prepared for liquid chromatography–electrospray ionization tandem mass spectrometry analysis. J ChromatogrA 1054: 359–363.
Salman M. 2008. Properties o screening and diagnostic test and issue related to gold standard. [bahan kuliah umum] Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. hlm 17-40.
Sanjaya AW. 1990. Pengamatan Kualitas Susu Pasteurisasi di DKI Jakarta, Bogor dan Bandung. Jurusan Sains Veteriner. Fakultas Pascasarjana. [tesis] IPB. Bogor.
Shammsipur M, Talebpour Z, Reza H, Tabatabaei S. 2002. Monitoring of Ampicillin and its related substances by NMR. J Phar Biomed Analy 30: 1075-1085.
Silva FVM, Gibbs PA. 2010. Non-proteolitic clostridium botulinum spores in low-acid cold-distributed food and design of pasteurization process. Trends Food Sci Technol 21: 95-105.
Sudarwanto M, Sanjaya W, Purnawarman T. 1992. Residu Antibiotika dalam Susu Pasteurisasi Ditinjau dari Kesehatan Masyarakat. Higiene dan Penyakit Ternak. Jakarta: Yayasan Obor Indonesia.
Syarief R, Halid H. 1997. Teknologi Penyimpanan Pangan. Bogor: Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Teuber M. 2001. Veterinary use and antibiotic resistance. Current Opinion Microbiol 4: 493-499.
Wang S, Xu B, Zhang Y, He JX. 2009. Development of enzyme-linked immunosorbent assay (ELISA) for the detection of neomisin residue in pig muscle, chicken muscle, egg, fish, and kidney. Meat Sci 82: 53-58.