EFEKTIVITAS SANITAISER KOMERSIAL UNTUK
MENGINAKTIVASI BAKTERI PATOGEN DAN BIOFILM
CYNTHIA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Efektivitas Sanitaiser Komersial Untuk Menginaktivasi Bakteri Patogen dan Biofilm adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2014
Cynthia
ABSTRAK
CYNTHIA. Efektivitas Sanitaiser Komersial Untuk Menginaktivasi Bakteri Patogen dan Biofilm. Dibimbing oleh RATIH DEWANTI-HARIYADI.
Penyakit bawaan pangan menjadi masalah kesehatan baik di negara maju maupun berkembang. Penyakit bawaan pangan adalah penyakit yang ditransmisikan melalui makanan dan disebabkan oleh bakteri patogen, bakteri pembusuk, virus, parasit atau kontaminan kimia. Tujuan penelitian ini adalah mengevaluasi efektivitas sanitaiser komersial untuk menginaktivasi bakteri patogen dan biofilm Salmonella Typhimurium dan Staphylococcus aureus. Sanitaiser komersial yang digunakan dalam penelitian ini adalah sanitaiser tunggal (quats, PAA) dan sanitaiser kombinasi (X, Y, Z). Hasil penelitian menunjukkan bahwa sanitaiser X dan Z pada konsentrasi 0.015 % merupakan sanitaiser yang paling efektif dalam mereduksi S. Typhimurium dan sanitaiser X pada konsentrasi 0.005 % merupakan sanitaiser yang paling efektif dalam mereduksi S. aureus.
Selain itu, hasil penelitian menunjukkan bahwa sanitaiser X merupakan sanitaiser yang paling efektif dalam mereduksi biofilm kedua bakteri uji dengan kisaran nilai reduksi sebesar 3.94-5.02 log CFU/cm2.
Kata kunci: penyakit bawaan pangan, sanitaiser komersial, patogen, biofilm
ABSTRACT
CYNTHIA. The Effectiveness of Commercial Sanitizers Against Pathogenic Bacteria and Biofilm. Supervised by RATIH DEWANTI-HARIYADI.
Foodborne diseases are considered an emergent public health problem in both developed and developing countries. It can be defined as diseases commonly transmitted through food and caused by pathogenic bacteria, spoilage bacteria, virus, parasite or chemical contaminants. The objective of this study is to evaluate the effectiveness of commercial sanitizers against pathogenic bacteria and biofilms Salmonella Typhimurium and Staphylococcus aureus. Commercial sanitizers used in this study are single sanitizers (quats, PAA) and combination sanitizers (X, Y, Z). The study shows that sanitizer X and Z in concentration 0.015 % are the most effective sanitizer against S. Typhimurium and sanitizer X in concentration 0.005 % is the most effective sanitizer against S. aureus. In addition, the study shows that sanitizer X is the most effective sanitizer against biofilm with the range of reduction is 3.94-5.02 log CFU/cm2.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
EFEKTIVITAS SANITAISER KOMERSIAL UNTUK
MENGINAKTIVASI BAKTERI PATOGEN DAN BIOFILM
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Efektivitas Sanitaiser Komersial Untuk Menginaktivasi Bakteri Patogen dan Biofilm
Nama : Cynthia NIM : F24090123
Disetujui oleh
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Pembimbing
Diketahui oleh
Dr Ir Feri Kusnandar, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala berkat dan kasih karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi dengan baik. Judul skripsi ini adalah “Efektivitas Sanitaiser Komersial Untuk Menginaktivasi Bakteri Patogen dan Biofilm”.
Selesainya kegiatan penelitian dan penyusunan skripsi ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Mama dan Papa tercinta yang telah dan selalu memberikan kasih sayang, semangat dan dukungan doa. Terima kasih juga kepada adik terkasih, Jordy, atas perhatian dan dukungan doanya.
2. Prof Dr Ir Ratih Dewanti-Hariyadi, MSc selaku dosen pembimbing skripsi dan pembimbing akademik yang selalu memberikan bimbingan, arahan, masukan, kepercayaan, dukungan moril dan materil bagi penulis sehingga karya ilmiah ini dapat diselesaikan dengan baik.
3. Dr Siti Nurjanah, STP MSi dan Dr Nur Wulandari, STP MSi selaku dosen penguji atas kesediaan waktu dan masukan yang membangun.
4. PT Kevin Chemindo Anugerah yang telah memberikan dukungan dana dan bahan dalam penelitian ini.
5. Seluruh staf pengajar Departemen Ilmu dan Teknologi Pangan yang telah memberikan ilmu dan bimbingan bagi penulis.
6. “Tim Biofilm” Dini, ka Yuda, ka Ian dan mba Desty atas semangat, dukungan, kegembiraan dan kebersamaan selama penelitian.
7. Sahabat-sahabat terkasih Mila, Dhini, Umi, Dian, Syarah, Haphiro, Ichi dan Rini atas dukungan, masukan, keceriaan dan kebersamaan selama penulis menjalani masa perkuliahan.
8. Teknisi Laboratorium Mikrobiologi SEAFAST CENTER, mba Ariyanti dan mas Yerris, yang telah memberikan masukan, dukungan dan semangat kepada penulis selama penelitian.
9. Teman-teman ITP 46 atas kebersamaan yang dilalui selama di ITP.
Semoga karya ilmiah ini bermanfaat dan dapat berkontribusi dalam memperkaya ilmu pengetahuan, terutama di bidang pangan. Terima kasih.
Bogor, Februari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
METODE 3
Bahan 3
Alat 3
Metode Penelitian 3
Prosedur Analisis Data 7
HASIL DAN PEMBAHASAN 7
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 21
DAFTAR TABEL
1 Karakteristik larutan stok sanitaiser komersial 8 2 Analisis statistik untuk reduksi S. Typhimurium dan S. aureus 12 3 Analisis statistik untuk reduksi densitas biofilm 15
DAFTAR GAMBAR
1 Tahapan penelitian 4
2 Reduksi S. Typhimurium oleh sanitaiser komersial tunggal 9 3 Reduksi S. aureus oleh sanitaiser komersial tunggal 9 4 Reduksi S. Typhimurium oleh sanitaiser komersial kombinasi 10 5 Reduksi S. aureus oleh sanitaiser komersial kombinasi 10
6 Reduksi densitas biofilm S. Typhimurium 15
7 Reduksi densitas biofilm S. aureus 15
DAFTAR LAMPIRAN
1 Konfirmasi S. Typhimurium pada pewarnaan Gram dan media selektif 21 2 Konfirmasi S. aureus pada pewarnaan Gram dan media selektif 21
3 Larutan stok sanitaiser komersial 21
4 Data jumlah dan log reduksi S. Typhimurium 22
5 Data jumlah dan log reduksi S. aureus 23
6 Perhitungan volume NB dan larutan stok sanitaiser komersial yang
diperlukan pada berbagai konsentrasi 24
7 Data densitas dan log reduksi densitas biofilm 24 8 Hasil analisis uji ANOVA dan Duncan untuk reduksi S. Typhimurium 25 9 Hasil analisis uji ANOVA dan Duncan untuk reduksi S. aureus 26 10 Hasil analisis uji ANOVA dan Duncan untuk reduksi biofilm
S. Typhimurium 27
PENDAHULUAN
Latar Belakang
Selama dua dekade terakhir, penyakit bawaan pangan (foodborne disease) menjadi masalah kesehatan baik di negara maju maupun negara berkembang (WHO 2007). Berdasarkan data Centers for Disease Control and Prevention
(CDC), jumlah kasus penyakit bawaan pangan yang terjadi di Amerika Serikat pada tahun 2009-2010 dilaporkan sebanyak 29,444 kasus orang sakit dan 23 kasus orang meninggal dunia (CDC 2013). Menurut Badan Pengawas Obat dan Makanan Republik Indonesia (BPOM RI), jumlah kasus penyakit bawaan pangan yang terjadi di Indonesia pada tahun 2011 dilaporkan sebanyak 6,901 kasus orang sakit dan 11 kasus orang meninggal dunia (BPOM 2012).
Penyakit bawaan pangan adalah penyakit akibat mengonsumsi pangan yang telah terkontaminasi oleh mikroba patogen, mikroba pembusuk, virus, parasit atau bahan kimia (WHO 2003). Kontaminasi dapat terjadi pada berbagai tahap, mulai dari tahap produksi pangan hingga konsumsi (“farm to fork”). Mikroba patogen yang berpotensi menyebabkan penyakit bawaan pangan, antara lain Salmonella,
Listeria monocytogenes, Escherichia coli O157:H7 dan Staphylococcus aureus
(CDNANZ 1997, WHO 2003). Sebagian besar kasus penyakit bawaan pangan yang terjadi di Amerika Serikat pada tahun 2009-2010 disebabkan oleh bakteri patogen, seperti Salmonella (243 kasus) dan Staphylococcus (19 kasus) (CDC 2013). Salmonella enterica serovar Enteritidis dan Typhimurium merupakan bakteri patogen yang paling umum menyebabkan penyakit bawaan pangan (Braden 2006). Selain Salmonella, Staphylococcus aureus merupakan salah satu bakteri yang sering menyebabkan penyakit bawaan pangan karena memproduksi enterotoksin (Loir et al. 2003).
Menurut US Food and Drug Administration (FDA) (2009), terdapat lima faktor utama penyebab penyakit bawaan pangan. Faktor-faktor tersebut antara lain pangan berasal dari sumber yang tidak aman, higiene personal yang kurang, proses pemasakan yang tidak tepat dari segi suhu dan waktu, penyimpangan suhu penyimpanan pangan (berada pada danger zone) dan kontaminasi dari peralatan. Berdasarkan data kasus penyakit bawaan pangan yang terjadi di Amerika Serikat, peralatan pangan yang terkontaminasi berkontribusi sebesar 16 % atau berada pada peringkat ketiga setelah penyimpangan suhu penyimpanan pangan (36 %) dan higiene pekerja yang kurang (19 %) (FDA 2009).
2
Untuk mencegah terjadinya penyakit bawaan pangan akibat kontaminasi mikroba pada peralatan pangan, perlu dilakukan upaya pembersihan dan sanitasi peralatan pangan. Pembersihan (cleaning) adalah penghilangkan cemaran atau kotoran dari permukaan area obyek (Roday 1999), sedangkan sanitasi adalah reduksi mikroorganisme sampai ke tingkat yang aman bagi kesehatan (BSN 2011). Sanitasi peralatan pangan umumnya dilakukan setelah pembersihan dan menggunakan sanitaiser food grade.
Sanitaiser adalah bahan kimia yang digunakan untuk menghambat atau mencegah pertumbuhan mikroba (Rossoni dan Gaylarde 2000). Sanitaiser dapat membunuh mikroba dengan berbagai cara, seperti bereaksi dengan dinding sel, bereaksi dengan membran sel yang mengakibatkan kebocoran sel, mengganggu replikasi DNA dan menginaktifkan enzim-enzim intraseluler (Denyer dan Steward 1998). Menurut Lawrence dan Bennet (2001), sanitaiser untuk peralatan yang kontak dengan pangan harus memenuhi beberapa persyaratan, yaitu memiliki spektrum aktivitas yang luas (efektif terhadap bakteri Gram negatif, Gram positif, kapang, kamir, virus dan parasit), mampu mereduksi mikroba sebanyak 99.999 % (5 log) dalam waktu 30 detik pada suhu 25 0C, tidak bersifat toksik, kompatibel dengan bahan kimia lain, tetap aktif baik sebelum maupun sesudah diencerkan dengan air sadah, ekonomis dan tidak merusak lingkungan. Efektivitas sanitaiser dipengaruhi oleh beberapa faktor, yaitu jumlah dan lokasi mikroorganisme, ketahanan mikroorganisme, waktu kontak, faktor kimia dan fisik (pH, suhu, RH, kesadahan air), keberadaan senyawa organik (lemak, karbohidrat, protein) dan biofilm (Rutala et al. 2008).
Industri pangan umumnya menggunakan berbagai jenis sanitaiser komersial untuk mensanitasi peralatan pangan. Jenis sanitaiser tunggal yang banyak digunakan oleh industri pangan adalah senyawa klorin, senyawa iodin, senyawa amonium kuaterner, asam organik, asam peroksi dan gabungan asam peroksi dengan asam organik (Simoes et al. 2010). Sanitaiser tunggal di atas telah disetujui oleh US FDA sebagai sanitaiser untuk peralatan yang kontak dengan pangan (CFR 2011). Selain sanitaiser tunggal, terdapat pula sanitaiser kombinasi. Oleh karena itu, perlu dilakukan evaluasi efektivitas sanitaiser komersial baik dalam bentuk tunggal maupun kombinasi untuk menginaktivasi bakteri patogen dan biofilm pada peralatan pangan yang terbuat dari bahan stainless steel.
Tujuan Penelitian
Tujuan penelitian ini adalah mengevaluasi efektivitas sanitaiser komersial baik dalam bentuk tunggal maupun kombinasi untuk menginaktivasi bakteri dan biofilm Salmonella Typhimurium dan Staphylococcus aureus.
Manfaat Penelitian
3
METODE
Bahan
Bakteri uji yang digunakan dalam penelitian ini adalah kultur Salmonella enterica serovar Typhimurium yang diisolasi dari udang (Dewanti-Hariyadi dan Hartini 2006) dan Staphylococcus aureus ATCC 25923. Kedua kultur diperoleh dari Laboratorium Patogen SEAFAST CENTER IPB.
Bahan yang digunakan adalah sanitaiser komersial dari PT Kevin Chemindo Anugerah, berupa sanitaiser tunggal (Quaternary Ammonium Compounds/quats,
Peracetic Acid/PAA) dan sanitaiser kombinasi (X, Y, Z). Sanitaiser X, Y dan Z mengandung 2 atau 3 komponen sanitaiser tunggal di atas dengan proporsi tertentu. Sanitaiser X mengandung komponen aktif quats, PAA dan coconut fatty acid; sanitaiser Y mengandung komponen aktif quats, PAA dan bahan pembersih asam; dan sanitaiser Z mengandung komponen aktif quats dan PAA. Selain itu, bahan lainnya yang digunakan adalah cotton bud, tusuk gigi, aluminium foil, pelat
stainless steel tipe 304 berukuran 1x1 cm yang diperoleh dari CV Halilintar Mekanika, akuades, spiritus, alkohol 70 %, kristal violet, lugol, alkohol 96 %, safranin, minyak imersi, KH2PO4, CaCl2, H2SO4 pekat, BaSO4, deterjen komersial, Tween 80 (Merck), Na-heksametafosfat (Sigma Aldrich) dan kalsium alginat (Sigma Aldrich).
Media yang digunakan adalah Tryptone Soy Agar/TSA (Oxoid), Tryptone Soy Broth/TSB (Oxoid), Nutrient Broth/NB (Oxoid), Brain Heart Infusion/BHI
Broth (Oxoid), Xylose Lysine Deoxycholate Agar/XLDA (Oxoid), Triple Sugar Iron Agar/TSIA (Difco), Lysine Iron Agar/LIA (Difco), Baird Parker Agar/BPA dan buffer penetralisasi Letheen Broth (Scharlau).
Alat
Alat yang digunakan dalam penelitian ini adalah tabung reaksi, erlenmeyer, gelas piala, labu takar, cawan petri, bunsen, jarum ose bulat, jarum ose tusuk, pipet tetes, pipet mohr, sudip, pinset, kaca preparat, gelas objek, mikroskop, mikropipet, tips, neraca analitik, autoklaf, oven, sentrifuse, spektrofotometer, inkubator goyang, inkubator 37 0C, inkubator 55 0C, hot plate, magnetik stirer, vortex dan refrigerator.
Metode Penelitian
4
Gambar 1 Tahapan penelitian Konfirmasi Kultur Bakteri Uji
Kultur bakteri uji diterima dalam bentuk kering beku dalam ampul gelas. Sebelum digunakan, kultur awetan tersebut disegarkan terlebih dahulu pada media BHI Broth. Sebanyak 1 mL medium BHI Broth dipipet secara aseptik ke dalam ampul. Campuran tersebut kemudian diinokulasikan dalam 5 mL medium BHI
Broth dan diinkubasi pada suhu 37 0C selama 24 jam. Setelah kultur berumur 24 jam, sebanyak 1 ose kultur tersebut diinokulasikan dalam medium TSA miring dan diinkubasi pada suhu 37 0C selama 24 jam. Kultur ini digunakan sebagai kultur stok dan disegarkan setiap dua minggu sekali. Uji kemurnian atau konfirmasi kultur Salmonella Typhimurium dilakukan dengan pewarnaan Gram dan menumbuhkan kultur pada media selektif XLDA, TSIA dan LIA (FDA 2011), sedangkan uji kemurnian Staphylococcus aureus dilakukan dengan pewarnaan Gram dan menumbuhkan kultur pada media selektif BPA yang telah ditambahkan
egg yolk tellurite (FDA 2001).
Persiapan Inokulum (modifikasi Yuliatin 2008)
Sebanyak 1 ose kultur pada TSA miring diinokulasikan dalam medium TSB dan diinkubasi pada suhu 37 0C selama 24 jam sehingga diperoleh kultur dengan populasi sekitar 109 CFU/mL. Setelah diinkubasi, kultur tersebut diencerkan dengan larutan fisiologis KH2PO4 hingga pengenceran 10-4. Sebanyak 1 mL kultur dengan populasi 104 CFU/mL kemudian diinokulasikan dalam 9 mL medium TSB sehingga diperoleh kultur sebanyak 103 CFU/mL. Kultur tersebut kemudian diinkubasi pada suhu 37 oC hingga mencapai fase akhir log atau diperkirakan populasi kultur mencapai 109 CFU/mL. Berdasarkan penelitian Hartini (2005),
S. Typhimurium mencapai fase akhir log setelah diinkubasi selama 20 jam dan berdasarkan penelitian Dwintasari (2010), S. aureus mencapai fase akhir log setelah diinkubasi selama 24 jam. Bakteri yang digunakan untuk uji aktivitas antibakteri harus berada pada fase akhir log karena pada fase tersebut biasanya sel
Dua sanitaiser komersial terpilih Tahap I :
1. Konfirmasi kultur bakteri uji 2. Persiapan inokulum
3. Persiapan larutan stok sanitaiser komersial
4. Uji efektivitas 5 jenis sanitaiser komersial terhadap bakteri patogen
Tahap II :
1. Persiapan inokulum bakteri uji
2. Persiapan larutan sanitaiser komersial 3. Persiapan pelat stainless steel
4. Pembentukan biofilm pada pelat stainless steel
5 melakukan adaptasi terhadap kondisi lingkungan yang kurang menguntungkan dimana laju metabolisme sel akan menurun agar nutrien yang terbatas tersebut tidak cepat habis sehingga sel akan memiliki resistensi tertinggi terhadap senyawa antibakteri (Purwoko 2009).
Setelah fase akhir log tercapai, kultur dipanen dengan cara disentrifus dingin pada suhu 4 oC, kecepatan 3500 rpm selama 15 menit untuk memisahkan massa sel dengan medium pertumbuhan. Bagian supernatan dibuang, sedangkan bagian endapan ditambahkan 9 mL larutan fisiologis sehingga diperoleh kultur dengan populasi sebanyak 109 CFU/mL. Kultur tersebut kemudian dibandingkan kekeruhannya dengan larutan standar McFarland 0.5 pada kertas warna putih yang diberi garis hitam sebagai kontras. Larutan standar McFarland 0.5 diasumsikan setara dengan populasi kultur sebanyak 1-2x108 CFU/mL (CLSI 2012). Kultur yang telah setara kekeruhannya dengan larutan standar McFarland 0.5 kemudian diencerkan hingga diperoleh populasi kultur sebanyak 107 CFU/mL.
Persiapan Larutan Standar McFarland 0.5 (CLSI 2012)
Sebanyak 0.5 mL BaCl2 1.175 % dicampur dengan 99.5 mL H2SO4 1 % dan diukur nilai OD (Optical Density) pada panjang gelombang 625 nm. Nilai OD-nya harus berada pada kisaran 0.08-0.13. Larutan standar ini dapat disimpan selama enam bulan pada suhu ruang dan dalam kondisi ruang yang gelap.
Persiapan dan Karakterisasi Larutan Stok Sanitaiser Komersial
Sanitaiser komersial diterima dalam bentuk cair dan dibuat larutan stoknya pada konsentrasi 1 %. Pelarut yang digunakan adalah akuades. Larutan stok sanitaiser komersial kemudian diamati karakteristik fisiknya secara visual.
Uji Efektivitas Sanitaiser Komersial Terhadap Bakteri Patogen dengan Metode MIC (modifikasi Puro 2012)
Sebanyak 6 buah tabung reaksi disiapkan, 1 buah tabung untuk kontrol positif dan 5 buah tabung untuk sampel uji. Medium NB, larutan stok sanitaiser komersial dan kultur bakteri ditambahkan secara berurutan ke dalam tabung reaksi. Untuk memperoleh larutan sanitaiser komersial dengan konsentrasi tertentu, sejumlah larutan stok sanitaiser dipipet secara aseptik ke dalam tabung reaksi yang sudah berisi sejumlah medium NB. Perhitungan jumlah larutan stok sanitaiser komersial yang diperlukan (Lampiran 6) menggunakan rumus pengenceran sebagai berikut.
M1 x V1 = M2 x V2 Keterangan:
M1 = konsentrasi larutan stok sanitaiser komersial (%) M2 = konsentrasi sanitaiser komersial yang diinginkan (%)
V1 = volume larutan stok sanitaiser komersial yang diperlukan (mL) V2 = volume total campuran NB, sanitaiser dan kultur bakteri (mL)
6
itu, dilakukan pengenceran serial dan pemupukan dengan metode tuang menggunakan medium TSA serta diinkubasi selama 48 jam pada suhu 37 0C. Untuk tabung kontrol positif, dilakukan pemupukan saat kontak 0 dan 24 jam. Koloni yang terbentuk dihitung dan dilaporkan sebagai colony forming unit per mL (CFU/mL). Perhitungan penurunan/reduksi jumlah bakteri uji menggunakan rumus berikut.
= log CFU/mL kontrol – log CFU/mL perlakuan
Persiapan Pelat Stainless Steel dan Swab Kalsium Alginat
Pelat SS tipe 304 berukuran 1x1 cm diberi tanda pada salah satu bagian sisinya agar dapat terdeteksi bila pelat terbalik saat pengambilan sampel. Pelat tersebut direndam dalam larutan deterjen komersial selama 1 jam, disikat, dibilas dengan akuades dan dicelupkan dalam alkohol 70 %. Pelat SS yang telah dibersihkan kemudian dikeringkan dalam oven bersuhu 55 0C sampai pelat benar-benar kering dan disterilisasi dalam autoklaf pada suhu 121 0C selama 15 menit (modifikasi Marques et al. 2007).
Swab kalsium alginat dibuat dengan cara menyambungkan tusuk gigi dan
cotton bud, kemudian swab direndam dalam larutan alginat 1 %, direndam dalam CaCl2.2H2O 1 % dan disterilisasi pada suhu 121 0C selama 15 menit (modifikasi Yunus 2000).
Pembentukan Biofilm dan Uji Efektivitas Sanitaiser Komersial Terpilih Terhadap Biofilm (modifikasi Dewanti-Hariyadi 1995)
Sebanyak 1 mL kultur kerja dengan populasi sekitar 107 CFU/mL diinokulasikan dalam erlenmeyer 300 mL yang berisi 100 mL medium 1/5 TSB dan 10 buah pelat SS sehingga diperoleh jumlah awal bakteri sekitar 105 CFU/mL. Erlenmeyer tersebut kemudian diinkubasi dalam inkubator bergoyang pada suhu kamar (28-30 0C), kecepatan 70 rpm selama 48 jam. Pelat SS yang mengandung biofilm berumur 48 jam kemudian diambil secara aseptik dengan pinset dan dikontakkan dengan 10 mL larutan sanitaiser komersial pada konsentrasi tertentu selama 2 menit di dalam cawan petri steril (dua buah pelat untuk setiap perlakuan). Pelat SS kemudian dikontakkan dengan 10 mL buffer penetralisasi letheen broth
7 Perhitungan densitas biofilm yang terbentuk menggunakan rumus berikut.
Keterangan:
N = total densitas biofilm
C = jumlah seluruh koloni yang dihitung n1 = jumlah cawan pada pengenceran pertama n2 = jumlah cawan pada pengenceran kedua d = pengenceran pertama atau yang terkecil
Prosedur Analisis Data
Seluruh data hasil penelitian disajikan dalam bentuk x ± SD dan diolah secara statistik menggunakan program SAS (Statistical Analysis Software) versi 9.1 dengan uji ANOVA (Analysis of Variance) yang dilanjutkan dengan uji berbeda nyata Duncan pada taraf signifikansi 95 %.
HASIL DAN PEMBAHASAN
Konfirmasi Kultur S. Typhimurium dan S. aureus
S. Typhimurium dan S. aureus yang digunakan dalam pengujian terlebih dahulu diuji kemurniannya. Uji kemurnian atau konfirmasi bertujuan untuk mengetahui bahwa bakteri uji yang digunakan tidak terkontaminasi dengan bakteri lain. Konfirmasi kultur S. Typhimurium dilakukan dengan pewarnaan Gram dan menggunakan media selektif XLDA, TSIA dan LIA, sedangkan konfirmasi kultur
S. aureus dilakukan dengan pewarnaan Gram dan menggunakan media selektif BPA yang telah ditambahkan egg yolk tellurite.
Dari Lampiran 1, terlihat hasil pewarnaan Gram kultur S. Typhimurium adalah sel berwarna merah (Gram negatif) dan berbentuk batang dengan penataan bergerombol. Selain itu, terlihat pula koloni yang tumbuh pada ketiga media selektif merupakan koloni tipikal, yaitu koloni yang tumbuh pada media XLDA berwarna pink dengan titik hitam dibagian tengah yang lebih dominan; koloni yang tumbuh pada media TSIA berwarna merah (hasil goresan) dan kuning (hasil tusukan) serta memproduksi H2S (berwarna hitam); koloni yang tumbuh pada media LIA berwarna ungu (hasil goresan dan tusukan), memproduksi H2S (berwarna hitam) dan tidak memproduksi gas. Kedua hasil di atas menunjukkan bahwa bakteri uji merupakan S. Typhimurium (FDA 2011, Fardiaz 1989).
8
Karakteristik Larutan Stok Sanitaiser Komersial
Tabel 1 menunjukkan karakteristik dari kelima larutan stok sanitaiser komersial dengan parameter warna, aroma dan busa. Larutan stok quats berwarna bening, tidak beraroma dan menghasilkan busa yang sangat banyak. Quats umumnya digunakan untuk mensanitasi lantai, dinding dan peralatan pangan yang tidak membutuhkan tahap pembilasan (Giese 1991). Larutan stok PAA berwarna bening, beraroma sangat asam karena terbentuk dari reaksi penggabungan antara hidrogen peroksida dengan asam asetat (FDA 1986) dan menghasilkan busa yang sedikit. PAA dapat diaplikasikan tanpa tahap pembilasan (Srey et al. 2012). Larutan stok sanitaiser X berwarna bening, tidak beraroma dan menghasilkan busa yang sangat banyak. Hal ini disebabkan komponen aktif paling dominan penyusun sanitaiser ini adalah quats dengan komposisi tertentu. Larutan stok sanitaiser Y berwarna bening, tidak beraroma dan menghasilkan busa yang banyak. Larutan stok sanitaiser Z berwarna bening, beraroma asam dan menghasilkan busa yang agak banyak. Hal ini disebabkan komponen aktif paling dominan penyusun sanitaiser ini adalah PAA dengan komposisi tertentu.
Pengaruh Sanitaiser Komersial Terhadap Bakteri Patogen
Pengukuran aktivitas antibakteri dari sanitaiser komersial uji dilakukan dengan metode MIC. MIC atau konsentrasi minimum penghambatan merupakan salah satu faktor penting dalam memilih suatu sanitaiser karena menunjukkan efektivitas sanitaiser dalam mereduksi mikroba (Andrew 2001). Dari Gambar 2, Gambar 3, Gambar 4 dan Gambar 5 terlihat jumlah log S. Typhimurium dan
S. aureus yang tereduksi akibat aktivitas antibakteri dari sanitaiser komersial yang diuji. Konsentrasi sanitaiser komersial yang digunakan adalah 0.005, 0.010, 0.015, 0.020 dan 0.025 %. Pemilihan kisaran konsentrasi di atas mengacu pada konsentrasi sanitaiser yang umumnya digunakan pada peralatan pangan, yaitu 200 ppm untuk quats dan 150-200 ppm untuk PAA (Gaulin et al. 2011).
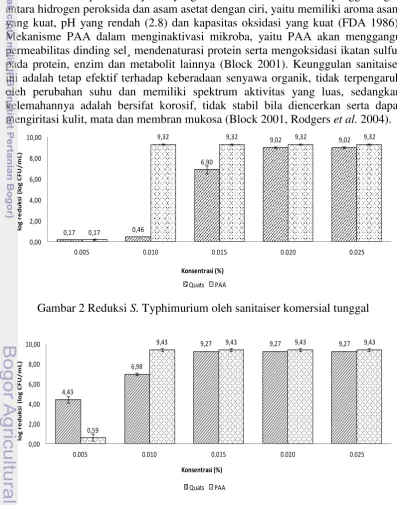
Gambar 2 dan Gambar 3 menunjukkan jumlah log S. Typhimurium dan
S. aureus yang tereduksi oleh dua jenis sanitaiser komersial tunggal. Dari Gambar 2, terlihat bahwa pada kisaran konsentrasi yang diaplikasikan, quats mampu mereduksi 0.17-9.02 log CFU/mL dan PAA mampu mereduksi 0.17-9.32 log CFU/mL S. Typhimurium. Selain itu, quats mampu mereduksi 4.43-9.27 log
Tabel 1 Karakteristik larutan stok sanitaiser komersial Sanitaiser Pelarut Parameter larutan stok sanitaiser
9 CFU/mL dan PAA mampu mereduksi 0.59-9.43 log CFU/mL S. aureus (Gambar 3). Dari Gambar 2 dan Gambar 3 terlihat pula bahwa sanitaiser tunggal yang lebih efektif dibandingkan quats dalam mereduksi S. Typhimurium dan S. aureus
karena konsentrasi yang dibutuhkan lebih rendah.
PAA merupakan senyawa yang dibentuk melalui reaksi penggabungan antara hidrogen peroksida dan asam asetat dengan ciri, yaitu memiliki aroma asam yang kuat, pH yang rendah (2.8) dan kapasitas oksidasi yang kuat (FDA 1986). Mekanisme PAA dalam menginaktivasi mikroba, yaitu PAA akan menggangu permeabilitas dinding sel¸ mendenaturasi protein serta mengoksidasi ikatan sulfur pada protein, enzim dan metabolit lainnya (Block 2001). Keunggulan sanitaiser ini adalah tetap efektif terhadap keberadaan senyawa organik, tidak terpengaruh oleh perubahan suhu dan memiliki spektrum aktivitas yang luas, sedangkan kelemahannya adalah bersifat korosif, tidak stabil bila diencerkan serta dapat mengiritasi kulit, mata dan membran mukosa (Block 2001, Rodgers et al. 2004).
0,17 0,46
Gambar 2 Reduksi S. Typhimurium oleh sanitaiser komersial tunggal
4,43
10
Gambar 4 Reduksi S. Typhimurium oleh sanitaiser komersial kombinasi
9,29 9,29 9,29 9,29 9,29
Gambar 5 Reduksi S. aureus oleh sanitaiser komersial kombinasi
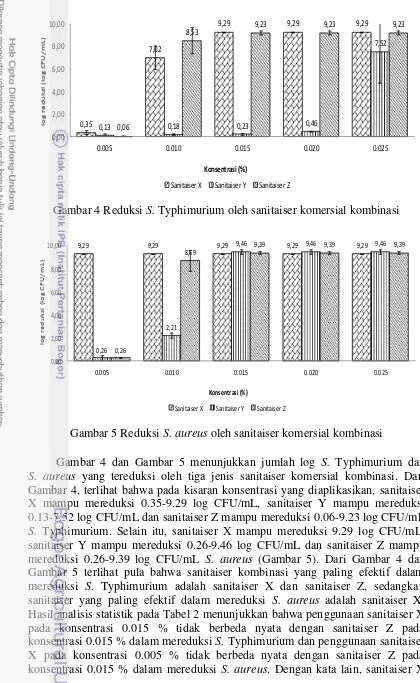
Gambar 4 dan Gambar 5 menunjukkan jumlah log S. Typhimurium dan
S. aureus yang tereduksi oleh tiga jenis sanitaiser komersial kombinasi. Dari Gambar 4, terlihat bahwa pada kisaran konsentrasi yang diaplikasikan, sanitaiser X mampu mereduksi 0.35-9.29 log CFU/mL, sanitaiser Y mampu mereduksi 0.13-7.52 log CFU/mL dan sanitaiser Z mampu mereduksi 0.06-9.23 log CFU/mL
11 sama efektifnya dengan sanitaiser Z dalam mereduksi S. Typhimurium, tetapi lebih efektif dibandingkan sanitaiser Z dalam mereduksi S. aureus karena konsentrasi yang dibutuhkan lebih rendah.
Menurut Lehmann (1988), kombinasi yang dilakukan antar sanitaiser dapat memberikan tiga jenis pengaruh, yaitu sinergis, additive dan antagonis. Pengaruh sinergis terjadi jika dengan kemampuan membunuh mikroba yang sama, konsentrasi sanitaiser kombinasi yang digunakan lebih rendah dibandingkan konsentrasi sanitaiser yang digunakan secara individu, sedangkan pengaruh antagonis terjadi jika sanitaiser yang satu menghambat kerja sanitaiser lainnya. Pengaruh sinergis diduga terdapat pada sanitaiser X. Hal ini didukung dengan hasil analisis statistik pada Tabel 2 yang menunjukkan bahwa penggunaan sanitaiser X pada konsentrasi 0.005 % tidak berbeda nyata dengan quats pada konsentrasi 0.015 % dan PAA pada konsentrasi 0.010 % dalam mereduksi
S. aureus. Dengan kata lain, sanitaiser X lebih efektif dibandingkan quats dan PAA dalam mereduksi S. aureus karena konsentrasi yang dibutuhkan lebih rendah. Sanitaiser X tersusun atas komponen aktif quats, PAA dan coconut fatty acid. Coconut fatty acid ditambahkan dalam jumlah yang sedikit dengan tujuan untuk coating sehingga akan memperlambat penguapan PAA. Berdasarkan MSDS (Material Safety Data Sheet) (2009), suhu penyimpanan PAA tidak boleh diatas 86 0F atau 30 0C karena suhu tinggi dapat menyebabkan dekomposisi.
Sanitaiser Y tersusun atas komponen aktif quats, PAA dan bahan pembersih asam. Tujuan penambahan asam pada sanitaiser Y adalah untuk menjadikan sampel ini sebagai produk “2 in 1”, artinya produk ini selain berfungsi sebagai
sanitaiser, juga berfungsi sebagai bahan pembersih. Dari Gambar 4 dan Gambar 5, terlihat bahwa sanitaiser Y kurang efektif dalam mereduksi S. Typhimurium dan
S. aureus. Penambahan asam menyebabkan efektivitas quats (salah satu komponen penyusun) menjadi berkurang sehingga efektivitas sanitaiser Y pun menjadi berkurang. Marriott (1999) menjelaskan efektivitas quats berkurang pada pH kurang dari 6.
Tabel 2 menunjukkan jumlah log S. Typhimurium dan S. aureus yang tereduksi oleh lima jenis sanitaiser komersial serta hasil analisis data tersebut secara statistik. Dari Tabel 2 terlihat bahwa dari kelima jenis sanitaiser komersial yang diuji, PAA pada konsentrasi 0.010 % paling efektif dalam mereduksi
S. Typhimurium dan S. aureus dengan nilai log reduksi masing-masing sebesar 9.32 log CFU/mL dan 9.43 CFU/mL. Walaupun PAA pada konsentrasi tersebut mampu mereduksi S. Typhimurium paling banyak, hasil analisis statistik pada Tabel 2 menunjukkan bahwa penggunaan PAA pada konsentrasi 0.010 % tidak berbeda nyata dengan quats pada konsentrasi 0.020 %, sanitaiser X pada konsentrasi 0.015 % dan sanitaiser Z pada konsentrasi 0.015 % dalam mereduksi
S. Typhimurium. Hal di atas berlaku juga untuk reduksi S. aureus dimana hasil analisis statistik menunjukkan bahwa penggunaan PAA pada konsentrasi 0.010 % tidak berbeda nyata dengan quats pada konsentrasi 0.015 %, sanitaiser X pada konsentrasi 0.005 % dan sanitaiser Z pada konsentrasi 0.015 % dalam mereduksi
12
Tabel 2 Analisis statistik untuk reduksi S. Typhimurium dan S. aureus
Sanitaiser
Data yang diikuti huruf sama pada kolom sama tidak berbeda nyata pada uji Duncan taraf 0.05
13 LaGrange 1991), sedangkan kelemahannya adalah efektivitas berkurang pada pH kurang dari 6, tidak kompatibel dengan deterjen anionik dan tidak dapat membunuh spora bakteri (hanya menghambat pertumbuhan) (Marriott 1999).
Dari Tabel 2, terlihat pula bahwa S. aureus lebih peka terhadap kelima sanitaiser komersial dibandingkan S. Typhimurium. Hal ini ditunjukkan dari nilai log reduksi S. aureus yang lebih besar dan konsentrasi sanitaiser komersial yang dibutuhkan untuk mereduksi S. aureus lebih rendah. S. aureus lebih peka terhadap sanitaiser karena bakteri Gram positif memiliki dinding sel yang sebagian besar tersusun atas lapisan peptidoglikan dan asam teikoat sehingga mudah dilewati oleh komponen yang bersifat hidrofilik, sedangkan bakteri Gram negatif memiliki dinding sel yang lebih kompleks karena terdapat membran luar yang melindungi lapisan peptidoglikan, yaitu lipopolisakarida (LPS) (Purwoko 2009). Suliantari (2009) menjelaskan bahwa perbedaan struktur dinding sel berpengaruh pada ketahanan mikroba terhadap perlakuan bahan antimikroba dan bagian penting dari dinding sel adalah lapisan peptidoglikan. Lapisan in berfungsi untuk melindungi sel bakteri dari perubahan kondisi lingkungan dan faktor-faktor luar yang dapat menyebabkan kerusakan membran sel dan akhirnya mengakibatkan kematian sel. Suliantari (2009) juga menjelaskan bahwa pada bakteri Gram positif, senyawa antimikroba dapat langsung masuk dan mengisi lapisan peptidoglikan, kemudian berikatan dengan protein dan selanjutnya menyebabkan sel bakteri mengalami lisis, sedangkan pada bakteri Gram negatif, senyawa antimikroba masuk melalui porin yang terdapat pada lapisan luar (LPS), kemudian masuk ke lapisan peptidoglikan dan membentuk ikatan dengan protein. Oleh karena itu, bakteri Gram positif lebih mudah diinaktivasi dibandingkan bakteri Gram negatif.
Berdasarkan hasil analisis statistik pada Tabel 2, ditetapkan bahwa sanitaiser X dan sanitaiser Z akan digunakan pada tahap selanjutnya untuk mereduksi biofilm. Sanitaiser X dan sanitaiser Z dipilih karena kedua sanitaiser ini merupakan sanitaiser kombinasi. Lehmann (1988) menjelaskan bahwa sanitaiser kombinasi memiliki beberapa manfaat, yaitu dapat memperluas spektrum aktivitas antimikroba sehingga spektrum tertentu yang tidak dapat dipenuhi oleh suatu sanitaiser akan dipenuhi oleh sanitaiser lainnya dan dapat menghasilkan pengaruh sinergis.
Pengaruh Sanitaiser Komersial Terhadap Biofilm
Sebelum dilakukan uji efektivitas sanitaiser komersial terhadap biofilm
S. Typhimurium dan S. aureus, terlebih dahulu dilakukan pembentukan biofilm. Costerton et al. (1995) mendeskripsikan biofilm sebagai sel-sel mikroorganisme yang menempel pada permukaan dan terperangkap di dalam polimer ekstraseluler (EPS/extracellular polymeric substances) yang diproduksi oleh mikroba tersebut. EPS dapat tersusun atas polisakarida, protein, fosfolipid, lipid dan asam nukleat (Jahn dan Nielsen 1998, Sutherland 2001). Menurut Tsuneda et al. (2003), komponen utama penyusun EPS adalah protein dan polisakarida (75-89 %). Faktor-faktor yang memengaruhi pembentukan biofilm adalah strain bakteri, karakteristik permukaan bahan dan bakteri, serta dan kondisi lingkungan (nutrisi, pH, suhu) (Chae dan Schraft 2000, Donlan 2002).
14
yang paling umum digunakan sebagai bahan peralatan di industri pangan (kontainer, pipa, dll) (Faille dan Carpentier 2009). Pemilihan media pertumbuhan biofilm mengacu pada penelitian Yunus (2000) yang menunjukkan bahwa densitas biofilm yang terbentuk pada pelat SS dengan media 1/5 TSB lebih banyak dibandingkan pada media TSB. Pemilihan waktu inkubasi mengacu pada penelitian Meira et al. (2012) yang menunjukkan bahwa waktu inkubasi yang ideal untuk membentuk biofilm adalah 48 jam. Berdasarkan penelitian Meira et al.
(2012), diketahui bahwa jumlah biofilm S. aureus strain S28 yang terbentuk pada pelat SS setelah diinkubasi selama 24 jam sekitar 4.0 log CFU/cm2, setelah diinkubasi selama 48 jam sekitar 5.0 log CFU/cm2 dan setelah diinkubasi selama 72 jam sekitar 3.9 log CFU/cm2. Ronner dan Wong (1993) menjelaskan bahwa dibutuhkan minimum 5.0-6.0 log CFU/cm2 untuk membentuk biofilm.
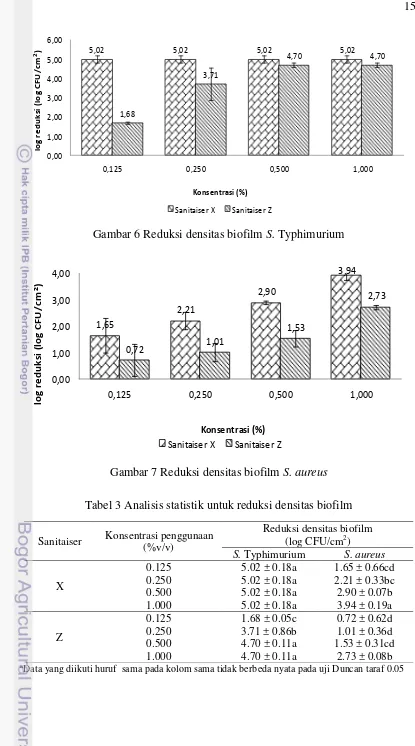
Gambar 6 dan Gambar 7 menunjukkan jumlah log biofilm S. Typhimurium dan S. aureus yang tereduksi oleh dua jenis sanitaiser komersial kombinasi. Sanitaiser yang digunakan adalah sanitaiser X dan sanitaiser Z dengan konsentrasi uji sebesar 0.125, 0.25, 0.5 dan 1 %. Dari Gambar 6, terlihat bahwa pada kisaran konsentrasi yang diaplikasikan, sanitaiser X mampu mereduksi 5.02 log CFU/cm2 dan sanitaiser Z mereduksi 1.68-4.70 log CFU/cm2 biofilm S. Typhimurium. Selain itu, sanitaiser X mampu mereduksi 1.65-3.94 log CFU/cm2 dan sanitaiser Z mereduksi 0.72-2.73 log CFU/cm2 biofilm S. aureus (Gambar 7).
Dari Gambar 6 dan Gambar 7, terlihat pula bahwa sanitaiser yang paling sanitaiser Z dalam mereduksi biofilm S. Typhimurium karena konsentrasi yang dibutuhkan lebih rendah.
15
Gambar 6 Reduksi densitas biofilm S. Typhimurium
1,65
Gambar 7 Reduksi densitas biofilm S. aureus
Tabel 3 Analisis statistik untuk reduksi densitas biofilm
Sanitaiser Konsentrasi penggunaan
16
Dari Tabel 3, terlihat bahwa biofilm yang dibentuk oleh S. aureus lebih sulit direduksi dibandingkan biofilm yang dibentuk oleh S. Typhimurium, baik oleh sanitaiser X maupun sanitaiser Z. Hasil penelitian Rossoni dan Gaylarde (2000) menunjukkan bahwa biofilm S. aureus bersifat lebih resisten terhadap peroksi asetat dibandingkan bakteri lainnya. Biofilm yang dibentuk oleh S. aureus bersifat lebih resisten terhadap sanitaiser karena diduga adanya pengaruh kandungan natrium klorida dan glukosa dari medium TSB. Berdasarkan hasil penelitian Moretro et al. (2003), diketahui biofilm yang dihasilkan oleh Staphylococcus
memiliki karakteristik yang lebih tebal karena adanya natrium klorida dan glukosa. Oleh karena itu, dibutuhkan konsentrasi bahan pembersih dan sanitaiser yang lebih tinggi untuk mereduksi biofilm S. aureus karena biofilm yang terbentuk lebih tebal.
SIMPULAN DAN SARAN
Simpulan
Dari kelima jenis sanitaiser komersial yang diuji, sanitaiser X dan Z pada konsentrasi 0.015 % merupakan sanitaiser yang paling efektif dalam menginaktivasi S. Typhimurium dengan nilai reduksi masing-masing sebesar 9.29 log CFU/mL dan 9.23 log CFU/mL, sedangkan sanitaiser X pada konsentrasi 0.005 % merupakan sanitaiser yang paling efektif dalam menginaktivasi S. aureus
dengan nilai reduksi sebesar 9.29 log CFU/mL. Selain itu, S. aureus bersifat lebih peka terhadap sanitaiser komersial dibandingkan dengan S. Typhimurium karena dinding sel bakteri Gram positif lebih mudah dimasuki oleh sanitaiser. Dalam hal mereduksi biofilm S. Typhimurium dan S. aureus, sanitaiser X lebih efektif dibandingkan sanitaiser Z. Hal ini disebabkan sanitaiser X mengandung komponen quats yang lebih dominan. Quats merupakan sanitaiser sekaligus surfaktan kationik sehingga quats dapat melarutkan EPS yang dibentuk biofilm dan membuat mikroba menjadi lebih sensitif terhadap sanitaiser.
Saran
17
DAFTAR PUSTAKA
[BPOM] Badan Pengawas Obat dan Makanan. 2012. Laporan tahun 2011 [Internet]. [diunduh 2013 Februari 11]. Tersedia pada: http://www.pom.go. id /ppid/rar/LAPTAH_ 2011.pdf.
[BSN] Badan Standardisasi Nasional. 2011. SNI Rekomendasi nasional kode praktis-prinsip umum higiene pangan [Internet]. [diunduh 2013 Februari 11]. Tersedia pada: http://pkpp.ristek.go.id/_assets/upload/docs/302_doc_2. pdf. [CDC] Centers for Disease Control and Prevention. 2013. Surveillance for
foodborne disease outbreaks United States 2009-2010. 62(3):41-47.
[CDNANZ] Communicable Disease Network Australia and New Zealand. 1997. Foodborne disease: towards reducing foodborne illness in Australia [Internet]. [diunduh 2013 Februari 11]. Tersedia pada: http://www.health. gov.au/internet/main/publishing.nsf/content/cda-cditechfoodborne.htm/$FIL E/foodbrne.pdf.
[CFR] Code of Federal Regulations. 2011. Indirect food additives: adjuvants, production aids, and sanitizers: substances utilized to control the growth of microorganism. Washington DC: US FDA.
[CLSI] Clinical and Laboratory Standards Institute. 2012. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard-ninth edition. 32(2):52.
[FDA] Food and Drug Administration. 1986. Hydrogen peroxide. Code of Federal Regulations 21, Parts 170-199, Section 184.1366, pp506 –507.
[FDA] Food and Drug Administration. 2001. Bacteriological analytical manual chapter 12 Staphylococcus aureus [Internet]. [diunduh 2013 Maret 10]. Tersedia pada: http://www.fda.gov/food/foodscienceresearch/laboratory methods/ ucm071429.htm.
[FDA] Food and Drug Administration. 2009. FDA report on the occurrence of foodborne illness risk factors in selected institutional foodservice, restaurant, and retail food storef types [Internet]. [diunduh 2013 Februari 11]. Tersedia pada: http://www.fda.gov/downloads/Food/FoodSafety/RetailFoodProtect ion/FoodborneIllnessandRiskFactorReduction/RetailFoodRiskFactorStudies /UCM224682.pdf.
[FDA] Food and Drug Administration. 2011. Bacteriological analytical manual chapter 5 Salmonella [Internet]. [diunduh 2013 Maret 10]. Tersedia pada: http://www.fda.gov/food/foodscienceresearch/laboratorymethods/ucm07014 9.htm.
[MSDS] Material Safety Data Sheet. 2009. 15 % Peracaetic acid [Internet]. [diunduh 2013 Maret 10]. Tersedia pada: http://www.ghenmaterials. com/uploads/8/3/2/6/8326000/paa-15c_msds.pdf.
[WHO] World Health Organization. 2003. The present state of foodborne disease in OECD Countries. Geneva: WHO.
[WHO] World Health Organization. 2007. Food safety and foodborne illness. Geneva: WHO.
18
Block SS. 2001. Disinfection, sterilization, and preservation 4th edition. Philadelphia (PA): Lea & Febiger.
Braden CR. 2006. Salmonella enterica serotype Enteritidis and eggs: a national epidemic in the United States. Clinical Infect. 43:512-517.
Chae MS, Schraft H. 2000. Comparative evalution of adhesion and biofilm formationof different Listeria monocytogenes strains. International Journal of Food Microbiology. 62(1-2):103-111.
Costerton JW, Lewandowski Z, Caldwell DE, Korber DR, Lappin-Scott HM. 1995. Microbial biofilms. Annual Review in Microbiology. 49:711-745. Costerton JW, Steward PS. 2001. Battling biofilm. Scientific American. 285(1):
74-81.
Denyer SP, Steward GSAB. 1998. Mechanisms of action of disinfectants.
International Biodeterioration and Biodegradation. 41:261-268.
Dewanti-Hariyadi R, Hartini US. 2006. Keberadaan dan perilaku Salmonella
dalam es batu. Prosiding PATPI. 22:184-191.
Dewanti-Hariyadi R. 1995. Studies on biofilm formation by Escherichia coli
O157:H7 [Dissertation]. Madison: University of Wisconsin.
Donlan RM. 2002. Biofilms: microbial life on surfaces. Emerging Infectious Disease. 8(9):881-890.
Dwintasari V. 2010. Pertumbuhan Staphylococcus aureus pada ayam suwir serta korelasinya dengan status kebersihan tangan pekerja dan praktik penanganan di warung bubur ayam [Skripsi]. Bogor (ID): IPB.
Faille C, Carpentier B. 2009. Food contact surfaces, surface soiling and biofilm formation. In: Fratamico PM, Annous BA, Gunther NW (eds.). Biofilm in the food and beverage industries. Boca Raton: CRC Press.
Fardiaz S. 1989. Mikrobiologi Pangan I. Bogor (ID): PAU IPB.
Gaulin C, Le ML, Shum M, Fong D. 2011. Disinfectants and sanitizers for use on food contact surfaces. Canada: National Colaborating Centre for Enviromental Health.
Giese J. 1991. Sanitation: the key to food safety and public health. Food Technology. 45(12):74-80.
Grinstead D. 2009. Cleaning and sanitation in food processing environment for the prevention of biofilm formation and biofilm removal. In: Fratamico PM, Annous BA, Gunther NW (eds.). Biofilm in the food and beverage industries. Boca Raton: CRC Press.
Hartini US. 2005. Analisis kandungan dan kemampuan bertahan Salmonella pada es batu dalam rangka evaluasi keamanan pangan [Skripsi]. Bogor (ID): IPB. Jahn A, Nielsen PH. 1998. Cell biomass and exopolymer composition in sewer
biofilms. Water Science and Technology. 37:17-24.
Lawrence AG, Bennet MK. 2001. Methods of testing sanitizers and bacteriostatic substances 5th edition. In: Block (ed.). Disinfection, sterilization, and preservation. Philadelphia (PA): Williams & Williams.
Lehmann RH. 1988. Synergisms in disinfectant formulations. In: Payne KR (ed.) Industrial biocides. Chichester: John Wiley Sons, 1988:68-90.
Loir Y, Baron F, Gautier M. 2003. Staphylococcus aureus and food poisoning.
Genetic and Molecular Research. 2:63-76.
19 stainless steel and glass surfaces and its resistance to some selected chemical sanitizers. Brazilian Journal of Microbiology. 38:538-543.
Marriott NG. 1999. Principles of food sanitation 4th edition. Gaithersburg (MD): Aspen.
McEldowney S, Fletcher M. 1987. Adhesion of bacteria from mixed cell suspension to solid surfaces. Arch Microbiology. 148:57-62.
Meira QGdS, Barbosa IdM, Athayde AJAA, Siqueira-Junior JP, Souza EL. 2012. Influence of temperature and surface kind on biofilm formation by
Staphylococcus aureus from-contact surfaces and sensitivity to sanitizers.
Journal of Food Control. 25:469-475.
Moretro T, Hermansen L, Holck AL, Sidhu MS, Rudi K, Langsrud S. 2003. Biofilm formation and the presence of the intercellular adhesion Locus ica among Staphylococci from food and food processing environments. Applied and Environmental Microbiology. 69(9):5648-5655.
O’Toole GA, Kaplan HB. 2000. Biofilm formation as microbial development.
Annual Review in Microbiology. 54:49-79.
Pan Y, Breidt F, Kathariou S. 2006. Resistance of Listeria monocytogenes
biofilms to sanitizing agents in a simulated food processing environment.
Applied and Environmental Microbiology. 72:7711-7717.
Parsek MR, Singh PK. 2003. Bacterial biofilm: an emerging link to disease pathogenesis. Annual Review of Microbiology. 57:677-701.
Puro I. 2012. Kajian aktivitas antibakteri daun gatel (Laportea Decumana (Roxb.) Wedd.) dan daun benalu cengkeh [Skripsi]. Bogor (ID): IPB.
Purwoko T. 2009. Fisiologi Mikroba. Jakarta (ID): Bumi Aksara.
Roday S. 1999. Food hygiene and sanitation. New Delhi: Tata McGraw-Hill Publishing Company Limited.
Rodgers SL, JN Cash, M Siddq, ET Ryser. 2004. A comparison of different chemical sanitizers for inactivating Escherichia coli O157:H7 and Listeria monocytogenes in solution and on apples, lettuce, strawberries, and cantaloupe. Journal of Food Protection. 67:721-731.
Ronner AB, Wong ACL. 1993. Biofilm development and sanitizer inactivation of
Listeria monocytogenes and Salmonella Typhimurium on stainless steel and buna-N rubber. Journal of Food Protection. 56:750-758.
Rossoni EMM, Gaylarde CC. 2000. Comparison of sodium hypochlorite and peracetic acid as sanitizing agents for stainless steel food processing surfaces using epifluorescence microscopy. International Journal of Food Microbiology. 61(1):81-85.
Rutala WA, Weber DJ. 2008. Guideline for disinfection and sterilization in healthcare facilities [Internet]. [diunduh 2013 April 17]. Tersedia pada: http://www.cdc.gov/hicpac/Disinfection_Sterilization/4_0efficacyDS.html. Simoes M, Simoes LC, Machado I, Pereira MO, Vieira MJ. 2006. Control of
flow-generated biofilms using surfactants-evidence of resistance and recovery. Food and Bioproducts Processing. 84:338-345.
Simoes M, Simoes LC, Vieira M. 2010. A review of current and emergent biofilm control strategies. LWT-Food Science and Technology. 43:573-583.
20
Suliantari. 2009. Aktivitas antibakteri dan mekanisme penghambatan ekstrak sirih hijau (Piper betle Linn) terhadap bakteri patogen pangan [Disertasi]. Bogor (ID): IPB.
Sutherland IW. 2001. The biofilm matrix-an immobilized but dynamic microbial environment. Trends in Microbiology. 9:222-227.
Todd EC, Greig JD, Bartleson CA, Michaels BS. 2007. Outbreaks where food workers have been implicated in the spread of foodborne disease, part 3, factors contributing to outbreaks and description of outbreak categories.
Journal of Food Protection. 70(9):2199-2217.
Tsuneda S, Aikawa H, Hayashi H, Yuasa A, Hirata A. 2003. Extracellular polymeric substances responsible for bacterial adhesion onto solid surface.
FEMS Microbiology Letters. 223:287-292.
Walker HW, LaGrange WS. 1991. Sanitation in food manufacturing operations.
In: Block SS (ed.). Disinfection, sterilization, and preservation 4th edition. Philadelphia (PA): Lea & Febiger.
Yuliatin F. 2008. Kemampuan bertahan Salmonella selama proses pembekuan es [Skripsi]. Bogor (ID): IPB.
21 Lampiran 1 Konfirmasi S. Typhimurium pada pewarnaan Gram dan media selektif
Keterangan:
A : Morfologi S. Typhimurium pada pewarnaan Gram (perbesaran 1000x) B : S. Typhimurium pada media selektif XLDA
C : S. Typhimurium pada media selektif TSIA D : S. Typhimurium pada media selektif LIA
Lampiran 2 Konfirmasi S. aureus pada pewarnaan Gram dan media selektif
Keterangan:
A : Morfologi S.aureus pada pewarnaan Gram (perbesaran 1000x) B : S. aureus pada media selektif BPA
Lampiran 3 Larutan stok sanitaiser komersial
Keterangan:
A : Quats D : Sanitaiser Y
B : PAA E : Sanitaiser Z
C : Sanitaiser X
A B C D
A B
A B C D E
22
Lampiran 4 Data jumlah dan log reduksi S. Typhimurium
Sanitaiser
Konsentrasi penggunaan
(%v/v)
23 Lampiran 5 Data jumlah dan log reduksi S. aureus
Sanitaiser
Konsentrasi penggunaan
(%v/v)
24
Lampiran 6 Perhitungan volume NB dan larutan stok sanitaiser komersial yang diperlukan pada berbagai konsentrasi
Konsentrasi larutan stok sanitaiser quats (M1) = 1.000 % Konsentrasi sanitaiser quats yang diinginkan (M2) = 0.010 % Volume total (V2) = 5.00 mL
Sehingga volume larutan stok sanitaiser quats yang diperlukan (V1), yaitu: 1 % x V1 = 0.010 % x 5.00 mL
V1 = 0.05 mL dan volume NB yang diperlukan, yaitu:
volume NB = V2 - V1 - volume kultur = 5.00 mL - 0.05 mL - 0.05 mL = 4.90 mL
Lampiran 7 Data densitas dan log reduksi densitas biofilm
Bakteri Sanitaiser
Konsentrasi penggunaan
(%v/v)
26
27 Lampiran 10 Hasil analisis uji ANOVA dan Duncan untuk reduksi biofilm
28
Lampiran 11 Hasil analisis uji ANOVA dan Duncan untuk reduksi biofilm