TOKSISITAS MOLUSKISIDA FENTIN ASETAT TERHADAP
KARAKTERISTIK HEMATOLOGI DAN PERTUMBUHAN
IKAN NILA (
Oreochromis
sp.)
AISYAH LUKMINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Toksisitas Moluskisida Fentin Asetat terhadap Karakteristik Hematologi dan Pertumbuhan Ikan Nila (Oreochromis sp.) adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2016
Aisyah Lukmini
RINGKASAN
AISYAH LUKMINI. Toksisitas Moluskisida Fentin Asetat terhadap Karakteristik Hematologi dan Pertumbuhan Ikan Nila (Oreochromis sp.). Dibimbing oleh EDDY SUPRIYONO dan TATAG BUDIARDI.
Fentin asetat (C20H18O2Sn) merupakan senyawa organotin yang banyak
digunakan sebagai bahan aktif dalam formulasi moluskisida pertanian. Penggunaan senyawa ini akan meninggalkan residu dalam lingkungan biotik dan abiotik. Lebih lanjut, fentin asetat bersifat mudah larut dalam lemak (lipofilik) sehingga dapat terserap dan terakumulasi di dalam tubuh organisme dan dapat mengganggu fisiologi biota budidaya. Senyawa ini diketahui mampu menurunkan laju pengambilan makanan, laju pertumbuhan, tingkat kelangsungan hidup dan menghambat sekresi hormon insulin.
Penelitian ini bertujuan untuk menganalisis toksisitas fentin asetat pada kondisi akut, serta menganalisis pengaruh fentin asetat pada kondisi sublethal terhadap karakteristik hematologi, kadar glukosa, kelangsungan hidup dan pertumbuhan juvenil ikan nila. Bahan uji yang digunakan adalah fentin asetat (C20H18O2Sn). Hewan uji yang digunakan adalah juvenil ikan nila dengan bobot
rata-rata 8,90±0,13 g. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) dengan perlakuan konsentrasi fentin asetat berbeda. Penelitian dilakukan dalam tiga tahap meliputi uji nilai kisaran, uji akut, dan uji toksisitas sublethal. Pada uji nilai kisaran digunakan 8 taraf konsentrasi yaitu K (kontrol), A (0,0075 ppm), B (0,025 ppm), C (0,0375 ppm), D (0,05 ppm), E (0,0625 ppm), F (0,06875 ppm), dan G (0,075 ppm) masing-masing dengan dua kali ulangan. Uji akut menggunakan 8 taraf konsentrasi yaitu K (kontrol), A (0,011 ppm), B (0,015 ppm), C (0,021 ppm), D (0,029 ppm), E (0,04 ppm), F (0,056 ppm), dan G (0,075 ppm) masing-masing dengan tiga kali ulangan. Uji toksisitas sublethal menggunakan 4 taraf konsentrasi yaitu K (kontrol), A (0,003 ppm), B (0,008 ppm) dan C (0,015 ppm) masing-masing dengan tiga kali ulangan.
Hasil penelitian menunjukkan bahwa nilai konsentrasi ambang bawah moluskisida fentin asetat (LC0-48 jam) adalah 0,0075 ppm dan nilai ambang atas
(LC100-24 jam) adalah 0,075 ppm. Nilai LC50- 24 ; 48; 72; dan 96 jam moluskisida
fentin asetat terhadap ikan nila adalah 0,058 ppm, 0,047 ppm, 0,036 ppm dan 0,03 ppm. Konsentrasi sublethal moluskisida fentin asetat berpengaruh nyata terhadap penurunan total eritrosit, kadar hemoglobin, kadar hematokrit, laju pertumbuhan, dan kelangsungan hidup. Total eritrosit, kadar hemoglobin, kadar hematokrit, laju pertumbuhan, dan kelangsungan hidup tertinggi terdapat pada kontrol sedangkan yang terendah pada perlakuan C. Hasil penelitian juga menunjukkan terjadi peningkatan total leukosit serta kadar glukosa darah ikan uji. Total leukosit dan kadar glukosa tertinggi ada pada perlakuan C, sedangkan yang terendah pada kontrol.
Nilai LC50-96 jam moluskisida fentin asetat adalah sebesar 0,03 ppm.
Terjadi penurunan total eritrosit, kadar hemoglobin, dan kadar hematokrit, tingkat kelangsungan hidup serta peningkatan leukosit dan kadar glukosa pada tingkat sublethal yang terjadi mulai konsentrasi 0,003 ppm.
SUMMARY
AISYAH LUKMINI. Toxicity of Fentin Acetate Molluscicide on Haematological Characteristics and Growth of Tilapia (Oreochromis sp). Supervised by EDDY
SUPRIYONO and TATAG BUDIARDI.
Fentin acetate is an organotin compound which widely used as active agent in molluscicide formulation on agriculture. Fentin acetate usage will leave residues to both biotic and abiotic environment. This compound characteristic includes high solubility in fat (lipophillic) so the compound can easily be absorbed and accumulated inside the body of organisms, therefore, harming the physiology of cultured organism. The compound largely known to decrease the rate of food intake, growth rate, survival rate, and inhibits insulin secretion.
This study aimed to analyze fentin acetate toxicity in its lethal condition and analyze the effect of the compound to the sublethal condition based on the haematological characteristic, glucose level, survival rate, and the growth of tilapia. Experiment material includes fentin acetate with tilapia juveniles as the object of the study. Juveniles used has average weight of 8.90±0.13 g. The study design was using complete randomized design with different fentin concentration as treatment. This study done in three steps : finding range test, acute test, and sublethal toxicity test.
Study on finding range test using 8 diffferent concentrations. Differences include control, A (0.0075 ppm), B (0.025 ppm), C (0.0375 ppm), D (0.05 ppm), E (0.0625 ppm), F (0.06875 ppm), and G (0.075). Two replications were being done for each concentration. Acute test were done using 8 different concentrations, those were K (control), A (0.011 ppm), B (0.015 ppm), C (0.021 ppm), D (0.029 ppm), E (0.040 ppm), F (0.056 ppm), and G (0.075ppm), with each concentration repeated three times. Sublethal toxicity test done using 4 level of concentrations, C (kontrol), A (0.003 ppm), B (0.008 ppm) and C (0.015 ppm), each concentration was being done in two repetitions.
Result shows that minimal concentration threshold of fentin acetate molluscicides was 0.0075 ppm while maximum concentration threshold (LC100-24
hours) was 0.075 ppm. LC50 value for 24h, 48h, 72h, and 96 hours of fentin
acetate molluscicides to affect tilapia were 0.058 ppm, 0.047 ppm, 0.036 ppm and 0.03 ppm. Sublethal concentration of fentin acetate decrease the total amount of erythrocytes, hemoglobin level, hematocrit level, growth rate, and survival rate. The highest value of erythrocytes, hemoglobin level, hematocrit level, growth rate, and survival rate is control. Result shows that fentin acetate increasing the total amount of leucocytes and glucose level.
The LC50-96 hours of fentin acetate for tilapia was 0,03 ppm. On sublethal
concentration, fentin acetate significantly affecting the decreasing of total erythrocytes, hemoglobin level, hematocrit level, and survival rate, also causing the increase of leucocytes level and glucose level from 0.003 ppm concentration.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
TOKSISITAS MOLUSKISIDA FENTIN ASETAT TERHADAP
KARAKTERISTIK HEMATOLOGI DAN PERTUMBUHAN
IKAN NILA (
Oreochromis
sp.)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Mei 2015 ini ialah toksikologi, dengan judul Toksisitas Moluskisida Fentin Asetat terhadap Karakteristik Hematologi dan Pertumbuhan Ikan Nila (Oreochromis sp.).
Penulis menyadari bahwa terselesaikannya tesis ini tidak lepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun material. Oleh karena itu penulis menyampaikan rasa terima kasih yang mendalam pada Dr Ir Eddy Supriyono, MSc dan Dr Ir Tatag Budiardi, MSi sebagai komisi pembimbing atas waktu dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga menyampaikan rasa terimakasih pada Dr Ir Kukuh Nirmala, MSc sebagai penguji luar komisi dan Dr Dinamella Wahjuningrum, SSi, MSi sebagai perwakilan dari Program Studi Ilmu Akuakultur yang memberikan saran selama ujian tesis.
Terima kasih disampaikan pada Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Unggulan Tahun 2013 sehingga penulis dapat melanjutkan studi di Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis haturkan pada Mama Siti Jedia dan Bapa Ismail Surdi, suamiku Muhammad As’ad, dua bidadariku Kanita Delphi Afiqa dan Kaniya Delphi Afiqa, serta seluruh keluarga atas segala doa dan kasih sayangnya.
Terima kasih kepada seluruh rekan-rekan S2 Ilmu Akuakultur angkatan 2013 atas kebersamaannya dalam menempuh studi.
Akhir kata, semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan.
Bogor, Juni 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis 3
Manfaat Penelitian 3
2 METODE 3
Waktu dan tempat 3
Bahan 3
Prosedur Penelitian 4
Parameter Penelitian 5
Analisis Data 7
3 HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 14
4 SIMPULAN DAN SARAN 16
Simpulan 16
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 20
DAFTAR TABEL
1 Analisis parameter fisika kimia air pada uji toksisitas sublethal 7 2 Nilai LC50 fentin asetat pada juvenil ikan nila 9
3 Kelangsungan hidup (%) ikan nila selama penelitian 13 4 Bobot rata-rata dan laju pertumbuhan spesifik pada akhir penelitian 14
DAFTAR GAMBAR
1 Persentase tingkat kematian kumulatif ikan nila selama uji nilai kisaran 8 2 Persentase tingkat kematian ikan nila selama uji akut 9 3 Jumlah eritrosit (x106 sel mm-3) ikan nila selama penelitian 10
4 Kadar hemoglobin (g%) ikan nila selama penelitian 11 5 Kadar hematokrit (%) ikan nila selama penelitian 11 6 Jumlah leukosit (x104 sel mm-3) ikan nila selama penelitian 12
7 Kadar glukosa (mg dL-1) ikan nila selama penelitian 13
DAFTAR LAMPIRAN
1 Analisis ragam dan uji lanjut (Duncan) karakteristik hematologi ikan
nila 20
2 Analisis ragam dan uji lanjut (Duncan) kadar glukosa ikan nila 22 3 Analisis ragam dan uji lanjut (Duncan) kelangsungan hidup (KH) ikan
nila 23
4 Analisis ragam bobot rata-rata (g/ekor) ikan nila pada akhir penelitian 23 5 Analisis ragam dan uji lanjut (Duncan) laju pertumbuhan spesifik ikan
1
PENDAHULUAN
Latar Belakang
Polusi air saat ini sudah menjadi masalah global. Salah satu bahan yang diketahui menyebabkan polusi air adalah pestisida. Penggunaan pestisida yang sudah semakin luas, selain membawa dampak positif berupa meningkatnya hasil-hasil pertanian juga memiliki potensi dampak negatif terutama di ekosistem perairan. Hal ini bisa terjadi karena jika digunakan dengan metode spray, sekitar
60-99% pestisida yang akan tertinggal pada target atau sasaran, sedangkan jika digunakan dalam bentuk serbuk hanya 10-40% yang mencapai target, sisanya melayang bersama aliran angin atau segera mencapai tanah (Sudarmo 1991). Sehubungan dengan hal tersebut, maka Komisi Pestisida telah mengidentifikasi berbagai kemungkinan yang timbul akibat penggunaan pestisida, antara lain adalah keracunan terhadap ikan. Penggunaan pestisida pada padi sawah atau lingkungan perairan lainnya dapat mengakibatkan kematian pada ikan yang dipelihara di sawah atau di kolam. Pada konsentrasi tertentu, pestisida akan terkonsentrasi di dalam lingkungan perairan sehingga berpotensi mengganggu keseimbangan ekosistem perairan. Selain itu, pestisida akan masuk ke dalam proses metabolisme organisme dan mengganggu fisiologi biota budidaya (Connel & Miller 1995).
Salah satu pestisida yang diketahui bersifat toksik terhadap organisme akuatik adalah fentin asetat dengan nama kimia trifeniltin asetat (berdasarkan IUPAC). Fentin asetat merupakan senyawa organotin yang banyak digunakan sebagai pestisida dalam bidang pertanian (Watermann et al. 2008). Senyawa organotin adalah senyawa organometalik yang disusun oleh satu atau lebih ikatan stannum-karbon (Sn-C).
Penggunaan senyawa organotin sudah dilarang di beberapa negara di Eropa dan Amerika, sedangkan di beberapa negara di Asia, seperti Indonesia, Malaysia, dan India penggunaannya masih diizinkan. Di Indonesia, senyawa ini digunakan untuk mengendalikan siput murbei (Pomacea canaliculata) di padi sawah, siput trisipan (Cheritidea sp.) di tambak udang windu dan bandeng, dan siput
Parmarion pupilaris di tanaman kubis bunga (Ditjen PSP 2014). Menurut
Guevarra et al. (1987), fentin asetat dengan dosis 0,6-1,2 kg ha-1 merupakan
moluskisida yang paling efektif untuk mengontrol populasi siput murbei (Pomacea canaliculata Lamarck) di sawah.
Adanya larangan terhadap penggunaan senyawa organotin disebabkan toksisitasnya yang sangat tinggi bagi organisme akuatik (Okoro et al. 2011). Senyawa ini bersifat lipofilik atau mudah larut dalam lemak sehingga dapat terserap dan terakumulasi di dalam tubuh organisme sehingga merupakan masalah dalam kegiatan budidaya (Cima et al. 1996). Dua jenis senyawa organotin yang
diketahui bersifat sangat toksik bagi organisme akuatik adalah tributiltin dan trifeniltin. Beberapa hasil penelitian menunjukkan bahwa kedua senyawa ini mampu mengganggu pertumbuhan dan menurunkan tingkat kelangsungan hidup
Mytilus edulis (Haggera et al. 2005), serta menghambat sekresi hormon insulin pada hamster (Miura et al. 2012). Hasil penelitian Stonner (1966) menunjukkan
2
tikus. Pada dosis 25 ppm, trifeniltin mampu menurunkan laju pertumbuhan pada tikus dan babi (Verschuuren et al. 1966).
Kannan dan Lee (1996) melaporkan bahwa trifeniltin yang digunakan sebagai pestisida dan kemudian lepas ke perairan akan terakumulasi di sedimen. Hasil penelitian Harino et al. (2012) di tiga lokasi perairan di Indonesia yaitu Bitung, Manado, dan Teluk Jakarta menemukan bahwa sedimen di tiga lokasi tersebut mengandung senyawa trifeniltin dengan konsentrasi yang sangat tinggi. Konsentrasi senyawa trifeniltin yang terdeteksi di tiga lokasi tersebut masing-masing berkisar antara <0,1-19 µg kg-1 di Bitung, 0,1 µg kg-1 di Manado dan
<0,1-7,1 µg kg-1 di Teluk Jakarta.
Tingginya kandungan trifeniltin baik di sedimen maupun di perairan, akan membahayakan organisme akuatik yang hidup di dalamnya. Hal ini diperparah dengan fakta bahwa air sungai dan waduk sering dimanfaatkan sebagai sumber air pasok budidaya ikan, sehingga akan mengancam kegiatan budidaya ikan yang sedang giat dikembangkan oleh masyarakat Indonesia, misalnya ikan nila (Oreochromis sp.). Ikan nila merupakan salah satu komoditas perikanan dalam
program percepatan industrialisasi dari jenis komoditas budidaya dengan jumlah produksi pada tahun 2014 sebesar 912.613,29 ton (KKP 2014). Komoditas ini dibudidayakan dengan memanfaatkan air sungai dan waduk sebagai sumber air pasok. Akan tetapi informasi mengenai batas nilai maksimum dari moluskisida fentin asetat yang bisa ditolerir oleh ikan nila, sampai saat ini belum diketahui. Selama ini penelitian mengenai daya toksik fentin asetat, lebih banyak dilakukan pada organisme teresterial seperti tikus (Stonner 1966) dan hamster (Miura et al.
2012). Penelitian mengenai toksisitas sublethal fentin asetat terhadap kondisi fisiologis ikan nila, belum pernah dilaporkan. Oleh karena itu, perlu untuk melakukan penelitian tentang toksisitas fentin asetat pada ikan nila.
Perumusan Masalah
Peningkatan penggunaan pestisida terutama dalam bidang pertanian telah menyebabkan pencemaran pada berbagai perairan. Hal ini terjadi karena pada umumnya aktivitas pertanian akan menggunakan lingkungan perairan sebagai tempat pembuangan limbah cair yang masih mengandung residu pestisida. Akibat aktivitas tersebut maka lingkungan perairan yang merupakan sumber air untuk berbagai kegiatan budidaya dapat tercemar oleh berbagai bahan aktif yang terkandung dalam formulasi pestisida.
Fentin asetat merupakan senyawa organotin yang digunakan sebagai bahan aktif dalam formulasi moluskisida pertanian. Penggunaan senyawa ini akan meninggalkan residu baik dalam lingkungan biotik maupun abiotik. Lebih lanjut, fentin asetat bersifat mudah larut dalam lemak (lipofilik) sehingga dapat terserap dan terakumulasi di dalam tubuh organisme dan mengganggu fisiologi biota budidaya.
3 dapat timbul pada ikan nila akibat terpapar pada air yang tercemar fentin asetat, baik pada konsentrasi akut maupun sublethal.
Estimasi toksisitas fentin asetat dan pengaruh yang dapat timbul terhadap ikan nila dapat diketahui melalui beberapa pengujian seperti uji hayati (bioassay), uji akumulasi, uji eliminasi dan uji sublethal. Dalam kondisi sublethal pengaruh dari toksisitas moluskisida fentin asetat dapat berdampak pada perubahan karakteristik hematologi dan kadar glukosa dalam darah sehingga dalam jangka waktu tertentu akan berpengaruh terhadap tingkat kelangsungan hidup dan laju pertumbuhan ikan nila.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menganalisis tingkat toksisitas akut fentin asetat yang diekspresikan dengan nilai LC50-96 jam dan menganalisis
toksisitas sublethal fentin asetat terhadap karakteristik hematologi, kadar glukosa, kelangsungan hidup, dan pertumbuhan ikan nila.
Hipotesis
Pada konsentrasi akut, fentin asetat dapat menyebabkan kematian ikan nila sedangkan pada konsentrasi sublethal, fentin asetat dapat menimbulkan perubahan karakteristik hematologi dan kadar glukosa dan selanjutnya mempengaruhi kelangsungan hidup dan pertumbuhan ikan nila.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat untuk menentukan daya toksik fentin asetat terhadap ikan nila dan memberikan informasi tentang konsentrasi sublethal fentin asetat yang dapat menganggu kelangsungan hidup dan pertumbuhan ikan nila.
2
METODE
Waktu dan tempat
Penelitian ini dilaksanakan pada bulan Mei hingga Juli 2015 di Laboratorium Lingkungan Akuakultur Departemen Budidaya Perairan (BDP) IPB, analisis karakteristik hematologi dilakukan di Laboratorium Kesehatan Ikan BDP IPB. Analisis kadar glukosa dilakukan di Laboratorium Fisiologi Fakultas Kedokteran Hewan IPB.
Bahan
Bahan yang digunakan untuk penelitian ini adalah fentin asetat (C20H18O2Sn) dalam bentuk serbuk. Biota uji yang digunakan adalah ikan nila
4
ikan uji dalam kondisi sehat, ditandai dengan aktif makan, aktif berenang dan tidak cacat. Sebelum digunakan, ikan uji diseleksi berdasarkan ukuran yang homogen berdasarkan bobot awalnya.
Prosedur Penelitian
Uji Nilai Kisaran
Uji nilai kisaran dilakukan selama 48 jam, menggunakan rancangan acak lengkap (RAL) yang bertujuan untuk menentukan konsentrasi ambang atas (N) dan konsentrasi ambang batas bawah (n) fentin asetat terhadap ikan nila. Konsentrasi ambang batas atas adalah konsentrasi terendah fentin asetat yang dapat menyebabkan semua ikan nila mati pada periode waktu 24 jam (LC100-24
jam). Konsentrasi ambang batas bawah adalah konsentrasi tertinggi dari fentin asetat yang dapat menyebabkan semua ikan nila hidup setelah pemaparan 48 jam (LC0-48 jam). Konsentrasi fentin asetat yang digunakan yaitu K (kontrol), A
(0,0075 ppm), B (0,025 ppm), C (0,0375 ppm), D (0,05 ppm), E (0,0625 ppm), F (0,06875 ppm), dan G (0,075 ppm), masing-masing dengan dua kali ulangan. Cara menformulasi tingkatan konsentrasi media uji adalah membuat larutan stok kemudian dilakukan pengenceran. Konsentrasi larutan uji dihitung menggunakan persamaan berikut :
V1N1=V2N2
Keterangan :
V1 = Volume larutan stok yang akan diambil (liter)
N1 = Konsentrasi pestisida dalam larutan stok (ppm)
V2 = Volume air penelitian yang akan digunakan (liter)
N2 = Konsentrasi pestisida yang diinginkan dalam media air (ppm)
Wadah percobaan yang digunakan adalah akuarium kaca berukuran 50x30x40 cm3 sebanyak 16 buah. Hewan uji dimasukkan sebanyak 10
ekor/akuarium. Pengamatan mortalitas hewan uji dilakukan pada jam ke-0, 2, 4, 8, 16, 24 dan 48.
Hasil dari uji penentuan kisaran diperoleh nilai ambang batas atas (N) dan ambang batas bawah (n). Nilai ambang batas atas dan batas bawah ini dimasukkan ke dalam rumus Komisi Pestisida (1983) :
Log N/n=k log(a/n)……….. (1)
a/n=b/a=c/b=d/c=N/d……….(2)
Keterangan :
N = Konsentrasi ambang atas (ppm) n = Konsentrasi ambang bawah (ppm)
K = jumlah konsentrasi yang diuji (a,b,c,d adalah konsentrasi yang diuji dengan nilai a sebagai konsentrasi terkecil)
5
Uji Akut
Uji akut dilakukan untuk menentukan median lethal concentration LC
50-96 jam fentin asetat pada juvenil ikan nila. Prosedur pada pengujian ini merujuk pada prosedur uji akut yang dilakukan oleh Supriyono et al. (1998). Uji ini dilakukan dengan memasukkan 10 ekor ikan nila ke dalam setiap akuarium berukuran 50x30x40 cm3. Konsentrasi pestisida yang digunakan yaitu K (kontrol),
A (0,011 ppm), B (0,015 ppm), C (0,021 ppm), D (0,029 ppm), E (0,04 ppm), F (0,056 ppm), dan G (0,075 ppm), masing-masing dengan tiga kali ulangan. Pengamatan mortalitas ikan dilakukan pada jam ke-0, 2, 4, 8, 10, 12, 24, 36, 48, 60, 72, dan 96. Nilai LC50 pada waktu pemaparan 24, 48, 72 dan 96 jam
ditentukan melalui analisis probit dengan perangkat lunak Minitab 16. Analisis probit adalah suatu cara transformasi statistik dari data persentase kematian ke dalam varian yang disebut probit dan kemudian digunakan untuk menentukan fungsi regresi probit dengan log konsentrasi agar dapat mengestimasi LC50.
Uji Toksisitas Sublethal
Tujuan uji sublethal yaitu untuk menganalisis pengaruh moluskisida fentin asetat terhadap perubahan karakteristik hematologi (total eritrosit (TE), kadar hemoglobin (Hb), kadar hematokrit (Hc) dan total leukosit), kadar glukosa, kelangsungan hidup dan laju pertumbuhan ikan nila. Wadah percobaan yang digunakan adalah akuarium kaca berukuran 100x50x50 cm3 dengan volume 160
L/akuarium sebanyak 12 buah. Hewan uji yang sudah diseleksi, ditebar sebanyak 30 ekor/akuarium. Sistem pemeliharaan dilengkapi dengan aerasi. Ikan dipelihara selama 21 hari. Selama uji ini berlangsung, ikan nila diberi pakan komersil secara
at satiation dengan frekuensi pemberian 2 kali sehari yaitupada pukul 07.00 dan 15.00 WIB. Penggantian air sebanyak 50 % dengan konsentrasi fentin asetat yang sama dilakukan setiap hari. Sampling dilakukan setiap tujuh hari. Rancangan penelitian menggunakan rancangan acak lengkap (RAL) yang terdiri dari 4 perlakuan konsentrasi fentin asetat yaitu K (0 ppm), A (0,003 ppm), B (0,008 ppm) dan C (0,015 ppm). Setiap perlakuan memiliki tiga ulangan. Penentuan konsentrasi didasarkan pada hasil uji akut, yaitu 10% (perlakuan A), 25% (perlakuan B), dan 50% (perlakuan C) dari nilai LC50-96 jam.
Parameter Penelitian
Karakteristik Hematologi
Sampling gambaran darah dilakukan pada hari ke-0, 7, 14, dan 21. Sebelum diambil darahnya, ikan dibius terlebih dahulu menggunakan MS222, kemudian darah diambil dari bagian ekor sebanyak 0,6 ml dari 2 ekor ikan menggunakan syringe steril berukuran 1 ml yang sebelumnya dicuci dengan antikoagulan (Na sitrat 3,8%). Sampel darah digunakan untuk pengukuran total eritrosit (TE), kadar hemoglobin (Hb), kadar hematokrit (Hc) dan total leukosit (TL).
6
sampai skala 1, kemudian ditambahkan larutan Hayem’s sampai skala 101, lalu
dilakukan pengadukan dengan menggoyangkan pipet yang sama selama 3–5 menit
hingga darah dan larutan Hayem’s tercampur rata. Tetesan pertama dibuang dan tetesan berikutnya diteteskan pada hemositometer, kemudian ditutup dengan gelas penutup dan diamati dengan mikroskop pembesaran 400x. Penghitungan TE dilakukan pada lima kotak kecil dalam hemositometer dengan persamaan sebagai berikut:
TE=Σ eritrosit x 1/(volume kotak) x faktor pengenceran
Kadar Hb diukur dengan metode Sahli menggunakan sahlinometer (Wedemeyer dan Yasutake 1977). Sampel darah dihisap menggunakan pipet Sahli hingga skala 20 mm3 atau 0,2 ml, kemudian dimasukkan ke dalam tabung
Hb-meter yang telah diisi dengan HCl 0,1 N sampai skala 10 (merah), lalu dilakukan pengadukan dan didiamkan selama 3–5 menit. Selanjutnya, akuades dimasukkan ke dalam tabung Hb-meter hingga terjadi perubahan warna seperti warna larutan standar pada Hb-meter. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung Sahli yang dilihat pada skala jalur g% (kuning) yang berarti banyaknya Hb per 100 ml darah.
Kadar Hc diukur dengan mengambil sampel darah menggunakan tabung mikrohematokrit dan disentrifus dengan kecepatan 5000 rpm selama 5 menit. Kadar hematokrit diketahui dengan membandingkan panjang sel darah yang mengendap dengan panjang total volume darah pada tabung mikrohematokrit (Anderson & Siwicki 1995) :
Hematokrit=(volume sel darah merah )/(total volume darah) x 100
Prosedur pengukuran TL dilakukan menurut Blaxhall dan Daisley (1973). Sampel darah diambil menggunakan pipet yang berisi bulir berwarna putih sampai skala 0,5, kemudian ditambahkan larutan Turk’s sampai skala 11, lalu dilakukan pengadukan dengan menggoyangkan pipet selama 3–5 menit hingga darah dan
larutan Turk’s tercampur rata. Tetesan pertama dibuang dan tetesan berikutnya diteteskan pada hemositometer, kemudian ditutup dengan gelas penutup dan diamati di bawah mikroskop dengan pembesaran 400x. Penghitungan TL dilakukan pada empat kotak besar dalam hemositometer menggunakan persamaan sebagai berikut:
TL=Σ leukosit x 1/(volume kotak) x faktor pengenceran
Kadar Glukosa
Pemeriksaan kadar glukosa darah ikan dilakukan sebagai indikator stres sekunder akibat toksisitas fentin asetat. Pengukuran kadar glukosa darah dilakukan sebanyak 4 kali yaitu pada hari ke 0, 7, 14 dan hari ke-21. Sebelum pengambilan darah, ikan dipuasakan selama 24 jam. Prosedur pengukuran glukosa darah yaitu: plasma darah diambil dengan cara disentrifus, selanjutnya 10 μl plasma darah dicampur dengan reagent sebanyak 1000 μl. Setelah itu, diinkubasi
pada suhu 20-250C selama 10 menit atau 370C selama 5 menit. Selanjutnya
7
GD = Au x Cs /As
Keterangan :
GD = Konsentrasi Glukosa darah (mg/100 ml) Au = Absorbansi sampel
Cs = Konsentrasi standar As = Absorbansi standar
Kinerja Pertumbuhan
Parameter kinerja pertumbuhan yang diukur meliputi tingkat kelangsungan hidup (TKH) dan laju pertumbuhan spesifik (LPS). Pengukuran TKH dilakukan pada hari ke 7,14 dan 21 menggunakan persamaan menurut Effendie (2002) sebagai berikut:
TKH=Nt/(N0 ) x 100
Keterangan:
TKH = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir penelitian (ekor) N0 = Jumlah ikan pada awal penelitian (ekor)
Pengukuran LPS dilakukan pada masa pemeliharaan menggunakan persamaan menurut Giri et al. (2013) sebagai berikut:
LPS= 100 x (ln We-ln Ws)/t
Keterangan:
LPS = Laju pertumbuhan spesifik (%)
We = Rata-rata bobot ikan pada akhir penelitian (g) Ws = Rata-rata bobot ikan pada awal penelitian (g) t = Waktu pemeliharaan (hari)
Fisika Kimia Air
Tabel 1 Analisis parameter fisika kimia air pada uji toksisitas sublethal
Parameter Satuan Alat
Suhu 0C Termometer
DO mg l-1 DO meter
pH - pH meter
TAN mg l-1 Spektrofotometer
Analisis Data
Data yang telah diperoleh kemudian ditabulasi dan dianalisis menggunakan Microsoft Excel 2010 dan SPSS 17. Analisis ragam (ANOVA)
8
kelangsungan hidup dan pertumbuhan. Apabila berpengaruh nyata, maka dilanjutkan dengan uji Duncan.
3
HASIL DAN PEMBAHASAN
Hasil
Uji Nilai Kisaran
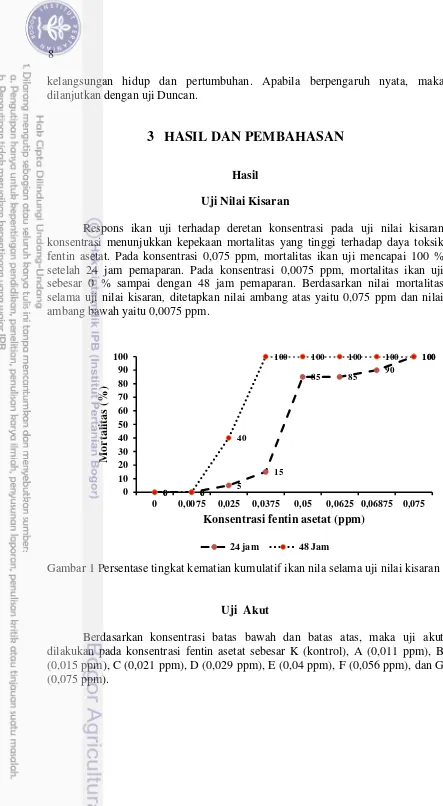
Respons ikan uji terhadap deretan konsentrasi pada uji nilai kisaran konsentrasi menunjukkan kepekaan mortalitas yang tinggi terhadap daya toksik fentin asetat. Pada konsentrasi 0,075 ppm, mortalitas ikan uji mencapai 100 % setelah 24 jam pemaparan. Pada konsentrasi 0,0075 ppm, mortalitas ikan uji sebesar 0 % sampai dengan 48 jam pemaparan. Berdasarkan nilai mortalitas selama uji nilai kisaran, ditetapkan nilai ambang atas yaitu 0,075 ppm dan nilai ambang bawah yaitu 0,0075 ppm.
Gambar 1 Persentase tingkat kematian kumulatif ikan nila selama uji nilai kisaran
0 0,0075 0,025 0,0375 0,05 0,0625 0,06875 0,075
9
Gambar 2 Persentase tingkat kematian ikan nila selama uji akut
Pada konsentrasi 0,075 ppm, mortalitas ikan uji mencapai 100 % setelah 24 jam pemaparan. Pada konsentrasi 0,011 ppm, mortalitas ikan uji sebesar 0% hingga jam ke 72, setelah itu terjadi mortalitas sebesar 3% pada jam ke 96. Pada kontrol, mortalitas ikan uji sebesar 0% sampai jam ke-96 setelah pemaparan fentin asetat. Hal ini menunjukkan bahwa kualitas media pemeliharaan dan vitalitas ikan selama pengujian dalam kondisi yang baik.
Tabel 2 Nilai LC50 fentin asetat pada juvenil ikan nila
LC50 Konsentrasi (ppm)
pemaparan 24, 48, 72 dan 96 jam berturut-turut adalah 0,058 ; 0,047; 0,036 dan 0,03 ppm. Hal ini menunjukkan bahwa semakin lama waktu pemaparan, nilai LC50 fentin asetat semakin rendah terhadap ikan nila.
Uji Toksisitas Sublethal
Uji toksisitas sublethal dilakukan selama 21 hari, bertujuan untuk menganalisis pengaruh fentin asetat terhadap perubahan karakteristik hematologi, kadar glukosa, kelangsungan hidup dan pertumbuhan juvenil ikan nila.
Karakteristik Hematologi
Perubahan karakteristik hematologi ikan nila selama penelitian, disajikan pada Gambar 3 (total eritrosit), Gambar 4 (kadar hemoglobin), Gambar 5 (kadar hematokrit), dan Gambar 6 (total leukosit).
0 0 0 0 0 0
0 0,011 0,015 0,021 0,029 0,040 0,056 0,075
10
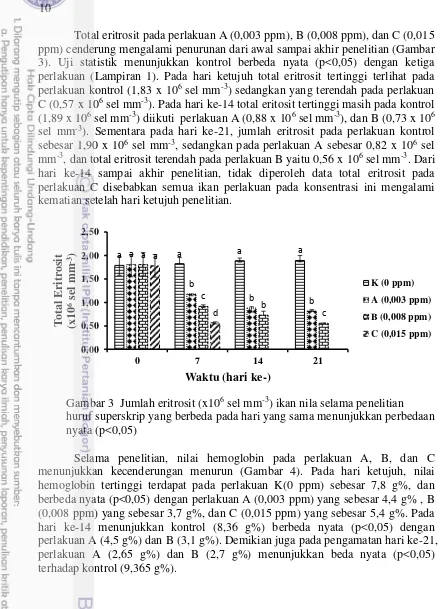
Total eritrosit pada perlakuan A (0,003 ppm), B (0,008 ppm), dan C (0,015 ppm) cenderung mengalami penurunan dari awal sampai akhir penelitian (Gambar 3). Uji statistik menunjukkan kontrol berbeda nyata (p<0,05) dengan ketiga perlakuan (Lampiran 1). Pada hari ketujuh total eritrosit tertinggi terlihat pada perlakuan kontrol (1,83 x 106 sel mm-3) sedangkan yang terendah pada perlakuan
C (0,57 x 106 sel mm-3). Pada hari ke-14 total eritosit tertinggi masih pada kontrol
(1,89 x 106 sel mm-3) diikuti perlakuan A (0,88 x 106 sel mm-3), dan B (0,73 x 106
sel mm-3). Sementara pada hari ke-21, jumlah eritrosit pada perlakuan kontrol
sebesar 1,90 x 106 sel mm-3, sedangkan pada perlakuan A sebesar 0,82 x 106 sel
mm-3, dan total eritrosit terendah pada perlakuan B yaitu 0,56 x 106 sel mm-3. Dari
hari ke-14 sampai akhir penelitian, tidak diperoleh data total eritrosit pada perlakuan C disebabkan semua ikan perlakuan pada konsentrasi ini mengalami kematian setelah hari ketujuh penelitian.
Gambar 3 Jumlah eritrosit (x106 sel mm-3) ikan nila selama penelitian
huruf superskrip yang berbeda pada hari yang sama menunjukkan perbedaan nyata (p<0,05)
11
Gambar 4 Kadar hemoglobin (g%) ikan nila selama penelitian
huruf superskrip yang berbeda pada hari yang sama menunjukkan perbedaan nyata (p<0,05)
Pada Gambar 5 terlihat bahwa selama penelitian terjadi kecenderungan penurunan nilai hematokrit ikan uji. Pada pengamatan hari ketujuh, nilai hematokrit tertinggi ada pada kontrol (30%) sedangkan yang terendah pada perlakuan B (12,68%). Pada pengamatan hari ke-14, kontrol berbeda nyata (p<0,05) terhadap perlakuan A dan B. Nilai hematokrit perlakuan kontrol, A, dan B masing-masing sebesar 31,83%, 18,53%, dan 12,34%. Pada pengamatan hari ke-21 kadar hematokrit pada kontrol (32,27%) berbeda nyata (p<0,05) dengan perlakuan A (12,75%) dan B (5,85%).
Gambar 5 Kadar hematokrit (%) ikan nila selama penelitian
12
perlakuan C (8,81 x 104 sel mm-3). Pada pengamatan hari ke-14, kontrol (7,49 x
104 sel mm-3) menunjukkan beda nyata (p<0,05) terhadap perlakuan A (8,42 x 104
sel mm-3) dan B (9,35 x 104 sel mm-3). Pada pengamatan hari ke-21, menunjukkan
total leukosit terendah ada pada kontrol (7,11 x 104 sel mm-3) sedangkan yang
terendah ada pada perlakuan B (10,80 x 104 sel mm-3).
Gambar 6 Jumlah leukosit (x104 sel mm-3) ikan nila selama penelitian
huruf superskrip yang berbeda pada hari yang sama menunjukkan perbedaan nyata (p<0,05)
Kadar Glukosa
Hasil penelitian menunjukkan kadar glukosa darah perlakuan A, B, dan C cenderung terus meningkat hingga akhir penelitian. Pada pengamatan hari ketujuh, kadar glukosa tertinggi ada pada perlakuan C (157,26 mg dL-1) diikuti perlakuan
13
Gambar 7 Kadar glukosa (mg dL-1) ikan nila selama penelitian
huruf superskrip yang berbeda pada hari yang sama menunjukkan perbedaan nyata (p<0,05)
Kelangsungan Hidup (KH)
Data kelangsungan hidup (KH) ikan nila selama penelitian disajikan pada Tabel 3. Persentase kelangsungan hidup tertinggi yaitu pada perlakuan kontrol diikuti berturut-turut perlakuan A (0,003 ppm), B (0,008 ppm), dan C (0,015 ppm). Hasil analisis statistik menunjukkan bahwa juvenil ikan nila yang terpapar fentin asetat memiliki tingkat kelangsungan hidup yang lebih rendah dibandingkan kontrol (Lampiran 3).
Tabel 3 Kelangsungan hidup (%) ikan nila selama penelitian
Konsentrasi fentin statistik menunjukkan bahwa perlakuan B berbeda nyata dengan kontrol (Lampiran 5). Pemberian fentin asetat dengan konsentrasi 0,008 ppm terbukti mampu menurunkan laju pertumbuhan spesifik juvenil ikan nila.
14
Tabel 4 Bobot rata-rata dan laju pertumbuhan spesifik pada akhir penelitian
Konsentrasi fentin
* huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
Kualitas Air
Suhu air selama penelitian berkisar antara 26-27⁰C, DO berkisar antara 6,80-7,40 ppm, pH berkisar antara 8,36-8,63, dan kisaran nilai TAN yaitu 0,184-0,203 ppm.
Pembahasan
Uji nilai kisaran dilakukan untuk memperoleh kisaran konsentrasi fentin asetat yang digunakan pada uji akut dengan memperhatikan batas bawah dan batas atas. Batas atas merupakan konsentrasi terkecil fentin asetat yang menyebabkan semua ikan nila mati pada periode waktu 24 jam, sedangkan batas bawah adalah konsentrasi tertinggi fentin asetat yang dapat menyebabkan semua ikan nila hidup setelah pemaparan selama 48 jam. Konsentrasi fentin asetat yang ditetapkan sebagai batas atas adalah 0,075 ppm dan batas bawah adalah 0,0075 ppm.
Hasil pengamatan pada uji akut menunjukkan bahwa gejala klinis sesaat setelah pemaparan fentin asetat. Gejala yang timbul diantaranya ikan berenang tidak teratur dengan sesekali menghentak dan kejang-kejang serta mengeluarkan lendir yang berlebihan dari permukaan tubuhnya, warna kulit memucat dan frekuensi pergerakan operkulum menjadi lebih sering tetapi tidak beraturan. Gejala tersebut merupakan tanggapan yang terjadi pada saat zat-zat fisika atau kimia menggangu proses sel atau subsel dalam makhluk hidup sampai suatu batas yang menyebabkan kematian secara langsung (Connel & Miller 1995).
Hasil analisis probit fentin asetat diketahui bahwa nilai LC50-96 jam
terhadap ikan nila sangat rendah yaitu sebesar 0,03 ppm. Berdasarkan Komisi pestisida (1983) dan Koesoemadinata (2003), menunjukkan bahwa toksisitas fentin asetat terhadap ikan nila diklasifikasikan kedalam golongan A yaitu pestisida yang memiliki toksisitas sangat tinggi (LC50 < 1 ppm, sangat tinggi).
Sedangkan menurut WHO, fentin asetat merupakan pestisida yang memiliki toksisitas sedang. Toksisitas sublethal pestisida fentin asetat pada penelitian ini diamati melalui karakteristik hematologi, kadar glukosa, kelangsungan hidup dan laju pertumbuhan ikan nila.
15 perlakuan yang diberi penambahan fentin asetat. Penurunan jumlah sel darah merah, hemoglobin dan hematokrit, diduga ikan stres karena paparan fentin asetat. Menurut Nabib dan Pasaribu (1989), rendahnya jumlah sel darah merah mengindikasikan ikan dalam keadaan stres.
Perubahan kondisi hematologi yang meliputi penurunan TE, Hb dan Hc merupakan ciri dari gejala anemia (Zhang et al. 2007). Anemia bisa disebabkan
beberapa faktor seperti (1) penghambatan sintesis globin dalam eritrosit. Senyawa organotin mampu menghambat sintesis Hb dengan cara mengganggu penyerapan zat besi (Fe) (Boyer 1989). Mineral Fe merupakan unsur essensial yang berperan dalam transpor oksigen dan respirasi seluler melalui aktivitas oksidasi-reduksi dan transfer elektron serta berperan dalam sintesis Hb (Setiawati et al. 2007). Hasil penelitian Groot et al. (1973) menunjukkan terjadinya penurunan konsentrasi Hb, sel darah merah, hematokrit, dan serum Fe pada tikus yang diberi pakan mengandung tin (Sn). Hal ini disebabkan Sn mampu menghambat laju penyerapan Fe dengan cara menginaktifkan enzim delta-aminolevulinic acid dehydratase
(δALAD) (Sun et al. 2014), pada reaksi perubahan ALA menjadi porpobilinogen
sehingga protoporfirin-9 yang terbentuk menjadi sedikit, akibatnya Hb yang terbentuk juga menjadi sedikit. Penurunan kadar hemoglobin menandakan bahwa kemampuan ikan untuk menyediakan oksigen yang cukup bagi jaringan tubuh mengalami keterbatasan sehingga menghasilkan penurunan aktivitas fisik (Wepener et al. 1992). (2) adanya penyakit yang menyerang ginjal. Ginjal adalah organ hematogenik paling penting untuk ikan (Ozaki 1982). Ginjal bagian anterior adalah organ utama pembentuk darah pada teleostei. Anemia yang terjadi akibat adanya penyakit atau kerusakan pada ginjal disebabkan berkurangnya produksi hormon eritropoietin (Reddy et al. 1992). Eritropoietin adalah hormon yang diproduksi oleh sel-sel khusus di ginjal yang merangsang sumsum tulang untuk meningkatkan produksi sel darah merah. Berkurangnya produksi hormon eritropoietin akan menyebabkan produksi sel darah merah juga berkurang, yang selanjutnya akan menyebabkan penurunan konsentrasi hemoglobin dan hematokrit di dalam darah. Benli dan Ozkul (2010) menemukan terjadinya perubahan histologi pada organ ginjal ikan nila yang dipapar insektisida fenitrothion selama 96 jam. Kerusakan tersebut berupa hemorage.
Hasil penelitian menunjukkan jumlah leukosit meningkat seiring dengan peningkatan konsentrasi fentin asetat pada media pemeliharaan (Gambar 6). Kenaikan leukosit mengindikasikan terjadinya kerusakan akibat infeksi jaringan tubuh, stres fisik yang parah, dan leukositosis. Leukositosis adalah keadaan dengan jumlah sel darah putih dalam darah meningkat melebihi nilai normal. Menurut El-sayed et al. (2007) terjadinya leukositosis distimulasi oleh limfopoiesis dan/atau meningkatnya pelepasan limfosit dari jaringan limfomyeloid di bawah kondisi stres. Hasil penelitian El-sayed et al. (2007)
menunjukkan terjadinya peningkatan jumlah leukosit dan limfosit pada ikan nila yang dipapar pestisida deltamethrin.
Nwani et al. (2012) menyatakan bahwa ikan yang dipapar pestisida dalam
16
perlakuan B. Rendahnya laju pertumbuhan pada penelitian ini diduga karena menurunnya jumlah TE dan Hb (Gambar 3 dan 4). Hb berfungsi mengikat oksigen yang digunakan dalam proses katabolisme untuk menghasilkan energi. Kemampuan mengikat oksigen dalam darah tergantung pada jumlah Hb dalam sel darah merah. Nilai Hb yang rendah pada perlakuan penambahan fentin asetat menyebabkan metabolisme menjadi terhambat dan energi yang dihasilkan menjadi sedikit. Hal ini berdampak pada pertumbuhan ikan menjadi rendah. Penurunan total eritrosit akan mengakibatkan suplai makanan ke sel, jaringan dan organ akan berkurang sehingga metabolisme akan terhambat (Bastami et al. 2009)
Penurunan laju pertumbuhan juga terjadi pada ikan yang dipaparkan dengan berbagai jenis pestisida. Ikan mas setelah dipaparkan moluskisida niklosamida pada konsentrasi sublethal 0,01; 0,03 dan 0,05 ppm selama 12 minggu memperlihatkan penurunan laju pertumbuhan spesifik pada semua perlakuan (Supriyono et al. 2013). Ikan nila yang dipapar dua jenis pestisida yaitu
dimethoate (20, 10 dan 5 ppm) dan malathion (2,0; 1,0 dan 0,5 ppm) mengalami penurunan laju pertumbuhan dan perubahan karakterisik hematologi berupa penurunan TE, Hb, dan hematokrit (Sweilum 2006).
Pada pengamatan kadar glukosa darah terlihat bahwa terjadi peningkatan kadar glukosa dalam darah ikan nila seiring dengan bertambahnya konsentrasi fentin asetat (Gambar 7). Kadar glukosa tertinggi terdapat pada perlakuan C (0,015 ppm) yaitu sebesar 157,26 mg/dL, sedangkan yang terendah ada pada kontrol. Naiknya kadar glukosa pada penelitian ini diduga disebabkan karena terjadinya glukoneogenesis. Adanya materi stres berupa paparan pestisida yang kemudian menstimulasi hipotalamus untuk melepaskan hormon kortisol yang memicu terjadinya lipolisis, glikogenolisis dan glukoneogenesis (Hontela et al. 1993). Glukoneogenesis merupakan istilah yang digunakan untuk mencakup semua mekanisme dan lintasan yang bertanggung jawab untuk mengubah senyawa nonkarbohidrat menjadi glukosa. Pada kondisi normal, meningkatnya kadar glukosa akan memicu pelepasan hormon insulin. Akan tetapi, beberapa penelitian menunjukkan bahwa senyawa organotin mampu menghambat sekresi hormon insulin dengan cara merusak fungsi dari sel-sel beta pankreas (Ogino et al.
1996), sehingga menurunkan pengambilan glukosa oleh sel-sel tubuh. Hasil penelitian Zuo et al. (2014) menemukan bahwa paparan tributiltin (TBT) mampu
meningkatkan kadar glukosa secara signifikan dan menurunkan kadar insulin. Miura et al. (2012) menemukan terjadinya inhibisi sekresi hormon insulin pada hamster yang dipapar trifeniltin chloride (TPT). Hormon insulin dihasilkan oleh sel-sel beta pankreas dan sangat penting untuk menurunkan kadar gula dalam darah. Kekurangan insulin akan menurunkan tingkat katabolisme glukosa serta menurunkan sintesis dan penyimpanan glikogen sehingga menyebabkan terjadinya hiperglikemia (Isnaeni 2006).
4
SIMPULAN DAN SARAN
Simpulan
17 penurunan total eritrosit, kadar hemoglobin, kadar hematokrit, kelangsungan hidup, dan pertumbuhan. Fentin asetat juga menyebabkan terjadinya peningkatan leukosit dan kadar glukosa di dalam darah yang terjadi mulai konsentrasi 0,003 ppm.
Saran
Perairan dengan kandungan fentin asetat minimal 0,003 ppm memerlukan
treatment khusus apabila akan digunakan untuk aktivitas budidaya.
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1995. Basic hematology and serology for fish health programs. Proceeding of the Second Symposium on Diseases in Asian
Aquaculture “Aquatic Animal Health and the Environment”; 1993 Okt 25-29;
Phuket, Thailand.
Bastami K, Darvish, Moradlou AH, Zaragabadi AM, Salehi MSV, Shakiba MM. 2009. Measurement of Some Haematological Characteristics of the Wild Carp. Springer-Verlag London. Comp Clin Pathol. 18: 321-323.
Benli ACK, Özkul A. 2010. Acute toxicity and histopathological effects of sublethal fenitrothion on Nile tilapia, Oreochromis niloticus. Pesticide Biochemistry and Physiology. 97(1): 32-5.
Blaxhall PC, Daisley KW. 1973. Routine haematological methods for use with fish blood. J Fish Biology. 5:577-581.
Boyer. 1989. Toxicity of dibutyltin, tributyltin and other organotin compounds to humans and to experimental animals. Toxicology. 55:253-298.
Cima F, Ballarin L, Bressa G, Martinucci G, Burighel P. 1996. Toxicity of Organotin Compounds on Embryos of a Marine Invertebrate (Styela plicata; Tunicata). Ecotoxicology And Environmental Safety. 35: 174-182.
Connel DW dan Miller GJ. 1995. Kimia dan ekotoksikologi pencemaran.
Universitas Indonesia (UI-Press): Jakarta.
[Ditjen PSP] Direktorat Jenderal Prasarana dan Sarana Pertanian. 2014. Pestisida Pertanian dan Kehutanan terdaftar 2014 [Internet]. [diunduh 24 Januari 2015]. Tersedia pada http://psp.pertanian.go.id/.
Effendie MI. 2002. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara. 163pp.
El-Sayed YS, Saad TT, El-Bahr SM. 2007. Acute intoxication of deltamethrin in monosex nile tilapia, Oreochromis niloticus with special reference to the clinical, biochemical and haematological effects. Environmental Toxicology and Pharmacology. 24:212–217.
Giri SS, Sukumaran V, Oviya M. 2013. Potential probiotic Lactobacillus plantarum
VSG3 improves the growth, immunity, and disease resistance of tropical freshwater fish, Labeo rohita. Fish & Shellfish Immunology. 34: 660-666.
Groot APD, Feron VJ, Til HP. 1973. Short-term Toxicity Studies on Some Salts and Oxides of Tin in Rats. Fd Cosmet. Toxicol.11: 19-30.
18
International Congress of Plant Protection, October 5-9, 1987, Manila, Philippines, pp.80-81, Manila, Philippines: International Congress of Plant Protection.
Haggera JA, Depledge MH, Galloway TS. 2005. Toxicity of tributyltin in the marine mollusk Mytilus edulis. Marine Pollutant Bulletin. 51: 811-816.
Harino H, Arifin Z, Rumengan IFM, Arai T, Ohji M, Miyazaki N. 2012. Distribution of Antifouling Biocides and Perfluoroalkyl Compounds in Sediments From Selected Locations in Indonesian Coastal Waters. Arch Environ Contam Toxicol. 63:13-21.
Hontela A, Rasmussen JB, Chevalier G. 1993. Endocrine responses as indicators of sublethal toxic stres in fish from polluted environments. Water Quality Research Journal of Canada. 28:767–780.
Isnaeni W. 2006. Fisiologi Hewan. Yogyakarta. Kanisius.
Kannan K, Lee RF. 1996. Triphenyltin and its degradation products in foliage and soils from sprayed pecan orchards and in fish from adjacent ponds.
Environmental Toxicology and Chemistry. 15: 1492–1499.
Koesoemadinata S. 2003. Metode standar pengujian toksisitas pestisida terhadap ikan. Jakarta.Komisi Pestisida. Direktorat Jenderal Bina Sarana Pertanian. Departemen Pertanian. 75 hal.
[KKP] Kementrian Kelautan dan Perikanan. 2014. Kelautan dan Perikanan dalam Angka 2014 [Internet]. [diunduh 24 Januari 2015]. Tersedia pada http://sidatik.kkp.go.id.
Komisi Pestisida. 1983. Pedoman umum pengujian laboratorium toksisitas akut pestisida pada ikan untuk keperluan pendaftaran. Jakarta. Departemen Pertanian. 18 hal.
Miura Y, Horib Y, Kimuraa S, Hachiyac H, Sakuraic Y, Inoued K, Sawadac T, Kubotac K. 2012. Triphenyltin impairs insulin secretion by decreasing glucose-induced NADP(H) and ATP production in hamster pancreatic β-cells.
Toxicology. 299:165-171.
Nabib R, Pasaribu FH. 1989. Patologi dan Penyakit Ikan. Departemen Pendidikan
dan Kebudayaan. Direktorat Jendral Bioteknologi. Institut Pertanian Bogor. 158.
Nwani CD, Okekea OC, Onyishia G, Atamaa C, Chinekwua U, & Enejeb LO. 2012. Toxicity and effects of diazinon on behaviour and some haematological parameters of African catfish Clarias gariepinus. Zoology and Ecology. 22(3-4): 246-253.
Okoro HK, Fatoki OS, Adekola FA, Ximba BJ, Snyman RG. 2011. Sources, Environmental Levels and Toxicity of Organotin in Marine Environment-A Review. Asian Journal of Chemistry. 23(2): 473-482.
Ogino K, Inukai T, Miura Y, Matsui H, Takemura Y. 1996. Triphenyltin chloride induces glucose intolerance by the suppression of insulin release from hamster pancreatic beta-cells. Exp Clin Endocrino! Diabetes.104(5): 409-11.
Ozaki. 1982. Fish Blood and Circulation Physiology. Shanghai : Science and
Technology Press.
Reddy DC, Vijayakumari P, Kalarani V, Davies RW. 1992. Changes in Erythropoietic Activity of Sarotherodon mossambicus Exposed to Sublethal
19 Setiawati M, Mokoginta I, Suprayudi MA, Manalu W. 2007. Pengaruh penambahan mineral Fe pada pakan ikan terhadap status kesehatan ikan kerapu bebek (Cromileptes altivelis). Jurnal Perikanan dan Kelautan. 12(1): 55-63.
Stonner. 1966. Toxicity of Triphenyltin. Br J Ind Med. 23(3): 222–229. Sudarmo S. 1991. Pestisida. Yogyakarta. Penerbit Kanisius.
Sun LH, Zhang NY, Zhai QH, Gao X, Li C, Zheng Q, Krumm CS, Qi DS. 2014. Effects of dietary tin on growth performance, hematology, serum biochemistry, antioxidant status, and tin retention in broilers. Biol Trace Elem Res. 162:302-308.
Supriyono E, Takashima F, Strussmann CA. 1998. Toxicity of Linear Alkylbenzene Sulphonate (LAS) to Juvenile Kuruma Shrimph, Penaeus japonicus : A Histophatological Study on Acute and Sub-chronic Levels.
Journal of Tokyo University of Fisheries. 85(1): 1-10.
Supriyono E, Yosmaniar, Nirmala K, Sukenda. 2013. Toksisitas moluskisida niklosamida terhadap pertumbuhan dan kondisi histopatologi juwana ikan mas (Cyprinus carpio). Jurnal Iktiologi Indonesia. 13(1): 77-84.
Sweilum MA. 2006. Effect of sub-akut toxicity of some pesticides on growth parameters, haematological properties and total production of Nile tilapia (Oreochromis niloticus L) and water quality of ponds. Aquaculture Research.
37:1079-1089.
Verschuuren HG, Kroes R, Vink HH, Van esch GJ. 1966. Short-term toxicity studies with triphenyltin compounds in rats and guinea pigs. Fd Cosmet. Toxicol. 4:35-45.
Watermann B, Grote K, Gnass K, Kolodzey H, Thomsen A, Appel KE, Carnevali DC, Oehlmann US. 2008. Histological alterations in ovaries of pubertal female rats induced by triphenyltin. Experimental and Toxicologic Pathology. 60:
313-321.
Wedemeyer GA, Yasutake WT. 1977. Clinical Methods for The Assesment of The Effects Environmental on Fish Health. California (US): U. S. Fish and Wildlife
Service.
Wepener W, Van Vuren JHJ, Du Preez HH. 1992. Effect of manganese and iron at neutral pH values on the haematology of the banded tilapia, Tilapia sparrmanii. Bull. Environ.C ontam.Toxicol. 49:613-619.
Zhang X, Xiea P, Lia D, Shia Z. 2007. Hematological and plasma biochemical responses of crucian carp (Carassius auratus) to intraperitoneal injection of extracted microcystins with the possible mechanisms of anemia. Toxicon. 49:1150-1157.
Zuo Z, Wu T, Lin M, Zhang S, Yan F,Yang Z, Wang Y, Wang C. 2014. Chronic Exposure to Tributyltin Chloride Induces Pancreatic Islet Cell Apoptosis and Disrupts Glucose Homeostasis in Male Mice. Environ. Sci. Technol.48:
20
LAMPIRAN
Lampiran 1. Analisis ragam dan uji lanjut (Duncan) karakteristik hematologi ikan nila
Perlakuan Nilai rata--rata (hari ke-)
7 14 21
K (0 ppm) 1,8250a 1,8900 a 1,8950 a
A (0,003 ppm) 1,1800b 0,8800 b 0,8200 b
B (0,008 ppm) 0,9150c 0,7300 b 0,5550 c
C (0,015 ppm) 0,5650d - -
*huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
21
Uji Duncan
Perlakuan Nilai rata--rata (hari ke-)
7 14 21
K (0 ppm) 7,8550a 8,3600 a 9,3650 a
A (0,003 ppm) 4,4000 b 4,5000 b 2,6500 b
B (0,008 ppm) 3,7000 bc 3,1000 b 2,7000 b
C (0,015 ppm) 5,4000 c - -
*huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
C. Hematokrit Sumber keragaman
Jumlah kuadrat
Derajat bebas
Kuadrat tengah
F P
Hematokrit Perlakuan 36,039 3 12,013 2,700 0,181 Hari ke-0 Error 17,798 4 4,449
Total 53,837 7
Hematokrit Perlakuan 364,306 3 121,435 16,700 0,010 Hari ke-7 Error 29,087 4 7,272
Total 393,393 7
Hematokrit Perlakuan 396,882 2 198,441 51,993 0,005 Hari ke-14 Error 11,450 3 3,817
Total 408,332 5
Hematokrit Perlakuan 751,495 2 375,748 44,034 0,006 Hari ke-21 Error 25,599 3 8,533
Total 777,094 5
Uji Duncan
Perlakuan Nilai rata--rata (hari ke-)
7 14 21
K (0 ppm) 30,0350a 31,8350 a 32,2750 a
A (0,003 ppm) 21,5000 b 18,5350 b 12,7450 b
B (0,008 ppm) 12,6800 bc 12,3400 b 5,8500 b
C (0,015 ppm) 14,9200c - -
22
Perlakuan Nilai rata-rata (hari ke-) 14 21
K (0 ppm) 7,4850a 7,1100a
A (0,003 ppm) 8,4200ab 8,8250b
B (0,008 ppm) 9,3500b 10,8000c
C (0,015 ppm)
*huruf superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (p<0,05)
Lampiran 2. Analisis ragam dan uji lanjut (Duncan) kadar glukosa ikan nila
Sumber
23
Uji Duncan
Perlakuan Nilai rata--rata (hari ke-)
7 14 21
K (0 ppm) 33,96650a 36,37650a 36,59400a
A (0,003 ppm) 89,24550b 92,02900b 94,63750b
B (0,008 ppm) 101,95500c 102,65250b 103,09450b
C (0,015 ppm) 157,26250d - -
*huruf superskrip yang berbeda pada hari yang sama menunjukkan perbedaan nyata (p<0,05)
Lampiran 3. Analisis ragam dan uji lanjut (Duncan) kelangsungan hidup (KH) ikan nila
Perlakuan N Rata-rata
K (0 ppm) 2 91,6650a
A ( 0,003 ppm) 2 70,0000ab
B (0,008 ppm) 2 30,0000b
*huruf superskrip yang berbeda menunjukkan perbedaan nyata (p<0,05)
Lampiran 4. Analisis ragam bobot rata-rata (g/ekor) ikan nila pada akhir penelitian
24
Uji Duncan
Perlakuan N Rata-rata
K (0 ppm) 3 1,03a
A ( 0,003 ppm) 3 0,08a
B (0,008 ppm) 3 -1,70b
25
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 16 Januari 1989 di Waingapu, Sumba timur dari orang tua bernama Ismail Surdi dan Siti Jedia. Penulis adalah anak pertama dari dua bersaudara. Penulis menikah dengan Muhammad As’ad pada tahun 2015 dan telah dikaruniai putri kembar, Kanita Delphi Afiqa dan Kaniya Delphi Afiqa.
Pendidikan formal yang pernah dilalui penulis adalah SDN 1 Waingapu (lulus tahun 2000), SMPN 2 Waingapu (lulus tahun 2003), dan SMAN 1 Waingapu (lulus tahun 2006). Penulis menempuh pendidikan sarjana pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Kelautan, Universitas Nusa Cendana tahun 2006 dan lulus pada tahun 2010. Selanjutnya, pada tahun 2013 penulis melanjutkan studinya dengan menempuh Program Magister pada program studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor. Program Magister ditempuh melalui Beasiswa Unggulan yang diberikan oleh Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD).
Artikel yang berjudul Toksisitas Moluskisida Fentin Asetat terhadap Karakteristik Hematologi dan Pertumbuhan Ikan Nila (Oreochromis sp.) telah