LAPORAN PRAKTIKUM TEKNIK KIMIA III
PEMBUATAN ASAM SULFANIL DARI ANILIN
Disusun oleh :
Shabrina Ananta 2013430150
JURUSAN TEKNIK KIMIA
FAKULTAS TEKNIK
UNIVERSITAS MUHAMMADIYAH JAKARTA
JAKARTA
I. PENDAHULUAN
Judul Percobaan :
Pembuatan Asam Sulfonil dari Anilin
Prinsip Percobaan :
Sulfonasi adalah reaksi kimia yang melibatkan penggabungan gugusan sulfamat – SO3H ke dalam suatu molekul ataupun ion. Pada saat pemisahan anili ke dalam asam sulfat
terjadi reaksi sulfonasi yaitu suatu reaksi substitusi yang mengsubstitusikan asam hidrogen dengan gugus asam sulfonat (SO3H) pada molekul organik melalui ikatan kimia pada atom
karbonnya.
Reaksi :
Tujuan :
Untuk mengetahui pembuatan asam sulfonil dari anilin.
Untuk mengetahui proses kristalisasi dan herkristalisasi.
Untuk mengetahui sifat fisika dan kimia SO3H.
A. Anilin ( C6H5NH2 ) dinetralkan dengan kapurdan disuling dengan uap lalu dimurnika n dengan penyulingan bertingkat dan anilin merupakan basa lemah, menurut reaksi sebagai berikut :
C6H5NO2+6HCl+3Fe→ C6H5NH2+3Fe Cl2+2H2O
Sifat fisika Anilin :
1. Berupa zat cair seperti minyak. 2. Sukar larut dalam air.
2. Anilin dapat bereaksi dengan asam membentuk garam – garamnya .
3. Anilin dapat bereaksi dengan H2SO4 membentuk anilin monosulfat dan anilin
monosulfat jika dipanaskan berubah menjadi asam sulfonat .
Kegunaan Anilin :
1. Untuk bahan dasar pembuatan zat warna. 2. Untuk bahan dasar pembuatan obat-obatan. 3. Untuk pembuatan bahan platik.
4. Untuk pembuatan bahan cat.
Asam sulfat ( H2SO4 )merupakan asam mineral (anorganik) yang kuat. Zat ini
larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia. Kegunaan utamanya termasuk pemrosesan bijih mineral, sintesis kimia, dan pemrosesan air limbah . Asam sulfat murni yang tidak diencerkan tidak dapat ditemukan secara alami di bumi oleh karena sifatnya yang higroskopis. Komponen utama asam sulfat yaitu belerang. Belerang adalah zat padat yang pada temeperatur kamar melebur pada 1190C, berwarna kuning
rapuh, dan kristal belerang berbentuk rombik dengan rumus S.
Sifat fisika :
1. Cairan kental berwarna kekuningan.
2. Memiliki aroma yang khas seperti belerang.
3. Bersifat korosif.
4. Bersifat higroskopis.
5. Berat jenis 1.84 g/mol.
6. Titik didih 2400C.
7. Titil leleh 100C.
Sifat kimia :
1. Merupakan asam kuat.
2. Jika dicampur dengan air akan menimbulkan proses ke lingkungan yaitu reaksi eksoterm (panas) sampai 1200C dan kontraksi, jadi isi campuran berkurang.
3. Bersifat encer dan tidak bereaksi dengan Bi, Hg, Cu, dan logam mulia.
5. Bersifat pekat.
Kegunaan H2SO4 :
1. Bahan pembuatan pupuk Ammonium sulfat dan asam sulfat. 2. Memurnikan minyak tanah.
3. Bahan kimia industri.
4. Menghilangkan karat besi sebelum baja dilapisi seng.
C. Asam Sulfonil
A s a m s u l f o n i l m e r u p a k a n p r o d u k h a s i l s u l f o n a s i y a n g m e r u p a k a n a s a m o rg a n i k d a r i g o l o n g a n a s a m s u l f o n a t , a t a u s e r i n g d i s e b u t j u g a a s a m p - a m i n o benzene sulfonat atau asam sulfanilat yang diperoleh dari mereaksikan anilin dan asam sulfat pekat. Asam sulfonil dianggap sebagai ion amfoter ( zat yang mampu menunjukkan dua sifat saling berlawanan,bersifat asam atau basa ). Zat ini terbentuk dari pemanasan anilin sulfat pada suhu 2000C. Asam sulfonat bereaksi terurai sebelum mencair pada suhu
3000C dan tidak d a p a t l a r u t d a l a m p e l a r u t o rg a n i k .
Pada pembuatan asam sulfonil ini menggunakan reaksi sulfonasi, sulfonasi yaitu reaksi yang terjadi dimana atom H yang terikat pada cincin benzene diganti d e n g a n g u g u s s u l f o n a t . I s t i l a h s u l f o n a s i aromatik dengan asam sulfat, dalam percobaan sulfonasi ini senyawa aromatik yang digunakan adalah anilin, d a n p e r c o b a a n d i l a k u k a n d e n g a n m e r e a k s i k a n a n i l i n d e n g a n a s a m s u l f a t p e k a t p a d a s u h u 1 8 0 - 1 9 00C
dan menghasilkan produk utama berupa asam sulfanilat dan air sebagai hasil sampingannya.
Sifat fisika asam sulfonil :
1. Berbentuk kristal berwarna putih ( dalam keadaan murni ). 2. Tidak dapat larut dalam pelarut organik.
3. Larut dalam air dingin -50C.
4. Terurai dalam ( sebelum ) mencair pada 3000C dan terbentuk pada suhu 1 8 0
Sifat kimia asam sulfonil : 1. Merupakan turunan benzen. 2. Bersifat amfoter.
3. Cenderung bersifat asam.
4. Dihasilkan dari anilin dengan asam sulfat,
Kegunaan asam sulfonil :
1. Digunakan sebagai katalis dalam proses industri. 2. Sebagai bahan dasar dalam industri farnasi. 3. Sebagai zat warna.
4. Sebagai zat pengemulsi.
D. Metode Proses
1. Kristalisasi
Kristalisasi adalah proses pembentukan bahan padat dari pengendapanlarutan, melt (campuran leleh), atau lebih jarang pengendapan langsung dari gas. Kristalisasi juga merupakan teknik pemisahan kimia antara bahan padat-cair, di mana temperatur, kondisi lewat jenuh dapat dicapai dengan pendinginan larutan panas yang jenuh.
b) Pemanasan
Untuk bahan-bahan yang kelarutannya berkurang sedikit dengan menurunnya suhu. Kondisi lewat jenuh dapat dicapai dengan penguapan sebagian pelarut. c) Pemanasan dan Pendinginan
panas penguapan diambil dari larutan itu sendiri, sehingga larutan menjadi dingin dan lewat jenuh. Metode ini disebut kristalisasi vakum.
d) Penambahan bahan (zat) lain.
Untuk pemisahan bahan organik dari larutan seringkali ditambahkan suatu garam. Garam ini larut lebih baik daripada bahan padat yang dinginkan sehinga terjadi desakan dan membuat bahan padat menjadi terkristalisasi.
2. Herkristalisasi
Rekristalisasi merupakan salah satu cara pemurnian zat padat yang jamak digunakan, dimana zat-zat tersebut atau zat-zat padat tersebut dilarutkan dalam suatu pelarut kemudian dikristalkan kembali. Cara ini bergantung pada kelarutan zat dalam pelarut tertentu di kala suhu diperbesar. Karena konsentrasi total impuriti biasanya lebih kecil dari konsentrasi zat yang dimurnikan, bila dingin, maka konsentrasi impuriti yang rendah tetapi dalam larutan sementara produk yang berkonsentrasi tinggi akan mengendap. (Arsyad, 2001).
Ada tujuh metode dalam rekristalisasi yaitu: memilih pelarut, melarutkan zat terlarut, menghilangkan warna larutan, memindahkan zat padat, mengkristalkan larutan, mengumpul dan mencuci kristal, mengeringkan produknya (hasil) dan selalu dikocok. ( di labu dasar bulat )
1. 50 gram Asam Sulfat dimasukkan dalam 11 gram Anilin.
2. Pemberian Asam Sulfat sedikit demi sedikit dan selalu dikocok.
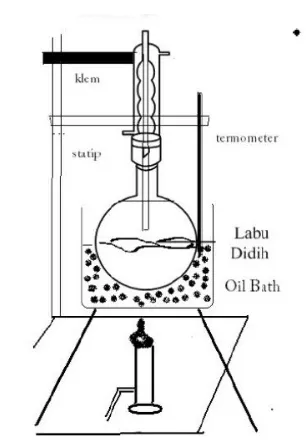
3. Campuran lalu dipanaskan dalam labu dasar bulat pada suhu 180-1900C dengan
menggunakan oil bath.
4. Pemanasan dilakukan selama 4 jam.
5. Setelah pemanasan campuran dituangkan ke dalam beaker glass berisi 300ml es batu.
6. Kristal yang didapat di herkristalisasi dengan menggunakan norit untuk menghilangkan kotoran – kotoran yang ada.
7. Setelah diherkristalisasi akan didapat kristal berupa jarum berwarna putih mengkilap dengan 2 mol air Kristal.
8. Hitung rendemen teoritis dari hasil yang didapat.
Rangkaian Alat dan Keterangan
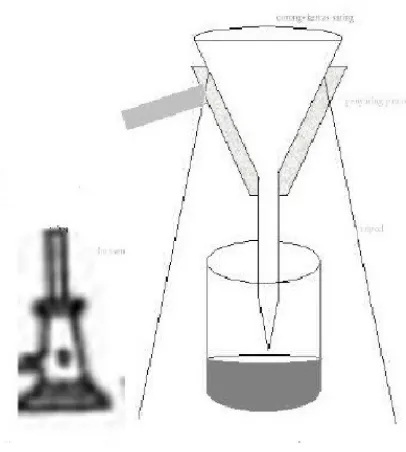
Gambar 2 : Proses penyaringan kristal.
IV.
DATA PENGAMATAN
1. Anilin
Massa anilin = 11 gram MR anilin = 93 gr/mol ρ anilin = 1,02 gr/mL Volume anilin = massa / ρ
= 11 gr / 1,02gr/mL = 10,78 mL
Mol Anilin = massa / MR = 11 gr / 93 gr/mol = 0,1182 mol
2. Asam Sulfat
MR H2SO4 = 98 gr/mol
ρ H2SO4 = 1,84 gr/mL
Volume H2SO4 = massa / ρ
= 50 gr/1,84gr/mL = 27,17 mL Mol H2SO4 = massa / MR
= 50 gr / 98 gr/mol = 0,5100 mol
Reaksi yang terjadi:
C6H5NH2 + H2SO4 C6H4NH2SO3H + H2O
Mula-mula : 0,1182 mol 0,5100 mol -
-Reaksi : 0,1182 mol 0,1182 mol 0,1182 mol 0,1182 mol - Sisa : 0 mol 0,3918 mol 0,1182 mol 0,1182 mol
Massa Asam sulfonil teoritis
Massa Asam Sulfonil = mol x MR
= 0,1182 mol x 173 gr/mol = 20,4486 gr
Massa Asam Sulfonil Praktis
Berat kertas saring + isi = 118.58 gr Berat kertas saring = 111.79 gr -Berat asam sulfonil = 6.79 gr
Rendemen= 6.79
20.4486 x100=33.21
V.
PEMBAHASAN
Larutan Anilin yang berwarna putih dimasukkan ke dalam labu dasar bulat lalu ditambahkan larutan Asam Sulfat berwarna putih. Pemberian Asam Sulfat ini sedikit demi sedikit dan selalu dikocok. Asam sulfat pekat dalam percobaan ini berfungsi sebagai elektrofilik yang akan menggantikan atom hidrogen pada anilin sedangkan anilin berfungsi sebagai penyumbang aril. Larutan tersebut berubah warna menjadi hitam setelah dicampurkan dengan Anilin, setelah itu campuran tersebut dipanaskan pada suhu 180-1900C dengan menggunakan oil bath. Suhu tersebut selalu
dijaga selama 4 jam agar metode kristalisasi dapat terbentuk .
keungu- keunguan. Proses pendinginan ini bertujuan agar kristal cepat terbentuk, setelah itu campuran yang sudah didinginkan dipisahkan air dan kristalnya dengan menggunakan pipet. Setelah air sudah habis lalu air tersebut diganti dengan volume air yang sama.
Lalu ditambahkan larutan norit diaduk sampai merata agar kotoran- kotoran yang ada dapat menghilang, lalu pemanasan herkristalisasi kembali di saringan pemanas agar kristal mengendap di bawah. Setelah itu campuran tersebut dituangkan dalam beaker glass yang berisi 300ml es batu agar kristal terbentuk saat bercampur dengan larutan Anilin + Asam Sulfat. Campuran tersebut disaring dengan kertas saring agar didapat kristal yang berwarna putih mengkilap. Setelah disaring, maka kristal tersebut dikeringkan dengan oven dan dihitung nilai rendemennya.
Mekanisme reaksi yang terjadi yaitu reaksi substitusi elektrofilik antara anilin dan asam sulfat pekat yaitu terjadi protonasi pada elektron bebas O pada asam sulfat sehingga atom O akan menyerang H pada anilin dan anilin akan kehilangan satu atom H. Kemudian anilin yang kehilangan satu atom H akan mengalami resonansi untuk menstabilkan senyawanya. Atom C negatif pada gugus benzena anilin akan menyerang atom S positif pada asam sulfat sehingga gugus sulfat akan berikatan pada anilin menjadi para amino benzen sulfonat. Para amino benzen sulfonat yang terbentuk akan mengalami resonansi untuk menstabilkan senyawanya lalu atom N negatif pada para amino benzen sulfonat akan menyerang atom H positif sehingga membentuk asam sulfanilat
VI.
KESIMPULAN
Pembuatan Asam Sulfanil merupakan gabungan reaksi Anilin dan Asam Sulfat. Proses pembuatan Asam Sulfanil ini menggunakan metode kristalisasi dan herkristalisasi pemanasan dan pendinginan. Larutan tersebut harus jenuh (superheated), suhu dijaga sampai 180 – 1900C agar kristal mudah terbentuk, dengan
saringan pemanas akan menghilangkan kotoran- kotoran, sehingga Kristal yang terbentuk berwarna putih mengkilap.
Berdasarkan praktikum pembuatan asam sulfonil dari anilin yang telah dilakukan, diperoleh bobot asam sulfanilat praktis sebesar 6.79 gram dari bobot asam sulfanilat teoritis sebesar 20,4486 gram. Maka, rendemen yang didapat sebesar 33.21 %.
VII.
TUGAS
1. Jelaskan mekanisme reaksi sulfonasi!
terbentuk akan mengalami resonansi untuk menstabilkan senyawanya lalu atom N negatif pada para amino benzen sulfonat akan menyerang atom H positif sehingga membentuk asam sulfanilat
2. Jelaskan perbedaan cooler dan kondensor! Mengapa sulfonasi tidak menggunakankeduanya?
Kondensor adalah sebuah alat penukar kalor (Heat Exchanger) yang digunakan untuk mengkondensasikan/mengubah gas yang bertekanan tinggi berubah menjadi cairan yang bertekanan tinggi yang kemudian akan dialirkan ke Receiver Dryer dan dilanjutkan ke expansi valve. Dalam penggunaannya kondensor diletakakan diluar ruangan yang sedang didinginkan supaya panas yang keluar saat pengoperasiannya dapat dibuang keluar sehingga tidak mengganggu proses pendinginan.
Cooler adalah suatu alat yang berfungsi untuk mencegah terjadinya over heating (panas berlebihan) dengan cara mendinginkan suatu fraksi panas dengan menggunakan media cairan dingin, sehingga akan terjadi perpindahan panas dari fluida yang panas ke media pendingin tanpa adanya perubahan suhu. Alat pendingin biasanya menggunakan media air, dalam prosesnya air pendingin tidak mengalami kontak langsung dengan fraksi pans tersebut, karena fraksi panas mengalir di dalam pipa sedangkan air pendingin berada di luar pipa.
3. Mengapa pemanasan dilakukan selama 4 jammenggunakan oilbath? Bisakah diganti dengan pemanas lain? Jelaskan!
pemilihan Oli sebagai agen penghantar panas adalah titik didihnya yang lebih tinggi, hal ini dibutuhkan untuk kebutuhan panas yang tinggi.
Tidak bisa digunakan pemanas lain, misal pemanas air (waterbath) karena air hanya dapat digunakan untuk memanaskan materi sampai suhu tidak melebihi 105°C karena diatas temperatur tersebut air sudah menguap.
4. Jelaskan mengapa herkristalisasi asam sulfonil harus dilakukan setelah pencucian dengan air aquadest? Bisakah dengan tanpa tahapan tersebut?
Dilakukan setelah pencucian dengan air aquadest yaitu untuk menghilangkan sisa-sia asam sulfat yang masih ada pada larutan dan untuk melarutkan sisa-sisa garam yang terbentuk. Apabila tahapan tersebut dilewatkan maka larutan asam sulfonilat yang terbentuk tidak sempurna karena masih mengandung sisa asam dari asam sulfat dan pengotor lainnya.