PEMANFAATAN MINYAK SEREH DAN FILTRAT
Trichoderma sp. UNTUK MENGENDALIKAN CENDAWAN
PATOGEN TERBAWA BENIH Acacia mangium Willd.
USMAN UMARELLA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Filtrat Trichoderma sp. Untuk Mengendalikan Patogen Terbawa Benih Acacia mangium Willd. adalah benar hasil karya saya sendiri dan belum pernah dipublikasikan. Semua sumber informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, April 2006
Usman Umarella NIM.E051020151
cendawan antagonis Trichoderma sp. dalam mengendalikan patogen terbawa
benih Acacia mangium Willd. Penelitian ini dilakukan di Laboratorium Bioteknologi Hutan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB dan Kebun Percobaan Cikabayan IPB. Perlakuan yang diuji adalah perendaman benih dalam minyak sereh 0,1%, perendaman dalam filtrat Trichoderma sp. dan kontrol (tanpa perendaman). Selanjutnya benih ditanam hingga semai berumur 30 hari untuk dilakukan pengamatan. Variabel yang diamati adalah aktivitas peroksidase, persentase serangan F. solani dan panjang batang semai. Rancangan yang digunakan adalah rancangan acak lengkap (RAL). Hasil penelitian menunjukkan bahwa aktivitas peroksidase, penurunan serangan tidak berbeda nyata antar perlakuan. Perlakuan perendaman benih dalam filtrat Trichoderma sp. cenderung meningkatkan panjang batang semai A. mangium.
Trichoderma sp. to Control Pathogen Fungus Carried by Seed of Acacia mangium
Willd. Under Guidance of Achmad, Abdul munif, and Baran Wirawan.
This research is aimed at studying the potency of lemon grass oil and antagonistic fungus Trichoderma sp. in controlling pathogen carried by Acacia mangium Willd. The research was conducted in Forest Biotechnology Laboratory
of Center for Natural Resources Reseach and Biotechnology IPB, and Cikabayan Experimental Station of IPB. The treatments were : (1) soaking seed in 0.1 % lemon grass oil, (2) soaking seeds in filtrate culture of Trichoderma sp., and (3) control (seeds without soaking). The experiment used complete randomized design with four replications. Variables observed were percentage of F. solani
attack, peroxidase activity, and the length of seedling stem. The result reveals that treatments were not significantly different based on the variables observed. However, soaking seeds in filtrate culture of Trichoderma sp. tend to be better lengthen the stem seedling of A. mangium.
Keyword: Seed disease, F. solani, fragrant grass oil, Trichoderma sp.,
A. mangium
@
Hak cipta Usman Umarella, tahun 2006
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian Bogor, sebagian atau seluruhnya
USMAN UMARELLA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pengetahuan Kehutanan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
mangium Willd. Nama : Usman Umarella NIM : E051020151
Disetujui
Komisi Pembimbing
Dr. Ir. Achmad, M.S. Ketua
Dr. Ir. Abdul Munif, M.Sc. Ir. Baran Wirawan, M.Sc.
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pengetahuan Kehutanan
Dr. Ir. Dede Hermawan, M.Sc. Prof. Dr. Ir. Syafrida Manuwoto, M.Sc.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian adalah Pemanfatan Minyak Sereh dan Filtrat Trichoderma sp. untuk Mengendalikan Patogen Terbawa Benih Acacia mangium Willd.
Terima kasih penulis sampaikan kepada Dr. Ir. Achmad, MS., Dr. Ir. Abdul Munif, M.Sc. dan Ir. Baran Wirawan, M.Sc. selaku komisi pembimbing yang telah memberikan saran dan arah an dalam merampungkan tesis ini, serta Bapak Dr. Ir. Bonny PW. Soekarno, MS. selaku penguji luar komisi pembimbing yang telah memberikan saran dan arahan.
Ucapan terimakasih juga penulis sampaikan kepada petugas Laboratorium Percobaan Cikabayan dan para laboran Laboratorium Bioteknologi Hutan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB yang telah banyak membantu selama penelitian ini. Terima kasih pula kepada teman-teman seperjuangan di asrama Pondok Permata Bunda.
Ucapan terima kasih kepada istri tercinta Sriwahyuni Tuasalamony dan anak tersayang Achmad Rizki Munif Umarella atas kesabaran, dukungan do’a dan dorongan kepada penulis dalam melaksanakan studi ini.
Ahkirnya, semoga hasil karya ini dapat bermanfaat.
Bogor, April 2006
Hasan Umarella dan Ibu (Alm) Hj. Kalsum Ohorella. Penulis adalah putra bungsu dari enam bersaudara.
Pendidikan sarjana ditempuh di Program Studi Budidaya Tanaman Fakultas Pertanian Universitas Darussalam Ambon dan lulus pada tahun 1999. Pada tahun 2002 penulis diterima di Program Studi Ilmu Pengetahuan Kehutanan pada Sekolah Pascasarjana Institut Pertanian Bogor. Beasiswa pendidikan Pascasarjana diperoleh dari Biaya Pendidikan Program Pascasarjana (BPPS). Departemen Pendidikan Nasional.
Penulis bekerja sebagai Dosen di Universitas Darussalam Ambon sejak tahun 2001. Pada tahun 2004 Penulis diterima sebagai Dosen Kopertis Wilayah XII di Ambon unit kerja Univ. Darussalam Ambon. Selama studi S2, penulis menjadi anggota Forum Wacana Sylva IPB.
Sebagai salah satu syarat penyelesaian studi pascasarjana, penulis melakukan penelitian dengan judul : Pemanfaatan Minyak Sereh dan Filtrat
Trichoderma sp. untuk Mengendalikan Patogen Terbawa Benih Acacia
DAFTAR TABEL ... xii
Mikroorganisme pada Benih... 5
Potensi Minyak Sereh untuk Pengendalian Cendawan Patogen... 7
Trichoderma sp. sebagai Antagonis Patogen... 8
Pelapisan Benih dengan Cendawan Antagonis... 9
Peroksidase... 10
BAHAN DAN METODE Tempat dan Waktu Penelitian... 13
Metode Penelitian... 13
HASIL DAN PEMBAHASAN Karakteristik Isolat Cendawan Patogen Lodoh dan Patogenesitasnya pada benih A.mangium... 22
Cendawan Antagonis... 23
Uji Antagonis in vitro... 24
Pengaruh Minyak Sereh terhadap Pertumbuhan F. solani secara in vitro... . 25
Pengendalian Serangan F. solani... 26
Aktivitas Peroksidase Semai A. mangium ... 27
Panjang Batang Semai A. mangium ... 28
Pembahasan... 28
Patogenisitas F. solani... 28
Pengujian in vitro... 30
Pengaruh Minyak Sereh dan Filtrat Trichoderma sp. terhadap Induksi Resistensi Semai A. mangium ... 30
Pengaruh Minyak Sereh dan Filtrat Trichoderma sp. terhadap Panjang Batang Semai A. mangium. ... 31
SIMPULAN DAN SARAN Simpulan ... 33
Halaman 1. Serangan penyakit lodoh (%) yang disebabkan oleh F. solani... 23 2. Daya hambat minyak sereh terhadap pertumbuhan cendawan
F. solani secara in vitro... 27
3. Pengaruh bahan penginduksi (minyak sereh dan filtrat Trichoderma sp.) terhadap persentase semai mati
A. mangium umur 2 minggusetelah sebar yang diinokulasi
dengan F. solani. ... 27 4. Pengaruh bahan penginduksi minyak sereh dan inokulasi
F. solani terhadap aktivitas peroksidase semai A. mangium
umur pada umur 4 minggu setelah sebar... 27
5. Pengaruh perlakuan minyak sereh dan filtrat Trichoderma sp.
Halaman 1. Tahapan Kegiatan Penelitian Pemanfaatan Minyak Sereh dan
Trichoderma sp. untuk mengendalikan Patogen terbawa Benih
Acacia mangiu m Willd ... 14
2. F. solani. (a) Koloni pada media PDA berumur empat hari,
(b) hifa dan (c) konidia... 22
3. Gejala serangan Lodoh pada benih A. mangium (a) Gejala
serangan terjadi pada benih belum berkecambah
(b) Gejala serangan terjadi pada benih sudah berkecambah.... ... 23 4. Trichoderma sp.: (a) koloni pada media PDA berumur 5 hari,
(b1) hifa, (b2) fialid dan (b3) konidia... 24 5. Uji antagonis antara F. Solani(F) dengan Trichodermasp. Secara
in vitro pada media PDA... 25
Halaman
1. Prosedur Uji Aktivitas Peroksidase... 39
2. Analisis ragam patogenisitas F. solani ... 40
3. Analisis ragam persentase daya hambat minyak sereh terhadap cendawan F. solani... 40
4. Analisis ragam persentase serangan cendawan F. solani... 40
5. Analisis ragam panjang batang semai A. mangium ……….... 40
6. Analisis ragam aktivitas peroksidase semai A. mangium... 40
Latar Belakang
Hutan merupakan salah satu sumber alam yang sangat penting yang perlu dilestarikan keberadaannya, sebab hutan memberikan dukungan yang penting untuk memenuhi kebutuhan hidup manusia. Dengan makin meningkatnya jumlah penduduk serta kebutuhan hidupnya maka diperlukan dukungan sumber daya alam yang meningkat pula.
Salah satu program dalam bidang kehutanan adalah dengan penerapan
pembangunan HTI yang merupakan suatu kebijakan yang perlu mendapat perhatian ekstra, dalam upaya untuk menjaga kelangsungan kebutuhan manusia.
Acacia mangium Willd. merupakan salah satu jenis pohon yang
dibudidayakan pada lokasi HTI karena cepat tumbuh serta dapat digunakan untuk
bahan industri. A. mangium mempunyai kelebihan-kelebihan bila dibandingkan dengan pohon HTI lainnya seperti : batang lurus, tajuk cepat menutup tanah dan mempunyai prospek yang baik untuk papan partikel seperti untuk kayu pertukangan maupun bahan pulp (Sindusuwarno dan Utomo 1981).
Keberhasilan pembangunan HTI ditentukan oleh berbagai faktor, salah satu diantaranya adalah ketersediaan benih yang bermutu dalam jumlah yang cukup. Mutu benih menjadi faktor penentu keberhasilan penanaman secara ekonomis. Penggunaan benih bermutu rendah akan menghasilkan tanaman yang
tidak seragam dengan persentase tumbuh rendah, dan dapat menjadi sumber inokulum bagi penyakit yang terbawa oleh benih (Ilyas 2000).
Cendawan patogen biji atau benih dapat dikelompokkan menjadi dua yaitu cendawan yang berasal dan terbawa dari lapangan (field fungi) dan cendawan
yang berkembang di penyimpanan (storage fungi).
Cendawan lapangan (field fungi) menyerang biji selama di lapangan dan menginfeksi biji yang telah masak atau sesudah panen sebelum dilakukan pemrosesan. Cendawan yang tergolong field fungi adalah Alternaria spp.,
Epicoccum purpurances, Fusarium spp., Verticillium alboatrum dan Sclerotium
rolfsii. Jenis cendawan tersebut dapat bertahan pada biji dalam kondisi dingin atau
disebabkan oleh Fusarium sp. (Soeyamto dan Mardji 1986 diacu dalam Kenneth 2000).
Perindungan terhadap benih dapat dilakukan secara kimiawi dengan menambahkan fungsida dan bakterisida atau bahan kimia lain yang mampu
menekan atau mencegah pertumbuhan patogen sejak benih disimpan hingga berkecambah. Perlindungan juga dapat dilakukan secara hayati yaitu dengan
menggunakan agen antagonis untuk mengendalikan patogen benih dan patogen penghuni tanah, misalnya dengan menggunakan cendawan antagonis (Copeland
dan McDonald 1985)
Usaha perlindungan tanaman dengan menginduksi ketahanan inang
merupakan salah satu alternatif pengendalian yang ramah lingkungan disamping cara pengendalian lain yang telah dikembangkan, misalnya dengan penggunaan
antagonis dan fungisida nabati secara langsung. Salah satu agen antagonis dan fungisida nabati yang mempunyai prospek untuk dikembangkan adalah
Trichoderma dan minyak sereh. Efektifitas Trichoderma harzianum dan
T. Pseudokoningii secara in vitro mampu menghambat pertumbuhan
F. oxysporum dan Rhizoctonia solani (Achmad 1997). Minyak sereh wangi
secara in vitro telah diketahui diantaranya dapat menghambat pertumbuhan F.
oxysporum (Mugiono 2002).
Perlakuan benih sebelum penanaman merupakan bentuk dari peningkatan
mutu benih (Taylor et al. 1998). Peningkatan mutu didefinisikan sebagai perlakuan pasca panen untuk meningkatkan perkecambahan benih dan
pertumbuhan semai atau menjadikan benih sebagai agen pembawa bahan lain yang dibutuhkan untuk perlindungan tanaman. Defenisi ini mencakup empat
aspek, yaitu (1) perlakuan hidrasi (priming), (2) pelapisan benih (seed coating) , (3) pembersihan benih dari kotoran / kontaminan dan (4) seleksi berdasarkan
kriteria fisik (seed conditioning).
Teknik pelapisan benih telah dikembangkan secara komersial pada benih
tanaman hortikultura, seperti pelapisan benih dengan menggunakan cendawan antagonis T. harzianum dan agen pengikat Pelgel, telah menunjukkan hasil yang
benih tanaman kehutanan teknik ini belum banyak diaplikasikan dan masih dalam tahap percobaan ( Schmidt 2000).
Sehubungan dengan hal di atas maka dirasakan perlu untuk melakukan penelitian tentang perlakuan pra tanam benih A. mangium dalam upaya
meningkatkan mutu benih sehingga diharapkan benih yang ditanam dapat tahan dari penyakit yang menyerang benih dalam masa penyimpanan.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji potensi minyak sereh dan cendawan antagonis Trichoderma sp. dalam pengendalian cendawan terbawa benih dan
meningkatkan vigor benih A. mangium.
Hipotesis
Minyak sereh dan filtrat biakan Trichoderma sp. dapat meningkatkan
A. mangium termasuk dalam famili Leguminose sub famili Mimosoidae.
Nama lainnya A. galucescens dan mangium montanum. Secara umum dikenal di Sabah dengan sebutan Alwood, Brown, Black wattle, Hickory wattle. Di Indonesia pohon ini telah banyak dikembangkan dan telah ditanam secara besar-besaran dalam rangka pembangunan HTI.
Tinggi pohon berkisar antara 15 -30 meter. Diameter batang 90 cm, kulit berwarna coklat, tebal, kasar dan keras. Waktu stadia kecambah bentuk daunnya hampir sama dengan Leucaena, Albizia dan jenis lain dari sub famili Mimosoidae.
Setelah beberapa minggu tumbuh daun palsu (phyllode) yang merupakan ciri khas
untuk membedakan jenis ini dalam sub familinya. Daun palsu merupakan daun tunggal, tulang daun sejajar, berukuran > 25 cm x 10 cm. Daun palsu inilah yang sehari-hari disebut sebagai daun.
Bunga tersusun secara longitudinal di dalamnya. Bunga majemuk berwarna putih atau kuning muda, penyerbukan sendiri atau silang. Panjang biji 3 – 5 mm, berkulit keras, warna hitam. Produksi biji 0,4 kg/pohon/tahun.
Padley (1978) menyatakan bahwa bunga A. mangium berbentuk bulir. Panjang bulir dapat mencapai 10 cm. Bulir ini terdapat secara tunggal atau
berpasangan pada ketiak daun bagian atas, ibu tangkai berbulu atau tidak dengan panjang sekitar 1 cm. Tangkai bunga berbulu halus serta bunga memiliki lima
kelopak dengan panjang 0.6 – 0.8 mm dengan sedikit bagian ujung yang membulat. Tajuk atau mahkota berjumlah lima, panjang dua kali panjang kelopak.
Penyebaran dan Tempat Tumbuh
Menurut Sindusuwarno dan Utomo (1981), A. mangium terdapat di
Australia bagian Utara, Irian Jaya bagian Selatan (Fak-fak, Manokwari, Sedai, sepanjang sungai Digul dan Merauke), di kepulauan Aru (pulau Tragam dan
kepulauan Ngaibar), dan merupakan jenis asli di Maluku (pulau Sula Besi/Sanana, Taliabu, Teje dan pulau Seram). A. mangium dijumpai mulai dari pantai sampai
A. mangium tidak membutuhkan persyaratan tumbuh yang sulit. Dapat
tumbuh dengan baik pada semua jenis tanah yaitu baik pada tanah yang miskin
hara sampai tanah yang subur. Pada tanah yang jelek masih dapat tumbuh lebih baik dari jenis pohon cepat tumbuh lainnya (Sindusuwarno dan Utomo 1981). Di
pulau Seram A. mangium tumbuh pada tanah podsolik merah kuning, sedangkan di Sabah telah ditanam pada tanah lentisol dan ultisol yang bersifat masam.
Davidson (1982) menyatakan bahwa di Maluku, Papua Nugini Barat pada daerah penyebaran A. mangium, suhu rata-rata tahunan antara 25 – 27 oC. Pada
daerah Oriomo (Papua Nugini) suhu rata-rata tahunan 26.7oC dengan rata-rata suhu maksimum 30.6 – 31.1 oC dan rata-rata suhu minimum 22.8 – 23.3 oC. Pada
daerah tersebut curah hujan tiap tahun berkisar 1500-4000 mm.
Mikroorganisme pada Benih
Infeksi cendawan pada buah dan benih dapat terjadi pada setiap tahap
perkembangan tetapi lebih banyak terjadi pada tahap pematangan, khususnya di daerah yang tahap perkembangannya bertepatan dengan musim yang kelembabannya tinggi (musim Hujan) (Schmidt 2000)
Benih membawa aneka macam jenis mikroorganisme. Mungkin sebagian
dari mikroorganisme tersebut bersifat patogen bagi tanaman (Christensen 1972; Limonard dan Tempe 1973; Mayumder 1974; Neergraard 1977). Mikroorganisme tersebut menempel pada permukaan testa dan disebut mikroorganisme eksternal, atau terdapat di dalam jaringan -jaringan benih dan disebut mikroorganisme
internal benih (Mayunder 1974).
Christensen (1972) menggolongkan mikroorganisme pada benih, khususnya cendawan, menjadi dua golongan. Golongan pertama adalah cendawan tempat penyimpanan. Golongan cendawan tersebut mengkontaminasi benih pada
saat panen dan pengolahan, serta pada saat benih disimpan dalam gudang. Kondisi ruang simpan yang lembab dan panas akan mendorong pertumbuhan cendawan. Aktifitas metabolisme cendawan akan menyebabkan ruang simpan menjadi lebih panas dan lembab, sehingga merangsang proses respirasi benih berlangsung lebih
Golongan kedua adalah cendawan lapang biasanya terdapat di dalam jaringan-jaringan benih atau pada permukaan benih. Cendawan tersebut
menyerang benih pada saat benih masih pada fase pembentukan dan perkembangan. Banyak diantara fungi lapang yang bersifat parasit. Biasanya
cendawan tersebut akan menjadi patogen yang dapat ditularkan melalui benih dan dapat menurunkan kualitas benih, menggagalkan perkecambahan benih dan
menimbulkan penyakit pada tanaman seperti Fusarium, Alternaria,
Helminthosporium (Chstensen 1972; Mayunder 1974).
Menurut Halloin (1986) organisme pada benih dikelompokkan kedalam tiga golongan berdasarkan parasitismenya. Ketiga kelompok tersebut ialah (1).
parasit obligat, (2) saprofit fakultatif dan (3) parasit fakultatif. Parasit obligat ialah organisme yang seluruh hidupnya tergantung pada sel induk inangnya. Parasit
fakultatif ialah organisme saprofit, tetapi dapat berperan sebagai parasit lemah. Saprofit fakultatif ialah organisme parasit, tetapi bersifat saprofit.
Diantara organisme-organisme yang terdapat pada benih dapat saling mematikan (antagonistik) atau saling bekerja sama (sinergistik). Benih sendiri
juga memberikan respon yang berbeda terhadap masing-masing organisme tersebut. Sebaliknya setiap jenis organisme pada benih juga memberikan respon
yang berbeda terhadap benih (Lomonard dan Tempe 1973)
Menurut Halloin (1986), ada dua mekanisme merusak dari organisme
terbawa oleh benih, yaitu dengan menghasilkan enzim eksoseluler dan toksin. Enzim eksoseluler yang biasanya diproduksi oleh mikroorganisme ialah enzim
selulase, pektinase, amilase, protease, dan nuklease. Cendawan penyimpanan dan cendawan lapang menghasilkan enzim eksoseluler untuk menguraikan
bahan-bahan cadangan benih (protein, lemak, dan karbohidrat) menjadi bahan-bahan-bahan-bahan yang dapat digunakan oleh cendawan. Aktifitas tersebut dapat menyebabkan
kualitas benih menurun.
Mikroorganisme terbawa oleh benih, khususnya cendawan tempat
penyimpanan dan cendawan lapang, menghasilkan senyawa-senyawa yang toksik terhadap ben ih. Beberapa dari senyawa toksik itu dapat meningkatkan konsentrasi
Bruimeister dan Plattner (1987) dapat mengisolasi F. tricinctum dari tanaman gandum di musim dingin yang menyebabkan busuk akar dan tajuk.
Patogen menghasilkan senyawa toksik enniatin. Bila larutan yang mengandung enniatin dipakai untuk melembabkan medium perkecambahan benih gandum,
maka akan terjadi reduksi pertumbuhan kecambah yang sebanding dengan besarnya konsentrasi enniatin. Pemanjangan akar lebih dihambat dari pad a
pemanjangan daun.
Kerugian yang ditimbulkan oleh mikroorganisme terbawa benih ialah: (1)
menurunkan viabilitas benih dan mempercepat laju kemunduran benih, (2) merupakan inokulum bagi tanaman-tanaman sehat lainnya di dalam lahan atau
antar lah an (Christensen 1972; Mayunder 1974; McDonald dan Nelson 1986). Pada umumnya penyakit yang ada di pesemaian A mangium akibat
serangan cendawan tanah, dilaporkan sebagai penyakit lodoh. Serangan cendawan lodoh dapat dibedakan dalam tiga fase pertumbuhan inang, yaitu:
1. Serangan terjadi pada benih yang belum berkecambah sehingga benih menjadi busuk. Gejala demikian disebut lodoh benih (germination -loss) (Hartley 1921
diacu dalamAchmad 1997).
2. Serangan terjadi pada benih yang sudah berkecambah tetapi belum sempat
muncul ke atas permukaan tanah, akibatnya bibit akan mati di dalam tanah. Gejala demikian disebut lodoh dalam tanah (pre-emergence damping-off)
(Boyce 1961).
3. Serangan terjadi pada benih yang sudah berkecambah dan sudah muncul ke atas
permukaan tanah. Gejala demikian disebut lodoh batang (post - emergence
damping off). Serangan pada fase ini dibedakan menjadi dua yaitu lodoh
pangkal batang (soil-infection type) jika invasi patogen terjadi pada akar atau pada hipokotil dekat permukaan tanah, dan lodoh tajuk (top-infection type atau
top damping-off) jika menyerang kotiledon atau hipokotil bagian atas (Boyce
1961).
Potensi Minyak Sereh untuk Pengendalian Cendawan Patogen
suku Poaceae atau rumput-rumputan. Menurut Said (1986) minyak sereh wangi mengandung tiga jenis senyawa kimia utama yaitu : sitronellal, sitronellol dan
geraniol. Minyak sereh wangi banyak digunakan dalam industri, terutama sebagai pewangi sabun, desinfektan, bahan pengilap, dan aneka ragam preparasi teknis.
Menurut penelitian yang dilakukan oleh Hartati et al. (1993) dilaporkan minyak sereh wangi dapat menghambat pertumbuhan Bacillus sp. dan
Pseudomonas solanacearum (E.F. Schmidt). Raghavaiah dan Jayaramaiah (1978)
melaporkan bahwa minyak sereh dapat menekan 20 % pertumbuhan Beuvaria sp.
Penambahan minyak sereh wangi dalam medium tumbuh pada konsentrasi 0.1 %, 0.2 %, 0.4 % mampu menekan pertumbuhan A. flavus dan F. oxysporum
sebesar 100 %. Perlakuan pada konsentrasi 0.1 % tidak menimbulkan efek fitotoksik terhadap perkecambahan benih, sehingga relatif aman untuk digunakan
dalam perlakuan benih (Mugiono 2002).
Trichoderma sp.sebagai Antagonis Patogen
Peningkatan pertumbuhan tanaman oleh strain Trichoderma telah
dilaporkan beberapa tahun lalu (Lindsey dan Baker 1967). Chang et al. (1986) melaporkan adanya peningkatan pertumbuhan tanaman yang menghasilkan
peningkatan perkecambahan, peningkatan pembungaan dan peningkatan berat tanaman pada tanah yang diberi perlakuan T. harzianum. Peningkatan
pertumbuhan tanaman juga dilaporkan oleh Windham et al. (1986) yang mengamati fenomena ini pada tanaman jagung, tomat, tembakau dan lobak.
Kleifeld dan Chet (1992) melaporkan bahwa T. harzianum T-203 yang
diaplikasikan untuk mengendalikan patogen tanah, mempunyai kemampuan untuk
menginduksi dan meningkatkan perkecambahan benih, tinggi tanaman, berat kering tanaman dan luas daun pada tanaman kacang tanah, lobak, tomat, cabe dan
ketimun. T. harzianum diaplikasikan kedalam tanah melalui tiga cara yaitu
aplikasi suspensi konidia, melalui sekam atau kompos dan pelapisan benih.
Mekanisme dalam antagonis antar jasad renik digolongkan dalam tiga mekanisme, yaitu antibiosis, kompetisi dan mikoparatisme (Baker dan Cook 1974,
Mekanisme antibiosis melibatkan metabolit beracun atau enzim ekstraseluler yang dihasilkan oleh cendawan antagonis (Wells 1988 diacu dalam
Achmad 1997). Mekanisme kompetisi menunjukkan penekanan pertumbuhan cendawan patogen, dalam hal ini cendawan antagonis lebih kompetitif dalam
memanfaatkan ruang tumbuh dan nutrisi. Pada mikoparasitisme terjadi penempelan dan pelilitan hifa cendawan antagonis terhadap cendawan patogen.
Penelitian Achmad (1997) menunjukkan pelilitan dan penetrasi hifa R. solani oleh
T. harzianum yang merupakan fenomena awal rusaknya hifa patogen.
Pelapisan Benih dengan Cendawan Antagonis
Perlakuan benih secara hayati, dapat dilakukan antara lain dengan
memanfaatkan cendawan antagonis. Perlakuan benih dengan cara pelapisan benih dengan menggunakan filtrat T. harzianum menunjukkan hasil yang nyata dalam mengendalikan serangan patogen lodoh pada benih tanaman hortikultura. Pada perlakuan ini cendawan antagonis akan melindungi benih dan akar tanaman dari
serangan patogen sehingga pertumbuhan tanaman menjadi meningkat (Taylor
et al. 1994).
Agar perlakuan benih secara hayati dapat berhasil dengan baik maka harus disiapkan bioprotectant yang berkualitas tinggi. Bioprotektant yang digunakan
harus memiliki viabilitas dan vigor yang tinggi, dalam arti propagulnya harus mampu berkecambah dan memenuhi tujuan yang diharapkan dan toleran terhadap pengeringan, sebab setelah selesai perlakuan benih akan disimpan sampai waktu akan ditanam.
Perlakuan benih secara hayati harus mencakup komponen-komponen yang
mendukung pertumbuhan mikroorganisme (Maude 1997). Ada dua faktor yang menghambat pertumbuhan mikroorganisme yang diinginkan tersebut pada benih yaitu karena adanya kompetisi dengan flora mikro dan karena lingkungan edafik
yang tidak menguntungkan seperti pH, nutrien dan kelembaban.
1. Bahan makanan bagi mikroba
Chitin dan selulosa mampu meningkatkan aktivitas T. harzianum dalam
mengendalikan R. solani atau P. ultimum (Harman et al. 1981, diacu dalam
Taylor dan Harman 1990).
2. Derajat kemasaman (pH)
Trichoderma spp. dapat tumbuh baik pada lingkungan ber-pH rendah sementara
bakteri lebih menyukai pH yang mendekati netral. Kulit benih yang memiliki kemasaman yang bervariasi akan mempengaruhi aplikasi bioprotectant.
3. Kolonisasi
Keuntungan dari perlakuan solid matric priming dengan menggunakan
bioprotectant adalah mikroba mengkolonisasi permukaan benih selama masa
priming.
4, Waktu
Efektifitas perlakuan benih secara hayati tergantung pada kecepatan
bioprotectant untuk mengkolonisasi benih. Pythium spp. berkecambah dalam
waktu 2 jam setelah benih ditanam sementara spora Trichoderma spp.
berkecambah setelah 14 jam benih ditanam. 5. Pengendalian terpadu bersama bahan toksik lain.
Ada beberapa keuntungan yang diperoleh dari memadukan perlakuan hayati dengan bahan toksik (biasanya pestisida). Pertama, bahan toksik dapat
meminimumkan pengaruh buruk dari kompetisi flora mikro terhadap
bioprotektant. Kedua, pengaruh bioprotektant dan agen kimia dapat bersifat
aditif dan sinergis untuk melawan satu patogen atau patogen yang kompleks.
Peroksidase
Peroksidae adalah enzim yang umum terdapat dalam sel-sel tumbuhan dan hewan tertentu. Peran peroksidase dalam pertahanan tanaman dihubungkan
menyebabkan enzim ini diduga terlibat dalam sistem pertahanan inang (Srivastava 1987).
Hasil analisis biokimia menunjukkan bahwa peroksidase, ketinase dan 1,3-glukanase terlibat dalam mekanisme resistensi terinduksi pada tanaman dikotil
terhadap cendawan biotrof. Ketinase dan 1,3-glukanase secara biologis berperan aktif terhadap penekanan cendawan melalui hidrolisis polimer dinding sel,
sedangkan peroksidase berperan dalam proses lignifikasi dan pembentukan senyawa metabolit sekunder (Wheeler 1975; Wahyuni 1999; Park dan Kloepper
2000).
Aktifitas peroksidase berpengaruh terhadap patogen secara in vitro dan in
vivo. Secara in vitro peroksidase dapat menghambat perkecambahan uredospora
P. graminis. Pengaruh penghambatan lebih besar jika ke dalam larutan
peroksidase ditambahkan hydrogen peroksida (Macko et al. 1968). Secara in-vivo, aktivitas peroksidase meningkat pada tanaman yang tahan dan rentan sebagai
respon terhadap infeksi cendawan patogen (Macko et al. 1988; Wulandari 1992).
Peningkatan aktivitas peroksidase pada tanaman yang tahan terhadap patogen
lebih tinggi dibandingkan pada tanaman yang rentan.
Peningkatan aktivitas peroksidase selain dapat terjadi karena infeksi
patogen, dapat juga terjadi karena luka mekanis, senyawa kimia atau mikroorganisme yang non-patagonik. Gentile et al. (1988) melaporkan bahwa
jaringan akar tanaman tomat yang ditempatkan dalam ruang panas pada suhu 510C selama 30 detik, dicelupkan ke dalam kloroform selama 3 menit atau
diinokulasi dengan cendawan yang non-patogenik dengan merendam akar tanaman dalam suspensi mikrokonidia (6x10-6/ml) Fusarium oxysporum,
Fusarium sp. selama 15 menit, akan menyebabkan peningkatan aktivitas
peroksidase yang mencapai maksimum pada 3 hari setelah perlakuan.
Peningkatan aktivitas peroksidase dapat menimbulkan induksi ketahanan, yang diikuti oleh peningkatan proses lignifikasi pada dinding sel tanaman inang.
Lignifikasi ini merupakan salah satu respon tanaman terhadap infeksi patogen (Hammerschmidt dan Kuc 1982). Vance et al. (1980) diacu dalam Stemer (1995)
oksidasif dari hydroxycinnamyl alkohol untuk membentuk lignin, proses ini umumnya dilaporkan sebagai mekanisme ketahanan tanaman. Fungsi lain dari
peroksidase adalah memperkuat dinding sel terhadap degradasi enzim yang dihasilkan oleh patogen melalui pembentukan protein struktural pada dinding sel.
Serangan patogen lodoh pada semai P. merkusi terbatas pada semai muda, dan ketahanan semai akan semakin meningkat dengan semakin bertambahnya
umur semai tersebut. Terdapat beberapa fenomena yang mungkin terjadi berkenaan dengan peningkatan ketahanan semai baik bersifat biokimia maupun
struktural dengan bertambahnya umur semai tersebut. Kemungkinan terjadi peningkatan kandungan senyawa fenolik semai dan peningkatan aktivitas enzim
oksitatif dengan semakin bertambahnya umur, sehingga ketahanan semai terhadap patogen lodoh meningkat.
Aktivitas peroksidase P. merkusi nyata berubah dengan bertambahnya umur semai (Achmad 1997). Pada semai umur satu minggu, aktifitas peroksidase
sebesar 17.65 UAE/gbb dan terus meningkat hingga mencapai aktivitas tertinggi yaitu sebesar 43.55 UAE/gbb pada semai umur 3 minggu. Aktivitas peroksidase
pada semai umur 4 minggu hingga 8 minggu terus berkurang secara nyata. Peningkatan aktivitas peroksidase diikuti dengan peningkatan persentase kadar
lignin batang semai P. merkusii. Kadar lignin batang semai umur satu minggu
sebesar 2.46 % dan terus meningkat hingga mencapai 8.39 % pada semai umur 8
minggu (Achmad 1997).
Achmad (1997) juga melaporkan bahwa aktivitas peroksidae pada semai
P. merkusii berhubungan dengan periode serangan patogen lodoh. Persentase
semai yang mati akibat inokulasi cendawan patogen lodoh pada semai umur muda
(0, 2, dan 4 minggu) nyata lebih tinggi dibanding pada semai yang lebih tua (6, 7, dan 8 minggu). Semai umur 8 minggu telah bebas dari kematian akibat patogen
Penelitian ini dilaksanakan di laboratorium Bioteknologi Hutan Pusat
Penelitian Sumberdaya Hayati dan Bioteknologi IPB, dan kebun Percobaan Cikabayan IPB. Penelitian ini dilaksanakan selama 4 bulan, dari bulan Januari sampai April 2005.
Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari benih A.
mangium, patogen, cendawan antagonis, dan minyak sereh. Benih A. mangium
yang diuji berasal dari KPH Cianjur. Patogen penyebab penyakit lodoh diisolasi dari benih A. mangium sedangkan cendawan antagonis diisolasi dari tanah tegakan
A. mangium. Minyak sereh yang diuji diperoleh dari pasar dan diproduksi oleh
Nuansa Kimia Farma Jakarta.
Metode Penelitian
Penelitian ini diawali dengan uji pendahuluan yang bertujuan untuk: (1) mendapatkan cendawan patogen penyebab penyakit lodoh, (2) mengisolasi
cendawan antagonis Trichoderma sp., (3) menguji kemampuan antagonisme dari
Trichoderma sp. terhadap cendawan patogen secara in vitro, (4) menguji pengaruh
minyak sereh terhadap pertumbuhan cendawan patogen secara in vitro, dan (5) menentukan konsentrasi minyak sereh yang akan digunakan dalam pelapisan
benih.
Apabila dari uji pendahuluan yang dilakukan secara in vitro diperoleh
hasil minyak sereh dan Trichoderma sp. mampu menekan pertumbuhan cendawan patogen, maka dilakukan pengujian pada semai (in vivo). Secara skematis, seluruh
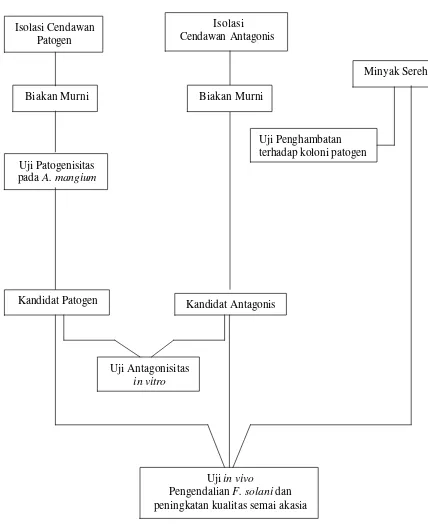
rangkaian percobaan, baik in vitro maupun in vivo mengikuti langkah-langkah sebagaiman tersaji pada Gambar 1.
Isolasi Cendawan Patogen Lodoh
Isolasi cendawan patogen penyebab penyakit lodoh dari benih A. mangium
Gambar 1.Tahapan Kegiatan Penelitian Pemanfaatan Minyak Sereh dan
Trichoderma sp. untuk Mengendalikan Patogen terbawa Benih Acacia mangium Willd.
Isolasi
Cendawan Antagonis
Biakan Murni
Uji Patogenisitas pada A. mangium
Kandidat Antagonis Kandidat Patogen
Isolasi Cendawan Patogen
Minyak Sereh
Biakan Murni
Uji Penghambatan terhadap koloni patogen
Uji Antagonisitas
in vitro
Uji in vivo
Metode kesehatan benih yang digunakan adalah metode blotter yang direkomendasikan ISTA (1999). Metode ini didasarkan pada pertumbuhan
kecambah dan propagul cendawan. Tahapan kegiatan dalam isolasi cendawan patogen penyebab penyakit lodoh dari benih A. mangium adalah sebagai berikut :
1. Penyiapan media. Tiga helai kertas merang steril dilembabkan dengan cara mencelupkannya ke dalam aquades, kemudian ditempatkan dalam
cawan petri.
2. Seleksi benih. Dipilih benih A. mangium yang besar, bernas, dan seragam untuk ditempatkan pada cawan petri yang telah berisi kertas merang. Kegiatan dilakukan secara aseptik di meja laminar.
3. Perlakuan benih. Untuk mendeteksi cendawan yang berada dalam jaringan benih, benih diberi perlakukan desinfektan alkohol 70 % selama
2-5 menit, kemudian dibilas dengan air steril. Sedangkan benih tanpa perlakuan desinfektan digunakan untuk mendeteksi cendawan pada
permukaan benih. Masing-masing perlakuan menggunakan 20 benih/cawan petri dengan 10 kali ulangan.
4. Kolonisasi patogen. Benih uji dalam cawan petri diinkubasi selama tujuh hari. Pada hari pertama benih ditempatkan pada suhu ruang selama 24 jam
dengan penyinaran NUV 12 jam terang dan 12 jam gelap. Pada 24 jam ke dua benih diinkubasi pada suhu -200C, selanjutnya pada hari ke tiga
sampai hari ke tujuh benih diinkubasi pada suhu ruang dengan penyinaran NUV 12 jam terang dan 12 jam gelap secara bergantian.
5. Pemurnian isolat. Patogen yang teridentifikasi sebagai F. solani diambil
sporanya menggunakan jarum ose di bawah mikroskop, kemudian
dimurnikan pada media PDA dan dipelihara selama lima hari.
Patogen hasil biakan tersebut akan digunakan dalam uji patogenisitas.
6. Pengamatan dan identifikasi isolat. Pada hari ke delapan diamati jenis patogen yang terbawa benih dengan menggunakan mikroskop, baik pada
perlakuan desinfektan maupun tanpa desinfektan. Isolat patogen yang teramati kemudian diidentifikasi menggunakan kunci identifikasi
Pengujian Patogenisitas Isolat Patogen Lodoh
Urutan kegiatan dalam pengujian patogenisitas isolat patogen lodoh adalah sebagai berikut :
1. Perbanyakan inokulum cendawan pato gen. Perbanyakan inokulum cendawan patogen dilakukan pada media CMS (Corn Meal Sand) yang berupa campuran pasir, hancuran biji jagung, dan air (96:4:20 g/g/ml). Sebanyak 100 g media tersebut dimasukkan ke dalam labu erlemeyer kemudian disterilkan dalam otoklaf (1210C, 1 atm). Pada masing-masing
media yang sudah steril tersebut di atas, ditanam tiga potongan koloni patogen (∅ 6 mm) yang sudah berumur 5 hari dan selanjutnya diinkubasi
pada suhu kamar selama 2 minggu
2. Pembuatan media tanam. Media tanam yang digunakan adalah campuran top soil dan pasir (1:1) yang telah disterilkan. Sebanyak 100 g media tanam tersebut dimasukkan ke dalam politube.
3. Infestasi patogen ke dalam media tanam. Setelah masa inkubasi cendawan beserta mediumnnya sebanyak 3.5 g dimasukkan ke dalam
media tanam, kemudian ditambahkan 15 ml air steril. Wadah tanam selanjutnya ditutup dengan plastik dan didiamkan selama 4 hari.
4. Penanaman benih A. mangium. Benih A. mangium ditanam pada media
tanam tersebut di atas. Untuk kontrol, benih A. mangium ditanam pad a
media tanam steril tanpa isolat cendawan.
5. Pemeliharaan. Pemeliharaan dilakukan dengan cara menyiram benih dalam politube pada pagi dan sore hari selama 30 hari.
6. Pengamatan. Pengamatan dilakukan terhadap gejala penyakit lodoh berdasarkan persentase semai mati, pada umur 2 minggu setelah sebar. Percobaan menggunakan rancangan acak lengkap (RAL) dengan F. solani
dan tanpa F. solani (kontrol) sebagai perlakuan. Masing-masing perlakuan diulang 4 kali sehingga terdapat 8 satuan percobaan, dan pada setiap satuan percobaan
dikecambahkan 10 benih A. mangium.
Data yang diperoleh dianalisis sidik ragam sesuai rancangan yang
Isolasi Cendawan Antagonis
Trichoderma sp. diisolasi dari tanah tegakan A. mangium dengan metode
pengenceran sebagai berikut :
1. Pembuatan suspensi. Sebanyak 10 g tanah disuspensikan dalam 90 ml air steril.
2. Pengenceran. Pengenceran yang digunakan untuk isolasi cendawan adalah 10-4.
3. Pembiakan cendawan. Seb anyak 0.1 ml suspensi yang telah diencerkan, ditumbuhkan pada medium PDA (Potato Dexrose Agar).
4. Pemurnian isolat. Cendawan antagonis yang teridentifikasi sebagai
Trichoderma sp. diambil sporanya menggunakan jarum ose di bawah
mikroskop, kemudian dimurnikan pada media PDA selama lima hari untuk
selanjutnya digunakan dalam pengujian antagonisme in vitro.
5. Pengamatan dan Identifikasi isolat. Jenis cendawan antagonis yang tumbuh diamati di bawah mikroskop. Isolat cendawan antagonis yang diperoleh kemudian diidentifikasi menggunakan kunci identifikasi
Watanabe (1993).
Pengujian Antagonisme in vitro
Uji antagonisme cendawan antagonis terhadap cendawan patogen dilakukan dengan cara sebagai berikut :
1. Pembiakan isolat cendawan antagonis Trichoderma sp. dan patogen
F. solani. Satu potong isolat Trichoderma sp. dan satu potong isolat
patogen F. solani, semuanya dari biakan yang berumur 5 hari, diletakkan dalam satu cawan petri berdiameter 9 cm yang berisi media PDA. Prosedur ini diulang tiga kali sebagai ulangan. P otongan biakan diletakkan berlawanan arah dengan jarak 5 cm dan jarak kedua isolat ke tepi cawan
petri mas ing-masing 2 cm. Kemudian, biakan dalam cawan petri tersebut diinkubasi selama 4 hari.
ini diamati pada hari ke-5 setelah penanaman dan dihitung berdasarkan persamaan Fokkema (1973) diacu oleh Skidmore (1976) sebagai berikut :
r1 – r2
Percobaan ini tidak menggunakan rancangan tertentu, sedangkan data yang diperoleh disajikan dalam bentuk rata-rata persentase penghambatan dan gambar
(Foto).
Pengujian Daya Hambat Minyak Sereh terhadap Pertumbuhan Koloni Patogen in vitro
Pengujian ini dilakukan dengan tahapan sebagai berikut :
1. Pembuatan konsentrasi minyak sereh. Pembuatan konsentrat minyak sereh dilakukan dengan mencampurkan minyak sereh dengan pengemulsi tween 80 dan air destilata, sehingga membentuk medium dengan konsentrasi minyak sereh tertentu. Untuk konsentrasi minyak sereh 0.1%
misalnya, dibuat dengan cara memipet minyak sereh, tween 80, dan air destilata masing-mas ing sebanyak 0.1, 0.5, dan 0.94 µl, kemudian ketiganya dicampur.
2. Aplikasi minyak sereh. Minyak sereh dengan konsentrasi seperti di atas dimasukkan ke dalam cawan petri, kemudian ditambahkan medium PDA.
3. Penanaman Patogen. Potongan biakan murni patogen (umur 7 hari dan berdiameter 6 mm) yang telah diperoleh berdasarkan uji patogenisitas ditumbuhkan pada cawan petri berisi medium campuran PDA dengan
minyak sereh dengan konsentrasi seperti di atas. Selanjutnya diinkubasi pada suhu ruang dan diberi sinar NUV 12 jam terang dan 12 jam gelap secara bergantian selama tujuh hari
R1 – R2
DH = ________ x 100 % R1
Keterangan : DH = persen daya hambat (%)
R1 = diameter koloni kontrol (mm) R2 = diameter koloni perlakuan (mm)
Nilai persentase penghambatan merupakan pengurangan pertumbuhan cendawan yang ditumbuhkan pada media yang ditambahkan dengan minyak sereh dibandingkan dengan pertumbuhan cendawan pada media kontrol.
Percobaan disusun dalam RAL dengan konsentrasi minyak sereh sebagai perlakuan yang terdiri dari empat taraf : 0.0% (tanpa minyak sereh sebagai kontrol), 0.1%, 0.2%, dan 0.4%. Masing-masing perlakuan diulang lima kali. Setiap ulangan berupa satu biakan dalam satu cawan petri.
Data yang diperoleh dianalisis ragam sesuai rancangan yang digunakan menggunakan program SAS. Apabila pengaruh perlakuan bersifat nyata, analisis dilanjutkan dengan uji wilayah berganda Duncan pada taraf nyata 5 % untuk mengetahui perbedaan nilai tengah perlakuan.
Pengujian in vivo
Uji in vivo dilakukan untuk mengetahui efektivitas minyak sereh dan cendawan antagonis Trichoderma sp. dalam mengendalikan patogen F. solani
penyebab penyakit lodoh dan meningkatkan kualitas benih A. mangium.
Bahan-bahan yang digunakan meliputi : minyak sereh, filtrat cendawan antagonis
Trichoderma sp., koloni patogen F. solani, benih A. mangium, dan media tanam.
Urutan kegiatan dalam percobaan ini adalah sebagai berikut :
1. Pembuatan filtrat Trichoderma sp. Tiga potongan koloni berdiameter 6 mm dari cendawan antagonis diambil dari biakan murni berumur 5 hari
kemudian ditanam dalam labu erlemeyer yang berisi 100 ml medium kentang dekstrosa cair. Biakan dalam labu erlemeyer tersebut diinkubasi
2. Pembuatan media tanam. Media tanam yang digunakan berupa campuran top soil dan pasir (1:1) yang telah disterilkan. Sebanyak 100 g
media tersebut dimasukkan ke dalam politube.
3. Perbanyakan inokulum cendawan patogen. Perbanyakan inokulum cendawan patogen dilakukan pada media CMS yang berupa campuran pasir, hancuran biji jagung, dan air (96:4:20 g/g/ml). Sebanyak 100 g
media tersebut dimasukkan ke dalam labu erlemeyer kemudian disterilkan dalam otoklaf (1210C, 1 atm). Pada masing-masing media yang sudah
steril tersebut di atas, ditanam tiga potongan koloni patogen (∅ 6 mm) yang sudah berumur 5 hari dan selanjutnya diinkubasi pada suhu kamar
selama 2 minggu.
4. Infestasi patogen dalam media tanam. Patogen F. solani yang digunakan diperoleh dari hasil isolasi dan pemurnian serta telah diuji patogenisitasnya sebagaimana telah dijelaskan pada percobaan
sebelumnya. Pada masing-masing media tanam, diinfestasikan sebanyak 3.5 g inokulum F. solani beserta mediumnya, kemudian ditambahkan 15 ml air steril. Selanjutnya media tanam ditutup dengan plastik dan didiamkan selama 4 hari.
5. Pelapisan benih dengan filtrat Trichoderma sp. Filtrat biakan dimasukkan ke dalam cawan petri, kemudian benih A. mangium direndam dalam filtrat tersebut selama 1 jam.
6. Pelapisan benih dengan minyak sereh. Minyak sereh dengan konsentrasi sesuai perlakuan dimasukkan ke dalam tabung reaksi, kemudian benih A. mangium direndam dalam minyak sereh tersebut selama 1 jam
7. Penanaman benih dalam politube. Setelah benih direndam dalam filtrat
Trichoderma sp. dan minyak sereh kemudian benih dicuci dengan air
steril, selanjutnya ditanam dalam politube.
8. Pemeliharaan. Pemeliharaan dilakukan dengan cara menyiram benih dalam politube pada pagi dan sore hari selama 30 hari.
terhadap persentase semai mati dilakukan pada umur 2 minggu, panjang batang pada umur 3 minggu, sedangkan kadar peroksidase pada umur 4
minggu setelah sebar.
a). Persentase serangan. Persentase serangan ditentukan dengan cara
menghitung jumlah benih terserang patogen dibagi total benih yang dikecambahkan kemudian dikali 100%.
b). Panjang batang (cm). Panjang batang diukur dari pangkal sampai ujung batang (pucuk).
c). Aktivitas peroksidase. Penentuan aktivitas peroksidase mengikuti prosedur Cohen dikemukakan oleh Simons dan Ross (1970) dan telah dimodifikasi seperti disajikan pada Lampiran 1.
Percobaan menggunakan RAL dengan pelapisan benih sebagai perlakuan
yang terdiri dari tiga taraf : tanpa pelapisan benih (A) sebagai kontrol, pelapisan benih dengan minyak sereh 0.1 % (B), dan pelapisan benih dengan filtrat biakan
Trichoderma sp. (C). Setiap perlakuan diulang empat kali sehingga terdapat 12
satuan percobaan. Masing-masing ulangan menggunakan 10 benih yang
masing-masing ditanam dalam tabung politube terpisah
Data yang diperoleh dianalisis ragam sesuai rancangan yang digunakan menggunakan program SAS. Apabila pengaruh perlakuan bersifat nyata, analisis dilanjutkan dengan uji wilayah berganda Duncan pada taraf nyata 5 % untuk
Benih A. mangium
Pemurnian patogen penyebab lodoh menghasilkan Fusarium solani.
Adapun karakteristik isolat F. solani yang ditumbuhkan pada media PDA dan
diinkubasi pada suhu kamar, yaitu koloni berupa miselium yang berwarna putih
bersih (seperti kapas), arah pertumbuhan koloni menyebar ke samping dan arah ke atas. Pada hari ke 4 di media PDA, diameter koloni berkisar 3 cm sebagaimana
ditunjukkan pada Gambar 2.
Gambar 2. F. solani. (a) Koloni pada media PDA berumur empat hari, (b) hifa dan (c) konidia
Konidiofor bervariasi, kadang ramping namun dapat juga gemuk dan pendek, konidia terdiri dari dua macam yakni makrokonidia dan mikrokonidia.
Makrokonidia terdiri dari beberapa sel berbentuk seperti kanoe dan ujung meruncing atau tumpul (Semangun 1989).
Ciri-ciri mikroskopis yang membedakan F. solani dengan Fusarium yang
lainnya yaitu F. solani memiliki mikrokonidia berwarna hialin yang terdiri dari
1-2 sel, berbentuk elips sampai panjang berukuran 8-6 x 2-4 µm. Makrokonidia
F. solani berwarna hialin, berbentuk memanjang, agak gemuk, ujung-ujungnya
meruncing dan ada cekukan pada sel kaki, bersekat 3 dengan ukuran 28-42 x 4-6
µm.
Gejala serangan lodoh pada benih A. mangium dapat dilihat pada Gambar 3 di bawah.
Gambar 3. Gejala serangan Lodoh pada benih A. mangium (a) Gejala serangan
terjadi pada benih belum berkecambah (b) Gejala serangan terjadi pada benih sudah berkecambah.
Gejala serangan terjadi pada benih yang belum berkecambah sehingga
benih menjadi mati. Gejala tersebut disebut lodoh benih (Gambar 3a) dan gejala serangan terjadi pada benih yang sudah berkecambah tetapi belum sempat muncul
ke atas permukaan tanah. Gejala demikian disebut lodoh dalam tanah (Gambar 3b).
Hasil uji patogenisitas menunjukkan bahwa F. solani dapat menyebabkan penyakit lodoh (Tabel 1) sehingga jenis ini digunakan untuk penelitian
selanjutnya.
Tabel 1. Serangan penyakit lodoh (%) yang disebabkan oleh F. solani
Perlakuan Benih mati (%)
Kontrol 0 a
F. solani 32 b
Cendawan Antagonis
Isolat Trichoderma sp. hasil isolasi pada media PDA terlihat berupa koloni yang pada mulanya berwarna putih, tetapi setelah umur 3 hari di medium PDA
pada bagian tengahnya berwarna hijau yang dikelilingi oleh miselium yang berwarna putih bersih. Pertumbuhan koloni cendawan konsentris dan setelah 4-5
hari menutupi seluruh medium yang ada pada petri berdiameter 9 cm. Setelah 6-7 hari koloni tersebut berubah menjadi berwarna hijau (Gambar 4).
Hasil pengamatan secara mikroskopis nampak bahwa isolat cendawan
Trichoderma sp. memiliki konidiofor dengan percabangan berbentuk piramid
yaitu cabang yang lebih panjang dibawahnya. Fialid tersusun pada kelompok-kelompok yang berbeda, terdapat 2-3 fialid perkelompok-kelompok. Fialid tidak rapat dan
teratur, ramping dan bengkokannya tidak teratur. Konidia bulat dengan diameter 3.5-4.5 µm. Morfologi secara mikroskopis dari cendawan Trichoderma sp.
disajikan pada Gambar 4
Gambar 4 Trichoderma sp.: (a) koloni pada media PDA berumur 5 hari, (b1) hifa, (b2) fialid dan (b3) konidia
Uji Antagonis in vitro
Hasil pengujian antagonis secara in vitro menunjukkan Trichoderma sp. menghambat pertumbuhan F. solani rata-rata hingga 29.22 %. Pada hari ke 5 ,
jari-jari F. solani yang menuju kearah cawan petri (r1) mencapai 2 cm, jari-jari
F. solani yang menuju ke arah koloni Trichoderma sp (r2) mencapai 1.3 cm. Pada
daerah pertemuan kedua jenis cendawan ini terdapat zona pembatas (Gambar 5). Kemampuan antagonis Trichoderma sp. dapat dilihat dari pertumbuhannya
yang lebih cepat dibanding F. solani. Pada hari ke-5 jari-jari koloni Trichoderma
sp. telah mencapai 3.5 cm, sedangkan jari-jari F. solani hanya mencapai 1.3 cm.
(a) (b)
1
2
Gambar 5. Uji antagonis in vitro antara F. solani (F) dengan Trichoderma sp. (T)
pada media PDA.
Pengaruh Minyak Sereh terhadap Pertumbuhan Patogen F. solani secara
in vitro
Penghambatan pertumbuhan arah radial cendawan patogen F. solani oleh
minyak sereh disajikan pada Gambar 6.
Gambar 6. Koloni biakan F. solani pada beberapa tingkat konsentrasi minyak
sereh dalam PDA. (A) Kontrol (B) 0.1% (C) 0.2% (D) 0.4%.
F. solani tumbuh pada media kontrol (PDA) memiliki miselia yang
bercabang-cabang, radial, dan padat dengan arah pertumbuhan horisontal dan
vertikal. Pada media yang ditambahkan minyak sereh konsentrasi 0.1 % sampai dengan konsentrasi 0.4 %, miselia tetap berwarna putih, bercabang-cabang, radial,
(TF)
F T
tetapi kurang padat, dan pertumbuhannya hanya ke arah horisontal. Diameter
F. solani berkurang sejalan dengan meningkatnya konsentrasi minyak sereh. Pada
minyak sereh konsentrasi 0.4%, diameter F. solani hanya mencapai 16.4 mm
sedangkan pada konsentrasi 0% (kontrol), 0.1%, dan 0.2% diameter F. solani
masing-masing mencapai 66.0 mm, 50.0 mm, dan 45.6 mm.
Tabel 2. Daya hambat minyak sereh terhadap pertumbuhan cendawan F. solani
secara in vitro
Perlakuan Rata-rata Daya Hambat (%) 0.0 % (kontrol)
0.1 % 24.24 a
0.2 % 30.91 b
0.4 % 75.15 c
Catatan: Angka yang diikuti huruf yang sama adalah tidak berbeda nyata berdasarkan uji jarak berganda Duncan pada taraf 5 %.
Hasil pengujian statistik menunjukkan minyak sereh berpengaruh nyata untuk menghambat pertumbuhan F. solani. Pada Tabel 2 dapat dilihat bahwa penghambatan pertumbuhan F. solani tertinggi 75.15 % terjadi pada konsentrasi
0.4 %, sedangkan penghambatan terkecil 24.14 % terjadi pada konsentrasi minyak
sereh 0.1 % .
Berdasarkan hasil pengujian di atas, ditetapkan konsentrasi minyak sereh 0.1% yang akan digunakan untuk pelapisan benih pada tahap penelitian selanjutnya, karena pada konsentrasi tersebut minyak sereh sudah mampu
menghambat pertumbuhan F. solani.
Pengendalian Serangan F. Solani.
Hasil analisis ragam menunjukkan bahwa perlakuan bahan penginduksi (minyak sereh dan filtrat Trichoderma sp.) memberikan pengaruh yang tidak
Tabel 3. Pengaruh bahan penginduksi (minyak sereh dan filtrat Trichoderma sp.) terhadap persentase semai mati A. mangium umur 2 minggu setelah sebar yang diinokulasi dengan F. solani.
Perlakuan Persentase semai mati
Kontrol 42.5 ± 15.0
Trichoderma sp. 30.0 ± 21.6
Minyak sereh 22.5 ± 17.1
- rataan ± simpangan baku
Meskipun demikian, nilai rata-rata persentase serangan F. solani tertinggi
terjadi pada kontrol sebesar 42.5 %, sedangkan persentase serangan terendah
ditunjukkan oleh semai A. mangium yang diinduksi dengan minyak sereh 0.1 % yakni sebesar 22.5 %, kemudan diikuti perlakuan filtrat Trichoderma sp. sebesar 30.0 % (Tabel 3).
Aktivitas Peroksidase Semai A. mangium
Hasil analisis ragam menunjukkan bahwa perlakuan memberikan pengaruh yang tidak nyata terhadap aktivitas peroksidase semai A. mangium
(Lampiran 6).
Tabel 4. Pengaruh bahan penginduksi minyak sereh dan inokulasi F. solani
terhadap aktivitas peroksidase semai A. mangium pada umur 4 minggu setelah sebar
Perlakuan Aktivitas Peroksidase (UAE/gbb)
Kontrol 0.190 ± 0.101
Trichoderma sp. 0.202 ± 0.116
Minyak Sereh 0.257 ± 0.137
- UAE/gbb (unit aktivitas enzim/gram bobot basah) - rataan ± simpangan baku
Meskipun demikian, nilai unit aktivitas peroksidase tertinggi ditunjukkan oleh
semai A. mangium yang diinduksi dengan minyak sereh konsentrasi 0.1 % yaitu sebesar 0.257 UAE/gbb (Tabel 4). Unit aktivitas peroksidase terendah adalah
pada perlakuan kontrol yaitu sebesar 0.190, kemudian diikuti perlakuan filtrat
Panjang Batang Semai A. mangium
Panjang batang semai A. mangium umur 3 minggu setelah sebar pada
perlakuan bahan penginduksi disajikan pada Tabel 5. Berdasarkan analisis ragam,
diketahui bahwa perlakuan cenderung meningkatkan panjang batang semai
A. mangium. Rata-rata panjang batang semai A. mangium tertinggi terjadi pada
perlakuan perendaman dalam filtrat Trichoderma sp. yaitu sebesar 6.2 cm,
kemudian diikuti perendaman benih dalam minyak sereh dan kontrol
masing-masing 5.2 cm dan 5.2 cm.
Tabel 5 Pengaruh perlakuan minyak sereh dan filtrat Trichoderma sp. terhadap panjang batang A. mangium umur 3 minggu setelah sebar
Perlakuan Panjang Batang Semai (cm)
Kontrol 5.2 ± 0.73
Trichoderma sp. 6.2 ± 0.44
Minyak Sereh 5.2 ± 0.54
- rataan ± simpangan baku
Pembahasan Patogenisitas F. solani
Fusarium merupakan cendawan patogen yang serangannya mengakibatkan
benih menjadi busuk hingga semai rebah. Cendawan patogen tersebut mempunyai kisaran inang yang cukup luas seperti agatis , pinus, jagung, dan kedelai. Isolat
patogen yang diperoleh pada penelitian ini, teridentifikasi sebagai F. solani dan
dapat menimbulkan penyakit lodoh pada benih A. mangium.
Benih A. mangium yang terinfeksi F. solani menunjukkan dua gejala. Gejala pertama adalah benih menjadi busuk. Menurut Hartley (1921) dalam
Achmad (1997) serangan yang terjadi pada benih yang belum berkecambah mengakibatkan benih menjadi busuk. Gejala ke dua, benih berkecambah tetapi
benih yang sudah berkecambah tetapi belum sempat muncul ke atas permukaan tanah, mengakibatkan bibit mati di dalam tanah.
Hifa cendawan patogen menembus di antara dan di dalam sel benih atau semai sambil menyerap bahan organik. Akan tetapi, untuk sebagaian cendawan
patogenik kerusakan tanaman inang lebih disebabkan oleh kerusakan pada sel akibat dikeluarkannya enzim dan racun oleh cendawan tersebut (Halloin 1986).
Ada dua mekanisme merusak dari organisme terbawa oleh benih, yaitu dengan menghasilkan enzim ekstraseluler dan toksin. Enzim ekstraseluler yang biasanya
diproduksi oleh mikroorganisme ialah enzim selulase, amilase, fruktase, dan nuklease (Halloin 1986). Selanjutnya Armenrout et al. (1987) mengemukakan
bahwa bila infeksi hanya mencapai ekstraseluler maka jaringan tersebut akan melakukan penutupan luka, sehingga gangguan proses fisiologis jaringan tidak
berlanjut dan meluas sehingga yang ada hanya nekrotik lokal saja.
Pada infeksi cendawan pada akhir pembentukan benih, cendawan akan
berada di permukaan testa atau jaringan-jaringan di bagian luar seperti testa, permukaan kotiledon atau endosperm. Akan tetapi bila infeksi itu terjadi pada
awal pembentukan benih, letak cendawan lebih ke dalam lagi. Inokulasi
F. moniliforme pada tanaman sorgum yang dilakukan pada saat awal
perkembangan benih sorgum, menghasilkan benih sorgum terinfeksi cendawan pada jaringan lebih dalam dari pada bila inokulasi dilakukan pada fase lanjut
perkembangan benih atau buah lebih tua. Benih sorgum akan masak lebih awal dan ukurannya lebih kecil dari pada benih normal bila diinfeksi cendawan (Castor
dan Frederiksen 1981).
Cendawan patogen F. solani menginfeksi pada benih sehingga
menimbulkan gejala lodoh benih dan lodoh dalam tanah. Akan tetapi hingga semai umur 30 hari serangan F. solani tidak mampu menimbulkan gejala layu
(lodoh batang). Hal tersebut kemungkinan disebabkan faktor virulensi dan lingkungan yang tidak sesuai untuk perkembangan F. solani. Hal ini sesuai
dengan pendapat Agrios (1997), bahwa timbulnya suatu penyakit pada tanaman adalah sebagai akibat dari interaksi antara tiga faktor, yaitu terdapatnya patogen
Pengujian in vitro
Pengujian in vitro bertujuan untuk mengetahui kemampuan cendawan
antagonis Trichoderma sp. dan minyak sereh untuk menekan perkembangan
cendawan patogen pada media PDA. Uji daya antagonisme menunjukkan
Trichoderma sp. yang diuji mampu menghambat pertumbuhan cendawan patogen
F. solani ditandai dengan pembentukan zona pembatas. Trichoderma sp. diketahui
mempunyai mekanisme penekanan perkembangan cendawan patogen melalui proses kompetisi, parasitisme dan antibiosis. Pelilitan dan penetrasi hifa R. solani
oleh T. harzianum yang merupakan fenomena awal rusaknya hif a patogen (Achmad 1997). Sedangkan kemampuan penghambatan minyak sereh dalam hasil
penelitian terdahulu, telah dilaporkan bahwa minyak sereh dapat menghambat pertumbuhan Bacillus sp. dan Pseudomonas solanacearum (Hartati et al. 1993),
Beuvaria sp. (Raghavaiah dan Jayaramaiah 1978), serta A. flavus dan F.
oxysporum (Mugiono 2002). Minyak sereh dapat menekan 20 % pertumbuhan
Beuvaria sp. (Raghavaiah dan Jayaramaiah 1978). Minyak atsiri menunjukkan
aktivitas bakteriosfatik dan bakterisida serta anti fungal (Akgul 1989).
Pengaruh Minyak Sereh dan Filtrat Trichoderma sp. terhadap Induksi Resistensi Semai A. mangium
Hasil penelitian menunjukkan bahwa minyak sereh dan filtrat
Trichoderma sp. dapat mengendalikan penyakit lodoh. Kemampuan minyak sereh
dan filtrat Trichoderma sp. dalam mengendalikan penyakit lodoh tersebut diduga terjadi karena dengan adanya pemberian minyak sereh dan filtrat Trichoderma sp.,
resistensi semai A. mangium terhadap penyakit lodoh meningkat. Meningkatnya resistensi semai, diduga karena meningkatnya aktivitas peroksidase. Hal ini
didukung oleh rendahnya persentase semai mati pada perlakuan menggunakan minyak sereh dan filtrat Trichoderma sp. tersebut.
Perlakuan perendaman benih A. mangium dalam minyak sereh dan filtrat
Trichoderma sp. menyebabkan peningkatan aktivitas peroksidase semai umur 30
hari setelah sebar. Walaupun berdasarkan analisis ragam, perendaman benih pada minyak sereh dan perendaman benih pada filtrat Trichoderma sp. serta tanpa
Schonbeck (1995) ekspresi gen ketahanan biasanya akan terdeteksi setelah adanya infeksi patogen susulan (challenge) pada waktu dan lokasi yang berbeda.
Berdasarkan hasil analisis kandungan peroksidase untuk semua perlakuan, perlakuan perendaman benih dalam minyak sereh dan filtrat Trichoderma sp.
menghasilkan aktivitas peroksidae lebih tinggi bila dibandingkan dengan kontrol. Hal ini menunjukkan adanya pengaruh dari minyak sereh dan filtrat
Trichoderma sp. terhadap aktivitas semai A. mangium. Menurut Stemer (1995)
dan Tuzun dan Kloepper (1995) diacu dalam Hartati (2003) peningkatan aktivitas
peroksidase selain dapat terjadi karena infeksi patogen, dapat juga disebabkan oleh luka mekanis, perlakuan fisik, mikroorganisme yang non patogenik, atau
bahan kimia.
Berdasarkan uraian di atas, dapat dikemukakan bahwa dengan
meningkatnya aktivitas peroksidase maka resistensi atau ketahanan tanaman terhadap serangan patogen akan meningkat. Jenis ketahanan ini terjadi akibat
adanya barier fisik yang diinduksi oleh senyawa kimia yang berasal dari minyak sereh, termasuk ketahanan aktif. Ketahanan aktif yang dibentuk setelah adanya
rangsangan dari patogen atau senyawa kimia dari luar tanaman umumnya berupa barier fisik, namun juga biokimia seperti peningkatan senyawa fenol, toksin dan
sintesis fitoaleksin (Agrios 1997). Ketahanan pasif dapat berbentuk struktur fisik maupun biokimia yang dibentuk tanpa infeksi patogen. Ketahanan aktif dapat juga
berbentuk struktur fisik maupun biokimia, namun baru terbentuk setelah adanya infeksi patogen. Aktivitas enzim oksidatif, antara lain peroksidase dan
polifenoloksidase, tanaman tahan adalah lebih tinggi dibanding pada tanaman rentan. Peran peroksidase dalam pertahanan tanaman dihubungkan dengan
kemampuan mengoksidasi metabolit penting baik pada patogen maupun pada inang, seperti senyawa fenolik, enzim, IAA, toksin dan sebagainya (Fric 1976
diacu dalam Achmad 1997).
Pengaruh Minyak Sereh dan Filtrat Trichoderma sp. terhadap Panjang Batang Semai A. mangium
Trichoderma sp. lebih panjang dibandingkan dengan perlakuan perendaman benih
pada minyak sereh dan kontrol.
Mekanisme antagonis dapat melalui kompetisi, antibiosis, hiperparatisme, produksi enzim litik, memacu pertumbuhan tanaman, secara tunggal maupun
kombinasi tersebut (Wells 1988). Selanjutnya Domsch dan Gams (1972) mengemukakan bahwa Gliocladium dan Trichoderma selain sebagai cendawan
antagonis juga diketahui sebagai mikroorganisme pelapuk yang dapat lebih menyediakan unsur hara bagi tanaman, dengan demikian akan lebih menunjang
pertumbuhan vegetatif dan generatif tanaman. Penambahan Trichoderma spp. dapat menekan penyakit sehingga pertumbuhan tanaman meningkat (Bailey dan
Lumsden 1998).
Dalam penelitian ini perlakuan perendaman benih pada filtrat
Trichoderma sp. selain cenderung meningkatkan panjang batang semai A.
mangium, juga dapat meningkatkan aktivitas peroksidase dan menurunkan
persentase serangan cendawan patogen, walaupun secara statistik tidak berbeda nyata. Oleh karena itu minyak sereh dan filtrat Trichoderma sp. mempunyai
1. Perendaman benih A. mangium dalam minyak sereh dan filtrat Trichoderma
sp. menekan serangan patogen lodoh dan meningkatkan aktivitas peroksidase meskipun secara statistik tidak berbeda nyata dengan kontrol.
2. Aktifitas peroksidase antar perlakuan tidak berbeda nyata, tetapi aktivitas peroksidase tertinggi pada perlakuan perendaman benih dalam minyak sereh
0.1% yaitu sebesar 0.257 UAE/gbb.
3. Perendaman benih dalam filtrat biakan Trichoderma sp. cenderung meningkatkan panjang batang semai A. mangium.
Saran
1. Cendawan antagonis Trichoderma sp. dan minyak sereh berpotensi
dikembangkan sebagai agen biokontrol dan sebagai pelapis benih.
Achmad. 1997. Mekanisme serangan patogen dan pertahanan inang serta pengendalian hayati penyakit lodoh pada Pinus merkusii [disertasi]. Bogor: Institut Pertanian Bogor.
Agrios GN, 1997. Plant Pathology. Edisi ke-4. New York: Academic Press.
Akgul, A. 1989. Volatile oil composition of sweet basil (Ocimum bassilicum L) Cultivating in Turkey. Nahrung 33:1.87-88: ref (abstr).
Armenrout, V. N. and A. J. Downer. 1987. Infection cushion development by
Rhizoctonia solani on cotton. Phytopatholo gy. 77: 619-623.
Baker KF, Cook RJ. 1974. Biologycal control of plant pathogen. San Fransisco: W. H. Freeman and Company.
Bailey DA, Lumsden RD. 1998. Direct effect of Trichoderma and Gliocladium on
plant growth and resistance to pathogens, Di dalam Harman GE, Kubicek CP, editor. Trichoderma and Gliocladium. Volume ke-2. London: Taylor & Francis. Hlm 185-200.
Boyce JS. 1961. Forest Pathology. New York : McGraw-Hill Co. Inc.
Brown, B. 1993. Current and potential diseases of fast growing industrial timber plantation trees. Mandala Agricultur Development Corporation (MADECOR). Jakarta.
Burgess LW, Liddell CM, Summerell BA. 1988. Laboratory manual for Fusarium
research : incorporating a key and description of common species found in Australasia. 2nd ed. Sydney: The University of Sydney.
Burmeister, H. R. and R. D. Platter. 1987. Enniatin production by Fusarium tricintum and its effect on germination wheat seeds. Phytopathology 77 : 1488.
Castor, L. L. and R. A. Frederiksen. 1981. Histopathology of Fusarium monoliforme infection of sorghum kernej (Abtrs) Phytopathology. 71: 208.
Chang YC, Baker R. 1986. Increased growth of plants in the presence of the biological control agent Trichoderma harzianum. Plant Disease 70:145-148.
Copeland LO, McDonald MB. 1985. Seed science and technology. New York: Chapman & Hall.
Davidson, J. 1982. Acacia mangium Willd . Eucalyptus and Forestry Services.
Ardile. Australia.
Domsch, K. H. and Gams, W. 1972. Fungi in Agricultural Soil. London. P. 173-177.
Gentile IA. Ferraris L. Matta A. 1988. Variations of phenoloxidase activities as a consequence of stresses that induce resistance on fusarium wilt of tomato. Phytopathology 122: 45-53.
Halloin, J. M. 1986. Microorganism and seed deterioration. pp. 89-100. In Mc Donald, M. B. and C. J. Nelson. (ed). Physiology of seed deterioration. Crop Science Society of America, Inc. Madison, Wisconsin, USA.
Hammerschmidt R. Kuc J. 1982. Association as a mechanism for induced systemic resistence in cucumber. Physiol. Plant Pathol. 20: 73-82.
Hartati S, 2003. Kemampuan minyak cengkeh dan filtrat Trichoderma harzianum
dalam mengendalikan Rhizopus stolonifer penyebab penyakit lodoh semai Pinus merkusii. [tesis]. Bogor. Program Pascasarjana, Institut Pertanian Bogor.
Hartati Y, Esther M Adhi, Nuri Karyani. 1993. Uji efikasi minyak cengkeh dan sereh wangi terhadap Pseudomonas solanacearum. Prosiding Seminar
Pemanfaatan Pestisida Botani. Bogor, 1-2 Desember 1993
Ilyas S. 2000. Konsep mutu benih aspek genetis, fisiologis, fisik dan kesehatan benih dalam perspektif kegiatan penanganan benih/bibit. Di dalam: The Second Training Course in Seed Biology; Bogor 11-12 Juni 2000. Bogor:Balai Teknologi Perbenihan – Indonesia Forest Seed Project.
[ISTA] International Seed Testing Association. 1999. International rules for seed testing rule 1999. Seed Sci. & Technol. 27, Suplement. Zurich.
Kenneth M. Old. 2000. A Manual of diseases of tropical acacia in Australia, South-East Asia and India. Center for International Forestry Researh.
Kleifeld O, Chet I. 1992. Trichoderma harzianum interaction with plants and effect on growth response. Plant and Soil 144:267-272.
Limonard, T. And J. D. Tempe. 1973. Seed fungal-bacterial interaction. Seed Sci. & Technol. 1, 203-216.