BAHAN BAKU PEMBUATAN BIOETANOL
HELMY
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
RINGKASAN
HELMY, Analisis Jaringan Tanaman Lindur (Bruguiera gymnorrhiza) dan Pemanfaatannya sebagai Bahan Baku Pembuatan Bioetanol. Dibimbing oleh AGOES M. JACOEB dan PIPIH SUPTIJAH.
Bioetanol merupakan bahan bakar alternatif yang berpotensi
menggantikan bahan bakar minyak. Bioetanol adalah etanol (alkohol) yang diproduksi dari proses fermentasi dengan bantuan mikroorganisme. Bahan-bahan yang bisa digunakan sebagai penghasil bioetanol biasanya mengandung karbohidrat, seperti pati, gula dan selulosa. Salah satu sumber hayati yang dapat
dikaji dalam pembuatan bioetanol adalah buah lindur (Bruguiera gymnorrhiza),
yang merupakan buah dari tumbuhan mangrove, yang cukup banyak ditemui di Indonesia. Kandungan karbohidrat yang tinggi menjadikan buah ini digunakan sebagai sumber alternatif pembuatan bioetanol.
Tujuan dari penelitian ini adalah untuk mempelajari jaringan tanaman
lindur (B. gymnorrhiza), memanfaatkan buah lindur sebagai bahan baku
pembuatan bioetanol dan menentukan waktu optimum fermentasi untuk menghasilkan bioetanol, serta menghasilkan kadar etanol yang terbaik.
Penelitian ini dilaksanakan pada bulan Januari-April 2012 di Laboratorium Mikrobiologi Hasil Perairan dan Laboratoriurn Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, penelitian histologi buah lindur dilakukan di Laboratorium Histologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor dan pengujian kadar bioethanol di Laboratorium Terpadu, Institut Pertanian Bogor. Penelitian terdiri dari penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi karakterisasi bahan baku (buah lindur), analisis histologi, uji proksimat, pembuatan starter (regenerasi kultur dan starter media cair), pembuatan media fermentasi, penambahan nutrient, pengaturan pH dan pasteurisasi. Penelitian utama meliputi pembuatan bioetanol, yaitu fermentasi alkohol, perlakuan inkubasi, pengujian (uji pH akhir dan uji kadar etanol).
Daun lindur tersusun atas jaringan epidermis, bunga karang, parenkim palisade dan jaringan pengangkut. Bagian batang lindur terdiri dari jaringan epidermis, jaringan korteks yang mengandung butiran pati dan jaringan pengangkut. Sedangkan, buah lindur tersusun atas jaringan epidermis, jaringan korteks yang terdapat pati dan jaringan pengangkut. Hasil uji proksimat buah
lindur (B. gymnorrhiza) segar memperlihatkan kadar air 62,92 %, abu 1,29 %,
lemak 0,79 %, protein 2,11 % dan karbohidrat 32,91 %. Semakin lama fermentasi, maka pH akhir fermentasi cenderung semakin rendah. Nilai pH paling tinggi dari fermentasi 3 hari (XI) yaitu 4,41 dan pH paling rendah pada waktu fermentasi 7 hari (X3) yaitu 3,97. Kadar etanol paling tinggi dihasilkan dari fermentasi dengan waktu 5 hari (X2) yaitu 3,51 %. Kadar etanol yang paling rendah dihasilkan dari fermentasi dengan waktu fermentasi 3 hari (XI) yaitu sebesar 3,01 %.
ANALISIS JARINGAN TANAMAN LINDUR
(Bruguiera gymnorrhiza) DAN PEMANFAATANNYA SEBAGAI
BAHAN BAKU PEMBUATAN BIOETANOL
HELMY C34080047
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Pembimbing I
Dr. Ir.Agoes M. Jacoeb.Dipl.-Biol. NIP. 195911 27 198601 1 005
Pembimbing II
Dr. Pipih Suptijah. MBA NIP. 195310 20 198503 2 001
Judul : Analisis Jaringan Tanaman Lindur (Bruguiera gymnorrhiza)
dan Pemanfaatannya sebagai Bahan Baku Pembuatan Bioetanol
Nama : HELMY
NRP : C34080047
Program studi : Teknologi Hasil Perairan
Menyetujui,
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr.Ir. Ruddy Suwandi, MS., M.Phill. NIP.19580511 198503 1 002
KATA PENGANTAR
Puji syukur alhamdulillah penulis panjatkan kehadirat Tuhan Yang Maha
Esa, karena berkat rahmat serta hidayah-Nya penulis dapat menyelesaikan skripsi
ini dengan baik. Skripsi ini berjudul “Analisis Jaringan Tanaman Lindur
(Bruguiera gymnorrhiza) dan Pemanfataannya sebagai Bahan Baku Pembuatan Bioetanol” dan merupakan salah satu syarat untuk memperoleh gelar Sarjana
Perikanan pada Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan
Ilmu Kelautan, Institut Pertanian Bogor.
Penyelesaian penulisan skripsi ini tidak lepas dari bantuan dan partisipasi
berbagai pihak. Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penulisan skripsi ini, terutama kepada :
1. Dr. Ir. Agoes M. Jacoeb, Dipl.-Biol. selaku pembimbing I yang telah
banyak memberikan saran, masukan, dan bimbingannya dalam
menyelesaikan skripsi ini.
2. Dr. Pipih Suptijah, MBA selaku pembimbing II atas segala bimbingan
dan pengarahan yang diberikan kepada penulis.
3. Roni Nugraha S.Si, M.Sc selaku dosen penguji atas segala saran yang
diberikan kepada penulis.
4. Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen
Teknologi Hasil Perairan.
5. Orang tua dan keluarga tersayang yang telah memberikan cinta, kasih
sayang dan doanya kepada penulis.
6. Teman-teman satu team buah lindur (Hardi, Niswani, Zahidah, Siluh
Putu, dan Selviani) terima kasih atas kebersamaan dan kerjasamanya
yang telah terjalin selama ini.
Penulis menyadari bahwa dalam penulisan skripsi ini memiliki banyak
kekurangan. Penulis mengharapkan saran dan kritik yang bersifat membangun
untuk perbaikan penulisan skripsi ini. Semoga tulisan ini bermanfaat bagi semua
pihak yang memerlukannya.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Tebet Timur Jakarta Selatan pada tanggal 20 Juni 1990 dari pasangan Bapak Muhammad Husein dan Ibu Ruthellena, dan merupakan anak kedua dari empat bersaudara. Pendidikan formal yang ditempuh penulis dimulai dari SD Negeri 03 Pagi Tebet Timur Jakarta Selatan dan lulus pada tahun 2002. Pada tahun yang sama melanjutkan pendidikan SLTP Negeri 265 Asem Baris Jakarta selatan dan lulus pada tahun 2005, serta melanjutkan pendidikan di SMA Muhammadiyah 5 Tebet Jakarta Selatan dan lulus pada tahun 2008.
Pada tahun 2008, penulis melanjutkan pendidikan ke jenjang yang lebih tinggi yaitu program Strata 1 (S1) Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI. Selama mengikuti perkuliahan, penulis aktif dalam unit kegiatan mahasiswa Himpunan Mahasiswa Teknologi Hasil Perikanan (HIMASILKAN) IPB, asisten mata kuliah Teknologi Penanganan dan Transportasi Biota Perairan periode 2010/2011, Teknologi Produk Tradisional Hasil Perairan periode 2011/2012 dan Teknologi Pengolahan Hasil Perairan periode 2011/2012.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor, penulis melakukan penelitian berjudul “Analisis
Jaringan Tanaman Lindur (Bruguiera gymnorrhiza) dan Pemanfaatannya sebagai Bahan Baku Pembuatan Bioetanol” dengan dosen pembimbing yaitu
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul "Analisis
Jaringan Tanaman Lindur (Bruguiera gymnorrhiza) dan Pemanfaatannya sebagai Bahan Baku Pembuatan Bioetanol" benar-benar hasil karya sendiri yang belum pernah diajukan sebagai karya tulis pada perguruan tinggi atau lembaga. Saya menyatakan bahwa skripsi ini tidak mengandung bahan-bahan yang pernah diterbitkan oleh pihak lain kecuali sebagai bahan rujukan yang telah
dinyatakan dalam naskah dan dicantumkan dalam daftar pustaka pada bagian
akhir skripsi ini.
Bogor, Juli 2012
Halaman
3.3.2 Pembuatan preparat dengan metode parafin dan pengamatan ... 17
3.3.3 Analisis proksimat ... 19
4.1 Karakteristik Histologi Tumbuhan Lindur (Bruguiera gymnorrhiza) ... 28
4.2 Komposisi Kimia Buah Lindur Segar ... 32
4.2.3 Kadar air ... 33
4.2.4 Kadar abu ... 34
4.2.3 Kadar lemak ... 34
4.2.4 Kadar protein ... 35
4.2.5 Kadar karbohidrat... 35
4.3 pH Akhir Media ... 37
4.4 Kadar Bioetanol ... 39
5 KESIMPULAN DAN SARAN ... 42
5.1 Kesimpulan ... 42
5.2 Saran ... 42
DAFTAR PUSTAKA ... 43
No. Halaman
1 Komposisi Kimia buah lindur (Bruguiera gymnorrhiza) segar ... 32
No. Halaman
1 Buah lindur (Bruguiera gymnorrhiza) ... 3
2 Morfologi tumbuhan lindur (Bruguiera gymnorrhiza) ... 4
3 Daun, bunga, dan buah lindur (Bruguiera gymnorrhiza) ... 5
4 Kurva pertumbuhan mikroba ... 10
5 Diagram alir pembuatan preparat dengan metode paravin ... 18
6 Diagram alir pembuatan media fermentasi buah lindur ... 25
7 Diagram alir pembuatan kultur starter ... 26
8 Diagram alir proses fermentasi alkohol dan penentuan kadar etanol ... 27
9 Penampang melintang daun tumbuhan lindur ... 29
10 Stomata pada bagian atas daun tumbuhan lindur ... 30
11 Penampang melintang batang tumbuhan lindur ... 30
12 Penampang melintang buah tumbuhan lindur ... 31
13 Berkas pembuluh pada buah tumbuhan lindur ... 32
14 Diagram nilai pH akhir fermentasi ... 37
1 PENDAHULUAN
1.1 Latar Belakang Masalah
Perubahan iklim global, penipisan lapisan ozon, dan polusi adalah masalah-masalah yang perlu mendapat perhatian bersama. Pertambahan kadar
CO2 yang sangat tinggi dari masa ke masa merupakan salah satu penyebab
terjadinya perubahan tersebut. Pembakaran kayu dan pemakaian energi fosil yang terus meningkat merupakan faktor utama dari eskalasi kadar gas karbon dioksida diudara. Kondisi seperti itu diperparah oleh penggundulan hutan tropis yang dijuluki sebagai paru-paru dunia, akibatnya polusi semakin meningkat dari waktu ke waktu.
Upaya yang bisa dilakukan untuk mengurangi peningkatan polusi yaitu
meminimalkan emisi gas atau bahan bakar dengan penggunaan atau pembuatan bioetanol. Bioetanol adalah etanol (alkohol) yang diproduksi dari proses fermentasi dengan bantuan makhluk hidup. Bahan-bahan yang bisa digunakan sebagai penghasil bioetanol biasanya mengandung karbohidrat, misalnya pati,
gula dan selulosa (Caylak et al. 1998). Pembuatan bioetanol dari bahan yang
kurang memiliki nilai jual dan kurang bermanfaat akan sangat menguntungkan. Karena selain menambah nilai guna dan nilai ekonomis, kegiatan ini juga merupakan solusi dalam peningkatan produksi campuran bahan bakar yang ramah
lingkungan (Qiu et al. 2010).
Salah satu sumber hayati yang dapat dikaji sebagai bahan baku dalam
pembuatan bioetanol adalah buah lindur (Bruguiera gymnorrhiza), buah ini adalah
salah satu jenis buah dari tumbuhan mangrove yang keberadaannya cukup banyak ditemui di Indonesia. Penyebaran buah lindur yaitu di daerah tropis Afrika Selatan dan Timur, Madagaskar, Asia Tenggara dan Selatan (termasuk Indonesia dan negara di kawasan Malaysia), sampai timur laut Australia, Mikronesia, Polinesia
and kepulauan Ryukyu (Duke dan James2006).
Tumbuhan dengan nama famili Rhyzophoraceae ini cukup banyak ditemui
bahkan di beberapa Negara, tanaman ini memiliki kandungan pati atau karbohidrat
yang sangat besar (Duke dan James2006). Oleh karena itu, di Indonesia buah ini
dijadikan sumber pangan alternatif ketika musim paceklik dan hanya pada sebagian wilayah nusantara. Hal tersebut yang mendasari penelitian ini, untuk memanfaatkan kandungan pati dari buah lindur dalam pembuatan bioetanol yang ramah lingkungan.
1.2 Tujuan
Penelitian ini bertujuan untuk mempelajari jaringan tanaman lindur (B. gymnorrhiza), memanfaatkan buah lindur sebagai bahan baku pembuatan
2 TINJAUAN PUSTAKA
2.1 Buah Lindur (Bruguiera gymnorrhiza)
Buah lindur (B. gymnorrhiza) adalah salah satu buah tumbuhan mangrove
yang biasanya dikenal sebagai bakau daun besar. Buah lindur memiliki pohon yang kadang-kadang mencapai ketinggian 30 m. Pohon lindur memiliki akar papan dan lutut, melebar ke samping di bagian pangkal pohon. Kulit kayu memiliki lentisel, permukaannya halus hingga kasar, berwarna abu-abu tua sampai cokelat. Buah lindur berwarna hijau dengan kelopak bunga diujung buah (berwarna merah), buah berbentuk silinder memanjang 12-30 cm dengan diameter
1,5-2 cm. B. gymnorrhiza tersebar di daerah tropis Afrika Selatan dan Timur dan
Madagaskar, ke Asia Tenggara dan Selatan (termasuk Indonesia dan negara di kawasan Malesia), sampai timur laut Australia, Mikronesia, Polinesia and kepulauan Ryukyu (Duke dan James 2006). Berikut ini adalah klasifikasi dan
Gambar 1 Buah lindur (B. gymnorrhiza)
Tumbuhan lindur memiliki daun yang umumnya berwarna hijau tua dan berbentuk elips. Daun memiliki panjang 8-22 cm dan lebar 5-8 cm. Ujung daun meruncing, berwarna hijau pada bagian atas dan hijau kekuningan pada bagian bawah dengan bercak-bercak hitam. Letak daun biasanya saling berhadapan dengan posisi menyilang. Batang dari tumbuhan ini umumnya berwarna abu-abu sampai hitam, memiliki lentisel yang besar dengan percabangan simpodial. Kulit kayu memiliki lentisel, permukaannya halus hingga kasar dengan warna abu-abu tua sampai coklat. Akar membentuk akar papan dan melebar kesamping tetapi juga memiliki sejumlah akar lutut. Morfologi dari tanaman lindur dapat dilihat pada Gambar 2.
Gambar 2 Morfologi tumbuhan lindur (B. gymnorrhiza).
Sumber : Duke dan James (2006)
Tumbuhan lindur juga memiliki bunga dan buah, bunga terletak diujung buah dengan kelopak berwarna merah muda hingga merah serta panjang bunga berkisar antara 1,5-3,5 cm. Buah berbentuk silinder (hipokotil), melingkar spiral dengan lebar 2-2,5 cm dan panjang 12-30 cm. Gambar 3 menunjukkan daun (a), bunga (b) dan buah (c).
(a) (b)
(c)
Gambar 3 Daun, bunga dan buah lindur.
Daun
Sumber : Duke dan James (2006)
Tanaman lindur mampu membantu menstabilkan tanah, melindungi pantai, dan sebagai habitat aneka fauna. Kayunya dapat digunakan sebagai kayu bakar dan untuk membuat arang. Pepagan (kulit batang) dimanfaatkan sebagai bahan penyamak kulit dan pengawet jala ikan yang baik karena mengandung tanin
rata-rata antara 28,5–32,2% (Glen 2005). Selain itu penduduk Solomon memanfaatkan
papagan untuk menyembuhkan luka bakar. Di pulau-pulau kecil Indonesia digunakan untuk mengobati diare dan demam, sementara di Kamboja dimanfaatkan sebagai anti malaria (Duke dan James 2006). Penduduk di pulau-pulau terpencil memanfatkan daun mudanya sebagai lalap atau sayuran. Bagian dalam hipokotil buah lindur dapat dimakan (manisan kandeka), dicampur dengan gula. Penduduk Indonesia bagian timur memanfaatkan buah lindur sebagai sumber pangan saat musim paceklik tiba (Glen 2005).
2.2Pemeriksaan Anatomi dan Jaringan Tumbuhan
Jaringan merupakan sekelompok sel yang mempunyai asal, struktur, dan
fungsi yang sama (Nugroho et al. 2006). Ilmu yang mempelajari struktur internal
tanaman disebut histologi tanaman. Histologi tumbuhan umumnya dikaji melalui teknik mikroskopis. Kajian objektif untuk mengidentifikasi histologi pada tanaman diukur dalam gambaran mikroskopis. Morfologi sel digambarkan dengan
ukuran sel dan bentuk dan dengan ketebalan dinding sel (Guillemin et al. 2004).
Metode umum untuk mempelajari jaringan diantaranya metode beku, metode seloidin, metode parafin, metode pananaman rangkap. Metode parafin banyak digunakan karena hampir semua matriks jaringan dapat dipotong baik bila menggunakan metode ini. Kelebihan metode parafin diantaranya irisan dapat jauh lebih tipis dibandingkan dengan menggunakan metode beku atau metode seloidin. Irisan-irisan yang bersifat seri dapat dikerjakan dengan mudah bila menggunakan metode ini dan prosesnya jauh lebih cepat dibandingkan dengan metode seloidin (Suntoro 1983).
Metode pembuatan preparat terlebih dahulu dilakukan sebelum mempelajari hitologi tanaman. Metode pembuatan preparat dapat dibagi menjadi
tiga macam yaitu preparat segar, preparat utuh (whole mount) dan preparat yang
dilakukan dengan pembuatan sayatan tipis melintang dan diletakkan pada gelas objek kemudian diwarnai. Pembuatan preparat utuh merupakan metode pembuatan preparat sampel secara utuh biasanya untuk tanaman dengan ukuran kecil. Tahapan untuk preparat ini terdiri atas fiksasi bertahap, penggunaan silol berseri, pewarnaan, inkubasi, dehidrasi dan perekatan ke gelas preparat kemudian
dilakukan penutupan. Proses pembuatan preparat embedding terdiri atas gelatin
embedding, parafin embedding, nitrocellulose embedding, double embedding, dan embedding pada plastik (Keirnan 1990, diacu dalam Kristiono 2009).
2.3Pembuatan Preparat dengan Metode Parafin
Proses pembuatan preparat dengan metode parafin terdiri dari beberapa
tahap yaitu fiksasi, pencucian, dehidrasi, infiltrasi, embedding, pengirisan,
penempelan, pewarnaan, dan penutupan. Tahap fiksasi dilakukan agar jaringan
tidak membusuk dan untuk mempertahankan struktur jaringan.
Formalin-acetoalcohol digunakan sebagai bahan yang memberikan fiksasi sempurna yang dilanjutkan dengan pencucian dan dehidrasi. Proses pencucian dilakukan untuk
menghilangkan reagen yang masih ada pada obyek. Cairan yang digunakan dalam
proses pencucian ini tergantung pada reagen yang digunakan sebelumnya. Hampir
semua larutan pengencer terutama yang mengandung chromic acid dapat dicuci
dengan air, jika proses pencucian dengan air mengalir sulit dilakukan dapat dilakukan dengan air dalam jumlah besar dan dikerjakan berulang kali. Apabila air yang digunakan terlalu banyak mengandung udara, maka harus dilakukan proses
penguapan dengan pemanasan atau menggunakan suction pump. Proses pencucian
dengan menggunakan larutan jumlahnya harus sama dengan larutan fiksasi (Johansen 1940).
Tahap dehidrasi selesai dilanjutkan dengan infiltrasi. Tahap ini merupakan proses transfer butil alkohol ke parafin. Bahan ditransfer untuk campuran yang sama pada minyak parafin dan tertier butil alkohol dilakukan selama 1 jam. Botol kecil diisi 3/4 cairan parowax dan didiamkan sampai cairan tersebut mulai mengeras namun jangan sampai membeku. Setelah obyek terendam campuran minyak parafin, parowax, dan alkohol diganti dengan cairan yang baru. Pergantian
cairan parafin yang baru dilakukan tiap 6 jam sekali sebanyak 3 kali (Johansen 1940).
Proses penanaman dikerjakan dengan memasukkan obyek dalam parafin cair ke dalam kotak/cetakan dan dibiarkan dalam air selama setengah jam sampai dingin. Jika pendinginan parafin terlalu lambat maka akan terbentuk kristal yang meyebabkan cetakan bercak putih dan tidak dapat dilakukan pengirisan. Proses penanaman selesai dan parafin telah dingin dan keras, akan dilakukan proses pengirisan yang merupakan pembuatan sayatan atau pita dari blok parafin yang telah terbentuk dengan menggunakan mikrotom. Setelah itu dilakukan proses penempelan pita yang telah dipotong ke dalam gelas obyek dan diberi beberapa tetes air (Humason 1967).
Tahap selanjutnya adalah pewarnaan yang merupakan proses pemberian warna pada gelas obyek. Proses ini dilakukan untuk memudahkan dalam melihat jaringan pada tumbuhan. Pewarnaan ini dapat menggunakan satu pewarna atau beberapa kombinasi warna disesuaikan dengan tujuan pengamatan. Sebagai contoh apabila pewarnaan ditujukan untuk melihat selulosa pada dinding sel maka dapat digunakan aniline blue, fast green CFC, light green, dan congo red. Untuk melihat protein dapat digunakan safranin, sedangkan lemak menggunakan sudan III dan lain-lain (Humason 1967). Sebelum pewarnaan ini dilakukan, parafin harus dihilangkan terlebih dahulu dari obyek. Untuk proses ini dapat digunakan xilol dan campuran xilol dengan etanol. Sebelum diberi pewarna gelas preparat dibilas terlebih dahulu dengan akuades kemudian dicelupkan ke dalam pewarna sesuai dengan tujuan pewarnaan. Setelah pencelupan dalam larutan pewarna selesai dilakukan dehidrasi dengan alkohol 35, 70, dan 95 % lalu ditutup dengan perekat
misalnya entelan (canada balsam) dan dilanjutkan dengan coverslip. Preparat
2.4Pati
Pati merupakan homopolimer glukosa dengan ikatan α-glikosidik. Pati terdapat pada tumbuhan tingkat tinggi sebagai granula semi kristalin dari bahan polimer. Dalam bentuk aslinya tepung pati merupakan butir-butir kecil yang disebut granula pati. Granula pati mempunyai bentuk dan ukuran yang berbeda-beda tergantung dari jenis patinya (Swinkle 1985). Granula pati tersusun atas tiga komponen utama yaitu amilosa, amilopektin dan bahan antara yang merupakan komponen minor berupa lemak dan protein.
Secara umum pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas di bawah suhu gelatinisasi. Fraksi terlarut disebut amilosa dan fraksi tidak
terlarut disebut amilopektin. Amilosa mempunyai struktur lurus dengan ikatan α
-(1,4)-D-glukosa sedangkan amilopektin terdiri dari struktur bercabang dengan ikatan α-(1,6)-D-glukosa sebanyak 4-5% berat total (Winarno 2008). Konsentrasi amilosa berpengaruh terhadap karakteristik gel yang terbentuk. Gel yang
mengandung banyak amilosa mempunyai karakteristik mekanik film yang
dihasilkan lebih baik dibandingkan dengan gel yang kaya akan amilopektin
(Leloup et al. 1991).
Pati dapat diekstrak dengan berbagai cara, berdasarkan bahan baku dan penggunaan dari pati itu sendiri. Pati dapat diproses dengan cara ekstraksi yang terdiri perendaman, disintegrasi, dan sentrifugasi. Perendaman dilakukan dalam larutan natrium bisulfit pada pH yang diatur untuk menghambat reaksi biokimia misal perubahan warna. Disintegrasi dan sentrifugasi dilakukan untuk memisahkan pati dari komponen lainnya (Cui 2005).
2.5 Ragi
Ragi adalah kelompok jamur uniseluler berukuran 5-20 µm yang umum
dipergunakan untuk fermentasi roti dan minuman beralkohol, lebih dari seribu spesies ragi telah teridentifikasi hingga saat ini dan yang paling umum
dipergunakan adalah Saccharomyces cerevisiae Hansen (Muslimin 1996).
fakultatif. Ragi memproduksi energi dalam kondisi ketiadaan oksigen dengan
mengubah gula menjadi etanol dan karbon dioksida. S. cerevisiae berkembang
biak dengan spora dan juga berkembang biak secara vegetative dengan cara penguncupan multilateral. Konjugasi isogami atau heterogami dapat terjadi setelah pembentukan askus yang berbentuk tonjolan-tonjolan, setiap askus mengandung satu sampai empat spora dengan berbagai bentuk spora yang dapat berkonjugasi (Pelczar dan Chan 1988).
Etanol adalah produk yang diinginkan dalam pembuatan minuman beralkohol. Dalam pembuatan roti, yang diinginkan adalah peran karbon dioksida sehingga roti dapat mengembang sedangkan etanol yang terbentuk dibiarkan menguap. Sebuah sel ragi mampu memfermentasi glukosa dengan massa yang sama dengan massa selnya sendiri dalam jangka waktu satu jam. Ragi dapat bereproduksi secara aseksual dengan membentuk tunas ataupun secara seksual
dengan pembentukan ascospora. Selama proses reproduksi aseksual, sebuah tunas
baru tumbuh dari ragi dengan kondisi tertentu dan saat mencapai ukuran dewasa ia akan melepaskan diri dari sel induknya. Reproduksi seksual ragi umumnya berlangsung pada kondisi kekurangan nutrisi pertumbuhan dengan cara
pembentukan ascospora (European Bioinformatics Institute 1996).
Saccharomyces cerevisiae Hansen adalah ragi dari famili saccharomycetaceae. Famili Saccharomycetaceae adalah famili ragi dari ordo
saccharomycetales yang bereproduksi dengan pembentukan tunas. Saccharomyces
cerevisiae Hansen telah lama dimanfaatkan dalam pembuatan roti dan minuman
beralkohol. Ragi S. cerevisiae Hansen diperoleh dari hasil isolasi mikroorganisme
pada kulit anggur. S. cerevisiae Hansen dapat tumbuh secara aerob pada substrat
glukosa, maltose, laktosa dan selobiosa. Fruktosa dan galaktosa merupakan substrat terbaik untuk pertumbuhan ragi ini (Kusmiyati 2010).
Ragi S. cerevisiae Hansen, selain dipergunakan dalam fermentasi juga
dimanfaatkan sebagai suplemen nutrisi karena ragi tersebut mengandung mineral yaitu selenium dan chromium serta vitamin B complex yang meliputi vitamin B1 (thiamine), B2 (riboflavin), B3 (niacin), B5 (asam pantotenat), B6 (piridoxin), B7
(biotin) dan B9 (asam folat). Ragi S. cerevisiae Hansen tidak mengandung vitamin
ragi S. cerevisiae Hansen berfungsi untuk menunjang kerja sistem saraf dan otot-otot saluran pencernaan serta memelihara kesehatan kulit, mata dan hati. Sumber ragi dapat berasal dari buah-buahan, bunga dan daun. Ragi adalah mikroorganisme yang bersifat saprofit dan umumnya serangga adalah yang
berperan memindahkan ragi dari satu tanaman ke tanaman ke tanaman lain
(Shen et al. 2008).
Laju pertumbuhan mikroorganisme dapat dibagi menjadi empat fase, yaitu
fase pertumbuhan lambat (lag phase), fase pertumbuhan cepat (exponential
phase), fase pertumbuhan statis (stationer phase) dan fase kematian (death phase)
(Shen et al. 2008). Laju pertumbuhan mikroorganisme dapat dilihat pada
Gambar 4.
Gambar 4 Kurva pertumbuhan mikroba
Fase lag merupakan fase khamir beradaptasi untuk menyesuaikan dengan substrat dan kondisi lingkungan sekitarnya. Fase ini juga terjadi pertumbuhan yang masih lambat. Fase ekponensial merupakan fase khamir membelah dengan cepat dan konstan. Fase statis merupakan fase populasinya sel khamir tetap karena jumlah sel yang mati sama dengan jumlah sel yang tumbuh. Ukuran sel pada fase ini lebih kecil karena sel tetap membelah meskipun zat nutrisi sudah mulai habis. Fase kematian merupakan fase sebagian populasi khamir mulai mengalami kematian yang disebabkan karena nutrient sudah habis dan energi cadangan dalam sel juga habis (Fardiaz 1992).
2.6Hidrolisis Asam
asam pekat H2SO4 72% dan HCl 42% pada suhu ruang. Selain itu juga bisa
dilakukan dengan larutan asam 1% pada suhu 100-200 oC selama 3 jam.
Karbohidrat dapat dirombak secara hidrolisis dalam suasana asam menjadi gula sederhana yang akan dijadikan sumber makanan bagi khamir, selanjutnya gula ini difermentasi (Greethlein 1978).
Hidrolisis asam dapat dikategorikan melalui dua pendekatan umum, yaitu hidrolisis asam konsentrasi tinggi pada suhu rendah dan konsentrasi rendah pada suhu tinggi. Pemilihan antara dua cara tersebut pada umumnya didasarkan pada beberapa pertimbangan yaitu laju hidrolisis, tingkat degradasi, produk dan biaya total proses produksi. Hidrolisis asam konsentrasi tinggi akan lebih ekonomis jika
asam dapat diperoleh kembali (recovery). Akan tetapi, asam kuat bersifat korosif,
sehingga memerlukan teknik khusus dan biaya tambahan untuk perawatan alat produksi (Kosaric dan Velayudhan 1991).
Asam yang biasa digunakan untuk menghidrolisis selulosa adalah asam sulfat, asam klorida, dan asam fosfat. Hidrolisis selulosa dengan asam untuk menghasilkan gula, pada proses ini juga terbentuk 5-hidroksi metil-2-5 furfuraldehid atau hidroksimetilifurfural (HMF) sebagai bentuk dari penguraian glukosa pada suasana asam, HMF ini akan bereaksi membentuk asam-asam organik, yakni asam levinulinat dan asam formiat pada suasana asam dan suhu tinggi (Greethlein 1978).
2.7 Bioetanol
Bioetanol adalah etanol yang dibuat dari proses fermentasi yang
mengandung komponen pati atau selulosa, misal singkong dan tetes tebu. Dalam dunia industri, etanol umumnya dipergunakan sebagai bahan baku industri turunan alkohol, campuran untuk minuman keras (misal sake atau gin), serta bahan baku farmasi dan kosmetika. Berdasarkan kadar alkoholnya, etanol terbagi menjadi tiga
grade sebagai berikut: (Prihardanadan Samsuri 2008).
Grade industri dengan kadar alkohol 90-94%,
Netral dengan kadar alkohol 96-99,5%, umumnya digunakan untuk
minuman keras atau bahan baku obat dalam industri farmasi,
Grade bahan bakar dengan kadar alkohol diatas 99,5%.
Secara umum produksi bioetanol mencakup tiga rangkaian proses yaitu, persiapan bahan baku, fermentasi dan pemurnian. Bahan baku bioetanol bisa diperoleh dari berbagai tanaman yang menghasilkan gula misal tebu dan molase dan juga tanaman penghasil pati atau tepung yakni jagung, singkong dan juga sagu. Pada tahapan persiapan, bahan baku berupa padatan harus dikonversi terlebih dahulu menjadi larutan gula sebelum akhirnya difermentasi untuk menghasilkan etanol, sedangkan bahan-bahan yang sudah dalam bentuk larutan gula misal molase dapat secara langsung difermentasi. Bahan padatan dikenai perlakuan pengecilan ukuran dan juga tahap pemasakan. Proses pengecilan ukuran dapat dilakukan dengan menggiling bahan (singkong, sagu, dan jagung) sebelum memasuki tahap pemasakan. Tahap pemasakan bahan meliputi proses liquifikasi
dan sakarifikasi. Pada tahap ini, tepung/pati dikonversi menjadi gula
(Hambali et al. 2008).
Tahap fermentasi merupakan tahap kedua dalam proses produksi bioetanol. Pada tahap ini terjadi proses pemecahan gula-gula sederhana menjadi etanol dengan melibatkan enzim dan ragi. Fermentasi dilakukan pada suhu sekitar
27 – 32 0C. Pada tahap ini akan dihasilkan gas CO2 sebagai by product dan sludge
sebagai limbahnya. Gas CO2 yang dihasilkan memiliki perbandingan stoikiometri
yang sama dengan etanol yang dihasilkan yaitu 1:1. Setelah melalui proses
pemurnian, gas CO2 dapat digunakan sebagai bahan baku gas dalam minuman
berkarbonat (Hambali et al. 2008).
Tahap berikutnya adalah pemurnian bioetanol yang diperoleh. Tahap ini dilakukan dengan metode destilasi. Destilasi dilakukan pada suhu diatas titik didih
etanol murni yaitu pada kisaran 78–100 0C. Produk yang dihasilkan pada tahap ini
memiliki kemurnian hingga 96%. Etanol hasil destilasi kemudian dikeringkan melalui metode purifikasi untuk meningkatkan kemurnian etanol hingga
memenuhi spesifikasi bahan bakar ataupun untuk keperluan industri
(Hambali et al. 2008).
2.6.2 Sakarifikasi
pati dari mikroorganisme, konversi pati untuk menghasilkan maltose dan dekstrin yang tidak terfermentasi terjadi karena hidrolisis enzimatis. Komposisi kimia dari pati adalah amilosa dan amilopektin. Amilosa merupakan polimer dari glukosa yang merupakan rantai lurus dan secara kuantitatif amilosa dapat dihidrolisis menghasilkan maltose sedangkan amilopektin hanya akan terhidrolisis sebagian. Pati jagung yang disakarifikasi akan menghasilkan 80% maltose dari total pati dan
sisanya disebut limit dekstrin (Hidayat et al. 2006).
2.6.3 Fermentasi
Tahap inti dari produksi bioetanol adalah fermentasi gula sederhana, baik yang berupa glukosa, sukrosa, maupun fruktosa dengan menggunakan ragi/yeast
terutama Saccharomyces sp. atau bakteri Zymomonas mobilis. Dalam proses ini,
gula akan dikonversi menjadi etanol dan gas karbon dioksida (Nowak 2000). Fermentasi dapat didefenisikan sebagai perubahan gradual oleh enzim beberapa bakteri, ragi, dan jamur. Contoh perubahan kimia dari fermentasi meliputi pengasaman susu, dekomposisi pati dan gula menjadi alkohol dan karbon
dioksida, serta oksidasi senyawa nitrogen organik (Wilkins et al. 2007). Bahan
dasar untuk kebutuhan fermentasi dapat berasal dari hasil pertanian, perkebunan, maupun limbah industri. Bahan dasar yang umum dipergunakan di negara berkembang adalah:
1) Molase (karena banyaknya tebu di negara tersebut).
2) Pati (gandum, jagung, beras, dll.)
3) Jerami
4) Dedak
5) Kulit kopi, kulit coklat, sabut kelapa.
6) Ampas tebu, ampas biji-bijian yang telah diambil minyaknya.
7) Kotoran binatang
8) Air limbah.
9) Sampah sebagai komponen pupuk
10) Sisa pabrik kertas, pabrik susu, dan sebagainya.
tidak diketahui secara pasti. Adanya mikroorganisme penghasil pigmen, terutama kapang akan menyebabkan produk fermentasi menjadi berwarna, berasa asam dan memiliki bau yang asing. Inokulum atau ragi yang ditambahkan dalam fermentasi
biasanya kurang dari 1%. Umumnya jumlah ragi yang dipakai adalah 0,2–0,5%
(Hidayat et al. 2006).
Secara garis besar, fermentasi karbohidrat oleh ragi dapat dibagi menjadi
dua tahap (Judoamidjojo et al.1992), yaitu :
1) Pemecahan karbohidrat (pati) menjadi gula pereduksi
Pemecahan karbohidrat menjadi gula pereduksi karena difermentasi oleh
enzim diastase dan zymase yang terkandung dalam ragi, seperti terlihat pada
2) Perubahan gula pereduksi menjadi etanol
Perubahan gula pereduksi menjadi etanol dilakukan oleh enzyme invertrase, yaitu enzim kompleks yang terkandung dalam ragi. Reaksinya adalah sebagai berikut :
Merupakan kelanjutan dari proses fermentasi alkohol. Proses dimulai dari proses pemecahan gula menjadi alkohol, selanjutnya alkohol menjadi asam asetat.
2C2H5OH + 2CO2 bakteri 2CH3COOH + 2H2O Bakteri yang aktif :
Acetobacter aceti
2.6.4 Destilasi
Kadar etanol hasil fermentasi tidak dapat mencapai level diatas 18 hingga
21%, sebab etanol dengan kadar tesebut bersifat toxic terhadap ragi yang
memproduksi etanol tersebut sehingga untuk memperoleh etanol dengan kadar yang lebih tinggi perlu dilakukan destilasi. Destilasi adalah proses pemanasan yang memisahkan etanol dan beberapa komponen cair lain dari substrat fermentasi sehingga diperoleh kadar etanol yang lebih tinggi (Jirasak dan Sornvoraweat 2011).
Tujuan proses destilasi adalah untuk memisahkan etanol dari campuran
etanol-air. Titik didih etanol adalah 78 0C dan titik didih air adalah 100 0C
sehingga dengan pemanasan pada suhu 78 0C dengan metode destilasi maka etanol
dapat dipisahkan dari campuran etanol-air. Konsentrasi maksimum etanol yang dapat diperoleh dengan cara destilasi adalah 96%. Etanol anhidrat (99,5%-100%) dapat diperoleh dengan menggunakan metode destilasi azeotrop menggunakan benzen (Waller 1981).
Campuran azeotrop etanol-air dapat dipisah dengan penambahan benzen dimana akan terbentuk campuran azeotrop benzen-etanol-air dengan titik didih
64,9 0C. Titik didih campuran tersebut lebih rendah dari campuran etanol-air
(78,2 0C) sehingga etanol dapat dipisahkan dari air dengan destilasi bertingkat,
namun pemisahan etanol dengan metode ini akan menyisakan beberapa ppm
residu benzene di dalam etanol yang diperoleh. Benzen adalah bahan yang toxic
bagi manusia, selain itu penggunaan metode ini juga menghasilkan etanol yang tidak murni sehingga metode ini tidak banyak dipergunakan (Graham 2003).
Metode alternatif yang dapat dipergunakan untuk memperoleh etanol
dengan kadar 100% dari etanol 96% adalah dengan menggunakan molecular
3 METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Januari-April 2012. Penelitian analisis komposisi kimia dan pembuatan bioetanol buah lindur dilakukan di Laboratorium Mikrobiologi dan Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, penelitian histologi buah lindur dilakukan di Laboratorium Histologi Fakultas Kedokteran Hewan, Intitut Pertanian Bogor dan pengujian kadar bioetanol di Laboratorium Terpadu, Institut Pertanian Bogor.
3.2 Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini terdiri dari bahan utama,
yaitu dari buah lindur (B. gymnorrhiza) yang diperoleh dari Pulau Kaya, Kota
Tual, Kabupaten Maluku Tenggara dan bahan untuk perhitungan proksimat misal
akuades, HCl, NaOH, katalis selenium, H2SO4, H3BO3 dan pelarut heksana.
Bahan untuk pembuatan bioetanol adalah gula pasir, HCl, NaOH, pupuk NPK
(Natrium, Posfor, Kalium), pupuk ZA (zwavelzuur ammonia), isolat
Saccharomyces cerevisiae, PDA (Potato Dextrose Agar), PDB (Potato Dextrose Broth). Sedangkan bahan–bahan yang digunakan untuk pewarnaan preparat adalah
parafin, xylol, toluidine blue, etanol, larutan seri Johansen, FAA.
Alat-alat yang digunakan antara lain mikroskop merk Olympus BH-2,
kromatografi gas SupelcoTM 37 Component FAME Mix, beker glass 2 L, kompor
listrik, alat pengaduk, timbangan digital, pH meter, gelas ukur 100 ml, saringan, spatula, pipet volumetrik, piknometer, selang (d=3 mm), toples kaca 300 ml, alumunium foil, jarum ose, blender, parutan kelapa, pisau, plastik, baskom,
inkubator, autoclave, thermometer, cawan porselen, oven, desikator, tabung
reaksi, gelas erlenmeyer, tabung Kjeldahl, tabung soxhlet, buret, mortar, tanur,
3.3Metode Penelitian
Penelitian ini menggunakan metode eksperimen di Laboratorium sesuai dengan prosedur kerja. Penelitian ini terdiri dari dua tahap, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi karakterisasi bahan baku (buah lindur), analisis histologi, uji proksimat, pembuatan starter (regenerasi kultur dan starter media cair), pembuatan media fermentasi,
penambahan nutrient, pengaturan pH dan pasteurisasi. Penelitian utama meliputi
pembuatan bioetanol, yaitu fermentasi alkohol, pelakuan inkubasi, dan pengujian (uji pH akhir dan uji kadar etanol).
3.3.1 Pengambilan dan preparasi sampel
Penelitian ini diawali dengan pengambilan dan preparasi sampel buah
lindur (B. gymnorrhiza). Buah lindur ditemukan di daerah mangrove dan banyak
terkena sinar matahari. Setelah sampel buah lindur diperoleh kemudian dibawa
dengan cool box hingga ke laboratorium kemudian dicuci dengan air bersih untuk
menghilangkan benda asing yg menempel lalu dikeringkan di bawah sinar matahari.
3.3.2 Pembuatan preparat dengan metode parafin dan pengamatan
Pengamatan jaringan tanaman diawali dengan pembuatan preparat
tanaman lindur (B. gymnorrhiza) kemudian pengambilan gambar objek pada
mikroskop. Pembuatan preparat dilakukan dengan metode parafin. Tahapannya terdiri atas fiksasi, pencucian, dehidrasi dan penjernihan, infiltrasi, pemurnian dalam blok, penyayatan, perekatan, dan pewarnaan. Bagian tanaman lindur yang diambil adalah daun, batang dan daun.
Fiksasi dilakukan selama >24 jam (5 hari) dalam larutan FAA, setelah itu larutan fiksasi dibuang dan sampel dicuci dengan etanol 50% sebanyak 4 kali dengan waktu penggantian masing-masing selama 30 menit. Kemudian didehidrasi dan dijernihkan secara bertahap melalui perendaman dalam larutan seri Johansen pada suhu ruang. Proses infiltrasi dimulai dari perendaman sampel dalam TBA dengan minyak parafin dengan perbandingan 1 : 1 dan 1/3 parafin beku dan disimpan pada suhu ruang selama 4 jam yang dilanjutkan pengovenan
pada suhu 58 oC selama 18 jam. Pergantian parafin dilakukan setiap 5 jam sekali
Proses penanaman dilakukan dengan cara sampel dari tahap infiltrasi dimasukkan ke dalam blok kotak yang berisi parafin cair dan disimpan pada suhu ruang hingga benar-benar membeku. Proses penyayatan dilakukan dengan menggunakan mikrotom putar setebal 10 µm. Blok parafin terlebih dahulu
dipotong dan dirapihkan kemudian ditempelkan pada holder lalu disayat. Hasil
sayatan direkatkan pada gelas objek yang telah diolesi albumin-gliserida dan
ditetesi air. Gelas berisi pita parafin kemudian dipanaskan pada hot plate dengan
suhu 45 oC selama 3-5 jam. Pewarnaan dilakukan dengan toluidin blue.
Proses selanjutnya adalah penutupan dengan pemberian entellen atau
canada balsam pada gelas objek dan ditutupi dengan gelas penutup. Proses pengambilan gambar dilakukan dengan mikroskop cahaya. Diagram alir pembuatan preparat dengan metode parafin, pewarnaan dan pengamatan disajikan pada Gambar 5.
Tumbuhan Lindur (daun, batang dan buah)
Pewarnaan
Pengamatan dengan mikroskop
Pemotongan dengan panjang 2 cm dan tebal 0,1 mm
Fiksasi FAA
Pencucian dengan etanol
Infiltrasi dengan parafin
Penanaman dalam parafin
Penyayatan blok parafin
Gambar 5 Diagram alir pembuatan preparat dengan metode parafin.
3.3.3 Analisis Proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia yang ada pada suatu bahan. Analisis proksimat
dilakukan untuk mengetahui kandungan gizi secara kasar (crude) yang meliputi
kadar air dengan menggunakan metode oven (AOAC 2005), kadar abu dengan menggunakan tanur (AOAC 2005), protein dengan menggunakan metode kjeldahl (AOAC 2005) dan lemak dengan menggunakan metode sokhlet (AOAC 2005).
a. Analisis Kadar air (AOAC 2005)
Kadar air dalam suatu bahan dapat diukur dengan berbagai cara. Metode pengukuran kadar air yang umum digunakan di laboratorium adalah dengan cara pengovenan atau destilasi. Tahap pertama yang dilakukan adalah mengeringkan
cawan porselen pada suhu 102-105 oC selama 30 menit. Cawan tersebut
diletakkan dalam desikator kurang lebih 30 menit hingga dingin kemudian ditimbang. Sampel buah lindur ditimbang sebanyak 1-2 gram setelah terlebih dahulu dipotong kecil-kecil, lalu dihomogenkan. Sampel yang telah dihomogenkan dimasukkan ke dalam cawan porselen. Cawan porselen beserta
sampel ke dalam oven dengan suhu 102-105 oC selama 6 jam. Setelah 6 jam
cawan tersebut dimasukkan ke dalam desikator hingga dingin kemudian ditimbang bobotnya.
Rumus
Keterangan: A = Berat cawan porselen kosong (gram)
B = Berat cawan porselen dengan sampel (gram) sebelum dioven C = Berat cawan porselen dengan sampel (gram) setelah dioven
b. Analisis Kadar Abu (AOAC 2005)
dengan suhu 105 oC, lalu didinginkan dalam desikator kemudian ditimbang. Sampel buah lindur sebanyak 1-2 gram yang telah dipotong kecil-kecil dimasukkan ke dalam cawan abu porselen. Cawan porselen beserta sampel buah
lindur didalamnya dipijarkan dalam tungku pengabuan bersuhu 105 oC sampai
tidak berasap. Selanjutnya cawan tersebut dimasukkan ke dalam tanur pada suhu
600 oC selama 2-3 jam. Proses pengabuan dilakukan sampai abu berwarna putih.
Setelah itu cawan abu porelin didinginkan dalam desikator selam 30 menit, kemudian ditimbang bobotnya.
Perhitungan kadar abu:
Keterangan: A = Berat cawan porselen kosong (gram)
B = Berat cawan porselen dengan sampel (gram) sebelum ditanur C = Berat cawan porselen dengansampel (gram) setelah ditanur
c. Analisis Kadar Protein (AOAC 2005)
Tahap – tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap
yaitu destruksi, destilasi dan titrasi. Pertama–tama, sampel dimasukkan sebanyak
0,1 gram ke dalam tabung kjelhdal. Selanjutnya ditambahkan selenium dan 3 ml
H2SO4 ke dalam tabung tersebut. Tabung yang berisi larutan tersebut dimasukkan
ke dalam alat pemanas dengan suhu 410 0C. Proses dekstruksi dilakukan sampai
larutan berwarna bening (Tahap destruksi). Selanjutnya isi labu dituangkan ke dalam labu destilasi, lalu ditambahkan ke dalam alat destilasi dan ditambahkan larutan NaOH 40% sebanyak 20 ml. Cairan dalam ujung tabung kondensor
ditampung dalam Erlenmeyer 125 ml berisi larutan H3BO3 indikator yang ada di
bawah kondensor. Destilasi dilakukan sampai diperoleh 200 ml destilat yang
bercampur dengan H3BO3 indikator dalam erlenmeyer (Tahap destilasi). Terakhir
Keterangan:
fp = Faktor pengenceran = 10 fk = Faktor konversi = 6,25
d. Analisis Kadar Lemak (AOAC 2005)
Lemak adalah senyawa yag larut dalam pelarut non polar. Sifat kelarutan lemak sangat tergantung pada strukturnya. Metode yang sering digunakan di Laboratorium adalah metode ekstraksi soxhlet, yakni secara langsung mengekstraksi lemak dari bahan degan pelarut organik non polar, misal heksana,
petroleum eter, dan dietil eter. Mula–mula sampel seberat 5 gram (W1)
dimasukkan ke dalam kertas saring dan dimasukkan ke dalam selongsong lemak, kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang reaktor tabung soxhlet dan disiram dengan pelarut lemak. Tabung
ekstraksi dipasang pada alat destilasi soxhlet lalu dipanaskan pada suhu 40 oC
dengan pemanas listrik selama 16 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung diruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke
dalam labu lemak, selanjutnya dikeringkan dalam oven dengan suhu 105 oC,
setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3). Perhitungan kadar lemak yaitu :
pengurangan dari 100% dari penjumlahan kadar air, kadar abu, kadar protein, dan kadar lemak sehingga kadar karbohidrat tergantung pada faktor pengurangan. Hal
[ [
3.3.4 Pembuatan starter (Fardiaz 1992)
Pembuatan starter untuk fermentasi diantaranya melalui proses regenerasi kultur dan starter pada media cair. Metode regenerasi kultur yang digunakan untuk
menumbuhkan khamir atau S. cerevei adalah pada PDA (Potato Dextrose Agar)
dengan metode tebar. Isolat S. cerevei dimasukkan ke dalam agar miring. PDA
(Potato Dextrose Agar) sebanyak 10 ml dengan cara ditebar dipermukaan media
PDA (Potato Dextrose Agar) sebanyak 3-5 jarum ose dan dibiakkan dalam
inkubator selama ± 48 jam dengan kondisi aerobik pada suhu 25-30 oC. Setelah
itu, biakan pada PDA (Potato Dextrose Agar) diinokulasi sebayak 5 jarum ose ke
dalam PDB (Potato Dextrose Broth) 100 ml, kemudian diinkubasi selama ± 48
jam dengan kondisi aerobik pada suhu 25-30 oC. Hasil biakan ini akan dipakai
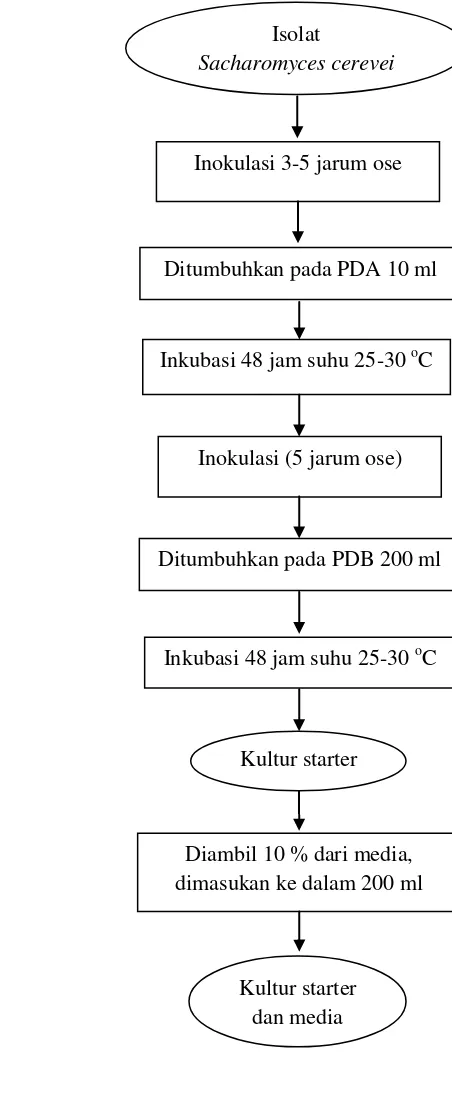
pada fermentasi utama. Diagram alir pembuatan starter disajikan pada Gambar 6.
3.3.5 Pembuatan media fermentasi (Junk dan Pancoast 1980)
Pembuatan media fermentasi yaitu dengan preparasi buah lindur,
penambahan nutrient, pengaturan pH dan pasteurisasi. Tepung buah lindur
(B. gymnorrhiza) sebanyak 100 g dibuat menjadi larutan suspensi, yakni tepung buah lindur dicampur dengan HCl 5% (v/v) dengan perbandingan 1:20 (b/v),
kemudian diaduk hingga rata sambil dipanaskan pada suhu 100 oC selama 1 jam.
Kemudian hidrolisis dilanjutkan di autoclave pada suhu 121 oC, tekanan 1 kg/m2
dengan waktu 1 jam. Hasil hidrolisis diendapkan ± 1 jam, lalu disaring menggunakan nilon mesh 150, dan diambil filtratnya sebagai media untuk
difermentasi. Selanjutnya, cairan hasil hidrolisis ditambah dengan nutrient berupa
0,5% NPK (b/b), 1% ZA (b/b) dan 2% gula pasir (b/b), diaduk hingga rata. Kemudian pH larutan diatur 4-5, diambil nilai tengahnya ± 4,6 dengan cara
ditambah NaOH sedikit demi sedikit. Langkah selanjutnya adalah pasteurisasi
pada suhu 80 oC selama 5 menit, lalu didinginkan hingga 30 menit. Diagram alir
pembuatan media fermentasi diperlihatkan pada Gambar 7.
Pembuatan bioetanol ini terdiri dari fermentasi alkohol dan perlakuan inkubasi. Fermentasi utama dilakukan pada toples kaca 200 ml. Substrat berupa cairan glukosa hasil hidrolisis dimasukkan ke dalam 3 toples kaca 250 ml masing-masing 200 ml. Starter ditambahkan sebanyak 10 %. Fermentasi dilakukan pada kondisi anaerobik. Pipa kecil dipasang pada kepala toples kaca yang sebelumnya
ditutup, ujung pipa tersebut dibenamkan ke dalam air untuk menangkap CO2 dan
menghambat adanya sirkulasi udara bebas.
Perlakuan yang diberikan yaitu saat inkubasi atau waktu fermentasi (X)
adalah 3, 5, 7 hari. Terbentuknya gelembung-gelembung udara menunjukkan
proses fermentasi pembentukan alkohol sedang berjalan. Fermentasi berlangsung
pada suhu kamar (25-30 oC). Setelah masing-masing toples kaca dan isinya
mendapat perlakuan inkubasi, kemudian dilakukan pengujian jumlah alkohol yang
didapat dari tiap perlakukan dengan menggunakan Gas Chromatography (GC).
Diagram alir proses fermentasi diperlihatkan pada Gambar 8.
3.3.7 Pengujian
Pengujian yang dilakukan diantaranya uji pH akhir fermentasi, uji kadar dan etanol (penetapan berat jenis). Diagram alir penentuan uji pH akhir, serta kadar alkohol disajikan pada Gambar 8.
1) Uji pH akhir fermentasi (AOAC 2005)
Media yang sudah difermentasi di uji pH akhirnya dengan menggunakan pH meter. Katoda pH meter dibilas dengan akuades kemudian dikeringkan dengan kertas tisu. Katoda dimasukkan ke dalam buffer dengan pH 6,8, ditunggu sampai ada tanda bunyi yang menunjukkan bahwa pH meter siap digunakan. pH meter dimasukkan ke dalam media uji, hasilnya dicatat.
2) Uji kadar etanol (Subekti 2006)
Pengukuran konsentrasi etanol yang dihasilkan dengan menggunakan Gas Chromatography (GC). Identifikasi kadar etanol dilakukan dengan
menginjeksikan metil ester pada kromatografi gas SupelcoTM 37 Component Fame
Mix dengan kondisi sebagai berikut: gas yang digunakan sebagai fase bergerak
dengan aliran 200-300 ml/menit, kolom yang digunakan adalah kolom kapiler (capillary column) dB-23 berisi cyanopropil methylsil sepanjang 60 m dengan diameter dalam 0,25 mm, dengan tebal lapisan film 0,25 µm. Temperatur
terprogram sebesar 125 oC, kemudian suhu dinaikkan 5 oC per menit hingga suhu
akhir 225 oC, suhu injektor 220 oC, dan suhu detektor 240 oC.
Konsentrasi etanol diperoleh dari perhitungan rasio Area dimana luas area etanol sampel dibagi dengan luas area n-propanol sampel. Kemudian hasil rasio area tersebut dibagi dengan slope hasil kurva kalibrasi etanol.
Konsentrasi etanol standar = 99,9 % Berat Jenis etanol standar = 798,21 g/L
Rasio Area = Luas area etanol sampel : Luas area n-propanol sampel
Gambar 6 Diagram alir pembuatan kultur starter.
(Rinaldy 1987 dalam Devis 2008 dimodifikasi)
Isolat
Sacharomyces cerevei
Inokulasi 3-5 jarum ose
Inkubasi 48 jam suhu 25-30 oC
Inokulasi (5 jarum ose)
Ditumbuhkan pada PDB 200 ml
Inkubasi 48 jam suhu 25-30 oC
Diambil 10 % dari media, dimasukan ke dalam 200 ml
Kultur starter
Kultur starter dan media
Buah Lindur (B. gymnorrhiza)
Pengeringan dan penghalusan
Diambil 200 gr
Hidrolisis (HCl 5 % 1:20 b/v, 121 oC, 2 jam)
Penyaringan (Nilon mesh 150)
Pasteurisasi 80 oC, 5 menit Penambahan nutrisi
Perlakuan 1 (X1) 200 ml media
(toples kaca)
Media
Filtrat
Gula 2 % NPK 0,5 %
ZA 1%
Media
Perlakuan 3 (X3) 200 ml media
(toples kaca) Perlakuan 2 (X2)
200 ml media (toples kaca)
Gambar 7 Diagram alir pembuatan media fermentasi dari buah lindur (B. gymnorrhiza).
(Rinaldy 1987 dalam Devis 2008 dimodifikasi)
Gambar 8 Diagram alir proses fermentasi dan penentuan kadar alkohol.
(Rinaldy 1987 dalam Davis 2008 dimodifikasi)
Uji pH Uji Kadar etanol Inkubasi 3 hari
(X1)
Kultur starter dan media fermentasi 660 ml
Alkohol
Inkubasi 7 hari (X5) Inkubasi 5 hari
3 HASIL DAN PEMBAHASAN
4.1 Karakteristik Jaringan Tanaman Lindur (B. gymnorrhiza)
Histologi tumbuhan adalah ilmu yang mempelajari struktur mikroskopis atau karakteristik sel dan fungsi dari jaringan dan organ. Beberapa metode dapat
digunakan untuk melihat jaringan tumbuhan (Hidayat 1995). Pembuatan preparat
daun, batang, dan buah tumbuhan lindur (B. gymnorrhiza) serta pengamatan
menggunakan mikroskop cahaya merk Olympus BH-2, memberikan hasil anatomi pada bagian daun, batang, dan buah tumbuhan lindur.
4.1.1 Deskripsi jaringan daun tanaman lindur (B. gymnorrhiza)
Daun merupakan suatu bagian tumbuhan yang penting dan pada umumnya tiap tumbuhan memiliki sejumlah besar daun. Alat ini hanya terdapat pada batang saja dan tidak pernah terdapat pada bagian lain pada tumbuhan. Daun biasanya
jaringan ini terdapat rongga interseluler. Bagian paling bawah biasanya terdapat epidermis bawah, dengan struktur yang mirip dengan epidermis atas namun berbeda dalam hal jumlah stomatanya. Menurut Astuti dan Sri (2010) menyatakan bahwa epidermis tumbuhan air tidak berfungsi untuk perlidungan tetapi untuk pengeluaran zat makanan, senyawa air dan pertukaran gas. Jaringan palisade tersusun dalam dua lapis sel. Adanya titik-titik yang tersebar dalam parenkim palisade menunjukan adanya kloroplas yang berfungsi untuk menangkap cahaya. Keadaan penampang melintang daun lindur disajikan pada Gambar 9.
Gambar 9 Penampang melintang daun tumbuhan lindur
Stoma adalah lubang atau celah yang terdapat pada epidermis organ tumbuhan yang berwarna hijau, dibatasi oleh sel khusus yang disebut penutup
(Nugroho et al. 2006). Stomata pada daun tumbuhan lindur terdapat pada bagian
atas dan bawah daun. Jenis stomata yang terdapat pada epidermis daun tumbuhan buah lindur berdasarkan penampakan stomata dewasa adalah jenis parasitik, yaitu stomata yang didampingi oleh satu atau lebih sel tetangga yang sejajar terhadap sumbu panjang dari celah dan sel penjaga (Dickison 2000). Berikut ini adalah gambar stomata yang terdapat pada daun tumbuhan lindur.
Gambar 10 Stomata pada bagian atas daun tumbuhan lindur.
4.1.2 Deskripsi jaringan batang tanaman lindur (B. gymnorrhiza)
Batang tanaman berperan dalam mendukung daun dan struktur reproduksi tanaman, menyediakan pengakut bagian dalam dan menghasilkan jaringan baru (Berg 2008). Fungsi utama dari batang adalah mendukung daun-daun sehingga selalu terbuka terhadap cahaya matahari. Batang bertindak sebagai pengangkut air dan mineral ke bagian atas tanaman dan mentransportasikan produk-produk fotosintesis dari daun ke bagian lain tanaman. Bentuk batang jika dilihat dari penampang melintang dapat dibedakan menjadi beberapa bentuk yaitu bulat, bersegi dan pipih. Batang tumbuhan dapat dibedakan menjadi batang basah, batang berkayu, batang rumput dan batang mendong (Tjitrosoepomo 1987). Batang dari tumbuhan lindur berwarna abu-abu hingga hitam. Batang tumbuhan lindur ketika dipotong melintang dapat dilihat bahwa terdapat banyak rongga. Jaringan yang terdapat pada batang lindur adalah epidermis, parenkim, korteks dan jaringan pengangkut. Keadaan penampang melintang batang lindur disajikan pada Gambar 11.
Gambar 11 Penampang melintang batang tumbuhan lindur.
Jaringan epidermis batang tanaman lindur terdiri atas satu lapis sel dan tersusun rapat. Pada penampang melintang batang lindur, bentuk sel epidermis umumnya cenderung bentuk persegi panjang. Dinding sel tangential epidermis bagian atas berukuran lebih panjang daripada dinding sel bagian bawah. Dinding sel sisi radial cenderung tegak terhadap dinding tangential dan berukuran lebih kecil dibandingkan dinding sel bagian atas. Sel-sel epidermis batang tersusun rapat dan berdinding tangential yang tebal dan berfungsi mengurangi transpirasi.
Nugroho et al. (2006), menyatakan bahwa susunan epidermis menyebabkan terjadinya pengurangan transpirasi dan melindungi jaringan di sebelah dalamnya.
Berkas pembuluh pada batang tersusun tegak lurus terhadap penampang batang lindur yang berbentuk segitiga. berkas pembuluh batang lindur dikelilingi oleh sejumlah sel yang merupakan bagian endodermis. Berkas pembuluh batang terbagi atas floem dan xilem. Floem terdiri atas sel-sel yang berukuran kecil dan mengelilingi pembuluh xilem.
4.1.3 Deskripsi jaringan buah tanaman lindur (B. gymnorrhiza)
Buah merupakan salah satu organ tumbuhan untuk pembiakan dan biasanya mengandung biji. Setelah pembuahan pistil (bunga betina) akan tumbuh menjadi buah (Sutrian 1992). Pada umumnya buah hanya akan terbentuk sesudah terjadi penyerbukan dan pembuahan pada bunga. Walaupun demikian mungkin pula buah terbentuk tanpa ada penyerbukan dan pembuahan.
Buah biasanya dibagi menjadi buah sejati dan buah semu. Buah lindur
diduga tergolong dalam buah semu (fructus spurius). Buah semu dibagi menjadi
tiga yaitu buah semu tunggal, buah semu ganda dan buah semu majemuk. Buah lindur dapat digolongkan buah semu tunggal karena terjadi dari satu bunga dengan satu bakal buah. Pada buah ini selain bakal buah ada bagian lain bunga yang ikut membentuk buah (Tjitrosoepomo 1987). Keadaan penampang melintang dari buah lindur disajikan pada Gambar 12.
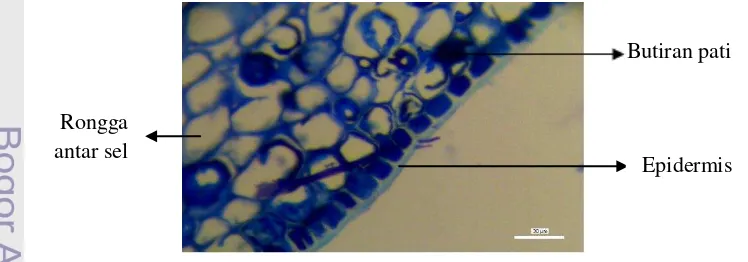
Gambar 12 Penampang melintang buah tumbuhan lindur.
Epidermis merupakan lapisan terluar pada buah yang tersusun rapat bersifat sebagai pelindung dengan bentuk yang cenderung persegi panjang dan terdiri dari satu lapis, dengan dinding tangential atas cenderung lebih tebal dari dinding tangential bawahnya. Kedua dinding radial sel cenderung lebih pendek
Butiran pati
Rongga antar sel
dari pada dinding tangential selnya. Pati ditemukan dalam jumlah besar pada jaringan korteks dalam vakuola.
Gambar 13 Berkas pembuluh pada buah tumbuhan lindur.
Berkas pembuluh pada buah tumbuhan lindur terlihat pada Gambar 13. Pada gambar tersebut terlihat bahwa silinder vaskuler pada buah tumbuhan lindur
membentuk sistem konsentris amphikribral dimana xilem berada di dalam
sedangkan floem mengelilingi xilem tersebut. Kerja xilem dalam hal transportasi air dan zat mineral dari akar ke seluruh jaringan serta adanya kandungan pati menyebabkan ukuran pembuluhnya lebih tebal daripada floem. Pati pada vakuola berfungsi sebagai cadangan makanan pada tumbuhan.
4.2 Komposisi Kimia Buah Lindur Segar
Buah lindur (B. gymnorrhiza) biasanya dimanfaatkan oleh masyarakat
sebagai makanan pengganti nasi pada saat musim paceklik, khususnya di Kabupaten Maluku Tenggara dan di beberapa wilayah nusantara. Salah satu cara untuk menentukan kandungan gizi suatu produk yaitu dengan menggunakan analisis proksimat. Hal paling mendasar dari unsur pokok dalam bahan pangan terdiri dari air, lemak total, protein kasar, dan abu, sedangkan karbohidrat dihitung
dengan karbohidrat N-free (100%-kadar air-kadar abu-lemak-protein-serat)
(AOAC 2005). Komposisi kimia buah lindur dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia buah lindur segar
No Analisa Proksimat Jumlah (%)
4 Kadar protein 2,11
5 Kadar karbohidrat 32,91
4.2.1 Kadar air
Air merupakan komponen yang penting dalam bahan makanan, karena air dapat memberikan pengaruh kepada penampakan, tekstur serta cita rasa. Bahkan di dalam makanan kering sekalipun, terkandung air dalam jumlah tertentu. Produk hasil perikanan memiliki kandungan air yang sangat tinggi, sekitar 80%. Kandungan air dalam bahan makanan ikut menentukan daya terima, kesegaran serta daya simpan bahan tersebut (Winarno 2008). Kandungan air dalam produk
perikanan diperkirakan sebesar 70-85 % (Nurjanah dan Abdullah 2008 dalam
Febrianti 2010). Berdasarkan hasil analisis proksimat dari buah lindur segar menunjukkan bahwa nilai kadar air adalah 62,92 %. Nilai ini lebih rendah dibandingkan dengan penelitian Fortuna (2005), yang menyatakan kadar air buah lindur sebesar 73,76%. Tingginya nilai kadar air pada buah lindur menyebabkan buah ini mudah mengalami kebusukan. Hal ini didukung oleh pernyataan Wirakusumah (2007), bahwa buah dan sayuran termasuk makanan yang yang
mudah mengalami kerusakan (high perishable food) karena peranan air dalam
bahan pangan dapat mempengaruhi aktivitas metabolisme seperti aktivitas enzim, aktivitas mikroba, aktivitas kimiawi yaitu terjadinya ketengikan dan reaksi-reaksi non enzimatik. Akan tetapi, nilai kadar air dari buah lindur tersebut lebih tinggi
dibandingkan dengan penelitian Wibowo et al. (2009) yang menyatakan bahwa
kadar air Avecennia marina sebesar 61,95%. Nilai ini menunjukan bahwa kadar
Air dalam tubuh berfungsi sebagai pelarut dan alat angkut zat-zat gizi, terutama vitamin larut air dan mineral. Selain itu air juga berfungsi sebagai katalisator, pelumas, fasilitator pertumbuhan, pengatur suhu dan peredam benturan (Wirakusumah 2007).
4.2.2 Kadar abu
Abu merupakan zat anorganik sisa hasil pembakaran suatu bahan organik. Kandungan abu dan komposisinya tergantung pada macam bahan yang dianalisis. Sebagian besar bahan makanan, sekitar 96% terdiri dari bahan organik dan air. Sisanya terdiri dari unsur-unsur mineral yang juga dikenal sebagai unsur anorganik (kadar abu). Komponen-komponen organik terbakar, tetapi komponen anorganiknya tidak dan komponen ini disebut abu (Winarno 2008).
Analisis proksimat yang telah dilakukan pada buah lindur segar menunjukkan bahwa kadar abu yang dikandung adalah 1,29 %. Hal ini tidak berbeda jauh dengan hasil penelitian Fortuna (2005) yang menyatakan kadar abu buah lindur sebesar 0,34 %. Apabila dibandingkan dengan kadar abu dari berbagai
jenis buah mangrove lain misalnya Sonneratia sp. dan Avecennia marina. Kadar
abu buah lindur hasil penelitian lebih rendah dibandingkan dengan penelitian
Febrianti (2010) yang menyatakan kadar abu Sonneratia sp. sebesar 4,35% dan
lebih tinggi nilai kadar abu buah lindur apabila dibandingkan dengan penelitian
Wibowo et al. (2009) yang menyatakan kadar abu buah mangrove jenis Avecennia
marina sebesar 1,27%. Mineral pada tanaman juga berkaitan dengan kandungan serat penyusun dinding sel dari jaringan tanaman. Elemen mineral tidak dapat dirusak oleh panas, cahaya, zat pengoksidasi, pH ekstrim maupun faktor lainnya. Mineral dapat dihilangkan dengan pelepasan secara fisik. Sejumlah mineral memiliki kelarutan dalam air. Secara umum, perebusan dalam air menyebabkan hilangnya mineral atau penyusutan mineral pada sebuah bahan jika dibandingkan dengan pengukusan (Harris & Karmas 1989).
melalui membran sel dan pemeliharaan kepekaan otot dan saraf terhadap rangsangan (Almatsier 2000).
4.2.3 Kadar lemak
Lemak merupakan bahan yang tidak larut dalam air yang berasal dari tumbuh-tumbuhan dan hewan. Lemak yang banyak digunakan dalam makanan adalah trigliserida yang merupakan ester dari gliserol dan berbagai asam lemak. Komponen-komponen lain yang mungkin terdapat adalah fosfolipid, sterol, vitamin dan zat warna yang larut dalam lemak misal klorofil dan karotenoid (Kusnandar 2010).
Berdasarkan hasil analisis yang dilakukan, buah lindur mengandung kadar lemak sebesar 0,79 %. Hal ini tidak berbeda jauh dengan hasil penelitian Fortuna (2005) yang menyatakan kadar abu buah lindur sebesar 1,25 %. Apabila dibandingkan dengan kadar lemak dari berbagai jenis buah mangrove lain
misalnya Sonneratia sp. dan Avecennia marina. Kadar lemak buah lindur hasil
penelitian lebih tinggi dibandingkan dengan penelitian Febrianti (2010) yang
menyatakan kadar lemak Sonneratia sp. sebesar 0,69 % dan penelitian Wibowo et
al. (2009) yang menyatakan kadar lemak buah mangrove jenis Avecennia marina
sebesar 0,04 %. Menurut Prabandari et al. (2005) menyatakan bahwa kandungan
lemak yang rendah pada buah dan sayur mempunyai peranan penting dalam mempertahankan tekstur, rasa, aroma dan warna berupa trigliserida, sterol dan kolestrol
Menurut Coimbra dan Jorge (2011) menyatakan bahwa lemak pada tumbuhan banyak terkandung di bagian biji dan buah. Di dalam sel tumbuhan lemak disimpan dalam sitoplasma. Lemak pada bahan nabati umumnya berupa asam lemak tidak jenuh. Fungsi asam lemak tidak jenuh yaitu sebagai komponen dari sel-sel saraf, membrane seluler dan senyawa yang menyerupai hormon. Penelitian lain yang mendukung yaitu nilai kadar lemak buah lindur penelitian ini lebih rendah dibandingkan dengan penelitian Hikmiyati dan Sandrie (2008) yang menyatakan bahwa kadar lemak kulit singkong sebesar 1,44 % (bb).
protein sebagai energi, pengemulsi, prekursor, dan penambah cita rasa. (Wirakusumah 2007)
4.2.4 Kadar protein
Protein merupakan suatu zat makanan yang penting bagi tubuh, karena selain berfungsi sebagai zat pembangun dan pengatur jaringan-jaringan baru yang selalu terjadi di dalam jaringan tubuh. Protein digunakan sebagai bahan bakar apabila keperluan energi mengandung N yang tidak dimiliki oleh lemak dan karbohidrat (Winarno 2008).
Protein merupakan komponen penting atau komponen utama sel hewan atau manusia. Protein dapat diperoleh dari hewan atau tumbuhan, protein pada hewan disebut protein hewani sedangkan protein dari tumbuhan disebut protein
nabati. Tumbuhan membentuk protein dari CO2, H2O dan senyawa nitrogen.
Komposisi rata-rata unsur kimia yang terdapat pada protein adalah 50% karbon (C), 7% hidrogen (H), 23% oksigen (O), 16% nitrogen (N), 0-3% belerang dan 0-3% fosfor (Supriyanti dan Poedjiadi 2007). Kadar protein
yang didapatkan dari hasil analisis proksimat buah lindur segar adalah 2,11%, nilai ini lebih tinggi dibandingkan dengan kadar protein buah lindur dari penelitian
sebelumnya dan kadar protein buah pedada (Sonneratia sp.) yang berturut-turut
sebesar 1,13% dalam penelitian yang dilakukan oleh Fortuna (2005) dan kadar
protein pedada (Sonneratia sp.) yang dilakukan oleh Febrianti (2010)
sebesar 1,17%.
Protein di dalam tubuh manusia berfungsi membentuk jaringan baru dan mempertahankan jaringan yang telah ada. Kekurangan protein dalam jangka waktu yang lama dapat mengganggu berbagai proses dalam tubuh dan menurunkan daya tahan tubuh terhadap penyakit. Angka kecukupan protein untuk orang dewasa menurut Kusnandar (2010) yaitu 50 g/hari untuk pria dan 42 g/hari untuk wanita.
4.2.5 Kadar karbohidrat