ABSTRAK
CERY CHINTIA. Stabilitas Sifat dan Perkembangan Bunga Hermaprodit pada Jarak Pagar (Jatropha curcas L.). Dibimbing oleh TRIADIATI dan DORLY.
Tanaman jarak pagar (Jatropha curcas L.) memiliki bunga hermaprodit yaitu satu bunga memiliki stamen dan stigma, tetapi jarang ditemukan. Sifat hermaprodit pada J.curcas kurang stabil. Untuk itu perlu dilakukan penelitian pemacuan stabilitas pembungaan hermaprodit dari biji yang dihasilkan dari bunga hermaprodit serta mengamati perkembangan bunga hermaprodit. Pemacuan pembungaan hermaprodit dilakukan dengan zat pengatur tumbuh. Parameter yang diamati adalah jumlah daun, jumlah cabang, tinggi tanaman, besar sudut percabangan, yang diamati tiap dua minggu. Pengamatan anatomi bunga hermaprodit dilakukan terhadap sediaan mikroskopis sayatan membujur. Hasil penelitian menunjukkan bahwa bunga hermaprodit pada
J.curcas stabil ke generasi berikutnya dengan produksi bunga rata-rata 11 bunga hermaprodit dan 136 bunga jantan pada perlakuan kombinasi Giberellin dan Kinetin (50 : 50 ppm) pada 23 hari pengamatan pembungaan tiap rangkaian. Giberellin konsentrasi 100 ppm berpengaruh signifikan terhadap pertumbuhan vegetatif tanaman J.curcas. Stigma reseptif pada J.curcas terjadi satu hari sebelum bunga mekar, sedangkan polen menempel pada stigma terjadi pada saat bunga mekar. Sayatan membujur pada ovul bunga hermaprodit satu hari sebelum bunga mekar, dijumpai sel-sel subdermal nuselar.
Kata kunci: Jatropha curcas, zat pengatur tumbuh, bunga hermaprodit.
ABSTRACT
CERY CHINTIA. Stability of hermaphrodite Flower and its development in Jatropha curcas L. Under supervised by of TRIADIATI and DORLY.
Jatropha curcas L. has hermaphrodite flowers which is stamen and pistil in the same flower, but very rarely found. It was assumed that hermaphrodite flowers unstable in the next generation. The aims of this study were to evaluate the stability of hermaphrodite flower in the next generation from the hermaphrodite seedling and to observe the development of hermaphrodite flower. To obtain the stability of hermaphrodite flower was used by plant growth regulator. The parameters observed in the study were leaf number, branch number, plant height, angle of branch every two weeks. Anatomical observation of flower hermaphrodite was done on microscopical slide of longitudinal section.The results showed that the hermaphrodite flowers of J.curcas was stable in the next generation. Application of Giberellin and Kinetin (50 : 50 ppm) has the heighest number of hermaphrodite flower, that is 136 male flowers and 11 hermphrodite flowers until 23 days after flower initiation. Giberellin 100 ppm has significantly effect on vegetative growth of J.curcas. A receptive stigma was occurred one day before the flowers anthesis, while the pollen attached on the stigma occured after the flowers anthesis. Longitudinal section of ovule of hermaphrodite flowers one day before anthesis, was found subdermal cell of nucellar.
PENDAHULUAN
Latar Belakang
Tanaman jarak pagar (Jatropha curcas
L.) dikenal sebagai tanaman yang memiliki bunga uniseksual (monocieous) yaitu bunga jantan atau bunga betina terdapat pada satu rangkaian yang sama. Kondisi bunga yang uniseksual memberi peluang pada tanaman untuk melakukan penyerbukan silang (cross pollinated). J. curcas ada yang berbunga hermaprodit, tetapi sangat jarang ditemukan.
Bunga hermaprodit memiliki 2 organ kelamin yaitu stamen dan stigma dalam satu bunga. Pada J. curcas yang berbunga hermaprodit juga ditemukan juga ditemukan bunga jantan pada satu rangkaian yang sama. Dari segi pemuliaan tanaman, tanaman hermaprodit memberikan keuntungan, karena dapat menghasilkan keturunan yang seragam, karena berpeluang terjadinya penyerbukan sendiri (Reale 2008). Pembentukan bunga hermaprodit pada J.curcas diduga merupakan interaksi faktor genetik dengan lingkungan (Hartati 2009).
Produksi bunga dipengaruhi oleh Zat Pengatur Tumbuh (ZPT) baik endogen maupun eksogen. Pemacuan dengan ZPT diharapkan dapat meningkatkan dan menstabilkan sifat bunga hermaprodit. Peranan ZPT berupa Giberellin dapat meningkatkan produksi bunga jantan pada
J.curcas (Makwana & Shukla 2010). Benziladenin, Asam Triiodobenzoat, Dikegulat juga dapat mengendalikan dan mengatur tingkat pembungaan pada tanaman
J. curcas (Abdelgadir 2009). Beberapa jenis ZPT yang sering digunakan untuk pemacuan pembungaan diantaranya auksin (IAA), giberellin (GA-3), dan sitokinin (kinetin). Fungsi auksin diantaranya adalah untuk memacu pengembangan sel, pertumbuhan akar, dan pembentukan kalus. Giberelin berfungsi merangsang tanaman menghasilkan bunga sebelum waktunya, mendorong tanaman kerdil menjadi tanaman raksasa dan meningkatkan tinggi tanaman menjadi 3 sampai 5 kali dari yang normal. Kinetin berfungsi mendukung terjadinya dormansi dan menghambat absisi (Pharis & King 1985).
J. curcas berbunga hermaprodit berpotensi dikembangkan menjadi sumber bibit karena peluang pembentukan buahnya lebih tinggi dari pada J. curcas berbunga uniseksual (Triadiati et al. 2010).
Permasalahan dalam budidaya J. curcas
diantaranya belum tersedia benih J. curcas yang berbunga hermaprodit. Sifat hermaprodit
belum diketahui diwariskan pada generasi berikutnya, diduga munculnya bunga hermaprodit karena interaksi faktor genetik dengan lingkungannya. Waktu pembuahan pada bunga hermaprodit belum diketahui terjadi sebelum atau sesudah bunga mekar.
Tujuan
Tujuan penelitian ini adalah (1) mengamati stabilitas pembungaan hermaprodit dari biji yang dihasilkan dari bunga hermaprodit, (2) mengamati waktu penyerbukan, dan (3) perkembangan bunga hermaprodit sebelum mekar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2010 sampai Agustus 2011 di Kebun Percobaan Cikabayan, Laboratorium Mikroteknik dan Laboratorium Terpadu, Departemen, Biologi Institut Pertanian Bogor.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan untuk penelitian ini adalah biji J. curcas dari tanaman induk berbunga hermaprodit aksesi Dompu. Tanaman induk J. curcas hermaprodit sebelumnya ditanam di Cikampek. Bahan lain yang digunakan adalah polibag, tanah, ZPT yang terdiri dari sitokinin (kinetin), giberellin (GA-3), dan auksin (IAA). Bahan yang digunakan pada pengamatan anatomi adalah alkohol, FAA (Formaldehyde Acetic-acid Alcohol), seri larutan johansen, parafin , xilol , akuades, safranin, fast green, dan entellan.
Alat yang digunakan untuk pengamatan fisiologi adalah penggaris, busur derajat, kamera digital, sedangkan pengamatan anatomi alat yang digunakan adalah tabung film, pinset, gelas piala, gelas ukur, kaca preparat, gelas penutup, mikroskop stereo, dan mikroskop cahaya.
Metode Percobaan Pengamatan Fisiologi.
PENDAHULUAN
Latar Belakang
Tanaman jarak pagar (Jatropha curcas
L.) dikenal sebagai tanaman yang memiliki bunga uniseksual (monocieous) yaitu bunga jantan atau bunga betina terdapat pada satu rangkaian yang sama. Kondisi bunga yang uniseksual memberi peluang pada tanaman untuk melakukan penyerbukan silang (cross pollinated). J. curcas ada yang berbunga hermaprodit, tetapi sangat jarang ditemukan.
Bunga hermaprodit memiliki 2 organ kelamin yaitu stamen dan stigma dalam satu bunga. Pada J. curcas yang berbunga hermaprodit juga ditemukan juga ditemukan bunga jantan pada satu rangkaian yang sama. Dari segi pemuliaan tanaman, tanaman hermaprodit memberikan keuntungan, karena dapat menghasilkan keturunan yang seragam, karena berpeluang terjadinya penyerbukan sendiri (Reale 2008). Pembentukan bunga hermaprodit pada J.curcas diduga merupakan interaksi faktor genetik dengan lingkungan (Hartati 2009).
Produksi bunga dipengaruhi oleh Zat Pengatur Tumbuh (ZPT) baik endogen maupun eksogen. Pemacuan dengan ZPT diharapkan dapat meningkatkan dan menstabilkan sifat bunga hermaprodit. Peranan ZPT berupa Giberellin dapat meningkatkan produksi bunga jantan pada
J.curcas (Makwana & Shukla 2010). Benziladenin, Asam Triiodobenzoat, Dikegulat juga dapat mengendalikan dan mengatur tingkat pembungaan pada tanaman
J. curcas (Abdelgadir 2009). Beberapa jenis ZPT yang sering digunakan untuk pemacuan pembungaan diantaranya auksin (IAA), giberellin (GA-3), dan sitokinin (kinetin). Fungsi auksin diantaranya adalah untuk memacu pengembangan sel, pertumbuhan akar, dan pembentukan kalus. Giberelin berfungsi merangsang tanaman menghasilkan bunga sebelum waktunya, mendorong tanaman kerdil menjadi tanaman raksasa dan meningkatkan tinggi tanaman menjadi 3 sampai 5 kali dari yang normal. Kinetin berfungsi mendukung terjadinya dormansi dan menghambat absisi (Pharis & King 1985).
J. curcas berbunga hermaprodit berpotensi dikembangkan menjadi sumber bibit karena peluang pembentukan buahnya lebih tinggi dari pada J. curcas berbunga uniseksual (Triadiati et al. 2010).
Permasalahan dalam budidaya J. curcas
diantaranya belum tersedia benih J. curcas yang berbunga hermaprodit. Sifat hermaprodit
belum diketahui diwariskan pada generasi berikutnya, diduga munculnya bunga hermaprodit karena interaksi faktor genetik dengan lingkungannya. Waktu pembuahan pada bunga hermaprodit belum diketahui terjadi sebelum atau sesudah bunga mekar.
Tujuan
Tujuan penelitian ini adalah (1) mengamati stabilitas pembungaan hermaprodit dari biji yang dihasilkan dari bunga hermaprodit, (2) mengamati waktu penyerbukan, dan (3) perkembangan bunga hermaprodit sebelum mekar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2010 sampai Agustus 2011 di Kebun Percobaan Cikabayan, Laboratorium Mikroteknik dan Laboratorium Terpadu, Departemen, Biologi Institut Pertanian Bogor.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan untuk penelitian ini adalah biji J. curcas dari tanaman induk berbunga hermaprodit aksesi Dompu. Tanaman induk J. curcas hermaprodit sebelumnya ditanam di Cikampek. Bahan lain yang digunakan adalah polibag, tanah, ZPT yang terdiri dari sitokinin (kinetin), giberellin (GA-3), dan auksin (IAA). Bahan yang digunakan pada pengamatan anatomi adalah alkohol, FAA (Formaldehyde Acetic-acid Alcohol), seri larutan johansen, parafin , xilol , akuades, safranin, fast green, dan entellan.
Alat yang digunakan untuk pengamatan fisiologi adalah penggaris, busur derajat, kamera digital, sedangkan pengamatan anatomi alat yang digunakan adalah tabung film, pinset, gelas piala, gelas ukur, kaca preparat, gelas penutup, mikroskop stereo, dan mikroskop cahaya.
Metode Percobaan Pengamatan Fisiologi.
2
Tabel 1 Perlakuan ZPT
No Zat Pengatur tumbuh Konsentrasi (ppm)
1. Kontrol -
2. Kinetin 100
3. GA-3 100
4. GA-3 : Kinetin 50 : 50
5. IAA : GA-3 50 : 50
6. IAA : Kinetin 50 : 50
7. IAA 100
Perlakuan diberikan pada saat tanaman berdaun minimal lima helai. Perlakuan diberikan dengan menyemprotkan ZPT di permukaan bawah daun pada pagi hari. Parameter yang diamati sebelum bunga anthesis adalah tinggi tanaman, jumlah bunga, jumlah cabang, dan besar sudut percabangan. Pengamatan dilakukan dalam selang waktu 2 minggu, sejak 6 Februari sampai 29 Mei 2011. Jika telah terlihat kuncup yang mencirikan bunga hermaprodit maka diamati saat munculnya bunga hermaprodit dan jantan serta menghitung jumlahnya per infloresen dan diamati sampai bunga itu mekar.
Pembuatan sediaan mikroskopis
Pembuatan preparat segar. Bunga hermaprodit satu hari sebelum mekar (H-1) dan saat mekar (H0) diambil, masing-masing 2 ulangan. Pengamatan menggunakan mikroskop stereo dengan beberapa perbesaran (1,0 x 2,5; 4,0 x 2,5; dan 5,0 x 2,5). Parameter yang diamati pada bunga H-1 ada tidaknya celah pada kuncup bunga, kondisi stigma yang reseptif dan saat polen anthesis, sedangkan pada bunga H-0 adalah menempelnya polen pada stigma.
Pembuatan preparat permanen.
Metode yang digunakan dalam pembuatan preparat permanen adalah metode parafin (Johansen 1940). Bunga yang mencirikan bunga hermaprodit diambil dari beberapa fase, yaitu kuncup kecil, kuncup menengah, dan satu hari sebelum mekar masing-masing 3 ulangan. Bunga difiksasi dengan larutan FAA (formaldehid : asam asetat glasial : alkohol 70% = 5 : 5 : 90) selama tiga hari. Tahap selanjutnya bunga dicuci menggunakan alkohol 50% sebanyak 3x ulangan. Tahapan dilanjutkan dengan dehidrasi dan penjernihan menggunakan seri larutan Johansen (Lampiran 1). Proses selanjutnya adalah penanaman sampel dalam parafin (embeding). Blok yang berisi sampel, dilunakkan dengan lautan Gifford (Lampiran 2) selama ± 1-3 minggu. Blok parafin yang telah lunak,
dipotong dengan menggunakan mikrotom Yamato RV-240 dengan ketebalan 10 µm. Pita parafin yang dihasilkan, diletakkan pada gelas objek yang telah diolesi dengan albumin-gliserin dan ditetesi air. Selanjutnya gelas objek berisi pita dipanaskan di atas
hotplate selama ± 12 jam agar pita parafin melekat. Pewarnaan menggunakan pewarna ganda safranin 2 % dalam air – fastgreen 0,5 % dalam alkohol 95 %, kemudian ditutup dengan media entellan.
Analisis Data
Hasil yang diperoleh dari pengaruh ZPT terhadap parameter pertumbuhan sebelum bunga mekar, jumlah bunga hermaprodit dan jantan pada tanaman J.curcas dianalisis dengan Analisis sidik ragam (ANOVA) menggunakan program SPSS 16.0. Jika hasil uji sidik ragam signifikan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf 5 %.
HASIL
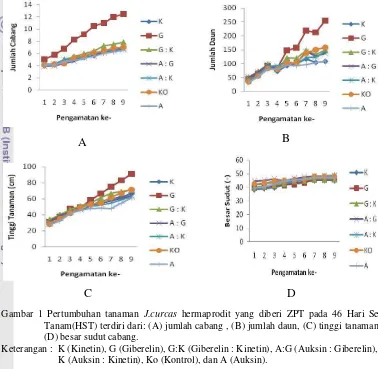
Pertumbuhan vegetatif yang dapat diamati sebelum bunga mekar adalah jumlah daun, tinggi batang, besar sudut cabang, dan jumlah cabang. Hasil pengamatan yang dilakukan dalam selang waktu dua minggu dapat dilihat pada Gambar 1, sedangkan perlakuan pemberian ZPT pada pertumbuhannya dapat dilihat pada Tabel 2. Pada Tabel 2 terlihat bahwa perlakuan Giberelin berbeda nyata dengan perlakuan ZPT yang lainnya pada parameter jumlah cabang, jumlah daun, dan tinggi tanaman, sedangkan pada parameter besar sudut percabangan menunjukkan pengaruh yang tidak berbeda nyata (Lampiran 3).
Tabel 1 Perlakuan ZPT
No Zat Pengatur tumbuh Konsentrasi (ppm)
1. Kontrol -
2. Kinetin 100
3. GA-3 100
4. GA-3 : Kinetin 50 : 50
5. IAA : GA-3 50 : 50
6. IAA : Kinetin 50 : 50
7. IAA 100
Perlakuan diberikan pada saat tanaman berdaun minimal lima helai. Perlakuan diberikan dengan menyemprotkan ZPT di permukaan bawah daun pada pagi hari. Parameter yang diamati sebelum bunga anthesis adalah tinggi tanaman, jumlah bunga, jumlah cabang, dan besar sudut percabangan. Pengamatan dilakukan dalam selang waktu 2 minggu, sejak 6 Februari sampai 29 Mei 2011. Jika telah terlihat kuncup yang mencirikan bunga hermaprodit maka diamati saat munculnya bunga hermaprodit dan jantan serta menghitung jumlahnya per infloresen dan diamati sampai bunga itu mekar.
Pembuatan sediaan mikroskopis
Pembuatan preparat segar. Bunga hermaprodit satu hari sebelum mekar (H-1) dan saat mekar (H0) diambil, masing-masing 2 ulangan. Pengamatan menggunakan mikroskop stereo dengan beberapa perbesaran (1,0 x 2,5; 4,0 x 2,5; dan 5,0 x 2,5). Parameter yang diamati pada bunga H-1 ada tidaknya celah pada kuncup bunga, kondisi stigma yang reseptif dan saat polen anthesis, sedangkan pada bunga H-0 adalah menempelnya polen pada stigma.
Pembuatan preparat permanen.
Metode yang digunakan dalam pembuatan preparat permanen adalah metode parafin (Johansen 1940). Bunga yang mencirikan bunga hermaprodit diambil dari beberapa fase, yaitu kuncup kecil, kuncup menengah, dan satu hari sebelum mekar masing-masing 3 ulangan. Bunga difiksasi dengan larutan FAA (formaldehid : asam asetat glasial : alkohol 70% = 5 : 5 : 90) selama tiga hari. Tahap selanjutnya bunga dicuci menggunakan alkohol 50% sebanyak 3x ulangan. Tahapan dilanjutkan dengan dehidrasi dan penjernihan menggunakan seri larutan Johansen (Lampiran 1). Proses selanjutnya adalah penanaman sampel dalam parafin (embeding). Blok yang berisi sampel, dilunakkan dengan lautan Gifford (Lampiran 2) selama ± 1-3 minggu. Blok parafin yang telah lunak,
dipotong dengan menggunakan mikrotom Yamato RV-240 dengan ketebalan 10 µm. Pita parafin yang dihasilkan, diletakkan pada gelas objek yang telah diolesi dengan albumin-gliserin dan ditetesi air. Selanjutnya gelas objek berisi pita dipanaskan di atas
hotplate selama ± 12 jam agar pita parafin melekat. Pewarnaan menggunakan pewarna ganda safranin 2 % dalam air – fastgreen 0,5 % dalam alkohol 95 %, kemudian ditutup dengan media entellan.
Analisis Data
Hasil yang diperoleh dari pengaruh ZPT terhadap parameter pertumbuhan sebelum bunga mekar, jumlah bunga hermaprodit dan jantan pada tanaman J.curcas dianalisis dengan Analisis sidik ragam (ANOVA) menggunakan program SPSS 16.0. Jika hasil uji sidik ragam signifikan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf 5 %.
HASIL
Pertumbuhan vegetatif yang dapat diamati sebelum bunga mekar adalah jumlah daun, tinggi batang, besar sudut cabang, dan jumlah cabang. Hasil pengamatan yang dilakukan dalam selang waktu dua minggu dapat dilihat pada Gambar 1, sedangkan perlakuan pemberian ZPT pada pertumbuhannya dapat dilihat pada Tabel 2. Pada Tabel 2 terlihat bahwa perlakuan Giberelin berbeda nyata dengan perlakuan ZPT yang lainnya pada parameter jumlah cabang, jumlah daun, dan tinggi tanaman, sedangkan pada parameter besar sudut percabangan menunjukkan pengaruh yang tidak berbeda nyata (Lampiran 3).
3
perlakuan Giberelin : Kinetin menunjukkan pengaruh yang berbeda nyata dari pemberian ZPT lainnya untuk jumlah bunga hermaprodit, sedangkan untuk jumlah bunga jantan tidak menunjukkan pengaruh yang berbeda nyata. Hal ini dapat dilihat dari produksi bunga hermaprodit dengan menghasilkan rata-rata 11 bunga hermaprodit dan 136 bunga jantan.
Bunga hermaprodit pada H-1 menunjukkan bunga hermaprodit dalam keadaan kuncup (Gambar 2 A). Pada bunga H0 menunjukkan keadaan anther sudah merekah, polen sudah anthesis dan menempel pada stigma (Gambar 2 B).
Gambar 1 Pertumbuhan tanaman J.curcas hermaprodit yang diberi ZPT pada 46 Hari Setelah Tanam(HST) terdiri dari: (A) jumlah cabang , (B) jumlah daun, (C) tinggi tanaman, dan (D) besar sudut cabang.
Keterangan : K (Kinetin), G (Giberelin), G:K (Giberelin : Kinetin), A:G (Auksin : Giberelin), A : K (Auksin : Kinetin), Ko (Kontrol), dan A (Auksin).
Tabel 2 Pengaruh ZPT terhadap parameter pertumbuhan sebelum bunga anthesis pada minggu ke- 9
Perlakuan Jumlah cabang Jumlah daun (helai)
Tinggi tanaman (cm)
Besar sudut cabang
(◦)
Kontrol 7 ± 3 a 158 ± 84 a 71,75 ± 8,68 a 47,87 ± 4,01 Kinetin 7 ± 3 a 108 ± 22 a 66,50 ± 6,26 a 45,25 ± 2,76
GA-3 12 ± 5 b 254 ± 20 b 91,12 ± 20,02 b 46,00 ± 4,57 GA-3 : Kinetin 8 ± 1 a 147 ± 38 a 71,25 ± 5,92 a 46,25 ± 3,28 IAA : GA-3 7 ± 1 a 137 ± 67 a 64,37 ± 7,65 a 48,12 ± 3,72 IAA : Kinetin 7 ± 1 a 144 ± 25 a 62,25 ± 5,20 a 48,75 ± 3,53 IAA 6 ± 2 a 109 ± 14 a 60,87 ± 2,95 a 47,25 ± 2,37 Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji
DMRT taraf 5%. Data menunjukkkan nilai rata-rata ± SD.
A
B
Tabel 3 Perbandingan bunga jantan dan bunga hermaprodit dalam satu rangkaian bunga pada 23 hari setelah inisiasi awal
Perlakuan Hermaprodit (H) Jantan (J) Nisbah H : J
Kontrol 10 ± 1 c 100 ± 13c 10 : 100
Kinetin 7 ± 3 c 100 ± 10 c 7 : 100
GA-3 7 ± 2 c 90 ± 10 b 7 : 90
GA-3 : Kinetin 11 ± 2 d 136 ± 34 c 11 : 136
IAA : GA-3 9 ± 1 c 127 ± 4 c 9 : 127
IAA : Kinetin 9 ± 1 c 128 ± 11 c 9 : 128
IAA 4 ± 1 b 59 ± 10 b 4 : 59
Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji DMRT taraf 5%. Data menunjukkkan nilai rata-rata ± SD.
Gambar 2 Bunga Hemaprodit dan Bunga jantan pada H-1 (A) dan Bunga Hermaprodit pada H-0 (B): (h) bunga hermaprodit, (b) bunga jantan , (st) stamen, dan (s) stigma.
Gambar 3 Preparat segar bunga hermaprodit terdiri dari (A) Bunga hermaprodit pada H-1, (B) celah pada kuncup bunga hermaprodit pada H-1, (C) Bunga hermaprodit pada H-1(D) Kondisi stigma yang reseptif pada H-1, dan (E) Penyerbukan pada H0: (c) celah, (s) stigma, dan (p) polen .
Pengamatan celah kuncup bunga (Gambar 3 A dan B) pada preparat segar menunjukkan kondisi kuncup yang masih tertutup. Kondisi stigma yang reseptif ditunjukkan pada gambar 3 C dan D. Stigma yang reseptif terjadi satu hari sebelum bunga mekar dan masa reseptif stigma dapat diamati 2-3 hari. Keadaan ini ditandai dengan adanya kondisi stigma yang mengkilap dan sekresi lendir. Sedangkan polen anthesis terjadi pada saat bunga mekar.
Preparat segar diamati untuk melihat penyerbukan (Gambar 3 E). Penyerbukan terjadi pada H0. Pada penyerbukan ini
ditunjukkan keadaan polen merekah dan menempel di stigma.
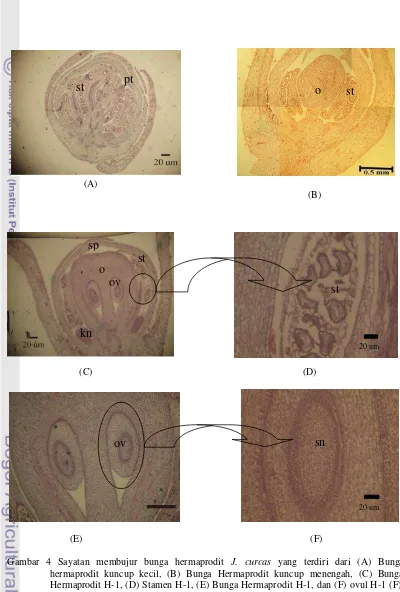
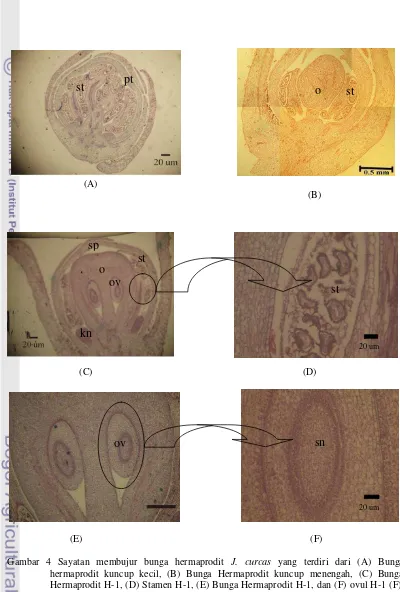
Pengamatan sayatan membujur bunga hermaprodit, pada stadia bunga kuncup kecil (Gambar 4 A) menunjukkan keadaan anther yang belum merekah dengan polen yang sudah matang. Pada stadia kuncup bunga yang sama juga belum terbentuk ovari. Pada stadia bunga kuncup menengah (Gambar 4 B) menunjukkan belum terlihat perkembangan ovul di dalam ovari.
Pada bunga H-1 (Gambar 4 C) ovul sudah dijumpai di dalam ovari. Pada bunga ini juga menunjukkan telah terbentuknya kelenjar nektar di samping ovari. Di samping itu, pada
A B
h
b
st
s
s
5
stadia bunga yang sama juga telah menunjukkan keadaan polen yang sudah dewasa dan anther belum anthesis (Gambar 4 D). Pada Gambar 4E ovul yang terlihat ada dua buah. Pada bunga H-1, pada ovul tidak
terlihat integumen, nuselus dan mikrofil. Di dalam ovul terlihat sel-sel subdermal nuselar, namun gametofit betina tidak terlihat (Gambar 4 F).
(A) (B)
(C) (D)
(E) (F)
Gambar 4 Sayatan membujur bunga hermaprodit J. curcas yang terdiri dari (A) Bunga hermaprodit kuncup kecil, (B) Bunga Hermaprodit kuncup menengah, (C) Bunga Hermaprodit H-1, (D) Stamen H-1, (E) Bunga Hermaprodit H-1, dan (F) ovul H-1 (F):
sn
ov
20 um
st
sp
st
pt
o
ov
st
20 um
kn
st
(st) stamen, (sp) sepal, (pt) petal, (o) ovari, (ov) ovul, (sn) subdermal nuselar dan (kn) kelenjer nektar.
PEMBAHASAN
Jumlah cabang, jumlah daun, dan tinggi tanaman (Gambar 1) menunjukkan bahwa pemberian giberellin berbeda dengan ZPT lainnya. Dapat dikatakan bahwa giberellin memberi pengaruh yang signifikan terhadap pertumbuhan vegetatif tanaman J. curcas
hermaprodit, kecuali pada besar sudut percabangan (Gambar 1 D). Giberellin berperan dalam pemacuan elongasi (pertambahan panjang) sel (Ghosh et al, 2010), sehingga sel-sel batang lebih memanjang pada tanaman yang diberi giberellin dan memberikan pengaruh pada pertambahan tinggi tanaman J. curcas.
Kombinasi perlakuan Giberellin dengan Kinetin dapat menghasilkan bunga hermaprodit yang lebih banyak pada 23 hari setelah inisiasi, tetapi hal ini belum dapat mencerminkan produksi bunga hermaprodit. ZPT adalah senyawa-senyawa organik tanaman yang dalam konsentrasi rendah mempengaruhi proses-proses fisiologis (Sumiati 2009). Selain itu kombinasi ZPT juga menghasilkan jumlah bunga yang lebih banyak dibandingkan menggunakan satu macam ZPT seperti yang terlihat pada hasil di Tabel 3. Bunga hermaprodit yang dihasilkan oleh tanaman ini stabil dari satu generasi ke generasi berikutnya. Pada perlakuan kombinasi Giberellin dan Kinetin dapat menghasilkan satu rangkaian bunga rata-rata 11 bunga hermaprodit dan 136 bunga jantan hingga 23 hari pengamatan sejak inisiasi bunga. ZPT yang diberikan sangat mempengaruhi munculnya bunga hermaprodit. Tanaman yang diberi ZPT mempunyai waktu berbunga lebih lama dibanding kontrol, kecuali perlakuan kinetin.
Pada penelitian ini menunjukkan bahwa ZPT yang berpengaruh pada pertumbuhan vegetatif adalah Giberellin, sedangkan untuk pertumbuhan generatif adalah Giberellin : Kinetin. Perlakuan ZPT pada masing-masing tanaman memiliki respon yang berbeda. Menurut Rosliani (2004) bahwa perlakuan ZPT tidak berpengaruh nyata terhadap pembungaan tanaman bawang merah. Pemberian ZPT mepiquat klorida (ZPT yang
menghambat biosintesis Giberellin) tidak mampu menstimulasi induksi pembungaan pada tanaman bawang merah, tetapi waktu tanam berpengaruh nyata terhadap pertumbuhan, pembungaan, dan pembijian bawang merah. Kushartoyo (1980) menyatakan bahwa Ethephon cepat memberikan respon dalam merangsang pembungaan pada tanaman nenas. Keberhasilan dari penggunaan Ethephon (1000 ppm) pada pembungaan dipengaruhi oleh konsentrasi, cara penggunaan, varietas dan macam bibit yang ditanam.
Perkembangan bunga hermaprodit
J.curcas dari inisiasi awal memerlukan waktu ± 2123 hari dan akan mekar pada umur 20 -23 hari. Bunga yang dihasilkan pada masing-masing perlakuan berbeda, pada perlakuan kombinasi Giberellin dan Kinetin menunjukkan hasil yang lebih baik, yaitu dalam 1 rangkaian bunga dalam waktu 23 hari dapat menghasilkan ± 11 bunga hermaprodit dan 136 bunga jantan. Utomo (2008) melaporkan bahwa perkembangan kuncup bunga betina J. curcas memerlukan waktu 16-21 hari, diikuti dengan periode bunga mekar sekitar 14-21 hari. Dalam satu malai periode bunga jantan mekar mencapai 21 hari, sedangkan bunga betina dan hermaprodit hanya 7 hari. Dalam satu hari bunga jantan mekar lebih awal sekitar pukul 07.00-08.00, sedangkan bunga betina sekitar pukul 08.00- 09.00. Rasio jumlah bunga betina/ hermaprodit dengan bunga jantan sebesar 1:12 dan berkorelasi dengan jumlah buah yang dihasilkan tiap malai.
7
bunga hermaprodit dibandingkan dengan bunga betina.
Keadaan bunga yang reseptif menunjukkan bahwa stigma siap untuk diserbuki. Stigma dikatakan reseptif dengan ciri mengkilap dan sekresi cairan di stigma (Raju &Ezradanam 2002). Bunga reseptif akan mengeluarkan cairan yang mengandung karbohidrat, protein, lemak, enzim, dan asam amino (Sedgley & Griffin 1989) dan akan menarik datangnya serangga untuk membantu penyerbukan. Pada bunga hermaprodit cairan tersebut diperlukan untuk perkecambahan polen. Informasi mengenai periode reseptif stigma sangat penting, karena pada periode tersebut merupakan waktu yang tepat untuk melakukan penyerbukan. Hal itu terkait dengan perbaikan mutu tanaman maupun produksi benih.
Sayatan membujur bunga hermaprodit J. curcas menunjukkan perkembangan bunga pada beberapa tingkatan (Gambar 4). Pada sayatan bunga H-1 terlihat adanya sepasang ovul. Ovul merupakan perkembangan dari plasenta di dalam ovari, tempat pembentukan megaspora dan tempat berkembangnya kantung embrio. Ovul terdiri dari nuselus, satu atau dua integumen, dan funikulus (Esau 1965). Nuselus akan berkembang menjadi sel-sel subdermal nusel-selar. Salah satu sel-sel pada subdermal nuselar, akan berkembang menjadi megasporofit (Reiser & Fischer 1993 ), tetapi pada sayatan ini megasporofit belum terlihat. Tiga zona primordium (dermal 1, 2, dan 3) pada ovul diinisiasi oleh pembelahan antiklinal dan periklinal. Zona ke-tiga pembelahan berasal dari meristem plasenta dengan pembelahan secara periklinal, sedangkan dua lapis terluar tergolong pada pembelahan antiklinal. Ketiga zona ini ditemukan pada banyak famili, diantaranya Euphorbiacea, Berberidaceae, Betulaceaea, dan Cistaceae (Johri 1984).
Ovul bunga hermaprodit pada hasil pengamatan sayatan membujur terlihat dua buah, sedangkan ovul yang terdapat pada tanaman J. curcas 2 sampai 3 buah. Buah
J.curcas terdiri dari 3 ruang yang masing-masing ruang berisi 1 biji (Hambali et al.
2005).
SIMPULAN
Bunga hermaprodit yang dihasilkan oleh tanaman J.curcas stabil dari satu generasi ke generasi berikutnya. Hal ini dapat dibuktikan oleh produksi bunga pada masing-masing rangkaian bunga menghasilkan rata-rata 11 bunga hermaprodit dan 136 bunga jantan
hingga 23 hari sejak inisiasi awal perlakuan kombinasi Giberellin dan Kinetin (50 : 50 ppm). Perlakuan Giberellin pada konsentrasi 100 ppm dapat memberi pengaruh yang signifikan terhadap pertumbuhan vegetatif tanaman J.curcas. Bunga reseptif terjadi satu hari sebelum bunga mekar, sedangkan polen anthesis terjadi saat bunga mekar. Sayatan membujur pada bunga hermaprodit H-1, menunjukkan bunga sudah memiliki ovul yang terdapat dalam ovari. Di dalam ovul dapat terlihat sel-sel yang merupakan perkembangan dari nuselus berupa subdermal nuselar.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui produksi bunga hermparodit pada J.curcas. Di samping itu, juga diharapkan untuk dilakukan pengamatan setelah bunga mekar, untuk mengetahui pembentukan dan perkembangan embrio pada tanaman J.curcas.
DAFTAR PUSTAKA
Abdelgadir HA, Jager AK, Johnson SD, Staden VJ. 2009. Influence of plant growth regulators on flowering, fruiting, seed oil content and oil quality of Jatropha curcas. South African 516: 1-2.
Esau K. 1965. Anatomy of Seed Plants 2nd Edition. California: University of California Santa Barbara.
Ghosh A, Chikara J, Chaudhary DR. 2010. Diminution of economic yield efeected by prunning and chemical manipulation of Jatropha curcas .
Biomass and Bioenergy 5: 1021 – 1029.
Hambali E, Dadang, Prawitasari T, Suryani A, Haryadi. 2005. Development of
Jatropha curcas Linn for Biodiesel. Bahan presentasi Pengembangan Jarak Pagar untuk Biodiesel (English version). SBRC, LPPM-IPB.
Hartati S. 2009. Jarak Pagar Hermaprodit, Informasi Genetik dan Lingkungan. Bogor : Pusat Penelitian dan Pengembangan Perkebunan, Badan Penelitian dan Pengembangan Pertanian 1: 4.
Johansen DA. 1940. Plant Microtechnique. New York: McGraw-Hill.
bunga hermaprodit dibandingkan dengan bunga betina.
Keadaan bunga yang reseptif menunjukkan bahwa stigma siap untuk diserbuki. Stigma dikatakan reseptif dengan ciri mengkilap dan sekresi cairan di stigma (Raju &Ezradanam 2002). Bunga reseptif akan mengeluarkan cairan yang mengandung karbohidrat, protein, lemak, enzim, dan asam amino (Sedgley & Griffin 1989) dan akan menarik datangnya serangga untuk membantu penyerbukan. Pada bunga hermaprodit cairan tersebut diperlukan untuk perkecambahan polen. Informasi mengenai periode reseptif stigma sangat penting, karena pada periode tersebut merupakan waktu yang tepat untuk melakukan penyerbukan. Hal itu terkait dengan perbaikan mutu tanaman maupun produksi benih.
Sayatan membujur bunga hermaprodit J. curcas menunjukkan perkembangan bunga pada beberapa tingkatan (Gambar 4). Pada sayatan bunga H-1 terlihat adanya sepasang ovul. Ovul merupakan perkembangan dari plasenta di dalam ovari, tempat pembentukan megaspora dan tempat berkembangnya kantung embrio. Ovul terdiri dari nuselus, satu atau dua integumen, dan funikulus (Esau 1965). Nuselus akan berkembang menjadi sel-sel subdermal nusel-selar. Salah satu sel-sel pada subdermal nuselar, akan berkembang menjadi megasporofit (Reiser & Fischer 1993 ), tetapi pada sayatan ini megasporofit belum terlihat. Tiga zona primordium (dermal 1, 2, dan 3) pada ovul diinisiasi oleh pembelahan antiklinal dan periklinal. Zona ke-tiga pembelahan berasal dari meristem plasenta dengan pembelahan secara periklinal, sedangkan dua lapis terluar tergolong pada pembelahan antiklinal. Ketiga zona ini ditemukan pada banyak famili, diantaranya Euphorbiacea, Berberidaceae, Betulaceaea, dan Cistaceae (Johri 1984).
Ovul bunga hermaprodit pada hasil pengamatan sayatan membujur terlihat dua buah, sedangkan ovul yang terdapat pada tanaman J. curcas 2 sampai 3 buah. Buah
J.curcas terdiri dari 3 ruang yang masing-masing ruang berisi 1 biji (Hambali et al.
2005).
SIMPULAN
Bunga hermaprodit yang dihasilkan oleh tanaman J.curcas stabil dari satu generasi ke generasi berikutnya. Hal ini dapat dibuktikan oleh produksi bunga pada masing-masing rangkaian bunga menghasilkan rata-rata 11 bunga hermaprodit dan 136 bunga jantan
hingga 23 hari sejak inisiasi awal perlakuan kombinasi Giberellin dan Kinetin (50 : 50 ppm). Perlakuan Giberellin pada konsentrasi 100 ppm dapat memberi pengaruh yang signifikan terhadap pertumbuhan vegetatif tanaman J.curcas. Bunga reseptif terjadi satu hari sebelum bunga mekar, sedangkan polen anthesis terjadi saat bunga mekar. Sayatan membujur pada bunga hermaprodit H-1, menunjukkan bunga sudah memiliki ovul yang terdapat dalam ovari. Di dalam ovul dapat terlihat sel-sel yang merupakan perkembangan dari nuselus berupa subdermal nuselar.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui produksi bunga hermparodit pada J.curcas. Di samping itu, juga diharapkan untuk dilakukan pengamatan setelah bunga mekar, untuk mengetahui pembentukan dan perkembangan embrio pada tanaman J.curcas.
DAFTAR PUSTAKA
Abdelgadir HA, Jager AK, Johnson SD, Staden VJ. 2009. Influence of plant growth regulators on flowering, fruiting, seed oil content and oil quality of Jatropha curcas. South African 516: 1-2.
Esau K. 1965. Anatomy of Seed Plants 2nd Edition. California: University of California Santa Barbara.
Ghosh A, Chikara J, Chaudhary DR. 2010. Diminution of economic yield efeected by prunning and chemical manipulation of Jatropha curcas .
Biomass and Bioenergy 5: 1021 – 1029.
Hambali E, Dadang, Prawitasari T, Suryani A, Haryadi. 2005. Development of
Jatropha curcas Linn for Biodiesel. Bahan presentasi Pengembangan Jarak Pagar untuk Biodiesel (English version). SBRC, LPPM-IPB.
Hartati S. 2009. Jarak Pagar Hermaprodit, Informasi Genetik dan Lingkungan. Bogor : Pusat Penelitian dan Pengembangan Perkebunan, Badan Penelitian dan Pengembangan Pertanian 1: 4.
Johansen DA. 1940. Plant Microtechnique. New York: McGraw-Hill.
STABILITAS SIFAT DAN PERKEMBANGAN BUNGA
HERMAPRODIT PADA Jarak Pagar (
Jatropha curcas
L.)
CERY CHINTIA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Kushartoyo D. 1980. Penggunaan Ethephon Secara Praktis Pada Beberapa Tanaman Pertanian. Yogyakarta: Departemen Agronomi Fakultas Pertanian UGM. Makwana V, Shukla P, Robin S. 2010. GA
Aplication induces alteration in sex ratio and cell death in Jatropha curcas.
Springer DOI 10.1007/s10725-010-9457-x.
Paris RP, King RW . 1985. Gibberellins and reproductive development in seed plants. Ann Rev Plant Physiol 36: 517– 568.
Raju S, Ezradanam V. 2002. Pollination ecology and fruiting behaviour in a monoecious spesies, Jatropha curcas L. (Euphorbiaceae). Curr Sci 83: 1395-1398.
Reale L, Korwar GR, Shanker AK, Ramakrishna Y. 2008. Morphological and cytological development and starch accumulation in hermaphrodite and staminate flowers of olive. Journal of Arid Environments 73: 877–884. Reiser L, Fischer R L. 1993. The Ovul and the
Embryo Sac. The Plant Cell 5 : 1291- 1301.
Rosliani R, Suwandi, dan Sumarni N. 2005. Pengaruh Waktu Tanam dan Zat Pengatur Tumbuh Mepiquat Klorida terhadap Pembungaan dan Pembijian Bawang Merah. J Hort 15:192-198. Sedgley M, Griffin 1989. Sexual Reproduction
of Tree Crops. Australia: Departement of Plant Physiology.
Sumiati, E. 2009. Pengaruh zat pengatur tumbuh terhadap hasil curd broccoli
(Brassica oleraceae) kultivar Green Comet. Bul Penel Hort 18: 4-5. Triadiati, Hamim, Pranowo D, Dasumiati.
2010. Pemacuan Pembentukan Bunga Hermaprodit (300 %) Menggunakan Zat Pengatur Tumbuh Pada Tanaman Jarak Pagar (Jatropha curcas) dan Seleksinya Terhadap Kekeringan (curah hujan ±10 mm/bl) dengan Produktivitas 8 ton /ha. Laporan Penelitian. Bogor: Institut Pertanian Bogor Bekerjasama dengan Sekretariat Badan Penelitian dan Pengembangan Pertanian.
STABILITAS SIFAT DAN PERKEMBANGAN BUNGA
HERMAPRODIT PADA Jarak Pagar (
Jatropha curcas
L.)
CERY CHINTIA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
CERY CHINTIA. Stabilitas Sifat dan Perkembangan Bunga Hermaprodit pada Jarak Pagar (Jatropha curcas L.). Dibimbing oleh TRIADIATI dan DORLY.
Tanaman jarak pagar (Jatropha curcas L.) memiliki bunga hermaprodit yaitu satu bunga memiliki stamen dan stigma, tetapi jarang ditemukan. Sifat hermaprodit pada J.curcas kurang stabil. Untuk itu perlu dilakukan penelitian pemacuan stabilitas pembungaan hermaprodit dari biji yang dihasilkan dari bunga hermaprodit serta mengamati perkembangan bunga hermaprodit. Pemacuan pembungaan hermaprodit dilakukan dengan zat pengatur tumbuh. Parameter yang diamati adalah jumlah daun, jumlah cabang, tinggi tanaman, besar sudut percabangan, yang diamati tiap dua minggu. Pengamatan anatomi bunga hermaprodit dilakukan terhadap sediaan mikroskopis sayatan membujur. Hasil penelitian menunjukkan bahwa bunga hermaprodit pada
J.curcas stabil ke generasi berikutnya dengan produksi bunga rata-rata 11 bunga hermaprodit dan 136 bunga jantan pada perlakuan kombinasi Giberellin dan Kinetin (50 : 50 ppm) pada 23 hari pengamatan pembungaan tiap rangkaian. Giberellin konsentrasi 100 ppm berpengaruh signifikan terhadap pertumbuhan vegetatif tanaman J.curcas. Stigma reseptif pada J.curcas terjadi satu hari sebelum bunga mekar, sedangkan polen menempel pada stigma terjadi pada saat bunga mekar. Sayatan membujur pada ovul bunga hermaprodit satu hari sebelum bunga mekar, dijumpai sel-sel subdermal nuselar.
Kata kunci: Jatropha curcas, zat pengatur tumbuh, bunga hermaprodit.
ABSTRACT
CERY CHINTIA. Stability of hermaphrodite Flower and its development in Jatropha curcas L. Under supervised by of TRIADIATI and DORLY.
Jatropha curcas L. has hermaphrodite flowers which is stamen and pistil in the same flower, but very rarely found. It was assumed that hermaphrodite flowers unstable in the next generation. The aims of this study were to evaluate the stability of hermaphrodite flower in the next generation from the hermaphrodite seedling and to observe the development of hermaphrodite flower. To obtain the stability of hermaphrodite flower was used by plant growth regulator. The parameters observed in the study were leaf number, branch number, plant height, angle of branch every two weeks. Anatomical observation of flower hermaphrodite was done on microscopical slide of longitudinal section.The results showed that the hermaphrodite flowers of J.curcas was stable in the next generation. Application of Giberellin and Kinetin (50 : 50 ppm) has the heighest number of hermaphrodite flower, that is 136 male flowers and 11 hermphrodite flowers until 23 days after flower initiation. Giberellin 100 ppm has significantly effect on vegetative growth of J.curcas. A receptive stigma was occurred one day before the flowers anthesis, while the pollen attached on the stigma occured after the flowers anthesis. Longitudinal section of ovule of hermaphrodite flowers one day before anthesis, was found subdermal cell of nucellar.
STABILITAS SIFAT DAN PERKEMBANGAN BUNGA
HERMAPRODIT PADA Jarak Pagar (
Jatropha curcas
L.)
CERY CHINTIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Stabilitas Sifat dan Perkembangan Bunga Hermaprodit pada
Jarak Pagar (Jatropha curcas L.)
Nama
: Cery Chintia
NIM
: G34070004
Menyetujui:
Pembimbing I,
Pembimbing II,
(Dr. Triadiati, M.Si)
(Dr.Ir. Dorly, M.Si)
NIP. 196002241986032001 NIP. 196404161991032002
Mengetahui:
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
(Dr. Ir. Ence Darmo Jaya Supena, M.Si)
NIP. 196410021989031002
PRAKATA
Puji syukur kepada ALLAH SWT atas rahmat dan kasih sayang-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan pada bulan Desember 2010 sampai Agustus 2011 dengan judul Stabilitas Sifat dan Perkembangan BungaHermaprodit Pada Jarak Pagar ( Jatropha curcas L.).
Penulis mengucapkan terima kasih kepada Ibu Dr. Triadiati, M.Si dan Ibu Dr. Ir. Dorly, M.Si atas bimbingan, masukan, dan arahan yang diberikan sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Terima kasih juga disampaikan kepada Ibu Dra. Taruni Sri Prawasti M.Si selaku penguji atas masukan dan arahan yang diberikan kepada penulis. Terima kasih kepada Ibu, Abah, dan adik yang telah memberikan dorongan secara moral, material, dan spiritual kepada penulis dalam melaksanakan penelitian ini. Terima kasih juga penulis ucapkan kepada seluruh staf Laboratorium Mikroteknik, Kebun Percobaan Cikabayan, Laboratorium Terpadu dan rekan-rekan yang melaksanakan penelitian di Laboratorium Mikroteknik dan Kebun Percobaan Cikabayan atas dukungan yang diberikan. Selain itu, terima kasih kepada DIKTI yang telah memberikan beasiswa sejak tahun 2007 sampai tahun 2011 sehingga penulis dapat menyelesaikan pendidikan di IPB. Terima kasih pula penulis ucapkan kepada semua pihak yang telah membantu dalam pengumpulan data karya ilmiah ini serta seluruh rekan Biologi angkatan 44 atas kebersamaan dan dukungan yang diberikan kepada penulis.
Penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi yang memerlukannya dan berharap masukan dari berbagai pihak.
Bogor, 4 Agustus 2011
RIWAYAT HIDUP
Penulis dilahirkan di Andaleh pada tanggal 28 Maret 1989 dari ayahanda Ardinal dan ibunda Nofrida Yenti. Penulis merupakan anak pertama dari dua bersaudara. Tahun 1995 penulis lulus dari TK Pertiwi Andalas, tahun 2001 penulis lulus dari SD Negeri 47 Andalas Bawah, tahun 2004 penulis lulus dari SMP Negeri 1 Sei. Kamuyang, tahun 2007 penulis lulus dari SMA Negeri 1 Lareh Sago Halaban. Pada tahun yang sama, penulis diterima sebagai mahasiswi program studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Pada tahun 2007-2008 penulis terdaftar sebagai penerima beasiswa Peningkatan Prestasi Akademik (PPA) dan tahun 2008 – 2011 penulis terdaftar sebagai penerima beasiswa Bantuan Beasiswa Mahasiswa (BBM) dari DIKTI.
Selama mengikuti perkuliahan, penulis aktif dalam beberapa organisasi kemahasiswaan dan berbagai kepanitian yang diselenggarakan di IPB. Penulis pernah menjadi staf divisi Biosains Himabio IPB tahun 2008-2009, bendahara pada kepanitiaan Revolusi Sains 1 dan Workshop Karya Ilmiah Populer, Lomba Cepat Tepat Biologi (LCTB), bendahara Departemen Keuangan Dewan Keluarga Masjid (LDK) Al-Hurriyah, bendahara Seminar Nasional Al-qur’an dan Sains (SNQS), sekretaris Paket Qiyamu Ramadhan (PQR), sekeretaris Serambih Ruhiyah Mahasiswa FMIPA (SERUM-G), mewakili Serum-G dalam Musyawarah Kerja Wilayah III Jaringan Rohis MIPA Nasional, staf divisi Penanggung Jawab Keluarga (PJK) dalam kepanitiaan Masa Perkenalan Kampus Mahasiswa Baru (MPKBM) tahun 2008 yang diselenggarakan oleh BEM TPB, serta beberapa kepanitiaan lainnya. Penulis juga aktif sebagai asisten praktikum Biologi Dasar pada tahun ajaran 2009/2010 dan 2010/2011, Fisologi Tumbuhan tahun ajaran 2010/2011, Pertumbuhan dan Perkembangan Tumbuhan tahun ajaran 2011/2012, dan Anatomi Tumbuhan tahun ajaran 2011/2012.
Pada tahun 2009, penulis melaksanakan studi lapang di Wana Wisata Cangkuang, Sukabumi
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ...1
Latar Belakang ...1
Tujuan ...1
Waktu dan Tempat ...1
BAHAN DAN METODE ...1
Bahan dan Alat ...1
Metode Percobaan ...1
Pengamatan Fisiologi ...1
Pembuatan sediaan mikroskopis ...2
HASIL ...2
PEMBAHASAN ...6
SIMPULAN ...7
SARAN ...7
DAFTAR PUSTAKA ...7
LAMPIRAN ...9
DAFTAR TABEL
Halaman
1 Perlakuan ZPT... 2 2 Pengaruh ZPT terhadap perameter sebelum bunga anthesis pada minggu
ke-9... 3 3 Perbandingan bunga jantan dan bunga hermaprodhit dalam satu rangkaian bunga 23 hari
setelah inisiasi awal... 3
DAFTAR GAMBAR
Halaman
1 Pertumbuhan tanaman J.curcas hermaprodit yang diberi ZPT, dapat diamati dalam (A) jumlah cabang, (B) jumlah daun, (C) tinggi tanaman, dan (D) besar sudut cabang ...
4
2 Bunga hermaprodit dan jantan H-1 (A) dan Bunga Hermparodit H0 (B)...
4
3 Preparat segar bunga hermaprodit terdiri dari (A) Celah pada kuncup bunga hermaprodit H-1, (B) kondisi stigma yang reseptif H-1, dan (C) penyerbukan pada H-0...
4
4 Sayatan membujur bunga hermaprodit J.curcas yang terdiri dari (A) Bunga hermaprodit kuncup kecil, (B) bunga hermaprodit kuncup menengah, (C) bunga hermaprodit H-1, (D) stamen H-1, (E) bunga hermaprodit H-1, dan (F) Ovul H-1...
5
DAFTAR LAMPIRAN
Halaman
1 Komposisi larutan dehidran dan clearing seri Johansen... 10 2 Komposisi larutan Gifford... 10 3 Analisis sidik ragam (ANOVA) pengaruh ZPT terhadap parameter
pertumbuhan... 11 4 Analisis sidik ragam (ANOVA) perbandingan jumlah bunga jantan dan bunga
PENDAHULUAN
Latar Belakang
Tanaman jarak pagar (Jatropha curcas
L.) dikenal sebagai tanaman yang memiliki bunga uniseksual (monocieous) yaitu bunga jantan atau bunga betina terdapat pada satu rangkaian yang sama. Kondisi bunga yang uniseksual memberi peluang pada tanaman untuk melakukan penyerbukan silang (cross pollinated). J. curcas ada yang berbunga hermaprodit, tetapi sangat jarang ditemukan.
Bunga hermaprodit memiliki 2 organ kelamin yaitu stamen dan stigma dalam satu bunga. Pada J. curcas yang berbunga hermaprodit juga ditemukan juga ditemukan bunga jantan pada satu rangkaian yang sama. Dari segi pemuliaan tanaman, tanaman hermaprodit memberikan keuntungan, karena dapat menghasilkan keturunan yang seragam, karena berpeluang terjadinya penyerbukan sendiri (Reale 2008). Pembentukan bunga hermaprodit pada J.curcas diduga merupakan interaksi faktor genetik dengan lingkungan (Hartati 2009).
Produksi bunga dipengaruhi oleh Zat Pengatur Tumbuh (ZPT) baik endogen maupun eksogen. Pemacuan dengan ZPT diharapkan dapat meningkatkan dan menstabilkan sifat bunga hermaprodit. Peranan ZPT berupa Giberellin dapat meningkatkan produksi bunga jantan pada
J.curcas (Makwana & Shukla 2010). Benziladenin, Asam Triiodobenzoat, Dikegulat juga dapat mengendalikan dan mengatur tingkat pembungaan pada tanaman
J. curcas (Abdelgadir 2009). Beberapa jenis ZPT yang sering digunakan untuk pemacuan pembungaan diantaranya auksin (IAA), giberellin (GA-3), dan sitokinin (kinetin). Fungsi auksin diantaranya adalah untuk memacu pengembangan sel, pertumbuhan akar, dan pembentukan kalus. Giberelin berfungsi merangsang tanaman menghasilkan bunga sebelum waktunya, mendorong tanaman kerdil menjadi tanaman raksasa dan meningkatkan tinggi tanaman menjadi 3 sampai 5 kali dari yang normal. Kinetin berfungsi mendukung terjadinya dormansi dan menghambat absisi (Pharis & King 1985).
J. curcas berbunga hermaprodit berpotensi dikembangkan menjadi sumber bibit karena peluang pembentukan buahnya lebih tinggi dari pada J. curcas berbunga uniseksual (Triadiati et al. 2010).
Permasalahan dalam budidaya J. curcas
diantaranya belum tersedia benih J. curcas yang berbunga hermaprodit. Sifat hermaprodit
belum diketahui diwariskan pada generasi berikutnya, diduga munculnya bunga hermaprodit karena interaksi faktor genetik dengan lingkungannya. Waktu pembuahan pada bunga hermaprodit belum diketahui terjadi sebelum atau sesudah bunga mekar.
Tujuan
Tujuan penelitian ini adalah (1) mengamati stabilitas pembungaan hermaprodit dari biji yang dihasilkan dari bunga hermaprodit, (2) mengamati waktu penyerbukan, dan (3) perkembangan bunga hermaprodit sebelum mekar.
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Desember 2010 sampai Agustus 2011 di Kebun Percobaan Cikabayan, Laboratorium Mikroteknik dan Laboratorium Terpadu, Departemen, Biologi Institut Pertanian Bogor.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan untuk penelitian ini adalah biji J. curcas dari tanaman induk berbunga hermaprodit aksesi Dompu. Tanaman induk J. curcas hermaprodit sebelumnya ditanam di Cikampek. Bahan lain yang digunakan adalah polibag, tanah, ZPT yang terdiri dari sitokinin (kinetin), giberellin (GA-3), dan auksin (IAA). Bahan yang digunakan pada pengamatan anatomi adalah alkohol, FAA (Formaldehyde Acetic-acid Alcohol), seri larutan johansen, parafin , xilol , akuades, safranin, fast green, dan entellan.
Alat yang digunakan untuk pengamatan fisiologi adalah penggaris, busur derajat, kamera digital, sedangkan pengamatan anatomi alat yang digunakan adalah tabung film, pinset, gelas piala, gelas ukur, kaca preparat, gelas penutup, mikroskop stereo, dan mikroskop cahaya.
Metode Percobaan Pengamatan Fisiologi.
Tabel 1 Perlakuan ZPT
No Zat Pengatur tumbuh Konsentrasi (ppm)
1. Kontrol -
2. Kinetin 100
3. GA-3 100
4. GA-3 : Kinetin 50 : 50
5. IAA : GA-3 50 : 50
6. IAA : Kinetin 50 : 50
7. IAA 100
Perlakuan diberikan pada saat tanaman berdaun minimal lima helai. Perlakuan diberikan dengan menyemprotkan ZPT di permukaan bawah daun pada pagi hari. Parameter yang diamati sebelum bunga anthesis adalah tinggi tanaman, jumlah bunga, jumlah cabang, dan besar sudut percabangan. Pengamatan dilakukan dalam selang waktu 2 minggu, sejak 6 Februari sampai 29 Mei 2011. Jika telah terlihat kuncup yang mencirikan bunga hermaprodit maka diamati saat munculnya bunga hermaprodit dan jantan serta menghitung jumlahnya per infloresen dan diamati sampai bunga itu mekar.
Pembuatan sediaan mikroskopis
Pembuatan preparat segar. Bunga hermaprodit satu hari sebelum mekar (H-1) dan saat mekar (H0) diambil, masing-masing 2 ulangan. Pengamatan menggunakan mikroskop stereo dengan beberapa perbesaran (1,0 x 2,5; 4,0 x 2,5; dan 5,0 x 2,5). Parameter yang diamati pada bunga H-1 ada tidaknya celah pada kuncup bunga, kondisi stigma yang reseptif dan saat polen anthesis, sedangkan pada bunga H-0 adalah menempelnya polen pada stigma.
Pembuatan preparat permanen.
Metode yang digunakan dalam pembuatan preparat permanen adalah metode parafin (Johansen 1940). Bunga yang mencirikan bunga hermaprodit diambil dari beberapa fase, yaitu kuncup kecil, kuncup menengah, dan satu hari sebelum mekar masing-masing 3 ulangan. Bunga difiksasi dengan larutan FAA (formaldehid : asam asetat glasial : alkohol 70% = 5 : 5 : 90) selama tiga hari. Tahap selanjutnya bunga dicuci menggunakan alkohol 50% sebanyak 3x ulangan. Tahapan dilanjutkan dengan dehidrasi dan penjernihan menggunakan seri larutan Johansen (Lampiran 1). Proses selanjutnya adalah penanaman sampel dalam parafin (embeding). Blok yang berisi sampel, dilunakkan dengan lautan Gifford (Lampiran 2) selama ± 1-3 minggu. Blok parafin yang telah lunak,
dipotong dengan menggunakan mikrotom Yamato RV-240 dengan ketebalan 10 µm. Pita parafin yang dihasilkan, diletakkan pada gelas objek yang telah diolesi dengan albumin-gliserin dan ditetesi air. Selanjutnya gelas objek berisi pita dipanaskan di atas
hotplate selama ± 12 jam agar pita parafin melekat. Pewarnaan menggunakan pewarna ganda safranin 2 % dalam air – fastgreen 0,5 % dalam alkohol 95 %, kemudian ditutup dengan media entellan.
Analisis Data
Hasil yang diperoleh dari pengaruh ZPT terhadap parameter pertumbuhan sebelum bunga mekar, jumlah bunga hermaprodit dan jantan pada tanaman J.curcas dianalisis dengan Analisis sidik ragam (ANOVA) menggunakan program SPSS 16.0. Jika hasil uji sidik ragam signifikan dilanjutkan dengan uji Duncan Multiple Range Test (DMRT) pada taraf 5 %.
HASIL
Pertumbuhan vegetatif yang dapat diamati sebelum bunga mekar adalah jumlah daun, tinggi batang, besar sudut cabang, dan jumlah cabang. Hasil pengamatan yang dilakukan dalam selang waktu dua minggu dapat dilihat pada Gambar 1, sedangkan perlakuan pemberian ZPT pada pertumbuhannya dapat dilihat pada Tabel 2. Pada Tabel 2 terlihat bahwa perlakuan Giberelin berbeda nyata dengan perlakuan ZPT yang lainnya pada parameter jumlah cabang, jumlah daun, dan tinggi tanaman, sedangkan pada parameter besar sudut percabangan menunjukkan pengaruh yang tidak berbeda nyata (Lampiran 3).
3
perlakuan Giberelin : Kinetin menunjukkan pengaruh yang berbeda nyata dari pemberian ZPT lainnya untuk jumlah bunga hermaprodit, sedangkan untuk jumlah bunga jantan tidak menunjukkan pengaruh yang berbeda nyata. Hal ini dapat dilihat dari produksi bunga hermaprodit dengan menghasilkan rata-rata 11 bunga hermaprodit dan 136 bunga jantan.
Bunga hermaprodit pada H-1 menunjukkan bunga hermaprodit dalam keadaan kuncup (Gambar 2 A). Pada bunga H0 menunjukkan keadaan anther sudah merekah, polen sudah anthesis dan menempel pada stigma (Gambar 2 B).
Gambar 1 Pertumbuhan tanaman J.curcas hermaprodit yang diberi ZPT pada 46 Hari Setelah Tanam(HST) terdiri dari: (A) jumlah cabang , (B) jumlah daun, (C) tinggi tanaman, dan (D) besar sudut cabang.
Keterangan : K (Kinetin), G (Giberelin), G:K (Giberelin : Kinetin), A:G (Auksin : Giberelin), A : K (Auksin : Kinetin), Ko (Kontrol), dan A (Auksin).
Tabel 2 Pengaruh ZPT terhadap parameter pertumbuhan sebelum bunga anthesis pada minggu ke- 9
Perlakuan Jumlah cabang Jumlah daun (helai)
Tinggi tanaman (cm)
Besar sudut cabang
(◦)
Kontrol 7 ± 3 a 158 ± 84 a 71,75 ± 8,68 a 47,87 ± 4,01 Kinetin 7 ± 3 a 108 ± 22 a 66,50 ± 6,26 a 45,25 ± 2,76
GA-3 12 ± 5 b 254 ± 20 b 91,12 ± 20,02 b 46,00 ± 4,57 GA-3 : Kinetin 8 ± 1 a 147 ± 38 a 71,25 ± 5,92 a 46,25 ± 3,28 IAA : GA-3 7 ± 1 a 137 ± 67 a 64,37 ± 7,65 a 48,12 ± 3,72 IAA : Kinetin 7 ± 1 a 144 ± 25 a 62,25 ± 5,20 a 48,75 ± 3,53 IAA 6 ± 2 a 109 ± 14 a 60,87 ± 2,95 a 47,25 ± 2,37 Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji
DMRT taraf 5%. Data menunjukkkan nilai rata-rata ± SD.
A
B
Tabel 3 Perbandingan bunga jantan dan bunga hermaprodit dalam satu rangkaian bunga pada 23 hari setelah inisiasi awal
Perlakuan Hermaprodit (H) Jantan (J) Nisbah H : J
Kontrol 10 ± 1 c 100 ± 13c 10 : 100
Kinetin 7 ± 3 c 100 ± 10 c 7 : 100
GA-3 7 ± 2 c 90 ± 10 b 7 : 90
GA-3 : Kinetin 11 ± 2 d 136 ± 34 c 11 : 136
IAA : GA-3 9 ± 1 c 127 ± 4 c 9 : 127
IAA : Kinetin 9 ± 1 c 128 ± 11 c 9 : 128
IAA 4 ± 1 b 59 ± 10 b 4 : 59
Keterangan: Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada uji DMRT taraf 5%. Data menunjukkkan nilai rata-rata ± SD.
Gambar 2 Bunga Hemaprodit dan Bunga jantan pada H-1 (A) dan Bunga Hermaprodit pada H-0 (B): (h) bunga hermaprodit, (b) bunga jantan , (st) stamen, dan (s) stigma.
Gambar 3 Preparat segar bunga hermaprodit terdiri dari (A) Bunga hermaprodit pada H-1, (B) celah pada kuncup bunga hermaprodit pada H-1, (C) Bunga hermaprodit pada H-1(D) Kondisi stigma yang reseptif pada H-1, dan (E) Penyerbukan pada H0: (c) celah, (s) stigma, dan (p) polen .
Pengamatan celah kuncup bunga (Gambar 3 A dan B) pada preparat segar menunjukkan kondisi kuncup yang masih tertutup. Kondisi stigma yang reseptif ditunjukkan pada gambar 3 C dan D. Stigma yang reseptif terjadi satu hari sebelum bunga mekar dan masa reseptif stigma dapat diamati 2-3 hari. Keadaan ini ditandai dengan adanya kondisi stigma yang mengkilap dan sekresi lendir. Sedangkan polen anthesis terjadi pada saat bunga mekar.
Preparat segar diamati untuk melihat penyerbukan (Gambar 3 E). Penyerbukan terjadi pada H0. Pada penyerbukan ini
ditunjukkan keadaan polen merekah dan menempel di stigma.
Pengamatan sayatan membujur bunga hermaprodit, pada stadia bunga kuncup kecil (Gambar 4 A) menunjukkan keadaan anther yang belum merekah dengan polen yang sudah matang. Pada stadia kuncup bunga yang sama juga belum terbentuk ovari. Pada stadia bunga kuncup menengah (Gambar 4 B) menunjukkan belum terlihat perkembangan ovul di dalam ovari.
Pada bunga H-1 (Gambar 4 C) ovul sudah dijumpai di dalam ovari. Pada bunga ini juga menunjukkan telah terbentuknya kelenjar nektar di samping ovari. Di samping itu, pada
A B
h
b
st
s
s
5
stadia bunga yang sama juga telah menunjukkan keadaan polen yang sudah dewasa dan anther belum anthesis (Gambar 4 D). Pada Gambar 4E ovul yang terlihat ada dua buah. Pada bunga H-1, pada ovul tidak
terlihat integumen, nuselus dan mikrofil. Di dalam ovul terlihat sel-sel subdermal nuselar, namun gametofit betina tidak terlihat (Gambar 4 F).
(A) (B)
(C) (D)
(E) (F)
Gambar 4 Sayatan membujur bunga hermaprodit J. curcas yang terdiri dari (A) Bunga hermaprodit kuncup kecil, (B) Bunga Hermaprodit kuncup menengah, (C) Bunga Hermaprodit H-1, (D) Stamen H-1, (E) Bunga Hermaprodit H-1, dan (F) ovul H-1 (F):
sn
ov
20 um
st
sp
st
pt
o
ov
st
20 um
kn
st
(st) stamen, (sp) sepal, (pt) petal, (o) ovari, (ov) ovul, (sn) subdermal nuselar dan (kn) kelenjer nektar.
PEMBAHASAN
Jumlah cabang, jumlah daun, dan tinggi tanaman (Gambar 1) menunjukkan bahwa pemberian giberellin berbeda dengan ZPT lainnya. Dapat dikatakan bahwa giberellin memberi pengaruh yang signifikan terhadap pertumbuhan vegetatif tanaman J. curcas
hermaprodit, kecuali pada besar sudut percabangan (Gambar 1 D). Giberellin berperan dalam pemacuan elongasi (pertambahan panjang) sel (Ghosh et al, 2010), sehingga sel-sel batang lebih memanjang pada tanaman yang diberi giberellin dan memberikan pengaruh pada pertambahan tinggi tanaman J. curcas.
Kombinasi perlakuan Giberellin dengan Kinetin dapat menghasilkan bunga hermaprodit yang lebih banyak pada 23 hari setelah inisiasi, tetapi hal ini belum dapat mencerminkan produksi bunga hermaprodit. ZPT adalah senyawa-senyawa organik tanaman yang dalam konsentrasi rendah mempengaruhi proses-proses fisiologis (Sumiati 2009). Selain itu kombinasi ZPT juga menghasilkan jumlah bunga yang lebih banyak dibandingkan menggunakan satu macam ZPT seperti yang terlihat pada hasil di Tabel 3. Bunga hermaprodit yang dihasilkan oleh tanaman ini stabil dari satu generasi ke generasi berikutnya. Pada perlakuan kombinasi Giberellin dan Kinetin dapat menghasilkan satu rangkaian bunga rata-rata 11 bunga hermaprodit dan 136 bunga jantan hingga 23 hari pengamatan sejak inisiasi bunga. ZPT yang diberikan sangat mempengaruhi munculnya bunga hermaprodit. Tanaman yang diberi ZPT mempunyai waktu berbunga lebih lama dibanding kontrol, kecuali perlakuan kinetin.
Pada penelitian ini menunjukkan bahwa ZPT yang berpengaruh pada pertumbuhan vegetatif adalah Giberellin, sedangkan untuk pertumbuhan generatif adalah Giberellin : Kinetin. Perlakuan ZPT pada masing-masing tanaman memiliki respon yang berbeda. Menurut Rosliani (2004) bahwa perlakuan ZPT tidak berpengaruh nyata terhadap pembungaan tanaman bawang merah. Pemberian ZPT mepiquat klorida (ZPT yang
menghambat biosintesis Giberellin) tidak mampu menstimulasi induksi pembungaan pada tanaman bawang merah, tetapi waktu tanam berpengaruh nyata terhadap pertumbuhan, pembungaan, dan pembijian bawang merah. Kushartoyo (1980) menyatakan bahwa Ethephon cepat memberikan respon dalam merangsang pembungaan pada tanaman nenas. Keberhasilan dari penggunaan Ethephon (1000 ppm) pada pembungaan dipengaruhi oleh konsentrasi, cara penggunaan, varietas dan macam bibit yang ditanam.
Perkembangan bunga hermaprodit
J.curcas dari inisiasi awal memerlukan waktu ± 2123 hari dan akan mekar pada umur 20 -23 hari. Bunga yang dihasilkan pada masing-masing perlakuan berbeda, pada perlakuan kombinasi Giberellin dan Kinetin menunjukkan hasil yang lebih baik, yaitu dalam 1 rangkaian bunga dalam waktu 23 hari dapat menghasilkan ± 11 bunga hermaprodit dan 136 bunga jantan. Utomo (2008) melaporkan bahwa perkembangan kuncup bunga betina J. curcas memerlukan waktu 16-21 hari, diikuti dengan periode bunga mekar sekitar 14-21 hari. Dalam satu malai periode bunga jantan mekar mencapai 21 hari, sedangkan bunga betina dan hermaprodit hanya 7 hari. Dalam satu hari bunga jantan mekar lebih awal sekitar pukul 07.00-08.00, sedangkan bunga betina sekitar pukul 08.00- 09.00. Rasio jumlah bunga betina/ hermaprodit dengan bunga jantan sebesar 1:12 dan berkorelasi dengan jumlah buah yang dihasilkan tiap malai.
7
bunga hermaprodit dibandingkan dengan bunga betina.
Keadaan bunga yang reseptif menunjukkan bahwa stigma siap untuk diserbuki. Stigma dikatakan reseptif dengan ciri mengkilap dan sekresi cairan di stigma (Raju &Ezradanam 2002). Bunga reseptif akan mengeluarkan cairan yang mengandung karbohidrat, protein, lemak, enzim, dan asam amino (Sedgley & Griffin 1989) dan akan menarik datangnya serangga untuk membantu penyerbukan. Pada bunga hermaprodit cairan tersebut diperlukan untuk perkecambahan polen. Informasi mengenai periode reseptif stigma sangat penting, karena pada periode tersebut merupakan waktu yang tepat untuk melakukan penyerbukan. Hal itu terkait dengan perbaikan mutu tanaman maupun produksi benih.
Sayatan membujur bunga hermaprodit J. curcas menunjukkan perkembangan bunga pada beberapa tingkatan (Gambar 4). Pada sayatan bunga H-1 terlihat adanya sepasang ovul. Ovul merupakan perkembangan dari plasenta di dalam ovari, tempat pembentukan megaspora dan tempat berkembangnya kantung embrio. Ovul terdiri dari nuselus, satu atau dua integumen, dan funikulus (Esau 1965). Nuselus akan berkembang menjadi sel-sel subdermal nusel-selar. Salah satu sel-sel pada subdermal nuselar, akan berkembang menjadi megasporofit (Reiser & Fischer 1993 ), tetapi pada sayatan ini megasporofit belum terlihat. Tiga zona primordium (dermal 1, 2, dan 3) pada ovul diinisiasi oleh pembelahan antiklinal dan periklinal. Zona ke-tiga pembelahan berasal dari meristem plasenta dengan pembelahan secara periklinal, sedangkan dua lapis terluar tergolong pada pembelahan antiklinal. Ketiga zona ini ditemukan pada banyak famili, diantaranya Euphorbiacea, Berberidaceae, Betulaceaea, dan Cistaceae (Johri 1984).
Ovul bunga hermaprodit pada hasil pengamatan sayatan membujur terlihat dua buah, sedangkan ovul yang terdapat pada tanaman J. curcas 2 sampai 3 buah. Buah
J.curcas terdiri dari 3 ruang yang masing-masing ruang berisi 1 biji (Hambali et al.
2005).
SIMPULAN
Bunga hermaprodit yang dihasilkan oleh tanaman J.curcas stabil dari satu generasi ke generasi berikutnya. Hal ini dapat dibuktikan oleh produksi bunga pada masing-masing rangkaian bunga menghasilkan rata-rata 11 bunga hermaprodit dan 136 bunga jantan
hingga 23 hari sejak inisiasi awal perlakuan kombinasi Giberellin dan Kinetin (50 : 50 ppm). Perlakuan Giberellin pada konsentrasi 100 ppm dapat memberi pengaruh yang signifikan terhadap pertumbuhan vegetatif tanaman J.curcas. Bunga reseptif terjadi satu hari sebelum bunga mekar, sedangkan polen anthesis terjadi saat bunga mekar. Sayatan membujur pada bunga hermaprodit H-1, menunjukkan bunga sudah memiliki ovul yang terdapat dalam ovari. Di dalam ovul dapat terlihat sel-sel yang merupakan perkembangan dari nuselus berupa subdermal nuselar.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui produksi bunga hermparodit pada J.curcas. Di samping itu, juga diharapkan untuk dilakukan pengamatan setelah bunga mekar, untuk mengetahui pembentukan dan perkembangan embrio pada tanaman J.curcas.
DAFTAR PUSTAKA
Abdelgadir HA, Jager AK, Johnson SD, Staden VJ. 2009. Influence of plant growth regulators on flowering, fruiting, seed oil content and oil quality of Jatropha curcas. South African 516: 1-2.
Esau K. 1965. Anatomy of Seed Plants 2nd Edition. California: University of California Santa Barbara.
Ghosh A, Chikara J, Chaudhary DR. 2010. Diminution of economic yield efeected by prunning and chemical manipulation of Jatropha curcas .
Biomass and Bioenergy 5: 1021 – 1029.
Hambali E, Dadang, Prawitasari T, Suryani A, Haryadi. 2005. Development of
Jatropha curcas Linn for Biodiesel. Bahan presentasi Pengembangan Jarak Pagar untuk Biodiesel (English version). SBRC, LPPM-IPB.
Hartati S. 2009. Jarak Pagar Hermaprodit, Informasi Genetik dan Lingkungan. Bogor : Pusat Penelitian dan Pengembangan Perkebunan, Badan Penelitian dan Pengembangan Pertanian 1: 4.
Johansen DA. 1940. Plant Microtechnique. New York: McGraw-Hill.
Kushartoyo D. 1980. Penggunaan Ethephon Secara Praktis Pada Beberapa Tanaman Pertanian. Yogyakarta: Departemen Agronomi Fakultas Pertanian UGM. Makwana V, Shukla P, Robin S. 2010. GA
Aplication induces alteration in sex ratio and cell death in Jatropha curcas.
Springer DOI 10.1007/s10725-010-9457-x.
Paris RP, King RW . 1985. Gibberellins and reproductive development in seed plants. Ann Rev Plant Physiol 36: 517– 568.
Raju S, Ezradanam V. 2002. Pollination ecology and fruiting behaviour in a monoecious spesies, Jatropha curcas L. (Euphorbiaceae). Curr Sci 83: 1395-1398.
Reale L, Korwar GR, Shanker AK, Ramakrishna Y. 2008. Morphological and cytological development and starch accumulation in hermaphrodite and staminate flowers of olive. Journal of Arid Environments 73: 877–884. Reiser L, Fischer R L. 1993. The Ovul and the
Embryo Sac. The Plant Cell 5 : 1291- 1301.
Rosliani R, Suwandi, dan Sumarni N. 2005. Pengaruh Waktu Tanam dan Zat Pengatur Tumbuh Mepiquat Klorida terhadap Pembungaan dan Pembijian Bawang Merah. J Hort 15:192-198. Sedgley M, Griffin 1989. Sexual Reproduction
of Tree Crops. Australia: Departement of Plant Physiology.
Sumiati, E. 2009. Pengaruh zat pengatur tumbuh terhadap hasil curd broccoli
(Brassica oleraceae) kultivar Green Comet. Bul Penel Hort 18: 4-5. Tr