UIN SYARIF HIDAYATULLAH JAKARTA
PENGUJIAN AKTIVITAS PENGHANCURAN
BIOFILM
Staphylococcus aureus
OLEH SEDUHAN
DAUN TEH PUTIH (
Camellia sinensis
(L.) Kuntze)
SKRIPSI
RIKA CHAERUNISA
1111102000133
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
PENGUJIAN AKTIVITAS PENGHANCURAN
BIOFILM
Staphylococcus aureus
OLEH SEDUHAN
DAUN TEH PUTIH (
Camellia sinensis
(L.) Kuntze)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar sarjana Farmasi
RIKA CHAERUNISA
1111102000133
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
HALAMAN PERNYATAAN ORISINALITAS
Skripsi ini adalah hasil karya sendiri,
dan semua sumber yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama NIM
Tanda Tangan
Tanggal
: : :
:
Rika Chaerunisa 1111102000133
Nama
Pengujian Aktivitas Penghancuran Biofilm Staphylococcus
aureus oleh Seduhan Daun Teh Putih (Camellia sinensis (L.)
Kuntze).
Daun teh putih (Camellia Sinensis (L.) Kuntze) merupakan daun teh muda yang masih berbentuk kuncup dengan kadar katekin tinggi. Penelitian ini bertujuan untuk menguji aktivitas penghancuran biofilm Staphylococcus aureus oleh seduhan daun teh putih. Seduhan pertama dilakukan dengan menggunakan daun teh putih langsung dari kemasan, seduhan kedua menggunakan daun teh putih hasil penyeduhan daun teh putih pertama, dan seduhan tiga menggunakan daun teh putih yang sebelumnya dihaluskan kemudian diayak dengan ayakan Mesh 20. Daun teh tersebut kemudian diseduh menggunakan akuades steril bersuhu 90°C selama 10 menit dan dianalisis kandungan total fenolnya menggunakan metode Follin-ciocalteau. Hasil kandungan total fenol berturut-turut adalah 0,018%, 0,025% dan 0,028% (b/v). Uji penghancuran biofilm dilakukan menggunakan metode microtiter plate assay terhadap seduhan daun teh putih yang memiliki kandungan total fenol tertinggi yaitu seduhan tiga dan dibuat seri konsentrasi seduhan 1%, 2%, 4% dan 8% (v/v). Hasil penelitian menunjukkan bahwa seduhan daun teh putih memiliki aktivitas penghancuran biofilm pada setiap konsentrasi. Hasil optimasi menggunakan respon surface analysis (RSA) menunjukan bahwa pada konsentrasi 3,253% (v/v) dengan waktu kontak pemberian seduhan selama 90 menit pada suhu 25°C dan waktu kontak pemberian seduhan selama 30 menit pada suhu 50°C menghasilkan kondisi terbaik dalam mendapatkan aktivitas penghancuran biofilm S. aureus. Berdasarkan penelitian ini, seduhan daun teh putih memiliki aktivitas penghancuran biofilm S. aureus.
ABSTRACT
sinensis (L.) Kuntze) Against Staphylococcus aureus
Biofilm Destruction Activity
White tea leaves (Camellia sinensis (L.) Kuntze) is a young or buds tea leaves which contained a high level of catechins. The aims of this study were to determine the activity of Staphylococcus aureus biofilm destruction by using brewed white tea leaves. The first group were prepared by using white tea leaves directly from the package, the second group were prepared by using the results of the first one, while the last group were prepared by using white tea leaves that were previously crushed and sieved by using Mesh 20 sieve. Those three groups then brewed by using a 90°C sterile distilled water for 10 minutes and the content of phenolic total were analyzed by using Follin-ciocalteau method. The results of phenolic content were 0.018%, 0.025% and 0.028% (w/v), respectively. The destruction of biofilm were performed by using microtiter plate assay method for 1%, 2%, 4% and 8% (v/v) of the third group, a brewed white tea leaves which has the highest content of phenolic. The results showed that all of the concentrations of the third group has the destruction activity. The results of optimization by using response surface analysis (RSA) showed that the 3.253% (v/v) of the third group which determined for 90 minutes at 25°C and 30 minutes at 50°C were the best condition to destruct the S. aureus biofilm activity. Based on this research, brewes white tea leaves has the activity to destructs S. aureus biofilm.
Alhamdulillahirobbil’alamin, segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan nikmat dan karunia-Nya sehingga
penulis dapat menyelesaikan penelitian dan menyusun skripsi berjudul “Pengujian Aktivitas Penghancuran Biofilm Staphylococcus aureus oleh Seduhan Daun Teh Putih (Camellia sinensis (L.) Kuntze)” untuk memenuhi persyaratan guna memperoleh gelar Sarjana Farmasi pada Fakultas Kedokteran
dan Ilmu Kesehatan (FKIK), Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta.
Selama perkuliahan, proses penelitian dan penyususnan skripsi ini, penulis
telah memperoleh banyak bantuan dari berbagai pihak yang selalu meluangkan waktu dalam memberikan bimbingan, saran, do’a serta dorongan kepada penulis. Maka perkenankanlah penulis menyampaikan rasa terima kasih yang
sebesar-besarnya khususnya kepada :
1. Bapak Yardi, Ph.D., Apt selaku Ketua Program Studi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta sekaligus
Dosen Penanggung Jawab Akademik Farmasi 2011 A.
2. Ibu Ofa Suzanti Betha, M. Si., Apt sebagai pembimbing I dan Bapak Novik
Nurhidayat, Ph.D sebagai pembimbing II yang dengan sabar dan rela
meluangkan waktunya dalam memberikaan bimbingan, saran, ilmu
pengetahuan dan dukungan dalam penelitian ini.
3. Dr. M. Yanis Musdja., Apt dan Ibu Puteri Amelia, M. Farm., Apt selaku
dosen penguji I dan II atas saran dan perbaikan dalam menyusun skripsi ini.
4. Seluruh staf pengajar Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan UIN Syarif Hidayatullah Jakarta atas ilmu pengetahuan, dukungan,
saran dan do’a yang telah diberikan kepada penulis. Terima kasih juga kepada
seluruh laboran dan karyawan Program Study Farmasi FKIK UIN Syarif
Hidayatullah Jakarta atas bantuan yang diberikan.
5. Bapak Drs. Umar Mansur, M. Sc., Apt selaku mantan Ketua Program Studi
Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah
ix
6. Bapak Novik Nurhidayat, Ph.D selaku kepala laboratorium Mikrobiologi
Kesehatan, Pusat Penelitian Biologi, LIPI Cibinong yang telah memberikan
izin kepada penulis untuk melakukan penelitian. Terima kasih juga kepada
segenap staf laboratorium, Ka Lusi, Pak Acun, dan Mbak Ana atas segala
bantuan, dukungan, ilmu dan keceriaan yang diberikan selama penelitian.
7. Pusat Penelitian Teh dan Kina Gambung Bandung, Pak Tajudin, Bu siti dan
para peniliti (Pak Dadan dan Pak Shabri), terima kasih atas bantuannya.
8. Terima kasih sebesar-besarnya kepada papa (Rachman Soleh, S.T) dan mama
(A. Lely Hartati, S.Pd) atas tulusnya cinta, kasih sayang, dukungan baik moril
maupun materil dan do’a yang tanpa henti selalu mengiringi langkah penulis.
Semoga Allah SWT selalu memberikan kesehatan, menjaga mama papa, dan
keberkahan selalu menyertai.
9. Kedua kakak tercinta (Rizky Adhari, S.E dan Sulastri Mubarok, S.E), terima
kasih atas cinta, kasih sayang, dukungan dan do’a yang telah diberikan.
10. Teman seperjuangan penelitian Biofilmers (Firda, Rezky, Fatah, Ka Via dan
Ka Eka) dan kaka Biosensors (Ka Anom dan Ka Afif), atas pengertian,
dukungan, keceriaan, do’a dan kerja sama selama penelitian.
11. Sahabat istimewa (Hanifa, Putri, Nk, Evi, Bani dan Hikmat) yang selalu ada menghiasi tiap langkah. Terimakasih atas do’a dan semangat yang diberikan. 12. Sahabat perkuliahan (Wafa, Ibo, Ni’mah, Nana, Nicky, Efri, Mida, Meri,
Nurul, Dana, Fitri, Tari, Dini, Mazay) dan seluruh keluarga besar Farmasi
2011, juga adik tingkat (Noni dan Nita) atas keceriaan dan dukungannya.
13. Keluarga CSSMoRa UIN, BEM FARMASI 2013-2014, Sepeda Sehat UIN,
dan Komunitas Pecinta Alam Arkadia UIN, terima kasih atas dukungan,
saran, ilmu, keceriaan serta do’a kepada penulis.
14. Semua pihak lain yang tidak dapat disebutkan satu persatu, yang telah
membantu penulis hingga terwujudnya skripsi ini.
Penulis menyadari bahwa penyusunan skripsi ini masih jauh dari sempurna
dan banyak kekurangan. Oleh karena itu saran dan kritik yang membangun sangat
diharapkan. Semoga skripsi ini bermanfaat bagi penulis dan pembaca. Amin.
TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIK
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif
Hidayatullah Jakarta, Saya yang bertanda tangan di bawah ini :
Nama : Rika Chaerunisa
NIM : 1111102000133
Program studi : Strata-1 Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
Demi pengembangan ilmu pengetahuan, saya menyetujui skripsi/karya
ilmiah saya dengan judul
PENGUJIAN AKTIVITAS PENGHANCURAN BIOFILM
Staphylococcus aureus OLEH SEDUHAN DAUN TEH PUTIH (Camellia Sinensis (L.) Kuntze)
untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-Undang Hak Cipta.
Dengan demikian persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Ciputat
Pada Tanggal : 17 Juni 2015
Yang menyatakan,
DAFTAR ISI
2.4 Deskripsi Daun Teh Putih (Camellia sinensis (L.) Kuntze)... 9
2.5 Response Surface Analysis ... 11
3.2.1 Alat Penelitian ... 12
3.3.2 Karakterisasi dan Penapisan Fitokimia Daun Teh Putih (C. sinensis) ... 13
3.3.2.1 Organoleptik ... 13
3.3.2.2 Penapisan Fitokimia ... 13
3.3.3 Penyiapan Seduhan dan Karakterisasi Seduhan Daun Teh Putih ... 14
3.3.4 Preparasi Bakteri Uji ... 15
3.3.4.1 Purifikasi dan Karakterisasi Bakteri Uji pada Media Luria Bertani Agar ... 15
3.3.4.2 Pembuatan Suspensi Bakteri Uji ... 15
3.3.5 Optimasi Waktu Pembentukan Biofilm S. aureus ... 15
3.3.6 Uji Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus Secara In Vitro ... 16
3.3.6.1 Uji Penghambatan Pertumbuhan dan Perkembangan Biofilm ... 16
3.3.6.2 Uji Penghancuran Biofilm ... 17
3.3.7 Rancangan Penelitian dan Analisis Data ... 17
3.3.8 Optimasi Aktivitas Penghancuran Biofilm S. aureus ... 18
BAB 4 HASIL DAN PEMBAHASAN ... 19
4.1 Determinasi ... 19
4.2 Hasil Karakterisasi dan Penapisan Fitokimia Daun Teh Putih (C. sinensis) ... 19
4.2.1 Organoleptik ... 19
4.2.2 Penapisan Fitokimia ... 19
4.3 Hasil Penyiapan Seduhan dan Karakterisasi Seduhan Daun Teh Putih ... 20
4.4 Preparasi Bakteri Uji ... 22
4.4.1 Hasil Purifikasi dan Karakterisasi BakteriUji pada Media Luria Bertani Agar ... 22
4.4.2 Hasil Suspensi Bakteri Uji ... 24
4.6 Hasil Uji Aktivitas Penghambatan dan Penghancuran Biofilm
S. aureus oleh Seduhan Daun Teh Putih (C. sinensis) ... 25
4.7 Hasil Optimasi Aktivitas Penghancuran Biofilm S. aureus ... 28
BAB 5 KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan... 33
5.2 Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR GAMBAR
Halaman
Gambar 1. Pembentukan Biofilm ... 6
Gambar 2. S. aureus yang Dilihat dari Mikroskop Elektron... 8
Gambar 3. Scanning Electron Micrograph (SEM) Biofilm S. aureus ... 9
Gambar 4. (A) Daun Teh Putih pada Tanaman Teh (C. sinensis) ... 10
Gambar 5. Karakteristik Daun Teh Putih (C. sinensis) ... 19
Gambar 6. Hasil Purifikasi Bakteri S. aureus Pada Media LB Agar ... 23
Gambar 7. Hasil Karakterisasi Bakteri S. aureus Menggunakan Pewarnaan Gram ... 23
Gambar 8. Diagram Optimasi Waktu Pembentukan Biofilm S. aureus Melalui Metode Microtitter Plate Biofilm Assay (OD595nm) ... 24
Gambar 9. Diagram Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus oleh Seduhan Daun Teh Putih (C. sinensis) Melalui Metode Microtitter Plate Biofilm Assay (OD595nm) ... 26
Gambar 10. Contour plot dari % Penghancuran vs Waktu Kontak dan Konsentrasi ... 30
Gambar 11. Contour plot dari % Penghancuran vs Suhu dan Waktu kontak ... 30
Halaman
Tabel 1. Hasil Uji Penapisan Fitokimia ... 20
Tabel 2. Hasil Uji Total Fenol ... 21
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Alur Kerja ... 39
Lampiran 2. Proses Pembuatan Media dan Cara Sterilisasi Alat dan Bahan. ... 40
Lampiran 3. Metode Penapisan Fitokimia ... 41
Lampiran 4. Metode Analisis Total Fenol ... 43
Lampiran 5. Alur Pewarnaan Gram ... 44
Lampiran 6. Perhitungan Seduhan Daun Teh Putih ... 45
Lampiran 7. Hasil Determinasi Tanaman Teh ... 46
Lampiran 8. Gambar Alat dan Bahan ... 47
Lampiran 9. Proses Penyiapan Seduhan Daun Teh Putih ... 48
Lampiran 10. Hasil Analisis Total Fenol ... 49
Lampiran 11. Hasil Uji Penapisan Fitokimia Daun Teh Putih ... 50
Lampiran 12. Hasil Uji Re-Identifikasi Reaksi Biokimia S. aureus ... 51
Lampiran 13. Hasil Uji Pembentukan dan Pertumbuhan Biofilm S. aureus. ... 52
Lampiran 14. Hasil Uji Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus oleh Seduhan Daun Teh Putih (C. Sinensis) ... 53
Lampiran 15. Analisis Data Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus oleh Seduhan Daun Teh Putih (C. Sinensis) ... 54
PENDAHULUAN
1.1 Latar Belakang
Infeksi masih menempati urutan teratas penyebab penyakit dan kematian
di negara berkembang, termasuk Indonesia. Infeksi dapat disebabkan oleh bakteri,
virus, maupun jamur, dan dapat terjadi di masyarakat maupun di rumah sakit
(Wahjono, 2007). Infeksi mikroba khususnya yang dapat merugikan manusia
dapat dikontrol oleh agen antimikroba, salah satunya dengan penggunaan
antibiotik. Namun, efektivitas antimikroba saat ini menurun akibat prevalensi
resisten banyak obat. Mikroba dapat membuat suatu pertahanan dengan
membentuk biofilm, yaitu suatu lapisan sel mikroba yang melekat di sebuah
permukaan dan tertanam dalam matriks eksopolisakarida yang dihasilkan sendiri
oleh miroorganisme tersebut (Saad Musbah Alasil et al., 2014).
Biofilm saat ini diakui sebagai mediator utama infeksi, dengan perkiraan
80% kejadian infeksi berkaitan dengan pembentukan biofilm (Archer et al.,
2011). Biofilm sebagai pertahanan bakteri sulit diberantas dengan antibiotik
dengan demikian bakteri patogen dalam bentuk biofilmnnya dapat menimbulkan
masalah serius bagi kesehatan manusia (J.-H. Lee et al., 2013). Selain itu, biofilm
bakteri dapat terbentuk pada permukaan sistem perairan alami, pipa air, jaringan
tubuh, permukaan gigi, alat medis dan implan. Pembentukan biofilm pada alat
medis dan implan seperti kateter, alat katup jantung, alat pacu jantung, sendi
buatan, serta lensa kontak menjadi masalah serius di dunia medis (Chen et al.,
2013).
Staphylococcus aureus telah dikenal sejak abad ke-19 sebagai penyebab
infeksi lokal maupun sistemik (Yuwono, 2010), merupakan salah satu bakteri
patogen yang menjadi perhatian akibat sifat resistensinya yang dikenal sebagai
methicillin-resistant S. aureus (MRSA) dan vancomycin- methicillin-resistant S.
aureus (J.-H. Lee et al., 2013). Kemampuan pembentukan biofilm merupakan
salah satu faktor virulensi S. aureus yang dapat menyebabkan peningkatan
toleransi terhadap antibiotik dan desinfektan serta resistensi terhadap fagositosis
2
Biofilm S. aureus berkembang dengan pesat dan membentuk koloni terutama
pada permukaan yang lembab dan kaya nutrisi (Traver, 2009). Hal ini
menyebabkan perlunya pengendalian biofilm khususnya untuk penghancuran
biofilm. Pengendalian biofilm dapat dilakukan secara kimia dengan penambahan
zat kimia seperti deterjen yang mengandung enzim, secara fisika dengan
peningkatan suhu dan secara biologi dengan menggunakan bakteriofage serta
interaksi mikrobiologis (M. Simoes et al., 2010).
Biofilm juga dapat dikontrol dengan memanfaatkan bahan alam yang salah
satunya dapat menggunakan senyawa kimia dari tanaman. Penggunaan
senyawa-senyawa tersebut lebih diterima karena aman dan telah lama digunakan oleh
masyarakan umum, baik sebagai pencegahan maupun pengobatan penyakit dan
infeksi (Guarrera, 2005 dalam sandasi et al, 2010). Pada penelitian ini
menggunakan seduhan daun teh putih (Camellia sinensis (L.) Kuntze) yang pada
penelitian sebelumnya belum diketahui memiliki aktivitas penghancuran biofilm
S. aureus.
Daun teh putih (C. sinensis) adalah jenis daun teh yang paling sedikit
diproses dan memiliki kandungan katekin tertinggi, merupakan daun teh muda
yang masih kuncup di proses secara penguapan dengan segera setelah dipanen
(Rai Nishant et al., 2012). Katekin termasuk senyawa polifenol dari kelompok
flavonoid. Polifenol teh atau sering disebut dengan katekin bersifat antimikroba
(Syah, Andi. 2006). Sama halnya dengan teh hijau, teh putih tersusun sebagian
besar dari senyawa-senyawa katekin serta struktur flavan 3-ol lainnya yang salah
satunya adalah EGCG (epigallocatechin-3-gallate). Pada penelitian Roccaro et al
(2004) dalam Steinmann et al (2012) menunjukkan bahwa EGCG yang
terkandung dalam teh hijau (C. sinensis) dapat menurunkan produksi lendir dan
menghambat pembentukan biofilm oleh isolat S. aureus dan S. epidermidis. Hasil
ini menunjukkan bahwa selain mengikat lapisan lipid dan peptidoglikan, EGCG
mengganggu bahan polimer ekstraseluler (glikokaliks) (Steinmann Joerg et al.,
1.2 Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas maka dapat
dirumuskan permasalahan sebagai berikut :
1) Apakah seduhan daun teh putih (C. sinensis) memiliki aktivitas
penghancuran biofilm S. aureus ?
2) Berapa konsentrasi seduhan, waktu kontak dan suhu inkubasi optimal yang
memiliki aktivitas penghancuran biofilm terbaik ?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan aktivitas penghancuran
biofilm terbaik dari aplikasi pemberian seduhan daun teh putih (C. sinensis)
dengan konsentrasi seduhan, waktu kontak dan suhu inkubasi optimal terhadap
biofilm S. aureus.
1.4 Hipotesis
1) Seduhan daun teh putih (C. sinensis) memiliki aktivitas penghancuran
biofilm S. aureus.
2) Perbedaan aktivitas penghancuran biofilm S. aureus dipengaruhi oleh
konsentrasi seduhan, waktu kontak dan suhu inkubasi.
3) Terdapat kondisi terbaik dalam mendapatkan aktivitas penghancuran
biofilm S. aureus yang optimal.
1.5 Manfaat Penelitian
Penelitian ini diharapkan menghasilkan informasi untuk masyarakat umum
mengenai kondisi yang terbaik dalam penggunaan seduhan daun teh putih (C.
sinensis) untuk mengontrol biofilm S. aureus, serta memberikan informasi ilmiah
BAB 2
TINJAUAN PUSTAKA
2.1 Infeksi
Penyakit infeksi masih merupakan penyebab utama morbiditas dan
mortalitas di dunia. Di samping itu penyakit infeksi juga bertanggung jawab pada
penurunan kualitas hidup jutaan penduduk di berbagai negara maju dan
berkembang. Menurut WHO sebanyak 25 juta kematian di seluruh dunia pada
tahun 2011, sepertiganya disebabkan oleh penyakit infeksi. Penyakit infeksi
adalah penyakit yang disebabkan oleh mikroba patogen, dan bersifat sangat
dinamis. Secara umum proses terjadinya penyakit melibatkan tiga faktor yang
saling berinteraksi yaitu : faktor penyebab penyakit (agen), faktor manusia atau
pejamu (host), dan faktor lingkungan (Septiari, 2012). Infeksi dapat terjadi di
masyarakat maupun di rumah sakit(Wahjono, 2007).
Infeksi mikroba khususnya yang dapat merugikan manusia dapat dikontrol
oleh agen antimikroba, salah satunya dengan penggunaan antibiotik. Namun,
efektivitas antimikroba saat ini menurun akibat prevalensi resisten banyak obat
(Saad Musbah Alasil et al., 2014). Resistensi antibiotik terhadap mikroba
menimbulkan beberapa konsekuensi yang fatal. Penyakit infeksi yang disebabkan
oleh bakteri yang gagal berespon terhadap pengobatan mengakibatkan
perpanjangan penyakit, meningkatnya resiko kematian dan semakin lamanya
masa rawat inap di rumah sakit (Deshpande et al., 2011).
2.2 Biofilm
2.2.1 Definisi Biofilm
Biofilm adalah lapisan yang terdiri dari kumpulan bakteri dan menempel
pada suatu permukaan. Biofilm yang melekat tersusun atas matrik polimer
ekstraseluler yang dihasilkan sendiri oleh bakteri tersebut (Chen et al., 2013). Di
dalam lapisan biofilm, mikroba cenderung tumbuh dan berkembang dengan pesat
hingga membentuk koloni terutama pada permukaan bahan yang lembab dan kaya
2.2.2 Struktur Biofilm
Unit struktural dasar biofilm adalah mikrokoloni, sel planktonik bakteri
tertanam dalam matriks extracellular polymeric substance (EPS). Mikrokoloni
dapat terdiri dari satu atau lebih jenis bakteri, tergantung pada jenis bakteri.
10-25% bagian dari biofilm tersusun atas sel bakteri sedangkan 79-90% bagian
lainnya tersusun atas matriks EPS. Matriks EPS melindungi sel bakteri dari
berbagai kondisi lingkungan yang buruk, seperti radiasi UV, perubahan nilai pH,
dan atau pengeringan. Komposisi umum EPS bakteri terdiri polisakarida, protein,
asam nukleat, lipid, fosfolipid, dan zat humat. Matriks molekul EPS diperlukan untuk komunikasi antar sel yang disebut quorum sensing. Quorum sensing
merupakan suatu proses yang memungkinkan bakteri dapat berkomunikasi dengan
mensekresikan molekul sinyal yang disebut autoinducer.
Diantara mikrokoloni, terdapat saluran air yang mengalir. Saluran air ini
berfungsi sebagai sistem sirkulasi sederhana untuk mendistribusikan nutrisi ke
mikrokoloni dan menerima metabolit yang merugikan. Biofilm juga dipengaruhi
oleh faktor lingkungan, seperti ketersediaan nutrisi dan hidrodinamika. Biofilm
bersifat polimorfik dan perubahan struktur menyesuaikan jumlah nutrisi, yang
ditunjukkan oleh percobaan dengan pemberian konsentrasi glukosa yang berbeda.
Ketika konsentrasi glukosa tinggi, mikrokoloni tumbuh dengan cepat
menghasilkan peningkatan ketebalan biofilm secara signifikan. Ketika konsentrasi
glukosa rendah, biofilm berkurang dan struktur sebelumnya diperbaiki. Studi
biofilm dalam kondisi hidrodinamik yang berbeda, seperti aliran laminar dan
aliran turbulen, telah menunjukkan bahwa perubahan struktur biofilm tergantung
pada jenis aliran. Dalalam aliran laminar mikrokoloni bakteri menjadi bulat,
dalam aliran turbulen mikrokoloni bakteri memanjang ke arah hilir (Maric S.,
Vranes J., 2007).
2.2.3 Pembentukan Biofilm
Proses pembentukan biofilm menurut Watnick dan Kolter (2000) terdiri
dari lima tahap. Pada tahap pertama sel planktonik bakteri akan berpindah dari
cairan ke permukaan benda padat. Pada tahap ini, proses perlekatan sel masih
6
permanen akibat terbentuknya material eksopolimer yang merupakan suatu
senyawa perekat yang lebih kuat.
Pada tahap ketiga ditandai dengan terbentuknya mikrokoloni dan biofilm
mulai terbentuk, bakteri mulai berkembang biak dan memancarkan sinyal kimiawi
sebagai alat komunikasi antarsel bakteri (Prakash et al., 2003). Sementara pada
tahap keempat, biofilm yang terbentuk semakin banyak dan membentuk struktur
tiga dimensi yang mengandung sel terselubung dalam beberapa kelompok yang
saling terhubung satu sama lainnya.
Pada tahap terakhir, perkembangan struktur biofilm mengakibatkan
terjadinya dispersi sel sehingga sel tersebut berpindah dan membentuk biofilm
yang baru. Perlu dicatat pada biofilm yang sudah terbentuk, proses pembelahan
sel jarang terjadi. Pada kondisi tersebut, sel biofilm menggunakan sebagian besar
energi untuk membentuk eksopolisakarida yang dibutuhkan sel sebagai nutrisi
(Watnick and Kolter, 2000).
Gambar 1. Pembentukan Biofilm
Sumber: Montana State University (MSU) Center of Biofilm Engineering
2.2.4 Pengendalian Biofilm
Biofilm yang terdiri dari bakteri patogen dapat menimbulkan masalah
yang serius bagi kesehatan manusia. Hal ini menyebabkan perlunya suatu cara
atau pengendalian khusus pada biofilm. Pengendalian biofilm dapat dilakukan
1) Secara Kimia
Biasanya pengendalian biofilm dilakukan seperti halnya proses sanitasi
dengan cara penambahan suatu zat kimia. Sanitasi kimia dilakukan dengan
menggunakan desinfektan. Tujuan penggunaan desinfektan ialah untuk mereduksi
jumlah mikroorganisme patogen. Selain itu menurut M. Simoes et al (2010) teknik perlakuan deaktivasi biofilm mikroba dapat dilakukan dengan
menggunakan enzim berbasis deterjen juga dikenal dengan bio-cleaners. 2) Secara Fisika
Selain menggunakan bahan kimia pengendalian biofilm dapat juga
dilakukan dengan metode fisika yaitu memanfaatkan suhu yang tinggi atau
pemanasan. Sanitasi dengan menggunakan air panas lebih menguntungkan karena
air panas mudah tersedia dan tidak beracun. Peralatan kecil seperti pisau, serta
bagian – bagian alat pengolahan pangan dapat direndam dalam air yang
dipanaskan hingga suhu 800C (Yunus, 2000). Tinggi rendahnya suhu mempengaruhi pertumbuhan mikroorganisme. Bakteri dapat tumbuh dalam
rentang suhu minus 500C sampai 800C, tetapi bagaimanapun juga setiap spesies mempunyai rentang suhu yang pendek yang ditentukan oleh sensitifitas sistem
enzimnya terhadap panas.
Aktivitas panas sering dijadikan sebagai sanitasi suatu peralatan kesehatan
dan peralatan proses penanganan makanan. Dari hasil penelitian (Trisnawati, 2010)
jumlah bakteri sebelum perlakuan sanitizer air panas berkisar antara 120 – 280
CFU/cm2. Sesudah perlakuan hasil pemeriksaan angka total bakteri berkisar antara 80 – 100 CFU/cm2
. Hasil analisis menunjukkan bahwa proses sanitasi memberikan
pengaruh terhadap penurunan angka total bakteri.
3) Secara Biologi
Teknik perlakuan deaktivasi biofilm mikroba secara biologi dapat
dilakukan dengan pengendalian fage dan interaksi mikrobiologis atau molekul
metabolit (M. Simoes et al., 2010).
Fage dapat digunakan untuk pengendalian biofilm. Pada dasarnya fage
merupakan virus yang menginfeksi bakteri melalui jalur yang spesifik serta besifat
non-tosik terhadap manusia, sehingga memiliki potensi yang baik untuk
8
Pengendalian biofilm juga dapat dilakukan dengan interaksi interspesies
jamak atau produksi suatu metabolit sederhana. Banyak bateri yang mampu
mensintesis dan mensekresikan biosurfaktan dengan sifat anti lekat yang kuat.
Davis and Marques (2009) melaporkan P. aeruginosa menghasilkan cis-2-asam dekanoat yang mampu menghambat pembentukan dan pengembangan biofilm.
Ditambahkan pula peranan cis-2-asam dekanoat dalam pengendalian biofilm
sangat terkait dengan kemampuan memancarkan sinyal dari molekul asam lemak
rantai pendek (Prasetia, H.A., 2012).
2.3 Staphylococcus aureus
Bakteri S. aureus merupakan bakteri Gram positif berbentuk sferis dengan
diameter 0,8 – 1,0 mikron, tidak bergerak, fakultatif anaerob, tidak berspora dan
tidak membentuk flagel. Koloni pada media yang padat akan berbentuk bulat,
halus, menonjol, dan berkilau-kilau, membentuk berbagai pigmen berwarna
kuning keemasan (Jawetz et al., 2005). Secara garis besar klasifikasi bakteri S.
aureus menurut Rosenbach (1884) berasal dari Filum Firmicutes, Kelas Bacili,
Ordo Bacillales, Familia Staphylococcaceae, Genus Staphylococcus, Spesies S.
aureus.
Gambar 2. S. aureus yang Dilihat dari Mikroskop Elektron. Sumber: Todar, 2008
S. aureus dapat menimbulkan penyakit melalui kemampuannya tersebar
luas dalam jaringan dan melalui pembentukan berbagai zat ekstraseluler.
Berbagai zat yang berperan sebagai faktor virulensi dapat berupa protein,
virulensi bakteri (Jawetz et al., 2008). Setiap jaringan ataupun alat tubuh yang
terinfeksi dapat menyebabkan timbulnya penyakit dengan tanda – tanda yang
khas, yaitu peradangan, nekrosis dan pembentukan abses (Assani S, 1994).
Pembentukan biofilm S. aureus dapat menyebabkan masalah kesehatan
yang serius karena dapat meningkatkan resistensi terhadap antibiotik, desinfektan
dan imunitas hospes. Kemampuan pembentukan biofilm merupakan salah satu
faktor virulensi S. aureus yang dapat menyebabkan peningkatan toleransi terhadap
antibiotik dan desinfektan serta resistensi terhadap fagositosis dan sel-sel
imunokompeten lain (Høiby, et al., 2010; J.-H. Lee et al., 2013).
Gambar 3. Scanning Electron Micrograph (SEM) Biofilm S. aureus. Sumber: Bixler, Gregory D., dan Bhushan, Bharat,. 2012.
2.4 Deskripsi Daun Teh Putih (Camellia sinensis (L.) Kuntze)
Daun teh putih adalah jenis daun teh yang diproduksi paling sedikit dan
memiliki kandungan katekin yang paling tinggi. Merupakan daun teh muda yang
masih kuncup dan di proses secara penguapan dengan segera setelah pemanenan
untuk menonaktifkan polifenol oksedase, suatu enzim yang dapat menghilangkan
katekin. Akibatnya, kandungan katekin pada teh putih lebih banyak dibanding teh
hijau (Rai Nishant et al. 2012). Menurut Pusat Penelitian Teh dan Kina (2012),
bahan teh putih adalah pucuk teh yang masih kuncup yang disebut peko. Peko
diolah tidak melalui proses oksidasi (atau hanya sedikit terjadi oksidasi) polifenol
sehingga memiliki antioksidan tertinggi. Disebut white tea karena penampakan
teh ini putih keperakan mengkilat dari bulu – bulu yang menyelimutinya dan
10
Gambar 4. (A) Daun Teh Putih pada Tanaman Teh (C. sinensis) Sumber: Mead, M. Nathaniel., 2007
Tanaman teh merupakan tanaman subtropis yang sejak lama telah dikenal
dalam peradaban manusia. Klasifikasi tanaman teh menurut Rai Nishant et al
(2012) berasal dari Kelas Magnoliopsida – Dicotyledon, Order Theales, Familia
Theaceae, Genus Camellia L, Spesies C. sinensis. Kandungan senyawa kimia
daun teh segar terdiri atas 4 kelompok besar, yaitu Substansi Fenol berupa
flavonol dan katekin, Substansi Bukan Fenol (karbohidrat, substansi pektin,
alkaloid, klorofil, protein dan asam amino bebas, asam organik, substansi resin,
vitamin, substansi mineral), Substansi Penyebab Aroma, dan Enzim (Arifin,
1994).
Katekin teh putih (C. sinensis) tersusun sebagian besar atas senyawa –
senyawa katekin (C), epikatekin (EC), epigalokatekin (EGC), epikatekin galat
(ECG) dan epigalokatekin-3-galat (EGCG). Konsentrasi katekin sangat tergantung
pada umur daun. Kandungan katekin berkisar 20-30% dari seluruh berat kering
daun (Rai Nishant et al., 2012).
Menurut Pusat Penelitian Teh dan Kina (2012), manfaat teh putih yaitu:
sangat baik menangkal radikal bebas; menurunkan kolesterol; menurunkan
tekanan darah; dipercaya dapat melindungi jantung; menurunkan kadar gula
darah; dapat menurunkan berat badan; dapat mencegah penuaan dan kerusakan
pada kulit; membakar lemak dan mencegah munculnya sel – sel lemak baru;
mencegah terjadinya mutasi sel penyebab kanker; menjadikan tulang, gigi, dan
gusi lebih kuat; mencegah dan melawan pengaktifan sel usus besar, prostat; serta
membantu kerja ginjal dan mencegah terjadinya batu empedu.
Alasan lain untuk minum teh, terutama teh putih menurut Syukur C (2011)
adalah sangat kaya akan antioksidan, mirip dengan beta – karoten dan vitamin C.
Hal ini disebabkan karena teh mengandung epigallocatechin-3-gallate, yang
dilaporkan memiliki kemampuan 200 kali lebih efektif sebagai antioksidan
daripada vitamin E. Antioksidan dapat membantu mencegah kanker dengan
menyerap radikal bebas, antioksidan sangat baik untuk sistem kekebalan tubuh,
dan antioksidan bahkan telah digunakan untuk mengurangi munculnya keriput.
2.5 Response Surface Analysis
Analisa response surface dilakukan untuk mengetahui kondisi optimal
guna menghasilkan aktivitas yang terbaik. Perancangan eksperimen statistika
merupakan suatu proses perencanaan eksperimen untuk memperoleh data yang
tepat sehingga dapat dianalisa dengan metode statistik serta kesimpulan yang
diperoleh dapat bersifat obyektif dan valid. Salah satu metoda perancangan
eksperimen yang digunakan untuk mengetahui kondisi optimal adalah Metode
Response Surface (Rahardjo, Jani., 2002).
Response Surface Methodology sudah dikenalkan oleh Box dan Wilson
sejak tahun 1951. Dalam buku Design and Analysis of Experiment, Montgomerry
(2001), menjelaskan bahwa Response Surface Methodology atau sering disingkat
dengan RSM, merupakan kumpulan teknik matematis dan statistik yang
digunakan untuk pemodelan dan analisis masalah dalam suatu respon yang
dipengaruhi oleh beberapa variabel dan tujuannya adalah untuk mengoptimasi
respon tersebut. Variabel yang mempengaruhi respon dinamakan variabel bebas
atau sering dinamakan faktor. RSM telah banyak digunakan dalam beberapa
bidang ilmu seperti, ilmu kimia, teknik kimia, teknologi pertanian, ilmu
BAB 3
METODE PENELITIAN
3.1 TEMPAT DAN WAKTU PENELITIAN
Penelitian dilaksanakan di Laboratorium Mikrobiologi Kesehatan, Bidang
Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI)
Cibinong. Waktu pelaksanaan penelitian dimulai pada bulan Maret sampai bulan
Mei 2015.
3.2 ALAT DAN BAHAN 3.2.1 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah gelas beker pyrex®, spatula, Erlenmeyer pyrex®, kertas saring Whatman no.1, membran penyaring 0.2 µm, corong pyrex®, ayakan Mesh 20, lumpang, alu, kain kassa, cawan petri pyrex®, tabung reaksi pyrex®, rak tabung reaksi, pinset, jarum ose, kapas, batang pengaduk, pipet tetes, pipet mikro gilson pipetman dan tube, bunsen, alumunium
foil, plastik wrap, vial, timbangan analitik denver instrument, termometer,
mikroskop nikon H550S, autoklaf hiclaveTM, oven vonavex, vortex maxi mix II, incubator sanyo dan isuzu, microwave sanyo, Laminar Air flow (LAF), lemari
pendingin LG dan polytron, seperangkat alat filtrasi sibata, spektrofotometer
UV-Vis shimadzu, microtitterplate flat-buttom polystyrene 96 wells costar®, iMark-Biorad Microplate Reader.
3.2.2 Bahan Penelitian 3.2.2.1Tanaman Uji
Tanaman teh (C. sinensis) dan kemasan yang berisi 100% daun teh putih
(C. sinensis) diperoleh dari Pusat Penelitian Teh dan Kina (PPTK) di Perkebunan
Gambung, Desa Mekarsari, Kecamatan Pasirjambu, Kabupaten Bandung – Jawa
Barat. Daun teh putih tersebut berbentuk daun kering yang telah diproses oleh
PPTK Gambung dan dikemas siap pakai. Tanaman teh dan kemasan daun teh
3.2.2.2Bakteri Uji
Kultur murni dari S. aureus didapat dari koleksi Laboratorium
Mikrobiologi Kesehatan (LIPI Cibinong) dengan kode strain LK1501. Mikroba
ini diisolasi dari permukaan kulit bagian tangan manusia. Penetapan bakteri uji
dilakukan melalui uji re-identifikasi S. sureus yang terdiri dari pengamatan secara
morfologis, pewarnaan Gram dan reaksi biokimia seperti uji katalase, koagulase,
phosphatase dan deteksi H2S oleh laboratorium mikrobiologi kesehatan (Breed,
Roberto et al., 1957).
3.2.2.3Bahan Lainnya
Akuades steril, etanol 96%, NaCl fisiologis, lugol, safranin, kristal violet 1
%, media heterotrof (HTR) cair, media luria bertani (LB) agar, media kingler iron
agar (KIA), susu skim, H2O2 3%, dan media pelarut fosfat.
3.3 METODE PENELITIAN
3.3.1 Determinasi Teh (C. sinensis)
Tujuan dilakukan determinasi adalah untuk memastikan klasifikasi dari
tanaman yang digunakan dalam penelitian. Determinasi terhadap tanaman teh (C.
sinensis) dilakukan di Herbarium Bogoriense, Pusat Penelitian Biologi, Lembaga
Ilmu Pengetahauan Indonesia (LIPI) – Cibinong.
3.3.2 Karakterisasi dan Penapisan Fitokimia Daun Teh Putih (C. sinensis) 3.3.2.1 Organoleptik
Dilakukan pengamatan secara organoleptik terhadap karakteristik daun
teh putih (C. sinensis) yang digunakan dalam penelitian ini meliputi bentuk, bau
dan rasa.
3.3.2.2 Penapisan Fitokimia
Penapisan fitokimia dilakukan untuk mengetahui metabolit sekunder yang
terkandung di dalam daun teh putih (C. sinensis). Metabolit sekunder yang diuji
secara kualitatif ini antara lain alkaloid (Wagner, Mayer dan Dragendorf), steroid,
14
penelitian ini dilakukan oleh Laboratorium Pusat Studi Biofarmaka, LPPM – IPB,
Bogor. Metode penapisan fitokimia tersebut dapat dilihat pada lampiran 3.
3.3.3 Penyiapan Seduhan dan Karakterisasi Seduhan Daun Teh Putih Pada penelitian ini daun teh putih yang digunakan berada dalam satu
kemasan yang sama dan diseduh sesuai dengan saran penyajian pada kemasan.
Penyiapan daun teh putih pada penelitian ini divariasikan yaitu seduhan 1
menggunakan daun teh kering yang langsung dari kemasan, seduhan 2
menggunakan daun teh putih hasil seduhan pertama dan seduhan 3 menggunakan
daun teh putih yang sebelumnya diserbuk halus dengan cara digiling pada
lumpang alu kemudian diayak dengan ayakan Mesh 20. Bertujuan untuk
mendapatkan hasil seduhan daun teh putih yang memiliki kandungan total fenol
tertinggi untuk digunakan pada uji penghambatan pertumbuhan dan penghancuran
biofilm S. aureus.
Mula – mula tiap variasi daun teh putih ditimbang sebanyak 2 gram, lalu
diseduh menggunakan 100 mL akuades bersuhu 90°C dalam keadaan ditutup dan
diamkan selama 10 menit tanpa di aduk. Setelah diseduh daun teh putih disaring
dengan menggunakan kertas saring untuk memisahkan daun teh dari seduhan lalu
disaring kembali menggunakan membran penyaring berukuran 0.2 µ untuk
menghindari kontaminan. Hasil tiap seduhan dikarakterisasi dengan cara dianalisis
secara kuantitatif kandungan total fenolnya di Laboratorium Pusat Studi
Biofarmaka, LPPM – IPB, Bogor, Jawa Barat. Metode analisis total fenol tersebut
dapat dilihat pada lampiran 4.
Seduhan daun teh putih yang memiliki kandungan total fenol (polifenol)
tertinggi selanjutnya dilakukan penyiapan berbagai seri konsentrasi dengan
dilakukan pengenceran menggunakan akuades steril dengan seri konsentrasi 1%,
2%, 4% dan 8% (v/v) untuk pengujian aktivitas penghambatan pertumbuhan dan
penghancuran biofilm S. aureus. Perhitungan pengenceran tersebut dapat dilihat
3.3.4 Preparasi Bakteri Uji
3.3.4.1Purifikasi dan Karakterisasi Bakteri Uji pada Media Luria Bertani Agar
Tujuan dilakukan purifikasi bakteri uji adalah untuk memurnikan biakan
bakteri uji dari kultur murni S. aureus. Teknik yang digunakan adalah Streak
Plate. Jarum ose dipanaskan terlebih dahulu hingga berpijar, dan didinginkan.
Kemudian bakteri diambil dari kultur murni dan digoreskan pada media luria
bertani agar lalu diinkubasi pada suhu 37°C selama 24 jam (Deby et al., 2010) dan
dilakukan pengamatan secara morfologis terhadap bakteri uji yang telah
dipurifikasi serta dilakukan karakterisasi bakteri dengan pewarnaan Gram.
3.3.4.2Pembuatan Suspensi Bakteri Uji
Diambil sebanyak satu ose bakteri uji yang telah dipurifikasi pada media
luria bertani agar dan dimasukkan ke dalam tabung berisi 10 mL media heterotrof
(HTR) cair dan diinkubasi selama 24 jam pada suhu 37°C. Tabung yang berisi kultur cair bakteri uji divorteks kemudian diukur nilai optical dencity (Absorbansi
OD600) untuk mengetahui konsentrasi suspensi bakteri tersebut (Bjarnsholt,
Thomas et al., 2011). Seluruh pengerjaan preparasi bakteri uji dilakukan secara
aseptis di dalam Laminar Air Flow (LAF) yang sebelumnya telah dibersihkan
dengan alkohol, lalu disterilkan dengan UV yang dinyalakan selama lebih kurang
2 jam sebelum digunakan.
3.3.5 Optimasi Waktu Pembentukan Biofilm S. aureus
Pengujian dilakukan menggunakan microtitierplate flat-bottom
polystyrene 96 wells, dengan cara memasukkan sebanyak 200 µL suspensi bakteri
ke dalam tiap wells kemudian di optimasi waktu inkubasinya. Bertujuan untuk
mendapatkan waktu inkubasi optimal dalam membentuk biofilm. Variasi waktu
inkubasi yang digunakan adalah 1, 2, 3, dan 4 hari. Setelah masa inkubasi,
microplate dicuci menggunakan air mengalir sebanyak 3 kali, kemudian
ditambahkan 200 µL larutan kristal violet 1% ke tiap well dan diinkubasi pada
suhu ruang selama 15 menit. Microplate dicuci kembali dengan menggunakan air
16
tiap well dan diinkubasi pada suhu ruang selama 15 menit. Selanjutnya dilakukan
pembacaan pertumbuhan biofilm (Absorbansi OD595) menggunakan alat
iMark-Biorad Microplate Reader. Pengujian dilakukan triplo dan dikerjakan secara
aseptis di dalam Laminar Air Flow (LAF) yang sebelumnya telah dibersihkan
dengan alkohol, lalu disterilkan dengan UV yang dinyalakan selama lebih kurang
2 jam sebelum digunakan. Hasil nilai absorbansi terbesar dinyatakan sebagai
pembentukan biofilm S. aureus yang optimal. Waktu inkubasi optimal digunakan
untuk kontrol negatif pada uji penghambatan pertumbuhan dan penghancuran
biofilm S. aureus.
3.3.6 Uji Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus Secara In Vitro (Prasasti dan Hertiani, 2010; Sandasi et al., 2010) 3.3.6.1Uji Penghambatan Pertumbuhan dan Perkembangan Biofilm
Tujuan dilakukan uji penghambatan pertumbuhan biofilm adalah untuk
mendapatkan aktivitas seduhan teh putih dalam penghambatan pertumbuhan
biofilm S. aureus. Pengujian dilakukan secara in vitro menggunakan
microtitterplate flat-bottom polystyrene 96 wells. Dilakukan secara aseptis di
dalam Laminar Air Flow (LAF) yang sebelumnya telah dibersihkan dengan
alkohol, lalu disterilkan dengan UV yang dinyalakan selama lebih kurang 2 jam
sebelum digunakan.
Suspensi bakteri uji, seduhan daun teh putih dan media dimasukkan dalam
waktu bersamaan. Ke dalam tiap well dimasukkan media HTR sebanyak 60 µL,
suspensi bakteri uji sebanyak 70 µL dan seduhan daun teh putih sebanyak 70 µL
dengan variasi konsentrasi 1%, 2%, 4%, dan 8% (v/v). Kemudian diinkubasi
selama 2 hari pada suhu 37°C. Setelah masa inkubasi, microplate dicuci menggunakan air mengalir sebanyak 3 kali, kemudian ditambahkan 200 µL
larutan kristal violet 1% ke tiap well dan diinkubasi pada suhu ruang selama 15
menit. Microplate dicuci kembali menggunakan air mengalir sebanyak 3 kali.
Larutan etanol 96% sebanyak 200 µL dimasukkan ke tiap well dan diinkubasi
pada suhu ruang selama 15 menit. Selanjutnya dilakukan pembacaan pertumbuhan
Pengujian dilakukan triplo. Persentase penghambatan dari biofilm S. aureus dapat
diukur dengan rumus sebagai berikut :
% penghambatan =
3.3.6.2Uji Penghancuran Biofilm
Tujuan dilakukan uji penghancuran biofilm adalah untuk mendapatkan
aktivitas seduhan daun teh putih dalam menghancurkan biofilm S. aureus.
Pengujian ini dilakukan sebagaimana pada uji penghambatan pertumbuhan
biofilm, hanya saja seduhan daun teh putih ditambahkan pada biofilm yang telah
terbentuk. Biofilm terbentuk setelah masing-masing wells diinkubasi selama 48
jam pada suhu 37°C dengan jumlah suspensi bakteri uji sebanyak 200 µL media
heterotrof (HTR). Setelah terbentuknya biofilm, suspensi bakteri uji dalam
microplate tersebut dibuang, kemudian dimasukkan seduhan daun teh putih
sebanyak 200 µL dengan variasi konsentrasi 1%, 2%, 4% dan 8% (v/v).
Selanjutnya diinkubasi pada suhu ruang selama 1 jam. Setelah masa inkubasi,
microplate dicuci menggunakan air mengalir sebanyak 3 kali, dan diberi
perlakuan sebagaimana yang telah dilakukan pada uji penghambatan pertumbuhan
biofilm. Persentase penghancuran dari biofilm S. aureus dapat diukur dengan
rumus sebagai berikut :
% penghancuran =
3.3.7 Rancangan Penelitian dan Analisis Data
Penelitian ini merupakan penelitian eksperimental laboratoris dengan
desain penelitian post test only control-group design. Data yang diperoleh dari uji
aktivitas penghambatan dan penghancuran biofilm S. aureus merupakan data
kuantitatif berupa nilai absorbansi atau pertumbuhan biofilm (absorbansi OD595).
Data hasil pengujian aktivitas penghambatan dan penghancuran biofilm seduhan
teh putih (C. sinensis) terhadap biofilm S. aureus dianalisis secara statistik.
18
putih memperlihatkan perbedaan aktivitas penghambatan dan penghancuran
biofilm yang signifikan terhadap biofilm yang dibentuk oleh bakteri S. aureus.
3.3.8 Optimasi Aktivitas Penghancuran Biofilm S. aureus
Pada penelitian ini, optimasi aktivitas penghancuran biofilm S. aureus
dilakukan dengan menggunakan aplikasi metode Response Surface Analysis
(RSA) tiga faktorial dengan jumlah replikasi 1. Tiga faktor yang digunakan
meliputi konsentrasi seduhan daun teh putih, waktu kontak pemberian seduhan
dan suhu inkubasi yang digunakan dalam desain dan analisis eksperimen RSA
divariasikan. Rentang yang digunakan pada konsentrasi seduhan daun teh putih
1% - 8% (v/v), waktu kontak pemberian seduhan daun teh putih 30 menit – 90
menit, dan suhu inkubasi pada suhu 25°C - 50°C. Tujuannya adalah untuk
mengetahui konsentrasi seduhan daun teh putih, waktu kontak dan suhu inkubasi
4.1 Determinasi
Berdasarkan hasil determinasi tanaman pada tanggal 06 Januari 2015
membuktikan bahwa tanaman yang digunakan adalah teh Camellia sinensis (L.)
Kuntze, suku Theaceae. Hasil determinasi tersebut dapat dilihat pada lampiran 7.
4.2 Hasil Karakterisasi dan Penapisan Fitokimia Daun Teh Putih (C. sinensis)
4.2.1 Organoleptik
Daun teh putih yang digunakan pada penelitian ini berada dalam kemasan
yang sama, bertujuan mengurangi variabel pengganggu yang menyebabkan
perbedaan komposisi zat berkhasiat, misalnya perbedaan waktu panen dan lama
penyimpanan. Karakteristik daun teh putih (C. sinensis) yang digunakan dalam
penelitian ini adalah berbentuk panjang, sedikit bengkok dan berujung runcing
menyerupai jarum. Berwarna hijau keperakan mengkilat dari bulu – bulu yang
menyelimutinya. Memiliki bau khas teh dengan rasa hambar saat di hisap dan
sedikit pahit jika dikunyah. Karakteristik daun teh putih yang digunakan pada
penelitian ini dapat dilihat pada gambar 5.
Gambar 5. Karakteristik Daun Teh Putih (C. sinensis) Sumber: Dokumen Pribadi
4.2.2 Penapisan Fitokimia
Kandungan metabolit sekunder pada daun teh putih (C. sinensis) diuji
20
dan Dragendorf), steroid, flavonoid, tanin, saponin, triterpenoid, dan hidrokuinon.
Hasil penapisan fitokimia daun teh putih (C. sinensis) dapat dilihat pada tabel 1.
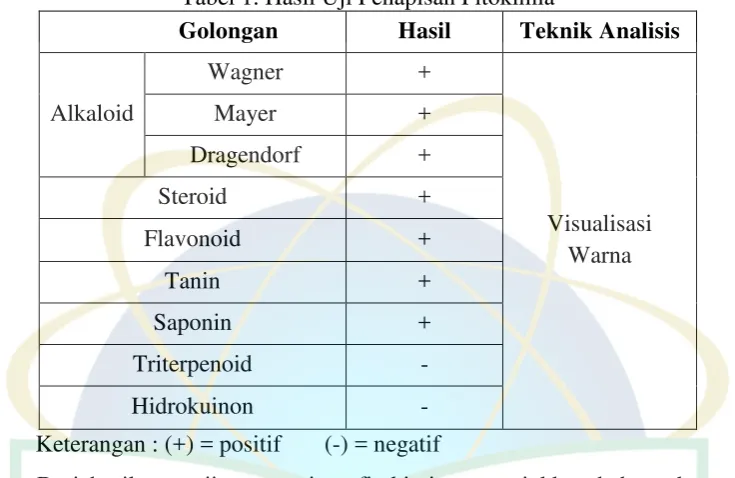
Tabel 1. Hasil Uji Penapisan Fitokimia
Golongan Hasil Teknik Analisis
Alkaloid
Dari hasil pengujian penapisan fitokimia menunjukkan bahwa daun teh
putih (C. sinensis) yang digunakan pada penelitian ini memiliki kandungan
senyawa flavonoid, tanin dan saponin dimana metabolit sekunder tersebut
berpotensi memiliki aktivitas antibiofilm. Menurut J.-H. Lee et al (2013) senyawa
kuersetin (salah satu zat aktif kelas flavonoid, termasuk dalam kelompok
flavonol) dan tanin berpotensi menghambat pembentukan biofilm. Kemampuan
ekstrak tanaman Alnus japonica yang mengandung senyawa kuersetin dan tanin
dapat menghambat ekspresi intercellular adhesion genes icaA dan icaD yang
berperan dalam inisiasi pembentukan biofilm (Cramton et al, 1999 dalam J.-H.
Lee et al, 2013). Sedangkan senyawa saponin dapat mengganggu pembentukan
biofilm dengan cara merusak matriks biofilm, membuat celah pada lapisan lipid
sehingga memungkinkan penembusan (Coleman et al., 2010). Senyawa lain
seperti polifenol dapat menembus biofilm dan melakukan aksi antimikroba.
Polifenol teh atau sering disebut dengan katekin bersifat antimikroba (Syah,
Andi., 2006).
ini dianalisis kandungan total fenol (polifenol total) dalam tiap seduhan secara
kuantitatif dengan metode Follin-ciocalteau di Laboratorium Pusat Studi
Biofarmaka, LPPM – IPB, Bogor, Jawa Barat pada tanggal 16 Maret 2015. Hasil
analisis total fenol tiap seduhan teh putih (C. sinensis) dapat dilihat pada tabel 2.
Tabel 2. Hasil Uji Total Fenol
Nama Sampel Hasil Teknik Analisis Seduhan 1 0,018% (b/v)
Spektrofotometri Seduhan 2 0,025% (b/v)
Seduhan 3 0,028% (b/v)
Dari hasil uji total fenol metode Folin-ciocalteau diatas terlihat pada
seduhan 1 hanya mengandung 0,018% (b/v), dimungkinkan karena daun teh putih
belum terekstrak sempurna. Jika dilihat dari karakteristiknya, daun teh putih
masih dalam bentuk kuncup dan menggulung sehingga kandungan metabolit
sekunder sulit terekstrak keluar dari dalam daun teh dan hanya menghasilkan total
fenol lebih sedikit dibandingkan seduhan lainnya. Pada seduhan 2 menghasilkan
kandungan total fenol yang lebih tinggi dari seduhan satu yaitu sebesar 0,025%
(b/v). Sesuai dengan saran penyajian kemasan, teh putih dapat diseduh ulang
hingga 2-3 kali menggunakan volume air yang sama, ini membuktikan bahwa
daun teh putih masih berkhasiat dan layak dikonsumsi meskipun sebelumnya telah
diseduh. Sedangkan pada seduhan 3 mengandung total fenol yang lebih tinggi dari
seduhan lainnya yaitu mencapai 0,028% (b/v), dimungkinkan karena daun teh
putih terekstrak sempurna karena daun teh putih sebelumnya telah diserbuk halus
dengan cara digiling dalam lumpang dan alu kemudian di ayak dengan ayakan
Mesh 20. Dengan perlakuan sebelumnya ini, sangat disayangkan karena dapat
menghilangkan keunikan dari bentuk daun teh putih meskipun menghasilkan total
fenol yang paling tinggi.
Dari hasil analisis total fenol didapatkan seduhan 3 memiliki polifenol
total yang paling tinggi yaitu 0,028% (b/v). Dipilihnya seduhan yang memiliki
kandungan polifenol total tertinggi karena dimungkinkan memiliki aktivitas
antibiofilm yang lebih baik khususnya dalam aktivitas penghambatan dan
penghancuran biofilm S. aureus. Polifenol dapat diartikan sebagai suatu senyawa
22
gugus aromatik yang terikat satu atau lebih gugus OH. Senyawa dari golongan
polifenol dalam daun teh putih yang digunakan pada penelitian ini, setelah
dilakukan penapisan fitokimia adalah flavonoid dan tanin yang keduanya
berpotensi memiliki aktivitas antibiofilm. Kemudian diseduh dan dianalisis secara
kuantitatif total fenol (polifenol totalnya), dimungkinkaan senyawa flavonoid dan
tanin pada daun teh putih larut selama proses penyeduhan karena senyawa fenol
cenderung mudah larut dalam air. Senyawa saponin juga mudah larut dalam air (J.
B. Harborne, 1987).
Seduhan 3 dijadikan larutan seduhan yang akan digunakan untuk
pengujian penghambatan pertumbuhan dan penghancuran biofilm S. aureus.
Larutan seduhan dianggap konsentrasi 100% karena daun teh putih tidak larut
sempurna dalam larutan penyeduh dan harus disaring untuk memisahkan daun teh
putih dari larutan seduhan dan tidak bisa dipastikan konsentrasi (b/v). Dari larutan
tersebut dibuat seri konsentrasi sebesar 1%, 2%, 4% dan 8% (v/v) dengan cara
dilakukan pengenceran menggunakan akuades steril. Seri konsentrasi seduhan
daun teh putih (C. sinensis) dibuat dengan tujuan untuk mendapatkan aktivitas
antibiofilm khususnya dalam aktivitas penghambatan pertumbuhan dan
penghancuran biofilm meskipun dengan menggunakan konsentrasi yang kecil.
4.4 Preparasi Bakteri Uji
4.4.1 Hasil Purifikasi dan Karakterisasi Bakteri Uji pada Media Luria Bertani Agar
Purifikasi bertujuan untuk memurnikan biakan bakteri uji dari kultur murni
S. aureus. Pada penelitian ini purifikasi bakteri uji menggunakan media luria
bertani (LB) agar selama 24 jam pada suhu 37°C untuk memenuhi kebutuhan
nutrisi bakteri uji sehingga dapat tumbuh dengan baik (J.-H. Lee et al., 2013).
Media LB agar merupakan media pendukung bagi banyak pertumbuhan dan
tersusun dari komponen yang umumnya diperlukan untuk memenuhi kebutuhan
nutrisi mikroorganisme, media LB agar bukan media selektif untuk bakteri S.
aureus (Pratiwi, 2008).
tertanam dalam perbenihan luria bertani agar jika dilihat dari sisi atas koloni –
koloni terlihat bundar, menonjol dan sisi meninggi, koloni berkilau berwarna
kuning tua keemasan dan tumbuh dengan baik pada media LB agar. Hasil
purifikasi bakteri uji pada media luria bertani agar dapat dilihat pada gambar 6.
Gambar 6. Hasil Purifikasi Bakteri S. aureus pada Media LB Agar. Sumber: Dokumen Pribadi
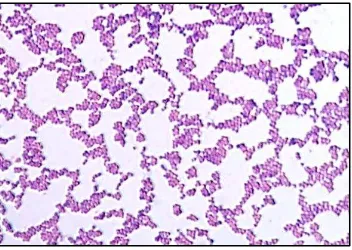
Dari hasil pewarnaan Gram dapat dilihat secara mikroskopik bahwa isolat
bakteri uji yang digunakan menghasilkan warna ungu, berbentuk bulat tidak
beraturan seperti anggur, dan tidak berspora. Dengan pewarnaan Gram, golongan
bakteri ini dapat menyerap dan mempertahankan zat warna kristal ungu pada
peptidoglikan setebal 20 – 80 nm (Mims et al., 1998) dengan komposisi terbesar
teichoic, asam teichuroni, dan berbagai macam polisakarida (Jawetz et al., 2005)
sehingga tidak luruh saat dicuci dengan alkohol 96%. Jadi dapat disimpulkan
isolat yang digunakan adalah benar merupakan bakteri Gram positif yaitu bakteri
S. aureus. Hasil karakterisasi bakteri S. aureus menggunakan pewarnaan Gram
dapat dilihat pada gambar 7.
24
4.4.2 Hasil Suspensi Bakteri Uji
Tabung yang berisi kultur cair bakteri uji yang telah diinkubasi selama 24
jam pada suhu 37°C terlihat lebih keruh dari hari sebelumnya, hal ini menandakan
bakteri uji telah tumbuh dan konsentrasi bakteri uji lebih tinggi dibandingkan
sebelumnya. Selanjutnya divortex selama 1 menit hingga homogen kemudian
diukur nilai Optical Density (Absorbansi OD600) menggunakan alat spektrometer,
kemudian dilakukan pengenceran menggunakan HTR cair hingga mencapai 0,5
(Abs OD600) atau ~108 CFU/mL. Digunakan OD 0,5 pada suspensi bakteri uji karena dapat membentuk biofilm yang baik (kuat) pada nilai OD ≥ 0.5 (Ando et
al., 2004). Selain itu, pada nilai OD 0,5 bakteri S. aureus berada pada tahap
pertengahan fase log (Bjarnsholt, Thomas et al., 2011) dan dalam laju
metabolisme yang cepat. Menurut Pratiwi, Sylvia (2008) fase log (fase
eksponensial) merupakan fase dimana mikroorganisme tumbuh dan membelah
pada kecepatan maksmum, tergantung pada genetika mikroorganisme, sifat
media, dan kondisi pertumbuhan. Sel-baru terbentuk dengan laju konstan dan
massa yang bertambah secara eksponensial.
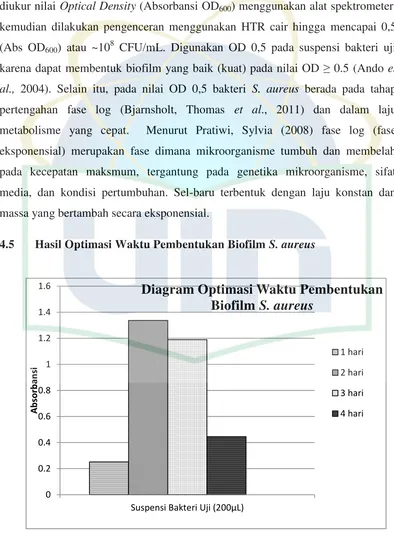
4.5 Hasil Optimasi Waktu Pembentukan Biofilm S. aureus
Sebelum dilakukan uji aktivitas penghambatan pembentukan dan
penghancuran biofilm seduhan daun teh putih (C. sinensis), kultur cair suspensi
bakteri S. aureus harus diuji pertumbuhan biofilm dengan menggunakan metode
Microtitter Plate Biofilm Assay (Absorbansi OD595) tujuannya memastikan bakteri
uji pada waktu inkubasi optimal dapat membentuk biofilm terbaik pada alat uji.
Diagram optimasi waktu pembentukan biofilm S. aureus dapat dilihat pada
gambar 8.
Pada grafik terlihat bakteri S. aureus dapat membentuk biofilm yang baik
dan pembentukan biofilm S. aureus paling optimal pada waktu inkubasi selama 2
hari. Jumlah suspensi bakteri uji yang digunakan sebanyak 200µL karena dapat
membentuk biofilm terbaik sesuai dengan hasil optimasi pembentukan biofilm
terbaik pada uji pendahuluan sebelumnya. Waktu inkubasi optimal dengan
suspensi bakteri uji sebanyak 200µL dijadikan sebagai kontol negatif pada
pengujian aktivitas penghambatan pertumbuhan dan penghancuran biofilm
seduhan daun teh putih (C. sinensis) terhadap biofilm S. aureus.
4.6 Hasil Uji Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus oleh Seduhan Daun Teh Putih (C. sinensis)
Setelah diketahui waktu optimal yang dibutuhkan bakteri S. aureus
membentuk biofilm paling baik, selanjutnya dilakukan uji aktivitas penghambatan
pertumbuhan dan penghancuran biofilm S. aureus oleh seduhan daun teh putih (C.
sinensis). Hasil pengujian pada penelitian ini menunjukkan bahwa seduhan daun
teh putih (C. sinensis) memiliki aktivitas penghambatan pertumbuhan dan
penghancuran biofilm S. aureus dan dapat dilihat pada tabel 3 dan gambar 9.
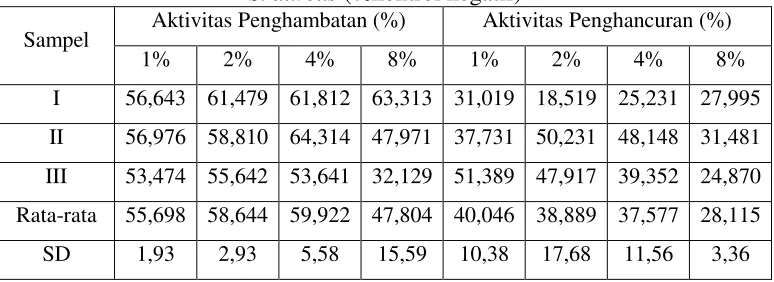
Tabel 3. Hasil Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus (%kontrol negatif)
Sampel Aktivitas Penghambatan (%) Aktivitas Penghancuran (%)
26
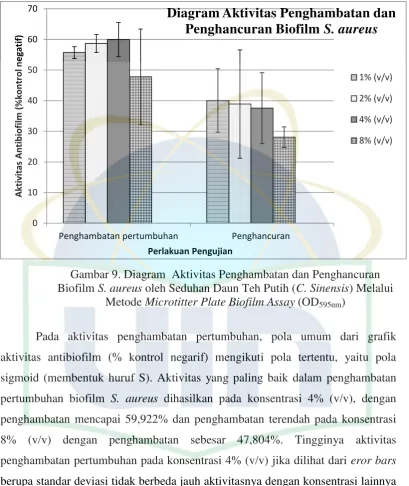
Gambar 9. Diagram Aktivitas Penghambatan dan Penghancuran Biofilm S. aureus oleh Seduhan Daun Teh Putih (C. Sinensis) Melalui
Metode Microtitter Plate Biofilm Assay (OD595nm)
Pada aktivitas penghambatan pertumbuhan, pola umum dari grafik
aktivitas antibiofilm (% kontrol negarif) mengikuti pola tertentu, yaitu pola
sigmoid (membentuk huruf S). Aktivitas yang paling baik dalam penghambatan
pertumbuhan biofilm S. aureus dihasilkan pada konsentrasi 4% (v/v), dengan
penghambatan mencapai 59,922% dan penghambatan terendah pada konsentrasi
8% (v/v) dengan penghambatan sebesar 47,804%. Tingginya aktivitas
penghambatan pertumbuhan pada konsentrasi 4% (v/v) jika dilihat dari eror bars
berupa standar deviasi tidak berbeda jauh aktivitasnya dengan konsentrasi lainnya
dan menunjukkan bahwa seduhan daun teh putih (C. sinensis) memiliki aktivitas
penghambatan pertumbuhan biofilm S. aureus.
Pada penelitian Roccaro et al (2004) dalam Steinmann et al (2012),
menunjukkan bahwa EGCG yang merupakan salah satu bentuk katekin yang
terkandung dalam teh hijau dapat menurunkan produksi lendir dan menghambat
pembentukan biofilm oleh isolat S. aureus dan S. epidermidis dari mata. Hasil ini
2012). Sama halnya dengan teh hijau, teh putih mengandung senyawa katekin
(sering disebut dengan polifenol teh) memiliki aktivitas dalam penghambatan
pembentukan biofilm S. aureus, namun jumlah kandungan katekin di setiap jenis
teh berbeda dan bergantung dengan cara pengolahan daun teh sebelum dilakukan
pengeringan. Selain itu mekanisme aktivitas penghambatan pertumbuhan biofilm
oleh seduhan daun teh putih belum diketahui.
Pada aktivitas penghancuran biofilm S. aureus, terlihat pola umum dari
grafik aktivitas antibiofilm (% kontrol negarif) mengikuti pola tertentu, yaitu pola
linier yang terus menurun dari konsentrasi seduhan rendah ke konsentrasi seduhan
tertinggi. Aktivitas paling baik dihasilkan pada konsentrasi 1% (v/v), dengan
penghancuran mencapai 40,046% dan penghancuran biofilm terendah pada
konsentrasi 8% (v/v) dengan penghancuran sebesar 28,115%. Jika dilihat dari eror
bars berupa standar deviasi pola grafik berbetuk sigmoid dengan titik puncak
pada konsentrasi 2% (v/v), hal ini dimungkinkan konsentrasi 2% (v/v) memiliki
aktivitas penghancuran paling baik namun tidak berbeda jauh aktivitasnya dengan
konsentrasi 1% (v/v) dan konsentrasi 4% sedangkan terlihat berbeda secara nyata
dengan konsentrasi 8% (v/v), dimungkinkan pada konsentrasi 8% (v/v)
merupakan konsentrasi yang terlalu besar sehingga menghasilkan nilai absorbansi
yang tinggi karena adanya senyawa daun teh putih yang tersisa dalam tiap wells.
Hasil pengujian pada penelitian ini menunjukkan bahwa seduhan daun teh putih
(C. sinensis) memiliki aktivitas penghancuran biofilm S. aureus.
Data yang telah diperoleh pada setiap aktivitas seduhan daun teh putih
terhadap penghambatan pertumbuhan dan penghancuran biofilm selanjutnya
dilakukan uji persyaratan. Hasil uji normalitas Kolmogorov-Smirnov
menunjukkan bahwa data terdistribusi normal (p≥0,05). Setelah dilakukan uji
normalitas, dilanjutkan uji homogenitas Levene. Hasil uji homogenitas
menghasilkan data yang homogen (p≥0,05). Hasil uji tersebut menunjukkan nilai
signifikan 0,160 (p≥0,05) untuk aktivitas penghambatan pertumbuhan dan 0,086
(p≥0,05) untuk aktivitas penghancuran biofilm. Hasil uji anova yang dilakukan
menunjukkan nilai signifikan 0,000 (p≤0,05) pada aktivitas penghambatan
pertumbuhan dan 0,006 (p≤0,05) pada aktivitas penghancuran biofilm, ketika
28
yang berbeda secara bermakna terhadap kontrol negatif (p≤0,05) namun tidak
berbeda secara bermakna antar konsentrasi seduhan daun teh putih untuk setiap
aktivitas. Kontrol negatif yang digunakan adalah biofilm S. aureus dengan
menggunakan jumlah kepadatan bakteri uji dan waktu inkubasi optimal
sebelumnya.
4.7 Hasil Optimasi Aktivitas Penghancuran Biofilm S. aureus
Optimasi dilakukan pada aktivitas penghancuran biofilm S. aureus. Hal ini
dilakukan karena bakteri S. aureus telah membentuk biofilm terlebih dahulu dan
berkembang dengan pesat hingga membentuk koloni terutama pada permukaan
yang lembab dan kaya nutrisi (Traver, 2009). Mikroba dapat membuat suatu
pertahanan dengan membentuk biofilm, yaitu suatu lapisan sel mikroba yang
melekat di sebuah permukaan dan tertanam dalam matriks eksopolisakarida yang
dihasilkan sendiri oleh miroorganisme tersebut (Saad Musbah Alasil et al., 2014)
sehingga masalah utama dari kejadian biofilm yaitu lebih diperlukan akivitas
penghancuran biofilm. Oleh karena itu pada penelitian ini dilakukan optimasi
aktivitas penghancuran biofilm S. aureus oleh seduhan daun teh putih (C.
sinensis).
Optimasi aktivitas penghancuran biofilm dilakukan terhadap 3 faktor yaitu
konsentrasi seduhan, waktu kontak pemberian seduhan dan suhu inkubasi yang
didesain dan analisis eksperimen pada Response Surface Analysis (RSA)
bervariasi. Rentang yang digunakan pada konsentrasi seduhan daun teh putih 1% -
8% (v/v), waktu kontak pemberian seduhan daun teh putih 30 menit – 90 menit,
dan suhu inkubasi pada suhu 25°C - 50°C. Pemilihan rentang konsentrasi seduhan
daun teh putih mengikuti uji penghambatan pertumbuhan dan penghancuran
biofilm sebelumnya yaitu dimulai dari 1% sampai dengan 8% (v/v). Sedangkan
rentang waktu kontak pada titik tengah mengikuti uji pada umumnya yaitu selama
60 menit (Prasasti dan Hertiani, 2010) kemudian dimodifikasi yaitu dengan
diturunkan dan ditingkatkan 30 menit, sehingga rentang waktu kontak pemberian
seduhan yang digunakan dimulai dari 30 menit hingga 90 menit. Dan untuk