IMOBILISASI CRUDE ENZIM PAPAIN YANG DIISOLASI DARI GETAH BUAH PEPAYA ( Carica papaya L ) DENGAN MENGGUNAKAN
KAPPA KARAGENAN DAN KITOSAN SERTA PENGUJIAN AKTIVITAS DAN STABILITASNYA
SKRIPSI
OLEH :
EKO WIBISONO 060802013
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
IMOBILISASI CRUDE ENZIM PAPAIN YANG DIISOLASI DARI GETAH BUAH PEPAYA ( Carica papaya L ) DENGAN MENGGUNAKAN
KAPPA KARAGENAN DAN KITOSAN SERTA PENGUJIAN AKTIVITAS DAN STABILITASNYA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
OLEH :
EKO WIBISONO 060802013
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : IMOBILISASI CRUDE ENZIM PAPAIN YANG
DIISOLASI DARI GETAH BUAH PEPAYA (Carica papaya L) DENGAN MENGGUNAKAN
KAPPA KARAGENAN DAN KITOSAN SERTA PENGUJIAN AKTIVITAS DAN STABILITASNYA
Kategori : SKRIPSI
Nama : EKO WIBISONO
Nomor Induk Mahasiswa : 060802013 Program Studi : SARJANA
Departemen : KIMIA
Fakultas :MATEMATIKA DAN ILMU PENGETAHUAN
ALAM ( FMIPA ) UNIVERSITAS SUMATERA UTARA
Disetujui di : Medan, Juli 2010
Komisi Pembimbing :
Pembimbing II Pembimbing I
Prof. Dr. Jamaran Kaban, M.Sc Drs. Firman Sebayang, MS NIP. 19510630 198002 1 001 NIP. 19560726 198503 1 001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU
PERNYATAAN
IMOBILISASI CRUDE ENZIM PAPAIN YANG DIISOLASI DARI GETAH BUAH PEPAYA (Carica papaya L) DENGAN MENGGUNAKAN KAPPA
KARAGENAN DAN KITOSAN SERTA PENGUJIAN AKTIVITAS DAN STABILITASNYA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2010
EKO WIBISONO
PENGHARGAAN
Puji syukur penulis ucapkan kepada ALLAH SWT yang telah memberikan
rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini yang
berjudul “IMOBILISASI CRUDE ENZIM PAPAIN YANG DIISOLASI DARI
GETAH BUAH PEPAYA (Carica papaya L) DENGAN MENGGUNAKAN KAPPA KARAGENAN DAN KITOSAN SERTA PENGUJIAN AKTIVITAS DAN STABILITASNYA”. Dalam kesempatan ini penulis ingin mengucapkan terima kasih kepada :
1. Ibunda Erni Suryani, ayahanda Aboy, adek Agung Satria Mandala, nenek
Rosmini dan kakek Iwan Wijaya yang sangat penulis cintai. Om Rudi
Purnomo, S.E dan Buk Fauziah, S.Ag serta kedua putrinya ( Sofi dan Nisa ),
dan keluarga penulis lainnya atas doa dan bantuannya baik secara material
maupun moril kepada penulis.
2. Bapak Drs. Firman Sebayang, MS selaku komisi pembimbing I dan Bapak
Prof. Dr. Jamaran Kaban, MSc selaku komisi pembimbing II penulis yang
dengan sabar telah meluangkan waktunya untuk membimbing peneliti dalam
melakukan penelitian dan penyusunan skripsi ini hingga selesai.
3. Ketua Departemen Kimia Ibu Dr. Rumondang Bulan, MS serta Sekretaris
Departemen Kimia Bapak Drs. Firman Sebayang, MS. Serta semua Bapak dan
Ibu dosen pengajar di jurusan kimia di FMIPA USU Medan, khususnya
kepada Bapak dan Ibu dosen bidang Biokimia, Prof.Dr.RA. Harlina SPW,Msc,
Dr.Ribu Surbakti,MS, Drs.Firman Sebayang,MS, Dr.Yuniarti Yusak,MS,
Dr.Rumondang Bulan,MSi, Dra. Emma Zaidar,Msi, atas semua ilmu dan saran
yang diberikan.
4. Teman seperjuangan dalam penelitian, Maria Sylvia Harlim yang telah
memberikan bantuan dan semangat kepada penulis (serta teman dalam insiden
ledakan bersama Suwanto Gullit). Juga kepada semua sahabat di Laboratorium
Oki, Decy, Erpina, Kak Pia, Kak Fika, Amy, Reni, Jimmy, Nelvi, Nuraida,
Rani, Ester, Tiwi, Febri, Mardiana dan semua teman-teman di Kimia S-1
stambuk 2006 (yang sangat kompak dan istimewa). Serta Irma dkk di
Laboratorium Farmasi Kuantitatif USU.
5. Skripsi ini khusus saya dedikasikan untuk ayahanda saya yang sangat saya
cintai, yang sampai saat ini tidak diketahui kabarnya dan belum juga kembali.
Semoga ayah selalu sehat dan bahagia. Akhirnya saya telah berhasil
menyelesaikan pendidikan sarjana saya sesuai dengan harapan dan
keinginannya.
6. Dan semua pihak yang tidak dapat penulis sebutkan satu persatu yang telah
banyak memberikan bantuan kepada penulis sehingga penulis dapat
menyelesaikan tulisan ini. Semoga ALLAH SWT akan membalasnya.
Penulis sadar bahwa tulisan skripsi ini jauh dari sempurna, untuk itu penulis
mengharapkan kritik dan saran yang membangun dari Bapak dan Ibu dosen serta
ABSTRAK
ABSTRACT
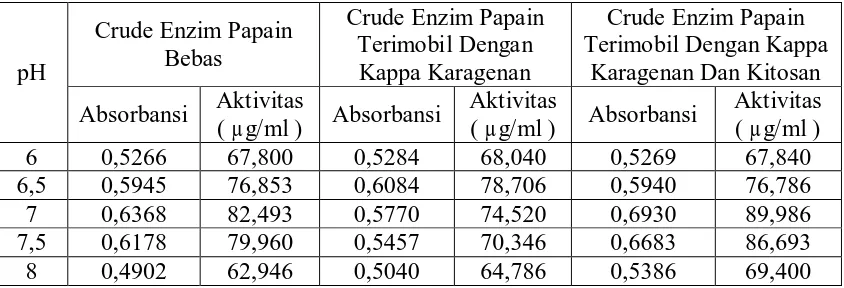
Crude papain enzyme has been isolated from papaya fruit latex (Carica papaya L) with Balls and Lineweaver method, where the crude papain enzyme was immobilized by entrapping the lattice type by using the kappa carrageenan and chitosan, and then tested its activity with the Murachi method. The activity of free crude papain enzyme 82.493 μg/ml at a temperature of 55oC and pH 7, the immobilized crude enzyme papain with kappa carrageenan 78.706 μg/ml at a temperature of 60oC and pH 6.5, and the immobilized crude enzyme papain with kappa carrageenan and chitosan 89.986
DAFTAR ISI
BAB II. TINJAUAN PUSTAKA
2.1. Tanaman Pepaya 5
2.2. Enzim 6
2.3. Enzim Papain 6
2.3.1. Jenis-jenis Enzim Papain 8
2.3.2. Manfaat Enzim Papain 9
2.3.3. Faktor-faktor yang Mempengaruhi Aktivitas Enzim Papain 10
2.4. Kitosan 11
2.4.1. Struktur Kitosan 11
2.4.2. Sifat Kitosan 13
2.4.3. Kegunaan Kitosan 14
2.5. Karagenan 15
2.5.1. Jenis-Jenis Karagenan 15
2.5.2. Kappa Karagenan 17
2.6. Imobilisasi Enzim 17
2.6.1. Sejarah Imobilisasi Enzim 18
2.6.2. Metode Imobilisasi Enzim 19
BAB III. BAHAN DAN METODE PENELITIAN
3.1. Alat-Alat 21
3.2. Bahan-Bahan 21
3.3. Prosedur Penelitian 23
3.3.1. Pembuatan Larutan Pereaksi 23
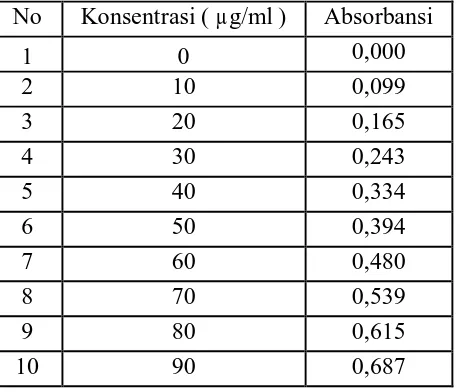
3.3.2. Pembuatan Kurva Kalibrasi Tyrosin 25
Metode Biuret
3.3.4. Preparasi Sampel Getah Buah Pepaya ( Carica papaya L ) 26 3.3.5. Isolasi Crude Enzim Papain dari Getah Buah Pepaya 26
( Carica papaya L )
3.3.6. Penentuan Kadar Protein Crude Enzim Papain Metode Biuret 26
3.3.7. Imobilisasi Crude Enzim Papain 26
3.3.8. Penentuan Kadar Crude Enzim Papain Yang Tidak Terimobilisasi 27 3.3.9. Pengujian Suhu dan pH Optimum Aktivitas Crude Enzim Papain 27 3.3.10. Pengujian Aktivitas Crude Enzim Papain Bebas dan Terimobil 28
Pada Suhu dan pH Optimumnya
3.3.11. Pengujian Stabilitas Crude Enzim Papain Terimobil Pada 29 Pemakaian Berulang
3.4. Bagan Penelitian 30
3.4.1. Pembuatan Kurva Kalibrasi Tyrosin 30
3.4.2. Pembuatan Kurva Kalibrasi Bovin Serum Albumin (BSA) 31 Metode Biuret
3.4.3. Preparasi Sampel Getah Buah Pepaya ( Carica papaya L ) 31 3.4.4. Isolasi Crude Enzim Papain dari Getah Buah Pepaya 32
( Carica papaya L )
3.4.5. Penentuan Kadar Protein Crude Enzim Papain Metode Biuret 32
3.4.6. Imobilisasi Crude Enzim Papain 33
3.4.7. Penentuan Kadar Crude Enzim Papain Yang Tidak Terimobilisasi 35 3.4.8. Pengujian Suhu dan pH Optimum Aktivitas Crude Enzim Papain 36 3.4.9. Pengujian Aktivitas Crude Enzim Papain Bebas dan Terimobil 38
Pada Suhu dan pH optimumnya
3.4.10. Pengujian Stabilitas Crude Enzim Papain Terimobil Pada 39 Pemakaian Berulang
BAB IV. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 41
4.1.1. Isolasi Crude Enzim Papain Dari Getah Buah Pepaya 41
4.1.2. Imobilisasi Crude Enzim Papain 42
4.1.2.1. Imobilisasi Crude Enzim Papain Dengan Kappa 42 Karagenan
4.1.2.2. Imobilisasi Crude Enzim Papain Dengan Kappa 43 Karagenan Dan Kitosan
4.1.3. Pengujian Aktivitas Crude Enzim Papain Bebas dan Crude Enzim 44 Papain Terimobil
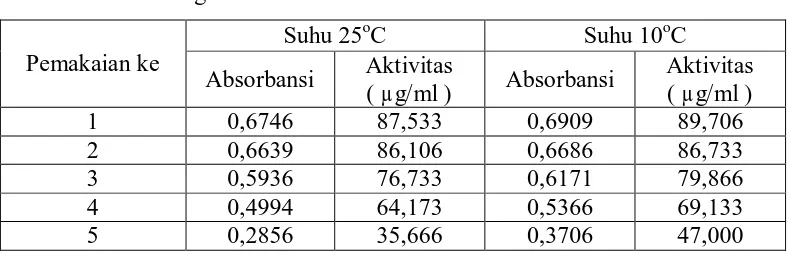
4.1.4. Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim 45 Papain Terimobil pada Pemakaian Berulang
4.2. Pembahasan 46
4.2.1. Isolasi Crude Enzim Papain Dari Getah Buah Pepaya 46
4.2.2. Imobilisasi Crude Enzim Papain 46
4.2.3. Pengujian Aktivitas Crude Enzim Papain Bebas dan Crude Enzim 48 Papain Terimobil
4.2.3.1. Pengaruh Suhu Terhadap Aktivitas Crude Enzim Papain 48 4.2.3.2. Pengaruh pH Terhadap Aktivitas Crude Enzim Papain 49 4.2.4. Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim 50
BAB V. KESIMPULAN DAN SARAN
5.1. Kesimpulan 53
5.2. Saran 53
DAFTAR PUSTAKA 54
DAFTAR GAMBAR
Gambar 1. Struktur Kitosan 12
Gambar 2. Kappa karagenan 16
Gambar 3. Iota karagenan 16
Gambar 4. Lamda karagenan 16
Gambar 5. Metode carrier binding 19
Gambar 6. Metode ikat silang 20
Gambar 7. Metode penjebakan tipe kisi 20
Gambar 8. Metode penjebakan tipe mikrokapsul 20
Gambar 9. Pengaruh suhu terhadap aktivitas crude enzim papain 48
Gambar 10. Pengaruh pH terhadap aktivitas crude enzim papain 49
Gambar 11. Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim 51
Papain Terimobil dengan Kappa Karagenan pada Pemakaian
Berulang
Gambar 12. Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim 51
Papain Terimobil dengan Kappa Karagenan dan Kitosan Pada
DAFTAR TABEL
Tabel 1. Penggolongan enzim secara internasional berdasarkan reaksi 6
yang dikatalisisnya
Tabel 2. Pembuatan Larutan Buffer Phosfat pH 6-8 24
Tabel 3. Data Absorbansi Larutan Standar Bovin Serum Albumin ( BSA ) 41
Tabel 4. Kadar Protein Crude Enzim Papain 42
Tabel 5. Kadar Crude Enzim Papain Yang Tidak Terimobilisasi Dengan Kappa 42
Karagenan
Tabel 6. Kadar Crude Enzim Papain Yang Tidak Terimobilisasi Dengan Kappa 43
Karagenan dan Kitosan
Tabel 7. Data Absorbansi Larutan Seri Standar Tyrosin 44
Tabel 8. Data Pengaruh Suhu Terhadap Aktivitas Crude Enzim Papain Bebas 45
dan Terimobil
Tabel 9. Data Pengaruh pH Terhadap Aktivitas Crude Enzim Papain Bebas dan 45
Terimobil
Tabel 10. Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim Papain 46
Terimobil Dengan Kappa Karagenan Pada Pemakaian Berulang
Tabel 11. Data Pengaruh Suhu Penyimpanan Terhadap Aktivitas Crude Enzim 46
Papain Terimobil Dengan Kappa Karagenan dan Kitosan Pada
Pemakaian Berulang
Tabel 12. Aktivitas Crude Enzim Papain Bebas Dan Terimobil 47
Tabel 13. Penurunan Persamaan Garis Regresi Metode Least Square kurva 57
Kalibrasi
Tabel 14. Penurunan Persamaan Garis Regresi Metode Least Square kurva 58
DAFTAR LAMPIRAN
Lampiran 1. Pengolahan Data Hasil Pengukuran Bovin Serum Albumin 57
( BSA )
Lampiran 2. Pengolahan Data Hasil Pengukuran Tyrosin 58
Lampiran 3. Kurva spektrum λmaks
Lampiran 4. Kurva kalibrasi larutan standar tyrosin 60
larutan standar tyrosin 59
Lampiran 5. Kurva spektrum λmaks
Lampiran 6. Kurva kalibrasi larutan standar bovin serum albumin ( BSA ) 61 larutan standar bovin serum albumin ( BSA ) 60
Lampiran 7. Penentuan Operating Time Untuk Pengukuran Absorbansi Larutan 61
ABSTRAK
ABSTRACT
Crude papain enzyme has been isolated from papaya fruit latex (Carica papaya L) with Balls and Lineweaver method, where the crude papain enzyme was immobilized by entrapping the lattice type by using the kappa carrageenan and chitosan, and then tested its activity with the Murachi method. The activity of free crude papain enzyme 82.493 μg/ml at a temperature of 55oC and pH 7, the immobilized crude enzyme papain with kappa carrageenan 78.706 μg/ml at a temperature of 60oC and pH 6.5, and the immobilized crude enzyme papain with kappa carrageenan and chitosan 89.986
BAB I
PENDAHULUAN
1.1.Latar Belakang
Pepaya ( Carica papaya L.) merupakan tanaman yang berasal dari Amerika tropis.
Batang, daun, dan buah pepaya muda mengandung getah berwarna putih. Getah ini
mengandung suatu enzim pemecah protein atau enzim proteolitik yang disebut papain
( Moehd, 1999 ).
Papain adalah suatu zat ( enzim ) yang dapat diperoleh dari getah tanaman
pepaya dan buah pepaya muda. Getah pepaya tersebut terdapat hampir di semua
bagian tanaman pepaya, kecuali bagian akar dan biji. Kandungan papain paling
banyak terdapat dalam buah pepaya yang masih muda. Getah pepaya ( papain ) cukup
banyak mengandung enzim yang bersifat proteolitik ( pengurai protein ). Sehingga
tepung getah pepaya kering ( papain ) banyak digunakan oleh para pengusaha industri
maupun ibu-ibu rumah tangga untuk mengolah berbagai macam produk.
Adapun enzim proteolitik bersifat menyerang bahan-bahan protein dalam
makanan. Bila enzim ini dicampurkan dalam makanan maka protein makanan akan
terpecah-pecah menjadi peptida, yang selanjutnya akan terpecah-pecah lagi menjadi
bentuk-bentuk yang lebih sederhana yang disebut asam amino.
Sebenarnya enzim proteolitik ( protease / pengurai protein ) tidak hanya
terdapat dalam getah papaya, melainkan juga terdapat dalam getah pohon pinus
(disebut fisin) dan sari buah nenas ( disebut bromelin ). Enzim proteolitik yang lain
dihasilkan dari lambung anak sapi ( disebut rennin ). Namun, dari semua jenis enzim
protease tersebut, papain paling banyak digunakan karena lebih mudah didapat dengan
harga relatif murah.Selain dengan cara membeli, papain dapat diperoleh dengan cara
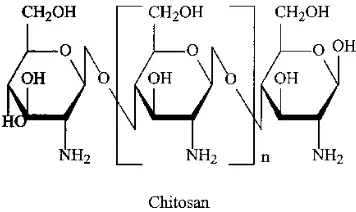
Kitosan adalah suatu rantai linear dari Glukosamin dan N-Asil
D-Glukosamin yang terangkai pada posisi β (1-4). Kitosan dihasilkan dari deasetilasi
kitin. Karena dalam bentuk kationik, bentuk kitosan yang tidak larut dalam air akan
membentuk polielektronik dengan anion polielektronik. Kitosan telah digunakan
dalam bidang biomedikal dan farmasi karena kitosan bersifat biokompatibel,
biodegradasi dan tidak beracun ( Adriana et al., 2003 ).
Kappa karagenan memiliki struktur D-galaktose dan beberapa gugus 2-sulfate
ester pada 3,6 anhydro-D-galaktose yang ditunjukan gambar 2. Gugus 6-sulfate ester
mengurangi daya kekuatan gel namun dapat mengurangi kerusakan akibat
pengolahan dengan menggunakan basa. Hal ini akan memberikan keteraturan rantai
yang lebih baik (
Kemajuan bidang bioteknologi dan industri, memungkinkan dilakukannya
berbagai upaya untuk memanfaatkan proses-proses enzimatis. Enzim mempunyai sifat
yang potensial untuk dimanfaatkan, antara lain daya katalitiknya yang besar dan
spesifitasnya terhadap substrat dari reaksi yang dikatalisisnya ( Lehninger, 1990 ).
Pada proses dan analisa yang melibatkan enzim, umumnya menggunakan cara
bath yaitu mereaksikan substrat dengan enzim yang sudah dilarutkan dalam air,
sehingga enzim bercampur dengan substrat ( Sarah, 2001 ).
Cara ini memiliki kelemahan karena enzim hanya digunkan sekali pakai.
Secara teknis sangat sulit untuk memisahkan enzim dan produk dan mendapatkan
kembali enzim yang aktif diakhir reaksi. Umumnya setelah reaksi selesai, enzim
diinaktifkan dengan pemanasan, pengubahan pH,atau cara lain yang menyebabkan
enzim terdenaturasi ( Chibata, 1978 ).
Salah satu cara mengatasi kelemahan dalam penggunaan enzim tersebut adalah
melalui imobilisasi enzim yaitu mengikatkan enzim pada bahan pendukung yang tidak
larut dalam air. Enzim dapat membentuk ikatan ionik, kovalen, ikatan silang atau
terjebak pada bahan pendukung. Pada saat digunakan, enzim imobil dapat berfungsi
sebagai katalis tanpa ikut terlarut dalam substrat ( Darwis et al., 1990 ).
Metode penjebakan enzim dilakukan kebanyakan dengan menggunakan
karagenan (sejenis polisakarida yang diekstrak dari rumput laut merah) (Chibata,
Firman Sebayang (1993) telah meneliti Isolasi, Karakterisasi serta Amobilisasi
Enzim Bromelin dari Limbah Bonggol Nenas. Kiling (2002) telah meneliti Imobilisasi
Papain dengan Kitosan dengan Metode Adsorpsi dan Pengikatan Silang dengan
Gutaraldehid. Namun enzim terimobilisasi tersebut menunjukkan nilai aktivitas
spesifik yang rendah. Sari Edi Cahyaningrum (2007) telah meneliti Pemakaian
Kitosan Limbah Udang Windu sebagai Matriks Pendukung pada Imobilisasi Papain.
Tontowi Ismail ( 2009 ) telah meneliti Etanol dari Molases Mengunakan Zymomonas
mobilis yang Diamobilisasi dengan K-karaginan Pada Reaktor Kontinyu
Berdasarkan hal tersebut peneliti ingin mengisolasi crude enzim papain dari
getah buah pepaya dan diimobilisasi dengan menggunakan kappa karagenan serta
dengan menggunakan kappa karagenan dan kitosan serta pengujian aktivitas dan
stabilitasnya, sehingga crude enzim papain terimobil yang dihasilkan dapat digunakan
berulang-ulang.
1.2.Permasalahan
1. Bagaimanakah perbandingan aktivitas crude enzim papain bebas dengan crude
enzim papain yang diimobilisasi dengan menggunakan kappa karagenan serta
dengan menggunakan kappa karagenan dan kitosan
2. Berapa kali crude enzim papain terimobil tersebut dapat digunakan secara
berulang-ulang sebelum mengalami kerusakan
3. Bagaimana pengaruh suhu penyimpanan terhadap perubahan aktivitas crude
enzim papain terimobil.
1.3.Pembatasan Masalah
Perbandingan aktivitas dan stabilitas crude enzim papain bebas dengan crude enzim
papain yang diimobilisasi dengan kappa karagenan dan dengan kappa karagenan dan
kitosan pada suhu dan pH optimumnya.
1.4.Tujuan Penelitian Penelitian ini bertujuan :
1. Untuk mengetahui aktivitas crude enzim papain bebas dan crude enzim papain
yang diimobilisasi dengan kappa karagenan serta dengan kappa karagenan dan
2. Untuk mengetahui berapa kali crude enzim papain terimobil tersebut dapat
digunakan secara berulang-ulang sebelum mengalami kerusakan
3. Untuk mengetahui bagaimana pengaruh suhu penyimpanan terhadap aktivitas
crude enzim papain terimobil.
1.5.Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan crude enzim papain terimobil yang
praktis dan bernilai ekonomis, sehingga dapat meningkatkan efisiensi penggunaan
enzim papain dalam bidang bioteknologi dan industri serta dapat memberikan
sumbangan bagi pemanfaatan polimer alam, khususnya kitosan dan kappa karegenan.
1.6.Metodologi Penelitian
Metodelogi penelitian yang digunakan adalah :
Isolasi crude enzim papain dari getah buah pepaya dengan metode Balls dan
Lineweaver, kemudian crude enzim papain ini diimobilisasi dengan metode
penjebakan berbentuk penjebakan kisi atau matriks dengan menggunakan kappa
karagenan serta dengan menggunakan kappa karagenan dan kitosan. Kemudian diuji
aktivitasnya dengan metode Murachi yang dilakukan dengan memvariasikan suhu dan
pH, dimana suhu dan pH optimumnya digunakan untuk pengujian aktivitas dan
stabilitas crude enzim papain terimobil terhadap pemakaian berulang, sehingga dapat
diketahui sampai pemakaian keberapa crude enzim papain terimobil tersebut masih
mempunyai aktivitas.
1.7.Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia / KBM dan pengukuran
absorbansinya dilakukan di Laboratorium Farmasi Kuantitatif, Fakultas Farmasi USU
BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Pepaya
Dalam sistematika (taksonomi) tumbuh-tumbuhan, tanaman pepaya ( Carica papaya )
diklasifikasikan sebagai berikut
Kingdom : Plantae ( tumbuh-tumbuhan )
Divisio : Spermatophyta ( tumbuhan berbiji )
Subdivisio : Angiospermae ( berbiji tertutup )
Class : Dicotyledonae ( biji berkeping dua )
Ordo : Caricales
Familia : Caricaceae
Genus : Carica
Species : Carica papaya L.
Pepaya ( Carica papaya L.) merupakan tanaman yang berasal dari Amerika
tropis. Buah pepaya tergolong buah yang popular dan digemari oleh hampir seluruh
penduduk penghuni bumi ini. Batang, daun, dan buah pepaya muda mengandung
getah berwarna putih. Getah ini mengandung suatu enzim pemecah protein atau enzim
proteolitik yang disebut papain ( Moehd, 1999 ).
Hampir semua bagian tanaman pepaya dapat dimanfaatkan, mulai dari daun,
batang, akar, maupun buah. Getah pepaya yang paling banyak terkandung didalam
buah pepaya jenis pepaya Bangkok. Getah pepaya yang sering disebut sebagai papain
dapat digunakan untuk berbagai macam keperluan, antara lain : penjernih bir,
pengempuk daging, bahan baku industri penyamak kulit, serta digunakan dalam
industri farmasi dan kosmetika (kecantikan). Papain merupakan enzim proteolitik,
2.2. Enzim
Kata enzim diperkenalkan oleh Kuhne pada tahun 1878 untuk suatu zat yang bekerja
pada suatu substrat. Kata enzim berasal dari bahasa Yunani yang berarti di dalam sel.
Kuhne menjelaskan bahwa enzim bukan suatu sel tetapi terdapat di dalam sel. Definisi
yang dikemukakan adalah enzim merupakan protein yang mempunyai daya katalitik
karena aktivitas spesifiknya ( Dixon, 1979 ). Enzim secara biokimia merupakan suatu
kelompok protein yang berperan sangat penting dalam proses aktivitas biologis.
Tugasnya sebagai katalisator di dalam sel dan bersifat khas. Kerja enzim umumnya
mempercepat reaksi dengan cara menurunkan energi aktivasi ( Lehninger, 1993 ).
Klasifikasi enzim didasarkan pada jenis reaksi yang dikatalisisnya, seperti
direkomendasikan oleh Commision on Enzyme of the International Union of
Biochemistry ( CEIUB ). Menurut sistem ini, enzim dibagi lagi menjadi beberapa sub
golongan. Penamaan enzim diawali dengan nama substrat, diikuti oleh macam reaksi
yang dikatalisis dan akhiran –ase ( Muchtadi et al., 1992 ). Adapun keenam golongan
enzim tersebut dan reaksi yang dikatalisisnya dapat dilihat pada tabel 1.
Tabel 1. Penggolongan enzim secara internasional berdasarkan reaksi yang
dikatalisisnya
No Kelas Utama Jenis reaksi yang dikatalisis
1 Oksidoreduktase Pemindahan electron
2 Transferase Reaksi pemindahan gugus fungsional
3 Hidrolase Reaksi hidrolisis (pemindahan gugus fungsional ke air)
4 Liase Penambahan gugus ke ikatan ganda atau sebaliknya
5 Isomerase Pemindahan gugus di dalam molekul menghasilkan isomer
6 Ligase Pembentukan ikatan C-C, C-S, C-O dan C-N oleh reaksi kondensasi yang berkaitan dengan penguraian ATP
Sumber : Lehninger ( 1993 )
2.3.. Enzim Papain
Papain adalah suatu zat ( enzim ) yang dapat diperoleh dari getah tanaman pepaya dan
buah pepaya muda. Getah pepaya tersebut terdapat hampir di semua bagian tanaman
pepaya, kecuali bagian akar dan biji. Kandungan papain paling banyak terdapat dalam
enzim yang bersifat proteolitik ( pengurai protein ). Sehingga tepung getah pepaya
kering ( papain ) banyak digunakan oleh para pengusaha industri maupun ibu-ibu
rumah tangga untuk mengolah berbagai macam produk ( Warisno, 2003 ).
Papain merupakan enzim proteolitik hasil isolasi dari penyadapan getah buah
pepaya (Carica papaya L.). Getah pepaya mengandung sebanyak 10% papain, 45%
kimopapain dan lisozim sebesar 20% (Winarno, 1995).
Berdasarkan sifat-sifat kimianya, papain digolongkan sebagai protease
sulfhidril (Muchtadi et al., 1992). Papain tersusun atas 212 residu asam amino dengan
sistein-25 tempat gugus aktif thiol (-SH) essensial, yang membentuk sebuah rantai
peptida tunggal dengan bobot molekul 21.000 - 23.000 g/mol. Rantai ikatan tersebut
tersusun atas arginin, lisin, leusin, dan glisin (Harrison et al., 1997). Sisi aktif yang
terdapat di dalam molekul papain terdiri atas gugus histidin dan sistein yang selama
katalisis berlangsung, sisi aktif tersebut berfungsi sebagai ion zwitter (Wong, 1989
diacu dalam Budiman, 2003).
Papain mengandung 212 asam amino dalam suatu rantai polipeptida dan
berikatan silang dengan tiga jembatan disulfida (Kalk, 1975). Berbagai jenis asam
amino ikut menyusun struktur protein papain kecuali metionin. Tidak terdapatnya
metionin dalam rantai polipeptida diduga karena komponen sulfur sebagian besar
berada dalam bentuk asam amino sistein (Glazer, 1971 diacu dalam Muchtadi et al.,
1992). Papain memiliki 6 gugus sulfhidril, tetapi hanya dua gugus sulfhidril yang
aktif. Gugus suflhidril ini mengandung unsur sulfur sekitar 1,2%.
Berdasarkan klasifikasi the international union of biochemistry, papain
termasuk enzim hidrolase yang mengkatalisis reaksi hidrolisis suatu substrat dengan
pertolongan molekul air. Aktivitas katalisis papain dilakukan melalui hidrolisis yang
berlangsung pada sisi-sisi aktif papain. Pemisahan gugus-gugus amida yang terdapat
di dalam protein tersebut berlangsung melalui pemutusan ikatan peptida (Wong, 1989
diacu dalam Budiman, 2003). Enzim ini mempunyai aktivitas katalitik sebagai
proteinase dan sanggup menghidrolisis peptida. Berdasarkan sifat-sifat kimia dari
lokasi aktif, papain termasuk protease sulfhidril, karena bagian aktif papain adalah
gugus –SH (Reed, 1975).
Aktivitas enzim papain cukup spesifik karena papain hanya dapat
mengkatalisis proses hidrolisis dengan baik pada kondisi pH serta suhu dalam kisaran
arginil etil ester), pH 6,5 pada substrat kasein, pH 7,0 pada albumin dan pH 5,0 pada
gelatin (Muchtadi et al., 1992). Suhu optimal papain sendiri adalah 50-60 o
Selain pepaya dikenal beberapa jenis tanaman lain yang menghasilkan enzim
protease. Komposisi dan daya aktif masing-masing enzim tersebut akan berbeda.
Berikut ini beberapa jenis tanaman penghasil enzim protease berikut nama enzimnya, C. Papain
relatif tahan terhadap suhu, bila dibandingkan dengan enzim proteolitik lainnya seperti
bromelin dan lisin (Winarno, 1995).
1. Tanaman nenas menghasilkan enzim bromelain
2. Tanaman cemara atau ficus menghasilkan enzim ficin
3. Tanaman Bromelia penguin menghasilkan enzim penguinain
4. Tanaman Asclepia menghasilkan enzim asclapain
Sebagai enzim proteolitik, papain memiliki nilai ekonomi tinggi dan banyak
digunakan dalam industri besar. Meskipun telah diketahui ada beberapa enzim
protease yang dihasilkan dari tanaman lain, ternyata papain merupakan enzim yang
paling banyak dan paling sering digunakan. Oleh karenanya, potensi pasar papain
dalam perdagangan dunia masih cukup besar ( Moehd, 1999 ).
Enzim papain dari getah pepaya dapat disadap dari buahnya yang berumur
2,5-3 bulan dimana dapat digunakan untuk pengempukan daging disamping sebagai
penjernih pada industri minuman bir, industri tekstil, industri penyamakan kulit,
industri farmasi dan alat-alat kecantikan ( kosmetik ). Enzim papain memiliki daya
tahan terhadap panas. Suhu optimumnya berkisar 60-70oC. Aktivitasnya berkurang
sekitar 20% pada pemanasan 70oC selama 30 menit pada pH 7. Papain menghidrolisis
serabut otot dan elastin lebih baik dari kolagen. Papain cocok dipergunakan sebagai
pengempukan daging karena aktif pada keadaan pH daging
(http://muhines.blogspot.com).
2.3.1. Jenis-jenis Enzim Papain
Dalam dunia perdagangan, dikenal dua macam papain, yaitu papain kasar ( crude
papain ) dan papain murni ( crystal papain ). Papain kasar ( crude papain ) adalah
getah pepaya yang telah dikeringkan, kemudian dihaluskan hingga menjadi
benrbentuk tepung. Metode-metode yang dapat digunakan dalam isolasi crude enzim
papain ada tiga cara, yaitu Cara Peckolt, Cara Walt dan Cara Balls dan Lineweaver.
baik adalah cara Balls dan Lineweaver. Dan persen rendemennya selanjutnya dapat
ditentukan. Papain murni ( crystal papain ) adalah hasil pemisahan dan pemurnian
papain kasar menjadi empat macam protein proteolitik, yaitu papain, chimopapain A,
chimopapain B, dan papaya peptidase ( Warisno, 2003 ).
Oleh karena sifat chimopapain A dan chimopapain B sifatnya agak mirip,
maka keduanya dapat disebut sebagai chimopapain saja. Keempat jenis enzim
proteolitik tersebut biasanya disebut papain saja atau papain kasar. Sifat daya
enzimatis papain kasar ini sangat tinggi karena terdiri dari gabungan keempat enzim
tersebut.Papain murni adalah hasil pemisahan pemurnian papain kasar menjadi
keempat enzim proteolitik diatas. Papain murni banyak digunakan dalam industri
farmasi ( Moehd, 1999 ).
2.3.2. Manfaat Enzim Papain
Adapun sifat enzim proteolitik adalah senang menyerang bahan-bahan protein dalam
makanan. Bila enzim ini dicampurkan dalam makanan maka protein makanan akan
terpecah-pecah menjadi peptida, yang selanjutnya akan terpecah-pecah lagi menjadi
bentuk-bentuk yang lebih sederhana yang disebut asam amino ( Warisno, 2003 ).
Berbagai penelitian kini sedang dilakukan dalam usaha pemanfaatan enzim
papain atau enzim sejenis lainnya pada bidang-bidang industri lain yang belum
digunakan. Prospek pemasaran papain tampaknya kian cerah.
Sejak dulu, penduduk asli di Amerika Tengah dan Amerika Selatan-tempat
tanaman pepaya banyak tumbuh secara liar-telah mengenal manfaat getah pepaya
sebagai pelunak daging. Demikian juga di Indonesia, pemanfaatan getah pepaya
sebagai pelunak daging sudah dikenal sejak dulu. Cara yang umum digunakan adalah
dengan membungkus daging tersebut beberapa saat dengan daun-daun pepaya yang
telah dicacah. Setelah itu, barulah daging dimasak.
Saat ini, enzim papain sebagai pelunak daging mudah dibeli di pasar-pasar,
terutama di pasar swalayan di kota-kota besar. Untuk pelunak daging, pemakaian
papain sangat mudah digunakan. Setelah ditusuk-tusuk dengan garpu, daging ditaburi
dengan tepung papain dan baru kemudian dimasak. Cara lain yang dapat dilakukan
adalah dengan merendam daging dalam larutan papain. Penusukan dengan garpu atau
Pada kenyataannya yang paling banyak menggunakan papain adalah industri
minuman, tepatnya industri pembuatan bir. Bir yang dibuat tanpa menggunakan
papain menjadi tidak jernih dan berkabut bila disimpan dalam keadaan dingin. Selain
itu, beberapa industri lain juga memanfaatkan daya enzimatis papain ini. Industri
makanan yang menggunakan papain diantaranya industri keju, pengembangan kue,
biskuit dan roti. Industri makanan ternak menggunakan papain untuk menghasilkan
konsentrat protein ikan.Industri farmasi menggunakan papain untuk pengobatan
penderita gangguan saluran pencernaan, penderita dispepsia, dan gastritis
Penggunaan papain pada daging akan menambah nikmat rasa daging. Daging
akan menjadi empuk sehingga mudah dipotong, digigit dan dikunyah. Selain itu,
daging akan mudah dicerna sehingga nilai gizi protein daging yang diserap tentunya
akan meningkat ( Moehd, 1999 ).
2.3.3. Faktor-faktor yang Mempengaruhi Aktivitas Enzim Papain Keefektifan enzim papain ini dipengaruhi oleh :
1) Konsentrasi enzim
Enzim papain mempunyai kemampuan untuk melunakkan daging dan
menghidrolisis ikatan peptida dari protein. Tingginya konsentrasi enzim yang
digunakan akan mempengaruhi banyaknya substrat yang dapat ditransformasi
(Girindra, 1993). Konsentrasi enzim yang berlebihan akan menyebabkan proses
tersebut menjadi tidak efisien. Derajat kemurnian enzim papain yang tinggi,
mempunyai hubungan linear dengan jumlah enzim dan taraf aktivitas (Lehninger,
1993).
2) Suhu
Reaksi yang dikatalisis oleh enzim sangat peka terhadap suhu. Enzim sebagai
protein akan mengalami denaturasi pada suhu yang tinggi sehingga
mengakibatkan daya kerja enzim tersebut menurun (Girindra, 1993). Enzim akan
semakin aktif apabila suhu dinaikkan (sampai suhu optimumnya), tetapi bila suhu
tersebut terus dinaikkan maka laju kerusakan enzim akan melampaui reaksi
katalisis enzim sehingga menyebabkan reaksi tidak efisien (Winarno, 1987).
3) pH
Enzim menunjukkan aktivitas maksimum pada suatu kisaran pH yang disebut pH
melakukan aktivitasnya. Enzim akan mengalami denaturasi dan mengakibatkan
kehilangan aktivitasnya apabila enzim bekerja di bawah atau di atas selang pH
tersebut. Derajat keasaman (pH) sangat berpengaruh terhadap aktivitas enzim,
karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi oleh pH.
pH ini juga menyebabkan daerah katalitik dan konformasi enzim menjadi berubah
(Lehninger, 1993).
4) Pengaruh Inhibitor (faktor penghambat)
Inhibitor adalah suatu senyawa atau gugus senyawa yang menghambat aktivitas
enzim. Enzim sangat peka terhadap senyawa atau gugus senyawa yang diikatnya
(Girindra, 1993). Enzim papain sangat sensitif terhadap logam. Adanya logam
akan merusak gugus sulfhidril yang merupakan gugus katalitik enzim papain.
Keaktifan enzim papain akan hilang bila direaksikan dengan oksidator.
2.4. Kitosan
2.4.1. Struktur Kitosan
Kitosan adalah suatu rantai linear dari D-Glukosamin dan N-Asil D-Glukosamin yang
terangkai pada posisi β (1-4). Kitosan dihasilkan dari deasetilasi kitin. Karena dalam
bentuk kationik, bentuk kitosan yang tidak larut dalam air akan membentuk
polielektronik dengan anion polielektronik. Kitosan telah digunakan dalam bidang
biomedikal dan farmasi karena kitosan bersifat biokompatibel, biodegradasi dan tidak
beracun ( Adriana et al., 2003 ).
Kitosan adalah poli-(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan
rumus molekul (C6H11NO4)n yang dapat diperoleh dari deasetilasi kitin. Kitosan juga
dijumpai secara alamiah di beberapa organisme. Proses deasetilasi kitosan dapat
dilakukan dengan cara kimiawi maupun enzimatik. Proses kimiawi menggunakan
basa, misalnya NaOH, dan dapat menghasilkan kitosan dengan derajat deasetilasi
yang tinggi, yaitu mencapai 85-93% (Tsigos et al., 2000). Namun proses kimiawi
menghasilkan kitosan dengan bobot molekul yang beragam dan deasetilasinnya juga
sangat acak (Martinou et al., 1995 & Tsigos et al., 2000), sehingga sifat fisik dan
kimia kitosan tidak seragam. Selain itu proses kimiawi juga dapat menimbulkan
pencemaran lingkungan, sulit dikendalikan, dan banyak melibatkan banyak reaksi
samping yang dapat menurunkan rendemen (Chang et al., 1997 & Tokuyasu et al.,
deasetilasi secara enzimatik bersifat selektif dan tidak merusak struktur rantai kitosan,
sehingga menghasilkan kitosan dengan karakteristik yang lebih seragam agar dapat
memperluas bidang aplikasinya ( Tokuyasu et al., 1997 ).
Kitosan juga terdapat secara alami dalam beberapa jamur namun tidak
sebanyak kitin. Struktur idealnya dapat dilihat dari gambar 1 :
Gambar 1. Struktur Kitosan
Kitosan merupakan padatan amorf yang berwarna putih kekuningan dengan
rotasi spesifik [α]D11 -3 hingga -10o ( pada konsentrasi asam asetat 2% ). Kitosan larut
pada kebanyakan larutan asam organik pada pH sekitar 4,0 tetapi tidak larut pada pH
lebih besar dari 6,5, juga tidak larut dalam pelarut air, alkohol, dan aseton. Dalam
asam mineral pekat seperti HCl dan HNO3, kitosan larut pada konsentrasi 0,15-1,1%,
tetapi tidak larut pada konsentrasi 10%. Kitosan tidak larut dalam H2SO4 pada
berbagai konsentrasi, sedangkan didalam H3PO4
Karena adanya gugus amino, kitosan merupakan polielektrolit kationik (pKa ≈
6,5) hal yang sangat jarang terjadi secara alami. Sifat yang basa ini menjadikan
kitosan :
tidak larut pada konsentrasi 1%,
sementara pada konsentrasi 0,1% sedikit larut. Perlu untuk kita ketahui, bahwa
kelarutan kitosan dipengaruhi oleh bobot molekul, derajat deasetilasi, dan rotasi
spesifiknya yang beragam bergantung pada sumber dan metode isolasi serta
transformasinya ( Purwantiningsih et al., 2009 ).
a. Dapat larut dalam media asam encer membentuk larutan yang kental sehingga
dapat digunakan dalam pembuatan gel. Dalam beberapa variasi konfigurasi
seperti butiran, membran, pelapis kapsul, serat dan spons.
b. Membentuk kompleks yang tidak larut dengan air dengan polianion yang dapat
c. Dapat digunakan sebagai pengkhelat ion logam berat dimana gelnya
menyediakan system produksi terhadap efek dekstruksi dari ion
(Meriaty,2002).
Kitosan merupakan hasil deasetilasi kitin, sedangkan kitin dapat diisolasi dari
serangga dan jamur, kerangka dan cangkang hewan golongan Artropoda, Molusca,
Nematoda, dan Crustacea. Pada penelitian ini kitin diisolasi dari cangkang udang.
Pada industri pengolahan udang disamping menghasilkan produk utama berupa udang
bersih juga menghasilkan limbah, berupa cangkang udang yang sangat potensial
sebagai pencemar lingkungan. Limbah udang dapat mencapai 30% sampai 40% dari
berat udang. Limbah cangkang udang ini masih mengandung protein, karbohidrat, dan
mineral. Jika dibuang begitu saja, akan mengalami denaturasi protein dan hidrolisis
secara alami. Proses tersebut menghasilkan bau busuk, meningkatkan BOD air,
sehingga menurunkan kualitas air ( Indra, 1993 ).
2.4.2. Sifat Kitosan
Kitosan adalah padatan amorf putih yang tidak larut dalam alkali dan asam mineral
kecuali pada keadaan tertentu. Kitosan merupakan molekul polimer yang mempunyai
berat molekul tinggi. Kitosan dengan berat molekul tinggi didapati dengan
mempunyai viskositas yang baik dalam suasana asam. Kitosan hasil deasetilasi kitin,
larut dalam asam encer seperti asam asetat, asam formiat, dll. Kitosan dapat
membentuk gel dengan n-metilmorpin n-oksida yang dapat digunakan dalam
formulasi pelepasan obat terkendali. Kandungan Nitrogen dalam kitin berkisar 5-8%
tergantung pada tingkat deasetilasi sedangkan nitrogen pada kitosan kebanyakan
dalam bentuk gugus amino. Maka kitosan bereaksi melalui gugus amino dalam
pembentukan N-asilasi dan reaksi Schiff yang merupakan reaksi yang penting
( Kumar, 2000 ).
Adanya gugus amino dan hidroksil dari kitosan juga menyebabkan kitosan
mudah dimodifikasi secara kimia. Karena kitin dan kitosan merupakan bahan alam
maka keduanya lebih bersifat biokompatibel dan biodegradabel dibanding dengan
polimer sintetik. Kitin dan kitosan serta senyawa turunannya telah banyak
diaplikasikan dalam berbagai industri. Nilai total perdagangan bahan-bahan tersebut
2.4.3. Kegunaan Kitosan
Dewasa ini aplikasi kitin dan kitosan sangat banyak dan meluas. Di bidang industri,
kitin dan kitosan berperan antara lain sebagai koagulan polielektrolit pengolahan
limbah cair, pengikat dan penyerap ion logam, mikroorganisme, mikroalga, pewarna,
residu pestisida, lemak, tannin, PCB ( poliklorinasi bifenil ), mineral dan asam
organik, media kromatografi afinitas, gel dan pertukaran ion, penyalut berbagai serat
alami dan sintetik, pembentuk film dan membran mudah terurai, meningkatkan
kualitas kertas, pulp dan produk tekstil. Sementara dibidang pertanian dan pangan,
kitin dan kitosan digunakan antara lain untuk pencampur pakan ternak, antimikroba,
antijamur, serat bahan pangan, penstabil, pembawa zat aditif makanan, flavor, zat gizi,
pestisida, herbisida, virusida tanaman, dan deasedifikasi buah-buahan, sayuran dan
penjernih sari buah. Fungsinya sebagai antimikrob dan antijamur juga diterapkan di
bidang kedokteran. Kitin dan kitosan dapat mencegah pertumbuhan Candida albicans
dan Staphylacoccus aureus. Selain itu, biopolimer tersebut juga berguna sebagai
antikoagulan, antitumor, antivirus, pembuluh darah-kulit dan ginjal sintetik, bahan
pembuat lensa kontak, aditif kosmetik, membran dialisis, bahan shampoo dan
kondisioner rambut , zat hemostatik, penstabil liposome, bahan ortopedik, pembalut
luka dan benang bedah yang mudah diserap, serta mempertinggi daya kekebalan,
antiinfeksi.
Kitosan sebagai adsorben dapat berada dalam berbagai bentuk, antara lain
bentuk butir, serpih, hidrogel, dan membran ( film ). Kitosan sebagai adsorben sering
dimanfaatkan untuk proses adsorpsi ion logam berat. Besarnya afinitas kitosan dalam
mengikat ion logam sangat bergantung pada karakteristik makrostruktur kitosan yang
dipengaruhi oleh sumber dan kondisi pada proses isolasi. Perbedaan bentuk kitosan
akan berpengaruh pada luas permukaannya. Semakin kecil ukuran kitosan, maka luas
permukaan kitosan akan semakin besar, dan proses adsorpsi pun dapat berlangsung
lebih baik.
Pembuatan kitosan dalam bentuk butiran antara lain sebanyak 3 gram kitosan
berbentuk serpihan dilarutkan dalam 100 ml larutan asam asetat 1%. Larutan kitosan
yang terbentuk diteteskan pada larutan basa NaOH 4%, sehingga diperoleh butiran
berbentuk bola dengan diameter rata-rata 2,5 mm. Kitosan butiran yang terbentuk
membentuk kitosan dalam bentuk butiran yang digunakan untuk proses adsorpsi
enzim catalase ( Purwantiningsih et al., 2009 ).
2.5. Karagenan
Karagenan merupakan senyawa polisakarida yang tersusun dari unit D-galaktosa dan
L-galaktosa 3,6 anhidrogalaktosa yang dihubungkan oleh ikatan 1-4 glikosilik. Setiap
unit galaktosa mengikat gugusan sulfat. Jumlah Sulfat pada karagenan lebih kurang
35,1% ( Tim Penulis PS, 1999 ).
Karagenan banyak digunakan pada sediaan makanan, sediaan farmasi dan
kosmetik sebagai bahan pembuat gel, pengental atau penstabil. Karagenan dapat
diekstraksi dari protein dan lignin rumput laut dan dapat digunakan dalam industri
pangan karena karakteristiknya yang dapat berbentuk gel, bersifat mengentalkan, dan
menstabilkan material utamanya. Karagenan digunakan dalam industri pangan karena
fungsi karakteristiknya yang dapat digunakan untuk mengendalikan kandungan air
dalam bahan pangan utamanya, mengendalikan tekstur, dan menstabilkan makanan
Rumput laut yang tergolong Rhodophyceae beberapa diantaranya mengandung
bahan yang cukup penting yaitu karagenan. Carragenophyt adalah kelompok
penghasil karaginan dari kelompok Rhodophyceae. Kelompok ini antara lain adalah
Chondrus, Gigartina dan Eucheuma. Dalam dunia industri, karagenan berbentuk
garam bila bereaksi dengan sodium, kalsium dan potassium ( Laode, 1991 ).
2.5.1. Jenis-Jenis Karagenan
Di alam ini, terdapat tiga jenis karagenan yang dapat ditemukan secara luas di
berbagai perairan di dunia. Ketiganya dibedakan berdasarkan struktur molekul yang
mengakibatkan perbedaan sifat fisik dan karakteristik penggunaannya dalam industri
pangan. Ketiga jenis karagenan ini adalah kappa, iota dan lambda. Perbedaan
ketiganya terletak pada perbedaan posisi gugus ester-sulphate dan jumlah residu 3,6
anhydro-D-galaktose.
1. Kappa Karagenan
Karagenan tipe kappa memiliki struktur D-galaktose dan beberapa gugus
2-sulfate ester pada 3,6 anhydro-D-galaktose yang ditunjukan gambar. Gugus 6-2-sulfate
pengolahan dengan menggunakan basa. Hal ini akan memberikan keteraturan rantai
yang lebih baik.
Gambar 2. Kappa karagenan
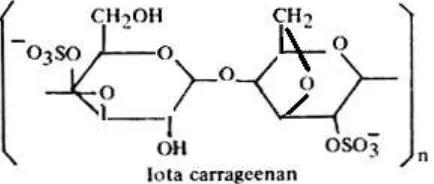
2. Iota Karagenan
Karagenan tipe iota mengandung gugus 4-sulfate ester dalam semua gugus
D-galaktose dan gugus 2-sulfate ester dalam 3,6 anhydro-D-D-galaktose. Ketidakberaturan
gugus 6-sulfate ester menggantikan gugus ester 4-sulfate dalam D-galaktose. Gugus
ini dapat digantikan dengan pengolahan dalam kondisi basa untuk meningkatkan
kekuatan gel.
Gambar 3. Iota karagenan
3. Lambda Karagenan
Karaginan tipe lambda mengandung residu disulfated-D-galaktose yang tidak
mengandung gugus ester 4-sulfate namun sejumlah gugus ester 2-sulfate
Gambar 4. Lamda karagenan
2.5.2. Kappa Karagenan
Kappa karagenan memiliki struktur D-galaktose dan beberapa gugus 2-sulfate ester
pada 3,6 anhydro-D-galaktose. Gugus 6-sulfate ester mengurangi daya kekuatan gel
namun dapat mengurangi loss akibat dari pengolahan dengan menggunakan basa. Hal
ini akan memberikan keteraturan rantai yang lebih baik. Struktur kappa karagenan
dapat dilihat pada gambar 2 (
Adapun sifat fisik yang dimiliki karagenan tipe kappa ini adalah dimana kappa
karagenan larut dalam air panas. Penambahan ion kalium menyebabkan pembentukan
gel yang tahan lama, namun rapuh, serta manambah temperatur pembnetukan gel dan
pelelehan. Kuat, gel padat, beberapa ikatan dengan ion K+ dan Ca++ menyebabkan
bentuk helik terkumpul, dan gel menjadi rapuh, gel berwarna transparan, diperkirakan
terdapat 25% ester sulfat dan 34% 3,6-AG. Kappa karagenan tidak dapat larut dalam
sebagian besar pelarut organik, sesuai dengan pelarut yang dapat bercampur dengan
air dan penggunaannya pada konsentrasi 0.02-2.0%
Kegunaan karaginan hampir sama dengan agar-agar, antara lain sebagai
pengatur kesetimbangan, bahan pengental, pembentuk gel, dan pengemulsi. Karaginan
digunakan dalam beberapa industri. Dalam industri makanan digunakan sebagai
pembuatan kue, roti, makaroni, jam, jelly, sari buah, bir, es krim, dan gel pelapis
produk daging. Dalam industri farmasi, karaginan digunakan sebagai bahan
pembuatan pasta gigi, obat-obatan, kosmetik, tekstil dan cat ( Tim Penulis PS, 1999).
2.6. Imobilisasi Enzim
Secara konvensional, reaksi enzimatis berlangsung pada reaksi secara batch dengan
menginkubasi campuran substrat dan enzim yang terlarut. Teknik tersebut memiliki
kelemahan yaitu kesulitan untuk merecovery enzim aktif dari campuran enzim
tersebut untuk digunakan kembali.Hal ini karena enzim terlarut dalam larutan
sehingga sulit dipisahkan kembali. Selain karakterisasi enzim yang sangat dipengaruhi
oleh pH dan suhu pemanasan, sehingga enzim bebas mudah terdenaturasi dan
mengalami inaktifasi. Hal ini sangat tidak ekonomis, karena enzim aktif hilang begitu
Untuk mengeliminasi kelemahan-kelemahan tersebut maka dilakukan
imobilisasi enzim bebas yang telah didapatkan. Dengan begitu enzim akan lebih stabil
pada pengaruh suhu dan pH lingkungan, dan tentunya dapat digunakan lagi setelah
mengkatalis suatu reaksi sintesis tertentu ( Chibata, 1978 ).
Enzim terimobilisasi didefinisikan sebagai enzim yang secara spesifik
ditempatkan dalam suatu ruang tertentu dengan tetap memiliki aktivitas katalitiknya
dan dapat digunakan secara berulang atau secara terus-menerus (Chibata, 1978).
Imobilisasi enzim adalah usaha untuk memisahkan antara enzim dengan
produk selama reaksi dengan menggunakan sistem dua fase, satu fase mengandung
enzim dan fase lainnya mengandung produk, sehingga tidak terjadi saling kontaminasi
antara enzim dan produk (Chaplin, 1990).
Imobilisasi merupakan suatu modifikasi untuk meniru keadaan asalnya di alam
yang diyakini berada dalam keadaan terikat pada membran atau partikelpartikel dalam
sel. Tujuan utama mengimobilisasi enzim adalah untuk mempekerjakan enzim yang
dapat memberikan proses katalitik yang berkesinambungan (Zaborsky, 1973).
2.6.1. Sejarah Imobilisasi Enzim
Teknik imobilisasi enzim pertama kali dilakukan oleh Nelson dan Griffin pada tahun
1916 (Muchtadi et al., 1992, Chibata, 1978) Nelson dan Griffin mengimobilisasi
enzim interfase dari khamir dengan cara adsorpsi pada arang aktif (Chibata, 1978).
Percobaan pertama untuk mengimobilisasi enzim dengan tujuan untuk
memperbaiki sifat-sifat enzim dilakukan oleh Grubhover dan Scheleith pada tahun
1953. Mereka mengimobilisasi karboksipeptidase, diastase, pepsin dan ribonuklease
dengan menggunakan diazotized poliaminopolystirene resin (Chibata, 1978).
Penggunaan enzim terimobilisasi akan memberikan beberapa keuntungan
(Messing, 1975 diacu dalam Smith, 1990) yaitu:
1) enzim dapat digunakan secara berulang;
2) proses dapat dihentikan secara cepat dengan mengeluarkan enzim dari larutan
substrat;
3) kestabilan enzim dapat diperbaiki;
4) larutan hasil proses tidak terkontaminasi oleh enzim;
2.6.2. Metode Imobilisasi Enzim
Metode imobilisasi enzim ada tiga macam, yaitu :
1. Metode carrier binding
Metode ini didasarkan atas pengikatan enzim langsung pada zat pembawa yang
tidak larut dalam air.
Gambar 5. Metode carrier binding
Metode ini dapat dibedakan menjadi tiga yaitu :
A. Metode adsorpsi fisik
Berdasarkan pada adsorpsi fisika dari protein enzim pada permukaan pembawa
yang tidak larut dalam air. Metode ini memiliki keburukan dimana enzim yang
diserap dapat bocor dari pembawa selama pemanfaatan karena gaya ikat antara
protein enzim dan pembawah lemah.
B. Metode pengikatan ionik
Berdasarkan pada pengikatan ionik dari protein enzim pada pembawa yang
tidak larut dalam air yang mengandung residu penukar ion. Kebocoran enzim
dari pembawa dapat terjadi dalam larutan substrat dengan kekuatan ionik yang
tinggi atau pada variasi pH.
C. Metode pengikatan kovalen
Berdasarkan pada pengikatan enzim dan pembawa yang tidak larut dalam air
dengan ikatan kovalen. Dalam metode ini diperlukan kondisi reaksi yang sulit
dan biasanya tidak dalam keadaan kamar. Dan dalam beberapa keadaan,ikatan
kovalen mengubah bentuk konformasi dan pusat aktif enzim yang
mengakibatkan kehilangan aktivitas atau perubahan spesifitas aktivitas.
2. Metode ikat silang
Metode ikatan silang berdasarkan pembentukan ikatan kimia, seperti dalam
metode ikat kovalen, namun pembawa yang tidak larut dalam air tidak digunakan
intermolekular diantara molekul enzim dengan penambahan reagen bi- atau
multifungsional.
Gambar 6. Metode ikat silang
3. Metode penjebakan
Metode penjebakan ini berdasarkan pada pengikatan enzim pada kisi-kisi matrik
polimer atau menutupi enzim dengan membran semipermiabel dan dibagi menjadi
tipe kisi dan tipe mikrokapsul.
A. Tipe kisi ( lattice type )
Metode penjebakan tipe kisi meliputi penjebakan enzim dalam bidang batas
(interstitial spaces) dari suatu ikat silang polimer yang tidak larut dalam air
sebagai contoh diantara gel matrik.
Gambar 7. Metode penjebakan tipe kisi
B. Tipe mikrokapsul
Tipe penjebakan mikrokapsul meliputi pelingkupan enzim dengan membran
polimer semipermiabel. Enzim mikrokapsul secara umum mempunyai
diameter 1-100 µm.
BAB III
BAHAN DAN METODE PENELITIAN
3.1. Alat-alat
1. Gelas Beaker pyrex
2. Gelas ukur pyrex
3. Labu takar pyrex
4. Tabung reaksi pyrex
5. Pipet tetes
6. Spatula
7. Corong pyrex
8. Termometer 210o
9. Rak tabung reaksi
C Fissons
10.Magnetik bar Scienceware
11.Kertas saring
12.Oven Vacum Elphor
13.Inkubator Gallenkamp
14.Neraca analitis Mettler Toledo
15.Indikator universal Merck
16.Spektrofotometer UV-VIS Shimadju
17.Cawan Petridis pyrex
18.Pipet takar pyrex
3.2. Bahan-bahan
1. Kappa karaginan Teknis
2. Kitosan Teknis
3. Getah pepaya ( Carica papaya L )
5. Kasein p.a. E. Merck
6. Akuades
7. Asam trikloroasetat p.a. E. Merck
8. L-Tyrosin p.a. E. Merck
9. Asam asetat glassial p.a. E. Merck
10.HCl(p)
11.KCl
p.a. E. Merck
(s)
12.NaOH
p.a. E. Merck
(s)
13.CuSO
p.a. E. Merck
4.5H2O(s)
14.K-Na-Tartrat
p.a. E. Merck
(s)
15.KI
p.a. E. Merck
(s)
16.Bovin Serum Albumin ( BSA ) p.a. E. Merck p.a. E. Merck
17.NaH2PO4.H2
18.Na
O p.a. E. Merck
3.3. Prosedur Penelitian
3.3.1. Pembuatan Larutan Pereaksi
3.3.1.1. Larutan Induk Standar Tyrosin 1000 mg/L
Ditimbang 1 g tyrosin dan ditambahkan HCl 1 N sedikit demi sedikit hingga
larut kemudian dimasukkan kedalam labu takar 1000 mL dan diencerkan dengan
akuades sampai garis tanda dan dihomogenkan. Diperoleh larutan induk standar
tyrosin 1000 mg/L.
3.3.1.2. Larutan Standar Tyrosin 100 mg/L
Dipipet 100 mL larutan induk standar tyrosin 1000 mg/L dan dimasukkan
kedalam labu takar 1000 mL kemudian diencerkan dengan akuades sampai garis tanda
dan dihomogenkan. Diperoleh larutan standar tyrosin 100 mg/L.
3.3.1.3. Larutan Seri Standar Tyrosin
Dibuat konsentrasi larutan seri standar tyrosin bervariasi
10;20;30;40;50;60;70;80;90 mg/L. Masing-masing dipipet sebanyak 2,5 ; 5 ; 7,5 ; 10 ;
12,5 ; 15 ; 17,5 ; 20 ; 22,5 mL larutan standar 100 mg/L dan dimasukkan kedalam labu
takar 25 mL kemudian diencerkan dengan akuades sampai garis tanda dan
dihomogenkan.
3.3.1.4. Larutan Kasein 1%
Dilarutkan 1 g kasein dengan buffer phosfat pH 7 kemudian dimasukkan ke
dalam labu takar 100 mL dan diencerkan sampai garis tanda.
3.3.1.5. Larutan Asam Trikloroasetat 30%
Dilarutkan 30 g asam trikloroasetat dengan akuades kemudian dimasukkan ke
dalam labu takar 100 mL dan diencerkan sampai garis tanda.
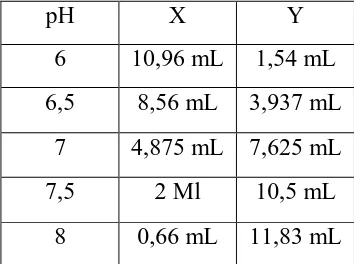
3.3.1.6. Larutan Buffer Phosfat Larutan A : Larutan NaH2PO4.H2
Larutan B : Larutan Na
O ( 3,174 g dalam 100 mL akuades )
X mL Larutan A + Y mL Larutan B, dimasukkan kedalam labu takar 25 mL dan
diencerkan dengan akuades sampai garis tanda.
pH X Y
Tabel 2. Pembuatan Larutan Buffer Phosfat pH 6-8
3.3.1.7. Larutan Crude Enzim Papain 1%
Dilarutkan 1 g crude enzim papain dengan buffer phosfat pH 7 kemudian
dimasukkan ke dalam labu takar 100 mL dan diencerkan sampai garis tanda.
3.3.1.8. Larutan Alkohol 92%
Dimasukkan 96 mL alkohol 96% dalam labu takar 100 mL kemudian
diencerkan dengan akuades sampai garis tanda.
3.3.1.9. Larutan CH3
Dimasukkan 0,57 mL CH COOH 0,1N
3COOH glassial dalam labu takar 100 mL kemudian
diencerkan dengan akuades sampai garis tanda.
3.3.1.10. Larutan CH3
Dimasukkan 0,1 mL CH COOH 0,1%
3COOH glassial dalam labu takar 100 mL kemudian
diencerkan dengan akuades sampai garis tanda.
3.3.1.11. Larutan NaOH 0,1N
Dilarutkan 0,4 g NaOH dengan akuades kemudian dimasukkan ke dalam labu
takar 100 mL dan diencerkan sampai garis tanda.
3.3.1.12. Larutan NaOH 0,2N
Dilarutkan 2 g NaOH dengan akuades kemudian dimasukkan ke dalam labu
3.3.1.13. Larutan HCl 1N
Dilarutkan 8,33 mL HCl(p) dalam labu takar 100 mL kemudian diencerkan
dengan akuades sampai garis tanda.
3.3.1.14. Pereaksi Biuret
Dilarutkan 3 g CuSO4.5H2O dan 9 g Na-K-Tartrat dengan NaOH 0,2 N
kemudian dimasukkan kedalam labu takar 500 mL dan diencerkan sampai garis tanda,
kemudian ditambahkan 5 g KI dan dimasukkan kedalam labu takar 1000 mL dan
diencerkan dengan NaOH 0,2 N sampai garis tanda.
3.3.2. Pembuatan Kurva Kalibrasi Tyrosin 3.3.2.1. Penentuan λmaks
Diambil larutan seri standar tyrosin 10 mg/L dan diukur λ
Larutan Standar Tyrosin
maks dengan melihat
spectrum puncak serapan maksimum tyrosin kemudian dilakukan pemeriksaan peak
spectrum tyrosin dan diperoleh λmaks pada absorbansi maksimum.
3.3.2.2. Penentuan Kurva Kalibrasi Larutan Standar Tyrosin
Dinolkan absorbansinya dengan blanko akuades. Masing-masing larutan seri
standar tyrosin 0;10;20;30;40;50;60;70;80;90 mg/L diukur absorbansinya pada λmaks
274 nm lalu diplotkan konsentrasi dan absorbansi larutan seri standar
3.3.3. Pembuatan Kurva Kalibrasi Bovin Serum Albumin ( BSA ) Metode Biuret 3.3. 3.1. Penentuan λmaks
Diambil salah satu konsentrasi larutan standar BSA dan diukur λ
Larutan BSA
maks dengan
melihat spectrum puncak serapan maksimum BSA kemudian dilakukan pemeriksaan
peak spectrum BSA dan diperoleh λmaks pada absorbansi maksimum.
3.3.3.2. Penentuan Kurva Kalibrasi Larutan BSA
Dinolkan absorbansinya dengan blanko akuades. Dipipet masing-masing
0;0,1;0,2;0,4;0,6;0,8;1 mL larutan standar BSA dan ditambahkan masing-masing
akuades hingga volume total masing-masing menjadi 4 ml kemudian ditambahkan
masing-masing 6 ml pereaksi biuret, diukur absorbansinya pada λmaks 549 nm lalu
3.3.4. Preparasi Sampel Getah Buah Pepaya ( Carica papaya L )
Digores buah pepaya Bangkok muda dengan pisau dan ditampung getah buah
pepaya tersebut dalam gelas beaker.
3.3.5. Isolasi Crude Enzim Papain dari Getah Buah Pepaya ( Carica papaya L ) Sebanyak 7 ml getah buah pepaya ( 26,9685 g ) dimasukkan kedalam gelas
beaker 100 mL, kemudian ditambahkan alkohol 92% sebanyak lima kali dari volume
getah buah pepaya dan diisimpan pada suhu 10oC selama 1 malam kemudian disaring.
Dikeringkan residunya dalam oven vakum pada suhu 40oC sampai berat konstan.
3.3.6. Penentuan Kadar Protein Crude Enzim Papain Metode Biuret
Dipipet 1 mL larutan crude enzim papain 1% dan dimasukkan kedalam gelas
beaker 100 mL dan ditambahkan akuades hingga volume total adalah 4 ml,
ditambahkan 6 ml Pereaksi Biuret dan didiamkan selama 16 menit pada suhu kamar,
dan diukur absorbansinya pada λmaks 549 nm.
3.3.7. Imobilisasi Crude Enzim Papain
3.3.7.1. Imobilisasi Crude Enzim Papain Dengan Kappa karagenan
Disediakan 2 gelas beaker, Dalam gelas beaker I dimasukkan sebanyak 0,6 g
Kappa karagenan dan dilarutkan dengan 20 mL akuades, kemudian dipanaskan pada
suhu 70oC sambil diaduk. Kemudian didiamkan hingga suhu 50oC. Dalam gelas
beaker II dimasukkan sebanyak 0,3 g crude enzim papain dan dilarutkan dengan 10
mL buffer phosfat pH 7 dan diaduk. Dicampurkan larutan Kappa karagenan kedalam
larutan crude enzim papain dan dibiarkan dingin pada suhu kamar, kemudian
ditambahkan 10 ml KCl 0,3M dan disimpan pada suhu 10oC selama 1 malam,
dipotong-potong dengan ukuran 5x5x5 mm dan dicuci dengan akuaes. Kemudian
larutannya diuji dengan metode Biuret.
3.3.7.2. Imobilisasi Crude Enzim Papain Dengan Kappa karagenan dan Kitosan Disediakan 2 gelas beaker, Dalam gelas beaker I dimasukkan sebanyak 0,9 g
Kappa karaginan dan dilarutkan dengan 30 mL akuades, kemudian dipanaskan pada
suhu 70oC. Kemudian didiamkan hingga suhu 50oC. Dalam gelas beaker II
dan diaduk kemudian ditambahkan larutan yang berisi 0,3 g crude enzim papain yang
telah dilarutkan dalam 10 mL buffer phosfat pH 7 dan diaduk. Dicampurkan larutan
Kappa karaginan kedalam larutan kitosan-crude enzim papain dan dibiarkan dingin
pada suhu kamar, kemudian ditambahkan 10 ml KCl 0,3M dan disimpan pada suhu
10oC selama 1 malam, dipotong-potong dengan ukuran 5x5x5 mm dan dicuci dengan
akuaes. Kemudian larutannya diuji dengan metode Biuret.
3.3.8. Penetuan Kadar Crude Enzim Papain Yang Tidak Terimobilisasi
Dipipet 1 mL larutan hasil pencucian crude enzim papain terimobil dan
dimasukkan kedalam gelas beaker 100 mL dan ditambahkan akuades hingga volume
total adalah 4 ml, ditambahkan 6 ml Pereaksi Biuret dan didiamkan selama 16 menit
pada suhu kamar, dan diukur absorbansinya pada λmaks 549 nm.
3.3.9. Pengujian Suhu dan pH Optimum Aktivitas Crude Enzim Papain
3.4.9.1. Pengujian Suhu Optimum Aktivitas Crude Enzim Papain Bebas dan Terimobil
Sebanyak 1 mL kasein 1% dimasukkan masing-masing kedalam 6 buah gelas
beaker 100 mL dan ditambahkan masing-masing 1 mL crude enzim papain 1% dan
ditambahkan masing 16 mL buffer phosfat pH 7 dan diinkubasi
masing-masing gelas beaker dengan variasi suhu 45,50,55,60,65,70oC selama 20 menit.
Kemudian ditambahkan masing-masing 2 mL asam trikloroasetat 30% dan diinkubasi
kembali masing-masing gelas beaker dengan variasi suhu yang sama selama 20 menit
dan disaring.Kemudian masing-masing filtratnya diukur absorbansinya pada λmaks
274 nm.
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dengan mengganti 1 ml crude enzim papain 1% menjadi 1,22 g crude
enzim papain terimobil dengan kappa karagenan
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dan kitosan dengan mengganti 1 ml crude enzim papain 1% menjadi
3.3.9.2. Pengujian pH Optimum Aktivitas Crude Enzim Papain Bebas dan Terimobil
Sebanyak 1 mL kasein 1% dimasukkan masing-masing kedalam 5 buah gelas
beaker 100 mL dan ditambahkan masing-masing 1 mL crude enzim papain 1% dan
ditambahkan masing-masing 16 mL buffer phosfat dengan variasi pH 6 ; 6,5 ; 7 ; 7,5
;8 untuk masing-masing gelas beaker dan diinkubasi pada suhu 55oC selama 20 menit.
Kemudian ditambahkan masing-masing 2 mL asam trikloroasetat 30% dan diinkubasi
kembali pada suhu 55oC selama 20 menit dan disaring. Kemudian masing-masing
filtratnya diukur absorbansinya pada λmaks 274 nm.
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dengan mengganti 1 ml crude enzim papain 1% menjadi 1,22 g crude
enzim papain terimobil dengan kappa karagenan
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dan kitosan dengan mengganti 1 ml crude enzim papain 1% menjadi
2,0869 g crude enzim papain terimobil dengan kappa karagenan dan kitosan
3.3.10. Pengujian Aktivitas Crude Enzim Papain Bebas dan Terimobil Pada Suhu dan pH Optimumnya
Sebanyak 1 mL kasein 1% dimasukkan kedalam gelas beaker 100 mL dan
ditambahkan 1 mL crude enzim papain 1% dan ditambahkan 16 mL buffer phosfat pH
7 dan diinkubasi pada suhu 55oC selama 20 menit. Kemudian ditambahkan 2 mL asam
trikloroasetat 30% dan diinkubasi kembali pada suhu 55oC selama 20 menit dan
disaring. Kemudian filtratnya diukur absorbansinya pada λmaks 274 nm.
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dengan mengganti 1 ml crude enzim papain 1% menjadi 1,22 g crude
enzim papain terimobil dengan kappa karagenan ( suhu 60, pH 6,5 )
* Dilakukan perlakuan yang sama untuk crude enzim papain terimobil dengan kappa
karagenan dan kitosan dengan mengganti 1 ml crude enzim papain 1% menjadi
2,0869 g crude enzim papain terimobil dengan kappa karagenan dan kitosan (suhu 65,
3.3.11. Pengujian Stabilitas Crude Enzim Papain Terimobil Pada Pemakaian Berulang
3.3.11.1. Pengujian Stabilitas Crude Enzim Papain Terimobil Dengan Kappa karagenan Pada Pemakaian Berulang
Sebanyak 1 mL kasein 1% dimasukkan kedalam gelas beaker 100 mL dan
ditambahkan 1,22 g crude enzim papain terimobil dengan kappa karagenan dan
ditambahkan 16 mL buffer phosfat pH 6,5 dan diinkubasi pada suhu 60oC selama 20
menit. Kemudian ditambahkan 2 mL asam trikloroasetat 30% dan diinkubasi kembali
pada suhu 60oC selama 20 menit dan disaring. Kemudian filtratnya diukur
absorbansinya pada λmaks 274 nm. Kemudian dipisahkan crude enzim papain terimobil dari endapan protein dalam residu tadi dan dimasukkan dalam KCl 0,3M dan
disimpan pada suhu 10oC dan 25oC. Kemudian crude enzim papain terimobil tersebut
digunakan kembali untuk uji aktivitas yang ke-2,3,4, dan 5.
3.3.11.2. Pengujian Stabilitas Crude Enzim Papain Terimobil Dengan Kappa karagenan dan Kitosan Pada Pemakaian Berulang
Sebanyak 1 mL kasein 1% dimasukkan kedalam gelas beaker 100 mL dan
ditambahkan 2,0869 g crude enzim papain terimobil dengan kappa karagenan dan
kitosan dan ditambahkan 16 mL buffer phosfat pH 7 dan diinkubasi pada suhu 65oC
selama 20 menit. Kemudian ditambahkan 2 mL asam trikloroasetat 30% dan
diinkubasi kembali pada suhu 65oC selama 20 menit dan disaring. Kemudian filtratnya
diukur absorbansinya pada λmaks 274 nm. Kemudian dipisahkan crude enzim papain terimobil dari endapan protein dalam residu tadi dan dimasukkan dalam KCl 0,3M
dan disimpan pada suhu 10oC dan 25oC. Kemudian crude enzim papain terimobil
tersebut digunakan kembali untuk uji aktivitas yang ke-2,3,4, dan 5 dengan selang
3.4. Bagan Penelitian
3.4.1. Pembuatan Kurva Kalibrasi Tyrosin
Ditambahkan HCl 1 N sedikit demi sedikit
hingga larut
Dimasukkan kedalam labu takar 1000 mL
Diencerkan dengan akuades hingga garis tanda
Dipipet 100 mL
Dimasukkan kedalam labu takar 1000 mL
Diencerkan dengan akuades hingga garis tanda
Dipipet 2,5 mL Dipipet masing – masing
Dimasukkan dalam labu 2,5;5;7,5;10;12,5;15;17,5;20;
takar 25 mL 22,5 mL
Diencerkan dengan akuades Dimasukkan dalam labu takar
hingga garis tanda 25 mL
Diukur absorbansinya Diencerkan dengan akuades
hingga garis tanda
Diukur absorbansinya pada
λmaks 274 nm
1 g Tyrosin
Kurva kalibrasi Tyrosin 1000 mg/L
Tyrosin 100 mg/L
3.4.2. Pembuatan Kurva Kalibrasi Bovin Serum Albumin ( BSA ) Metode Biuret
Dipipet sebanyak 0;0,1;0,2;0,4;0,6;0,8;1 mL dan
dimasukkan kedalam tabung reaksi
Ditambahkan akuades hingga volume total
masing-masing tabung reaksi menjadi 4 mL
Ditambahkan masing-masing 6 mL pereaksi
biuret
Diukur absorbansi Diukur absorbansinya
salah satu konsentrasi BSA pada λmaks
549 nm
3.4.3. Preparasi Sampel Getah Buah Pepaya ( Carica papaya L )
Digores dengan pisau
Ditampung getah buah pepaya dalam gelas
beaker Larutan BSA 5 mg/ml
Kurva kalibrasi Larutan ungu
λmaks = 549 nm
Hasil
3.4.4. Isolasi Crude Enzim Papain dari Getah Buah Pepaya (Carica papaya L)
Dimasukkan kedalam gelas beaker 100 mL
Ditambahkan alkohol 92% sebanyak lima kali
dari volume getah pepaya
Disimpan pada suhu 10o
Disaring
C selama 1 malam
Dikeringkan dalam oven vakum pada
Suhu 40oC sampai berat konstan
3.4.5. Penentuan Kadar Protein Crude Enzim Papain Metode Biuret
Dimasukkan kedalam gelas beaker 100 mL
Ditambahkan akuades hingga volume total
adalah 4 mL
Ditambahkan 6 mL pereaksi Biuret
Dibiarkan selama 16 menit pada suhu kamar
Diukur absorbansinya pada λmaks 549 nm 7 ml getah buah pepaya ( 26,9685 g )
Residu Filtrat
Crude Enzim Papain ( 4,3171 g )
Hasil
3.4.6. Imobilisasi Crude Enzim Papain
3.4.6.1. Imobilisasi Crude Enzim Papain Dengan Kappa karagenan
Dimasukkan kedalam gelas Dimasukkan kedalam
beaker 100 mL gelas beaker 100 mL
Ditambahkan 20 mL akuades Ditambahkan 10 mL
Dipanaskan pada suhu 70o
sambil diaduk Diaduk
C buffer phosfat pH 7
Didiamkan hingga suhu menjadi
50oC
Dicampurkan larutan kappa karagenan dan crude
enzim papain
Diaduk
Dituangkan ke cawan Petridis
Dibiarkan dingin pada suhu kamar
Ditambahkan larutan 10 ml KCl 0,3M
Disimpan pada suhu 10o
Dipotong-potong dengan ukuran 5x5x5 mm C selama 1 malam
Dicuci dengan akuades
Diuji kadar protein
bebasnya dengan metode
Biuret
0,6 g Kappa karagenan 0,3 g Crude enzim papain
Hasil
3.4.6.2. Imobilisasi Crude Enzim Papain Dengan Kappa karagenan dan Kitosan
Dimasukkan kedalam gelas Dimasukkan kedalam
beaker 100 mL gelas beaker 100 mL
Ditambahkan 30 mL akuades Ditambahkan 10 mL
Dipanaskan pada suhu 70o
sambil diaduk Ditambahkan larutan yang
C Asam asetat 0,1%
Didiamkan hingga suhu berisi 0,3 g crude enzim
menjadi 50o
Diaduk
C papain yang telah
dilarutkan dalam 10 mL
buffer phosfat pH 7
Dicampurkan larutan kappa karagenan dan
kitosan-crude enzim papain
Diaduk
Dituangkan ke cawan Petridis
Dibiarkan dingin pada suhu kamar
Ditambahkan 10 ml larutan KCl 0,3M
Disimpan pada suhu 10o
Dipotong-potong dengan ukuran 5x5x5 mm C selama 1 malam
Dicuci dengan akuades
Diuji kadar protein
bebasnya dengan metode
Biuret
0,9 g Kappa karagenan 0,3 g Kitosan
Hasil
3.4.7. Penetuan Kadar Crude Enzim Papain Yang Tidak Terimobilisasi
Dimasukkan kedalam gelas beaker 100 mL
Ditambahkan akuades hingga volume total
adalah 4 mL
Ditambahkan 6 mL pereaksi Biuret
Dibiarkan selama 16 menit pada suhu kamar
Diukur absorbansinya pada λmaks 549 nm
Hasil