KARAKTERISTIK PEPTIDA KOLAGEN TERIPANG GAMA
(
Stichopus variegatus
) SEBAGAI INGRIDIEN POTENSIAL
PANGAN FUNGSIONAL ANTIHIPERTENSI
MUHAMMAD HABBIB KHIRZIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakteristik Peptida Kolagen Teripang Gama (Stichopus variegatus) sebagai Ingridien Potensial Pangan Fungsional Antihipertensi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
Muhammad Habbib Khirzin
F251130081
_________________________
RINGKASAN
MUHAMMAD HABBIB KHIRZIN. Karakteristik Peptida Kolagen Teripang Gama (Stichopus variegatus) sebagai Ingridien Potensial Pangan Fungsional Antihipertensi. Dibimbing oleh SUKARNO, NANCY DEWI YULIANA dan EKOWATI CHASANAH.
Teripang merupakan hewan berkulit duri (echinodermata) yang memiliki panjang tubuh 10-30 cm dengan warna bervariasi dan banyak ditemukan di dasar perairan yang jernih. Teripang gama merupakan salah satu jenis teripang yang memiliki warna tubuh hijau tua dengan bintik-bintik kecil berwarna putih dan banyak ditemui di perairan Lampung dan Nusa Tenggara. Teripang diketahui memiliki berbagai komponen bioaktif yang bermanfaat untuk kesehatan. Teripang kering memiliki kandungan protein yang tinggi dimana 70% nya merupakan protein kolagen. Hidrolisis kolagen secara enzimatis menghasilkan hidrolisat yang mengandung peptida kolagen. Produk ini dilaporkan memiliki bioaktivitas yang bermanfaat untuk kesehatan diantaranya penghambat enzim ACE (antihipertensi) dan antioksidan. ACE merupakan enzim peptidil-dipeptidase yang mengkatalisis perubahan substrat angiotensin I menjadi angiotensin II. Perubahan ini menyebabkan penyempitan pembuluh darah sehingga tekanan darah menjadi meningkat. Antioksidan merupakan senyawa yang mampu menghambat proses oksidasi di dalam tubuh sehingga kerusakan metabolisme yang diakibatkan oleh paparan radikal bebas dapat dihambat.
Saat ini masyarakat cenderung kembali ke bahan alami karena dinilai lebih aman terhadap kesehatan. Eksplorasi bahan alami dan khasiatnya terus dikembangkan sebagai sumber pangan fungsional maupun obat tanpa efek samping. Salah satunya yaitu eksplorasi teripang gama sebagai sumber kolagen dan peptidanya sebagai agen penghambat enzim ACE (ACE inhibitor) dan antioksidan. Oleh karena itu, tujuan dari penelitian ini adalah untuk mengetahui aktivitas penghambatan ACE dan antioksidan peptida kolagen teripang gama. Penelitian ini dibagi menjadi 3 tahap yaitu: 1) pra-perlakuan, 2) ekstraksi kolagen, 3) hidrolisis kolagen.
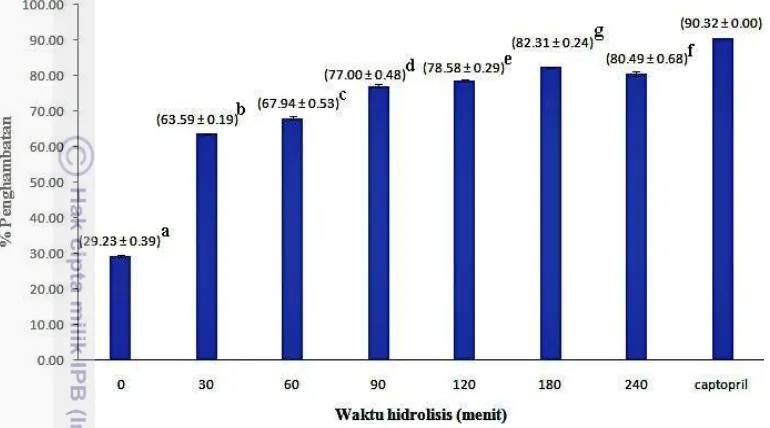
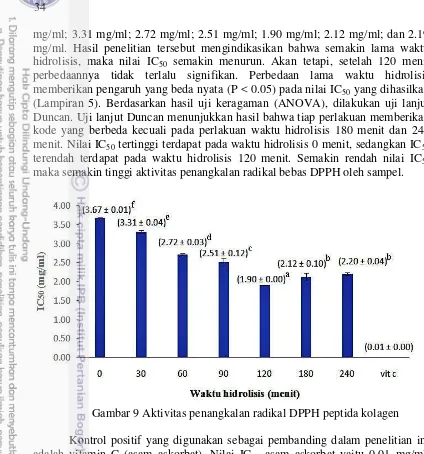
Ekstraksi kolagen memberikan hasil rendemen sebesar 16.40% dengan berat molekul sebesar 130.33 kDa. Hidrolisis kolagen dengan enzim pepsin mencapai derajat hidrolisis tertinggi pada waktu inkubasi 120 menit dengan persentase sebesar 54.61% dan kolagen terhidrolisis menjadi 3 fraksi peptida dengan berat molekul 95.03-91.91 kDa; 47.14-42.06 kDa; dan 29.55-24.1 kDa. Aktivitas penghambatan ACE terbaik terdapat pada peptida yang dihidrolisis selama 180 menit dengan persen penghambatan sebesar 82.31% sedangkan aktivitas antioksidan terbaik terdapat pada peptida yang dihidrolisis selama 120 menit dengan nilai inhibition concentration 50 (IC50 ) sebesar 1.9 mg/ml.
SUMMARY
MUHAMMAD HABBIB KHIRZIN. Study on Antihypertensive Activity of Collagen Peptides from Gama Sea Cucumber (Stichopus variegatus) as a Potential Ingredient of Functional Food. Supervised by SUKARNO, NANCY DEWI YULIANA and EKOWATI CHASANAH.
Sea cucumber is one of echinoderm (thorn-skined animals) which has body length about 10-30 cm. It has various colors and dwelt in the bottom of the sea. Gama sea cucumber is one of sea cucumber’s species which has dark green body loss, with small spots around it. They can be found around Lampung’s or
Nusa Tenggara’s coastal region. They are known to have bioactive compound
which has benefit for health. Dried sea cucumber contains a high level of protein, in which 70% of the protein consists of collagen. Enzymatic hydrolysis of collagen produces hydrolysates which contains collagen peptides. Researches have already reported that marine peptides posses bioactive compound which is good for health such as ACE inhibitor (Antihypertensive) and antioxidant. ACE is a peptidyl-dipeptidase enzyme which is catalyzes angiotensin I to be angiotensin II. This transformation can cause vasoconstriction of blood vessel and thus increase the blood pressure level (hypertension). In the other side, antioxidant are compound which are able to prevent oxidation process in our body so metabolism failure can be inhibited.
Nowadays people prefer to use natural products because of their safety health. Exploration of natural products and their benefit are developed continuosly as functional food and possibilities to provide healing without side effect. One of them is the exploration of sea cucumber as source of collagen and its peptides as ACE inhibitor (antihypertensive) and antioxidant. Accordingly, aim of this research was to assess ACE inhibitor and antioxidant activity of sea cucumber collagen peptides. This research was divided into 3 steps: 1) pretreatment, 2) extraction of collagen, 3) hydrolysis of collagen.
Extraction of collagen produced yield of 16.40% with molecular weight of 130.33 kDa. Hydrolysis of collagen with pepsin enzyme produced highest degree of hydrolysis at incubation time of 120 minutes with percentage of 54.61%. Collagen peptides has been obtained in the form of three fractions. First fraction had moleculer weight between of 95.03-91.91 kDa, the second fraction had moleculer weight of 47.14-42.06 kDa, and the third fraction had moleculer weight of 29.55-24.1 kDa. The best level of antioxidant activity of peptides was obtained from 120 minutes hydrolysis (IC50 1.9 mg/ml) while ACE inhibitors activity was
the highest in the peptides resulted from 180 minutes hydrolysis with a percent inhibition of 82.31%.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
KARAKTERISTIK PEPTIDA KOLAGEN TERIPANG GAMA
(
Stichopus variegatus
) SEBAGAI INGRIDIEN POTENSIAL
PANGAN FUNGSIONAL ANTIHIPERTENSI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2014 hingga Agustus 2015 ini ialah Karakteristik Peptida Kolagen Teripang Gama (Stichopus variegatus) sebagai Ingridien Potensial Pangan Fungsional Antihipertensi. Riset ini merupakan bagian dari kegiatan penelitian APBN Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP).
Terima kasih penulis ucapkan kepada Bapak Dr Ir Sukarno MSc, Ibu Dr Nancy Dewi Yuliana STP MSc, dan Ibu Dr Ir Ekowati Chasanah MSc selaku tim komisi pembimbing yang telah memberikan arahan, bantuan, motivasi dan saran selama proses penyusunan tesis. Penulis mengucapkan terima kasih kepada Ibu Dr Ir Endang Prangdimurti MSi sebagai dosen penguji yang telah memberikan saran dan masukan untuk perbaikan tesis. Di samping itu, ucapan terima kasih juga disampaikan kepada Drs H Agung Darmanto (Ayah), Dra Hj Sulikah (Ibu), Dhina Rohmah Halimatul Azizah (adik), Laily Yunita Susanti SPd MSi (istri) dan keluarga besar.
Penulis mengucapkan terima kasih kepada Dekan Pascasarjana IPB Dr Ir Dahrul Syah MSc dan Kepala Program Studi Ilmu Pangan Prof Dr Ir Ratih Dewanti-Hariyadi MSc yang telah memberikan izin untuk penelitian dan penulisan tesis. Terima kasih kepada para peneliti Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP) Bu Nuri, Pak Nursid, Bu Dewi Z, Bu Dewi R, Pak Tamrin, Pak Dedy, Bu Dini, Bu Tati, Bu Rinta, Bu Elena, para teknisi dan staff Mas Benget, Mbak Maya, Mbak Candra, Mbak Iis, Mas Joe, Mbak Hana, Mas Yudi, Pak Har, Pak Tomi, Pak Agus yang telah banyak membantu dan kepada rekan pejuang BBP4BKP Bu Sherly, Bang Sepri, Hana, Ayu, Gita, Gesti, Omi, Anjar, Ifah, Nur, Sabrina, Erni, Fajar, dan April yang selalu kompak dan saling mendukung.
Ucapan terima kasih juga disampaikan kepada keluarga besar Ilmu Pangan angkatan 2013, FORMASIP dan staff Departemen Ilmu Pangan yang telah membantu, sahabat wisma sas Alvian, Ridho, Haga, Rahman, keluarga besar UB-IPB Fajrin, Alif, barok, Wahida, Nora, Miftah, Tirta, dan sahabat-sahabat Hendratna, Silvie, Mas Novan, dan Winda RG yang selalu membantu dalam penelitian dan memberikan support demi terselesaikannya tesis. Terakhir ucapan terima kasih disampaikan kepada DIKTI yang telah memberikan kesempatan untuk melanjutkan studi program magister dengan beasiswa BPPDN 2013 dan BBP4BKP Jakarta Pusat yang telah memberikan kesempatan penelitian.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2016
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Rumusan Masalah 3
Hipotesis 3
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Teripang 4
Kolagen 6
Ekstraksi Kolagen 8
Pangan Fungsional 10
Peptida Bioaktif 12
Hipertensi 13
Antioksidan 16
3 METODOLOGI PENELITIAN 19
Waktu dan Tempat Penelitian 19
Alat dan Bahan 19
Metode 19
Pra-perlakuan 21
Ekstraksi Kolagen 21
Hidrolisis Kolagen 21
Penentuan Derajat Hidrolisis dan Pola Peptida Kolagen 21
Derajat Hidrolisis 21
Pola Peptida Kolagen 22
Uji Bioaktivitas Peptida Kolagen 22
Uji Penghambatan ACE 22
Uji Antioksidan 23
Rancangan dan Analisis Data 23
4 HASIL DAN PEMBAHASAN 24
Persiapan Bahan Baku 24
Pra-perlakuan dan Ekstraksi Kolagen 24
Rendemen Kolagen 26
Persen Derajat Hidrolisis 27
Pola Peptida Kolagen dan Hidrolisat Kolagen 29
Aktivitas Antioksidan 33
5 SIMPULAN DAN SARAN 36
Simpulan 36
Saran 36
Ucapan Terima Kasih 36
DAFTAR PUSTAKA 37
LAMPIRAN 45
RIWAYAT HIDUP 52
DAFTAR TABEL
1 Kandungan gizi teripang 5
2 Komposisi asam amino kolagen tipe I (residu/1000residu) 8 3 Metode ekstraksi kolagen dari berbagai sumber bahan 9 4 Aktivitas penghambatan ACE dari berbagai sumber bahan 16 5 Aktivitas antioksidan dari berbagai sumber bahan 17 6 Persen derajat hidrolisis dari berbagai substrat, metode, dan enzim 29
DAFTAR GAMBAR
1 Teripang gama (Stichopus variegatus) 5
2 Struktur kimia kolagen tipe I.a) sekuens asam amino primer, b) struktur sekunder left handed helix dan tersier right handed triple-helix, c)
struktur kuartener 7
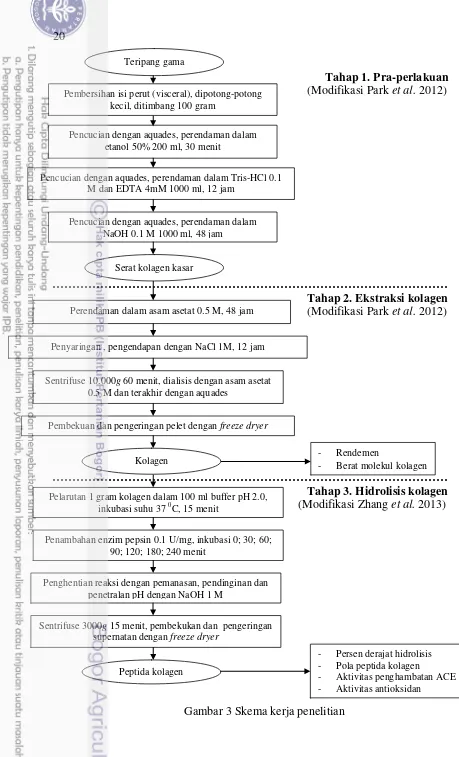
3 Skema kerja penelitian 20
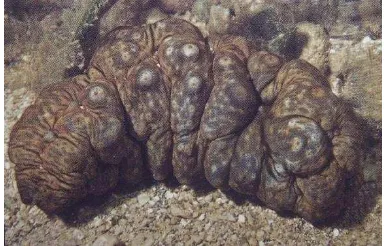
4 Teripang gama segar (Stichopus variegatus) 24
5 Kolagen teripang gama 26
6 Derajat hidrolisis kolagen teripang gama 28
7 Pola hidrolisis kolagen oleh enzim pepsin dengan aktivitas 0.1 U/mg 30
8 Aktivitas penghambatan ACE peptida kolagen 32
9 Aktivitas penangkalan radikal DPPH peptida kolagen 34
DAFTAR LAMPIRAN
1 Komposisi dan pereaksi SDS PAGE 47
2 Perhitungan berat molekul kolagen dan peptida kolagen 49 3 Analisis keragaman dan uji lanjut untuk persen derajat hidrolisis 50 4 Analisis keragaman dan uji lanjut untuk aktivitas penghambatan ACE 51 5 Analisis keragaman dan uji lanjut untuk aktivitas antioksidan 52
PENDAHULUAN
Latar Belakang
Teripang merupakan salah satu hewan berkulit duri (Echinodermata) yang memiliki warna bervariasi, tubuhnya bulat dan silindris memanjang, berlendir, banyak ditemukan di dasar perairan yang jernih, tenang, dan di wilayah yang banyak ditumbuhi oleh lamun, rumput laut, dan terumbu karang. Makanan utama teripang adalah organisme kecil, detritus, protozoa, dan nematoda (Kustiariyah 2007). Permintaan pasar dunia terhadap ketersediaan teripang terus meningkat dalam 10 tahun terakhir. Beberapa komoditas ekspor teripang Indonesia diantaranya teripang pasir, teripang hitam, teripang getah, teripang merah, dan teripang coklat (Martoyo et al. 2000). Harga jual teripang tersebut di pasaran bervariasi antara Rp 50.000,00 hingga Rp 300.000,00 per kg bahkan jenis teripang pasir yang sudah dikeringkan bisa mencapai Rp 1.000.000,00 per kg (KKP 2013). Teripang gama merupakan salah satu jenis teripang yang memiliki ciri tubuh berwarna hijau tua dengan bintik-bintik kecil berwarna putih, tubuh bagian dalam berwarna abu-abu muda, memiliki panjang 20-30 cm, bertekstur kenyal, dan tubuhnya silindris memanjang. Teripang ini jumlahnya cukup melimpah akan tetapi nilai ekonomisnya masih rendah. Teripang gama banyak dijumpai di perairan Provinsi Lampung dan Nusa Tenggara (Setyastuti dan Purwati 2015). Teripang di beberapa negara Asia merupakan salah satu makanan yang lezat dan telah diperdagangkan selama ribuan tahun. Teripang mengandung berbagai komponen bioaktif yang bermanfaat terhadap kesehatan (Forero et al. 2013). Teripang memiliki kandungan protein yang tinggi yaitu sekitar 73 % dimana 2/3 dari total protein tersebut merupakan protein jenis kolagen (Saito et al. 2002).
Kolagen merupakan salah satu jenis protein jaringan ikat yang menyusun komponen gigi, otot, tulang, kuku, dan kulit. Kolagen memiliki stuktur yang unik karena struktur primernya berbentuk triple helix yang berarti 3 rantai polipeptida spiral (Kucharz 1992). Kolagen yang selama ini banyak beredar di pasaran merupakan kolagen yang berasal dari kulit dan tulang mamalia darat seperti kulit babi (46 %), tulang sapi (23 %), dan ayam. Beberapa tahun terakhir banyak ditemukan laporan sapi terserang penyakit sapi gila dan juga mewabahnya firus flu burung yang banyak menyerang unggas (Gomez-Guillen et al. 2009). Selain itu, meningkatnya kesadaran masyarakat akan sumber pangan yang halal (non babi) menyebabkan masyarakat berusaha mencari alternatif sumber kolagen yang lebih aman. Teripang memiliki potensi untuk dikembangkan sebagai alternatif sumber kolagen dari biota laut. Beberapa penelitian melaporkan kolagen dapat diekstrak dari teripang jenis Stichopus vastus, Parastichopus californicus, dan
Stichopus monotuberculatos (Abeedin et al. 2013; Liu et al. 2010; Zhong et al.
2015).
2
unik dan memiliki aktivitas penghambatan ACE (antihipertensi). Selain itu, peptida protein juga memiliki aktivitas antioksidan seperti yang dilaporkan You et al. (2010) pada hidrolisat ikan sidat dan antimikroba seperti yang dilaporkan Liu
et al. (2008) pada hidrolisat kerang.
Hipertensi merupakan penyakit tidak menular yang disebabkan karena mekanisme renin angiotensinogen yang tidak seimbang di dalam tubuh. Renin mengkatalisis substrat angiotensinogen yang dihasilkan oleh hati menjadi senyawa aktif angiotensin I. Senyawa ini selanjutnya dikatalisis oleh enzim ACE (angiotensin-I converting enzyme) dari paru-paru menjadi angiotensin II. Perubahan angiotensin I menjadi II menyebabkan meningkatknya sekresi aldosteron, aktivitas syaraf simpatik, retensi garam, dan vasokonstriksi pembuluh darah sehingga tekanan darah menjadi meningkat (Kearney et al. 2005). Beberapa senyawa penghambat kerja enzim ACE (ACE inhibitor) yang telah diproduksi secara sintetik diantaranya captopril, ramipril dan enalapril (Jimsheena dan Gowda 2010). Peptida bioaktif dilaporkan memiliki aktivitas penghambatan ACE menyerupai senyawa sintetik. Hal ini disebabkan karena peptida mampu berikatan dengan sisi aktif enzim sehingga menghalangi reaksi enzim dan substrat. Selain itu, peptida bioaktif juga mampu membentuk molekul kompleks dengan substrat sehingga proses katalisis enzim menjadi terganggu (Kim dan Byun 2012).
Radikal bebas yang berasal dari lingkungan maupun pangan dapat memicu terjadinya stres oksidatif tingkat seluler. Apabila hal ini terjadi secara terus menerus maka dapat memicu kerusakan sistem metabolisme dan timbulnya penyakit degeneratif. Senyawa yang mampu menangkal radikal bebas dan menghambat laju oksidasi disebut dengan antioksidan (Valko et al. 2007). Senyawa antioksidan alami yang bisa didapatkan dari sumber makanan diantaranya vitamin C, vitamin E, senyawa fenolik, flavonoid sedangkan senyawa antioksidan sintetik diantaranya BHT (buthylated hydroxyl toluene), BHA (buthylated hydroxyl anisole), dan TBHQ (Tertier buthylated hydroxyl quinone) (Shebis et al. 2013). Selain dari kedua sumber tersebut, antioksidan juga bisa dihasilkan dari peptida bioaktif. Hal ini disebabkan peptida mampu mendonorkan atom hidrogen sehingga mampu menghambat laju oksidasi (Mendis et al. 2005).
3 Rumusan Masalah
Teripang gama (Stichopus variegatus) dapat dijumpai di beberapa perairan Indonesia dengan jumlah yang cukup melimpah. Akan tetapi sampai saat ini pemanfaatan secara komersial masih terbatas pada jenis teripang pasir (Holothuria scabra). Malaysia secara intensif telah mengeksplorasi jenis teripang gama untuk dijadikan ekstrak teripang. Teripang gama memiliki potensi yang besar untuk dikembangkan sebagai komoditas ekspor perikanan Indonesia. Permintaan pasar yang terus meningkat dan wilayah laut yang begitu luas merupakan peluang bagi Indonesia untuk menjadi produsen produk teripang bernilai tambah.
Saat ini masyarakat cenderung kembali pada penggunaan bahan alami karena dinilai lebih aman dibandingkan obat-obat yang umumnya berasal dari senyawa sintetik yang memiliki efek samping. Potensi kolagen dan hidrolisat kolagen dari teripang gama masih belum banyak diteliti sehinga diperlukan penelitian mengenai metode ekstraksi, hidrolisis, dan pengujian bioaktivitasnya. Oleh karena itu, rumusan masalah dalam penelitian ini adalah :
1. Perlu mengetahui pengaruh derajat hidrolisis terhadap bioaktivitas peptida dari kolagen teripang, dan
2. Perlu mengetahui aktivitas penghambatan ACE dan antioksidan peptida bioaktif dari kolagen teripang.
Hipotesis
Hipotesis yang ingin dibuktikan pada penelitian ini adalah peptida kolagen teripang gama (Stichopus variegatus) memiliki aktivitas penghambatan ACE dan antioksidan.
Tujuan Penelitian
Penelitian yang dilakukan memiliki tujuan 1) mendapatkan persen derajat hidrolisis yang menghasilkan peptida bioaktif dengan aktivitas yang diharapkan, 2) mendapatkan data bioaktivitas peptida kolagen meliputi aktivitas penghambatan ACE dengan enzim angiotensin-I coverting enzyme dan aktivitas antioksidan.
Manfaat Penelitian
4
TINJAUAN PUSTAKA
Teripang
Teripang merupakan salah satu anggota hewan berkulit duri (Echinodermata) tapi tidak semua memiliki duri. Duri tersebut sebenarnya merupakan rangka (skeleton) yang tersusun dari zat kapur yang terbenam di dalam kulit. Di antara 3 famili teripang, hanya famili Holothuroidea dan Stichopodidea saja yang dapat dimakan dan bernilai ekonomis (Martoyo et al. 2000). Tubuh teripang pada umumnya berbentuk bulat dengan panjang sekitar 10-30 cm. Mulutnya ada pada salah satu ujung dan duburnya berada di ujung lain. Tubuh teripang silindris memanjang seperti mentimun. Oleh sebab itu teripang sering disebut dengan istilah mentimun laut. Gerakannya sangat lamban sehingga hampir seluruh hidupnya berada di dasar perairan. Warna tubuh teripang bermacam-macam ada yang hitam pekat, coklat, abu-abu, dan ada juga yang merah tua dan orange. Teripang banyak ditemukan di dasar perairan yang jernih dengan kedalaman 1-40 m. makanan utama teripang adalah organisme kecil, detritus, rumput laut, lamun, diatom, protozoa, dan nematoda (Widodo 2011). Ukuran tubuh teripang berbeda-beda antar spesies misalnya jenis Actinophyga mauritidna
memiliki panjang 30 cm dengan berat 2.8 kg, sedangkan jenis Holothuria scabra
dengan panjang 25-35 cm memiliki berat antara 0.25-0.35 kg. Di Indonesia terdapat sekitar 23 spesies yang telah teridentifikasi (Sendih dan Gunawan 2006).
Genus teripang yang banyak ditemukan di Indonesia dan memiliki nilai ekonomis ada 3 yaitu Holothuria, Muelleria, dan Stichopus. Spesies dari genus Holothuria diantaranya Holothuria scabra, Holothuria vacabunda, Holothuria edulis, dan Holothuria marmorata. Spesies dari genus Muelleria hanya satu yaitu
Muelleria lecanora sedangkan spesies dari genus Stichopus diantaranya Stichopus vastus, Stichopus cloronotus, Stichopus quadrifascinatus, dan Stichopus variegatus (Setyastuti dan Purwati 2015). Teripang gama merupakan nama lokal untuk spesies Stichopus variegatus. Teripang ini memiliki warna tubuh kuning agak hijau tua kehitaman dengan bintik-bintik kecil berwarna putih di seluruh tubuh sedangkan tubuh bagian dalam berwarna abu-abu muda. Tubuhnya dipenuhi oleh duri-duri halus, bertekstur kenyal, silindris memanjang dan berlendir. Teripang dewasa memiliki berat 500-1000 gram per ekor. Teripang gama banyak ditemukan di perairan dangkal Provinsi Lampung dan Nusa Tenggara (Colin dan Arneson 1995). Gambar teripang gama disajikan pada Gambar 1. Secara taksonomi, teripang gama diklasifikasikan sebagai berikut (WoRMS 2012) :
Phylum : Echinodermata Class : Holothuroidea Ordo : Aspidochirota Family : Stichopodidae Genus : Stichopus
5
Gambar 1 Teripang gama (Sumber: Colin dan Arneson 1995)
Teripang kering memiliki kandungan gizi tinggi yang kaya akan kandungan protein, asam lemak tidak jenuh (omega 3), mineral (magnesium, fosfor, sodium, potassium, seng, tembaga), vitamin B kompleks (tiamin, riboflavin, niasin), dan beberapa senyawa bioaktif seperti lektin, glukosamin, kondroitin sulfat, mukopolisakarida, dan saponin glikosida (Kordi 2010). Teripang memiliki kandungan protein yang tinggi sekitar 72 % dan telah banyak dimanfaatkan dalam bidang farmasi dan medis. 70 % dari total kandungan protein tersebut merupakan protein jenis kolagen (Saito et al. 2002). Manfaat kolagen dalam tubuh diantaranya sebagai agen antipenuaan, memelihara kesehatan sendi dan tulang, serta mampu mempercepat penyembuhan luka. Asam lemak omega 3 mampu menurunkan kadar trigliserida dan kolesterol di dalam darah, mempercepat penyembuhan luka dan menghalangi pembentukan prostaglandin penyebab radang. Lektin dari ekstrak teripang mampu menghambat pertumbuhan sel kanker dan memiliki efek positif terhadap perlawanan virus HIV. Glukosamin mampu meningkatkan sistem imun, mencegah terjadinya gangguan persendian, antiinflamasi, dan juga dapat menurunkan resiko terkena aterosklerosis (Sendih dan Gunawan 2006). Kondroitin sulfat memiliki manfaat dapat mencegah pengeroposan sendi, memperbaiki jaringan tulang rawan, dan sebagai suplemen yang dapat meningkatkan stamina tubuh. Saponin glikosida memiliki struktur yang sama dengan senyawa ganoderma pada gingseng laut. Senyawa ini dilaporkan mampu menghambat pertumbuhan sel kanker dan sebagai tonik suplemen gizi (Widodo 2011). Komposisi kandungan gizi teripang disajikan pada Tabel 1.
Tabel 1 Kandungan gizi teripang Komposisi Persentase (%)
Air (bb) 87.33 ± 1.09 Protein (bk) 72.93 ± 7.58 Lemak (bk) 3.54 ± 0.24
6
Kolagen
Kolagen merupakan salah satu jenis protein jaringan ikat berbentuk serat yang menyusun sekitar sepertiga tubuh vertebrata. Kolagen merupakan komponen utama penyusun gigi, otot daging, tulang, dan lapisan kulit dalam. Kolagen tersusun dari asam amino unik yang membentuk struktur tripel heliks. Glisin sebagai asam amino utama penyusun kolagen dan selalu berada pada posisi ketiga disetiap pengulangan sekuens. Struktur utama kolagen yaitu gly-x-y, dimana x biasanya berisi asam amino prolin sedangkan y berisi asam amino hidroksiprolin. Hidroksiprolin merupakan turunan prolin dari reaksi hidroksilasi pos-translasi yang dimediasi oleh prolil hidroksilase. Kolagen juga mengandung asam amino yang tidak umum yaitu hidroksilisin. Hidroksilisin terbentuk dari lisin yang mengalami hidroksilasi oleh enzim lisil hidroksilase. Kedua asam imino tersebut membentuk ikatan hidrogen dan struktuk yang stabil dari tripel heliks kolagen (Kucharz 1992).
Struktur helix kolagen berbentuk left hand helix. Ketiga molekul heliks dihubungkan satu sama lain dengan ikatan hidrogen seperti pada -helix DNA (Cui et al. 2007). Selain struktur heliks, kolagen juga mengandung stuktur non heliks berupa telopeptida yang mengapit bagian heliks, C-propeptida, dan N-propeptida. Telopeptida berfungsi membentuk ikatan silang kovalen antar molekul dan sebagai penghubung matriks antar molekul. Stuktur sekunder kolagen terus berpilin membentuk stuktur tersier kompleks dan akhirnya menjadi serat (fibril). Kolagen saat ini telah terbagi menjadi 28 tipe, akan tetapi 90 % nya merupakan kolagen tipe I, II, III, dan IV (Friess 1998).
Kolagen tipe I merupakan kolagen utama penyusun kulit, tendon, dan tulang hewan. Tipe ini tersusun dari γ rantai, dua rantai identik berbentuk α1(I),
dan satu rantai berbentuk αβ(I) dengan komposisi asam amino yang berbeda dan
terkadang juga tersusun dari trimer rantai α1(I). Stuktur kolagen tipe I disajikan pada Gambar 2. Kolagen tipe II terdapat pada tulang rawan hialin dan subunit
α1(II) memiliki bentuk yang mirip dengan α1(I). Tipe III ditemukan dalam jumlah
yang sedikit (sekitar 10 %) dan berikatan dengan tipe I. Tipe ini terkadang menjadi penghalang proses ekstraksi kolagen tipe I pada kulit hewan. Komponen penyusun pembuluh darah banyak didominasi oleh kolagen tipe III. Kolagen tipe I, II, dan III sebagian besar tersusun dari komponen homolog tergantung spesies. Kolagen tipe IV merupakan penyusun utama jaringan urat syaraf pada membran basal. Kolagen tipe lain terdapat dalam jumlah yang sedikit di dalam tubuh dan biasanya berikatan dengan kolagen tipe I-IV (Kucharz 1992). Menurut Kadler et al. (2007), pembagian tipe kolagen adalah sebagai berikut :
Kolagen fibrillar, yaitu kolagen tipe I, II, III, V, dan XI.
Kolagen yang membentuk jaringan, yaitu kolagen Tipe IV (Lamina densa dari dasar membran Hemidesmosom), VIII dan X.
Kolagen fibrillar terasosiasi (FACIT), yaitu kolagen tipe IX, XII, XIV, dan XXII.
Kolagen berbentuk rangkaian mutiara, yaitu kolagen tipe VI.
Verankerungsfibrillen, yaitu kolagen tipe VII.
7
Gambar 2. Stuktur kimia kolagen tipe I. a) sekuens asam amino primer, b) stuktur sekunder left handed helix dan tersier right handed triple-helix, c) stuktur kuartener (Friess 1998).
Fungsi kolagen dalam tubuh yaitu menghasilkan asam amino penting diantaranya (Kadler et al. 2007) :
Lisin, prolin dan glisin secara khusus diperlukan oleh tubuh untuk membentuk struktur jaringan penyokong, dan untuk menjaga fungsi sel
Hidroksiprolin, memberi kekuatan dan kekenyalan pada jaringan penyokong dan tulang
Glisin, melembabkan kulit
Alanin, prolin dan asparagin menstabilkan struktur dan mengenyalkan kulit dan sebagai agen anti penuaan
Arginin, mengatur pola tidur yang seimbang
Melindungi tulang rawan dan sendi dari kerusakan oksidatif
Mengenyalkan dan melembabkan kulit.
8
Tabel 2 Komposisi asam amino kolagen tipe I (residu/1000residu) Asam
Permasalahan utama dalam ekstraksi kolagen tipe I dari jaringan adalah keberadaan ikatan silang kovalen antar molekul. Kolagen merupakan protein yang tidak larut dalam pelarut organik. Jumlah kolagen yang bisa diekstrak tergantung pada jenis jaringan dan usia hewan. Jaringan hewan yang masih muda mengandung sedikit ikatan silang antar molekul sehingga kolagen mudah larut dalam pelarut air. Kolagen tipe I dapat diekstrak dengan beberapa metode di antaranya metode asam, basa, modifikasi asam-enzim, dan garam netral (Friess 1998). Sebelum ekstraksi, sampel kolagen terlebih dahulu dilakukan proses pra-perlakuan. Tahapan ini bertujuan untuk membuka struktur kolagen yang terikat pada matriks tripel heliks. Komponen nonkolagen dapat dipisahkan dengan melarutkannya ke dalam larutan basa hidroksida atau basa sulfat seperti 10 % NaOH dan Na2SO4 selama 48 jam. Lemak yang terikat pada kolagen mengalami
saponifikasi, telopeptida nonheliks terpotong dan serat kolagen terpisah. Ukuran dan berat molekul kolagen yang dihasilkan tergantung pada lamanya waktu perendaman dan konsentrasi larutan basa (Roreger 1995).
9 terbuka. Larutan asam tidak dapat memisahkan ikatan silang keto-imin sehingga kolagen yang berasal dari jaringan seperti tulang, kartilago, hewan yang sudah tua tidak akan larut dalam pelarut asam. Ekstraksi asam biasanya dilakukan pada suhu dingin untuk menjaga integritas jaringan dan dicuci dengan aquades untuk menghilangkan protein larut air dan polisakaria (Trelstad 1982). Selain menggunakan metode asam, ekstraksi kolagen juga dapat dilakukan dengan modifikasi asam-enzim. Penggunaan enzim seperti pepsin, kimotripsin, dan pronase dibawah suhu 20 0C yang dikombinasikan dengan asam asetat 0.5 M mampu menghasilkan rendemen kolagen yang lebih tinggi. Hal ini disebabkan karena enzim mampu memutus ikatan peptida dan ikatan silang pada ujung nonheliks kolagen. Selain itu ujung telopeptida pada rantai polimer juga terputus sehingga kelarutan kolagen dalam pelarut asam menjadi meningkat (Piez 1985).
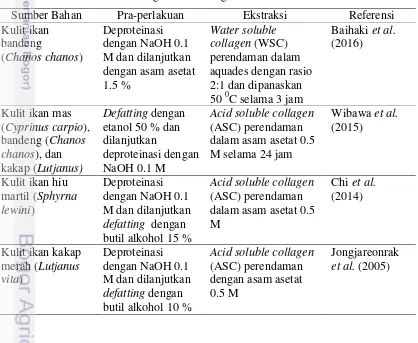
Kolagen larut asam biasanya dimurnikan dengan metode persipitasi setelah suhu, pH dan konsentrasi garamnya dinetralkan. Larutan kolagen yang terlalu tinggi kekentalannya membutuhkan metode tambahan seperti kromatografi, elektroforesis dan sedimentasi (Piez 1985). Garam netral yang biasa digunakan dalam ekstraksi kolagen adalah NaCl dengan konsentrasi 0.1-2 M. Modifikasi suhu, laju pengadukan, dan rasio sampel dengan larutan pengekstrak dapat mengubah komposisi turunan kolagen. Bahan yang telah terekstrak biasanya dimurnikan dengan dialisis, persipitasi, dan sentrifugasi (Fielding 1976). Beberapa metode ekstraksi kolagen dari berbagai sumber bahan disajikan pada Tabel 3.
Tabel 3 Metode ekstraksi kolagen dari berbagai sumber bahan
Sumber Bahan Pra-perlakuan Ekstraksi Referensi
10
Tabel 3 Metode ekstraksi kolagen dari berbagai sumber bahan (lanjutan) Teripang
Pangan fungsional merupakan pangan konvensional bagian dari menu diet yang mampu memberikan manfaat bagi kesehatan dan mengurangi resiko terkena penyakit kronis (Health Canada 2006). Pangan fungsional merupakan pangan modifikasi maupun pangan alami yang mampu memberikan manfaat kesehatan melebihi nutrisi dasar yang terkandung didalamnya (Arai 2002). Pangan yang dikonsumsi secara teratur sebagai diet keseharian yang telah dirancang secara khusus untuk memberikan manfaat kesehatan dengan mengatur fungsi tubuh untuk melindungi terhadap penyakit seperti hipertensi, kanker, diabetes, jantung koroner, dan osteoporosis (CSIRO Human Nutrition 2004).
Pangan fungsional dikategorikan menjadi 2, yaitu pangan konvensional dan pangan modifikasi. Pangan konvensional merupakan pangan yang mengandung komponen alami dan tersedia dalam bentuk utuh misalnya biji-bijian utuh, kacang, kedelai, buah, sayuran dan sebagainya. Pangan modifikasi merupakan pangan yang telah diubah dengan teknologi untuk mendapatkan khasiat fungsional, dengan diperkaya atau ditambahkan komponen tertentu yang memiliki efek positif, atau juga dengan menghilangkan komponen yang memiliki dampak negatif (misalnya protein alergen, laktosa susu) (Giacco et al. 2013). Beberapa aspek yang harus dipenuhi sebagai syarat pangan fungsional (Doyon dan Labrecque 2003):
1. Pangan (bukan kapsul tablet, atau serbuk) yang berasal dari bahan alami 2. Bisa dikonsumsi sebagai diet keseharian
11
Meningkatkan mekanisme pertahanan tubuh
Mencegah penyakit tertentu
Memulihkan dari penyakit tertentu
Mengendalikan kondisi fisik dan mental
Memperlambat proses penuaan dini
Pangan fungsional selain memberikan asupan nutrisi juga memberikan manfaat terhadap kesehatan diantaranya meningkatkan kesehatan saluran pencernaan, menyeimbangkan metabolisme glukosa dan lipid, mengurangi resiko penyakit kardiovaskular, mengurangi resiko kanker, dan meningkatkan kesehatan tulang (Giacco et al. 2013). Indeks glikemik (IG) merupakan indikator kemampuan karbohidrat dalam meningkatkan gula darah yang secara langsung berhubungan dengan meningkatnya resiko diabetes militus tipe 2 dan penyakit jantung koroner. Pangan dengan IG rendah dipercaya mampu menurunkan resiko terhadap penyakit tersebut. Beberapa bahan pangan yang memiliki nilai IG rendah diantaranya pati resistan, inulin, FOS (fructo-oligosaccaride), dan GOS ( gluco-oligosaccaride). Bahan pangan tersebut juga dapat berfungsi sebagai prebiotik. (Liu et al. 2013). Selain prebiotik, bahan pangan yang mengandung probiotik juga diketahui mampu meningkatkan kesehatan usus dan mengurangi resiko terkena kanker kolon. Probiotik yang biasa ditambahkan ke dalam pangan diantaranya
Lactobacillus sp, Bifidobacterium sp, dan Stretococcus sp. (Howlett 2008). Pasien dengan riwayat penyakit diabetes memiliki resiko yang lebih tinggi terkena penyakit kardiovaskular. Resiko ini tidak hanya disebabkan karena kadar gula yang tinggi akan tetapi juga karena konsentrasi kolesterol yang tinggi. Diet rendah kolesterol serta peningkatan asupan serat tinggi dan fitosterol mampu menurunkan resiko penyakit kardiovaskular. Pangan yang mengandung serat tinggi diantaranya barley, oat, gandum, umbi-umbian. Selain itu kedelai dan kacang juga mampu menurunkan konsentrasi kolesterol. (Jenkins et al. 2011). Penyakit kardiovaskular merupakan kelompok penyakit degeneratif dari jantung dan sistem sirkulasi darah termasuk penyakit jantung koroner (PJK), aterosklerosis (penyempitan pembuluh darah), dan stroke. Radikal bebas diketahui sebagai penyebab timbulnya penyakit jantung kronis dan akut karena di dalam sel terjadi stress oksidatif. Oksidasi LDL (Low Density Lipoprotein) yang berasal dari lemak jenuh dan trans menyebabkan terjadinya aterosklerosis dan PJK yang di inisiasi oleh terbentuknya plak pada pembuluh arteri. (Wang et al. 2007).
Penyakit jantung koroner merupakan masalah kesehatan utama di dunia dan secara langsung berhubungan dengan tekanan darah tinggi (hipertensi). Hipertensi meningkatkan resiko kerusakan pembuluh arteri. Faktor penting penyebab timbulnya penyakit jantung koroner diantaranya obesitas, kolesterol tinggi, tekanan darah tinggi, dan diabetes militus tipe 2. Peningkatan resiko PJK tidak hanya dikarenakan pola makan yang buruk, tetapi juga disebabkan gaya hidup tidak sehat seperti merokok dan mengkonsumsi alkohol. Orang dengan pola konsumsi pangan yang sehat, gaya hidup produktif, tidak merokok dan tidak mengkonsumsi alkohol memiliki resiko lebih rendah terkena PJK (Riccioni et al.
12
Peptida Bioaktif
Peptida bioaktif merupakan potongan-potongan protein spesifik yang memiliki efek positif terhadap tubuh dan dapat mempengaruhi kesehatan. Protein dalam bentuk utuh memiliki bioaktivitas yang rendah sedangkan protein yang telah dihidrolisis dengan enzim akan meningkat bioaktivitasnya karena protein telah lepas dari ikatan panjang fragmennya. Peptida bioaktif memiliki potensi sebagai senyawa antihipertensi, antioksidan, antagonis opioid, antibakteri, antitrombotik, dan imunomodulator (Murray dan Fitzgerald 2007). Peptida yang dihasilkan dari protein pangan dapat menurunkan tekanan darah, menjaga keseimbangan berat badan, menghambat aktivitas endopeptidase spesifik prolin, meningkatkan sistem imun, menghambat agregasi platelet darah, menghambat proteinase HIV dan proses oksidasi, memiliki aktivitas antibakteri dan antikapang, mengikat ion dan membantu tanspor mineral dan memperbaiki nilai gizi pangan (Li dan Yu 2014; Chakrabarti et al. 2014).
Beberapa peptida dilaporkan memiliki manfaat multifungsi sebagai contoh peptida dengan sekuen tertentu memiliki aktivitas antioksidan maupun antihipertensi. Aktivitas suatu peptida tergantung pada komposisi dan sekuen asam amino. Peptida bioaktif biasanya tersusun dari 2-20 residu asam amino meskipun beberapa penelitian melaporkan peptida dengan sekuen lebih dari 20 asam amino juga memiliki aktivitas biologis (Pihlanto 2001). Peptida bioaktif memiliki aktivitas menyerupai hormon atau obat-obatan yang memodulasi fungsi biologis melalui interaksi ikatan spesifik terhadap suatu reseptor pada sel target sehingga memberi efek kesehatan (Sharma et al. 2011). Aplikasi peptida untuk tujuan terapi seperti terapi kanker, infeksi, kerusakan sistem imun, dan penyakit kardiovaskular telah banyak diteliti dan dikembangkan (Bhat et al. 2015).
Peptida bioaktif dapat dihasilkan dari beberapa cara yaitu 1) hidrolisis enzimatis dengan enzim pencernaan, 2) fermentasi dengan memanfaatkan aktivitas mikroba, 3) sintesis kimia (Bhat et al. 2015). Hidrolisis enzimatis protein dengan enzim proteolitik yang sesuai mampu menghasilkan peptida dengan aktivitas yang diharapkan. Kondisi fisiko-kimia dari substrat seperti suhu dan pH larutan harus sesuai dengan kondisi optimal kerja enzim. Beberapa enzim yang
biasa digunakan untuk hidrolisis diantaranya papain, tripsin, α-kimotripsin, pepsin,
bromelain, alkalase, dan netrase. Faktor terpenting dalam produksi peptida bioaktif adalah berat molekul dari peptida tersebut. Metode yang biasa digunakan untuk menghasilkan peptida dengan berat molekul tertentu adalah sistem membran ultrafiltrasi. Sistem hidrolisis bertingkat dengan memanfaatkan beberapa enzim sekaligus mampu menghasilkan peptida dengan ukuran yang lebih kecil. Kombinasi dari sistem membran reaktor multistep hidrolisis dan sistem membran ultrafiltrasi mampu menghasilkan peptida dengan aktivitas optimal (Kim dan Wijesekara 2010).
Mikroba yang ada secara alami dalam bahan pangan maupun starter yang telah dikembangkan seperti golongan bakteri asam laktat (BAL) dilaporkan mampu menghasilkan senyawa peptida bioaktif. Beberapa jenis BAL yang digunakan dalam fermentasi diantaranya Lactobacillus sp, Streptococcus sp,
13 mikroba protease mampu menghasilkan peptida dengan ukuran kecil sehingga bioaktivitasnya mengalami peningkatan (Bhat et al. 2015). Selain susu, hidrolisat daging hewan juga telah banyak dilaporkan menghasilkan peptida bioaktif. Saiga
et al. (2003) melaporkan daging ayam yang difermentasi dengan Aspergillus sp
kemudian dihidrolisis dengan enzim pencernaan menghasilkan peptida dengan sekuens Gly-Phe-Hyp-Gly-Thr-Hyp-Gly-Leu-Hyp-Gly-Phe. Peptida ini memiliki aktivitas penghambatan ACE.
Sintesis secara kimiawi merupakan metode yang paling banyak digunakan untuk memproduksi peptida dalam skala laboratorium. Ada dua metode yang digunakan yaitu sintesis fase cair dan fase padat. Sintesis fase padat mampu menghasilkan peptida dengan residu 1-10 asam amino. Peptida yang telah diketahui sekuen dan residunya dari hasil hidrolisis enzimatis selanjutnya dilakukan sintesis secara kimiawi untuk menghasilkan peptida dengan sekuen yang sama. Selain secara kimiawi, peptida juga bisa dihasilkan dari teknologi DNA rekombinan. Akan tetapi, metode ini belum mampu menghasilkan peptida dengan sekuen kurang dari 10 asam amino. Pengembangan metode sintesis terus dilakukan untuk menghasilkan peptida dengan aktivitas yang sama dari proses hidrolisis secara enzimatis maupun fermentasi mikroba (Korhonen dan Pihlanto 2003).
Biota laut telah banyak diteliti mampu menghasilkan peptida bioaktif dengan hidrolisis secara enzimatis (Jee et al. 2005). Peptida bioaktif dari sumber biota laut maupun dari limbah pengolahan telah dilaporkan memiliki fungsi fisiologis diantaranya sebagai agen antioksidan, antimikroba, dan penghambatan ACE (Mendis et al. 2005; Liu et al. 2008; Byun dan Kim 2001). Beberapa penelitian telah mengungkapkan aktivitas peptida bioaktif secara in vitro maupun
in vivo dan mengkaji hubungan antara keduanya namun klaim resmi sifat fungsionalnya masih belum dilakukan oleh komunitas kesehatan internasional karena masih dalam tahap investigasi (Shahidi 2007).
Kolagen dan gelatin yang diekstrak dari sumber biota laut kemudian dihidrolisis dengan enzim pencernaan menghasilkan peptida dengan sifat yang unik. Aleman et al. (2013) melaporkan kolagen yang diekstrak dari cumi-cumi kemudian dihidrolisis dengan enzim esperase menghasilkan dekapeptida dengan sekuen Gly-Arg-Gly-Ser-Val-Pro-Ala-Hyp-Gly-Pro. Dekapeptida ini memiliki aktivitas penghambatan ACE (antihipertensi). Vo et al. (2011) dalam penelitiannya menggunakan gelatin dari kulit ikan nila kemudian dihidrolisis menggunakan enzim alkalase, pronase E, pepsin, dan tripsin. Hidrolisis dengan enzim alkalase menghasilkan peptida dengan sekuens Asp-Pro-Ala-Leu-Ala-Thr-Glu-Pro-Asp-Pro-Met-Pro-Phe dan peptida ini juga memiliki aktivitas penghambatan ACE (antihipertensi).
Hipertensi
14
hipertensi berat dengan tekanan darah > 160 mmHg dan > 100 mmHg. 90 % hipertensi disebabkan karena gejala primer yang belum diketahui sebabnya dan 10 % karena gejala sekunder akibat rusaknya metabolisme organ tubuh seperti penyakit ginjal, kelainan endokrin, penurunan fungsi organ tubuh atau karena pemakaian obat. Hipertensi merupakan bagian dari kelompok penyakit kardiovaskular (cardiovascular disease) termasuk aterosklerosis, jantung koroner, gagal jantung, dan stroke. Kardiovaskular merupakan jenis penyakit yang menyebabkan kematian terbesar di seluruh dunia. Sekitar 25% populasi manusia di dunia mengalami hipertensi pada tahun 2000 dan akan meningkat menjadi 1.56 triliyun pada tahun 2025 (Baker 2005).
Sistem renin-angiotensin aldosteron merupakan sistem hormon yang mengatur tekanan darah dan keseimbangan cairan tubuh. Selain itu, sistem tersebut memegang peranan penting dalam patofisiologi penyakit kardiovaskular seperti jantung koroner dan hipertensi. Renin plasma yang dihasilkan oleh ginjal bertanggung jawab dalam mengubah hormon angiotensinogen yang dilepaskan hati menjadi angiotensin I. Angiotensin I merupakan dekapeptida dengan sekuens Asp-Arg-Tyr-Val-Ile-His-Pro-Phe-His-Leu. Senyawa ini akan aktif apabila dikatalisis oleh enzim ACE (angiotensin-I converting enzymes) yang dihasilkan oleh paru-paru menjadi oktapeptida angiotensin II (Khullar 2012). Angiotensin II merupakan hormon yang kuat dan menyebabkan serangkaian perubahan di dalam tubuh. Hormon ini pada pembuluh darah menyebabkan vasokontriksi sehingga dinding pembuluh darah menebal dan menyempit. Angiotensin II merangsang adrenal korteks untuk memproduksi senyawa aldosteron sehingga retensi garam natrium di dalam darah meningkat. Selain itu, angiotensin II juga meningkatkan aktivitas sistem syaraf simpatik. Semua mekanisme tersebut menyebabkan tekanan darah menjadi meningkat (hipertensi). Keberadaan angiotensin II di dalam darah hanya sekitar 30-60 detik dan selanjutnya dikatalisis oleh aminopeptidase A menjadi angiotensin III dan aminopeptidase N menjadi angiotensin IV. Kedua angiotensin ini merupakan hormon yang tidak aktif dan didetoksifikasi oleh organ ginjal (Kearney et al. 2005).
Penelitian mengenai hipertensi terus dikembangkan hingga menghasilkan obat antihipertensi komersial. Obat hipertensi dibagi menjadi beberapa golongan yaitu diuretik (hydrochlorothiazide, indapamida, metalozone), aldosteron reseptor bloker (eplerenone, spironolactone), alfa bloker (doxasozin, terasozin), beta bloker (atenolol, nadolol, propanolol), kombinasi alfa dan beta bloker (carvediol, labetalol), ACE inhibitor (captopril, enalapril, ramipril), Angiotensin II reseptor bloker (candesartan, irbesartan, valsartan), kalsium channel bloker (amlodipine, felodipine, nisoldipine), direct renin inhibitor (aliskirene, remikirene), dan direct vasodilator (hydralazine, minoxidil). Semua obat tersebut disintesis secara kimiawi dan telah disetujui oleh Food and Drug Association (FDA) (Chobanian et al. 2003). Obat hipertensi yang diproduksi secara kimiawi dilaporkan memiliki efek samping terhadap kesehatan diantaranya sesak nafas, perut kembung, susah buang air besar, mulut kering, alergi kulit, dan pusing kepala. Selain itu, obat hipertensi juga memicu munculnya penyakit degeneratif yang lain. Oleh karena itu, semenjak 1 dekade terakhir mulai dikembangkan obat hipertensi yang lebih alami dan tidak memiliki efek samping (Vikrant dan Tiwari 2001).
15 tekanan darah melalui sistem renin angiotensin. ACE merupakan enzim yang disekresikan oleh paru-paru dan aktif pada pH 8.0 (Norris dan Richard 2013). ACE memiliki 3 sisi aktif yaitu antepenultimate (S1) yang berupa ion Zn2+,
penultimate (S1’) yang berupa ikatan hidrogen dan ultimate (Sβ’) yang berupa
ikatan kovalen. ACE bekerja spesifik pada substrat angiotensin I yang merupakan dekapeptida kemudian sisi aktif Zn2+ memutus ikatan peptida antara asam amino fenilalanin dan histidin menghasilkan oktapeptida angiotensin II. Angiotensin II merupakan vasokonstriktor kuat yang menyebabkan tekanan darah menjadi meningkat. Senyawa yang mampu menghambat kerja enzim ACE diantaranya captopril dan enalapril. Captopril bekerja secara spesifik dengan mengikat sisi aktif enzim ACE dan termasuk inhibitor kompetitif sehingga substrat angiotensin I tidak bisa bereaksi dengan enzim ACE (Guimaraes et al. 2011).
Penghambat ACE secara alami terdapat pada racun ular berbisa dan beberapa jenis kalajengking sedangkan penghambat ACE yang sintesis diantaranya captopril. Meskipun bahan sintetik ini mampu menghambat hipertensi, tetapi menimbulkan beberapa efek samping seperti batuk, alergi, pahit, dan kulit kering. Oleh karena itu penelitian tentang penghambat ACE yang lebih alami dan lebih aman terus dikembangkan untuk mencegah hipertensi (Patchett et al. 1980). Peptida yang dihasilkan dari hidrolisis protein memiliki sifat inhibitor kompetitif. Akan tetapi, beberapa tahun terakhir dilaporkan ada yang bersifat nonkompetitif. Meskipun beberapa penelitian mengungkapkan adanya hubungan positif antara peptida dengan ACE, akan tetapi penelitian tersebut masih secara in vitro dan secara in vivo masih belum banyak dilaporkan. Aktivitas peptida sebagai penghambat ACE harus sampai pada target organ dan dalam bentuk aktif. Namun demikian, karena peptida ini melewati saluran pencernaan dan didegradasi enzim pencernaan, maka terjadi perbedaan aktivitas antara penghambatan secara in vitro
dan in vivo. Oleh karena itu perlu dilakukan kajian mendalam tentang bioavailabilitas peptida di dalam tubuh (Guimaraes et al. 2011).
Penelitian terkini melaporkan bahwa peptida yang dihasilkan dari hidrolisis berbagai sumber biota laut memiliki aktivitas penghambatan ACE. Wijesekara et al. (2011) melaporkan bahwa ikan pipa (Syngnathus schlegeli) yang dihidrolisis dengan enzim alkalase kemudian dimurnikan dengan gel filtrasi dan RP HPLC menghasilkan 2 peptida dengan sekuens Thr-Phe-Pro-His-Gly-Pro dan His-Trp-Thr-Thr-Gln-Arg. Peptida ini memiliki aktivitas penghambatan ACE sebesar 0.62 mg/ml dan 1.44 mg/ml. Jung et al. (2006) dalam penelitiannya mengemukakan bahwa tulang ikan sebelah (Limanda aspera) yang dihidrolisis
dengan enzim α-kimotripsin kemudian dipurifikasi menghasilkan peptida dengan
16
Tabel 4 Aktivitas penghambatan ACE dari berbagai sumber bahan
Sumber Sekuens IC50 Referensi
Telur ikan
Otot ikan pipa KVNGPAMSPNAN 63.9 µM Kim dan Byun (2012) Tulang ikan reaktif yang disebut radikal bebas. Radikal bebas dapat memicu kerusakan sistem metabolisme dan memicu timbulnya penyakit degeneratif. Senyawa yang mampu menetralisir radikal bebas yaitu antioksidan. Beberapa enzim dalam tubuh yang mampu menetralisir radikal bebas diantaranya Super Oxide Dismutase (SOD), gluthatione dan katalase. Antioksidan juga bisa diperoleh dari makanan yang kaya kandungan vitamin, mineral, fenol dan senyawa bioaktif (Valko et al. 2007). Peranan antioksidan sangat penting dalam meredam efek radikal bebas yang berkaitan erat dengan terjadinya penyakit degeneratif seperti tekanan darah tinggi, jantung koroner, diabetes dan kanker yang didasari oleh proses biokimiawi dalam tubuh (Hamid et al. 2010).
17
Reducing Antioxidant Capacity (CUPRAC), dan Trolox-Equivalent Antioxidant Capacity (TEAC). Metode HAT meliputi Oxygen Radical Absorbance Capacity
(ORAC), 2.2’-azobis(2-amidinopropane) hydrochloride (AAPH), dan Total peroxyl radical-Trapping Antioxidant Parameter (TRAP) (Aspak et al. 2013).
Mekanisme kerja antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan yaitu sebagai pemberi atom hidrogen. Antioksidan yang mempunyai fungsi utama tersebut sering disebut sebagai antioksidan primer. Senyawa ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R*, ROO*) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A*) tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Molyneux 2004).
Produksi radikal bebas yang tidak terkendali dapat menyebabkan kerusakan makromolekul seperti lemak, protein, DNA, dan penyakit degeneratif seperti diabetes militus, kerusakan syaraf, inflamasi, dan kanker (Butterfiled et al.
2002). Terlebih lagi, kerusakan beberapa bahan pangan juga disebabkan karena proses oksidasi lemak sehingga menyebabkan bau tengik. Oleh karena itu, dalam industri pangan biasanya ditambahkan bahan antioksidan sintesis seperti BHT, BHA, TBHQ, dan PG untuk mencegah proses oksidasi. Namun demikian, penggunaan antioksidan sintetik harus mengikuti peraturan karena bisa memicu timbulnya penyakit tertentu (Park et al. 2001).
Penelitian terkini menunjukan bahwa selain dari tumbuhan yang kaya akan kandungan fenolik, makanan dari sumber hewani juga memiliki aktivitas antioksidan (Kim et al. 2001). Beberapa penelitian mengungkapkan bahwa peptida dari hasil hidrolisis sumber biota laut memiliki aktivitas antioksidan diantaranya cumi-cumi (Mendis et al. 2005), kerang (Qian et al. 2008), ikan tuna (Je et al. 2008), ikan Alaska Pollack (Je et al. 2005), belut (Ranathunga dan Rajapakse 2006), dan ikan sebelah (Jun et al. 2004). Peptida-peptida dari hasil hidrolisis protein mampu mendonorkan atom hidrogen dan muatan proton sehingga mampu menghambat laju proses oksidasi (Vo et al. 2011). Aktivitas antioksidan dari beberapa sumber bahan disajikan pada Tabel 5.
Tabel 5 Aktivitasantioksidan dari berbagai sumber bahan
18
Tabel 5 Aktivitasantioksidan dari berbagai sumber bahan (lanjutan) Kerang
hijau
Hidroksil radikal
YPPAK 228 µg/ml Wang et al. (2012)
DPPH YPPAK 2.62 mg/ml
Superoksida anion
YPPAK 72 µg/ml
Teripang DPPH - 2.13 mg/ml Althunibat et al. (2009) Teripang
coklat
Hidroksil radikal
- 2.77 mg/ml Yu et al. (2013) Superoksida
anion
- 5.08 mg/ml
DPPH - 3.59 mg/ml
Kulit ikan hoki
Superoksida anion
HGPLGPL 28.8 µM Mendis et al. (2005) Carbon
centered
HGPLGPL 94.1 µM Kerang Hidroksil
radikal
LKQELED LLEKQE
28.76 µM Qian et al. (2008) Superoksida
anion
LKQELED LLEKQE
19
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Oktober 2014 hingga Agustus 2015 di Laboratorium Bioteknologi, Laboratorium Kimia, dan Laboratorium Fisik Balai Besar Penelitian Pengembangan Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan (BBP4BKP) Jakarta Pusat. Selain itu penelitian juga dilaksanakan di Laboratorium Biokimia Pangan Fakultas Teknologi Pertanian Institut Pertanian Bogor.
Alat dan Bahan
Peralatan yang digunakan dalam penelitian ini yaitu pisau, timbangan analitik, gelas beaker, erlenmeyer, stirer, gelas ukur, sentrifuge (Beckman coulter, USA), kain saring, freeze dryer (christ alpha 1-2 LD, USA), kantong dialisis (Sigma-Aldrich, USA), spatula, waterbath, tabung reaksi, mikropipet (Eppendorf, Sigma-Aldrich, USA), tabung konikal, botol vial, vortex, oven, microtube
(Thermofisher, Denmark), microplate 96 well (Thermofisher, Denmark), Spektrofotometer UV-Vis (ShimadzuUVmini-1240, Jepang).
Bahan utama yang digunakan dalam penelitian ini yaitu teripang gama yang didapat dari Balai Budidaya Perikanan Lampung. Bahan untuk ekstraksi dan hidrolisis kolagen yaitu aquades, EDTA, etanol, tris-HCl, NaOH, CH3COOH,
NaCl, enzim pepsin (P7000, Sigma-Aldrich, USA), KCl dan HCl. Bahan untuk analisis derajat hidrolisis dan pola peptida kolagen yaitu Na2CO3, CuSO4,
NaKTartat, BSA (bovine serum albumin), TCA, gliserol, APS, SDS, Bromphenol blue, glisin, merkaptoetanol, akrilamida, bisakrilamida, TEMED, metanol, dan CBB. Bahan untuk uji bioaktivitas yaitu enzim angiotensin-I converting enzyme
(ACE from rabbit lung A6778-.25 UN, Sigma-Aldrich, USA), substrat N-Hippuryl-His-Leu hydrate (H1635-100MG, Sigma-Aldrich, USA), captopril (PHR1307-1G, Fluka, Jerman), bufer borat, NaCl, HCl, etil asetat, aquabides, metanol, DPPH (1,1-diphenyl-2-picrylhidrazil) (1898-66-4, Sigma-Aldrich, USA), asam askorbat (100468, Merkmillipore, USA).
Metode
20
Tahap 1. Pra-perlakuan
(Modifikasi Park et al. 2012)
………
Tahap 2. Ekstraksi kolagen (Modifikasi Park et al. 2012)
………
Tahap 3. Hidrolisis kolagen
(Modifikasi Zhang et al. 2013)
Gambar 3 Skema kerja penelitian Pembekuan dan pengeringan pelet dengan freeze dryer
Penyaringan , pengendapan dengan NaCl 1M, 12 jam Perendaman dalam asam asetat 0.5 M, 48 jam
Pelarutan 1 gram kolagen dalam 100 ml buffer pH 2.0, inkubasi suhu 37 0C, 15 menit
Penambahan enzim pepsin 0.1 U/mg, inkubasi 0; 30; 60; 90; 120; 180; 240 menit
Penghentian reaksi dengan pemanasan, pendinginan dan penetralan pH dengan NaOH 1 M
Sentrifuse 3000g 15 menit, pembekukan dan pengeringan supernatan dengan freeze dryer
Peptida kolagen
- Persen derajat hidrolisis - Pola peptida kolagen
- Aktivitas penghambatan ACE - Aktivitas antioksidan
Sentrifuse 10.000g 60 menit, dialisis dengan asam asetat 0.5 M dan terakhir dengan aquades
Kolagen - - Rendemen Berat molekul kolagen
Teripang gama
Pencucian dengan aquades, perendaman dalam etanol 50% 200 ml, 30 menit
Pencucian dengan aquades, perendaman dalam Tris-HCl 0.1 M dan EDTA 4mM 1000 ml, 12 jam
Pencucian dengan aquades, perendaman dalam NaOH 0.1 M 1000 ml, 48 jam
Serat kolagen kasar
21 Pra-perlakuan
Teripang segar diambil dan dicuci bersih dengan air, kemudian bagian perut dibelah menggunakan pisau dan dibuang isi perut (visceral). Selanjutnya teripang kembali dicuci dengan air lalu disimpan dan dibekukan sampai siap digunakan. Tahapan pra-perlakuan mengacu pada metode Park et al. (2012) dengan sedikit modifikasi pada waktu inkubasi yang digunakan. Semua tahapan ekstraksi dilakukan pada suhu 4 0C. 100 gram teripang segar dipotong-potong kecil kemudian direndam dalam aquades 1000 ml selama 30 menit sambil diaduk menggunakan stirrer. Selanjutnya sampel teripang direndam dalam etanol 50% 200 ml selama 30 menit kemudian dicuci dengan akuades lalu direndam dalam sedikit modifikasi pada bufer dialisis yang digunakan. Serat kolagen kasar yang dihasilkan dari tahapan pra-perlakuan direndam ke dalam 1000 ml asam asetat 0.5 M selama 48 jam. Suspensi disaring menggunakan kain saring lalu filtrat diendapkan dengan NaCl 1 M selama 12 jam. Filtrat disentrifuse kecepatan 10.000g selama 60 menit lalu pelet dilarutkan kedalam 0.5 M CH3COOH dan
didialisis menggunakan kantong dialisis dengan buffer asetat 0.1 M. Bufer diganti secara berkala dan terakhir dengan akuades selama 12 jam. Pelet kemudian dibekukan dan dikeringkan dengan freeze dryer.
Hidrolisis Kolagen
Hidrolisis kolagen dilakukan berdasarkan pada metode Zhang et al. (2013) dengan sedikit modifikasi pada jumlah substrat dan enzim yang digunakan. Satu gram sampel kolagen dilarutkan ke dalam 100 ml buffer pH 2.0 lalu diaduk secara merata. Sampel diinkubasi pada suhu 37 0C dengan waterbath shaker selama 15 menit. Selanjutnya ditambahkan enzim pepsin dengan aktivitas 0.1 U dan diinkubasi selama 0; 30; 60; 90; 120; 180; dan 240 menit. Reaksi dihentikan dengan dipanaskan pada air mendidih selama 4 menit. Sampel didinginkan lalu dinetralkan dengan menambahkan NaOH 1 M. Selanjutnya sampel disentrifuse dengan kecepatan 10.000g selama 15 menit lalu supernatan yang didapat selanjutnya dibekukan untuk uji derajat hidrolisis dan dikeringkan dengan freeze dryer untuk uji aktivitas penghambatan ACE dan antioksidan.
Penentuan Derajat Hidrolisis dan Pola Peptida kolagen Derajat Hidrolisis
Persen derajat hidrolisis ditentukan berdasarkan metode Silvestree et al.
22
digunakan sebagai standar protein. Persen derajat hidrolisis dihitung dengan rumus:
DH (%) = Protein terlarut 20% TCA x 100 Total kandungan protein Pola Peptida Kolagen
Instrumen SDS PAGE (Sodium Deodecyl Sulphate Polyacrilamide Gel Electroforesis) digunakan untuk menganalisis pola peptida kolagen sebelum dan sesudah dihidrolisis. Komposisi gel dan reagen disajikan pada Lampiran 1. Prosedur uji yang digunakan berdasarkan metode Laemmli (1970). Sebanyak 10 mg sampel dilarutkan dalam 0.5 ml SDS 10% kemudian diinkubasi suhu 85 0C selama 1 jam. Selanjutnya 80 µl sampel ditambahkan 20 µl buffer sampel (mengandung Tris-HCl, gliserol, SDS, merkaptoetanol dan bromfenol biru) lalu dipanaskan selama 5 menit. Sampel diinjeksikan ke dalam gel yang berisi 10 % gel pemisah (separating gel) dan 4 % gel penahan (stacking gel). Elektroforesis dijalankan pada 35 volt 15 mA selama 6 jam. Setelah itu, gel diwarnai dengan larutan pewarna (staining solution) selama 1 jam lalu dilunturkan dengan larutan peluntur (destaining solution) sampai band protein terlihat jelas di permukaan gel. Sebagai penanda protein digunakan marker broad range protein ladder dari Thermo scientific. Berat molekul protein ditentukan dengan memasukan jarak migrasi ke dalam persamaan regresi linier standar marker.
Uji Bioaktivitas Peptida Kolagen
Uji penghambatan ACE (Antihipertensi)
Uji penghambatan ACE (ACE inhibitor) dilakukan berdasarkan metode Arihara et al. (2001). Sebanyak 50 µl sampel (15 mg/ml) ditambahkan dengan 125 µl larutan buffer substrat (mengandung 7.6 mM N-hippuryl-his-leu hydrate
dan 608 mM NaCl dalam 10 ml buffer borat pH 8.3) lalu ditambahkan 15 µl BSA (10 mg/ml). Selanjutnya campuran diinkubasi pada suhu 37 0C selama 15 menit dengan menggunakan waterbath. Reaksi dimulai dengan menambahkan 50 µl enzim ACE 50 mU/ml lalu diinkubasi selama 30 menit. Reaksi dihentikan dengan menambahkan 200 µl HCl 1 N. Campuran divortex kemudian ditambah 1140 µl etil asetat lalu disentrifuse 10.000g selama 10 menit. Supernatan diambil sebanyak 1000 µl lalu dikeringkan dengan oven suhu 95 0C selama 75 menit. Asam hipurat yang terbentuk dilarutkan ke dalam 1000 µl aquabides. Absorbansi diukur pada panjang gelombang 228 nm menggunakan spektrofotometer UV-Vis dan sebagai kontrol positif digunakan standar kaptopril. Aktivitas penghambatan ACE dihitung dalam bentuk persen menggunakan rumus :
(%) aktivitas penghambatan: (A-B)-(C-D) x 100% (A-B)
Keterangan :
23 Uji Aktivitas Antioksidan
Uji aktivitas antioksidan menggunakan radikal bebas DPPH berdasarkan metode Li et al. (2006). Sepuluh miligram sampel dilarutkan ke dalam metanol p.a lalu dibuat seri konsentrasi 100; 200; 400; dan 800 ppm. Tiap seri konsentrasi dimasukan ke dalam sumur microplate sebanyak 160 µl, kemudian ditambahkan larutan DPPH (0.3 mg/ml) masing-masing 40 µl. Larutan DPPH dibuat dengan cara melarutkan 3 mg DPPH ke dalam 10 ml metanol p.a. Blanko sampel dibuat dengan cara 160 µl sampel dimasukan ke dalam sumur lalu ditambahkan 40 µl metanol p.a. Kontrol negatif dibuat dengan cara 160 µl metanol p.a ditambahkan dengan 40 µl DPPH dan sebagai blanko digunakan 200 µl metanol p.a. Asam askorbat digunakan sebagai kontrol positif dengan seri konsentrasi 4; 6; 8; 10 ppm. Selanjutnya microplate diinkubasi pada suhu ruang selama 30 menit dan dibaca absorbansinya dengan spektrofotometer UV-Vispada panjang gelombang 517 nm. Persen aktivitas penghambatan radikal bebas dihitung dengan rumus :
% aktivitas penghambatan: (A-B)-(C-D) x 100% (A-B)
Keterangan:
A = absorbansi kontrol negatif (metanol + DPPH) B = absorbansi blanko (metanol)
C = absorbansi sampel (metanol + DPPH + sampel) D = absorbansi blanko sampel (metanol + sampel)
Persen aktivitas penghambatan yang didapat kemudian diplotkan ke dalam kurva regresi linier dengan sumbu x berupa konsentrasi dan sumbu y berupa persen penghambatan. Nilai IC50 (inhibition concentration 50) didapat dengan
memasukan angka 50 ke dalam sumbu y dan hasil IC50 sampel dibandingkan
dengan IC50 dari standar asam askorbat.
Rancangan dan Analisis Data
24
HASIL DAN PEMBAHASAN
Persiapan Bahan Baku
Teripang gama yang diteliti diperoleh dari Balai Budidaya Laut Provinsi Lampung. Secara umum morfologi teripang gama berbentuk bulat, panjang, berwarna hijau tua kehitaman dengan bintik-bintik putih. Tubuhnya kenyal, lembek jika ditekan dan bertekstur seperti kasur sehingga sering disebut dengan istilah teripang kasur. Teripang gama yang digunakan dalam penelitian ini berukuran 15-25 cm dengan berat 250-300 g/ekor. Menurut Dewi (2008), teripang dikatakan dewasa apabila memiliki bobot 200-500 g/ekor dengan panjang 25-35 cm. Teripang gama yang digunakan dalam penelitian ditunjukkan pada Gambar 4. Teripang segar dicuci bersih dengan air mengalir untuk membersihkannya dari kotoran, kemudian dibelah perutnya dengan menggunakan pisau untuk membersihkan isi perut dan bagian visceral. Kulit teripang dikerok secara perlahan dengan menggunakan pisau, dicuci dengan air dingin, dimasukan kedalam kantong plastik yang tertutup rapat dan disimpan di dalam freezer. Penyimpanan ini bertujuan untuk mempertahankan kesegaran teripang dan kualitas teripang sebelum diolah pada proses selanjutnya.
Gambar 4 Teripang gama segar (Stichopus variegatus)
Pra-perlakuan dan Ekstraksi Kolagen
Beberapa metode ekstraksi kolagen dari teripang telah dicoba dalam penelitian ini. Metode ekstraksi yang pernah dilakukan di antaranya metode Cui et al. (2007), Zhu et al. (2012) dan Park et al. (2012). Ketiga metode tersebut mengacu pada metode sebelumnya yaitu Trotter et al. (1995) dan Saito et al.
(2002). Berdasarkan metode tersebut, hasil ekstraksi kolagen yang didapatkan kurang maksimal. Hal ini diduga karena proses ekstraksi yang terlalu lama dan perbedaan spesies teripang yang digunakan sehingga rendemen yang didapatkan sedikit. Berdasarkan hasil percobaan yang telah dilakukan maka metode ekstraksi yang digunakan adalah modifikasi dari metode Park et al. (2012).
25 diulangi sebanyak 2 kali. Perendaman dalam aquades bertujuan untuk mencuci teripang dari sisa kotoran yang masih menempel pada daging dan melarutkan senyawa yang larut dalam air. Sampel teripang kemudian disaring lalu direndam dalam 200 ml etanol 50% selama 30 menit. Etanol berfungsi untuk melarutkan senyawa pengotor yang tidak bisa larut dalam air.
Selanjutnya, sampel dicuci dengan aquades untuk menetralkan pH dan direndam dalam 1000 ml HCl 0.1 M dan 4 mM EDTA selama 12 jam. Tris-HCl mampu mempertahankan stabilitas dan pH sehingga proses ekstraksi berjalan dengan benar. pH saat perendaman dengan Tris-HCl adalah 8.0. Larutan Tris-HCl dan EDTA berubah menjadi larutan kental berwarna kuning. Matsumura et al.
(1973) menyatakan bahwa EDTA tidak mampu memisahkan jaringan hewan. Akan tetapi, penelitian yang diungkapkan Trotter et al. (1995) dan Cui et al.
(2007) melaporkan bahwa inkubasi teripang dalam air dan EDTA mampu memisahkan serat kolagen kasar sehingga integritas jaringan terjaga karena terjadi interaksi elektrostatik.
Tahapan selanjutnya yaitu pencucian sampel dengan aquades untuk menetralkan pH dan perendaman sampel dalam 1000 ml NaOH 0.1 M selama 48 jam. Perendaman dalam NaOH menyebabkan sampel membengkak dan mengembang beberapa kali lipat. Menurut Sato et al. (1987) perendaman dalam NaOH bertujuan untuk defatting (menghilangkan lemak), demineralisasi (menghilangkan mineral pengotor), menghilangkan komponen protein nonkolagen, dan menghilangkan pengaruh protease endogenous pada kolagen. Menurut Parker (1982) zat basa menyebabkan tropokolagen terdenaturasi kemudian terdisosiasi
menjadi γ komponen yaitu α, , ϒ. Komponen α merupakan komponen rantai
tunggal polipeptida, sedangkan dan ϒ merupakan dimer dan trimer. Zhou dan
Regenstein (2005) mengungkapkan penggunaan larutan basa pada tahap praperlakuan ekstraksi lebih efektif dalam proses pengeluaran protein nonkolagen. Jaswir et al. (2011) menambahkan bahwa selama perendaman NaOH terjadi pembengkakan kulit, yang menyebabkan air masuk kedalam matriks protein nonkolagen sehingga protein tersebut mudah dilepaskan.
Setelah perendaman dengan NaOH, sampel dicuci dengan aquades sampai pH mendekati netral dan direndam dalam 1000 ml asam asetat 0.5 M selama 48 jam. Kolagen merupakan salah satu jenis protein yang larut dalam asam. Ketika direndam dalam asam asetat disertai dengan pengadukan secara kontinyu, maka kolagen akan larut. Produk hasil ekstraksinya disebut dengan kolagen larut asam. Menurut Jaswir et al. (2011) asam mampu meningkatkan ion H+ sehingga air mudah masuk kedalam serat kolagen dan terjadi gaya elektrostatik antargugus polar dan ikatan hidrogen antargugus nonpolar. Gimenez et al. (2009) menambahkan bahwa efek lyotropic dari asam karboksilat lebih dominan dalam peningkatan swelling.