EFIKASI VAKSIN DNA KHV TERHADAP INFEKSI KOI
HERPESVIRUS PADA BUDIDAYA IKAN MAS (Cyprinus carpio)
SKALA LAPANG DENGAN KEPADATAN BERBEDA
ASEP AKMAL AONULLAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Efikasi Vaksin DNA KHV Terhadap Infeksi Koi Herpesvirus Pada Budidaya Ikan Mas (Cyprinus carpio) Skala Lapang Dengan Kepadatan Berbeda adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Asep Akmal Aonullah
NIM C151130341
RINGKASAN
ASEP AKMAL AONULLAH. Efikasi Vaksin DNA KHV Terhadap Infeksi Koi Herpesvirus Pada Budidaya Ikan Mas (Cyprinus carpio) Skala Lapang Dengan Kepadatan Berbeda. Dibawah bimbingan SRI NURYATI, ALIMUDDIN dan SRI MURTINI.
Ikan mas merupakan komoditas budidaya yang menghadapi epidemi serius dari kemunculan koi herpesvirus. Penyakit ini disebabkan oleh cyprinid herpesvirus-3 (CyHV-3) atau dikenal sebagai carp interstitial nephritis and gill necrosis virus
(CNGV). KHV pertama kali dilaporkan pada 1998 di Israel, kemudian menyebar ke berbagai belahan dunia dan menjadi masalah global. Penyakit ini bersifat sangat virulen dengan ciri penyebaran yang cepat dan mortalitas tinggi. Uji skala laboratorium pada ikan yang diinfeksi dengan KHV menunjukkan hasil lebih dari 80% mengalami kematian. Wabah KHV di Indonesia terjadi pada awal Maret 2002 kemudian dengan cepat menyebar dan menimbulkan kerugian ekonomi yang besar pada industri budidaya. Sampai saat ini langkah pencegahan KHV masih dilakukan mengingat sifat virus yang mampu bertahan dalam jangka waktu lama. Vaksinasi menjadi langkah strategis dalam upaya pecegahan KHV, mengingat tidak adanya terapi/pengobatan yang efektif dan spesifik terhadap virus ini. Vaksin DNA dapat dijadikan sebagai alternatif solusi karena mampu memperbaiki beberapa kelemahan vaksin konvensional (vaksin hidup dan vaksin mati). Oleh karena itu penelitian mengenai aplikasi vaksin DNA melalui metode perendaman dengan pendekatan skala produksi (berbagai kepadatan ikan) perlu dilakukan untuk memperoleh informasi kepadatan optimal vaksinasi dan sejauh mana vaksin tersebut efektif terhadap infeksi KHV.
Ikan uji yang digunakan dalam penelitian ini adalah benih ikan mas varietas Majalaya (rerata bobot tubuh 0.19±0.01 g) berumur 20 hari pascatetas (hpt) yang diperoleh dari Balai Besar Perikanan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat. Screening status kesehatan ikan uji dilakukan selama masa aklimatisasi, dan konfirmasi ikan terbebas dari KHV dilakukan menggunakan metode polymerase chain reaction (PCR). Perlakuan kepadatan yang digunakan adalah 800 ekor/L (V8) dan 1200 ekor/L (V12). Dosis vaksin DNA anti-KHV yang digunakan adalah 1.3×109 CFU/L sebanyak 10 mL/L air selama 30 menit, dan sebagai kontrol (K8 dan K12) tidak dilakukan vaksinasi. Parameter uji yang diamati meliputi kelangsungan hidup (SR), kelangsungan hidup relatif (RPS), laju pertumbuhan harian (LPH), aktivitas fagositik (AF) dan titer antibodi (ELISA).
Hasil penelitian ini menunjukkan bahwa kelangsungan hidup benih ikan mas yang divaksin pada masa uji tantang perlakuan 800 ekor/L menghasilkan nilai tertinggi (P<0.05) dibandingkan dengan perlakuan 1200 ekor/L selama masa pengamatan 30 hari. Hal ini didukung dengan tingginya nilai RPS yang diperoleh pada perlakuan 800 ekor/L dibandingkan dengan 1200 ekor/L, masing-masing 68.93±8.74% dan 9.89±4.76%. Titer antibodi pada benih ikan mas yang divaksin hingga 21 hpv teramati sama dengan kontrol (P>0.05), kemudian terjadi peningkatan secara signifikan pada 28 hpv (P<0.05). Pada 28 hpv inilah antibodi spesifik KHV mulai terbentuk pada perlakuan 800 ekor/L (ditandai dengan persinggungan nilai absorbansi Cut off Value
dibandingkan dengan kontrol masing-masing perlakuan hingga 50 hpv. Nilai AF teramati meningkat pada semua perlakuan mulai awal pengamatan hingga 28 hpv. Secara umum nilai AF perlakuan vaksinasi lebih tinggi (P<0.05) dibandingkan dengan kontrol masing-masing perlakuan, dimulai dari 14 hpv baik pada masa pemeliharaan maupun uji tantang. Hasil pengamatan SR kumulatif menunjukkan bahwa perlakuan 800 ekor/L menghasilkan nilai lebih tinggi (P<0.05) dibandingkan 1200 ekor/L, masing-masing sebesar 95.17±1.28% dan 83.78±1.44%. Demikian pula dengan nilai LPH, perlakuan V8 (4.12±0.03%) menghasilkan nilai lebih tinggi (P<0.05) dibandingkan dengan perlakuan V12 (3.92±0.12%). Secara umum aplikasi vaksin DNA KHV melalui perendaman memiliki potensi besar untuk diaplikasikan dalam proses budidaya mengingat tingkat proteksi, efisiensi serta keamanan dalam penggunaannya.
SUMMARY
ASEP AKMAL AONULLAH. Eficacy of KHV DNA Vaccine Against Koi Herpesvirus Infection on Cyprinus carpio Field Scale Culture at Different Densities. Supervised by SRI NURYATI, ALIMUDDIN and SRI MURTINI.
Common carp is an aquaculture commodity which faces a serious epidemic of koi herpesvirus (KHV) emergence. This disease is caused by cyprinid herpesvirus-3 (CyHV-3) or known as carp interstitial nephritis and gill necrosis virus (CNGV). KHV outbreak was first reported in 1998 in Israel, then spread around the world and becomes a global problem. This disease is highly virulent with rapid spread and high mortality. Laboratory scale test on fish infected with KHV showed mortality more than 80%. The KHV outbreaks in Indonesia occurred in early March 2002, then quickly spread and cause great economic losses to the aquaculture industry. Until now, preventive action of KHV has been still developed considering the nature of this virus which is able to survive in the long term. Vaccination becomes a strategic step to prevent KHV infection considering there is no therapy for the disease. DNA vaccine can be used as an alternative solution because of its advantages to fix some conventional vaccines weakness. Therefore, the study on the application of DNA vaccine through immersion method with approach on the production scale (various fish densities) should be carried out to obtain the information about the optimal density of vaccination and to know how effective the vaccine work against KHV infection.
The experimental fish used in this study were juvenile of common carp Majalaya strain (body weight mean: 0.19±0.01 g) 20 days post-hatching (dph) obtained from Main Center for Freshwater Fisheries Aquaculture, Sukabumi, West Java. Screening of experimental fish health status was performed during acclimatization period and confirmation of the fish which were free of KHV was done through polymerase chain reaction (PCR). Treatment densities used were 800 fish/L (V8) and 1200 fish/L (V12). Dose of KHV DNA vaccine used was 1.3×108 CFU/mL as much as 10 mL/L of water for 30 minutes, and as the control treatments (K8 and K12) without any vaccination. Parameters observed were survival rate (SR), relative percent survival (RPS), specific growth rate (SGR), phagocytic activity (PA) and antibody titre.
SGR values; V8 (4.12±0.03%) showed higher value (P<0.05) compared to V12 (3.92±0.12%). In general, the application of KHV DNA vaccine has great potency to be applied in aquaculture practices related to its protection level, efficiency and safety in application.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EFIKASI VAKSIN DNA KHV TERHADAP INFEKSI KOI
HERPESVIRUS PADA BUDIDAYA IKAN MAS (Cyprinus carpio)
SKALA LAPANG DENGAN KEPADATAN BERBEDA
ASEP AKMAL AONULLAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
Pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga karya ilmiah yang berjudul Efikasi Vaksin DNA KHV Terhadap Infeksi Koi Herpesvirus (KHV) Pada Budidaya Ikan Mas (Cyprinus carpio) Skala Lapang Dengan Kepadatan Berbeda ini berhasil diselesaikan. Karya ilmiah ini ditulis berdasarkan hasil penelitian yang dilaksanakan pada bulan Agustus 2014 sampai dengan Maret 2015 bertempat di Institut Pertanian Bogor.
Penulis menyadari bahwa terselesaikannya tesis ini tidak lepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun materiil. Terima kasih penulis sampaikan kepada Ibu Dr Sri Nuryati, SPi MSi, Bapak Dr Alimuddin, SPi MSc dan Ibu Dr Drh Sri Murtini, MSi sebagai komisi pembimbing atas waktu, saran, nasihat dan bimbingannya mulai dari penyusunan proposal, pelaksanaan penelitian hingga penulisan karya ilmiah ini. Penulis juga menyampaikan ucapan terima kasih kepada Bapak Dr Ir Agus Oman Sudrajat, MSc sebagai penguji luar komisi dan perwakilan Program Studi Ilmu Akuakultur yang telah banyak memberikan saran dan masukan.
Terima kasih penulis sampaikan pula pada Direktorat Jendral Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) Tahun 2013 sehingga penulis dapat melanjutkan jenjang studi Magister di Sekolah Pascasarjana, Institut Pertanian Bogor. Disamping itu, ungkapan terima kasih juga disampaikan kepada rekan-rekan S2 Ilmu Akuakultur IPB angkatan 2013 atas kebersamaannya dalam menempuh studi, rekan-rekan di Laboratorium Kesehatan Ikan, rekan-rekan di Laboratorium Genetika Ikan dan adik-adik S1 atas kebersamaan, bantuan dan kerjasamanya, serta pihak-pihak yang banyak membantu secara teknis dalam penelitian ini diantaranya Bapak Ayi Santika SPi MSi, Rangga Garnama, S.Pi, Dinda Januari Cipta, S.Pi, Hasan Nasrullah, S,Pi, Windu Sukendar, S.Pi, Dendi Hidayatullah, S.Pi M.Si, Sekar Ayu Chairunnisa S.Pi, Abung Maruli Simanjuntak SPi MSi, Rifqi Tamamdusturi SPi MSi, Bapak Ranta, Kang Dedi dan Pak Henda atas segala bantuan dan kerjasamanya hingga terselesaikannya penelitian ini dan dukungan serta kebersamaan dari rekan-rekan Al-Hikmah (Mas Rahmat, Kak ino, Pak Yuds, Kak Fitri, Bu Aty, Bu Artin, Icha, Abung, Ari, Nurin dan Aisyah).
Tidak terlupa, terima kasih dan penghargaan yang tinggi juga dipersembahkan pada kedua orang tua penulis, Bapak Drs. Murod Zuhri dan Ibu Dra. Meitun Rukiah, serta seluruh keluarga atas doa, bantuan, dan dukungan selama menjalani masa studi.
Semoga karya ilmiah ini bermanfaat untuk kemajuan ilmu pengetahuan, khususnya perikanan budidaya.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
GLOSARIUM ... vii
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
2 METODE PENELITIAN ... 3
Waktu dan Tempat Penelitian ... 3
Rancangan Penelitian ... 3
Materi Uji ... 3
Ikan uji ... 3
Vaksin DNA KHV ... 4
Prosedur Penelitian... 4
Perbanyakan vaksin DNA KHV GP25 ... 4
Produksi antibodi poliklonal anti-ikan mas ... 4
Vaksiansi melalui metode perendaman ... 5
Pemeliharaan ikan uji pascavaksinasi ... 5
Pengadaan filtrat KHV dan uji tantang ... 5
Deteksi KHV dengan metode polymerase chain reaction (PCR) ... 5
Parameter Uji ... 6
Analisis Data ... 8
3 HASIL DAN PEMBAHASAN ... 8
Hasil ... 8
Kelangsungan hidup ikan uji pada masa uji tantang ... 8
Pola kematian ikan uji ... 9
Gejala klinis ikan uji ... 10
Respons imunitas ikan uji ... 11
Kinerja Pertumbuhan ... 14
Pembahasan ... 14
4 SIMPULAN DAN SARAN ... 19
Simpulan ... 19
Saran ... 19
DATAR PUSTAKA ... 19
LAMPIRAN ... 23
DAFTAR GAMBAR
1. Kematian kumulatif benih ikan mas pascainfeksi KHV 9 2. Elektroforegram hasil validasi kematian ikan pada saat uji tantang KHV
menggunakan metode PCR 10
3. Elektroforegram hasil konfirmasi status kesehatan ikan uji bebas KHV
menggunakan metode PCR 10
4. Gejala klinis perubahan morfologi benih ikan mas pada masa uji
tantang 11
5. Respons imun non-spesifik ikan mas terhadap infeksi KHV 12 6. Respons antibodi spesifik benih ikan mas terhadap KHV 13 7. Pola interaksi respons imun non-spesifik dan spesifik pada benih ikan
mas yang diberi perlakuan vaksin DNA KHV melalui perendaman 13 8. Kelangsungan hidup kumulatif (SR) dan laju pertumbuhan harian
(LPH) selama pemeliharaan di kolam 14
DAFTAR LAMPIRAN
1. Metode pengukuran kepadatan vaksin DNA KHV whole cell bacteria
menggunakan spektrofotometer 24
2. Visualisasi hasil deteksi keberadaan antibodi poliklonal anti-ikan mas
pada kelinci 24
3. Konfirmasi infeksi KHV pada ikan uji menggunakan metode
Polymerase chain reaction (PCR) 24
GLOSARIUM
Ab antibodi
ACP alternative complement pathway
ADCC antibody-dependent celluler citotoxicity
AF aktivitas fagositik
AGPT agar gell precipitation test
APC antigen precenting cell
BBPBAT Balai Besar Pengembangan Budidaya Air Tawar
bp base pair
CDC complement-dependent Citotoxicity
CFU colony forming unit
CNGV Carp interstitial nephritis and gill necrosis virus
CV cut off value
CyHV-3 Cyprinid herpesvirus-3
DNA deoxyribonucleic acid
DO dissolve oxygen
ELISA enzim linked immunosorbent assay
FAC Freund’s adjuvant complete
GMP good management practices
MHC major histocompatibilty complex
nm nano meter
PBS phospate buffered saline
PCR polymerase chain reaction
pH power of hydrogen
rpm revolutions per minute
RPS relative percent survival
Sc subcutan
SR survival rate
TAN total amonium nitrat
TCR T-cell receptor
1
1 PENDAHULUAN
Latar Belakang
Ikan mas merupakan komoditas budidaya yang menghadapi epidemi serius dari kemunculan penyakit yang disebabkan oleh virus patogen, yaitu koi herpesvirus (KHV) (Sunarto dan Cameron 2006). Kasus awal infeksi KHV telah dilaporkan sejak tahun 1998 di Israel (Perelberg et al. 2003), USA (Hedrick et al. 2000), Inggris (Hartmann et al. 2008), Jerman (Bretzinger et al. 1999) dan tersebar luas ke berbagai belahan dunia meliputi Uni Eropa (Belgia, Denmark, Belanda, Swiss, Italia, Prancis) dan Afrika Selatan (Crane et al. 2004; Haenen et al. 2004). Infeksi KHV di Asia terjadi di sejumlah Negara seperti Indonesia (Sunarto et al. 2002), Taiwan (Tu et al. 2004), Korea (Cho et al. 2005), Jepang (Sano et al. 2004), Thailand dan Singapura (Sano et al. 2004). Virus KHV dikenal juga sebagai cyprinid herpes virus-3 (CyHV-3) dan digolongkan sebagai virus DNA dalam keluarga Herpesviridae (Ronen et al. 2003). KHV bersifat sangat virulen, pada infeksi alami sering menyebabkan kematian hingga 80-90% dalam waktu kurang dari satu minggu pada populasi ikan koi dan mas (Perelberg et al. 2003; Sunarto et al. 2005). Penyakit ini memiliki periode inkubasi selama 5-7 hari dengan ciri khas yang dimiliki adalah infeksi terjadi secara tiba-tiba dan penyebaran berlangsung cepat terutama pada rentang suhu 15-25 C yang mengakibatkan kerugian ekonomi maupun sosial signifikan di berbagai Negara (Gilad et al. 2003; Ronen et al. 2003; Sunarto dan Cameron 2006). Tiga bulan pertama pascawabah KHV kerugian pada sentra budidaya diperkirakan hingga 5 Milyar, dan sepanjang tahun 2002 hingga 2003 kerugian diperkirakan mencapai US$ 10 juta dan US$ 15 juta, masing-masing (Sunarto et al. 2005).
Langkah pencegahan KHV hingga saat ini masih dilakukan mengingat sifat virus yang mampu bertahan dalam jangka waktu lama (Gilad et al. 2004; Eide et al. 2011; Sunarto et al. 2014). Penelitian mengenai KHV telah dilakukan sebelumnya untuk mengetahui metode penanganan virus tersebut. Metode awal yang pernah dilakukan diantaranya melalui perlakuan suhu pada kondisi non-permissive KHV (30 C) (Ronen et al. 2003), regulasi dan penerapan biosecurity, pencegahan perpindahan ikan dari lokasi terinfeksi KHV, praktek good management practices (GMP) serta penggunaan bahan-bahan kimia maupun senyawa aktif dari bahan alami (Sunarto et al. 2005; Nuryati et al. 2010). Vaksinasi menjadi langkah strategis dalam upaya pencegahan KHV, mengingat tidak adanya terapi/pengobatan yang efektif dan spesifik terhadap virus ini. Aplikasi vaksin yang telah dilakukan diantaranya melalui attenuated vaccine
(Ronen et al. 2003; Perelberg et al. 2008) dan inactivated vaccine (Perelberg et al. 2005; Yasumoto et al. 2006). Namun demikian, beberapa cara tersebut dinilai kurang efektif mengingat sulitnya menjaga suhu perairan (Hartmann et al. 2008), bahan alami yang terbatas pada respons imun non-spesifik (Nuryati et al. 2010), kekhawatiran akan resiko penyebaran dan kembalinya virulensi virus meskipun
2
Vaksin DNA dapat menjadi salah satu metode alternatif dalam upaya penanganan infeksi KHV karena kelebihannya yang dapat memperbaiki beberapa kelemahan vaksin tradisional (vaksin hidup dan vaksin mati). Vaksin ini merupakan terobosan teknik eksperimental untuk melindungi organisme melawan penyakit dengan cara menginjeksikan DNA murni (naked DNA) untuk mebangkitkan respons kekebalan (Lorenzen dan LaPatra 2005; Nuryati 2010). Vaksin ini dihasilkan dari proses pengkonstruksian sebuah vektor yang disisipi gen penyandi protein tertentu untuk menjadi suatu protein antigen protektif dari patogen yang diinginkan (Kurath 2008). Pengembangan dan penelitian vaksin DNA terhadap infeksi KHV menunjukkan hasil yang menjanjikan. Aplikasi vaksin DNA mampu menginduksi produksi antibodi spesifik ikan mas terhadap KHV dan menurunkan tingkat mortalitas ikan pada saat uji tantang (Nuryati et al. 2010; Nuswantoro et al. 2012; Nuryati et al. 2013; Zhou et al. 2014a; Zhou et al. 2014b). Beberapa rute administrasi vaksin DNA juga telah dilakukan dalam skala laboratorium (Nuryati et al. 2010; Nuswantoro et al. 2012; Nuryati et al. 2013). Kelebihan vaksin DNA diantaranya mampu mengaktivasi baik mekanisme pertahanan seluler maupun humoral, memberikan proteksi yang baik apabila diberikan pada stadia awal, waktu induksi yang singkat dan memberi proteksi dalam jangka waktu yang lama, serta mampu memberikan proteksi baik dalam suhu rendah maupun tinggi (Lorenzen dan LaPatra 2005), tidak menyebabkan anti-medikasi pada ikan dan dampak kontaminasi pada air (Zheng et al. 2006).
Masih sedikitnya hasil penelitian maupun produk vaksin DNA terhadap infeksi KHV menjadikkan pengembangan aplikasi vaksin DNA KHV harus terus dilakukan. Dengan demikian, vaksin DNA KHV memiliki peluang yang lebih besar untuk efektif diterapkan dalam proses budidaya. Salah satunya adalah aplikasi vaksin DNA KHV pada benih ikan mas melalui perendaman dengan pendekatan skala lapang untuk mengetahui sejauh mana vaksin tersebut efektif terhadap infeksi KHV.
Perumusan Masalah
3
lapang setelah memenuhi ketentuan efektif dan aman terhadap lingkungan. Oleh karena itu perlu diuji terlebih dahulu untuk membuktikan efektivitas vaksin DNA KHV melalui metode perendaman dalam meningkatkan respons imunitas benih ikan mas terhadap infeksi KHV.
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji efikasi vaksin DNA KHV melalui metode perendaman terhadap infeksi koi herpesvirus pada benih ikan mas
Cyprinus carpio skala lapang dengan kepadatan berbeda.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi serta strategi lanjut dalam upaya pencegahan/pengendalian infeksi KHV skala lapang pada budidaya ikan mas melalui penggunaan vaksin DNA KHV.
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Agustus 2014 sampai dengan Maret 2015 di beberapa tempat diantaranya Laboratorium Kesehatan Organisme Akuatik dan Laboratorium Genetika, Fakultas Perikanan dan Ilmu Kelautan serta Laboratoruim Mikrobiologi Medis, Fakultas kedokteran Hewan Institut Pertanian Bogor.
Rancangan Penelitian
Penelitian ini menggunakan rancangan acak lengkap dengan 4 perlakuan dan 3 ulangan, yaitu vaksinasi perendaman dengan kepadatan berbeda. Perlakuan kepadatan yang digunakan adalah 800 ekor/L (V8) dan 1200 ekor/L (V12). Dosis vaksin DNA KHV yang digunakan adalah 1.3109 CFU/L air sebanyak 10 mL. Waktu perendaman dilakukan 1 30 menit dan sebagai perlakuan kontrol (K8 dan K12) dilakukan tanpa vaksinasi.
Materi Uji
Ikan uji
4
masing-masing berisi 600 ekor ikan. Ikan diberi pakan cacing sutra selama masa aklimatisasi dan selanjutnya diberi pakan komersial (protein 30-34%) secara at satiation dengan frekuensi 3 kali sehari. Suhu air pemeliharaan dipertahankan pada rentang 27-28 C dan pergantian air dilakukan sebanyak 20-30% setiap hari.
Screening status kesehatan ikan uji dilakukan selama masa aklimatisasi, dan konfirmasi ikan terbebas dari KHV dilakukan menggunakan metode polymerase chain reaction (PCR).
Vaksin DNA KHV
Vaksin DNA yang digunakan dalam penelitian ini adalah vaksin DNA KHV GP25 whole cell bacteria hasil konstruksi Nuryati et al. (2010). Vaksin ini menggunakan gen penyandi glikoprotein 25 (GP25) yang berasal dari KHV isolat lokal (Indonesia) dengan promoter β-aktin (Act) dari ikan medaka, dan diintroduksikan ke dalam sel kompeten bakteri Escherichia coliDH5α.
Prosedur Penelitian
Perbanyakan vaksin DNA KHV GP25
Bakteri E. coli DH5α mengandung plasmid pAct-GP25 berfungsi sebagai vaksin DNA KHV (Nuryati et al. 2010) dikultur dengan media 2xYT padat pada suhu inkubasi 37 C selama 16-20 jam. Koloni berukuran besar dipindahkan ke media kultur 2xYT cair 500 mL dan diinkubasi dalam incubation shaker pada suhu 37 ºC dengan kecepatan 200 rpm selama 16-20 jam. Pelet bakteri dipanen dengan sentrifugasi pada 5000 rpm selama 10 menit, kemudian dicuci dengan
phosphate buffer saline (PBS) sebanyak 2 kali. Bakteri hasil pencucian dilarutkan dalam 10 mL PBS. Kepadatan bakteri diukur dengan spektrofotometer pada panjang gelombang 600 nm (Lampiran 1). Selanjutnya, kepadatan sel bakteri dibuat menjadi 108 CFU/mL. Bakteri diinaktivasi dengan cara direndam pada air bersuhu 80 ºC selama 5 menit kemudian disimpan dalam suhu -20 ºC hingga waktu vaksinasi.
Produksi antibodi poliklonal anti-ikan mas
Serum diambil sebanyak 1 mL/ekor dari ikan mas sehat dengan bobot 250-300 g dan disuntikkan pada kelinci ras White New Zealand (bobot sekitar 3 kg). Imunisasi pertama dilakukan dengan menginjeksikan 0.2 mL serum yang diemulsi
Freund’s adjuvant complete (FAC) pada rute subcutan (Sc). Imunisasi ke-2 dilakukan pada minggu ke-4 dengan dosis 0.2 mL serum yang diemulsi Freund’s
adjuvant incomplete. Imunisasi ke-3 dilakukan pada minggu ke-7 dengan dosis 0.2 mL serum yang diemulsi dalam FAC. Darah kelinci diambil 2 minggu setelah imunisasi ke-3, dari pembuluh vena auricularis (telinga). Darah diinkubasi pada suhu ruang selama 1 jam kemudian diinkubasi dalam suhu 4 ºC selama semalam (overnight) hingga tampak adanya serum dalam syringe. Serum dipisahkan dari bekuan darah dan diuji keberadaan antibodinya dengan uji agar gel presipitation test (AGPT) (Lampiran 2). Selanjutnya, darah dipanen dari kelinci yang telah membentuk antibodi terhadap ikan mas. Serum yang telah membentuk antibodi anti-ikan mas disimpan dalam suhu -20 C hingga akan digunakan untuk uji
5
Vaksinasi melalui metode perendaman
Vaksinasi dilakukan pada benih ikan mas berumur 30 hpt dengan metode perendaman. Kepadatan ikan yang divaksinasi adalah 800 ekor/L dan 1200 ekor/L air yang berisi bakteri E.coli DH5α pembawa plasmid DNA KHV GP25 (1.3109 CFU/L) sebanyak 10 mL. Sebagai kontrol, benih ikan mas direndam di air media tanpa vaksin DNA KHV GP25. Benih ikan direndam di dalam plastik dan dioksigenasi. Waktu perendaman yang digunakan adalah 1 30 menit (Nuswantoro et al. 2012).
Pemeliharaan ikan uji pascavaksinasi
Ikan mas yang telah divaksinasi kemudian dipelihara kembali di akuarium (100 50 50 cm3) dengan kepadatan berbeda yaitu 800 dan 1200 ekor/akuarium selama 30 hari (umur ikan 60 hpt). Ikan uji pascapemeliharaan vaksinasi selanjutnya ditebar di kolam pembesaran (ukuran 20 10 1.5 m3) yang disekat dengan hapa berukuran 2.5 2.5 1.5 m3 selama 30 hari (umur ikan 90 hpt). Ikan diberi pakan komersial sebanyak 5% bobot tubuh sebanyak 2 kali, yaitu pada waktu pagi dan sore hari. Selama pemeliharaan kualitas air dipertahankan pada kondisi DO (5-7 mg/L), pH (6.5-8), TAN (<1 mg/L),sedangkan pengukuran suhu dilakukan setiap hari. Suhu air berkisar 27-28 C.
Pengadaan filtrat KHV dan uji tantang
Virus yang digunakan dalam uji tantang berasal dari ikan mas pada saat terjadi wabah KHV (September 2014) di Waduk Cirata, Jawa Barat. Sebanyak 1 gram insang ikan mas yang terinfeksi virus KHV disuspensikan dengan 9 mL PBS menggnakan mortar hingga halus. Suspensi disentrifugasi pada 6500 rpm, 4 C selama 10 menit. Supernatan diambil dan disaring dengan syringe filter 0.45 μm untuk dijadikan stok filtrat 10-1 kemudian diencerkan hingga 10-3 (1 mL filtrat : 99 mL PBS). Ikan uji setelah pemeliharaan vaksinasi (umur ikan 60 hpt) diambil sebanyak 15 ekor tiap perlakuan untuk uji tantang. Uji tantang dilakukan dengan menginjeksikan secara intramuskuler (IM) 0.1 mL filtrat KHV konsentrasi 10-3 (Nuswantoro et al. 2012). Sebagai kontrol negatif (K-) ikan mas tanpa vaksinasi diinjeksi dengan PBS dan kontrol positif (K+) ikan mas tanpa vaksinasi diinjeksi dengan 0.1 mL filtrat KHV. Ikan diuji tantang selama 28 hari pada suhu
permissive KHV (21±1 C). Ikan mati diambil dan dianalisis dengan PCR untuk memastikan kematian akibat infeksi KHV. Kematian kumulatif dan relative percent survival (RPS) diamati selama 28 hari pascauji tantang.
Deteksi KHV dengan metode polymerase chain reaction (PCR)
6
Produk PCR selanjutnya diseparasi menggunakan elektroforesis dengan konsentrasi gel agarosa 1.5% (TopVision® Agarose, USA), dan marka KAPA™ Universal DNA ladder 100 ng/µl (KAPA Biosystem, USA). Hasil elektroforesis selanjutnya didokumentasikan.
Parameter Uji
Parameter uji yang diamati dalam penelitian ini meliputi kelangsungan hidup uji tantang, relative percent survival, kinerja pertumbuhan (laju pertumbuhan harian, kelangsungan hidup kumulatif,) dan respons imunitas ikan (aktivitas fagositik, titer antibodi).
Kelangsungan hidup
Kelangsungan hidup uji tantang diamati pada ikan uji selama 28 hari masa uji tantang, sedangkan kelangsungan hidup kumulatif diamati hingga akhir masa penelitian. Penghitungan nilai kelangsungan hidup berdasarkan persamaan sebagai berikut:
SR % = NNt
0 100
Keterangan:
SR = Kelangsungan hidup (%)
Nt = Jumlah populasi ikan pada akhir pemeliharaan (ekor) N0 = Jumlah populasi ikan pada awal pemeliharaan (ekor)
Relative Percent Survival (RPS)
Pengamatan relative percent survival dilakukan setiap hari pascauji tantang selama 28 hari. Persentase mortalitas tiap perlakuan dibandingkan dengan kontrol dan kelangsungan hidup relatif dihitung untuk masing-masing perlakuan. Perhitungan dilakukan dengan persamaan Ellis (1988), sebagai berikut:
RPS % =(1-MnM
0) 100
Keterangan:
RPS = Relative percent survival (%)
Mn = Persentase mortalitas ikan perlakuan ke-n M0 = Persentase mortalitas ikan kontrol
Laju Pertumbuhan Harian (LPH)
7
LPH = Laju pertumbuhan harian (%)
Wt = Bobot rata-rata ikan pada akhir pemeliharaan (g) W0 = Bobot rata-rata ikan pada awal pemeliharaan (g) t = Lama waktu pemeliharaan ikan (hari)
Gejala Klinis
Pengamatan gejala klinis diamati secara visual setiap hari selama 28 hari masa uji tantang. Gejala klinis yang diamati diantaranya perubahan tingkah laku serta morfologi ikan uji meliputi adanya luka serta kerusakan yang terjadi pada tubuh ikan akibat infeksi KHV.
Aktivitas Fagositik (AF)
Aktivitas fagositik dihitung berdasarkan metode Anderson dan Siwicki (1993). Darah ikan uji diambil sebanyak 50 μl dan dimasukkan dalam microplate. Suspensi Staphylococcus aureus ditambahkan ke dalam microplate, kemudian dihomogenkan dan diinkubasi dalam suhu ruang selama 20 menit. Campuran tersebut kemudian diambil sebanyak 5 µL untuk dibuat preparat ulas. Preparat selanjutnya difiksasi dengan metanol selama 5 menit dan dikeringkan, kemudian direndam dalam larutan Giemsa selama 15 menit, lalu dicuci dalam air mengalir dan dikeringkan. Preparat diamati menggunakan mikroskop dan dihitung jumlah sel yang menunjukkan proses fagositosis dari 100 sel fagosit yang teramati.
AF (%) = (∑ jumlah sel fagosit yang aktif ÷ ∑ sel fagosit yang diamati) × 100
Enzim Linked Imunosorbent Assay (ELISA)
Pada 0, 7, 14, 21, 28, 35, 43 dan 50 hpv, 5 ekor ikan pada masing-masing perlakuan diambil secara acak untuk preparasi serum. Serum diperoleh setelah proses sentrifugasi 3500 rpm, 4 C selama 10 menit dan disimpan pada -20 C hingga siap digunakan. Preparasi antigen untuk uji ELISA dilakukan dengan memecah filtrat KHV menggunakan sonikator pada frekuensi 40 Hz selama 5 menit (on ice). Antigen kemudian diukur konsentrasi proteinnya dengan metode uji Bradford. Antigen diencerkan 1:50 menggunakan coating buffer (0.05 M
carbonate-bicarbonate pH 9.6) sehingga konsentrasi akhir yang digunakan adalah 5 µg/mL. Antigen kemudian dimasukkan ke dalam masing-masing sumur
microplate sebanyak 100 μl/sumur dan diinkubasi pada 4 C selama semalam (overnight). Plate selanjutnya dicuci 5 kali menggunakan PBS-T (PBS pH 7.4 + 0.05% Tween-20) sebanyak 300 µl tiap sumur. Masing-masing sumur pada plate
8
IgG anti-ikan mas yang berasal dari kelinci ditambahkan sebanyak 100 µl pada tiap sumur dan diinkubasi pada 37 C selama 1 jam. Plate selanjutnya dicuci seperti langkah sebelumnya. IgG anti-rabit yang telah dikonjugasi dengan Horse Reddish Peroxydase (HRP) diencerkan menjadi 1:10000 kemudian ditambahkan pada tiap sumur sebanyak 100 µl dan diinkubasi pada 37 ºC selama 1 jam. Plate
selanjutnya dicuci seperti langkah sebelumnya. One-Step Ultra TMB-ELISA
sebagai substrat selanjutnya ditambahkan pada tiap sumur sebanyak 100 µl dan didiamkan selama 20-30 menit. Reaksi ELISA dihentikan dengan menambahkan 50 µl H2SO4 2M dan dilakukan pembacaan optical density (OD) pada 655 nm. Nilai cut of value (CV) pada uji ini diperoleh dengan persamaan:
CV = Rerata kontrol negatif + (2 standar deviasi)
Analisis Data
Data yang diperoleh selama masa penelitian ditabulasi dengan program MS. Office Excel 2010. Parameter SR uji tantang, SR kumulatif, RPS, LPH, AF dan titer antibodi dianalisis dengan uji one way ANOVA menggunakan program SPSS
ver.16 dengan selang kepercayaan 95%. Uji lanjut dilakukan dengan uji Duncan. Pengamatan gejala klinis dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
Kelangsungan hidup ikan uji pada masa uji tantang
9
Tabel 1. Kelangsungan hidup (SR) dan relative percent survival (RPS) benih ikan mas pada saat uji tantang KHV
Parameter Perlakuan
Keterangan: Kontrol negatif kepadatan 800 ekor/L (K-8), kontrol negatif kepadatan 1200
ekor/L (K-12), kontrol positif kepadatan 800 ekor/L (K+8), kontrol positif kepadatan 1200
ekor/L (K+12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi
kepadatan 1200 ekor/L (V12). Huruf superscript yang berbeda pada baris yang sama
menunjukkan perlakuan berbeda nyata (P<0.05). Nilai yang tertera merupakan nilai
rata-rata dan simpangan baku.
Pola kematian ikan uji
Minggu ke-2 dan minggu ke-3 pascauji tantang dalam penelitian ini merupakan puncak infeksi KHV. Hal tersebut ditunjukkan dengan tingginya nilai mortalitas, baik pada perlakuan K+8, K+12, V8 maupun V12 masing-masing sebesar 40%, 60%, 20% dan 33% dari populasi. Kematian pada ikan perlakuan V8 dan V12 mulai terhenti pada 20 hari pascainfeksi (hpi), sedangkan pada kontrol positif kematian masih berlanjut hingga 28 hpi (Gambar 1).
Gambar 1. Kematian kumulatif benih ikan mas pascainfeksi KHV. Perlakuan vaksinasi dan kontrol positif diuji tantang dengan 0.1 mL filtrat KHV konsentrasi 10-3. Kontrol negatif kepadatan 800 ekor/L (K-8), kontrol negatif kepadatan 1200 ekor/L (K-12), kontrol positif kepadatan 800 ekor/L (K+8), kontrol positif kepadatan 1200 ekor/L (K+12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi kepadatan 1200 ekor/L (V12).
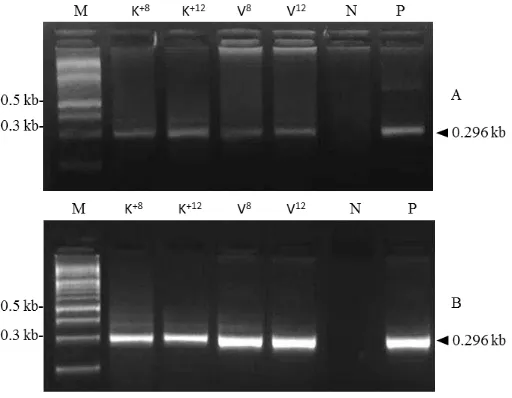
Insang pada ikan uji yang mati diperiksa dan dilakukan validasi terhadap keberadaan virus KHV dengan metode PCR. Hasil validasi membuktikan bahwa kematian yang terjadi pada ikan uji akibat infeksi KHV (Gambar 2A dan 2B).
10
Gambar 2. Elektroforegram hasil validasi kematian ikan pada saat uji tantang KHV menggunakan metode PCR. Validasi infeksi KHV minggu ke-2 pascauji tantang (A). Validasi infeksi KHV minggu ke-3 pascauji tantang (B). DNA marker: KAPA universal DNA ladder (M), kontrol negatif (N), kontrol positif KHV (P), perlakuan kontrol positif kepadatan 800 ekor/L (K+8), perlakuan kontrol positif kepadatan 1200 ekor/L (K+12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi kepadatan 1200 ekor/L (V12). Tanda kepala panah menunjukkan posisi fragmen DNA KHV (296 bp).
Gajala klinis ikan uji
Pengamatan gejala klinis pada ikan uji dilakukan selama 28 hari masa uji tantang. Konfirmasi awal status kesehatan ikan uji bebas KHV dilakukan sebelum perlakuan vaksinasi. Hasil konfirmasi menggunakan metode PCR menunjukkan bahwa ikan yang digunakan adalah sehat dan bebas KHV (Gambar 3).
11
Gejala klinis ikan uji mulai teramati pada 7 hpi yaitu perlakuan V8, V12 dan kontrol positif (K+), sedangkan perlakuan kontrol negatif (K-) teramati normal. Gejala klinis tingkah laku ikan uji yang teramati pada saat uji tantang KHV antara lain penurunan nafsu makan yang drastis, ikan berkumpul di permukaan air, pernafasan berlangsung cepat (megap-megap), dan bergerak tidak beraturan. Adapun perubahan morfologi pada ikan uji yang teramati antara lain perubahan warna ikan (discolouration), kulit ikan terasa kasar, mata ikan menjadi cekung (sunken eyes) geripis pada sirip ikan, pendarahan (hemorraghe) pada tubuh ikan, serta nekrosis pada insang ikan terutama perlakuan K+ pada periode puncak infeksi KHV (Gambar 4).
Gambar 4. Gejala klinis perubahan morfologi benih ikan mas pada masa uji tantang. Pendarahan pada kulit dan tubuh ikan (hemorraghe), mata ikan nampak cekung (sunken eyes) (A). Pembengkakan pada bagian abdomen ikan uji (hyperemia) (B). Kulit ikan menjadi kasar, geripis pada sirip ikan (C). Nekrosis pada bagian insang ikan (D).
Respons imunitas ikan uji
12
inang/ikan uji. Pengamatan pada masa uji tantang secara umum nilai persentase AF perlakuan vaksinasi lebih tinggi (P<0.05) dibandingkan dengan kontrol (K+ dan K-) masing-masing perlakuan, dengan nilai tertinggi diperoleh oleh perlakuan V8 (Gambar 5).
Gambar 5. Respons imun non-spesifik ikan mas terhadap infeksi KHV. Kontrol positif kepadatan 800 ekor/L (K+8), kontrol positif kepadatan 1200 ekor/L (K+12), kontrol negatif kepadatan 800 ekor/L (K-8), kontrol negatif kepadatan 1200 ekor/L (K-12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi kepadatan 1200 ekor/L (V12). Huruf yang berbeda di atas bar menunjukkan perlakuan berbeda nyata (P<0.05). Tanda panah menunjukkan awal pengamatan AF pada masa uji tantang.
13
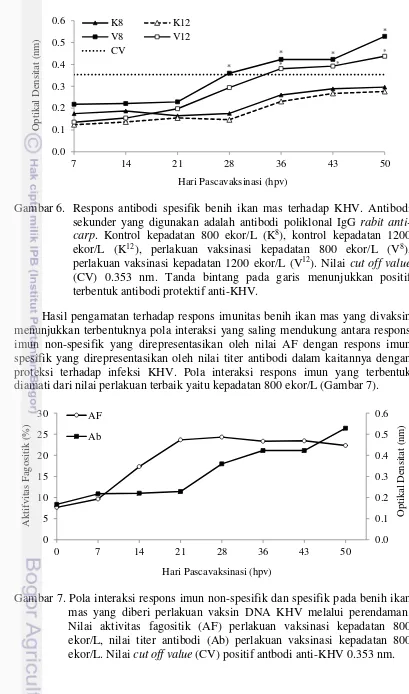
Gambar 6. Respons antibodi spesifik benih ikan mas terhadap KHV. Antibodi sekunder yang digunakan adalah antibodi poliklonal IgG rabit anti-carp. Kontrol kepadatan 800 ekor/L (K8), kontrol kepadatan 1200 ekor/L (K12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi kepadatan 1200 ekor/L (V12). Nilai cut off value
(CV) 0.353 nm. Tanda bintang pada garis menunjukkan positif terbentuk antibodi protektif anti-KHV.
Hasil pengamatan terhadap respons imunitas benih ikan mas yang divaksin menunjukkan terbentuknya pola interaksi yang saling mendukung antara respons imun non-spesifik yang direpresentasikan oleh nilai AF dengan respons imun spesifik yang direpresentasikan oleh nilai titer antibodi dalam kaitannya dengan proteksi terhadap infeksi KHV. Pola interaksi respons imun yang terbentuk diamati dari nilai perlakuan terbaik yaitu kepadatan 800 ekor/L (Gambar 7).
Gambar 7. Pola interaksi respons imun non-spesifik dan spesifik pada benih ikan mas yang diberi perlakuan vaksin DNA KHV melalui perendaman. Nilai aktivitas fagositik (AF) perlakuan vaksinasi kepadatan 800 ekor/L, nilai titer antibodi (Ab) perlakuan vaksinasi kepadatan 800 ekor/L. Nilai cut off value (CV) positif antbodi anti-KHV 0.353 nm.
14
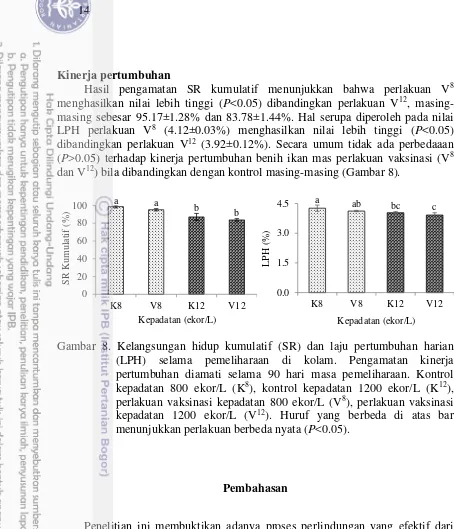
Hasil pengamatan SR kumulatif menunjukkan bahwa perlakuan V8 menghasilkan nilai lebih tinggi (P<0.05) dibandingkan perlakuan V12, masing-masing sebesar 95.17±1.28% dan 83.78±1.44%. Hal serupa diperoleh pada nilai LPH perlakuan V8 (4.12±0.03%) menghasilkan nilai lebih tinggi (P<0.05) dibandingkan perlakuan V12 (3.92±0.12%). Secara umum tidak ada perbedaaan (P>0.05) terhadap kinerja pertumbuhan benih ikan mas perlakuan vaksinasi (V8 dan V12) bila dibandingkan dengan kontrol masing-masing (Gambar 8).
Gambar 8. Kelangsungan hidup kumulatif (SR) dan laju pertumbuhan harian (LPH) selama pemeliharaan di kolam. Pengamatan kinerja pertumbuhan diamati selama 90 hari masa pemeliharaan. Kontrol kepadatan 800 ekor/L (K8), kontrol kepadatan 1200 ekor/L (K12), perlakuan vaksinasi kepadatan 800 ekor/L (V8), perlakuan vaksinasi kepadatan 1200 ekor/L (V12). Huruf yang berbeda di atas bar menunjukkan perlakuan berbeda nyata (P<0.05).
Pembahasan
Penelitian ini membuktikan adanya proses perlindungan yang efektif dari pemberian vaksin DNA KHV (1.3×109 CFU/L) pada benih ikan mas 30 hpt. SR benih ikan mas yang divaksin pada saat uji tantang adalah lebih tinggi (P<0.05) dibandingkan dengan perlakuan tanpa vaksinasi, berturut-turut 68.89% dan 17.8%. Perbedaan nilai SR ini menguatkan bahwa efikasi vaksin DNA KHV secara efektif mampu memberikan perlindungan pada benih ikan mas terhadap infeksi KHV. Disamping itu, tingginya kematian pada benih ikan mas tanpa vaksinasi (hingga 100%) pada masa uji tantang mengindikasikan bahwa virus yang digunakan adalah bersifat virulen. Vaksin DNA penyandi glikoprotein KHV
diaplikasikan menggunakan promoter β-aktin ikan medaka. Penggunaan promoter
β-aktin pada vaksin DNA memiliki peluang besar untuk dapat memproduksi glikoprotein KHV pada ikan mas, selanjutnya glikoprotein tersebut diproduksi sebagai antigen yang kemudian menginduksi respons imun ikan melalui pembentukan antibodi anti-KHV (Nuryati et al. 2010). Hal inilah yang kemudian
15
berpengaruh terhadap efektivitas proteksi vaksin DNA KHV pada benih ikan mas yang divaksin. Hasil serupa juga diperoleh pada penelitian Nuswantoro et al. (2012), kelangsungan hidup benih ikan mas yang divaksin memiliki nilai SR lebih tinggi (60.00-63.33%) dibandingkan dengan kontrol (26.67%).
Perbedaaan hasil persentase nilai SR pada proses vaksinasi dapat pula disebabkan oleh frekuensi dan lama waktu pemberian vaksin. Namun demikian,
dalam penelitian ini aplikasi vaksin DNA KHV (1.3×109 CFU/L) sebanyak 1 kali
nilai SR pada perlakuan vaksinasi 800 ekor/L dibandingkan dengan 1200 ekor/L (Tabel 1) pada saat uji tantang diduga lebih disebabkan oleh pengaruh perbedaan kepadatan dalam vaksinasi. Peningkatan kepadatan populasi ikan pada saat vaksinasi berpengaruh terhadap pola distribusi dan uptake plasmid target, sehingga menyebabkan perbedaaan respons imun yang terbentuk.
Efikasi vaksin DNA KHV pada benih ikan mas terhadap infeksi KHV berkaitan erat dengan hasil persentase nilai RPS. Nilai RPS menunjukkan kisaran nilai untuk proteksi yang efektif dari suatu proses vaksinasi. Pengamatan RPS pada penelitian ini menunjukkan bahwa perlakuan vaksinasi kepadatan 800 ekor/L (63.37%) memiliki nilai lebih tinggi (P<0.05) dibandingkan dengan kepadatan 1200 ekor/L (9.89%). Nilai ini memenuhi kisaran untuk proteksi yang efektif pada proses vaksinasi. Hasil tersebut sesuai dengan Armend (1981) kisaran nilai RPS untuk proteksi yang efektif adalah lebih dari 60%. Hasil perolehan nilai RPS pada penelitian ini sejalan dengan nilai SR pada saat uji tantang pada ikan uji, perlakuan vaksinasi 800 ekor/L teramati memiliki nilai lebih tinggi dibandingkan dengan 1200 ekor/L. Hasil ini juga lebih baik apabila dibandingkan dengan penelitian sebelumnya (Nuswantoro et al. 2010), dengan nilai RPS yang diperoleh sebesar 44.10-50%.
16
tubuh ikan. Infeksi virus KHV berjalan dengan cepat dan menyebar ke seluruh tubuh sehingga menyebabkan kerusakan pada organ tubuh ikan (Pikarsky et al. 2004). Hal tersebut ditandai dengan hemorraghe yang terjadi pada hampir seluruh tubuh ikan dengan diikuti pembengkakan pada bagian abdomen ikan. Ikan yang terinfeksi KHV umumnya mengalami kerusakan pada insang berupa nekrosis dan bintik putih pada filamen, serta perubahan tingkah laku ikan. Namun demikian, beberapa ikan yang terinfeksi KHV tidak selalu menunjukkan gejala klinis. Gejala klinis yang secara konsisten teramati adalah discolouration, dan frekuensi pernafasan yang tinggi (Hedrick et al. 2000; Gray et al. 2002)
Secara umum nilai aktivitas fagositik perlakuan vaksinasi lebih tinggi dibandingkan dengan ikan kontrol positif baik pada masa pemeliharaan maupun uji tantang, peningkatan terjadi secara signifikan teramati mulai minggu ke-2 pascavaksinasi (Gambar 5). Penurunan nilai aktivitas fagositik teramati pada saat uji tantang baik perlakuan vaksinasi maupun kontrol positif yaitu mulai 36 hpv. Penurunan nilai aktivitas fagositik yang terjadi berkaitan dengan puncak infeksi KHV pada saat uji tantang, ditandai dengan nilai mortalitas ikan yang tinggi pada semua perlakuan. Kondisi ini berkaitan dengan adanya pengaruh dari aktivitas kekebalan seluler pada sistem sirkulasi, di mana kemungkinan besar aktivitas fagositik berlangsung di tempat terjadinya infeksi sehingga sel-sel leukosit yang ditemukan di pembuluh darah melakukan proses fagositosis lebih rendah (Nuryati 2010). Peningkatan dan penurunan nilai aktivitas fagositik tersebut sangat berkaitan dengan respons imun seluler yang terjadi pada ikan yang diinfeksi oleh patogen. Nilai aktivitas fagositik berkaitan dengan perluasan infeksi dari suatu penyakit, yaitu apabila sel-sel fagosit bekerja secara optimal maka perluasan infeksi di dalam tubuh ikan dapat dibatasi. Hal yang sama dikemukakan pula oleh Tizard (1998), pola peningkatan aktivitas fagositik mencerminkan fungsi peningkatan total leukosit maupun persentase sel-sel leukosit masing-masing pada limfosit, monosit dan neutrofil terhadap patogen yang menyerang.
Aplikasi vaksin DNA KHV whole cell bacteria pada benih ikan mas yaitu melalui bakteri kompeten E. coli DH5α pada penelitian ini menjadi pemicu
peningkatan respons imun non-spesifik pada ikan uji. Mekanisme pertahanan tubuh ikan melalui imunitas bawaan (innate immunity) terhadap bakteri dilakukan melalui produksi berbagai substansi antimikroba dengan spektrum luas, aktivasi komplemen, rilis sitokin, mekanisme inflamasi serta proses fagositosis dengan melibatkan berbagai sel kompeten (Ellis 2001). Lapisan peptidoglikan yang terdapat pada dinding bakteri E. coli DH5α selanjutnya akan memicu respons
17
Respons antibodi spesifik yang terbentuk merupakan parameter penting dari efek vaksinasi. Titer antibodi spesifik pada penelitian ini meningkat secara perlahan pada dua minggu pertama dan secara signifikan meningkat (positif terbentuk) pada 28 hpv. Hal ini menunjukkan bahwa tingkat proteksi pada saat uji tantang berkaitan dengan antibodi spesifik yang terbentuk. Ikan uji yang divaksinasi memiliki kelangsungan hidup yang lebih tinggi dan secara signifikan berbeda dengan perlakuan kontrol. Pengamatan titer antibodi antar perlakuan vaksinasi menunjukkan bahwa kepadatan 800 ekor/L mampu membentuk antibodi spesifik lebih cepat dibandingkan perlakuan kepadatan 1200 ekor/L, masing-masing pada 28 dan 36 hpv. Hal inilah yang menyebabkan tingkat mortalitas benih ikan mas perlakuan 800 ekor/L lebih rendah dibandingkan 1200 ekor/L. Hasil uji ekspresi DNA pada penelitian sebelumnya membuktikkan bahwa pemberian vaksin DNA GP25 melalui perendaman mampu terekspresi hingga hari ke-28 (Nuswantoro et al. 2012), sedangkan melalui injeksi berupa plasmid DNA KHV GP25 mampu terekspresi mulai hari kedua setelah injeksi hingga dua minggu selanjutnya (Nuryati et al. 2010).
DNA merupakan molekul yang stabil, aplikasinya dalam proses vaksinasi mampu menginduksi dengan kuat baik respons imun spesifik (melalui ekspresi dari antigen) maupun non-spesifik (melalui CpG-S motif) (Heppel et al. 2000; Lorenzen dan LaPatra 2005). Respons imun pascavakinasi dimulai oleh sel APC yaitu sel dendrit maupun makrofag, plasmid DNA masuk ke dalam sel yang selanjutnya ditranslasikan sehingga menghasilkan protein imunogenik (Tonheim
et al. 2008). Protein imunogenik inilah yang kemudian dianggap sebagai ‘benda
asing’ oleh inang/ikan. Administrasi vaksin DNA selanjutnya akan mengaktivasi MHC I, spesifik limfosit T sitotoksik dan MHC II. Sistem imun menggunakan dua jalur untuk mengeleminasi antigen intraseluler dan ekstraseluler. Antigen endogeneous diproses di jalur sitosolik (cytosolic pathway) dan dipresentasikan oleh molekul MHC kelas I. Antigen eksogenus diproses di jalur endositik (endocytic pathway) (Rawat et al. 2007). Sel-sel APC dapat mengambil antigen terlarut (peptida) yang dilepas oleh sel yang lain misalnya myosit. Sel-sel APC selanjutnya memprosesnya dan mempresentasikannya melalui molekul MHC kelas II yang ada di permukaan sel. Sel TCR (T cell receptor) mengenali peptida yang dipresentasikan oleh molekul MHC kelas I dan kelas II masing-masing melalui molekul CD8+ yang ada di T cell (cytotoxic T cell) dan CD4+ dari T cell (T helper) (Tonheim et al. 2008). Jalur sitosolik berperanan dalam membangkitkan respons kekebalan seluler (non-spesifik), sedangkan jalur endositik berperanan dalam membangkitkan respons kekebalan humoral melaui pembentukan antibodi (spesifik).
Salah satu keunggulan vaksin DNA adalah kemampuannya untuk menstimulasi baik respons imun seluler maupun humoral (Restifo et al. 2000; Tonheim et al. 2008). Respons imun seluler secara sederhana, dilakukan dengan aktivasi sel Th1 yang selanjutnya akan mensekresikan pro-inflamatory cytokines
18
tingkat proteksi pada respons imunitas non-spesifik yang digambarkan oleh persentase nilai AF pada saat uji tantang, selanjutnya mekanisme proteksinya akan digantikan oleh respons imun spesifik melalui pembentukan antibodi anti-KHV. Hasil tersebut menggambarkan bahwa proses vaksinasi menggunakan vaksin DNA KHV mampu untuk menginduksi baik respons imun non-spesifik maupun spesifik, sehingga proteksi yang dihasilkan pada saat uji tantang lebih baik dibandingkan dengan kontrol (Gambar 1).
Rendahnya mortalitas ikan uji yang divaksinasi pada saat uji tantang terutama pada perlakuan 800 ekor/L, berkaitan dengan kemampuan netralisasi virus KHV oleh antibodi anti-KHV. Netralisasi dapat dikatakan sebagai hilangnya infektivitas pada virus akibat pengikatan oleh antibodi terhadap partikel virus (Dimmock 1995). Mekanisme netralisasi terjadi apabila terdapat proporsi antibodi yang cukup pada situs infeksi sehingga antibodi mampu menghambat proses penempelan (attachment) dan masuknya virus pada sel inang (Burton 2002). Proses netralisasi dilakukan pada virus dalam bentuk virus bebas (free virus).
Antibody Fc-mediated effector system mampu melawan virus bebas melalui beberapa mekanisme antara lain aktivasi komplemen yang kemudian akan mengikat dan mendeposisikan partikel virus ke permukaan virion sehingga akan meningkatkan proses netralisasi melalui virolisis. Reseptor antibodi dan komplemen akan melakukan pengikatan melalui ikatan antibody-coated virion
atau complement-coated virion yang selanjutnya akan menginisiasi terjadinya proses fagositosis dan inaktivasi virion di dalam kompartemen sel fagosit (Spear
et al. 2001). Proses netralisasi pada sel yang terinfeksi dilakukan melalui pengikatan molekul-molekul pada amplop virus yang terekspresi pada membran sel inang. Proses pelekatan ini selanjutnya akan menginisiasi terjadinya lisis dan pembersihan (clearance) virus oleh antibodi melalui antibody-dependent celluler cytotoxicity (ADCC) atau complement-dependent cytotoxicity (CDC), yang akan menghambat replikasi virus di dalam sel, keluarnya (release) virus dari dalam sel yang terinfeksi maupun transmisi virus dari sel ke sel lainnya (Burton 2002).
19
ini dapat dilihat dari nilai SR dan RPS yang lebih tinggi pada masa uji tantang dibandingkan dengan perlakuan lainnya (Tabel 1). Hasil perhitungan biaya produksi vaksin untuk kepadatan 800 ekor/L dalam penelitian ini diperoleh nilai sebesar Rp. 2.96/ekor ikan (Lampiran 4). Nilai tersebut sangat ekonomis untuk dapat ditambahkan dalam biaya produksi budidaya ikan mas.
4 SIMPULAN DAN SARAN
Simpulan
Aplikasi vaksin DNA KHV whole cell bacteria (1.3×109 CFU/L) melalui metode perendaman sebanyak 1×30 menit dengan kepadatan 800 ekor/L menunjukkan hasil optimal dalam meningkatkan respons imunitas benih ikan mas (30 hpt; rerata bobot tubuh 0.19±0.01 g) terhadap infeksi KHV. Hal ini didukung dengan nilai kelangsungan hidup, aktivitas fagositik dan titer antibodi yang tinggi. Pemberian vaksin DNA KHV terhadap benih ikan mas tidak menunjukkan adanya proses penghambatan terhadap pertumbuhan benih ikan mas yang dipelihara.
Saran
Penelitian lanjut terhadap titer antibodi dengan rentang waktu pengamatan yang lebih panjang perlu dilakukan untuk mengetahui profil dan pola imunitas spesifik yang lebih lengkap untuk membuktikan apakah vaksin DNA memerlukan
booster atau tidak. Aspek keamanan vaksin terhadap lingkungan budidaya perlu dilakukan penelitian untuk memastikan keamanannya (biosafety).
DAFTAR PUSTAKA
Anderson DP, Siwicki AK. 1995. Basic hematology and serology for fish health programs. In: Diseases in Asian Aquaculture II. (M. Shariff, J.R. Auther & R.P. Subasinghe ed.), pp. 185-202, Fish Health Section, Asian Fisheries Society, Manila.
Armend DF. 1981. Potency testing of fish vaccines. Develop Biol Stand 49:447-454.
Bretzinger A, Fischer-Scherl T, Oumouna M, Hoffmann R, Truyen U. 1999. Mass mortalities in koi carp, Cyprinus carpio, associated with gill and skin disease. Bull Eur Assoc Fish Pathol. 19:182-185.
Burton DR. 2002. Antibodies, viruses and vaccines. Nature Reviews. 2:706-713 Cho MY, Shon SK, Park SI. 2005. The status of viral disease of carp in Korea: Its
20
Crane M, Sano M, Komar C. 2004. Infection with koi herpes virus-disease carp. Developed to support the NACA/FAO/OIE regional quarterly aquatic animal disease (QAAD) reporting system in the Asia-Pacific. NACA, Bangkok. 11p
Dimmock NJ. 1995. Update on the neutralization of animal viruses. Rev Med Virol. 5:165–179.
Eide KE, Miller-Morgan T, Heidel JR, Kent ML, Bidfell RJ, LaPatra S, Watson G, Jin L. 2011. Investigation of koi herpesvirus latency in koi. J Virol
85:4954-4962.
Ellis AE. 2001. Innate host defense mechanisms of fish against virus and bacteria.
Dev Com Immunol. 25:827-839.
Ellis AE. 1999. Imunity to bacteria in fish. Fish Shell Immunol. 9:291-308.
Ellis AE. 1988. General principles of fish vaccination, in: Ellis, A.E. (ed), Fish vaccination. Academic press, London, pp: 255.
Gilad O, Yun S, Fransisco J, Zagmut-Vergara, Leutenegger CM, Becovier H, Hedrick RP. 2004. Concentration of a Koi herpesvirus (KHV) in tissues of experimentally infected Cyprinus carpio koi as assessed by real-time TaqMan PCR. Dis Aquat Org. 60:179-187.
Gilad O, Yun S, Adkison MA, Way K, Willits NH, Bercovier H, Hedrick RP. 2003. Molecular comparison of isolates of an emerging fish pathogen, koi herpesvirus, and the effect of water temperature on mortality of experimentally infected koi. J Gen Virol. 84:2661-2668.
Gray WL, Mullis L, LaPatra SE, Groff JM, Goodwin A. 2002. Detection of koi herpesvirus DNA in tissue of infected fish. J Fish Dis. 25:171-178.
Haenen OLM, Way K, Bergmann SM, Ariel E. 2004. The emergence of koi herpesvirus and its significance to European aquaculture. Bull Eur Assoc Fish Pathol. 24:293–307.
Hartman KH, Yanong RPE, Pouder DB, Petty BD, Francis-Floyd R, Riggs AC. 2008. Koi herpesvirus (KHV) disease. Fact Sheet VM-149 The Institute of Food and Agricultural Sciences (IFAS) University of Florida (UF).
Hedrick RP, Gilad O, Yun S, Spangenberg JV, Marty GD, Nordhausen RW, Kebus MJ, Bercovier H, Eldar A. 2000. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp. J Aquat Animal Health. 12:44-57.
Heppel J, Heather L, Davis. 2000. Application of DNA vaccine technology to aquaculture. Adv Drug Deliv Rev. 43:29-43.
Huisman EA. 1987. Principles of fish cultureproduction. Department of Aquaculture. Wageningen University, Netherand.
Kurath G. 2008. Biotechnology and DNA vaccines for aquatic animals. Rev Sci Tech. International Office of Epizootics. 27:175-196.
Lorenzen N, LaPatra SE. 2005. DNA vaccines for aquacultured fish. Rev Sci Tech. International Office of Epizootics. 24:201-213.
21
Nuryati S, Yuliyanti, Alimuddin. 2013. Frekuensi dan persistensi vaksin DNA penyandi GP25 yang diberikan melalui pakan buatan pada ikan mas
Cyprinus carpio. J Akua Indo. 12:151–157.
Nuryati S, Alimudin, Sukenda, Soejoedono RD, Santika A, Pasaribu FH, Sumantadinata K. 2010. Construction of a DNA Vaccine using glycoprotein gene and its expression towards increasing survival rate of KHV-Infected common carp, Cyprinus carpio. J Natur Indo. 13:47-52.
Nuryati S. 2010. Pengembangan vaksin DNA penyandi Glikoprotein virus KHV (koi herpesvirus) menggunakan isolat lokal. [Disertasi]. Prodi Sains Veteriner. Sekolah Pascasarjana Institut Pertanian Bogor, Bogor.
Nuswantoro S, Alimuddin, Yuhana M, Santika A, Nuryati S, Zainun Z, Mawardi M. 2012. Efikasi vaksin DNA penyandi glikoprotein koi herpesvirus pada ikan mas stadia benih melalui perendaman. J Akua Indo. 1:76-85.
Perelberg A, Ilouze M, Kotler M, Steinitz M. 2008. Antibody response and resistance of Cyprinus carpio immunized with cyprinid herpes virus 3 (CyHV-3). Vaccine. 26:3750-3756.
Perelberg A, Ronen A, Hutoran M, Smith Y, Kotler M. 2005. Protection of cultured Cyprinus carpio against a lethal viral disease by an attenuated virus vaccine. Vaccine. 23:3396-3403.
Perelberg A, Smirov M, Hutoran M, Diamant A, Bejerano Y, Kotler M. 2003. Epidemiological description of a new viral disease afflicting cultured
Cyprinus carpio in Israel. Israeli J Aqua. 55:5-12.
Pikarsky E, Ronen A, Abramowitz J, Lovali-Sivan B, Hutoran M, Saphira Y, Steinitz M, Parelberg A, Soffer D, Kotler M. 2004. Pathogenesis of acute viral disease induce in fish by carp interstitial nephritis and gill necrosis virus. J Virol. 78:9544-51.
Rawat M, Singh D, Saraf S, Saraf S. 2007. An overview of biochemical aspects of DNA vaccine. Asian J Biochem. 2:208-223.
Restifo NP, Ying H, Hwang L, Leitner WW. 2000. The Promise of nucleic acide vaccines. Gene Therapy. 7:89-92
Ronen A, Perelberg A, Abramowitz J, Hutoran M, Tinman S, Bejerano I, Steinitz M, Kotler M. 2003. Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio. Vaccine. 21:4677-4684.
Sano M, Ito T, Kurita J, Yanai T, Watanabe N, Satoshi W, Iida T. 2004. First detection of koi herpesvirus in cultured common carp Cyprinus carpio in Japan. Fish Pathol. 39:165-168.
Spear GT, Hart M, Olinger GG, Hashemi FB, Saifuddin M. The role of the complement system in virus infections. Curr Top Microbiol Immunol.
260:229–245.
Sunarto A, McColl KA, Crane MSJ, Schat KA, Slobedman B, Barnes AC, Walker PJ. 2014. Characteristic of cyprinid herpervirus 3 in different phases of infection: Implications for disease transmission and control. Vir Res 188:45-53.
22
Sunarto A, Rukyani A, Itami T. 2005. Indonesian experience on the outbreak of koi herpesvirus in koi and carp Cyprinus carpio. Bull Fish Res Agency. Supplement 2:15-21.
Sunarto A, Taukhid, Rukyani A, Koesharyani I, Supriyadi H, Huminto H, Agungpriyono DR, Pasaribu FH, Widodo, Herdikiawan D, Rukmono D, Prayitno SB. 2002. Field investigations on a serious disease outbreak among koi and common carp Cyprinus carpio in Indonesia. Paper presented in 5th Symposium on Diseases in Asian Aquaculture, 24-28 November 2002, Gold Coast, Australia.)
Taukhid, Lusiastusi AM., Andiyani W., Rosidah, Sriati. 2010. Induksi kekebalan spesifik pada ikan mas Cyprinus carpio Linn. terhadap infeksi koi herpesvirus (KHV) melalui teknik kohabitasi terkontrol. J Ris Akua. 5:257-276
Taukhid, Sunarto A, Koeshani I, Supriyadi H dan Gardenia L. 2004. Strategi pengendalian penyakit koi herpes virus (KHV) pada ikan mas dan koi. Makalah workshop pengendalian penyakit koi herpes virus (KHV) pada budidaya ikan air tawar, Bogor.
Tizard I. 1988. An Introduction to Veterinary Immunology. Second Ed. Wb. Sanders Company. Philadelphia
Tonheim TC, BØgwald J, Dalmo RA. 2008. What happens to the DNA vaccine in fish? A review of current knowledge. Fish Shell Immunol. 25:1-18.
Tu C, Weng MC, Shiau JR, Lin SY. 2004. Detection of koi herpesvirus in koi
Cyprinus carpio in Taiwan. Fish Pathol. 39:109-110.
Yasumoto S, Kazuya Y, Yasuda M, Yoshimura T, Miyazaki T. 2006. Oral immunization of common carp with a liposome vaccine fusing koi herpesvirus antigen. Fish Pathol. 41:141-145.
Zheng FR, XQ Sun, HZ Liu, JX Zhang. 2006. Study on the distribution and expression of a DNA vaccine against lymphocystis disease virus in Japanese flounder Paralichthys olivaceus. Aquaculture. 261:1128-1134.
Zhou J-X, Wang H, Li X-W, Lu W-L, Zhang D-M. 2014a. Construction of KHV-CJ ORF25 DNA vaccine and immune challenge test. J Fish Dis. 37:319-325.
23
24
Lampiran 1. Metode pengukuran kepadatan vaksin DNA KHV whole cell bacteria
menggunakan spektrofotometer.
1. Bakteri Escherichia coli (DH5α) dikultur dengan media 2xYT padat pada suhu inkubasi 37C selama 16-20 jam
2. Koloni berukuran besar dipindahkan ke media kultur 2xYT cair 500 mL dan diinkubasi dalam incubation shaker pada suhu 37ºC dengan kecepatan 200 rpm selama 16-20 jam
3. Pelet bakteri dipanen dengan sentrifugasi kemudian dicuci dengan phosphate buffer saline (PBS) sebanyak dua kali
4. Pelet bakteri hasil pencucian dilarutkan dalam PBS sebanyak 10 mL dan diukur kepadatannya menggunakan spektrofotometer
5. Bakteri menunjukkan kepadatan 109 sel/mL bila diperoleh nilai absorbansi sekitar 1-1.5 pada panjang gelombang 600 nm (A600)
Lampiran 2. Visualisasi hasil deteksi keberadaan antibodi poliklonal anti-ikan mas pada kelinci.
Keterangan: sampel antigen KHV (a), sampel serum antibodi anti-ikan mas (m), sampel serum antibodi anti-ikan koi (k), sumur negatif tanpa serum (n)
Lampiran 3. Konfirmasi infeksi KHV pada ikan uji menggunakan metode
Polymerase chain reaction (PCR)
1. Preparasi sampel uji
a. Insang ikan diambil dan dipotong seberat 5-20 mg
b. Insang dibersihkan dan dimasukkan dalam microtube untuk proses selanjutnya
2. Cell lysis
a. Cell lysis solution dimasukkan ke dalam microtube sebanyak 200 µl kemudian ditambahkan dengan 1.5 µl Proteinase K (20 mg/mL)
b. Sampel jaringan insang selanjutnya dimasukkan sebanyak 5-20 mg ke dalam microtube
25
3. RNase treatment
a. Sampel hasil inkubasi selanjutnya didinginkan pada suhu ruangan
b. Ditambahkan 1.5 µl RNase (4 mg/mL) pada microtube kemudian dihomogenkan dengan cara digoyang-goyangkan (± 30 kali)
c. Sampel diinkubasi kembali pada 37 °C selama 1 jam, kemudian didinginkan pada suhu ruangan.
4. Protein precipitation
a. Protein precipitation solution ditambahkan pada microtube sebanyak 50 µl, kemudian di-vortex dengan kecepatan tinggi selama 30 detik
b. Sampel disimpan ke dalam ice bath selama 10-15 menit, kemudian sentrifuge pada 13000 rpm, 4 °C selama 10 menit
c. Microtube baru disiapkan dan ditambahkan ke dalamnya 300 µl 100% isopropanol
d. Supernatan yang mengandung DNA hasil sentrifugasi selanjutnya dituangkan ke dalam microtube yang mengandung isopropanol
e. Sampel dihomogenkan dengan cara inverting 50 kali
f. Sampel selanjutnya disentrifugasi pada 13000 rpm, 4 °C selama 10 menit g. Supernatan selanjutnya dibuang dan ditambahkan 300 µl 70% EtOH h. Sampel kembali disentrifugasi pada 13000 rpm, 4 °C selama 10 menit i. ETOH selanjutnya dibuang dengan hati-hati dan dikeringanginkan
microtube selama 10 menit
j. Ion exchange water (IEW sebanyak 20 µl kemudian ditambahkan pada
microtube dan simpan DNA pada suhu -20 °C untuk penyimpanan lama
5. Proses PCR
a. Microtube ukuran 200 µl dan 600 µl masing-masing disiapkan untuk wadah sampel dan premix dalam proses PCR
b. Campuran premix selanjutnya disiapkan ke dalam microtube 600 µl,
- Premix dihomogenkan dengan menggunakan vortex
c. Premix yang telah dihomogenkan selanjutnya dimasukkan sebanyak 1 µl ke dalam microtube baru (ukura 200 µl)
d. Sebanyak 1 µl sampel (hasil ekstraksi DNA) selanjutnya ditambahkan ke dalam microtube dan dihomogenkan dengan cara pipetting.
26
Lampiran 4. Perhitungan harga produksi vaksin DNA KHV whole cell bacteria
Komposisi Bahan
Jenis Produk
Bobot Bahan (g)
Jumlah Bahan yang
digunakan Harga Bahan (Rp) %/100
mL
g/100 mL
g/500
mL 500 g 1 g 500 mL 1 mL
Tripthone
(1.6%) Himedia 500 g 1.6 1.6 g 8 1250000 2500 20000 40 Yeast extract
(1%) Himedia 500 g 1 1 g 5 680000 1360 6800 13.6 NaCl (0.5%) Himedia 500 g 0.5 0.5 g 2.5 300000 600 1500 3 Miliq Water 20 L 100 mL 500 mL 600000 30000 15000 30 Amphicilin Phytotech 5 g 100 µl 500 µl 1520000 304000 75000 150 Harga Total
Bahan (Rp) 118300 236.6 Harga/ekor
(Rp)
400 ekor 5.915 800 ekor 2.958
27
RIWAYAT HIDUP
Penulis dilahirkan di Rangkasbitung, Lebak, Provinsi Banten pada tanggal 26 November 1990 dari pasangan Bapak Drs. Murod Zuhri dan Dra. Meitun Rukiah. Penulis merupakan anak ketiga dari 3 bersaudara. Pendidikan formal dilalui penulis di SDN Muara Ciujung Timur I (lulus tahun 2002), SMPN 2 Rangkasbitung (lulus tahun 2005) dan SMAN 1 Rangkasbitung (lulus tahun 2008). Penulis menempuh pendidikan sarjana pada Program Studi Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Universitas Diponegoro melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) tahun 2008 dan menyelesaikan pendidikan pada tahun 2012. Pada tahun 2013 penulis melanjutkan studi dengan menempuh Program Magister pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor.