EFEKTIVITAS VAKSIN DNA
DALAM MENINGKATKAN KELANGSUNGAN HIDUP
IKAN MAS YANG TERINFEKSI KOI HERPESVIRUS (KHV)
ISWI HAYATI FITRIA
SKRIPSI
PROGRAM STUDI TEKNOLOGI MANAJEMEN PERIKANAN BUDIDAYA FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2009
EFEKTIVITAS VAKSIN DNA
DALAM MENINGKATKAN KELANGSUNGAN HIDUP
IKAN MAS YANG TERINFEKSI KOI HERPESVIRUS (KHV)
ISWI HAYATI FITRIA
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyampaikan bahwa skripsi yang berjudul :
EFEKTIVITAS VAKSIN DNA DALAM MENINGKATKAN KELANGSUNGAN HIDUP IKAN MAS YANG TERINFEKSI KOI HERPESVIRUS (KHV)
Adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2009
ISWI HAYATI FITRIA C14104004
RINGKASAN
ISWI HAYATI FITRIA. Efektivitas Vaksin DNA dalam Meningkatkan
Kelangsungan Hidup Ikan Mas yang Terinfeksi Koi Herpesvirus (KHV). Dibimbing oleh SRI NURYATI dan YANI HADIROSEYANI
Ikan mas Cyprinus carpio adalah spesies ikan air tawar yang bernilai ekonomis penting yang sudah tersebar luas di Indonesia dan merupakan salah satu dari 12 jenis komoditas andalan perikanan budidaya di Indonesia. Koi Herpesvirus sampai saat ini masih menjadi masalah dalam budidaya ikan mas. Penyakit ini sangat ganas dan dapat menyebabkan kematian massal (80-100%).
Pengendalian virus yang utama sebenarnya pada manajemen budidaya yang baik. Pengendalian ini dapat dilakukan melalui karantina terhadap pemasukan ikan-ikan baru. Namun, bagaimanapun baiknya sistem karantina, sulit menjamin ikan tersebut bebas dari virus, hal ini disebabkan metode yang ada untuk mendeteksi virus masih terbatas dan virus dapat hadir dalam tubuh inang tanpa menunjukkan gejala klinis.
Vaksinasi merupakan salah satu usaha pengendalian penyakit. Dalam perkembangannya, terdapat empat jenis vaksin diantaranya vaksin yang dimatikan (killed vaccine), vaksin yang dilemahkan (attenuated vaccine), vaksin protein rekombinan dan vaksin DNA. Vaksin DNA dipercaya menjadi vaksin di masa yang akan datang. Hal ini disebabkan beberapa keunggulan dari vaksin DNA diantaranya proses produksi yang relatif murah, kemudahan penyimpanan karena plasmid DNA memiliki stabilitas kimia yang tinggi, modifikasi yang cepat dari vaksin DNA untuk melawan patogen mutan, tidak membutuhkan adjuvant dan boosting untuk memperoleh kekebalan dan efektif dalam memacu sistem imun humoral dan cell mediated immunity serta aman digunakan bagi ikan.
Penelitian ini dilaksanakan pada bulan November 2008 sampai Maret 2009, bertempat di Laboratorium Genetika Ikan, Budidaya Perairan, Institut Pertanian
dosis 7.5 μg/100 μl), C ( vaksin DNA dengan dosis 12.5 μg/100 μl ), dan K (kontrol, tanpa vaksin). Virus yang digunakan memiliki konsentrasi 10-3
sebanyak 0.1 ml. Masa vaksinasi selama 42 hari dan uji tantang selama 29 hari. Hasil penelitian menunjukkan bahwa terdapat gejala klinis seperti pada gejala klinis ikan yang terserang KHV. Hasil PCR membuktikan bahwa ikan yang mati positif KHV. Perlakuan A memiliki mortalitas 100% pada hari ke-15, B pada hari ke-20, C pada hari ke-35 dan K pada hari ke-17. Ikan A mengalami kematian total paling cepat yaitu pada hari ke-15 setelah uji tantang bahkan lebih cepat dari kontrol. Ikan C dapat hidup paling lama yaitu 29 hari setelah uji tantang.
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa pemberian vaksin DNA dengan dosis 12.5 μg/100 μl dapat mempertahankan kelangsungan hidup paling lama yaitu sebesar 96.67% selama 29 hari setelah uji tantang.
EFEKTIVITAS VAKSIN DNA
DALAM MENINGKATKAN KELANGSUNGAN HIDUP
IKAN MAS YANG TERINFEKSI KOI HERPES VIRUS (KHV)
ISWI HAYATI FITRIA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
SKRIPSI
Judul Skripsi : Efektivitas Vaksin DNA dalam Meningkatkan Kelangsungan Hidup Ikan Mas yang Terinfeksi Koi Herpes Virus (KHV) Nama Mahasiswa : Iswi Hayati Fitria
Nomor Pokok : C14104004
Program Studi : Teknologi Manajemen Perikanan Budidaya Departemen : Budidaya Perairan
Disetujui
Pembimbing I Pembimbing II
Sri Nuryati, S.Pi, M.Si Ir. Yani Hadiroseyani, MM NIP : 197106061995122001 NIP : 196001311986032002
Diketahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indra Jaya, M.Sc NIP : 196104101986011002
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 30 Agustus 1986 dari pasangan Bapak Ismail Umar dan Ibu Nurhayati. Pendidikan formal yang telah dilalui penulis adalah SMUN 47 Jakarta dan lulus pada tahun 2004. Pada tahun yang sama, penulis melanjutkan pendidikan di Program Studi Teknologi dan Manajemen Akuakultur, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor (USMI).
Selama mengikuti perkuliahan, penulis pernah melaksanakan Praktek Kerja Lapang (PKL) di Balai Riset Perikanan Budidaya Air Payau (BRPBAP) Maros, Sulawesi Selatan dan Balai Budidaya Air Payau (BBAP) Takalar, Sulawesi Selatan. Penulis juga pernah menjadi asisten mata kuliah Pendidikan Agama Islam pada 2005/2006 dan 2006/2007, asisten mata kuliah Dasar-dasar Mikrobiologi Akuatik 2007/2008 dan asisten mata kuliah Penyakit Ikan 2007/2008. Selain itu penulis juga mengikuti kegiatan keorganisasian mahasiswa selaku Sekertaris Departemen Pengembangan Sumberdaya Muslim, Forum Keluarga Muslim pada periode 2005/2006 dan 2006/2007.
Tugas akhir di Institut Pertanian Bogor diselesaikan dengan menulis skripsi yang berjudul “ Efektivitas Vaksin DNA dalam Meningkatkan
PRAKATA
Segala puji bagi Allah SWT yang senatiasa memberikan pertolongan, kekuatan dan kesabaran untuk menyelesaikan skripsi ini. Shalawat serta salam kepada Rosululullah Muhammad saw Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Skripsi ini berjudul ” Efektivitas Vaksin
DNA dalam Meningkatkan Kelangsungan Hidup Ikan Mas yang Terinfeksi Koi Herpesvirus (KHV)”
Penulis menyampaikan terima kasih kepada semua pihak yang telah membantu dalam penyusunan skripsi ini, diantaranya :
1. Bapak Drs. H. Ismail Umar dan Ibu Nurhayati, S.Pdi selaku orang tua tercinta, adikku Alfi Nurfadhilah serta keluarga besar Nawawi atas kasih sayang, semangat, doa, pengorbanan yang telah diberikan
2. Ibu Sri Nuryati, S.Pi, M.Si sebagai pembimbing I, Ibu Ir. Yani Hadiroseyani, MM sebagai pembimbing II
3. Prof. Enang Harris sebagai Pembimbing Akademik, Dr Alimuddin atas segala masukan dan nasihatnya
4. Ibu Yuni Puji Hastuti S.Pi sebagai dosen penguji yang telah memberikan saran dan masukannya dalam penyelesaian tugas akhir ini.
5. Bapak Ayi Santika, S.Pi, M.Si, Ibu Zaki Zaenun, Bapak Udin dan semua pihak di Balai Besar Pengembangan Budidaya Air Tawar-Sukabumi atas bantuannya selama penelitian
6. Sahabat dan guru terbaik di ’MUI Depok’, Sahabat ROHIS 47, FKM-C, Forsmile, FORMASI BDP, ’BINTANG’, LPQ
7. Mba Ana, Mba Lina, Pak Ranta, Dwi Hany Yanti, Phyto Ardhi, Nur Akbar Maswan atas bantuannya selama penelitian, Keluarga Besar BDP dari angkatan 40-44, dosen dan staff di BDP, semua pihak yang tidak dapat disebutkan satu per satu
Penulis menyadari bahwa skripsi ini masih belum sempurna. Saran dan kritik yang membangun sangat diharapkan. Semoga karya ini dapat bermanfaat dan mendapat ridho dari Allah SWT.
Bogor, September 2009
DAFTAR ISI
DAFTAR TABEL...xi
DAFTAR GAMBAR... xii
DAFTAR LAMPIRAN... xiii
I. PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian... 2
II. TINJAUAN PUSTAKA ... 3
2.1 Ikan Mas Cyprinus carpio ... 3
2.2 Sistem Kekebalan Tubuh Ikan... 3
2.3 Koi Herpes Virus (KHV) ... 5
2.3.1 Biologi KHV... 5
2.3.2 Epidemiologi KHV... 6
2.3.3 Gejala klinis KHV ... 7
2.4 Vaksinasi ... 8
III. METODOLOGI ... 12
3.1 Waktu dan Tempat Penelitian ... 12
3.2 Alat dan Bahan ... 12
3.3 Metode Penelitian... 12
3.3.1 Isolasi Plasmid... 12
3.3.2 Penyiapan Virus KHV ... 13
3.3.3 Vaksinasi dan Uji Tantang ... 13
3.4 Parameter Penelitian ... 14
3.4.1 Gejala Klinis ... 14
3.4.2 Tingkat Kelangsungan Hidup ... 14
3.4.3 Kualitas Air... 14
IV. HASIL DAN PEMBAHASAN... 15
4.1 Hasil... 15
4.1.1 Gejala Klinis... 15
4.1.2 Tingkat Kelangsungan Hidup... 15
4.1.3 Kualitas Air... 18
4.2 Pembahasan ... 19
V. KESIMPULAN DAN SARAN... 22
5.1 Kesimpulan... 22
5.2 Saran ... 22
DAFTAR PUSTAKA ... 23
DAFTAR TABEL
Halaman 1. Metode Vaksinasi (Ellis 1988) ... 9 2. Tingkat Kelangsungan Hidup Setelah Uji Tantang ... 18 3. Kisaran Parameter Kualitas Air... 18
DAFTAR GAMBAR
Halaman
1. Ikan mas Cyprinus carpio (Anonima2009) ...3
2. Mekanisme pembentukan respon imun ikan (Cancer Research Institute 2002)...5
3. Peta penyebaran KHV di Indonesia (Sunarto et al. 2005)...7
4. Mekanisme kerja vaksin DNA (Tonheim et al. 2008)...11
5. Kondisi fisik ikan sehat dan ikan sakit ...16
6. Gejala klinis ikan yang terinfeksi KHV ...17
DAFTAR LAMPIRAN
Halaman
1. Gambar bahan dan alat penelitian ...27
2. Gambar penyiapan virus KHV...28
3. Gejala klinis ikan setelah diuji tantang ...29
I. PENDAHULUAN
1.1 Latar Belakang
Ikan mas Cyprinus carpio adalah spesies ikan air tawar yang bernilai ekonomis penting yang sudah tersebar luas di Indonesia dan merupakan salah satu dari komoditas andalan perikanan budidaya di Indonesia. Perkembangan budidaya ikan mas mengalami kemajuan yang pesat dan mempunyai tingkat pembudidayaan yang mendekati sempurna. Perkembangan budidaya ikan mas dapat diketahui dari banyaknya strain pada ikan mas (Susanto 2007).
Koi Herpesvirus (KHV) sampai saat ini masih menjadi masalah dalam budidaya ikan mas. Penyakit ini sangat ganas dan dapat menyebabkan kematian massal (80-100%) pada suhu 17-270C. KHV menyerang semua stadia ikan mas.
Hampir semua wilayah dimana terdapat berbagai strain ikan mas, terserang KHV. Infeksi KHV pertama kali terjadi di Blitar pada tahun 2002 dan menyebar ke beberapa wilayah di Indonesia terutama di Jawa, Bali, dan Sumatera (Mudjiutami
et al. 2006).
Pengendalian virus yang utama sebenarnya pada manajemen budidaya yang baik. Pengendalian ini dapat dilakukan melalui karantina terhadap pemasukan ikan-ikan baru, dengan menempatkan secara terpisah dari ikan-ikan lainnya dalam jangka waktu 2-4 minggu. Selama masa karantina tersebut, ikan diamati tingkah laku dan kesehatannya. Namun, bagaimanapun baiknya sistem karantina, sulit menjamin ikan tersebut bebas dari virus, hal ini disebabkan metode yang ada untuk mendeteksi virus masih terbatas dan virus dapat hadir dalam tubuh inang tanpa menunjukkan gejala klinis (Irianto 2005).
Vaksinasi merupakan salah satu usaha pengendalian penyakit. Vaksin adalah antigen buatan yang berasal dari suatu jasad patogen yang tidak bersifat patogen lagi karena sudah dilemahkan atau dimatikan, yang akan merangsang sistem imun dengan cara meningkatkan kekebalan ikan dari infeksi patogen selanjutnya (Ellis 1988). Dalam perkembangannya, terdapat empat jenis vaksin diantaranya vaksin yang dimatikan (killed vaccine), vaksin yang dilemahkan (attenuated vaccine), vaksin protein rekombinan dan vaksin DNA. Vaksin DNA dipercaya menjadi vaksin di masa yang akan datang. Hal ini disebabkan beberapa keunggulan dari vaksin DNA diantaranya proses produksi yang relatif murah, kemudahan penyimpanan karena plasmid DNA memiliki stabilitas kimia yang tinggi, modifikasi yang cepat dari vaksin DNA untuk melawan patogen
mutan, tidak membutuhkan adjuvant dan boosting untuk memperoleh kekebalan dan efektif dalam memacu sistem imun humoral dan cell mediated immunity serta aman digunakan bagi ikan (Feng-Rong Zheng et al. 2006). Vaksin DNA cukup efektif mencegah infectious haematopoietic necrosis virus (IHNV) dan viral
haemorrhagic septicaemia virus (VHSV) pada ikan salmon (Lorenzen et al.
2005). Berdasarkan hal tersebut maka diperlukan penelitian untuk membuktikan keefektifan vaksin DNA KHV dalam meningkatkan kelangsungan hidup ikan mas Cyprinus carpio yang terinfeksi KHV.
1.2 Tujuan Penelitian
Penelitian ini bertujuan menguji efektivitas vaksin DNA KHV dengan dosis 2.5, 7.5, dan 12.5 µg/100µl dalam meningkatkan kelangsungan hidup ikan mas
II . TINJAUAN PUSTAKA
2.1 Ikan Mas (Cyprinus carpio)
Ikan mas memiliki tubuh memanjang dan sedikit pipih ke samping. Mulutnya terletak di ujung tengah dan dapat disembulkan. Ikan ini mempunyai dua pasang sungut. Sungut inilah yang merupakan salah satu pembeda antara ikan mas dengan ikan mas koki. Ikan mas termasuk ikan pemakan segala (omnivor). Suhu dan pH air optimal untuk pertumbuhan ikan mas adalah 20-250C
dan 7-8 (Susanto 2007). Ikan mas dapat dilihat pada Gambar 1.
Gambar 1. Ikan mas Cyprinus carpio (Anonima 2009)
2.2 Sistem Kekebalan Tubuh Ikan
Ikan seperti hewan pada umumnya, memiliki mekanisme pertahanan diri (sistem imun) terhadap patogen. Meskipun sistem imun belum selengkap pada vertebrata tingkat tinggi tetapi sistem imun ikan jauh lebih berkembang dibandingkan dengan sistem imun pada invertebrata. Selain itu pada ikan sudah terdapat respon imun spesifik terhadap antigen (Irianto 2005).
Menurut NOAH (2006), sistem imun ikan terdiri dari sistem pertahanan alami (innate) dan sistem pertahanan dapatan (acquired). Menurut Irianto (2005), sistem pertahanan alami menjalankan perlindungan secara umum terhadap invasi flora normal, kolonisasi, infeksi dan penyakit infeksi yang disebabkan oleh patogen. Sistem imun alami merupakan sistem pertahanan yang bersifat non spesifik, respon ini meliputi barrier mekanik dan kimiawi (mukus, kulit, sisik, dan insang) dan pertahanan seluler (sel makrofag, leukosit seperti monosit, netrofil, eosinofil, dan basofil). Mukus ikan yang terdapat di permukaan tubuh, insang dan
juga terdapat pada lapisan mukosa usus berperan sebagai pemerangkap patogen secara mekanik dan eliminasi patogen secara kimiawi dengan lisosim dan enzim proteolitik lainnya (Anderson 1974).
Adapun sistem pertahanan dapatan, maka untuk berfungsi dengan baik harus diinduksi antara lain dengan pemaparan pada patogen atau produk-produk yang berasal dari patogen (misalnya vaksin). Sistem imun dapatan terdiri dari sistem pertahanan humoral dan cell mediated response. Sistem imun ini mengandung imunoglobulin, sel-T reseptor, sitokin, dan HSC (histocompability
complex molecules). Tanggap kebal yang ditimbulkan oleh sel-T disebut dengan
kekebalan berperantara sel (cell mediated immunity) sedangkan tanggap kebal yang dihasilkan oleh sel-B disebut dengan humoral immunity. Sifat dari kekebalan yang dihasilkan oleh sel-T adalah tidak spesifik, sedangkan yang dihasilkan oleh sel-B bersifat spesifik (NOAH 2006).
Perbedaan tanggap kebal spesifik dengan yang tidak spesifik adalah: a) kespesifikan, b) keheterogenan dan c) ingatan/memori imunologi. Kespesifikan adalah pemilihan yang tepat baik oleh antibodi maupun limfosit untuk bereaksi dengan antigen atau benda asing lain dengan konfigurasi yang sama dengan antigen tersebut. Sifat keheterogenan dari tanggap kebal spesifik adalah terbentuknya berbagai jenis sel maupun hasil sel yang dikeluarkan sewaktu tubuh inang tersebut dimasuki oleh antigen. Sel-sel yang beraneka jenis tersebut akan menghasilkan antibodi dan limfosit sensitif yang bersifat heterogen. Sifat ketiga adalah terbentuknya memory immunology dalam sel-sel limfosit. Jadi apabila sewaktu waktu inang tersebut dimasuki oleh antigen yang sejenis maka inang tersebut akan cepat bereaksi untuk membentuk antibodi. Dengan adanya memori imunologi ini akan mempercepat dan meningkatkan terbentuknya zat anti (antibodi) pada tubuh inang (Lamers et al. 1985)
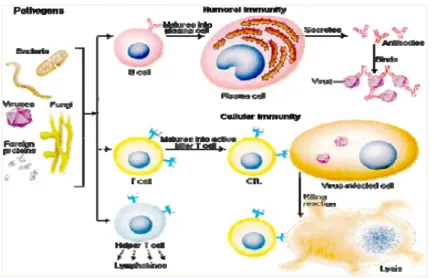
Antibodi merupakan suatu senyawa protein yang terbentuk sebagai respon pertahanan terhadap masuknya benda asing ke dalam tubuh yang dapat bereaksi dengan antigen khusus (Tizard 1988). Antigen merupakan benda asing
Gambar 2. Mekanisme pembentukan respon imun ikan (Cancer Research Institute 2002)
Pembentukan respon imun dimulai oleh stimulasi patogen (antigen). Setelah terjadi aktifasi antigenik, melalui proses fagositosis makrofag yang merupakan pertahanan pertama akan menghancurkan antigen tersebut, mengirimkan sandi-sandi ke sel-sel limfosit. Sel limfosit berproliferasi membentuk sel T (respon imun seluler) dan sel B (respon imun humoral). Sel T akan membentuk sel efektor yang berperan dalam respon pertahanan yang diperantai sel. Sel efektor ini berpartisipasi dalam eliminasi benda asing melalui suatu proses fagositosis. Sedangkan sel B akan membentuk antibodi (immunoglobulin). Selain membentuk antibodi terhadap suatu patogen, sel B juga membentuk sel memori terhadap patogen tersebut. Dengan adanya sel memori ini akan mempercepat waktu pembentukan respon sekunder terhadap patogen yang sama ( Lamers et al. 1985).
2.3 Koi Herpesvirus (KHV) 2.3.1 Biologi KHV
Virus merupakan agen infeksi non-seluler dan hanya dapat melakukan multiplikasi dalam sel inang. Virus berukuran sangat kecil yaitu bervariasi dari 18-200 nm (Smail dan Munro 1989), sehingga menyebabkan virus sulit untuk dideteksi. Teknik yang biasanya digunakan untuk identifikasi awal virus yaitu menggunakan mikroskop elektron, menumbuhkan virus di laboratorium
menggunakan cell-lines, menggunakan teknik serologi, PCR dan sequencing DNA (Irianto 2005).
KHV hanya dapat menyerang ikan mas Cyprinus carpio dan koi Cyprinus
carpio koi baik ukuran larva, juvenil maupun dewasa (Gilad et al. 2002). Namun
berdasarkan hasil uji kohabitasi, menunjukkan bahwa ikan ukuran benih lebih rentan dibandingkan dengan ukuran induk. Virus ini dapat menginfeksi ikan mas apabila suhu air pemeliharaan berada pada kisaran 17-270C namun virulensi
tertinggi terjadi pada suhu 22-240C (Perelberg et al. 2003).
Herpesvirus pada ikan secara umum diidentifikasi sebagai penyebab penyakit mulai dari infeksi sisik hingga infeksi sistemik yang fatal (Gilad et al. 2003). Pada herpesvirus yang menyerang cyprinid, sebelumnya sudah dikenal adanya pox herpesvirus ikan mas (Cyprinid herpesvirus 1, CyHV-1) dan
haematopoietic necrosis herpesvirus ikan maskoki (Cyprinid herpesvirus 2,
CyHV-2) (Walczak et al. 2005).
Cyprinid herpes virus 3 (CyHV-3) yang sebelumnya disebut CNGV dan
lebih dikenal sebagai Koi Herpesvirus (KHV), merupakan penyebab penyakit koi dan mas di seluruh dunia. Morfologi virus menyerupai herpes virus, namun bears
genome dari virus ini adalah 277-295 kbp, berbeda dari kebanyakan genomic sequence yang tersedia di GenBank (Dishon et al. 2007).
2.3.2 Epidemiologi KHV
KHV dilaporkan mulai terjadi pada tahun 1998 di Israel , Amerika Serikat (1998), Belgia (1999), Inggris (2000), Austria (2003), Perancis (2001), Afrika Selatan (2001), Malaysia (2001), Hongkong (2001), Denmark (2002), Jerman (2002), Belanda (2002), Italia (2003), Luxemburg (2003), Swiss (2003), Polandia (2003), Taiwan (2003), Thailand (2004) (Pokorova et al. 2005).
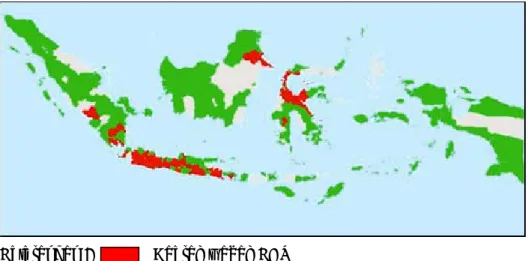
Di Indonesia, KHV menyerang ikan mas dan koi pada Maret 2002 di Blitar, Jawa Timur yang merupakan pusat produksi ikan koi. Kejadian ini terjadi setelah hujan lebat. Ikan ini diimpor dari China melalui Hongkong pada Desember 2001
Keterangan : Daerah wabah KHV
Gambar 3. Peta penyebaran KHV di Indonesia (Sunarto et al. 2005)
Pada Februari 2003 wabah terjadi di Lubuk Lingau, Sumatera Selatan yang kemudian menyebar ke daerah sekitarnya termasuk Bengkulu Selatan dan Jambi bagian barat (Sunarto et al. 2002 diacu dalam Sunarto et al. 2005). Pada September 2004 penyakit ini mewabah di Kalimantan. Tahun 2005, KHV menyerang ikan mas di Danau Toba. Penyebaran KHV yang semakin meluas ini akibat adanya pengiriman ikan dari daerah yang terinfeksi sebelumnya. Akibat wabah ini, kegiatan budidaya ikan mas mengalami penurunan hingga sekarang (Mudjiutami et al. 2006). Virus ini menular pada ikan sehat melalui kontak langsung dengan ikan sakit, air dan peralatan ( Sunarto et al. 2005).
2.3.3 Gejala KHV
Gejala-gejala klinis ditandai dengan insang pucat dan berlanjut pada kerusakan insang, kulit mengalami kerusakan, hemoragik berat pada insang dan disertai nekrosis, hemoragik pada permukaan tubuh, kadangkala sirip dan ekor juga mengalami hemoragik, kulit luka melepuh seperti terkena api. Seringkali ikan yang terinfeksi KHV mengalami infeksi sekunder non spesifik oleh bakteri, fungi dan parasit. Kematian ikan umumnya terjadi pada hari ke-7 setelah ikan diuji tantang. Ikan yang mati memiliki ciri tubuh memerah dan banyak memproduksi lendir (Laelawati 2008). Menurut Sunarto et al. (2005), ikan yang terinfeksi KVH terlihat lesu, menunjukkan kehilangan keseimbangan dan megap-megap, hilangnya lendir dan kasar tampilan pada kulit atau menunjukkan melepuh seperti luka pada kulit, hemoragi pada operkulum, sirip, dan kerusakan insang yang parah.
2.4 Vaksinasi
Vaksin adalah antigen buatan yang berasal dari suatu jasad patogen yang tidak bersifat patogen lagi karena sudah dilemahkan atau dimatikan, yang akan merangsang sistem imun dengan cara meningkatkan kekebalan ikan dari infeksi patogen selanjutnya (Ellis 1988).
Menurut Alifuddin (1999), vaksin mempunyai beberapa manfaat diantaranya peningkatan daya tahan ikan, pencegahan efek samping kemoterapeutika, proteksi terhadap serangan penyakit, keamanan lingkungan budidaya dari pencemaran bahan kemoterapeutik, dan keamanan konsumen dari residu antibiotik. Untuk mencapai sasaran vaksinasi yaitu sintasan yang tinggi, maka vaksin harus bersifat antigenik, imugenik dan protektif. Sifat-sifat ini menunjukkan bahwa vaksin yang diberikan harus memacu terbentuknya antibodi yang menyebabkan ikan tahan terhadap patogen tersebut. Di samping itu, vaksin harus aman, tidak boleh menimbulkan tanda-tanda sakit yang secara spesifik disebabkan oleh patogen tersebut.
Faktor yang mempengaruhi vaksinasi pada ikan antara lain adalah temperatur, umur ikan, dan berat ikan. Temperatur rendah menyebabkan produksi antibodi lambat, begitu pula jika ikan yang digunakan umurnya kurang dari 2 minggu dan berat badannya kurang dari 1 gram (Kordi 2004)
Penggunaan vaksin pada ikan dapat dilakukan dengan berbagai metode yaitu suntikan (injection), perendaman (immersion), dan melalui pakan (oral). Keuntungan dan keterbatasan pada masing-masing metode dapat dilihat pada Tabel 1.
Tabel 1. Metode vaksinasi (Ellis 1988)
Metode Kelebihan Keterbatasan Suntikan Vaksin masuk ke dalam
tubuh ikan dengan jumlah yang tepat sehingga efektivitasnya terjamin
Tidak efisien digunakan pada ikan yang berukuran kecil dengan jumlah yang banyak
Perendaman Tidak menimbulkan cekaman pada ikan serta penghematan dalam hal tenaga
Tidak dapat ditaksir banyaknya antigen yang dapat diserap oleh ikan
Pakan Dapat digunakan pada berbagai ukuran ikan serta tidak menyebabkan cekaman pada ikan
Vaksin yang diberikan melalui pakan belum tentu dimakan oleh ikan serta dosis yang diberikan harus tinggi.
Organ tubuh ikan yang berfungsi merespons kekebalan baru bisa tercapai sempurna setelah 2 minggu sehingga dianjurkan melakukan vaksinasi pada umur tersebut dan kemudian dapat diulangi pada saat ikan berumur 2 bulan (Alifuddin 1999). Bagi ikan yang berumur kurang dari 2 minggu, karena organ tubuh yang merespons kekebalan belum sempurna memproduksi antibodi, maka perlakuan dengan vaksinasi biasanya jarang berhasil (Kordi 2004).
Vaksin pertama kali dikembangkan pada tahun 1970 dan mulai diterapkan pada skala komersial pada awal tahun 1980. Dalam perkembangannya, terdapat empat jenis vaksin diantaranya vaksin yang dimatikan (killed vaccine), vaksin yang dilemahkan (attenuated vaccine), vaksin protein rekombinan dan vaksin DNA. Masalah besar yang dihadapi oleh pembuat vaksin adalah teknik pembuatan vaksin dan peraturan dari pemerintah. Biasanya pemerintah hanya memperhatikan dua aspek dalam pembuatan vaksin yaitu aspek keamanan dan keefektifan (Anonimb 2006).
Vaksin mati biasanya lebih murah dan untuk mengembangkannya cepat, namun harus dibuktikan bahwa virus ini pada kenyataannya benar-benar mati sehingga tidak dapat menginfeksi ikan, vaksin ini kurang efektif memicu respon imun. Vaksin yang dilemahkan relatif murah tetapi untuk mengembangkannya
diperlukan waktu yang cukup lama dan harus dipastikan bahwa virus tidak akan berubah kembali ke bentuk yang dapat menghasilkan penyakit (Anonimb 2006)
Pengembangan vaksin DNA dimulai pada awal tahun 1990, dan dahulu penggunaannya hanya sebatas untuk penelitian. Vaksin DNA didasarkan pada susunan plasmid yang mengkode antigen. Ekspresi dari plasmid di sel somatik inang memicu sistem imun humoral dan selular. Penggunaan vaksin DNA untuk budidaya ikan memiliki beberapa keuntungan yaitu proses produksi yang relatif murah, kemudahan penyimpanan karena plasmid DNA memiliki stabilitas kimia yang tinggi, modifikasi yang cepat dari vaksin DNA untuk melawan patogen mutan, tidak membutuhkan adjuvant dan boosting untuk memperoleh kekebalan dan efektif dalam memacu sistem imun humoral dan cell mediated immunity serta aman digunakan bagi ikan (Feng-Rong Zheng et al 2006). Vaksin DNA cukup efektif mencegah infectious haematopoietic necrosis virus (IHNV) dan
viral haemorrhagic septicaemia virus (VHSV) pada ikan salmon (Lorenzen et al.
2005).
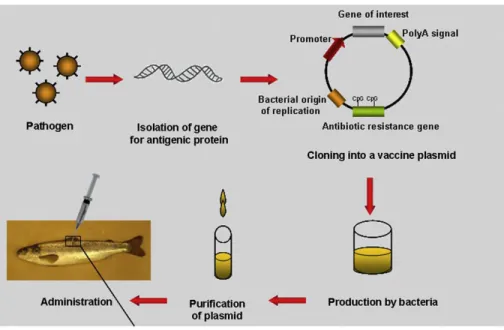
Langkah pertama dalam memproduksi vaksin DNA adalah mengidentifikasi dan mengklon antigen yang paling protektif yang berasal dari patogen. Pada VHSV dan IHNV, bagian dari patogen yang memacu pembentukan antibodi (protektif) adalah glikoprotein. Gen yang mengandung glikoprotein dicari dengan perangkat sekuensing yang terekspresi pada sel eukariotik. Glikoprotein ditransformasikan ke dalam bakteri, kemudian dikultur, dipurifikasi dalam bentuk plasmid dan siap dipakai sebagai vaksin DNA ( Lorenzen et al. 2005). Mekanisme kerja vaksin DNA dapat dilihat pada Gambar 4.
Gambar 4. Mekanisme kerja vaksin DNA (Tonheim et al. 2008)
Pada uji ekspresi vaksin DNA terhadap ikan Japanase flounder
Paralichthys olivaceus, dosis yang digunakan adalah 15 µg/100µl (Feng-Rong
Zheng et al. 2006). Pada uji tantang ikan rainbow trout berukuran 3-4 gram melawan VHSV, dosis vaksin DNA 0.1 µg/100µl dapat menurunkan mortalitas sebesar 70% akibat VHSV ( LaPatra et al. 2001)
III. METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan November 2008 sampai dengan Maret 2009 di Laboratorium Genetika Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor dan Laboratorium Karantina, Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi, Jawa Barat.
3.2 Alat dan Bahan
Peralatan yang digunakan adalah 8 akuarium berukuran (40x40x60) cm3,
instalasi aerasi, timbangan, penggaris, autoklaf, oven, erlenmeyer, cawan petri, aluminium foil, syringe, bunsen, inkubator, shaker, sentrifuge, kulkas, mikropipet, tube, spektrofotometer pengukur konsentrasi DNA bermerk Gene-quant, termometer.
Bahan yang digunakan dalam penelitian ini adalah ikan mas (Cyprinus
carpio) strain wildan berumur 3.5 bulan dengan bobot rata-rata 15-20 gram,
vaksin DNA yang mengandung gen glikoprotein virus KHV, media 2YT, PBS (Phospat Buffer Saline), bahan untuk isolasi plasmid, aquadest, alkohol, dan minyak cengkeh. Gambar alat dan bahan yang digunakan dapat dilihat pada Lampiran 1.
3.3 Metode Penelitian
Penelitian ini dilakukan dalam beberapa rangkaian yaitu 1) isolasi plasmid untuk menghasilkan plasmid, 2) vaksinasi dan uji tantang.
3.3.1 Isolasi Plasmid
Media yang digunakan untuk memperbanyak vaksin adalah media 2YT yang bahan-bahannya terdiri dari trypton 3,2 gram, yeast extract 2 gram, NaCl 1 gram dan aquades sebanyak 200 ml. Cara pembuatan media 2YT adalah
yang sudah mengandung bakteri konstruksi tersebut disimpan dalam shaker dengan kecepatan tinggi (225) selama 18-20 jam. Setelah itu bakteri dipanen dengan cara memasukkan 4 ml bakteri ke dalam 1.5 ml mikrotube dan dilakukan peletting dan dilanjutkan dengan prosedur isolasi plasmid.
Berikut ini adalah langkah-langkah isolasi plasmid (Fermentas Life Science, EU). Sebanyak 250 μl resuspension solution dimasukkan ke dalam mikrotube yang berisi pellet bakteri hasil pengkulturan, kemudian di vortex selama 1 menit. Setelah itu 250 μl lysis solution ditambahkan dan diaduk perlahan, untuk mencegah kontaminasi DNA, tidak digunakan vortex. Langkah selanjutnya adalah 350 μl neutralization solution ditambahkan dan diaduk ke atas-bawah serta disentrifuge 12000 rpm selama 5 menit. Supernatan yang dihasilkan dipindahkan ke tube fermentas dan disentrifuge 12000 rpm selama 2 menit. Kemudian pada tube fermentas ditambahkan 500μl wash solution dan disentrifuge 10000 rpm selama 2 menit, pemberian wash solution ini dilakukan lagi pada tahap selanjutnya. Setelah itu, colom fermentas diletakkan di atas 1.5 ml mikrotube yang bersih, 30 μl SDW ditambahkan ke bagian colom fermentas yang mengandung plasmid, kemudian didiamkan selama 2 menit dan disentrifuge 12000 rpm selama 1 menit dan dihasilkan plasmid sebanyak 30 μl. Plasmid tersebut kemudian dihitung konsentrasi DNA dengan menggunakan spektrofotometer pengukur konsentrasi DNA bermerk gene-quant. Kemudian dicampurkan PBS sesuai dosis yang diinginkan. Vaksin DNA dapat disimpan di freezer pada suhu -200C.
3.3.2 Penyiapan virus KHV
Virus KHV disiapkan untuk uji tantang. Adapun cara membuatannya yaitu insang yang terinfeksi KHV ditimbang sebanyak 1 gram, kemudian insang tersebut ditumbuk dengan menggunakan mortar dan dilakukan pengenceran sebesar 10-1 dengan menambahkan 9 ml PBS. Setelah itu, virus yang diencerkan
disaring dengan filter bakteri dan dimasukkan kedalam mikrotube 1.5 ml dan kemudian disentrifuge 5000 rpm selama 30 menit. Virus dengan pengenceran 10-1 merupakan stok virus yang kemudian diencerkan sampai mencapai 10-3 kali
dengan mencampurkan 1 ml virus stock dengan 99 ml PBS. Gambar penyiapan virus dapat dilihat pada Lampiran 2.
3.3.3 Vaksinasi dan Uji Tantang
Ikan sebanyak 120 ekor dipelihara dalam 4 akuarium, masing-masing akuarium berisi 30 ekor. Ikan diaklimatisasi selama 5 hari sebelum disuntik
vaksin DNA. Masa pemeliharaan ikan setelah divaksin adalah 42 hari. Ada 4 perlakuan dosis vaksin yang disuntikkan yaitu :
Perlakuan A : ikan disuntik vaksin dengan dosis 2.5 μg/100μl Perlakuan B : ikan disuntik vaksin dengan dosis 7.5 μg/100μl Perlakuan C : ikan disuntik vaksin dengan dosis 12.5 μg/100μl Perlakuan K : ikan tanpa vaksin
Setelah itu semua ikan perlakuan diuji tantang dengan cara disuntik virus KHV yang telah disiapkan sebelumnya sebanyak 0.1 ml tiap ikan yang merupakan dosis letal (dosis yang mematikan). Penyuntikan dilakukan pada bagian belakang sirip punggung ikan mas. Masa pengamatan setelah uji tantang untuk melihat efektivitas vaksin adalah 29 hari.
3.4 Parameter Penelitian 3.4.1 Gejala Klinis
Parameter gejala klinis yang diamati dari ikan percobaan yang terinfeksi KHV adalah tingkah laku, respon makan, serta kondisi fisik ikan.
3.4.2 Tingkat Kelangsungan Hidup
Kematian ikan dicatat sebelum dan sesudah uji tantang. Tingkat
kelangsungan hidup ikan dihitung dengan menggunakan rumus :
SR = Nt x 100% No
Keterangan :
SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah ikan yang hidup pada akhir pengamatan (ekor) No : Jumlah ikan yang hidup pada awal pengamatan (ekor)
3.4.3 Kualitas Air
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Gejala Klinis
Berdasarkan pengamatan selama penelitian, ikan yang sakit dilihat dari perubahan tingkah laku, nafsu makan dan kondisi fisik tubuhnya yang tidak normal. Ikan yang sakit cenderung menyendiri atau berpisah dari ikan lainnya dan gerak refleksnya lambat serta sering berenang di permukaan air. Perbedaan kondisi fisik ikan sehat dan ikan sakit terdapat pada Gambar 5. Gejala klinis ikan terinfeksi KHV adalah terdapat bercak merah pada tubuhnya (Gambar 6a) yang disusul dengan melepuhnya sisik (Gambar 6b). Hari berikutnya ikan terlihat bergerak lemah, dipermukaan (Gambar 6c) maupun bergerombol didasar akuarium (Gambar 6d ) dan akhirnya mati. Ikan yang mati akibat KHV dapat dilihat dari tanda-tandanya, diantaranya perubahan warna tubuh (Gambar 6e), rusaknya sisik (Gambar 6f), dan insang yang pucat dan rusak (Gambar 6g).
4.1.2 Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (%) ikan mas setelah dilakukan vaksinasi (42 hari) adalah 100%. Penghitungan terhadap tingkat kelangsungan hidup ikan pada masa vaksinasi bertujuan untuk mengetahui keamanan vaksin (Ellis 1988). Dari berbagai perlakuan yang diamati, tingkat kelangsungan hidup perlakuan A, B, C, dan K adalah 100%.
Pengujian kekebalan ikan terhadap KHV setelah vaksinasi dilakukan dengan cara melakukan uji tantang yaitu dengan menginfeksi KHV. Pengamatan dilakukan selama 29 hari setelah uji tantang. Adapun perubahan nilai kelangsungan hidup ikan mas selama uji tantang disajikan pada Tabel 2 dan Gambar 8.
A B
A B
A B
Gambar 5. Kondisi fisik ikan sehat dan ikan yang terinfeksi KHV. A) Ikan sehat B) ikan terinfeksi KHV
a b c d e e f f g g
Gambar 6. Gejala Klinis ikan mas yang terinfeksi KHV. Gambar : a) bercak merah; b) sisik melepuh; c) ikan dipermukaan; d) ikan bergerombol di dasar akuarium; e) perubahan warna pada kulit ikan; f) kerusakan pada sirip ekor; g) kerusakan insang
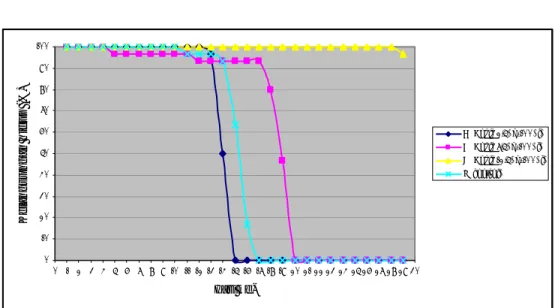
Tabel 2. Perubahan nilai kelangsungan hidup ikan setelah diuji tantang (%)
Hari ke- (setelah ikan diuji tantang) Perlakuan 5 11 12 13 14 15 16 17 18 19 20 29 A 100 100 100 96.7 50 0 0 0 0 0 0 0 B 96.7 96.7 93.3 93.3 93.3 93.3 93.3 93.3 80 46.7 0 0 C 100 100 100 100 100 100 100 100 100 100 100 96.67 K 100 96.7 96.7 96.7 93.3 63.3 16.7 0 0 0 0 0 0 10 20 30 40 50 60 70 80 90 100 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Hari k e-K e la ngs un ga n hi dup ( % ) A (Dosis 2.5μg/100μl) B (Dosis 7.5μg/100μl) C (Dosis 12.5μg/100μl) K (kontrol)
Gambar 8. Pola kelangsungan hidup ikan setelah diuji tantang (29 hari)
Pada Tabel 2 dan Gambar 8 ditunjukkan bahwa kematian ikan mulai terjadi pada minggu ke-2 setelah uji tantang. Kematian total ikan didahului oleh perlakuan A (dosis 2.5 μg/100 μl), kontrol, kemudian dilanjtkan dengan perlakuan B (7.5 μg/100 μl), sedangkan perlakuan C (12.5 μg/100 μl) ikan baru mengalami kematian saat hari ke-29 setelah uji tantang yaitu sebanyak satu ekor.
Tabel 3. Kisaran parameter kualitas air
Parameter kualitas air Suhu (0C) pH DO (mg/l) NH
3N (mg/l)
Kisaran 23,5-25 6,5-7,8 4,01-5,74 0,034-0,055
4.2 Pembahasan
Gejala klinis yang diamati pada ikan perlakuan meliputi perubahan tingkah laku, nafsu makan ikan, dan kondisi fisik tubuh ikan. Sakit pada ikan yaitu suatu keadaan abnormal yang ditandai dengan penurunan kemampuan ikan dalam mempertahankan fungsi-fungsi fisiologik normal. Tingkah laku ikan yang terinfeksi KHV cenderung menyendiri atau terpisah dari ikan lainnya yang sehat, gerak refleksnya lambat dan sering berenang di permukaan air atau bergerombol di dasar akuarium, menunjukkan kehilangan keseimbangan dan megap-megap akibat kerusakan insang. Gejala klinis muncul sebagai ekspresi abnormalitas organ akibat infeksi KHV.
Ikan-ikan yang terinfeksi KHV menunjukkan tidak mempunyai nafsu makan. Kekurangan suplai energi dan material penyusun tubuh sebagai akibat dari menurunnya nafsu makan merupakan faktor yang mempercepat terjadinya kerusakan organ dan kematian ikan. Dengan kondisi kekurangan energi dan tubuh lemah akan memberi peluang lebih besar masuknya infeksi lain atau terjadinya kerusakan organ lainnya seperti habisnya mukus dan rusaknya sisik.
Kondisi fisik ikan yang terinfeksi KHV adalah terdapat bercak merah pada tubuhnya yang disusul dengan melepuhnya sisik, kerusakan sirip ekor pengeluran lendir yang berlebih, sehingga akhirnya menyebabkan tubuh ikan menjadi kesat. Hal ini sesuai dengan Sunarto et al. (2005), yang menyatakan bahwa ikan yang terinfeksi KVH terlihat lesu, menunjukkan kehilangan keseimbangan dan megap-megap, hilangnya lendir dan kasar tampilan pada kulit atau menunjukkan melepuh seperti luka pada kulit, hemoragi pada operkulum, sirip, dan kerusakan insang yang parah.
Gejala klinis pada ikan uji tampak 10 hari setelah dilakukan uji tantang. Masa inkubasi virus pada penelitian ini lebih lama dari Davenport (2001) diacu dalam Fitrianis (2005) yang menyatakan bahwa pada suhu 18-300C, KHV
memilki masa inkubasi 5-7 hari. Sedangkan pada Hartman et al. (2008), pada suhu 22-25.50C, masa inkubasi KHV adalah 14 hari. Perbedaan ini diduga
berkaitan dengan suhu pemeliharaan. Lingkungan yang memiliki kisaran suhu yang luas relatif memiliki masa inkubasi yang lebih cepat.
Infeksi KHV diawali dari pelekatan virus pada permukaan tubuh maupun insang. Pada permukaan tubuh, diduga virus mampu menembus pertahanan awal ikan yang berupa mukus, sisik dan epitel tubuh, sedangkan di insang, virus KHV mampu melewati mukus dan epitel insang. Virus KHV mengambil alih peranan sel inang yang seharusnya digunakan untuk metabolisme inang. Sel insang yang terinfeksi akan mengalami kerusakan. Kerusakan sel secara terus-menerus akan menyebabkan rusaknya jaringan insang yang ditandai dengan insang memutih sampai 80%. Kerusakan insang akan mengganggu respirasi di insang. Untuk mengimbangi suplai oksigen akan meningkatkan frekuensi pergerakan operkulum. Ikan yang terus menerus kekurangan oksigen akhirnya mati. Hal ini sesuai dengan pernyataan Tamba (2006).
Masa pemeliharaan ikan setelah divaksin adalah 42 hari. Penghitungan terhadap kelangsungan hidup ikan pada masa vaksinasi bertujuan untuk mengetahui keamanan vaksin (Ellis 1988). Dari berbagai perlakuan yang diamati, tingkat kelangsungan hidup perlakuan A (2.5 μg/100 μl), B (7.5 μg/100 μl), C (12.5 μg/100 μl), dan K (kontrol) adalah 100% dan tidak ditemukan adanya gejala klinis ikan terinfeksi KHV. Hal ini membuktikan bahwa vaksin DNA yang digunakan aman bagi ikan.
Pengamatan terhadap ikan dilakukan selama 29 hari setelah uji tantang. Kosentrasi virus yang digunakan adalah 10-3 yang merupakan dosis letal (dosis
mematikan). Dari hasil uji tantang ditunjukkan bahwa pada perlakuan A, B, K, memiliki nilai tingkat kelangsungan hidup sebesar 0% sedangkan perlakuan C yang merupakan perlakuan dengan dosis tertinggi memiliki tingkat kelangsungan hidup sebesar 96.7%. Hal ini menunjukkan bahwa kualitas vaksin dalam hal ini dosis mempengaruhi pembentukan respon imun.
Pada perlakuan C, dosis yang digunakan sebesar 12.5 μg/100 μl, dosis tersebut diduga dapat memproduksi glikoprotein dalam jumlah cukup untuk
berproliferasi membentuk sel-T dan sel-B. Sel-B akan membentuk antibodi dan membentuk sel memori terhadap glikoprotein tersebut. Dengan adanya sel memori ini akan mempercepat waktu pembentukan respon sekunder terhadap antigen yang sama. Jumlah produksi glikoprotein tergantung pada dosis yang digunakan. Semakin tinggi dosis yang digunakan, vaksin DNA dapat memproduksi glikoprotein dalam jumlah yang tinggi pula.
Ikan A mulai mati pada hari ke-13 setelah uji tantang dan memiliki kematian total pada hari ke-15. Ikan B mulai mati pada hari ke-5 dan memiliki kematian total pada hari ke-20, kematian 1 ekor ikan pada hari ke-5 pada ikan B diduga akibat faktor genetik dari ikan tersebut . Ikan C mulai mati pada hari ke-29 yaitu sebanyak 1 ekor. Perlakuan K mulai mati pada hari ke-11 dan memiliki kematian total pada hari ke-17. Dari grafik dapat dilihat bahwa perlakuan A lebih dahulu mengalami kematian daripada perlakuan K, hal ini diduga dipengaruhi oleh cekaman akibat suntikan, karena pada perlakuan K, tidak dilakukan penyuntikan, sehingga tidak menimbulkan cekaman.
Dari hasil penelitian menunjukkan bahwa ikan yang disuntik mengalami cekaman. Cekaman merupakan keadaan saat suatu hewan tidak mampu mengatur kondisi fisiologis yang normal karena berbagai faktor merugikan yang mempengaruhi kondisi kesehatannya. Sebagai usaha menyesuaikan diri terhadap gangguan yang ada, maka ikan akan menggunakan seluruh energi cadangan. Jika gangguan tersebut terus berlangsung, energi cadangan menjadi habis dan ikan menjadi lemah untuk menghadapi agen penyakit yang secara berkelanjutan kontak dengan ikan. Gangguan ini dapat mengakibatkan ikan menjadi sakit, bahkan mati. Hal ini menjadi penyebab ikan A mengalami kematian terlebih dahulu dibandingkan dengan ikan K.
Pada lingkungan perairan, faktor fisik, kimiawi dan biologis berperan dalam pengaturan homeostatis yang diperlukan bagi pertumbuhan dan reproduksi ikan. Perubahan-perubahan faktor tersebut hingga batas tertentu dapat menyebabkan cekaman dan dan timbulnya penyakit. Kisaran parameter kualitas air pada penelitian ini adalah suhu 23.5-250, pH 6.5-7.8, DO 4.01-5.74 mg/l.
Menurut Irianto (2005),kondisi perairan di BBPBAT mendukung untuk kehidupan ikan.
V. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan dapat disimpulkan bahwa pemberian vaksin DNA dengan dosis 12.5 µg/100µl dapat mempertahankan kelangsungan hidup ikan mas yang terinfeksi KHV sebesar 96.7% selama 29 hari setelah uji tantang.
5.2 Saran
Diperlukan penelitian lanjutan terkait dengan dosis vaksin DNA dan teknik aplikasi vaksinasi yang meminimalisir terjadinya cekaman seperti perendaman atau melalui pakan (oral).
DAFTAR PUSTAKA
Alifuddin M. 1999. Imunostimulasi pada Hewan Akuatik. Bogor : Laboratorium Kesehatan ikan, Jurusan Budidaya Perairan, Institut Pertanian Bogor.
Anderson D. P. 1974. Immunology of Fish Disease. In S. F. Snieszko and H.R. Axelrod (eds.). Book 4. Disease of Fishes. TFH Publication. Neptune, N. J.
Anonima. 2009. Ikan Mas. http ://www.wikipedia.org
Anonimb. 2006. KHV Vaccine Development World Wide. A Status Report by The
Project KHV Team. http://www.akcaprojectkhv.org/
Dishon A, Davidovich M, Ilouze M, Kotler M. 2007. Journal of Virology,
Ellis A E (Ed.). 1988. Fish Vaccination. Academic Press. San Diego.
Feng-Rong Zheng, Xiu-Qin Sun, Hong-Zhan Liu, Jin-Xing Zhang. 2006. Study on distribution and Expression of a DNA Vaccine Againts Lymphocystis Disease Virus in Japanese Flounder. Elsevier Aquaculture 261 (2006) 1128-1134
Fitrianis Yulissa. 2005. Pengaruh Suhu terhadap Pertumbuhan KHV di dalam Kultur Sel KT-2 [skripsi]. Bogor : Fakultas Kedokteran Hewan IPB.
Gilad, O., Yun, S., Andree, K., Adkison, M., Zlotkin, A., Bercovier, H., Eldar, A., Hedrick, R., 2002. Initial Characteristics of Koi Herpes Virus and Development of a PCR Assay to Detect the Virus in Koi. J. Disease of
Aquatic Organisms. Vol 48 : 101-108 2002.
Gilad, O., Yun, S., Andree, K., Adkison, M., Zlotkin, A., Bercovier, H., Eldar, A., Hedrick, R., 2003. Molecular Comparison of Isolates of an Emerging Fish Patogen, Koi Herpes Virus and The Effect of Water Temperature on Mortality of Experimentally Infected Koi. Journal of General Virology 84, 2661-2668.
Irianto Agus. 2005. Patologi Ikan Teleostei. Yogyakarta : Gadjah Mada University Press.
Kordi MGH. 2004. Penanggulangan Hama dan Penyakit Ikan. Jakarta : PT. Rineka Cipta dan PT Bina Adiaksara.
Laelawati Euis. 2009. Respon Tanggap Kebal Ikan Mas Cyprinus carpio terhadap Vaksin Koi Herpesvirus yang Diberikan secara Suntik dengan Konsentrasi yang Berbeda [skripsi]. Bogor : Program Studi Teknologi dan Manajemen Akuakultur IPB.
Lamers C.H.J dan M.H.J De Haas. 1985. Antigen localization in the lymphoid organs of carp (Cyprinus carpio). Cell Tissue Res. 242 : 491-498
LaPatra Scott E, Serge C, Gerald R J, William D S, Niels L, Eric D A, Gael K. Protection of rainbow trout against hematopoietic necrosis virus four days after specific or semi specific DNA vaccination. J.Elsevier. vaccine (2001) 4011-4019
Lorenzen N, Lapatra. 2005. DNA Vaccines for Aquaculture Fish. Rev. sci. tech. Off. Int. Epiz. 2005. 24 (1), 201-213
Mudjiutami E, Ciptoroso, Zainun Z. 2006. Uji Toleransi berbagai Strain Ikan Mas terhadap KHV. Abstrak Balai Besar Pengembangan Budidaya Air Tawar
[NOAH] National Office of Animal Health. 2006. Responsible Use of Vaccines ann Vaccination in Fish Production. RUMA Guidelines.
Perelberg, A., Smirnov, M., Hutoran, M., Diamant, A., Bejerano, T., Kotler, M., 2003. Epidemiological Description of New Viral Desease Afflicting Cultured Cyprinus carpio in Israel. Isr. J. Aquac. Bamidgeh 55, 5-12.
Pokorova D, Vesely T, Piackova V, Reschova S, Hulova J. 2005. Current Knowledge on Koi Herpesvirus (KHV): A Review. Vet. Med. –Czech, 50, 139-147.
Smail, D.M.; and Munro, A.L.S.(1989). The Virology of Teleost. Dalam : Roberts, R.J. (Ed.). Fish Pathology. Second Ed. Bailliere Tindall, London. Hal : 173-241
Tamba A. 2006. Kerentanan dan Gambaran Darah Ikan Mas Cyprinus carpio yang Terinfeksi Koi Herpes Virus (KHV) [Tesis]. Bogor : Sekolah Pasca Sarjana, Institut Pertanian Bogor
Tizard I. 1988. An introduction to veterinary immunology. Peterjemah P. Masduki dan S. Hardjosworo. 1988. Pengantar Immunology Veteriner. Univ. Airlangga
Tonheim Tom Cristian, Jarl Bogwald, Roy Ambli Dalmo. What happens to the DNA vaccine in fis? A review of current knowledge. J. Fish and Shellfish Immunology (2008) 25, 1-18
Walczak B. Z. 1985. Immune Capability of Fish-a literatur review. Canadian Tech. report of Fisheries and Aquatis Science. No. 1334. 33 hal.
Lampiran 1. Gambar Bahan dan Alat Penelitian Bahan
Bakteri konstruksi media 2YT antibiotik ampicilin Ikan mas 15-20 gr insang terinfeksi KHV PBS
Alat
Akuarium mikropipet mikrotube mikrotip erlemeyer isolasi plasmid kit
Lampiran 2. Gambar Penyiapan Virus KHV
Insang ditimbang 1 gr insang ditumbuk diencerkan dengan PBS 10-1
diencerkan PBS 10-3 sentrifuse 5000 rpm 15’,ambil supernatan disaring
SIAP DISUNTIKKAN Gejala klinis selama
Lampiran 3. Gejala klinis ikan setelah diuji tantang
Hari ke Perlakuan A Perlakuan B Perlakuan C Perlakuan K
1
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
2
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
3
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
4
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
5
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
6
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
7
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
8
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
9
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
10
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
11
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan berwarna kemerahan, sering ke permukaan
12
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan berwarna kemerahan, sering ke permukaan
13
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya, menghasilkan banyak lendir, sirip ekor rusak
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah di bagian tubuhnya
14
ikan diam bergerombol didasar akuarium, tidak ada nafsu makan, tubuh kesat dan lesu
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
15 ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
16 ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya, menghasilkan banyak lendir, sirip ekor rusak
17 ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
ikan diam bergerombol didasar akuarium, tidak ada nafsu makan, tubuh kesat dan lesu
18 ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya, menghasilkan banyak lendir, sirip ekor rusak
ikan bergerak normal, nafsu makan baik, kondisi fisik normal
Lanjutan
19 ikan mengalami kematian
ikan diam bergerombol didasar akuarium, tidak ada nafsu makan, tubuh kesat dan lesu
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan mengalami kematian
20 ikan mengalami kematian
ikan diam bergerombol didasar akuarium, tidak ada nafsu makan, tubuh kesat dan lesu
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan mengalami kematian
21 ikan mengalami kematian ikan mengalami kematian
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan mengalami kematian
22 ikan mengalami kematian ikan mengalami kematian
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan mengalami kematian
23 ikan mengalami kematian ikan mengalami kematian
ikan bergerak normal, nafsu makan baik, kondisi fisik
normal ikan mengalami kematian
24 ikan mengalami kematian ikan mengalami kematian
satu ekor ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak
merah di bagian tubuhnya ikan mengalami kematian
25 ikan mengalami kematian ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan
melepuh di bagian tubuhnya ikan mengalami kematian
26 ikan mengalami kematian ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan
melepuh di bagian tubuhnya ikan mengalami kematian
27 ikan mengalami kematian ikan mengalami kematian
ikan bergerak namun gerak refleksnya lambat, nafsu makan berkurang, terdapat bercak merah dan melepuh di bagian tubuhnya, menghasilkan banyak
lendir, sirip ekor rusak ikan mengalami kematian
28 ikan mengalami kematian ikan mengalami kematian
ikan diam bergerombol didasar akuarium, tidak ada
nafsu makan, tubuh kesat dan lesu ikan mengalami kematian
Lampiran 4. Tabel data harian suhu pemeliharaan setelah uji tantang
Hari ke Pagi Sore
1 24 25 2 24 25 3 24 25 4 24 25 5 23.5 25 6 24 25 7 24 25 8 24 25 9 24 25 10 24 25 11 23.5 25 12 23.5 25 13 23.9 25 14 24 24.5 15 23.5 24.5 16 23.5 25 17 23.8 24.8 18 24 25 19 23.8 24.8 20 23.5 24.5 21 23.5 24.8 22 23.5 24.5 23 23.5 24.5 24 24 25 25 24 25 26 24 25 27 24 25 28 23.5 24.5 29 23.5 24.5