UJI POTENSI DAN EFIKASI VAKSIN INAKTIF TERHADAP
KHV DENGAN PENAMBAHAN ADJUVAN PADA IKAN KOI
(Cyprinus carpio)
LILI SHOLICHAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Uji Potensi dan Efikasi Vaksin Inaktif terhadap KHV dengan Penambahan Adjuvan pada Ikan Koi (Cyprinus carpio) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2016
Lili Sholichah
RINGKASAN
LILI SHOLICHAH. Uji Potensi dan Efikasi Vaksin Inaktif terhadap KHV dengan Penambahan Adjuvan pada Ikan Koi (Cyprinus carpio). Dibimbing oleh MUNTI YUHANA dan ANGELA MARIANA LUSIASTUTI.
Koi Herpesvirus (KHV) adalah virus ganas yang menginfeksi ikan mas dan koi pada semua ukuran dan dapat menyebabkan kematian hingga 95%. Wabah KHV pertama kali dilaporkan terjadi di Israel dan Amerika Serikat pada tahun 1998. Penyakit KHV terjadi di Indonesia dilaporkan pertama kali pada bulan April 2002. KHV dapat menyerang berbagai stadia ikan dan menyebabkan mortalitas yang lebih tinggi pada benih dibandingkan ikan dewasa. Ikan yang terinfeksi KHV berwarna putih pucat dan terdapat nekrosis pada filamen insang, mata yang abnormal, produksi lendir yang berlebih, bintik pucat yang kasar pada kulit. Ikan sering berenang ke permukaan dan menunjukkan stress pernapasan, lesu, memisahkan diri pada inlet dan sisi kolam, hilangnya keseimbangan dan disorientasi renang. Pada beberapa kasus wabah KHV, beberapa ikan yang terinfeksi tidak menunjukkan gejala klinis.
Penelitian ini menggunakan bahan tambahan adjuvan yang dicampurkan pada vaksin. Jenis adjuvant yang digunakan yaitu Complete Freund’s Adjuvant (CFA) dan Incomplete Freund’s Adjuvant (IFA). Adjuvan adalah bahan yang ditambahkan pada vaksin untuk merangsang respon imun. Perbedaan CFA dan IFA terdapat pada komposisi bahan penyusun dimana dalam satu mL CFA terkandung satu mg bakteri Mycobacterium tuberculosis dalam bentuk heat-killed /dried; 0.85 ml paraffin oil; dan 0.15 ml mannide monooleate. Bakteri M.
tuberculosis tidak terdapat di dalam IFA.
Tujuan dari penelitian ini adalah untuk menguji potensi dan efikasi vaksin inaktif terhadap KHV dengan penambahan adjuvan pada ikan koi. Vaksin yang digunakan dalam bentuk vaksin yang dilemahkan dengan 0,1% formalin dan adjuvan sedangkan perbanyakan virus dilakukan dengan menggunakan kultur sel KF-1. Ikan uji koi (10,38 ± 1,25 g) dipelihara dalam wadah plastik diaerasi dan diberi pakan dengan pelet dua kali sehari. Setelah 14 hari adaptasi, setiap ikan divaksinasi dengan menyuntikkan 0,1 ml vaksin, kemudian setelah 21 hari ikan diuji tantang dengan menyuntikkan 0,1 ml virus KHV 104,58 TCID50/mL. Penelitian
ini terdiri dari 5 perlakuan dan 4 ulangan (A = vaksin; B = vaksin + Complete Freund’s Adjuvant / CFA; C = vaksin + Incomplete Freund Adjuvant / IFA; K + = kontrol positif, dan K- = kontrol negatif).
Parameter uji yang diamati dalam penelitian ini meliputi kelangsungan hidup uji tantang, relative percent survival, gejala klinis KHV, respon imun spesifik berupa titer antibodi dengan uji ELISA, hematologi darah yang diwakili hematokrit, imunitas non spesifik berupa lisosim dan respiratory burst. Analisa histologi juga dilakukan pada organ target insang.
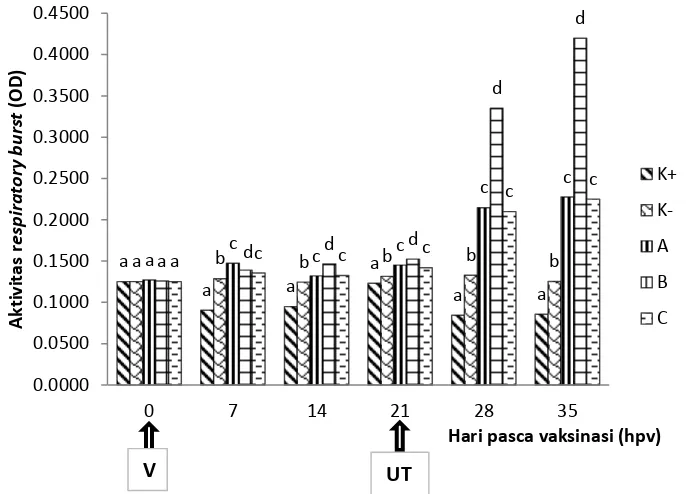
vaksinasi) dan 28hpv yaitu 0,564 nm dan 0,532 nm. Nilai cut off value (CV) atau batas nilai yang menunjukkan positif terbentuknya antibodi protektif terhadap KHV yang diperoleh dalam pengujian ini sebesar 0.377 nm. Kadar hematokrit mencapai puncak tertinggi pada minggu ketiga (21hpv) berbeda nyata dengan perlakuan lainnya (p <0,05) yaitu 60,36±0,17% dicapai pada perlakuan B. Aktivitas lisosim tertinggi dicapai perlakuan B pada 21hpv sebesar 217,46±1,76 UI/mL/menit dan berbeda nyata dengan perlakuan lainnya (p <0,05). Sedangkan aktivitas respiratory burst mencapai puncak pada hari ke-14 pasca uji tantang (35hpv) sebesar 0,4200±0,001 nm dan berbeda nyata dengan perlakuan lainnya (p<0,05).
Gejala klinis tingkah laku ikan uji setelah uji tantang KHV yang dapat teramati antara lain penurunan nafsu makan yang drastis, ikan berkumpul di permukaan air, pernafasan berlangsung cepat (megap-megap), dan bergerak tidak beraturan (hilang keseimbangan). Adapun perubahan morfologi pada ikan uji yang teramati antara lain perubahan warna ikan (discolouration), kulit ikan terasa kasar, mata ikan menjadi cekung (sunken eyes), geripis pada sirip ikan, pendarahan (hemorraghe) pada tubuh ikan, serta nekrosis pada filamen insang ikan terutama pada kontrol positif.
Pengamatan pada preparat histologi menunjukkan bahwa pada ikan kontrol positif (tidak divaksin, diuji tantang) mengalami kerusakan yang lebih parah bila dibandingkan dengan ikan yang divaksin, ditandai dengan banyak sel yang mengalami hiperplasia, kerusakan struktur lamela insang dan munculnya pembengkakan filamen insang sebagai ciri khas kerusakan jaringan yang disebabkan oleh serangan virus.
Kesimpulan penelitian yaitu pemberian vaksin inaktif yang mengandung 0,1% formalin dengan penambahan Complete Freund’s Adjuvant melalui metode suntik dengan volume larutan vaksin yang disuntikkan 0,1 mL per ikan pada 104.58 TCID50/mL menunjukkan hasil yang optimal dalam meningkatkan respon imunitas
ikan koi terhadap infeksi KHV.
SUMMARY
LILI SHOLICHAH. Potency and Efficacy Test of Inactivated Vaccine Against Koi Herpesvirus with Adjuvant in Koi Fish (Cyprinus carpio). Supervised by MUNTI YUHANA and ANGELA MARIANA LUSIASTUTI.
Koi Herpesvirus (KHV) is a malignant virus that infects carp and koi in all sizes and caused the fish mortality up to 95%. KHV outbreaks were reported in Israel and the United States in 1998. The first case occurred in Indonesia was reported in April 2002. The KHV can attack various stadia and caused mortality higher in juvenils than adult fish. Fish infected by KHV showed pale white and necrosis in gill filaments, abnormal eye, over mucus production, pale spots on the skin. The fish often swimming to the surface and show the stress of breathing, lethargic, and a breakaway on the inlet side of the pool, swimming disorientation and loss of balance. Some infected fish however showed no clinical symptoms.
This study used an adjuvant as additive mixed into a vaccine. The type of adjuvant were Complete Freund's Adjuvant (CFA) and Incomplete Freund's Adjuvant (IFA). Adjuvants was substances added to vaccines to stimulate the immune response. Differences between CFA and IFA contained in the composition of the constituent material which was in 1 mL CFA consisted of 1 mg of
Mycobacterium tuberculosis in the form of heat-killed / dried; 0.85 ml of paraffin oil; and 0.15 ml mannide monooleate. However M. tuberculosis not contained in the IFA.
The purpose of this study was to determine the potency and efficacy of inactivated vaccine against KHV combine with adjuvant in koi fish. The vaccine used in the form of an inactivated vaccine with 0.1% formalin and the addition of the adjuvant while the viral propagation was done using cell cultures KF-1. Koi fish (10.38 ± 1.25 g) were reared in aerated plastic containers and fed by pellets twice a day. After 14 days of adaptation, every fish was vaccinated by injecting 0.1 ml of the vaccine, and then after 21 days the fish was challenged by injecting 0.1 ml KHV virus 104.58 TCID50/mL. This study consisted of 5 treatments and 4 replications (A
= vaccine; B = vaccine + Complete Freund's Adjuvant; C = vaccine + Incomplete Freund's Adjuvant; K+ = positive control, and K- = negative control).
Parameters observed in this study included survival rate (SR) after the challenge test, relative percent survival, clinical symptoms of KHV, specific immune responses in the form of the antibody titer by ELISA, blood hematology represented as hematocrit, non-specific immunity in the form of lysozyme and respiratory burst. Histological analysis was also conducted in the target organs of gills.
The results showed that the survival rate of treatment B reached the highest
treatments (p<0.05) 60.36 ± 0.17% and this was achieved by treatment B. The highest lysozyme activity achieved by the treatment of B at 21dpv of 217.46 ± 1.76 UI/mL/min and significantly different from other treatments (p <0.05). Whereas the respiratory burst activity reached its maximum value at day 14 post-challenge test (35dpv) of 0.4200 ± 0.001 nm and was significantly different from other treatments (p <0.05).
Clinical symptoms after KHV challenged test observed were lost in appetite, schooling at the surface, respiratory disordered and lost of balance. The morphological changes in the fish were observed, among others, changes in color of the fish (discolouration), the skin became rough, eyelets become concave (sunken eyes), bleeding (hemorraghe) on the fish's body, and necrosis in the gill filaments fish especially showed by the positive control fish.
Histopathological observations showed that the positive control (not vaccinated, but challenged) suffered further damage when compared to vaccinated fish, marked by cells hyperplasia, structural damaged of secondary lamellae and the emergenced of swollen gill filaments as typical damaged caused by viral attack.
The conclusion of research was that the application of inactivated vaccine containing 0.1% formalin with the addition of Complete Freund's Adjuvant through the injection of volume of 0.1 mL per fish in 104.58 TCID50 /mL has resulted optimal
protection and capable of enhancing the immune responses of KHV infection in koi fish.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
UJI POTENSI DAN EFIKASI VAKSIN INAKTIF TERHADAP
KHV DENGAN PENAMBAHAN ADJUVAN PADA IKAN KOI
(Cyprinus carpio)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Uji potensi dan Efikasi Vaksin Inaktif terhadap KHV dengan Penambahan Adjuvan pada Ikan Koi (Cyprinus carpio) Nama : Lili Sholichah
NIM : C151130411
Disetujui oleh Komisi Pembimbing
Dr Munti Yuhana, SPi, MSi
Ketua
Dr drh Angela Mariana Lusiastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 31 Agustus 2016
PRAKATA
Puji syukur senantiasa penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian Uji Potensi dan Efikasi Vaksin Inaktif terhadap KHV dengan Penambahan Adjuvan pada ikan Koi (Cyprinus carpio) telah dilaksanakan pada bulan September 2014 – Desember 2015.
Terima kasih penulis ucapkan kepada Ibu Dr Munti Yuhana, MSi dan Ibu Dr drh Angela Mariana Lusiastuti, MSi, selaku pembimbing yang banyak memberi saran dan masukan, serta kepada Dr Ir Sukenda, MSc dan Dr Ir Widanarni, MSi sebagai penguji.
Terima kasih juga penulis sampaikan kepada Kementrian Kelautan dan Perikanan yang telah memberikan beasiswa periode September 2013 – Agustus 2015. Disamping itu, penghargaan penulis sampaikan kepada Balai Penelitian dan Pengembangan Budidaya Ikan Hias; Instalasi Penelitian dan Pengembangan Pengendalian Penyakit dan seluruh staf peneliti BPPBIH maupun IP4I. Ungkapan terima kasih juga disampaikan kepada ibunda Hikmatul Maula, ayahanda Soekono, suami tercinta Budhi Adhi Utomo, ananda tersayang Fathiyya dan Muzzammil serta Bude Nur atas segala doa dan kasih sayangnya yang selalu menemani dan memberikan semangat selama proses pelaksanaan penelitian dan penulisan tesis ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan dan Manfaat Penelitian 3
Hipotesis 3
2 METODE 3
Waktu dan Tempat 3
Materi Uji 3
Rancangan Penelitian 4
Prosedur Penelitian 4
Parameter Uji 6
Analisis Data 8
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 15
4 SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1 Kelangsungan hidup dan kelangsungan hidup relatif ikan koi pada saat
uji tantang dengan KHV 9
DAFTAR GAMBAR
1 Gejala klinis perubahan morfologi pada ikan koi setelah diuji tantang
dengan KHV 10
2 Titer antibodi hasil uji indirect-ELISA menggunakan antigen KHV yang sudah dimurnikan dengan nilai cut off value 0,377 nm 11 3 Kadar hematokrit darah ikan koi setelah divaksinasi dengan vaksin
inaktif terhadap KHV selama masa pemeliharaan 12
4 Aktivitas lisosim pada darah ikan koi setelah divaksinasi dengan vaksin inaktif terhadap KHV selama masa pemeliharaan 12 5 Aktivitas respiratory burst pada darah ikan koi setelah divaksinasi
dengan vaksin inaktif terhadap KHV selama masa pemeliharaan 1Error! Bookmark not defined.
6 Elektroforegram hasil konfirmasi infeksi positif KHV pada ikan koi
menggunakan metode PCR 14
7 Histopatologi organ insang pada ikan koi yang sehat dan yang positif
terinfeksi KHV 14
DAFTAR LAMPIRAN
1 Data hasil pengamatan efek sitopatik pada sel KF-1 yang diinokulasi dengan virus KHV BJMN-2 setelah inkubasi 14 hari 2Error! Bookmark not defined.
2 Mikroskopis efek sitopatik hasil pengamatan dengan mikroskop inverted
Olympus BX-41 pada sumur pelat 24
3 Kalkulasi TCID50 berdasarkan hasil pengamatan efek sitopatik
mengacu kepada Reed dan Muench (1938) 25
4 Garis presipitasi yang terbentuk pada Agar Gell Precipitation Test
1
PENDAHULUAN
Latar Belakang
Koi Herpesvirus Disease (KHVD) merupakan virus ganas yang dapat menginfeksi ikan koi dan ikan mas dan cepat menyebar luas (Ilouze et al. 2006). Nama lain dari penyakit ini adalah Cyprinid Herpesvirus (CyHV-3), Carp Intestinal Nephritis Gill Necrosis Virus (CNGV) (Hedrick et al. 2004, Thomas et al. 2005, Ronen et al. 2003). Penyakit ini pertama kali dilaporkan terjadi di Israel dan Amerika Serikat pada tahun 1998. Selanjutnya, penyakit ini tersebar ke negara-negara lainnya seperti Polandia, Inggris, Jerman dan Belanda (Antychowicz et al. 2005). Di Asia, wabah KHVD pertama kali dilaporkan terjadi di Indonesia pada bulan April 2002 (Melba 2004).
Ikan yang terinfeksi KHV berwarna putih pucat dan terdapat nekrosis pada filamen insang. Ikan sering berenang ke permukaan dan menunjukkan stress respiratori (Lio-Po 2011). Perubahan tingkah laku lainnya yaitu lethargic, memisahkan diri pada inlet dan sisi kolam, beberapa ikan menujukkan gejala berupa hilangnya keseimbangan dan disorientasi tetapi juga menunjukkan gejala berupa hiperaktivitas (OIE 2012). Gejala klinis lainnya dapat berupa mata yang abnormal, permukaan tubuh yang pucat, produksi lendir yang banyak, bintik pucat yang kasar pada kulit (Lio-Po 2011). Analisa histopatologi ditemukan adanya focal atau semua epidermis hilang, hiperemia, dan lesi (Michel et al. 2010). Pada beberapa kasus wabah KHV, beberapa ikan yang terinfeksi tidak menunjukkan gejala klinis (Lio-Po 2011).
KHV dapat menyerang ikan mas dan ikan koi (Cyprinus carpio) baik ukuran larva, juvenil maupun dewasa (Gilad et al. 2002). Penyakit viral ini menyerang berbagai stadia ikan dan menyebabkan mortalitas yang lebih tinggi pada benih dibandingkan ikan dewasa (Dishon et al. 2005; Pikarsky et al. 2004). Virus ini dapat menginfeksi ikan mas apabila suhu air pemeliharaan berada pada kisaran 17-270C namun virulensi tertinggi terjadi pada suhu 22-240C (Perelberg et al. 2003). Kematian yang disebabkan oleh KHV dapat mencapai 80-95% (Sunarto 2005).
Vaksinasi merupakan salah satu cara pengendalian penyakit pada budidaya ikan yang ramah lingkungan yang dapat meningkatkan respon imun (sistem kekebalan tubuh) ikan. Menurut Iwama dan Nakanishi (1996) bahwa vaksinasi yang dilakukan bertujuan untuk meningkatkan sistem kekebalan spesifik sehingga tubuh dapat melakukan proteksi dari infeksi patogen tertentu. Masuknya benda asing termasuk antigen ke dalam tubuh akan direspons langsung oleh tubuh. Respons tanggap kebal tubuh pada ikan umumnya hampir sama seperti pada mamalia, tetapi lebih sederhana. Respons imun yang terdapat pada ikan terdiri dari respons imun non spesifik (innate) dan respons imun spesifik (adaptive).
2
ikan uji dan vaksin harus menimbulkan kekebalan terhadap penyakit pada ikan yang diberi vaksin.
Penelitian Ronen et al. 2003 dengan menggunakan virus hidup yang telah dilemahkan (live-attenuated virus) menunjukkan titer antibodi dan imunitas yang tinggi terhadap KHV. Namun, vaksin attenuated tersebut mempunyai 2 kendala, yaitu efektivitas yang kurang tinggi sehingga ikan yang divaksinasi tidak cukup memproduksi antigen untuk melawan virus yang aktif. Virus yang dilemahkan dan dijadikan vaksin kemungkinan bisa menjadi aktif sehingga menimbulkan penyakit bagi ikan yang divaksin. Dampak buruk dikhawatirkan akan terjadi mutasi pada virus sehingga menjadi lebih ganas dan menjadi strain KHV baru yang berbahaya (Yasumoto et al. 2006).
Yasumoto et al. (2006) di Jepang mengembangkan formalin-inaktif KHV vaksin dengan memanfaatkan membran liposomal yang diaplikasikan pada pakan ikan. Vaksin yang digunakan pada penelitian ini produksinya merujuk kepada Nakajima et al. 1999 dan Yasumoto et al., 2006 dengan sedikit modifikasi. Hedrick
et al. 2000 melaporkan bahwa cell line KF-1 yang berasal dari jaringan epitel sirip ikan Koi telah berhasil mengisolasi virus KHV secara laboratoris di mana hasil uji pada ikan mas menunjukkan gejala klinis, serta lesi patologis yang sama dengan ikan yang terinfeksi KHV secara alami yang disertai tingkat kematian yang tinggi. KHV positif akan membentuk cytopathic effect (CPE) berupa vakuola pada sel kultur dengan masa inkubasi 7-14 hari pada suhu 200C.
Penelitian ini menggunakan bahan tambahan adjuvan yang dicampurkan pada vaksin. Jenis adjuvant yang digunakan yaitu Complete Freund’s Adjuvant (CFA) dan Incomplete Freund’s Adjuvant (IFA). Adjuvan adalah bahan yang ditambahkan pada vaksin untuk merangsang respon imun. Perbedaan CFA dan IFA terdapat pada komposisi bahan penyusun di mana dalam satu mL CFA terkandung satu mg bakteri Mycobacterium tuberculosis dalam bentuk
heat-killed/dried; 0.85 ml paraffin oil; dan 0.15 ml mannide monooleate. Bakteri M.
tuberculosis tidak terdapat pada IFA. Kelebihan M.tuberculosis adalah dinding sel tebal, termasuk bakteri yang imunogenik dan lebih tahan pada kondisi asam. Salah satu upaya untuk meningkatkan efektivitas vaksinasi untuk mempercepat peningkatan titer antibodi adalah dengan penggunaan adjuvan pada vaksin. Vaksin tanpa adjuvan tidak mampu merespon titer antibodi secara maksimal dan protektif pada pencegahan influensa (Stephenson et al. 2002; Galli et al. 2009).
Keberadaan respons imun spesifik ditunjukkan dengan peningkatan produksi antibodi pada ikan yang divaksin dan dapat diketahui dengan beberapa metode salah satunya adalah metode indirect-enzim linked immunosorbent assay (indirect -ELISA).
Perumusan Masalah
3 secara genetis (Genetically Modified Organism) (GMO) untuk pengobatan penyakit ikan menjadikan pentingnya penelitian ini dilakukan.
Oleh karena itu pada penelitian ini akan diuji apakah FKC yang digunakan memiliki potensi sebagai vaksin alternatif untuk pengendalian penyakit KHV pada ikan hias koi.
Tujuan dan Manfaat Penelitian
Tujuan dari penelitian ini yaitu untuk menguji potensi dan efikasi vaksin inaktif terhadap KHV dengan penambahan adjuvan yang diproduksi dari kultur sel primer KF-1. Penelitian ini diharapkan dapat memberikan manfaat sebagai tindakan pencegahan sehingga sintasan ikan koi meningkat dan dapat digunakan pada saat terjadi wabah.
Hipotesis
Pemberian vaksin inaktif terhadap KHV dengan penambahan adjuvan dapat meningkatkan kelangsungan hidup dan sistem imun ikan koi yang diinfeksi KHV dibandingkan dengan kontrol.
2
METODE
Waktu dan Tempat Penelitian
Penelitian dilakukan di Laboratorium Virologi pada Instalasi Penelitian dan Pengembangan Pengendalian Penyakit Ikan (IP4I) Depok dan Balai Penelitian dan Pengembangan Budidaya Ikan Hias Depok. Penelitian dilakukan dari bulan September 2014 sampai Desember 2015.
Materi Uji
Ikan Uji
Ikan uji menggunakan ikan hias koi (Cyprinus carpio) berukuran 10,38+1,25 g/ekor yang berasal dari farm swasta di Kabupaten Sukabumi, Jawa Barat. Morfologi anatomi ikan uji tidak menunjukkan gejala penyakit KHV dan diperkuat dengan hasil uji PCR menunjukkan negatif KHV. Selain itu selama masa aklimatisasi 14 hari tidak ditemukan adanya gejala penyakit KHV dan kondisi ikan sehat dan stabil.
Virus Uji
4
Rancangan Percobaan
Rancangan penelitian ini adalah rancangan acak lengkap (RAL) dengan 5 perlakuan dan 4 ulangan sebagai berikut :
Perlakuan A :Vaksin, diuji tantang
Perlakuan B :Vaksin+Complete Freund’s Adjuvant,diuji tantang Perlakuan C :Vaksin+Incomplete Freund’s Adjuvant, diuji tantang Perlakuan K+ :Kontrol positif (tidak divaksin, disuntik PBS, diuji tantang) Perlakuan K- :Kontrol negatif (tidak divaksin, disuntik PBS, tidak diuji
tantang)
Ikan dipelihara dalam bak plastik berukuran 60x70x40 cm dengan kepadatan 15 ekor ikan setiap wadah. Ulangan keempat pada tiap-tiap perlakuan digunakan untuk pengambilan sampel darah dan serum. Parameter kelangsungan hidup (survival rate, SR) dan kelangsungan hidup relatif (relative percent survival, RPS) dihitung dari ketiga ulangan (ulangan satu, dua, dan tiga).
Prosedur Penelitian
Pasase Sel KF-1
Virus yang digunakan untuk membuat vaksin terlebih dahulu diinokulasikan dan diperbanyak di dalam sel. Sel yang digunakan merupakan sel lestari (cell line) yang dibuat dari organ sirip ikan dan diberi nama sel KF-1. Terlebih dahulu dilakukan sub kultur (passage) sel KF-1 yaitu dalam media Leibovitz (L-15) + 20% FBS dan wadah berupa flask. Sub kultur dilakukan jika konfluensi sel sudah mencapai ± 80%. Media lama dibuang dari flask lalu ditambahkan PBS dan
monolayer dibilas sambil flask dimiringkan. Trypsinised dilakukan dengan menambahkan 0,25% larutan tripsin 1 ml ke tabung meliputi seluruh monolayer
sampai lapisan sel terlihat putih (opaque). Inokulasi Virus KHV
Ikan yang menunjukkan gejala KHV diambil bagian insang, ginjal, dan limpa (3:1:1 w/w) sebanyak 1 gram digerus halus lalu ditambahkan PBS sebanyak 9 mL. Setelah itu disentrifus dengan kecepatan 15000 rpm selama 15 menit pada suhu 40C dan disaring menggunakan 0,45 µm filter. Supernatan homogenate virus diperoleh dari hasil kultur sel setelah diinkubasi selama 10 hari pada suhu 40C. Panen Virus KHV
Virus siap dipanen apabila efek sitopatik (cythopatic effect, CPE) sudah mencapai ±80%. Isi flask dituang ke dalam tabung falcon 50 mL untuk kemudian disentrifus dengan kecepatan 3000 rpm selama 15 menit. Supernatan diambil dan disimpan pada suhu -800C sampai waktunya digunakan dan sebagian digunakan untuk penghitungan TCID50.
Tissue culture infective dose (TCID50)
5 µL pada tiap sumur dan diinkubasi pada 25°C. Pengenceran berseri dilakukan menggunakan Media L-15 yaitu stok virus, 10-1, 10-2, 10-3, 10-4, 10-5 dan 10-6 dan kontrol sel (Lampiran 1). Penelitian dilakukan dengan menggunakan 12 duplikat dari sumur (12 ulangan). Pertumbuhan virus dalam kultur sel (Lampiran 2) diamati selama 14 hari pasca inokulasi di bawah mikroskop inverted Olympus BX 41. Perhitungan TCID50 (Lampiran 3) didasarkan pada metode Reed dan Muench (1938):
= ( % positif pengenceran di atas % − % positif di bawah %)% − % positif pengenceran di bawah %
Produksi Vaksin Inaktif
Pembuatan vaksin inaktif dilakukan dengan penambahan larutan formalin ke dalam larutan virus yang sudah dipanen mengacu kepada metoda Nakajima et al. (1999) dan Yasumoto et al. (2006) dengan sedikit modifikasi. Nakajima dalam penelitiannya pada ikan red sea bream (Pagrus major) membuat vaksin iridovirus dari sel GF (grunt fin) dengan penambahan formalin 0,1% dan larutan vaksin disimpan 12 hari pada suhu 40C baru kemudian diaplikasikan. Berbeda halnya dengan yang dilakukan Yasumoto pada penelitian ikan mas (Cyprinus carpio) dimana vaksin koi herpesvirus diproduksi dari sel KF-1 yang diinaktivasi dengan 0,3% formalin dan disimpan selama 48 jam pada suhu 240C sebelum digunakan.
Vaksin pada penelitian ini diinaktivasi dengan formalin 0,1% dari virus KHV yang diperbanyak dalam sel KF-1 kemudian difiltrasi menggunakan 450 nm
millipore dan langsung digunakan untuk uji. Vaksinasi
Vaksinasi dilakukan dengan metode suntik secara intramuscular dengan volume 0,1 mL larutan vaksin pada masing-masing ekor ikan. Larutan vaksin yang siap pakai dikocok terlebih dahulu hingga tidak ada bagian yang mengendap di dasar wadah vaksin.
Penambahan adjuvan baik complete maupun incomplete dilakukan dengan perbandingan (0,25/0,75) (v/v) dengan larutan vaksin. Perbandingan volume antara vaksin dengan adjuvan diperoleh dari uji Agar Gel Precipitation Test (AGPT) yang dilakukan sebelumnya (Lampiran 4). Ikan uji kontrol positif tidak divaksin, tetapi disuntik PBS dan kemudian diuji tantang. Perbandingan adjuvan dengan vaksin (0,25/0,75) (v/v) aman digunakan karena tidak menimbulkan luka atau borok pada daerah bekas suntikan.
Setelah divaksin ikan dipelihara dalam bak plastik berukuran 60cm x 70cm x 40cm dan diisi air sebanyak 30 liter per wadah . Ikan diberi pakan berupa pelet dua kali sehari setiap pagi dan sore hari secara at satiation
Uji Tantang
Uji tantang dilakukan pada hari ke-21 setelah vaksinasi dan pemeliharaan dilakukan selama 14 hari pasca uji tantang. Ikan diinjeksi secara intraperitoneal
6
Parameter Uji
Parameter uji yang diamati dalam penelitian ini meliputi kelangsungan hidup uji tantang, relative percent survival, gejala klinis KHV, respon imun spesifik berupa titer antibodi dengan uji ELISA, hematologi darah yang diwakili hematokrit, imunitas non spesifik berupa lisosim dan respiratory burst. Analisa histologi juga dilakukan pada organ target insang.
Kelangsungan hidup ikan (survival rate, SR)
Kelangsungan hidup uji tantang dan kelangsungan hidup kumulatif diamati pada ikan uji selama 14 hari masa uji tantang. Penghitungan nilai kelangsungan hidup berdasarkan persamaan :
SR =No xNt %
Keterangan :
SR : Tingkat kelangsungan hidup (%)
Nt : Jumlah ikan pada akhir pemeliharaan (ekor) No : Jumlah ikan pada awal pemeliharaan (ekor) Relative Percent Survival (RPS):
� = ( − % % � �� � �� � � ) �
Gejala Klinis
Pengamatan gejala klinis diamati secara visual setiap hari selama 14 hari masa uji tantang. Gejala klinis yang diamati diantaranya perubahan tingkah laku serta morfologi ikan uji meliputi adanya luka serta kerusakan yang terjadi pada tubuh ikan akibat infeksi KHV.
Titer Antibodi dengan ELISA
Preparasi antigen untuk uji ELISA terlebih dahulu dilakukan dengan proses purifikasi virus KHV sesuai Ronen et.al 2003. Antigen diultrasentrifus dengan kecepatan 100.000 g pada suhu 40C selama 60 menit kemudian dicuci dengan PBS (Phosphate-Buffered Saline) dan terakhir diperoleh pelet yang merupakan antigen murni. Antigen yang telah dipurifikasi diukur konsentrasi proteinnya dengan metode Bradford.
Antigen dilekatkan sebanyak 10 µg/mL pada tiap sumur dan diinkubasi pada suhu 40C semalaman. Tanpa dicuci terlebih dahulu, plate uji disaturasi atau dihambat menggunakan 200 µL PBS-BSA (Bovine Serum Albumin) 1% dan diinkubasi pada suhu 220C selama satu jam. Plate dicuci tiga kali dengan 400 µL
PBS-Tween 20. Sampel serum kemudian ditambahkan pada tiap sumur sebanyak 200 µL (duplo) dan diinkubasi pada suhu 220C selama tiga jam. Plate dicuci tiga kali dengan 400 µL PBS-Tween 20. Antibodi spesifik yang digunakan merupakan monoklonal antibodi yang berupa IgM ikan koi ‘Koi carp (Cyprinus carpio) IgM
7 suhu 220C selama satu jam. Plate dicuci tiga kali dengan 400 µL PBS-Tween 20. One-Step Ultra TMB-ELISA selanjutnya ditambahkan pada tiap sumur sebanyak 100 µL dan diamkan selama 10 menit. Reaksi ELISA dihentikan dengan menambahkan 50 µL H2SO4 3M dan dilakukan pembacaan kerapatan optik (OD)
pada 450 nm. Nilai cut off value (CV) pada uji ini diperoleh dengan persamaan : CV = Rerata kontrol negatif + (2 x standar deviasi)
Kadar Hematokrit
Hematokrit merupakan persentase volume eritrosit dalam darah ikan. Kadar hematokrit diukur menurut Anderson dan Siwicki (1995) yaitu dengan menggunakan tabung mikro hematokrit yang berupa pipa kapiler berlapis heparin.
Pengukuran dilakukan dengan membandingkan bagian darah yang mengendap (a) dengan seluruh bagian darah yang ada dalam tabung mikrohematokrit (b) kadar hematokrit dinyatakan sebagai % volume padatan sel darah yang dihitung dengan cara :
= %
Pengukuran lisozim dilakukan dengan metode Kafilzadeh (2013) dengan sedikit modifikasi. Plasma sebanyak 10 μl ditambahkan suspensi cair Micrococcus lysodeicticus (Sigma) sebanyak 190 μl (0,2 mg/ml dalam 0,05 M NaH2PO4 pada
25°C). Kemudian dilakukan dua kali pembacaan adsorpsi pada panjang gelombang 540 nm di spektrofotometer setelah 30 detik pencampuran dan 30 menit pencampuran. Secara matematis aktifitas lisozim dapat dirumuskan sebagai berikut :
Aktifitas lisozim (UI/ml/menit) = [(OD30s - OD30m) x1000] x(1/(t x p))
Keterangan :
1000 = Konversi hasil absorbansi (OD) menjadi unit internasional (UI) t = waktu (menit)
p = jumlah plasma (ml)
OD 30s = pembacaan densitas optikal detik ke – 30 OD 30m = pembacaan densitas optikal menit ke – 30 Respiratory Burst Activity
8
Suspensi NBT-sel darah 0,05 ml diambil dan dimasukkan kedalam tabung kaca yang berisi 1,0 ml N, N-dimethyl formamide (DMF) selanjutnya tabung kaca disentrifus selama 5 menit pada 3000 x g. Supernatan sampel diambil, dan dibaca dengan menggunakan alat spektrofotometer pada 540 nm atau 620 nm.
Konfirmasi Ikan Uji dengan PCR
Konfirmasi PCR dilakukan terhadap ikan uji secara random yang mewakili masing-masing perlakuan. Organ target yang digunakan untuk konfirmasi berupa insang dengan cara non lethal sampling. Ikan dibius lalu bagian insang digunting sedikit tanpa menimbulkan luka dan setelah itu ikan dikembalikan ke air hingga sadar. Primer yang digunakan merujuk kepada Yuasa et.al. 2005 dengan Forward = 5’-GAC-ACC-ACA-TCT-GCA-AGG-AG-3’ dan Reverse = 5’ -GAC-ACA-TGT-TAC-AAT-GGT-CGC-3’ dengan program PCR yang digunakan adalah pre -denaturasi 940C selama 30 detik, denaturasi 940C selama 30 detik, annealing 630C selama 30 detik, ekstensi 720C selama 30 detik dengan total 40 siklus amplifikasi,
dan ekstensi akhir 720C selama 7 menit sesuai dengan Yuasa et al. (2005).
Ikan uji yang mati setelah proses uji tantang diambil dan dilakukan konfirmasi PCR untuk memastikan ikan yang mati benar-benar disebabkan oleh agen KHV, yang ditunjukkan dengan hasil uji positif.
Analisis Data
9
3
HASIL DAN PEMBAHASAN
Hasil
Kelangsungan hidup ikan uji
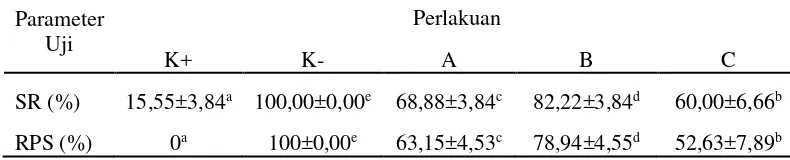
Nilai kelangsungan hidup perlakuan vaksinasi berkisar 60,00-82,22% lebih tinggi dibandingkan perlakuan kontrol positif (15,55%) (Tabel 1). Hal tersebut mengindikasikan bahwa proses vaksinasi dalam penelitian ini mampu meningkatkan kelangsungan hidup ikan koi terhadap infeksi KHV pada masa uji tantang.
Tabel 1. Kelangsungan hidup (SR) dan kelangsungan hidup relatif (RPS) ikan koi pada saat uji tantang KHV
Parameter
Keterangan: Kontrol positif, tidak divaksin diuji tantang (K+), kontrol negatif, tidak divaksin tidak diuji tantang (K-), perlakuan vaksin (A), perlakuan vaksin dengan Complete Freund’s Adjuvant (B), perlakuan vaksin dengan Incomplete Freund’s Adjuvant (C). a Huruf yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
Kelangsungan hidup relatif ikan koi perlakuan vaksin pada penelitian ini berkisar 52,63-78,94% dan merujuk kepada (Amend 1981) bahwa efektivitas vaksin dapat dilihat dari nilai RPS yang lebih besar dari 60%. Sehingga perlakuan A dan B dapat dijadikan kandidat vaksin KHV.
Gejala Klinis
10
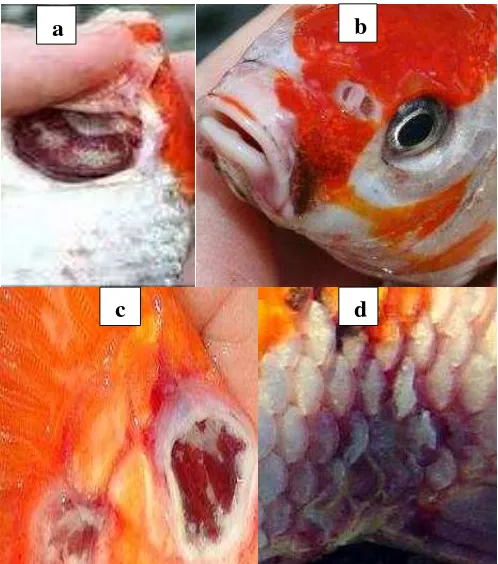
Gambar 1. Gejala klinis perubahan morfologi pada ikan koi setelah diuji tantang dengan KHV.
Keterangan : nekrosis pada filamen insang (a), mata menjadi cekung /
sunken eyes (b), ulcer dan borok pada pangkal ekor (c), dan timbul kemerahan pada kulit / haemorraghe sehingga sisik mudah lepas (d)
Titer antibodi dengan ELISA
Keberadaan respons imun spesifik ditunjukkan dengan peningkatan produksi antibodi pada ikan yang divaksin dan dapat diketahui dengan beberapa metode yang sudah banyak dikembangkan, salah satunya adalah metode indirect-enzim linked immunosorbent assay (indirect-ELISA). Prinsip ELISA secara umum adalah mendeteksi adanya antibodi atau antigen dalam sampel. Adanya ikatan antara antigen dan antibodi yang berpasangan dapat dideteksi dengan penambahan konjugat yang dilabel enzim aktif yang bereaksi dengan substrat yang menghasilkan warna yang spesifik (Levinson dan Jawetz 2000).
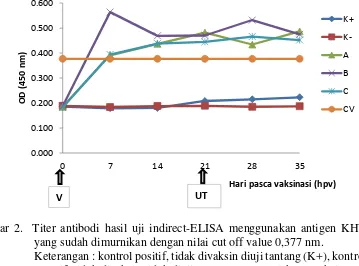
Gambar 2 menunjukkan hasil pengukuran titer antibodi ikan koi yang divaksin dengan vaksin inaktif adjuvan dan formalin maupun kontrol. Sebagai pembatas terbentuk atau tidaknya antibodi adalah cut off value (CV) yaitu 0,377 nm. Kontrol positif maupun negatif teramati bahwa selama proses pemeliharaan tidak membentuk antibodi. Antibodi terbentuk pada perlakuan vaksinasi yaitu pada perlakuan A, B, dan C dibuktikan dengan kerapatan optik yang dicapai melebihi nilai CV. Dapat dilihat bahwa antibodi mulai terbentuk pada 7hpv (hari pasca vaksinasi) dan bertahan hingga akhir pemeliharaan ikan uji (35hpv).
a b
11
Gambar 2. Titer antibodi hasil uji indirect-ELISA menggunakan antigen KHV yang sudah dimurnikan dengan nilai cut off value 0,377 nm.
Keterangan : kontrol positif, tidak divaksin diuji tantang (K+), kontrol negatif, tidak divaksin tidak diuji tantang (K-), perlakuan vaksin (A), perlakuan vaksin dengan Complete Freund’s Adjuvant (B), perlakuan vaksin dengan Incomplete Freund’s Adjuvant (C)
Susunan darah ikan merupakan faktor diagnostik penting, sehingga perubahan gambaran darah banyak digunakan untuk menilai status kesehatan ikan. Kadar hematokrit merupakan persentase perbandingan antara padatan sel darah merah dan plasma dalam darah, dapat dilihat pada Gambar 3. Kadar hematokrit mencapai puncak tertinggi pada minggu ketiga (21hpv) berbeda nyata dengan perlakuan lainnya (p <0,05) yaitu 60,36±0,17% dicapai pada perlakuan B.
12
Gambar 3. Kadar hematokrit darah ikan koi setelah divaksinasi dengan vaksin inaktif terhadap KHV selama masa pemeliharaan.
Keterangan : huruf yang berbeda pada kelompok waktu sampling yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. Kontrol positif, tidak divaksin diuji tantang (K+), kontrol negatif, tidak divaksin tidak diuji tantang (K-), perlakuan vaksin (A), perlakuan vaksin dengan Complete Freund’s
Adjuvant (B), perlakuan vaksin dengan Incomplete Freund’s Adjuvant (C)
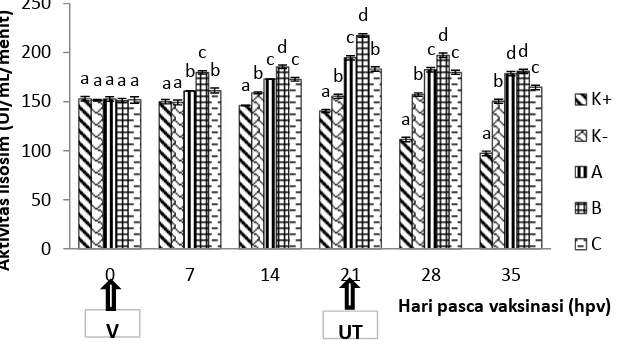
Gambar 4. Aktivitas lisosim pada darah ikan koi setelah divaksinasi dengan vaksin inaktif terhadap KHV selama masa pemeliharaan.
Keterangan : huruf yang berbeda pada kelompok waktu sampling yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. Kontrol positif, tidak divaksin diuji tantang (K+), kontrol negatif, tidak divaksin tidak diuji tantang (K-), perlakuan vaksin (A), perlakuan vaksin dengan Complete Freund’s
13 Aktivitas respiratory burst mencapai puncak pada hari ke-14 (Gambar 5) pasca uji tantang (35hpv) sebesar 0,4200±0,001 nm dan berbeda nyata dengan perlakuan lainnya (p <0,05). Ikan memiliki mekanisme membunuh sel-sel fagosit melalui oksigen bebas dalam vakuola lisosom yang mampu meningkatkan permeabilitas sel bakteri sehingga bisa menyebabkan masuknya substansi dan cairan dalam sel bakteri yang kemungkinan bisa menyebabkan plasmolisis.
Gambar 5. Aktivitas respiratory burst pada darah ikan koi setelah divaksinasi dengan vaksin inaktif terhadap KHV selama masa pemeliharaan. Keterangan : huruf yang berbeda pada kelompok waktu sampling yang sama menunjukkan hasil yang berbeda nyata pada taraf uji 5% (uji selang berganda Duncan). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. Kontrol positif, tidak divaksin diuji tantang (K+), kontrol negatif, tidak divaksin tidak diuji tantang (K-), perlakuan vaksin (A), perlakuan vaksin dengan Complete Freund’s Adjuvant (B), perlakuan vaksin dengan Incomplete Freund’s Adjuvant (C)
Insang pada ikan uji yang mati dan atau moribund diperiksa dan dilakukan validasi terhadap keberadaan virus KHV dengan metode PCR. Hasil validasi membuktikan bahwa kematian yang terjadi pada ikan uji perlakuan A, B, C, K+ adalah akibat infeksi KHV (Gambar 6).
14
Gambar 6. Elektroforegram hasil konfirmasi infeksi positif KHV pada ikan koi menggunakan metode PCR.
Keterangan : 1 = kontrol negatif; 2 = kontrol positif; 3 = sampel perlakuan A; 4 = sampel perlakuan B; 5 = sampel perlakuan C; 6 =kontrol negatif perlakuan; 7 = kontrol positif perlakuan; M=marker
(DNA ladder 100bp, Fermentas)
Histologi merupakan salah satu teknik untuk mengidentifikasi kerusakan terhadap jaringan organ atau tubuh yang diakibatkan oleh bakteri, parasit maupun serangan virus. Histologi sangat penting dalam kaitannya dengan diagnosis penyakit karena salah satu pertimbangan dalam penentuan diagnosis adalah melalui hasil pengamatan terhadap jaringan yang diduga terganggu. Jenis kerusakan pun tergantung dari seberapa parah serangan dari penyakit tersebut. Perbandingan histologi organ insang antara ikan yang sehat dengan ikan yang terinfeksi KHV dapat dilihat pada Gambar 7.
Gambar 7. Histopatologi organ insang pada ikan koi yang sehat dan yang positif terinfeksi KHV.
Keterangan : insang ikan sehat (a), kerusakan struktur lamela sekunder insang ikan sakit (b), hemorraghe (c), hiperplasia sel epitel insang ikan sakit (d)
292bp
2
bp bp
d
a b
15 Pengamatan pada preparat histologi menunjukkan bahwa pada ikan kontrol positif (tidak divaksin, diuji tantang) mengalami kerusakan yang lebih parah bila dibandingkan dengan ikan yang divaksin, ditandai dengan banyak sel yang mengalami hiperplasia, kerusakan struktur lamela insang dan munculnya pembengkakan filamen insang sebagai ciri khas kerusakan jaringan yang disebabkan oleh serangan virus.
Pembahasan
Hasil penelitian menunjukkan bahwa penggunaan vaksin inaktif maupun vaksin inaktif dengan penambahan adjuvan dapat meningkatkan respon imun pada ikan koi. Respon imun non spesifik ditandai dengan terjadinya peningkatan kadar hematokrit, aktivitas lisosim, dan aktivitas RB. Respon imun spesifik ditandai dengan terbentuknya antibodi. Selain itu disertai peningkatan kelangsungan hidup maupun kelangsungan hidup relatif pada ikan koi. Vaksin mengandung antigen yang mampu merangsang terbentuknya kekebalan tubuh. Kekebalan tubuh yang dibentuk diharapkan mampu melindungi tubuh dari serangan penyakit dengan jenis patogen yang sama.
Kelangsungan hidup ikan kontrol berbeda nyata (p<0,05) dengan ikan perlakuan (Tabel 1), hal ini menandakan bahwa vaksinasi dapat meningkatkan kelangsungan hidup ikan. Pada kontrol negatif semua ikan uji dalam keadaan hidup dari awal hingga akhir penelitian, dan berbeda halnya dengan kontrol positif dimana ikan yang tersisa tinggal 15,55%±3,84. Kelangsungan hidup tertinggi dicapai pada perlakuan vaksinasi dengan penambahan Complete Freund’s Adjuvant/CFA (perlakuan B), disusul perlakuan vaksin saja (perlakuan A) baru kemudian perlakuan vaksinasi dengan penambahan Incomplete Freund’s Adjuvant/IFA (perlakuan C). Penambahan vaksin dengan adjuvan ternyata dapat lebih meningkatkan kelangsungan hidup ikan dibandingkan hanya vaksin saja. Hal ini ditunjukkan bahwa B berbeda nyata (p<0,05) dengan A dan sesuai dengan pendapat Kuby 2007 bahwa adjuvan merupakan substansi yang jika dicampurkan dengan antigen kemudian diinjeksikan bersama akan bekerja memperbesar imunogenisitas antigen.
Sedangkan efektivitas proteksi vaksin juga dapat dilihat dari kelangsungan hidup relatif pada Tabel 1. Nilai kelangsungan hidup tertinggi dicapai pada perlakuan B lalu disusul perlakuan A dan perlakuan C. Perlakuan B berbeda nyata (p<0,05) dengan A dan C, dimana A tidak berbeda nyata (p>0,05) dengan C. Nilai RPS yang yang diperoleh pada perlakuan vaksinasi memenuhi kisaran untuk proteksi yang efektif pada proses vaksinasi kecuali perlakuan C (52,63%±7,89) . Hal ini sejalan dengan Amend 1981 bahwa untuk proteksi yang efektif nilai RPS yang disarankan lebih dari 60%. Berdasarkan hasil pada penelitian ini maka tidak disarankan menggunakan perlakuan C, meskipun secara statistik C berbeda nyata dengan A tetapi C tidak memenuhi batas minimal efektifitas proteksi vaksin.
Perlakuan C dengan penambahan incomplete adjuvan ternyata memberikan nilai RPS yang tidak lebih baik dari perlakuan A yaitu perlakuan vaksin saja, hal ini diduga terjadinya efek imunosupresif yang ditimbulkan dari penambahan
16
melepaskan antigen secara perlahan-lahan, imunitas yang diinduksi oleh adjuvan tipe W/O bersifat kuat dan lama.
Vaksinasi bertujuan untuk menginduksi imunitas jangka panjang dengan merangsang komponen dari respons imun spesifik yaitu antibodi. Mekanisme pertahanan sel hewan terhadap virus secara invivo, dapat berupa imunitas sel itu sendiri, yaitu berupa adanya antibodi dan interferon dari sel yang dapat menghambat invasi virus. Titer antibodi mencerminkan kemampuan tubuh ikan terhadap infeksi bakteri melalui responss imun spesifik. Antibodi berperan sebagai presipitin dan aglutinin, cara lain antibodi menghalangi efek antigen dengan cara blokade, yaitu bereaksi dengan epitop antigen sehingga antigen tidak mampu mengenal reseptor sel inang menyebabkan kegagalan proses perlekatan antigen pada permukaan sel inang. Selain itu antibodi untuk mempercepat eliminasi antigen dengan proses opsonisasi (antibodi sebagai opsonin). Antigen dalam keadaan teropsonisasi lebih mudah dikenal makrofag dan lebih efektif untuk dihancurkan (Anderson, 1974).
Gambar 1 menunjukkan nilai titer antibodi selama penelitian yang diukur menggunakan uji ELISA. Sebelum dilakukan vaksinasi titer antibodi cenderung sama dan tidak berbeda nyata (p>0,05) antar perlakuan. Sukenda dan Wakabayashi (2002) menggunakan prosedur indirect-ELISA yang cukup sensitif untuk mendeteksi antibodi serum Plecogiossus altivelis yang divaksinasi dengan bakterin dengan metode perendaman.
Nilai cut off value (CV) atau batas nilai yang menunjukkan positif terbentuknya antibodi protektif terhadap KHV yang diperoleh dalam pengujian ini sebesar 0.377 nm. Nilai absorbansi K+ maupun K- selama penelitian berada di bawah nilai CV, hal ini menandakan bahwa tidak terbentuk antibodi protektif terhadap KHV.
Antibodi terhadap KHV mulai terbentuk pada 7 hpv yaitu pada perlakuan A dan C yang bersinggungan dengan garis CV. Sedangkan pada perlakuan B sudah positif terbentuk antibodi bahkan langsung mencapai puncak tertinggi terbentuknya antibodi. Hal ini diduga karena pengaruh pemberian vaksin dan penambahan
adjuvan pada vaksin. Pembentukan antibodi tersebut dipengaruhi oleh beberapa faktor antara lain suhu, dosis vaksin, cara pemberian vaksin, umur dan bobot ikan serta sifat antigen (Ellis, 1988). Penggunaan adjuvan mampu meningkatkan titer dua kali lebih tinggi dibandingkan tanpa adjuvan (De Jong et al. 2003). Di samping itu adjuvan juga mampu membuat keseimbangan respon antibodi humoral dan antibodi berperantaraan sel (Hunter 2002). Hal tersebut menunjukkan bahwa antigen yang dimasukkan bersifat antigenik karena mampu menginduksi respon imun dengan peningkatan nilai titer antibodi pada perlakuan vaksinasi. Antigen merupakan suatu bahan atau senyawa yang dapat merangsang pembentukan satu jenis atau lebih antibodi. Antigen ini dapat berwujud protein, lemak, dan polisakarida (Wibawan dan Soejoedono, 2013). Romstad et al. (2012) juga menyebutkan bahwa selain konsentrasi antigen, metode preparasi antigen juga menentukan terhadap hasil titer antibodi.
17 kadar hematokrit mencapai puncak tertinggi pada minggu ketiga (21 hpv) yaitu dicapai pada perlakuan B. Dalam kondisi normal, kadar hematokrit darah ikan mas berkisar 32-43,8% (Radu 2009). Sesaat setelah uji tantang, kadar hematokrit mengalami peningkatan lalu mulai menurun hingga akhir masa pemeliharaan. Penurunan kadar hematokrit setelah uji tantang menunjukkan bahwa infeksi KHV yang menyerang ikan sudah cukup serius. Faktor penyebab penurunan hematokrit diduga berkaitan dengan penurunan hemoglobin akibat infeksi KHV. Perubahan jumlah sel darah akan menyebabkan perubahan persentase sel darah dibanding plasma. Penurunan ini terkait dengan hemoragi pada pangkal sirip dan pendarahan di otak. Terdapat korelasi yang kuat antara hematokrit dan jumlah hemoglobin darah, semakin rendah jumlah sel-sel darah merah maka semakin rendah pula kandungan hemoglobin dalam darah.
Lisosim merupakan komponen yang penting dalam sistem pertahanan tubuh terhadap patogen yang masuk. Lisosim pada ikan dapat dideteksi dari serum, mukus, plasma, dan organ ikan seperti insang dan hati. Gambar 3 menunjukkan secara umum aktivitas lisosim cenderung meningkat setelah vaksinasi dan cenderung turun setelah uji tantang. Perlakuan vaksinasi mampu meningkatkan aktivitas lisosim dan berbeda nyata (p<0,05) dengan kontrol. Hal yang sama terjadi pada ikan nila yang diinjeksi vaksin bivalen ECP Streptococcus agalactiae (Sugiani, 2012). Peningkatan aktivitas lisosim juga diperoleh pada ikan nila yang diinjeksi ECP Pseudomonas fluorescens (Attia et al. 2012). Menurut Saurabh dan Sahoo (2008) lisozim merupakan hidrolase yang terdistribusi, dan berperan penting dalam sistem pertahanan-biologis. Enzim ini memiliki antivirus, antibakteri, dan sifat anti-inflamasi. Selain itu peningkatan aktivitas lisozim berkaitan erat dengan faktor humoral yang dapat meningkatkan aktivitas fagositosis pada ikan (Veersamy et al. 2014).
Pada kontrol positif (K+) sangat jelas terlihat penurunan aktivitas lisosim setelah uji tantang. Lisosim pada ikan merupakan indikator non spesifik respon terhadap invasi antigen yang masuk karena respon imun non spesifik merupakan pertahanan lapis pertama yang sangat penting pada ikan untuk melawan patogen yang masuk (Saurabh dan Sahoo, 2008). Lisosim dapat meningkatkan aktivitas fagositosis yaitu sebagai opsonin atau secara langsung mengaktifkan neutrofil dan makrofag. Penurunan aktivitas fagositosis yang dilakukan oleh makrofag dapat disebabkan adanya aktivitas immunosupresif. Aktivitas makrofag dapat menentukan suatu obat yang diberikan bersifat immunoenhancer atau
immunosupressor (Bhagwat et al. 2010).
Pada proses respiratory burst (RB) dihasilkan radical oxygen species (ROS) seperti superoxide (O2-), hidrogen peroksida (H2O2), dan hipoklorit (OCl-). ROS
18
tidak divaksin tetapi diuji tantang sehingga pertahanan tubuh ikan kontrol positif tidak sebaik kontrol negatif apalagi perlakuan vaksinasi. Ikan mempunyai mekanisme membunuh sel-sel fagosit melalui oksigen bebas dalam vakuola lisosom.
Ikan koi yang divaksinasi dengan penambahan CFA (perlakuan B) setelah diuji tantang menunjukkan nilai NBT yang lebih tinggi dibanding perlakuan lain dan kontrol. Diduga pemberian vaksin+CFA pada ikan koi mampu meningkatkan kemampuan sel fagosit dalam melawan antigen. Nilai NBT tertinggi dicapai dua minggu setelah uji tantang (35 hpv) pada perlakuan B. Hal ini sesuai dengan penelitian Anderson, 2004 yang menyebutkan bahwa uji NBT dapat digunakan untuk melihat respon imun non-spesifik setelah aplikasi imunostimulan dan vaksin. Peningkatan NBT dapat mengindikasikan bahwa perlakuan penyuntikan vaksin telah efektif merangsang sistem kekebalan tubuh ikan (Anderson, 2004).
4
SIMPULAN DAN SARAN
Simpulan
Aplikasi vaksin inaktif yang mengandung 0,1% formalin dengan penambahan Complete Freund’s Adjuvant melalui metode suntik dengan volume larutan vaksin yang disuntikkan 0,1 mL per ikan pada 104.58 TCID50/mL menunjukkan hasil yang
optimal dalam meningkatkan respon imunitas ikan koi terhadap infeksi KHV (10.38±1.25 g). Hal ini didukung dengan nilai kelangsungan hidup, kelangsungan hidup relatif dan titer antibodi yang tinggi. Selain itu adanya peningkatan kadar hematokrit, aktivitas lisosim dan aktivitas RB.
Saran
19
DAFTAR PUSTAKA
Amend DF. 1981. Potency testing of fish vaccines. Developments in Biological Standardization. 49:447-454.
Anderson DP. 1974. Fish immunology. Hongkong: TFH Publication Ltd. pp 182 Anderson DP, Siwicki AK. 1995. Basic Hematology and Serology for Fish Health
Programs. Di dalam : Shariff M, Arthur JR, Subasinghe RP, editor. Fish Health Section. Asia Fisheries society (eds), Disease in Asian Aquaculture II. Manila, Philippines. 185-202.
Anderson DP. 2004. Immunostimulants, vaccines and environmental stressor in aquaculture; NBT assay to show neutrofil activity by these immunodulators. In Suarez, C. et al. (Eds.), Avances en acuicola VII. Memorias del Simposium International de Nutricion Acuicola. Sonora Mexico, 16-19 November 2004. Antychowicz J, Matras M, Bergmann SM, Haenen O. 2005. Epidemiology, Pathogenicity and Molecular Biology of Koi Herpesvirus Isolated in Poland.
Veterinary Research. 40: 367-373.
Attia A, Mesalhy S, Galil YA & Fathi M. 2012. Effect of injection vaccination against Pseudomonas fluorescent on specific and non-specific immune response of nile tilapia (Oreochromis niloticus) using different prepared antigens. DOI:10.4172/scientificreports.552. Scientific Reports. 1(12) 1-7. Aucouturier J, Dupuis L, Ganne V. 2001. Adjuvants designed for veterinary and
human vaccines. Vaccine. 19: 2666-2672.
Bhagwat DP, Kharya MD, Bani S, Kaul A, Kour K, Chauhan PS, Suri KA, dan Satti NK. 2010. Immunosuppressive properties of Pluchea lanceolata leaves.
Indian Journal of Pharmacology. 42 (1): 21 – 26.
De Jong JC, Palache AM, Beyer WE, Rimmelzwaan GF, Boon AC, Osterhaus ADME. 2003. Haemagglutination- inhibiting antibody to influenza virus.
Developmental Biology. 115:63-73.
Dishon A, Davidovich M, Ilouze M, Kotler M. 2005. Persistence of Cyprinid Herpesvirus 3 in Infected Cultured Carp Cells. Journal of Virology. 81: 4828-4836.
Ellis AE. 1988. General principles of fish vaccination. In: Ellis A-E (ed) Fish Vaccination. Academic Press. London. hlm 1-19.
Ellis AE. 1988. Current aspects of fish vaccination. Disease of Aquatic Organisms. 4: 159 – 164
Galli G, Hancock K, Hoschler K, DeVos J, Praus M, Bardelli M, Malzone C, Castellino F, Gentile C, McNally T, Del Giudice G, Banzhoff A, Brauer V, Montomoli E, Zambon M, Katz J, Nicholson K, Stephenson I. 2009. Fast rise of broadly cross-reactive antibodies after boosting long-lived human memory B cells primed by an MF59 adjuvanted prepandemic vaccine. Proceeding of the National Academy of Sciences. 106:7962-7967.
20
Gilad O, Yun S, Andree K, Adkison M, Zlotkin A, Bercovier H, Eldar A, Hedrick R. 2002. Initial Characteristics of Koi Herpes Virus and Development of a PCR Assay to Detect the Virus in Koi. Journal Disease of Aquatic Organisms. 48 : 101-108.
Hedrick RP, Gilad O, Yun S, Spangenberg JV, Marty GD, Nordhausen RW, Kebus MJ, Bercovier H, Eldar A. 2000. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp. Journal of Aquatic Animal Health. 12:44-57.
Hedrick RP, Gilad O, Yun SC, McDowell TS, Waltzek TB, Kelley GO, Adkison MA. 2004. Initial Isolation and Characterization of Herpes-like Virus (KHV) from Koi and Common carp. In: The International Symposium on Koi Herpesvirus Disease-Strategy for Koi Herpesvirus Disease Control, Yokohama, Japan.
Hunter RL. 2002. Overview of vaccine adjuvants: Present and future. Vaccine. 20:7-12.
Ilouze M, Dishon A, Kahan T, Kotler M. 2006. Cyprinid Herpes Virus-3 (CyHV-3) Bears Genes of Genetically Distant Large DNA Viruses. FEBS Letters. 580: 4473-4478.
Iwama G, Nakanishi T. 1996. The Fish Immune System, Organism, Pathogen and Environment. Academic Press. USA. 380 hlm.
Kafilzadeh R, Mousavi SM, dan Baboli MJ. 2013. Effects of Saccharomyces cerevisiae (Saccharomycetes: Saccharomycetaceae) on Astronotus ocellatus
as growth promoter and immuno stimulant. AACL Bioflux. 6 (6): 587 – 598. Kuby. 2007. Immunology. 6th ed. W.H. Freeman and Company. New York (US).
574 pp.
Levinson W dan Jawetz E. 2000. Medical Microbiology and Immunology Examination and Board Review. Sixth Edition. The McGraw Hill Co. Amerika Serikat. Halaman : 271-277. 388.
Lio-Po, GD. 2011. Recent Development in The Study and Surveillance of Koi Herpesvirus (KHV) in Asia. In: MG Bondad-Reantaso, JB Jones, F Corsin, and T Aoki (eds.). Disease in Asian Aquaculture VII. Fish Health Section, Asian Fisheries Society, Selangor, Malaysia.
Melba, GBR. 2004. Trans-boundary Aquatic Animal Diseases: Focus on Koi Herpes virus (KHV). Aquaculture Asia. 9: 24-28.
Michel B, Guillaume F, François L, Bérénice C, and Alain V. 2010. Cyprinid Herpesvirus 3. Emerging Infectious Diseases. 16: 1835-1843.
Nakajima K, Maeno Y, Honda A, Yokoyama K, Tooriyama T, Manabe S. 1999. Effectiveness of a vaccine against red sea bream iridoviral disease in a field trial test. Disease of Aquatic Organisms. 36: 73 – 75.
[OIE] Office International Des Epizooties. 2012. Manual of Diagnostic Tests for Aquatic Animals. Paris (FR): Office International Des Epizooties.
Perelberg A, Smirnov M, Hutoran M, Diamant A, Bejerano T, Kotler M. 2003. Epidemiological Description of New Viral Desease Afflicting Cultured
Cyprinus carpio in Israel. Israeli Journal of Aquaculture. 55: 5-12.
21 Reed LJ, Muench H. 1938. A simple method of estimating fifty percent endpoints.
American Journal of Hygiene. 27: 493-497.
Romstad AB, Reitan LJ, Midtlyng P, Gravningen K & Evensen O. 2012. Development of an antibody ELISA for potency testing of furunculosis (Aeromonas salmonicida subsp. salmonicida) vaccines in Atlantic salmon (Salmo salar L). Biologicals. 40: 67-71.
Ronen A, Perelberg A, Abramowitz J, Hutoran M, Tinman S, Bejerano I, Steinitz M, Kotler M. 2003. Efficient Vaccine against The Virus Causing A Lethal Disease in Cultured Cyprinus carpio. Vaccine. 21: 4677-4684.
Saurabh S dan Sahoo PK. 2008. Lysozyme: an important defence molecule of fish innate immune system. Aquaculture research. 39: 223-239.
Stephenson I, Nicholson KG, Colegate A, Podda A, Wood J, Yoma E, Zambon M. 2002. Boosting immunity to influenza H5N1 with MF59-adjuvanted H5N3A/Duck/Singapore/97 vaccine in a primed human population.
Vaccine. 21:1687-1693.
Sugiani D. 2012. Vaksin bivalent untuk pencegahan penyakit motile aeromonas septicemia dan streptococcosis pada ikan nila (Oreochromis niloticus). Disertasi. Institut Pertanian Bogor. Bogor (ID).
Sukenda, Wakabayashi H. 2002. Use of an indirect enzyme-linked immunosorbent assay (ELISA) to detect antibodies in ayu (Plecogiossus altivelis) vaccinated by immersion administration. Jurnal Akuakultur Indonesia. 1(1): 27 – 30. Sunarto A, Rukyani A, Itami T. 2005. Indonesian Experience on the Outbreak of
Koi Herpesvirus in Koi and Carp (Cyprinus caprio). Bulletin Fisheries Research Agency Suplement. 2: 15-21.
Thomas BW, Garry OK, David MS, Keith W, Larry H, Hideo F, Ikuo H, Takashi A, Andrew JD, Ronald PH. 2005. Koi Herpesvirus Represents A Third Cyprinid Herpesvirus (CyHV-3) in The Family Herpesviridae. General Virology. 86: 1659-1667.
Veersamy R, Min LS, Mohanraj, Pauline R, Sivadasan S, Varghese C, Rajak H, dan Marimuthu K. 2014. Effect of aqueous extract of Polygonum minus leaf on the immunity and survival of African catfish (Clarias gariepinus). Journal of Coastlife Medicine. 2 (3): 209 – 213.
Wibawan, IWT & Soejoedono, RD. 2013. Intisari imunologi medis. Fakultas Kedokteran Hewan IPB. Bogor (ID). 157 pp.
Yasumoto S, Kuzuya Y, Yoshimura Y, Miyazaki T. 2006. Oral immunization of common carp with a liposome vaccine fusing Koi Herpesvirus antigen. Fish Pathology. 41: 141-145.
22
23
Lampiran 1. Data hasil pengamatan efek sitopatik pada sel KF-1 yang diinokulasi dengan virus KHV BJMN-2 setelah inkubasi 14 hari
Pengenceran Virus
Ulangan
1 2 3 4 5 6 7 8 9 10 11 12
Virus stok +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
10-1 +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++ +++
10-2 +++ +++ ++ + - +++ - +++ - ++ + +
10-3 +++ - +++ ++ ++ ++ +++ - +++ - - +++
10-4 - - - - +++ - - - - - - -
10-5 - - - - - - - - - - - -
10-6 - - - - - - - - - - - -
Sel kontrol - - - -
Keterangan : +++ = CPE > 70% ++ = 30 ≤ CPE ≥ 70% + = CPE < 30%
24
Lampiran 2. Mikroskopis efek sitopatik hasil pengamatan dengan mikroskop
inverted Olympus BX-41 pada sumur pelat
25 Lampiran 3. Kalkulasi TCID50 berdasarkan hasil pengamatan efek sitopatik
mengacu kepada Reed dan Muench (1938) Penghitungan :
10-3 = 8/12 = 2/3 = 66,7
10-4 = 1/12 = 8,33 Masuk ke rumus
= ( % positif pengenceran di atas % − % positif di bawah %)% − % positif pengenceran di bawah %
= 0− ,33, − ,33
= ,
− , = , ↔ Antilog 3,2862 = 1932,86 (20)
= 38657,2 Log 38657,2= 4,58 TCID50= 104,58
Lampiran 4. Garis presipitasi yang terbentuk pada Agar Gell Precipitation Test
(AGPT) untuk menentukan perbandingan volume adjuvan dengan vaksin
Keterangan : sampel antigen yaitu berupa virus KHV (Ag); perbandingan adjuvan 6,25; perbandingan adjuvan 12,5; perbandingan adjuvan 25
26
RIWAYAT HIDUP
Penulis dilahirkan di Padang pada tanggal 18 November 1980 sebagai anak kelima dari tujuh bersaudara pasangan Hikmatul Maula dan Soekono. Pendidikan Sekolah Menengah Tingkat Atas ditempuh di SMU Negeri 5 Yogyakarta pada tahun 1996 dan lulus pada tahun 1999. Pendidikan sarjana ditempuh di Jurusan Budidaya Perairan, Fakultas Pertanian Universitas Gajah Mada pada tahun 2000 dan lulus pada tahun 2004. Kesempatan untuk melanjutkan ke Program Magister pada Program Studi Ilmu Akuakultur IPB diperoleh dari program beasiswa KKP pada tahun 2013.
Penulis bekerja sebagai Peneliti Muda di Badan Penelitian dan Pengembangan Kelautan dan Perikanan, Kementerian Kelautan dan Perikanan sejak tahun 2008, ditempatkan di Balai Penelitian dan Pengembangan Budidaya Ikan Hias, Depok sebagai peneliti bidang kesehatan ikan.