PENGGUNAAN JAMUR ENDOFIT DARI TERONG BELANDA
(Solanum betacea) UNTUK MENGENDALIKAN
Fusarium oxysporum f.sp. capsici DAN Alternaria solani
SECARA IN VITRO
SKRIPSI
OLEH :
AMALIA TRI KURNIA 090301158
AGROEKOTEKNOLOGI - HPT
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
PENGGUNAAN JAMUR ENDOFIT DARI TERONG BELANDA
(Solanum betacea) UNTUK MENGENDALIKAN
Fusarium oxysporum f.sp. capsici DAN Alternaria solani
SECARA IN VITRO
SKRIPSI
OLEH :
AMALIA TRI KURNIA 090301158
AGROEKOTEKNOLOGI - HPT
Skripsi sebagai salah satu syarat untuk memperoleh Gelar sarjana di Fakutas Pertanian
Universitas Sumatera Utara
PROGRAM STUDI AGROEKOTEKNOLOGI
FAKULTAS PERTANIAN
Judul Skripsi :Penggunaan jamur endofit dari terong belanda (solanum betacea) untuk mengendalikan
Fusarium oxysporum f.sp. capsici dan Alternari solani secara in vitro
Nama : Amalia Tri Kurnia
NIM : 090301158
Program Studi : Agroekoteknologi
Minat Studi : Hama dan Penyakit Tumbuhan
Disetujui Oleh Komisi Pembimbing
Ir. Mukhtar Iskandar Pinem, M. Agr Ir. Syahrial Oemry, M. S
Ketua Anggota
Mengetahui,
ABSTRAK
Amalia Tri Kurnia. Penggunaan jamur endofit dari terong belanda (Solanum betacea) untuk mengendalikan Fusarium oxysporum f.sp. capsici dan
Alternaria solani secara in vitro, dibawah bimbingan Mukhtar Iskandar Pinem dan Syahrial Oemry. Penelitian ini bertujuan untuk mengetahui efektifitas jamur endofit dalam mengendalikan Fusarium oxysporum f.sp. capsici pada tanaman cabai dan
Alternaria solani pada tanaman tomat. Penelitian dilakukan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian USU pada Mei 2013 - Januari 2014, menggunakan Rancangan Acak Lengkap Faktorial, dengan 2 faktor perlakuan dalam 2 ulangan. Faktor pertama yakni jenis patogen (Fusarium oxysporum f.sp. capsici
dan Alternaria solani). Faktor kedua jenis endofit (E1, E2, E3, E4, E5, E6, E7, E8, E9, E10, E11, E12, E13, E14, E15). Hasil penelitian menunjukkan jenis patogen, jenis endofit serta interaksi keduanya berpengaruh sangat nyata terhadap daerah hambatan, luas pertumbuhan koloni, diameter koloni. Hasil terbaik ditunjukkan pada E6 untuk mengendalikan patogen F. oxysporum dan A. solani dengan daerah hambatan 56.89% dan 54.10%.
ABSTRACT
Amalia Tri Kurnia. Using of endophytic fungi from Solanum betacea to control Fusarium oxysporum f.sp. capsici and Alternaria solani in vitro, supervised by Mukhtar Iskandar Pinem dan Syahrial Oemry. This research aimed to know
efectivity of endophytic fungi from Solanum betacea to control Fusarium oxysporum f.sp. capsici and Alternaria solani in vitro. This research
was conducted on Plant Disease Laboratory of Fakultas Pertanian USU on May 2013 until January 2014, used Randomized Complete Design with two factor in 2 replicate. First factor was kind of pathogen (Fusarium oxysporum f.sp. capsici and Alternaria solani). Second factor was kind of endophytic (E1, E2, E3, E4, E5, E6, E7, E8, E9, E10, E11, E12, E13, E14, E15). The result of this research showed that kind of phatogen, kind of endophytic and interaction between them so significantly effect on inhibiting zone, growth width of colony and diameter of colony. The best result was showed on E6 to control F. oxysporum and A. solani with 56.89% and 54.10 % inhibiting zone.
RIWAYAT HIDUP
Amalia Tri Kurnia, dilahirkan di Medan, Sumatera Utara, pada tanggal 12 Mei 1991 dari Ayah Syafruddin dan Ibu Anita Rahman. Penulis merupakan
putri ketiga dari lima bersaudara.
Tahun 2009 penulis lulus dari SMA Swasta Sutomo 1, Medan dan pada tahun yang sama masuk ke Fakultas Pertanian USU melalui jalur ujian tertulis SNMPTN. Penulis memilih program studi Agroekoteknologi.
Selama mengikuti perkuliahan, penulis aktif sebagai asisten praktikum di Laboratorium Agroklimatologi dan Ekologi Tanaman.
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan sebaik-baiknya.
Adapun judul dari skripsi ini adalah ” Penggunaan Jamur Endofit Dari
Terong Belanda (Solanum betacea) untuk Mengendalikan
Fusarium oxysporum f.sp. capsici dan Alternari solani Secara In Vitro” merupakan salah satu syarat untuk memperoleh gelar sarjana di Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Ir. Mukhtar Iskandar Pinem, M. Agr selaku ketua pembimbing dan Ir. Syahrial Oemry, M. S selaku anggota pembimbing yang telah memberikan
bimbingan dan arahan kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan terima kasih dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, Maret 2014
DAFTAR ISI
Hal. j
ABSTRAK ... i
ABSTRACT ... ii
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... v
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Hipotesa Penelitian ... 4
Tujuan Penelitian ... 4
Kegunaan Penelitian ... 4
TINJAUAN PUSTAKA Biologi Fusarium oxysporum f.sp. capsici... 5
Gejala Serangan ... 6
Faktor yang mempengaruhi Penyakit ... 7
Pengendalian Penyakit ... 8
Biologi Alternaria solani ... 9
Gejala Serangan ... 11
Faktor yang mempengaruhi Penyakit ... 12
Pengendalian Penyakit ... 13
Jamur Endofit ... 14
BAHAN DAN METODE Tempat dan Waktu Penelitian ... 15
Bahan dan Alat ... 15
Metode Penelitian ... 15
Pelaksanaan Penelitian ... 17
Isolasi Patogen penyebab penyakit ... 18
Eksplorasi Jamur Endofit dari tanaman terong belanda ... ………. 18
Uji Antagonisme Jamur endofit Terhadap Patogen di Laboratorium ... 19
Peubah Amatan ... 19
Persentase Daerah hambatan (Inhibiting Zone) ... 19
Diamtere Koloni ... 20
Luas Pertumbuhan Koloni ... 20
HASIL DAN PEMBAHASAN
Daerah Hambatan (Inhibiting Zone) ...21
Diameter koloni (cm) ...28
Luas Pertumbuhan Koloni (cm2) ...33
Bentuk Interaksi Endofit dan F.oxysporum...38
Bentuk Interaksi Endofit dan A.solani ...39
KESIMPULAN DAN SARAN Kesimpulan ...42
Saran ...42 DAFTAR PUSTAKA
DAFTAR TABEL
No. Hal.
1 Rataan daerah hambatan (%) pada beberapa jenis endofit dan
jenis patogen
21
2 Rataan diameter koloni (cm) pada beberapa jenis endofit dan jenis patogen
29
3 Rataan luas pertumbuhan koloni (cm2) pada beberapa jenis endofit dan jenis patogen
DAFTAR GAMBAR
No. Hal.
1 F. Oxysporum (A) Mikrokonidia, (B). Makrokonidia, (C). klamidospora (1000x)
6
2 Gejala Layu Fusarium Pada Tanaman Cabai 8
3 A. solani (A) Hifa, (B). Konidia 10
4 Gejala Serangan A. Solani 11
5 Uji Antagonisme Jamur Endofit Terhadap patogen 19
6 Uji interaksi jamur endofit terhadap patogen 19
7 Hubungan persentase daerah hambatan 7 hsi pada beberapa jenis endofit
25
8 Hubungan persentase daerah hambatan 7 hsi pada beberapa jenis patogen
25
9 Pengujian inhibiting zone (A) E6, (B) E3, (C) E4, (D) E5, (E) E10, (F) E9, (G) E12, (H) E11, (I) E15, (J) E1, (K) E14, (L) E7, (M) E8, (N) E13, (O) E2. (Keterangan: a. Jamur endofit, b. F. oxysporum
27
10 Pengujian inhibiting zone (A) E6, (B) E3, (C) E5, (D) E9, (E) E4, (F) E14, (G) E15, (H) E11, (I) E1, (J) E13, (K) E8, (L) E12, (M) E2, (N)E7, (O) E10. (Keterangan: a. Jamur endofit, b. A.solani)
28
11 Hubungan diameter koloni 7 hsi pada beberapa jenis endofit 32 12 Hubungan diameter koloni 7 hsi pada beberapa jenis patogen 32
13 Hubungan luas pertumbuhan koloni 7 hsi pada beberapa jenis endofit 37 14 Hubungan luas pertumbuhan koloni 7 hsi pada beberapa jenis patogen 37
15 Interaksi anatar jamur endofit dan F. Oxysporum. (A) dan (B) hifa
patogen berwarna transparan (400x) . (C) hifa patogen menjadi
mengeriting (400x). (D) hifa endofit melilit hifa patogen (400x). (E) hifa endofit menjerat hifa patogen (400x).
38
16 Interaksi antara jamur endofit dan A. solani. (A) hifa endofit melilit hifa patogen (400x), (B) dan (C) hifa endofit mengkait hifa
patogen (400x). (D) dan (E) hifa patogen berwarna transparan (400x). (F) hifa patogen mengeriting (400x). (G) hifa patogen patah-patah (400x). (H) hifa endofit masuk dan menembus hifa patogen (400x).
DAFTAR LAMPIRAN
No. Hal.
1 Bagan penelitian ... 49
2 Data pengamatan daerah hambatan 1 hsi (%) ... 51
3 Data pengamatan daerah hambatan 2 hsi (%) ... 52
4 Data pengamatan daerah hambatan 3 hsi (%) ... 54
5 Data pengamatan daerah hambatan 4 hsi (%) ... 56
6 Data pengamatan daerah hambatan 5 hsi (%) ... 58
7 Data data pengamatan daerah hambatan 6 hsi (%) ... 60
8 Data pengamatan daerah hambatan 7 hsi (%) ... 62
9 Data pengamatan panjang diameter koloni 1 hsi (cm) ... 64
10 Data pengamatan panjang diameter koloni 2 hsi (cm) ... 66
11 Data pengamatan panjang diameter koloni 3 hsi (cm)……… 68
12 Data pengamatan panjang diameter koloni 4 hsi (cm)……… 70
13 Data pengamatan panjang diameter koloni 5 hsi (cm)...……… 72
14 Data pengamatan panjang diameter koloni 6 hsi (cm) ... 74
15 Data pengamatan panjang diameter koloni 7 hsi (cm) ... 76
16 Data pengamatan luas pertumbuhan koloni 1 hsi (cm2) ... 78
17 Data pengamatan luas pertumbuhan koloni 2 hsi (cm2) ... 80
18 Data pengamatan luas pertumbuhan koloni 3 hsi (cm2) ... 82
19 Datapengamatan luas pertumbuhan koloni 4 hsi (cm2) ... 84
20 Data pengamatan luas pertumbuhan koloni 5 hsi (cm2) ... 86
22 Data pengamatan luas pertumbuhan koloni 7 hsi (cm2) ... 89
ABSTRAK
Amalia Tri Kurnia. Penggunaan jamur endofit dari terong belanda (Solanum betacea) untuk mengendalikan Fusarium oxysporum f.sp. capsici dan
Alternaria solani secara in vitro, dibawah bimbingan Mukhtar Iskandar Pinem dan Syahrial Oemry. Penelitian ini bertujuan untuk mengetahui efektifitas jamur endofit dalam mengendalikan Fusarium oxysporum f.sp. capsici pada tanaman cabai dan
Alternaria solani pada tanaman tomat. Penelitian dilakukan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian USU pada Mei 2013 - Januari 2014, menggunakan Rancangan Acak Lengkap Faktorial, dengan 2 faktor perlakuan dalam 2 ulangan. Faktor pertama yakni jenis patogen (Fusarium oxysporum f.sp. capsici
dan Alternaria solani). Faktor kedua jenis endofit (E1, E2, E3, E4, E5, E6, E7, E8, E9, E10, E11, E12, E13, E14, E15). Hasil penelitian menunjukkan jenis patogen, jenis endofit serta interaksi keduanya berpengaruh sangat nyata terhadap daerah hambatan, luas pertumbuhan koloni, diameter koloni. Hasil terbaik ditunjukkan pada E6 untuk mengendalikan patogen F. oxysporum dan A. solani dengan daerah hambatan 56.89% dan 54.10%.
ABSTRACT
Amalia Tri Kurnia. Using of endophytic fungi from Solanum betacea to control Fusarium oxysporum f.sp. capsici and Alternaria solani in vitro, supervised by Mukhtar Iskandar Pinem dan Syahrial Oemry. This research aimed to know
efectivity of endophytic fungi from Solanum betacea to control Fusarium oxysporum f.sp. capsici and Alternaria solani in vitro. This research
was conducted on Plant Disease Laboratory of Fakultas Pertanian USU on May 2013 until January 2014, used Randomized Complete Design with two factor in 2 replicate. First factor was kind of pathogen (Fusarium oxysporum f.sp. capsici and Alternaria solani). Second factor was kind of endophytic (E1, E2, E3, E4, E5, E6, E7, E8, E9, E10, E11, E12, E13, E14, E15). The result of this research showed that kind of phatogen, kind of endophytic and interaction between them so significantly effect on inhibiting zone, growth width of colony and diameter of colony. The best result was showed on E6 to control F. oxysporum and A. solani with 56.89% and 54.10 % inhibiting zone.
PENDAHULUAN
Latar Belakang
Cabai merupakan tanaman perdu dari famili terung-terungan (solanaceae). Keluarga ini diduga memiliki sekitar 90 genus dan sekitar 2.000 spesies yang terdiri dari tumbuhan herba, semak, dan tumbuhan kerdil lainnya. Dari banyaknya spesies tersebut, hampir dapat dikatakan sebagian besar merupakan tumbuhan negeri tropis. Namun yang dapat dimanfaatkan hanya beberapa spesies saja. Di antaranya adalah kentang (Solanum tuberosum), cabai (Capsicum annum), tomat (Lycopersicum esculentum) dan tembakau (Nicotiana tabacum) (Sinaga, 2011).
Cabai (Capsicum annum L.) merupakan komoditas yang memiliki nilai ekonomi yang tinggi di Indonesia dan diusahakan secara komersial baik dalam skala besar maupun kecil. Daerah- daerah sentra pertanaman cabai di Indonesia tersebar mulai dari Sumatera Utara sampai Sulawesi Selatan dengan rata-rata total
produksi cabai di sentra pertanaman berkisar 841.015 ton per tahun (Winarsih dan Syafrudin, 2001).
Budidaya tanaman cabai mempunyai resiko tinggi akibat serangan organisme pengganggu tanaman (OPT) yang dapat menyebabkan kegagalan panen (Asian Vegetable Research and Development Center, 1990 dalam Syamsuddim 2003). Penyakit yang umum dijumpai pada pertanaman cabai adalah
Colletotrichum capsici, C. gloeosporium, Cercospora capsici, Fusarium oxysporum, Sclerotium rolfsii dan Pseudomonas capsici. Cendawan Fusarium
tanaman cabai mulai dari masa perkecambahan sampai dewasa. Meskipun dikenal sebagai patogen tular tanah, infeksi cendawan ini tidak hanya diperakaran tetapi dapat menginfeksi organ lain seperti batang, daun, bunga dan buah, misalnya melalui luka (Mukarlina dkk, 2010).
Tomat adalah salah satu famili solanaceae dan merupakan salah satu sayuran yang paling banyak ditanam didunia. Ada beberapa penyakit tomat yang
disebabkan oleh jamur, bakteri, virus, nematode dan faktor abiotik (Balanchard, 1992). Penyakit bercak daun yang disebabkan oleh Alternaria solani
(Ellis and Martin) adalah salah satu penyakit yang paling merugikan di dunia. Organisme penyebab adalah patogen tular udara yang menyebabkan bercak didaun, busuk batang dan busuk buah tomat (Arunakumara, 2006).
Bercak daun adalah penyakit yang secara signifikan mempengaruhi tanaman tomat dan tanaman famili solanaceae lainnya baik dalam budidaya konvensional atau organik. Penyakit sering terjadi dimana pun tanaman tomat tumbuh yang mengakibatkan kerugian besar dalam hasil produksinya. Agen etiologi adalah jamur Alternaria solani (Ellis and Martin) (Carneiro dkk, 2010).
Selama ini pengendalian Organisme Pengganggu Tanaman (OPT) yang dilakukan selalu berlebihan atau dengan menggunakan pestisida kimia, apabila hal tersebut dilakukan maka akan berdampak negatif dan juga menjadikan lingkungan menjadi rusak. Oleh karena itu perhatian pada alternatif pengendalian yang ramah lingkungan semakin dibutuhkan untuk mengurangi penggunaan pestisida sintetis (Krisnawan, 2012).
dalam jaringan tumbuhan tanpa menimbulkan gejala penyakit pada tumbuhan inangnya. Hubungan antara mikroba endofit dan tumbuhan inangnya merupakan suatu bentuk hubungan simbiosis mutualisme yaitu sebuah bentuk hubungan yang saling menguntungkan. Mikroba endofit dapat memperoleh nutrisi untuk melengkapi siklus hidupnya dari tumbuhan inangnya, sebaliknya tumbuhan inang memperoleh proteksi terhadap patogen tumbuhan dari senyawa yang dihasilkan mikroba endofit (Haniah, 2008).
Jamur endofit menghasilkan alkoloid dan mikotoxin lainnya sehingga memungkinkan digunakan untuk meningkatkan ketahanan tanaman terhadap penyakit (Petrini, 1993). Jamur endofit menghasilkan senyawa aktif biologis secara
in-vitro antara lain alkaloid, paxillin, lolitrems dan tetranone steroid (Sudantha dan Abadi, 2007).
Berdasarkan hal di atas maka dirasa perlu dilakukan percobaan menggunakan jamur endofit untuk mengendalikan patogen dari beberapa tanaman famili Solanaceae untuk mengurangi pengendalian yang selama ini masih menggunakan pengendalian secara kimiawi.
Hipotesa Penelitian
Ada pengaruh jenis jamur endofit, jenis patogen serta interaksi keduanya terhadap pengendalian Fusarium oxysporum f.sp. capsici pada tanaman cabai dan
Alternaria solani pada tanaman tomat secara in vitro. Tujuan Penelitian
Kegunaan Penelitian
TINJAUAN PUSTAKA
1. Biologi Fusarium oxysporum f.sp capsici
Menurut Agrios (1996), penyakit layu Fusarium dapat diklasifikasikan sebagai berikut:
Kingdom : Fungi Divisio : Mycota
Sub divisio : Deuteromycotina Class : Deuteromycetes Ordo : Moniliales Family : Tuberculariaceae Genus : Fusarium
Spesies : Fusarium oxysporum
Fusarium sp. menghasilkan 3 jenis spora. Mikrokonidia tidak berwarna, bersel tunggal, berbentuk bulat dengan panjang 6-15 μm dan berdiameter 3-5 μm. Makrokonidia berbentuk bulan sabit, tidak berwarna, mempunyai 3-5 sekat, masing-masing panjangnya 30-50 μm dan berdiameter 2-5 μm. Klamidospora halus, berbentuk bola, bersel tunggal yang menghasilkan miselium yang tua dan rata-rata berdiameter 10 μm. Ketiga jenis spora tersebut merupakan patogen tular tanah yang akan menginfeksi tanaman. Setelah mengadakan infeksi, tanaman akan mati kemudian jamur dan spora tersebut akan tetap berada di dalam tanah dimana
jamur dapat bertahan pada jangka waktu yang tidak terbatas (Sinaga, 2011).
tingkat yang telah lanjut. Konidiofor bercabang-cabang rata-rata mempunyai panjang 70μm. Cabang-cabang samping biasanya bersel satu, panjangnya sampai
14 μm. Konidium terbentuk pada ujung cabang utama atau cabang samping.
(Djaenuddin, 2011).
Koloni pada media OA (Oat Agar) atau PDA (25˚C) mencapai diameter 3,5 - 5,0 cm. Miselia aerial tampak jarang atau banyak seperti kapas, kemudian menjadi seperti beludru, berwarna putih atau salem dan biasanya agak keunguan yang tampak lebih kuat dekat permukaan medium. Sporodokia terbentuk hanya pada beberapa strain. Sebaliknya koloni berwarna kekuningan hingga keunguan.
Konidiofor dapat bercabang dapat tidak, dan membawa monofialid (Kirnando, 2011).
Gambar 1. F. oxysporum
(a.. Mikrokonidia, b. Makrokonidia, c. klamidospora (1000x))
Fusarium spp. dapat bertahan di dalam tanah dari lingkungan yang tidak menguntungkan dengan cara membentuk klamidiospora. Klamidiospora bersel tunggal yang memiliki dinding tebal, zat warna pada dinding tubuhnya dan lemak yang merupankan cadangan makanannya. Klamidiospora berkembang langsung dari sel hifa atau dari untaian konidia yang perkecambahannya tidak terjadi (Pohan, 2003).
Gejala Serangan
Patogen menyerang jaringan empulur batang melalui akar yang luka atau terinfeksi. Batang yang terserang akan kehilangan banyak cairan dan berubah warna menjadi kecokelatan, pada batang kadang-kadang terbentuk akar adventif. Kadang-kadang lapisan luar batang palsu terbelah dari permukaan tanah (Semangun, 1994). Cendawan ini menyerang jaringan pembuluh batang sehingga menyebabkan daun-daunnya menguning. Dengan melubangi batang tanaman yang daunnya tampak menguning layu, akan terlihat jaringan seperti sarang laba-laba yang mengering dan berwarna cokelat. Akibatnya, tanaman sukar berbunga dan
apabila mampu berbunga sukar membentuk buah yang normal (Djaenuddin, 2011).
Tanaman yang terserang tidak akan mampu berbuah atau buahnya tidak terisi. Lamanya waktu antara saat terjadinya infeksi penyakit sampai munculnya gejala penyakit berlangsung kurang lebih 2 bulan. Buah mengering dan tidak merunduk. Namun anakan tampak normal meskipun telah tercemar. Gejala yang paling khas adalah gejala dalam terjadi pada pangkal batang. Bila pangkal batang dibelah membujur tampak garis-garis berwarna cokelat atau merah. Gejala sangat bervariasi tergantung pada keadaan tanaman, dan lingkungan, dan biasanya
serangan tampak pada tanaman berumur 5-10 bulan (Semangun, 2000)
menyebabkan pelayuan daun dengan cara menghambat jaringan angkut xilem dan menghambat perpindahan air (Beckman, 1987).
Gambar 2. Gejala Layu Fusarium Pada Tanaman Cabai Faktor-Faktor yang Mempengaruhi
Cendawan F. oxysporum sangat sesuai pada tanah dengan kisaran pH 4,5-6,0 tumbuh baik pada biakan murni dengan kisaran pH 3,6-8,4 sedangkan
untuk pensporaan, pH optimum sekitar 5,0. Pensporaan yang terjadi pada tanah dengan pH di bawah 7,0 adalah 5-20 kali lebih besar dibandingkan dengan tanah yang mempunyai pH di atas 7. Pada pH di bawah 7, pensporaan terjadi secara melimpah pada semua jenis tanah, tetapi tidak akan terjadi pada pH di bawah 3,6 atau di atas 8,8. Suhu optimum untuk pertumbuhan cendawan F. oxysporum adalah 200 C dan 300 C, maksimum pada 370 C sedangkan optimum untuk pensporaan adalah 200 - 250 C (Djaenuddin, 2011).
Pengendalian
memberikan banyak harapan, namun masih memerlukan banyak penelitian untuk dapat dianjurkan dalam praktek (Sinaga, 2011).
Beberapa ahli telah mengisolasi dan meneliti endofit dari berbagai tanaman. Dari sekitar 300.000 jenis tanaman yang tersebar di muka bumi, masing-masing tanaman mengandung satu atau lebih mikroorganisme endofit yang terdiri dari bakteri dan fungi. Bakteri atau fungi tersebut dapat menghasilkan senyawa metabolit yang dapat berfungsi sebagai antibiotika (antifungi/antibakteri), antivirus, antikanker, antidiabetes, antimalaria, antioksidan, antiimunopressif, antiserangga, zat pengatur tumbuh, dan penghasil enzim-enzim hidrolitik seperti amilase, selulase, xilanase, ligninase, dan kitinase (Zinniel dkk, 2002).
2. Biologi Alternari solani
A. solani merupakan jamur tidak sempurna (imperfect) tanpa tahap seksual. Miselium terdiri dari septa, bercabang, hifa berwarna coklat muda yang lama kelamaan menjadi lebih gelap. Sel sel mengandung 0-14 inti sedangkan sel terminal memiliki 14-36 inti. Konidiosfor berukuran 50-90 x 9 µ m dan berwarna gelap. Konidia berukuran 120-296 x 12-20 µ m, berparuh , muriform,, berwarna gelap dan tunggal (Raziq dan Ishtiaq, 2010).
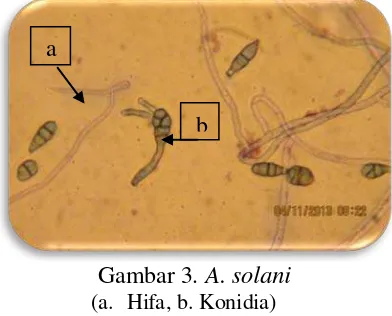
Gambar 3. A. solani
(a. Hifa, b. Konidia)
a
Gejala Serangan
Gejala pertama biasanya muncul pada daun tua berupa bercak kecil, bentuknya tidak beraturan, berwarna coklat gelap. Bercak-bercak konsentrik sering terbentuk sehingga memberikan gejala yang khas. Biasanya terbentuk daerah klorotik (kuning) di sekitar bercak yang merupakan batas dari bagian yang normal. Apabila bercak-bercak tasi dalam jumlah yang banyak maka daun tampak kuning kemudian daun-daun layu dan gugur. (Winarni, 1984).
Patogen dapat menyerang bibit dan tanaman muda. Pada bibit, bercak gelap terbentuk pada daun hipokotil, batang dan daun. Hipokotil dapat mati dan batang yang terserang akan terkulai (Setiawati dkk, 2001).
Gambar 4. Gejala Serangan A. solani
Faktor-faktor yang Mempengaruhi
infeksi oleh A. solani paling cepat dibawah 28-300C dengan kondisi basah. Patogen bertahan antara tanaman di sisa-sisa tanaman dan benih. Spora yang berada di musim sebelumnya didalam tanah, biji atau inang solanaceae dapat berkecambah dan menembus daun langsung atau masuk dari goresan. Setelah
infeksi awal, bercak dapat terlihat dalam waktu dua atau tiga hari
(Pasche dkk, 2004).
inkubasi dibawah lampu neon (λ = 380 -775 ηm) pada suhu 250C atau selama 16 jam penyinaran pada 200C. Namun spectrum cahaya fluorescent mengandung panjang gelombang penghambatan, kususnya panjang gelombang biru (Rodrigues dkk, 2010).
Pengendalian
Langkah-langkah sanitasi yang baik dapat menjaga spora untuk tidak menginfeksi tanaman berikutnya. Pada akhir musim tanam semua sampah tomat harus d buang, kompos (jika tumpukan cukup panas untuk membunuh spora) atau digarap ke dalam tanah. Rotasi tanaman merupakan cara lain untuk membantu mengurangi penyakit pada penanaman tomat. Semua sayuran memiliki maslah penyakit yang sama. Sebuah rotasi minimal tiga tahun dianggap penting untuk membantu mengurangi populasi jamur tular tanah (Wyenandt, 2005).
Pengendalian penyakit tanaman dapat dilakukan dengan menggunakan agens hayati. Agens hayati mikroba lebih aman digunakan karena sedikit kemungkinan merugikan lingkungan dan mempunyai prospek yang baik, sehingga menjadi pilihan alternatif daripada penggunaan pestisida (Kobayashi dkk,2002). Jamur Endofit
beberapa tanaman, misalnya pada tanaman obat dan tanaman budidaya seperti padi (Lingga, 2009).
Hampir semua tanaman berpembuluh memiliki endofit. Fungi endofit hidup dalam jaringan tanaman dan membantu tanaman dalam fiksasi Nitrogen (N2). Sementara itu asosiasi fungi endofit dengan tumbuhan inangnyadigolongkan menjadi dua kelompok, yaitu mutualisme konstitutif dan induktif. Mutualisme konstitutif merupakan asosiasi yang relatif erat hubungannya antara fungi endofit dengan tanaman inang terutama rumput-rumputan. Pada kelompok ini fungi endofit menginfeksi ovula (benih) inang, dan penyebarannya melalui benih serta organ penyerbukan inang. Mutualisme induktif merupakan asosiasi antara mikroorganisme endofit dengan tumbuhan inang yang penyebarannya terjadi secara bebas melalui udara dan air. Jenis ini hanya berasosiasi dalam bagian vegetatif inang dan sering berada dalam keadaan tidak aktif dalam periode cukup lama dan membentuk biomassa yang kecil (Siadari, 2010).
Beberapa ahli telah mengisolasi dan meneliti endofit dari berbagai tanaman diantaranya; tanaman obat (Tan dan Zou, 2001), tanaman perkebunan
(Zinniel dkk, 2002), dan tanaman-tanaman hutan (Strobel, 2002; Suryanarayanan dkk, 2003). Dari sekitar 300.000 jenis tanaman yang tersebar di
penghasil enzim-enzim hidrolitik seperti amilase, selulase, xilanase, ligninase, kitinase (Maysarah, 2009).
Penelitian Brunner dan Petrini (1992) yang melakukan seleksi pada lebih dari 80 spora fungi endofit, hasilnya menunjukkan bahwa 75 % fungi endofit mampu menghasilkan antibiotika. Fungi endofit Xylotropik, suatu kelompok fungi yang berasosiasi dengan tumbuhan berkayu, juga merupakan penghasil metabolit sekunder. Fungi endofit juga mampu menghasilkan siklosporin A, yang berpotensi sebagai antifungal dan bahan imunosupresif (Haniah, 2008).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Fakultas
Pertanian Universitas Sumatera Utara, Medan dengan ketinggian tempat + 25 m dpl pada bulan Mei 2013 sampai Januari 2014.
Bahan dan Alat
Adapun bahan yang digunakan adalah tanaman terong belanda yang sehat, tanaman cabai yang terserang layu fusarium, tanaman tomat yang terserang bercak
A. solani, alcohol 96%, kloroks 1%, spirtus, aquades, media Potato Dexstrose Agar (PDA), aluminium foil, cling wrap, kertas stencil dan label nama.
Alat-alat yang digunakan dalam penelitian ini adalah cawan petri, tabung reaksi, inkubator, timbangan analitik, erlenmeyer, bunsen, autoclaf, bunsen, oven,
laminar air flow, coke borer, refrigerator, mikroskop compound, jarum ose, gunting, pisau, kamera.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial dengan 2 faktor perlakuan dan 3 ulangan, yaitu:
Faktor I : jamur endofit yang terdiri dari 15 jenis : E1A : Jamur endofit 1 dari akar
E6B : Jamur endofit 6 dari batang E7B : Jamur endofit 7 dari batang E8B: Jamur endofit 8 dari batang E9B: Jamur endofit 9 dari batang E10B : Jamur endofit 10 dari batang E11B : Jamur endofit 11 dari batang E12B : Jamur endofit 12 dari batang E13D : Jamur endofit 13 dari daun E14D : Jamur endofit 14 dari daun E15D : Jamur endofit 15 dari daun
Faktor II : patogen penyebab penyakit terdiri dari dua patogen yaitu: P1: Fusarium oxysporum f.sp capsici
P2: Alternaria solani
Sehingga diperoleh 30 kombinasi perlakuan :
29 (r – 1) ≥ 15 29r - 29 ≥ 15 r ≥ 44 / 29 r ≥ 1.5 r = 2
Jumlah ulangan : 2 ulangan
Jumlah Perlakuan : 30 x 2 = 60 Model linier yang digunakan adalah :
Yijk = �+ ��+��+ (��)��+ ∑ijk
Dimana :
Yijk = Hasil pengamatan akibat pengaruh perlakuan ke- i, ke- j dan ulangan ke-
k
μ = Nilai tengah umum (rataan)
�� = Efek perlakuan taraf ke-i βj = Efek perlakuan taraf ke- j
(αβ)ij = Efek interaksi perlakuan ke- I dan ke-j
∑ijk = Efek galat perlakuan ke-i, ke- j dan ulangan ke- k
Pelaksanaan Penelitian
Isolasi patogen penyebab penyakit
Sumber inokulum diambil dari tanaman cabai yang terserang layu fusarium
dan diinkubasi pada temperatur kamar selama 1 minggu. Setelah miselium patogen tumbuh, diisolasi kembali untuk mendapatkan biakan murni.
Eksplorasi Jamur Endofit dari tanaman terong belanda yang sehat
Jamur endofit diisolasi dari tanaman terong belanda yang sehat diambil dari akar, batang dan daun yang diambil dari daerah Berastagi. Dari pertanaman yang ada, dipilih tanaman yang sehat diantara tanaman yang sakit dengan asumsi bahwa tanaman tersebut mempertahankan diri karena memiliki agens antagonis di dalam jaringannya.
Bagian tanaman tersebut dicuci dengan menggunakan air mengalir selama ± 5 menit setelah itu dipotong ± 1 cm . Setelah itu dilakukan sterilisasi permukaannya dengan memasukkannya ke dalam larutan alkohol 70% selama ± 1 menit dan dilanjutkan ke dalam larutan NaOCl 1 % selama ± 5 menit kemudian dikeringkan dengan tissue steril, selanjutnya bagian tanaman tersebut dibilas dengan aquades steril ± 1 menit diulang 2 kali, lalu ditempelkan di atas cawan petri berisi media PDA dilakukan dengan cara membelah bagian tanaman tersebut dan meletakkanya pada posisi tertelungkup. Cawan petri yang sudah mengandung sampel tanaman kemudian diinkubasi dalam inkubator pada suhu kamar selama 2- 4 hari sampai tampak jamur yang tumbuh. Kemudian jamur endofit yang digunakan untuk penelitian adalah jamur yang tumbuh pada belahan akar bagian dalam (Sunarmi, 2010).
Uji Antagonisme Jamur Endofit Terhadap Patogen di Laboratorium
Uji antagonisme dilakukan dengan pengujian dual culture antara patogen
koloni patogen diletakkan tepat di tengah petri (Gambar 5). Pertumbuhan jamur diamati setiap hari mulai 1 hari setelah inokulasi (hsi).
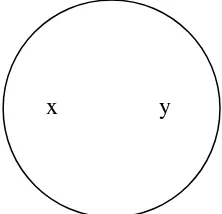
Gambar 5. Uji Antagonisme Jamur Endofit Terhadap patogen
Keterangan :
X = jamur endofit Y = patogen
r1 = Jari-jari yang menjauhi jamur endofit
r2 = Jari-jari yang mendekati jamur endofit
Interaksi jamur endofit terpilih dengan patogen
Pengujian ini dilakukan untuk melihat interaksi jamur endofit dan
patogen dalam satu cawan petri yang berdiameter 7 cm. Patogendan jamur endofit diletakkan berhadapan kemudian di bagian tengah diletakkan objek glass yang telah diberi lapisan tipis PDA (Gambar 6).
Gambar 6. Uji interaksi jamur endofit terhadap patogen
X Y r2 r1
Keterangan :
x = jamur patogen y = jamurendofit Peubah Amatan
1. Daerah hambatan (Inhibiting zone) (%)
Pengamatan dilakukan dengan mengukur daerah hambatan yang dihasilkan cendawan endofit terhadap patogen. Pengukuran dilakukan dengan menggunakan rumus yang dikemukakan oleh (Dharmaputra dkk,1990), yaitu:
IZ = �1−�2
�1 � 100%
Keterangan :
IZ = persentasi zona penghambat pertumbuhan (%) r1 = jari-jari patogen yang menjauhi jamur endofit (cm)
r2 = jari-jari patogen yang mendekati jamur endofit (cm)
2. Diameter koloni (cm)
Data diperoleh dengan mengamati dan mengukur diameter pertumbuhan koloni patogen dan jamur endofit yang terbentuk setiap hari sampai 7 hari setelah inokulasi (hsi).
3. Luas pertumbuhan koloni (cm2)
Pengamatan dan pengukuran luas pertumbuhan jamur endofit dan patogen dilakukan setiap hari mulai 1 hsi sampai 7 hsi dengan cara menggambar
pola luas pertumbuhan keduanya pada plastik transparan, digunting sesuai pertumbuhannya dan dihitamkan, lalu dihitung dengan menggunakan pola patron dengan rumus, yaitu:
�1
Keterangan:
A1 : Berat pola lingkaran petridish yang digunakan (g)
B1 : Luas pola lingkaran petridish yang digunakan (cm2)
A2 : Berat pola lingkaran sesuai dengan pertumbuhan jamur (g)
B2 : Luas pola lingkaran sesuai dengan pertumbuhan jamur (cm2)
4. Bentuk interaksi
HASIL DAN PEMBAHASAN
Berdasarkan hasil pengamatan dan sidik ragam Lampiran 2-22 diketahui bahwa perlakuan jenis endofit, jenis patogen serta interaksi keduanya memberikan pengaruh sangat nyata terhadap parameter daerah hambatan, diameter koloni dan luas pertumbuhan koloni.
Daerah Hambatan (Inhibiting Zone)
Berdasarkan Lampiran 2-8 diketahui bahwa perlakuan jenis endofit, jenis patogen serta interaksi keduanya memberikan pengaruh sangat nyata terhadap parameter daerah hambatan. Rataan daerah hambatan 1-7 hari setelah inokulasi (hsi) dapat dilihat pada Tabel 1.
Tabel 1. Rataan daerah hambatan (%) pada beberapa jenis endofit dan jenis patogen
Jenis Endofit
Jenis Patogen
Rataan P1 (F. oxysporum) P2 (A. solani)
1 hsi E1 7.86 fgh 16.78 defgh 12.32 d
E2 25.20 bcdefg 31.70 abcd 28.45 bc
E3 43.02 a 41.51 ab 42.27 a
E4 18.23 cdefgh 16.78 defgh 17.50 cd
E5 26.63 abcdef 36.82 abc 31.73 ab
E6 17.77 defgh 26.25 abcdefg 22.01 bcd
E7 7.12 fgh 16.78 defgh 11.95 d
E8 10.07 fgh 10.42 fgh 10.24 d
E9 17.94 cdefgh 19.49 cdefgh 18.72 bcd
E10 15.82 defgh 10.80 efgh 13.31 d
E11 25.56 abcdefg 17.16 defgh 21.36 bcd
E12 6.46 gh 16.78 defgh 11.62 d
E13 16.33 defgh 26.57 abcdefg 21.45 bcd
E14 30.25 abcde 10.42 fgh 20.33 bcd
E15 25.45 bcdefg 4.05 h 14.75 d
Rataan 19.58 b 20.15 a 19.87
2 hsi E1 26.09 fghi 11.08 ghi 18.59 defg
E2 26.97 efgh 15.03 ghi 21.00 defg
E3 12.98 ghi 46.51 abcd 29.75 cdef
E4 36.55 bcdef 50.16 ab 43.35 ab
E5 31.15 cdefg 29.46 cdefgh 30.31 cde
E8 28.49 lm 28.63 lm 28.56 h
Keterangan : Angka-angka yang diikuti notasi yang sama pada kelompok kolom yang sama menunjukkan berbeda tidak nyata pada taraf 5% menurut Duncan Multiple Range Test
Pada tabel 1 dapat dilihat bahwa jamur endofit yang memiliki kemampuan menghambat pertumbuhan koloni F. oxysporum paling baik pada 7 hsi adalah jenis endofit E6 sebesar 56,89%, E3 sebesar 54,64%, E10 sebesar 48,43%, E4 sebesar 45,79%, E5 sebesar 42,30%. Sedangkan jamur endofit yang mampu menghambat
pertumbuhan koloni A.solani yang paling baik adalah jenis endofit E6 sebesar 54,10%, E5 sebesar 51,73%, E4 sebesar 50,16%, E3 sebsar 49,54%,
E15 sebesar 47,84% E9 sebsar 47,29%, E14 sebesar 45,53%, dan E11 sebesar 45,94%. Persentase daerah hambatan di bawah 40% dinyatakan
kurang unggul karena pertumbuhan koloni patogen lebih cepat daripada pertumbuhan jamur endofit.
Dari rataan tabel 1 diketahui bahwa perlakuan jamur endofit, patogen dan interaksi keduanya berpengaruh sangat nyata. Hal ini berarti pemberian jamur endofit yang berasal dari tanaman solanaceae (terong belanda) berpengaruh dalam menghambat pertumbuhan patogen dari tanaman solanaceae lainnya (cabai dan tomat) secara invitro. Disebabkan oleh adanya persamaan morfologi dan anatomi beberapa tanaman solanaceae sehingga memudahkan jamur endofit untuk berinteraksi dengan beberapa patogen penyebab penyakit pada beberapa tanaman solanaceae lainnya. Haniah (2008) menyatakan bahwa jamur endofit menghasilkan senyawa aktif biologis secara invitro antara lain alkaloid, paxillin, lolitrems dan tetranone steroid yang dapat digunakan untuk mengendalikan patogen.
Gambar 7. Hubungan persentase daerah hambatan 7 hsi pada beberapa jenis endofit
Gambar 7 menunjukkan bahwa perlakuan endofit E6 menunjukkan daerah hambatan terbesar yakni 55,50% dan terendah pada E2 yakni 36.73 %. Hubungan persentase daerah hambatan dengan jenis patogen dapat dilihat pada Gambar 8.
Gambar 8. Hubungan persentase daerah hambatan 7 hsi pada beberapa jenis patogen
Dari hasil pengamatan diketahui bahwa beberapa jenis jamur endofit memiliki pertumbuhan yang lebih cepat daripada pertumbuhan patogen dan
38.78
P1 (F. oxysporum) P2 (A. solani)
terdapat pula beberapa jenis endofit yang memiliki pertumbuhan lebih lambat daripada pertumbuhan patogen. Hal tersebut berarti beberapa jenis endofit dapat menyebabkan pertumbuhan patogen menjadi terhambat karena terjadinya kompetisi nutrisi dan ruang. Pada beberapa jenis endofit seperti E1 dan E15 terlihat bahwa jamur endofit mengeluarkan toksin berupa perubahan warna media PDA yang berpengaruh terhadap pertumbuhan patogen. Carrol (1988) menyatakan bahwa jenis agens hayati yang banyak dikembangkan adalah mikroba alami, baik yang hidup sebagai saprofit di tanah, air dan bahan organik, maupun yang hidup dalam jaringan tanaman (endofit) memiliki sifat menghambat pertumbuhan dan berkompetisi dalam ruang dan nutrisi dengan patogen sasaran, dan bersifat menginduksi ketahanan tanaman
a
b
A
a
b
B
a
b
C
a
b
D
a
b
E
a
b
F
a
b
a
b
a
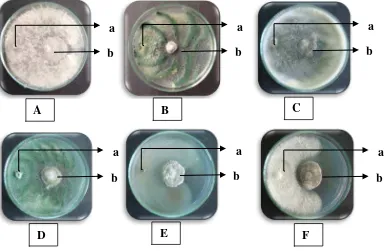
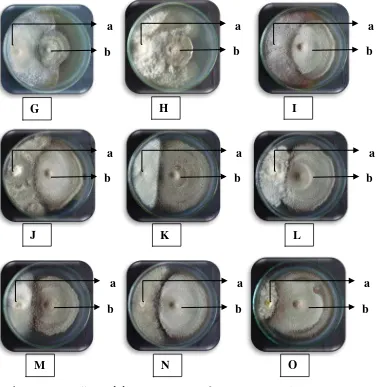
Gambar 9. Pengujian inhibiting zone (A) E6, (B) E3, (C) E4, (D) E5, (E) E10, (F) E9, (G) E12, (H) E11, (I) E15, (J) E1, (K) E14, (L) E7, (M) E8, (N) E13, (O) E2. (Keterangan: a. Jamur endofit, b. F. oxysporum
Berdasarkan Lampiran 9-15 diketahui bahwa perlakuan jenis endofit, jenis patogen serta interaksi keduanya memberikan pengaruh sangat nyata terhadap parameter diameter koloni. Rataan diameter koloni 1-7 hsi dapat dilihat pada Tabel 2.
Tabel 2. Rataan diameter koloni (cm) pada beberapa jenis endofit dan jenis patogen
E3 1.94 m 1.35 p 1.64 i
E4 1.73 n 1.44 p 1.58 i
E5 2.16 kl 1.58 o 1.87 h
E6 2.11 l 1.92 m 2.01 g
E7 2.55 def 2.33 hij 2.44 cd
E8 2.70 ab 2.42 ghi 2.56 a
E9 2.52 efg 2.12 l 2.32 e
E10 2.04 lm 2.67 abcd 2.35 de
E11 2.45 fgh 1.78 n 2.12 f
E12 2.57 cdef 2.34 hij 2.45 bc
E13 2.76 a 2.29 ij 2.53 ab
E14 2.46 fgh 1.77 n 2.12 f
E15 2.60 bcde 1.78 n 2.19 f
Rataan 2.38 a 2.03 b 2.21
Keterangan : Angka-angka yang diikuti notasi yang sama pada kelompok kolom yang sama menunjukkan berbeda tidak nyata pada taraf 5% menurut Duncan Multiple Range Test
Dari hasil pengujian antagonisme yang terlihat pada tabel 2 dapat dilihat bahwa diameter koloni F. oxysporum yang terendah terdapat pada jenis endofit E4 sebesar 1.73 cm, E3 sebesar 1.94 cm. Pada hasil pengamatan diameter koloni A. solani yang terendah juga terdapat pada E4 sebesar 1.44 cm dan E3 sebesar 1.58 cm. Hal ini disebabkan oleh pertumbuhan jamur endofit lebih cepat berkembang daripada pertumbuhan patogen sehingga jenis jamur endofit E3 dan E4 dapat dikatakan efektif untuk menghambat dan mengendalikan patogen F. oxysporum
Hubungan dari diameter koloni dan jenis endofit dapat dilihat pada Gambar11.
Gambar 11. Hubungan diameter koloni 7 hsi pada beberapa jenis endofit Gambar 11 menunjukkan bahwa perlakuan endofit E8 menunjukkan diameter koloni terbesar yakni 2.56 cm dan terendah pada E4 yakni 1.58 cm. Hubungan diameter koloni dengan jenis patogen dapat dilihat pada Gambar 12.
Gambar 12. Hubungan diameter koloni 7 hsi pada beberapa jenis patogen
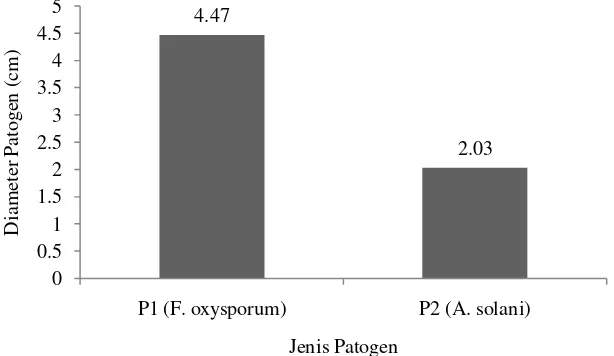
2.47 2.44
P1 (F. oxysporum) P2 (A. solani)
Pada hasil rataan tabel 2 di 7 hsi terlihat bahwa diameter koloni
F. oxysporum yang tertinggi adalah jenis endofit E13 sebesar 2.76 cm dan diameter koloni A.solani yang tertinggi adalah jenis endofit E10 sebesar 2.67 cm. Hal ini disebabkan oleh pertumbuhan F. oxysporum dan A. solani lebih cepat daripada jamur endofit. Pertumbuhan beberapa jenis jamur endofit tampak berbeda dikarenakan isolasi jamur endofit dari bagian yang berbeda. Isolasi jamur endofit yang dilakukan adalah di dapat pada bagian tanaman akar, batang dan daun dari tanaman yang sehat sehingga jenis dan sifat isolat berbeda pula. Wahyudi (2008) menyatakan bahwa jamur endofit yang dihasilkan dari tumbuhan inang dapat menghasilkan jenis isolat yang berbeda-beda dan jumlah bervariasi. Isolasi jamur endofit dari bagian tanaman yang berbeda dari satu tumbuhan inang, mengandung jenis isolat yang berbeda pula. Bahkan dari satu jaringan hidup suatu tumbuhan dapat diisolasi lebih dari 1 jenis jamur endofit
Luas Pertumbuhan koloni (cm2)
Berdasarkan Lampiran 16-22 diketahui bahwa perlakuan jenis endofit, jenis patogen serta interaksi keduanya memberikan pengaruh sangat nyata terhadap parameter luas pertumbuhan koloni (cm2). Rataan luas pertumbuhan 1-7 hsi dapat dilihat pada Tabel 3.
Tabel 3. Rataan luas pertumbuhan koloni (cm2) pada beberapa jenis endofit dan jenis patogen
Jenis Endofit
Jenis Patogen
Rataan P1 (F. oxysporum) P2 (A. solani)
1 hsi E1 1.19 abc 0.85 i 1.02 abcde
E2 1.20 abc 0.91 ghi 1.06 abc
E3 1.04 def 0.89 hi 0.97 defg
E4 1.13 bcd 0.89 hi 1.01 bcde
E5 1.16 abc 0.89 hi 1.02 abcde
E6 1.11 cde 0.89 hi 1.00 cdef
E8 4.59 def 5.24 b 4.91 a
E9 4.33 gh 2.32 l 3.33 f
E10 3.06 j 5.74 a 4.40 e
E11 3.91 i 2.57 k 3.24 f
E12 4.30 gh 4.92 c 4.61 cd
E13 4.53 efg 4.62 def 4.57 d
E14 3.81 i 2.32 l 3.07 g
E15 4.22 h 2.42 kl 3.32 f
Rataan 3.84 a 3.49 b 3.66
Keterangan : Angka-angka yang diikuti notasi yang sama pada kelompok kolom yang sama menunjukkan berbeda tidak nyata pada taraf 5% menurut Duncan Multiple Range Test
Hubungan dari luas pertumbuhan koloni dan jenis endofit dapat dilihat pada Gambar 13.
Gambar 13. Hubungan luas pertumbuhan koloni 7 hsi pada beberapa jenis endofit Gambar 13 menunjukkan bahwa perlakuan endofit E8 menunjukkan luas
pertumbuhan koloni terbesar yakni 4.91 cm2 dan terendah pada E4 yakni 1.77 cm2. Hubungan luas pertumbuhan koloni dengan jenis patogen dapat dilihat
pada Gambar 14.
Gambar 14. Hubungan luas pertumbuhan koloni 7 hsi pada beberapa jenis patogen
4.614.75
P1 (F. oxysporum) P2 (A. solani)
Luas pertumbuhan koloni F. oxysporum dan A.solani yang terendah adalah pada jenis endofit E3 dan E4 dimana jenis endofit tersebut berasal dari akar tanaman terong belanda yang sehat. Jamur endofit dapat ditemukan disetiap tanaman yang berpembuluh dan mempunyai potensi untuk mengendalikan patogen yang menganggu tanaman induknya. Hal ini sesuai dengan Masyarah (2009) yang menyatakan bahwa jenis tanaman yang tersebar di muka bumi, masing-masing tanaman mengandung satu atau lebih mikroorganisme endofit yang terdiri dari bakteri dan fungi yang mampu menghasilkan senyawa biologi atau metabolit yang dapat berfungsi sebagai antibiotika, antivirus, antikanker, antidiabetes, antimalaria, antioksidan, antiimun opressif, antiserangga, zat pengatur tumbuh dan penghasil enzim-enzim hidrolitik seperti amilase, selulase, xilanase, ligninase, kitinase
Bentuk Interaksi Endofit dan F. oxysporum.
Gambar 15: Interaksi antara jamur endofit dan F. oxysporum. (A) dan (B) hifa patogen berwarna transparan (400x) . (C) hifa patogen menjadi
mengeriting (400x). (D) hifa endofit melilit hifa patogen (400x). (E) hifa endofit menjerat hifa patogen (400x).
A
E D
Bentuk Interaksi Endofit dan A.solani
Gambar 16: Interaksi antara jamur endofit dan A. solani. (A) hifa endofit melilit hifa patogen (400x), (B) dan (C) hifa endofit mengkait hifa patogen (400x). (D) dan (E) hifa patogen berwarna transparan (400x). (F) hifa patogen mengeriting (400x). (G) hifa patogen patah-patah (400x). (H) hifa endofit masuk dan menembus hifa patogen (400x). Dari hasil pengamatan interaksi beberapa jenis jamur endofit yang unggul didapat bentuk interaksi yang bervariasi pula. Pada jenis jamur endofit E3 dan E4
didapat bentuk interaksi yang menyebabkan hifa patogen F. oxysporum dan
A. solani menjadi jernih dan kosong (Gambar 15A, 15B, 16D, 16E) . Hal ini disebabkan oleh jamur endofit merebut nutrisi dari patogen (kompetisi nutrisi) sehingga terjadi perubahan pada hifa patogen yang akan menyebabkan pertumbuhan patogen terhambat. Sunarwati dan Yoza (2010) menyatakan bahwa
A B C
F E
D
interaksi hifa patogen dan antagonis ditandai dengan berubahnya warna hifa patogen menjadi jernih dan kosong karena isi sel dimanfaatkan oleh agen biokontrol sebagai nutrisi.
Dari hasil pengamatan diketahui bahwa bentuk interaksi jenis jamur endofit E6 adalah menyebabkan hifa patogen F. oxysporum dan A. solani menjadi mengeriting (Gambar 15C dan 16F). Hal ini disebabkan petumbuhan jamur endofit yang lebih cepat sehingga mampu memberikan perubahan terhadap patogen sehingga menghambat pertumbuhannya. Shehata dkk (2008) menyatakan bahwa salah satu sifat mikroba antagonis adalah pertumbuhannya lebih cepat dibanding dengan patogen dan atau menghasilkan senyawa antibiotik yang dapat menghambat pertumbuhan patogen
Dari hasil pengamatan diketahui bahwa bentuk interaksi yang terjadi antara jenis endofit E15 dengan hifa A. solani adalah hifa patogen menjadi abnormal atau malformasi. Perubahan hifa tampak seperti patah-patah (Gambar 16G). . Hal ini dikarenakan jamur endofit menghasilkan senyawa antibiotik yang mampu merusak dan menghambat pertumbuhan patogen. Petrini (1993) melaporkan bahwa jamur endofit menghasilkan alkaloid dan mikotoksin sehingga memungkinkan digunakan untuk meningkatkan ketahanan tanaman terhadap penyakit.
hifa patogen (Gambar 16B dan 16C) . Jamur endofit membentuk kait di sekitar hifa patogen sebelum penetrasi, atau kadang-kadang menembus dan masuk langsung (Gambar 16A). Dolakatabadi dkk (2012) menyatakan bahwa jamur endofit membentuk kait di sekitar hifa patogen sebelum penetrasi, atau kadang-kadang masuk langsung. bahwa mekanisme kerja senyawa antimikroba dalam melawan mikroorganisme patogen dengan cara merusak dinding sel, mengganggu metabolisme sel mikroba, menghambat sintesis sel mikoba, mengganggu permeabilitas membran sel mikroba, menghambat sintesis protein dan asam nukleat sel mikroba.
KESIMPULAN DAN SARAN
Kesimpulan
1. Jenis jamur endofit berpengaruh sangat nyata terhadap daerah hambatan, diameter koloni serta luas pertumbuhan koloni dengan hasil terbaik diperoleh pada jenis E6 dan E3.
2. Jenis patogen berpengaruh sangat nyata terhadap daerah hambatan, diameter koloni serta luas pertumbuhan koloni, dengan daerah hambatan tertinggi pada P2 (A. solani).
3. Interaksi jenis jamur endofit dan jenis patogen berpengaruh sangat nyata terhadap terhadap daerah hambatan, diameter koloni serta luas pertumbuhan koloni dengan hasil terbaik pada E6P1 (jenis endofit 1 dengan F. oxysporum), E3P1 (jenis endofit 3 dengan F. oxysporum) dan E6P2 (jenis endofit 6 dengan
A. solani).
4. Bentuk interaksi antara jenis endofit dan jenis patogen menunjukkan gejala mikroskopis seperti transparan (E3 dan E4), mengeriting (E6), malformasi
(E15), menjerat (E10), membentuk kait (E9 dan E14), melilit (E5), menembus (E11) .
Saran
DAFTAR PUSTAKA
Agrios, G. N., 1996. Ilmu Penyakit Tumbuhan. Edisi Ketiga. Terjemahan M. Busnia. UGM-Press, Yogyakarta
Arunakumara, K. T., 2006. Studies on Alternaria solani (Allis and Martin) Jones and Grount Causing Raely Blight of Tomato. Thesis. University of Agricultural Sciences, Dharwad.
Beckman, C. H., 1987. The Nature of Wilt Diseases of Plants. The American Phytopathological Society, St. Paul, MN.
Brunner, F. and O. Petrini. 1992. Taxonomic Studies of Xylaria species and Xylariaceous Endophytes by Izozyme Electrophoresis. Mycological Research
96: 723 – 733.
Carneiro, S. M. T. P. G., E. D. B. Romano., E.Pignoni., M. Z. Teixeira., M. E. da C. Vasconcelos and J. C. Gomes. 2010. Effect Of Biotherapic of
Alternaria solani on The Early Blight of Tomato-Plant and The In Vitro Development of The Fungus. Original Article. Int J High Dilution Res 2010; 9(33): 147-155
Carrol, G.C., 1988. Fungal Endophytes in Stems and Leaves. From Latent Pathogens to Mutualistic Symbiont. Ecology. 69: 2-9
Dahlam, D. L., H. Eichenseer and M. R. Siegel. 1991. Chemical Perspectives on Endophyte- Grass Interaction and Their Implications to Insect Herbivory. In: Microbial Mediation of Plant-Herbivore Interaction (Eds. Barbosa, P., V. A. Krichil and C. G. Jones). Jhon Wiley & Sons Inc., New York: 227 – 252.
Derbalah, A. S., M.S. El-Mahrouk dan A. B. El-Sayed., 2011. Efficacy and Safety of Some Plant Extracts against Tomato Early Disease Caused by
Alternaria solani. Institude of Plant Pathology Research, Egypt. Pathology Journal 10(3): 115-121..
Djaenuddin , N., 2011. Bioekologi Penyakit Layu Fusarium Fusarium oxysporum.
Balai Penelitian Tanaman Serealia, Maros.
Dolakatabadi, H. K., E. M. Goltapeh, N. Mohammadi, M. Rabiey, N. Rohani, and Varma. Biocontrol Potential of Root Endophytic Fungi and
Trichoderma Species Against Fusarium Wilt of Lentil Under In vitro and Greenhouse Conditions. J. Agr. Sci. Tech. (2012) Vol. 14: 407-420.
Haniah, M., 2008. Isolasi Jamur Endofit Dari Daun Sirih (Piper Betle L.) Sebagai Antimikroba Terhadap Escherichia coli, Staphylococcus aureus dan
Indratmi, D., 2008. Mekanisme Penghambatan Colletotrichum gloeosporioldes
Patogen Penyakit Antraknosa Pada Cabai Dengan Khamir
Debaryomyces sp. Universitas Muhammadiyah Malang, Malang.
Kirnando, A. F., 2011. Pengaruh Gliocladium virens Dan Varietas Terhadap Perkembangan Penyakit Fusarium oxysporum f.sp lycopersici (Sacc) Pada Tanaman Tomat (Lycopersicum esculentum Smith) Di Lapangan. Skripsi. Universitas Sumatera Utara, Medan.
Kobayashi, D.Y., 2002. Bacterial Endophytes and Their Effects on Plant and Uses in Agriculture. In Microbial Endophyties. Edited by CW Bacon and JF White jr. New York, Marcel Dekker Inc.
Krisnawan., 2012. Pengaruh Agensia Hayati Pseudomonad Fluoresen Terhadap Perkembangan Penyakit Layu (Fusarium sp.) Dan Pertumbuhan Tanaman Cabai (Capsicum annum L.). Skripsi. Universitas Pembangunan Nasional “Veteran” Jawa Timur, Surabaya.
Lingga, R., 2009. Sumatera Utara, Medan.
Maria, P. D., 2002. Eksplorasi dan Uji Antagonisme Bakteri Rhizosfer Tanah dan Endofit Akar untuk Pengendalian Penyakit Layu (F.oxysporum f.sp. cubense) pada Pisang (Musa paradisiaca). Skripsi. Fakultas Pertanian. IPB.
Maysarah., 2009.
Mukarlina, Siti Khotimah dan Reny Rianti., 2010. Uji Antagonis
Trichoderma harzianum Terhadap Fusarium spp. Penyebab Penyakit Layu Pada Tanaman Cabai (Capsicum annum) Secara In Vitro. Skripsi. Universitas Tanjungpura.
Pasche, J. S., C. M. Wharam dan N. C. Gudmestad., 2004. Shift in Sensitivity of
Alternaria solani in Response to QoI Fungicides. Department of Plant Pathology, North Dakota State University, Fargo.
Petrini, O. 1993. Endophyt of Pteridium spp. Some Consederations for Biological Control. Sydowia 45: 330 –338.
Raziq, F dan Ishtiaq, S., 2010. Integrated Control of Alternaria solani With
Trichoderma spp. And Fungicides under InVitro Conditions. Department of Plant Pathology, KP, Agricultural University, Peshawar-Pakistan.
Sarhad J. Agric. Vol. 26, No. 4
Rodrigues, T. T. M. S., Luiz A. Maffia., Onkar D. Dhingra dan Eduardo S.G. Mizubuti., 2010. In vitro production of conidia of Alternaria solani.
Universidade Federal de Vicosa, Brazil. Research Article. Tropical Plant Pathology, vol. 35, 4, 203-212
Semangun, H., 1994. Penyakit – Penyakit Tanaman Hortikultura Di Indonesia. Gadjah Mada University Press. Yogyakarta.
., 2000. Penyakit – Penyakit Tanaman Hortikultura Di Indonesia. Gadjah Mada University Press. Yogyakarta.
Setiawati, W., Ineu Sulastrini dan Neni Gunaeni., 2001. Penerapan Teknologi PHT pada Tanaman Tomat. Balai Penelitian Tanaman Sayuran. Lembang Bandung.
Shehata, Fawzy, S dan Borollosy, AM., 2008. Induction of Resistance Against Zuccini Yellow Mosaic Potyvirus and Growth Enhancement of Squash Plants Using Some Plant Growth Promoting Rhizobacteria. Australia Journal of Basic and Applied Scienes 2: 174-182.
Siadari, M. H., 2010
Sinaga, M. H., 2011
Strobel GA, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiol Mol Biol Rev 67:419- 502.
Strobel GA, Ford E, Woapong J, Harper JK, Arif AM, Grant DM, Fung PCW, Chan K., 2002. Isopestacin, an Isobenzopuranone from Pestalotiopsis microspora, prosses-ing antifungal and antioxidant activities.
Phytochemistry 60:179-183.
Sudantha, I. M dan A. L. Abadi., 2007. Identifikasi Jamur Endofit dan Mekanisme Antagonismenya Terhadap Jamur Fusarium oxysporum f. sp. Vanillae Pada Tanaman Vanili. Skripsi. Universitas Mataram dan Universitas Brawijaya. Sunarmi, N. 2010. Isolasi Dan Identifikasi Jamur Endofit Dari Akar Tanaman
Bakteri (Ralstonia Solanacaerum). Skripsi. Universitas Islam Negri Malang, Malang.
Sunarwati, D. dan R. Yoza. 2010. Kemampuan Trichoderma dan Penicillium
dalam Menghambat Pertumbuhan Cendawan Penyebab Penyakit Busuk Akar Durian (Phytophthora palmivora) Secara In Vitro. Balai Penelitian Tanaman Buah Tropika. Seminar Nasional Program dan Strategi Pengembangan Buah Nusantara. Solok, 10 Nopember 2010. 176-189.
Suryanarayanan, T. S., 2003. Endophytic Fungi Associated with Cacti of Arizona.
Mycological Research 109: 635-639
Syamsuddin., 2003. Pengendalian Penyakit Terbawa Benih (Seedborne Diseases) Pada Tanaman Cabai (Capsicum annum L.) Menggunakan Agenbiokontrol dan Ekstrak Botani,
Tan, R. X, and W.X. Zou., 2001. Endophytes: A Rich of functional metabolites.
Nat. Prod. Rep. 18: 448-459
Winarni, S., 1984. Pengamatan Penyakit Pada Tanaman Tomat (Lycopersicum esculentum Mill.) di Kecamatan Cisaat dan Kecamatan
Sukabumi Kabupaten Dati II Sukabumi Propinsi Jawa Barat. Institut Pertanian Bogor.
Winarsih, S. dan Syafrudin., 2001. Pengaruh Pemberian Trichoderma viridae dan
Sekam Padi Terhadap Penyakit Rebah Kecambah di Persemaian Cabai.
J. Ilmu-Ilmu Pertanian, 3(1): 49-55
Wyenandt, A., 2005. Diagnosing and Controlling Fungal Diseases of Tomato in the Home Garden. Rutgers, The State University of New Jersey, New Brunswick.
Zinniel, D. K., P. Lambrecht, N. B. Haris, Z. Feng, D. Kuczmarski, P. Higley, C. A. Ishimaru, A. Arunakumari, R. G. Barletta, and A. K. Vidader., 2002.
Lampiran 1. Bagan Percobaan
P1: Fusarium oxysporum f.sp capsici
P2: Alternaria solani
Lampiran 2 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 1 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 5883.67 202.89 2.75 1.88 2.46 **
P 1.00 4.93 4.93 0.07 4.17 7.56 tn
E 14.00 4328.07 309.15 4.19 2.04 2.74 **
P*E 14.00 1550.68 110.76 1.50 2.04 2.74 **
Galat 30.00 2215.99 73.866
Total 59.00 8099.67
FK 23683.11
Lampiran 3 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 2 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2 Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 12229.45 421.71 5.92 1.88 2.46 **
P 1.00 760.37 760.37 10.68 4.17 7.56 **
E 14.00 6413.42 458.10 6.43 2.04 2.74 **
P*E 14.00 5055.66 361.12 5.07 2.04 2.74 **
Galat 30.00 2135.77 71.192
Total 59.00 14365.22
FK 45662.30
Lampiran 4 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 3 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 10369.95 357.58 10.27 1.88 2.46 **
P 1.00 810.00 810.00 23.25 4.17 7.56 **
E 14.00 6789.21 484.94 13.92 2.04 2.74 **
P*E 14.00 2770.75 197.91 5.68 2.04 2.74 **
Galat 30.00 1045.05 34.835
Total 59.00 11415.01
FK 48438.57
Lampiran 5 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 4 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 11625.75 400.89 21.82 1.88 2.46 **
P 1.00 76.13 76.13 4.14 4.17 7.56 tn
E 14.00 9306.83 664.77 36.18 2.04 2.74 **
P*E 14.00 2242.79 160.20 8.72 2.04 2.74 **
Galat 30.00 551.15 18.372
Total 59.00 12176.90
FK 63665.09
Lampiran 6 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 5 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 5865.23 202.25 36.45 1.88 2.46 **
P 1.00 167.34 167.34 30.16 4.17 7.56 **
E 14.00 4325.37 308.96 55.68 2.04 2.74 **
P*E 14.00 1372.52 98.04 17.67 2.04 2.74 **
Galat 30.00 166.47 5.549
Total 59.00 6031.71
FK 87409.25
Lampiran 7 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 6 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 3796.91 130.93 20.44 1.88 2.46 **
P 1.00 198.42 198.42 30.98 4.17 7.56 **
E 14.00 2867.70 204.84 31.98 2.04 2.74 **
P*E 14.00 730.80 52.20 8.15 2.04 2.74 **
Galat 30.00 192.16 6.405
Total 59.00 3989.07
FK 96857.86
Lampiran 8 :
DAERAH HAMBATAN (Inhibiting Zone) PENGAMATAN 7 HSI
Ars sin √X
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 2991.11 103.14 20.69 1.88 2.46 **
P 1.00 207.15 207.15 41.55 4.17 7.56 **
E 14.00 1937.45 138.39 27.76 2.04 2.74 **
P*E 14.00 846.52 60.47 12.13 2.04 2.74 **
Galat 30.00 149.55 4.985
Total 59.00 3140.66
FK 106103.74
Lampiran 9 :
DIAMETER KOLONI PENGAMATAN 1 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2 Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 1.10 0.04 42.80 1.88 2.46 **
P 1.00 1.03 1.03 1162.26 4.17 7.56 **
E 14.00 0.05 0.003 3.65 2.04 2.74 **
P*E 14.00 0.02 0.002 1.99 2.04 2.74 **
Galat 30.00 0.03 0.001
Total 59.00 1.13
FK 86.74 Keterangan
KK 2.48 **: sangat nyata
Lampiran 10:
DIAMETER KOLONI PENGAMATAN 2 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 0.80 0.03 6.21 1.88 2.46 **
P 1.00 0.001 0.001 0.29 4.17 7.56 tn
E 14.00 0.46 0.03 7.43 2.04 2.74 **
P*E 14.00 0.34 0.02 5.42 2.04 2.74 **
Galat 30.00 0.13 0.004
Total 59.00 0.93
FK 134.19
Lampiran 11:
DIAMETER KOLONI PENGAMATAN 3 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 2.42 0.08 47.16 1.88 2.46 **
P 1.00 0.95 0.95 534.98 4.17 7.56 **
E 14.00 0.86 0.06 34.68 2.04 2.74 **
P*E 14.00 0.61 0.04 24.79 2.04 2.74 **
Galat 30.00 0.05 0.002
Total 59.00 2.47
FK 177.71
Lampiran 12:
DIAMETER KOLONI PENGAMATAN 4 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 5.48 0.19 52.75 1.88 2.46 **
P 1.00 3.34 3.34 931.74 4.17 7.56 **
E 14.00 1.16 0.08 23.07 2.04 2.74 **
P*E 14.00 0.98 0.07 19.64 2.04 2.74 **
Galat 30.00 0.11 0.004
Total 59.00 5.58
FK 218.27
Lampiran 13:
DIAMETER KOLONI PENGAMATAN 5 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 7.05 0.24 45.68 1.88 2.46 **
P 1.00 2.86 2.86 537.29 4.17 7.56 **
E 14.00 2.65 0.19 35.52 2.04 2.74 **
P*E 14.00 1.55 0.11 20.72 2.04 2.74 **
Galat 30.00 0.16 0.005
Total 59.00 7.21
FK 250.33
Lampiran 14:
DIAMETER KOLONI PENGAMATAN 6 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 7.97 0.27 59.92 1.88 2.46 **
P 1.00 1.98 1.98 432.09 4.17 7.56 **
E 14.00 4.15 0.30 64.57 2.04 2.74 **
P*E 14.00 1.84 0.13 28.68 2.04 2.74 **
Galat 30.00 0.14 0.005
Total 59.00 8.11
FK 275.58
Lampiran 15:
DIAMETER KOLONI PENGAMATAN 7 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 9.04 0.31 111.70 1.88 2.46 **
P 1.00 1.89 1.89 678.17 4.17 7.56 **
E 14.00 5.52 0.39 141.33 2.04 2.74 **
P*E 14.00 1.63 0.12 41.62 2.04 2.74 **
Galat 30.00 0.08 0.003
Total 59.00 9.12
FK 292.17
Lampiran 16:
LUAS PERTUMBUHAN KOLONI PENGAMATAN 1 HSI
Transformasi √x+0.5
Perlakuan Ulangan Total Rataan
1 2
Perlakuan Ulangan Total Rataan
Daftar Sidik Ragam
SK db JK KT F.Hit F.005 F.001 Ket
Perlakuan 29.00 1.07 0.04 19.16 1.88 2.46 **
P 1.00 0.79 0.79 406.00 4.17 7.56 **
E 14.00 0.18 0.01 6.78 2.04 2.74 **
P*E 14.00 0.11 0.01 3.90 2.04 2.74 **
Galat 30.00 0.06 0.002
Total 59.00 1.13
FK 60.71