SUMBER KARBON PADA PRODUKSI BIOPLASTIK
POLIHIDROKSIALKANOAT SECARA
FED-BATCH
OLEH
Ralstonia eutropha
Oleh :
NUR ATIFAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Sesungguhnya dalam penciptaan langit dan bumi, dan pergantian malam dan siang,
terdapat tanda-tanda (kebesaran Allah) bagi orang yang berakal, (yaitu) orang-orang yang mengingat Allah sambil berdiri,
duduk, atau dalam keadaan berbaring,
dan mereka memikirkan tentang penciptaan langit dan bumi (seraya berkata),
“Ya Tuhan kami, tidaklah E ngkau menciptakan semua ini sia-sia; M aha Suci Engkau, lindungilah kami dari azab neraka.”
(QS 3 :190-191)
Kupersem bahkan karya kecil in i un tuk para pen cin ta ilm u
yang m enginginkan ketinggian derajat hakiki di sisi Allah,
Produksi Bioplastik Polihidroksialkanoat secara Fed -Batch oleh Ralstonia eutropha. Dibimbing oleh ANI SURYANI, KHASWAR SYAMSU dan LIESBETINI HARTOTO.
Mengaitkan isu dampak negatif sampah plastik terhadap lingkungan, potensi pasar bioplastik yang prospektif dan keterbatasan aplikasi bioplastik polihidroksialkanoat (PHA) akibat harganya yang belum kompetitif maka penelitian ini dilakukan untuk mengetahui kemampuan Ralstonia eutropha untuk tumbuh dan memproduksi PHA menggunakan substrat yang relatif murah yang berasal dari tanaman tropis khas Indonesia, yaitu hidrolisat pati sagu (Metroxylon sp). PHA merupakan suatu polimer dari hidroksialkanoat yang dihasilkan sejumlah mikroba sebagai cadangan karbon dan energi. Akumulasi PHA di dalam sel R. eutropha ditingkatkan dengan menerapkan kultivasi fed-batch (semi sinambung).
Penelitian ini bertujuan untuk mendapatkan konsentrasi hidrolisat pati sagu yang terbaik bagi pertumbuhan R. eutropha secara batch (curah), mengetahui jenis substrat pengumpan/pembatasan nutrisi yang tepat pada kultivasi fed -batch yang menghasilkan perolehan PHA tertinggi serta mengetahui karakter istik PHA yang dihasilkan. Perlakuan jenis substrat yang dicobakan adalah umpan media lengkap (F1), hidrolisat pati sagu (F2), hidrolisat pati sagu + MgSO4 (F3) dan
hidrolisat pati sagu + MgSO4 + (NH4)2HPO4 (F4) dengan kontrol tanpa umpan
(batch). Kultivasi fed-batch dengan perlakuan pengumpanan terbaik selanjutnya dilakukan dengan pembatasan aerasi dan tanpa pembatasan aerasi.
Hasil penelitian menunjukkan bahwa pada rentang konsentrasi total gula awal hidrolisat pati sagu 10-50 g/L (labu kocok 250 mL, volume kerja 100 mL), R. eutropha tumbuh paling baik pada konsentrasi gula awal 30 g/L dengan laju pertumbuhan spesifik maksimal (µmaks) tertinggi 0,108/jam. Pada kultivasi batch
selama 96 jam (bioreaktor 2 L, volume kerja 1 L)didapatkan konsentrasi akhir sel, µmaks, Yx/s, Yp/x, Yp/s dan ?S/So berturut -turut sebesar 4,41 g/L, 0,109/jam, 0,15 g
sel/g gula, 0,38 g PHA/g sel, 0,06 g PHA/g gula dan 0,99.
Jenis substrat pada kultivasi fed-batch berpengaruh nyata terhadap konsentrasi akhir PHA dan kadar PHA dalam sel, namun tidak berpengaruh nyata terhadap konsentrasi akhir sel. Pembatasan aerasi pada kultivasi fed -batch tidak berpengaruh nyata terhadap konsentrasi sel, konsentrasi PHA dan kadar PHA dalam sel pada akhir kultivasi. Kultivasi fed-batch dengan substrat pengumpan hidrolisat pati sagu merupakan perlakuan terbaik yang menghasilkan konsentrasi akhir sel dan PHA tertinggi yaitu sebesar 4,86 g/L dan 3,72 g/L (76,54% dari bobot kering sel). Terdapat indikasi bahwa N, P, Mg, S merupakan nutrisi pembatas sedangkan oksigen bukan merupakan nutrisi pembatas yang signifikan untuk meningkatkan akumulasi PHA dalam sel R. eutropha.
The Production of Polyhydroxyalkanoates by Fed-Batch Culture of Ralstonia eutropha. Under the direction of ANI SURYANI, KHASWAR SYAMSU and LIESBETINI HARTOTO.
The problems concerning the global environment and solid waste management caused by petrochemical based plastic disposal wastes have created much interest in the development of biodegradable plastics (bioplastics). Polyhydroxyalkanoates (PHAs) have been considered as one of the most promising bioplastics because of its similar physical properties to petrochemical plastics, biocompatibility and complete biodegradability. PHAs are the polymer of hydroxyalkanoates accumulated as a carbon and energy storage material in various microorganisms, usually under unfavorable growth conditions, such as limitation of N, P, S, Mg, or O2 in the presence of excess carbon source. However, one of the problems hindering commercialization of PHA is its high price. The utilization of hydrolyzed sago starch, an indigenous Indonesian crop, as main cultivation substrate is one effort to reduce the production cost of PHA.
This research was conducted to investigate the ability of Ralstonia eutropha to grow and produce PHA on cultivation media containing hydrolyzed sago starch. The accumulation of intracellular PHA was increased by implementing fed-batch cultivations. The fed-batch treatment was the kind of substrate feedings, including complete media (F1), hydrolyzed sago starch (F2), hydrolyzed sago starc h + MgSO4 (F3), and hydrolyzed sago starch + MgSO4 + (NH4)2HPO4 (F4).
Limitation of aeration at stationary growth phase was then treated to the best fed-batch cultivation. The characteristics of PHA obtained were analy ze d.
As the results, R. eutropha grown on hydrolyzed sago starch with initial sugar concentration of 30 g/L showed the best value of maximum spe cific growth rate (µmax) of 0,108 h-1. Kinetic parameters in 96 hour-batch cultivation including
the final cell concentration, Yx/s, Yp/x, Yp/s and ?S/So were 4,41 g/L, 0,15 g cell/g
sugar, 0,38 g PHA/g cell, 0,06 g PHA/g sugar and 99%, respectively.
The kind of feeding substrate on fe d-batch cultivations affected the final PHA concentration and PHA content (P/X) but did not affect the final cell concentration (a = 0,05). Limitation of aeration and its interaction w ith the best fed-batch treatment did not affect the final cell concentration, PHA concentration and PHA content. Feeding with stock solution containing only hydrolyzed sago starch in fed-batch cultivation was the best treatment which resulted in 4,86 g/L of final cell concentration and 3,72 g/L of final PHA concentration (76,54% of cell dry mass). The fed-batch cultivation increased the final PHA concentration more than two folds compared to the batch one. It indicated that N, P, Mg, and S were limiting factors which could increase intracellularly PHA accumulation of R. eutropha but O2 was not.
PHA obtained from the experiment was poly-(3-hydroxybutyrate) (PHB) which had melting temperature of 163,96 oC and relative purity compared to the PHB standard of 76,6%. The PHB functional groups identified from FTIR (Fourier Transform Infrared) analysis were C=O, -C-O-, -CH2-, -CH3, -C-C- and
Dengan ini saya menyatakan bahwa tesis yang berjudul :
PEMANFAATAN HIDROLISAT PATI SAGU SEBAGAI SUMBER KARBON PADA PRODUKSI BIOPLASTIK
POLIHIDROKSIALKANOAT SECARA FED-BATCH
OLEH Ralstonia eutropha
adalah benar merupakan hasil karya sendiri atas arahan komisi pembimbing dan belum pernah dipublikasikan. Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Oktober 2006
Nur Atifah
SUMBER KARBON PADA PRODUKSI BIOPLASTIK
POLIHIDROKSIALKANOAT SECARA
FED-BATCH
OLEH
Ralstonia eutropha
NUR ATIFAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Nur Atifah
NIM : F351020031
Disetujui Komisi Pembimbing
Dr. Ir. Ani Suryani, DEA Ketua
Dr. Ir. Khaswar Syamsu, M.Sc. Dr. Ir. Liesbetini Hartoto, M.S.
Anggota Anggota
Diketahui
Ketua Departemen Dekan Sekolah Pascasarjana Teknologi Industri Pertanian
Dr. Ir. Irawadi Jamaran Dr. Ir. Khairil Anwar Notodiputro, M.S.
© Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari
Institut Pertanian Bogor, sebagian atau seluruhnya dalam bentuk apapun ,
baik cetak, fotokopi, mikrofilm dan sebagainya.
Penulis dilahirkan di Temanggung Jawa Tengah pada tanggal 16 Juli 1977 sebagai anak ketujuh dari delapan bersaudara dari pasangan Syamsuddin (alm.) dan Hj. Maswiyah. Penu lis melangsungkan pernikahan dengan Hidayat Nasrun, Lc. S.Ag. dan telah dikaruniai dua orang putri, yaitu Syarifa Nurul Izzah dan Syifa Shabreena .
Segala puji hanyalah milik Allah SWT semata yang telah memperkenankan penulis menyelesaikan penelitian dengan tema bioplastik dari bakteri dan menuangkan hasilnya dalam bentuk tesis yang berjudul
“Pemanfaatan Hidrolisat Pati Sagu sebagai Sumber Karbon pada Produksi
Bioplastik Polihidroksialkanoat secara Fed-Batch oleh Ralstonia eutropha” sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Departemen Teknologi Industri Pertanian, Sekolah Pascasarjana Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada Ibu Dr. Ir. Ani Suryani, DEA, Bapak Dr. Ir. Khaswar Syamsu, M.Sc. dan Ibu Dr. Ir. Liesbetini Hartoto, M.S. selaku dosen pembimbing atas segala bimbingan, motivasi, arahan dan bantuan finansial yang telah diberikan selama penelitian dan penyusunan tesis. Terima kasih juga penulis sampaikan kepada Ibu Dr. Ir. Titi Candra Sunarti, M.S. selaku dosen penguji luar komisi yang bersedia menguji dan memberikan masukan dalam penulisan tesis.
Terimakasih secara khusus penulis sampaikan kepada suami dan anak-anak tercinta, ibunda Maswiyah dan Zainab, Mas Lutfi dan Mbak Nining, beserta keluarga besar ayahanda Syamsuddin (alm.) dan Ahmad (alm.) yang telah memberikan perhatian, kasih sayang, dorongan dan doa selama pelaksanaan tugas belajar. Terima kasih juga penulis sampaikan kepada segenap pihak yang telah membantu kelancaran pelaksanaan tugas akhir: rekan-rekan di TIP Brawijaya, para laboran di PPSHB (Mbak Peppy, Mbak Emi, Pak Mulya dkk) dan TIP IPB, Teteh Yuli serta teman-teman seperjuangan di berbagai kegiatan studi dan taklim. Atas segala hal yang telah diberikan, Allah-lah sebaik-baik pembalas amal perbuatan.
Penulis berharap karya kecil ini dapat bermanfaat bagi pihak-pihak yang membutuhkan. Semoga dengan mengetahui sekelumit hal tentang bioplastik bakteri ini, akan menambah keimanan kita kepada Dzat Yang Maha Pandai, Pencipta dan Pengatur alam semesta, Allah Subhanahu wa Ta’ala.
Bogor, Oktober 2006
DAFTAR TABEL... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN...xv
PENDAHULUAN...1
Latar Belakang ... .1
Tujuan...3
Hipotesis ...4
Ruang Lingkup ...4
Manfaat...5
TINJAUAN PUSTAKA...6
Hidrolisat Pati Sagu (Metroxylon sp) ...6
Poli(3-Hidroksialkanoat) (PHA) ...7
Ralstonia eutropha dan Jalur Biosintes is PHB ...10
Proses Produksi PHA...14
Proses Hilir PHA...17
Kinetika Kultivasi ...18
Kultivasi Fed-batch...21
METODOLOGI...23
Metode Penelitian...23
Persiapan Substrat... 23
Kinetika Kultivasi BatchR. eutropha...26
Kultivasi Fed-batch dengan Pengumpanan Berbagai Jenis Substrat...27
Pembatasan Aerasi pada Kultivasi Fed -batch Terpilih ...28
Karakterisasi PHA...29
Tempat dan Waktu Penelitian ...29
Bahan dan Alat...29
Karakterisasi Hidrolisat Pati Sagu...32
Kinetika Kultivasi Batch R. eutropha...35
Kultivasi R. eutropha pada Labu Kocok 250 mL ...35
Kultivasi R. eutropha pada Bioreaktor 2 L ...41
Kultivasi Fed-batch...45
Pengaruh Jenis Substrat Pengumpan terhadap Konsentrasi Sel Kering pada Akhir Kultiv asi ...48
Pengaruh Jenis Substrat Pengumpan terhadap Konsentrasi PHA dan Kadar PHA dalam Sel pada Akhir Kultivasi...51
Pembatasan Aerasi pada Kultivasi Batch dan Fed -batch...54
Pengaruh Pembatasan Aerasi terhadap Konsentrasi Sel Kering pada Akhir Kultivasi...55
Pengaruh Pembatasan Aerasi terhadap Konsentrasi PHA dan Kadar PHA dalam Sel pada Akhir Kultivasi ...56
Evaluasi Perlakuan Terbaik ...58
Karakterisasi PHA...60
Sifat Termal PHA...60
Analisis Gugus Fungsional...63
Kemurnian Relatif terhadap PHB Standar...68
KESIMPULAN DAN SARAN ...70
DAFTAR PUSTAKA ...72
Halaman
1 Aplikasi praktis PHA...9 2 Karakteristik hidrolisat pati sagu...32 3 Nilai µmaksR. eutropha yang ditumbuhkan pada berbagai konsentrasi gula
hidrolisat pati sagu ...37 4 Nilai Yx/sR. eutropha yang ditumbuhkan pada hidrolisat pati sagu...40
5 Parameter kinetika kultivasi batch R. eutropha yang ditumbuhkan pada
substrat hidrolisat pati sagu (bioreaktor 2 L) ...45 6 Konsentrasi sel kering, PHA dan kadar PHA dalam sel R. eutropha pada
akhir kultivasi batch dan fed-batch...48 7 Konsentrasi sel kering, PHA dan kadar PHA di dalam sel R. eutropha pada
1 Struktur kimia PHA...8
2 Hasil scanning electron microscope granula PHB pada R. eutropha...11
3 Lintasan umum biosintesis dan degradasi PHB oleh mikroba (Ralstonia eutropha, Azotobacter beijerinckii)...13
4 Skema tahapan umum produksi PHA ...14
5 Kurva pertumbuhan mikroba pada kultivasi batch ...19
6 Diagram alir penelitian...24
7 Diagram alir pembuatan hidrolisat pati sagu secara enzimatis ...25
8 Bioreaktor Biostat M skala 2 L yang digunakan untuk penelitian...30
9 Pola pertumbuhan R. eutropha secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu (labu kocok 250 mL)...36
10 Plot nilai µmaksR. eutropha yang ditumbuhkan secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu ...37
11 Pola konsumsi gula R. eutropha yang ditumbuhkan secara batch pada berbagai konsentrasi total gula (TG) hidrolisat pati sagu ...39
12 Plot nilai Yx/sR. eutropha yang ditumbuhkan pada berbagai konsentrasi total gula (T G) hidrolisat pati sagu ...40
13 Pola pertumbuhan sel dan pembentukan PHA oleh R. eutropha pada hidrolisat pati sagu (batch, bioreaktor 2 L) ...42
14 Kecepatan pembentukan PHA oleh R. eutropha pada kultivasi batch...42
15 Pola dan kecepatan konsumsi gula dalam hidrolisat pati sagu oleh R. eutropha selama kultivasi batch...43
16 Laju dilusi pada kultivasi fed-batch...47
17 Pertumbuhan sel R. eutropha pada kultivasi batch dan fed-batch (bioreaktor 2 L) ...49
18 Sel R. eutropha (mikroskop cahaya, perbesaran 1000 kali)...51
pembatasan aerasi...56
21 Konsentrasi PHA dan kadar PHA dalam sel R. eutropha pada akhir kultivasi batch dan fed-batch dengan tanpa pembatasan aerasi...57
22 Pertumbuhan sel dan pembentukan PHA oleh R. eutropha selama kultivasi batch dan fed-batch...59
23 Serbuk PHA hasil kultivasi fed-batch R. eutropha dengan s umber karbon hidrolisat pati sagu ...60
24 Spektra DSC PHB standar ...61
25 Spektra DSC PHA dari pati sagu ...61
26 Spektra FTIR PHA dari pati sagu ...65
27 Spektra FTIR PHB standar ...65
28 Struktur kimia PHB...67
29 Kromatogram hasil metanolisis PHB standar (menggunakan kromatografi gas) ...68
1 Prosedur analisis...78
2 Contoh penghitungan konsentrasi karbon dan nitrogen...81
3 Kurva standar untuk penentuan kadar total gula dengan metode Fenol-Sulfat...82
4 Kromatogram hasil analisis HPLC larutan standar...83
5 Kromatogram hasil analisis HPLC hidrolisat pati sagu ...84
6 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultiva si batch (skala labu kocok 250 mL) dengan konsentrasi total gula (TG) awal 10, 20, 30, 40 dan 50 g/L ...85
7 Kinetika kultivasi R. eutropha secara batch pada bioreaktor 2 L ...86
8 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi fed -batch dengan komposisi dan volume umpan seperti media awal pada tahap batch (F1)...87
9 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi fed-batch dengan umpan hidrolisat pati sagu(F2) ...88
10 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi fed -batch dengan umpan hidrolisat pati sagu + MgSO4(F3) ...89
11 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi fed -batch dengan umpan hidrolisat pati sagu + MgSO4 + (NH4)2HPO4 (F4) ...90
12 Penghitungan laju dilusi ...91
13 Rekapitulasi data data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi batch (tanpa pengumpanan) dan aerasi dihentikan pada fase stasioner(Ao) ...92
14 Rekapitulasi data konsentrasi sel kering R. eutropha dan gula sisa pada kultivasi fed -batch dengan umpan hidrolisat pati sagu dan aerasi dihentikan pada fase stasioner(F5) ...93
15 Analis is ragam pengaruh pengumpanan terhadap konsentrasi sel kering...94
16 Analis is ragam pengaruh pengumpanan terhadap konsentrasi PHA...95
sel kering, konsentrasi PHA dan kadar PHA dalam sel...97 19 Kromatogram hasil metanolisis PHB standar (menggunakan
kromatografi gas) ...99 20 Kromatogram hasil metanolisis PHA yang dihasilkan pada penelitian
Latar Belakang
Plastik sangat dekat dengan kehidupan manusia karena fungsinya yang luas untuk berbagai tujuan penggunaan. Sebagai polimer sintetis, plastik diproduksi dari bahan-bahan petrokimia yang merupakan sumberdaya terbatas dan tidak terbaharukan. Semakin meningkatnya kebutuhan barang plastik akan menimbulkan masalah lingkungan yang serius karena limbah plastik tidak mudah diurai oleh alam, baik oleh curah hujan dan panas matahari maupun oleh mikroba. Paustin (1998) menyatakan bahwa se kitar 75 milyar pon (34 juta ton) plastik per tahun diproduksi oleh industri plastik dunia dan sekitar 40%-nya dibuang ke tempat penimbunan sampah (landfill area) yang kapasitasnya juga terbatas. Sementara itu, menurut Indonesia Plastic Industries kebutuhan plastik 220 juta penduduk Indonesia pada tahun 2003 mencapai sekitar 1,35 juta ton sedangkan kemampuan pemerintah mengolah sampah hanya 20-30% (Anonim 2002).
Penggunaan bahan plastik ramah lingkungan yang dapat didegradasi secara biologis oleh mikroba (bioplastik) sebagai substitusi plastik berbasis petrokimia merupakan salah satu alternatif pemecahan masalah lingkungan yang ditimbulkan oleh limbah plastik. Kebutuhan dunia akan bioplastik semakin meningkat dari tahun ke tahun. Potensi pasar bioplastik saat ini cukup besar, yaitu mencapai 20 ribu ton. Japan Biodegradable Plastic Society memproyeksikan produksi bioplastik akan mencapai 1,2 juta ton pada tahun 2010. Industri bioplastik akan berkembang menjadi industri besar di masa yang akan datang (Pranamuda 2001).
Dibandingka n bahan bioplastik lain seperti pati dan protein, PHB memiliki keunggulan karena sifatnya yang hidrofobik, resistensinya yang besar terhadap uap air dan permeabilitas oksigennya yang rendah. Hal tersebut membuat kalangan industri tertarik untuk memanfaatkannya sebagai bahan plastik ramah lingkungan dalam bidang pertanian, kelautan dan obat-obatan. PHB dapat diaplikasikan sebagai coating (pelapis), kemasan, kontainer, bahan-bahan sekali pakai, pembawa (carrier) bahan aktif pada bahan-bahan kimia dan obat-obatan, keperluan operasi bedah seperti benang jahit operasi, pembalut luka dan penyambungan tulang yang retak/patah (Lee et al. 1999, Paustin 1998).
Terkait dengan perkembangan riset PHA di Indonesia, Suryani et al. (2001, 2003), Syamsu et al. (2003) dan Wicaksono (2005) telah melakukan kajian produksi PHA oleh Ralstonia eutropha dengan sistem kultivasi batch menggunakan minyak kelapa sawit sebagai sumber karbon. Penelitian Wicaksono (2005) tentang optimasi proses produksi PHA menggunakan sumber karbon hidrolisat minyak kelapa sawit menunjukkan bahwa pada skala labu kocok 250 mL produksi PHA tertinggi mencapai 10,9586 g/L (68,23% dari bobot kering sel) selama 7 hari kultivasi. Namun demikian, pada percobaan skala bioreaktor 2 L, produksi PHA tertinggi hanya mencapai 2,4644 g/L (72,62% dari bobot kering sel). Pada tahap optimasi selanjutnya didapatkan PHA dengan konsentrasi 10,6685 g/L (51,45% dari bobot kering sel). Meskipun PHA yang dihasilkan relatif tinggi dibandingkan penelitian Suryani et al. (2001, 2003) namun kadar PHA dalam sel masih tergolong rendah karena secara alami R. eutropha dapat mengakumulasi PHA hingga 80-90% berat selnya pada kondisi yang sesuai (Kim dan Lenz 2001, Madison dan Huisman 1999). Penelitian tersebut masih perlu ditindaklanjuti dan dikembangkan untuk mendapatkan hasil yang lebih baik.
simulasi proses produksi PHB yang dapat menekan harga PHB menjadi US$ 3,31/kg.
Strategi yang dapat dilakukan untuk menurunkan biaya produksi PHB adalah dengan pengembangan galur bakteri yang lebih unggul, proses kultivasi dan pemisahan yang lebih efektif dan efisien serta penggunaan substrat/bahan baku yang murah dan terbaharukan (Godbole et al. 2003). Salah satu alternatif bahan baku murah dan terbaharukan yang melimpah di Indonesia adalah sagu. Indonesia merupaka n pemilik areal sagu terbesar di dunia dengan luas areal sekitar 1,128 juta ha atau 51,3% dari 2,201 juta ha areal sagu dunia. Namun dari segi pemanfaatannya Indonesia masih jauh tertinggal dibandingkan Malaysia dan Thailand yang masing-masing hanya memil iki areal sagu seluas 1,5% dan 0,2% dari areal sagu dunia (Abner dan Miftahorrahman 2002). Pati sagu sebagai hasil ekstraksi batang empulur sagu dapat dihidrolisis menjadi komponen lebih sederhana seperti glukosa, maltosa dan oligosakarida sehingga dapat dimanfaatkan sebagai sumber karbon yang relatif murah dalam proses produksi PHA.
Ralstonia eutropha merupakan salah satu jenis bakteri yang telah digunakan untuk produksi PHA secara komersial. Kultivasi fed-batch (semi sinambung) dapat diterapkan untuk meningkatkan akumulasi PHA di dalam sel R. eutropha, terutama untuk menciptakan ketidakseimbangan nutrisi pada media pertumbuhan. Teknik kultivasi fed-batch yang berfokus pada pengumpanan sumber karbon yang murah dan pembatasan nutrisi esensial lainnya (nitrogen, fosfat, magnesium, sulfat, oksigen) diharapkan dapat meningkatkan akumulasi PHA dalam sel sehingga ketika dipadukan dengan teknik pemisahan/isolasi yang mudah dan murah maka pada akhirnya dapat menurunkan biaya produksi PHA.
Tujuan
dicobakan (10, 20, 30, 40, 50 g/L), mendapatkan jenis substrat pengumpan/ pembatasan nutrisi yang tepat pada kultivasi fed-batch yang menghasilkan perolehan PHA tertinggi serta mengetahui karakteristik PHA yang dihasilkan.
Hipotesis
Hipotesis yang diajukan pada penelitian ini adalah :
1. Hidrolisat pati sagu diduga dapat digunakan sebagai sumber karbon bagi pertumbuhan dan pembentukan PHA oleh R. eutropha.
2. Sistem kultivasi fed-batch diduga dapat meningkatkan konsentrasi sel dan perolehan PHA dibandingkan dengan sistem kultivasi batch.
3. Pembatasan aerasi pada sistem kultivasi fed -batch diduga dapat meningkatkan perolehan PHA dibandingkan tanpa pembatasan aerasi.
4. Denga n menggunakan sumber karbon gula (hidrolisat pati sagu), R. eutropha akan menghasilkan PHA jenis PHB.
Ruang Lingkup
Ruang lingkup penelitian ini adalah :
1. Melakukan proses produksi hidrolisat pati sagu (Metroxylon sp) secara enzimatis menggunakan a -amilase dan amiloglukosidase (AMG) serta melakukan karakterisasi hidrolisat pati sagu yang dihasilkan (total gula , profil gula , kandungan nitrogen dan mineral).
2. Mengkaji kinetika pertumbuhan R. eutropha secara batch pada skala labu kocok 250 mL (volume kerja 100 mL) pada berbagai konsentrasi gula hidrolisat pati sagu (10, 20, 30, 40, 50 g/L).
3. Mengkaji kinetika kultivasi R. eutropha secara batch pada skala bioreaktor 2 L pada konsentrasi gula terpilih pada Tahap 2.
5. Mengkaji pengaruh pembatasan aerasi terhadap konsentrasi sel kering, konsentrasi PHA dan kadar PHA di dalam sel R. eutropha pada akhir kultivasi fed -batch yang terpilih pada Tahap 4.
6. Melakukan karakterisasi PHA yang dihasilkan meliputi sifat termal, gugus-gugus fungsional, tingkat kemur nian relatif terhadap PHB standar serta menentukan jenis PHA.
Manfaat
Secara umum manfaat penelitian ini adalah :
1. Meningkatkan nilai tambah pati sagu sebagai produk tanaman tropis alami Indonesia.
2. Memberikan sumbangan pemikiran dalam pengembangan proses produksi PHA sebagai bahan plastik ramah lingkungan.
3. Menjaga keanekaragaman haya ti (biodiversity) dengan mengembangkan bioplastik sebagai substitusi plastik konvensional berbasis petroleum.
4. Sebagai salah satu upaya untuk meningkatkan kompatibilitas dan penyelarasan bidang penelitian dalam kerangka pembangunan nasional dengan perkembangan isu lingkungan global.
Hidrolisat Pati Sagu (Metroxylon sp)
Pati sagu merupakan hasil ekstraksi pati dari batang empulur tanaman sagu. Sagu merupakan tumbuhan monokotil dari ordo Spadiciflorae, keluarga Palmae dan genus Metroxylon. Di Indonesia tanaman utama penghasil pati sagu adalah Metroxylon yang tumbuh di lahan basah dan Arenga microcarpha (sagu baruk) yang tumbuh di lahan kering. Di Irian Jaya dan sebagian daerah Maluku, sagu merupakan bahan makanan pokok sedangkan di propinsi lain sagu dimanfaatkan sebagai bahan baku industri dan bahan makanan. Pada produksi tahun 1999 sebesar 16178 ton sagu dikonsumsi oleh industri menengah besar dalam negeri, terutama di pulau Jawa, yang menggunakan sagu sebagai bahan baku makaroni, spagetti, bihun, soun dan bakso. Jepang memanfaatkan sagu sebagai bahan baku industri plastik biodegradabel (Abner dan Miftahorrahman 2002).
Pati merupakan homopolimer glukosa dengan ikatan a-glikosidik. Pati terdiri dari dua fraksi yang dapat dipisahkan dengan air panas. Fraksi terlarut disebut amilosa dan fraksi tidak larut disebut amilopektin. Amilosa mempunyai struktur rantai lurus dengan ikatan a-(1,4)-D-glukosa sedangkan amilopektin selain mempunyai rantai lurus juga mempunyai cabang dengan ikatan a -(1,6)-D-glukosa sebanyak 4-5% dari berat total (Winarno 1997). Kebanyakan pati terdiri dari amilosa dan amilopektin dengan perbandingan 1:3 (Pomeranz 1991).
Sirup glukosa adalah cairan jernih dan kental dengan komponen utama glukosa dan diperoleh dari proses hidrolisis pati dengan cara kimia atau enzimatik (SNI 01-2978-1992). Cara hidrolisis pati ada tiga macam, yaitu hidrolisis asam (pada umumnya HCl) yang disebut konversi asam, konversi asam-enzim dan konversi enzim-enzim. Cara terakhir paling banyak digunakan saat ini.
konsentrasi enzim yang tinggi, waktu hidrolisis reaksi yang lama dan konsentrasi substrat yang relatif tinggi (30-40% basis kering, b/b) pada proses industri dapat menyebabkan reaksi reversi (balik) yaitu sintesis kembali sa karida dari glukosa (Govindasamy et al. 1995)
a -amilase (a-1,4 glukan-4-glukonohidrolase) yang digunakan dalam tahap likuifikasi merupakan endoamilase, yaitu enzim yang memecah secara acak ikatan a -(1,4) yang terletak pada bagian dalam rantai polisakarida. Pemecahan ini menghasilkan glukosa, maltosa dan a -limit dekstrin, yaitu oligosakarida dengan empat atau lebih residu glukosa yang semuanya mengandung ikatan a -(1,6). Tahap ini ditandai dengan menurunnya viskositas suspensi pati dan daya pewarnaan larutan yodium terhadap amilosa. Pengaruh pH terhadap kestabilan dan keaktifan enzim sangat penting. a-amilase dari Bacillus subtilis mempunyai pH optimum antara 5,8 – 6,0 (Norman 1981).
Terdapat dua jenis endoamilase, yaitu termostabil dan termolabil. Endoamilase termostabil terutama berasal dari genus Bacillus. Amilase dari B. subtilis optimum pada suhu 65-70 oC dengan keberadaan Ca2+ sedangkan amilase dari B. licheniformis optimum pada suhu di atas 90 oC tanpa adanya Ca2+. Amilase termolabil berasal dari kapang, biasanya Aspergillus oryzae (Fullbrook 1984).
Glukoamilase atau amiloglukosidase atau AMG yang digunakan pada tahap sakarifikasi merupakan eksoenzim, yaitu enzim yang bekerja melepaskan unit glukosa secara berturut -turut dari ujung non reduksi pati. AMG mempunyai keaktifan optimal pada pH 4-5 dengan suhu 50-60 oC. Pada tahap sakarifikasi ini terjadi hidrolisis oligosakarida atau dekstrin menjadi glukosa. Tidak seperti likuifikasi yang hanya memakan waktu sekitar 60 menit, sakarifikasi biasanya memakan waktu yang lebih lama yaitu 24-96 jam (Fullbrook 1984).
Poli(3-Hidroksialkanoat) (PHA)
2001). Steinbüchel dan Valentin (1995) sebagaimana dikutip oleh Kim dan Lenz (2001) menyatakan bahwa lebih dari 90 unit monomer hidroksialkanoat yang telah dideteksi se bagai konstituen penyusun PHA. Hal ini menyebabkan PHA sebagai bahan termoplastik memiliki sifat mekanis yang bervariasi, misalnya sebagai penyusun polimer kristalin yang kuat atau karet elastis tergantung dari unit-unit monomer penyusunnya (Lee 1996).
Berdasarkan panjang unit penyusun polimernya, PHA diklasifikasikan menjadi 2 kelompok, yaitu PHA rantai pendek (short chain length PHA/poly HASCL) dan PHA rantai menengah (medium chain length PHAs/poly HAMCL). PHA rantai pendek terdiri dari tiga sampai lima atom karbon, yaitu unit 3HB (hidroksibutirat) dan 3HV (hidroksivalerat). PHA rantai menengah terdiri enam atau lebih atom karbon, yaitu unit-unit yang lebih panjang dari 3HV. PHA yang terdiri dari dua tipe di atas disebut sebagai hibrid PHA rantai pe ndek dan menengah (Kim dan Lenz 2001, Lee dan Choi 2001). Struktur umum PHA dapat dilihat pada Gambar 1.
R O
CH C
CH2 O
n
Gambar 1 Struktur kimia PHA (Madison dan Huisman 1999).
Penamaan PHA ditentukan berdasarkan gugus alkil R pada unit monomer penyusunnya. Misalnya, dinamakan PHB atau poli(3-hidroksibutirat) jika R adalah CH3 (metil), PHV atau poli( 3-hidroksivalerat) jika R adalah CH2CH3 (etil),
PHC atau hidroksikaproat) jika R adalah n-propil, PHH atau poli(3-hidroksiheptanoat) jika R adalah n-butil, PHO atau poli(3-hidroksioktanoat) jika R adalah n-pentil, PHN atau poli(3-hidroksinanoat) jika R adalah n-heksil, PHD atau poli(3-hidroksidekanoa t) jika R adalah n-heptil, PHUD atau poli(3-hidroksi undekanoat) jika R adalah n-oktil dan PHDD atau poli(3-hidroksidodekanoat) jika R adalah n-nonil (Atkinson dan Mavituna 1991, Brandl et al. 1990).
R dapat terdiri dari C1-C13,
PHA ada dalam bentuk homo dan heteropolimer. Homopolimer poli(3-hidroksibutirat) atau PHB memiliki sifat termoplastik dengan sifat mekanis bagus, mirip dengan polipropilen dan merupakan jenis PHA yang pertama ditemukan dan paling banyak diteliti. Namun demikian, sebagai plastik PHB bersifat sangat rapuh karena tingginya derajat kristalinitas, di samping itu suhu pelelehannya (180 oC) mendekati suhu degradasi termalnya (200 oC). Kelemahan ini dapat diperbaiki dengan kopolimerisasi 3HB dan 3HV menjadi kopolimer poli(3HB-co-3HV) yang lebih fleksibel dan rendah suhu prosesnya (Kim dan Lenz 2001). Suatu galur mutan Ralstonia eutropha yang ditumbuhkan pada glukosa dan asam propionat dapat menghasilkan kopolimer dari monomer 3HB dan 3HV. Kerapuhan kopolimer HB-HV lebih rendah daripada PHB, sifat termomekanisnya lebih bervariasi tergantung dari kadar unit 3-HV penyusunnya sehingga aplikasinya lebih luas (Lefebvre et al. 1997, Klem 1999). Beberapa contoh aplikasi PHA dapat dilihat pada Tabel 1.
Tabel 1 Aplikasi praktis PHA*)
Aplikasi medis
1. Keperluan operasi bedah : benang jahit, pin, penyeka 2. Pembalut luka
3. Pemasangan pembuluh darah
4. P enyambungan tulang dan lempeng tulang
5. Stimulasi pertumbuhan tulang (karena PHA bersifat piezoelektrik) 6. Pembawa (carrier) bahan aktif pada obat-obatan
Aplikasi industri
1. Pembawa (carrier) bahan aktif pada herbisida, fungisida, insekstisida atau pupuk
2. Kemasan kontainer, botol, pembungkus, kantong dan film
3. Bahan-bahan sekali pakai seperti popok bayi dan pembalut wanita
*)
Brandl et al. (1990), Lee et al. (1999)
tentang metabolisme, biologi dan genetika molekuler serta kloning lebih dari 20 gen biosintesis PHA memungkinkan dilakukannya konstruksi galur-galur rekombinan bakteri yang dapat mensintesis poliester dengan unit monomer yang berbeda -beda dan atau bakteri yang dapat mengakumulasi polimer dalam jumlah lebih banyak (Lee 1996).
Terdapat lebih dari 300 jenis mikroba yang dapat mensintesis PHA (30-80% dari berat kering selnya) namun hanya sejumlah bakteri termasuk Ralstonia eutropha, Alcaligenes latus, Azotobacter vinelandii, Chromobacterium violaceum,
metilotrof, pseudomonad dan rekombinan Escherichia coli yang prospektif digunakan dalam komersialisasi produksi PHA karena produktifitasnya lebih besar dari 2 g/L.jam (Lee 1996, Lee dan Choi 2001).
Ralstonia eutropha danJalur Biosintesis PHB
Klem (1999) menyatakan bahwa berdasarkan kajian sekuens dan hibridisasi RNA 16S, Alcaligenes eutrophus dikelompokkan ke dalam genus Ralstonia dengan nama baru Ralstonia eutropha. R. eutropha termasuk bakteri Gram negatif, aerob obligat, motil, suhu optimum 20-37 oC, koloni tidak berwarna
pada Nutrient Agar, oksidase positif dan katalase positif, tidak memproduksi indol, kemoorganotrofik atau dapat menggunakan berbagai macam asam organik dan asam amino sebagai sumber karbon, dapat mereduksi NO3- menjadi NO2- dan
dapat tumbuh secara anaerobik dengan adanya NO3-. Habitat alaminya adalah
awal fase akumulasi polimer dan produksi polimer mulai menurun ketika kadar PHB hampir 80% meskipun aktifitas sintase PHB masih cukup tinggi. Gambar granula PHB pada R. eutropha dapat dilihat pada Gambar 2.
Gambar 2 Hasil scanning electron microscopegranula PHB pada R. eutropha (Sumber : http://che.kaist.ac.kr/~biosyst/research/pha/pha.html).
Selama pertumbuhan normal, pembentukan PHA biasanya tidak mencapai konsentrasi tinggi dalam sel yaitu antara 2-10% dari bobot kering sel, tergantung dari galur bakteri. Namun demikian, kadar PHB dapat mencapai lebih dari 80% berat kering sel jika pertumbuhan dibatasi dengan berkurangnya suatu komponen nutrisi penting (Braunegg et al. 1995). Tiga galur R. eutropha yang paling banyak dipelajari adalah (1) produsen PHB asli H16 (ATCC 17699), (2) mutan yang dapat menggunakan glukosa yaitu 11599 dan (3) SH-69 (ATCC 17697) (Madison
dan Huisman 1999). Komponen awal yang terpenting pada sintesis PHB intra selular dalam sel
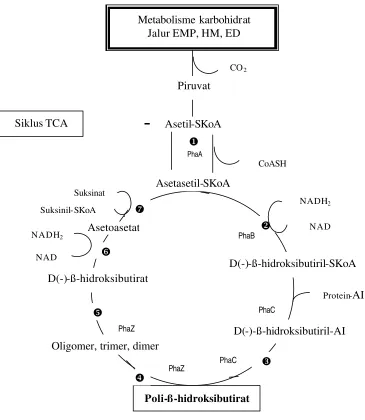
katalis PHB polimerase (Lafferty et al. 1988). Jalur metabolisme dan degradasi PHB oleh R. eutropha dari karbohidrat secara lebih lengkap dapat dilihat pada Gambar 3.
Memperjelas pendapat Lafferty et al. (1988), Klem (1999) menyatakan bahwa pada R. eutropha terdapat operon tunggal yang mengandung 3 jenis gen yang diperlukan untuk sintesis PHB, yaitu phbA, phbB dan phbC. PhbA (suatu ketot iolase ) bergabung dengan dua molekul asetil-KoA untuk menghasilkan asetoasetil-KoA yang kemudian direduksi menjadi R-ß-hidroksibutiril-KoA oleh phbB (yaitu suatu reduktase asetosetil-KoA yang membutuhkan NADPH). Molekul R-ß -hidroksibutiril-KoA membentuk unit monomer PHB, kemudian dipolimerisasi melalui ikatan ester oleh phbC (suatu PHB sintase). Pada lingkungan yang ka ya, PHB secara enzimatis didegradasi menjadi asetil-KoA yang masuk ke jalur primer metabolisme dan dimineralisasi menjadi CO2.
Degradasi dimulai oleh depolimerase yang dikode sebagai gen phbZ.
Keterangan :
u ß-ketothiolase (ß-ketoasilthiolase, asetoasetil-KoA, asetasetil-KoA thiolase)
v Asetasetil-KoA reduktase
w PHB polimerase (PHB sintetase)
x PHB hidrolase
y Dimer hidrolase
z ß-hidroksibutirat dehidrogenase
{ Thiophorase (asetasetil-SKoA thiokinase; Asetoasetat -suksinil-KoA transferase) EMP : jalur glikolisis Embden-Meyerhof-Parnas
HM : jalur Heksosa Monofosfat ED : jalur Entner-Doudoroff
Gambar 3 Lintasan umum biosintesis dan degradasi PHB oleh mikroba (Ralstonia eutropha, Azotobacter beijerinckii) (Lafferty et al.1988).
Proses Produksi PHA
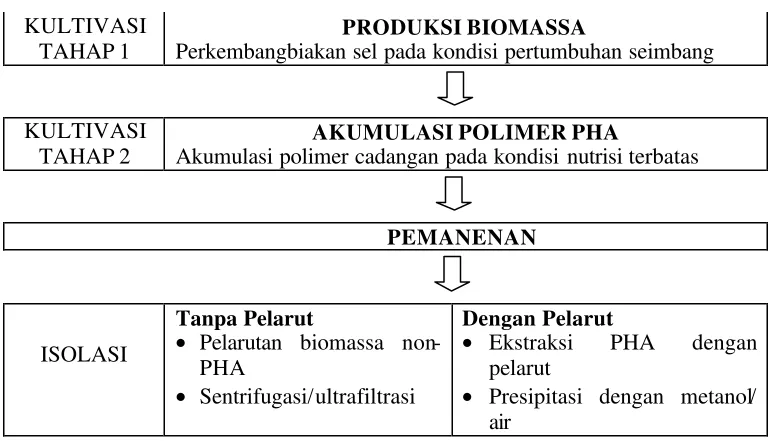
Proses produksi PHA secara umum terdiri dari dua tahap utama, yaitu kultivasi dan recovery/isolasi PHA. Tahap kultivasi merupakan tahap pertumbuhan biomassa sel dan akumulasi biopolimer PHA. Setelah kultivasi berakhir, dilakukan pemanenan biomassa dan biopolimer yang diikuti dengan tahap isolasi biopolimer. Pemisahan biopolimer dapat dilakukan dengan pelarut (solvent based) maupun tanpa pelarut (non-solvent-based). Pemisahan tanpa pelarut pada dasarnya adalah pr oses melarutkan biomassa non-PHA, diikuti dengan sentrifugasi atau ultrafiltrasi. Pemisahan dengan pelarut merupakan proses ekstraksi PHA dengan pelarut, diikuti de ngan presipitasi dengan air/metanol (Kessler et al. 2001). Tinjauan umum proses produksi PHA lebih jelas dapat dilihat pada Gambar 4.
KULTIVASI TAHAP 1
PRODUKSI BIOMASSA
Perkembangbiakan sel pada kondisi pertumbuhan seimbang
KULTIVASI TAHAP 2
AKUMULASI POLIMER PHA
Akumulasi polimer cadangan pada kondisi nutrisi terbatas
PEMANENAN
Gambar 4 Skema tahapan umum produksi PHA (Kessler et al. 2001).
(curah), fed-batch (semi sinambung) maupun kontinyu (sinambung). Sistem fed-batch banyak diterapka n terutama untuk memicu peningkatan akumulasi PHA di dalam sel. Pada saat pergantian operasi dari batch ke fed -batch, densitas biomassa telah mencapai level yang tinggi dan konsentrasi substrat kunci menurun dan hampir habis. Level substrat pembatas yang rendah tersebut dipertahankan dengan pengumpanan perlahan substrat berkonsentrasi tinggi secara konstan (Nie lsen dan Villadsen 1993). Terkait dengan penggunaan glukosa sebagai sumber karbon bagi R. eutropha, beberapa strategi pengumpanan substrat telah dikembangkan selama kultivasi fed-batch untuk menjaga konsentrasi glukosa agar tetap berada dalam rentang yang optimal untuk akumulasi PHB (Lee dan Choi 2001).
Tanaka et al. (1993) menggunakan metode kultur dua tahap untuk menghasilkan PHB dari xilosa. Xilosa dikonversi menjadi L-asam laktat dan asam asetat oleh Lactococcus lactis IO-1, selanjutnya dikonversi menjadi PHB oleh R. eutropha. Hasil penelitian menunjukkan bahwa dari 10 g/L L-laktat dihasilkan 8,5 g/L biomassa R. eutropha dengan kadar PHB 55% selama 24 jam kultivasi .
Kim et al. (1994) memproduksi PHB dari R. eutropha dengan teknik kultur fed -batch secara otomatis dengan perlakuan pembatasan amonium. Konsentrasi glukosa pada kultur dikontrol pada kisaran 10-20 g/L menggunakan analisator glukosa secara on line dan berdasarkan data gas keluar yang diperoleh dari spektrometer massa. Konsentrasi akhir sel, konsentrasi PHB dan produktifitas PHB meningkat ketika pengumpanan amoniak dihentikan pada saat sel mencapai konsentrasi tinggi. Hasil penelitian menunjukkan bahwa ketika pengumpanan amoniak dihentikan saat konsentrasi sel mencapai 70 g/L maka konsentrasi PHB dan total sel berturut-turut mencapai 121 g/L dan 164 g/L dalam waktu 50 jam kultivasi. Rendemen PHB maksimal yang dapat dicapai pada penelitian ini adalah 76% dari berat kering sel dengan produktifitas sebesar 2,42 g/L.jam dan rendemen sebesar 0,3 g PHB/g glukosa.
berdasarkan pengontrolan konsentrasi oksigen terlarut. Dengan konsentrasi awal fosfat sebesar 5,5 g/L, konsentrasi akhir sel yang dihasilkan mencapai 281 g/L, konsentrasi PHB 232 g/L dan produktifitas PHB 3,14 g/L.jam.
Sang Yup Lee dalam serangkaian penelitiannya menggunakan R. eutropha dan rekombinan E. coli dengan sistem kultivasi fed-batch. Pengumpanan substrat dilakukan berdasarkan pH disertai dengan pengontrolan kandungan oksigen terlarut untuk menghasilkan homopolimer PHB maupun kopolimer HB-HV dengan produktifitas yang lebih tinggi. Disertai dengan teknik isolasi PHA yang relatif murah, mudah dan ramah lingkungan menggunakan pelarut NaOH, Lee dan Choi (2001) mensimulasikan faktor -faktor tersebut sehingga biaya produksi PHB menjadi lebih rendah, yaitu US$ 3,31/kg.
Komersialisasi PHA dimulai oleh ZENECA-Inggris yang menggunakan mutan R. eutropha untuk memproduksi PHB dan PHBV berskala industri sejak tahun 1982 dengan merek BIOPOL. Sumber karbon yang digunakan adalah glukosa dengan fosfat sebagai nutrisi pembatas. Proses produksi menggunakan bioreaktor berskala 200 000 L dengan sistem kultivasi fed -batch dua tahap. Pada tahap pertama, sel ditumbuhkan pada media garam mineral dengan glukosa sebagai satu-satunya sumber karbon dan sumber energi serta dan sejumlah fosfat yang telah dihitung berdasarkan kebutuhan mikroba untuk memproduksi sejumlah biomassa tertentu. Sejalan dengan pertumbuhan kultur, fosfat dalam media semakin berkurang. Pada tahap kedua ketika fosfat berada dalam jumlah terbatas, sel mulai memproduksi dan menyimpan polimer. Pada saat tersebut, glukosa diumpankan ke dalam kultur kemudian kultivasi dilanjutkan sampai jumlah polimer yang diinginkan tercapai. Masing-masing tahap berlangsung kira-kira 48 jam dan berat kering biomassa akhir mencapai 100 g/L. Pada tahun 1996 produksi tersebut diteruskan oleh MONSANTO-Amerika Serikat namun kemudian terhenti pada tahun 1998 (Byrom 1990, 1992 dikutip oleh Kessler et al. 2001).
produksinya dihentikan pada tahun 1993 (Byrom 1990, 1992 dikutip oleh Kessler et al. 2001).
Prose Hilir PHA
Setelah tahap kultivasi, sel yang mengandung PHA harus dipisahkan dari broth (media kultivasi) dengan berbagai prosedur konvensional seperti sentrifugasi, filtrasi atau flokulasi-sentrifugasi. Sel selanjutnya dipecah agar polimer di dalamnya dapat diisolasi (Kessler et al. 2001). Metode yang paling sering digunakan untuk mengisolasi PHA adalah ekstraksi polimer dari biomassa menggunakan pelarut (seperti: kloroform, metilen klorida, propilen karbonat, dikloroetan). Namun demikian, proses tersebut membutuhkan pelarut dalam jum lah besar. Pada proses ekstraksi PHB dengan pelarut kloroform, PHB yang diperoleh memiliki kemurnian tinggi dan tidak terjadi degradasi selama ekstraksi. Namun kelemahannya, diperlukan kloroform dalam jumlah besar karena larutan polimer yang mengandung PHB = 5% (b/v) bersifat sangat kental (viscous) sehingga proses operasinya menjadi sulit (Lee et al. 1999).
Beberapa metode lain juga dikembangkan, misalnya penggunaan sodium hipoklorit untuk memecah bahan-bahan sel non-PHA secara bertahap. Meskipun efektif, sodium hipoklorit dapat mendegradasi PHA sehingga menurunkan berat molekulnya (Kessler et al. 2001). Hahn et al. (1995) membandingkan penggunaan sodium hipoklorit dan dispersi sodium hipoklorit -kloroform untuk mengisolasi PHB yang disintesis oleh R. eutropha dan rekombinan E. coli. Tingkat degradasi PHB pada perlakuan dispersi sodium hipoklorit-kloroform lebih rendah jika dibandingkan dengan perlakuan sodium hipoklorit saja. Semakin tinggi konsentrasi hipoklorit yang digunakan, semakin kecil berat molekul PHB yang diperoleh.
Choi dan Lee (1999) telah me neliti kemampuan berbagai jenis bahan kimia untuk memecah bahan sel selain PHB, meliputi asam (HCl, H2SO4), alkali
(NaOH, KOH, NH4OH) dan surfaktan (ga ram sodium dioktilsulfosuksinat/AOT,
untuk isolasi PHB dari rekombinan E. coli namun harganya mahal dan limbahnya menimbulkan masalah baru.
NaOH dan KOH juga efisien dan ekonomis untuk isolasi PHB sehingga digunakan untuk optimasi kondisi isolasi. Pada perlakuan NaOH 0,2 N selama 1 jam, kultur dengan densitas sel 50 g/L dan rendemen PHB 77% dapat diperoleh dengan kemurnian 98,5%. Selanjutnya dibandingkan 2 metode, antara surfaktan-hipoklorit dan NaOH. Dengan proses kultivasi yang menghasilkan PHB 157 g/L, rendemen 77% dan produktifitas 3,2 g PHB/L.jam dipadukan dengan metode isolasi NaOH maka biaya produksi PHB dapat ditekan 25% lebih rendah menjadi US$ 3,66/kg dibandingkan dengan metode surfaktan-hipoklorit (Choi dan Lee 1999).
Lee et al (1999) melakukan pemecahan sel rekombinan E. coli yang mengandung 69% PHB dengan NaOH 0,2 N selama 1 jam pada suhu 30 oC dan PHB yang diperoleh menunjukkan kemurnian 97%. Jika waktu pemecahan (digestion) diperpanjang hingga 5 jam maka kemurnian PHB meningkat menjadi 98%, begitu juga jika konsentrasi NaOH ditingkatkan menjadi 2 N. Pemecahan bahan-bahan sel non-PHA dengan NaOH (NaOH digestion) memiliki beberapa kelebihan, yaitu (a) murah dan ramah lingkungan, (b) PHB yang diperoleh memiliki kemurnian tinggi (>98%) dan (c) selama proses ekstraksi tidak terjadi degradasi PHB.
Kinetika Kultivasi
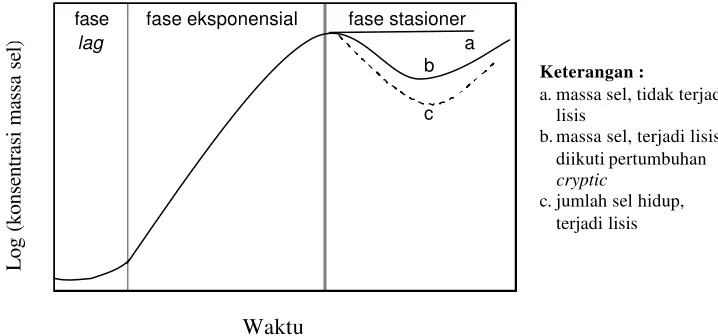
fase fase eksponensial fase stasioner
lag a
b
c
Gambar 5 Kurva pertumbuhan mikroba pada kultivasi batch (Wang et al. 1979)
Pada fase lag (fase awal dan pe nyesuaian) yang merupakan masa penyesuaian mikroba sejak sel mikroba diinokulasi ke media biakan, massa sel meningkat tetapi tidak terjadi pembelahan sel. Oleh karena itu, X = Xo = tetap dengan Xo = konsentrasi sel pada t = 0.
Laju pertumbuhan, rx (g/L.j) = dx/dt = 0 ...(1)
Laju pertumbuhan spesifik, µ (j-1) = dx/dt .1/X = 0 ...(2) Ketika kultur mikroba dipindahkan ke lingkungan baru maka dibutuhkan penataan ulang terhadap komponen penyusun mikro dan makromolekularnya . Setelah fase adaptasi selesai, maka sel menuju fase pertumbuhan eksponensial (log/ logaritmik).
Pada fase eksponensial, jumlah sel meningkat pada laju konstan, laju pertumbuhan meningkat sebanding dengan X. Laju pertumbuhan spesifik tetap dan mencapai nilai maksimal (µm).
dx/dt . 1/X = µm
? 1/X. dx = ? µm . dt
Ln X2 – Ln X1 = µm (t2 - t1) ...(3)
Waktu generasi atau penggandaan (tg), yaitu waktu yang dibutuhkan untuk
menggandakan massa sel dua kali semula sehingga X2 = 2X1, dapat ditentukan
sebagai berikut :
a. massa sel, tidak terjadi lisis
b. massa sel, terjadi lisis diikuti pertumbuhan cryptic
Pada fase pelambatan, substrat yang diperlukan untuk pertumbuhan mendekati habis dan terjadi penumpukan produk-produk penghambat sehingga terjadi penurunan laju pertumbuhan. Pada fase stasioner, konsentrasi biomassa mencapa i maksimal. Laju kematian sel sebanding dengan laju penggandaan sel. Oleh karena itu pertumbuhan berhenti dan menyebabkan terjadinya modifikasi struktur biokimiawi sel. Pada fase menurun laju kematian lebih cepat daripada laju penggandaan sel. Fase ini ditandai dengan berkurangnya jumlah sel hidup akibat terjadinya kematian yang diikuti autolisis oleh enzim selular. Wang et al. (1979) menyatakan bahwa pada fase stasioner masih terjadi metabolisme dan akumulasi produk di dalam sel atau broth. Massa sel total mungkin konstan (Gambar 5a), akan tetapi jumlah sel hidup mungkin menurun (Gambar 5c). Dengan menurunnya jumlah sel hidup, maka terjadilah lisis sel sehingga massa sel menurun (Gambar 5b). Produk-produk lisis sel dalam media memungkinkan terjadinya periode pertumbuhan sekunder yang disebut pertumbuhan kriptik (cryptic).
Pertumbuhan dan pembentukan produk oleh mikroba merupakan proses biokonversi nutrisi menjadi massa sel dan metabolit (Wang et al. 1979). Yield atau rendemen biomassa (Yx/s) dan rendemen produk (Yp/s) merupakan parameter
penting yang menggambarkan efisiensi konversi substrat menjadi biomassa dan produk. Parameter tersebut didefinisikan sebagai bobot biomassa atau produk yang terbentuk per bobot substrat yang dikonsumsi dalam selang waktu tertentu (Scragg 1991).
? X X- Xo
Yx/s = = ...(8)
? S So – S
? P P - Po
Yp/s = = ...(9)
? S So – S
dengan ? X dan ? P merupakan ju mlah sel dan produk yang terbentuk dengan dikonsumsinya substrat sebanyak ? S. Koefisien konversi nutrisi dalam substrat yang berhubungan dengan efisiensi penggunaan substrat dijelaskan dengan persamaan berikut :
Mangunwidjaja dan Suryani (1994) menyatakan bahwa hubungan kinetika pertumbuhan sel dan pembentukan produk tergantung pada peranan produk dalam metabolisme sel. Dalam hal ini dikenal tiga pola hubungan, yaitu :
1. Pola pertumbuhan berasosiasi dengan pembentukan produk yaitu laju pembentukan produk berbanding secara proporsional dengan laju pertumbuhan. dP/dt = a dx/dt atau rp = Yp/x . rx ...(5)
2. Pola pembentukan produk tak berasosiasi dengan pertumbuhan yaitu laju pembentukan produk cenderung berbanding secara proporsional dengan konsentrasi selular daripada dengan laju pertumbuhan. rp = ß X ...(6)
3. Pola campuran per tumbuhan berasosiasi dan tak berasosiasi yaitu laju pembentukan produk berbanding lurus dengan konsentrasi sel maupun laju pertumbuhan. rp = a rx + ß X atau rp/X = a µ + ß ...(7)
dengan dP/dt = rp : laju pembentukan produk, rx : laju pertumbuhan sel, Yp/x :
rendemen produk yang dihasilkan per biomassa terbentuk (g/g), a : tetapan pembentukan produk yang berasosiasi dengan pertumbuhan, ß: tetapan pembentukan produk yang tidak berasosiasi dengan pertumbuhan.
Kultivasi Fed-batch
Yoshida et al. (1973) seperti dikutip oleh Stanbury dan Whitaker (1984) memperkenalkan istilah fed-batch untuk menggambarkan kultur batch yang diumpan dengan media secara kontinyu atau terputus -putus tanpa pengambilan cairan kultur sehingga volume kultur semakin bertambah selama waktu kultivasi. Scragg (1991) mendefinisikan kultur fed-batch sebagai kultur dengan pasokan nutrisi secara kontinyu yang dapat dioperasikan dalam dua cara, yaitu dengan volume yang berubah-ubah dan dengan volume konstan. Tipe kultivasi ini dapat mencegah penghambatan substrat terhadap pertumbuhan dengan menambahkan substrat pada tahap batch dan dapat menyebabkan perubahan laju pertumbuhan secara periodik.
berikut (dengan asumsi bahwa jum lah inokulum awal tidak signifikan dibandingkan dengan biomassa akhir) :
Xmaks ˜ Y. SR ...(11)
dengan Y = yield untuk substrat pembatas (g biomassa/g substrat yang dikonsumsi) dan SR = konsentrasi substrat dalam media.
Jika media segar ditambahkan ke dalam bejana kultivasi pada laju dilusi (D) yang lebih kecil daripada µmaks maka sebenarnya semua substrat akan
dikonsumsi saat diumpankan ke dalam sistem. Meskipun ju mlah biomassa dalam bejana bertambah seiring waktu kultivasi, namun sebenarnya konsentrasi sel (x) adalah konstan, yaitu dx/dt ˜ 0 dan oleh karena itu µ = D. Sistem tersebut dikatakan berada dalam keadaan quasi-steady state. Semakin bertambahnya waktu kultivasi dan volume kultur, maka laju dilusi akan menurun. Nilai D dijelaskan dengan persamaan berikut :
F
D = ... (12) Vo + F .t
dengan F = laju pengumpanan, Vo = volume awal kultur, t = waktu pengumpanan pada operasi fed -batch..
Metode Penelitian
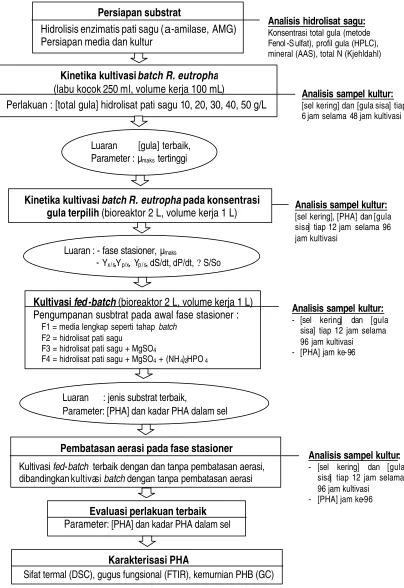
Penelitian dibagi menjadi lima tahap, yaitu : (1) persiapan substrat, (2) kajian kinetika kultivasi batch, (3) kultivasi fed-batch dengan perlakuan variasi jenis substrat pengumpan, (4) pembatasan aerasi pada kultivasi fed -batch terpilih dan (5) karakterisasi PHA yang dihasilkan dari perlakuan terbaik. Diagram alir penelitian dapat dilihat pada Gambar 6.
Persiapan Substrat
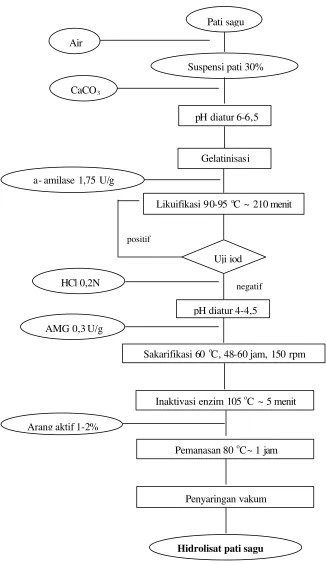
Pembuatan Hidrolisat Pati Sagu (Akyuni 2004)
Suspensi pati sagu dalam air 30% (b/v) diatur pH-nya 6-6,5 dengan menambahkan CaCO3 kemudian digelatinisasi sempurna dengan cara
memanaskan (70-80 oC) dan mengaduknya hingga kental dan bening. Likuifikasi dilakukan dengan menambahkan a-amilase sebanyak 1,75 U/g pati dan memanaskan (disertai pengadukan) suspensi pati yang telah tergelatinisasi pada suhu 90-95 oC selama 210 menit. Hasil likuifikasi selanjutnya disakarifikasi pada suhu 60 oC, pH 4-4,5 selama 48-60 jam pada inkubator goyang 150 rpm dengan menambahkan amiloglukosidase (AMG) sebanyak 0,3 U/g pati.
5
Gambar 6 D iagram alir penelitian.
Analisa hidrolisat sagu
Konsentrasi total gula (metode fenol sulfat), profil gula (HPLC), mineral (AAS), total N (Kjehldahl)
Kinetika kultivasi batch R. eutropha
(labu kocok 250 ml, volume kerja 100 mL)
Perlakuan : [total gula] hidrolisat pati sagu 10, 20, 30, 40, 50 g/L
Kultivasi fed -batch (bioreaktor 2 L, volume kerja 1 L)
Pengumpanan susbtrat pada awal fase stasioner :
F1 = media lengkap seperti tahap batch
F2 = hidrolisat pati sagu F3 = hidrolisat pati sagu + MgSO4
F4 = hidrolisat pati sagu + MgSO4 + (NH4)2HPO4
Karakterisasi PHA
Sifat termal (DSC), gugus fungsional (FTIR), kemurnian PHB (GC) Luaran : [gula]terbaik,
Parameter : µmaks tertinggi
Luaran : jenis substrat terbaik,
Parameter: [PHA] dan kadar PHA dalam sel
Analisis sampel kultur:
[sel kering] dan [gula sisa] tiap 6 jam selama 48 jam kultivasi
Kinetika kultivasi batchR. eutropha pada konsentrasi
gula terpilih (bioreaktor 2 L, volume kerja 1 L) Analisis sampel kultur: [sel kering], [PHA] dan [gula
sisa] tiap 12 jam selama 96 jam kultivasi
Luaran : - fase stasioner, µmaks
- Yx/s,Yp/x, Yp / s, dS/dt, dP/dt, ?S/So
Kultivasi fed- batch terbaik dengan dan tanpa pembatasan aerasi, dibandingkan kultivasi batch dengan tanpa pembatasan aerasi
Analisis sampel kultur:
Hidrolisis enzimatis pati sagu (a-amilase, AMG) Persiapan media dan kultur
Analisis hidrolisat sagu:
Konsentrasi total gula (metode Fenol -S ulfat), profil gula (HPLC), mineral (AAS), total N (Kjehldahl)
Gambar 7 Diagram alir pembuatan hidrolisat pati sagu secara enzimatis. Uji iod
positif
Pati sagu
pH diatur 6-6,5 Suspensi pati 30% Air
CaCO3
a- amilase 1,75 U/g
pH diatur 4-4,5
Sakarifikasi 60 oC, 48-60 jam, 150 rpm AMG 0,3 U/g
HCl 0,2N
Inaktivasi enzim 105 oC ~ 5 menit
Penyaringan vakum Pemanasan 80 oC~ 1 jam Arang aktif 1-2%
negatif
Hidrolisat pati sagu Gelatinisasi
Persiapan Media dan K ultur
Kultur R. eutropha dipelihara dalam bentuk kering-beku. Kultur disegarkan setiap 2 minggu dengan menumbuhkannya pada media Nutrient Broth (inkubasi 34 oC selama 24 jam). Formulasi media kultivasi per liter adalah X mL hidrolisat pati sagu dan Y g (NH4)2HPO4 sedemikian rupa sehingga rasio C/N
awal 10:1 dengan asumsi bahwa konsentrasi karbon pada hidrolisat sagu = 40% dari total gula dan konsentrasi N pada (NH4)2HPO4 adalah 21,21% (contoh
perhitungan dapat dilihat pada Lampiran 2); 5,8 g K2HPO4; 3,7 g KH2PO4; 10
mL MgSO4 0,1 M; dan 1 mL larutan mikroelemen. Larutan mikroelemen terdiri
dari 2,78 g FeSO4.7H2O; 1,98 g MnCl2.4H2O; 2,81 g CoSO4.7H2O; 1,67 g
CaCl2.2H2O; 0,17 g CuCl2.2H2O dan 0,29 g ZnSO4.7H2O yang dilarutkan dalam
1 L HCl 1 N (Ayorinde et al. 1998). Sebelum digunakan, media disterilisasi pada suhu 121 oC selama 15 menit (sumber karbon dan sumber nitrogen disterilisasi dalam wadah yang terpisah untuk menghindari reaksi pencoklatan). Media didiamkan beberapa saat setelah disterilisasi sehingga suhunya 25-30 oC dan siap diinokulasi.
Untuk keperluan kultivasi, terlebih dahulu dilakukan propagasi kultur dengan menumbuhkan kultur segar R. eutropha ke dalam media steril (10% v/v) pada inkubator goyang 150 rpm, suhu 34 oC selama 24 jam. Komposisi media propagasi sama dengan media kultivasi sedangkan volume kultur propagasi 10% dari volume media kultivasi. Kultur hasil propagasi selanjutnya diinokulasikan ke dalam media kultivasi.
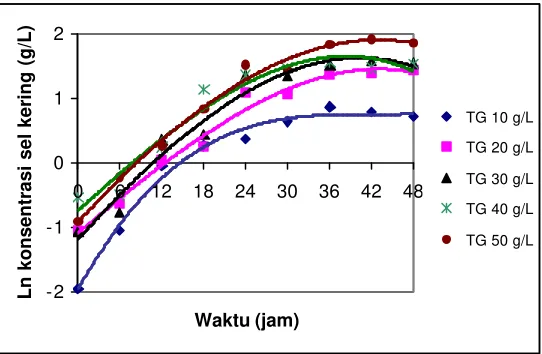
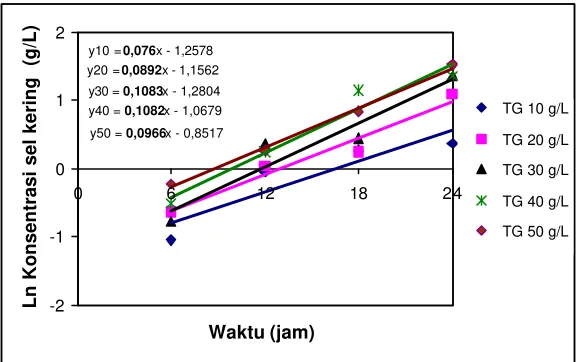
Kinetika Kultivasi Batch R. eutropha
gula yang memberikan nilai µmaks (laju pertumbuhan spesifik maksimal) tertinggi
dipilih untuk tahap berikutnya.
Selanjutnya R. eutropha ditumbuhkan secara batch selama 96 jam pada bioreaktor berkapasitas 2 L, volume kerja 1 L dengan konsentrasi gula terpilih, pH 6,9, suhu 34 oC, agitasi 150 rpm dan aerasi 0,2 vvm. Parameter yang diamati setiap 12 jam adalah konsentrasi sel kering, konsentrasi gula sisa dan konsentrasi PHA (metode NaOH digestion). Prosedur analisis pengukuran parameter dapat dilihat pada Lampiran 1a, 1c dan 1d.
Kadar PHA dalam sel merupakan persentase hasil pembagian konsentrasi PHA dengan konsentrasi sel kering. Pola pertumbuhan sel dan konsumsi gula diamati untuk menentukan mulai terjadinya fase stasioner ketika konsentrasi gula sisa hampir habis. Kinetika pertumbuhan sel, pembentukan produk PHA dan penggunaan substrat gula dievaluasi.
Kultivasi Fed-ba tch dengan Pengumpanan Berbagai Jenis Substrat
Pada tahap ini dilakukan pengumpanan pada awal fase stasioner dengan perlakuan 4 jenis substrat pengumpan, yaitu :
(1) media lengkap dengan komposisi dan volume sama dengan media pada tahap batch (F1),
(2) larutan stok hidrolisat sagu dengan konsentrasi gula 300 g/L (F2),
(3) larutan stok hidrolisat sagu dengan konsentrasi gula 300 g/L + MgSO4.7H2O
8,57 g/L (F3) ,
(4) larutan stok hidrolisat sagu dengan konsentrasi gula 300 g/L + MgSO4.7H2O
8,57 g/L + (NH4)2HPO4 56,15 g/L (F4).
dan F4 ke dalam 1 L kultur batch diumpankan sejumlah substrat yang setara dengan 20 g gula per L kultur atau sekitar 66,7 mL larutan stok dengan kecepatan pengumpanan konstan 1,7 mL/menit. Pada perlakuan F4 dilakukan dua kali pengumpanan, yaitu pada jam ke-48 dan 96. Hal ini dilakukan berdasarkan metode yang dikembangkan oleh Hahn et al. (1995) yaitu pengumpanan berdasarkan pH kultur; jika pH kultur >6,9 (menandakan gula dalam media hampir habis dikonsumsi) maka ke dalam kultur diumpankan sejumlah larutan stok yang menghasilkan konsentrasi glukosa dalam kultur sekitar 20 g/L. Konsentrasi gula yang diumpan setara dengan 20 g gula/L kultur berdasarkan penelitian Kim et al. (1994) dan Braunegg et al. (1995) yang mengatur konsentrasi glukosa pada fase akumulasi polimer oleh R. eutopha pada rentang 10-20 g/L dan 5-20 g/L.
Pengamatan dilakukan tiap 12 jam selama 96 jam (untuk F1, F2, F3) dan 168 jam (untuk F4) meliputi konsentrasi sel kering dan konsentrasi gula sisa. Analisis konsentrasi PHA dan penghitungan kadar PHA dalam sel dilakukan pada akhir kultivasi. Perlakuan terbaik ditentukan berdasarkan konsentrasi PHA dan kadar PHA dalam sel yang tertinggi. Sebagai pembanding, digunakan data hasil kultivasi batch pada tahap sebelumnya.
Pembatasan Aerasi pada Kultivasi Fed-batch Terpilih
Karakterisasi PHA
PHA yang dihasilkan dari perlakuan terbaik dianalisis sifat termal, gugus fungsional dan kemurnian PHB. Sifat termal dianalisis menggunakan DSC (Differential Scanning Calorimetry) PerkinElmerTM dengan program pemanasan 50–200 oC dengan laju pemanasan l0 oC per menit, sebagai purge gas digunakan gas nitrogen dengan kecepatan aliran 50 mL/menit. Analisis gugus fungsional dilakukan menggunakan FTIR (Fourier Transform Infrared Spectroscopy) dengan standar uji ASTM E 1252-98 dimana serbuk sampel PHA dibentuk pelet bersama kristal KBr. Analisis kemurnian PHB dilakukan menggunakan GC (Gas Chromatography). Serbuk sampel PHA dan standar PHB murni dimetanolisis asam dengan metode Braunegg et al. (1978). Prosedur persiapan sampel dapat dilihat pada Lampiran 1e. Kemurnian PHB pada sampel PHA merupakan perbandingan relatif antara persentase PHB dalam sampel PHA terhadap persentase PHB dalam standar PHB murni, dikalikan 100%.
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Rekayasa Bioproses Pusat Penelitian Sumberdaya Hayati dan Bioteknologi, Institut Pertanian Bogor dan laboratorium di lingkungan Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Karakterisasi PHA dilakukan di Puspiptek Serpong dan Balai Penelitian Pascapanen Bogor. Penelitian berlangsung selama 1 tahun (Desember 2004 - Desember 2005).
Bahan dan Alat
Galur bakteri yang digunakan dalam penelitian ini adalah Ralstonia eutropha IAM 12368 yang diperoleh dari IAM Culture Collection, Institute of Molecular and Cellular Biosciences, The University of Tokyo. Bahan-bahan yang digunakan untuk pembuatan hidrolisat pati sagu adalah pati sagu, a -amilase, amiloglukosidase (AMG), CaCO3, iod, HCl 0,2 N dan arang aktif. Pati sagu
Bahan-bahan untuk kultivasi bakteri dan isolasi PHA adalah Nutrient Broth, (NH4)2HPO4, K2HPO4, KH2PO4, MgSO4, FeSO4.7H2O, MnCl2.4H2O,
CoSO4.7H2O, CaCl2.7H2O, CuCl2.2H2O , ZnSO4.7H2O, NaOH dan H3PO4.
Untuk analisis karakteristik PHA digunakan pembanding PHB murni komersial (natural origin) merk Sigma-Aldrich.
Alat-alat utama yang digunakan adalah penyaring vakum, oven, shaking waterbath, termometer, pipet mikro, neraca analitik, inkubator, spektofotometer, bioreaktor Biostat M kapasitas 2 L (Gambar 8), pompa perista ltik, sent rifus dingin kecepatan tinggi, DSC (Differential Scanning Calorymetry), FTIR (Fourier Transform Infrared Spectroscopy) dan kromatografi gas.
Gambar 8 Bioreaktor Biostat M skala 2 L yang digunakan untuk penelitian.
Pengatur aerasi Tangki/
bejana Selang pengambilan contoh
Botol asam/basa Pemanas air Elektroda pH Display pH, suhu, agitasi
Pengatur suhu dan agitasi
Penyaring udara
Selang umpan
Botol umpan Pengatur pH
Tombol On/Off
Pompa peristaltik
Rancangan Percobaan
Untuk mengetahui pengaruh jenis substrat pengumpan terhadap konsentrasi sel kering, konsentrasi PHA dan kadar PHA dalam sel pada akhir kultivasi fed-batch, digunakan rancangan acak lengkap faktor tunggal yang terdiri dari lima taraf dengan dua kali ulangan. Model matematika yang digunakan adalah Yik = µ + Fi + eik (Montgomery 1991), dengan :
i = 1, 2, 3, 4, 5 (jenis substrat yang diumpan) k = 1, 2 (ulangan)
Yik = variabel respon karena pengaruh jenis umpan ke-i, ulangan ke-k
µ = rata-rata sebenarnya
Fi = pengaruh jenis umpan taraf ke -i
eik = galat percobaan karena jenis umpan ke-i pada ulangan ke-k
Untuk mengetahui pengaruh aerasi dan interaksi aerasi dengan pengumpanan substrat terpilih terhadap konsentrasi sel kering, konsentrasi PHA dan kadar PHA dalam sel pada akhir kultivasi, digunakan rancangan acak lengkap faktorial 2 x 2 dengan 2 kali ulangan. Model matematika yang digunakan adalah Yijk = µ + Ai + Fj + (AF) ij + eijk (Montgomery 1991), dengan :
i = 1,2 (aerasi tetap dan tanpa aerasi selama fase stasioner) j = 1,2 (jenis umpan terpilih tahap sebelumnya dan tanpa umpan) k = 1,2 (ulangan)
Yijk = variabel respon karena pengaruh faktor aerasi ke-i dan pengumpanan
ke-j pada ulangan ke-k µ = rata-rata sebenarnya
Ai = pengaruh faktor aerasi taraf ke-i
Bj = pengaruh faktor pengumpanan taraf ke-j
(AB) ij = pengaruh interaksi antara taraf ke-i faktor aerasi dan taraf ke-j faktor
pengumpanan
eijk = galat percobaan karena perlakuan aerasi ke-i dan pengumpanan ke -j
pada ulangan ke-k
Berikut ini ditampilkan diagram perlakuan dan pensimbolan yang dilakukan:
Aerasi (A)
Pengumpanan (F) Aerasi tetap Aerasi dihentikan
Karakterisasi Hidrolisat Pati Sagu
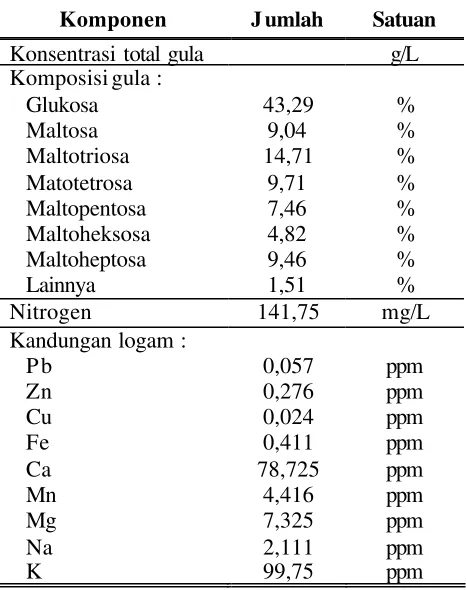
Sebelum digunakan sebagai media kultivasi, hidrolisat pati sagu terlebih dahulu dikarakterisasi (Tabel 2). Parameter konsentrasi total gula dan total nitrogen digunakan sebagai dasar perhitungan konsentrasi karbon dan nitrogen dalam formulasi media kultivasi. Profil gula (sakarida) menggambarkan berbagai jenis gula yang terkandung dalam hidrolisat pati sagu. Hal ini terkait dengan efektifitas proses hidrolisis yang dilakukan dan juga terkait dengan evaluasi kemungkinan konsumsi gula oleh bakteri. Sementara itu, informasi mengenai kandungan logam pada hidrolisat pati sagu digunakan untuk mendeteksi jika ada logam-logam yang mungkin dapat menghambat atau justru menunjang pertumbuhan bakteri.
Tabel 2 Karakteristik hidrolisat pati sagu
Komponen J umlah Satuan
Konsentrasi total gula g/L
Konsentrasi total gula hidrolisat sagu sebagaimana tertera pada Tabel 2 adalah 465 g/L, menunjukkan bahwa terdapat 465 g glukosa/L hidrolisat pati sagu, baik dalam bentuk glukosa bebas (monosakarida) maupun unit-unit glukosa yang terikat sebagai molekul disakarida maupun oligosakarida. Kurva standar untuk penentuan konsentrasi glukosa disajikan pada Lampiran 3. Pada pembahasan selanjutnya, istilah ‘konsentrasi total gula’ (hasil analisis menggunakan metode Fenol-Sulfat) menggambarkan konsentrasi total glukosa yang terdapat pada analat.
Berdasarkan hasil analisis HPLC (Lampiran 4 dan 5) didapatkan bahwa selain mengandung glukosa sebagai komponen gula utama (43,29%), hidrolisat pati sagu juga mengandung maltosa (disakarida ), maltotriosa, maltotetrosa, maltopentosa, maltoheksosa dan maltoheptosa (oligosakarida ) lebih dari 50% . Hal ini menunjukkan bahwa proses hidrolisis secara enzimatis yang terjadi belum sempurna. Meskipun demikian, dengan terurainya komponen polis akarida pati sagu yang kompleks menjadi turunan gula yang lebih sederhana akan memudahkan bakteri memanfaatkannya sebagai sumber karbon bagi pertumbuhan dan pembentukan produk yang diharapkan. Babel et al. (2001) me nyatakan bahwa PHB dapat disintesis dari komponen-komponen C1 tereduksi seperti
metana dan metanol, dari Knallgas (gas peledak) dan dari substrat multikarbon seperti karbohidrat dan hidrokarbon baik dari substrat murni maupun limbah bahkan dari komponen beracun seperti fenol.
R. eutropha tipe liar dilaporkan dapat tumbuh pada fruktosa sedangkan tipe mutan dapat tumbuh pada glukosa (John et al. 1994). Karbohidrat lain yang telah diteliti dapat digunakan sebagai sumber karbon bagi pertumbuhan dan produksi PHA oleh R. eutropha adalah xilosa (Linko et al. 1993), L-laktat hasil konversi xilosa (Tanaka et al. 1993), hidrolisat laktosa , gula invert (Marangoni et al. 2001), selulosa limbah jagung (Chakraborty et al. 2004) dan hidrolisat tapioka yang mengandung 90% glukosa (Kim dan Chang 1995 dikutip oleh Madison dan Huisman 1999) . Pada penelitian ini akan dikaji kemampuan R. eutropha untuk tumbuh dan memproduksi PHA dengan sumber karbon hidrolisat pati sagu yang mengandung glukosa sekitar 43% .
pertumbuhan mikroba. Nitrogen pada hidrolisat pati sagu berasal dari kandungan protein alami pada pati sagu dan komponen protein pada enzim yang digunakan pada proses hidrolisis pati sagu, yaitu a-amilase dan amiloglukosidase. Hughes et al. (1984) menyatakan bahwa berbagai nutrisi dalam bentuk garam la rut air yang secara umum dibutuhkan untuk pertumbuhan mikroba adalah nitrogen (N), fosfor (P), sulfur (S), potasium (K), sodium (Na), magnesium (Mg), kalsium (Ca) dan besi (Fe). Selain itu juga dibutuhkan mineral kelumit seperti mangan (Mn), seng (Zn) dan tembaga (Cu). Konsent rasi mineral yang paling dominan pada hidrolisat pati sagu adalah K (kalium) sebanyak 99,75 ppm dan Ca (kalsium) sebanyak 78,725 ppm. Kalsium terutama berasal dari penambahan CaCO3 yang berfungsi
sebagai penstabil a-amilase pada proses likuifikasi pati sagu.
Pada media kultivasi, berfungsi sebagai sumber karbon adalah hidrolisat pati sagu sedangkan sebagai sumber nitrogen adalah (NH4)2HPO4 yang
merupakan nitrogen inorganik dan kandungan nitrogen organik yang terdapat dalam hidrolisat sagu. Rasio C/N media pada awal kultivasi diatur dengan perbandingan 10:1 dengan asumsi penghitungan bahwa konsentrasi karbon dalam gula (glukosa) adalah 40% (sebanding dengan perbandingan bobot atom C dalam molekul gula) sedangkan konsentrasi N dalam (NH4)2HPO4 adalah
21,21% (sebanding dengan perbandingan bobot atom N dalam molekul diamonium hidrogen fosfat). Jumlah (NH4)2HPO4 yang ditambahkan
disesuaikan dengan jumlah N yang terdapat pada hidrolisat sagu sedemikian, sehingga konsentrasi total N dalam media mencapai sepersepuluh konsentrasi karbon. Contoh perhitungan dapat dilihat pada Lampiran 2.