ABSTRACT
MICROORGANISM THAT CAUSE SURGICAL SITE INFECTION (SSI) AND SENSITIVITY TO ANTIBIOTICS
IN RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG YEAR OF 2016
By
Zulfa Labibah
Background Surgical site infection (SSI) is a nosocomial infection that the microorganisms spread through a surgical wound. SSI can be prevent by using an appropiate antibiotic prophylaxis. The research objective was to determine the microorganisms that cause SSI at RSUD Dr. H. Abdoel Moeloek Bandar Lampung and the sensitivity pattern to antibiotics.
Methods This study was a descriptive study. Sampling was conducted at RSUD Dr. H. Abdoel Moeloek Bandar Lampung in September-October 2016. The sample is operation wound swabs totaling 26 samples. The independent and dependent variables is a bacterium that can be isolated from the operation wound swabs and sensitivity pattern. Antibiotics used were Ceftriaxone, Cefazolin, Ampicillin-Sulbactam, Ciprofloxacin, Amikacin, and Gentamicin. Sensitivity test results compared with CLSI table. The results of the research were analyzed in descriptive.
Results Microorganisms that cause SSI are Klebsiella sp. (26.7%), Staphylococcus epidermidis (16.7%), Pseudomonas aeruginosa (13.3%), Staphylococcus saprophyticus
(13.3%), Staphylococcus aureus (10%). The microorganisms sensitivity pattern is resistent to Ampicillin-Sulbactam (56,7%), Ceftriaxone (73,3%), Cefazolin (83,3%), Gentamicin (60%), and Ciprofloxacin (60%). While the microorganisms sensitivity pattern to amikacin are sensitive (70%).
Conclusions: Microorganism that causes most SSI is Klebsiella sp. Amikacin is the most sensitive antibiotic to microorganisms that cause ILO, while the most resistant is Cefazolin.
ABSTRAK
MIKROORGANISME PENYEBAB INFEKSI LUKA OPERASI DAN KEPEKAANNYA TERHADAP ANTIBIOTIK DI RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG
TAHUN 2016
Oleh
Zulfa Labibah
Latar Belakang Infeksi luka operasi (ILO) merupakan infeksi nosokomial yang penyebaran mikroorganismenya melalui luka bedah. Pencegahan ILO dapat dilakukan dengan penggunaan antibiotik profilaksis yang tepat. Tujuan penelitian adalah untuk mengetahui mikroorganisme penyebab ILO nosokomial di RSUD Dr. H. Abdoel Moeloek Bandar Lampung dan pola kepekaannya terhadap antibiotik.
Metode Penelitian Penelitian ini merupakan penelitian deskriptif. Pengambilan sampel dilakukan di RSUD Dr. H. Abdoel Moeloek Bandar Lampung pada September-Oktober 2016. Sampel merupakan swab luka operasi yang berjumlah 26 sampel. Variabel bebas dan terikat penelitian adalah bakteri yang berhasil diisolasi dari swab luka operasi dan pola kepekaannya. Antibiotik yang digunakan adalah Ceftriakson, Cefazolin, Ampisilin-Sulbaktam, Ciprofloksasin, Amikasin, dan Gentamisin. Hasil uji kepekaan dibandingkan dengan tabel CLSI. Hasil penelitian di analisis secara deskriptif.
Hasil Penelitian Mikroorganisme penyebab ILO yang banyak didapatkan adalah
Klebsiella sp. (26,7%), Staphylococcus epidermidis (16,7%), Pseudomonas aeruginosa
(13,3%), Staphylococcus saprophyticus (13,3%), Staphylococcus aureus (10%). Hasil pola kepekaan mikroorganisme penyebab ILO adalah resisten terhadap Ampisilin-Sulbaktam (56,7%), Ceftriakson (73,3%), Cefazolin (83,3%), Gentamisin (60%), dan Ciprofloksasin (60%). Sedangkan pola kepekaan terhadap Amikasin adalah sensitif (70%).
Simpulan penelitian Mikroorganisme yang paling banyak menyebabkan ILO adalah
Klebsiella sp. Pola kepekaan mikroorganisme penyebab ILO yang paling sensitif adalah terhadap Amikasin, sedangkan yang paling resisten adalah terhadap Cefazolin.
MIKROORGANISME PENYEBAB INFEKSI LUKA OPERASI (ILO) DAN KEPEKAANNYA TERHADAP ANTIBIOTIK
DI RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG TAHUN 2016
(Skripsi)
Oleh
ZULFA LABIBAH
FAKULTAS KEDOKTERAN UNIVERSITAS LAMPUNG
MIKROORGANISME PENYEBAB INFEKSI LUKA OPERASI (ILO) DAN KEPEKAANNYA TERHADAP ANTIBIOTIK
DI RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG TAHUN 2016
Oleh
ZULFA LABIBAH
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar SARJANA KEDOKTERAN
Pada
Program Studi Pendidikan Dokter Fakultas Kedokteran Universitas Lampung
PROGAM STUDI PENDIDIKAN DOKTER FAKULTAS KEDOKTERAN
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
ABSTRACT
MICROORGANISM THAT CAUSE SURGICAL SITE INFECTION (SSI) AND SENSITIVITY TO ANTIBIOTICS
IN RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG YEAR OF 2016
By
Zulfa Labibah
Background Surgical site infection (SSI) is a nosocomial infection that the microorganisms spread through a surgical wound. SSI can be prevent by using an appropiate antibiotic prophylaxis. The research objective was to determine the microorganisms that cause SSI at RSUD Dr. H. Abdoel Moeloek Bandar Lampung and the sensitivity pattern to antibiotics.
Methods This study was a descriptive study. Sampling was conducted at RSUD Dr. H. Abdoel Moeloek Bandar Lampung in September-October 2016. The sample is operation wound swabs totaling 26 samples. The independent and dependent variables is a bacterium that can be isolated from the operation wound swabs and sensitivity pattern. Antibiotics used were Ceftriaxone, Cefazolin, Ampicillin-Sulbactam, Ciprofloxacin, Amikacin, and Gentamicin. Sensitivity test results compared with CLSI table. The results of the research were analyzed in descriptive.
Results Microorganisms that cause SSI are Klebsiella sp. (26.7%), Staphylococcus epidermidis (16.7%), Pseudomonas aeruginosa (13.3%), Staphylococcus saprophyticus
(13.3%), Staphylococcus aureus (10%). The microorganisms sensitivity pattern is resistent to Ampicillin-Sulbactam (56,7%), Ceftriaxone (73,3%), Cefazolin (83,3%), Gentamicin (60%), and Ciprofloxacin (60%). While the microorganisms sensitivity pattern to amikacin are sensitive (70%).
Conclusions: Microorganism that causes most SSI is Klebsiella sp. Amikacin is the most sensitive antibiotic to microorganisms that cause ILO, while the most resistant is Cefazolin.
ABSTRAK
MIKROORGANISME PENYEBAB INFEKSI LUKA OPERASI DAN KEPEKAANNYA TERHADAP ANTIBIOTIK DI RSUD DR. H. ABDOEL MOELOEK BANDAR LAMPUNG
TAHUN 2016
Oleh
Zulfa Labibah
Latar Belakang Infeksi luka operasi (ILO) merupakan infeksi nosokomial yang penyebaran mikroorganismenya melalui luka bedah. Pencegahan ILO dapat dilakukan dengan penggunaan antibiotik profilaksis yang tepat. Tujuan penelitian adalah untuk mengetahui mikroorganisme penyebab ILO nosokomial di RSUD Dr. H. Abdoel Moeloek Bandar Lampung dan pola kepekaannya terhadap antibiotik.
Metode Penelitian Penelitian ini merupakan penelitian deskriptif. Pengambilan sampel dilakukan di RSUD Dr. H. Abdoel Moeloek Bandar Lampung pada September-Oktober 2016. Sampel merupakan swab luka operasi yang berjumlah 26 sampel. Variabel bebas dan terikat penelitian adalah bakteri yang berhasil diisolasi dari swab luka operasi dan pola kepekaannya. Antibiotik yang digunakan adalah Ceftriakson, Cefazolin, Ampisilin-Sulbaktam, Ciprofloksasin, Amikasin, dan Gentamisin. Hasil uji kepekaan dibandingkan dengan tabel CLSI. Hasil penelitian di analisis secara deskriptif.
Hasil Penelitian Mikroorganisme penyebab ILO yang banyak didapatkan adalah
Klebsiella sp. (26,7%), Staphylococcus epidermidis (16,7%), Pseudomonas aeruginosa
(13,3%), Staphylococcus saprophyticus (13,3%), Staphylococcus aureus (10%). Hasil pola kepekaan mikroorganisme penyebab ILO adalah resisten terhadap Ampisilin-Sulbaktam (56,7%), Ceftriakson (73,3%), Cefazolin (83,3%), Gentamisin (60%), dan Ciprofloksasin (60%). Sedangkan pola kepekaan terhadap Amikasin adalah sensitif (70%).
Simpulan penelitian Mikroorganisme yang paling banyak menyebabkan ILO adalah
Klebsiella sp. Pola kepekaan mikroorganisme penyebab ILO yang paling sensitif adalah terhadap Amikasin, sedangkan yang paling resisten adalah terhadap Cefazolin.
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang, pada tanggal 23 April 1996 sebagai anak
pertama pasangan Mohamad Natsir dan Yuni Yuningsih. Penulis memiliki dua
saudara kandung, yaitu Muhammad Naufal dan Muhammad Nabil.
Pendidikan Taman Kanak-kanak (TK) diselesaikan di TK Al-Hidayah Jakarta
pada tahun 2001, pendidikan Sekolah Dasar (SD) diselesaikan di SDS Angkasa
IX Halim Perdana Kusuma Jakarta pada tahun 2007, pendidikan Sekolah
Menengah Pertama (SMP) diselesaikan di SMPN 81 Jakarta pada tahun 2010,
pendidikan Sekolah Menengah Atas (SMA) diselesaikan di SMAN 67 Jakarta
pada tahun 2013.
Tahun 2013 penulis terdaftar sebagai mahasiswa Fakultas Kedokteran
Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi
Negeri (SNMPTN).
Selama menjadi mahasiswa penulis pernah aktif dalam organisasi FSI Ibnu
Sina sebagai Staf Kesekretariatan tahun 2014-2015, PMPATD Pakis FK Unila
sebagai anggota Pengabdian Masyarakat tahun 2015-2016, dan UKM Taekwondo
Sebagai Ucapan Rasa Syukur Dan Terima Kasihku Kepada Ibu Dan Ayah Yang Sudah Membesarkanku. Serta Sebagai Persembahan Kepada Keluargaku Tersayang
Impianmu akan terwujud
Dengan syarat,
Kerahkan semua kekuatan anda dan jangan cepat putus asa.
Sabar dan teruslah berusaha
SANWACANA
Assalamualaikum Wr.Wb
Puji syukur kehadirat Allah SWT yang Maha Pengasih lagi Maha Penyayang,
yang telah melimpatkan anugrah, nikmat dan ridho-Nya. Shalawat beriring salam
tercurah kepada junjungan kita Nabi Muhammad SAW, keluarga dan para
sahabatnya.
Skripsi yang berjudul “Mikroorganisme Penyebab Infeksi Luka Operasi
(ILO) dan Kepekaannya Terhadap Antibiotik di RSUD Dr. H. Abdoel Moeloek
Bandar Lampung Tahun 2016” ini merupakan syarat untuk memperoleh gelar Sarjana Kedokteran Universitas Lampung.
Melalui kesempatan ini penulis ingin mengucapkan terimakasih terhadap
semua pihak yang telah memberi dukungan moril dan spiritual kepada:
1. Kepada Prof. Dr. Ir. Hasriadi Mat Akin, M.P., selaku Rektor Universitas
Lampung;
2. Kepada Prof. Dr. Ir. Sugeng P. Harianto, M.S., selaku Rektor Universitas
Lampung saat penulis diterima sebagai mahasiswi Universitas Lampung
3. Kepada Dr. dr. Muhartono, S.Ked., M.Kes., Sp. PA, selaku Dekan Fakultas
Kedokteran Universitas Lampung;
4. Kepada dr. Dwita Oktaria, S.Ked., M.Pd.Ked., selaku pembimbing akademik
semangat untuk penulis selama skripsi ini. Terimakasih untuk bimbingan dan
arahan yang diberikan selama proses penyusunan skripsi;
6. Kepada dr. Rasmi Zakiah Oktarlina, S.Ked., M.Farm, selaku pembimbing II
yang telah bersedia meluangkan waktu, tenaga, dan pikiran untuk
membimbing penulis. Terimakasih untuk bimbingan dan arahan yang
diberikan selama proses penyusunan skripsi;
7. Kepada dr. M. Ricky Ramadhian, S.Ked., M.Sc., selaku penguji yang telah
memberikan kritik, saran dan masukan dalam memperbaiki skripsi;
8. Seluruh Staf dosen pengajar dan Staf karyawan Fakultas Kedokteran
Universitas Lampung yang telah berbagi ilmu dan pengalaman selama
perkuliahan;
9. Kedua orangtua tercinta, Ibu dan Ayah, Yuni Yuningsih dan Mohamad Natsir
yang menjadi inspirasi terbesar penulis. Terimakasih atas segala dukungan
baik moral, spiritual dan materil yang diberikan. Semoga Allah SWT selalu
memberikan yang terbaik, umur panjang, kesehatan kebahagian dan
perlindungan kepada Ibu dan Ayah;
10. Adik-adik tersayang, Muhammad Naufal dan Muhammad Nabil, terimakasih
telah menjadi adik-adik yang pintar dan penurut. Semoga penulis bisa
menjadi contoh yang baik untuk kalian berdua;
11. Keluarga besar yang telah membantu dalam berbagai hal dan selalu
meluangkan waktu demi terpenuhinya data penelitian dan terselesaikannya
skripsi ini;
13. Kepada seluruh dokter dan perawat di ruang rawat Kutilang, Mawar, dan
Delima RSUD Dr. H. Abdoel Moeloek Bandar Lampung yang telah bersedia
meluangkan waktu membantu penulis dalam memperoleh sampel;
14. Kepada Pa Lamiran, Bu Asti, Bu Erni dan seluruh Staf karyawan
Mikrobiologi Labkesda Provisinsi Lampung yang telah meluangkan waktu,
tenaga dan pikiran dalam membimbing penulis selama penelitian di
laboratorium;
15. Kepada Ka Ferina, Ka Edo, Ka Airi, ka Ria Rizki, dan kaka koas lain yang
telah meluangkan waktu untuk membantu penulis dalam memperoleh sampel;
16. Kepada Tante Yanti dan Om Firman selaku orang tua di tempat perantauan
ini, terimakasih atas dukungan dan doa yang diberikan, semoga Tante dan
Om diberi kesehatan dan rahmat oleh Allah SWT;
17. Kepada sahabat terdekat, Gifari Alief Rahman, terimakasih atas dukungan,
perhatian, dan waktunya, semoga selalu menemani di tahun-tahun berikutnya;
18. Kepada Pondok E5, Dian, Dinda, Vera, dan Oci yang menjadi keluarga dan
sahabat, terimakasih atas dukungan dan bantuan yang diberikan, semoga
persahabatan kita dapat terjaga selamanya;
19. Kepada Kuah Ketoprak, Hanum, Faridah, Sayyik, Fauziah, Nida, Zahra, Kak
20. Kepada Putri Dea, Rika P, Prizka, Nunung, dan Aci, Intan, Monik yang
menjadi keluarga dan sahabat, terimakasih atas semangat dan dukungan yang
diberikan, semoga persahabatan kita dapat terjaga selamanya;
21. Kepada Palemers, Erisa, Natasha, Mulya Dita, Analia, Restu, Gilang, Nando,
Benny, Anam, Asep, Ani, Mae, Tiwi, Rani, Elma, Rendika, adik-adik
Palemers 2015 dan 2016 yang menjadi keluarga di komplek Palem,
terimakasih atas dukungan dan semangat yang diberikan;
22. Kepada ka Prianggara, ka Desta, ka Meta, dan ka Nora, ka Hani, ka Gea, ka
Desti, ka Techa, Ria, Azrie, dan teman-teman BBQ, Indah, Ara, Riska,
Tifani, Dita, Riska, Tara, Ola, terimakasih atas dukungan, saran, dan pikiran
yang diberikan;
23. Kepada teman-teman satu bimbingan, Annisa A, Dessy, Ani, Jefri, Ega, Devi,
Fahrisal, Ara, Dika, dan Lisa, semoga dapat menjadi dokter yang amanah;
24. Kepada teman-teman seluruh angkatan 2013 (Cere13ellums) semoga kita
semua bisa menjadi dokter yang amanah;
25. Kepada SC 08 dan keluarga besar PMPATD Pakis Rescue Team, keluarga
besar FSI Ibnu Sina, dan keluarga besar UKM Taekwondo Unila, terimakasih
atas pengalaman, ilmu, dan kebersamaan yang diberikan;
26. Kepada KKN Desa Menggala ka Agatha, ka Shely, Vandu, Adi, Bani, dan ka
Sholeh, terimakasih atas kebersamaan dan pengalaman yang kalian ajarkan;
27. Kepada Bunda Family Yolla, Rani, Ayun, Sana, Resti, Riri, Yuki, sahabat
Penulis menyadari bahwa masih terdapat kekurangan dalam penulisan skripsi
karena keterbatasan pengetahuan yang penulis miliki. Namun, penulis berharap
semoga skripsi yang sederhana ini dapat bermanfaat bagi kita semua. Semoga
segala keikhlasan, kebaikan dan dukungan selama ini mendapat balasan oleh
Allah SWT. Amin.
Bandar Lampung, Januari
2017
Penulis
DAFTAR ISI
1.4 Manfaat Penelitian... 5
1.4.1 Bagi Peneliti... 5
1.4.2 Bagi Instansi Terkait... 6
1.4.3 Bagi Peneliti Selanjutnya... 6
BAB II TINJAUAN PUSTAKA 2.1 Tinjauan Pustaka ... 7
2.1.1 Infeksi Nosokomial... 7
2.1.1.1Pengertian Infeksi Nosokomial... 7
2.1.1.2Infeksi Nosokomial yang Paling Sering Dijumpai ... 7
2.1.2 Infeksi Luka Operasi ... 9
2.1.2.1Pengertian Infeksi Luka Operasi... 9
2.1.2.2Penyebab Infeksi Luka Operasi... 9
2.1.2.3Klasifikasi Luka Operasi... 11
2.1.2.4Faktor Risiko Infeksi Luka Operasi ... 12
2.1.2.5Kriteria Diagnosis Infeksi Luka Operasi ... 13
2.1.2.6Tata Laksana Infeksi Luka Operasi... 14
2.1.2.7Pencegahan Infeksi Luka Operasi... 14
2.1.3 Antibiotik Profilaksis... 16
2.1.3.1Pengertian Antibiotik Profilaksis... 16
2.1.3.2Indikasi Pemberian Antibiotik Profilaksis ... 16
2.1.3.4Resistensi Antibiotik... 21
2.1.3.5Uji Kepekaan Antibiotik... 22
2.2 Kerangka Teori ... 24
2.3 Kerangka Konsep... 25
BAB III METODE PENELITIAN 3.1 Desain Penelitian... 26
3.2 Waktu dan Tempat Penelititan... 26
3.3 Subyek Penelitian... 27
3.3.1 Populasi dan Sampel Penelitian... 27
3.3.2 Besar Sampel... 28
3.3.3 Teknik Sampling... 29
3.4 Alat dan Bahan... 29
3.5 Prosedur Penelitian ... 30
3.6 Alur Penelitian... . 34
3.7 Definisi Operasional ... 36
3.8 Etik Penelitian... 37
3.9 Penyajian dan Analisis Data ... 37
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian ... 38
4.1.1 Mikroorganisme Penyebab Infeksi Luka Operasi ... 38
4.1.2 Pola Kepekaan Mikroorganisme Penyebab ILO Terhadap Antibiotik... 39
4.2 Pembahasan ... 44
4.2.1 Mikroorganisme Penyebab Infeksi Luka Operasi... 44
DAFTAR TABEL
Tabel Halaman
1. Kriteria Interpretasi Diameter Zona Hambat...23
2. Definisi Operasional ...36
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka Teori ...24
2. Kerangka Konsep ...25
3. Alur Penelitian Identifikasi Bakteri ...34
4. Alur Penelitian Uji Kepekaan Bakteri Terhadap Antibiotik ... 35
5. Pola Identifikasi Bakteri Penyebab ILO pada Pasien di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Periode September-Oktober 2016 ... 39
6. Diagram Persentase Pola Kepekaan Isolat Bakteri Terhadap Beberapa Antibiotik di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Periode September-Oktober 2016 ...40
7. Diagram Pola Kepekaan Isolat Bakteri Penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Terhadap Ampisilin-Sulbaktam ...41
8. Diagram Pola Kepekaan Isolat Bakteri Penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Terhadap Ceftriakson ... 41
9. Diagram Pola Kepekaan Isolat Bakteri Penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Terhadap Cefazolin ...42
10.Diagram Pola Kepekaan Isolat Bakteri Penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Terhadap Amikasin ... 42
11.Diagram Pola Kepekaan Isolat Bakteri Penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar Lampung Terhadap Gentamisin ...43
DAFTAR LAMPIRAN
Lampiran
1. Data Tanda Infeksi Lokal dan Data Sekunder Responden Penelitian ...59
2. Hasil Identifikasi Mikroorganisme Penyebab ILO dan Kepekaannya ...61
3. Hasil Pengamatan Pemeriksaan Mikrobiologi Bakteri Penyebab ILO dari Swab Pasien Suspect ILO pada Media BHI, Agar Darah, dan Mac Conckey ... 63
4. Hasil Pengamatan Uji Biokimia Bakteri Penyebab ILO dari Swab Pasien Suspect ILO ...65
5. Hasil Analisis Univariat Data Penelitian ...67
6. Foto Kegiatan Penelitian ...74
7. Surat Izin Penelitian ...77
BAB I PENDAHULUAN
1.1Latar Belakang
Rumah sakit merupakan salah satu fasilitas pelayanan kesehatan perorangan
yang memberikan pelayanan kepada masyarakat secara paripurna dalam upaya
pemeliharaan kesehatan (Kemenkes RI, 2014). Disisi lain, rumah sakit juga
berperan dalam transmisi berbagai mikroorganisme yang dapat menyebabkan
infeksi selama pasien dirawat atau segera setelah pasien dipulangkan. Infeksi yang
diperoleh pasien selama dirawat di rumah sakit disebut infeksi nosokomial atau
hospital associated/acquired infection (HAI) (Bereket et al., 2012).
Infeksi nosokomial merupakan infeksi yang timbul setelah 72 jam pasien
dirawat inap sampai 30 hari lepas rawat. Infeksi nosokomial meningkatkan
morbiditas dan mortalitas di dunia baik di negara maju maupun negara
berkembang (Nasution, 2012). Selain itu, infeksi nosokomial juga dapat
meningkatkan biaya rumah sakit pasien (Diouf, Bèye, Diop, Kane, & Ka, 2007).
Suatu penelitian yang dilakukan di 11 rumah sakit di DKI Jakarta menunjukkan
bahwa 9,8% pasien yang dirawat inap mengalami infeksi nosokomial (Nasution,
2012). Penelitian yang dilakukan di RSUD Setjonegoro Kabupaten Wonosobo
pada Juli 2009 sampai dengan Desember 2011 menunjukkan bahwa infeksi
diikuti oleh infeksi saluran kemih (ISK) dan sepsis (Nugraheni, Suhartono, &
Winarni, 2012). Hasil penelitian di RS Islam Sultan Agung Semarang juga
menunjukkan hasil yang sama bahwa ILO merupakan infeksi nosokomial yang
banyak ditemukan (Setianto, Lazuardi, & Dahesihdewi, 2013). Selain itu, sekitar
5% pasien yang mendapatkan tindakan bedah mengalami ILO. Penelitian
menunjukkan bahwa lebih dari sepertiga kematian pasca operasi berhubungan
dengan ILO (National Collaborating Centre for Women’s and Children’s Health, 2008).
Infeksi luka operasi (ILO) merupakan komplikasi pembedahan akibat
penyebaran kuman yang memang berada di area pembedahan atau akibat
masuknya kuman melalui luka bedah (Sjamsuhidajat, Karnadihardja, Prasetyono,
& Rudiman, 2010). Insiden ILO di Bangsal Kebidanan dan Kandungan RSCM
Jakarta selama Agustus-Oktober 2011 adalah sebesar 4,4% dengan
mikroorganisme penyebab terbanyak adalah Escherichia coli (Wardoyo, Tjoa,
Ocvyanty, & Moehario, 2014). Penelitian yang dilakukan di RSUD Dr. H. Abdoel
Moeloek Bandar Lampung tahun 2011 menunjukkan bakteri terbanyak yang
menyebabkan ILO di ruang rawat bedah adalah Pseudomonas sp. 29,27%,
Staphylococcus epidermidis 21,95%, dan Klebsiella sp. 14,62%, sedangkan di
ruang rawat kebidanan adalah Pseudomonas sp. 25%, Escherichia coli 19,44%,
Klebsiella sp. 16,67%, dan Staphylococcus epidermidis 13,89% (Samuel, 2013).
Berdasarkan hasil diatas, diperlukan cara untuk menghambat pertumbuhan
bakteri pada luka operasi sehingga angka kejadian ILO dapat menurun. Angka
kejadian ILO telah terbukti dapat diturunkan dengan memberikan antibiotik
Prasetyono, & Rudiman, 2010). Pedoman praktis klinis tentang antibiotik
profilaksis tindakan bedah yang dikeluarkan oleh The American Society of
Health-System Pharmacists (ASHP) merekomendasikan Ampisilin-Sulbaktam, Cefazolin,
Ceftriakson dan beberapa antibiotik lainnya (Bratzler et al., 2013). Hasil
penelitian di RS Islam Sultan Agung Semarang periode Januari 2012 sampai Juni
2014 menunjukkan bahwa pada 50 pasien sectio caesarea yang diberikan
antibiotik profilaksis Ampisilin-Sulbaktam tidak terdapat infeksi pada luka
operasi (Sulistiawati, 2015). Di sebuah RSUD di Jakarta, antibiotik yang banyak
digunakan pada tahun 2013 adalah Ampisilin-Sulbaktam dan Ceftriakson
(Syachroni, 2015).
Ceftriakson banyak digunakan di Rumah Bersalin Daerah (RBD) Panti
Nugroho Purbalingga sebagai antibiotik profilaksis dengan persentase 50,26%
(Nuraliyah, Hapsari, & Utaminingrum, 2012). Antibiotik yang sama, yaitu
Ceftriakson juga banyak digunakan di RS Kanker Dharmais Jakarta dan penelitian
menunjukkan antibiotik profilaksis masih sensitif dengan persentasi tidak terjadi
ILO adalah 96,55% (Desiyana, Soemardi, & Radji, 2008). Survey pendahuluan
menunjukkan bahwa Ceftriakson merupakan antibiotik lini pertama yang
digunakan di RSUD Dr. H. Abdoel Moeloek Bandar Lampung. Penelitian di
RSUP Dr. Kariadi Semarang menunjukkan penggunaan antibiotik yang berbeda.
Penelitian di RSUP Dr. Kariadi Semarang menunjukkan penggunaan
antibiotik profilaksis terbanyak di bangsal bedah adalah Ceftriakson, sedangkan di
bangsal kebidanan adalah Cefazolin. Sementara itu, pada pedoman antibiotik
profilaksis bangsal kebidanan dan bedah rumah sakit tersebut Cefazolin
review menunjukkan penggunaan Cefazolin sebagai antibiotik profilaksis
berkaitan dengan penurunan infeksi maternal setelah tindakan sesar (Tita et al.,
2009). Penggunaan antibiotik profilaksis setiap rumah sakit berbeda sesuai dengan
pola bakteri dan kepekaan di rumah sakit yang bersangkutan (Bratzler et al.,
2013). Hasil yang berbeda ditunjukkan pada penelitian yang dilakukan di RSUD
Dr. H. Abdoel Moeloek Bandar Lampung.
Penelitian pola sensitvitas antibiotik terhadap pasien Rawat Inap Bedah dan
Kebidanan RSUD Dr. H. Abdoel Moeloek Bandar Lampung pada tahun 2011
menunjukkan bahwa bakteri penyebab ILO resisten terhadap Penisilin G,
Eritromisin, dan Kloramfenikol, kurang sensitif terhadap Ceftazidim dan
Cefotaxim, dan sensitif terhadap Ciprofloksasin, Amikasin, dan Gentamisin
(Samuel, 2013). Tetapi belum diketahui pola sensitivitas bakteri penyebab ILO
terhadap antibiotik Ceftriakson, Cefazolin, dan Ampisilin-Sulbaktam.
Berdasarkan latar belakang diatas, penulis tertarik untuk melakukan
penelitian pola bakteri penyebab ILO di RSUD Dr. H. Abdoel Moeloek Bandar
Lampung periode September-Oktober 2016 dan kepekaannya terhadap antibiotik
profilaksis yang sering digunakan di rumah sakit lain dan antibiotik yang
menunjukkan hasil sensitif pada penelitian sebelumnya. Antibiotik yang sering
digunakan di rumah sakit lain adalah Ceftriakson, Cefazolin, dan
Ampisilin-Sulbaktam. Sedangkan antibiotik yang menunjukkan hasil sensitif pada penelitian
sebelumnya di RSUD Dr. H. Abdoel Moeloek Bandar Lampung adalah
1.2Rumusan Masalah
Berdasarkan latar belakang penelitian tersebut, maka dapat dirumuskan
masalah yaitu:
Mikroorganisme apa saja yang menyebabkan infeksi luka operasi (ILO)
nosokomial di RSUD Dr. H. Abdoel Moeloek Bandar Lampung dan bagaimana
pola kepekaannya terhadap antibiotik Ceftriakson, Cefazolin,
Ampisilin-Sulbaktam, Ciprofloksasin, Amikasin, dan Gentamisin?
1.3Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk mengetahui mikroorganisme
penyebab infeksi luka operasi (ILO) nosokomial di RSUD Dr. H. Abdoel
Moeloek Bandar Lampung dan pola kepekaannya terhadap antibiotik Ceftriakson,
Cefazolin, Ampisilin-Sulbaktam, Ciprofloksasin, Amikasin, dan Gentamisin.
1.4 Manfaat Penelitian
1.4.1 Bagi Peneliti
Manfaat penelitian bagi peneliti adalah sebagai berikut:
a. Peneliti dapat mengetahui pola bakteri dan kepekaannya terhadap antibiotik
Ceftriakson, Cefazolin, Ampisilin-Sulbaktam, Ciprofloksasin, Amikasin dan
Gentamisin pada pasien infeksi luka operasi (ILO) di RSUD Dr. H. Abdoel
b. Peneliti dapat menambah ilmu pengetahuan dan pengalaman penelitian
dalam bidang mikrobiologi terutama mengenai infeksi nosokomial yang
terjadi pada pasien infeksi luka operasi.
1.4.2 Bagi Instansi Terkait
Manfaat penelitian bagi instansi terkait khususnya RSUD Dr. H. Abdoel
Moeloek Bandar Lampung adalah sebagai berikut:
a. Memberikan informasi terkait pola bakteri dan kepekaannya terhadap
antibiotik Ceftriakson, Cefazolin, Ampisilin-Sulbaktam, Ciprofloksasin,
Amikasin dan Gentamisin pada pasien infeksi luka operasi (ILO) di RSUD
Dr. H. Abdoel Moeloek Bandar Lampung.
b. Hasil penelitian diharapkan dapat dijadikan masukan dalam pengendalian dan
pencegahan infeksi nososkomial khususnya infeksi luka operasi (ILO) di
RSUD Dr. H. Abdoel Moeloek Bandar Lampung.
c. Hasil penelitian diharapkan dapat dijadikan masukan untuk pengendalian dan
pencegahan resistensi mikroorganisme dengan pemberian antibiotik yang
sesuai dengan pola sensitivitas bakteri yang ditemukan.
1.4.3 Bagi Peneliti Selanjutnya
Manfaat penelitian bagi peneliti selanjutnya adalah diharapkan hasil
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Pustaka
2.1.1 Infeksi Nosokomial
2.1.1.1 Pengertian Infeksi Nosokomial
Infeksi nosokomial (Health-Care Associated Infections) adalah infeksi yang
timbul setelah pasien mendapatkan perawatan di rumah sakit lebih dari 72 jam
(Nugraheni, Suhartono, & Winarni, 2012; Sjamsuhidajat, Karnadihardja,
Prasetyono, & Rudiman, 2010)
2.1.1.2 Infeksi Nosokomial yang Paling Sering Dijumpai
a. Infeksi Saluran Kemih
Infeksi saluran kemih (ISK) nosokomial adalah infeksi yang terjadi setelah
pemasangan kateter urin selama 72 jam dan ditemukan koloni bakteri pada urin
sebanyak 105/ml. Bakteri yang sering ditemukan adalah Eschericia coli dan
urin dibatasi hanya sampai 3 hari untuk mengurangi risiko infeksi (Sjamsuhidajat,
Karnadihardja, Prasetyono, & Rudiman, 2010).
b. Infeksi Luka Operasi
Infeksi luka operasi (ILO) merupakan infeksi nosokomial yang terjadi pada
pasien pascabedah. Infeksi ini dapat disebabkan kurangnya tingkat sterilitas
tenaga kesehatan, ruang bedah, dan peralatan medis (Sjamsuhidajat,
Karnadihardja, Prasetyono, & Rudiman, 2010). Keadaan pasien juga dapat
mempengaruhi terjadinya ILO, seperti daya tahan tubuh pasien. Salah satu
tindakan pencegahan yang direkomendasikan adalah penggunaan antibiotik
profilaksis sebelum pembedahan (Wardoyo, Tjoa, Ocvyanty, & Moehario, 2014).
c. Infeksi Saluran Napas Bawah
Infeksi saluran napas bawah yang paling sering terjadi pada pasien rawat inap
adalah pneumonia. Pneumonia nosokomial yang terbanyak adalah Ventilator
Associated Pneumonia (VAP). Selain pengguna ventilator, pasien yang memiliki
risiko tinggi terkena pneunomia nosokomial adalah penderita luka bakar dan
pasien trakeostomi. Bakteri Gram negatif yang banyak menyebabkan pneumonia
adalah Pseudomonas sp., Klebsiella sp., dan Escherichia coli, sedangkan bakteri
Gram positif adalah Staphylococcus aureus (Sjamsuhidajat, Karnadihardja,
d. Infeksi Intravaskuler (Bakteriemia)
Penggunaan kateter intravaskuler yang bertujuan untuk memberikan obat dan
nutrisi secara parenteral, pemantauan hemodinamik, tindakan hemodialisa, atau
plasmaferesis menyebabkan bakteriemia. Beberapa pasien diantaranya mengalami
sepsis dan kegagalan organ ganda. Tindakan pencegahan dapat dilakukan dengan
prosedur aseptik dan antiseptik saat pemasangan kateter intravaskular (Diouf,
Bèye, Diop, Kane, & Ka, 2007).
2.1.2 Infeksi Luka Operasi
2.1.2.1 Pengertian Infeksi Luka Operasi
Infeksi luka operasi (ILO) atau Surgical Site Infection (SSI) adalah infeksi
dimana organisme patogen berkembang atau bermultipikasi di suatu luka operasi
yang menyebabkan tanda dan gejala lokal seperti panas, kemerahan, nyeri, dan
bengkak dalam kurun waktu 30 hari pasca operasi (Sjamsuhidajat, Karnadihardja,
Prasetyono, & Rudiman, 2010; National Collaborating Centre for Women’s and
Children’s Health, 2008).
2.1.2.2Penyebab Infeksi Luka Operasi
Bakteri penyebab terbanyak ILO adalah flora normal kulit, yaitu
Staphylococcus aureus dan coagulase-negative Staphylococcus (seperti
Staphylococcus epidermidis) (Bratzler et al., 2013; Nasution, 2012). Bakteri lain
coli (Bereket et al., 2012; Nasution, 2012). Penelitian yang dilakukan di RSUD
Dr. H. Abdoel Moeloek Bandar Lampung tahun 2011 menunjukkan
mikroorganisme penyebab ILO di ruang rawat bedah terbanyak adalah
Pseudomonas sp. 29,27%, Staphylococcus epidermidis 21,95%, dan Klebsiella sp.
14,62%. Sedangkan bakteri penyebab ILO di ruang rawat kebidanan terbanyak
adalah Pseudomonas sp. 25%, Escherichia coli 19,44%, Klebsiella sp. 16,67%,
dan Staphylococcus epidermidis 13,89% (Samuel, 2013).
Pseudomonas sp. merupakan bakteri Gram negatif yang dapat ditemukan di
usus dan kulit manusia. Bakteri ini merupakan penyebab terbanyak infeksi
nosokomial dan banyak terdapat di lingkungan rumah sakit yang lembab. Bakteri
patogen yang sering dijumpai dari spesies ini adalah Pseudomonas aeruginosa.
Pseudomonas aeruginosa merupakan bakteri yang dapat menyebabkan infeksi
dan menimbulkan pus hijau kebiruan (Ryan & Ray, 2014; Brooks, Carroll, Butel,
Morse, & Mietzner, 2010).
Staphylococcus aureus merupakan bakteri koagulase positif yang paling
sering menyebabkan infeksi terutama apabila kekebalan tubuh pejamu menurun.
Bakteri lain yang ditemukan pada isolat ILO merupakan flora normal manusia.
Staphylococcus epidermidis terdapat di kulit, traktus respiratori, dan traktus
gastrointestinal manusia. Bakteri Gram positif lain yang berpotensi menyebabkan
infeksi nosokomial adalah Streptococcus sp. Bakteri ini dapat menghemolisis sel
darah merah in vitro. Berdasarkan kemampuan hemolisisnya, bakteri ini dibagi
menjadi β hemolitik yang ditandai dengan bersihnya daerah sekitar pertumbuhan bakteri dan α hemolitik yang ditandai oleh reduksi hemoglobin dan pembentukan
Klebsiella sp., dan Escherichia coli merupakan bakteri Enterobacteriaceae
yang terdapat di traktus intestinal manusia. Selain kedua bakteri ini, bakteri
Enterobactericeae lain yang berpotensi menyebabkan infeksi adalah Proteus sp.
dan Enterobacter sp. (Ryan & Ray, 2014). Pada penelitian Samuel tahun 2011,
Proteus sp. dan Enterobacter sp. juga didapatkan, tetapi tidak sebanyak Klebsiella
sp. (Samuel, 2013). Bakteri Enterobacteriaceae dapat menyebabkan infeksi
terhadap manusia apabila berpindah tempat dari habitat alaminya atau pejamu
mengalami penurunan imunitas (Brooks, Carroll, Butel, Morse, & Mietzner,
2010).
2.1.2.3Klasifikasi Luka Operasi
Luka operasi terbagi berdasarkan kontaminasi bakterinya, yang terdiri dari:
a. Operasi Bersih
Luka operasi bersih adalah luka operasi yang tidak terinfeksi dimana
tidak terdapat inflamasi dan saluran pernapasan, pencernaan, dan kemih atau
genitalia tidak dibuka selama operasi. Biasanya luka operasi bersih tertutup
dan didrainase dengan drainase tertutup.
b. Luka Operasi Bersih Terkontaminasi
Luka operasi bersih terkontaminasi adalah luka operasi dimana saluran
pernapasan, pencernaan dan kemih atau genitalia dibuka selama operasi dan
tanpa kontaminasi. Operasi usus buntu, saluran empedu, vagina, dan
c. Luka Operasi Terkontaminasi
Luka operasi terkontaminasi adalah luka operasi yang tidak terdapat
tanda infeksi tetapi terdapat kontaminasi karena saluran pernapasan,
pencernaan dan kemih atau genitalia dibuka. Luka operasi terbuka dan
disengaja seperti operasi usus besar, operasi kulit, operasi pijat jantung, dan
sebagainya termasuk dalam kategori ini.
d. Luka Operasi Kotor atau Terinfeksi
Luka operasi kotor atau terinfeksi adalah luka operasi dimana luka
terinfeksi akibat luka traumatis lama yang terjadi di daerah operasi atau akibat
keadaan klinis seperti perforasi atau abses. Infeksi yang terjadi pada kategori
ini disebabkan oleh mikroorganisme yang terdapat dalam tubuh pasien
sebelum tindakan operasi (CDC, 2016; Sjamsuhidajat, Karnadihardja,
Prasetyono, & Rudiman, 2010).
2.1.2.4 Faktor Risiko Infeksi Luka Operasi
Infeksi luka operasi (ILO) dipengaruhi oleh dua faktor risiko, yaitu faktor
pasien dan faktor operasi. Faktor pasien yang meningkatkan risiko ILO adalah
status nutrisi, diabetes tidak terkontrol, merokok, obesitas, infeksi yang terjadi
pada area selain area operasi sebelum operasi, imunodefisiensi, kolonisasi bakteri,
dan riwayat rawat inap lama sebelum operasi (Wardoyo et al., 2014).
Imunodefisiensi disebabkan oleh faktor primer, yaitu kerusakan herediter yang
berhubungan dengan perkembangan imun atau faktor sekunder seperti infeksi,
penuaan, imunosupresi, autoimunitas, kanker, atau kemoterapi (Kumar, Cotran, &
adalah persiapan sebelum operasi seperti cukur rambut atau persiapan kulit, lama
operasi, antibiotik profilaksis, sterilitas peralatan medis dan ruang operasi,
drainase pembedahan, dan teknik operasi (Wardoyo et al., 2014).
2.1.2.5 Kriteria Diagnosis Infeksi Luka Operasi (ILO)
CDC Healthcare-Associated Infections (HAIs) membagi ILO menjadi tiga,
yaitu ILO superfisial, ILO insisi dalam, dan ILO organ atau rongga tubuh. Setiap
kategori dibedakan berdasarkan letak luka operasi (CDC, 2016).
Seseorang dikatakan mengalami ILO jika meemiliki tiga kriteria dibawah ini:
a. Infeksi yang terjadi dalam waktu 30 hari setelah tindakan operasi (hari ke-1
adalah hari tindakan operasi dilakukan).
b. Luka terjadi pada:
1. Kulit atau jaringan subkutan dibawahnya (ILO superfisial).
2. Insisi jaringan lunak dalam, yaitu fascia atau lapisan otot (ILO insisi
dalam).
3. Jaringan tubuh yang lebih dalam dari lapisan otot atau fascia, yang dibuka
atau dimanipulasi selama tindakan operasi (ILO organ atau rongga tubuh).
c. Pasien setidaknya memiliki ILO satu kondisi dibawah ini:
1. Sekret purulen yang berasal dari insisi superfisial (ILO superfisial), insisi
dalam (ILO insisi dalam), atau drainase organ atau rongga tubuh (ILO
organ atau rongga tubuh).
2. Terdapat mikroorganisme pada spesimen yang diperoleh dari luka operasi
pada pemeriksaan kultur atau metode pemeriksaan mikrobiologi lain yang
3. Insisi sengaja dibuka oleh dokter bedah atau dokter lain dan pemeriksaan
kultur atau pemeriksaan mikrobiologi lain tidak dilakukan, dan pasien
mengalami salah satu gejala inflamasi yaitu nyeri, pembengkakan lokal,
eritema, atau panas.
4. Dokter bedah atau dokter lain yang menangani pasien mendiagnosis terjadi
ILO superfisial, insisi dalam, ataum organ atau rongga tubuh (CDC, 2016).
2.1.1.6 Tata Laksana Infeksi Luka Operasi
Penatalaksanaan ILO tergantung jenis luka yang dialami pasien.
Penatalaksanaan ILO superfisial adalah dengan membuka jahitan pada luka,
mendrainase pus, membuang jaringan yang sudah mati dan dibalut dengan kassa
steril. Pemeriksaan kultur perlu dilakukan sebelum memberikan terapi antibiotik.
Antibiotik diberikan jika pasien mengalami imunosupresif dan atau selulitis
melebihi 2 cm dari tepi luka. Penatalaksanaan ILO luka dalam dapat dilakukan
dengan drainase perkutan jika tidak ditemukan sumber infeksi yang berkelanjutan
seperti perforasi saluran pencernaan. Sumber infeksi seperti perforasi memerlukan
tindakan operasi eksplorasi (Sjamsuhidajat, Karnadihardja, Prasetyono, &
Rudiman, 2010).
2.1.1.7 Pencegahan Infeksi Luka Operasi
Infeksi luka operasi (ILO) dapat dicegah dengan meminimalisir
tenaga kesehatan, kamar operasi, dan peralatan medis. Pencegahan ILO terbagi
menjadi tiga fase, yaitu:
a. Fase Prabedah
Pada fase prabedah dilakukan persiapan pasien bedah dan tenaga kesehatan.
Persiapan pasien bedah terdiri dari mandi atau membersihkan tubuh, mencukur
rambut yang menjadi area operasi, dan menggunakan pakaian ruang operasi. Pada
pasien bedah kolorektal juga dilakukan persiapan usus mekanik dan pengeluaran
feses. Selain itu, pasien bedah diberikan antibiotik profilaksis single dose secara
intravena beberapa saat sebelum operasi. Persiapan tenaga kesehatan terdiri dari
menggunakan pakaian operasi, seperti menggunakan scrub suits, surgical caps,
alas kaki khusus ruang operasi, dan masker, dekontaminasi nasal, dan
dekontaminasi tangan tenaga kesehatan dengan menggunakan antiseptik.
b. Fase Intrabedah
Fase intrabedah terdiri dari menggunakan incise drapes yang merupakan film
perekat untuk menutupi kulit di lokasi sayatan, memberikan antiseptik ke area
operasi, mempertahankan homeostasis pasien dengan mempertahankan oksigen,
perfusi, gula darah, dan temperatur tubuh pasien, melakukan irigasi luka dan bilas
intrakavitas seperti lambung dan usus dengan antiseptik, memberikan antiseptik
dan antibiotik topikal pada luka insisi sebelum penutupan luka, memilih
penutupan luka yang tepat, dan membalut luka operasi.
c. Fase Pascabedah
Fase pasca operasi terdiri dari mengganti pembalut dengan teknik aseptik,
membersihkan luka operasi dengan sterile saline solution sampai 48 jam setelah
dan melakukan debridemen atau membuang jaringan nekrotik (National
Collaborating Centre for Women’s and Children’s Health, 2008).
2.1.3 Antibiotik Profilaksis
2.1.3.1 Pengertian Antibiotik Profilaksis
Antibiotik profilaksis adalah penggunaan antibiotik sebelum, selama, atau
setelah tindakan diagnosis, terapi, atau bedah untuk mencegah komplikasi infeksi.
Penggunaan antibiotik profilaksis pada setiap pasien berbeda, tergantung pada
riwayat alergi yang dialami pasien. Pasien yang memiliki riwayat anafilaksis,
edema laring, bronkospasme, hipotensi, pembengkakan lokal, urtikaria, atau ruam
gatal yang terjadi setelah konsumsi Penisilin, memiliki risiko hipersensitivitas
terhadap Beta-laktam. Oleh karena itu, pasien tidak boleh diberikan antibiotik
golongan Beta-laktam dan harus diberikan terapi alternatif. Antibiotik profilaksis
harus diberikan secara single dose kecuali dalam keadaan tertentu, seperti operasi
dalam waktu yang berkepanjangan, kehilangan banyak darah, atau indikasi lain
(SIGN, 2014; Katzung, 2010).
2.1.3.2 Indikasi Pemberian Antibiotik Profilaksis
Pemberian antibiotik profilaksis didasarkan atas indikasi untuk mengurangi
jumlah penggunaan antibiotik yang akan meningkatkan resistensi mikroorganisme
a. Sangat Direkomendasikan
Penggunaan antibiotik profilaksis mengurangi morbiditas utama, mengurangi
biaya rumah sakit, dan mengurangi penggunaan antibiotik secara keseluruhan.
Tindakan operasi yang sangat direkomendasikan menggunakan antibiotik
profilaksis antara lain operasi katarak, apendektomi, operasi kolorektal, operasi
sesar, induksi aborsi, transurethral resection of the prostate, arthoplasty, fraktur
terbuka, operasi terbuka untuk fraktur tertutup, dan fraktur panggul.
b. Direkomendasikan
Tindakan operasi yang direkomendasikan menggunakan antibiotik profilaksis
antara lain craniotomi, operasi spinal, operasi glaukoma, operasi lakrimal, operasi
orognatik, operasi kepala dan leher (terkontaminasi/bersih-terkontaminasi), insersi
cardiac peacemaker, reseksi pulmonar, operasi oesofageal, operasi lambung dan
duodenum, operasi duktus biliaris, operasi liver, operasi pankeras, histerektomi
abdominal, histerektomi vaginal, transrectal prostate biopsy, shock wave
lithotripsy, sistektomi radikal, amputasi lower limb, operasi vaskular (abdominal
and lower limb arterial reconstruction), dan operasi bersih-terkontaminasi.
c. Perlu Dipertimbangkan
Penggunaan antibiotik profilaksis harus dipertimbangkan kepada semua
pasien terutama pasien dengan risiko rendah infeksi karena dapat meningkatkan
konsumsi antibiotik. Beberapa operasi yang perlu dipertimbangkan dalam
pemberian antibiotik profilaksis adalah operasi plastik wajah dengan implan,
d. Tidak Direkomendasikan
Penggunaan antibiotik profilaksis tidak efektif secara klinis, tidak
menurunkan antibiotik, tetapi meningkatkan penggunaan antibiotik sehingga tidak
direkomendasikan. Operasi yang tidak direkomendasikan diberikan antibiotik
profilaksis antara lain operasi plastik wajah (bersih), operasi telinga
(bersih/bersih-terkontaminasi), operasi kandung empedu, perbaikan hernia,
tindakan diagnosis endoskopi, splenektomi, pemasangan IUD (intrauterine
device), reseksi transuretra pada tumor kandung kemih, dan nefrektomi (SIGN,
2014).
2.1.3.3 Pemilihan Antibiotik Profilaksis
Pemilihan antibiotik profilaksis harus disesuaikan dengan pola bakteri dan
kepekaannya terhadap antibiotik. Bakteri penyebab diperkirakan dengan pola
bakteri lokal yang biasanya menyebabkan ILO, seperti bakteri Gram negatif pada
kolon. Selain memperhatikan pola bakteri dan kepekaannya, pemilihan antibiotik
profilaksis juga harus memperhatikan keadaan fisiologis pasien, terutama fungsi
ginjal dan hati, kekebalan tubuh pasien, riwayat alergi, dan biaya antibiotik
(SIGN, 2014; Katzung; 2010). Pemberian antibiotik profilaksis setidaknya 60
menit sebelum dilakukan insisi (Syachroni, 2015).
Prinsip pemberian antibiotik profilaksis prabedah adalah sebagai berikut:
a. Antibiotik spektrum luas yang efektif terhadap agen infeksi yang biasa
ditemui pada ILO.
c. Waktu paruh antibiotik harus dicapai saat insisi, sehingga waktu pemberian
antibiotik harus tepat.
d. Duration of action (DoA) antibiotik pendek, single dose, dan efek toksisitas
minimal.
e. Penggunaan antibiotik terbaru diperuntukkan jika telah terjadi resistensi obat.
f. Digunakan antibiotik dengan biaya terendah jika semua prinsip telah
terpenuhi (Katzung, 2010).
Antibiotik profilaksis yang direkomendasikan oleh The American Society of
Health-System Pharmacists (ASHP) antara lain Ampisilin-Sulbaktam, Cefazolin,
Ceftriakson dan beberapa antibiotik lainnya (Bratzler et al., 2013).
a. Ampisilin-Sulbaktam
Ampisilin-Sulbaktam merupakan kombinasi antibiotik spektrum luas
golongan Penisilin yang merupakan senyawa Beta-laktam (Katzung, 2010).
Antibiotik ini efektif terhadap bakteri Gram positif, Gram negatif, dan bakteri
anaerob. Aktifitas antimikroba dari Ampisilin-Sulbaktam lebih bersprektrum luas
daripada Sefalosporin generasi pertama dan kedua. Suatu Randomized-trials
menunjukkan bahwa Ampisilin-Sulbaktam lebih diutamakan daripada
Sefalosporin sebagai antibiotik profilaksis bedah (Ziogos, Tsiodras, Matalliotakis,
Giamarellou, & Kanellakopoulou, 2010).
b. Ceftriakson
Ceftriakson merupakan antibiotik spektrum luas golongan Sefalosporin
generasi ketiga. Antibiotik ini efektif terhadap bakteri Gram negatif dan
c. Cefazolin
Cefazolin merupakan antibiotik golongan Sefalosporin generasi pertama.
Sefalosporin generasi pertama memiliki aktivitas spektrum luas dan relatif tidak
toksik. Antibiotik ini sangat efektif terhadap bakteri kokus Gram positif, seperti
Pneumococcus, Streptococcus, dan Staphylococcus. Cefazolin dapat menembus
sebagian besar jaringan dengan baik dan merupakan pilihan untuk profilaksis
bedah. Antibiotik ini merupakan alternatif untuk pasien yang alergi terhadap
Penisilin (Bratzler et al., 2013; Katzung, 2010).
Berikut ini adalah antibiotik yang sering digunakan di ruang rawat inap
bagian bedah dan kebidanan RSUD Dr. H. Abdoel Moeloek Bandar Lampung
yang sensitif terhadap mikroorganisme penyebab ILO (Samuel, 2013):
a. Ciprofloksasin
Ciprofloksasin merupakan antibiotik golongan Fluorokuinolon yang bekerja
dengan menghambat sintesis DNA bakteri. Antibiotik ini memiliki efek yang
sangat baik terhadap bakteri Gram negatif tetapi terbatas terhadap Gram positif.
Ciprofloksasin merupakan pilihan antibiotik untuk profilaksis. Antibiotik ini tidak
dapat digunakan pada pasien yang berusia dibawah 18 tahun karena memiliki efek
terhadap kartilago yang dapat menghambat pertumbuhan dan menyebabkan
artropati.
b. Amikasin
Amikasin merupakan antibiotik golongan aminoglikosida yang memiliki
cincin heksosa. Antibiotik ini efektif terhadap bakteri enterik Gram negatif,
seperti Pseudomonas, Enterobacter, dan Serratia. Amikasin memiliki efek
c. Gentamisin
Gentamisin merupakan antibiotik golongan aminoglikosida yang efektif
terhadap bakteri Gram positif dan Gram negatif. Antibiotik ini tidak bekerja
terhadap bakteri anaerob. Gentamisin memiliki efek nefrotoksisitas yang
reversibel dan ringan (Katzung, 2010).
2.1.3.4 Resistensi Antibiotik
Penggunaan antibiotik yang tidak rasional, tidak berdasarkan indikasi, dan
tidak berdasarkan hasil uji kepekaan meningkatkan resistensi bakteri terhadap
antibiotik. Saat ini, peningkatan resistensi bakteri terjadi di semua rumah sakit
(SIGN, 2014).
Mekanisme resistensi mikroorganisme terhadap antibiotik berbeda-beda.
Berikut ini adalah beberapa mekanisme resistensi antibiotik:
a. Mikroorganisme menghasilkan enzim yang menghancurkan obat. Contohnya
adalah Staphylococcus yang resisten terhadap Penisilin G mengeluarkan
enzim beta-laktamase yang menghancurkan obat. Bakteri Gram negatif lain
juga mengeluarkan enzim beta-laktamase. Bakteri Gram negatif resisten
terhadap aminoglikosida dengan menghasilkan enzim adenilasi, fosforilasi,
atau asetilasi yang menghancurkan obat.
b. Mikroorganisme mengubah permeabilitasnya terhadap obat. Contohnya
adalah Tetrasiklin yang terakumulasi di dalam bakteri yang rentan, tetapi
c. Mikroorganisme mengubah target struktural terhadap obat. Contohnya adalah
perubahan penicillin-binding proteins (PBPs) pada Streptococcus
pneumoniae dan Enterococcus sp. menyebabkan resistensi terhadap Penisilin.
d. Mikroorganisme mengubah jalur metabolik yang menghambat kerja obat.
Contohnya adalah bakteri yang resisten terhadap Sulfonamida tidak
memerlukan paraaminobenzic acid (PABA) ekstraseluler untuk
menghasilkan asam folat, tetapi dapat memanfaatkan asam folat preformed
seperti sel mamalia.
e. Mikroorganisme menghasilkan enzim yang masih dapat melakukan fungsi
metabolisme karena hanya sedikit terpengaruh oleh obat. Contohnya adalah
bakteri yang resisten terhadap Trimetoprim menghasilkan asam dihidrofolik
reduktase sehingga hanya sedikit terhambat dibandingkan bakteri yang rentan
(Brooks, Carroll, Butel, Morse, & Mietzner, 2010).
2.1.3.5 Uji Kepekaan Antibiotik
Pemberian antibiotik secara empiris diperlukan agar tidak terjadi peningkatan
resistensi antibiotik. Oleh sebab itu, diperlukan uji kepekaan terhadap antibiotik
sebelum pemberian terapi untuk memastikan efektifitas antibiotik terhadap
mikroorganisme. Uji kepekaan antibiotik mengukur daya hambat obat terhadap
pertumbuhan mikroorganisme (minimal inhibitory concentration/MIC) atau
mengukur kerja obat dalam mebunuh bakteri (minimal baktericidal
concentration/MBC). Uji kepekaan yang rutin dilakukan adalah uji kepekaan MIC
(Katzung, 2010). Selain uji MIC, uji kepekaan dengan metode difusi cakram yang
Antibiotika yang diuji biasanya diwakili oleh satu jenis obat dari
masing-masing kelas utama. Contohnya adalah uji kepekaan bakteri Staphylococcus,
antibiotik yang digunakan antara lain Penisilin G, Cefazolin, Eritromisin,
Gentamisin, dan Vankomisin. Antibiotik yang digunakan dalam uji kepekaan
dipilih berdasarkan pola resistensi mikroorganisme, jenis infeksi (infeksi
komunitas atau nosokomial), sumber infeksi, dan harga antibiotik.
Hasil uji kepekaan dilihat dari ukuran zona hambat pertumbuhan
mikroorganisme pada setiap antibiotik. Ukuran zona hambat antibiotik
dibandingkan dengan standar untuk menentukan diameter minimum zona hambat
obat yang menunjukkan kerentanan dari suatu isolat dengan teknik difusi cakram.
Diameter zona hambat kemudian diinterpretasikan menjadi sensitif (S),
intermediet (I), atau resisten (R) (Brooks, Carroll, Butel, Morse, & Mietzner,
2010).
Tabel 1. Kriteria Interpretasi Diameter Zona Hambat Antibiotik Jumlah Tiap Cakram
Diameter Zona Hambat (mm)
S I R
Ampisilin-Sulbaktam 10µg ≥15 12-14 ≤11
Cefazolin 30µg ≥23 20-22 ≤19
Ceftriakson 30µg ≥23 20-22 ≤19
Gentamisin 10µg ≥15 13-14 ≤12
Amikasin 30µg ≥17 15-16 ≤14
Ciprofloksasin 5µg ≥21 16-20 ≤15
2.2 Kerangka Teori
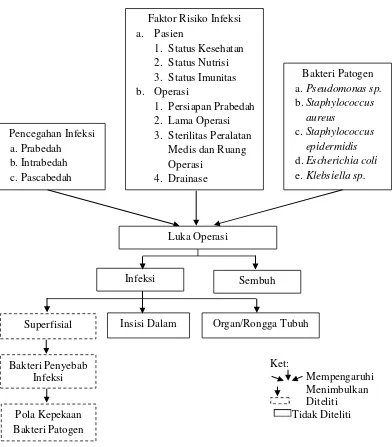
Gambar 1. Kerangka Teori (CDC, 2016; Wardoyo, Tjoa, Ocvyanty, & Moehario, 2014; Bereket et al., 2012; Brooks, Carroll, Butel, Morse, & Mietzner, 2010; Sjamsuhidajat,
Karnadihardja, Prasetyono, & Rudiman 2010; National Collaborating Centre for Women’s and Children’s Health, 2008)
Faktor Risiko Infeksi
Superfisial Insisi Dalam Organ/Rongga Tubuh
2.3 Keragka Konsep
Variable Independent Variable Dependent
Gambar 2. Kerangka Konsep Bakteri yang Berhasil
Diisolasi dari Swab Luka Pasien Suspect Infeksi Luka
Operasi (ILO)
Antibiotik 1. Ampisilin-Sulbaktam 2. Ceftriakson
3. Cefazolin 4. Gentamisin 5. Amikasin 6. Ciprofloksasin
Pola Kepekaan Bakteri Penyebab ILO Terhadap
BAB III
METODE PENELITIAN
3.1 Desain Penelitian
Penelitian ini merupakan penelitian deskriptif karena menggambarkan pola
mikroorganisme penyebab infeksi luka operasi (ILO) di RSUD Dr. H. Abdoel
Moeloek Bandar Lampung dan kepekaannya terhadap antibiotik Ampisilin-
Sulbaktam, Ceftriakson, Cefazolin, Gentamisin, Amikasin, dan Ciprofloksasin
(Sastroasmoro, 2011).
3.2 Waktu dan Tempat Penelitian
Pengambilan sampel dilakukan pada bulan September-Oktober 2016 di
Ruang Rawat Inap RSUD Dr. H. Abdoel Moeloek Bandar Lampung yang
merawat pasien pasca operasi. Penelitian identifikasi bakteri dan uji kepekaan
dilakukan pada bulan September-November 2016 di Laboratorium Kesehatan
3.3 Subjek Penelitian
3.3.1 Populasi dan Sampel Penelitian
Populasi penelitian ini adalah semua pasien yang telah mendapatkan tindakan
operasi dan masih mendapatkan perawatan di ruang rawat inap RSUD Dr. H.
Abdoel Moeloek Bandar Lampung. Sampel penelitian ini adalah pasien yang telah
mendapatkan tindakan operasi dan masih mendapatkan perawatan di ruang rawat
inap RSUD Dr. H. Abdoel Moeloek Bandar Lampung.
a. Kriteria Inklusi
1. Pasien yang telah mendapatkan tindakan operasi di RSUD Dr. H. Abdoel
Moeloek Bandar Lampung.
2. Pasien yang mendapatkan antibiotik profilaksis sebelum tindakan
operasi.
3. Pasien yang mendapatkan perawatan di ruang rawat inap bagian bedah
dan kebidanan RSUD Dr. H. Abdoel Moeloek Bandar Lampung.
4. Pasien yang mengalami tanda-tanda infeksi setelah 72 jam tindakan
operasi.
5. Pasien pasca operasi yang memiliki tanda infeksi lokal berupa pus, nyeri,
bengkak, eritema, atau jahitan dibuka.
b. Kriteria Eksklusi
1. Pasien berusia kurang dari 15 tahun.
2. Pasien yang tidak bersedia dilakukan pengambilan pus pada daerah luka
3.3.2 Besar Sampel
Besar sampel penelitian ini ditentukan dengan menggunakan rumus untuk
deskriptif kategorik karena desain penelitian yang digunakan adalah penelitian
deskriptif dan skala yang digunakan adalah kategorik yang akan menggambarkan
jenis bakteri dan kepekaannya terhadap antibiotik.
Rumus besar sampel yang digunakan adalah (Dahlan, 2013):
Keterangan:
n = jumlah sampel minimal
Zα = derivat baku alpa, dengan nilai α= 5%, maka Zα=1,96
P = proporsi (50%), karena tidak diketahui prevalensi ILO di RSUD Dr. H.
Abdoel Moeloek Bandar Lampung
Q = 1-P
d = presisi (20%), penyimpangan yang masih dapat diterima
Maka perhitungan besar sampel yang digunakan adalah:
Besar sampel yang digunakan adalah 24,01 dan dibulatkan menjadi 24 sampel.
3.3.3 Teknik Sampling
Teknik pengambilan sampel dalam penelitian ini adalah teknik consecutive
sampling, dimana sampel adalah semua pasien yang memenuhi kriteria inklusi
selama bulan September-Oktober 2016 sampai besar sampel minimal terpenuhi
(Dahlan, 2013).
3.4 Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah kapas lidi steril,
autoklaf, inkubator, pinset, pipet hisap, cawan petri, kapas, lampu bunsen, hockey
stick L, gelas ukur, labu erlenmeyer, ose bulat, mikropipet, rak dan tabung reaksi,
spiritus, dan penggaris.
Bahan-bahan yang digunakan dalam penelitian ini adalah:
a. Isolat bakteri aerob dari swab luka operasi pasien suspect ILO di ruang rawat
inap bedah dan kebidanan RSUD Dr. H. Abdoel Moeloek Bandar Lampung.
b. Disk/cakram antibiotik, yaitu Ampisilin-Sulbaktam, Ceftriakson, Cefazolin,
Ciprofloksasin, Amikasin, dan Gentamisin dan disk Novobiosin.
c. Media yang digunakan adalah nutrient agar miring, agar darah, agar Mac
Conkey, agar DNAse, TSIA, agar SIM, agar SC, Simmon citrate agar, media
BHI yang digunakan untuk pembuatan suspensi bakteri dan agar Muller
Hinton yang digunakan dalam uji sensitivitas isolat bakteri terhadap
antibiotik.
d. Larutan Standar Mac Farland, aquades, larutan pewarnaan Gram, dan larutan
3.5 Prosedur Penelitian
a. Sterilisasi Alat
Sterilisasi alat dilakukan dengan mencuci dan mengeringkan alat terlebih
dahulu. Kemudian cawan petri dibungkus dengan kertas perkamen. Sedangkan
alat-alat gelas seperti tabung reaksi ditutup dengan menggunakan kapas lalu
dibalut dengan kassa dan dibungkus dengan kertas perkamen. Kemudian
sterilisasi dengan menggunakan autoklaf pada suhu 1210C selama 30 menit.
Sterilisasi ose bulat dilakukan dengan membakarnya diatas lampu bunsen hingga
membara kemudian didinginkan, sedangkan sterilisasi object glass dilakukan
dengan melewatkannya diatas lampu bunsen beberapa kali (Raihana, 2011).
b. Pengambilan Spesimen Pus
Pengambilan spesimen dilakukan dengan menggunakan kapas lidi steril. Cara
mengambil spesimen adalah dengan mengusap/swab luka operasi kemudian
memasukkannya kembali ke dalam tempat steril. Selanjutnya spesimen dibawa ke
Labkesda untuk pemeriksaan identifikasi bakteri dan kepekaannya (Misnadiarly &
Djajaningrat, 2014).
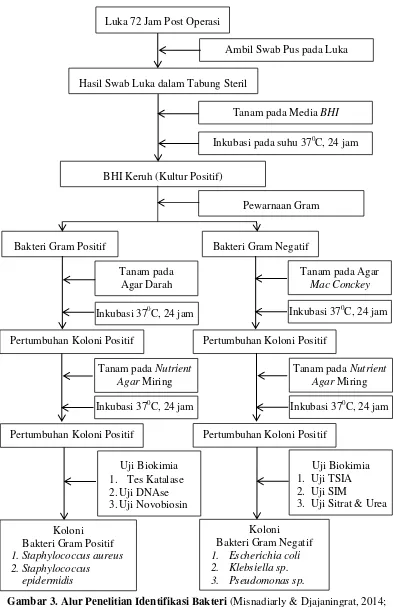
c. Isolasi dan Identifikasi Mikroorganisme Penyebab ILO
Isolasi spesimen dilakukan dengan mengoleskan spesimen ke dalam nutrient
agar miring sebagai media perbenihan dan inkubasi pada suhu 370C selama 24
jam. Setelah itu, identifikasi sifat bakteri dengan melakukan pewarnaan Gram.
Kemudian memeriksa hasil perwarnaan Gram dibawah mikroskop untuk
mengetahui sifat bakteri merupakan Gram positif atau Gram negatif. Setelah
mengetahui sifat bakteri, dilakukan penanaman bakteri dan dilanjutkan dengan
dilakukan pada media selektif agar darah dan Gram negatif pada agar Mac
Conkey. Setelah ditemukan koloni tertentu dari media selektif, kemudian
melakukan uji biokimia (Vandepitte et al., 2010).
d. Uji Biokimia Bakteri
Uji biokimia bakteri Gram positif adalah sebagai berikut:
1. Tes Katalase
Pengambilan koloni menggunakan ose bulat dan memindahkan ke object
glass. Kemudian teteskan cairan H2O2. Hasil positif jika terdapat gelembung
udara yang menandakan Staphylococcus sp. dan hasil negatif jika tidak terdapat
gelembung udara yang menandakan Streptococcus sp.
2. Tes DNAse
Tes DNAse dilakukan untuk identifikasi Staphylococcus aureus dan
membedakannya dengan Staphylococcus sp. lainnya. Tanam bakteri pada DNAse
agar plate, lalu inkubasi pada suhu 370C selama 24 jam. Selanjutnya, genangi
koloni yang tumbuh dengan HCl 10% selama 1-2 menit. Hasil positif jika terdapat
zona bening disekitar koloni yang menandakan spesies Staphylococcus aureus
dan negatif jika tidak terdapat zona bening.
3. Uji Novobiosin
Pemeriksaan dilakukan dengan mengoleskan bakteri pada media Muller
Hinton, lalu diletakkan disk Novobiosin diatas koloni bakteri. Kemudian media
diinkubasi pada suhu 370C selama 24 jam. Hasil positif jika terdapat diameter
Uji biokimia bakteri Gram negatif adalah sebagai berikut:
1. Uji Triple Sugar Iron Agar (TSIA)
Uji TSIA bertujuan untuk mengetahui kemampuan bakteri dalam melakukan
fermentasi glukosa, laktosa dan sukrosa. Hasil positif jika terdapat perubahan
warna agar dari orange menjadi hitam pada bagian miring dan dasar. Kemampuan
bakteri dalam desulfurasi asam amino dan metion akan menghasilkan H2S yang
bereaksi terhadap Fe2+ sehingga terbentuk endapan hitam.
2. Uji Sulfur Indole Motility (SIM)
Uji menggunakan media SIM dilakukan untuk mengetahui adanya hidrogen
sulfida, timbulnya indol karena aktivitas enzim triptopanase. Hasil positif jika
larutan kovac berubah menjadi merah serta terdapat motilitas atau pergerakan
bakteri.
3. Uji Sitrat
Uji sitrat yang menggunakan media Simmon citrate agar bertujuan untuk
mengetahui kemampuan bakteri dalam menggunakan natrium sitrat sebagai
sumber utama metabolisme dan pertumbuhan yang ditandai dengan perubahan
warna akibat suasana asam. Hasil positif jika terjadi perubahan warna dari hijau
menjadi biru.
4. Uji Urea
Uji urea digunakan untukidentifikasi bakteri Gram negatif batang. Uji ini
bertujuan untuk mengetahui kemampuan bakteri dalam memecah urea menjadi
ammonia dan karbon dioksida. Hasil positif menunjukkan bakteri memiliki enzim
urease untuk memecah urea. Hasil positif jika terdapat perubahan warna agar dari
e. Pembuatan Suspensi Bakteri
Setelah identifikasi bakteri, tanam bakteri pada media BHI. Kemudian
inkubasi pada suhu 370C selama 4-6 jam atau kekeruhannya sama dengan standar
kekeruhan Mac Farland 0,5 (Vandepitte et al., 2010).
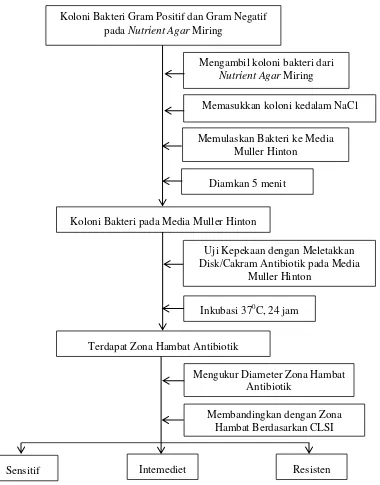
f. Pengukuran sensitivitas antibiotik dengan metode difusi Kirby-Bauer
Uji sensitivitas antibiotik terdiri dari langkah-langkah sebagai berikut:
1. Memulaskan suspensi bakteri yang telah disesuaikan dengan standar
kekeruhan Mac Farland 0,5 ke seluruh permukaan media agar Muller Hinton
secara merata dengan hockey stickL dan diamkan selama 5 menit agar bakteri
meresap ke dalam media (Vandepitte et al., 2010).
2. Meletakkan disk/cakram yang terdiri dari 6 jenis antibiotik pada media agar
Muller Hinton yang sudah diolesi bakteri isolat luka pasca operasi dengan
menggunakan pinset. Jarak antara cakram yang satu dengan cakram yang lain
kurang lebih 3cm dan 2cm dari pinggir sehingga terdapat kontak yang baik
antara cakram obat dengan bakteri, kemudian inkubasi pada suhu 370C
selama 24 jam (Vandepitte et al., 2010).
3. Setelah inkubasi, melakukan pengukuran diameter daerah hambatan yang
ditandai dengan zona hambat disekitar cakram menggunakan penggaris
dengan satuan mm, kemudian bandingkan dengan diameter zona hambat
berdasarkan CLSI (CLSI, 2014).
4. Mengulangi percobaan yang sama untuk bakteri dari isolat bakteri luka pasca
3.6 Alur Penelitian
Gambar 3. Alur Penelitian Identifikasi Bakteri (Misnadiarly & Djajaningrat, 2014; Ryan & Ray, 2014; Raihana, 2011; Brooks, Carroll, Butel, Morse, & Mietzner, 2010;
Goldman & Green, 2009) Luka 72 Jam Post Operasi
Ambil Swab Pus pada Luka
Hasil Swab Luka dalam Tabung Steril
Tanam pada Media BHI
Inkubasi pada suhu 370C, 24 jam
Gambar 4. Alur Penelitian Uji Kepekaan Bakteri Terhadap Antibiotik (Vandepitte et al., 2010; Goldman & Green, 2009)
Koloni Bakteri Gram Positif dan Gram Negatif pada Nutrient Agar Miring
Mengambil koloni bakteri dari
Nutrient Agar Miring
Memulaskan Bakteri ke Media Muller Hinton
Diamkan 5 menit
Koloni Bakteri pada Media Muller Hinton
Uji Kepekaan dengan Meletakkan Disk/Cakram Antibiotik pada Media
Muller Hinton
Terdapat Zona Hambat Antibiotik
Inkubasi 370C, 24 jam
Membandingkan dengan Zona Hambat Berdasarkan CLSI
Resisten Intemediet
Sensitif
Mengukur Diameter Zona Hambat Antibiotik
4.7 Definisi Operasional
Tabel 2. Definisi Operasional
Variabel Definisi Alat Ukur Hasil Ukur Skala
Bakteri yang
Jenis bakteri (spesies bakteri yang berhasil diisolasi)
Zona hambat antibiotik pada media Muller Hinton menunjukkan bakteri dapat dibunuh dengan antibiotik
Intermediet (I):
Zona hambat antibiotik pada media Muller Hinton menunjukkan bakteri dapat dihambat pertumbuhannya dengan antibiotik
Resisten (R):
Zona hambat antibiotik pada media Muller Hinton menunjukkan bakteri tidak dapat dihambat