OPTIMALISASI REAKSI EPOKSIDASI METIL ESTER
JARAK PAGAR DENGAN KATALIS BENTONIT
ADE ABDUL WAHID
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ADE ABDUL WAHID. Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar dengan Katalis Bentonit. Dibimbing oleh TUN TEDJA IRAWADI dan PURWANTININGSIH SUGITA.
Jarak pagar merupakan tanaman penghasil minyak yang sangat potensial. Minyak jarak pagar dapat dibuat menjadi metil ester (MEJP). Diversifikasi metil ester dapat dilakukan dengan memanfaatkannya sebagai pemlastis untuk menggantikan pemlastis dari kelompok ftalat. Pemlastis dapat dibuat dengan mengepoksidasi MEJP menggunakan campuran asam asetat, toluena, hidrogen peroksida, dan bentonit (1, 2, 3%), lalu dipanaskan pada suhu 50, 60, dan 70 oC dan waktu 12, 24, dan 36 jam. Senyawa epoksida yang didapat kemudian dianalisis bilangan oksirananya dan dioptimalisasi dengan perangkat lunak Modde 5. Setelah itu, dilakukan validasi dengan cara melakukan reaksi epoksidasi pada kondisi optimum.
Sampel MEJP memiliki nilai bilangan oksirana dan bilangan iodin sebesar 0.04% dan 96.15 g I/100 g sementara MEJP epoksida memiliki nilai bilangan oksirana dan bilangan iodin berturut–turut sebesar 1.12% dan 72.22 g I/100 g. Optimalisasi dengan menggunakan perangkat lunak Modde 5 menghasilkan keadaan optimum pada kondisi waktu 36 jam, suhu 70 oC, dan konsentrasi bentonit 3% dengan nilai bilangan oksirana 1.11%. Hasil validasi prediksi kondisi optimum reaksi epoksidasi tersebut menunjukkan bahwa pada jam ke-36 diperoleh bilangan oksirana yang paling tinggi. Hasil ini diperkuat dengan spektrum FTIR yang menunjukan kenaikan transmitans pada gugus C=C.
ABSTRACT
ADE ABDUL WAHID. Optimalization of Methyl Ester Epoxidation Reaction Using Bentonite Catalyst. Supervised by TUN TEDJA IRAWADI and PURWANTININGSIH SUGITA.
Jatropha curcas L. is very potential oil–producing plant. Jatrophas oil can be converted into methyl ester (JME). Methyl ester diversification can be performed by using it as a plasticizer to substitute plasticizer from phtalate group. Plasticizer can be produced by epoxidizing JME with a mixture of acetic acid, toluene, hydrogen peroxide, and bentonite (1, 2, and 3%) and then heat it at 50, 60, and 70 oC for 12, 24, and 36 hours. The epoxide produced can be later analyzed for its oxirane number and optimized with
Modde 5 software. Validation can be subsequently performed by epoxidation on the optimum condition.
OPTIMALISASI REAKSI EPOKSIDASI METIL ESTER
JARAK PAGAR DENGAN KATALIS BENTONIT
ADE ABDUL WAHID
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
Nama NIM
:
: :
Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar dengan Katalis Bentonit.
Ade Abdul Wahid G44202037
Menyetujui:
Pembimbing I
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 130 536 664
Pembimbing II
Dr. Purwantiningsih Sugita, MS
NIP 131 779 513
Mengetahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT karena atas rahmat dan karunia-Nya Penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Optimalisasi Reaksi Epoksidasi Metil Ester Jarak Pagar dengan Katalis Bentonit yang dilaksanakan pada bulan April 2006 sampai dengan April 2007 di Laboratorium Kimia Organik dan Kimia Fisik IPB.
Penulis mengucapkan terima kasih kepada berbagai pihak yang telah membantu terselesaikannya karya ilmiah ini, di antaranya Ibu Prof. Dr. Ir. Tun Tedja Irawadi, MS dan Ibu Dr. Purwantiningsih Sugita, MS selaku pembimbing yang telah banyak memberikan masukan dan pengarahan kepada penulis, juga kepada Bapak Drs. Ahmad Sjahriza dan Ibu Henny Purwaningsih, MSi serta Kak Budi Arifin, SSi, atas diskusi-diskusi berharga yang berkaitan dengan penelitian ini. Penulis juga mengucapkan terima kasih kepada Program Hibah Kompetisi A2 selaku penyedia dana. Tidak lupa pula Penulis mengucapkan terima kasih kepada Pak Sabur, Ibu Yeni, Ibu Aah, dan teman-teman seperjuangan: Wahyu, Joko, Tedi, dan Tria serta rekan-rekan satu Laboratorium Tuti, Rida, Steven, Obie, Tri, Tesar, Budhi, Amel dan Marudut. Ungkapan terima kasih juga Penulis haturkan kepada Bapak, Mamah, keluarga, kimia 39 serta teman-teman Badepoel atas doa dan semangat yang diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2007
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 9 Juli 1984 sebagai anak ketiga dari tiga bersaudara dari pasangan Endang Sudjana dan Enung Nurjannah. Tahun 2002, Penulis lulus dari SMU Negeri 1 Ujung Batu, dan pada tahun yang sama masuk Institut Pertanian Bogor (IPB) melalui Undangan Seleksi Masuk IPB (USMI) pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Tahun 2005, Penulis mengikuti kegiatan Praktik Lapangan di Balai Penelitian Teknologi Karet (BPTK), dengan judul Karakterisasi Nilai Viskositas dan Kadar Nitrogen Lateks Depolimerisasi.
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN . ... 1
TINJAUAN PUSTAKA Jarak Pagar ... 1
Pemlastis ... 2
Epoksidasi ... 2
Katalis Bentonit ... 2
BAHAN DAN METODE Bahan dan Alat ... 2
Metode Penelitian ... 3
HASIL DAN PEMBAHASAN Analisis Bahan Baku ... 3
Optimasi Reaksi Epoksidasi... 3
SIMPULAN DAN SARAN Simpulan ... 5
Saran ... 6
DAFTAR PUSTAKA ... 6
DAFTAR TABEL
Halaman
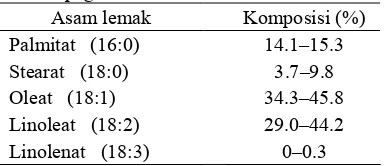
1 Kandungan asam lemak minyak jarak pagar...1
2 Pengaruh variasi waktu epoksidasi terhadap bilangan oksirana...4
3 Pengaruh variasi suhu epoksidasi terhadap bilangan oksirana ...4
4 Pengaruh variasi konsentrasi bentonit terhadap bilangan oksirana ...4
5 Kondisi optimum reaksi epoksidasi ...5
6 Perubahan bilangan oksirana dan iodin selama 36 jam epoksidasi pada suhu 70 oC ...5
DAFTAR GAMBAR
Halaman 1 Buah jarak pagar ...12 Salah satu struktur minyak dari biji jarak pagar ...1
3 Reaksi pembukaan cincin epoksida...2
4 Struktur bentonit...2
5 Radas epoksidasi ...3
DAFTAR LAMPIRAN
Halaman
1 Mekanisme reaksi epoksidasi...9
2 Bagan alir penelitian...10
3 Analisis kimia minyak jarak pagar ...11
4 Prosedur aktivasi katalis bentonit...12
5 Bilangan iodin dan oksirana MEJPE...13
6 Kurva 3 dimensi hubungan suhu dan konsentrasi katalis bentonit pada berbagai waktu 12 jam (a), 24 jam (b), dan 36 jam (c) terhadap bilangan oksirana. ...14
7 Kurva 3 dimensi hubungan waktu dan konsentrasi katalis bentonit pada berbagai suhu reaksi 50 oC (a), 60 oC (b), dan 70 oC (c) terhadap bilangan oksirana. ...15
8 Kurva 3 dimensi hubungan waktu dan suhu reaksi pada berbagai konsentrasi katalis bentonit: 1% (a), 2% (b), dan 3% (c) terhadap bilangan oksirana.. ...16
9 Spektrum FTIR MEJP...17
10 Spektrum FTIR MEJPE dengan katalis bentonit...18
11 Kurva hubungan bilangan oksirana dan iodin terhadap waktu reaksi pada suhu 70 oC. ...19
PENDAHULUAN
Biji jarak pagar memiliki kandungan minyak yang tinggi. Selain itu, tanaman jarak pagar dapat tumbuh di lahan kritis yang kekurangan air. Selama ini, pemanfaatan minyak jarak pagar diarahkan untuk membuat bahan bakar alternatif yang ramah lingkungan dan terbarukan, yaitu sebagai turunan metil esternya, atau yang lebih dikenal dengan nama biodesel.
Metil ester jarak pagar (MEJP) dapat dibuat melalui dua tahap, yaitu esterifikasi dan transesterifikasi. Esterifikasi merupakan proses pembentukan metil ester dari asam lemak bebas sedangkan transesterifikasi merupakan pembentukan metil ester dari trigliserida. Diversifikasi produk MEJP diperlukan untuk meningkatkan nilai tambahnya, salah satunya ialah sebagai pemlastis.
Pemlastis dapat dibuat salah satunya dengan reaksi epoksidasi dari minyak nabati. Saat ini minyak nabati yang banyak digunakan dalam industri pemlastis masih didominasi oleh minyak biji bunga matahari, minyak kelapa sawit, dan minyak kedelai (Chou & Lee 1997; Supriyadi 1992; Hazimah et al. 2000).
Reaksi epoksidasi penting dalam sintesis senyawa organik karena epoksida yang terbentuk merupakan zat antara yang dapat dikonversi menjadi beraneka ragam produk (Solomons 1980). Metode epoksidasi yang bersih dan efisien menurut Rios (2003) adalah dengan asam perkarboksilat, yang dapat dipercepat dengan menggunakan katalis. Pada penelitian ini katalis yang digunakan adalah bentonit.
Bentonit merupakan sejenis tanah liat yang mengandung mineral montmorilonit. Bentonit Indonesia umumnya digunakan untuk penjernihan minyak kelapa sawit (Soedjoko & Adrianto 1987). Pemilihan bentonit sebagai katalis adalah karena sifatnya yang ramah lingkungan jika dibandingkan dengan H2SO4.
Selain itu, bentonit merupakan katalis heterogen sehingga dapat dengan mudah dipisahkan dari hasil reaksi.
Penelitian ini bertujuan untuk mendapatkan kondisi (suhu, waktu, dan konsentrasi bentonit) optimum untuk menghasilkan senyawa epoksida dari MEJP. Parameter yang diukur meliputi bilangan oksirana dan bilangan iodin.
TINJAUAN PUSTAKA
Jarak Pagar
Jarak pagar (Jatropha curcas L.) diklasifikasikan ke dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledone, ordo Euphorbiales, famili Euphorbiceae, genus Jatropha, spesies curcas (Heyne 1987). Jarak pagar merupakan pohon perdu yang besar dengan tinggi sekitar 2 m. Daunnya bertekstur kasar dan bertajuk majemuk, terutama pada pohon yang sudah tua. Biji jarak pagar yang masih muda berwarna hijau muda, berubah kekuningan setelah tua, dan mencapai kadar minyak optimum setelah menjadi kehitaman (Gambar 1).
Gambar 1 Buah jarak pagar.
Biji jarak pagar mengandung 35–45% trigliserida, baik yang tersusun dari asam lemak jenuh seperti asam stearat maupun asam lemak takjenuh seperti asam oleat maupun linoleat. Kandungan asam lemak pada minyak jarak pagar ditampilkan pada Tabel 1.
Gambar 2 Salah satu struktur minyak dari biji jarak pagar (Manurung 2005).
Tabel 1 Kandungan asam lemak minyak jarak pagar
Sumber: Gubitz et al. (1998).
Pemlastis
Pemlastis merupakan bahan yang jika ditambahkan pada polimer akan mengurangi gaya antarmolekul dalam rantai polimer tersebut. Dengan cara ini pemlastis meningkatkan fleksibilitas dan pemanjangan yang membuat polimer lebih mudah dikerjakan (Ahmad et al. 1987). Jenis-jenis pemlastis antara lain ftalat, adipat, trimelitat, maleat, benzoat; minyak nabati terepoksidasi, sulfonamida, fosfat, dan glikol atau polieter.
Pertimbangan dalam memilih pemlastis salah satunya adalah kompatibilitas (Ahmad et al. 1987). Kompatibilitas berkaitan dengan kemampuan pemlastis untuk berikatan dengan polimer. Untuk pemlastis jenis minyak nabati terepoksidasi, kompatibilitas dapat diperbaiki dengan meningkatkan kandungan epoksidanya.
Epoksidasi
Pada dasarnya ada empat teknologi untuk menghasilkan epoksida dari alkena (ikatan tak jenuh C═C pada rantai asam lemak) (Rios 2003). Pertama ialah epoksidasi dengan asam perkarboksilat. Cara ini umum digunakan untuk industri, dan dapat dikatalisis oleh asam atau enzim. Cara kedua ialah epoksidasi dengan peroksida organik dan anorganik, termasuk epoksidasi alkali dan nitril dengan hidrogen peroksida serta epoksidasi berkatalis logam transisi. Ketiga, epoksidasi dengan halohidrin, menggunakan asam hipohalit (HOX) dan garamnya sebagai medium untuk epoksidasi alkena dengan ikatan rangkap yang tuna elektron, dan yang keempat ialah epoksidasi dengan molekul oksigen. Dari keempat metodologi tersebut, yang sering digunakan ialah metodologi pertama dan kedua karena bersih dan efisien. Mekanisme reaksi epoksidasi dapat dilihat pada Lampiran 1.
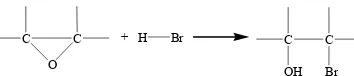
Banyaknya epoksida yang terbentuk dapat diuji dengan bilangan oksirana. Penentuan bilangan oksirana dilakukan dengan cara titrasi langsung. Senyawa oksirana akan bereaksi dengan HBr sebagai titran, sehingga cincin epoksi akan terbuka dan kandungan oksigen oksirana dapat dihitung. Reaksinya dapat dilihat pada Gambar 3.
C C
O
+ H Br C C
OH Br
Gambar 3 Reaksi pembukaan cincin epoksi.
Katalis Bentonit
Bentonit adalah tanah liat yang mengandung mineral-mineral esensial dari kelompok mineral liat smektit dengan sifat-sifat yang ditentukan oleh mineral yang berjumlah paling banyak, yaitu montmorilonit. Bentonit dibedakan menjadi bentonit yang mudah mengembang dan yang tidak dapat mengembang. Bentonit yang mudah mengembang adalah bentonit natrium (Na–bentonit) yang digunakan dalam pengeboran minyak dan gas bumi, dalam industri minyak sawit, serta dalam industri farmasi. Bentonit kalsium (Ca–bentonit) dan bentonit magnesium (Mg–bentonit), yaitu bentonit yang tidak dapat mengembang, digunakan dalam industri besi baja serta dalam industri kimia sebagai katalis, zat pemutih, zat penyerap, dan pengisi. Na-bentonit mudah mengembang apabila mengadsorpsi air, dan dapat mencapai 15 kali lebih besar dari volume asalnya (Sumardi 1982). Nilai pH bentonit natrium dalam air adalah 8.5–9.8 sedangkan bentonit kalsium adalah 4–7 (Rukiyah & Supriyatna 1991). Bentonit memiliki kemampuan menjerap dan mempertukarkan kation-kation, seperti K+, Na+, Ca2+, dan Mg2+. Kemampuan itu muncul karena adanya muatan negatif pada permukaan spesifik mineral. Bentonit mengandung kurang lebih 85% montmorilonit, sedangkan sisanya adalah campuran dari beberapa komponen lain seperti beidelit dan sponit.
Gambar 4 Struktur bentonit.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan antara lain oven, lempeng pemanas, saringan vakum, alat-alat kaca, dan perangkat spektrofotometer inframerah transformasi fourier (FTIR tipe Shimadzu 8400).
(PT Bentonit Alam Raya Cibinong), CH3COOH, toluena, Na2S2O3, NaHCO3, H2O2
35% (dalam air), KOH, indikator fenolftalein, HCl 0.5 N, NaOH 0.01 N, kloroform, iodin murni, larutan brom KI 10%, Na2S2O3 0.1 N,
larutan HBr, natrium sulfat anhidrat, dan indikator amilum 1%.
Metode Penelitian
Tahapan yang dilakukan dalam penelitian meliputi analisis bahan baku dan optimalisasi reaksi epoksidasi. Analisis bahan baku meliputi bilangan oksirana dan bilangan iodin. Optimalisasi dilakukan dengan meragamkan suhu dan waktu reaksi serta konsentrasi katalis. Bagan alir penelitian dapat dilihat pada Lampiran 2.
Analisis Bahan Baku
Analisis kimia MEJP meliputi bilangan oksirana dan bilangan iodin. Metode selengkapnya dapat dilihat di Lampiran 3.
Optimalisasi Reaksi Epoksidasi (modifikasi Rios 2003)
Sebanyak 10 gram MEJP dicampur dengan 0.8 mL asam asetat dan 2.9 mL toluena sebagai pelarut, kemudian ditambahkan katalis bentonit (1, 2, dan 3%) yang sebelumnya telah diaktivasi. Prosedur aktivasi diberikan pada Lampiran 4. Setelah itu, 5.78 gram H2O2 35% dalam air
ditambahkan tetes demi tetes dari corong pisah sambil diaduk dengan suhu dijaga konstan pada 50, 60, dan 70 oC dengan terus diaduk kuat. Setelah 12, 24, dan 36 jam, fase minyak dinetralkan dengan NaHCO3 lalu
dicuci berulang kali dengan akuades. Bilangan oksirana, bilangan iodin, dan spektrum FTIR-nya dianalisis.
Data hasil analisis bilangan oksirana dan bilangan iodin diolah dalam perangkat lunak Modde 5. Kondisi optimum yang diperoleh kemudian divalidasi. Validasi dilakukan pada kondisi konsentrasi bentonit dan suhu tetap sedangkan waktu reaksi divariasikan. Rangkaian radas epoksidasi yang digunakan dapat dilihat pada Gambar 5.
Gambar 5 Radas epoksidasi.
HASIL DAN PEMBAHASAN
Analisis Bahan Baku
Analisis MEJP awal dilakukan untuk mengetahui pengaruh proses epoksidasi yang dilakukan pada penelitian ini. Hasil analisis bilangan oksirana dan bilangan iodin berturut-turut sebesar 0.04% dan 96.15 g I/100 g.
Optimalisasi Reaksi Epoksidasi
Data hasil analisis bilangan oksirana dan bilangan iodin produk epoksidasi terdapat pada Lampiran 5. Pengolahan data tersebut dengan perangkat lunak Modde 5. menghasilkan kurva–kurva 3 dimensi yang ditampilkan di Lampiran 6–8.
Tabel 2 Pengaruh variasi waktu reaksi epoksidasi terhadap bilangan oksirana MEJP epoksida.
Bilangan Oksirana (%) Waktu
(Jam) Minimum Maksimum 12 24 36 0.43–0.45 0.54–0.57 0.64–0.68 0.58–0.59 0.82–0.85 1.07–1.11
Kurva 3 dimensi hubungan waktu dengan konsentrasi bentonit pada berbagai suhu terhadap bilangan oksirana ditampilkan di Lampiran 7. Dapat disimpulkan bahwa suhu yang semakin tinggi meningkatkan bilangan oksirana (Tabel 3). Kenaikan suhu akan meningkatkan pengikatan oksigen pada ikatan rangkap. Pengikatan oksigen ini sangat berpengaruh terhadap konversi gugus takjenuh dalam minyak menjadi senyawa epoksi (Eckey 1954). Menurut Wood & Termini (1958), proses epoksidasi biasanya dilakukan pada suhu 65–75 oC. Suhu yang lebih rendah akan memperpanjang waktu epoksidasi dan menurunkan efisiensinya. Sementara berdasarkan hasil penelitian Haya (1991), proses epoksidasi pada suhu 100–105
o
C menghasilkan senyawa epoksi dengan bilangan oksirana yang tinggi.
Tabel 3 Pengaruh variasi suhu reaksi epoksidasi terhadap bilangan oksirana MEJP epoksida.
Bilangan Oksirana (%) Suhu
(oC) Minimum Maksimum 50 60 70 0.44–0.46 0.50–0.53 0.55–0.61 0.65–0.67 0.86–0.89 1.06–1.11
Lampiran 8 menunjukan kurva 3 dimensi hubungan suhu dan waktu pada berbagai konsentrasi bentonit terhadap bilangan oksirana. Dapat disimpulkan bahwa kenaikan konsentrasi bentonit (1–3%) cenderung tidak berpengaruh terhadap bilangan oksirana (Tabel 4). Konsentrasi bentonit yang digunakan diduga terlalu kecil jika dibandingkan dengan hasil penelitian lainnya, misalnya yang dilakukan oleh Petrovic et al. (2001) yang konsentrasinya mencapai 25%. Prinsip kerja bentonit pada reaksi epoksidasi ini adalah dengan cara menyediakan luas permukaan dan kemasaman permukaan. Luas permukaan dan kemasaman permukaan bentonit dapat ditingkatkan dengan cara aktivasi.
Tabel 4 Pengaruh variasi konsentrasi bentonit terhadap bilangan oksirana MEJP epoksida.
Bilangan Oksirana (%) [Ben]
(%) Minimum Maksimum 1 2 3 0.44–0.50 0.47–0.53 0.50–0.55 1.04–1.10 1.05–1.11 1.06–1.11
Bentonit merupakan katalis heterogen. Keuntungan penggunaan katalis heterogen yaitu, mudah dipisahkan dari hasil reaksi dan bersifat ramah lingkungan. Nilai bilangan oksirana jika digunakan bentonit sebagai katalis lebih rendah dibandingkan dengan menggunakan katalis amberlit yang memiliki nilai 3.61% (Suharto 2007). Sementara jika dibandingkan dengan katalis zeolit yang memiliki nilai optimum bilangan oksirana sebesar 0.62%, katalis bentonit menghasilkan bilangan oksirana yang lebih tinggi (Diana 2007). Akan tetapi, jika dibandingkan dengan katalis homogen seperti H2SO4 yang memiliki
bilangan oksirana sebesar 4.02% (Sary 2007), epoksidasi dengan katalis bentonit kurang berhasil. Hal ini disebabkan ion H+ dari H2SO4 dapat bergerak bebas sehingga bekerja
lebih optimum.
Selain bilangan oksirana, parameter lain yang dianalisis adalah bilangan iodin. Pada kondisi optimum reaksi epoksidasi dihasilkan bilangan iodin sebesar 72.22 g I/100 g.
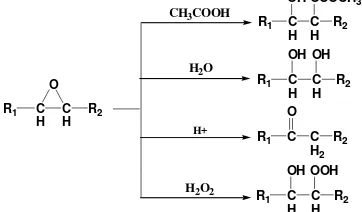
Terlihat penurunan bilangan iodin dari MEJP awal yang nilai bilangan iodinnya 96.15 g I/100 g. Penurunan ini terjadi karena hilangnya ikatan rangkap dan telah terbentuknya epoksida. Epoksida yang terbentuk mudah mengalami pembukaan cincin menghasilkan bermacam-macam produk (Gambar 6). Pembukaan cincin dapat terjadi pada suasana asam (Campanella & Baltanas 2005).
CH3COOH
H2O
H2O2 H+
R1 C
H C H
R2
OH OCOCH3
R1 C
H C H
R2
OH OH
R1 C C
H2
R2
O
R1 C
H C H
R2
OH OOH R1 C
H C H R2 O Gambar 6 Reaksi pembukaan cincin oksirana
Produk epoksidasi juga diidentifikasi gugus fungsinya dengan menggunakan FTIR. Spektrum MEJP epoksida memiliki puncak-puncak serapan yang sama seperti pada MEJP. Adapun puncak-puncak yang dimiliki meliputi gugus C=O ester pada 1743.5 cm-1; gugus C=C pada 1654.8 cm-1; dan gugus C–O pada bilangan gelombang 1018.3, 1118.6, 1168.8, 1195.8, dan 1245.9 cm-1 (Lampiran 9 & 10). Perbedaan kedua spektrum hanya pada % transmitans (%T) C=C. MEJP memiliki %T 77% sedangkan untuk MEJPE sebesar 79%. Kenaikan %T menandai berkurangnya jumlah gugus C=C yang menyerap pada daerah inframerah. Kemiripan spektrum antara MEJP dan MEJPE diduga karena tidak semua ikatan C=C menjadi epoksida.
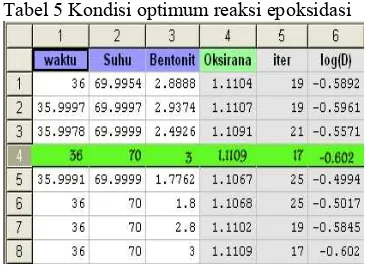
Tabel 5 menunjukkan data optimum dari tiga peubah terhadap bilangan oksirana. Nilai ini didapat dengan menggunakan perangkat lunak Modde 5. Kondisi optimum yang diperoleh adalah pada waktu reaksi 36 jam, suhu 70 oC, dan konsentrasi bentonit 3% dengan bilangan oksirana sebesar 1.11%.
Tabel 5 Kondisi optimum reaksi epoksidasi
Validasi dilakukan pada kondisi suhu dan konsentrasi bentonit optimum. Pengambilan dilakukan setiap 6 jam kemudian dianalisis bilangan oksirana dan bilangan iodinnya. Hasil yang diperoleh ditunjukkan pada Tabel 6, sedangkan kurva bilangan oksirana dan bilangan iod dapat dilihat pada Lampiran 11. Terlihat bahwa kenaikan bilangan oksirana diikuti dengan penurunan bilangan iodin. Selain itu, bilangan oksirana optimum dicapai pada waktu 36 jam, yaitu sebesar 2.37%. Dengan demikian, prediksi kondisi optimum yang menghasilkan bilangan oksirana optimum dengan menggunakan perangkat lunak Modde 5 (Tabel 5) dapat dikatakan sahih. Namun, keterulangan nilai bilangan oksirana masih perlu diuji kembali, dan dilakukan dengan waktu reaksi lebih lama.
Tabel 6 Pengaruh hubungan variasi waktu terhadap bilangan oksirana pada suhu 70 oC
Jam Ke-
Bilangan oksirana (%)
Bilangan Iod (g I/100 g) 0 6 12 18 24 30 36 0.04 0.61 1.09 1.50 1.88 2.12 2.37 81.09 72.72 64.84 58.99 51.11 45.57 39.64
Hasil analisis keragaman atau Anova (Lampiran 12) menghasilkan persamaan pengaruh suhu reaksi, konsentrasi katalis bentonit, waktu epoksidasi, dan interaksi di antara mereka terhadap bilangan oksirana. Persamaan yang didapat adalah
Y= 0.699511 + 0.0157278a + 0.18025b + 0.139994c – 0.006875ab
–0.00542496ac + 0.087725bc dengan a b c ab ac bc
= konsentrasi bentonit = waktu reaksi = suhu reaksi
= interaksi konsentrasi bentonit dengan waktu reaksi
= interaksi konsentrasi bentonit dengan suhu reaksi
= interaksi waktu reaksi dengan suhu reaksi
dengan nilai R2 dan Q2 berturut-turut adalah 0.654 dan 0.351 Linearitas dari optimalisasi tergolong rendah (0.654<0.9995). Rendahnya nilai linearitas ini disebabkan oleh ketidakseragaman setiap sintesis yang dilakukan, terutama faktor suhu yang digunakan.
Persamaan di atas memberikan pengaruh nyata terhadap bilangan oksirana dengan nilai peluang (P) 0.001, lebih kecil daripada taraf α (5%). Hal ini membuktikan bahwa perbedaan suhu, waktu, dan konsentrasi bentonit akan memengaruhi besarnya bilangan oksirana yang diperoleh.
SIMPULAN DAN SARAN
Simpulan
Kondisi optimum epoksidasi MEJP yang didapat dengan menggunakan perangkat lunak Modde 5 adalah pada waktu 36 jam, suhu 70
o
Saran
Penyimpanan MEJP perlu diperhatikan karena sangat tidak stabil. Juga diperlukan penelitian dengan meragamkan konsentrasi pereaksi-pereaksi yang digunakan dan dengan menggunakan suhu dan waktu reaksi yang lebih tinggi.
DAFTAR PUSTAKA
Ahmad S et al. 1987. Potential Application of Epoxydized Palm Oil in Plastic and Rubber Industries. Di dalam Palm Oil Conferences. Conferences II: Technolog; [tempat tidak diketahui], 29 Juni–1 Juli 1987.
Campanella A, Baltanas MA. 2005. “Degradation of the oxirane ring of epoxidized vegetable oils in liquid-liquid system: I. hydrolysis and attack by H2O2”.
La. Am Appl Res 35: 205-210.
Chou TC, Lee V. 1997. Epoxidation of oleic acid in the present of benzaldehyde using cobalt(II) tetraphenylphorpirin as catalyst. Indust Eng Res 36:1485-1490.
Diana W. 2007. Optimalisasi reaksi epoksidasi metil ester jarak pagar dengan katalis zeolit sebagai pemlastis alternatif [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Eckey EW. 1954. Vegetable fats and Oils. New York: Reinhold.
Gubitz GM, Mittelbatch M, Trabi M. 1999. Exploitation of the tropical oil seed plant Jatropha curcas L. Bioresource Tech 67:73-82.
Haya MD. 1991. Mempelajari pembuatan senyawa epoksi dari minyak kelapa sawit kasar [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Hazimah AH, Salimah A, Ahmad I. 2000. Epoxidation palm oil creates exciting avenues for palm-based industrilisation. Forum Information Service ISSN 0218-5726.
Heyne K. 1987. Tumbuhan Berguna Indonesia. Jilid ke-2. Jakarta. Yayasan Sana Wana Jaya.
Jaya I, Sugita P, & Sudrajat. 2005. Optimasi sintesis biodiesel dari minyak jarak pagar (Jatropha curcas L.) melalui Proses Esterifikasi-Transesterifikasi [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Koto ZS. 1992. Pembuatan senyawa epoksi metil ester asam lemak dari fraksi olein minyak sawit [skripsi]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Manurung R. 2005. Straight Jatropha oil: promissing green fuel. Jatr Oil 46:25. [terhubung berkala]. http://www.chem.ac. ad /jatropha/marung.pdf. [23 Mar 2005]
Petrović ZS, Zlatanić A, Lava CC, Sinadinović-Fišer S. 2001. Epoxidation of soybean oil in toluene with peroxoacetic and peroxoformic acids - Kinetics and side reactions. USA. Pittsburg State University, Kansas Polymer Research Center.
Purwaningsih H. 1998. Isomerisasi xilena dengan katalis bentonit [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rios LA. 2003. Heterogeneously catalyzed reactions with vegetable oils: Epoxidation and nucleophilic epoxide ring-opening with alcohol [disertasi]. The Institute of Chemical Technology and Heterogenous Catalysis. University RWTH-Aachen.
Rukiyah & Supriyatna. 1991. Aplikasi berbagai zeolit dan bentonit sebagai adsorben simulasi air limbah tekstil serta uji toksisitas terhadap larva A. Salina Leach. Laporan penelitian. Bandung: Fakultas Matematika dan Ilmu pengetahuan Alam, Universitas Padjajaran.
Solomons TWG. 1980. Organic Chemistry. Ed ke-2. New York: J Wiley.
Soedjoko TS & B Adrianto. 1987. Penelitian Pemanfaatan Bentonit Indonesia. Buletin. PPTM. 9:4-28.
Suharto J. 2007. Kinetika dan optimalisasi reaksi epoksidasi metil ester jarak pagar dengan katalis amberlit IR-120 [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Sumardi. 1982. Penggunaan bentonit untuk penurunan tahanan pertanahan. Laporan Penelitian. Bandung: Lembaga Kimia Nasional-LIPI.
Lampiran 1 Mekanisme reaksi epoksidasi
Tahap 1
Tahap 2
C C O
H
O C
O
R
+
OO
H O
C
R
C
C
R C
O HO
O C
C
+
Asam peroksiasetat Senyawa tak jenuh
Epoksida
Asam karboksilat
Lampiran 2 Bagan alir penelitian
Reaksi Epoksidasi
Optimalisasi:
• Waktu (12, 24, dan 36 jam) • Suhu (50, 60, dan 70 oC) • [Bentonit] (1, 2, dan 3%)
5.78 g H2O2 35%
Sentrifugasi
Fase minyak
Netralisasi (NaHCO3) dan
pencucian dengan air
Fase minyak
Pengamatan:
1. Penentuan bilangan iodin 2. Penentuan bilangan oksirana 3. Analisis dengan FTIR
Validasi
Optimalisasi dengan Modde 5
Membuat kurva pengaruh variasi [katalis], suhu (T), dan waktu (t)
terhadap bilangan oksirana.
Fase cair 0.8 ml CH3COOH
2.9 ml Toluena
Fase cair
Metil Ester Jarak Pagar
Analisis bahan baku
• Bilangan oksirana
• Bilangan iod
Lampiran 3 Analisis kimia minyak jarak pagar
Bilangan Oksirana (AOAC, 1984)
Sampel sebanyak (0.3–0.5) g (± 0.0001 g) ditimbang, lalu dimasukkan ke dalam labu
Erlenmeyer 50 mL, kemudian dilarutkan dalam 10 mL asam asetat glasial. Setelah itu,
ditambahkan indikator kristal ungu sebanyak 5 tetes (maksimum 0.1 mL), lalu dititrasi dengan
larutan HBr 0.1 N sampai berwarna hijau kebiruan selama 30 detik.
contoh
bobot
60
1
oksirana
Bilangan
=
V
×
N
×
.
dengan:
V = volume HBr (mL)
N = normalitas HBr
Bilangan Iodin (AOAC, 1984)
Ditimbang ± 0.5 g contoh lemak/minyak ke dalam Erlenmeyer 250 mL lalu ditambahkan
10 mL kloroform dan 25 mL larutan Hanus (IBr), kemudian didiamkan selama 3 jam dalam ruang
gelap. Setelah itu, ditambahkan 20 mL KI 10% dan Erlenmeyer segera ditutup. Dikocok sebentar
lalu dititrasi dengan larutan Na2S2O3 0.1 N. Setelah titrat berwarna kuning muda, ditambahkan 5
tetes indikator amilum 1% dan dititrasi kembali sampai warna biru tepat hilang. Dikerjakan juga
penetapan blangko.
Pembuatan larutan Hanus. Sebanyak 13.2 g iodium murni dilarutkan dalam 1 liter asam
asetat glasial sambil dipanaskan sehingga iodium melarut sempurna (lakukan dengan hati-hati di
ruang asam). Larutan tersebut dibiarkan sampai dingin. Setelah itu, ditambahkan 3 ml brom
sehingga larutan berwarna kelabu tua. Larutan disimpan dalam botol berwarna gelap dan ditutup
rapat. Bilangan iod dihitung sebagai berikut:
Bilangan iod =
M
)
V
(V
T
12.69
×
×
3−
4Dengan:
T : Normalitas larutan standar Na2S2O3 0.1 N
V3 : Volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan
blanko (mL).
V4 : Volume larutan Na2S2O3 0.1 N yang diperlukan untuk mentitrasi larutan
contoh (mL).
Lampiran 4 Prosedur aktivasi katalis bentonit (Purwaningsih, 1998)
Bentonit dicampur dengan H2SO4 24% kemudian dipanaskan pada suhu 100 oC selama 4
jam. Selanjutnya bentonit disaring dan dicuci dengan air sampai netral. Setelah dikeringkan di
Lampiran 5 Bilangan iodin dan oksirana MEJPE
Kondisi ReaksiNo Waktu (jam)
Suhu (°C)
[Bentonit] (%)
Bilangan Iodin (g I/100 g)
Bilangan Oksirana
(%)
1 12 50 1 78.68 0.53
2 12 60 1 80.31 0.49
3 12 70 1 80.49 0.58
4 12 50 2 79.45 0.41
5 12 60 2 83.75 0.45
6 12 70 2 84.52 0.36
7 12 50 3 83.07 0.37
8 12 60 3 81.27 0.48
9 12 70 3 77.20 0.75
10 24 50 1 77.70 0.56
11 24 60 1 75.04 0.72
12 24 70 1 75.28 0.83
13 24 50 2 79.92 0.45
14 24 60 2 69.42 1.03
15 24 70 2 74.78 0.73
16 24 50 3 78.82 0.74
17 24 60 3 77.76 0.84
18 24 70 3 77.97 0.90
19 36 50 1 78.88 0.57
20 36 60 1 74.54 0.85
21 36 70 1 66.07 1.35
22 36 50 2 79.91 0.54
23 36 60 2 72.56 0.97
24 36 70 2 78.66 0.70
25 36 50 3 78.92 0.63
26 36 60 3 75.14 0.95
Lampiran 6 Kurva 3 dimensi hubungan suhu dan konsentrasi katalis bentonit pada
berbagai waktu reaksi 12 jam (a), 24 jam (b), dan 36 jam (c) terhadap
bilangan oksirana
(a) (b)
Lampiran 7 Kurva 3 dimensi hubungan waktu dan konsentrasi katalis bentonit
pada berbagai suhu reaksi 50
oC (a), 60
oC (b), dan 70
oC (c)
terhadap bilangan oksirana
(a) (b)
Lampiran 8 Kurva 3 dimensi hubungan waktu dan suhu reaksi pada berbagai
konsentrasi katalis bentonit: 1% (a), 2% (b), dan 3% (c) terhadap
bilangan oksirana.
(a) (b)
Lampiran 9 Spektrum F
T
Lampiran 11 Kurva hubungan bilangan oksirana (a) dan iodin (b) terhadap waktu
pada suhu 70
oC
y = 0,3862x - 0,1725 R2 = 0,9771
0 0,5 1 1,5 2 2,5 3
0 6 12 18 24 30 36
Waktu (jam) B ila n g a n o k s ir a n a ( % )
(a)
y = -1,1451x + 79,753 R2 = 0,9956
0 10 20 30 40 50 60 70 80 90
0 10 20 30 40
Lampiran 12 Hasil uji Anova dan koefisien kuadratik
Uji Anova untuk oksirana
Oksirana DF SS MS F p SD
(variance)
Total 27 147.955 0.547981
Constant 1 132.115 132.115
Total Corrected 26 158.397 0.0609219 0.246824
Regression 6 103.531 0.172552 629.001 0.001 0.415394
Residual 20 0.548655 0.0274328 0.165628
N = 27 Q2 = 0.351 Cond. no. = 15.000 DF = 20 R2 = 0.654 Y-miss = 0
R2 Adj. = 0.550 RSD = 0.1656
Uji Koefisien kuadratik untuk oksirana
Oksirana Coeff. SC Std. Err. P Conf. int(±)
Constant 0.699511 0.0318752 1,82E-10 0.0664906
Ben 0.0157278 0.039039 0.691314 0.0814341
Wak 0.18025 0.039039 0.000166559 0.0814341
Suh 0.139994 0.039039 0.00184737 0.0814341
Ben*Wak -0.006875 0.0478128 0.887105 0.099736
Ben*Suh -0.00542496 0.0478128 0.910796 0.0997359
Wak*Suh 0.087725 0.0478128 0.081461 0.0997359
N = 27 Q2 = 0.351 Cond. no. = 15.000
DF = 20 R2 = 0.654 Y-miss = 0
R2 Adj. = 0.550 RSD = 0.1656