UJI TOKSISITAS KADMIUM DAN TIMBAL PADA
MIKROALGA Chaetoceros gracilis
MARTIWI DIAH SETIAWATI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
UJI TOKSISITAS KADMIUM DAN TIMBAL PADA MIKROALGA
Chaetoceros gracilis
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RINGKASAN
MARTIWI DIAH SETIAWATI. C54050557. UJI TOKSISITAS KADMIUM DAN TIMBAL PADA MIKROALGA Chaetoceros gracilis. Dibimbing oleh : RICHARDUS KASWADJI dan DWI HINDARTI
Kadmium dan timbal adalah jenis logam berat yang sering digunakan untuk bahan baku maupun bahan tambahan suatu industri. Pengetahuan mengenai sifat dan karakteristik serta potensi toksisitas kedua logam berat tersebut terhadap organisme sangat dibutuhkan dalam upaya pencegahan dan penanggulangan pencemaran akibat kegiatan industri . Kadmium dan timbal diujikan pada satu spesies mikroalga yaitu C. gracillis. Jenis mikrolaga ini dipilih karena spesies ini banyak digunakan untuk aktivitas budidaya laut yaitu sebagai pakan udang dan sebagai produsen primer di lingkungan perairan laut.
Tujuan dari penelitian ini adalah menduga nilai IC50 (Inhibition
Concentration), NOEC (No Observed Effect Concentration), dan LOEC (Lowest Observed Effect Concentration) selama 96 jam setelah diberikan toksikan berupa kadmium dan timbal terhadap perkembangan jumlah sel C. gracillis. Metode penelitian yang digunakan mengacu pada Asean Canada CPMS II, 1995. Penelitian dilakukan di laboratorium Ekotoksikologi dan Analisis Kimia P2O LIPI pada bulan Februari sampai dengan bulan Mei 2009. Penelitian dilakukan dengan beberapa tahap diantaranya; persiapan alat dan bahan, kultivasi C. gracillis, uji toksisitas pendahuluan, uji definitif, dan pengukuran konsentrasi aktual. Data kepadatan sel dan konsentrasi aktual yang diperoleh kemudian
dianalisis menggunakan program ICPIN untuk menghitung nilai IC50 dan program
TOXSTAT untuk menghitung nilai NOEC dan LOEC..
Nilai IC50-96 jam dari toksikan kadmium dan timbal terhadap C.gracillis
© Hak cipta milik Martiwi Diah Setiawati, tahun 2009
Hak cipta dilindungi
UJI TOKSISITAS KADMIUM DAN TIMBAL PADA
MIKROALGA Chaetoceros gracilis
MARTIWI DIAH SETIAWATI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : UJI TOKSISISTAS KADMIUM DAN TIMBAL PADA MIKROALGA Chaetoceros gracilis
Nama : MARTIWI DIAH SETIAWATI
NRP : C54050557
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Richardus Kaswadji , M.Sc Ir. Dwi Hindarti, M.Sc
NIP. 19450405 197301 1 001 NIP. 19610501 198603 2 003
Mengetahui, Ketua Departemen ITK
Prof. Dr. Ir. Setyo Budi Susilo,M.Sc NIP. 19580909 198303 1 003
KATA PENGANTAR
Puji syukur kepada ALLAH SWT karena dengan rahmat dan karuniaNya kepada penulis sehingga mampu menyelesaikan skripsi. Skripsi ini disusun berdasarkan hasil penelitian yang dilakukan pada bulan Februari sampai bulan Mei 2009 di Laboratorium Ekotoksikologi dan Laboratorium Analisis Kimia, Pusat Penelitian Oseanografi LIPI, Jakarta.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada : 1. Dr. Ir. Richardus Kaswadji M. Sc dan Ir. Dwi Hindarti M.Sc selaku dosen
pembimbing.
2. Dr. Ir.Tri Prartono, M.Sc sebagai dosen penguji dan Dr. Henry M. Manik, M.T sebagai Ketua Komisi Pendidikan Departemen ITK, FPIK, IPB. 3. Prof. Dr. Ir. Indra Jaya, M.Sc selaku pembimbing akademik.
4. Triyoni Purbonegoro, S.Si; Rahma Puspitasari, S.Si; Suratno, S.Si; Rozak Amd; dan Eston Amd yang telah banyak membantu penulis dalam
penelitian.
5. Kedua orangtua penulis atas doa dan dukungan yang diberikan dalam berbagai hal.
Akhir kata, semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Agustus 2009
DAFTAR ISI
3.2.1 Alat Pemeliharaan Kultur C. gracilis, Uji Toksisitas dan Pengukuran Konsentrasi Aktual ... 12
3.2.2 Bahan-Bahan Untuk Pemeliharaan C. gracilis, Uji Toksisitas dan Pengukuran Konsentrasi Aktual ... 12
3.3.5 Uji Toksisitas Kadmium dan Timbal Terhadap Perkembangan Jumlah Sel C. gracilis ... 17
3.3.6 Pengukuran Kualitas Air ... 19
3.3.7 Pengukuran Konsentrasi Aktual Larutan Uji ... 20
3.3.8 Analisis Data ... 21
4. HASIL DAN PEMBAHASAN 4.1 Pola Pertumbuhan C. gracilis ... 24
4.2 Parameter Kualitas Air ... 25
4.2.2 Derajat Keasamaan (pH) ... 26
4.2.3 Salinitas ... 26
4.2.4 Oksigen Terlarut... 27
4.3 Uji Toksisitas Pendahuluan (Range Finder Test) ... 27
4.4 Uji Definitif ... 31
4.4.1 Konsentrasi Aktual ... 31
4.4.2 Toksisitas Kadmium dan Timbal Terhadap Pertumbuhan Sel C. gracilis ... 32
5. KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 44
DAFTAR TABEL
Halaman
1. Toksisitas kadmium terhadap beberapa jenis organisme laut ... 6 2. Toksisitas timbal terhadap beberapa jenis organisme laut ... 8 3. Komposisi bahan-bahan media Walne bagi pemeliharaan
C. gracilis ... 14
4. Kondisi yang direkomendasikan Asean-Canada CPMS II (1995)
untuk uji toksisitas pertumbuhan mikroalga ... 19 5. Hasil pengukuran kualitas air pada uji toksisitas kadmium pada
mikroalga C. gracilis ... 25 6. Hasil pengukuran kualitas air pada uji toksisitas timbal pada
mikroalga C. gracilis ... 25 7. Kualitas air uji pendahuluan toksisitas timbal pada C. gracilis ... 27 8. Persentase penghambatan kepadatan C. gracilis terhadap timbal
pada uji pendahuluan... 28 9. Kandungan timbal dan nitrat dalam senyawa Pb(NO3)2 dalam
berbagai konsentrasi ... 30 10.Hasil pengukuran konsentrasi nominal dan aktual... 31 11. Persentas penghambatan pertumbuhan sel C. gracilis akibat
pengaruh kadmium dan timbal pada jam ke-96 ... 36 12. Nilai IC50, NOEC dan LOEC pada uji toksisitas kadmium dan timbal
UJI TOKSISITAS KADMIUM DAN TIMBAL PADA
MIKROALGA Chaetoceros gracilis
MARTIWI DIAH SETIAWATI
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
UJI TOKSISITAS KADMIUM DAN TIMBAL PADA MIKROALGA
Chaetoceros gracilis
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RINGKASAN
MARTIWI DIAH SETIAWATI. C54050557. UJI TOKSISITAS KADMIUM DAN TIMBAL PADA MIKROALGA Chaetoceros gracilis. Dibimbing oleh : RICHARDUS KASWADJI dan DWI HINDARTI
Kadmium dan timbal adalah jenis logam berat yang sering digunakan untuk bahan baku maupun bahan tambahan suatu industri. Pengetahuan mengenai sifat dan karakteristik serta potensi toksisitas kedua logam berat tersebut terhadap organisme sangat dibutuhkan dalam upaya pencegahan dan penanggulangan pencemaran akibat kegiatan industri . Kadmium dan timbal diujikan pada satu spesies mikroalga yaitu C. gracillis. Jenis mikrolaga ini dipilih karena spesies ini banyak digunakan untuk aktivitas budidaya laut yaitu sebagai pakan udang dan sebagai produsen primer di lingkungan perairan laut.
Tujuan dari penelitian ini adalah menduga nilai IC50 (Inhibition
Concentration), NOEC (No Observed Effect Concentration), dan LOEC (Lowest Observed Effect Concentration) selama 96 jam setelah diberikan toksikan berupa kadmium dan timbal terhadap perkembangan jumlah sel C. gracillis. Metode penelitian yang digunakan mengacu pada Asean Canada CPMS II, 1995. Penelitian dilakukan di laboratorium Ekotoksikologi dan Analisis Kimia P2O LIPI pada bulan Februari sampai dengan bulan Mei 2009. Penelitian dilakukan dengan beberapa tahap diantaranya; persiapan alat dan bahan, kultivasi C. gracillis, uji toksisitas pendahuluan, uji definitif, dan pengukuran konsentrasi aktual. Data kepadatan sel dan konsentrasi aktual yang diperoleh kemudian
dianalisis menggunakan program ICPIN untuk menghitung nilai IC50 dan program
TOXSTAT untuk menghitung nilai NOEC dan LOEC..
Nilai IC50-96 jam dari toksikan kadmium dan timbal terhadap C.gracillis
© Hak cipta milik Martiwi Diah Setiawati, tahun 2009
Hak cipta dilindungi
UJI TOKSISITAS KADMIUM DAN TIMBAL PADA
MIKROALGA Chaetoceros gracilis
MARTIWI DIAH SETIAWATI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
SKRIPSI
Judul : UJI TOKSISISTAS KADMIUM DAN TIMBAL PADA MIKROALGA Chaetoceros gracilis
Nama : MARTIWI DIAH SETIAWATI
NRP : C54050557
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Richardus Kaswadji , M.Sc Ir. Dwi Hindarti, M.Sc
NIP. 19450405 197301 1 001 NIP. 19610501 198603 2 003
Mengetahui, Ketua Departemen ITK
Prof. Dr. Ir. Setyo Budi Susilo,M.Sc NIP. 19580909 198303 1 003
KATA PENGANTAR
Puji syukur kepada ALLAH SWT karena dengan rahmat dan karuniaNya kepada penulis sehingga mampu menyelesaikan skripsi. Skripsi ini disusun berdasarkan hasil penelitian yang dilakukan pada bulan Februari sampai bulan Mei 2009 di Laboratorium Ekotoksikologi dan Laboratorium Analisis Kimia, Pusat Penelitian Oseanografi LIPI, Jakarta.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih kepada : 1. Dr. Ir. Richardus Kaswadji M. Sc dan Ir. Dwi Hindarti M.Sc selaku dosen
pembimbing.
2. Dr. Ir.Tri Prartono, M.Sc sebagai dosen penguji dan Dr. Henry M. Manik, M.T sebagai Ketua Komisi Pendidikan Departemen ITK, FPIK, IPB. 3. Prof. Dr. Ir. Indra Jaya, M.Sc selaku pembimbing akademik.
4. Triyoni Purbonegoro, S.Si; Rahma Puspitasari, S.Si; Suratno, S.Si; Rozak Amd; dan Eston Amd yang telah banyak membantu penulis dalam
penelitian.
5. Kedua orangtua penulis atas doa dan dukungan yang diberikan dalam berbagai hal.
Akhir kata, semoga skripsi ini bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Agustus 2009
DAFTAR ISI
3.2.1 Alat Pemeliharaan Kultur C. gracilis, Uji Toksisitas dan Pengukuran Konsentrasi Aktual ... 12
3.2.2 Bahan-Bahan Untuk Pemeliharaan C. gracilis, Uji Toksisitas dan Pengukuran Konsentrasi Aktual ... 12
3.3.5 Uji Toksisitas Kadmium dan Timbal Terhadap Perkembangan Jumlah Sel C. gracilis ... 17
3.3.6 Pengukuran Kualitas Air ... 19
3.3.7 Pengukuran Konsentrasi Aktual Larutan Uji ... 20
3.3.8 Analisis Data ... 21
4. HASIL DAN PEMBAHASAN 4.1 Pola Pertumbuhan C. gracilis ... 24
4.2 Parameter Kualitas Air ... 25
4.2.2 Derajat Keasamaan (pH) ... 26
4.2.3 Salinitas ... 26
4.2.4 Oksigen Terlarut... 27
4.3 Uji Toksisitas Pendahuluan (Range Finder Test) ... 27
4.4 Uji Definitif ... 31
4.4.1 Konsentrasi Aktual ... 31
4.4.2 Toksisitas Kadmium dan Timbal Terhadap Pertumbuhan Sel C. gracilis ... 32
5. KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 44
DAFTAR TABEL
Halaman
1. Toksisitas kadmium terhadap beberapa jenis organisme laut ... 6 2. Toksisitas timbal terhadap beberapa jenis organisme laut ... 8 3. Komposisi bahan-bahan media Walne bagi pemeliharaan
C. gracilis ... 14
4. Kondisi yang direkomendasikan Asean-Canada CPMS II (1995)
untuk uji toksisitas pertumbuhan mikroalga ... 19 5. Hasil pengukuran kualitas air pada uji toksisitas kadmium pada
mikroalga C. gracilis ... 25 6. Hasil pengukuran kualitas air pada uji toksisitas timbal pada
mikroalga C. gracilis ... 25 7. Kualitas air uji pendahuluan toksisitas timbal pada C. gracilis ... 27 8. Persentase penghambatan kepadatan C. gracilis terhadap timbal
pada uji pendahuluan... 28 9. Kandungan timbal dan nitrat dalam senyawa Pb(NO3)2 dalam
berbagai konsentrasi ... 30 10.Hasil pengukuran konsentrasi nominal dan aktual... 31 11. Persentas penghambatan pertumbuhan sel C. gracilis akibat
pengaruh kadmium dan timbal pada jam ke-96 ... 36 12. Nilai IC50, NOEC dan LOEC pada uji toksisitas kadmium dan timbal
DAFTAR GAMBAR
Halaman
1. Morfologi Chaetoceros gracilis ... 10 2. Kurva pertumbuhan kultur C. gracilis selama 7 hari ... 24 3. Grafik kepadatan sel C. gracilis dengan berbagai konsentrasi
timbal jam ke-96 pada uji toksisitas pendahuluan ... 29 4. Grafik kepadatan sel C. gracilis selama 96 jam pada berbagai
konsentrasi kadmium... 32
5. Grafik kepadatan sel C. gracilis selama 96 jam pada berbagai
DAFTAR LAMPIRAN
Halaman
1. Perhitungan kepadatan sel mikroalga dengan menggunakan
Haemocytometer ... 44 2. Pembuatan berbagai konsentrasi kadmium dari larutan stok
kadmium sebesar 1000 ppm ... 45 3. Pembuatan berbagai konsentrasi timbal dari larutan stok timbal
1000 dan 100 ppm ... 47 4. Pembuatan stok kultur untuk inokulasi agar memiliki kepadatan awal
106 sel/ml ... 49 5. Penentuan fase pertumbuhan C. gracilis ... 50 6. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-48
dengan toksikan kadmium pada uji akhir ... 52 7. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-72
dengan toksikan kadmium pada uji akhir ... 53 8. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-96
dengan toksikan kadmium pada uji akhir... 54 9. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-96
dengan toksikan timbal pada uji pendahuluan ... 55 10. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-48
dengan toksikan timbal pada uji akhir ... 56 11. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-72
dengan toksikan timbal pada uji akhir ... 57 12. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-96
dengan toksikan timbal pada uji akhir ... 58 13. Hasil penentuan nilai IC50 96 jam pada uji toksisitas kadmium
pada pertumbuhan C. gracilis menggunakan program ICPIN ... 59 14. Hasil penentuan nilai IC50 96 jam pada uji toksisitas timbal
pada pertumbuhan C. gracilis menggunakan program ICPIN ... 60 15. Hasil penentuan nilai NOEC dan LOEC 96 jam pada uji tosisitas
kadmium pada pertumbuhan C. gracilis menggunakan program
16. Hasil penentuan nilai NOEC dan LOEC 96 jam pada uji toksisitas timbal pada pertumbuhan C. gracilis menggunakan program
TOXSTAT ... 63 17. Diagram alir analisis statistik untuk uji toksisitas kronik pada
1.
PENDAHULUAN
1.1 Latar belakang
Semakin meningkatnya perkembangan industri akan berdampak pada peningkatan jumlah limbah yang dibuang ke lingkungan sekitar termasuk di dalamnya adalah lingkungan perairan laut. Salah satu limbah yang diproduksi adalah limbah logam berat. Kandungan logam berat akan semakin meningkat dengan adanya peningkatan aktivitas industri yang berbahan baku logam berat maupun sebagai bahan tambahan. Apabila limbah yang dihasilkan tidak diolah sebelum dibuang ke laut, hal ini menimbulkan kekhawatiran di kalangan
masyarakat luas karena tingkat toksisitas logam berat yang sangat tinggi terhadap makhluk hidup, terutama ketika terjadi bioakumulasi dalam rantai makanan.
Kadmium dan timbal adalah jenis logam berat yang sering digunakan untuk bahan baku maupun bahan tambahan suatu industri. Kadmium biasanya dimanfaatkan oleh beberapa industri seperti industri peleburan logam, industri petrokimia, industri pelapisan logam, industri PVC dan plastik, dan lain-lain. Timbal banyak dimanfaatkan untuk industri baterai, pigmen, keramik, insektisida, bahan peledak, hasil pembakaran bensin yang mengandung bahan aditif tetraetil dan pembangkit listrik tenaga panas. Pengetahuan mengenai sifat dan
karakteristik serta potensi toksisitas kedua logam berat tersebut terhadap organisme sangat dibutuhkan dalam upaya pencegahan dan penanggulangan pencemaran akibat kegiatan industri .
Kadmium dan timbal diujikan pada satu spesies mikroalga yaitu C. gracilis. Jenis mikrolaga ini dipilih karena spesies ini banyak digunakan untuk
lingkungan perairan laut. Penelitian mengenai toksisitas kadmium terhadap C. gracilis sudah pernah dilakukan (Hindarti, 1997, 2008, Damayati,1998). Uji
toksisitas timbal pada mikroalga telah dilakukan (Rivkin, 1979, Henaldi, 1998, Yap et al., 2004). Perbedaan penelitian ini dengan sebelumnya adalah penggunaan konsentrasi timbal pada biota uji mikroalga yang lebih besar dari 1 mg/l. Dengan uji toksisitas dapat diketahui konsentrasi logam berat tertinggi yang tidak
berpengaruh nyata (No Observed Effect Concentration), konsentrasi logam berat terendah yang berpengaruh nyata (Lowest Observed Effect Concentration),
konsentrasi aman dan debit aman limbah yang diperbolehkan dibuang ke perairan, sehingga data yang diperoleh dapat digunakan sebagai pedoman dalam penetapan baku mutu lingkungan.
Peningkatan konsentrasi kadmium dan timbal dalam tubuh C. gracilis dapat berpengaruh terhadap proses metabolisme dan yang paling nyata adalah gangguan pada kloroplas (Wong et al., in Puspitasari (2000)) yang berakibat pada penghambatan pertumbuhan sel, sehingga keberadaan mikroalga tersebut di lingkungan laut menjadi semakin berkurang. Oleh karena itu diperlukan penelitian dengan menggunakan metoda uji toksisitas untuk mengetahui
1.2 Tujuan
Tujuan dari penelitian ini adalah menduga nilai IC50 (Inhibition
Concentration) selama 96 jam setelah diberikan toksikan berupa kadmium dan
2. TINJAUAN PUSTAKA
2.1. Kadmium
2.1.1 Karakteristik dan Sumber Kadmium
Kadmium (Cd) termasuk golongan II B periode 5 pada daftar unsur-unsur periodik. Unsur ini memiliki nomor atom 48, massa atom relatif 112.40 gram/mol, titik cair 320.9 oC, dan titik didih 767 oC (Shadily, 1980). Kadmium dapat
berbentuk kompleks dengan ion lainnya. Terdapat 4 bentuk utama dari kadmium, yaitu kadmium halida, kadmium sulfida, kadmium oksida, dan kadmium organik. Beberapa kandungan kadmium seperti CdO, CdS, Cd(OH)2, CdCO3, and CdSiO3
yang memiliki kelarutan yang rendah di air, bergantung pada pH (Chongprasith et al., 1999).
Kadmium dapat ditemukan dari berbagai sumber, baik dari alam maupun dari aktivitas manusia. Di alam dapat ditemukan berbagai sumber kadmium, tetapi kebanyakan ditemukan dalam bijih seng, timbal dan tembaga. Sumber lain
kadmium adalah bijih tetrahedrite-tennartile nitrat yang dapat ditemukan pada lapisan atas perairan, yang biasanya dipengaruhi oleh zona fotik dan produktivitas fitoplankton. (Simpson et al., 1981 in Chongprasith et al., 1999). Menurut
Fergusson (1990) in Chongprasith et al. (1999), pada kulit bumi jumlah kadmium berkisar 0.2 ppm yaitu pada batuan beku berkisar <0.001 - 1.6 ppm dan
atmosfer adalah dari percikan laut, kebakaran hutan dan pelepasan partikel logam dari vegetasi darat. Sumber ini sulit untuk dikuantifikasi dengan baik.
Sumber utama kadmium dari aktivitas manusia adalah aktivitas
pertambangan, industri metalurgi dan lumpur limbah. Konsentrasi kadmium pada asap dari peleburan tembaga, timbal, nikel dan seng sulfide relatif tinggi karena logam tersebut mudah menguap (Chongprasith et al., 1999).
2.1.2 Kadmium di Laut
Pada konsentrasi tertentu kadmium memberikan akibat yang buruk pada organisme laut dan kesehatan pada umumnya. Di perairan laut dengan salinitas 10 sampai dengan 35 o/oo, kadmium umumnya dalam bentuk kadmium kompleks
klorida (Chongprasith et al., 1999). Kadmium kloro (CdCl2, CdCl3+ dan CdCl-)
banyak ditemukan pada air laut pada pH 7 sampai 9. Kadmium kloro cenderung stabil karena ikatan yang kuat. Berdasarkan Keputusan Menteri Negara
Lingkungan Hidup No.51 tahun 2004 tentang baku mutu air laut, konsentrasi kadmium yang diinginkan untuk biota laut adalah 0.001 mg Cd/L. Kriteria kualitas air laut wilayah ASEAN untuk perlindungan kesehatan manusia dari dampak buruk akibat mengkonsumsi makanan laut yang tercemar adalah 0.023 mg Cd/L dan untuk aktivitas rekreasi laut adalah 0.0357 mg Cd/L (Chongprasith et al., 1999). Kadmium yang masuk di perairan laut disarankan tidak melebihi
2.1.3 Toksisitas Kadmium Terhadap Organisme Laut
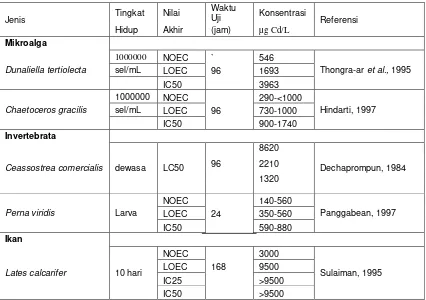
Kadmium ditempatkan pada posisi kedua dari beberapa penelitian toksisitas akut terhadap organisme air. Adapun urutan toksisitasnya adalah Hg2+> Cd2+>Ag+>Ni2+>Pb2+>As2+>Cr2+>Sn2+>Zn2+ (Waldhichuk, 1974 in Hutagalung, 1984 ). Toksisitas kadmium terhadap beberapa jenis organisme laut dapat dilihat dalam Tabel 1.
Tabel 1. Toksisitas kadmium terhadap beberapa jenis organisme laut (Chongprasith et al., 1999)
Jenis Tingkat Nilai
Waktu
Uji Konsentrasi Referensi
Hidup Akhir (jam) µg Cd/L
Ceassostrea comercialis dewasa LC50
8620
Perna viridis Larva
NOEC 140-560
Panggabean, 1997
LOEC 24 350-560
IC50 590-880
Ikan
Lates calcarifer 10 hari
NOEC 3000
2.2.1 Karakteristik dan Sumber Timbal
(Pb3O4) dan Cerrussite (PbCO3). Timbal tidak pernah ditemukan dalam logam
murni (Palar, 2004).
Timbal banyak digunakan dalam industri baterai, pigmen, keramik, insektisida, bahan peledak, hasil pembakaran bensin yang mengandung bahan aditif tetraetil dan pembangkit listrik tenaga panas. Timbal tidak termasuk unsur yang esensial bahkan bersifat toksik untuk makhluk hidup karena dapat
menyebabkan kerusakan hebat pada ginjal, sistem reproduksi, hati, otak dan sistem saraf sentral bahkan kematian (Saeni, 1989 in Dewi et al., 2005).
2.2.2 Timbal di Laut
Logam timbal bersifat kronik dan kumulatif. (Hutagalung dan Hamidah in Dewi et al., 2005). Logam ini dalam bentuk organik lebih toksik daripada
anorganik. Di air laut kandungan timbal normal adalah 0.03 μg/L
(Waldichuk,1974 in Hutagalung, 1984), untuk pengamanan biota laut maka EPA menetapkan kadar maksimal timbal dalam air laut adalah 0.03-50 μg/L. Dalam bentuk garam sederhana timbal adalah racun yang sangat berbahaya bagi biota laut pada konsentrasi diatas 2.5 mg/L (Silalahi, 1999).
Menurut Fredmen et al., (1980) in Rahmawati 1998 menyatakan bahwa di laut timbal memiliki siklus yang singkat, hal ini dikarenakan adanya proses adsorbsi, desorbsi, presipitasi dan proses biologi oleh organisme yang
menyebabkan berkurangnya konsentrasi timbal dalam air laut, sehingga sedimen adalah tempat terakhir bagi timbal yang mengendap di lingkungan laut.
dengan meningkatnya salinitas toksisitas timbal akan berkurang. Berdasarkan Golberg, 1983 in Silalahi 1999 kandungan timbal terlarut di laut hanya 10%.
Menurut Scoullus in Dewi et al., (2005), Pb dapat menjadi sangat larut di dalam air pada beberapa kondisi perairan tertentu, antara lain; pH rendah,
kandungan bahan organik rendah, konsentrasi padatan terlarut serta berbagai macam garam, yakni kalsium, besi, mangan, seng dan kadmium.
2.2.3 Toksisitas Timbal Terhadap Organisme Laut Chaetoceros gracilis
Timbal ditempatkan pada posisi ke lima dari beberapa penelitian toksisitas akut terhadap organisme air. Adapun urutan toksisitasnya adalah
Hg2+>Cd2+>Ag+>Ni2+>Pb2+>As2+>Cr2+>Sn2+>Zn2+.(Waldhichuk,1974 in
Hutagalung, 1984). Toksisitas kadmium terhadap beberapa jenis organisme laut dapat dilihat dalam Tabel 2.
Tabel 2. Toksisitas Timbal terhadap beberapa jenis organisme laut
Jenis Tingkat Nilai
Waktu
Uji Konsentrasi Refrensi
2.3 Mikroalga Sebagai Organisme Uji Toksisitas
Mikroalga merupakan produsen primer di laut. Perubahan yang drastis dalam populasi mikroalga akan berpengaruh terhadap organisme tingkat trofik yang lebih tinggi. Uji toksisitas menggunakan mikroalga berguna untuk
menentukan tokisisitas suatu toksikan terhadap mikrolaga. Dalam uji toksisitas, kultur mikroalga telah diketahui umur dan kepadatannya, dan dipaparkan dalam suatu seri toksikan (Rand and Petrocelli, 1985). Beberapa parameter yang digunakan untuk mengukur respon mikrolaga terhadap toksikan antara lain; kepadatan sel, kandungan klorofil, asimilasi karbon 14 (14C), dan konsentrasi Adenosine Triphosphate (ATP) (Parrish, 1985).
Uji toksisitas dengan menggunakan parameter kepadatan sel merupakan uji yang paling cepat dan mudah dilakukan. Nilai akhir (end point) dari uji ini adalah nilai IC50, NOEC dan LOEC. IC50 adalah nilai konsentrasi toksikan yang
menghambat pertumbuhan mikroalga sebesar 50% dibandingkan dengan kontrol. NOEC merupakan konsentrasi tertinggi dari toksikan yang secara statistik tidak berpengaruh nyata. LOEC adalah konsentrasi terendah dari toksikan yang secara statistik berpengaruh nyata terhadap organisme uji (Rand dan Petrocelli,1985).
Beberapa penelitian telah dilakukan oleh Darmayati (1998) untuk mengetahui pengaruh kadmium terhadap C. gracilis, Tetraselmis sp dan Perna viridis. Hal yang sama dilakukan oleh Hindarti (2008) untuk mengetahui
2.3Chaetoceros gracillis
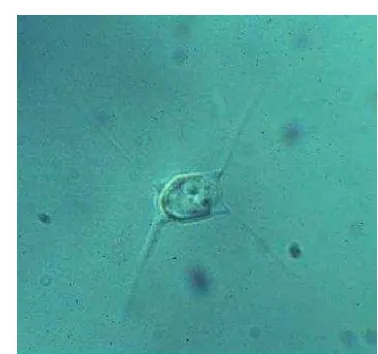
C. gracillis merupakan jenis dari marga Chaetoceros dan termasuk divisi
Bacillariophyta. Bacillariophyta biasa dikenal dengan nama diatom, mikroalga ini mudah dikenali karena selnya dilindungi semacam kapsul gelas dan tidak memilki pergerakan yang jelas. Bagian yang hidup dari diatom tinggal di dalam kotak yang tersusun dari silikon oksida (SiO2). Hidup dari C. gracilis adalah
uniselluler dan memiliki septa.
Urutan taksonomi dari C. gracilis adalah sebagai berikut (Sekolah Ilmu dan Teknologi Hayati, 2009)
Divisi : Bacillariophyta Kelas : Bacillariophyceae Bangsa : Centrales
Suku : Chaetocerotaceae Marga : Chaetoceros Jenis : gracilis
Pertimbangan utama dalam pemilihan biota uji adalah biota yang dipilih harus sensitif terhadap bahan yang digunakan dalam uji, kelimpahan tinggi dalam suatu perairan, distribusi dan ketersediaannya sepanjang tahun, bernilai ekonomis, kemudahan dalam pemeliharaan, dan keadaan fisik secara umum (Hindarti, 1997). Mikroalga termasuk C. gracilis direkomendasikan menjadi biota uji karena
memenuhi kriteria diatas dan memiliki peranan ekologi penting.
Chaetoceros merupakan salah satu genus diatom penting dalam plankton laut, karena Chaetoceros merupakan genus terbesar dalam diatom laut dengan jumlah spesies sekitar 400 (Von-Quillfeldt, 2001) dan berperan sebagai produsen primer serta merupakan makanan penting bagi biota lain, terutama udang
3. METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Februari sampai dengan bulan Mei 2009 di Laboratorium Ekotoksikologi dan Laboratorium Analisis Kimia, Pusat
Penelitian Oseanografi Lembaga Ilmu Pengetahuan Indonesia (P2O-LIPI), Ancol, Jakarta Utara. Penelitian ini adalah bagian dari program penelitian Laboratorium Ekotoksikologi, Pusat Penelitian Oseanografi Lembaga Ilmu Pengetahuan Indonesia (P2O-LIPI), Ancol, Jakarta Utara.
3.2 Alat dan Bahan
3.2.1 Alat Pemeliharaan Kultur C. gracilis, Uji toksisitas dan Pengukuran Konsentrasi Aktual
Alat-alat yang dibutuhkan untuk pemeliharaan kultur C. gracillis, uji toksisitas, dan pengukuran konsentrasi aktual terdiri dari; ruang dengan
pencahayaan terus-menerus sebesar 400 ft-c (foot candle) dan suhu 27 ±10C, alat saring dan kertas millipore 0.45 μm, thermometer, DO (Dissolved Oxygen) meter, refraktometer, pH meter, autoclave, labu erlenmeyer (1 L dan 250 ml), alumunium foil, micropippet dan tip, mikroskop, haemocytometer dan penutup, botol sampel 2 ml, pipet pasteur, botol Nalgen, corong pisah dan AAS (Atomic Absorption Spectrophotometer).
3.2 Bahan Pemeliharaan C. gracilis, Uji Toksisitas dan Pengukuran Konsentrasi Aktual
Laboratorium Kelompok Penelitian Marikultur P2O-LIPI, media Walne (Tabel 3), aseton, asam nitrat 10%, akuades, air laut yang telah disaring dengan membran filter 0.45 μm dan disterilisasi dengan autoclav, larutan induk (stock solution) kadmium (CdCl2) dan timbal (Pb(NO3)2), serta larutan lugol sebagai bahan
pengawet. Bahan-bahan yang dibutuhkan untuk ekstraksi perolehan konsentrasi aktual adalah HNO3 1N, NaOH 1N, APDC (amonium pyrollidine
dithiocarbamate) 2%, MIBK (methyl isobutyl ketone), akuades dan HNO3 pekat.
3.3 Metode Pelaksanaan
3.3.1 Pencucian dan Sterilisasi Peralatan
Pencucian peralatan disesuaikan dengan prosedur ASEAN Canada CPMS-II (1995), sebagai berikut:
1. Peralatan dari bahan dasar kaca maupun plastik dicuci dengan detergen non fosfat/ teepol sampai bersih kemudian dibilas dengan air ledeng. 2. Peralatan dari bahan dasar kaca maupun plastik dicuci dengan HNO3 10%
untuk menghilangkan logam berat yang masih ada, kemudian dibilas dengan akuades 3 kali.
3.3.2 Kultur C. gracilis dan Pemeliharaannya
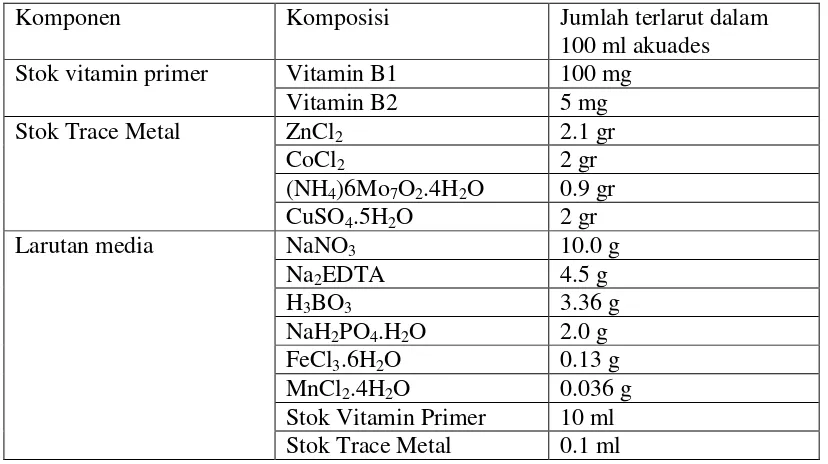
Pemeliharaan kultur C. gracilis dimulai dengan pembuatan media Walne sebagai media kultur. Pembuatan Walne meliputi penambahan trace metal, vitamin dan nutrien ke dalam air laut yang steril. Susunan dari komponen media Walne ditunjukkan pada Tabel 3.
Tabel 3. Komposisi bahan-bahan media Walne bagi pemeliharaan C. gracilis (Asean Canada CPMS-II,1995)
Komponen Komposisi Jumlah terlarut dalam
100 ml akuades
Stok vitamin primer Vitamin B1 100 mg
Vitamin B2 5 mg
Stok Vitamin Primer 10 ml Stok Trace Metal 0.1 ml
Kultur untuk mengamati pertumbuhan C. gracillis dimulai dengan menambahkan 1 ml media Walne + EDTA pada satu liter air laut steril. Kemudian ambil 100 ml air laut yang telah ditambahkan Walne ke dalam gelas Erlenmeyer 250 ml dan tambahkan C. gracillis sebanyak 1 ml. Sebelumnya kepadatan awal C. gracilis dihitung dengan menggunakan haemocytometer di bawah mikroskop. Jumlah sel yang dihitung dengan menggunakan formula sebagai berikut:
Kepadatan =
0.00025 1000 ) 400 /
(x x
... (1)
dimana x merupakan banyaknya jumlah sel yang terhitung (Lampiran 1). Satuan yang digunakan adalah sel per mililiter (sel/ml). Erlenmeyer tersebut kemudian ditutup dengan kapas yang bertujuan untuk menghindari masuknya benda asing ke dalam wadah, setelah itu diaerasi dan diberi label yang
3.3.3 Pembuatan larutan CdCl2 dan Pb (NO3)2
Larutan induk (stock solution) kadmium dibuat dari kadmium klorida monohidrat (CdCl2.H2O), formula pembuatan larutan induk adalah sebagai
berikut:
………..(2)
Berat molekul CdCl2.H2O adalah 201,329 gram/mol dan berat molekul logam
kadmium adalah 112.40 gram/mol serta konsentrasi larutan induk yang diinginkan adalah 1000 mg/L.
Dalam pembuatan larutan induk dengan konsentrasi 1000 mg/L maka 1.7911 g CdCl2.H2O dilarutkan dalam 1 liter akuades. Pembuatan larutan CdCl2 dengan
konsentrasi yang berbeda-beda dalam air laut terdapat pada Lampiran 2 .
Larutan induk (stock solution) timbal dibuat dari Timbal (II) Nitrat (Pb (NO3)2.
Dimana berat molekul Pb (NO3)2 adalah 331.2098 gram/mol dan berat molekul
logam timbal adalah 207.2 gram/mol serta konsentrasi larutan induk yang diinginkan adalah 1000 mg/L.
Dalam pembuatan larutan induk dengan konsentrasi 1000 mg/l, maka 1.589 g (Pb (NO3)2dilarutkan dalam 1 liter akuades. Pembuatan larutan (Pb (NO3)2
3.3.4 Uji mencari kisaran konsentrasi (Range Finder Test)
Sebelum melakukan uji toksisistas perlu dilakukan uji pendahuluan untuk menentukan kisaran konsentrasi timbal (Pb) yang akan diujikan. Uji pendahuluan tidak perlu dilakukan pada kadmium karena kisaran konsentrasi kadmium untuk biota uji C. gracilis mengacu pada penelitian Hindarti, 2008. Uji ini dilakukan karena informasi atau literatur tentang toksisitas timbal terhadap pertumbuhan C. gracilis belum ditemukan. Uji dilakukan selama 96 jam dengan menggunakan
urutan konsentrasi, yaitu kontrol, 0.01, 0.1, 1, 10, dan 100 mg/l dengan tiga kali ulangan untuk tiap konsentrasi. Nilai IC50 didapatkan berdasarkan analisis
statistik dengan menggunakan prinsip interpolasi linier. Nilai ini digunakan sebagai dasar untuk menentukan kisaran konsentrasi timbal dalam uji definitif dengan satuan yang digunakan adalah mg/l.
3.3.5 Uji Toksisitas Kadmium dan Timbal terhadap Perkembangan Jumlah sel C. gracilis
Berdasarkan penelitian sebelumnya (Hindarti, 2008) diperoleh seri
konsentrasi kadmium definitive test yang dilakukan selama 96 jam, yaitu kontrol, 0.56, 1, 1.8 , 3.2, dan 5.6 mgCd/L dengan tiga kali ulangan untuk tiap konsentrasi. Berdasarkan nilai IC50 yang diperoleh dari uji pendahuluan, maka konsentrasi
Larutan uji yang telah dibuat dimasukkan ke dalam Erlenmeyer 250 ml sebanyak 100 ml. Pembuatan larutan uji dimulai dari kontrol, konsentrasi larutan terendah sampai dengan konsentrasi tertinggi. Setelah itu ditambahkan C. gracilis yang telah berumur 4 hari sebanyak 1 ml dengan kepadatan 1x106 sel/ml
(Lampiran 4). Hal ini dilakukan agar dalam 100 ml larutan uji terdapat 104 sel C. gracilis per mililiter. Kemudian seluruh Erlenmeyer ditutup dengan alumunium
foil agar terhindar dari kontaminasi.
Seluruh Erlenmeyer diletakkan pada ruang yang bersuhu 27±10C dengan pencahayaaan terus menerus sebesar 400 foot candle. Setiap hari Erlenmeyer diaduk dua kali agar larutan di dalamnya menjadi homogen dan posisinya diacak agar mendapat pencahayaan yang merata. Kepadatan kultur diamati secara teratur dengan menghitung jumlah sel pada jam ke-48, 72, dan 96. Perhitungan
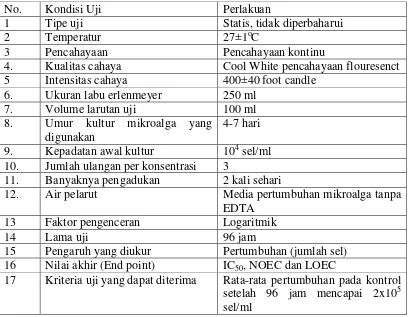
Tabel 4. Kondisi yang direkomendasikan Asean-Canada CPMS II(1995) untuk uji toksisitas pertumbuhan mikroalga.
No. Kondisi Uji Perlakuan
1 Tipe uji Statis, tidak diperbaharui
2 Temperatur 27±1oC
3 Pencahayaan Pencahayaan kontinu
4. Kualitas cahaya Cool White pencahayaan flouresenct
5 Intensitas cahaya 400±40 foot candle
6. Ukuran labu erlenmeyer 250 ml 10. Jumlah ulangan per konsentrasi 3
11. Banyaknya pengadukan 2 kali sehari
12. Air pelarut Media pertumbuhan mikroalga tanpa
EDTA
13 Faktor pengenceran Logaritmik
14 Lama uji 96 jam
15 Pengaruh yang diukur Pertumbuhan (jumlah sel) 16 Nilai akhir (End point) IC50, NOEC dan LOEC
17 Kriteria uji yang dapat diterima Rata-rata pertumbuhan pada kontrol setelah 96 jam mencapai 2x105 sel/ml
3.3.6. Pengukuran kualitas air
3.3.7 PengukuranKonsentrasi Aktual Larutan Uji
Pengukuran konsentrasi aktual dibagi menjadi 3 tahap yaitu, pengenceran larutan, ekstraksi, dan pengukuran konsentrasi aktual dengan AAS. Prosedur Ekstraksi larutan berdasarkan Standard Method (1992) dan Margusson danWesterland (1981) adalah sebagai berikut:
1. Pada konsentrasi kadmium 0.56 Cd mg/l dan 1 Cd mg/l serta seluruh konsentrasi timbal diencerkan 10 kali dalam 250 ml, sedangkan
pengenceran konsentrasi kadmium 1.8, 3.2, dan 5.6 mg/l dilakukan 100 kali dalam 250 ml.
2. pH larutan diatur sesuai dengan range optimum ekstraksi, yaitu kadmium sampai dengan pH 3 dan timbal sampai dengan pH 2.3 ± 0.2, dengan penambahan NaOH 1N atau HNO3 1N
3. Setelah itu dituangkan ke corong pisah dan dilakukan penambahan APDC 2% sebanyak 5 ml serta dikocok ± 1 menit, kemudian ditambahkan 25 ml MIBK dan kocok ± 1 menit. Setelah itu biarkan sampai fase organik dan anorganik terpisah
4. Setelah terpisah fase organik diambil, dibilas dengan air suling 10 ml dan dibiarkan ± 5 menit sampai fase organik dan an organik terpisah kembali 5. Kemudia fase organik diambil dan ditambahkan 0.25 ml HNO3 pekat lalu
1. Penyetingan alat yaitu dengan menyesuaikan panjang gelombangnya dan slit width.
2. Pengukuran absorbansi blanko, larutan standart, dan reagent
3. Jika hasil yang diperoleh memiliki koefisisen determinasi 99% maka larutan standart itu dapat digunakan sebagai acuan untuk menghitung konsentrasi aktual
4. Pengukuran konsentrasi aktual yang diurutkan dari konsentrasi rendah ke konsentrasi yang tinggi.
3.3.8 Analisis Data
Hasil eksperimen yang didapat selama observasi dianalisis dengan cara sebagai berikut. Persentase penghambatan (Inhibition) atau perangsangan (Stimulation) perkembangan jumlah sel jika dibandingkan dengan kontrol dihitung dengan rumus:
Untuk menganalisis data yang diperoleh digunakan dua macam program yaitu TOXSTAT untuk menganalisis NOEC dan LOEC dan ICPIN (Inhibition Concentration Program) untuk menghitung IC50.
Dalam menghitung nilai IC50 menggunakan metode interpolasi linier
dengan persamaan matematis sebagai berikut:
)
Cj : Konsentrasi dimana rata-rata respon yang diamatai lebih besar daripada Mi(1-p/100)
Cj+1 : Konsentrasi dimana rata-rata respon yang diamatai lebih kecil daripada Mi(1-p/100)
Mi : Rata-rata respon kontrol Mj : Rata-rata respon konsentrasi j Mj+1 : Rata-rata respon konsentrasi j+1
p : persentase penghambatan respon perlakuan terhadap respon kontrol
ICp : Konsentrasi dimana pertumbuhan terhambat sebesar p% dibanding dengan rata-rata respon kontrol
Untuk menggunakan program TOXSTAT maka data harus diubah dalam bentuk log10, kemudian sebelum menganalisis NOEC dan LOEC data harus diuji
normalitasnya dengan menggunakan uji Shapirowilks dan keseragaman dengan menggunakan uji Bartlet’s. Jika uji tersebut telah dilakukan dan data menyebar
ij
ij i
Y ...(6) dimana:
Yij : Jumlah sel C. gracillis akibat perlakuan logam berat kadmium atau timbal
μ : rataan umum
τi : Pengaruh kadmium atau timbal ke-i
εij : galat akibat pengaruh perlakuan kadmium atau timbal ke-i dan ulangan
ke-j
4. HASIL DAN PEMBAHASAN
4.1 Pola Pertumbuhan C. gracilis
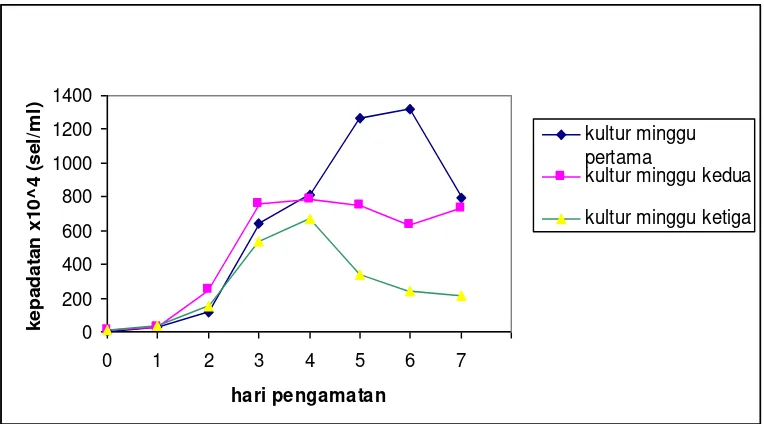
Berdasarkan hasil pengamatan, kepadatan kultur C. gracilis sebagai bagian dari persiapan uji toksisitas selama 7 hari diperoleh kurva pertumbuhan yang disajikan pada Gambar 2.
Pola Pertumbuhan C.gracillis
Gambar 2. Kurva pertumbuhan kultur C. gracilis selama 7 hari
Menurut kurva pertumbuhan sel diatas, adaptasi kultur terjadi sampai hari ke-1. Pada hari ke-1 sampai hari ke-2 terjadi percepatan pertumbuhan, sedangkan pada permulaan hari ke-2 sampai hari ke-3 terjadi fase eksponensial, hari ke-3 sampai dengan hari ke-4 terjadi pengurangan laju pertumbuhan, hari ke-4 sampai hari ke-5 hampir tidak ada penambahan populasi (stationary phase) dan terjadi penurunan sel pada awal hari ke-5 menuju hari ke-7 (Lampiran 5).
yaitu pada hari 3 sampai 4 dan dapat diketahui pola pertumbuhannya yaitu cenderung logaritmik sehingga memudahkan saat menganalisis data untuk perolehan nilai NOEC dan LOEC. Kultur ini dilakukan selama 3 kali. Hal ini untuk memastikan bahwa pada saat hari ke-4 C. gracilis telah mencapai kepadatan 106 sel/ml sehingga memenuhi kriteria sebagai biota uji menurut Asean Canada CPMS-II,1995.
4.2 Parameter Kualitas Air
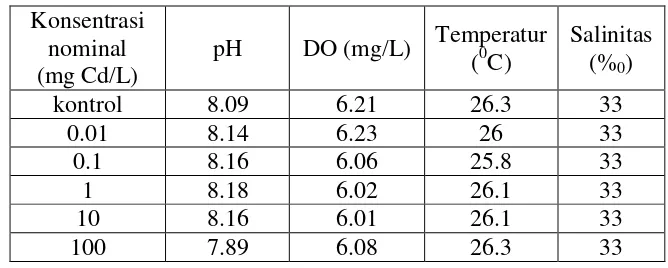
Kualitas air uji memiliki peranan yang penting dalam menentukan kelayakan habitat bagi biota uji. Beberapa parameter yang digunakan dalam penentuan kualitas air uji adalah suhu, salinitas, pH, dan oksigen terlarut. Hasil pengukuran kualitas air disajikan pada Tabel 5 dan 6.
Tabel 5. Hasil pengukuran kualitas air pada uji toksisitas kadmium pada mikroalga C. gracilis.
Konsentrasi
4.2.1 Suhu
Pada pengukuran kualitas air uji dengan toksikan kadmium dan timbal diperoleh suhu berkisar antara 24.1-24.2 oC. Nilai suhu air pada setiap
konsentrasi kadmium dan timbal cenderung sama karena penelitian ini dilakukan di laboratorium sehingga perbedaan suhu dapat dikontrol. Kualitas air uji masih mendukung penelitian ini karena C. gracilis tumbuh optimal pada suhu 12-25oC (Bissinger et al., 2008).
4.2.2 Derajat Keasamaan (pH)
Derajat keasaman (pH) kualitas air uji pada masing-masing perlakuan kadmium dan timbal berkisar antara 8.13-8.18, sehingga kondisi ini merupakan kondisi yang layak untuk media pertumbuhan. pH untuk masing-masing perlakuan memiliki perbedaan yang relatif kecil karena dengan pemberian toksikan tidak secara langsung memberikan pengaruh terhadap perubahan pH pada media air uji dan C. gracilis dapat mentoleransi pH tersebut. Hal inilah yang akan memudahkan uji analisis berikutnya, dimana faktor yang benar-benar ingin dilihat adalah konsentrasi logam berat dan parameter kualitas air
diasumsikan sama.
Newel dan Newel (1977) in Darmayati et al., (1998) menyatakan bahwa diatom sangat dipengaruhi oleh pH air laut, akan tetapi pH dengan rentang 7.8-8.8 bukanlah suatu faktor pembatas untuk pertumbuhan diatom.
4.2.3 Salinitas
salinitas akan konstan selama uji berlangsung karena dengan penurunan nilai salinitas akan meningkatkan toksisitas logam. Lioa et all in Yuniananda 1996 mengemukakan bahwa salinitas minimum untuk pertumbuhan Chaetoceros sp adalah 6 %0 , tetapi jenis diatom ini juga dapat tumbuh pada salinitas 50 %0.
4.2.4 Oksigen Terlarut
Hasil pengukuran oksigen terlarut pada media air uji untuk masing-masing perlakuan kadmium dan timbal berkisar antara 6.21-6.37 mg/l. Kondisi ini
memungkinkan media air dijadikan media uji, karena menurut Keputusan Mentri Negara Lingkungan Hidup No.51 tahun 2004 tentang baku mutu air laut, oksigen terlarut yang diinginkan untuk biota laut lebih besar dari 5 mg/l. Nilai oksigen terlarut pada suatu media akan berpengaruh terhadap tingkat toksisitasnya.
4.3 Uji Pendahuluan (Range Finder Test)
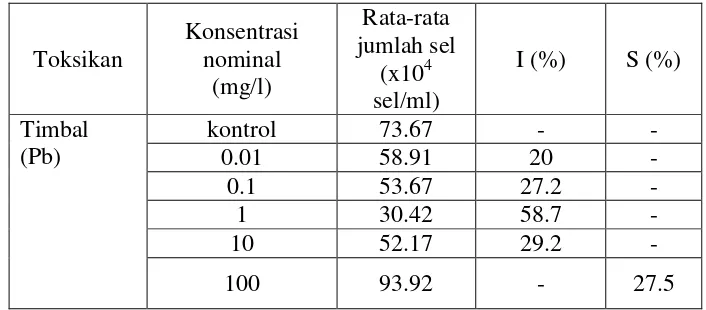
Uji ini dilakukan untuk mendapatkan kisaran konsentrasi akhir dari logam berat timbale yang akan digunakan untu uji definitive. Pada saat yang sama dilakukan pengukuran kualitas air uji. Tabel 7 menyajikan pengukuran kualitas air uji pendahuluan toksikan timbal pada C. gracilis dan Tabel 8 menyajikan hasil uji pendahuluan
Tabel 8. Persentase penghambatan kepadatan C. gracilis terhadap timbal pada uji
I (%) = persentase penghambatan (inhibition) S (%) = Persentase rangsangan (stimulation)
Tabel 7 menunjukkan bahwa parameter kualitas air tidak memiliki pengaruh terhadap pertumbuhan sel C. gracilis karena tiap – tiap parameter memiliki nilai yang hampir sama walaupun dikondisikan memiliki konsentrasi timbal yang berbeda-beda dan data kualitas air ini menunjukkan bahwa C. gracilis berada pada kondisi optimum untuk pertumbuhannya.
Berdasarkan analisis statistik menggunakan sistem interpolasi linier yang terdapat pada program ICPN, diperoleh nilai IC50 untuk timbal pada uji
pendahuluan adalah 0.7 mg/l. Dengan demikian konsentrasi timbal yang digunakan untuk uji akhir (definitive test) adalah 0.32, 0.56, 1, 1.8 dan 3.2 ppm dan konsentrasi kadmium yang dipakai adalah 0.56, 1, 1.8, 3.2 dan 5.6 ppm. Urutan kisaran konsentrasi dalam uji definitif mengacu pada deret logaritmik.
0
kontrol 0.01 0.1 1 10 100
konsentrasi Pb mg/l
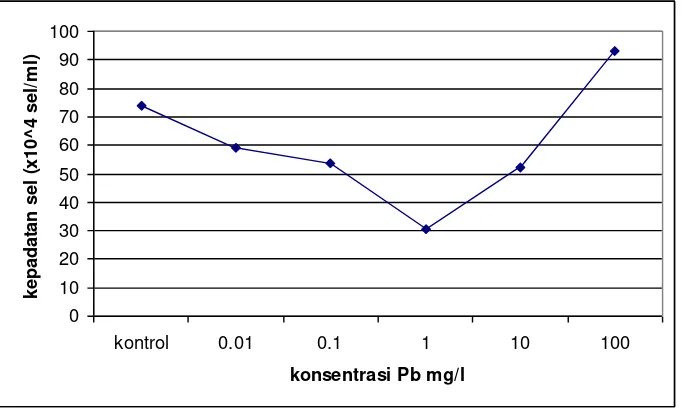
Gambar 3. Grafik kepadatan sel C. gracilis dengan berbagai konsentrasi timbal jam ke-96 pada uji toksisitas pendahuluan
Gambar 3 menunjukkan bahwa kepadatan sel terendah terdapat pada konsentrasi timbal 1 mg/l. Kepadatan sel tertinggi terdapat pada konsentrasi timbal 100 mg/l, berdasarkan data Tabel 8 berarti kepadatan sel pada konsentrasi 100 mg/l lebih tinggi daripada kepadatan sel kontrol, dengan kata lain pada konsentrasi 100 mg/l C. gracilis mengalami rangsangan untuk melakukan pertumbuhan. Berdasarkan Gambar 3 semakin tinggi konsentrasi timbal yang diberikan belum tentu akan menurunkan kepadatan sel C. gracilis. Hal ini di sebabkan oleh kemampuan timbal yang mudah mengendap diperairan laut, seperti reaksi kimia berikut:
Pb(NO3)2 + 2NaHCO3 Pb(CO3) s + 2NaNO3+ CO2+H2O
(Moody,1991)
dalam air. Mengendapnya timbal (II) karbonat berarti mengurangi tingkat
toksisistas dalam kolom air, dengan kata lain konsentrasi timbal 10 mg/l dan 100 mg/l dimungkinkan memiliki kandungan timbal terlarut yang jauh lebih kecil dari konsentrasi nominalnya, sedangkan sodium nitrat sebagai nutrient bagi mikroalga tidak mengendap. Sehingga pertumbuhan dari C. gracilis akan terjadi
perangsangan karena turunnya toksisitas dan bertambahnya nutrien yang dibutuhkan.
Dibawah ini merupakan komposisi kandungan timbal dan nitrat dalam Senyawa Pb(NO3)2:
Tabel 9. Kandungan timbal dan nitrat dalam senyawa Pb(NO3)2 dalam berbagai
konsentrasi Konsentrasi nominal timbal (mg/l)
Kandungan timbal (mg) Kandungan nitrat (mg)
0.01 0.016 0.027
0.1 0.16 0.267
1 1.6 2.67
10 15.99 26.7
100 159.85 267
4.4 Uji Definitif
4.4.1 Konsentrasi Aktual
Konsentrasi aktual diukur dengan menggunakan AAS (Atomic Absorption Spectrophotometer). Larutan yang ingin diukur diekstrak terlebih dahulu. Larutan yang telah dibuat bisa digunakan jika nilai koefisien determinasi larutan standart mencapai 99%. Berdasarkan hasil yang diperoleh, nilai konsentrasi aktual kadmium mendekati nilai nominalnya, sedangkan nilai konsentrasi aktual timbal memiliki simpangan yang agak jauh dari nilai nominalnya. Hal ini disebabkan kemampuan timbal yang mudah mengendap di larutan yang basa. Walaupun pada saat preservasi larutan telah diawetkan dengan HNO3 pekat.
Tabel 10. Hasil pengukuran konsentrasi nominal dan aktual Toksikan Konsentrasi nominal
(mg/l)
Konsentrasi aktual (mg/l)
Kadmium (Cd) kontrol 0
0.56 0.56
1 0.92
1.8 1.7
3.2 3.2
5.6 4.9
Timbal (Pb) kontrol 0
0.32 0.26
0.56 0.45
1 0.71
1.8 1.79
4.4.2 Toksisitas Kadmium dan Timbal terhadap Pertumbuhan Sel C. gracilis
Data parameter kualitas air pada penelitian ini menunjukkan bahwa larutan uji berada dalam kondisi optimum untuk pertumbuhan mikroalga. Menurut hasil perhitungan, kepadatan sel setelah 96 jam pada larutan kontrol kadmium adalah 9.74x105 sel/ml dan larutan kontrol timbal adalah 9.42x105 sel/ml. Hal ini berarti uji ini valid untuk melakukan uji akhir (definitive test) sesuai dengan kriteria yang ditetapkan oleh ASEAN-Canada CPMS-II (1995) untuk uji toksisitas pada
mikrolaga.
Respon yang dihasilkan pada penelitian ini adalah berupa perkembangan jumlah sel C. gracilis selama 96 jam dengan konsentrasi kadmium dan timbal yang berbeda-beda. Hasil pengukuran perkembangan jumlah sel terhadap kadmium selama 96 jam terdapat pada Gambar 4 dan terhadap timbal selama 96 jam terdapat pada Gambar 5.
0
kontrol 0.56 0.92 1.7 3.2 4.9
konsentrasi CdCl2 (mg/l)
0
kontrol 0.26 0.45 0.71 1.79 2.74
konsentrasi Pb(NO3)2 mg/l
Perkembangan jumlah sel dimulai pada jam ke-0 dengan kepadatan sel seluruh konsentrasi sebesar 104 sel/ml. Setelah dilakukan pengamatan pada jam ke-48, 72 dan 96 terjadi penurunan jumlah sel pada tiap-tiap perlakuan kadmium dibandingkan dengan kontrol. Berdasarkan data yang diperoleh ditunjukkan bahwa semakin tinggi konsentrasi kadmium maka pertumbuhan sel C. gracilis menurun, hal ini ditunjukkan pada penurunan jumlah sel C . gracilis. Jadi, dengan adanya toksikan kadmium akan menghambat pertumbuhan C. gracilis. Nilai persentase penghambatan pertumbuhan C. gracilis selama uji toksisitas kronik kadmium pada jam ke-48, 72 dan 96 dapat dilihat dalam Lampiran 6, 7 dan 8.
Berbeda halnya dengan C. gracilis yang diberi perlakuan berupa timbal. Setelah dilakukan pengamatan pada jam ke- 48, dan 72 terjadi penurunan jumlah sel C. gracilis sampai dengan konsentrasi 0.45 mg/l. Akan tetapi untuk
konsentrasi yang lebih besar mengalami peningkatan jumlah sel secara bertahap, begitu halnya pada pengamatan jam ke-96 terjadi penurunan jumlah sel C.
gracilis sampai dengan konsentrasi 0.71 mg/l, akan tetapi jumlah sel kembali
meningkat pada saat konsentrasinya lebih besar dari 0.71 mg/l. Berdasarkan deskripsi Gambar 4 dan 5, kedua logam berat yang digunakan pada penelitian ini yaitu kadmium mampu menurunkan jumlah sel C. gracilis dibandingkan dengan kontrol.
Respon alga selama periode perlakuan logam berat secara umum berhubungan dengan penurunan jumlah sel (Foster in Yuniananda, 1996). Ini berarti bahwa terdapat hubungan negatif dimana meningkatnya konsentrasi yang diberikan pada medium akan meningkatkan penurunan jumlah sel mikroalga.
Penelitian uji toksisitas kadmium terhadap mikrolga telah banyak
dilakukan Hindarti et al. (2008); Yap et al. (2004) ; Darmayati et al. (1998) dan seluruhnya memiliki respon yang sama yaitu semakin tinggi konsentrasi yang diberikan maka jumlah sel mikroalga akan turun. Karena hasilnya konsisten maka kadmium digunakan sebagai referensi toksikan. Pada penelitian kali ini hasilnya cenderung sama dengan penelitian sebelumnya.
Hal ini dapat terjadi karena beberapa faktor; pertama timbal memiliki sifat mudah mengendap dalam air laut sehingga kandungan timbal di kolom perairan jauh lebih sedikit dibandingkan di dasar perairan. Hal ini telah disimulasikan dan terbukti pada pengamatan visual bahwa konsentrasi timbal 10 ppm mengendap lebih sedikit daripada 100 ppm, sehingga pemberian timbal pada konsentrasi tinggi pada pertumbuhan C. gracilis cenderung tidak efektif untuk uji toksisitas. Mungkin dengan alasan seperti itulah dua penelitian sebelumnya hanya
menggunakan konsentrasi timbal maksimal adalah 1 mg/l. Akan tetapi pada penelitian Yap et al. (2004) digunakan konsentrasi sampai dengan 2.5 mg/l dengan hasil semakin tinggi konsentrasi semakin rendah kepadatan sel Isochrysis sp dengan frekuensi pengadukan yang tidak dipaparkan.
Faktor kedua adalah adanya phytochelatin pada mikroalga yang berfungsi sebagai detoksifikan logam berat. Bajguz (2004) menyatakan bahwa kandungan Phytochelatin maksimal dalam tubuh Chlorella vulgaris semakin meningkat dengan bertambahnya konsentrasi timbal yag diberikan. Oleh karena itu, hal inilah yang menyebabkan kepadatan sel semakin bertambah setelah konsentrasi 0.71 mg/l.
Secara umum respon biota uji terhadap pemberian toksikan adalah negatif, maksudnya pemberian toksikan akan menyebabkan berkurangnya jumlah sel dibandingkan dengan kontrol. Presentase inhibition (penghambatan) dan stimulation (perangsangan) dari pertumbuhan C. gracilis pada jam ke-96 akibat
Tabel 11. Persentase penghambatan pertumbuhan sel C. gracilis akibat pengaruh kadmium dan timbal pada jam ke-96
Toksikan
I (%) = persentase penghambatan (inhibition) S (%) = Persentase rangsangan (stimulation)
Berdasarkan Tabel 11, pemberian toksikan yang berupa kadmium akan meningkatkan penghambatan sel C. gracilis dengan semakin tingginya
konsentrasi kadmiun yang diberikan. Berbeda halnya dengan pemberian toksikan yang berupa timbal, dimana peningkatan penghambatan sel C. gracilis sampai dengan konsentrasi timbal sebesar 0.71 mg/l, sedangkan pada saat konsentrasi timbal 1.71 mg/l dan 2.74 mg/l penghambatannya semakin berkurang. Dari data penghambatan pertumbuhan sel C. gracilis kemudian dapat diduga nilai IC50,
LOEC dan NOEC.
Nilai IC50 merupakan konsentrasi toksikan yang secara nyata mampu
pertumbuhan C. gracilis. Pada Tabel 12 disajikan nilai IC50, NOEC, dan LOEC
pada masing-masing toksikan.
Tabel 12. Nilai IC50, NOEC dan LOEC pada uji toksisitas kadmium dan timbal
pada C. gracilis
Toksikan IC50 NOEC LOEC
Kadmium (Cd) (mg/l) 1.3 < 0.56 0.56
Timbal (Pb) (mg/l) 0.7 < 0.26 0.26
Metode pencarian IC50 berdasarkan metode interpolasi linier dan pada
penelitian ini digunakan program ICPIN. Nilai IC50-96 jam dari toksikan
kadmium dan timbal bagi C. gracllis adalah 1.3 mg Cd/l dan 0.7 mg Pb/l. Ini berarti bahwa pada konsentrasi kadmium 1.3 mg/l dan timbal 0.7 mg/l mampu menghambat pertumbuhan sel C. gracilis sebesar 50%. Perhitungan nilai IC50-96
jam terdapat dalam Lampiran 13 dan 14.
Nilai LOEC dan NOEC dihitung dengan software TOXSTAT, dimana sebelumnya digunakan analisis ragam dengan Rancangan Acak Lengkap, yang masing-masing datanya telah diubah menjadi bentuk logaritmik basis 10. Hal ini dilakukan karena biota uji yang dipakai adalah fitoplankton yang memiliki pola pertumbuhan logaritmik. Berdasarkan data yang diperoleh, baik timbal maupun kadmium masing-masing memiliki pengaruh yang nyata terhadap pertumbuhan sel C. gracilis. Ini ditunjukkan dengan nilai F hitung yang lebih besar dari pada F tabel. Karena perlakuan memberikan pengaruh yang berbeda nyata terhadap respon
mg/l untuk kadmium dan kurang dari 0.26 mg/l untuk timbal. Ini berarti bahwa nilai NOEC terletak antara nilai LOEC dan kontrol untuk masing-masing
perlakuan. Perhitungan LOEC dan NOEC dapat dilihat pada Lampiran 15 dan 16. Nilai IC50 kadmium yang dihitung adalah 1.3 mg/l, hal ini memiliki
kecenderungan nilai yang mirip dengan hasil penelitian Yuniananda (1996) yaitu 0.89 mg Cd/l dan Hindarti et al. (2008) yaitu 1.8mg Cd/l. Berbeda halnya dengan nilai IC50 timbal yang berbeda-beda dari beberapa penelitian yang telah
dilakukan dengan spesies mikroalga yang berbeda-beda. Nilai IC50 timbal pada
penelitian ini adalah 0.7 mg/l. Nilai IC50 ini diperoleh tanpa mengikutsertakan
data pada konsentrasi 1.79 mg/l dan 2.74 mg/l, jika diikutkan maka nilai dugaan IC50 akan terlalu tinggi atau terlalu rendah dan dua penelitian sebelumnya
konsentrasi yang dipakai hanya sampai 1 mg/l.
Kedua logam berat ini mampu menghambat kepadatan sel karena adanya pemanfaatan ion logam berat oleh organisme dalam sistem kultur yang terjadi dalam dua tahap, yaitu sistem pasif dan sistem aktif (Ting et al., 1989).
penegangan dinding sel dan pengaruh yang paling nyata adalah gangguan pada kloroplas (Wong et al (1995) in Puspitasari (2000)
Kadmium dan timbal yang berlebih akan berpengaruh terhadap kloroplas, hal ini akan terjadi pada struktur dan proses metabolisme di dalamnya. Dimana akan menyebabkan degradasi membran tilakoid, dimana tilakoid adalah satu bagian dari kloroplas yang menerima cahaya matahari (Gambar 6).
Gambar 6. Organel yang terdapat di kloroplas (www.mcdaniel.edu)
Degradasi membran tilakoid akan menyebabkan terhambatnya reaksi kimia fotosintesis juga dapat menggangu biomassa klorofil sel tersebut. Terganggunya reaksi kimia fotosintesis dan rendahnya kandungan klorofil inilah yang
menyebabkan adanya hambatan terbentuknya ATP dan NADPH sebagai output fotosintesis. Terhambatnya pembentukan ATP dan NADPH berarti akan menghambat aktivitas dari mikroalga, seperti respirasi, metabolisme sel dan reproduksi sel. Jika energi yang ada tidak mampu menyokong untuk kebutuhan dasar makhluk hidup maka organisme tersebut akan mati. Hal inilah yang
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penelitian uji toksisitas kadmium dan timbal pada pertumbuhan C. gracilis menunjukkan bahwa respon yang diberikan oleh C. gracilis merupakan
respon akibat perlakuan yang diberikan bukan dari pengaruh parameter kualitas air.
Nilai IC50-96 jam logam berat kadmium terhadap perkembangan jumlah
sel C. gracilis adalah 1.3 mg Cd/l dan nilai IC50-96 jam logam berat timbal
terhadap perkembangan jumlah sel C. gracilis adalah 0.7 mg Pb/l.
Nilai LOEC 96 jam logam berat kadmium terhadap perkembangan jumlah sel C. gracilis adalah 0.56 mg Cd/l dan nilai LOEC 96 jam logam berat timbal terhadap perkembangan jumlah sel C. gracilis adalah 0.26 mg Pb/l. Nilai NOEC untuk kadmium lebih kecil dari 0.56 mg/l dan untuk timbal lebih kecil dari 0.26 mg/l. Berdasarkan data IC50, NOEC dan LOEC logam berat timbal lebih toksik daripada cadmium pada biota uji C. gracilis.
5.2 Saran
DAFTAR PUSTAKA
ASEAN-Canada CPMS II. 1995. Protocol for Sublethal Toxicity Test Using Tropical Marine Organism. Regional Workshop on Chronic Toxicity Testing, Burapha University, Institute of Marine Science. Hal 10-19 Bajguza, A. dan B. G. Zylkiewicz. 2004. Protective Role of 20-Hydroxyecdysone
Against Lead Stress in Chlorella vulgaris Cultures. Phytochemistry 65: 713
Bissinger, J. E., J. S. Davis, dan D. Atkitson. Predicting Marine Phytoplankton Maximum Growth Rates From Temperature: Improving On The Eppley Curve Using Quantile Regression. Limnol. Oceanogr. 53(2):487–493 Chongprasith, P., W. Utomprurkporn dan C. Rattikhansuka. 1999. ASEAN
Marine Water Quality Criteria For Cadmium. ASEAN-Canada CPMS-II AMWQC for Cadmium. Marine Environment Division, Water Quality Management Bureau, Pollution Control Department. Bangkok. Hal VII-1 sampai VII-64
Darmayati, Y., D. Hindarti, M. G. L. Panggabean, dan Sulistijo. 1998. Toxicity of PT. Asahimas as Effluent on Phytoplankton Growth and Green Mussel (Perna Viridis) Embrio Development, h 106-108. Proceedings Of The Fourth ASEAN-Canada Technical Conference on Marine Science, 26-30 Oktober 1998. EVS Environment Consultants Ltd and Departement of Fisheries Malaysia, Langkawi, Malaysia.
Darmono.1995. Logam dalam Sistem Biologi Makhluk Hidup. Jakarta. Unirvesitas Indonesia. Hal 1-45.
Dewi, A. B. N., D. Setiadi, dan M. S. Saeni. 2005. Pencemaran Logam Berat Timbal Pada Udang Putih dan Cumi-cumi Di Perairan Teluk Jakarta. Analisis Lingkungan 2(2): 226-227
Environmental Protection Agency (EPA). 1991. Methods of Measuring The Acute Toxicity of Enffluents to Freshwater and Marine Organism 4th Edition. Ed C.L Weber. Environmental Monitoring and Support Laboratory. US EPA. Cincinati. Ohio. EPA/600/4//027. h 21-496.
Henaldi. 1998. Toksisitas Kronik Kadmium (Cd) dan Timbal (Pb) Terhadap Pertumbuhan Tetraselmis sp.[Skripsi]. FPIK-IPB. Bogor.
Hindarti, D., Z. Arifin, R. Puspitasari, dan E. Rochyatun. 2008. Sediment Contaminant and Toxicity in Kelabat Bay, Bangka Belitung Province. Marine Research Indonesia. 33 (2): 203-211.
Hutagalung H. P. 1984. Logam Berat dalam Lingkungan Laut. Oseana. IX(1) : 12-14
Menteri Negara Lingkungan Hidup Republik Indonesia. 2004. Keputusan Menteri Negara Lingkungan Hidup No.51 tahun 2004 tentang Baku Mutu air Laut untuk Biota Laut. Menteri Negara Lingkungan Hidup.
Moody, B. 1991. Comparative Inorganic Chemistry Third Edition. Chapman and Hall,Inc. New York. Hal 83-85
Palar H. 2004. Pencemaran dan Toksikologi Logam Berat. Rineka Cipta : Jakarta Parish, P. R. Acute Toxicity Test. In: Rand, and S. R. Petrocelli. 1985.
Fundamental of Aquatic Toxicology. Hemisphere Publishing Co. Hal 44-54
Puspasari, R. 2000. Peran Fitoplankton Dalam Mengurangi Kandungan Logam Berat Pb Dalam Air Laut. [Tesis]. FPIK-IPB. Bogor.
Panggabean, L. M. G. 1997. Toxicity of Hexavalent Chromium and Cadmium to Green Mussel (Perna Viridis) Embryos. EVS Environment Consultants, NorthVancouver and Departement of Fisheries Malaysia. Kuala Lumpur. Von-Quillfeltdt, C. H. 2001. Identification of Some Easily Confused Common
Diatom Species in Arctic Spring Blooms. Botanica Marina Vol. 44. dalam http://en.wikipedia.org/wiki/Chaetoceros [20 April 2009] Rand, G. M dan , S. R. Petrocelli. 1985. Fundamental of Aquatic Toxicology.
Hemisphere Publishing Co. Hal 1-25.
Rahmawati, F. B. 1998. Uji Toksisitas Kadmium (Cd) dan Timbal (Pb) terhadap fertilisasi telur Bulu Babi. [Skripsi]. FPIK-IPB. Bogor.
Rivkin, B. 1979. Effect of Lead on Growth of The Marine Diatom Skeletonema Costatum. Marine Biology 50: 242-241.
Sekolah Tinggi Ilmu Sumber Daya Hayati. 2009. Klasifikasi Tumbuhan
Chaetoceros gracilis. Dalam www.bi.itb.ac.id/herbarium?index.php [16 Februari 2009]
Silalahi, M. D. S. 1999. Penyisihan Pb dalam air Limbah Dengan Teknik Pertukaran Ion, Studi Kasus Air Limbah Pabrik Aki P.T G.S
Batteray,Inc, Sunter, Jakarta Utara. [Tesis]. Jakarta. Ilmu Lingkungan-UI.
Standard Methods. 1992. Extraction or Air-Acetyllene Flame Method APHAA 3111 C. California.
Margunson, B dan S. Westerlund. 1981.Solvent Extraction Procedure Combine with Back Extraction for Trace Metals Determinations by Atomic Absorption Spectrophotometry.
Ting Y. P., F. Lawson, dan I. G. Prince.1990. The Uptake of Heavy Metals Ions By Algae. Australian Jurnal of Biotechnology. 4(3):197-200.
Yap C. K., A. Ismail, H. Omar, dan S. G. Tan. 2004. Toxicities and Tolerances of Cd, Cu, Pb and Zn in a primary producer (Isochrysis galbana) and in a primary consumer (Perna viridis). Environmental International 29: 1100–1101.
Yuniananda, D. 1996. Pengaruh Kronik Kadmium (Cd) dan Kromium Heksavalen (Cr6+) Terhadap Pertumbuhan Chaetoceros gracilis. [Skripsi]. FPIK-IPB. Bogor.
http://www.serc.si.edu/labs/phytoplankton/guide/diatoms/images/Chaetoceros/Ch aetoceros-gracile-1.jpg [16 Februari 2009].
Lampiran 1. Perhitungan kepadatan sel mikroalga dengan menggunakan haemocytometer
Haemocytometer dibagi kedalam beberapa persegi untuk memudahkan dalam penghitungan sel. Pada tiap sisi dari haemocytometer terdapat 25 persegi yang lebih besar, didalamnya terdapat 16 persegi yang lebih kecil, jadi total persegi adalah 400. Untuk mendapatkan kepadatan sel (sel/ml) dimana x adalah jumlah sel mikroalga, maka gunakan formula berikut.
Kepadatan =
0.00025 1000 ) 400 /
(x x
Lampiran 2. Pembuatan berbagai konsentrasi kadmium dari larutan stok kadmium sebesar 1000 ppm
a. konsentrasi kadmium 0.56 mg Cd/l (ppm) 2
C1 : konsentrasi yang diinginkan (ppm)
V1 : volume larutan akhir ( air laut + logam berat kadmium) C2 : konsentrasi larutan stok (ppm)
V2 : Volume konsentrasi larutan stok kadmium yang ditambahkan
Sehingga
Ini berarti bahwa untuk mendapatkan larutan kadmium dengan konsentrasi 0.56 ppm dalam 500 ml maka perlu ditambahkan larutan stok kadmium sebesar 0.28 ml.
b. Konsentrasi kadmium 1 ppm 2
Ini berarti bahwa untuk mendapatkan larutan kadmium dengan konsentrasi 1 ppm dalam 500 ml maka perlu ditambahkan larutan stok kadmium sebesar 0.5 ml.
Lampiran 2. (lanjutan)
c. Konsentrasi kadmium 1.8 ppm 2
Ini berarti bahwa untuk mendapatkan larutan kadmium dengan konsentrasi 1.8 ppm dalam 500 ml maka perlu ditambahkan larutan stok kadmium sebesar 0.9 ml.
1000
Ini berarti bahwa untuk mendapatkan larutan kadmium dengan konsentrasi 1 ppm dalam 500 ml maka perlu ditambahkan larutan stok kadmium sebesar 0.5 ml.
e. Konsentrasi kadmium 5.6 ppm 2
Ini berarti bahwa untuk mendapatkan larutan kadmium dengan konsentrasi 1 ppm dalam 500 ml maka perlu ditambahkan larutan stok kadmium sebesar 0.5 ml.
Lampiran 3. Pembuatan berbagai konsentrasi timbal dari larutan stok timbal 1000 dan 100 ppm
Ini berarti bahwa untuk mendapatkan larutan timbal dengan
konsentrasi 0.32 ppm dalam 500 ml maka perlu ditambahkan larutan stok timbal 100ppm sebesar 0.9 ml
b Konsentrasi Timbal 0.56 ppm
Ini berarti bahwa untuk mendapatkan larutan timbal dengan
Lampiran 3.(lanjutan)
Ini berarti bahwa untuk mendapatkan larutan timbal dengan
konsentrasi 1 ppm dalam 500 ml maka perlu ditambahkan larutan stok timbal 100ppm sebesar 0.5 ml
d. Konsentrasi Timbal 1.8 ppm
Ini berarti bahwa untuk mendapatkan larutan timbal dengan
konsentrasi 1.8 ppm dalam 500 ml maka perlu ditambahkan larutan stok timbal 100ppm sebesar 0.9 ml
e. Konsentrasi Timbal 3.2 ppm
Lampiran 4. Pembuatan stok kultur untuk inokulasi agar memiliki kepadatan awal
C1 : kepadatan sel yang diinginkan (sel/ml) V1 : volume akhir
C2 : Kepadatan sel hasil kultur pada hari keempat (sel/ml)
V2 : Volume kepadatan sel hasil kultur pada hari keempat yang ditambahkan
6
Lampiran 5. Penentuan Fase Pertumbuhan C. gracilis
Fase ini hampir tidak ada penambahan populasi. Fase ini dimulai saat inokulasi mikroalga ke dalam media kultur sehingga terjadi beberapa penyesuaian terhadap lingkungan yang baru.
1-2 : Fase akselerasi pertumbuhan
Penambahan populasi terjadi secara tajam
Pemeliharaan kultur dilakukan sebanyak 3 kali
Lampiran 5. (lanjutan) 2-3 : Fase eksponensial
Penambahan populasi terjadi secara konstan dan merupakan kondisi optimum untuk pertumbuhan. Disebut eksponensial karena apabila dibandingkan dengan hari ke-0 memiliki hubungan eksponensial.
y = 6.3197e1.5714x R2 = 0.9974
0 100 200 300 400 500 600 700 800
0 1 2 3 4
Series1 Expon. (Series1)
3-4 :Fase pengurangan laju pertumbuhan
Penambahan populasi mengalami perlambatan. Pada fase ini sudah terjadi perubahan lingkungan kultur seperti kurangnya nutrien dan persaingan antar individu
4-5 : Fase stasioner
Hampir tidak ada penembahan populasi 5-6 : Fase penurunan
Lampiran 6. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-48 dengan toksikan kadmium pada uji akhir
Toksikan : CdCl2 Biota uji : C. gracilis
Lampiran 7. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-72 dengan toksikan kadmium pada uji akhir
Toksikan : CdCl2 Biota uji : C. gracilis
Lampiran 8. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-96 dengan toksikan kadmium pada uji akhir
Toksikan : CdCl2 Biota uji : C. gracilis
Lampiran 9. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-96 dengan toksikan Timbal pada uji pendahuluan
Toksikan : Pb(NO3)2 Biota uji : C. gracilis
Lampiran 10 . Persentase penghambatan pertumbuhan C. gracilis pada jam ke-48 dengan toksikan timbal pada uji akhir
Toksikan : Pb(NO3)2 Biota uji : C. gracilis
Lampiran 11. Persentase penghambatan pertumbuhan C. gracilis pada jam ke-72 dengan toksikan timbal pada uji akhir
Toksikan : Pb(NO3)2 Biota uji : C. gracilis