1. PENDAHULUAN
1.1. Latar Belakang
Salah satu indikator biologi untuk kesehatan ekosistem perairan adalah larva chironomida (Carew et al. 2003). Chironomida atau yang biasa disebut
„non-biting midges‟ adalah lalat kecil mirip nyamuk yang mempunyai panjang yang bervariasi yakni 2-18 mm bergantung pada spesies. Kumpulan chironomida ini dapat dilihat pada subuh atau petang hari di kawasan dekat pinggiran danau dan hampir di semua tempat yang berdekatan dengan perairan terbuka baik yang stagnan maupun mengalir. Perbedaan chironomida dengan nyamuk adalah chironomida tidak menggigit dan tidak menjadi pembawa penyakit (Bay 2003).
Larva chironomida digunakan sebagai indikator lingkungan dan perubahan iklim karena sangat cepat merespon perubahan kondisi perairan (Walkel 2001 in Heinrich et al.2006). Selain itu larva chironomida memiliki manfaat yang sangat besar pada jaring-jaring makanan di lingkungan akuatik, yakni sebagai pakan alami ikan dan membantu membongkar sedimen-sedimen organik (Bay 2003). Sementara itu, di Indonesia belum banyak penelitian yang dilakukan untuk mengembangkan potensi biota akuatik yang satu ini padahal insekta ini memiliki distribusi yang sangat luas di lingkungan air tawar. Chironomida dapat tumbuh dan berkembang pada perairan yang telah terkontaminasi misalnya kolam stabilisasi limbah di mana larva chironomida menjadi makroinvertebrata yang mendominasi (Winner et al. 1980 in Halpern et al. 2002).
telur di permukaan air yang nantinya akan tenggelam ke dasar maupun tersangkut di bagian tumbuhan yang bersifat subemerged menjadi penyebab sulitnya kuantifikasi chironomida. Oleh karena itu, digunakan metode pengamatan skala laboratorium untuk mengatasi kesulitan tersebut.
Pengetahuan ini dapat digunakan sebagai dasar kegiatan perbanyakan larva chironomida yang diharapkan dapat menguntungkan secara ekologis maupun ekonomis, yakni sebagai indikator lingkungan dan budidaya pakan alami. Kebutuhan informasi mengenai pola pertumbuhan dan perkembangan biota ini sebagai dasar dari penelitian-penelitian lain untuk mengembangkan potensi chironomida baik dengan tujuan ekologis maupun ekonomis melatarbelakangi penelitian yang dilakukan.
1.2. Perumusan Masalah
1.3. Tujuan
Penelitian ini bertujuan untuk mengetahui pola perkembangan dan pertumbuhan larva chironomida khususnya genus Chironomus sp. yang ditumbuhkan di laboratorium pada level bahan organik yang berbeda.
1.4. Manfaat
Hasil penelitian diharapkan dapat memberikan informasi mengenai dinamika populasi larva Chironomus sp. yang mencakup pola perkembangan dan pertumbuhan pada lingkungan buatan. Selanjutnya hasil penelitian dapat dijadikan rujukan dan masukan bagi penelitian lain mengenai larva chironomida terkait dengan potensi pengembangan budidaya larva ini sebagai pakan alami ikan maupun pemanfaatan chironomida sebagai bioindikator dan aspek paleolimnologi.
Gambar 1. Skema perumusan masalah mengenai pola pertumbuhan dan perkembangan larva Chironomus sp. skala laboratorium
Perkembangan ukuran larva Chironomus sp.
Pola pertumbuhan dan perkembangan Chironomus sp. pada lingkungan buatan
Larva Chironomus sp.
Kualitas air Bahan organik
+
2. TINJAUAN PUSTAKA
2.1. Chironomida
Organisme akuatik yang seringkali mendominasi dan banyak ditemukan di lingkungan perairan adalah larva serangga air. Salah satu larva serangga air yang dapat ditemukan sebagai benthos adalah Ordo Diptera dari Famili Chironomidae. Kebanyakan spesies anggota chironomida ini memiliki kebiasaan hidup meliang pada sedimen yang lunak pada fase larva. Larva akan berkembang menjadi pupa setelah ± 1 bulan untuk daerah tropis. Pupa selanjutnya akan berkembang menjadi chironomida dewasa. Setelah melakukan pemijahan, chironomida dewasa akan meletakkan telurnya di permukaan air dalam bentuk gelatin yang kompleks. Telur-telur ini selanjutnya akan tenggelam dan menetap pada sedimen maupun tanaman air dan benda-benda lain yang tenggelam.
Chironomida adalah serangga kecil yang mirip nyamuk, memiliki variasi panjang tubuh mulai dari 2 hingga 18 milimeter bergantung pada masing-masing spesies. Warnanya pun juga bervariasi sesuai spesies, berkisar dari yang benar-benar terang, hijau pucat hingga hampir mendekati hitam pekat. Ratusan spesies chironomida tersebar luas di dunia, dan spesies-spesies yang berbeda mendominasi populasi-populasi tertentu di tempat-tempat yang berdekatan dengan danau, kolam, atau aliran sungai. Tidak seperti larva nyamuk, yang sebagian besar hidupnya berada di permukaan air dengan tujuan untuk bernafas, larva chironomida hidup di dasar atau pada tanaman dan benda-benda tenggelam lainnya.
2.2. Parameter Fisika dan Kimia Tempat Hidup
Kualitas air terdiri dari keseluruhan faktor fisika, kimia, dan biologi yang mempengaruhi pemanfaatan suatu perairan (Boyd 1998). Karakteristik dari suatu perairan akan mempengaruhi ketahanan hidup, reproduksi, pertumbuhan, termasuk manajemen pengelolaan perikanan. Oleh karena itu, aspek kualitas air menjadi fokus perhatian sebelum dilakukan pemanfaatan dari perairan itu sendiri. Parameter fisika yang diamati pada penelitian ini adalah suhu sedangkan parameter kimia yang diamati adalah pH, oksigen terlarut, dan COD.
2.2.1. Suhu
Suhu adalah suatu ukuran dari energi kinetik rata-rata dari molekul-molekul, dengan suhu yang lebih tinggi aksi molekul meningkatkan tekanan dan menyebabkan mengembangnya material (Odum 1992). Suhu menjadi parameter penting dalam perairan dan berpengaruh secara langsung maupun tidak langsung terhadap kehidupan di perairan. Suhu disebutkan memberikan pengaruh bagi proses kimia maupun biologi di perairan. Secara umum, tingkat reaksi kimia dan biologi meningkat menjadi dua kali lipat untuk setiap kenaikan suhu sebesar 100C. Hal ini menunjukkan bahwa organisme akuatik menggunakan oksigen terlarut dua kali lebih banyak untuk suhu 30 ºC dibandingkan suhu 20 ºC, dan reaksi kimia menunjukkan kemajuan dua kali lebih cepat pada suhu 30 ºC dibandingkan suhu 20 ºC (Boyd 1998).
Thompson (1942) dan Johnson et al. (1942) in Odum (1992) menunjukkan banyak proses dengan kurva respons terhadap suhu yang menyerupai bentuk punuk (hump-shaped). Berdasarkan hal tersebut, proses-proses mencapai maksimum pada suhu menengah. Peningkatan suhu juga menyebabkan terjadinya peningkatan dekomposisi bahan organik oleh mikroba, dengan kata lain banyak proses yang berjalan maksimum saat suhu optimum.
dengan oksigen terlarut yang merupakan faktor pembatas bagi kehidupan chironomida.
2.2.2. Oksigen terlarut
Oksigen adalah salah satu elemen yang dapat ditemukan dalam banyak bentuk di lingkungan alami termasuk badan air. Bentuk pradominan di atmosfer adalah gas oksigen, yakni lebih kurang 21% dari keseluruhan gas-gas di atmosfer. Oksigen juga ditemukan berikatan dengan elemen-elemen lainnya. Oksigen sebagai komponen mayor bahan organik dan secara biologi relevan dengan komponen-komponen anorganik (Kodds 2002).
Jumlah oksigen yang terlarut di perairan adalah fungsi dari banyak faktor, termasuk tingkat aktivitas metabolisme. Fotosintesis adalah salah satu sumber terbesar penghasil oksigen. Cahaya, suhu, dan nutrien adalah pengontrol proses fotosintesis. Sementara itu, aktivitas respirasi adalah salah satu pemakai terbesar dari oksigen di perairan. Volume dari oksigen terlarut di suatu perairan pada waktu tertentu dipengaruhi oleh beberapa hal antara lain: suhu badan air, tekanan parsial gas di atmosfer yang berhubungan langsung dengan air, serta konsentrasi dari salinitas (garam-garaman), khusus untuk air laut.
Oksigen terlarut adalah faktor pembatas yang sangat penting di habitat danau. Nilai dari oksigen terlarut ini berkaitan langsung dengan suhu karena tingkat atau persentase saturasi dari oksigen dipengaruhi oleh suhu perairan. Ketersediaan oksigen adalah salah satu variabel yang memiliki pengaruh langsung bagi distribusi larva chironomida (Jo ´nasson, 1972, 1984; Heinis & Davids, 1993; Hamburger 1998 in Brodersen et al. 2008). Hal ini membuktikan bahwa oksigen sangat berpengaruh dan menjadi salah satu faktor pembatas bagi kehidupan chironomida.
2.2.3. Chemical Oxygen Demand (COD)
COD menggambarkan besarnya bahan organik yang dioksidasi dengan agen pengoksidasi kuat seperti K2Cr2O7 (Nemerow 1991). Perbedaan utama
melainkan secara kimia. Oleh karena itu, nilai COD besarnya sama atau lebih besar dari nilai BOD. Pengukuran COD untuk memperkirakan nilai oksigen ekuivalen dari bahan organik pada air yang dirasa tercemar yang dapat dioksidasi secara kimiawi dengan menggunakan dikromat dalam larutan asam (Metcalf & Eddy 2004).
COD diukur dengan mengkonversi semua bahan organik pada air contoh menjadi karbondioksida dan air melalui proses oksidasi dengan melibatkan potassium dikromat dan asam sulfat (Boyd 1998). Sumber dari bahan organik ini biasanya berasal dari alam maupun aktivitas rumah tangga dan industri. Perairan yang memiliki nilai COD tinggi tidak diinginkan bagi kepentingan perikanan dan pertanian.
2.2.4. pH
Konsentrasi ion hidrogen adalah salah satu parameter kualitas air yang sangat penting baik untuk perairan alami maupun air limbah. Definisi yang biasanya digunakan untuk menyatakan konsentrasi hidrogen adalah pH, yang didefinisikan sebagai logaritma negatif dari konsentrasi ion hidrogen. Kisaran konsentrasi pH bagi keberadaan hampir semua kehidupan biologi biasanya sangat sempit dan kritis (6-9) (Metcalf & Eddy 2004).
Alat yang umumnya digunakan dalam pengukuran pH adalah pH-meter. Selain itu, juga ada berbagai variasi dari kertas pH dan larutan indikator yang mengalami perubahan warna untuk mengukur nilai pH suatu perairan. Pengukuran pH dilakukan dengan membandingkan warna dari kertas atau larutan dengan seri warna standar yang telah ditetapkan.
2.2.5. Bahan organik
berasal dari tanaman maupun hewan yang sudah mati. Sumber bahan organik bisa berasal dari perairan itu sendiri (autochtonous) maupun dari ekosistem lain (allochtonous). Kebanyakan makroinvertebrata memanfaatkan bahan organik sebagai sumber makanan. Beberapa bersifat grazer, collector, maupun scavenger. Oleh karena itu, ketersediaan bahan organik di perairan sangat berpengaruh bagi pertumbuhan organisme akuatik yang memanfaatkannya.
Bahan-bahan organik ini selanjutnya akan didekomposisi oleh bakteri dekomposer. Hasil dekomposisi ini adalah unsur-unsur hara yang bisa dimanfaatkan oleh organisme autotrof seperti tanaman air maupun fitoplankton. Oleh karena itu, bahan organik sering diasosiasikan dengan kesuburan perairan dan produktivitas primer. Oksigen yang merupakan salah satu faktor pembatas di perairan apabila tidak mencukupi jumlahnya akan mempengaruhi kehidupan biota akuatik.
3. METODE PENELITIAN
3.1. Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada bulan Mei - Juli 2011, berlokasi di Laboratorium Biologi Mikro I, Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Institut Pertanian Bogor. Penelitian dilakukan pada skala laboratorium dan lingkungan yang terkontrol. Wadah plastik berukuran 34x26x7 cm3 digunakan sebagai tempat hidup larva chironomida yang menjadi objek penelitian. Pertimbangan penggunaan wadah plastik ini adalah untuk mempermudah pemeliharaan, kuantifikasi, maupun pengamatan larva chironomida itu sendiri. Massa telur chironomida diperoleh dari Danau Lido (Lampiran 1) yang terletak di Desa Watesjaya, Kecamatan Cigombong, 25 km dari arah Kota Bogor ke arah Sukabumi.
3.2. Tahapan Penelitian 3.2.1. Persiapan
Tahap persiapan dilakukan dengan menyiapkan peralatan yang akan digunakan untuk mengambil larva chironomida dari Danau Lido. Pada tahap ini dibutuhkan wadah berupa botol sampel sebagai tempat untuk menampung massa telur chironomida. Jumlah botol yang dibutuhkan adalah sembilan buah sesuai dengan wadah pemeliharaan di laboratorium. Selanjutnya dilakukan pengambilan massa telur yang berlokasi di Danau Lido. Pengambilan telur dilakukan pada pagi hari. Massa telur yang diambil diusahakan dalam kuantitas yang sama untuk masing-masing botol sampel agar jumlah larva yang nantinya dipelihara untuk masing-masing wadah pemeliharaan jumlahnya seragam. Pengambilan massa telur dilakukan di sekitar Karamba Jaring Apung dengan menggunakan bantuan kuas (Lampiran 2). Selain massa telur, dilakukan pula pengambilan air dari Danau Lido tersebut sebagai media pemeliharaan larva chironomida di laboratorium.
3.2.2. Pelaksanaan
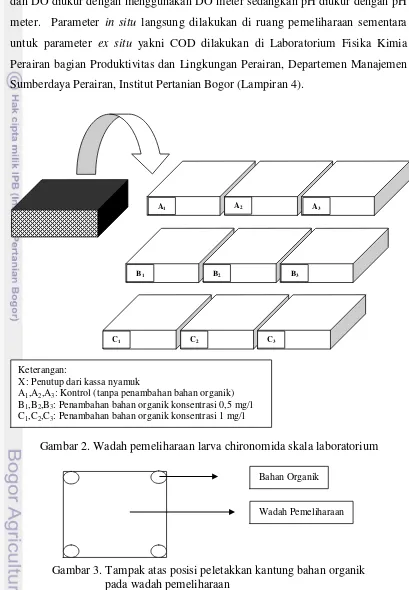
Larva chironomida yang ditumbuhkan di laboratorium diambil dalam bentuk massa telur yang berasal dari Danau Lido. Massa telur ditetaskan pada cawan petri yang berbeda untuk masing-masing wadah. Pengamatan selama lebih kurang 24 jam pertama sejak telur diambil dari alam dilakukan setiap 4 jam dengan kamera yang dihubungkan dengan mikroskop. Setelah telur menetas menjadi larva, larva kemudian dipindahkan ke wadah plastik pemeliharaan berukuran 34x26x7 cm3 yang diisi air Danau Lido setinggi 4 cm. Wadah pemeliharan (Lampiran 3) ini dilengkapi dengan penutup yang dibuat dari kain kassa nyamuk (Gambar 2). Hal ini dilakukan untuk menghindari insekta lain yang berpotensi menjadi predator bagi larva chironomida.
Media kultur massa telur yang dipelihara di dalam wadah pemeliharaan adalah air yang diberi tambahan bahan organik berupa kotoran kuda. Pertimbangan penambahan bahan organik didasarkan pada teknik kultur chironomida oleh Mc Larney et al. (2003). Teknik kultur dilakukan dengan menumbuhkan chironomida pada kolam berukuran 2 m x 1 m x 0.5 m. Bahan organik yang digunakan adalah kotoran kuda dengan konsentrasi 1,0 mg/l. Penelitian dilakukan dengan menerapkan dua perlakuan. Wadah pertama adalah kontrol berupa media air dari Danau Lido tanpa penambahan bahan organik, perlakuan kedua ditambahkan bahan organik dengan konsentrasi 0,5 mg/l, dan perlakuan ketiga dengan konsentrasi 1 mg/l. Penelitian pendahuluan yang dilakukan dengan mencobakan bahan organik konsentrasi 1 mg/l dan 2 mg/l menyebabkan massa telur chironomida membusuk. Oleh karena itu, penelitian ini menggunakan konsentrasi bahan organik 0,5 mg/l dan 1,0 mg/l. Bahan organik yang digunakan dibungkus dengan kain kassa dan diletakkan di masing-masing sudut wadah pemeliharaan (Gambar 3). Kotoran kuda yang sudah dikeringkan diayak hingga diperoleh bagian yang halus (Lampiran 3). Bagian inilah yang digunakan sebagai sumber bahan organik dalam wadah pemeliharaan.
hari. Pengukuran kualitas air berupa suhu, DO, dan COD dilakukan setiap tiga hari sekali, sedangkan pengukuran pH dilakukan setiap satu minggu sekali. Suhu dan DO diukur dengan menggunakan DO meter sedangkan pH diukur dengan pH meter. Parameter in situ langsung dilakukan di ruang pemeliharaan sementara untuk parameter ex situ yakni COD dilakukan di Laboratorium Fisika Kimia Perairan bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Institut Pertanian Bogor (Lampiran 4).
Gambar 2. Wadah pemeliharaan larva chironomida skala laboratorium
Gambar 3. Tampak atas posisi peletakkan kantung bahan organik pada wadah pemeliharaan
Bahan Organik
Wadah Pemeliharaan X
Keterangan:
X: Penutup dari kassa nyamuk
A1,A2,A3: Kontrol (tanpa penambahan bahan organik) B1,B2,B3: Penambahan bahan organik konsentrasi 0,5 mg/l C1,C2,C3: Penambahan bahan organik konsentrasi 1 mg/l
A1 A2 A3
B1 B2 B3
3.2.3. Pengambilan contoh
Metode pengambilan contoh yang digunakan dalam pengambilan massa telur dari Danau Lido untuk kemudian dipelihara di laboratorium adalah metode purposive sampling yaitu metode pengambilan contoh dengan didasarkan pada pertimbangan-pertimbangan yang sudah ada. Pengambilan larva dilakukan pada lokasi Karamba Jaring Apung (KJA), dengan pertimbangan bahwa chironomida dewasa diketahui lebih menyukai KJA sebagai tempat meletakkan massa telurnya. Pengambilan dilakukan dengan menggunakan bantuan kuas dan disimpan dalam botol sampel dengan jumlah sama dengan jumlah wadah pemeliharaan dan kuantitas telur untuk masing-masing wadah diseragamkan secara visual. Massa telur selanjutnya dimasukkan ke dalam botol kaca berukuran sedang. Botol kaca tersebut sebelumnya telah diisi dengan air yang berasal dari Danau Lido. Kemudian massa telur dibawa ke Laboratorium Biologi Mikro I dan ditetaskan di cawan petri. Pengamatan dilakukan setiap 4 jam sekali dengan mikroskop majemuk yang dihubungkan dengan kamera dan program video Quickcam. Setelah seluruh telur menetas, larva dipindahkan ke wadah plastik yang diletakkan di ruangan tertutup dengan kisaran suhu 26,1-27,4 0C. Wadah plastik diletakkan pada bagian ruangan yang tidak terkena sinar matahari secara langsung untuk menekan pertumbuhan alga yang diperkirakan dapat mengganggu pertumbuhan larva chironomida.
Tabel 1. Metode dan alat yang digunakan pada pengukuran parameter fisika-kimia perairan.
Parameter Unit Alat Metode Pustaka Acuan
FISIKA
Analisis sampel larva chironomida dilakukan di Laboratorium Biologi Mikro I, Bagian Produktivitas dan Lingkungan Perairan, Departemen Manajemen Sumberdaya Perairan, Institut Pertanian Bogor. Sampel larva chironomida yang telah diambil dari wadah pemeliharaan dan diawetkan dengan alkohol 70% dipindahkan ke dalam botol kaca yang telah diberi KOH 10%. Pemberian KOH dilakukan untuk membersihkan jaringan-jaringan internal chironomida untuk mempermudah proses identifikasi. Perendaman dengan KOH disesuaikan dengan ukuran chironomida. Setelah dirasa cukup bersih, chironomida disusun di atas kaca preparat dengan bantuan mikroskop bedah lalu diangin-anginkan hingga kering. Selanjutnya diberi Entellan® dan ditutup dengan menggunakan kaca penutup. Preparat inilah yang akan diidentifikasi dan dihitung ukuran tubuh yang terdiri dari panjang total, lebar badan, panjang kepala, dan lebar kepala. Proses identifikasi sekaligus pengukuran dilakukan dengan bantuan mikroskop majemuk yang terhubung dengan kamera optilab dan dilengkapi program Image Raster (Lampiran 7).
3.3. Pengolahan Data
3.3.1. Penentuan kohort melalui analisis distribusi frekuensi panjang larva chironomida
Data yang diperoleh selama pengamatan berlangsung akan diolah untuk menghasilkan penjelasan secara deskriptif. Ciri-ciri penting sejumlah besar data dengan segera dapat diketahui melalui pengelompokan data tersebut ke dalam beberapa kelas dan kemudian dihitung banyaknya pengamatan yang masuk ke dalam tiap kelas. Susunan dari data ini biasanya disajikan dalam bentuk tabel yang disebut sebaran frekuensi (Walpole 1992). Data yang disajikan dibuat dalam bentuk kelompok untuk memperoleh gambaran yang lebih baik mengenai populasi yang sedang diamati.
Penentuan selang kelas berdasarkan Walpole (1992) adalah dengan menentukan banyaknya kelas yang dihitung dengan menggunakan rumus sebagai berikut, dengan n sebagai jumlah data panjang:
Kemudian ditentukan wilayah dengan mengurangi nilai maksimum dengan minimum data keseluruhan. Selanjutnya adalah penentuan lebar kelas sesuai dengan rumus:
Langkah selanjutnya adalah mendaftar selang kelas atas dan selang kelas bawah dengan data terkecil sebagai permulaan selang kelas bawah. Sedangkan batas kelas diperoleh dengan menambah atau mengurangi selang kelas dengan ½ kali nilai satuan terkecil. Nilai tengah didapat dengan merata-ratakan batas kelas atas dan batas kelas bawah. Selanjutnya nilai frekuensi ditentukan pada masing-masing kelas dan yang terakhir adalah pengecekan jumlah kolom frekuensi memiliki jumlah yang sama terhadap banyaknya total pengamatan.
kohort dan sebaran distribusinya per minggu dilakukan dengan metode NORMSEP (Normal Separation) dan bantuan program FISAT II.
3.3.2. Rancangan acak lengkap
Rancangan acak lengkap adalah salah satu rancangan percobaan yang paling sederhana. Metode ini digunakan untuk mengetahui apakah perlakuan bahan organik yang berbeda mempengaruhi perubahan ukuran larva chironomida. Rancangan ini digunakan apabila bahan maupun kondisi percobaan bersifat homogen. Rancangan ini digunakan karena relatif lebih mudah dan analisis statistiknya sederhana. Penelitian kali ini menggunakan perlakuan yang dibedakan berdasarkan konsentrasi bahan organik yang digunakan. Hipotesis yang digunakan yaitu sebagai berikut:
H0 : semua αi = 0 (atau tidak ada pengaruh perlakuan bahan organik terhadap
pertumbuhan larva chironomida)
H1 : minimal ada satu αi ≠ 0 (atau minimal ada satu perlakuan bahan organik
yang mempengaruhi pertumbuhan larva chironomida)
Jika Ftabel>Fhitung maka keputusan yang diperoleh adalah terima H0 sedangkan jika
Ftabel<Fhitung maka keputusan yang diperoleh adalah tolak H0 atau terima H1.
Selanjutnya, kesimpulan yang diperoleh jika keputusannya terima H0 adalah tidak
ada satu pun perlakuan yang memberikan perbedaan yang nyata terhadap pertumbuhan larva chironomida. Sementara itu jika keputusan yang didapat tolak H0 atau terima H1, maka kesimpulan yang bisa diambil adalah minimal ada satu
perlakuan yang mempengaruhi pertumbuhan larva chironomida. Parameter yang digunakan dalam rancangan acak lengkap adalah panjang total, lebar badan, panjang kepala, dan lebar kepala.
3.3.3. Analisis kelompok
4. HASIL DAN PEMBAHASAN
4.1. Hasil
4.1.1. Deskripsi lokasi pengambilan massa telur
Lokasi pengambilan massa telur yang digunakan untuk penelitian utama adalah kawasan Karamba Jaring Apung Danau Lido. Lokasi ini dipilih berdasarkan hasil pengamatan pendahuluan dan survei yang dilakukan bahwa chironomida dewasa sering meletakkan telurnya pada jaring karamba yang terdapat di Danau Lido. Lokasi pengambilan terletak dekat dengan jalan raya dan restoran terapung serta rumah makan di pinggir danau. Lokasi ini memiliki kedalaman sekitar 9,5 m dan tidak ditemukan adanya tumbuhan air. Massa telur diambil dari jaring karamba maupun benda-benda terapung di sekitar KJA. Massa telur berbentuk seperti gumpalan bening gelatin yang bila diperhatikan dengan seksama terdiri dari butir-butir telur berwarna kecoklatan (Gambar 4). Satu massa telur umumnya terdiri dari 200 butir telur chironomida.
Gambar 4. Massa telur chironomida genus Chironomus sp. Sumber: Dokumentasi pribadi
4.1.2. Larva chironomida
baik dalam jumlah spesies maupun jumlah individu yang dapat ditemukan pada hampir seluruh habitat air tawar (Eppler 2001).
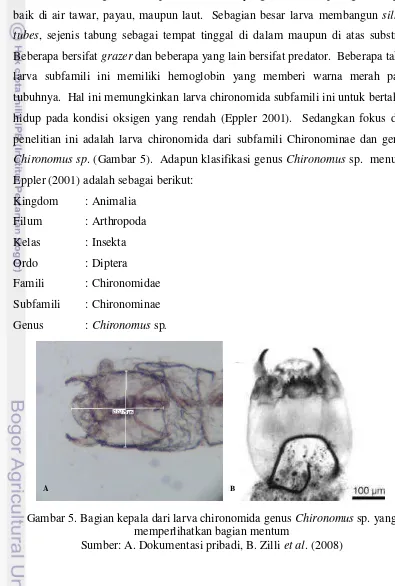
Chironomida yang menjadi objek penelitian ini adalah pada fase larva chironomida Subfamili Chironominae yang memiliki ciri berupa antena yang terdiri dari 4-8 segmen merupakan subfamili yang ditemukan paling melimpah baik di air tawar, payau, maupun laut. Sebagian besar larva membangun silken tubes, sejenis tabung sebagai tempat tinggal di dalam maupun di atas substrat. Beberapa bersifat grazer dan beberapa yang lain bersifat predator. Beberapa taksa larva subfamili ini memiliki hemoglobin yang memberi warna merah pada tubuhnya. Hal ini memungkinkan larva chironomida subfamili ini untuk bertahan hidup pada kondisi oksigen yang rendah (Eppler 2001). Sedangkan fokus dari penelitian ini adalah larva chironomida dari subfamili Chironominae dan genus Chironomus sp. (Gambar 5). Adapun klasifikasi genus Chironomus sp. menurut Eppler (2001) adalah sebagai berikut:
Kingdom : Animalia Filum : Arthropoda Kelas : Insekta Ordo : Diptera Famili : Chironomidae Subfamili : Chironominae Genus : Chironomus sp.
Gambar 5. Bagian kepala dari larva chironomida genus Chironomus sp. yang memperlihatkan bagian mentum
Sumber: A. Dokumentasi pribadi, B. Zilli et al. (2008)
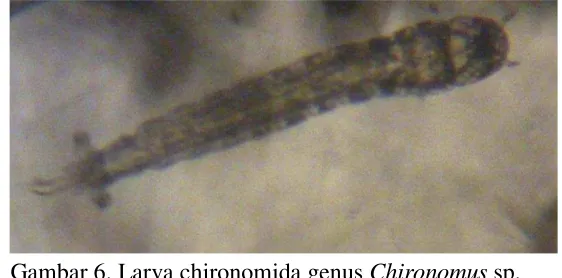
Gambar 6. Larva chironomida genus Chironomus sp. Sumber: Dokumentasi pribadi
Gambar 5 dan 6 merupakan larva chironomida dari genus Chironomus sp. Genus ini dapat dibedakan dengan bentuk mentum yang terdiri dari 3 atau 4 gigi tengah yang terpisah dari bagian lateral mentum oleh garis mulai dari gigi paling belakang hingga sudut anterimedial dari lempeng ventromental.
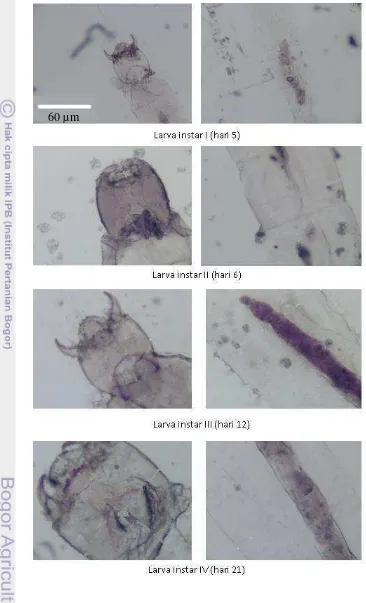
4.1.3. Perkembangan larva Chironomus sp.
Gambar 7. Pupa Chironomus sp. (A. Pupa dengan isi, B. Pupa kosong/exoviae) Sumber: Dokumentasi pribadi
4.1.4. Keadaan fisika kimia air wadah pemeliharaan
Pengukuran parameter fisika maupun kimia air dilakukan untuk melihat pengaruh perlakuan penambahan bahan organik terhadap kecenderungan keadaan fisika kimia air pada wadah pemeliharaan. Nilai parameter fisika kimia yang telah diukur disajikan pada Lampiran 8.
Hari
ke-Gambar 8. Nilai COD pada tiga perlakuan berbeda
COD (Chemical Oxygen Demand) merupakan gambaran besarnya bahan organik di suatu perairan yang dapat didekomposisi secara biologi maupun kimia. Pengukuran COD dilakukan dengan tujuan untuk membandingkan pengaruh penambahan bahan organik terhadap kandungan bahan organik di masing-masing
wadah pemeliharaan. Berdasarkan Gambar 8 dapat dilihat bahwa terdapat perbedaan besarnya nilai COD. Ketiga perlakuan memiliki kecenderungan variasi perubahan yang sama untuk nilai COD, yakni mengalami kenaikan sampai hari tertentu dan mengalami penurunan hingga pengamatan terakhir.
Nilai COD paling tinggi adalah pada wadah dengan konsentrasi bahan organik sebesar 1,0 mg/l dengan nilai 86,67 mg/l pada pengamatan hari ke-12. Sedangkan nilai COD tertinggi pada perlakuan bahan organik 0,5 mg/l adalah 59,33 mg/l pada hari ke-15 dan untuk dan perlakuan tanpa penambahan bahan organik adalah 20,67 mg/l untuk pengamatan hari ke-6. Kisaran nilai COD untuk perlakuan tanpa bahan organik adalah 16,67-20,67 mg/l. Perlakuan dengan bahan organik 0,5 mg/l memiliki kisaran 14,33-59,33 mg/l. Sedangkan pada wadah perlakuan dengan penambahan bahan organik 1,0 mg/l, nilai COD berkisar antara 15,67-86,67 mg/l. Perbedaan nilai COD ini disebabkan oleh perbedaan jumlah bahan organik yang ditambahkan pada masing-masing wadah perlakuan.
Salah satu parameter fisika yang diukur adalah suhu, yakni salah satu parameter yang berpengaruh langsung terhadap kehidupan biota air. Metabolisme biota akan meningkat jika terjadi kenaikan suhu hingga batas tertentu dan sebaliknya, akan terjadi penurunan tingkat metabolisme bila terjadi penurunan suhu. Pengukuran parameter suhu dilakukan setiap tiga hari. Suhu yang tercatat berkisar antara 26,1-27,4 ºC. Kecenderungan variasi suhu untuk masing-masing perlakuan sama, seperti yang terlihat pada Gambar 9. Masing-masing wadah pemeliharaan tidak memperlihatkan kenaikan maupun penurunan suhu yang signifikan. Suhu paling tinggi terjadi pada pengamatan hari ke-9 dan paling rendah terjadi pada pengamatan hari ke-6.
hari ke-Gambar 9. Nilai suhu pada tiga perlakuan berbeda
Gambar 10. Nilai pH pada tiga perlakuan berbeda
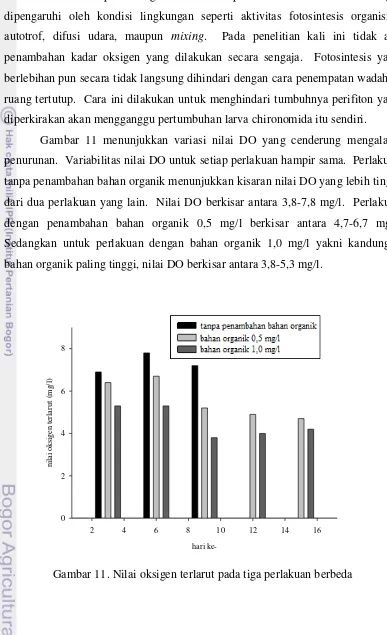
masukan untuk respirasi bagi mahluk hidup heterotrof. Nilai DO sangat dipengaruhi oleh kondisi lingkungan seperti aktivitas fotosintesis organisme autotrof, difusi udara, maupun mixing. Pada penelitian kali ini tidak ada penambahan kadar oksigen yang dilakukan secara sengaja. Fotosintesis yang berlebihan pun secara tidak langsung dihindari dengan cara penempatan wadah di ruang tertutup. Cara ini dilakukan untuk menghindari tumbuhnya perifiton yang diperkirakan akan mengganggu pertumbuhan larva chironomida itu sendiri.
Gambar 11 menunjukkan variasi nilai DO yang cenderung mengalami penurunan. Variabilitas nilai DO untuk setiap perlakuan hampir sama. Perlakuan tanpa penambahan bahan organik menunjukkan kisaran nilai DO yang lebih tinggi dari dua perlakuan yang lain. Nilai DO berkisar antara 3,8-7,8 mg/l. Perlakuan dengan penambahan bahan organik 0,5 mg/l berkisar antara 4,7-6,7 mg/l. Sedangkan untuk perlakuan dengan bahan organik 1,0 mg/l yakni kandungan bahan organik paling tinggi, nilai DO berkisar antara 3,8-5,3 mg/l.
4.1.5. Pengelompokan larva chironomida berdasarkan instar
Fase hidup chironomida saat larva adalah tahapan hidup paling lama dari keempat siklus hidup chironomida. Perkembangan larva chironomida di daerah tropis umumnya membutuhkan waktu ± 1 bulan. Selama fase ini, chironomida mengalami empat instar. Waktu capaian masing-masing instar dari larva chironomida berbeda-beda bergantung pada spesiesnya. Penentuan capaian instar dari larva chironomida pada penelitian ini dilakukan dengan mengukur panjang dan lebar kapsul kepala. Kapsul kepala dari larva chironomida terbuat dari zat kitin. Penentuan instar didasarkan pada pergantian kulit (molting) pada kapsul kepala yang menandai terjadinya pergantian instar. Tabel 2 merupakan dasar pengelompokan instar berdasarkan penelitian Dettinger-Klemm (2003).
Tabel 2. Karakteristik ukuran larva Chironomus sp. berdasarkan instar
Instar Head L (µm) Head W (µ m) Body L (mm) Body W (µ m)
I 105-108; 123 ± 10,9 101-184; 112 ± 11,2 0,7-2,0 40-201 II 182-224; 199 ± 10,7 159-208; 190 ± 9,9 1,7-3,8 102-347
III 270-405; 355 ± 29,7 245-356; 311 ± 22,3 3,0-7,5 161-564
IV 494-649; 585 ± 40,3 409-592; 510 ± 37,1 4,7-12,8 353-1128
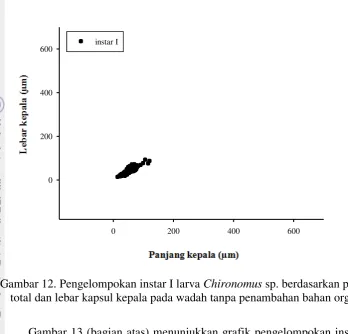
Tabel 2 dijadikan pedoman dalam menentukan centroid atau pemusatan data panjang dan lebar kapsul kepala dari larva chironomida. Selanjutnya data diolah dengan menggunakan perangkat lunak MINITAB 14. Larva dikelompokkan menjadi 4 instar. Masing-masing instar memiliki kisaran panjang dan lebar kapsul kepala yang berbeda. Berikut ditampilkan grafik pengelompokan larva berdasarkan instar dengan pedoman ukuran dari Dettinger-Klemm (2003).
0 200 400 600 0
200 400
600 instar I
Gambar 12. Pengelompokan instar I larva Chironomus sp.berdasarkan panjang total dan lebar kapsul kepala pada wadah tanpa penambahan bahan organik
0 100 200 300 400 500 600 0
100 200 300 400 500 600
0 100 200 300 400 500 600 0
100 200 300 400 500 600
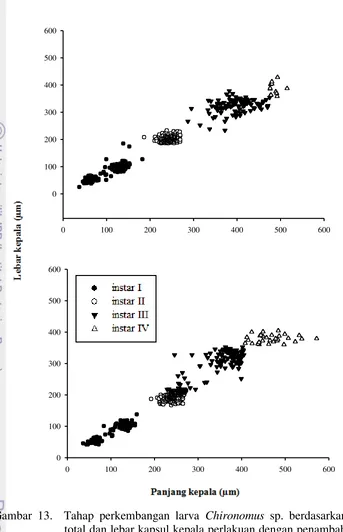
Gambar 13. Tahap perkembangan larva Chironomus sp. berdasarkan panjang total dan lebar kapsul kepala perlakuan dengan penambahan bahan organik 0,5 mg/ l (atas) dan 1,0 mg/l (bawah)
baik dan mencapai empat instar hingga dewasa. Berdasarkan Gambar 13 dapat diketahui bahwa kisaran panjang kapsul kepala untuk instar I berkisar antara 44,5-160 µm dan lebar kapsul kepala 40,9-137 µm. Kisaran panjang dan lebar kapsul kepala untuk instar II berkisar antara 193-228 µm dan 166-208 µm. Larva Chironomus sp. instar III memiliki panjang kapsul kepala sebesar 229-405 µm dan lebar kapsul kepala antara 209-353 µm. Instar terakhir (instar IV) panjang dan lebar kapsul kepala berkisar antara 408-572 µm dan 360-404 µm. Berdasarkan perbandingan kedua grafik tersebut, dapat dilihat bahwa penambahan bahan organik yang lebih banyak akan menyebabkan terjadinya pertumbuhan yang lebih besar. Titik-titik pada grafik menunjukkan bahwa pada penambahan bahan organik 1,0 mg/l mengakibatkan pertumbuhan lebih besar pada instar IV.
Berdasarkan pengelompokan instar, dapat diketahui waktu capaian masing-masing instar dengan membandingkan kisaran panjang total larva Chironomus sp. dengan waktu. Hal ini diperkuat oleh pernyataan Zilli et al. (2008) yang menyatakan bahwa kurva pertumbuhan populasi erat kaitannya dengan pertumbuhan panjang total berdasarkan waktu. Tabel 3 menggambarkan hasil penelitian Zilli et al. (2008) mengenai waktu capaian instar pada spesies C. calligraphus.
Tabel 3. Karakteristik ukuran larvadan waktu capaian instar C. calligraphus
Instar Lebar Kapsul
Tabel 4. Karakteristik ukuran larva dan waktu capaian instar berdasarkan
**waktu capaian ketika sudah ada chironomida yang mencapai fase pupa
Berdasarkan hasil penelitian dapat dibandingkan jangka waktu yang dibutuhkan larva pada masing-masing perlakuan untuk melewati masing-masing instar. Larva pada perlakuan tanpa penambahan bahan organik hanya bertahan hingga pengamatan hari ke-7 karena tidak tersedianya bahan organik sebagai sumber makanan. Fase hidup larva chironomida pada perlakuan ini hanya fase planktonik dan instar I. Perlakuan dengan penambahan bahan organik 0,5 mg/l dan 1,0 mg/l memiliki pola yang sama untuk jangka waktu instar I dan II. Akan tetapi terdapat perbedaan yang cukup signifikan pada instar III dan IV. Penambahan bahan organik yang lebih tinggi menyebabkan larva Chironomus sp. lebih cepat mencapai instar IV, namun jangka waktu untuk instar IV menjadi lebih lama. Hal ini membuktikan, bahan organik memberikan pengaruh bagi waktu capaian instar pada Chironomus sp.
Gambar 14. Perbandingan kapsul kepala dan lebar badan setiap instar pada perlakuan penambahan bahan organik 0,5 mg/l
Gambar 15. Perbandingan kapsul kepala dan lebar badan setiap instar pada perlakuan penambahan bahan organik 1,0 mg/l
4.1.6. Penentuan kohort berdasarkan analisis distribusi frekuensi panjang larva chironomida dengan metode NORMSEP
Larva chironomida yang diamati memperlihatkan perubahan ukuran baik panjang total, lebar badan, panjang kepala, maupun lebar kepala. Hal ini membuktikan bahwa larva chironomida mengalami pertumbuhan. Analisis pertumbuhan yang digunakan dalam penelitian ini adalah metode NORMSEP (Normal Separation). Larva chironomida diklasifikasikan menjadi beberapa selang kelas panjang dan diolah dalam bentuk grafik distribusi panjang dengan perangkat lunak FISAT II.
Berdasarkan data panjang total larva chironomida yang telah dikelompokkan berdasarkan selang kelas tertentu, perlakuan tanpa penambahan bahan organik tidak menunjukkan pertumbuhan yang signifikan sehingga tidak dapat dideskripsikan dengan menggunakan metode ini. Gambar 15 menunjukkan perbandingan grafik distribusi panjang untuk perlakuan dengan penambahan bahan organik sebanyak 0,5 mg/l dan 1,0 mg/l. Setiap grafik menunjukkan hanya ada satu sebaran normal untuk masing-masing perlakuan. Hal ini menjelaskan bahwa hanya ada satu kohort (kelompok umur) pada kedua perlakuan ini.
Pergeseran garis merah ke arah kanan menggambarkan terjadinya perubahan nilai modus setiap minggunya. Berdasarkan metode ini dapat dijelaskan bahwa pertumbuhan panjang larva chironomida cukup signifikan dilihat dari pergerakan ke kanan dari nilai modus yang terjadi (Lampiran 5).
Gambar 16. Distribusi panjang total Chironomus sp. (kiri: bahan organik 0,5 mg/l, kanan: bahan organik 1,0 mg/l)
Berdasarkan pergeseran nilai modus, diperoleh hubungan regresi linier sederhana antara waktu dengan modus panjang total larva Chironomus sp. Perlakuan dengan penambahan bahan organik 1,0 mg/l menyebabkan kenaikan nilai modus sebesar 1136 µm setiap satu minggu. Perlakuan dengan penambahan bahan organik yang lebih sedikit, yaitu 0,5 mg/l menunjukkan kenaikan nilai modus yang lebih kecil, yakni 870,6 µm. Gambar 17 memperlihatkan grafik hubungan antara waktu dengan penambahan nilai modus.
minggu
Selain menggunakan hubungan regresi linier sederhana untuk menunjukkan perbedaan pengaruh penambahan bahan organik, dilakukan uji rancangan acak lengkap untuk melihat pengaruh bahan organik terhadap nilai modus yang dicapai dari grafik distribusi frekuensi panjang. Berdasarkan tabel pengujian rancangan acak lengkap, diperoleh hasil Fhitung>Ftabel. Keputusan yang
diperoleh adalah tolak H0 yang artinya perlakuan mempengaruhi nilai modus yang
diperoleh berdasarkan waktu. Hal ini menggambarkan bahwa penambahan bahan organik memberikan pengaruh bagi pertumbuhan panjang total larva chironomida.
4.1.7. Pengaruh perbedaan perlakuan bahan organik terhadap berbagai parameter pertumbuhan
Pertumbuhan adalah salah satu ciri mahluk hidup yang membedakannya dari mahluk tak hidup. Secara teoritis pertumbuhan dapat diartikan sebagai perubahan dimensi (panjang, berat, ukuran, volume, dan jumlah) per satuan waktu baik individu, stok maupun komunitas. Pertumbuhan banyak dipengaruhi oleh faktor internal dan eksternal. Faktor internal meliputi faktor keturunan, jenis kelamin, umur, ketahanan terhadap penyakit, dan kemampuan dalam memanfaatkan makanan. Sedangkan faktor eksternal meliputi jumlah makanan yang tersedia di perairan, ukuran makanan, kandungan gizi makanan, dan faktor lingkungan.
Pertumbuhan ada yang bersifat positif dan ada yang bersifat negatif. Pertumbuhan positif ditandai oleh selisih yang nilainya positif, sedangkan pertumbuhan negatif ditandai oleh selisih yang nilainya negatif atau dengan kata lain mengalami penurunan. Berdasarkan faktor yang mempengaruhi pertumbuhan, penelitian ini mengambil aspek bahan organik yang dalam kehidupan larva chironomida berperan sebagai sumber makanan dan bahan pembuatan tubes. Tiga perlakuan bahan organik diamati pengaruhnya bagi pertumbuhan larva Chironomus sp. Berdasarkan data yang diambil setiap hari selama tiga minggu pada fase larva, diperoleh empat parameter pertumbuhan yakni panjang total, lebar badan, serta panjang dan lebar kapsul kepala.
dimasukkan ke dalam tabel rancangan acak lengkap. Pengujian dilakukan dengan
menggunakan tabel ‟Anova: single factor‟ pada perangkat lunak Ms. Excell. Berdasarkan tabel hasil pengujian rancangan acak lengkap untuk keempat parameter, yakni panjang total, lebar badan, serta panjang dan lebar kapsul kepala diperoleh nilai Ftabel<Fhitung. Keputusan yang dihasilkan adalah tolak H0, artinya
minimal ada satu perlakuan yang mempengaruhi pertumbuhan larva Chironomus sp. Hal ini menggambarkan bahwa bahan organik yang ditambahkankan pada wadah pemeliharan larva Chironomus sp. memberikan pengaruh bagi pertumbuhan larva tersebut.
4.1. Pembahasan
Larva, pupa, maupun chironomida dewasa membentuk bagian yang terintegrasi pada jaring-jaring makanan. Organisme ini berperan sebagai makanan bagi invertebrata yang lebih besar, ikan, amfibi maupun burung (Eppler 2001). Peran chironomida lainnya adalah sebagai bioindikator untuk memantau kondisi dan kesehatan suatu perairan. Beberapa genus dari subfamili chironomidae bersifat toleran terhadap kondisi lingkungan yang buruk. Selain itu, penggunaan chironomida dalam fungsi paleolimnologi juga mulai dikembangkan. Penggunaan analisis isotop terhadap sedimen memungkinkan rekonstruksi ulang beberapa hal di masa lampau seperti variasi fisik, iklim dan lingkungan. Hal ini dilakukan dengan menguji rekaman sedimen lewat penggunaan sisa-sisa biologis termasuk chironomida (Velle & Laroque 2007). Pengujian seringkali dilakukan dengan menggunakan kapsul kepala karena bagian kepala larva chironomida ini terbuat dari zat kitin yang bisa bertahan sangat lama di alam tanpa terdekomposisi. Oleh karena, itu dibutuhkan penelitian yang lebih spesifik mengenai chironomida untuk mengetahui seberapa besar potensinya dapat dimanfaatkan bagi kepentingan lingkungan dan manusia.
Chironomida memiliki empat fase metamorfosis. Fase pertama yakni fase telur, dimulai dari pemijahan dewasa yang pada sebagian besar spesies chironomida terjadi di udara dan di tanah untuk beberapa spesies. Selanjutnya chironomida meletakkan telurnya di permukaan air. Beberapa saat setelah peletakkan, telur akan dibungkus oleh struktur kompleks berupa gelatin. Massa telur kemudian tenggelam ke dasar perairan atau tersangkut di beberapa tumbuhan air yang tenggelam. Beberapa spesies chironomida, massa telurnya tetap mengapung di permukaan air dalam bentuk massa gelatin. Masing-masing massa telur berjumlah kurang dari 100 hingga 2000 telur bergantung pada spesies (Bay 2003). Telur-telur ini biasanya memerlukan waktu tetas sekitar 24 sampai 36 jam (Bay 2003) bahkan bisa mencapai 3 hari (Zilli et al. 2008). Sedangkan pada penelitian ini, telur membutuhkan waktu ±17 jam sejak pengambilan massa telur dari alam hingga menetas. Kemungkinan yang terjadi adalah massa telur telah diletakkan cukup lama oleh chironomida dewasa sehingga hanya memerlukan waktu kurang dari 24 jam untuk menetas.
Pemeliharaan chironomida setelah menetas dilakukan di wadah dengan perlakuan yang berbeda. Wadah tanpa penambahan bahan organik, wadah dengan penambahan bahan organik sebesar 0,5 mg/l, dan wadah dengan penambahan bahan organik 1,0 mg/l. Masing-masing perlakuan diulang sebanyak tiga kali dan bahan organik diduga berperan sebagai sumber makanan maupun bahan pembuat tubes bagi chironomida. Kotoran kuda kering adalah bahan organik yang digunakan dalam penelitian kali ini.
Selama penelitian berlangsung, parameter fisika kimia yang diamati antara lain suhu, pH, DO dan COD. Suhu yang teramati hanya berkisar antara 26,1-27,4 ºC. Suhu yang cenderung stabil disebabkan pemeliharaan yang dilakukan di laboratorium sehingga suhu air dalam wadah tidak terlalu dipengaruhi oleh suhu lingkungan. Begitu pula dengan nilai pH, berkisar antara 6,9-7,7. Nilai tersebut masih mendukung kehidupan biota air sehingga tidak terlalu berpengaruh terhadap kehidupan larva chironomida.
penambahan bahan organik karena tidak dilakukannya penambahan bahan organik sehingga oksigen yang terlarut di air tidak terlalu banyak dimanfaatkan untuk dekomposisi bahan organik. Kisaran ini menurun seiring penambahan kandungan bahan organik. Wadah perlakuan dengan penambahan bahan organik paling tinggi yakni 1,0 mg/l memiliki kisaran nilai DO yang paling kecil karena oksigen digunakan untuk proses dekomposisi (perombakan bahan organik). Sedangkan untuk nilai COD, kecenderungan nilainya hampir sama untuk setiap wadah perlakuan yakni rendah pada pengamatan awal, kemudian mengalami kenaikan hingga titik tertentu dan kembali turun hingga hari terakhir pengamatan. Hal ini disebabkan karena pada awal pengamatan, bahan organik belum begitu berpengaruh pada kondisi kualitas air pada wadah. Selanjutnya COD mengalami kenaikan karena bahan organik mulai mempengaruhi air dan kembali mengalami penurunan seiring pertumbuhan chironomida. Hal ini menjelaskan bahwa bahan organik digunakan oleh larva chironomida sebagai sumber makanan dan bahan pembuatan tubes.
Larva Chironomus sp. membutuhkan waktu ± 3 minggu untuk berubah menjadi pupa. Selama waktu tersebut, larva Chironomus sp. mengalami perubahan ukuran kapsul kepala sebanyak empat kali. Perubahan ukuran ini lebih dikenal dengan sebutan pergantian instar. Kapsul kepala merupakan satu-satunya bagian tubuh Chironomus sp. yang terbuat dari zat kitin. Oleh karena itu, perkembangan ukurannya tidak mengikuti layaknya perkembangan ukuran tubuh. Ukurannya hanya berubah sebanyak 4 kali dalam suatu kelompok selang per instar. Parameter yang biasa digunakan sebagai penentuan instar ini adalah panjang dan lebar kapsul kepala. Penelitian ini berpedoman pada Dettinger-Dettinger-Klemm (2003) untuk pengelompokan larva Chironomus sp. berdasarkan instar.
Pengelompokan berdasarkan instar terdiri dari 4. Hasil yang diperoleh menunjukkan bahwa larva Chironomus sp. yang ditemukan terdiri dari 4 instar untuk perlakuan dengan penambahan bahan organik. Sedangkan untuk perlakuan tanpa penambahan bahan organik hanya ditemukan larva instar I. Hal ini terjadi karena ketidaktersediaan bahan organik pada wadah perlakuan tanpa penambahan bahan organik sehingga pertumbuhan larva terhambat. Berdasarkan waktu capaian instar juga dapat dilihat pengaruh bahan organik bagi jangka waktu yang dibutuhkan untuk melewati satu instar. Perlakuan dengan kandungan bahan organik yang lebih tinggi menyebabkan larva Chironomus sp. lebih cepat mencapai instar IV. Namun membutuhkan jangka waktu yang lebih lama pada instar IV. Hal ini membuktikan bahwa penambahan bahan organik dapat meningkatkan pertumbuhan larva chironomida.
tanpa penambahan bahan organik tidak terjadi pertumbuhan. Larva Chironomus sp. hanya bertahan hingga selama lebih kurang satu minggu. Larva Chironomus sp. pada perlakuan tanpa penambahan bahan organik tidak tumbuh karena tidak tersedianya makanan sebagai sumber energi untuk melakukan proses metabolisme. Perbedaan pertumbuhan juga diperlihatkan pada uji rancangan acak lengkap. Berdasarkan uji Anova: Single factor (Lampiran 6), diperoleh hasil bahwa minimal ada satu perlakuan yang mempengaruhi pertumbuhan larva Chironomus sp. Hasil tersebut ditunjukkan pada empat parameter yang diuji yakni panjang total, lebar badan, serta panjang dan lebar kapsul kepala.
Berdasarkan hasil pengamatan di Danau Lido, keberadaan Keramba Jaring Apung memiliki dampak negatif, yaitu menambah masukan bahan organik ke Danau Lido yang bersumber dari pelet atau pakan buatan ikan budidaya. Dampak negatif ini dapat dikurangi dengan mempertimbangkan peran larva chironomida sebagai pakan alami ikan. Larva chironomida diharapkan dapat mengurangi pencemaran akibat masukan bahan. Berdasarkan hasil penelitian, diketahui kondisi perairan yang optimum bagi pertumbuhan maupun perkembangan larva Chironomus sp. sehingga dapat dilakukan optimalisasi larva chironomida sebagai pakan alami untuk mengurangi jumlah pakan buatan yang digunakan dalam budidaya ikan di Danau Lido.
5. KESIMPULAN DAN SARAN
5.1. Kesimpulan
Perlakuan dengan penambahan bahan organik 0,5 mg/l dan 1,0 mg/l menunjukkan pertumbuhan panjang hingga 3 minggu, sedangkan pada perlakuan tanpa penambahan bahan organik, kelangsungan hidup larva hanya mencapai 1 minggu dan instar pertama.
5.2. Saran
Penelitian akan menjadi lebih baik apabila pemeliharaan Chironomus sp. dapat dimulai dari fase pemijahan sehingga diperoleh informasi mengenai telur
PERTUMBUHAN DAN PERKEMBANGAN
LARVA
Chironomus
sp. PADA LEVEL BAHAN ORGANIK
BERBEDA DALAM SKALA LABORATORIUM
SITI ANINDITA FARHANI
SKRIPSI
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
Pertumbuhan dan Perkembangan Larva Chironomus sp. pada Level Bahan
Organik Berbeda dalam Skala Laboratorium
adalah benar merupakan hasil karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Januari 2012
RINGKASAN
Siti Anindita Farhani. C24070014. Pertumbuhan dan Perkembangan Larva
Chironomus sp. pada Level Bahan Organik Berbeda dalam Skala
Laboratorium. Di bawah bimbingan Majariana Krisanti dan Yusli Wardiatno.
Chironomida adalah salah satu serangga air yang memiliki beragam kegunaan. Chironomida pada stadia larva memiliki peran dalam jaring-jaring makanan yakni sebagai sumber pakan alami invertebrata lain, ikan, amfibi maupun burung. Larva chironomida juga dimanfaatkan sebagai bioindikator lingkungan. Beberapa spesies bersifat sensitif dan beberapa yang lain bersifat toleran terhadap kondisi kualitas air. Selain itu, peran larva chironomida yang tak kalah penting adalah dari aspek paleolimnologi. Larva chironomida mampu memberikan informasi mengenai keadaan iklim dan lingkungan pada masa lampau lewat penelitian yang terfokus pada kapsul kepala. Hal ini dapat dilakukan karena kapsul kepala larva chironomida terbuat dari zat kitin yang mampu bertahan untuk jangka waktu yang lama. Minimnya informasi mengenai larva chironomida seringkali diakibatkan karena sulitnya pengamatan yang dilakukan di alam. Oleh karena itu, penelitian ini dilaksanakan dalam skala laboratorium dengan melibatkan pengujian pengaruh bahan organik bagi pola perkembangan larva chironomida genus Chironomus sp.
Pengamatan dilakukan selama 3 minggu dengan tiga perlakuan yang berbeda terdiri dari perlakuan tanpa penambahan bahan organik, dan perlakuan dengan bahan organik konsentrasi 0,5 mg/l dan 1,0 mg/l. Berdasarkan penelitian, dapat dibuktikan bahwa larva Chironomus sp. bergantung pada bahan organik sebagai sumber makanan maupun bahan pembuatan tubes. Hal ini digambarkan oleh pertumbuhan larva yang lebih pesat pada wadah dengan penambahan bahan organik. Larva Chironomus sp. dapat tumbuh dengan baik pada wadah dengan bahan organik sedangkan pada wadah tanpa penambahan bahan organik, larva Chironomus sp. hanya mampu tumbuh hingga minggu pertama. Selain itu, larva pada perlakuan tanpa bahan organik hanya hidup pada stadia planktonik dan instar pertama.
i
PERTUMBUHAN DAN PERKEMBANGAN
LARVA
Chironomus
sp.
PADA LEVEL BAHAN ORGANIK
BERBEDA DALAM SKALA LABORATORIUM
SITI ANINDITA FARHANI C24070014
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN MANAJEMEN SUMBERDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
ii
PENGESAHAN SKRIPSI
Judul Skripsi : Pertumbuhan dan Perkembangan Larva Chironomus sp. pada Level Bahan Organik Berbeda dalam Skala Laboratorium
Nama Mahasiswa : Siti Anindita Farhani
NIM : C24070014
Program Studi : Manajemen Sumberdaya Perairan
Menyetujui,
Pembimbing I Pembimbing II
Majariana Krisanti, S.Pi, M.Si Dr. Ir. Yusli Wardiatno, M.Sc NIP. 19691031 199512 2 001 NIP. 19660728 199103 1 002
Mengetahui:
Ketua Departemen Manajemen Sumberdaya Perairan
Dr. Ir. Yusli Wardiatno, M.Sc NIP. 19660728 199103 1 002
iii
PRAKATA
Puji syukur atas nikmat Allah SWT, karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi ini dengan baik. Skripsi yang berjudul Pertumbuhan dan Perkembangan Larva Chironomus sp. pada Level Bahan
Organik Berbeda dalam Skala Laboratorium disusun berdasarkan kegiatan penelitian pada Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor yang dilaksanakan pada bulan Mei-Juli 2011.
Pada kesempatan ini tidak lupa penulis mengucapkan terima kasih yang sebesar-besarnya kepada Majariana Krisanti, S.Pi, M.Si selaku dosen pembimbing pertama dan Dr. Ir. Yusli Wardiatno, M.Sc selaku dosen pembimbing kedua serta Ir. Agustinus M. Samosir, M.Phil selaku Komisi Pendidikan S1 MSP yang telah banyak membantu dalam pemberian bimbingan, masukan, dan arahan sehingga penulis dapat menyelesaikan skripsi ini.
Penulis menyadari skripsi ini masih jauh dari sempurna dikarenakan keterbatasan pengetahuan penulis. Akan tetapi, skripsi ini diharapkan dapat memberikan masukan dan tambahan informasi bagi dunia akademis maupun penelitian-penelitian selanjutnya.
Bogor, Januari 2012
iv
UCAPAN TERIMA KASIH
1. Majariana Krisanti, S.Pi, M.Si dan Dr. Ir. Yusli Wardiatno, M.Sc, selaku komisi pembimbing yang telah memberikan arahan dan bimbingan selama penelitian hingga penyelesaian skripsi ini.
2. Dr. Ir. Luky Adrianto, M.Sc selaku dosen pembimbing akademik yang telah banyak memberikan nasihat dan bimbingan selama penulis menyelesaikan studi di Departemen Manajemen Sumberdaya Perairan, IPB.
3. Dr. Ir. Isdrajad Setyobudiandi, M.Sc dan Ir. Agustinus M. Samosir, M.Phil selaku dosen penguji tamu dan dari program studi yang telah memberikan masukan dan saran untuk penyempurnaan skripsi ini.
4. Staf dan karyawan Departemen Sumberdaya Perairan serta Fakultas Perikanan dan Ilmu Kelautan atas semua bantuannya.
5. Keluarga tercinta (Ayah, Mama, dan Nur Rafidah) dan Reiza Maulana Aditriawan yang telah memberikan dukungan penuh serta kasih sayang kepada penulis.
6. Ade Willy, Desnita, dan Hendry sebagai rekan satu penelitian di Danau Lido atas kerjasama dan dukungan selama penulis melaksanakan penelitian hingga penulisan skripsi.
7. Sahabat-sahabat tersayang (Dayu, Septi, Uswah, Wulan, Pipit, Dhila, Caca) atas bantuan dan dukungannya selama penulis menyelesaikan studi.
8. Tim Lido I (Ayu, Amanah, Ekie, Marthin, dan Arif) dan Kru Bimi (Dede, Nto, Nta, Ilman, Zulmi, Mega, Icha, Cmay,Furry, Rini, Ipul,) atas dukungannya. 9. Teman-teman MSP khususnya angkatan 44 serta 43, 45, dan 46 juga semua
v
RIWAYAT HIDUP
Penulis dilahirkan di Kota Jambi pada tanggal 1 Juni 1989 dari pasangan Bapak Marzuki Nurdin dan Ibu Zuleha Sy. Penulis merupakan putri pertama dari dua bersaudara. Pendidikan formal ditempuh di SDN 42/IV Kota Jambi, SMPN 7 Kota Jambi, dan SMAN 1 Kota Jambi. Pada tahun 2007 penulis diterima sebagai mahasiswa di Institut Pertanian Bogor melalui jalur penerimaan USMI. Setelah melewati tahap Tingkat Persiapan Bersama selama satu tahun, penulis masuk ke departemen Manajemen Sumberdaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.
Selama mengikuti perkuliahan penulis berkesempatan menjadi asisten mata kuliah Ekologi Perairan (2008 dan 2009), Limnologi (2009 dan 2010), dan Dinamika Populasi (2009). Selain itu penulis juga ikut serta pada kelembagaan mahasiswa yakni Dewan Perwakilan Mahasiswa Fakultas Perikanan dan Ilmu Kelautan.
Untuk menyelesaikan studi di Fakultas Perikanan dan Ilmu Kelautan, penulis melaksanakan penelitian yang berjudul “Pertumbuhan dan Perkembangan Larva Chironomus sp. pada Level Bahan Organik Berbeda
vi
3.3.1. Penentuan kohort melalui analisis distribusi
frekuensi panjang larva chironomida ... 14 3.3.2. Rancangan acak lengkap ... 15 3.3.2. Analisis kelompok ... 15 4. HASIL DAN PEMBAHASAN ... 17 4.1. Hasil ... 17 4.1.1. Deskripsi lokasi pengambilan massa telur dan penelitian ... 17 4.1.2. Larva chironomida ... 17 4.1.3. Perkembangan larva Chironomus sp. ... 19 4.1.4. Keadaan fisika kimia wadah pemeliharaan ... 20 4.1.5. Pengelompokan larva chironomida berdasarkan instar... 24 4.1.6. Penentuan kohort berdasarkan analisis distribusi frekuensi panjang
vii
4.1.7. Pengaruh perbedaan perlakuan bahan organik terhadap berbagai
parameter pertumbuhan ... 33 4.2. Pembahasan ... 34
viii
DAFTAR TABEL
Halaman 1. Metode dan alat yang digunakan pada pengukuran
parameter fisika-kimia perairan ... 13 2. Karakteristik ukuran larva Chironomus sp. berdasarkan instar ... 24 3. Karakteristik ukuran larva dan waktu capaian instar C. Calligraphus ... 27 4. Karakteristik ukuran larva dan waktu capaian instar berdasarkan
ix
DAFTAR GAMBAR
Halaman 1. Skema perumusan masalah mengenai pola pertumbuhan dan perkembangan
larva Chironomus sp. skala laboratorium ... 3 2. Wadah pemeliharaan larva chironomida skala laboratorium ... 11 3. Tampak atas posisi peletakkan kantung bahan organik pada wadah
pemeliharaan ... 11 4. Massa telur chironomida genus Chironomus sp. ... 17 5. Bagian kepala dari larva chironomida genus Chironomus sp. yang
memperlihatkan bagian mentum ... 18 6. Larva chironomida genus Chironomus sp. ... 19 7. Pupa Chironomus sp. ... 20 8. Nilai COD pada tiga perlakuan berbeda ... 20 9. Nilai suhu pada tiga perlakuan berbeda ... 22 10.Nilai pH pada tiga perlakuan berbeda ... 22 11.Nilai oksigen terlarut pada tiga perlakuan berbeda ... 23 12. Pengelompokan instar I larva Chironomus berdasarkan panjang total dan
lebar kapsul kepala pada wadah tanpa penambahan bahan organik ... 25 13.Tahap perkembangan larva Chironomus berdasarkan panjang total dan
lebar kapsul kepala perlakuan dengan penambahan bahan organik 0,5
mg/l dan 1,0 mg/l ... 26 14. Perbandingan kapsul kepala dan lebar badan setiap instar pada perlakuan
penambahan bahan organik 0,5 mg/l ... 29 15. Perbandingan kapsul kepala dan lebar badan setiap instar pada perlakuan
x
DAFTAR LAMPIRAN
1. PENDAHULUAN
1.1. Latar Belakang
Salah satu indikator biologi untuk kesehatan ekosistem perairan adalah larva chironomida (Carew et al. 2003). Chironomida atau yang biasa disebut
„non-biting midges‟ adalah lalat kecil mirip nyamuk yang mempunyai panjang yang bervariasi yakni 2-18 mm bergantung pada spesies. Kumpulan chironomida ini dapat dilihat pada subuh atau petang hari di kawasan dekat pinggiran danau dan hampir di semua tempat yang berdekatan dengan perairan terbuka baik yang stagnan maupun mengalir. Perbedaan chironomida dengan nyamuk adalah chironomida tidak menggigit dan tidak menjadi pembawa penyakit (Bay 2003).
Larva chironomida digunakan sebagai indikator lingkungan dan perubahan iklim karena sangat cepat merespon perubahan kondisi perairan (Walkel 2001 in Heinrich et al.2006). Selain itu larva chironomida memiliki manfaat yang sangat besar pada jaring-jaring makanan di lingkungan akuatik, yakni sebagai pakan alami ikan dan membantu membongkar sedimen-sedimen organik (Bay 2003). Sementara itu, di Indonesia belum banyak penelitian yang dilakukan untuk mengembangkan potensi biota akuatik yang satu ini padahal insekta ini memiliki distribusi yang sangat luas di lingkungan air tawar. Chironomida dapat tumbuh dan berkembang pada perairan yang telah terkontaminasi misalnya kolam stabilisasi limbah di mana larva chironomida menjadi makroinvertebrata yang mendominasi (Winner et al. 1980 in Halpern et al. 2002).
telur di permukaan air yang nantinya akan tenggelam ke dasar maupun tersangkut di bagian tumbuhan yang bersifat subemerged menjadi penyebab sulitnya kuantifikasi chironomida. Oleh karena itu, digunakan metode pengamatan skala laboratorium untuk mengatasi kesulitan tersebut.
Pengetahuan ini dapat digunakan sebagai dasar kegiatan perbanyakan larva chironomida yang diharapkan dapat menguntungkan secara ekologis maupun ekonomis, yakni sebagai indikator lingkungan dan budidaya pakan alami. Kebutuhan informasi mengenai pola pertumbuhan dan perkembangan biota ini sebagai dasar dari penelitian-penelitian lain untuk mengembangkan potensi chironomida baik dengan tujuan ekologis maupun ekonomis melatarbelakangi penelitian yang dilakukan.
1.2. Perumusan Masalah
1.3. Tujuan
Penelitian ini bertujuan untuk mengetahui pola perkembangan dan pertumbuhan larva chironomida khususnya genus Chironomus sp. yang ditumbuhkan di laboratorium pada level bahan organik yang berbeda.
1.4. Manfaat
Hasil penelitian diharapkan dapat memberikan informasi mengenai dinamika populasi larva Chironomus sp. yang mencakup pola perkembangan dan pertumbuhan pada lingkungan buatan. Selanjutnya hasil penelitian dapat dijadikan rujukan dan masukan bagi penelitian lain mengenai larva chironomida terkait dengan potensi pengembangan budidaya larva ini sebagai pakan alami ikan maupun pemanfaatan chironomida sebagai bioindikator dan aspek paleolimnologi.
Gambar 1. Skema perumusan masalah mengenai pola pertumbuhan dan perkembangan larva Chironomus sp. skala laboratorium
Perkembangan ukuran larva Chironomus sp.
Pola pertumbuhan dan perkembangan Chironomus sp. pada lingkungan buatan
Larva Chironomus sp.
Kualitas air Bahan organik
+
2. TINJAUAN PUSTAKA
2.1. Chironomida
Organisme akuatik yang seringkali mendominasi dan banyak ditemukan di lingkungan perairan adalah larva serangga air. Salah satu larva serangga air yang dapat ditemukan sebagai benthos adalah Ordo Diptera dari Famili Chironomidae. Kebanyakan spesies anggota chironomida ini memiliki kebiasaan hidup meliang pada sedimen yang lunak pada fase larva. Larva akan berkembang menjadi pupa setelah ± 1 bulan untuk daerah tropis. Pupa selanjutnya akan berkembang menjadi chironomida dewasa. Setelah melakukan pemijahan, chironomida dewasa akan meletakkan telurnya di permukaan air dalam bentuk gelatin yang kompleks. Telur-telur ini selanjutnya akan tenggelam dan menetap pada sedimen maupun tanaman air dan benda-benda lain yang tenggelam.
Chironomida adalah serangga kecil yang mirip nyamuk, memiliki variasi panjang tubuh mulai dari 2 hingga 18 milimeter bergantung pada masing-masing spesies. Warnanya pun juga bervariasi sesuai spesies, berkisar dari yang benar-benar terang, hijau pucat hingga hampir mendekati hitam pekat. Ratusan spesies chironomida tersebar luas di dunia, dan spesies-spesies yang berbeda mendominasi populasi-populasi tertentu di tempat-tempat yang berdekatan dengan danau, kolam, atau aliran sungai. Tidak seperti larva nyamuk, yang sebagian besar hidupnya berada di permukaan air dengan tujuan untuk bernafas, larva chironomida hidup di dasar atau pada tanaman dan benda-benda tenggelam lainnya.
2.2. Parameter Fisika dan Kimia Tempat Hidup
Kualitas air terdiri dari keseluruhan faktor fisika, kimia, dan biologi yang mempengaruhi pemanfaatan suatu perairan (Boyd 1998). Karakteristik dari suatu perairan akan mempengaruhi ketahanan hidup, reproduksi, pertumbuhan, termasuk manajemen pengelolaan perikanan. Oleh karena itu, aspek kualitas air menjadi fokus perhatian sebelum dilakukan pemanfaatan dari perairan itu sendiri. Parameter fisika yang diamati pada penelitian ini adalah suhu sedangkan parameter kimia yang diamati adalah pH, oksigen terlarut, dan COD.
2.2.1. Suhu
Suhu adalah suatu ukuran dari energi kinetik rata-rata dari molekul-molekul, dengan suhu yang lebih tinggi aksi molekul meningkatkan tekanan dan menyebabkan mengembangnya material (Odum 1992). Suhu menjadi parameter penting dalam perairan dan berpengaruh secara langsung maupun tidak langsung terhadap kehidupan di perairan. Suhu disebutkan memberikan pengaruh bagi proses kimia maupun biologi di perairan. Secara umum, tingkat reaksi kimia dan biologi meningkat menjadi dua kali lipat untuk setiap kenaikan suhu sebesar 100C. Hal ini menunjukkan bahwa organisme akuatik menggunakan oksigen terlarut dua kali lebih banyak untuk suhu 30 ºC dibandingkan suhu 20 ºC, dan reaksi kimia menunjukkan kemajuan dua kali lebih cepat pada suhu 30 ºC dibandingkan suhu 20 ºC (Boyd 1998).
Thompson (1942) dan Johnson et al. (1942) in Odum (1992) menunjukkan banyak proses dengan kurva respons terhadap suhu yang menyerupai bentuk punuk (hump-shaped). Berdasarkan hal tersebut, proses-proses mencapai maksimum pada suhu menengah. Peningkatan suhu juga menyebabkan terjadinya peningkatan dekomposisi bahan organik oleh mikroba, dengan kata lain banyak proses yang berjalan maksimum saat suhu optimum.
dengan oksigen terlarut yang merupakan faktor pembatas bagi kehidupan chironomida.
2.2.2. Oksigen terlarut
Oksigen adalah salah satu elemen yang dapat ditemukan dalam banyak bentuk di lingkungan alami termasuk badan air. Bentuk pradominan di atmosfer adalah gas oksigen, yakni lebih kurang 21% dari keseluruhan gas-gas di atmosfer. Oksigen juga ditemukan berikatan dengan elemen-elemen lainnya. Oksigen sebagai komponen mayor bahan organik dan secara biologi relevan dengan komponen-komponen anorganik (Kodds 2002).
Jumlah oksigen yang terlarut di perairan adalah fungsi dari banyak faktor, termasuk tingkat aktivitas metabolisme. Fotosintesis adalah salah satu sumber terbesar penghasil oksigen. Cahaya, suhu, dan nutrien adalah pengontrol proses fotosintesis. Sementara itu, aktivitas respirasi adalah salah satu pemakai terbesar dari oksigen di perairan. Volume dari oksigen terlarut di suatu perairan pada waktu tertentu dipengaruhi oleh beberapa hal antara lain: suhu badan air, tekanan parsial gas di atmosfer yang berhubungan langsung dengan air, serta konsentrasi dari salinitas (garam-garaman), khusus untuk air laut.
Oksigen terlarut adalah faktor pembatas yang sangat penting di habitat danau. Nilai dari oksigen terlarut ini berkaitan langsung dengan suhu karena tingkat atau persentase saturasi dari oksigen dipengaruhi oleh suhu perairan. Ketersediaan oksigen adalah salah satu variabel yang memiliki pengaruh langsung bagi distribusi larva chironomida (Jo ´nasson, 1972, 1984; Heinis & Davids, 1993; Hamburger 1998 in Brodersen et al. 2008). Hal ini membuktikan bahwa oksigen sangat berpengaruh dan menjadi salah satu faktor pembatas bagi kehidupan chironomida.
2.2.3. Chemical Oxygen Demand (COD)
COD menggambarkan besarnya bahan organik yang dioksidasi dengan agen pengoksidasi kuat seperti K2Cr2O7 (Nemerow 1991). Perbedaan utama
melainkan secara kimia. Oleh karena itu, nilai COD besarnya sama atau lebih besar dari nilai BOD. Pengukuran COD untuk memperkirakan nilai oksigen ekuivalen dari bahan organik pada air yang dirasa tercemar yang dapat dioksidasi secara kimiawi dengan menggunakan dikromat dalam larutan asam (Metcalf & Eddy 2004).
COD diukur dengan mengkonversi semua bahan organik pada air contoh menjadi karbondioksida dan air melalui proses oksidasi dengan melibatkan potassium dikromat dan asam sulfat (Boyd 1998). Sumber dari bahan organik ini biasanya berasal dari alam maupun aktivitas rumah tangga dan industri. Perairan yang memiliki nilai COD tinggi tidak diinginkan bagi kepentingan perikanan dan pertanian.
2.2.4. pH
Konsentrasi ion hidrogen adalah salah satu parameter kualitas air yang sangat penting baik untuk perairan alami maupun air limbah. Definisi yang biasanya digunakan untuk menyatakan konsentrasi hidrogen adalah pH, yang didefinisikan sebagai logaritma negatif dari konsentrasi ion hidrogen. Kisaran konsentrasi pH bagi keberadaan hampir semua kehidupan biologi biasanya sangat sempit dan kritis (6-9) (Metcalf & Eddy 2004).
Alat yang umumnya digunakan dalam pengukuran pH adalah pH-meter. Selain itu, juga ada berbagai variasi dari kertas pH dan larutan indikator yang mengalami perubahan warna untuk mengukur nilai pH suatu perairan. Pengukuran pH dilakukan dengan membandingkan warna dari kertas atau larutan dengan seri warna standar yang telah ditetapkan.
2.2.5. Bahan organik