MELALUI IRADIASI SINAR GAMMA SECARA IN VITRO
UNTUK MEMPEROLEH KLON KRISAN BARU
OLEH: EKA NOVITA SARI
A24051815
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
EKA NOVITA SARI. Induksi Keragaman Somaklonal Beberapa Kultivar Krisan (Dendrathema grandiflora Tzvelev.) melalui Radiasi Sinar Gamma secara In Vitro untuk Memperoleh Klon Krisan Baru. Dibimbing oleh (NURHAYATI ANSORI MATTJIK).
Penelitian ini bertujuan untuk mempelajari pengaruh dari iradiasi sinar gamma terhadap variasi genetik tanaman krisan dalam kultur in vitro, untuk mengetahui dosis sinar gamma yang optimum untuk menginduksi variasi somaklonal pada empat varietas krisan, untuk membandingkan ketahanan tanaman terhadap sinar gamma di antara empat kultivar krisan, dan untuk mengetahui interaksi antara kedua faktor, yaitu faktor kultivar dan dosis sinar gamma.
Penelitian ini dilaksanakan dari bulan April-Agustus 2009 di Laboratorium Bioteknologi Departemen Agronomi dan Hortikultura IPB. Percobaan menggunakan rancangan faktorial acak kelompok dengan dua faktor. Faktor pertama yaitu kultivar krisan yang terdiri atas Puspita Nusantara, Puspita Asri, Cut Nyak Dien, dan Dewi Ratih. Faktor kedua adalah dosis sinar gamma, yaitu 0, 0.5, 1, 1.5, dan 2 krad yang diulang sebanyak 5 kali. Pertumbuhan terbaik terdapat pada krisan kultivar Puspita Nusantara pada dosis 0 krad. Dosis 0.5 krad atau lebih dapat menginduksi keragaman somaklonal kultivar Puspita Nusantara, Puspita Asri, Cut Nyak Dien, dan Dewi Ratih. Dosis sinar gamma secara nyata menghambat pertumbuhan jumlah daun, namun tidak berpengaruh nyata terhadap jumlah tunas dan tinggi tanaman. Nilai LD50 masing-masing kultivar melebihi
MELALUI IRADIASI SINAR GAMMA SECARA IN VITRO
UNTUK MEMPEROLEH KLON KRISAN BARU
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
OLEH: EKA NOVITA SARI
A24051815
DEPARTEMEN AGRONOMI DAN HORTIKULTURA FAKULTAS PERTANIAN
(DENDRATHEMA GRANDIFLORA TZVELEV.) MELALUI RADIASI SINAR GAMMA SECARA
IN VITRO UNTUK MEMPEROLEH KLON
KRISAN BARU Nama Mahasiswa : Eka Novita Sari Nomor Pokok : A24051815
Menyetujui, Dosen Pembimbing
Prof. Dr. Ir. Nurhayati A. Mattjik, M.S NIP. 19460807 197303 2 001
Mengetahui, Ketua Departemen
Dr. Ir. Agus Purwito, M.Sc.Agr NIP. 19611101 198703 1 003
Penulis dilahirkan di Gresik pada tanggal 17 November 1989 dan merupakan anak pertama dari pasangan Sugiarto dan Titik Setyowati.
Tahun 2001 penulis lulus dari SDN 029 Jenebora, Kalimantan Timur, kemudian pada tahun 2003 telah menyelesaikan studi di SLTP Negeri 1 Balikpapan, Kalimantan Timur melalui program akselerasi (program 2 tahun). Selanjutnya penulis lulus dari SMA International Islamic Boarding School pada tahun 2005 juga melalui program akselerasi.
Pada tahun 2005 penulis diterima di Institut Pertanian Bogor melalui jalur SPMB (Seleksi Penerimaan Mahasiswa Baru), selanjutnya tahun 2006 penulis diterima sebagai mahasiswa di Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
Puji dan syukur selalu kami panjatkan kepada Allah SWT yang telah memberikan Rahmat dan Ridha-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Induksi Keragaman Somaklonal Beberapa Kultivar Krisan (Dendrathema grandiflora Tzvelev.) melalui Radiasi Sinar Gamma secara In Vitro untuk Memperoleh Klon Krisan Baru”. Skripsi ini merupakan salah satu syarat kelulusan Sarjana Pertanian pada Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Rasa hormat, ucapan terima kasih dan penghargaan yang sebesar-besarnya penulis persembahkan kepada Prof. Dr. Ir. Nurhajati A. Mattjik, MS. selaku dosen pembimbing skripsi yang senantiasa memberikan bimbingan, arahan, saran, serta nasehat selama ini. Ucapan terima kasih penulis kepada Dosen Penguji, yaitu Dr. Dewi Sukma, SP. M.Si. dan Ir. Megayani, M.Si., yang telah bersedia meluangkan waktu dan perhatiannya untuk mengoreksi dan memberikan saran terhadap skripsi ini.
Pada kesempatan ini penulis mengucapkan banyak terima kasih kepada pihak-pihak yang telah banyak membantu penulis selama penyusunan dan penyelesaikan skripsi ini, yaitu:
1. Keluargaku, Sugiarto (bapak) dan Titik Setyowati (mama), yang senantiasa memberikan perhatian, dorongan, semangat, dukungan moril dan materi kepada penulis.
2. Kawan-kawan sekelas, yaitu Rifqi, Warno, Rofiq, Hafith, Dial, Estherlina, Feni, Kaka dan Anton. Rekan seperjuangan se-pembimbing; Ester, Hila dan Neneng. Terima kasih juga kepada Henmen atas dukungan dan semangatnya. 3. Staf Tata Usaha, Staf Laboratorium Kultur Jaringan, dan Staf Laboratorium
Fisiologi Tanaman (Bu Juju, Teh Iif, Pak Joko, Bu Fury, Pak Wasta, Pak Qohar, Pak Udin, dan lainnya).
5. Seluruh pihak yang telah membantu dalam penyusunan skripsi ini, namun tidak dapat disebutkan satu persatu, terima kasih banyak.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi semua pihak. Akhir kata penulis mengucapkan terima kasih kepada semua pihak yang telah membantu penulis dalam menyelesaikan skripsi ini, semoga Allah SWT membalas semuanya.
Bogor, Juni 2011
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 4
Hipotesis ... 4
TINJAUAN PUSTAKA ... 5
Potensi Tanaman Krisan ... 5
Syarat Tumbuh Tanaman Krisan ... 6
Keragaman Somaklonal ... 8
Induksi Mutasi ... 9
Induksi Mutasi Tanaman Krisan ... 11
BAHAN DAN METODE ... 13
Waktu dan Tempat ... 13
Bahan dan Alat ... 13
Metode Percobaan ... 13
Pelaksanaan Percobaan ... 14
HASIL DAN PEMBAHASAN ... 17
Kondisi Umum Percobaan ... 17
Persentase Tanaman Hidup ... 20
Lethal Dosis 50 ... 22
Tinggi Tunas ... 25
Jumlah Daun ... 26
Jumlah Kromosom ... 29
KESIMPULAN DAN SARAN ... 32
DAFTAR PUSTAKA ... 33
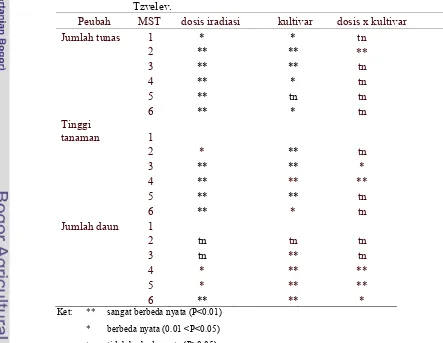
Nomor Halaman 1. Rekapitulasi Hasil Uji F Pengaruh Kultivar dan Iradiasi Sinar
Gamma terhadap Peubah Kuantitatif Dendrathema
grandiflora Tzvelev. ... 18
2. Persentase Tunas Hidup pada Berbagai Dosis Radiasi ... 20
3. Pengaruh Radiasi Sinar Gamma dan Kultivar terhadap Rata-Rata Jumlah Tunas In Vitro ... 21
4. Persamaan dan LD50 Masing-Masing Kultivar ... 22
5. Pengaruh Dosis dan Kultivar terhadap Tinggi Planlet Krisan ... 25
6. Pengaruh Dosis dan Kultivar terhadap Jumlah Daun Krisan ... 27
7. Pengaruh Interaksi Dosis Iradiasi Sinar Gamma dan Kultivar Krisan terhadap Peubah Jumlah Daun ... 28
Nomor Halaman 1. Eksplan Kultivar Puspita Nusantara yang Berkalus pada
Pangkal Batangnya ... 18
2. Penampilan Planlet Kontrol Dendrathema grandiflora
Tzvelev. dan Planlet yang Diradiasi dengan Sinar Gamma ... 19
3. Kurva Persentase Tunas Hidup Krisan Kultivar Puspita
Nusantara setelah Iradiasi ... 22
4. Kurva Persentase Tunas Hidup Krisan Kultivar Puspita Asri
setelah Iradiasi ... 23
5. Kurva Persentase Tunas Hidup Krisan Kultivar Cut Nyak
Dien setelah Iradiasi ... 23
6. Kurva Persentase Tunas Hidup Krisan Kultivar Dewi Ratih
setelah Iradiasi ... 24
7. Grafik Analisis Regresi Pengaruh Dosis Radiasi terhadap
Peubah Jumlah Daun ... 28
Nomor Halaman 1. Sidik Ragam Peubah Jumlah Tunas Hidup. ... 18
2. Sidik Ragam Peubah Jumlah Tinggi Tanaman ... 20
PENDAHULUAN
Latar Belakang
Perkembangan bisnis tanaman hias telah berkembang dengan pesat dalam
beberapa dekade terakhir ini yang disebabkan oleh meningkatnya daya beli dan
kesejahteraan masyarakat sehingga preferensi untuk memenuhi kebutuhan
kepuasan akan keindahan dengan tanaman hias lebih tinggi. Salah satu tanaman
hias yang cukup populer di Indonesia bahkan pasar internasional adalah krisan
(Dendrathema grandiflora Tzvelev).
Krisan telah dikenal lama sebagai tanaman hias di dataran tinggi dan
industri komersialnya mulai menggeliat pada awal 1990 (Wuryaningsih, 2008).
Data statistik produktivitas tanaman krisan dalam 5 tahun terakhir menunjukkan
angka yang terus meningkat, pada tahun 2005 produksinya mencapai 47,465,794
tangkai, tahun 2006 berjumlah 63,716,256 tangkai, pada tahun 2007 sebanyak
66,979,260 tangkai, pada tahun 2008 berjumlah 99,158,942 tangkai, pada tahun
2009 sebanyak 107,847,072 tangkai, pada tahun 2010 mencapai 120,485,784
tangkai, dan akan terus meningkat setiap tahunnya (BPS, 2011). Pasar-pasar
potensial tanaman krisan antara lain Jerman, Inggris, Swiss, Italia, Austria,
Amerika Serikat, Swedia, dan masih banyak negara lainnya. Peningkatan produksi
krisan ini mencerminkan peningkatan konsumsi krisan sehingga metode-metode
untuk mengembangkan krisan harus pula ditingkatkan. Berdasarkan analisis
perkembangan tanaman hias tahun 2001, 2002 dan tahun 2003 tanaman hias
krisan mempunyai nilai rata–rata skor terbesar yaitu 16,66 untuk luas panen,
produksi, produktivitas dan potensi ekspor, selanjutnya diikuti oleh anggrek 16,33,
mawar 15,33 dan sedap malam 14,00 (Wuryaningsih, 2008).
Lebih dari 700 kultivar tanaman krisan tersedia di dunia, dan yang menjadi
mata dagangan ada sekitar 250 kultivar (Horst, 1990) dan Wuryaningsih (2008)
menambahkan bahwa dari sekitar itu, di Indonesia kultivar yang komersial kurang
dari 20. Selama ini kultivar-kultivar yang telah komersil di Indonesia merupakan
kultivar yang berasal dari luar negeri, sehingga pengembangan kultivar dari dalam
negeri sendiri perlu ditingkatkan sehingga dapat dihasilkan kultivar-kultivar yang
Penelitian-penelitian tentang pemuliaan tanaman perlu ditingkatkan guna menghasilkan
kultivar-kultivar komersil baru sehingga konsumen tidak jenuh dengan model
krisan yang sedikit jumlahnya. Pemuliaan secara konvensional memiliki kendala
pada waktu, yaitu membutuhkan waktu yang lama, sehingga salah satu metode
pemuliaan yang dapat ditempuh adalah dengan jalan mutasi. Terdapat tiga macam
mutagen, yaitu mutage biologi, mutagen fisik, dan mutagen kimia, namun di
antara beberapa macam mutagen tersebut mutage fisik lah yang paling
menguntungkan karena mudah diaplikasikan dengan penetrasi serta frekuensi
mutasinya tinggi (Broertjes dan Van Harten, 1988). Salah satu jenis mutagen fisik
yang banyak digunakan adalah sinar gamma.
Teknologi mutasi dapat memperluas keragaman genetik suatu tanaman
dan mutan baru akan didapatkan dalam waktu yang singkat, selain itu teknologi
ini dapat mengubah susunan makhluk hidup sampai ke tingkat kromosom.
Van Harten (2002) mengungkapkan bahwa dengan perlakuan mutasi 55%
terjadi perubahan warna bunga, 15% perubahan morfologi bunga pada hampir 20
tanaman. Menurut Evans dan Sharp (1986), salah satu aspek pemanfaatan teknik
in vitro adalah untuk meningkatkan keragaman genetik tanaman melalui pembentukan keragaman somaklonal. Keragaman somaklonal terjadi karena
mutasi genetik, perubahan epigenetik, atau kombinasi kedua proses tersebut
(Larkin dan Scowcroft, 1981).
Pada tanaman Vitis venifera, pemberian sinar gamma dengan dosis 5
sampai 100 Gy dapat meningkatkan kalus embriogenik sebanyak 7.6% (Valeria et
al, 1997). Mutasi pada tanaman mawar ditandai dengan perubahan tipe bunga,
warna, ukuran, jumlah petal serta perubahan bentuk dan warna daun (Ibrahim,
1998). Perubahan warna bunga juga terjadi pada mutan gloxinia (Lertphanichkul
et al., 2003), sedangkan pada gladiol, iradiasi berpengaruh nyata terhadap
pertumbuhan akar dan tunas serta keragaman warna bunga (Cantor et al., 2002)
Iradiasi tanaman krisan dilakukan dalam penelitian ini untuk menginduksi
keragaman somaklonal dari empat kultivar krisan. Sumber iradiasi yang akan
digunakan adalah sinar gamma. Dosis sinar gamma yang diberikan diharapkan
ditentukan dosis yang optimal untuk menginduksi keragaman tanaman krisan
pada beberapa kultivar yang akan diteliti.
Dalam penelitian ini juga akan menggunakan teknik analisis kromosom.
Analisis ini digunakan untuk mendeteksi terjadinya mutasi pada tingkat
Tujuan
1. Untuk mengetahui dosis sinar gamma yang optimum untuk menghasilkan
keragaman somaklonal pada empat kultivar krisan.
2. Untuk membandingkan kultivar yang paling tahan terhadap iradiasi sinar
gamma.
3. Untuk mengetahui interaksi antara kultivar dan dosis sinar gamma yang
diberikan.
4. Untuk mengetahui nilai LD50 masing-masing kultivar.
Hipotesis
1. Akan diperoleh dosis sinar gamma yang baik dan tepat untuk
menghasilkan keragaman somaklonal pada empat kultivar krisan.
2. Diketahui ada kultivar yang menghasilkan keragaman somaklonal.
TINJAUAN PUSTAKA
Potensi Tanaman Krisan
Krisan (Dendrathema grandiflora Tzvelev.) merupakan salah satu jenis
tanaman hias yang memiliki nilai ekonomi tinggi dan merupakan komoditas
andalan dalam industri florikultura di Indonesia (Wuryaningsih, 2008). Tanaman
ini diperkirakan berasal dari Asia Timur, tepatnya di daratan Cina (Puslitbanghort,
2006). Belum ditemukan data atau informasi yang pasti tentang kapan tanaman
krisan masuk ke wilayah Indonesia, namun beberapa literatur menunjukkan
sekitar tahun 1800 krisan mulai di tanam di Indonesia dan sejak tahun 1940 krisan
mulai dibudidayakan secara komersial sebagai tanaman hias. Beberapa sentra
produksi tanaman hias krisan di antaranya adalah Cipanas (Cianjur), Sukabumi,
Lembang (Bandung), Bandungan (Jawa Tengah), Malang (Jawa Timur), dan
Berastagi (Sumatera Utara) (Puslitbanghort, 2006). Pada saat ini krisan telah
dibudidayakan di daerah-daerah lain, seperti NTB, Bali, Sulawesi Utara, dan
Sumatera Selatan.
Produksi tanaman hias setiap tahunnya mengalami peningkatan dari tahun
ke tahun, pada tahun 2005 produksinya mencapai 47,465,794 tangkai, tahun 2006
berjumlah 63,716,256 tangkai, pada tahun 2007 sebanyak 66,979,260 tangkai,
pada tahun 2008 berjumlah 99,158,942 tangkai, pada tahun 2009 sebanyak
107,847,072 tangkai, pada tahun 2010 mencapai 120,485,784 tangkai, dan akan
terus meningkat setiap tahunnya (BPS, 2011). Sihombing dan Rahayuningsih
(2004) menambahkan perkiraan peluang ekspor dunia untuk florikultura pada
tahun 2007 mencapai US$ 120 milyar. Negara-negara yang menjadi pasar
petensial tersebut, yaitu Jerman, Inggris, Swiss, Italia, Austria, Amerika Serikat,
Swedia, dan masih banyak negara lainnya. Fenomena ini menunjukkan bahwa
Indonesia berpeluang mengembangkan usaha tani krisan, baik untuk memenuhi
kebutuhan pasar dalam negeri maupun untuk diekspor ke pasar internasional
(Reginawanti, 1999). Analisis perkembangan tanaman hias tahun 2001, 2002 dan
tahun 2003 menghasilkan tanaman hias krisan mempunyai nilai rata–rata skor
selanjutnya diikuti oleh anggrek 16.33, mawar 15.33 dan sedap malam 14.00
(Wuryaningsih, 2008).
Syarat Tumbuh Tanaman Krisan
Krisan umumnya dibudidayakan dan tumbuh baik di dataran medium
sampai tinggi pada kisaran 650 hingga 1,200 meter di atas permukaan laut
(Puslitbanghort, 2006). Budidaya krisan di Indonesia umumnya dilakukan di
dalam rumah terlindung yang dapat berupa rumah kaca atau rumah plastik
(Puslitbanghort, 2006). tanaman krisan di dalam rumah terlindung ditanam pada
bedengan dengan jarak tanam tertentu. Tanaman krisan tumbuh baik di tanah
bertekstur liat berpasir, dengan kerapatan jenis 0.2-0.8 g/cm3 (berat kering), total
porositas 50-75%, kandungan air 50-70%, kandungan udara dalam pori 10-20%,
kandungan garam terlarut 1-1.25 dS/m2 dan kisaran pH sekitar 5.5-6.5
(International Chrysanthemum Society, 2002). Kondisi ini dapat dicapai dengan memodifikasi media tumbuh dalam bedengan atau pot. Putrasamedja dan
Sutapraja (1989) mengemukakan bahwa media tumbuh yang baik berupa
campuran tanah, humus bambu, dan pupuk kandang (1:1:1). Wuryaningsih et al.
(2002) menambahkan tanaman krisan dapat tumbuh dengan baik dalam campuran
media tanpa tanah zeolit dan sabut kelapa, karena diduga erat kaitannya dengan
ketersediaan air, unsur hara dan kapasitas tukar kation. Serbuk sabut kelapa
mempunyai daya menyimpan air yang sangat baik, yaitu 6-8 kali dari berat media
serta mengandung unsur-unsur yang diperlukan tanaman seperti N, P, Ca dan Mg
meskipun dalam jumlah yang sangat kecil (Ketaren dan Djatmiko, 1981).
Kapasitas memegang air yang tinggi sangat penting bagi retensi yang lebih dalam
terhadap kelembaban tanah untuk menghindari kekeringan (Singarium, 1994).
Krisan merupakan tanaman subtropis, sehingga dalam budidayanya
dilakukan secara khusus, yaitu memerlukan perlakuan panjang hari yang
berhubungan dengan fotoperiodisme. Tanaman krisan memerlukan perlakuan hari
panjang (penyinaran lebih lama dari batas kritis) ketika berada dalam fase
vegetatif dan perlakuan hari pendek (penyinaran lebih pendek dari batas kritis)
saat fase generatif. Batas kritis panjang hari (Critical Daylength-CDL) krisan
diberi pencahayaan melebihi batas kritisnya untuk mengoptimalkan pertumbuhan
vegetatifnya. Hal ini dilakukan apabila produk yang diinginkan adalah berupa
bibit. Sebaliknya untuk menginduksi pembungaan atau pertumbuhan generatif,
pencahayaan dilakukan kurang dari atau sama dengan batas kritisnya. Cara ini
dilakukan apabila produk akhir yang akan dicapai berupa tanaman krisan
berbunga. Krisantini (1989) menambahkan bahwa tanaman untuk produksi bunga
potong di daerah tropis diberi perlakuan hari panjang minimal 14,5 jam per hari
dan suhu malam rendah (15,50C) untuk merangsang pertumbuhan dan mencapai
panjang batang tertentu sebelum pembungaan.
Langton (1987) mengemukaan lebih lanjut bahwa kepekaan krisan
terhadap panjang hari tidak tetap. Pengaruh panjang hari terhadap fisiologi
pembungaan krisan sering kali berinteraksi dengan suhu harian. Pada kondisi hari
panjang dengan suhu siang hari sekitar 220C dan 160C pada malam hari,
penambahan tinggi tanaman dan pembentukan tunas berjalan optimal
(Puslitbanghort, 2006). Induksi ke fase generatif akan terjadi apabila suhu pada
siang hari turun kurang dari 180C (Lint dan Heij, 1987) dan suhu malam naik
hingga lenih dari 250C (Wilkins et al., 1990).
Kualitas cahaya mempengaruhi pertumbuhan dan perkembangan tanaman
krisan selain suhu dan panjang hari. Harjadi (1989) mengemukakan bahwa
kondisi hari panjang dan hari pendek pada tanaman dapat diubah oleh pigmen
biru yang bernama fitokrom. Pigmen inilah yang diduga bekerja seperti enzim
yang menyebabkan fotoperiodisme. Fitokrom berupa protein warna yang larut
dalam air terdapat dalam dua bentuk yang berbeda, yaitu Pr dengan daya absorbs
maksimal pada panjang gelombang merah (maksimal 660 nm) dan Pfr dengan
daya absorbs maksimal pada panjang gelombang merah panjang (maksimal 730
nm). Cahaya merah panjang akan merubah fitokrom dari bentuk Pfr menjadi Pr
yang menyebabkan turunnya persentase Pfr dan memberikan efek hari pendek,
sebaliknya cahaya merah akan mengubah Pr menjadi Pfr sehingga menaikkan Pfr
mencapai 88% yang akan memberikan efek hari panjang (Salisbury dan Ross,
1995).
Hal yang juga berpengaruh terhadap pertumbuhan bunga krisan adalah
pertumbuhan untuk pembentukan akar (Puslitbanghort, 2006). Mortensen (2000)
mengemukakan bahwa pertumbuhan optimal pada tanaman dewasa dicapai pada
kelembaban udara sekitar 70-85%. Maaswinkel dan Sulyo (2004) menyatakan
bahwa evapotranspirasi pada tanaman krisan pada saat matahari penuh (musim
kemarau) dapat mencapai 5-7 L/m2/hari. Evapotranspirasi maksimum ini tercatat
pada saat tanaman mencapai tinggi sekitar 25 cm pada bedengan.
Keragaman Somaklonal
Studi keragaman genetik pada prinsipnya bertujuan untuk mengkaji
komposisi genetik individu di dalam atau antar populasi. Keragaman genetik
dapat terjadi karena adanya perubahan susunan sejumlah rantai nukleotida DNA
(Syafni, 2006).
Keragaman somaklonal adalah keragaman genetik dari tanaman yang
dihasilkan melalui teknik kultur jaringan dan dapat diwariskan pada progeni
tanaman hasil regenerasi (Larkin dan Scocroft, 1981).
Keragaman somaklonal dapat diperoleh dengan cara regenerasi langsung,
kultur sel tunggal, atau kultur protoplas. Kultur sel tunggal atau kultur protoplas
merupakan metode yang baik untuk mendapatkan keragaman, namun
keberhasilan meregenerasikan sel atau protoplas menjadi tanaman yang lengkap
pada saat sekarang masih rendah sehingga menggunakan regenerasi langsung
untuk mendapatkan keragaman merupakan cara yang relatif lebih mudah
dibandingkan dengan dua cara lainnya (Wattimena et al., 1988).
Dalam menginduksi variasi somaklonal, sumber eksplan merupakan
bagian yang sangat menentukan karena jaringan yang berbeda dapat menimbulkan
frekuensi variasi somaklonal yang berbeda. Semakin tua atau semakin khusus
suatu jaringan maka akan besar variasi yang diperoleh dari tanaman yang
diregenerasikan. Keragaman genetik juga dapat terjadi pada fase yang
berdiferensiasi yang relatif panjang (Evans dan Sharp, 1986).
D’Amato (1986) menyatakan bahwa penyebab terjadinya keragaman
somaklonal adalah perubahan genetik yang meliputi perubahan gen atau
kromosom yang terjadi pada saat induksi kalus atau selama pertumbuhan sel dan
struktur dan jumlah kromosom. Perubahan struktur kromosom meliputi delesi,
inversi, duplikasi, atau translokasi, dan perubahan jumlah kromosom dapat
menyebabkan euploidi dan aneupolidi. Hal ini disebabkan rusaknya
benang-benang gelendong yang berfungsi menarik kromosom ke kutub-kutubnya pada
fase anafase dalam mitosis, sehingga dapat menyebabkan mutasi kromosom atau
aberasi kromosom. Mutasi gen dapat menimbulkan perubahan sifat yang
menguntungkan ataupun merugikan.
Induksi Mutasi
Poespadarsono (1988) mengemukakan bahwa mutasi dapat terjadi pada
setiap bagian tumbuhan dan pertumbuhan tanaman namun lebih banyak terjadi
pada bagian yang sedang aktif mengadakan pembelahan sel, misalnya tunas, biji,
dan sebagainya. Beliau menambahkan bahwa induksi radiasi dapat menyebabkan
mutasi karena sel yang teradiasi dibebani tenaga kinetik yang tinggi sehingga
dapat mempengaruhi atau mengubah reaksi kimia yang akhirnya menyebabkan
perubahan susunan kromosom.
Mutasi dapat terjadi secara alami maupun secara buatan. Mutasi secara
alami terjadi secara spontan dan berlangsung lama sekali, sedangkan mutasi
buatan terjadi karena adanya perkawinan silang, pemberian zat kimia, dan radiasi
nuklir (Soeminto, 1985). Radiasi merupakan salah satu mutagen yang paling
potensial. Radiasi terbagi ke dalam dua tipe, yaitu radiasi elektromagnetik (UV,
sinar X, dan sinar gamma) dan radiasi partikel (elektron, neutron, proton, partikel
α, dan partikel β). Sinar gamma biasanya diperoleh dari radioisotop 137Cs dan
60
Co. Cobalt-60 mempunyai dua macam energi radiasi, yaitu 1.33 dan 1.17 MeV,
dengan masa paruh waktu 5.3 tahun, sedangkan Cesium-137 adalah jenis
monoenergi dengan energi 0.66 MeV dengan paruh waktu 33 tahun (Van Harten,
1998). Keuntungan menggunakan radioisotop 137Cs adalah masa paruh waktunya
yang lebih lama dibandingkan dengan 60Co dan energi sinar gamma yang
dikeluarkannya lebih sedikit sehingga lebih aman, sedangkan kelemahannya
adalah daya penetrasinya yang tinggi ke dalam jaringan (Sparrow, 1961).
Handro (1981) menyatakan iradiasi adalah salah satu mutagen yang
walaupun hanya beberapa kasus yang sudah sukses dipublikasikan.
Poespadarsono (1988) menambahkan bahwa perbaikan sifat tanaman memerlukan
keragaman genetik yang diharapkan melalui mutasi buatan.
Soeminto (1985) mengemukakan bahwa arah mutasi radiasi bersifat acak
(random), artinya perubahan sifat yang akan terjadi tidak dapat diramalkan, namun keunggulannya adalah teknik mutasi dalam waktu yang singkat dapat
diperoleh dari bahan pilihan (seleksi) yang banyak.
Penggunaan iradiasi selain menguntungkan tetapi dapat juga merugikan.
Pada dasarnya semua jenis radiasi adalah merusak jaringan biologi. Ada dua
kemungkinan terjadinya kerusakan biologi akibat iradiasi, yaitu efek langsung dan
efek tidak langsung. Efek langsung merupakan saat radiasi langsung menumbuk
(mengenai) inti sel dan pecah menjadi fragmen-fragmen yang tidak berguna lagi,
sedangkan efek tidak langsung yaitu radiasi yang mengenai molekul-molekul sel
menimbulkan reaksi tertentu sehingga terjadi ionisasi dan radikal-radikal bebas
(Soeminto, 1985). Sistem radiasi mempunyai kemampuan menghasilkan radiasi
pengion yang berefek tidak langsung terhadap sistem biologi pada tanaman.
Tahapan-tahapan akibat kerusakan radiasi tersebut adalah tahap fisik, tahap kimia,
dan tahap metabolisme (Van Harten, 1998).
Wattimena dan Mattjik (1991) menyatakan hasil-hasil percobaan yang
dilakukan cukup banyak yang menguntungkan yaitu dengan perolehan baru baik
dalam penampilan sifat-sifat morfologis organ tanaman (fenotip) maupun
perbaikan sifat lainnya., banyak laporan dalam kultur in vitro yang menyatakan
keuntungan dalam menggunakan mutagen fisik (radiasi), namun dalam
penggunaannya diperlukan kecermatan dalam menentukan dosis dan memilih
bagian yang diradiasi karena kemungkinan besar dapat menyebabkan kerusakan
fisiologis.
Beberapa penelitian dilakukan untuk menunjukkan pengaruh radiasi sinar
gamma terhadap keragaman fenotipik tanaman. Prasetyorini (1991) menyatakan
bahwa pemberian radiasi dosis rendah (500 rad) secara nyata dapat merangsang
munculnya tunas, akar, dan jumlah akar yang terbentuk pada tunas-tunas in vitro
tanaman gerbera (Gerbera jamesonii Bolus ex Hook). Hasil penelitian Wardhani
indusiata mampu merangsang pertumbuhan jumlah daun. Eksplan yang diberi perlakuan radiasi pada dosis radiasi 20 Gy memperlihatkan persentase tumbuh
terbaik, yaitu 100% pada 10 MSP. Semakin besar dosis radiasi yang diberikan
maka warna daun akan semakin menuju ke arah kuning. Perlakuan penyinaran
iradiasi sinar gamma 15 Gy pada Euphorbia milii merah muda berpengaruh
terhadap percepatan munculnya bunga, peningkatan keragaman warna seludang,
penambahan ukuran diameter seludang, dan peningkatan jumlah bunga. Dosis
sinar gamma yang dianjurkan untuk peningkatan keragaman E. milii berkisar
antara 15-30 Gy (Handayani, 2007). Perlakuan radiasi tunggal Alpinia purpurata
mempunyai pengaruh yang lebih positif dibandingkan dengan radiasi yang
diulang (Soedjono, 1992). Mutan yang dihasilkan berupa tanaman dengan warna
dan ukuran rata-rata sama dengan kontrol, tetapi warna bunga merah menjadi
putih dan putih dengan pinggir merah. Hal yang sama juga dipaparkan oleh
Ratnasari (2007) pada iradiasi melati. Dosis iradiasi berulang 45 (20+25) Gy dan
60 (35+25) Gy secara nyata menghambat pertumbuhan tinggi tanaman pada
genotipe melati Jasminum sambac kingianum dan Jasminum multiflorum.
Induksi Mutasi Tanaman Krisan
Krisan terkenal dengan variasi warna bunganya yang bermacam-macam.
Bunga krisan yang dikenal saat ini berasal dari pemuliaan tanaman selama
puluhan tahun, namun disadari bahwa pemuliaan secara konvensional dirasa
kurang efektif karena memerlukan waktu yang relatif lebih panjang (Sanjaya,
1996). Cara yang dapat ditempuh untuk meningkatkan variasi tanaman krisan
secara lebih cepat adalah dengan iradiasi. Iaea (1992) menambahkan bahwa hasil
mutasi induksi radiasi memiliki nilai pasar yang cukup tinggi.
Tanaman yang diperbanyak secara vegetatif seperti krisan, perlakuan
mutasi induksi secara fisik dengan iradiasi lebih baik daripada mutasi induksi
secara kimiawi karena penetrasinya lebih kuat dalam jaringan tanaman, mudah
diaplikasikan, serta frekuensi mutasinya tinggi (Anonim, 2005). Salah satu
mutagen fisik yang banyak digunakan adalah sinar gamma.
Hasil penelitian Badriah dan Soedjono (1991) mengemukakan bahwa
Glory ternyata dapat mengubah warna bunga putih tepi ungu menjadi kuning.
Penelitian iradiasi tanaman krisan kultivar Sri Rejeki, Dewi Sartika, Chandra
Kirana, Shakuntala, dan Cat Eyes oleh Sanjay et al. (2003) mengakibatkan
penurunan daya hidup tanaman, tinggi tanaman, diameter batang, jumlah daun
dan peningkatan/penurunan jumlah bunga pita dan bunga tabung serta
abnormalitas bunga. Perubahan bentuk dan warna bunga terdeteksi pada tanaman
yang diiradiasi dengan sinar gamma diatas 15 Gy. Daun Dewi Sartika yang
diiradiasi 15 Gy menjadi variegata.
Masing-masing jenis, bagian dan umur tanaman yang berbeda memiliki
sensitivitas dan tanggap yang berbeda terhadap jenis dan dosis iradiasi. Bagian
tanaman krisan yang diradiasi pada umumnya adalah setek berakar dengan iradiasi
sinar gamma dosis 1.0 krad sampai 3.0 krad (Datta, 2001). Informasi untuk biakan
atau planlet masih terbatas, tetapi dengan dosis 0.8 krad sampai 2.5 krad
merupakan dosis optimum (Wuryaningsih, 2009). Hasil penelitian Lamsejaan et al.
(2000) juga menunjukkan hasil yang sama bahwa perlakuan iradiasi terhadap
biakan dalam botol kultur dengan dosis di atas 3.0 krad telah menyebabkan
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April 2009 sampai dengan bulan
Agustus 2009 bertempat di Laboratorium Bioteknologi Institut Pertanian Bogor
dan Laboratorium Pusat Penelitian dan Pengembangan Teknologi Isotop dan
Radiasi, Badan Tenaga Nuklir Nasional (BATAN) di Pasar Jumat, Jakarta.
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini antara lain stek tunas
aksilar dan terminal tanaman krisan kultivar krisan Puspita Nusantara, Puspita
Asri, Dewi Ratih, dan Cut Nyak Dien. Media perbanyakan yang digunakan adalah
media MS + IAA 0.1 ppm + BAP 0.5 ppm + sukrosa 30 g/L + agar 7 g/L,
0,8-hydroxyquinoline 0.002 M, asam asetat glasial, klorofom, tepung orcein, alkohol
70%, alkohol absolut, spiritus, aquades, plastik wrapping, tisu, botol kultur, dan
kantong plastik.
Alat yang digunakan dalam penelitian, yaitu autoclave, pinset, pipet,
ember, sprayer, cutter, stirer, bunsen, mikroskop, gunting, laminar airflow
cabinet, dan bakerglass, dan untuk meradiasi planlet digunakan Gamma Chamber dengan sumber iradiasi berupa Co-60 dengan dosis sebesar 136,977 krad/jam.
Metode Percobaan
Percobaan ini menggunakan rancangan perlakuan faktorial yang disusun
dalam rancangan lingkungan acak kelompok. Faktor pertama adalah kultivar
krisan dan sebagai faktor kedua adalah dosis sinar gamma. Kultivar yang diujikan
terdiri atas 4 taraf, yaitu kultivar krisan Dewi Ratih, Puspita Nusantara, Puspita
Asri, dan Cut Nyak Dien. Dosis sinar gamma yang diberikan terdiri atas lima taraf,
yaitu 0, 500, 1000, 1500, dan 2000 rad dan terdiri atas 5 ulangan. Jumlah satuan
percobaan seluruhnya adalah 100 satuan percobaan.
Peubah yang diamati antara lain tinggi tanaman, jumlah daun, persentase
Pelaksanaan Percobaan Persiapan bahan tanam
Bahan tanam yang digunakan adalah tunas aksilar dari tanaman in vitro
nodus tunggal berumur 4 minggu untuk kemudian diperbanyak ke dalam media
MS + IAA 0.1 ppm + BAP 0.5 ppm + sukrosa 30 g/L selama 4 minggu sebanyak
5-7 eksplan per botol. Panjang eksplan yang digunakan adalah 0.5 – 1 cm.
Iradiasi sinar gamma
Hasil perbanyakan tanaman diiradiasi dengan dimasukkan ke dalam ruang
gamma cell pada iradiator 60Co di P3TIR BATAN setelah planlet berakar dan memiliki cukup daun kemudian planlet langsung disubkultur ke media yang baru.
Subkultur
Planlet yang telah diradiasi kemudian disubkultur dengan tujuan untuk
mencegah kematian tunas yang disebabkan oleh residu radiasi sinar gamma.
Subkultur dilakukan dengan memindahkan planlet ke media yang sama seperti
yang digunakan saat perbanyakan, yaitu MS + IAA 0.1 ppm + BAP 0.5 ppm +
sukrosa 30 g/L, lalu diinkubasi di ruang kultur selama 6 minggu. Penyinaran yang
diberikan adalah selama 16 jam/hari dengan intensitas 1000 lux dan setelah
dilakukan inkubasi, planlet dapat diaklimatisasi.
Analisis Kromosom
Metode pengerjaan analisis kromosom dibagi ke dalam dua tahap, yaitu
tahap persiapan larutan dan tahap pengamatan mitosis.
1. Persiapan larutan
Larutan 0,8-hydroxyquinoline 0.002 M dibuat dengan cara melarutkan
0.3 g 0,8-hydroxyquinoline dalam 1 L aquades pada suhu 700C, kemudian
diaduk dengan menggunakan magnetic stirrer selama 1 jam sampai terlihat
warna kekuningan, lalu larutan disimpan dalam wadah tertutup di dalam
lemari es. Larutan carnoy dibuat dengan cara mencampur 10 ml asam asetat
glasial dengan 60 ml alkohol absolut dan klorofom 30 ml. Aseto orcein 2%
sampai mendidih, diangkat, lalu dimasukkan 1 g tepung orcein sambil wadah
digoyangkan selama 10 menit (suhu dipertahankan 90-950C). Larutan ini
kemudian ditambahkan 27.5 ml aquades dan dibiarkan hingga suhu
mencapai 200C dan dilakukan filtrasi di gelas lain kemudian disimpan dalam
wadah yang ridak tembus cahaya langsung.
2. Pengamatan mitosis
Bahan yang digunakan untuk membuat preparat adalah ujung akar dan
pucuk daun. Bagian ujung akar diambil dengan memilih bagian ujung akar
yang aktif, yaitu yang berwarna keputihan, kemudian dipotong sepanjang 1
cm, dan membuang kotoran pada akar dengan cara direndam dalam air.
Ujung akar yang telah bersih ini kemudian dimasukkan ke dalam
0,8-hydroxyquinolin selama 3-5 jam. Hal yang dilakukan selanjutnya adalah
perlakuan fiksasi sebelum pengamatan dengan mengambil dua ujung akar
yang telah sebelumnya direndam dalam air bersih, kemudian tudung akarnya
dibuang dan dimasukkan ke dalam larutan campuran I N HCl dan asam
asetat 45% dengan perbandingan konsentrasi 3:1 dengan suhu 600C selama 1
sampai 3 menit. Ujung akar tersebut diangkat dan dimasukkan ke dalam
orcein, kemudian dipindahkan ke gelas preparat dan dipotong sepanjang 1-2
mm untuk selanjutnya ditetesi dengan orcein. Kaca penutup dipasang dan
dipijat dengan halus dengan pensil berkaret lalu dipanaskan kembali. Taha0p
selanjutnya adalah pengamatan preparat.
Pembuatan preparat bagian pucuk adalah dengan mengupas bagian
pucuk daun sehingga didapatkan bagian daun yang paling muda. Bagian
tersebut dimasukkan ke dalam 0,8-hydroxyquinolin 200C selama 3 jam dan
dipindahkan ke dalam larutan carnoy, selanjutnya disiapkan tempat lain
berisi kertas tissu atau kertas lain yang dibasahi dengan 45% asam asetat.
Orsein hydroschlorite (1% orcein : 1 N HCl = 9:1) disiapkan kemudian
materi tanaman dalam preparat diambil, lalu diurai dalam gelas preparat
dibawah binokuler dengan bantuan jarum dan ditetesi orcein sampai
terendam. Materi tanaman dimasukkan pada tempat yang berisi 45% asam
dipijat atau dipukul halus dengan pensil berkaret, seperti pembuatan preparat
akar.
Pengamatan
Kegiatan pengamatan dilakukan pada persentase hidup planlet, tinggi
planlet, jumlah daun, dan jumlah kromosom. Pengamatan dilakukan setiap 1
minggu selama 6 minggu setelah planlet disubkultur pasca iradiasi.
1. Persentase hidup planlet
Pengamatan dilakukan secara visual dengan menghitung jumlah tunas
adventif yang muncul pada batang planlet.
2. Tinggi planlet
Pengukuran tinggi planlet dilakukan dengan menempelkan penggaris di luar
botol di sisi yang terdekat dengan planlet yang diukur.
3. Jumlah daun
Pengamatan jumlah daun dilakukan secara visual dengan menghitung jumlah
daun yang telah membuka setengah dan membuka sepenuhnya pada setiap
planlet.
4. Jumlah kromosom
Penghitungan jumlah kromosom juga dilakukan secara visual menggunakan
HASIL DAN PEMBAHASAN
Kondisi Umum Percobaan
Kondisi laboratorium tempat dilakukan percobaan memiliki suhu berkisar
antara 18-220C dan kelembaban mencapai 90%. Kondisi tersebut merupakan
kondisi yang memadai untuk tanaman yang ditanam secara in vitro. Tanaman
yang diberikan perlakuan merupakan tanaman berumur 4 minggu yang berasal
dari subkultur tunas aksilar tanaman in vitro.
Sebagian besar tanaman yang mati disebabkan oleh cendawan dan bakteri.
Kontaminasi tersebut dapat berasal dari faktor internal dan eksternal. Faktor
internal berupa media yang kurang steril dalam proses pembuatannya serta dari
dalam bahan tanam yang membawa cendawan, untuk itu perlunya dilakukan
sterilisasi bahan tanam sebelum dilakukan perbanyakan. Sterilisasi dilakukan
dengan merendam bahan tanam dengan larutan klorox 5% selama 1 menit.
Sedangkan faktor eksternal berupa kurang sterilnya peralatan maupun laminar
yang digunakan.
Berdasarkan pengamatan satu minggu setelah tanam (1 MST), sebagian
besar tanaman sudah bertunas dengan persentase 62%. Satu eksplan rata-rata
menghasilkan satu tunas. Pada umur 2 MST kuncup telah membuka dan
pertumbuhannya tampak jelas. Kultivar krisan Cut Nyak Dien (CND) memiliki
pertumbuhan tunas terendah dibandingkan dengan kultivar lainnya, dan tanaman
dengan perlakuan dosis 2 krad menunjukkan pertumbuhan tunas terendah
dibandingkan dengan perlakuan dosis lainnya. Tunas tanaman terus mengalami
peningkatan pertumbuhan sampai 3 MST yang tertinggi yaitu 89% kemudian
mengalami penurunan pertumbuhan pada tiga minggu berikutnya karena terdapat
beberapa tunas yang mengalami browning dan akhirnya mati.
Hampir seluruh tunas kultivar Puspita Nusantara (PN) berkalus pada
pangkal batangnya dan ukuran tunas menjadi kerdil namun tetap mengalami
pertumbuhan daun walaupun sedikit. Sedangkan pada kultivar Dewi Ratih (DR),
juga menghasilkan kalus pada pangkal batang, namun pertumbuhan tunas tidak
Gambar 1. Eksplan Kultivar Puspita Nusantara yang Berkalus pada Pangkal Batangnya
Hasil uji F tabel 1 menunjukkan dosis radiasi dan kultivar yang digunakan
memberikan pengaruh yang berbeda pada peubah-peubah karakter kuantitatif
yang diamati.
Tabel 1. Rekapitulasi Hasil Uji F Pengaruh Kultivar dan Iradiasi Sinar
Gamma terhadap Peubah Kuantitatif Dendrathema grandiflora
Tzvelev.
Kultivar yang digunakan dalam penelitian ini menunjukkan pengaruh
berbeda sangat nyata, berbeda nyata dan tidak nyata pada peubah-peubah karakter
yang diamati. Hal ini disebabkan keempat kultivar yang digunakan memiliki
radiosensitivitas yang berbeda-beda terhadap perlakuan dosis iradiasi. Taraf-taraf
dosis yang digunakan berselang sebesar 0.5 krad. Besarnya selang dosis yang
digunakan diduga sebagai penyebab terjadinya perbedaan yang sangat nyata pada
sebagian besar karakter kuantitatif yang diamati. Tidak ada interaksi antar dosis
iradiasi terhadap kultivar pada peubah jumlah tunas hidup dan tinggi tanaman,
namun terdapat interaksi yang sangat nyata pada peubah jumlah daun.
Gambar 2. Penampilan Planlet Kontrol Dendranthema grandiflora
Tzvelev. dan Planlet yang Diiradiasi dengan Sinar Gamma
Menurut Broertjes dan Van Harten (1988), terdapat dua faktor yang dapat
menyebabkan radiosensitivitas, yaitu faktor biologi dan lingkungan. Faktor
biologi meliputi perbedaan ukuran dalam inti sel, volume inti (Nuclear Volume),
spesies yang berbeda. Faktor lingkungan yang mempengaruhi radiosensitivitas,
yaitu oksigen, air, suhu, dan kondisi simpan setelah proses iradiasi.
Persentase Tunas Hidup
Berdasarkan Soedjono (1992), penginduksian sinar gamma akan
menyebabkan kerusakan pada sel sehingga keadaan fisiologinya akan terganggu,
diantaranya adalah kadar oksigen (O2) dan jumlah ion radikal akan meningkat.
Tujuan dari penelitian-penelitian mutasi yang telah dilakukan biasanya untuk
menghasilkan sebanyak mungkin mutan-mutan yang viable Oleh karena itu
digunakan dosis-dosis iradiasi yang tinggi untuk mendapatkan frekuensi mutan
yang lebih banyak namun hal tersebut menyebabkan kerusakan-kerusakan dengan
banyaknya tanaman-tanaman yang mati atau menjadi steril akibat iradiasi
sehingga sifat-sifat mutan yang akan muncul pada keturunan selanjutnya akan
hilang (IAEA, 1969)..
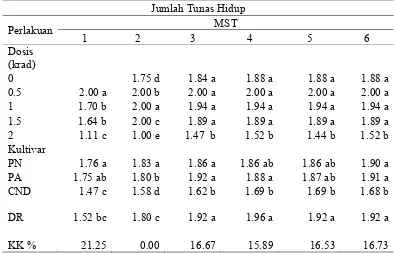
Tabel 2. Persentase Tunas Hidup pada Berbagai Dosis Radiasi
Dosis
PN = Puspita Nusantara PA = Puspita Asri CND = Cut Nyak Dien DR = Dewi Ratih
Hasil penelitian Wulandari (2001) pada tanaman krisan menunjukkan
bahwa dosis iradiasi sinar gamma berpengaruh nyata terhadap persentase tanaman
hidup dibandingkan kontrol. Dosis 20 Gy dan 30 Gy berbeda nyata dengan
kontrol, namun tidak berbeda pengaruh antara kedua perlakuan, dengan persentase
tanaman hidup terendah didapat pada perlakuan dosis 40 Gy. Hasil penelitian
Hapsari (2004) menunjukkan hal yang serupa pada tanaman melati, terdapat
kombinasi yang sangat nyata antara dosis iradiasi sinar gamma dan spesies melati
50 Gy dan 55 Gy mengurangi kemampuan tanaman untuk hidup pada semua
spesies melati yang digunakan.
Tabel 3. Pengaruh Radiasi Sinar Gamma dan Kultivar terhadap Rata-Rata
Jumlah Tunas In Vitro selama 6 Minggu Pengamatan
Jumlah Tunas Hidup
Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
Kultivar: PN = Puspita Nusantara, PA = Puspita Asri, CND = Cut Nyak Dien, DR = Dewi Ratih
KK = Koefisien Keragaman
Masing-masing perlakuan dosis sinar gamma dan kultivar berpengaruh
sangat nyata dan terhadap persentase tunas yang hidup, namun interaksi antara
keduanya berpengaruh tidak nyata. Dosis 2 krad memberikan pengaruh yang
nyata dengan kontrol, sedangkan dosis 0.5, 1, dan 1.5 tidak memberikan pengaruh
nyata dan persentase tanaman terendah terdapat pada dosis 2 krad pada semua
kultivar.
Secara umum tunas-tunas yang dibentuk oleh perlakuan pemberian dosis
0.5 krad paling baik dibandingkan dengan kontrol dan dosis lainnya pada setiap
minggu pengamatan. Prasetyorini (1991) menyatakan bahwa pemberian dosis
rendah (500 rad) secara nyata merangsang pembentukan tunas in vitro, sedangkan
Letal Dosis 50
Letal dosis 50 (LD50) merupakan dosis yang menyebabkan kematian
sebanyak 50% dari populasi yang diradiasi. Kisaran dari taraf dosis iradiasi yang
diaplikasikan sangat penting dalam menentukan dosis yang optimum pada
tanaman yang akan diradiasi (Boertjes dan Van Harten, 1988). Nilai LD50 didapat
dari perhitungan persentase tanaman yang hidup setelah radiasi dengan
menggunakan curve fit analysis. Pengamatan terhadap persentase tanaman hidup
hasil iradiasi sinar gamma untuk menentukan nilai LD50 umumnya dilakukan
antara 1-2 bulan dan pada penelitian ini penentuan nilai LD50 dilakukan pada
minggu akhir pengamatan, yaitu setelah tanaman berumur 6 minggu.
Nilai LD50 pada kultivar Puspita Nusantara yaitu 5.93 krad, 6.61 krad pada
Puspita Asri, 6.81 krad pada Cut Nyak Dien, dan 12.77 krad pada kultivar Dewi
Ratih.
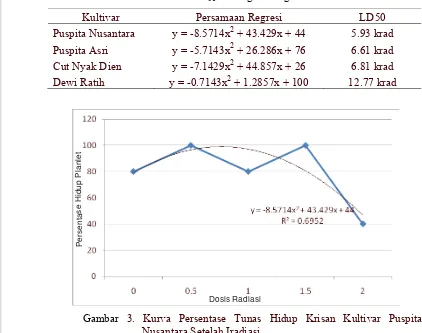
Tabel 4. Persamaan dan LD50 Masing-Masing Kultivar
Kultivar Persamaan Regresi LD50
Puspita Nusantara y = -8.5714x2 + 43.429x + 44 5.93 krad
Gambar 3. Kurva Persentase Tunas Hidup Krisan Kultivar Puspita
Model persamaan nilai LD50 yang diperoleh pada krisan kultivar Puspita
Nusantara adalah model quadratic fit. Persamaan regresi pada kultivar Puspita
Nusantara adalah y = -8.5714x2 + 43.429x + 44 yang mempunyai nilai LD50
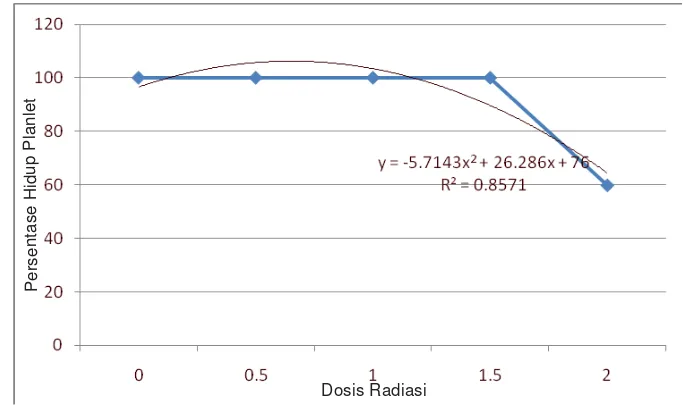
Gambar 4. Kurva Persentase Tunas Hidup Krisan Kultivar Puspita Asri
Setelah Iradiasi
Krisan kultivar Puspita Asri mempunyai model persamaan regresi
quadratic fit dengan persamaan y = -5.7143x2 + 26.286x + 76 yang mempunyai nilai LD50 sebesar 6.61 krad.
Gambar 5. Kurva Persentase Tunas Hidup Krisan Kultivar Cut Nyak Dien
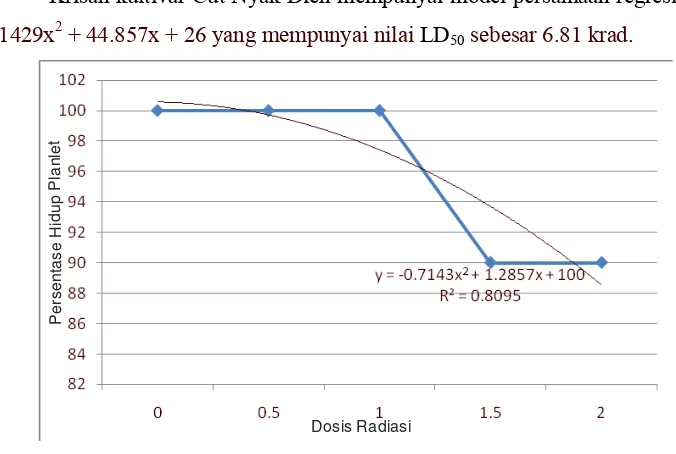
Krisan kultivar Cut Nyak Dien mempunyai model persamaan regresi y =
-Gambar 6. Kurva Persentase Tunas Hidup Krisan Kultivar Dewi Ratih
Setelah Iradiasi
Krisan kultivar Dewi Ratih memiliki model persamaan regresi y =
-0.7143x2 + 1.2857x + 100 dengan nilai LD50 sebesar 12.77 krad.
Pada pengujian nilai LD50 (Gambar 3, 4, 5, dan 6) terlihat bahwa
masing-masing kultivar menunjukkan tingkat radiosensitivitas yang berbeda. Terlihat dari
nilai LD50 yang diperoleh, maka diduga bahwa radiosensitivitas kultivar Puspita
Nusantara adalah yang tertinggi dan kultivar Dewi Ratih yang terendah.
Nilai-nilai LD50 yang dihasilkan lebih besar dari dosis maksimal yang diberikan
sehingga kultivar yang digunakan dapat dikatakan memiliki radiosensitivitas yang
rendah.
Berdasarkan Sparrow (1961), radiosensitivitas antar spesies tanaman
dipengaruhi oleh volume inti sel (semakin banyak kandungan DNA, semakin
sensitif terhadap radiasi), jumlah kromosom (semakin sedikit jumlah kromosom,
semakin sensitif terhadap radiasi), dan tingkat ploidi (semakin tinggi tingkat plodi,
semakin rendah radiosensitivitasnya). Faktor-faktor lain yang mempengaruhi
adalah faktor genetik, iklim, dan kondisi lingkungan sebelum dan setelah
perlakuan sehingga akan mempengaruhi pertumbuhan akar dan tunas.
Hasil penelitian Faradilla (2008) menunjukkan bahwa anthurium kultivar
62.17 Gy. Nariah (2008) dalam penelitiannya menyatakan bahwa empat kultivar
Caladium spp. memiliki nilai LD50 masing-masing pada varietas Candidum sebesar 61.80 Gy, varietas Sweet Heart sebesar 80 Gy, varietas Pink Beauty
sebesar 70 Gy, dan varietas Miss Muffet sebesar 37.35 Gy.
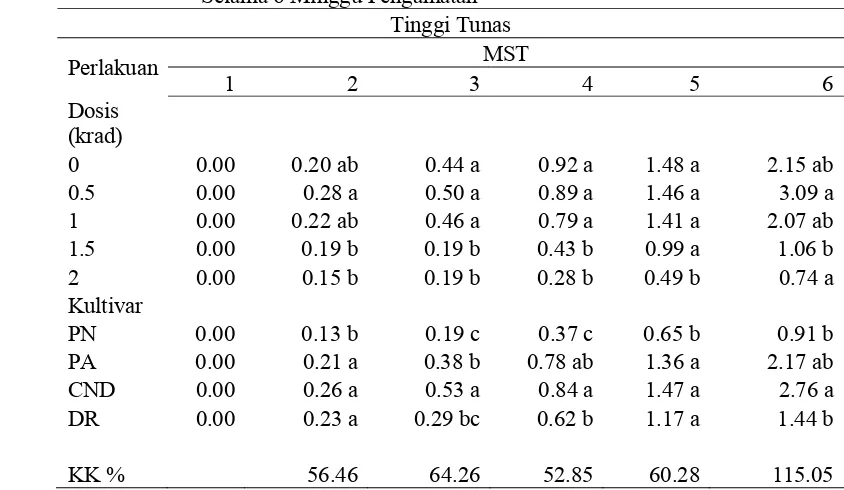
Tinggi Tunas
Pengukuran tinggi tunas dilakukan mulai dari pangkal batang tunas sampai
ke ujung tunas yang belum membuka. Peubah karakter tinggi tanaman tidak
menunjukkan adanya interaksi antara dosis iradiasi terhadap kultivar krisan (Tabel
1). Dosis dan kultivar memiliki pengaruh berbeda pada setiap minggu terhadap
tinggi tunas krisan (Tabel 4). Pada pengamatan minggu ke-3, 4, dan 5 tinggi tunas
menunjukkan perbedaan yang nyata terhadap kontrol. Pada minggu ke-3 dan ke-4
perlakuan dengan dosis 1.5 dan 2 krad secara nyata menghambat percepatan
pertumbuhan tunas, sedangkan pada minggu ke-5, hanya pada taraf dosis 2 krad
yang memberikan pengaruhnya yang nyata.
Tabel 5. Pengaruh Dosis dan Kultivar Terhadap Tinggi Planlet Krisan Selama 6 Minggu Pengamatan
Tinggi Tunas
Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
Kultivar: PN = Puspita Nusantara, PA = Puspita Asri, CND = Cut Nyak Dien, DR = Dewi Ratih
Tampak di grafik bahwa pemberian dosis rendah 0.5 krad menunjukkan
pertumbuhan tanaman in vitro yang paling baik, namun dosis lebih dari 1 krad
justru menurunkan pertumbuhan tinggi tanaman. Prasetyorini (1991) menyatakan
bahwa pemberian dosis rendah (500 rad) secara nyata merangsang pembentukan
tunas in vitro. Sedangkan radiasi dosis lebih dari 1000 rad secara nyata
menghambat pembentukan tunas.
Ichikawa dan Ikushima (1967) menyatakan walaupun kerusakan seluler
pada meristem pucuk dapat menyebabkan pertumbuhan tanaman dalam kultur in
vitro terhambat, namun pada suatu tingkat dosis radiasi tertentu justru dapat merangsang pertumbuhan tanaman. Hal ini dapat disebabkan hilangnya
kemampuan sebagian sel pada meristem untuk membelah diri menyebabkan
aktivitas sel-sel meristem yang lain meningkat. Pierik (1987) menambahkan
bahwa radiasi dosis 100 rad dapat meningkatkan pembentukan tunas adventif
pada kultur kalus Anthurium adreanum.
Perlakuan beberapa macam kultivar menunjukkan perbedaan yang nyata
pada peubah tinggi tunas (Tabel 5). Kultivar CND menunjukkan nilai rata-rata
yang paling tinggi pada peubah tinggi tunas dibandingkan dengan kultivar lainnya,
sedangkan yang pertumbuhan tunas paling lambat adalah kultivar PN (Puspita
Nusantara).
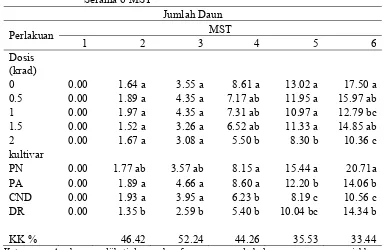
Jumlah Daun
Pada peubah jumlah daun menunjukkan adanya interaksi yang nyata
antara dosis dan kultivar (Tabel 1). Rata-rata jumlah daun tertinggi dihasilkan
oleh tanaman kontrol, yaitu dimulai dari 4 MST sampai dengan minggu akhir
pengamatan. Hal ini menunjukkan dosis sinar gamma yang diberikan terbukti
menghambat pertumbuhan daun tanaman krisan. Semakin tinggi dosis yang
diberikan maka pertumbuhan daun semakin menurun. Kultivar PN memiliki
jumlah daun paling banyak yaitu 20.7 helai sedangkan kultivar CND memiliki
jumlah daun yang paling sedikit. Dosis radiasi 2 krad menyebabkan pertumbuhan
daun terhambat yang ditunjukkan dengan jumlah daun paling sedikit pada semua
kultivar krisan. Pada dosis ini pula dihasilkan keragaman tanaman yang berbeda
Tabel 6. Pengaruh Dosis dan Kultivar Terhadap Jumlah Daun Krisan
Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji DMRT taraf 5%.
Kultivar: PN = Puspita Nusantara, PA = Puspita Asri, CND = Cut Nyak Dien, DR = Dewi Ratih
KK = Koefisien Keragaman
Tabel 7 menunjukkan bahwa interaksi yang sangat nyata terhadap rataan
jumlah daun. Rataan jumlah daun terbanyak terdapat pada kultivar PN kontrol,
sedangkan rataan terendah terdapat pada kultivar PN dosis iradiasi 2 krad.
Semakin tinggi dosis iradiasi sinar gamma yang diberikan akan semakin
menghambat pertumbuhan tanaman, ditunjukkan dengan semakin menurunnya
jumlah daun seiring dengan peningkatan dosis sinar gamma, kecuali pada kultivar
PA pada dosis sinar gamma 0.5 krad. Wardhani (2005) melaporkan bahwa
pertumbuhan jumlah daun anggrek in vitro Brachyeza indusiata meningkat oleh
dosis iradiasi sinar gamma 10 Gy, dan seiring dengan penambahan dosis iradiasi,
pertumbuhan jumlah daun semakin menurun. Ichikawa dan Ikushima dalam
Pratiwi (1995) menyatakan bahwa kerusakan sel dalam meristem akibat pengaruh
radiasi sinar gamma menghambat pertumbuhan tanaman in vitro, namun pada
tingkat iradiasi tertentu justru meningkatkan pertumbuhan. Hilangnya kemampuan
membelah diri sebagian sel pada meristem menyebabkan aktivitas sel-sel
Tabel 7. Pengaruh Interaksi Dosis Iradiasi Sinar Gamma dan Kultivar Krisan Terhadap Peubah Jumlah Daun
interaksi jumlah daun
D0*PN 29.9a Keterangan: Angka yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan
tidak berbeda nyata menurut uji DMRT taraf 5%.
Kultivar: PN = Puspita Nusantara; PA = Puspita Asri; CND = Cut Nyak Dien; DR = Dewi Ratih
Dosis: D0 = 0 krad; D1 = 0.5 krad; D2 = 1 krad; D3 = 1.5; D4 = 2 krad
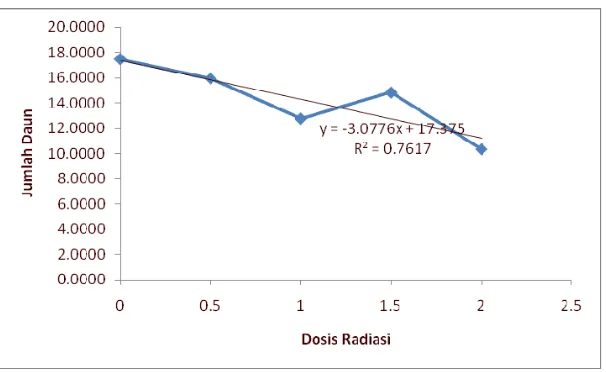
Persamaan yang dapat dibuat dari Gambar 3 adalah y = -3.0776x + 17.375
(R² = 0.7617). Dari persamaan ini dihasilkan slope grafik yang negatif. Hal ini
menunjukkan bahwa setiap peningkatan dosis radiasi akan menurunkan jumlah
daun. Koefisien determinasi yang dihasilkan cukup tinggi, yaitu 76.17%, artinya
sebanyak 76.17% keragaman dari Y dapat dijelaskan oleh model regresi linear
sederhana tersebut.
Jumlah Kromosom
Analisis kromosom dilakukan untuk mendapatkan data jumlah kromosom
pada ekplan yang diradiasi dan tidak diradiasi yang bertujuan mengetahui apakah
ada eksplan yang mengalami perubahan kromosom atau menjadi mutan setelah
diberikan perlakuan iradiasi. Eksplan yang diradiasi dalam percobaan ini
merupakan eksplan berumur 4 minggu yang telah berakar dan memiliki cukup
daun, sehingga akan lebih tahan terhadap radiasi. Pengamatan kromosom
dilakukan setelah tanaman berusia 6 minggu setelah disubkultur terlebih dahulu
pasca radiasi yang dilakukan pada pucuk ataupun akar, namun mengamati akar
lebih mudah dalam penghitungan kromosom. Jumlah sampel yang seharusnya
diamati total adalah 20 sampel, namun 4 tanaman mengalami kematian pada saat
pengamatan dalam botol kultur sehingga sampel yang diamati adalah 16 sampel.
Saat terbaik untuk mengamati kromosom adalah pada saat proses mitosis
berlangsung, yaitu pada saat terjadi profase. Menurut Campbell et all. (1999) pada
saat terjadi profase, kromosom teramati dengan jelas, yaitu terdiri dari dua
kromatid identik yang terbentuk pada interfase. Dua kromatid tersebut bergabung
pada sentromernya, seta benang-benang spindel terlihat memanjang dari
sentromernya.
Hasil analisis kromosom pada tanaman krisan yang diteliti menunjukkan
beberapa kombinasi perlakuan yang memiliki jumlah kromosom yang berbeda.
Kultivar PN kontrol memiliki jumlah kromosom ±28, PA memiliki jumlah
kromosom ±19, CND ±29, dan DR ±21. Sedangkan kultivar yang diberikan
perlakuan iradiasi memiliki jumlah kromosom yang beragam, ada yang lebih
Kultivar PN dosis 0 krad Kultivar PN dosis 1 krad Kultivar PN dosis 1.5 krad
Kultivar PA dosis krad0 Kultivar PA dosis 0.5 krad Kultivar PA dosis krad1 Kultivar PA dosis 1.5 krad Kultivar PA dosis 2 krad
Kultivar CND dosis 0 krad Kultivar CND dosis 0.5 krad Kultivar CND dosis krad1 Kultivar CND dosis 1.5 krad Kultivar CND dosis 2 kra
Kultivar DR dosis 0 krad Kultivar DR dosis krad1 Kultivar CND dosis krad2
Tabel 8. Jumlah Kromosom Empat Kultivar Krisan pada Lima Dosis Sinar
Gamma
kultivar dosis radiasi (krad)
0 0.5 1 1.5 2
PN ± 28 - ± 20 ± 40 -
PA ± 19 ± 17 ± 17 ± 18 ± 20
CND ± 29 ± 15 ± 22 ± 22 ± 26
DR ± 21 - ± 25 - ± 16
Keterangan: Kultivar: PN = Puspita Nusantara, PA = Puspita Asri, CND = Cut Nyak Dien, DR = Dewi Ratih
Perubahan jumlah kromosom krisan yang diradiasi diduga akibat adanya
pematahan kromosom. Sinar gamma merupakan radiasi pengion yang dapat
memutuskan rantai kromosom pada tempat-tempat tertentu sehingga mengubah
struktur kromosom, oleh karena itu radiasi menyebabkan terjadinya mutasi
kromosom atau aberasi kromosom (Crowder, 1990). Aberasi kromosom yang
terjadi akibat patahan pada kromosom, patahan pada kromatid, patahan pada
subkromatid, patahan pada isokromatid, patahan yang menyatu kembali,
pembelahan sentromer secara transversal, translokasi, inversi, duplikasi atau
delesi (Sparrow, 1979).
Patahan kromosom yang terjadi menimbulkan kromosom yang berbeda
ukurannya dengan kromosom normalnya. Suatu kromosom yang patah seringkali
menghasilkan suatu bagian yang asentrik dan satu bagian lainnya disentrik.
Bagian asentrik tersebut umumnya akan hilang pada proses pembelahan
selanjutnya, sedangkan bagian disentriknya mungkin masih tetap ada dan
membentuk satu ujung kromosom. Ujung-ujung tadi pun dapat mengalami
pecahan, ujung-ujung yang terbantuk dapat saling bertaut kembali pada
pembelahan berikutnya, sedangkan jika radiasi pengion tersebut merusak
benang-benang gelendong (spindle fibre) yang berfungsi menarik kromosom ke
kutub-kutubnya pada fase anaphase saat pembelahan mitosis, maka akan mengubah
jumlah kromosom dan menyebabkan terjadinya keadaan euploidi dan aneuploidi
(Crowder, 1990).
Perlakuan radiasi sinar gamma dalam penelitian ini menghasilkan
keragaman somaklonal, diketahui dari tanaman yang memiliki jumlah kromosom
yang berbeda dengan tanaman yang tidak diradiasi. Tanaman yang memiliki
jumlah kromosom yang lebih banyak dari kontrolnya, kemungkinan memiliki
ukuran yang lebih besar, karena menurut Poespadarsono (1988) dengan
bertambahnya jumlah kromosom dapat berpengaruh terhadap ukuran sel dan
KESIMPULAN
- Interaksi antara faktor dosis radiasi dan kultivar yang menunjukkan
pertumbuhan tanaman paling baik dalam penelitian ini adalah dosis 0 krad
pada tanaman krisan kultivar Puspita Nusantara.
- Radiasi sinar gamma di atas 0.5 krad dapat menimbulkan keragaman
somaklonal pada krisan kultivar Puspita Nusantara, Puspita Asri, Cut Nyak
Dien, dan Dewi Ratih.
- Radiasi sinar gamma berpengaruh nyata terhadap krisan in vitro dengan
menurunkan jumlah daun, namun tidak berpengaruh nyata terhadap jumlah
tunas in in vitro dan tinggi tanaman.
- Nilai LD50 pada kultivar Puspita Nusantara yaitu 5.93 krad, 6.61 krad pada
Puspita Asri, 6.81 krad pada Cut Nyak Dien, dan 12.77 krad pada kultivar
Dewi Ratih.
SARAN
- Perlu dilakukan penelitian lanjutan sampai ke tahap pembungaan untuk
melihat keragaan fenotip tanaman untuk mengetahui keragamannya.
- Analisis molekuler di tingkat DNA untuk meneliti perubahan genetik tanmaan
DAFTAR PUSTAKA
Anonim. 2005. Iradiasi sinar gamma meningkatkan keragaman krisan. Warta Penelitian dan Pengembangan Pertanian Vol. 27 No. 6.
Badriah, D.S. dan S. Soedjono. 1991. Perbaikan Varietas dengan Iradiasi. Laporan Hasil Penelitian Tanaman Hias. Sub Balai Penelitian Hortikultura. Cipanas.
BPS. 2004. Statistic Tanaman Obat-Obatan dan Hias. Badan Pusat Statistik Indonesia. Hal 21.
___. 2005. Statistik Tanaman Obat-Obatan dan Hias. Badan Pusat Statistik Indonesia. Hal 23.
___. 2011. Produksi Tanaman Hias di Indonesia. http://www.bps.go.id. Jakarta. [03 Juli 2011].
Broertjes, C dan A.M. Van Harten. 1988. Applied mutation breeding for vegetatively propagated crops. Elsevier Science Publ. Amsterdam. The Netherland. 3450p.
Campbell, N.A., J.B. Reece, dan L.W. Mitchell. 1999. Pembelahan mitosis dan
meiosis. Hal 250-251. Dalam A. Safitri (Ed.). Biologi Edisi Kelima.
Erlangga. Jakarta.
Cantor, M., I. Pop dan Korosfoys. 2002. Studies concerning the effect of gamma radiation and magnetic feild exposure on gladiolus. J. Central European Agric. Vol 3 (2002) No. 4. 277-284.
Crowder, L.V. 1990. Genetika Tumbuhan. Gajah Mada University Press. Yogyakarta. 499 hal.
D’Amato, F. 1986. Spontaneous mutations and somaclonal variation. P. 3-9. In
Proceedings on nuclear techniques and in vitro culture for plant improvement. International Atomic Energy Agency. Vienna.
Datta, S.K. 2001. Mutation studies on garden Chrysanthemum. A Review. Sci.
Hort. 7 : 159 - 199.
Evans, D.A. and W.R. Sharp. 1986. Somaclonal and gametoconal variation. In
Evans, D.A., W.R. Sharp, and P.V. Amirato (Ed.). Hand Book of Plant
Cell Culture. Volume 4. Mc. Millan Publ. New York.
Faradilla, F.M. 2008. Mutasi Induksi Melalui Sinar Gamma pada Dua Kultivar
Anthurium (Anthurium adreanum ‘Mini’ dan A. adreanum ‘Holland’).
Skripsi. Program Sarjana, Institut Pertanian Bogor. Bogor. 66 hal.
Handayani, A. 2007. Peningkatan Keragaman Tanaman Euphorbia milii melalui
Iradiasi Sinar Gamma. Institut Pertanian Bogor. Bogor. 28 hal.
Handro, W. 1981. Mutagenesis and In Vitro Selection. p 155-175. In T.A. Thrope.
(Ed.). Plant Tissue Culture: Method and Application in Agriculture.
Academic Press. London.
Hapsari, L. 2004. Induksi Mutasi pada Melati (Jasminum spp.) melalui Iradiasi
Sinar Gamma. Skripsi. Departemen Budidaya Pertanian, Fakultas Pertanian, IPB. Bogor
Harjadi, S. S. 1989. Dasar-Dasar Hortikultura. Faperta IPB. Bogor. 506 hal.
Horst, R. K. 1990. Chrysanthemum. In P.V. Ammirato, D.A. Evans, W.R. Sharp
and Y. P. S. Bajaj (Eds.) Handbook of Plant Cell Culture Ornamental
Species. McGraw Hill. Publish. Co. New York.
IAEA (International Atomic Energy Agency) 1992. Mutation Breeding News Letter. Joint Fao/Iaea. Vienna. No. 39:14-33.
Ibrahim, R. 1998. In vitro mutagenesis in Roses. A rose by any other name:
Application of Radiation Technique and Biotechnology for Production of Mutant Varieties of Rose. http://www.symbiosisonline.com. 3 Juni 2003. 1-5.
Ichikawa, S. and Y. Ikushima. 1967. A development study of diploid oats by means of radiation induced somatic mutation Rad. Bot. 7: 205-215.
International Chrysanthemum Society. 2002. Chrysanthemum: challenge and prospect. Mcgraw-Hill, Inc. NewYork. pp 4-5.
Ketaren, S. dan B. Djatmiko. 1981. Daya Guna Kelapa. Jurusan Teknologi Industri Fakultas Teknik Pertanian. IPB.
Krisantini. 1989. Florikultur. p. 469-477. dalam S.S. Harjadi (Ed.). Dasar-Dasar
Hortikultura. Jurusan Budidaya Pertanian. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
chrysanthemum (Chrysanthemum morifolium). Kasetsart J. (Nat. Sci.)34: 417 – 422.
Langton. 1987. Apical dissection and light integral monitoring as methods to determine when long day interruption should be given in chrysanthemum growing. Acta Hort. 197:31-41.
Larkin, P. J. and W. R. Scowcroft. 1981. Somaclonal variation anovel source of variabilityfrom cel culture for plant improvement. Theor. Appl. Genet. 60: 197- 204.
Lertphanichkul, D. Meepien dan Kassiri. 2003. Effect of gamma radiation on
mutation of gloxinia. http://user.school.net.th/~anuparp/aptc2.htm. 13
April 2004. 1-2.
Lint P.J.A.L. dan G. Heij. 1987. Effect of day and night temperature on growth and flowering of chrysanthemum. Acta Hort. 197:53-61.
Maaswinkel, R. dan Y. Sulyo. 2004. Chrysanthemum physiologie in Training on Chrysanthemum Cultivation I. Balithi.
Mortensen, L.M.. 2000. Effect of air humidity on growth, flowering, keeping quality and water relations of four short-day greenhouse species. Scientia Hortic. 86:299-310.
Nariah, F. 2008. Pengaruh Mutasi Fisik Melalui Iradiasi Sinar Gamma Terhadap
Keragaan Caladium spp. Skripsi. Program Sarjana, Institut Pertanian
Bogor. Bogor. 78 hal.
Pierik, R.L.M. 1987. Genetic Variability in Tissue Culture Impact on Germplasm Concervation and Utilization International Board for Plant Genetic
Resources. Rome. 41 p.
Poespadarsono, S. 1988. Dasar-Dasar Ilmu Pemuliaan Tanaman. Pusat Antar Universitas. IPB. 169 p. Tidak dipublikasikan.
Prasetyorini. 1991. Pengaruh Radiasi Sinar Gamma dan Jenis Eksplan terhadap
Keragaman Somaklonal pada Tanaman Gerbera (Gerbera jamesonii Bolus
ex Hook). Tesis. Program Pasca Sarjana. Institut Pertanian Bogor. Bogor. Tidak dipublikasikan.
Puslitbanghort. 2006. Budidaya Krisan Bunga Potong. Pusat Penelitian dan Pengembangan Hortikultura. Jakarta. 60 hal.
Ratnasari. 2007. Evaluasi Keragaman Fenotipe Melati (Jasminum spp.) Hasil Iradiasi Berulang Sinar Gamma. Insitut Pertanian Bogor. Bogor. 38 hal.
Reginawanti. 1999. Krisan. http://www.kpel.or.id. Bandung. [19 September 1999].
Salisbury, F. B. dan C. W. Ross. 1995. Fisiologi Tumbuhan Jilid Tiga. Institut Teknologi Bandung. Bandung. 343 hal. (terjemahan)
Sanjay,L., Y.Supriyadi, R.Meilasari dan K. Yuniarto. 2003. Induksi Mutasi dengan Menggunakan Sinar Gamma pada Varietas-Varietas Krisan. Balai Penelitian Tanaman Hias. Cipanas. 1 hal.
Sanjaya, L. 1996. Krisan, bunga potong dan tanaman pot yang menawan. Jurnal Penelitian dan Pengembangan Pertanian. XV(3):55-60.
Sihombing, M. dan Rahayuningsih. 2004. Krisan Kian Digemari dan Menguntungkan. http://www.bisnis.com/servlet/page?. Jakarta. [18 Mei 2004].
Singarium, P. 1994. Effect of coir pith as an amendment for tannery polkited soils. Madras Aric. J. 81(10):548-549.
Soeminto B. 1985. Manfaat Tenaga Atom untuk Kesejahteraan Manusia. CV. Karya Indah. Jakarta. 236 hal.
Soedjono. 1992. Mutasi Imbas terhadap Bibit Alpinia purpurata. Jurnal
Hortikultura. Jakarta. Vol. 2 No. 4(1-5).
Sparrow, A.H. 1961. Types of Ionizing Radiation and Their Cytogenic Effects. p 55-119. Symposium of Mutation anf Plant Breeding. National Academic Sciences. Washington D.C.
Syafni, 2006. Induksi Keragaman Genetik Gloxinia (Siningia speciosa Benth.)
melalui Radiasi Sinar Gamma. Tesis. Program Pasca Sarjana. Institut Pertanian Bogor. Bogor. Tidak Dipublikasikan.
Valeria, B. K., M.P. Nikolai dan Y.G. Yari. 1997. Somaclonal variation and in vitro
induced mutagenesis in grapine. Plant cell, tissue and organ culture. 49 p.
Van Harten, A.M. 1998. Mutation Breeding: Theory and Practical Applications. Cambridge University Press. 353 p.
_______________. 2002. Mutation breeding of vegetatively propagated ornamental.
P. 104-128. In Vainstein A. (Ed). Bioteknologi Tanaman. PAU
Bioteknologi. IPB. Bogor. Hal 174-236.
Wattimena, G.A. dan N.A. Mattjik dan L. W. Gunawan. 1988. Teknologi Kultur Jaringan untuk Mendapatkan Berbagai Varietas Bunga melalui Keragaman Somaklonal. Seminar dan Bisnis Bunga Jakarta 6-7 Juni.
Wattimena, G.A. dan N.A. Mattjik. 1991. Pemuliaan Tanaman secara In Vitro. P
150-272. In G.A. Wattimena. (Ed.). Bioteknologi Tanaman. Tim
Laboratorium Kultur Jaringan Tanaman. Avery Publ. Group Inc. New Jersey/ 110 p.
Wilkins, H.F., W. E. Healy dan K.L. Grueber. 1990. Temperature regimes at various stage of production influences growth and flowering of Dendrathema x grandiflorum. J. Amer. Soc. Hort. Sci. 115(5):732-736.
Wulandari, A. 2001. Induksi Mutasi Krisan (Dendranthema grandiflora Tzvelev)
melalui Radiasi Stek Pucuk. [Skripsi] Fakultas Pertanian. Institut Pertanian Bogor. 36 hal. (Tidak dipublikasikan).
Wuryaningsih, S. 2008. Kajian karakter kuantitatif tanaman hias bunga potong krisan. http://www.wuryan.wordpress.com. [10 November 2008].
______________, A. Muharram dan I. Rusyadi. 2002 Tanggapan tiga kultivar mawar terhadap media tumbuh tanpa tanah. J. Hortikultura. 13 (2) : 76 – 85.
LAMPIRAN
Lampiran 1. Sidik Ragam Peubah Jumlah Tunas Hidup
Minggu I
Source DF Type III SS Mean Square F Value Pr > F
D 3 7.65203252 2.55067751 21.35 0.0001
K 3 0.99811247 0.33270416 2.78 0.0486
D*K 9 1.78357327 0.19817481 1.66 0.1199
Minggu II
Source DF Type III SS Mean Square F Value Pr > F
D 4 14.26116230 3.56529057 99999.99 0.0001
K 3 0.72009292 0.24003097 99999.99 0.0001
D*K 12 2.97264563 0.24772047 99999.99 0.0001
Minggu III
Source DF Type III SS Mean Square F Value Pr > F
D 4 3.46063907 0.86515977 9.26 0.0001
K 3 1.36576381 0.45525460 4.87 0.0037
D*K 12 1.49855594 0.12487966 1.34 0.2161
Minggu IV
Source DF Type III SS Mean Square F Value Pr > F
D 4 2.81884637 0.70471159 8.13 0.0001
K 3 0.90662134 0.30220711 3.49 0.0198
D*K 12 1.90133234 0.15844436 1.83 0.0585
Minggu V
Source DF Type III SS Mean Square F Value Pr > F
D 4 3.86204521 0.96551130 10.43 0.0001
K 3 0.66616935 0.22205645 2.40 0.0747
D*K 12 1.49048072 0.12420673 1.34 0.2141
Minggu VI
Source DF Type III SS Mean Square F Value Pr > F
D 4 2.52289088 0.63072272 6.52 0.0002
K 3 0.81399753 0.27133251 2.80 0.0458
Lampiran 2. Sidik Ragam Peubah Tinggi Tunas
Minggu II
Source DF Type III SS Mean Square F Value Pr > F
D 4 0.17637259 0.04409315 3.04 0.0222
K 3 0.22496654 0.07498885 5.16 0.0026
D*K 12 0.17966551 0.01497213 1.03 0.4297
Minggu III
Source DF Type III SS Mean Square F Value Pr > F
D 4 1.67519027 0.41879757 7.92 0.0001
K 3 1.43094518 0.47698173 9.02 0.0001
D*K 12 1.44685380 0.12057115 2.28 0.0155
Minggu IV
Source DF Type III SS Mean Square F Value Pr > F
D 4 6.59347224 1.64836806 13.42 0.0001
K 3 3.16337281 1.05445760 8.59 0.0001
D*K 12 3.66297283 0.30524774 2.49 0.0084
Minggu V
Source DF Type III SS Mean Square F Value Pr > F
D 4 13.00861298 3.25215324 6.46 0.0002
K 3 9.10068516 3.03356172 6.02 0.0010
D*K 12 10.97074918 0.91422910 1.81 0.0607
Minggu VI
Source DF Type III SS Mean Square F Value Pr > F
D 4 66.29477307 16.57369327 3.66 0.0090
K 3 44.93823023 14.97941008 3.31 0.0248