PEMBERIAN KADAR PROTEIN PAKAN BERBEDA
TERHADAP PERTUMBUHAN UDANG VANAME
Litopenaeus vannamei
DENGAN TEKNOLOGI BIOFLOK
PADA KEGIATAN PENDEDERAN
TEUKU MUHAMMAD HAJA AL MUQARAMAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemberian Kadar Protein Pakan Berbeda Terhadap Pertumbuhan Udang Vaname Litopenaeus vannamei dengan Teknologi Bioflok pada Kegiatan Pendederan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
RINGKASAN
TEUKU MUHAMMAD HAJA AL MUQRAMAH. Pemberian Kadar Protein Pakan Berbeda Terhadap Pertumbuhan Udang Vaname Litopenaeus vannamei dengan Teknologi Bioflok pada Kegiatan Pendederan. Dibimbing oleh MIA SETIAWATI dan NUR BAMBANG PRIYOUTOMO.
Budidaya udang vaname Litopenaeus vannamei memiliki prospek sangat bagus untuk dikembangkan sehingga ketersedian juvenil berkualitas dengan kuantitas yang berkelanjutan sangat diperlukan untuk kegiatan pembesaran, terutama untuk pembesaran dengan sistem karamba jaring apung (KJA) di laut. Upaya untuk menjamin ketersediaan juvenil dapat dimulai melalui kegiatan pendederan dengan menggunakan sistem intensif. Penerapan budidaya intensif berdampak pada penggunaan jumlah pakan yang diberikan pada udang meningkat. Hal ini menimbulkan beberapa permasalahan seperti tingginya kebutuhan pakan dan biaya pengadaan pakan. Teknologi bioflok telah berhasil dikembangkan untuk mengurangi limbah kegiatan budidaya dan dengan terdapatnya bakteri heterotrof yang membentuk flok dapat menjadi sumber pakan alami udang. Oleh karena itu, diduga bioflok dapat meminimalisir kebutuhan protein sehingga efesiensi pakan dapat ditingkatkan.
Penelitian ini bertujuan untuk mengevaluasi pemberian kadar protein pakan berbeda terhadap pertumbuhan juvenil udang vaname L. vannamei dengan teknologi bioflok pada kegiatan pendederan. Rancangan percobaan yang digunakan adalah rancangan acak lengkap (RAL) dengan 4 perlakuan dan 3 ulangan. Perlakuan yang dicobakan adalah udang uji dipelihara dalam media bioflok dengan pemberian pakan: (A) protein 30%, (B) protein 35%, (C) protein 40% dan (K) pemberian protein 40% tanpa teknologi bioflok. Penelitian dilakukan pada akuarium berukuran 60x40x40 cm3, ketinggian air 30 cm, dengan volume air 72 L, yang dilengkapi dengan 3 titik aerasi. Pemeliharaan udang dilakukan selama 28 hari, udang uji yang digunakan adalah udang vaname L. vannamei PL 16 dengan bobot rata-rata 0,03±0,04 g/ekor dan panjang total rata-rata 1,60±1,69 cm/ekor yang ditebar dengan kepadatan 1528 ekor/m3 (108 ekor/akuarium). Selama pemeliharaan udang, frekuensi pemberian pakan diberikan 4 kali sehari (06.00, 11.00, 16.00 dan 21.00 WIB) dengan feeding rate sebesar 25%.
menunjukan hasil lebih tinggi dibandingkan kontrol (tanpa teknologi bioflok) (P<0.05). Pada parameter stres (glukosa plasma tubuh) diakhir pemeliharan terlihat bahwa pemberian kadar protein pakan 35% dengan teknologi bioflok memiliki kadar glukosa plasma tubuh lebih rendah (73,02 mg/dL) dibandingkan perlakuan lainnya. Hasil dari parameter kualitas air selama masa pemeliharan dengan teknologi bioflok masih berada pada kisaran optimal untuk kelayakan budidaya.
Berdasarkan penelitian ini dapat disimpulkan bahwa dengan teknologi bioflok, maka kegiatan pendederan udang vaname dapat diberikan pakan dengan kadar protein 35% yang memberikan peningkatan efisiensi pakan (63%), pertumbuhan panjang (42%), pertumbuhan bobot (46%) dan kelangsungan hidup mencapai (96,06%) dibandingkan dengan pemberian pakan dengan kadar protein 40% tanpa teknologi bioflok.
SUMMARY
TEUKU MUHAMMAD HAJA AL MUQRAMAH. Different Feed Protein Level on Growth Performance of White Shrimp Litopenaeus vannamei with Biofloc Technology on Nursery Activity. Supervised by MIA SETIAWATI and NUR BAMBANG PRIYOUTOMO.
White shrimp (Litopenaeus vannamei) culture has very good prospects to be expanded, so that the availability of juvenile with quality and sustainable quantity is necessary for grow-out activity, especially for grow-out with floating cage system in the sea. The efforts to ensure the availability of juvenile can be initiated through the nursery by using an intensive system. Application of intensive culture was impacted on increased of the use feed quantity on the shrimp. It is causes several problems such as the incresed of quantity and costs for feed on shrimp culture activity. Biofloc technology has been successfully developed to reduced waste of aquaculture and the heterotrophic bacteria in biofloc can be a source of natural food for shrimp. Therefore, biofloc technology was expected can minimize the feed protein requirement so that the feed efficiency can be improved.
The aimed of this research was to evaluated the different feed protein level on growth performance of white shrimp juvenile with biofloc technology on nursery activity. The experimental design was completely randomized design (CRD) with four design and three replication, shrimps were reared in biofloc water; (A) shrimps were feed with 30% protein, (B) shrimps were feed with 35% protein, (C) shrimps were feed with 40% protein, and (K) shrimps were feed with 40% protein without biofloc technology. This research used aquarium with dimensions 60x40x40 cm3, 30 cm water level, 72 L water volume in aquarium with three spot aeration. This research carried out during 28 days, the white shrimp which used were postlarvae PL-16 with 0,03±0,04 g body weight average and 1,60±1,69 cm body length average, the stocking density were 1528 postlarvae/m3 (108 postlarvae/aquarium). Feeding frequency were four time a day (06.00 am, 11.00 am , 04.00 pm, and 09.00 pm) with feeding rate was 25%.
The conclusion based on this research, the biofloc technology can used for shrimp nursery activity with feeding 35% protein which incresed feed efficiency (63%), the growth of length (42%) and weight (46%) and also survival rate (96.06%). These results were higher than the shrimp feeding 40% protein without biofloc technology.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PEMBERIAN KADAR PROTEIN PAKAN BERBEDA
TERHADAP PERTUMBUHAN UDANG VANAME
Litopenaeus vannamei
DENGAN TEKNOLOGI BIOFLOK
PADA KEGIATAN PENDEDERAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Pemberian Kadar Protein Pakan Berbeda Terhadap Pertumbuhan Udang Vaname Litopenaeus vannamei Dengan Teknologi Bioflok Pada Kegiatan Pendederan
Nama : Teuku Muhammad Haja Al Muqaramah NIM : C151130131
Disetujui oleh Komisi Pembimbing
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dengan
judul “Pemberian Kadar Protein Pakan Berbeda Terhadap Pertumbuhan Udang Vaname Litopenaeus vannamei dengan Teknologi Bioflok pada Kegiatan
Pendederan” dilaksanakan sejak bulan Maret-April 2015 di Fasilitas Praktek Program Ilmu Perikanan, Diploma, Kampus Gunung Gede, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada:
1. Ibu Dr. Ir. Mia Setiawati, M.Si, Bapak Dr. Ir. Nur Bambang Priyoutomo M.Si selaku pembimbing atas kesabaran, arahan, bimbingan dan motivasi sejak penyusunan rencana penelitian sampai penyusunan tesis ini.
2. Bapak Ir. Irzal Effendi M.Si selaku ketua Penelitian Institusi di bawah lembaga PKSPL, LPPM, IPB atas izin untuk bergabung dalam bagian penelitian ini, serta saran dan dukungan dalam menjalankan penelitian ini.
3. Ibu Dr. Widanarni, M.Si selaku Ketua Program Studi Ilmu Akuakultur atas arahan, masukan dan perbaikan tesis ini.
4. Ibu Dr. Dinamella Wahjuningrum, S.Si, M.Si selaku penguji luar komisi, atas arahan dan masukan untuk perbaikan dalam penyusunan tesis ini.
5. Ayah dan ibu tercinta serta saudara-saudaraku atas doa dan dukungan yang tidak pernah surut selama ini.
6. Teknisi Laboratorium BDP IPB; Bapak Wasjan dan Mbak Retno (Lab Nutrisi FPIK IPB) Bapak Jajang dan Kang Abe (Lab Lingkungan FPIK IPB), yang telah membantu penulis selama melakukan analisa laboratorium.
7. Teknisi Fasilitas Praktek Program IKN, Diploma, IPB; Kang Narya yang telah membantu Penulis selama menjalankan penelitian.
8. Rekan-rekan terbaik Shavika Miranti, S.Pi, M.Si, Wiwik Hildayanti, S.Pi, M.Si, dan Didi Humaidi Yusuf, S.Pi, M.Si, yang telah membantu selama penelitian berlangsung serta semua rekan-rekan mahasiswa Program Mayor Ilmu Akuakultur angkatan 2013, Ikamapa Aceh, Nanda Rizki Purnama, S.Kel, M.Si, Sufal Diansyah S.Kel, M.Si atas kebersamaan dan kerjasama yang baik serta bantuannya dalam perkuliahan, penelitian dan penyelesaian karya ilmiah ini.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR LAMPIRAN v
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
2 METODE 2
Persiapan Wadah dan Penyediaan Bioflok 2
Pemeliharaan Udang Uji 3
Parameter Pengamatan 4
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 10
4 SIMPULAN DAN SARAN 14
Simpulan 14
Saran 14
DAFTAR PUSTAKA 15
LAMPIRAN 18
RIWAYAT HIDUP 29
DAFTAR TABEL
1 Formulasi bahan baku pakan (%) bobot kering pada pakan protein
A (30%), (B 35%), C dan K (40%) 3
2 Komposisi proksimat pakan udang vaname Litopenaeus vannamei pada pakan protein A 30%, B 35%, C dan K 40% (% bobot kering) 4 3 Komposisi nutrien bioflok yang terbentuk pada media pemeliharaan
udang vaname Litopenaeus vannamei dengan pemberian protein pakan berbeda selama 28 hari masa pemeliharaan 8 4 Nilai indeks asam amino esensial (EAAI) pakan dan bioflok selama
pemeliharan udang vaname Litopenaeus vannamei pada perlakuan pakan protein berbeda selama 28 hari masa pemeliharaan 8 5 Parameter pengamatan yang diukur pada pemeliharaan udang vaname
Litopenaeus vannamei dengan pemberian protein pakan berbeda
selama 28 hari masa pemeliharaan 9
6 Kadar glukosa plasma tubuh udang vaname Litopenaeus vannamei dengan pemberian protein berbeda selama 28 hari masa pemeliharaan 9 7 Parameter kualitas air pada media pemeliharaan udang vaname
Litopenaeus vannamei dengan pemberian protein berbeda selama 28
hari masa pemeliharaan 10
DAFTAR LAMPIRAN
1 Prosedur penambahan karbon (De Schryver et al. 2008) 18 2 Prosedur analisa proksimat untuk pakan, tubuh udang, dan bioflok 18 3 Prosedur analisis kadar glukosa menggunakan KIT Glucose GOD FS
dari DiaSys International 21
4 Komposisi proksimat tubuh udang vaname Litopenaeus vannamei (% bobot kering) pada perlakuan pemberian pakan protein A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi bioflok selama 28 hari masa pemeliharaan 21 5 Komposisi profil asam amino pakan udang vaname Litopenaeus
vannamei pada perlakuan pemberian pakan protein A 30%, B 35%, C dan K 40% selama 28 hari masa pemeliharaan 22 6 Komposisi profil asam amino bioflok udang vaname Litopenaeus
vannamei pada perlakuan pemberian pakan protein A 30%, B 35%,
dan C 40% selama 28 hari masa pemeliharaan 22
7 Komposisi profil asam amino udang vaname Litopenaeus vannamei pada perlakuan pemberian pakan protein A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi
bioflok selama 28 hari masa pemeliharaan 23
8 Analisis statistik parameter pengamatan pada perlakuan pemberian protein pakan A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi bioflok selama 28 hari masa
pemeliharaan 24
9 Rumus indeks asam amino esensial (EAAI) pada pakan dan bioflok
1
1
PENDAHULUAN
Latar Belakang
Budidaya udang vaname Litopenaeus vannamei memiliki prospek sangat bagus untuk dikembangkan sehingga ketersedian juvenil berkualitas dengan kuantitas yang berkelanjutan sangat diperlukan untuk kegiatan pembesaran. Saat ini, pemanfaatan potensi laut untuk kegiatan marinkultur sedang dikembangkan, salah satunya adalah terobosan membudidayakan udang vaname menggunakan sistem keramba jaring apung (KJA) di laut. Hal ini juga sebagai upaya dalam mengatasi kondisi lahan darat yang semakin kompetitif. Kondisi pemeliharaan udang di keramba jaring apung (KJA) membutuhkan benur yang berkualitas dan memiliki daya tahan tubuh yang tinggi. Menjamin ketersedian juvenil tersebut, dapat diperoleh dari persiapan juvenil melalui tahap pendederan dengan menggunakan sistem intensif. Namun sistem tersebut memiliki beberapa kendala karena menggunakan padat tebar tinggi sehingga meningkatkan jumlah pakan yang diberikan. Pakan yang digunakan pada sistem intensif juga sangat bergantung pada pakan buatan dengan kadar protein pakan tinggi. Hal ini menyebabkan pakan buatan memiliki peranan penting dalam budidaya karena diperkirakan dapat mencapai 60-80% dari total biaya produksi (Priyadi et al. 2008). Hasil limbah dari metabolisme dan sisa pakan yang tidak termakan terutama limbah nitrogen dapat menjadi toksik bagi udang (Avnimelech dan Ritvo 2003).
Saat ini, teknologi bioflok (BFT-Bio-flocs technology) mulai dikembangkan untuk mengurangi limbah kegiatan budidaya (Avnimelech 2006; 2007). Teknologi bioflok merupakan teknologi budidaya yang didasarkan kepada prinsip asimilasi nitrogen anorganik (amonia, nitrit, dan nitrat) oleh komunitas mikroba (bakteri heterotrof) dalam media budidaya sebagai sumber nutrisi bakteri (De Schryver et al. 2008). Bioflok merupakan suspensi yang terdapat di dalam air yang berupa fitoplankton, bakteri, agregat hidup, bahan organik dan pemakan bakteri (Avnimelech 2007). Tujuan dikembangkannya teknologi bioflok ini adalah untuk memperbaiki dan mengontrol kualitas air budidaya, biosekuriti, membatasi penggunaan air, serta efisiensi penggunaan pakan (Avnimelech 2012). Flok mikroba ini mengandung nutrisi seperti protein (19,0-40,6%), lemak (0,46-11,6%), dan abu (7-38,5%) yang cukup baik bagi ikan/udang budidaya (Tacon 2000; Ekasari 2008). Menurut Avnimelech (1999) menyatakan bahwa pada teknologi bioflok terdapat bakteri heterotrof yang membentuk flok dapat dimanfaatkan oleh hewan akuatik sehingga terbukti mampu mengurangi nitrogen anorganik dan menggantikan protein pakan.
2
dibudidayakan. Pengurangan kadar protein dalam suatu pakan, tetapi tetap dapat memberikan kinerja pertumbuhan yang baik pada udang vaname melalui penggunaan teknologi bioflok ini perlu diketahui lebih lanjut. Hal ini diharapkan, pemanfaatan limbah budidaya dan upaya penggunaan pakan lebih efesien sehingga dapat menurunkan biaya produksi.
Perumusan Masalah
Penerapan budidaya intensif berdampak pada peningkatan pemberian jumlah pakan pada udang. Hal ini menimbulkan beberapa permasalahan seperti tingginya kebutuhan pakan dan biaya pengadaan pakan. Selain itu, limbah yang dihasilkan dari metabolisme udang juga ikut meningkat sehingga untuk mengatasi hal ini perlu digunakan sistem pemeliharaan menggunakan teknologi bioflok. Bioflok dimanfaatkan oleh udang sebagai sumber pakan alami, sehingga diduga kebutuhan protein dapat diminimalisirkan dan efisiensi pakan dapat ditingkatkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi pemberian kadar protein pakan berbeda terhadap pertumbuhan udang vaname L. vannamei dengan teknologi bioflok pada kegiatan pendederan.
Hipotesis
Pemberian kadar protein pakan tertentu dengan metode pemeliharaan teknologi bioflok dapat meningkatkan nutrisi untuk pertumbuhan udang vaname L. vannamei pada kegiatan pendederan.
2
METODE
Persiapan Wadah dan Penyediaan Bioflok
3
Pemeliharaan Udang Uji
Udang vannamei PL16 berbobot 0,03±0,04 g/ekor dan berukuran 1,60±1,69 cm/ekor ditebar dengan kepadatan 1.528 ekor/m3 atau 110 ekor/ akuarium, dipelihara selama 28 hari. Selama pemeliharaan udang, frekuensi pemberian pakan diberikan 4 kali sehari (06.00, 11.00, 16.00 dan 21.00 WIB) dengan feeding rate sebesar 25%.
Penelitian terdiri dari 4 perlakuan dengan 3 kali ulangan. Menggunakan rancangan acak lengkap (RAL) dengan kadar protein pakan berbeda sebagai faktor perlakuan. Penempatan wadah penelitian dilakukan secara acak.
Perlakuan yang dicobakan adalah :
Perlakuan A = Pemberian formulasi pakan dengan protein 30%. Perlakuan B = Pemberian formulasi pakan dengan protein 35%.
Perlakuan C = Pemberian formulasi pakan dengan protein 40%.
Perlakuan K = Pemberian formulasi pakan dengan protein 40% tanpa perlakuan bioflok sebagai kontrol.
Perlakuan kontrol adalah perlakuan yang tidak ditambahkan sumber karbon eksternal (molase) ke dalam wadah perlakuan. Pada perlakuan kontrol juga dilakukan penyiponan setiap tiga hari sekali.
Pakan perlakuan dengan kadar protein berbeda 30%, 35%, 40%, dan 40% tanpa perlakuan bioflok sebagai kontrol, C/P rasio 10, sedangkan GE (Gross Energy) yaitu 1 g protein = 5,6 kkal GE, 1 g lemak = 9,4 kkal GE, 1 g karbohidrat/BETN = 4,1 kkal GE (Watanabe, 1988). Pada pembuatan pakan perlakuan sebagai sumber protein yaitu tepung ikan, tepung udang, lemak yaitu minyak ikan, minyak jagung dan karbohidrat yaitu tepung pollard, tepung bungkil kedelai. Adapun formulasi pakan yang digunakan dalam penelitian dapat dilihat pada Tabel 1 di bawah ini.
Tabel 1 Formulasi bahan baku pakan (%) bobot kering pada pakan protein A (30%), (B 35%), C dan K (40%)
Bahan(%) Pakan Perlakuan (protein %)
A(30%) B(35%) Cdan K (40%)
Tepung Kepala Udang 30,00 22,50 25,00
Tepung Bungkil Kedelai 6,00 14,00 20,00
4
Tabel 2 Komposisi proksimat pakan udang vaname Litopenaeus vannamei pada pakan protein A 30%, B 35%, C dan K 40% (% bobot kering) Energi Total (kkal/g) 3394,89 3850,19 4020,60 BETN* = Bahan ekstrak tanpa nitrogen
Parameter Pengamatan
Pengumpulan data bobot dan panjang udang dilakukan saat sampling setiap 7 hari sekali, sedangkan jumlah udang yang hidup dihitung pada sampling terakhir. Hasil sampling bobot dan panjang menjadi dasar penentuan jumlah pakan yang diberikan setiap harinya dengan mengasumsikan tingkat kelangsungan hidup pada minggu sampling tersebut. Parameter uji yang diukur meliputi volume flok, nutrien flok, panjang relatif, laju pertumbuhan harian, efisiensi pakan, tingkat kelangsungan hidup, retensi protein dan retensi lemak dihitung pada akhir pengamatan (pada hari ke 28). Selama pemeliharaan diukur parameter stres, analisi kimia dan parameter kualitas air.
Volume Flok
Volume flok merupakan reprentasi dari kepadatan partikel flok dalam suatu kolom air Avnimelech (2012). Sebanyak 50 ml sampel air diendapkan selama 30 menit dalam tabung conical 50 ml. Volume flok yang mengendap dicatat dan selanjutnya dihitung dengan rumus :
Volume flok (mL/L) = olume ndapan
olume ampel ir
1000
Nutrien Flok
Nutrien flok diketahui melalui analisis proksimat bioflok meliputi kadar protein, lemak, abu, dan serat kasar dilakukan pada awal, tengah dan akhir penelitian. Nutrien flok diukur dengan menggunakan metode Takeuchi (1988). Prosedur analisis dapat dilihat pada Lampiran 2.
Panjang Relatif
Panjang relatif (PR) adalah presentase pertambahan udang setiap hari selama penelitian. Panjang relatif dihitung dengan menggunakan rumus (Acarli & Lok, 2008):
5 Keterangan:
PR : Panjang Relatif (%)
Lt : Panjang rata-rata ikan pada akhir penelitian (cm) Lo : Panjang rata-rata ikan pada awal penelitian (cm) T : Lama waktu pemeliharaan (hari)
Laju Pertumbuhan Harian
Laju pertumbuhan harian (α) adalah presentase pertambahan udang setiap hari selama penelitian. Laju pertumbuhan harian udang dihitung dengan menggunakan rumus (Huisman 1987) sebagai berikut:
[ √ ]
Keterangan:
α : Laju Pertumbuhan Harian %
Wo : Bobot tubuh rata-rata pada awal pemeliharaan (g) Wt : Bobot tubuh rata-rata pada akhir pemeliharaan (g) n : Lama waktu pemeliharaan
Efisiensi Pakan
Efisiensi pakan merupakan perbandingan biomassa udang dengan jumlah pakan yang diberikan selama massa pemeliharaan. Efisiensi pakan dapat dihitung dengan menggunakan rumus Takeuchi (1988):
Keterangan:
EP : Efisiensi Pakan %
F : Jumlah pakan yang diberikan selama pemeliharaan (g) Wt : Bobot total udang pada akhir pemeliharaan (g)
Wo : Bobot total udang pada awal pemeliharaan (g) Wd : Bobot total udang mati (g)
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (TKH) adalah perbandingan jumlah ikan yang hidup sampai akhir pemeliharaan dengan jumlah ikan pada awal pemeliharaan, yang dihitung menggunakan rumus dari Goddard (1996) yaitu:
TKH =
Keterangan:
TKH : Tingkat kelangsungan hidup (%)
6
Retensi Protein
Nilai Retensi Protein dapat dihitung dengan menggunakan rumus Watanabe et al. (2001):
Nilai retensi lemak dapat dihitung dengan menggunakan rumus Watanabe et al. (2001):
Pengambilan plasma tubuh udang dilakukan dengan cara menggerus udang pada wadah mortar dengan perbandingan udang dan Na-sitrat 3,8% sebagai antikoagulan sebanyak 1:10. Selanjutnya hasil gerusan dimasukkan dalam mikrotube lalu disentrifuse dengan kecepatan 3000 rpm selama 5 menit. Supernatan yang diperoleh dipisahkan untuk uji glukosa dari plasma tubuh udang tersebut.
Parameter Stres
Glukosa Plasma Tubuh
Analisis kadar glukosa menggunakan KIT Glucose GOD FS dari DiaSys International (Lampiran 3) dan dihitung menggunakan rumus berikut ini (Wedemeyer dan Yasutake, 1977) :
Keterangan :
[GD] : Konsentrasi glukosa darah (mg/dL) AbsSp : Absorbansi sampel
AbsSt : Absorbansi standar
[GSt] : Konsentrasi glukosa standar (mg/dL)
Parameter Kimia
Parameter kimia terdiri dari analisis proksimat dan analisis asam amino. Analisis proksimat tubuh udang meliputi kadar protein kasar, lemak kasar, abu, dan air dilakukan pada awal penelitian dan akhir penelitian. Sebanyak 20 g udang dari setiap perlakuan dan ulangan digunakan untuk analisis proksimat tubuh
7 (Lampiran 4). Analisis asam amino dilihat pada pakan, bioflok dan pada udang. Analisis asam amino pada pakan dilihat pada awal penelitian, sedangkan untuk bioflok dan udang dilihat pada akhir penelitian (Lampiran 5, 6, 7).
Parameter Kualitas Air
Parameter kualitas air yang diukur meliputi suhu, pH, DO (Dissolved oxygen), salinitas, amonia, nitrit dan nitrat. Pengukuran amonia, nitrit, nitrat dilakukan setiap 1 minggu sekali setelah sampling. Sedangkan suhu, pH, DO, dan salinitas dilakukan 3 hari sekali. Parameter kualitas air berupa amonia, nitrit dan nitrat diukur dengan menggunakan alat spectrofotometer.
Analisis Data
Rancangan percobaan yang akan digunakan adalah rancangan acak lengkap (RAL) dengan 4 perlakuan dan 3 ulangan. Data hasil perhitungan ditabulasi dan dianalisis menggunakan program Microsoft Excel 2013 dan SPSS 22.0. Untuk mengetahui pengaruh perlakuan terhadap setiap parameter yang diuji maka digunakan analisis ragam dan uji lanjutan menggunakan uji Duncan (Lampiran 8).
3
HASIL DAN PEMBAHASAN
Hasil
Data hasil mengenai rata-rata volume flok, nutrien flok, panjang relatif, laju pertumbuhan harian, efisiensi pakan, tingkat kelangsungan hidup, retensi protein dan retensi lemak ditunjukkan pada Gambar 1 dan Tabel 3,4 di bawah ini.
8
Gambar 1 Volume flok yang terbentuk pada media pemeliharaan udang vaname Litopenaeus vannamei dengan pemberian protein berbeda selama 28 hari masa pemeliharaan
Hasil volume flok pada akhir pengamatan menunjukkan perbedaan yang sangat signifikan diantara perlakuan (P<0.05), lampiran 8. Berdasarkan Gambar 1 dapat diketahui bahwa nilai tertinggi volume flok terdapat pada perlakuan pemberian protein pakan 40% yaitu 21 mL/L pada akhir pemeliharaan.
Tabel 3 Komposisi nutrien bioflok yang terbentuk pada media pemeliharaan udang vaname Litopenaeus vannamei dengan pemberian protein pakan berbeda selama 28 hari masa pemeliharaan
Komposisi
(-) tidak dilakukan pengukuran (perlakuan tersebut tidak diproksimat) BETN*= Bahan ekstrak tanpa nitrogen
GE** = Gross energi = 1 gram protein= 5,6 kkal GE, 1 gram lemak = 9,4 kkal GE, 1 gram BETN = 4,1 kkal GE. (Watanabe 1988)
Flok yang terbentuk pada pemberian protein pakan berbeda, memiliki nilai nutrien yang berbeda. Nilai nutrien tertinggi terdapat pada perlakuan kadar protein pakan 40% dengan teknologi bioflok yaitu memiliki nilai gross energi (GE) 2619,64 kkal/kg.
Nilai indeks asam amino esensial (EAAI) padapakan dan pada bioflok yang diamati selama pengamatan ditunjukkan dalam Tabel 4 di bawah ini.
Tabel 4 Nilai indeks asam amino esensial (EAAI) pakan dan bioflok selama pemeliharan udang vaname Litopenaeus vannamei pada perlakuan pakan protein berbeda selama 28 hari masa pemeliharaan
Nilai EAAI Perlakuan Bioflok
Perlakuan Tanpa Bioflok
A(30%) B(35%) C(40%) Kontrol K(40%)
Pakan % 66,27 61,75 54,06 54,06
Bioflok % 0,82 0,92 1,84 -
Keterangan : Nilai yang tertera merupakan nilai rata-rata asam amino esensial.
9 30% dan kandungan terendah terdapat pada perlakuan protein pakan 40%. Sedangkan hasil EAAI pada bioflok, tertinggi terdapat pada perlakuan protein pakan 40% dan kandungan terendah pada perlakuan protein pakan 30%.
Parameter pengamatan yang diukur selama pengamatan ditunjukkan pada Tabel 5 di bawah ini.
Tabel 5 Parameter pengamatan yang diukur pada pemeliharaan udang vaname Litopenaeus vannamei dengan pemberian protein pakan berbeda selama 28 hari masa pemeliharaan Keterangan : Huruf superscript yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan
yang berbeda nyata (P<0.05). Nilai yang tertera merupakan nilai rata-rata ± standard deviasi. Total JKP* = Total jumlah konsumsi pakan. LPH Bobot** = Laju pertumbuhan hari bobot.
Berdasarkan Tabel 5 di atas diketahui bahwa panjang relatif, laju pertumbuhan bobot harian, nilai efisiensi pakan, kelangsungan hidup, nilai retensi protein dan retensi lemak pada pemberian pakan protein 30, 35, dan 40% dengan teknologi bioflok memberikan nilai berbeda lebih tinggi dengan pakan protein 40% tanpa teknologi bioflok (P<0.05; Lampiran 8).
Parameter stres (glukosa plasma tubuh) yang diamati selama pengamatan ditunjukkan pada Tabel 6 di bawah ini.
Tabel 6 Kadar glukosa plasma tubuh udang vaname Litopenaeus vannamei dengan pemberian protein berbeda selama 28 hari masa pemeliharaan
Glukosa plasma Perlakuan
10
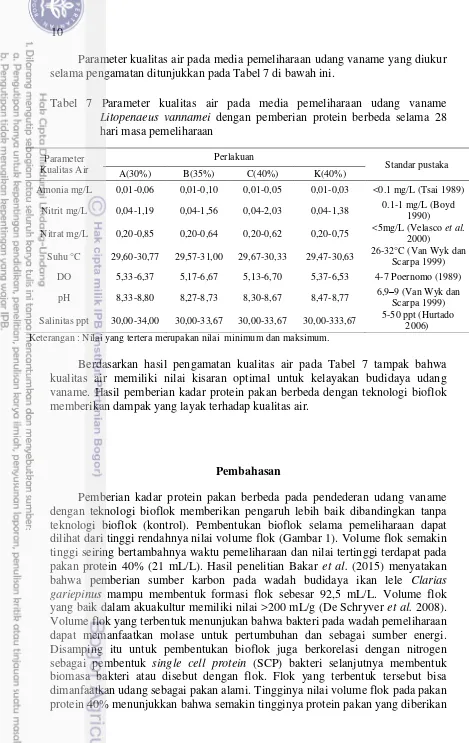
Parameter kualitas air pada media pemeliharaan udang vaname yang diukur selama pengamatan ditunjukkan pada Tabel 7 di bawah ini.
Tabel 7 Parameter kualitas air pada media pemeliharaan udang vaname Litopenaeus vannamei dengan pemberian protein berbeda selama 28
hari masa pemeliharaan
Amonia mg/L 0,01-0,06 0,01-0,10 0,01-0,05 0,01-0,03 <0.1 mg/L (Tsai 1989)
Nitrit mg/L 0,04-1,19 0,04-1,56 0,04-2,03 0,04-1,38 0.1-1 mg/L (Boyd 1990)
Nitrat mg/L 0,20-0,85 0,20-0,64 0,20-0,62 0,20-0,75 <5mg/L (Velasco et al. 2000)
Suhu °C 29,60-30,77 29,57-31,00 29,67-30,33 29,47-30,63 26-32°C (Van Wyk dan Scarpa 1999) DO 5,33-6,37 5,17-6,67 5,13-6,70 5,37-6,53 4-7 Poernomo (1989)
pH 8,33-8,80 8,27-8,73 8,30-8,67 8,47-8,77 6,9–9 (Van Wyk dan Scarpa 1999)
Salinitas ppt 30,00-34,00 30,00-33,67 30,00-33,67 30,00-333,67 5-50 ppt (Hurtado 2006) Keterangan : Nilai yang tertera merupakan nilai minimum dan maksimum.
Berdasarkan hasil pengamatan kualitas air pada Tabel 7 tampak bahwa kualitas air memiliki nilai kisaran optimal untuk kelayakan budidaya udang vaname. Hasil pemberian kadar protein pakan berbeda dengan teknologi bioflok memberikan dampak yang layak terhadap kualitas air.
Pembahasan
11 maka semakin tinggi nitrogen yang dapat dimanfaatkan oleh bakteri sebagai pembentuk flok, semakin banyak flok yang terbentuk maka semakin tinggi volume floknya.
Pada perlakuan pemberian protein pakan berbeda, nutrien flok yang terbentuk juga berbeda-beda tergantung mikroorganisme pembentuk flok tersebut. Komposisi organisme dalam flok akan mempengaruhi struktur bioflok dan kandungan nutrien bioflok (Izquierdo et al. 2006; Ju et al. 2008). Organisme penyusun bioflok tidak hanya bakteri, fungi dan alga saja, namun ditemukan tiga kelompok lain penyusun bioflok seperti rotifer, protozoa dan cacing yang merupakan pakan alami bagi udang dihabitat aslinya (Azim and Litle 2008). Menurut (De schryver et al. 2008) bioflok mengandung protein, asam lemak tak jenuh, dan lipid yang tinggi sehingga cocok digunakan sebagai pakan untuk udang.
Penilaian kualitas protein suatu bahan makanan ditentukan oleh kadar terendah dari asam amino esensialnya, bila dibandingkan dengan kebutuhan udang sebagai standarnya. Penentuan kualitas protein dapat dilakukan membandingkan komposisi asam amino esensial yang dikandung bahan pakan dengan standar kebutuhan asam amino esensial pada hewan uji. Pengukuran asam amino esensial ini dilakukan dengan rumus indeks asam amino esensial (EAAI = Esential Amino Acid Index), yang merupakan ukuran rata-rata asam amino esensial. Hasil pengukuran indeks asam amino esensial pada pakan, tertinggi terdapat pada perlakuan protein pakan 30%. Asam amino esensial pakan tertinggi secara keseluruhan adalah sebesar 66,27% bila dibandingkan dengan kebutuhan udang. Atau dengan kata lain defisiensi masing masing asam amino esensial pakan perlakuan protein 30% sebesar 33,73% terhadap kandungan masing masing asam amino esensial dalam kebutuhan udang (Tabel 4, Lampiran 5 dan 9). Berdasarkan dari hasil pengukuran indeks asam amino esensial terlihat bahwa kandungan asam amino esensial pakan uji dapat memenuhi tingkat kebutuhan asam amino esensial bagi pertumbuhan udang. Kelengkapan asam amino esensial dalam pakan uji sangat dipengaruhi oleh penetuan kandungan energi dan protein yang terdapat dalam pakan uji tersebut dan udang dapat tumbuh normal apabila komposisi EAAI dalam pakan tidak jauh berbeda dengan komposisi EAAI dalam tubuh udang.
Hasil pengukuran EAAI pada bioflok, tertinggi terdapat pada perlakuan pemberian protein pakan 40%. Asam amino esensial bioflok tetinggi secara keseluruhan adalah sebesar 1,84% bila dibandingkan dengan kebutuhan udang. Atau dengan kata lain defisiensi masing masing asam amino esensial bioflok 98,16% terhadap kandungan masing masing asam amino esensial dalam kebutuhan udang (Tabel 4, Lampiran 6 dan 9). Berdasarkan dari hasil pengukuran EAAI terlihat bahwa kandungan asam amino esensial bioflok sangat rendah sehingga asam amino esensial bioflok tidak dapat memenuhi tingkat kebutuhan asam amino esensial udang, namun asam amino bioflok berfungsi sebagai nutrisi tambahan/ suplemen sehingga membantu meningkatkan pertumbuhan udang. Kelengkapan asam amino esensial dalam bioflok sangat dipengaruhi oleh penetuan kandungan energi dan protein yang terdapat dalam bioflok. Kandungan energi dan protein pada bioflok dipengaruhi oleh mikroorganisme pembentuk bioflok tersebut.
12
laju pertumbuhan harian bobot udang vaname tertinggi (9,85%) terdapat pada pakan protein 40% dengan teknologi bioflok diikuti dengan pemberian pakan protein 35%, 30% dan terendah (5,98%) terdapat pada pakan protein 40% tanpa teknologi bioflok (Tabel 5). Hal ini dikarenakan pemeliharaan pada teknologi bioflok, adanya penambahan molase ke dalam media pemeliharaan yang menstimulasi pertumbuhan bakteri heterotrof sehingga membentuk biomassa flok yang dapat berperan sebagai pakan alami untuk udang. Menurut Crab et al. (2012) teknologi bioflok mampu memproduksi protein pakan secara in situ dalam wadah pemeliharaan. Bioflok yang terbentuk dapat menggantikan kekurangan protein pada pakan berkadar protein rendah. Hasil pengamatan terhadap kandungan nutrisi bioflok yang tumbuh pada air media pemeliharaan udang vaname pada kadar protein pakan berbeda menunjukkan bahwa bioflok mengandung nutrisi seperti protein 12-19%, lemak 2,56-3,02% dan abu 33,42-40,77% (Tabel 3). Komposisi organisme dalam flok akan mempengaruhi struktur bioflok dan kandungan nutrisi bioflok (Izquierdo et al. 2006; Ju et al. 2008). Ju et al. (2008) melaporkan bahwa bioflok yang didominasi oleh bakteri dan mikroalga hijau mengandung protein yang lebih tinggi (38 dan 42% protein) dari pada bioflok yang didominasi oleh diatom (26%). Ekasari (2008) flok mikroba mengandung nutrisi seperti protein (19,0-40,6%), lemak (0,46-11,6%) dan abu (7-38,5%) yang cukup baik bagi ikan/ udang budidaya.
Selain meningkatkan pertumbuhan, aplikasi bioflok juga meningkatkan efisiensi pakan. Nilai efisiensi pemberian pakan selama pemeliharaan menunjukkan bahwa perlakuan teknologi bioflok berbeda signifikan dibandingkan kontrol (tanpa teknologi bioflok) (Tabel 5). Dengan teknologi bioflok, efisiensi pakan tertinggi (37.33%) terdapat pada pemberian protein pakan 40%, nilai tersebut tidak berbeda signifikan dengan protein pakan 35% (36,85%), diikuti protein pakan 30% (29,03%) (P<0.05; Lampiran 8). Hal ini menunjukan bahwa flok yang terbentuk dimanfaatkan oleh udang vaname untuk pertumbuhan karena adanya pakan alami dari flok, flok juga yang terbentuk membuat udang dapat memanfaatkan bakteri sebagai salah satu sumber protein (Beristain et al. 2005). Pada prinsipnya, nilai tambah teknologi bioflok ditentukan oleh potensinya sebagai sumber pakan tambahan udang (De Schryver et al. 2008).
13 terbentuk diduga dimanfaatkan oleh udang sebagai nutrisi tambahan sehingga dapat meningkatkan pertumbuhan.
Perlakuan pemberian kadar protein pakan berbeda dengan teknologi bioflok menunjukkan perbedaan lebih tinggi terhadap tingkat kelangsungan hidup udang vaname dibandingkan kontrol (P<0.05; Lampiran 8). Selama 28 hari masa pemeliharan, semua perlakuan memiliki nilai kelangsungan hidup sangat tinggi (Tabel 5). Pada perlakuan pakan protein 35% teknologi bioflok memiliki nilai tingkat kelangsungan hidup tertinggi mencapai (96,06%). Sesuai dengan pendapat Riani et al. (2012) menyatakan bahwa bioflok mampu meningkatkan derajat kelangsungan hidup sebesar 92% pada udang vanamei. Hal ini menunjukkan bahwa perlakuan dengan teknologi bioflok yang diberikan tidak mengganggu proses fisiologis dan tingkah laku udang, serta diduga dapat meningkatkan kondisi kesehatan. Salah satu penyusun agregat bioflok adalah bakteri, salah satunya bakteri Bacillus sp. Bakteri Basilus sp strain Bacillus substilis mampu memproduksi zat yang memiliki aktifitas antimikroba terhadap patogen Vibrio sp termasuk V alginolyticus, V. parahaemolyticus dan V. Harveyi (Balcazar dan Rojas-Luna 2007). Bakteri Bacillus sp penyusun bioflok diketahui juga dapat mengakumulasikan senyawa Poly-ß-hydroxybutyrate (PHB) yang diketahui dapat menghambat pertumbuhan dari berbagai jenis patogen (Michaud et al. 2006). Adanya kandungan PHB pada bioflok diangap dapat meningkatkan sistem imun udang sehingga memberi dampak positif terhadap kelangsungan hidup udang vaname.
Hasil pengamatan pada parameter stres selama pemeliharan terlihat bahwa kadar glukosa plasma udang tertinggi pada perlakuan pakan protein 30% (220,63 mg/dL) dibandingkan perlakuan pakan protein 40% (115,54 mg/dL) tanpa teknologi bioflok. Pada akhir pemeliharaan, perlakuan pakan protein 40% menggunakan teknologi bioflok lebih tinggi (169,68 mg/dL) dibandingkan perlakuan pakan protein 35% menggunakan teknologi bioflok (93,81 mg/dL). Terjadinya peningkatan kadar glukosa di dalam plasma mengindikasikan bahwa udang mengalami stres. Salah satu indikator yang sering terlihat dari efek metabolik akibat stres adalah peningkatan kadar glukosa dalam plasma (Evans dan Claiborne 2006). Menurut (Cuzon et al. 2004) bahwa pada golongan udang jika kadar glukosa tinggi diduga membutuhkan sumber energi yang lebih tinggi untuk proses molting maupun mekanisme dalam mempertahankan glukosa dalam hemolim.
Hasil parameter kualitas air dapat diketahui bahwa kandungan amonia selama masa pemeliharaan udang vaname berkisar antara 0,01-0,10 (mg/L). Kandung amonia tertinggi 0,10 (mg/L) pada pakan protein 35% dan terendah 0,03 (mg/L) pada pakan protein 40% kontrol (Tabel 7). Pada pakan protein 35% tidak dilakukan penyiponan sedangkan pada pakan protein 40% sebagai kontrol, dilakukan penyiponan tiga hari sekali selama masa pemeliharaan. Konsentrasi ini masih dalam kisaran optimal untuk pemeliharaan udang yaitu (<0,1 mg/L Tsai 1989).
14
(mg/L). Namun, nilai ini masih dapat ditoleransi oleh udang vaname karena tidak mengganggu pertumbuhan dan kelangsungan hidup selama masa pemeliharaan.
Kandungan nitrat dalam wadah penelitian dengan aplikasi bioflok mengalami peningkatan antara 0,20-0,85 (mg/L) (Tabel 7). Namun peningkatan tidak terlalu signifikan. Terjadinya peningkatan nitrat juga dilaporkan Avnimelech (2009), yaitu nilainya mencapai 40 (mg/L) setelah 50 hari pemeliharaan. Menurut Velasco et al. (2000) didalam aplikasi bioflok yang memanfaatkan nitrat sebagai sumber N bagi kehidupannya bukan dari jenis fitoplanton saja, tetapi juga dari beberapa jenis mikroba lainya termasuk bakteri.
Suhu pada wadah pemeliharaan udang vaname selama masa penelitian berkisar antara 29,47-31 °C (Tabel 7). Kisaran suhu tersebut masih berada pada kisaran optimal untuk pemeliharaan udang vaname. Menurut Van Wyk dan Scarpa (1999) suhu optimum pertumbuhan udang vaname berkisar 26–32 oC.
Dinamika oksigen terlarut selama masa pemeliharaan udang vaname berkisar antara 5,13-5,70 mg/L (Tabel 7). Nilai kandungan oksigen terlarut selama penelitian masih berada dalam kisaran optimal untuk pemeliharaan udang vaname. Menurut Poernomo (1988) kandungan oksigen terlarut dalam air yang dapat mendukung kehidupan udang ninimum 3 mg/L, sedangkan untuk pertumbuhan yang normal bagi udang yaitu 4-7 mg/L.
Nilai kisaran pH selama penelitian masih berada pada kisaran optimal yaitu 8,30–8,80 (Tabel 7). Menurut Avnimelech et al. (2009) perubahan konsentrasi pH dapat disebabkan oleh adanya proses nitrifikasi dalam wadah budidaya. Dari hasil penelitian ini menunjukkan nilai pH pemeliharaan udang vaname sesuai dan dapat mendukung pertumbuhan secara baik. Udang mampu mentolerir pH pada kisaran 6,9–9 (Van Wyk dan Scarpa 1999)
Salinitas berperan dalam pengaturan osmoregulasi. Hasil pengukuran salinitas pada pemeliharaan udang vaname berkisar antara 30-34 ppt (Tabel 7). Nilai kisaran tersebut masih dapat ditolerir oleh udang vaname dan dari hasil penelitian ini memberikan pertumbuhan yang baik karena salinitas berada pada kisaran optimal. Menurut Hurtado et al. (2006) mengemukakan bahwa udang vaname dapat hidup pada kondisi salinitas yang lebar yakni bekisar 5-50 ppt.
4
SIMPULAN DAN SARAN
Simpulan
Kegiatan pendederan udang vaname dengan teknologi bioflok dapat diberikan pakan kadar protein 35% menghasilkan efisiensi pakan dan kelangsungan hidup sama dengan protein pakan 40%.
Saran
15
DAFTAR PUSTAKA
Acarli S, Lok A. 2008. Larvae Development Stages of the European Flat Oyster (Ostrea edulis). The Israeli Journal of Aquaculture-Bamidgeh. 61 (2): 114-120. Avnimelech Y. 1999. Carbon/nitrogen ratio as a control element in aquaculture
sytems. Aquaculture. 176 : 227-235.
Avnimelech Y, Ritvo G. 2003. Shrimp and fish pond soils: processes and management. Aquaculture. 220: 549–567.
Avnimelech Y. 2006. Bio-filters: The need for a new comprehensive approach. Aquaculture. 34: 172 – 178
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs tecnology ponds. Aquaculture. 264: 140-147.
Avnimelech Y. 2009. Biofloc Technology. World Aquaculture Society, Louisiana, USA. 182 p.
Avnimelech Y. 2012. Biofloc technology- a practical guide book, 2nd edition. United States: The World Aquaculture Society.
Azim ME, Litle DC. 2008. The biofloc technology (BFT) in indoor tanks: Water quality, biofloc composition, growth and welfare of Nila tilapia (Oreochromis niloticus). Aquaculture. 283: 29-35.
Arnold, S.J., Coman, F.E., Jackson, C.J., Groves, S.A., 2009. High-intensity, zero waterexchange production of juvenile tiger shrimp, Penaeus monodon: an evaluation of artificial substrates and stocking density. Aquaculture. 293, 42– 48.
Bakar NSA, Nasir NM, Lananan F, Hamid SHA, Lam SS, Jusoh A. 2015. Optimization of c/n ratios for nutrient removal in aquaculture system culturing African catfish, (Clarias gariepinus) utilizing bioflocs technology. International Biodeterioration & Biodegradation (x) : 1-7.
Balcazar Jl, Rojas-Luna T. 2007. Inhibitory Activity of Probiotic Bacillus subtilis UTM 126 Against Vibrio Species Confers Protection Against Vibriosis in Juvenile Shrimp (Litopenaeus vannamei). Current Microbiology 55(5): 409-412.
Beristain BT, Verdegem M, Avnimelech Y. 2005. Microbial ecology and role in aquaculture ponds. Di dalam: Organic matter decomposition in simulated aquaculture ponds. [Thesis]. Fish Culture and Fisheries Group. Wageningen Institute of Animal Science. Wageningen University. Netherlands.
Boyd CE. 1990. Water Quality in Pond for Aquaculture. Auburn University, aquaculture: Beneficial effects and future challenges. Aquaculture (356-357) : 351-356 http://dx.doi.org/10.1016/j.aquaculture.2012.04.046.
16
Ekasari J. 2008. Biofloc technology: The effect different carbon source, salinityand the addition of probiotics on the primary nutritional value of thebio-flocs. [thesis]. Ghent. Ghent University, Belgium. 72p.
Evans, D.H. dan Claiborne, J.B. 2006. The physiology of fishes. Third Edition.Taylor and Francis. 601 p.
Goddard S. 1996. Feed Management in Intensive Aquaculture. Chapman and Hall : New York.
Huisman EA. 1987. The Principles of Fish Culture Production. Department of Aquaculture, Wageningen University, The Netherlands, p. 100.
Hurtado MA, Racotta IS, Arjona O, Rodriguez MH, Goytortua E, Civera R, Palaclos E. 2006. Effect of hypo-and hyper-saline conditions on osmorolarity and fatty acid composition of yuwane shrimp Litopenaeus vannamei (Boone, 1993) fed low-and high-HUFA diets. Aquaculture research. 37: 1316-1326. Izquierdo, M., Forster, L, Divakaran, S., Conquest, L., Decamp, O., Tacon, A.,
2006. Effect of green and clear water and lipid source on survival, growth and biochemical composition of Pacific white shrimp Litopenaeus vannamei. Aquaculture Nutrition 12,192 - 202.
Ju, Z.Y., Forster, 1., Conquest, L., Dominy, W., Kuo, W.C., Horgen, F.D., 2008. Determination of microbial community structures of shrimp floe cultures by biomarkers and analysis of floe amino acid profiles. Aquaculture Research 39, 118-133.
Lovell T. 1989. Nutrition and Feeding of Fish. Van Nostrand Reinhold. New York. Michaud L, Blancheton J, Bruni V, Piedrahita R. 2006. Effect of particulate
organik carbon on heterotrophic bacterial populations and nitrification efficiency in biological filters. Aquaculture engineering (34): 224-233.
Poernomo, A. 1988. Pembuatan Tambak Udang di Indonesia. Depertemen Pertanian. Badan Penelitian dan Pengembangan Pertanian. Balai Penelitian Perikanan Budidaya Pantai. Maros.
Priyadi A, Azwar ZI, Subamia IW, Hem S. 2008. Pemanfaatan maggot sebagai pengganti tepung ikan dalam pakan buatan untuk benih ikan balashark (Balanthiocheilus Melanopterus Bleeker).
Riani H, Rostika R, Lili W. 2012. Efek pengurangan pakan terhadap pertumbuhan udang vaname (Litopenaeus vannamei) PL-21 yang diberi bioflok. Jurnal Perikanan dan Kelautan (3) : 207-211.
Stickney RR, 2005. Aquaculture: An introductory text. CABI Publishing. USA. 256p.
Tacon AGJ. 2000. Shrimp feeds and feeding regime in zero exchange outdoor tanks. Global Aquaculture Advocate. 3(2): 15-16.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutrient. Dalam Watanabe T, editor. Fish Nutrition and Marinculture. Tokyo. JICA Kanagawa International Fisheries Training Centre. Hlm 179-225.
Tsai C. 1989. Ambient water Quality Criteria for Ammonia (Salt water). U.S. Environmental Protection Agency Office of Research and Development Research Laboratory Narragansett. Rhode Island.
17 Velasco M, Lawrence AL, Castille FL, Obaldo LG. 2000. Dietary protein requirement for Litopenaeus vannamei. In: Cruz-Suarez L.E., Ricque-Marie, D., Tapia-Salazar, M., Olvera-Novoa, M.A., Civera-Cerecedo, R. (Ed.). Avances en Nutricion Acuicola V. Memorias del V Simposium Internacionale de Nutricion Acuicola. Merida, Yucatan, Mexico.
Watanabe OW, Ellis SC, Chaves J. 2001. Effect of dietary lipid and energy to protein ratio on growth and feed utilization of juvenile mutton snapper Lutjanus analis fed isonitrogenous diets at two temperature. Journal of The World Aquaculture Society. 32(1): 30-40.
Watanabe T. 1988. Fish Nutrition and Mariculture. JICA Text Book. The GeneralAquaculture Course. Departemen of Aquaculture Bioscience: Tokyo University of Fisheries.
Wasielesky, W., Atwood, H., Stokes, A., Browdy, C.L., 2006. Effect of natural production in a zero exchange suspended microbial floc based super-intensive culture system for white shrimp Litopenaeus vannamei. Aquaculture. 258, 396–403.
18
LAMPIRAN
Lampiran 1 Prosedur penambahan karbon (De Schryver et al. 2008)
Jumlah pakan / hari yaitu FR (%) x biomassa (gram)
_ _ _ _ _ _ _ _ _ _ ( persamaan 1) Persamaan 1 x kandungan protein pakan
_ _ _ _ _ _ _ _ _ _ ( persamaan 2) Persamaan 2 x16 % ( jumlah N dalam protein pakan)
_ _ _ _ _ _ _ _ _ _ ( persamaan 3)
Persamaan 3 x75% ( jumlah pakan menjadi limbah)
_ _ _ _ _ _ _ _ _ _ ( persamaan 4)
Persamaan 4 x rasio C/N yang ditentukan
_ _ _ _ _ _ _ _ _ _ ( persamaan 5)
37,63% Persamaan 5 = 100 / molase yang dibutuhkan
Bedasarkan alur perhitungan penambahan karbon, apabila jumlah pakan yang diberikan setiap hari sebanyak 1 kg dengan kandungan protein berbeda beda dan kandungan karbon didalam molase 37,63%, maka penambahan molase yang ditambahkan setiap hari untuk 1 kg pakan dengan C/N rasio 10 yaitu 372,04 gram / hari.
Lampiran 2 Prosedur analisa proksimat untuk pakan, tubuh udang, dan bioflok
Metode semi mikro Kjedahl
1. Sampel ditimbang sebanyak 0,5 gram dan dimasukkan ke dalam labu Kjedahl dan salah satu labu digunakan sebagai blanko dimana labu tidak dimasukkan sampel.
19 3. Labu no.2 dipanaskan 3-4 jam sampai cairan dalam labu berwarna hijau bening. 4. Larutan didinginkan, lalu ditambahkan air destilasi 30 ml, kemudian larutan no.2 dimasukkan ke labu takar dan ditambahkan larutan destilasi sampai volume larutan menjadi 100 ml.
5. Dilakukan proses destilasi untuk membebaskan kembali NH3 yang berasal dari proses destruksi pada no.4.
6. Erlenmeyer diisi 10 ml H2SO4 0,05 N dan ditambahkan 2 tetes indicator methyl red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
7. Sebanyak 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong, kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
8. Pemanasan dengan uap terhadap labu destilasi dilakukan minimal 10 menit setelah kondensasi uap terlihat pada kondensor.
9. Larutan hasil destilasi dengan larutan NaOH 0,05 N. 10. Prosedur yang sama juga dilakukan pada blanko.
Keterangan:
Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
* = Setiap ml 0,05 NaOH ekivalen dengan 0.0007 gram Nitrogen ** = Faktor Nitrogen
Prosedur analisa kadar lemak (Takeuchi, 1988)
Metode ekstraksi sokhlet (analisa lemak untuk bahan pakan dan pakan uji)
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110oC selama 1 jam, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1).
2. Sekitar 3–5 gram sampel ditimbang (A), dimasukkan di dalam tabung selongsong tabung filter dan kemudian dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100–150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening.
5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanaskan dalam oven selama 15-60 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2).
Metode Folch (analisa lemak untuk tubuh dan daging ikan uji)
20
2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas homogenize dan ditambahkan larutan kloroform/methanol (20 x A), sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenizer selama 5 menit setelah itu disaring dengan vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalam labu pemisah yang telah diberi larutan MgCl2 0,03 N (0.2 x C), kemudian dikocok dengan kuat minimal selama 1 menit kemudian ditutup dengan alumunium foil dan didiamkan selama 1 malam.
5. Lapisan bawa yang terdapat dalam labu pemisah disaring ke dalam labu silinder kemudian dievaporator sampai kering. Sisa kloroform/methanol yang terdapat dalam labu ditiup dengan menggunakan vacuum setelah itu ditimbang (X2).
Prosedur analisa kadar abu (Takeuchi, 1988)
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2. Bahan ditimbang 2 – 3 gram (A)
3. Cawan dan bahan dipanaskan ke dalam tanur pada suhu 600oC sampai menjadi abu kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2)
Prosedur analisa kadar serat kasar (Takeuchi, 1988)
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110oC, setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1).
2. Sebanyak 0,5 gram sampel ditimbang (A) dan dimasukkan ke dalam Erlenmeyer 250 ml.
3. H2SO4 0,3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer, kemudian dipanaskan di atas pembakar Bunsen selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanaskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat proses filtrasi.
5. Larutan dan bahan yang ada pada corong Buchner kemudian dibilas secara berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N, 50 ml air panas, dan 25 ml acetone.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven pada suhu 105–110oC selama 1 jam, kemudian didinginkan dalam desikator selama 5–15 menit dan ditimbang (X2).
21
Prosedur analisa kadar air (Takeuchi, 1988)
1. Cawan dipanaskan dalam oven pada suhu 100oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1).
2. Bahan ditimbang 2-3 gram (A).
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110oC selama 4 jam kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X2).
Lampiran 3 Prosedur analisis kadar glukosa menggunakan KIT Glucose GOD FS dari DiaSys International
1. Mempersiapkan larutan blanko, standar dan sampel hemolim pascalarva udang vaname dengan menambahkan akuades atau reagen sesuai prosedur berikut ini:
2. Homogenkan dengan bantuan vortex. Selanjutnya diinkubasi selama 20 menit pada suhu 20-25oC, atau selama 10 menit pada suhu 37oC
3. Baca absorbansi dalam 60 menit dan dibandingkan dengan blanko. Panjang gelombang yang digunakan 546 nm.
4. Penghitungan kadar glukosa : * Dengan standar atau kalibrator :
konsentrasi Std/Cal [mg/dl] = 100 mg /dl ( 5,55 mmol/l ) * Konversi faktor :
Glukosa [mg/dl] x 0,05551 = Glukosa [mmol/l]
Lampiran 4 Komposisi proksimat tubuh udang vaname Litopenaeus vannamei (% bobot kering) pada perlakuan pemberian pakan protein A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi bioflok selama 28 hari masa pemeliharaan
Proksimat Perlakuan
Awal A(30%) B(35%) C(40%) K(40%)
22
Protein 6.72±0.00 9.90±1.74 11.33±1.35 11.46±1.85 8.74±1.02 Lemak 0.63±0.00 1.27±0.21 1.16±0.36 2.54±1.87 1.10±0.27 Serat Kasar 2.36±0.00 1.48±0.05 0.97±0.14 1.21±0.71 0.89±0.06 BETN 1.42±0.00 1.43±0.71 1.04±0.21 0.48±0.12 0.58±0.35
Lampiran 5 Komposisi profil asam amino pakan udang vaname Litopenaeus vannamei pada perlakuan pemberian pakan protein A 30%, B 35%, C dan K 40% selama 28 hari masa pemeliharaan
No. Jenis-jenis Asam
Lampiran 6 Komposisi profil asam amino bioflok udang vaname Litopenaeus vannamei pada perlakuan pemberian pakan protein A 30%, B 35%, dan C 40% selama 28 hari masa pemeliharaan
23
Lampiran 7 Komposisi profil asam amino udang vaname Litopenaeus vannamei pada perlakuan pemberian pakan protein A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi bioflok selama 28 hari masa pemeliharaan
24
Lampiran 8 Analisis statistik parameter pengamatan pada perlakuan pemberian protein pakan A 30%, B 35%, C 40% dengan teknologi bioflok dan K 40% sebagai kontrol tanpa teknologi bioflok selama 28 hari masa pemeliharaan
*) Perlakuan protein pakan berbeda berpengaruh nyata pada volume flok yang terbentuk pada media pemeliharaan udang vaname selama 28 hari
25 3 Laju Pertumbuhan Bobot (% /hari)
a Deskripsi
Ulangan
Perlakuan
A(30%) B(35%) C(40%) K(40%)
1 7,31 8,79 10,07 5,13
2 8,02 8,59 9,79 6,41
3 7,89 8,83 9,67 6,39
Rata 7,74 8,74 9,85 5,98
b Anova
Sumber
Keragaman JK DB KT F P
Perlakuan 24,257 3 8,086 43,842 ,000*)
Sisa 1,475 8 ,184
Total 25,732 11
*) Perlakuan protein pakan berbeda berpengaruh nyata pada laju pertumbuhan bobot udang vaname selama 28 hari pemeliharaan (P<0,05).
4 Efisiensi Pakan (%) a Deskripsi
Ulangan
Perlakuan
A(30%) B(35%) C(40%) K(40%)
1 26,25 35,33 34,10 19,87
2 31,83 35,27 41,05 24,77
3 28,99 39,94 36,83 23,04
Rata 29,03 36,85 37,33 22,56
b Anova
Sumber
Keragaman JK DB KT F P
Perlakuan 445,584 3 148,528 17,790 ,001*)
Sisa 66,793 8 8,349
Total 512,378 11
26
5 Kelangsungan Hidup (%) a Deskripsi
Ulangan
Perlakuan
A(30%) B(35%) C(40%) K(40%)
1 94,55 94,55 97,27 94,55
2 93,64 98,18 93,64 92,73
3 95,45 95,45 95,45 90,91
Rata 94,55 96,06 95,45 92,73
b Anova
Sumber
Keragaman JK DB KT F P
Perlakuan 19,008 3 6,336 2,300 ,154*)
Sisa 22,039 8 2,755
Total 41,047 11
*) Perlakuan protein pakan berbeda berpengaruh nyata pada kelangsungan hidup udang vaname selama 28 hari pemeliharaan (P<0,05).
6 Retensi Protein (%) a Deskripsi
Ulangan
Perlakuan
A(30%) B(35%) C(40%) K(40%)
1 9,06 10,77 10,74 4,59
2 11,55 10,53 12,72 4,40
3 9,30 14,66 11,18 5,24
Rata 9,97 11,99 11,55 4,75
b Anova
Sumber
Keragaman JK DB KT F P
Perlakuan 99,612 3 33,204 15,559 ,001*)
Sisa 17,072 8 2,134
Total 116,684 11
27
*) Perlakuan protein pakan berbeda berpengaruh nyata pada retensi lemak udang vaname selama 28 hari pemeliharaan (P<0,05).
28
*) Perlakuan protein pakan berbeda berpengaruh nyata pada glukosa plasma tubuh udang vaname selama 28 hari pemeliharaan (P<0,05).
d Anova glukosa akhir
Sumber
Keragaman JK DB KT F P
Perlakuan 15724,325 3 5241,442 3,936 ,054*)
Sisa 10654,055 8 1331,757
Total 26378,380 11
*) Perlakuan protein pakan berbeda berpengaruh nyata pada glukosa plasma tubuh udang vaname selama 28 hari pemeliharaan (P<0,05).
Lampiran 9 Rumus indeks asam amino esensial (EAAI) pada pakan dan bioflok selama pengamatan
EAAI =
√
Keterangan :
n = jumlah asam amino esensial (=10)
a,b, c,...j = persentase asam amino esensial di dalam masing masing pakan yang dievaluasi.
29
RIWAYAT HIDUP
Penulis dilahirkan di Aceh, 2 Maret 1989 dari pasangan suami istri bapak Teuku H Syamaun dan Ibu Hjh Fatimah. Penulis anak ke tujuh dari tujuh saudara. Tahun 2007 penulis lulus dari SMA Negeri 1 Peusangan, Kabupaten Bireuen, Aceh. Pada tahun yang sama penulis melanjutkan pendidikan S1 pada program Studi Budidaya Perairan, Fakultas Perikanan, Universitas Abulyatama, Aceh dan berhasil lulus pada tahun 2011. Pada bulan September tahun 2013 penulis resmi menjadi mahasiswa Pascasarjana pada Program Studi Ilmu Akuakultur, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Penulis mengambil program magister yang disponsori oleh beasiswa BPPDN dari DIKTI. Selama menjalani program magister penulis juga aktif sebagai asisten peneliti dari PKSPL. Sebagai salah satu syarat memperoleh gelar Magister dalam program studi Ilmu Akuakultur Penulis melakukan penelitian dan penyusun tesis yang berjudul
“Pemberian Protein Pakan Berbeda terhadap Kinerja Pertumbuhan Udang
Vaname Litopenaeus vannamei dengan Teknologi bioflok pada Kegiatan Pendederan”. Bagian dari tesis ini dengan judul “ valuation of Different Feed