PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN DOSIS
BERBEDA MELALUI PAKAN UNTUK PENCEGAHAN
VIBRIOSIS PADA UDANG VANAME (Litopenaeus vannamei)
ANIS ZUBAIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda melalui Pakan untuk Pencegahan Vibriosis pada Udang Vaname (Litopenaeus vannanei) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2014
Anis Zubaidah
RINGKASAN
ANIS ZUBAIDAH. Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda melalui Pakan untuk Pencegahan Vibriosis pada Udang Vaname (Litopenaeus vannamei). Dibimbing oleh MUNTI YUHANA dan WIDANARNI.
Vibriosis merupakan penyakit bakterial pada udang vaname yang disebabkan oleh bakteri genus Vibrio. Vibriosis merupakan penyakit yang berbahaya karena dapat mengakibatkan kematian massal. Seiring dengan pelarangan penggunaan antibiotik pada budidaya udang vaname, maka upaya pencegahan penyakit yang telah dilakukan adalah dengan pemberian prebiotik, probiotik, maupun sinbiotik. Permasalahannya adalah pemberian sinbiotik dalam bentuk kultur segar dinilai tidak efektif, dan viabilitas selnya tidak bertahan lama. Kebutuhan ini menuntut adanya aplikasi sinbiotik agar menjadi lebih efektif, efisien dan dapat mempertahankan viabilitas selnya. Oleh sebab itu, metode mikroenkapsulasi diterapkan dalam penelitian ini. Tujuan dari penelitian ini adalah untuk menentukan dosis pemberian mikrokapsul sinbiotik yang terbaik untuk pencegahan vibriosis pada udang vaname.
Penelitian ini dilaksanakan mulai bulan Oktober hingga Desember 2013. Penelitian ini terdiri dari dua tahap. Persiapan mikrokapsul sinbiotik yang dilakukan di Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan IPB dan Laboratorium Pilot Plan SEAFAST (South East Asian Food Agriculture Science and Technology) Center IPB. Uji efektivitas pemberian mikrokapsul sinbiotik secara in vivo yang dilakukan di Laboratorium Kesehatan dan Lingkungan Balai Budidaya Air Payau Situbondo. Bahan penyalut yang digunakan adalah gabungan antara whey dan maltodekstrin. Rancangan penelitian yang digunakan adalah rancangan acak lengkap dengan 5 perlakuan yaitu (Kontrol +, Kontrol -, dosis mikrokapsul sinbiotik 0.5% (A), 1% (B), dan (C) 2%) masing-masing diulang 4 kali. Udang vaname yang digunakan berukuran 2.43 ±0.26 g/ekor. Udang yang digunakan sebanyak 10 ekor pada setiap bak plastik.
Hasil penelitian menunjukkan nilai total heemocyte count (THC) setelah 30 hari pemberian mikrokapsul sinbiotik dengan dosis 2% (perlakuan C) mengalami peningkatan lebih tinggi dibanding dengan kontrol. Peningkatan nilai THC mengindikasikan reaksi cepat imunitas udang vaname terhadap infeksi yang diberikan. Hasil pengamatan aktivitas phenoloxidase (PO) selama penelitian juga menunjukkan adanya peningkatan nilai PO setelah perlakuan pemberian mikrokapsul sinbiotik, terutama pada perlakuan C, yaitu pemberian mikrokapsul sinbiotik dengan dosis 2%. Peningkatan nilai PO menyebabkan kemampuan udang vaname dalam mengenali benda asing semakin baik. Demikian halnya pada hasil pengamatan differential haemocyte count (DHC), udang vaname yang diberi mikrokapsul sinbiotik dengan dosis 2% juga menunjukkan persentase sel granular yang lebih tinggi dibanding perlakuan lainnya. Hal ini menunjukkan bahwa dengan adanya pemberian mikrokapsul sinbiotik dengan dosis 2% mampu meningkatkan pembentukan sel granular, akibatnya kemampuan atau respon imun humoralnya semakin meningkat.
bakteri di usus tertinggi ditunjukkan oleh perlakuan C (dosis pemberian 2%) dengan nilai hingga 9 log CFU g-1. Pemberian mikrokapsul sinbiotik pada udang vaname dapat mempengaruhi komposisi mikroflora pada usus udang vaname yang ditunjukkan dengan populasi Bacillus NP5 RfR yang mencapai 6 log CFU g-1. Selain itu, dominasi Bacillus NP5 juga terbukti mampu menekan pertumbuhan bakteri Vibrio harveyi RfR pada usus udang vaname.
Pemberian mikrokapsul sinbiotik dengan dosis 2% (perlakuan C) mampu meningkatkan sintasan udang vaname hingga 93±11.5%, dan menunjukkan laju pertumbuhan yang lebih tinggi dibanding perlakuan lainnya dengan nilai 2.98±0.42%. Pemberian mikrokapsul sinbiotik pada udang vaname juga mampu menekan penggunaan pakan, terlihat dari nilai nilai rasio konversi pakan, perlakuan C (dosis 2%) menunjukkan nilai rasio konversi pakan yang lebih baik dibanding perlakuan lainnya (1.26±0.19). Demikian juga bila ditinjau dari segi ekonomisnya, pemberian mikrokapsul sinbiotik dosis 2% (perlakuan C) mampu memberikan pendapatan yang lebih tinggi dibanding perlakuan lainnya. Meskipun terdapat tambahan biaya untuk mikrokapsul sinbiotik, namun udang vaname yang diberi mikrokapsul sinbiotik mampu menekan biaya penggunaan pakan. Selain itu, penggunaan mikrokapsul sinbiotik juga mampu menunjukkan sintasan dan bobot udang yang lebih baik, sehingga produksi udang lebih tinggi dibanding perlakuan lainnya dan berdampak pada peningkatan pendapatan.
SUMMARY
ANIS ZUBAIDAH. Supplementation of encapsulated synbiotic through diet with different dosages to prevent vibriosis in white shrimps Litopenaeus vannamei. Supervised by MUNTI YUHANA and WIDANARNI.
Vibriosis is one of bacterial disease in shrimp that caused by genus Vibrio. This disease is very dangerous to the shrimps, because it can cause mass mortality. Along with restriction of antibiotics application in shrimp culture, vibriosis control has been done by feed supplementation of prebiotics, probiotics, and synbiotics. The problem was that fresh synbiotic application has been considered ineffective, since the short period of cells viability. This requires the application of synbiotic in the field in the from of microencapsulated to protect the cells viability. The aim of this study was to determine the best dosage of encapsulated synbiotic as the dietary supplementation to prevent vibriosis.
This study was conducted from October to December 2013. This study consisted of two steps experiment. The preparation of encapsulated synbiotic conducted in Fish Health Laboratory, Department of Aquaculture, Faculty of Fisheries and Marine Science, IPB and Pilot Plan Laboratory of SEAFAST (South East Asian Food Agriculture Science and Technology) Center IPB. The in vivo
test conducted in Fish Health and Environmental Laboratory of Situbondo Brackishwater Aquaculture Development Center (BBAP). Coating material used for microencapsulation was a combination of whey and maltodextrin. This experiment was conducted in a completely randomized design with 5 treatments i.e (positive control (C+), negative control (C-), three dosages of encapsulated synbiotic 0.5% (A), 1% (B), and (C) 2% (w/w)) each repeated with in 4 times. Shrimps used in the experiment approximately in sizes of 2.43 ± 0.26 g per shrimp. The applied stocking density was 10 shrimps of each tank.
The results of the total haemocyte count (THC) after 30 days of supplementation of 2% encapsulated synbiotic (treatment C) showed highest compared with the controls. The increasing in THC means a rapid reaction of shrimp immunity to infection. The observation of the activity of phenoloxidase (PO) during the study also showed an increasing in the PO activity after supplementation of encapsulated synbiotic, especially in treatment C (supplementation of 2 % encapsulated synbiotic). Increasing PO activity lead the ability to better recognize antigen that enters the shrimp body’s system. Similarly, the observation in parameter of differential haemocyte count (DHC), shrimp that treated by supplementation of 2% encapsulated synbiotic also showed highest percentage of granular cells than other treatments. This means that the supplementation of 2% encapsulated synbiotic can increase the formation of granular cells, so that it can increase the humoral immunity responses.
affect the composition of intestinal microflora demonstrated with the Bacillus
NP5 RfR cells population reached 6 log CFU g-1. In addition, the dominance of
Bacillus NP5 was also able to suppress the growth of Vibrio harveyi RfR in shrimp intestine.
Supplementation of 2% encapsulated synbiotic (treatment C) was able to increase the survival rate of shrimp up to 93±11.5%, and showed a highest growth rate than the other treatments with a value of 2.98±0.42%. Supplementation of encapsulated synbiotic on shrimp also able to reduce the use of feed, observed from the value of feed conversion ratio (FCR), treatment C (supplementation of 2% encapsulated synbiotic) showed best FCR than the other treatments (1.26±0.19). Likewise, when determined from its economical point of view, 2% dietary supplementation of encapsulated sinbiotic (treatment C) was of providing highest income than the other treatments. Although there were additional costs for encapsulated synbiotic application, shrimps supplemented by encapsulated synbiotic however were able to reduce the cost of feed consumption. In addition, the application of encapsulated lead the higher shrimp production, so that the economical value of shrimps sale highest than other treatments and resulted in increasing the income.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Mayor Ilmu Akuakultur
PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN DOSIS
BERBEDA MELALUI PAKAN UNTUK PENCEGAHAN
VIBRIOSIS PADA UDANG VANAME (Litopenaeus vannamei)
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis :Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda melalui Pakan untuk Pencegahan Vibriosis pada Udang Vaname
(Litopenaeus vannamei) Nama : Anis Zubaidah
NIM : C151120121
Disetujui oleh Komisi Pembimbing
Dr Munti Yuhana, Spi, MSi Ketua
Dr Ir Widanarni, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober hingga Desember 2013 ini ialah penyakit udang, dengan judul Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda melalui Pakan untuk Pencegahan Vibriosis pada Udang Vaname (Litopenaeus vannamei).
Terima kasih penulis ucapkan kepada Ibu Dr Munti Yuhana, SPi, MSi dan Ibu Dr Ir Widanarni, MSi selaku pembimbing, yang telah banyak memberi arahan dan masukan selama penyusunan tesis ini. Terima kasih juga kepada Bapak Prof Dr Ir Muhammad Zairin Junior, MSc selaku penguji serta Dr Ir Eddy Supriyono, MSc selaku ketua program studi yang telah memberikan banyak kritik dan saran untuk perbaikan dan kesempurnaan dalam penulisan tesis ini. Di samping itu, penghargaan penulis sampaikan kepada Bapak Bambang Hanggono, SPi, MSc selaku Pembimbing Lapang, serta staf Balai Budidaya Air Payau Situbondo, keluarga besar Pasca AKU 2012 serta semua pihak yang telah membantu selama pelaksanaan penelitian. Ungkapan terima kasih juga disampaikan kepada suami tercinta Yulianto Hadi Saputra, ayah Chusnul Chamim, ibu Sunariyah, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Terima kasih juga disampaikan kepada DIKTI atas pembiayaan penelitian melalui dana BOPTN. Scheme (2013) penelitian Strategis IPB kepada Dr Munti Yuhana dengan nomor kontrak 134/IT3.41.2/L2/SPK/2013 pada tanggal 15 Mei 2013.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2014
DAFTAR ISI
Uji Efektifitas Pemberian Mikrokapsul Sinbiotik secara in vivo 4
Persiapan Hewan Uji dan Wadah Penelitian 4
Persiapan Pakan dan Pemberian Pakan 5
Infeksi Bakteri Vibrio harveyi 5
Parameter Pengamatan 5
Pengamatan Respon Imun 5
Total Hemosit 5
Aktivitas Phenoloxidase (PO) 6
Differential Haemocyte Count (DHC) 6
Populasi Bakteri di Usus 7
Sintasan 7
Laju Pertumbuhan Spesifik 7
Rasio Konversi Pakan 8
Differential Haemocyte Count (DHC) 10
Populasi Bakteri Usus 11
Sintasan 14
Laju Pertumbuhan Spesifik 15
DAFTAR TABEL
1. Pengujian efektifitas pemberian mikrokapsul sinbiotik secara in vivo 4 2. Analisis ekonomi penggunaan mikrokapsul sinbiotik dengan berbagai
dosis pada budidaya udang vaname 18
3. Rincian biaya pembuatan 100 g mikrokapsul sinbiotik 19
DAFTAR GAMBAR
1. TotalHemocyteCount (THC) udang vaname pada perlakuan
pemberian mikrokapsul sinbiotik dengan dosis berbeda 8 2. Aktivitas Phenoloxidase (PO) pada udang vaname yang diberi
perlakuan mikrokapsul sinbiotik dengan dosis berbeda 10 3. DifferentialHaemocyte Count (DHC); sel hyalin (a) dan sel granular (b)
pada udang vaname yang diberi perlakuan mikrokapsul sinbiotik
dengan dosis berbeda 11
4. Populasi total viable bacterial count (TBC) pada usus udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda 12 5. Populasi Bacillus NP5 RfRcount pada usus udang vaname yang diberi
perlakuan mikrokapsul sinbiotik dengan dosis berbeda 13 6. Populasi V.harveyi Rf R count (VC) pada usus udang vaname yang
diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda 13 7. Sintasan udang vaname pada perlakuan pemberian mikrokapsul
sinbiotik dengan dosis berbeda 14
8. Specificgrowth rate (SGR) pada udang vaname selama 30 hari perlakuan dengan pemberian mikrokapsul sinbiotik dosis berbeda (P<0.05) 15 9. Rasio konversi pakan (FCR) pada udang vaname selama 30 hari perlakuan
dengan pemberian mikrokapsul sinbiotik dosis berbeda (P<0.05) 16
DAFTAR LAMPIRAN
1. Data hasil pengamatan sintasan pada udang vaname yang diberi
perlakuan mikrokapsul sinbiotik dengan dosis berbeda melalui pakan 24 2. Data hasil pengamatan pertumbuhan (SGR) pada udang vaname
yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis
berbeda 25
3. Data hasil pengamatan rasio konversi pakan (FCR) pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis
berbeda melalui pakan 26
4. Data hasil pengamatan THC dan PO pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda
5. Data hasil pengamatan DHC pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan 27 6. Data hasil pengamatan kelimpahan bakteri di usus/total viable bacterial
count (TVBC) pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan 27 7. Data hasil pengamatan Bacillus NP5 RfRcount pada usus udang vaname
yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis
berbeda melalui pakan 28
8. Data hasil pengamatan Vibrio harveyi RfRcount pada usus udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis
PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) merupakan salah satu jenis udang hasil introduksi ke Indonesia. Udang vaname memiliki keunggulan seperti pertumbuhan yang cepat (masa pemeliharaan 100-110 hari), sintasan selama pemeliharaan tinggi dan nilai konversi pakan (FCR) yang rendah (1:1.3) (KKP 2012). Hal inilah yang membuat para petambak udang di tanah air beberapa tahun terakhir banyak yang menekuni usaha budidaya udang vaname.
Budidaya udang vaname, di balik keunggulannya juga dapat mengalami kerugian ekonomi yang sangat besar akibat serangan penyakit (Austin dan Zhang 2006; Flegel dan Sritunyalucksana 2011; Li dan Xiang 2012). Salah satu penyakit yang menyerang udang vaname adalah vibriosis, di kalangan petambak sering disebut penyakit udang menyala. Diantara genus Vibrio, spesies V. harveyi
merupakan agen penyebab utama luminous vibriosis (penyakit udang menyala) (Robertson et al. 1998). Vibriosis pada udang vaname termasuk penyakit yang berbahaya karena setiap saat dapat mengakibatkan kematian massal (Chrisolite et al. 2008), selain itu adanya ko-infeksi antara vibrio dan virus dalam budidaya udang dapat meningkatkan mortalitas udang vaname. Hasan (2011) melaporkan hasil penelitiannya bahwa adanya ko-infeksi antara V. harveyi (berbagai dosis) dengan IMNV dapat mempercepat dan meningkatkan mortalitas dibanding dengan infeksi tunggal IMNV.
Seiring dengan pelarangan penggunaan antibiotik pada budidaya udang vaname, maka upaya pencegahan penyakit yang telah dilakukan adalah dengan pemberian prebiotik (Li et al. 2007), probiotik (Guo et al. 2009; Rivera et al.
2014) maupun sinbiotik (Li et al. 2009; Arangure et al. 2013; Ramirez et al. 2013). Sinbiotik merupakan kombinasi seimbang antara prebiotik dan probiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan makhluk hidup (Schrezenmer dan Vrese 2001). Verschuere et al. (2000) mengungkapkan bahwa probiotik adalah mikroba tambahan yang mampu memberikan pengaruh menguntungkan bagi inang melalui peningkatan nilai nutrisi pakan dan meningkatkan respon inang terhadap penyakit. Sedangkan prebiotik menyediakan nutrisi tambahan bagi mikroba seperti diungkapkan oleh Schrezenmer dan Vrese (2001) bahwa prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang tetapi memberikan keuntungan bagi inang dengan cara merangsang pertumbuhan mikroflora normal di dalam saluran pencernaan inang.
Bakteri NP5 merupakan spesies Bacillus sp. yang diisolasi dari usus ikan nila dan mampu memproduksi exoenzymes (Putra et al. 2014) yang berfungsi untuk meningkatkan respon imun inang (Verschuere et al. 2000). Penggunaan isolat NP5 sebagai probiotik pernah diujikan pada udang vaname oleh Widanarni
2
NP5 pada ikan nila, juga mampu meningkatkan pertumbuhan dan efisiensi pakan (Putra et al. 2014).
Permasalahan yang kemudian muncul adalah, selama ini pemberian sinbiotik (Bacillus sp. NP5 dan oligosakarida) diberikan dalam bentuk kultur segar. Hal ini dinilai tidak efektif karena selain tidak praktis, sinbiotik kultur segar juga tidak dapat disimpan dalam waktu yang lama, yakni dalam hitungan minggu (Weinbreck 2010). Sedangkan pemberian sinbiotik dalam bentuk kering dapat menurunkan viabilitas sel (Ubbink dan Krueger 2006; Ross et al. 2005), sehingga dibutuhkan suatu metode yang perlu diterapkan pada sinbiotik agar pemakaiannya dapat lebih praktis dan efisien serta tidak menurunkan viabilitas sel bakteri. Anal dan Singh (2007) mengungkapkan bahwa metode yang bisa diterapkan untuk mempertahankan viabilitas sel dari lingkungan yang tidak menguntungkan adalah mikroenkapsulasi.
Mikroenkapsulasi diartikan sebagai metode yang digunakan untuk menyalut atau melapisi mikroorganisme dengan suatu bahan penyalut tertentu (Wu et al. 2000). Dengan adanya lapisan bahan penyalut ini maka bakteri probiotik dapat terlindungi dari kondisi lingkungan yang ekstrim seperti pH lambung yang rendah, sehingga viabilitas selnya dapat dipertahankan (Anal dan Singh 2007). Penelitian Triana et al. (2006) membuktikan bahwa viabilitas sel Lactobacillus
terenkapsulasi dapat bertahan dalam waktu dua minggu baik dalam penyimpanan suhu 5 ˚C maupun suhu 37 ˚C. Mikrokapsul sinbiotik (Bacillus sp. NP5 dan oligosakarida) telah diteliti oleh Yuhana et al. (2014) dan mampu mempertahankan viabilitas selnya sampai 6 log CFU g-1 dalam waktu 7 bulan.
Pemberian mikrokapsul sinbiotik untuk pencegahan vibriosis pada udang vaname selama ini belum pernah diujikan, sehingga perlu dikaji tentang dosis pemberian yang optimum pada udang vaname. Hal ini dimungkinkan dengan adanya metode mikroenkapsulasi dapat berpengaruh jika dibandingkan dengan dosis pemberian sinbiotik yang diberikan dalam bentuk kultur segar. Penelitian mengenai dosis sinbiotik yang diberikan dalam bentuk kultur segar telah banyak dilakukan (Damayanti 2011; Nurhayati et al. 2014; Putra et al. 2014) namun penelitian mengenai dosis mikrokapsul sinbiotik belum pernah dilaporkan. Oleh sebab itu penelitian ini ditujukan untuk menentukan dosis terbaik pemberian mikrokapsul sinbiotik untuk pencegahan vibriosis pada udang vaname.
Perumusan Masalah
3
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan dosis pemberian mikrokapsul sinbiotik melalui pakan untuk pencegahan vibriosis pada udang vaname.
Manfaat Penelitian
Manfaat dari penelitian ini adalah pengembangan metode pemberian sinbiotik pada udang vaname terutama dalam mencegah penyakit vibriosis. Pemberian mikrokapsul sinbiotik juga diharapkan mampu menjadi solusi dan menjawab permasalahan tentang pemberian sinbiotik yang lebih efektif dan efisien, serta dapat diterapkan untuk budidaya udang vaname secara intensif.
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini telah dilaksanakan selama 3 bulan mulai bulan Oktober sampai dengan Desember 2013 di Laboratorium Kesehatan Ikan dan Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Pilot Plant SEAFAST (South East Asian Food and Agriculture Science and Technology) Center Institut Pertanian Bogor, serta Laboratorium Kesehatan dan Lingkungan, Balai Budidaya Air Payau Situbondo, Jawa Timur.
Prosedur Penelitian
Penelitian ini dilakukan melalui dua tahap, yaitu; penyiapan mikrokapsul sinbiotik dan uji efektifitas pemberian mikrokapsul sinbiotik secara in vivo.
Penyiapan Mikrokapsul Sinbiotik
Penyiapan mikrokapsul sinbiotik meliputi penyiapan prebiotik dan probiotik serta proses mikroenkapsulasi. Penyiapan prebiotik meliputi proses ekstraksi oligosakarida dari tepung kukus ubi jalar varietas Jago yang mengacu pada metode Marlis (2008). Tepung kukus ubi jalar disuspensikan pada etanol 70% dengan perbandingan 1:10. Homogenisasi dilakukan dengan menggunakan
4
Probiotik yang digunakan dalam penelitian ini adalah probiotik NP5. Isolat ini merupakan bakteri Bacillus sp. koleksi Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Isolat tersebut kemudian diberi penanda resisten antibiotik Rifampisin (0.5 µg ml-1). Kultur bakteri probiotik NP5 dilakukan pada media SWC (Sea Water Complete) (bacto peptone 0.5%, yeast extract 0.1%, glycerol
0.3%, bacto agar 2%, air laut 75%, dan aquadest 25%) agar miring selama 24 jam pada suhu ruang. Selanjutnya isolat NP5 diinokulasikan ke dalam media SWC cair (bacto peptone 0.5%, yeast extract 0.1%, glycerol 0.3%, air laut 75%, dan
aquadest 25%) 50 ml dan diinkubasi dalam waterbath shaker selama 24 jam pada suhu 29°C dengan kecepatan 140 rpm.
Pemanenan sel bakteri dilakukan dengan cara menuang hasil kultur bakteri ke dalam tabung sentrifus 50 ml kemudian disentrifus selama 15 menit dengan kecepatan 5000 rpm untuk memisahkan pelet sel dan media (supernatan). Sel kemudian dicuci dengan larutan PBS (Phosphat Buffer Saline) (NaCl 0.8%, K2HPO4 0.15%, Na2HPO4 0.02%, dan KCl 0.02%) sebanyak 50 ml, dihomogenkan dan disentrifus selama 15 menit pada kecepatan 5000 rpm. Setelah itu ditambahkan larutan PBS sebanyak 50 ml dan dihomogenisasi kembali. Suspensi sel ini merupakan bahan yang akan dicampurkan dengan prebiotik untuk kemudian diproses mikroenkapsulasi. Tahapan pembuatan probiotik dilakukan di Laboratorium Kesehatan Ikan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Mikroenkapsulasi sinbiotik dilakukan dengan mengacu pada metode Yuhana et al. (2014). Proses mikroenkapsulasi menggunakan metode spray drying dilakukan di Laboratorium Pilot Plant SEAFAST (South East Asian Food and Agriculture Science and Technology) Center Institut Pertanian Bogor.
Uji Efektifitas Pemberian Mikrokapsul Sinbiotik secara In Vivo
Tahapan uji mikrokapsul sinbiotik secara in vivo dilakukan di Laboratorium Kesehatan dan Lingkungan, Balai Budidaya Air Payau Situbondo. Pada tahap ini dilakukan pengujian dosis pemberian mikrokapsul sinbiotik dengan tiga taraf perlakuan yaitu 0.5%, 1%, dan 2% (w/w), serta kontrol negatif dan kontrol positif. Untuk lebih jelasnya dapat dilihat pada Tabel 1 berikut:
Tabel 1. Pengujian efektifitas pemberian mikrokapsul sinbiotik secara in vivo
Perlakuan Keterangan
C+ Pemberian pakan tanpa penambahan mikrokapsul sinbiotik serta diinfeksi dengan bakteri V. harveyi
C- Pemberian pakan tanpa penambahan mikrokapsul sinbiotik dan tanpa infeksi bakteri V. harveyi
A Pemberian pakan dan penambahan 0.5% mikrokapsul sinbiotik serta diinfeksi dengan bakteri V. harveyi
B Pemberian pakan dan penambahan 1% mikrokapsul sinbiotik serta diinfeksi dengan bakteri V. harveyi
5
Masing-masing perlakuan tersebut diulang sebanyak empat kali, tiga ulangan digunakan untuk mengamati pertumbuhan, konversi pakan dan sintasan udang, sedangkan ulangan ke empat digunakan untuk mengukur parameter darah.
Persiapan Hewan Uji dan Wadah Penelitian
Hewan uji yang digunakan pada penelitian ini adalah udang vaname
L. vannamei dengan berat 2.43±0.26 g ekor-1. Udang diperoleh dari Balai Budidaya Air Payau Situbondo. Udang dipelihara pada bak plastik berukuran 60 x 40 x 40 cm3 yang diisi air sebanyak 35 L dengan kepadatan 10 ekor per bak. Bak yang digunakan dilengkapi dengan aerator, sedangkan sistem pergantian air sebanyak 10 L dilakukan setiap hari sekali pada saat sipon (setelah pemberian pakan pertama). Kotoran dan sisa pakan yang tidak termakan dikeluarkan setiap hari pada saat penyiponan. Kualitas air selama pemeliharaan adalah temperatur air 28-29 ºC, salinitas 33-34 ppt, TAN 0.02-0.66 mg L-1, DO 5– 6.5 mg L-1, pH 7.6-7.9. Pengamatan kualitas air dilakukan sebanyak dua kali selama pemeliharaan, yaitu sebelum dan sesudah pergantian air.
Persiapan Pakan dan Pemberian Pakan
Pakan yang digunakan pada penelitian ini adalah pakan udang komersil dalam bentuk pelet (kadar protein 36%, kadar lemak 5%, serat 4%, kadar air 12%, serta kadar abu 15%). Proses pencampuran pakan dengan mikrokapsul sinbiotik dilakukan secara manual untuk tiap-tiap perlakuan. Mikrokapsul sinbiotik ditimbang sesuai perlakuan kemudian ditambahkan dengan putih telur sebagai perekat sebanyak 2% (v/w) dari feeding rate (FR) yang diberikan (Wang 2007). Pakan yang telah ditimbang sesuai FR kemudian dimasukkan pada campuran mikrokapsul sinbiotik dan putih telur kemudian diaduk rata. Pemberian pakan dilakukan sebanyak 4 kali sehari pada pukul 07.00, 11.00, 15.00, dan pukul 19.00 WIB. Pemberian pakan perlakuan dilakukan setiap hari selama 30 hari masa resisten antibiotik Rifampisin (0.5 µg ml-1).
Parameter Pengamatan Pengamatan Respon Imun
Pengamatan respon imun meliputi THC (total hemocyte count), aktivitas
phenoloxidase (PO), DHC (differential hemocyte count), dan total bakteri di usus.
Total Hemosit
6
dengan syringe 1 ml yang telah berisi 0.1 ml antikoagulan (trinatrium sitrat8.82 g; natrium klorida19.89 g; ethylen diamine tetra-acetic acid 3.72 g, dan aquadest 1000 ml). Selanjutnya campuran tersebut dihomogenkan dengan cara menggoyangkan tangan membentuk angka delapan. Tetesan pertama dibuang, tetesan selanjutnya diteteskan pada hemositometer. Total hemosit didapatkan dengan menghitung jumlah selnya per ml di bawah mikroskop dengan perbesaran 400 kali dengan
Pengukuran PO dilakukan berdasarkan prosedur yang dikemukakan oleh Liu dan Chen (2004). Aktivitas PO hemosit diukur berdasarkan formasi
dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 ml campuran hemolim dan antikoagulan disentrifuse pada kecepatan 1500 rpm selama 10 menit pada temperatur 4 °C. Supernatan dikeluarkan dan pelet disuspensikan kembali secara perlahan-lahan ke dalam 1 ml larutan cacodylate-citare buffer (0.01 M sodium cacodylate; 0.45 M sodium chloride; 0.10 M trisodium citrate; pH 7) kemudian disentrifuse kembali. Pelet kemudian diambil dan disuspensikan dalam 200 µl
cacodylate buffer. Larutan yang telah homogen dibagi menjadi dua masing 100 µl untuk larutan standar (blanko) dan elicitor (test).
Suspensi sel sebanyak 100 µl kemudian diinkubasi dengan 50 µl trypsin (1 mg ml-1cacodylate buffer) sebagai aktivator selama 10 menit pada temperatur 25 – 26 °C. Selanjutnya ditambahkan 50 µl L-DOPA (3 mg/ml cacodylate buffer) setelah 5 menit, dan ditambahkan 800 µl cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer pada panjang gelombang 490 nm.
Larutan standar mengandung 100 µl suspensi hemosit, 50 µl cacodylate buffer (pengganti tripsin), dan 50 µl L-DOPA digunakan untuk mengukur aktivitas PO pada semua larutan uji. Densitas optikal (OD) dari aktivitas PO pada semua kondisi uji dinyatakan sebagai formasi dopachrome dalam 50 µl hemolimph.
Differential Haemocyte Count (DHC)
7
Populasi Bakteri di Usus
Populasi bakteri di usus yang dihitung adalah kelimpahan bakteri/total viable bacterial count (TVBC), Vibrio harveyi RfR count (VC) dan Bacillus NP5 RfR count. Usus udang vaname diambil dan ditimbang (g) kemudian dimasukkan pada tabung mikro yang telah berisi larutan PBS sebanyak 1 ml, kemudian dilakukan metode pengenceran bertingkat untuk selanjutnya dilakukan TPC. Tiga macam media digunakan untuk membedakan bakteri yang diamati. SWC tanpa Rifampisin digunakan untuk menentukan total viable bacterial count (TVBC), SWC dengan Rifampisin (0.5 µg ml-1) untuk menentukan Bacillus NP5 RfRcount, dan thiosulphate citrate bile-salt sucrose (TCBS Criterion, USA) untuk menentukan V. harveyi RfRcount (VC).
Sintasan
Sintasan atau survival rate (SR) udang uji dapat diketahui dari jumlah udang pada akhir perlakuan dibagi dengan jumlah udang awal (Effendi 2004), dirumuskan sebagai berikut:
SR = [Nt / N0] x 100% Keterangan:
SR = Sintasan (%)
Nt = Jumlah udang pada akhir perlakuan (ekor) N0 = Jumlah udang pada awal perlakuan (ekor)
Pengamatan sintasan dilakukan pada dua periode, yaitu selama 30 hari pada masa pemberian mikrokapsul sinbiotik (sebelum uji tantang), dan selama 10 hari setelah udang diinfeksi oleh V. harveyi.
Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik atau specific growth rate (SGR) dihitung dengan menggunakan rumus yang digunakan oleh Arangure et al. (2013)sebagai berikut:
SGR = [(ln Wt– ln W0) / t] x 100% Keterangan:
SGR = Laju pertumbuhan spesifik (%)
Wt = Bobot rata-rata udang pada akhir perlakuan (g) W0 = Bobot rata-rata udang pada awal perlakuan (g) t = Periode pemeliharaan (hari)
8
Rasio Konversi Pakan
Rasio konversi pakan selama pemeliharaan dihitung dengan menggunakan rumus (Zonneveld et al. 1991):
FCR = [Jumlah Pakan / (Wt– W0)] Keterangan:
FCR = Konversi pakan (feed convertion ratio)
Jumlah pakan = Jumlah pakan yang dikonsumsi selama pemeliharaan (g) Wt = Biomassa udang pada saat akhir perlakuan (g)
W0 = Biomassa udang pada saat awal perlakuan (g)
Rasio konversi pakan dihitung setelah 30 hari perlakuan pemberian mikrokapsul sinbiotik.
Analisis Data
Rancangan perlakuan yang digunakan pada penelitian ini adalah rancangan acak lengkap (RAL). Data yang diperoleh dari penelitian ini yang meliputi sintasan, laju pertumbuhan spesifik dan konversi pakan dianalisis varians (ANOVA), jika berpengaruh nyata dilanjutkan dengan uji beda nyata terkecil (BNT) menggunakan Microsoft Excel 2010. Data respon imun disajikan dalam bentuk grafik dan dianalisis secara deskriptif.
Analisis Ekonomi
9
HASIL DAN PEMBAHASAN
Pengamatan Respon Imun
Total Hemosit
Total hemosit setelah 30 hari pemberian mikrokapsul sinbiotik pada perlakuan A, B dan C mengalami peningkatan lebih tinggi dibanding dengan kontrol (Gambar 1). Peningkatan juga terjadi setelah uji tantang (hari ke-32) pada semua perlakuan dan tertinggi adalah perlakuan B dengan total hemosit 5.1 x 106 sel ml-1. Nilai ini juga lebih tinggi dibanding nilai THC udang vaname yang telah resisten V. harveyi yaitu 2.4 x 106 sel ml-1 (Huang et al. 2013). Peningkatan nilai THC mengindikasikan reaksi cepat imunitas udang vaname terhadap infeksi yang diberikan. Namun pada hari ke-40 total hemosit pada semua perlakuan mengalami penurunan. Penurunan jumlah sel hemosit ini merupakan efek dari berkerjanya mekanisme pertahanan tubuh seperti infiltrasi hemosit pada jaringan yang terinfeksi, kematian sel hemosit akibat apoptosis (Costa et al. 2009). Aktivitas fagositosis, enkapsulasi, pembentukan nodul, serta terjadinya proses degranulasi untuk aktivitas sistem prophenoloxidase (PO) dan mekanisme pertahanan tubuh yang lainnya (Smith
et al. 2003). Hasil penghitungan total hemosit ditampilkan pada Gambar 1 berikut.
Gambar1. Total haemocyte count (THC) udang vaname pada perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, dan ( ) pengamatan pada hari ke-40.
Aktivitas Phenoloksidase
10
Gambar 2. Aktivitas phenoloxidase (PO) pada udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, dan ( ) pengamatan pada hari ke-40.
Phenoloxidase merupakan suatu enzim yang bertanggung jawab terhadap proses melanisasi pada krustase sebagai respon terhadap penyerang asing dan juga bertanggung jawab untuk pigmentasi (Zufelato et al. 2004). Meningkatnya aktivitas PO menyebabkan kemampuan udang vaname untuk mengenali benda asing yang masuk ke dalam tubuh menjadi semakin baik (Garcia-Carreno et al.
2008). Kenaikan nilai PO pada hari ke-30 pada perlakuan C (dosis 2%) diimplikasikan akibat pemberian mikrokapsul sinbiotik, namun kemudian menurun pada hari ke-32 diduga karena pada perlakuan ini (C) udang tidak memiliki cukup energi. Energi yang ada digunakan untuk pertumbuhan sehingga mekanisme PO untuk melawan infeksi terhambat. Disisi lain, perlakuan B (1%) nilai PO meningkat dan lebih tinggi dibanding yang lainnya pada hari ke-32 dimungkinkan karena udang pada perlakuan B sudah mengalami masa recovery
setelah 24 jam pasca infeksi V. harveyi (Huang et al. 2013).
Differential Haemocyte Count (DHC)
11
(a) (b)
Gambar 3. Differential haemocyte count (DHC); sel hyalin (a) dan sel granular (b) pada udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, dan ( ) pengamatan pada hari ke-40.
Differential haemocyte count (DHC) pada penelitian ini menunjukkan bahwa sel granular pada perlakuan pemberian mikrokapsul sinbiotik sebelum uji tantang (hari ke-30) lebih tinggi dibandingkan kontrol, demikian juga pada saat setelah uji tantang dan pada akhir pengamatan (hari ke-32). Hal ini menunjukkan bahwa dengan adanya pemberian mikrokapsul sinbiotik mampu meningkatkan pembentukan sel granular. Fungsi dari sel hyalin dan sel granular adalah menghancurkan partikel asing yang masuk ke tubuh udang melalui fagositosis, enkapsulasi, pembentukan nodul, dan produksi komponen-komponen humoral. Komponen humoral tersebut disimpan dalam granula hemosit diantaranya adalah protein antikoagulan, aglutinin, enzim PO, peptida antimikrobial, dan inhibitor protease (Jiravanichpaisal et al. 2006). Pemberian mikrokapsul melalui pakan pada penelitian ini berdampak pada peningkatan sel granular (perlakuan A, B, dan C hari ke-30), sedangkan penurunan jumlah sel merupakan akibat dari migrasi sel-sel hemosit pada bagian-bagian tubuh udang yang terinfeksi patogen (Li et al. 2008).
Populasi Bakteri Usus
Populasi bakteri usus yang diamati meliputi kelimpahan bakteri / total viable bacterial count (TVBC), V. harveyi Rf R count (VC) dan Bacillus NP5 RfR
12
Gambar 4. Populasi total viable bacterial count (TVBC) pada usus udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan hari ke-0, ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, ( ) pengamatan hari ke-35, dan ( ) pengamatan pada hari ke-40.
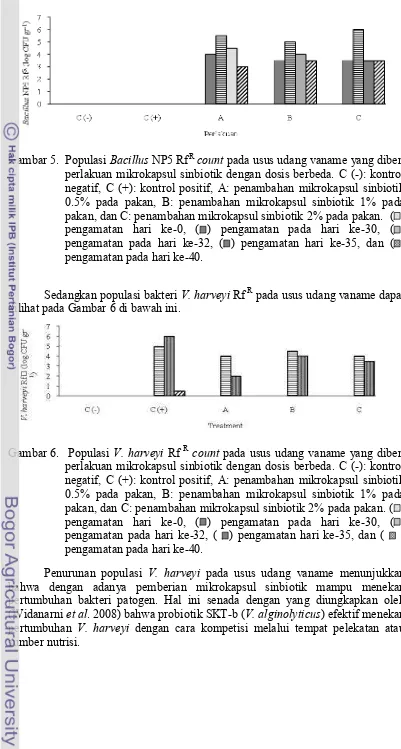
Berdasarkan gambar 10 diketahui bahwa jumlah bakteri di usus berkisar antara 7 – 9 log CFU g-1. Populasi bakteri usus pada perlakuan C meningkat dengan adanya perlakuan pemberian mikrokapsul sinbiotik (hari ke-30), namun tidak terjadi pada perlakuan A, B serta kontrol. Populasi bakteri pada kontrol positif (C+) dan perlakuan C juga semakin meningkat setelah pemberian uji tantang (infeksi) dengan bakteri V. harveyi,sedangkan kontrol negatif (C-), A dan B tidak mengalami peningkatan. Pada hari ke-35 dan hari ke-40 pada perlakuan C penurunan populasi bakteri di usus lebih besar dibandingkan dengan kontrol positif. Penurunan populasi bakteri di usus dimungkinkan karena telah terjadi penurunan populasi sel Bacillus NP5 dan V. harveyi seperti yang terlihat pada Gambar 5.
Populasi sel Bacillus NP5 di usus relatif mengalami penurunan pada hari ke-35 dan hari ke-40. Meskipun mengalami penurunan, namun angka ini masih lebih tinggi dibandingkan dengan hasil penelitian Widanarni et al. (2014) yang juga menggunakan Bacillus NP5, dinyatakan bahwa populasi Bacillus NP5 pada usus udang vaname adalah 2.6 x 103 CFU g-1, hal ini menunjukkan bahwa bakteri
Bacillus NP5 yang diberikan bersama prebiotik dan telah dienkapsulasi mampu bertahan hidup dan diduga dapat memanfaatkan prebiotik pada usus udang. Prebiotik oligosakarida dapat meningkatkan kesehatan dan keberadaan bakteri usus yang menguntungkan serta menekan bakteri yang berpotensi merusak (Ringo
13
Gambar 5. Populasi Bacillus NP5 RfRcount pada usus udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan hari ke-0, ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, ( ) pengamatan hari ke-35, dan ( ) pengamatan pada hari ke-40.
Sedangkan populasi bakteri V. harveyi Rf Rpada usus udang vaname dapat dilihat pada Gambar 6 di bawah ini.
Gambar 6. Populasi V. harveyi Rf Rcount pada usus udang vaname yang diberi perlakuan mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan hari ke-0, ( ) pengamatan pada hari ke-30, ( ) pengamatan pada hari ke-32, ( ) pengamatan hari ke-35, dan ( ) pengamatan pada hari ke-40.
14
Sintasan
Sintasan atau survival rate (SR) udang vaname diamati selama 30 hari pemberian mikrokapsul sinbiotik (sebelum uji tantang) dan setelah uji tantang dengan bakteri V. harveyi, hasilnya dapat ditunjukkan pada Gambar 7 di bawah ini.
Gambar 7. Sintasan udang vaname pada perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda. C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan. ( ) pengamatan sintasan sebelum infeksi V. harveyi, ( ) pengamatan sintasan setelah infeksi V. harveyi
Berdasarkan Gambar 7 dapat dilihat bahwa sintasan sebelum uji tantang adalah sama untuk semua perlakuan dan kontrol yaitu 100%. Namun setelah uji tantang dengan infeksi V. harveyi secara injeksi, perlakuan kontrol positif (C+) menunjukkan sintasan yang lebih rendah (63.33%) dan berbeda nyata dibanding kontrol negatif dan perlakuan lainnya (P<0.05). Sintasan yang lebih tinggi dibandingkan dengan kontrol pada seluruh perlakuan yaitu 93.33% mengindikasikan bahwa pemberian mikrokapsul sinbiotik memberikan efek positif untuk peningkatan resistensi udang terhadap infeksi V. harveyi.
Udang vaname yang diberi mikrokapsul sinbiotik dalam pakan diduga memiliki ketahanan tubuh yang lebih baik dibanding dengan udang tanpa pemberian mikrokapsul sinbiotik. Pernyataan ini diperkuat oleh Nayak (2010) yang mengungkapkan bahwa penambahan Bacillus subtilis baik sel hidup maupun inaktif mampu meningkatkan kemampuan fagositosis, aktivitas bakterisidal,
respiratory burst, serta respon imunitas lainnya. Dalam penelitian ini dapat dilihat bahwa dengan penambahan mikrokapsul sinbiotik dalam pakan juga mampu meningkatkan total hemosit (Gambar 1) dan nilai aktivitas phenoloxidase
15
Laju Pertumbuhan Spesifik
Laju pertumbuhan spesifik atau specific growth rate (SGR) dihitung setelah 30 hari pemberian mikrokapsul sinbiotik. Nilai SGR ditampilkan pada grafik di bawah ini (Gambar 8).
Gambar 8. Specific growth rate (SGR) pada udang vaname selama 30 hari perlakuan dengan pemberian mikrokapsul sinbiotik dosis berbeda (P<0.05). C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan.
SGR udang vaname setelah 30 hari perlakuan berkisar antara 2.09 – 2.98%, dengan hasil terbaik adalah perlakuan C, yaitu pemberian mikrokapsul sinbiotik dosis 2% yang menunjukkan nilai SGR sebesar 2.98% dan berbeda nyata (P<0.05) dibanding dengan kontrol dan perlakuan lainnya. Hasil ini menunjukkan bahwa mikrokapsul sinbiotik mampu memberikan pengaruh yang menguntungkan terhadap udang vaname dengan meningkatkan pertumbuhan. Semakin tinggi dosis yang digunakan, maka laju pertumbuhan semakin meningkat. Hasil ini juga sesuai dengan hasil penelitian yang dilakukan Widanarni et al. (2014) bahwa laju pertumbuhan harian semakin meningkat dengan pemberian probiotik NP5 dengan dosis 8 log CFU ml-1. Peningkatan laju pertumbuhan diduga karena adanya aktivitas enzimatik dalam usus udang vaname. Bakteri probiotik NP5 yang digunakan merupakan bakteri probiotik yang diisolasi dari usus ikan nila yang mampu mensekresikan enzim amilase (Putra et al. 2014) dan telah diadaptasi pada media bakteri air laut (SWC) agar mampu bertahan hidup saat pakan terpapar air laut dan di dalam usus udang. Enzim amilase tersebut berperan sebagai enzim
16
Rasio Konversi Pakan
Rasio konversi pakan atau feed conversion ratio (FCR) udang vaname setelah 30 hari perlakuan ditunjukkan pada Gambar 9 di bawah ini.
Gambar 9. Rasio konversi pakan (FCR) pada udang vaname selama 30 hari perlakuan dengan pemberian mikrokapsul sinbiotik dosis berbeda (P<0.05). C (-): kontrol negatif, C (+): kontrol positif, A: penambahan mikrokapsul sinbiotik 0.5% pada pakan, B: penambahan mikrokapsul sinbiotik 1% pada pakan, dan C: penambahan mikrokapsul sinbiotik 2% pada pakan.
Rasio konversi pakan (FCR) udang vaname yang diberi perlakuan mikrokapsul sinbiotik berbagai dosis menunjukkan nilai yang lebih rendah dan berbeda nyata (P<0.05) dibanding dengan kontrol, baik kontrol negatif maupun kontrol positif. Nilai FCR terendah ditunjukkan oleh perlakuan C, yaitu dosis pemberian mikrokapsul sinbiotik 2% dengan nilai rasio konversi pakan 1.26±0.19. Penurunan nilai FCR yang berarti peningkatan nilai efisiensi pakan menunjukkan bahwa dengan adanya penambahan mikrokapsul sinbiotik dalam pakan, udang vaname mampu memanfaatkan nutrien dalam pakan dengan optimal dan menggunakannya untuk pertumbuhan. Pemberian sinbiotik melalui pakan mampu meningkatkan aktivitas enzim amilase dan protease dalam saluran pencernaan ikan nila sehingga efisiensi pakan meningkat. Demikian halnya pemberian sinbiotik SKT-b (Vibrio alginolyticus) memberikan pengaruh yang signifikan terhadap pertumbuhan dan konversi pakan udang vaname (Nurhayati et al. 2014).
Analisis Ekonomi
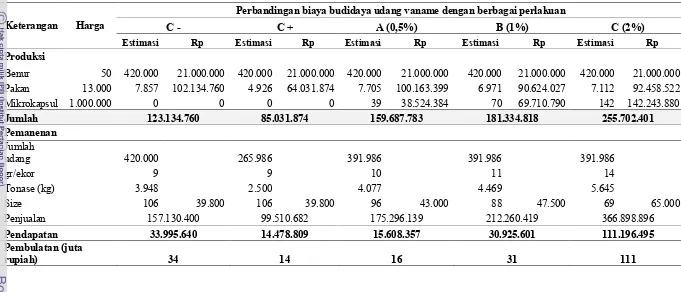
Analisis ekonomi yang digunakan pada penelitian ini bertujuan untuk membandingkan kelayakan penggunaan mikrokapsul sinbiotik pada budidaya udang vaname ditinjau dari segi ekonomis berdasarkan data-data dari hasil penelitian yang telah dilakukan. Metode yang digunakan menggunakan pendekatan asumsi-asumsi dengan membandingkan nilai atau jumlah pendapatan yang berkaitan erat dengan penggunaan mikrokapsul sinbiotik pada budidaya udang vaname pada masing-masing perlakuan. Berikut ini adalah tabel analisis ekonomi penggunaan mikrokapsul sinbiotik dengan berbagai dosis pada budidaya udang vaname (Tabel 2).
17
perlakuan 120 ekor per m2. Harga benur yang digunakan adalah Rp. 50,- per ekor, sedangkan harga pakan Rp. 13.000,- per kg. Harga mikrokapsul sinbiotik yang digunakan dalam tabel di atas adalah Rp. 1.000.000,- per kg, harga ini diperoleh berdasarkan penelitian (skala laboratorium) dengan rincian biaya dapat dilihat pada Tabel 3. Penggunaan pakan dihitung berdasarkan nilai FCR yang diperoleh dari hasil penelitian pada masing-masing perlakuan yang dikalikan dengan harga pakan. Setelah dipelihara dengan lama masa pemeliharaan yang sama pada semua perlakuan (60 hari) diperoleh jumlah udang pada akhir masa pemeliharaan yang disesuaikan dengan nilai sintasan masing-masing perlakuan dari hasil penelitian. Bobot udang dihitung berdasarkan nilai GR yang diperoleh dari hasil penelitian.
18
Tabel 2. Analisis ekonomi penggunaan mikrokapsul sinbiotik dengan berbagai dosis pada budidaya udang vaname
Keterangan Harga
Perbandingan biaya budidaya udang vaname dengan berbagai perlakuan
C - C + A (0,5%) B (1%) C (2%)
Estimasi Rp Estimasi Rp Estimasi Rp Estimasi Rp Estimasi Rp
Produksi
Benur 50 420.000 21.000.000 420.000 21.000.000 420.000 21.000.000 420.000 21.000.000 420.000 21.000.000 Pakan 13.000 7.857 102.134.760 4.926 64.031.874 7.705 100.163.399 6.971 90.624.027 7.112 92.458.522 Mikrokapsul 1.000.000 0 0 0 0 39 38.524.384 70 69.710.790 142 142.243.880
Jumlah 123.134.760 85.031.874 159.687.783 181.334.818 255.702.401
Pemanenan Jumlah
udang 420.000 265.986 391.986 391.986 391.986
gr/ekor 9 9 10 11 14
Tonase (kg) 3.948 2.500 4.077 4.469 5.645
Size 106 39.800 106 39.800 96 43.000 88 47.500 69 65.000
Penjualan 157.130.400 99.510.682 175.296.139 212.260.419 366.898.896
Pendapatan 33.995.640 14.478.809 15.608.357 30.925.601 111.196.495
Pembulatan (juta
19
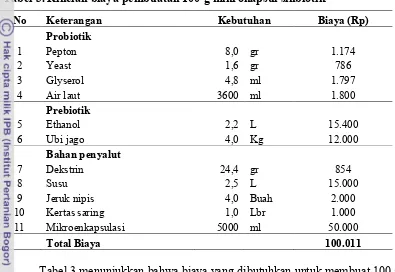
Pada proses pembuatan mikrokapsul sinbiotik, komponen utamanya adalah bahan untuk probiotik dan prebiotik, bahan penyalut serta proses mikroenkapsulasi. Proses mikroenkapsulasi yang dilakukan pada penelitian ini masih menggunakan skala laboratorium, sehingga biaya-biaya yang digunakan juga disesuaikan dengan skala laboratorium. Berikut ini adalah rincian biaya untuk pembuatan 100 g mikrokapsul sinbiotik (Tabel 3).
Tabel 3. Rincian biaya pembuatan 100 g mikrokapsul sinbiotik
No Keterangan Kebutuhan Biaya (Rp)
Probiotik
Tabel 3 menunjukkan bahwa biaya yang dibutuhkan untuk membuat 100 g mikrokapsul sinbiotik diperlukan biaya sebesar Rp. 100.011,-. Biaya tersebut meliputi biaya untuk penyiapan probiotik, pembuatan prebiotik, bahan penyalut untuk mikrokapsul serta proses mikroenkapsulasi. Komponen biaya terbesar untuk pembuatan mikrokapsul sinbiotik adalah proses mikroenkapsulasi yang memakan biaya hingga 50% dari total biaya pembuatan mikrokapsul sinbiotik. Hal ini dikarenakan pembuatan mikrokapsul sinbiotik yang masih skala laboratorium serta belum tersedianya alat mikroenkapsulasi, sehingga biaya tersebut dianggap sebagai biaya sewa alat.
SIMPULAN DAN SARAN
Simpulan
20
mikrokapsul dosis 2% juga mampu memberikan jumlah pendapatan yang lebih tinggi dibanding perlakuan yang lainnya.
Saran
Perlu dilakukan penelitian mikrokapsul sinbiotik dengan frekuensi pemberian yang berbeda serta pengujian efektifitasnya terhadap jenis penyakit lain (viral).
DAFTAR PUSTAKA
Anal AK, Singh H. 2007. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery. Trends Food Sci Tech. 18: 240–251.
Arangure BOP, Gonzalez AL, Coronado JAF, Miranda MCF, Ocampo HAG. 2013. Effect of inulin and probiotic bacteria on growth, survival, immune response, and prevalence of white spot syndrome virus (WSSV) in
Litopenaeus vannamei cultured under laboratory conditions. Afr J Biotechnol. 12:3366-3375.
Austin B, Zhang XH. 2006. Vibrio harveyi: a significant pathogen of marine vertebrates and invertebrates. Lett Appl Microbiol. 43:119–24.
Blaxhall PC, Daishley KW. 1973. Routine haematological methods for use with fish blood. J Fish Biol. 5:577-581.
Chrisolite B, Thiyagarajan S, Alavandi SV, Abhilash EC, Kalaimani N, Vijayan KK, Santiago TC. 2008. Distribution of luminescent Vibrio harveyi and their bacteriophages in commercial shrimp hatchery in South India.
Aquaculture 275:13-19
Costa AM, Buglione CC, Bezerra FL, Martins PCC, Barracco MA. 2009. Immune assessement of farm-reared Penaeus vannamei shrimp naturally infected by IMNV in NE Brazil. Aquaculture 291:141-146.
Damayanti. 2011. Pemberian sinbiotik dengan dosis berbeda pada pakan udang vaname untuk pencegahan infeksi IMNV (Infectious Myonecrosis Virus). [skripsi]. Bogor (ID). Institut Pertanian Bogor
Effendi I. 2004. Pengantar akuakultur. Depok (ID). Penebar Swadaya.
21
Flegel T, Sritunyalucksana K, 2011. Shrimp molecular responses to viral pathogens. Mar Biotechnol. 13:587–607.
Garcia-Carreno FL, Cota K, Navarrete del Toro MA. 2008. Phenoloxidase activity of hemocyanin in whiteleg shrimp Penaeus vannamei: conversion, characterization of catalytic properties, and role in postmortem melanosis. J Agr Food Chem. 56:6454–6459.
Guo JJ, Liu KF, Cheng SH, Chang CI, Lay JJ, Hsu YO, Yang JY, Chen TI. 2009. Selection of probiotic bacteria for use in shrimp larviculture. Aquac Res.
40:609-618
Hai NV, Fotedar R. 2009. Comparison of the effects of prebiotics (Bio-Mos® and β-1.3-D-glucan) and the customized probiotics (Pseudomonas synxantha
and P. aeruginosa) on the culture of juvenile western king prawn (Penaeus latisulcatus Kishinouye. 1896). Aquaculture 289:310-316.
Hasan A. 2011. Ko-infeksi Infectious Myonecrosis Virus (IMNV) dan Vibrio harveyi pada udang vaname (Litopenaeus vannamei). [Tesis]. Bogor (ID). Institut Pertanian Bogor.
Huang HH, Liu XL, Xiang JH, Wang P. 2013. Immune response of Litopenaeus vannamei after infection with Vibrio harveyi. Aquaculture 406-407:115-120.
Jiravanichpaisal P, Lee BL, Soderhall K. 2006. Cell-mediated immunity in arthropods: hematopoiesis, coagulation, melanization, and opsonization.
Immunobiology 211:213-236.
[KKP] Kementrian Kelautan dan Perikanan. 2012. Budidaya udang vaname (Litopenaeus vannamei) pola tradisional plus. [diunduh 2013 April 21]. Tersedia pada: http://www.kkp.go.id/Index.php/arsip/c/7519/BUDIDAYA-UDANG VANNAMEI-Litopenaeus-vannamei-pola-tradisional-plus. Li CC, Yeh ST, Chen JC. 2008. The immune response of white shrimp
Litopenaeus vannamei following Vibrio alginolyticus injection. Fish and Shellfish Immunol. 25:853–860.
Li F, Xiang J. 2012. Recent advances in researches on the innate immunity of shrimp in China. Dev Comp Immunol. 1:11–26.
Li JQ, Tan BP, Mai KS. 2009. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp (Litopenaeus vannamei). Aquaculture 291:35–40.
22
influences gastrointestinal microbiota composition and immunity characteristics of Pacific white shrimp, Litopenaeus vannamei, cultured in a recirculating system. J Nutr. 137:2763-8.
Liu CH, Chen JC. 2004. Effect of amonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio algynolyticus. Fish Shellfish Immunol. 16:321-324.
Marlis A. 2008. Isolasi oligosakarida ubi jalar (Ipomoea batatas L.) dan pengaruh pengelolaan terhadap potensi prebiotiknya. [Thesis]. Bogor (ID): Institut Pertanian Bogor
Nayak SK. 2010. Probiotics and immunity: a fish perspective. Review. Fish Shellfish Immunol. 29:2-14.
Nurhayati D, Widanarni, Yuhana M. 2014. Effect of dietary probiotic SKT-b and oligosaccharide from sweet potato (Ipomoea batatas L) on growth performance, immune responses and resistance to co-infection with IMNV and Vibrio harveyi in white shrimp Litopenaeus vannamei. Biotropia,
Forthcoming.
Putra AN, Widanarni, Utomo NBP. 2014. Isolasi dan seleksi bakteri amilolitik sebagai kandidat prebiotik pada budidaya ikan nila (Oreochromis niloticus).
JAI. Accepted
Ramirez NB, Seiffert WQ, Vieira FN, Mourino JLP, Jesus GFA, Ferreira GS, Andreatta ER. 2013. Prebiotic, probiotic, and synbiotic-supplemented diet for marine shrimp farming. Pesqui Agropecu Brasil. 48:913-919.
Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H, Hemre GI. 2010. Prebiotics in aquaculture: a review. Aquacult Nutr. 16:117-136.
Rengpipat S, Phianphak W, Piyatiratitivorakul S, Menasveta P. 1998. Effects of a probiotic bacterium on black tiger shrimp (Penaeus vannamei) survival and growth. Aquaculture. 167:301–313.
Rivera DA, Davó AP, Escalante K, Chávez C, Cuzon G, Gaxiola G. 2014. Probiotic effect of FLOC on vibrios in the pacific white shrimp Litopenaeus vannamei. Aquaculture 424:215–219.
Robertson PAW, Calderon J, Carrera L, Stark JR, Zherdmant M, Austin B. 1998. Experimental Vibrio harveyi infections in Penaeus vannamei larvae. Dis Aquat Organ. 32:151-155.
23
Saeed ZN, Mehran HR, Ghobad AT, Donald LL, Ali-Reza M, Mehdi S. 2006. The effect of Bacillus spp bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture 252:516-524.
Schrezenmer J & Vrese M. 2001. Probiotics, prebiotics, and synbiotics-approaching a definition. ACJN. 73:361-364.
Smith VJ, Brown JH, Hauton C. 2003. Immunostimulation in crustacean: does it really against infection? Fish Shellfish Immunol. 15:71-90.
Taoka Y, Maeda H, Jo Y, Sakata T. 2007. Influence of comercial probiotics on the digestive enzyme activities of Tilapia (Oreochromis niloticus). Aquat Sci.
55:183-189.
Triana E, Yulianto E, Nurhidayat N. 2006. Uji viabilitas Lactobacillus sp. Mar8 terenkapsulasi. Biodiversitas 7:114-117
Ubbink J, Krueger J. 2006. Physical approaches for the delivery of active ingredients infoods. Trends Food Sci Tech. 17:244–254.
Verschuere L, Rombaut G, Sorgeloos P, Verstrate W. 2000. Probiotic bacteria as biological control agents in aquaculture. MMBR. 64:655-671
Wang YB. 2007. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture 269:259-264.
Weinbreck F, Bodnar I, Marco ML. 2010. Can encapsulation lengthen the shelf-life of probiotic bacteria in dry products? IJ Food Micro. 136:364-367 Widanarni, Muhammad A, Yuhana M. 2014. Effects of the probiotic Bacillus sp.
(NP5) on the growth performance, immune response, and resistance againts Infectious Myonecrosis Virus in white shrimp. IJBR. Review
Wu WH, Roe WS, Gimino VG, Seriburi V, Martin DE, Knapp SE. 2000. Low melt encapsulation with high laurate canola oil. USPTO. 1240.4
Yuhana M, Widanarni, Zubaidah A. 2014. Pengujian viabilitas sel mikrokapsul sinbiotik NP5. In preparation
Zonneveld N, Huisman EA, Boon JH.1991. Prinsip-prinsip budidaya ikan. Jakarta (ID): Gramedia Pustaka Utama.
24
Lampiran 1. Data hasil pengamatan sintasan udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Rataan
(%) SD
C- 100.00 0.00
C+ 63.33 5.77
A 93.33 5.77
B 93.33 5.77
C 93.33 11.55
ANOVA Sumber
Variasi Db JK KT Fhitung
F tabel 0.05 0.01 Perlakuan 4.00 2506.67 626.67 13.43 ** 4.07 7.59
Galat 10.00 466.67 46.67
Total 14.00 2973.33
Uji BNT
Perlakuan C- A B C C+ Notasi
C- A
A 6.67 tn A
B 6.67 tn 0.00 tn A
C 6.67 tn 0.00 tn 0.00 tn A
25
Lampiran 2. Data hasil pengamatan pertumbuhan (SGR) pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Rataan
(%) SD
C- 2.12 0.31
C+ 2.09 0.23
A 2.23 0.16
B 2.69 0.30
C 2.98 0.42
ANOVA Sumber
Variasi Db JK KT Fhitung
Ftabel 0.05 0.01 Perlakuan 4.00 1.84 0.46 5.16 * 4.07 7.59
Galat 10.00 0.89 0.09
Total 14.00 2.72
Uji BNT
Perlakuan C B A C- C+ Notasi
C a
B 0.29 ** b
A 0.75 ** 0.46 ** c
C- 0.86 ** 0.57 ** 0.11 ** d
26
Lampiran 3. Data hasil pengamatan rasio konversi pakan (FCR) pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Rataan SD
C- 1.99 0.25
C+ 1.97 0.27
A 1.89 0.08
B 1.56 0.25
C 1.26 0.19
ANOVA Sumber
Variasi db JK KT Fhitung
Ftabel 0.05 0.01 Perlakuan 4.00 1.20 0.30 6.31 * 4.07 7.59
Galat 10.00 0.48 0.05
Total 14.00 1.68
Uji BNT
Perlakuan C- C+ A B C Notasi
C- d
C+ 0.02 tn d
A 0.10 ** 0.08 ** c
B 0.43 ** 0.41 ** 0.33 ** b
27
Lampiran 4. Data hasil pengamatan THC dan PO pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Lampiran 6. Data hasil pengamatan kelimpahan bakteri di usus/total viable bacterial count (TVBC) pada udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Pengamatan hari ke- (log CFU g
28
Lampiran 7. Data hasil pengamatan Bacillus NP5 RfR count pada usus udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Pengamatan hari ke- (log CFU g
-1
)
0 30 32 35 40
C (-) 0.00 0.00 0.00 0.00 0.00
C (+) 0.00 0.00 0.00 0.00 0.00
A 0.00 4.00 5.50 4.50 3.00
B 0.00 3.50 5.00 4.00 3.50
C 0.00 3.50 6.00 3.50 3.50
Lampiran 8. Data hasil pengamatan Vibrio harveyi NP5 RfR count pada usus udang vaname yang diberi perlakuan pemberian mikrokapsul sinbiotik dengan dosis berbeda melalui pakan
Perlakuan Pengamatan hari ke- (log CFU g
-1
)
0 30 32 35 40
C (-) 0.00 0.00 0.00 0.00 0.00
C (+) 0.00 0.00 5.00 6.00 0.50
A 0.00 0.00 4.00 2.00 0.00
B 0.00 0.00 4.50 4.00 0.00
29
RIWAYAT HIDUP
Penulis dilahirkan di Malang pada tanggal 27 Februari 1986 dari Bapak Chusnul Chamim dan Ibu Sunariyah sebagai anak pertama dari empat bersaudara. Penulis memulai pendidikan Sekolah Menengah Umum di SMU Negeri 8 Malang pada tahun 2001 dan tamat pada tahun 2004. Penulis baru melanjutkan sekolah sarjana pada tahun 2007 di Universitas Muhammadiyah Malang, dan berhasil menyelesaikan studi serta memperoleh gelar Sarjana Perikanan pada tahun 2011.