ABSTRACT
GHITA RYAN SEPTIANI. The giving of sinbiotic with the different frequency in feed of white shrimp Litopenaeus vannamei for prevention of IMNV (Infectious Myonecrosis Virus). Supervised by Widanarni and Sukenda.
White shrimp Litopenaeus vannamei is the prioritized export of Indonesian fisheries commodity. However, outbreak of main bacterial and viral diseases are often decreased the white shrimp production. One of the viral disease which often attacks white shrimp is IMNV (Infectious Myonecrosis Virus). This study evaluated the effectiveness of sinbiotic with different frequencies of survival rate, growth, and immune response of white shrimp infected by IMNV. The weight of the shrimp is 0,493±0,035 grams/head, it was kept as many as 15 shrimps in aquarium (60x35x30)cm. The aquarium filled with sea water as much as 30 liters. The study was conducted with five treatments consisted of A (without the giving of sinbiotic and infected by IMNV), B (without the giving of sinbiotic and without infection of IMNV), C (the giving of sinbiotic every day and infected by IMNV), D (the giving of sinbiotic twice a week and infected by IMNV), and E (the giving of sinbiotic once a week and infected by IMNV). The results showed that the giving of sinbiotic every day give a better effect than other treatments. Shrimp maintained with daily feeding sinbiotic and infected by IMNV have a high survival rate (80%) and give a better immune response than others.
ABSTRAK
GHITA RYAN SEPTIANI. Pemberian sinbiotik dengan frekuensi berbeda pada pakan udang vaname Litopenaeus vannamei untuk pencegahan IMNV (Infectious Myonecrosis Virus). Dibimbing oleh Widanarni dan Sukenda.
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor unggulan di bidang perikanan. Namun penyakit bakterial dan viral sering menjadi kendala dalam budidaya udang vaname. Salah satu penyakit viral yang saat ini banyak menyerang udang vaname adalah IMNV (Infectious Myonecrosis Virus). Penelitian ini dilakukan untuk menguji efektivitas pemberian pakan sinbiotik dengan frekuensi berbeda terhadap sintasan, pertumbuhan, dan respons imun udang vaname yang diinfeksi IMNV. Udang yang digunakan memiliki bobot 0,493±0,035 gram/ekor, dipelihara sebanyak 15 ekor dalam akuarium berukuran 60x35x30 cm yang diisi air laut sebanyak 30 liter. Penelitian dilakukan dengan 5 perlakuan yaitu A (tanpa pemberian sinbiotik dan diinfeksi IMNV), B (tanpa pemberian sinbiotik dan tanpa infeksi IMNV), C (pemberian sinbiotik setiap hari dan diinfeksi IMNV), D (pemberian sinbiotik dua kali seminggu dan diinfeksi IMNV), dan E (pemberian sinbiotik satu kali seminggu dan diinfeksi IMNV). Hasil penelitian menunjukkan bahwa pemberian sinbiotik dengan frekuensi setiap hari memberikan pengaruh yang lebih baik dibanding perlakuan lainnya. Udang yang dipelihara dengan pemberian pakan sinbiotik setiap hari dan diinfeksi IMNV memiliki sintasan yang tinggi (80%) serta respons imun yang lebih baik.
1
I. PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor unggulan di bidang perikanan yang persentasenya cukup tinggi. Kementerian Kelautan dan Perikanan (KKP) pada tahun 2009 menetapkan target produksi udang vaname meningkat sampai 209% untuk tahun 2014, berarti harus terjadi peningkatan produksi dari 244.650 ton pada tahun 2009 menjadi 511.000 ton pada tahun 2011 (Ditjen Perikanan Budidaya 2010). Upaya yang dapat dilakukan untuk memenuhi target tersebut adalah dengan cara melakukan budidaya udang vaname secara intensif melalui peningkatan padat tebar udang vaname. Namun demikian, serangan penyakit sering menjadi masalah dalam budidaya udang vaname secara intensif.
Penyakit yang sering menjadi kendala dalam kegiatan budidaya udang vaname adalah penyakit bakterial dan viral. Salah satu penyakit viral yang saat ini banyak menyerang udang vaname adalah IMNV (Infectious Myonecrosis Virus) (Costa et al. 2009). Menurut Tang et al (2005), gejala klinis yang umum terjadi pada udang yang terserang IMNV adalah rusaknya jaringan dan adanya warna putih pada otot. Menurut Coelho et al. (2009), infeksi IMNV dapat menimbulkan tingkat mortalitas di atas 60% pada tambak udang dan dapat menyerang udang pada stadia post-larva (PL), juvenil, dan dewasa. Oleh karena itu, perlu dilakukan pengendalian terhadap serangan virus tersebut. Salah satu alternatif yang dapat dilakukan untuk mengendalikan penyakit tersebut adalah melalui aplikasi sinbiotik (kombinasi antara probiotik dan prebiotik).
2 pertumbuhan bakteri patogen Vibrio harveyi dalam uji in vitro dan in vivo. Selain itu Gullian et al. (2004) menyatakan bahwa V. alginolyticus mampu meningkatkan pertumbuhan dan respon imun pada udang vaname L. vannamei.
Menurut Lisal (2005), konsep probiotik ini memiliki kelemahan, yaitu kemampuan bertahan, kolonisasi, dan kompetisi nutrien dari bakteri probiotik untuk masuk ke dalam satu lingkungan ekosistem yang sudah mengandung berbagai jenis bakteri lainnya. Lisal (2005) menyatakan bahwa jika terjadi perubahan lingkungan yang ekstrim, maka bakteri dalam saluran pencernaan akan dengan cepat mengalami wash out. Dalam hal ini, dibutuhkan pendekatan yang dapat mengatasi keterbatasan tersebut, salah satunya adalah melalui pemberian prebiotik.
Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang, namun memiliki pengaruh yang menguntungkan terhadap inang dengan menstimulir pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrezenmeir & Vrese 2001). Prebiotik yang digunakan dalam penelitian ini adalah ekstrak oligosakarida yang berasal dari tepung ubi jalar varietas Sukuh Ipomoea batatas L. Perpaduan antara probiotik dan prebiotik disebut sinbiotik. Menurut Schrezenmeir & Vrese (2001) sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan mahluk hidup.
3
II. METODOLOGI
2.1 Penyiapan Prebiotik
2.1.1 Ekstraksi Oligosakarida/Prebiotik
Sebanyak 500 gram tepung ubi jalar dicampur air dengan perbandingan 1:1 (w/v) dan dikukus selama 30 menit pada suhu 100oC. Setelah itu tepung ubi jalar dikeringkan dalam oven pada suhu 55oC selama 18 jam. Selanjutnya, digiling dan disaring menggunakan ayakan hingga tepung kukus ubi jalar dapat terkumpul. Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi (1989). Tepung kukus ubi jalar disuspensikan ke dalam etanol 70% dengan perbandingan 1:10, diaduk menggunakan magnetic stirer selama 15 jam. Kemudian disaring menggunakan kertas saring steril. Setelah itu disentrifuse selama 10 menit dengan kecepatan 5000 rpm dan dilakukan penyaringan kembali. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil evaporator diencerkan dengan akuades steril menggunakan perhitungan total padatan terlarut (TPT).
2.1.2 Pengukuran Total Padatan Terlarut
Pengujian total padatan terlarut (TPT) ini mengacu pada metode Apriyantono et al. (1989). Cawan porselin dimasukkan ke dalam oven selama 1 jam dengan suhu 100oC, kemudian dimasukkan ke dalam desikator dan ditimbang (a gram). Setelah itu, sebanyak 1 ml ekstrak oligosakarida hasil ekstraksi dari ubi jalar ditempatkan pada cawan porselin tersebut, kemudian ditimbang (b gram). Cawan porselin berisi ekstrak oligosakarida tersebut dimasukkan ke dalam oven dengan suhu 100oC selama 24 jam. Setelah itu cawan didinginkan dalam desikator selama 10 menit, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan rumus:
TPT= c−a
b x 100%
4
2.2 Pengujian Sinbiotik secara In Vivo
2.2.1 Persiapan Wadah
Wadah yang digunakan dalam penelitian ini adalah 15 akuarium berukuran 60 cm x 30 cm x 35 cm. Sebelum digunakan, akuarium dicuci terlebih dahulu menggunakan deterjen dan dikeringkan. Kemudian akuarium didesinfeksi menggunakan kaporit 100 ppm selama 24 jam. Setelah itu akuarium yang telah didesinfeksi dibilas dengan air tawar hingga bersih, kemudian sebanyak 30 liter air laut dimasukkan pada masing-masing akuarium.
2.2.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah benur udang vaname stadia PL10 yang berasal dari PT. Global Gen, Labuan, Banten. Sebelum diberi perlakuan, benur terlebih dahulu dipelihara selama 30 hari dalam akuarium. Bobot benur yang digunakan adalah 0,493±0,035 gram/ekor. Masing-masing akuarium dilengkapi shelter sebagai tempat udang berlindung ketika molting. Pengelolaan kualitas air dilakukan dengan penyiponan dan pergantian air setiap pagi hari sebanyak 10% dari total volume akuarium. Sebelum diberi perlakuan, udang uji dipuasakan selama 24 jam dengan tujuan menghilangkan sisa pakan dalam tubuh.
2.2.3 Persiapan Pakan Uji
5 probiotik yang akan dicampurkan ke dalam pakan. Pembuatan sinbiotik dilakukan dengan cara mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan. Dosis probiotik yang digunakan sebesar 1% dari jumlah pakan yang akan diberikan (Wang 2007), dan prebiotik sebesar 2% dari jumlah pakan yang akan diberikan (Mahious et al. 2006). Pencampuran dilakukan dengan menambahkan kuning telur sebanyak 2% dari total pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan ke udang, pakan dikeringudarakan terlebih dahulu selama 10-15 menit untuk mengurangi kelembaban.
2.2.4 Pengujian Pakan Uji pada Udang Vaname
Pakan uji yang digunakan dalam penelitian ini berupa pelet komersil dengan kandungan protein sebesar 40%. Pengujian terdiri dari 5 perlakuan (Tabel 1) dengan 3 kali ulangan, yaitu:
Tabel 1. Perlakuan pemberian sinbiotik dan uji tantang
Pemeliharaan udang dengan pemberian perlakuan sinbiotik dilakukan selama 30 hari. Udang uji sebanyak 15 ekor dipelihara dalam akuarium dengan volume air laut 30 liter. Pemberian pakan dilakukan lima kali dalam sehari pada pukul 07.00, 11.00, 15.00, 19.00, dan 23.00 WIB. Pada perlakuan C, pakan dengan penambahan sinbiotik diberikan pada udang uji setiap hari, namun pada perlakuan D dan E pakan yang telah ditambahkan sinbiotik diberikan secara periodik masing-masing adalah dua kali seminggu dan satu kali seminggu (Tabel 1). Jumlah pakan yang diberikan didasarkan pada Feeding Rate (FR) menurut SNI 01-7246-2006 dengan persentase FR yang menurun secara bertahap mulai 15% hingga 5% sesuai dengan bobot udang pada masing-masing perlakuan.
Setelah udang uji diberi perlakuan sinbiotik selama 30 hari, kemudian dilakukan uji tantang secara oral menggunakan IMNV melalui pemberian pakan
Perlakuan Keterangan
Perlakuan A Pemberian pakan komersil tanpa penambahan sinbiotik kemudian diinfeksi IMNV (kontrol (+))
Perlakuan B Pemberian pakan komersil tanpa penambahan sinbiotik dan tanpa infeksi IMNV (kontrol (-))
Perlakuan C Pemberian setiap hari pakan komersil dengan penambahan sinbiotik kemudian diinfeksiIMNV
Perlakuan D Pemberian dua kali seminggu pakan komersil dengan penambahan sinbiotik kemudian diinfeksi IMNV
6 menggunakan cacahan udang yang positif terinfeksi IMNV terhadap udang uji. Uji tantang dilakukan selama 3 hari dan pengamatan dilakukan selama 14 hari.
2.3 Parameter Pengamatan 2.3.1 Sintasan
Sintasan atau tingkat kelangsungan hidup udang dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dan akhir penelitian pasca infeksi IMNV. Sintasan dihitung berdasarkan rumus (Effendie 1997):
SR = Nt
No x 100% Keterangan :
SR = Kelangsungan hidup (%)
Nt = Jumlah udang pada akhir pemeliharaan (ekor) No = Jumlah udang pada awal pemeliharaan (ekor)
2.3.2 Laju Pertumbuhan Harian
Laju pertumbuhan spesifik atau Spesific Growth Rate (SGR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dengan menggunakan formula di bawah ini (Huisman 1987):
� = �� ��
�
−1 × 100%
Keterangan :
SGR = Laju pertumbuhan harian (%)
Wt = Bobot rata-rataudang pada akhir perlakuan (gram) Wo = Bobot rata-rata udang pada awal pemeliharaan (gram) t = Periode pemeliharaan (hari)
2.3.3 Rasio Konversi Pakan
Rasio konversi pakan selama pemeliharaan dengan perlakuan sinbiotik dihitung menggunakan rumus (Zonneveld et al. 1991):
FCR = F
Bt + Bm−Bo Keterangan :
7 Bt = Biomassa udang pada saat akhir perlakuan (gram)
Bm = Biomassa udang yang mati saat perlakuan (gram) Bo = Biomassa udang pada saat awal perlakuan (gram)
2.3.4 Total Hemosit
Pengamatan terhadap respon imun udang dilakukan pada akhir perlakuan sinbiotik dan pasca infeksi IMNV. Prosedur penghitungan total hemosit mengacu pada metode Blaxhall dan Daishley (1973). Haemolymph diambil sebanyak 0,1 ml dari pangkal kaki renang pertama dengan syringe 1 ml yang sudah berisi 0,3 ml antikoagulan Na-sitrat 3,8%. Campuran dihomogenkan, kemudian tetesan pertama dibuang sedangkan tetesan selanjutnya diteteskan pada haemositometer. Total hemosit dilihat dan dihitung jumlah selnya per ml di bawah mikroskop.
2.3.5 Aktivitas Phenoloxidase (PO)
Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu dan Chen (2004). Aktivitas PO haemocyte diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 ml campuran hemolim-antikoagulan disentrifuse pada 1.500 rpm selama 10 menit pada temperatur 4 oC. Supernatan dikeluarkan dan pelet disuspensikan kembali secara perlahan-lahan ke dalam 1 ml larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian disentrifuse kembali. Pelet kemudian diambil dan disuspensikan dalam 200 µ l cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
8
2.3.6 Diferensial Hemosit
Diferensial hemosit dihitung berdasarkan metode yang dilakukan Martin dan Graves (1995). Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase tiap jenisnya (hyaline dan granular). Persentase tiap jenis sel hemosit dihitung dengan rumus:
Persentase jenis sel hemosit = Jumlah tiap jenis sel hemosit
Total hemosit x 100%
2.3.7 Indeks Fagositik
Penghitungan indeks fagositik mengacu pada metode Anderson dan Siwicki (1993). Aktivitas fagositik diukur berdasarkan persentase sel-sel fagosit yang menunjukkan proses fagositosis dari 100 sel fagosit yang diamati. Indeks fagositik dihitung dengan rumus:
Indeks fagositik = Jumlah sel fagosit yang melakukan fagositosis
jumlah sel fagosit x 100%
2.3.8 Gejala Klinis
Pengamatan gejala klinis dilakukan dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati ialah terbentuknya otot berwarna putih pada bagian ruas tubuh udang, dan warna kemerahan pada bagian ekor.
2.3.9 Pengamatan Kualitas Air
Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan pada akhir penelitian. Parameter kualitas air yang diukur adalah suhu, pH, DO, salinitas, dan TAN.
2.4 Analisis Data
9
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
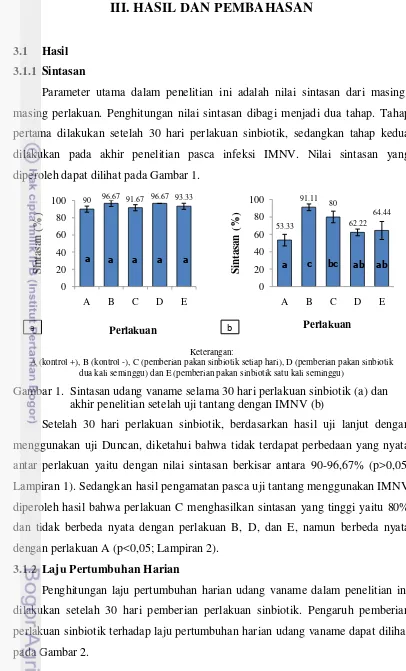
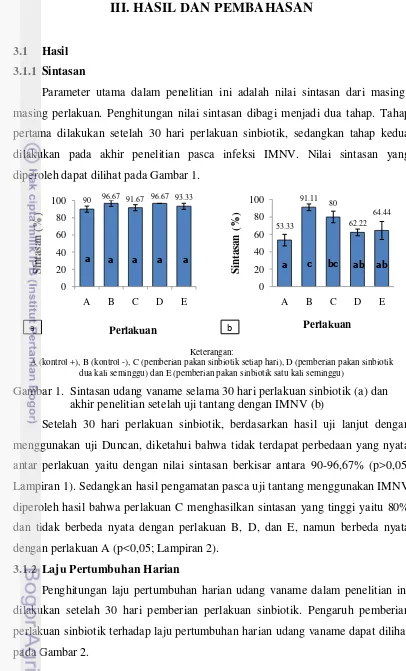
Parameter utama dalam penelitian ini adalah nilai sintasan dari masing-masing perlakuan. Penghitungan nilai sintasan dibagi menjadi dua tahap. Tahap pertama dilakukan setelah 30 hari perlakuan sinbiotik, sedangkan tahap kedua dilakukan pada akhir penelitian pasca infeksi IMNV. Nilai sintasan yang diperoleh dapat dilihat pada Gambar 1.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 1. Sintasan udang vaname selama 30 hari perlakuan sinbiotik (a) dan akhir penelitian setelah uji tantang dengan IMNV (b)
Setelah 30 hari perlakuan sinbiotik, berdasarkan hasil uji lanjut dengan menggunakan uji Duncan, diketahui bahwa tidak terdapat perbedaan yang nyata antar perlakuan yaitu dengan nilai sintasan berkisar antara 90-96,67% (p>0,05; Lampiran 1). Sedangkan hasil pengamatan pasca uji tantang menggunakan IMNV diperoleh hasil bahwa perlakuan C menghasilkan sintasan yang tinggi yaitu 80% dan tidak berbeda nyata dengan perlakuan B, D, dan E, namun berbeda nyata dengan perlakuan A (p<0,05; Lampiran 2).
3.1.2 Laju Pertumbuhan Harian
10 Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 2. Laju pertumbuhan harian udang pada akhir perlakuan sinbiotik
Berdasarkan Gambar 2, diketahui bahwa laju pertumbuhan harian perlakuan C, D, dan E (6,93-6,97%) tidak memiliki perbedaan yang nyata, namun ketiga perlakuan tersebut memberikan perbedaan yang nyata terhadap perlakuan A dan B (6,65-6,66%) (p<0,05; Lampiran 3).
3.1.3 Rasio Konversi Pakan
Pengaruh pemberian pakan sinbiotik terhadap konversi pakan dapat dilihat pada Gambar 3. Berdasarkan hasil uji lanjut menggunakan uji Duncan, diketahui bahwa setelah 30 hari perlakuan sinbiotik diperoleh nilai konversi pakan pada perlakuan C dan D (1,54-1,58%) berbeda nyata dengan perlakuan A dan B (1,86%) (p<0,05; Lampiran 4).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
11
3.2.4 Total Haemocyte Count (THC)
Pengukuran THC dilakukan pada akhir masa perlakuan sinbiotik dan pasca infeksi IMNV. Hasil pengukuran THC disajikan pada Gambar 4.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 4. Total Haemocyte Count udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
Berdasarkan hasil pengukuran THC yang didapat pada akhir masa perlakuan sinbiotik diketahui bahwa THC pada perlakuan C dan D memiliki nilai tertinggi (3,03-3,05)x107sel/ml, serta menunjukkan perbedaan yang nyata dengan perlakuan lainnya. Jumlah sel hemosit pada perlakuan E lebih rendah dibanding perlakuan C dan D namun lebih tinggi dibanding perlakuan kontrol, serta menunjukkan perbedaan yang nyata (p<0,05; Lampiran 5).
Nilai THC pasca uji tantang mengalami penurunan pada semua perlakuan, namun penurunan THC pada perlakuan B (kontrol (-)) tidak terlalu signifikan. Jumlah sel hemosit tertinggi pada pengukuran pasca uji tantang terdapat pada udang yang diberi perlakuan C yaitu sebesar 2,76x107 sel/ml, serta menunjukkan perbedaan yang nyata dengan perlakuan lainnya. Jumlah sel hemosit pada perlakuan D dan E lebih rendah dibanding perlakuan C, namun lebih tinggi dibanding perlakuan A (kontrol(+)) dan memberikan perbedaan yang nyata (p<0,05; Lampiran 6).
3.1.5 Aktivitas Phenoloxidase (PO)
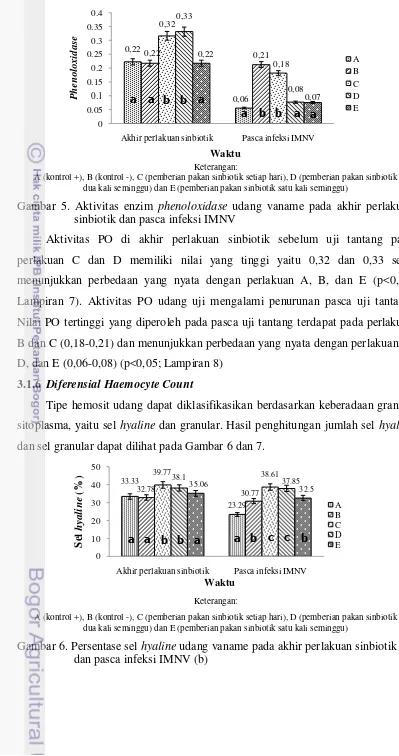
Pengaruh pakan sinbiotik terhadap aktivitas phenoloxidase (PO) pada udang vaname dapat dilihat pada Gambar 5.
1.42
Akhir perlakuan sinbiotik Pasca infeksi IMNV
12 Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 5. Aktivitas enzim phenoloxidase udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
Aktivitas PO di akhir perlakuan sinbiotik sebelum uji tantang pada perlakuan C dan D memiliki nilai yang tinggi yaitu 0,32 dan 0,33 serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (p<0,05; Lampiran 7). Aktivitas PO udang uji mengalami penurunan pasca uji tantang. Nilai PO tertinggi yang diperoleh pada pasca uji tantang terdapat pada perlakuan B dan C (0,18-0,21) dan menunjukkan perbedaan yang nyata dengan perlakuan A, D, dan E (0,06-0,08) (p<0,05; Lampiran 8)
3.1.6 Diferensial Haemocyte Count
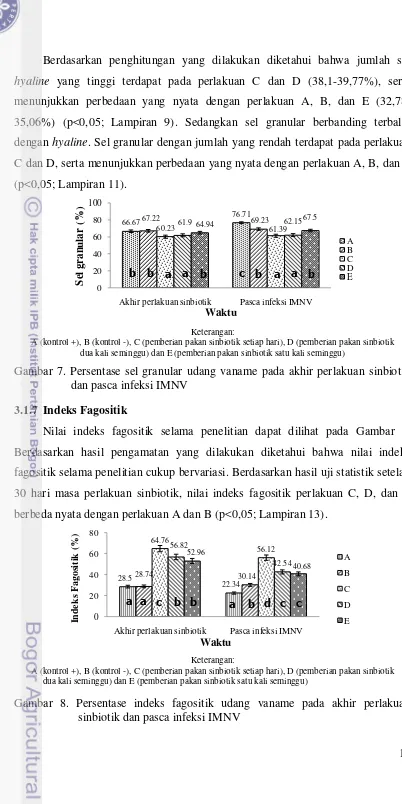
Tipe hemosit udang dapat diklasifikasikan berdasarkan keberadaan granula sitoplasma, yaitu sel hyaline dan granular. Hasil penghitungan jumlah sel hyaline dan sel granular dapat dilihat pada Gambar 6 dan 7.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 6. Persentase sel hyaline udang vaname pada akhir perlakuan sinbiotik (a) dan pasca infeksi IMNV (b)
0,22
Akhir perlakuan sinbiotik Pasca infeksi IMNV
Ph
Akhir perlakuan sinbiotik Pasca infeksi IMNV
13 Berdasarkan penghitungan yang dilakukan diketahui bahwa jumlah sel hyaline yang tinggi terdapat pada perlakuan C dan D (38,1-39,77%), serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (32,78-35,06%) (p<0,05; Lampiran 9). Sedangkan sel granular berbanding terbalik dengan hyaline. Sel granular dengan jumlah yang rendah terdapat pada perlakuan C dan D, serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (p<0,05; Lampiran 11).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 7. Persentase sel granular udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
3.1.7 Indeks Fagositik
Nilai indeks fagositik selama penelitian dapat dilihat pada Gambar 8. Berdasarkan hasil pengamatan yang dilakukan diketahui bahwa nilai indeks fagositik selama penelitian cukup bervariasi. Berdasarkan hasil uji statistik setelah 30 hari masa perlakuan sinbiotik, nilai indeks fagositik perlakuan C, D, dan E berbeda nyata dengan perlakuan A dan B (p<0,05; Lampiran 13).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 8. Persentase indeks fagositik udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
66.67
Akhir perlakuan sinbiotik Pasca infeksi IMNV
S
Akhir perlakuan sinbiotik Pasca infeksi IMNV
14 Nilai indeks fagositik pasca infeksi IMNV mengalami penurunan kecuali pada perlakuan B (kontrol (-)). Namun nilai tertinggi tetap diperoleh pada perlakuan C dengan nilai 56,12%, dan memberikan perbedaan yang nyata dengan perlakuan lainnya (p<0,05; Lampiran 14).
3.1.8 Gejala Klinis
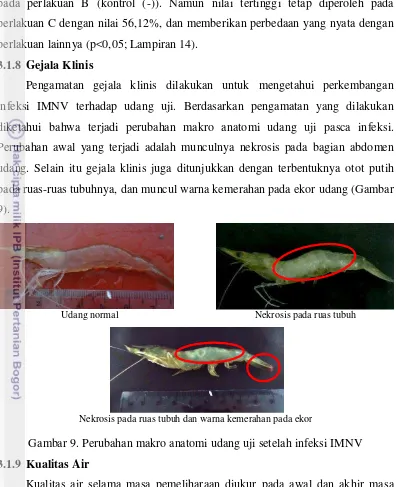
Pengamatan gejala klinis dilakukan untuk mengetahui perkembangan infeksi IMNV terhadap udang uji. Berdasarkan pengamatan yang dilakukan diketahui bahwa terjadi perubahan makro anatomi udang uji pasca infeksi. Perubahan awal yang terjadi adalah munculnya nekrosis pada bagian abdomen udang. Selain itu gejala klinis juga ditunjukkan dengan terbentuknya otot putih pada ruas-ruas tubuhnya, dan muncul warna kemerahan pada ekor udang (Gambar 9).
Udang normal Nekrosis pada ruas tubuh
Nekrosis pada ruas tubuh dan warna kemerahan pada ekor
Gambar 9. Perubahan makro anatomi udang uji setelah infeksi IMNV
3.1.9 Kualitas Air
15 Tabel 2. Nilai kualitas air pada media pemeliharaan udang vaname
Parameter
Nilai kualitas air selama masa pemeliharaan pada semua perlakuan masih berada pada kisaran untuk pertumbuhan udang vaname. Sehingga diasumsikan perubahan kelangsungan hidup, pertumbuhan, konversi pakan, dan respon imun yang terjadi pada udang uji bukan diakibatkan oleh kualitas air media pemeliharaan.
3.2 Pembahasan
Sintasan merupakan peluang hidup suatu individu dalam waktu tertentu (Effendie 1997). Penghitungan nilai sintasan dalam penelitian ini dibagi menjadi dua tahap. Tahap pertama dilakukan setelah 30 hari perlakuan sinbiotik, sedangkan tahap kedua dilakukan pada akhir penelitian pasca infeksi IMNV. Setelah 30 hari perlakuan sinbiotik (Gambar 1), diketahui bahwa tidak terdapat perbedaan yang nyata antar perlakuan. Sedangkan hasil pengamatan pasca uji tantang menggunakan IMNV diperoleh hasil bahwa perlakuan C menghasilkan sintasan yang tertinggi yaitu 80% dan tidak berbeda nyata dengan perlakuan B, D, dan E, namun berbeda nyata dengan perlakuan A.
16 metazoa. Selain itu, penambahan prebiotik juga mampu meningkatkan kerja dari bakteri probiotik. Schrezenmeir & Vrese (2001) menyatakan bahwa prebiotik mampu menstimulir pertumbuhan atau aktivitas metabolik bakteri di dalam usus. Hasil penelitian Li et al. (2009) menunjukkan bahwa penambahan gabungan probiotik Bacillus dan prebiotik isomaltooligosaccharides pada udang vaname yang diinfeksi WSSV memberikan nilai sintasan 41,38% lebih tinggi dibanding perlakuan kontrol.
Udang uji pada perlakuan D juga menunjukkan jumlah hemosit yang tinggi dan tidak berbeda nyata dengan perlakuan C, namun pada perlakuan D nilai sintasan yang dihasilkan rendah. Hal tersebut diduga karena jumlah sel hemosit yang melakukan proses fagositosis pada udang perlakuan D (56,82%) lebih rendah dibanding perlakuan C (64,76%) dan menunjukkan perbedaan yang nyata (Gambar 8). Sehingga udang pada perlakuan C lebih mampu menghadapi patogen. Rodriguez dan Lee Moullac (2000) menyatakan bahwa nilai indeks fagositik yang tinggi menggambarkan bahwa organisme tersebut memiliki kemampuan untuk memproduksi sel-sel fagosit dalam darah dengan jumlah lebih banyak, sehingga ketika terjadi paparan mikroorganisme patogen, sel darah siap melakukan proses fagositosis.
17 sinbiotik meningkat. Menurut Atlas et al. (1984), mikroba amilolitik adalah mikroba yang mampu menghasilkan enzim amilase yang akan mendegradasi zat pati menjadi maltosa dan glukosa yang digunakan sebagai sumber karbon dan energi. Sedangkan mikroba proteolitik adalah mikroba yang mampu menghasilkan enzim protease yang akan merombak protein menjadi asam amino yang kemudian dimanfaatkan sebagai sumber karbon dan energi.
Effendi (2004) menyatakan bahwa Feed Conversion Ratio (FCR) atau rasio konversi pakan merupakan suatu ukuran yang menyatakan jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging. Gambar 3 menunjukkan bahwa setelah 30 hari perlakuan sinbiotik diperoleh nilai konversi pakan pada perlakuan C dan D (1,54-1,58%) berbeda nyata dengan perlakuan A dan B (1,86%). Berdasarkan hasil yang diperoleh diketahui bahwa pemberian pakan sinbiotik terhadap udang vaname memberikan pengaruh yang baik terhadap nilai FCR. Hal tersebut diduga disebabkan oleh bakteri probiotik SKT-b yang mampu menghasilkan enzim amilase dan protease. Berdasarkan hasil penelitian Widagdo (2011), diketahui bahwa SKT-b merupakan bakteri yang memiliki aktivitas enzim amilase dan protease. Sehingga kemampuan probiotik SKT-b dalam menghasilkan enzim-enzim tersebut yang diduga menyebabkan nilai konversi pakan udang lebih baik. Price dan Stevens (1996) dalam Yandri et al. (2008) menyatakan bahwa protease merupakan suatu enzim yang berfungsi memecah ikatan peptida untuk menghasilkan asam amino dan peptida sederhana lainnya. Protease adalah salah satu enzim yang penting dalam proses pencernaan, termasuk di dalamnya tripsin dan kemotripsin yang bertanggung jawab terhadap hampir 60% pada proses pencernaan udang (Lemos et al. 2000).
18 perlakuan E lebih rendah dibanding perlakuan C dan D namun lebih tinggi dibanding perlakuan kontrol, serta menunjukkan perbedaan yang nyata.
Nilai THC pasca uji tantang mengalami penurunan pada semua perlakuan, namun penurunan THC pada perlakuan B (kontrol (-)) tidak terlalu signifikan. Jumlah sel hemosit tertinggi pada pengukuran pasca uji tantang terdapat pada udang yang diberi perlakuan C yaitu sebesar 2,76x107 sel/ml, serta menunjukkan perbedaan yang nyata dengan perlakuan lainnya. Jumlah sel hemosit pada perlakuan D dan E lebih rendah dibanding perlakuan C, namun lebih tinggi dibanding perlakuan A (kontrol(+)) dan memberikan perbedaan yang nyata.
Berdasarkan hasil yang diperoleh, diketahui bahwa walaupun jumlah sel hemosit mengalami penurunan, namun perlakuan dengan pemberian sinbiotik tetap memberikan nilai THC yang lebih tinggi dibanding kontrol (+). Hal tersebut diduga karena adanya pengaruh sinbiotik yang diberikan dalam pakan udang. Bachere (2000) menyatakan bahwa proses imun pertama pada krustase adalah rekognasi mikroorganisme penyerang yang dimediasi oleh hemosit. Pembentukan hemosit ini dapat dirangsang oleh beta glukan dan probiotik.
Phenoloxidase (PO) merupakan suatu enzim yang bertanggung jawab
terhadap proses melanisasi pada krustase sebagai respon terhadap penyerang asing (Sritunyalucksana dan Soderhall 2000). Enzim phenoloxidase (PO) terdapat dalam hemolim sebagai inactive pro-enzyme yang disebut proPO. Transformasi proPO menjadi PO melibatkan beberapa reaksi yang dikenal sebagai proPO activing system (sistem aktivasi proPO). Sistem ini terutama diaktifkan oleh beta glukan,
peptidoglikan, dan LPS.
19 total sel hemosit, karena salah satu fungsi dari hemosit udang adalah dalam produksi dan pelepasan PO ke dalam hemolim dalam bentuk inactive pro-enzyme (Manoppo 2011). Sehingga pada umumnya semakin banyak jumlah hemosit semakin tinggi pula produksi PO, begitu pula sebaliknya.
Tipe hemosit udang dapat diklasifikasikan berdasarkan keberadaan granula sitoplasma, yaitu sel hyaline dan granular (Johansson et al. 2000). Sel hyaline merupakan tipe sel yang paling kecil dengan rasio nukleus sitoplasma tinggi dan tanpa granular. Sel granular merupakan tipe sel paling besar dengan nukleus yang lebih kecil dan terbungkus dengan granula. Berdasarkan Gambar 6, penghitungan yang dilakukan diketahui bahwa jumlah persentase sel hyaline yang tinggi terdapat pada perlakuan C dan D (38,1-39,77%), serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (32,78-35,06%). Sedangkan persentase sel granular berbanding terbalik dengan sel hyaline (Gambar 7). Sel granular dengan jumlah yang rendah terdapat pada perlakuan C dan D, serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E. Total diferensial hemosit merupakan jumlah persentase dari sel hyaline dan sel granular. Masing-masing tipe sel aktif dalam reaksi kekebalan tubuh. Sel hyaline terlibat dalam fagositosis, sedangkan sel granular aktif dalam enkapsulasi, pelepasan proPO dan cytotoxicity (Johansson et al. 2000). Fase saat pergantian kulit pada udang berpengaruh terhadap jumlah sel hyaline dan granular. Rodriguez dan Lee Moullac (2000) menyatakan bahwa jumlah sel hyaline yang tinggi terdapat pada fase molting, sedangkan jumlah sel granular yang tinggi dalam hemolim terjadi selama fase intermoult.
Salah satu mekanisme respon imun yang dibentuk oleh tubuh udang dalam mempertahankan diri dari serangan infeksi adalah melalui proses fagositosis (Rodriguez dan Lee Moullac 2000). Nilai indeks fagositik selama penelitian dapat dilihat pada Gambar 8. Berdasarkan hasil pengamatan yang dilakukan diketahui bahwa nilai indeks fagositik selama penelitian cukup bervariasi. Berdasarkan hasil uji statistik setelah 30 hari masa perlakuan sinbiotik, nilai indeks fagositik perlakuan C, D, dan E berbeda nyata dengan perlakuan A dan B.
20 perlakuan C dengan nilai 56,12%, kemudian diikuti perlakuan D dan E. Hal tersebut menunjukkan bahwa pemberian sinbiotik mampu meningkatkan respon imun udang. Rodriguez dan Lee Moullac (2000) menyatakan bahwa nilai indeks fagositik yang tinggi menggambarkan bahwa organisme tersebut memiliki kemampuan untuk memproduksi sel-sel fagosit dalam darah lebih banyak, sehingga ketika terjadi paparan mikroorganisme patogen, sel darah siap melakukan proses fagositosis. Sel yang melakukan aktivitas fagositosis pada udang adalah sel hyaline. Johansson et al. (2000) menyatakan bahwa sel hyaline terlibat dalam proses fagositosis.
21
IV. KESIMPULAN DAN SARAN
4.1. Kesimpulan
Hasil penelitian menunjukkan bahwa pemberian sinbiotik dalam pakan dengan frekuensi setiap hari memberikan pengaruh yang lebih baik dibanding perlakuan lainnya. Udang yang dipelihara dengan pemberian pakan sinbiotik setiap hari dan diinfeksi IMNV memiliki sintasan yang tinggi yaitu sebesar 80%. Selain itu, perlakuan pemberian pakan sinbiotik mampu meningkatkan respon imun udang.
4.2 Saran
PEMBERIAN SINBIOTIK DENGAN FREKUENSI BERBEDA
PADA PAKAN UDANG VANAME
Litopenaeus vannamei
UNTUK
PENCEGAHAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
GHITA RYAN SEPTIANI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi yang berjudul:
PEMBERIAN SINBIOTIK DENGAN FREKUENSI BERBEDA
PADA PAKAN UDANG VANAME
Litopenaeus vannamei
UNTUK
PENCEGAHAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Desember 2011
ABSTRAK
GHITA RYAN SEPTIANI. Pemberian sinbiotik dengan frekuensi berbeda pada pakan udang vaname Litopenaeus vannamei untuk pencegahan IMNV (Infectious Myonecrosis Virus). Dibimbing oleh Widanarni dan Sukenda.
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor unggulan di bidang perikanan. Namun penyakit bakterial dan viral sering menjadi kendala dalam budidaya udang vaname. Salah satu penyakit viral yang saat ini banyak menyerang udang vaname adalah IMNV (Infectious Myonecrosis Virus). Penelitian ini dilakukan untuk menguji efektivitas pemberian pakan sinbiotik dengan frekuensi berbeda terhadap sintasan, pertumbuhan, dan respons imun udang vaname yang diinfeksi IMNV. Udang yang digunakan memiliki bobot 0,493±0,035 gram/ekor, dipelihara sebanyak 15 ekor dalam akuarium berukuran 60x35x30 cm yang diisi air laut sebanyak 30 liter. Penelitian dilakukan dengan 5 perlakuan yaitu A (tanpa pemberian sinbiotik dan diinfeksi IMNV), B (tanpa pemberian sinbiotik dan tanpa infeksi IMNV), C (pemberian sinbiotik setiap hari dan diinfeksi IMNV), D (pemberian sinbiotik dua kali seminggu dan diinfeksi IMNV), dan E (pemberian sinbiotik satu kali seminggu dan diinfeksi IMNV). Hasil penelitian menunjukkan bahwa pemberian sinbiotik dengan frekuensi setiap hari memberikan pengaruh yang lebih baik dibanding perlakuan lainnya. Udang yang dipelihara dengan pemberian pakan sinbiotik setiap hari dan diinfeksi IMNV memiliki sintasan yang tinggi (80%) serta respons imun yang lebih baik.
ABSTRACT
GHITA RYAN SEPTIANI. The giving of sinbiotic with the different frequency in feed of white shrimp Litopenaeus vannamei for prevention of IMNV (Infectious Myonecrosis Virus). Supervised by Widanarni and Sukenda.
White shrimp Litopenaeus vannamei is the prioritized export of Indonesian fisheries commodity. However, outbreak of main bacterial and viral diseases are often decreased the white shrimp production. One of the viral disease which often attacks white shrimp is IMNV (Infectious Myonecrosis Virus). This study evaluated the effectiveness of sinbiotic with different frequencies of survival rate, growth, and immune response of white shrimp infected by IMNV. The weight of the shrimp is 0,493±0,035 grams/head, it was kept as many as 15 shrimps in aquarium (60x35x30)cm. The aquarium filled with sea water as much as 30 liters. The study was conducted with five treatments consisted of A (without the giving of sinbiotic and infected by IMNV), B (without the giving of sinbiotic and without infection of IMNV), C (the giving of sinbiotic every day and infected by IMNV), D (the giving of sinbiotic twice a week and infected by IMNV), and E (the giving of sinbiotic once a week and infected by IMNV). The results showed that the giving of sinbiotic every day give a better effect than other treatments. Shrimp maintained with daily feeding sinbiotic and infected by IMNV have a high survival rate (80%) and give a better immune response than others.
PEMBERIAN SINBIOTIK DENGAN FREKUENSI BERBEDA
PADA PAKAN UDANG VANAME
Litopenaeus vannamei
UNTUK
PENCEGAHAN IMNV (
INFECTIOUS MYONECROSIS VIRUS
)
GHITA RYAN SEPTIANI
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Program Studi Teknologi dan Manajemen Perikanan Budidaya
Departemen Budidaya Perairan Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul : Pemberian sinbiotik dengan frekuensi berbeda pada pakan udang vaname Litopenaeus vannamei untuk pencegahan IMNV (Infectious Myonecrosis Virus)
Nama : Ghita Ryan Septiani
Nrp : C14070037
Disetujui,
Pembimbing I Pembimbing II
Dr. Ir. Widanarni, M.Si. Dr. Ir. Sukenda, M.Sc. NIP : 19670927 199403 2 001 NIP. 19671013 199302 1 001
Diketahui,
Ketua Departemen Budidaya Perairan
Dr. Ir. Odang Carman, M.Sc. NIP : 19591222 198601 1 001
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karunia-Nya, sehingga penyusunan skripsi dengan judul "Pemberian sinbiotik dengan frekuensi berbeda pada pakan udang vaname Litopenaeus vannamei untuk pencegahan IMNV (Infectious Myonecrosis Virus)" dapat diselesaikan. Penelitian ini dilaksanakan pada bulan Juni sampai dengan Juli 2011 bertempat di Laboratorium Kesehatan Ikan, Laboratorium Lingkungan Akuakultur, dan Laboratorium Nutrisi Ikan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ucapan terima kasih penulis sampaikan kepada Dr. Ir. Widanarni, M.Si. dan Dr. Ir. Sukenda, M.Sc. sebagai dosen pembimbing atas bimbingan yang telah diberikan selama ini, serta kepada Dr. Ir. Odang Carman, M.Sc. sebagai dosen penguji tamu. Penulis juga menyampaikan terima kasih kepada Ibunda Surini dan Ayahanda Iryanto atas dukungan dan bimbingannya, serta kepada Febry Ryan Priyatna, Zelika Rizky Sholeha, Firly Ryan Nouvaly dan Suryaman. Ucapan terima kasih juga disampaikan kepada Bapak Ranta dan Kak Rahman yang telah membantu penulis dalam pengerjaan penelitian ini, serta kepada Dama, Dwi, Ika, Kak Angga, Kak Fariq, Bu Dian, Mba Eza, Kang Adna, Kang Asep, Mba Yuli, teman-teman LKI’ers (Iling, Mumun, Trian, Lita, Iis, Yue, Vika, Yesy, Ood, Ezy, Hendar, dan Novi), teman-teman BDP 44, dan semua pihak yang telah memberikan dukungannya kepada penulis dalam menyelesaikan skripsi ini.
Bogor, Desember 2011
Ghita Ryan Septiani
DAFTAR RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 17 September 1989 dari pasangan Bapak Iryanto dan Ibu Surini. Penulis merupakan anak kedua dari empat bersaudara.
Pendidikan formal yang dilalui penulis adalah SMAN 1 Sumber, Cirebon dan lulus pada tahun 2007. Pada tahun yang sama penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) dan memilih Mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan serta dengan Minor Manajemen Fungsional.
Selama mengikuti perkuliahan, penulis pernah melakukan praktik lapang akuakultur (PLA) di PT. Centralpertiwi Bahari Rembang dan PT. Triwindu Graha Manunggal Anyer dengan judul laporan “Pembenihan Udang Vaname (Litopenaeus vannamei)”. Penulis juga aktif menjadi pengurus Himpunan Mahasiswa Akuakultur sebagai staf divisi Pengembangan Sumberdaya Masyarakat (2009/2010) serta sebagai kepala divisi Publikasi dan Pengembangan Sumber Daya (2010/2011). Penulis juga pernah menjadi asisten mata kuliah Dasar-dasar Mikrobiologi Akuatik program Sarjana semester genap (2009/2010) dan (2010/2011), Mikrobiologi Akuatik program Diploma semester ganjil (2011/2012), Mikrobiologi Akuakultur program Pascasarjana semester ganjil (2011/2012), dan Penyakit Organisme Akuatik program Sarjana semester ganjil (2011/2012). Penulis merupakan salah satu anggota penerima dana DIKTI pada
PKM bidang pengabdian masyarakat (2010) yang berjudul “Pelatihan Produksi
Ikan Hias dengan Metode Induced Breeding Di Kampung Setu, Desa Parigi Mekar, Kecamatan Ciseeng, Kabupaten Bogor”.
DAFTAR ISI
DAFTAR TABEL
DAFTAR GAMBAR
Halaman 1. Sintasan udang vaname selama 30 hari perlakuan sinbiotik (a) dan
akhir penelitian setelah uji tantang dengan IMNV (b) ... 9 2. Laju pertumbuhan harian udang pada akhir perlakuan sinbiotik ... 10 3. Nilai rasio konversi pakan udang vaname pada akhir sinbiotik ... 10 4. Total Haemocyte Count udang vaname pada akhir perlakuan
sinbiotik dan pasca infeksi IMNV ... 11 5. Aktivitas enzim phenoloksidase udang vaname pada akhir
perlakuan sinbiotik dan pasca infeksi IMNV ... 12 6. Persentase sel hyaline udang vaname pada akhir perlakuan
sinbiotik dan pasca infeksi IMNV ... 12 7. Persentase sel granular udang vaname pada akhir perlakuan
sinbiotik dan pasca infeksi IMNV ... 13 8. Persentase indeks fagositik udang vaname pada akhir perlakuan
DAFTAR LAMPIRAN
Halaman 1. Analisis statistik terhadap sintasan udang vaname pada akhir
perlakuan sinbiotik ... 26 2. Analisis statistik terhadap sintasan udang vaname pasca infeksi
IMNV ... 26 3. Analisis statistik terhadap laju pertumbuhan harian udang vaname
pada akhir perlakuan sinbiotik ... 27 4. Analisis statistik terhadap rasio konversi pakan udang vaname
pada akhir perlakuan sinbiotik ... 27 5. Analisis statistik terhadap total haemocyte count udang vaname
pada akhir perlakuan sinbiotik ... 28 6. Analisis statistik terhadap total haemocyte count udang vaname
pasca infeksi IMNV... 29 7. Analisis statistik terhadap aktivitas phenoloxydase udang vaname
pada akhir perlakuan sinbiotik ... 29 8. Analisis statistik terhadap aktivitas phenoloxydase udang vaname
pasca infeksi IMNV... 30 9. Analisis statistik terhadap jumlah sel hyaline udang vaname pada
akhir perlakuan sinbiotik ... 30 10. Analisis statistik terhadap jumlah sel hyaline udang vaname pasca
infeksi IMNV ... 31 11. Analisis statistik terhadap jumlah sel granular udang vaname pada
akhir perlakuan sinbiotik ... 32 12. Analisis statistik terhadap jumlah sel granular udang vaname pasca
infeksi IMNV ... 32 13. Analisis statistik terhadap indeks fagositik udang vaname pada
akhir perlakuan sinbiotik ... 33 14. Analisis statistik terhadap indeks fagositik udang vaname pasca
1
I. PENDAHULUAN
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor unggulan di bidang perikanan yang persentasenya cukup tinggi. Kementerian Kelautan dan Perikanan (KKP) pada tahun 2009 menetapkan target produksi udang vaname meningkat sampai 209% untuk tahun 2014, berarti harus terjadi peningkatan produksi dari 244.650 ton pada tahun 2009 menjadi 511.000 ton pada tahun 2011 (Ditjen Perikanan Budidaya 2010). Upaya yang dapat dilakukan untuk memenuhi target tersebut adalah dengan cara melakukan budidaya udang vaname secara intensif melalui peningkatan padat tebar udang vaname. Namun demikian, serangan penyakit sering menjadi masalah dalam budidaya udang vaname secara intensif.
Penyakit yang sering menjadi kendala dalam kegiatan budidaya udang vaname adalah penyakit bakterial dan viral. Salah satu penyakit viral yang saat ini banyak menyerang udang vaname adalah IMNV (Infectious Myonecrosis Virus) (Costa et al. 2009). Menurut Tang et al (2005), gejala klinis yang umum terjadi pada udang yang terserang IMNV adalah rusaknya jaringan dan adanya warna putih pada otot. Menurut Coelho et al. (2009), infeksi IMNV dapat menimbulkan tingkat mortalitas di atas 60% pada tambak udang dan dapat menyerang udang pada stadia post-larva (PL), juvenil, dan dewasa. Oleh karena itu, perlu dilakukan pengendalian terhadap serangan virus tersebut. Salah satu alternatif yang dapat dilakukan untuk mengendalikan penyakit tersebut adalah melalui aplikasi sinbiotik (kombinasi antara probiotik dan prebiotik).
2 pertumbuhan bakteri patogen Vibrio harveyi dalam uji in vitro dan in vivo. Selain itu Gullian et al. (2004) menyatakan bahwa V. alginolyticus mampu meningkatkan pertumbuhan dan respon imun pada udang vaname L. vannamei.
Menurut Lisal (2005), konsep probiotik ini memiliki kelemahan, yaitu kemampuan bertahan, kolonisasi, dan kompetisi nutrien dari bakteri probiotik untuk masuk ke dalam satu lingkungan ekosistem yang sudah mengandung berbagai jenis bakteri lainnya. Lisal (2005) menyatakan bahwa jika terjadi perubahan lingkungan yang ekstrim, maka bakteri dalam saluran pencernaan akan dengan cepat mengalami wash out. Dalam hal ini, dibutuhkan pendekatan yang dapat mengatasi keterbatasan tersebut, salah satunya adalah melalui pemberian prebiotik.
Prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang, namun memiliki pengaruh yang menguntungkan terhadap inang dengan menstimulir pertumbuhan mikroflora normal di dalam saluran pencernaan inang (Schrezenmeir & Vrese 2001). Prebiotik yang digunakan dalam penelitian ini adalah ekstrak oligosakarida yang berasal dari tepung ubi jalar varietas Sukuh Ipomoea batatas L. Perpaduan antara probiotik dan prebiotik disebut sinbiotik. Menurut Schrezenmeir & Vrese (2001) sinbiotik merupakan kombinasi seimbang dari probiotik dan prebiotik dalam mendukung kelangsungan hidup dan pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan mahluk hidup.
3
II. METODOLOGI
2.1 Penyiapan Prebiotik
2.1.1 Ekstraksi Oligosakarida/Prebiotik
Sebanyak 500 gram tepung ubi jalar dicampur air dengan perbandingan 1:1 (w/v) dan dikukus selama 30 menit pada suhu 100oC. Setelah itu tepung ubi jalar dikeringkan dalam oven pada suhu 55oC selama 18 jam. Selanjutnya, digiling dan disaring menggunakan ayakan hingga tepung kukus ubi jalar dapat terkumpul. Proses ekstraksi oligosakarida/prebiotik mengacu pada metode Muchtadi (1989). Tepung kukus ubi jalar disuspensikan ke dalam etanol 70% dengan perbandingan 1:10, diaduk menggunakan magnetic stirer selama 15 jam. Kemudian disaring menggunakan kertas saring steril. Setelah itu disentrifuse selama 10 menit dengan kecepatan 5000 rpm dan dilakukan penyaringan kembali. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil evaporator diencerkan dengan akuades steril menggunakan perhitungan total padatan terlarut (TPT).
2.1.2 Pengukuran Total Padatan Terlarut
Pengujian total padatan terlarut (TPT) ini mengacu pada metode Apriyantono et al. (1989). Cawan porselin dimasukkan ke dalam oven selama 1 jam dengan suhu 100oC, kemudian dimasukkan ke dalam desikator dan ditimbang (a gram). Setelah itu, sebanyak 1 ml ekstrak oligosakarida hasil ekstraksi dari ubi jalar ditempatkan pada cawan porselin tersebut, kemudian ditimbang (b gram). Cawan porselin berisi ekstrak oligosakarida tersebut dimasukkan ke dalam oven dengan suhu 100oC selama 24 jam. Setelah itu cawan didinginkan dalam desikator selama 10 menit, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dengan rumus:
TPT= c−a
b x 100%
4
2.2 Pengujian Sinbiotik secara In Vivo
2.2.1 Persiapan Wadah
Wadah yang digunakan dalam penelitian ini adalah 15 akuarium berukuran 60 cm x 30 cm x 35 cm. Sebelum digunakan, akuarium dicuci terlebih dahulu menggunakan deterjen dan dikeringkan. Kemudian akuarium didesinfeksi menggunakan kaporit 100 ppm selama 24 jam. Setelah itu akuarium yang telah didesinfeksi dibilas dengan air tawar hingga bersih, kemudian sebanyak 30 liter air laut dimasukkan pada masing-masing akuarium.
2.2.2 Persiapan Hewan Uji
Hewan uji yang digunakan dalam penelitian ini adalah benur udang vaname stadia PL10 yang berasal dari PT. Global Gen, Labuan, Banten. Sebelum diberi perlakuan, benur terlebih dahulu dipelihara selama 30 hari dalam akuarium. Bobot benur yang digunakan adalah 0,493±0,035 gram/ekor. Masing-masing akuarium dilengkapi shelter sebagai tempat udang berlindung ketika molting. Pengelolaan kualitas air dilakukan dengan penyiponan dan pergantian air setiap pagi hari sebanyak 10% dari total volume akuarium. Sebelum diberi perlakuan, udang uji dipuasakan selama 24 jam dengan tujuan menghilangkan sisa pakan dalam tubuh.
2.2.3 Persiapan Pakan Uji
5 probiotik yang akan dicampurkan ke dalam pakan. Pembuatan sinbiotik dilakukan dengan cara mengkombinasikan probiotik dan prebiotik pada pakan yang akan diberikan. Dosis probiotik yang digunakan sebesar 1% dari jumlah pakan yang akan diberikan (Wang 2007), dan prebiotik sebesar 2% dari jumlah pakan yang akan diberikan (Mahious et al. 2006). Pencampuran dilakukan dengan menambahkan kuning telur sebanyak 2% dari total pakan yang berfungsi sebagai perekat (Wang 2007). Sebelum diberikan ke udang, pakan dikeringudarakan terlebih dahulu selama 10-15 menit untuk mengurangi kelembaban.
2.2.4 Pengujian Pakan Uji pada Udang Vaname
Pakan uji yang digunakan dalam penelitian ini berupa pelet komersil dengan kandungan protein sebesar 40%. Pengujian terdiri dari 5 perlakuan (Tabel 1) dengan 3 kali ulangan, yaitu:
Tabel 1. Perlakuan pemberian sinbiotik dan uji tantang
Pemeliharaan udang dengan pemberian perlakuan sinbiotik dilakukan selama 30 hari. Udang uji sebanyak 15 ekor dipelihara dalam akuarium dengan volume air laut 30 liter. Pemberian pakan dilakukan lima kali dalam sehari pada pukul 07.00, 11.00, 15.00, 19.00, dan 23.00 WIB. Pada perlakuan C, pakan dengan penambahan sinbiotik diberikan pada udang uji setiap hari, namun pada perlakuan D dan E pakan yang telah ditambahkan sinbiotik diberikan secara periodik masing-masing adalah dua kali seminggu dan satu kali seminggu (Tabel 1). Jumlah pakan yang diberikan didasarkan pada Feeding Rate (FR) menurut SNI 01-7246-2006 dengan persentase FR yang menurun secara bertahap mulai 15% hingga 5% sesuai dengan bobot udang pada masing-masing perlakuan.
Setelah udang uji diberi perlakuan sinbiotik selama 30 hari, kemudian dilakukan uji tantang secara oral menggunakan IMNV melalui pemberian pakan
Perlakuan Keterangan
Perlakuan A Pemberian pakan komersil tanpa penambahan sinbiotik kemudian diinfeksi IMNV (kontrol (+))
Perlakuan B Pemberian pakan komersil tanpa penambahan sinbiotik dan tanpa infeksi IMNV (kontrol (-))
Perlakuan C Pemberian setiap hari pakan komersil dengan penambahan sinbiotik kemudian diinfeksiIMNV
Perlakuan D Pemberian dua kali seminggu pakan komersil dengan penambahan sinbiotik kemudian diinfeksi IMNV
6 menggunakan cacahan udang yang positif terinfeksi IMNV terhadap udang uji. Uji tantang dilakukan selama 3 hari dan pengamatan dilakukan selama 14 hari.
2.3 Parameter Pengamatan 2.3.1 Sintasan
Sintasan atau tingkat kelangsungan hidup udang dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dan akhir penelitian pasca infeksi IMNV. Sintasan dihitung berdasarkan rumus (Effendie 1997):
SR = Nt
No x 100% Keterangan :
SR = Kelangsungan hidup (%)
Nt = Jumlah udang pada akhir pemeliharaan (ekor) No = Jumlah udang pada awal pemeliharaan (ekor)
2.3.2 Laju Pertumbuhan Harian
Laju pertumbuhan spesifik atau Spesific Growth Rate (SGR) dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dengan menggunakan formula di bawah ini (Huisman 1987):
� = �� ��
�
−1 × 100%
Keterangan :
SGR = Laju pertumbuhan harian (%)
Wt = Bobot rata-rataudang pada akhir perlakuan (gram) Wo = Bobot rata-rata udang pada awal pemeliharaan (gram) t = Periode pemeliharaan (hari)
2.3.3 Rasio Konversi Pakan
Rasio konversi pakan selama pemeliharaan dengan perlakuan sinbiotik dihitung menggunakan rumus (Zonneveld et al. 1991):
FCR = F
Bt + Bm−Bo Keterangan :
7 Bt = Biomassa udang pada saat akhir perlakuan (gram)
Bm = Biomassa udang yang mati saat perlakuan (gram) Bo = Biomassa udang pada saat awal perlakuan (gram)
2.3.4 Total Hemosit
Pengamatan terhadap respon imun udang dilakukan pada akhir perlakuan sinbiotik dan pasca infeksi IMNV. Prosedur penghitungan total hemosit mengacu pada metode Blaxhall dan Daishley (1973). Haemolymph diambil sebanyak 0,1 ml dari pangkal kaki renang pertama dengan syringe 1 ml yang sudah berisi 0,3 ml antikoagulan Na-sitrat 3,8%. Campuran dihomogenkan, kemudian tetesan pertama dibuang sedangkan tetesan selanjutnya diteteskan pada haemositometer. Total hemosit dilihat dan dihitung jumlah selnya per ml di bawah mikroskop.
2.3.5 Aktivitas Phenoloxidase (PO)
Pengukuran PO dilakukan berdasarkan prosedur yang dikemukan oleh Liu dan Chen (2004). Aktivitas PO haemocyte diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 ml campuran hemolim-antikoagulan disentrifuse pada 1.500 rpm selama 10 menit pada temperatur 4 oC. Supernatan dikeluarkan dan pelet disuspensikan kembali secara perlahan-lahan ke dalam 1 ml larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) kemudian disentrifuse kembali. Pelet kemudian diambil dan disuspensikan dalam 200 µ l cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
8
2.3.6 Diferensial Hemosit
Diferensial hemosit dihitung berdasarkan metode yang dilakukan Martin dan Graves (1995). Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase tiap jenisnya (hyaline dan granular). Persentase tiap jenis sel hemosit dihitung dengan rumus:
Persentase jenis sel hemosit = Jumlah tiap jenis sel hemosit
Total hemosit x 100%
2.3.7 Indeks Fagositik
Penghitungan indeks fagositik mengacu pada metode Anderson dan Siwicki (1993). Aktivitas fagositik diukur berdasarkan persentase sel-sel fagosit yang menunjukkan proses fagositosis dari 100 sel fagosit yang diamati. Indeks fagositik dihitung dengan rumus:
Indeks fagositik = Jumlah sel fagosit yang melakukan fagositosis
jumlah sel fagosit x 100%
2.3.8 Gejala Klinis
Pengamatan gejala klinis dilakukan dengan melihat perubahan atau kelainan pada anatomi makro udang. Gejala klinis yang diamati ialah terbentuknya otot berwarna putih pada bagian ruas tubuh udang, dan warna kemerahan pada bagian ekor.
2.3.9 Pengamatan Kualitas Air
Pengamatan kualitas air dilakukan pada air stok awal dan air media pemeliharaan masing-masing perlakuan pada akhir penelitian. Parameter kualitas air yang diukur adalah suhu, pH, DO, salinitas, dan TAN.
2.4 Analisis Data
9
III. HASIL DAN PEMBAHASAN
3.1 Hasil 3.1.1 Sintasan
Parameter utama dalam penelitian ini adalah nilai sintasan dari masing-masing perlakuan. Penghitungan nilai sintasan dibagi menjadi dua tahap. Tahap pertama dilakukan setelah 30 hari perlakuan sinbiotik, sedangkan tahap kedua dilakukan pada akhir penelitian pasca infeksi IMNV. Nilai sintasan yang diperoleh dapat dilihat pada Gambar 1.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 1. Sintasan udang vaname selama 30 hari perlakuan sinbiotik (a) dan akhir penelitian setelah uji tantang dengan IMNV (b)
Setelah 30 hari perlakuan sinbiotik, berdasarkan hasil uji lanjut dengan menggunakan uji Duncan, diketahui bahwa tidak terdapat perbedaan yang nyata antar perlakuan yaitu dengan nilai sintasan berkisar antara 90-96,67% (p>0,05; Lampiran 1). Sedangkan hasil pengamatan pasca uji tantang menggunakan IMNV diperoleh hasil bahwa perlakuan C menghasilkan sintasan yang tinggi yaitu 80% dan tidak berbeda nyata dengan perlakuan B, D, dan E, namun berbeda nyata dengan perlakuan A (p<0,05; Lampiran 2).
3.1.2 Laju Pertumbuhan Harian
10 Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 2. Laju pertumbuhan harian udang pada akhir perlakuan sinbiotik
Berdasarkan Gambar 2, diketahui bahwa laju pertumbuhan harian perlakuan C, D, dan E (6,93-6,97%) tidak memiliki perbedaan yang nyata, namun ketiga perlakuan tersebut memberikan perbedaan yang nyata terhadap perlakuan A dan B (6,65-6,66%) (p<0,05; Lampiran 3).
3.1.3 Rasio Konversi Pakan
Pengaruh pemberian pakan sinbiotik terhadap konversi pakan dapat dilihat pada Gambar 3. Berdasarkan hasil uji lanjut menggunakan uji Duncan, diketahui bahwa setelah 30 hari perlakuan sinbiotik diperoleh nilai konversi pakan pada perlakuan C dan D (1,54-1,58%) berbeda nyata dengan perlakuan A dan B (1,86%) (p<0,05; Lampiran 4).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
11
3.2.4 Total Haemocyte Count (THC)
Pengukuran THC dilakukan pada akhir masa perlakuan sinbiotik dan pasca infeksi IMNV. Hasil pengukuran THC disajikan pada Gambar 4.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 4. Total Haemocyte Count udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
Berdasarkan hasil pengukuran THC yang didapat pada akhir masa perlakuan sinbiotik diketahui bahwa THC pada perlakuan C dan D memiliki nilai tertinggi (3,03-3,05)x107sel/ml, serta menunjukkan perbedaan yang nyata dengan perlakuan lainnya. Jumlah sel hemosit pada perlakuan E lebih rendah dibanding perlakuan C dan D namun lebih tinggi dibanding perlakuan kontrol, serta menunjukkan perbedaan yang nyata (p<0,05; Lampiran 5).
Nilai THC pasca uji tantang mengalami penurunan pada semua perlakuan, namun penurunan THC pada perlakuan B (kontrol (-)) tidak terlalu signifikan. Jumlah sel hemosit tertinggi pada pengukuran pasca uji tantang terdapat pada udang yang diberi perlakuan C yaitu sebesar 2,76x107 sel/ml, serta menunjukkan perbedaan yang nyata dengan perlakuan lainnya. Jumlah sel hemosit pada perlakuan D dan E lebih rendah dibanding perlakuan C, namun lebih tinggi dibanding perlakuan A (kontrol(+)) dan memberikan perbedaan yang nyata (p<0,05; Lampiran 6).
3.1.5 Aktivitas Phenoloxidase (PO)
Pengaruh pakan sinbiotik terhadap aktivitas phenoloxidase (PO) pada udang vaname dapat dilihat pada Gambar 5.
1.42
Akhir perlakuan sinbiotik Pasca infeksi IMNV
12 Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 5. Aktivitas enzim phenoloxidase udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
Aktivitas PO di akhir perlakuan sinbiotik sebelum uji tantang pada perlakuan C dan D memiliki nilai yang tinggi yaitu 0,32 dan 0,33 serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (p<0,05; Lampiran 7). Aktivitas PO udang uji mengalami penurunan pasca uji tantang. Nilai PO tertinggi yang diperoleh pada pasca uji tantang terdapat pada perlakuan B dan C (0,18-0,21) dan menunjukkan perbedaan yang nyata dengan perlakuan A, D, dan E (0,06-0,08) (p<0,05; Lampiran 8)
3.1.6 Diferensial Haemocyte Count
Tipe hemosit udang dapat diklasifikasikan berdasarkan keberadaan granula sitoplasma, yaitu sel hyaline dan granular. Hasil penghitungan jumlah sel hyaline dan sel granular dapat dilihat pada Gambar 6 dan 7.
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 6. Persentase sel hyaline udang vaname pada akhir perlakuan sinbiotik (a) dan pasca infeksi IMNV (b)
0,22
Akhir perlakuan sinbiotik Pasca infeksi IMNV
Ph
Akhir perlakuan sinbiotik Pasca infeksi IMNV
13 Berdasarkan penghitungan yang dilakukan diketahui bahwa jumlah sel hyaline yang tinggi terdapat pada perlakuan C dan D (38,1-39,77%), serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (32,78-35,06%) (p<0,05; Lampiran 9). Sedangkan sel granular berbanding terbalik dengan hyaline. Sel granular dengan jumlah yang rendah terdapat pada perlakuan C dan D, serta menunjukkan perbedaan yang nyata dengan perlakuan A, B, dan E (p<0,05; Lampiran 11).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 7. Persentase sel granular udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
3.1.7 Indeks Fagositik
Nilai indeks fagositik selama penelitian dapat dilihat pada Gambar 8. Berdasarkan hasil pengamatan yang dilakukan diketahui bahwa nilai indeks fagositik selama penelitian cukup bervariasi. Berdasarkan hasil uji statistik setelah 30 hari masa perlakuan sinbiotik, nilai indeks fagositik perlakuan C, D, dan E berbeda nyata dengan perlakuan A dan B (p<0,05; Lampiran 13).
Keterangan:
A (kontrol +), B (kontrol -), C (pemberian pakan sinbiotik setiap hari), D (pemberian pakan sinbiotik dua kali seminggu) dan E (pemberian pakan sinbiotik satu kali seminggu)
Gambar 8. Persentase indeks fagositik udang vaname pada akhir perlakuan sinbiotik dan pasca infeksi IMNV
66.67
Akhir perlakuan sinbiotik Pasca infeksi IMNV
S
Akhir perlakuan sinbiotik Pasca infeksi IMNV
14 Nilai indeks fagositik pasca infeksi IMNV mengalami penurunan kecuali pada perlakuan B (kontrol (-)). Namun nilai tertinggi tetap diperoleh pada perlakuan C dengan nilai 56,12%, dan memberikan perbedaan yang nyata dengan perlakuan lainnya (p<0,05; Lampiran 14).
3.1.8 Gejala Klinis
Pengamatan gejala klinis dilakukan untuk mengetahui perkembangan infeksi IMNV terhadap udang uji. Berdasarkan pengamatan yang dilakukan diketahui bahwa terjadi perubahan makro anatomi udang uji pasca infeksi. Perubahan awal yang terjadi adalah munculnya nekrosis pada bagian abdomen udang. Selain itu gejala klinis juga ditunjukkan dengan terbentuknya otot putih pada ruas-ruas tubuhnya, dan muncul warna kemerahan pada ekor udang (Gambar 9).
Udang normal Nekrosis pada ruas tubuh
Nekrosis pada ruas tubuh dan warna kemerahan pada ekor
Gambar 9. Perubahan makro anatomi udang uji setelah infeksi IMNV
3.1.9 Kualitas Air
15 Tabel 2. Nilai kualitas air pada media pemeliharaan udang vaname
Parameter
Nilai kualitas air selama masa pemeliharaan pada semua perlakuan masih berada pada kisaran untuk pertumbuhan udang vaname. Sehingga diasumsikan perubahan kelangsungan hidup, pertumbuhan, konversi pakan, dan respon imun yang terjadi pada udang uji bukan diakibatkan oleh kualitas air media pemeliharaan.
3.2 Pembahasan
Sintasan merupakan peluang hidup suatu individu dalam waktu tertentu (Effendie 1997). Penghitungan nilai sintasan dalam penelitian ini dibagi menjadi dua tahap. Tahap pertama dilakukan setelah 30 hari perlakuan sinbiotik, sedangkan tahap kedua dilakukan pada akhir penelitian pasca infeksi IMNV. Setelah 30 hari perlakuan sinbiotik (Gambar 1), diketahui bahwa tidak terdapat perbedaan yang nyata antar perlakuan. Sedangkan hasil pengamatan pasca uji tantang menggunakan IMNV diperoleh hasil bahwa perlakuan C menghasilkan sintasan yang tertinggi yaitu 80% dan tidak berbeda nyata dengan perlakuan B, D, dan E, namun berbeda nyata dengan perlakuan A.
16 metazoa. Selain itu, penambahan prebiotik juga mampu meningkatkan kerja dari bakteri probiotik. Schrezenmeir & Vrese (2001) menyatakan bahwa prebiotik mampu menstimulir pertumbuhan atau aktivitas metabolik bakteri di dalam usus. Hasil penelitian Li et al. (2009) menunjukkan bahwa penambahan gabungan probiotik Bacillus dan prebiotik isomaltooligosaccharides pada udang vaname yang diinfeksi WSSV memberikan nilai sintasan 41,38% lebih tinggi dibanding perlakuan kontrol.
Udang uji pada perlakuan D juga menunjukkan jumlah hemosit yang tinggi dan tidak berbeda nyata dengan perlakuan C, namun pada perlakuan D nilai sintasan yang dihasilkan rendah. Hal tersebut diduga karena jumlah sel hemosit yang melakukan proses fagositosis pada udang perlakuan D (56,82%) lebih rendah dibanding perlakuan C (64,76%) dan menunjukkan perbedaan yang nyata (Gambar 8). Sehingga udang pada perlakuan C lebih mampu menghadapi patogen. Rodriguez dan Lee Moullac (2000) menyatakan bahwa nilai indeks fagositik yang tinggi menggambarkan bahwa organisme tersebut memiliki kemampuan untuk memproduksi sel-sel fagosit dalam darah dengan jumlah lebih banyak, sehingga ketika terjadi paparan mikroorganisme patogen, sel darah siap melakukan proses fagositosis.
17 sinbiotik meningkat. Menurut Atlas et al. (1984), mikroba amilolitik adalah mikroba yang mampu menghasilkan enzim amilase yang akan mendegradasi zat pati menjadi maltosa dan glukosa yang digunakan sebagai sumber karbon dan energi. Sedangkan mikroba proteolitik adalah mikroba yang mampu menghasilkan enzim protease yang akan merombak protein menjadi asam amino yang kemudian dimanfaatkan sebagai sumber karbon dan energi.
Effendi (2004) menyatakan bahwa Feed Conversion Ratio (FCR) atau rasio konversi pakan merupakan suatu ukuran yang menyatakan jumlah pakan yang dibutuhkan untuk menghasilkan 1 kg daging. Gambar 3 menunjukkan bahwa setelah 30 hari perlakuan sinbiotik diperoleh nilai konversi pakan pada perlakuan C dan D (1,54-1,58%) berbeda nyata dengan perlakuan A dan B (1,86%). Berdasarkan hasil yang diperoleh diketahui bahwa pemberian pakan sinbiotik terhadap udang vaname memberikan pengaruh yang baik terhadap nilai FCR. Hal tersebut diduga disebabkan oleh bakteri probiotik SKT-b yang mampu menghasilkan enzim amilase dan protease. Berdasarkan hasil penelitian Widagdo (2011), diketahui bahwa SKT-b merupakan bakteri yang memiliki aktivitas enzim amilase dan protease. Sehingga kemampuan probiotik SKT-b dalam menghasilkan enzim-enzim tersebut yang diduga menyebabkan nilai konversi pakan udang lebih baik. Price dan Stevens (1996) dalam Yandri et al. (2008) menyatakan bahwa protease merupakan suatu enzim yang berfungsi memecah ikatan peptida untuk menghasilkan asam amino dan peptida sederhana lainnya. Protease adalah salah satu enzim yang penting dalam proses pencernaan, termasuk di dalamnya tripsin dan kemotripsin yang bertanggung jawab terhadap hampir 60% pada proses pencernaan udang (Lemos et al. 2000).