EFEK PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN
DOSIS BERBEDA PADA UDANG VANAME
Litopenaeus
vannamei
YANG DIKO-INFEKSI WSSV DAN
Vibrio harveyi
YUNARTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Efek Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda pada Udang Vaname Litopenaeus vannamei yang Diko-infeksi WSSV danVibrio harveyi” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2015
Yunarty
RINGKASAN
YUNARTY. Efek Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda pada Udang Vaname Litopenaeus vannamei yang Diko-infeksi WSSV dan Vibrio harveyi. Dibimbing oleh MUNTI YUHANA dan WIDANARNI.
Penyakit infeksi dan ko-infeksi oleh virus WSSV dan bakteri Vibrio sp. dapat dicegah dengan meningkatkan sistem imun udang. Berbagai penelitian yang pernah dilakukan membuktikan bahwa penerapan sinbiotik terbukti dapat meningkatkan respons imun dan resistensi inang terhadap penyakit serta kinerja pertumbuhan udang dan ikan. Sinbiotik umumnya digunakan dalam bentuk segar sehingga berdaya simpan terbatas. Teknologi mikroenkapsulasi spray drying
memungkinkan bakteri sinbiotik terlindungi dari kondisi lingkungan ekstrim dan memperpanjang daya simpannya. Sinbiotik bakteri probiotikBacillussp. NP5 RfR dan prebiotik MOS berpeluang dikemas dalam bentuk mikrokapsul sinbiotik (MS), dan belum dikaji aplikasinya pada udang vaname. Oleh sebab itu, perlu dilakukan penelitian yang mengkaji efek dari aplikasi MS tersebut terhadap respons imun, kinerja pertumbuhan dan resistensi udang vaname yang diko-infeksi dengan WSSV danV. harveyi. Penelitian ini bertujuan untuk menentukan dosis optimum MS kombinasiBacillussp. NP5 RfRdan MOS yang menghasilkan respons imun, kinerja pertumbuhan, dan resistensi terbaik pada udang vaname.
Penelitian dilakukan menggunakan rancangan tiga perlakuan pemberian MS dosis 0.5% (MS0.5), 1.0% (MS1.0), dan 2.0% (MS2.0), kontrol positif (Kp) dan kontrol negatif (Kn), masing-masing diulang sebanyak 3 kali. Uji in vivo dilakukan pada udang vaname dengan bobot rata-rata perekor (5.44±0.44 g) yang dipelihara dalam akuarium ukuran (60×35×30 cm3) ditebari 15 ekor/akuarium, dan diberikan pakan sesuai rancangan percobaan empat kali sehari menggunakan
feeding rate sebesar 6% selama 30 hari, dan duji tantang dengan injeksi WSSV (104 copy ml-1) secara intramuskular, serta imersi V. harveyi (106CFU ml-1) 24 jam setelahnya. Parameter yang diamati meliputi respons imun (total haemocyte count, aktivitas phenoloxidasedan respiratory burst), kelimpahan bakteri di usus (total viable bacterial count,presumptive vibrio count, totalBacillussp. NP5 RfR
count dan total V. harveyi RfR count), kinerja pertumbuhan (laju pertumbuhan spesifik, rasio konversi pakan), konfirmasi WSSV dan V. harveyi, dan kelangsungan hidup.
Pemberian mikrokapsul sinbiotik yang mengandung kombinasi Bacillus sp. NP5 RfRdan MOS dosis 0.5%, 1% dan 2% secara umum mampu meningkatkan respons imun,
mempertahankan kelimpahan bakteri di usus, menambah laju pertumbuhan spesifik sebesar 3.7–5.7%, mengurangi konversi rasio pakan sebesar 24–76% dan mempertahankan kelangsungan hidup udang vaname. Mikrokapsul sinbiotik dosis 1% merupakan dosis optimum yang berhasil mempertahankan populasi sel bakteri Bacillus
sp. NP5 RfR tertinggi di akhir pemeliharaan (5±0.04 log CFU g-1) maupun pascauji
tantang (4.39±0.19 log CFU g-1). Pemberian mikrokapsul sinbiotik ini belum mampu
meningkatkan resistensi udang terhadap ko-infeksi berat WSSV dan V.harveyi, namun pada pemberian dengan dosis 0.5 dan 1% secara signifikan mampu menurunkan mortalitas udang vaname sebesar 8.89–11.11%.
Kata kunci: ko-infeksi, Litopenaeus vannamei, mikroenkapsulasi, sinbiotik,
SUMMARY
YUNARTY. Effects of Microencapsulated Synbiotic Administration at Different Dosages against WSSV and Vibrio harveyi Co-infection in Pacific White Shrimp
Litopenaeus vannamei. Supervised by MUNTI YUHANA and WIDANARNI. Shrimp diseases caused by infection or co-infection of WSSV andVibrioon Pacific white shrimp Litopenaeus vannamei may prevented by synbiotic application. In previous studies, synbiotic combination of probiotic and prebiotic have shown its capability in improving immune responses, growth performance and disease resistance. As yet, synbiotic generally used as a fresh culture that has a problem with a short time expired for use. This problem can be solved by microencapsulation spray drying technique to stabilize the synbiotic material and to maintain the cells viability during storage. Thus, microcapsulated synbiotic (MS) is more applicable in shrimp culture. This study was conducted to determine the optimum dosage of MS (combination of Bacillus sp. NP5 RfR and mannan oligosaccharide) administration through feed on growth performance and immune responses of Pacific white shrimp co-infected by WSSV andV. harveyi.
The in vivo experiment was conducted by using the shrimps in average body weight of 5.44±0.44 g shrimp-1. The shrimp were reared in plastic tank (60×35×30 cm3) with stocking density of 15 shrimp tank-1, and fed with two artificial diets without MS as controls; positive control (Kp) and negative control (Kn), and three different MS treatments contained diets namely 0.5% (MS0.5), 1.0% (MS1.0), and 2.0% (MS2.0) four times a day at 6% feeding rate for 30 days. Each treatment was performed in three repetition. The challenge test was done by intramuscular injection of WSSV filtrate (104 copies ml-1) after 30 day rearing, followed by V. harveyi cells immersion (106 CFU ml-1) 24 hours after virus injection. Experimental parameters observed in this research consisted of immune responses (total hemmocyte count, phenoloxidase and respiratory burst), the abundance of intestinal bacteria (total bacterial count, presumptive Vibrio count, total Bacillussp. NP5 RfRand total bacterial V. harveyi RfR, growth performance (specific growth rate and feed conversion ratio), and the survival rate. PCR analysis was performed for the confirmation of the presence of WSSV and
V.harveyi.
Results showed that the administration of MS dosage of 0.5%, 1% and 2% generally improved immune responses, maintained the abundance of intestinal bacterial cells, increased a growth performance (3.7–5.7%), reduced a feed conversion ratio (24–76%) and maintained a survival rate. Administration of MS with 1% dose was optimum that significanly maintained higher Bacillus sp. NP5 RfR cells population in last rearing (5±0.04 Log CFU g-1) as well as after a challenge test (4.39±0.19 Log CFU g-1). However, the administration of MS has not been able to prevent a disease caused by heavy co-infection of WSSV and
V.harveyi, yet in application of MS dose 0.5 and 1% significantly reduced the shrimp mortality by 8.89–11.11%.
Key words: co-infection, Litopenaeus vannamei, microencapsulated, synbiotic,
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EFEK PEMBERIAN MIKROKAPSUL SINBIOTIK DENGAN
DOSIS BERBEDA PADA UDANG VANAME
Litopenaeus
vannamei
YANG DIKO-INFEKSI WSSV DAN
Vibrio harveyi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah kesehatan ikan, dengan judul Efek Pemberian Mikrokapsul Sinbiotik dengan Dosis Berbeda pada Udang Vaname (Litopenaeus vannamei)yang Diko-infeksi WSSV danVibrio harveyi.
Terima kasih penulis ucapkan kepada ibu Dr Munti Yuhana, S.Pi, M.Si dan ibu Dr. Ir Widanarni, M.Si selaku pembimbing serta Dr. Sri Nuryati, S.Pi, M.Si selaku dosen penguji luar komisi tesis penulis. Selain itu, penghargaan penulis sampaikan kepada Bapak Ir. Dwi Soeharmanto, MM, bapak Bambang Hanggono, S.Pi, M.Sc dan ibu Veni Darmawiyanti, S.Pi, M.Si selaku pembimbing lapangan, beserta seluruh staf Balai Perikanan Budidaya Air Payau, Situbondo, Jawa Timur. Disamping itu, rasa terimakasih juga diberikan kepada Kementerian Kelautan dan Perikanan dalam hal ini Badan Pengembangan Sumber Daya Manusia Kelautan dan Perikanan yang telah memberikan bantuan biaya pendidikan kepada penulis selama menempuh studi di Institut Pertanian Bogor. Ungkapan terimakasih juga diberikan kepada kepala SUPM Negeri Pariaman dan teman-teman seperjuangan di Pariaman, siswa/i SUPMN Pariaman khususnya Rafika, Fajar dan Aldo, sahabat–sahabat tercinta (Yayasan Al Hikmah Corner : Abung, Icha, Fitria, Rahmat, Asep, Artin, Rifqi, Ino, Yudha, Nurin dan Aisyah), sahabat sepenelitian (Dwi), teman-teman LKI’ers, sahabat sebimbingan (Hilma), teknisi laboratorium Kesehatan Organisme Akuatik, dan seluruh teman–teman Ilmu Akuakultur 2013. Tak lupa pula terimakasih yang tak terhingga kepada ayahanda Yahya dan ibunda Fatimah, adik–adik (Uly, Ady, Osy) seluruh keluarga besar Sunusi-Lampugu Sinassara di Makassar dan keluarga besar mertua ayahanda T.Pintu (alm) dan ibunda Yuliana Sonda di Pinrang, Tana Toraja serta suami tercinta Elias Moni atas dukungannya baik moril maupun materiil.
Akhir kata Semoga karya ilmiah ini bermanfaat.
Bogor, November 2015
DAFTAR ISI
DAFTAR GAMBAR vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
Ruang Lingkup Penelitian 3
2 METODE 3
Waktu dan Tempat 3
Materi Uji 3
Rancangan Penelitian 4
Prosedur Penelitian 4
Parameter Pengamatan 7
Analisis Data 9
3 HASIL DAN PEMBAHASAN 9
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 24
DAFTAR GAMBAR
1 Total hemocyte count (THC) udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan 10 2 Aktivitas phenoloxidase (PO) udang vaname selama penelitian dengan
perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan 11 3 Aktivitas respiratory burst (RB) udang vaname selama penelitian dengan
perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan 12 4 Total viable bacterial count (TBC) dalam usus udang vaname selama
penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dengan dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan
(p<0.05) antar perlakuan 13
5 Presumptive vibrio count (PVC) dalam usus udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05)
antar perlakuan 14
6 Populasi sel bakteriV. harveyiRfRdalam usus udang vaname setelah uji tantang pada perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan 14 7 Bacillus NP5 RfR count pada usus udang vaname pada saat akhir
perlakuan dan setelah uji tantang dengan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan. Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan 15 8 Laju Pertumbuhan Spesifik pada saat akhir perlakuan sinbiotik dari udang
vaname dengan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan. Hurufsuperscriptberbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan
(p<0.05) antar perlakuan 16
periode pengamatan yang sama menunjukkan perbedaan yang signifikan
(p<0.05) antar perlakuan 17
10 Gejala klinis udang vaname yang diko-infeksi WSSV dan Vibrio harveyi. (A) udang sehat nampak badan berwarna cerah (a), udang mulai nampak gejala klinis berupa bintik merah kecoklatan akibat infeksi WSSV dan serangan bakteriVibrio harveyii. (B) Udang mengalami kerusakan jaringan dan nekrosis hampir di seluruh bagian tubuh 18 11 Hasil pengujian PCR udang vaname terhadap infeksi WSSV. band 1:
penanda negatif;band2: Kontrol negatif (Kn);band3: Kontrol positif (Kp) terdeteksi WSSV;band 4 (sampel MS0.5), band 5 (sampel MS1.0), band 6 (sampel MS2.0) positif terdeteksi WSSV;band7: penanda WSSV 19 12 Kelangsungan hidup udang vaname yang diko-infeksi WSSV dan V.
1 PENDAHULUAN
Latar Belakang
Penyakit infeksi yang disebabkan oleh virus dan bakteri merupakan salah satu faktor yang dapat menurunkan produksi udang vaname (Litopenaeus vannamei) (Phuoc et al. 2009). Salah satu penyakit viral yang saat ini banyak ditemukan dalam budidaya udang adalah white spot disease (WSD) yang disebabkan oleh white spot syndrome virus (WSSV). WSSV menyebabkan kematian 90-100% populasi udang hanya dalam waktu 3–10 hari setelah muncul gejala klinis (Sanchez-Martinez et al. 2007). Selain penyakit viral, udang juga rentan terhadap infeksi yang disebabkan oleh bakteri, antara lainVibrio sp. yang mengakibatkan infeksi sekunder (Liu and Chen 2004).
Beberapa penelitian melaporkan bahwa patogen tidak hanya menyerang udang sebagai infeksi tunggal, namun infeksi juga dapat terjadi secara bersama antar patogen terhadap inang yang sama, atau disebut sebagai ko-infeksi (Teixera-Lopes 2011). Dalam hal ini, beberapa jenis virus dan bakteri yang umumnya berperan dalam ko-infeksi pada udang antara lain infectious myonecrosis virus
(IMNV) dengan V. harveyi (Nurhayati et al. 2015), WSSV dengan V. harveyi, serta WSSV denganV. campbellii (Phuocet al. 2009). Dari beberapa macam ko-infeksi tersebut, ko-ko-infeksi WSSV dan Vibrio sp. merupakan ko-infeksi yang paling signifikan meningkatkan mortalitas udang vaname saat stadia awal dan ukuran juvenil (Phuoc et al. 2009). Ko-infeksi tersebut ditunjukkan dengan terjadinya infeksi sekunder oleh Vibrio pada udang yang telah terinfeksi WSSV (Selvin dan Lipton 2003). Upaya pencegahan terhadap serangan ko-infeksi tersebut di masyarakat pembudidaya pada umumnya dilakukan dengan cara meningkatkan sistem imun pada udang, antara lain melalui aplikasi probiotik, prebiotik, maupun sinbiotik selama pemeliharaan udang.
Probiotik yang ditambahkan pada pakan dapat meningkatkan sistem imun terhadap bakteri Vibrio sp. dan virus WSSV (Gullian et al. 2004). Selanjutnya, penambahan prebiotik berupa mannan oligosakarida (MOS) dapat meningkatkan
survival rate, status kesehatan dan kekebalan tubuh pada lobster (Cherax tenuimanus) (Sang et al. 2011). Sementara itu, sinbiotik merupakan kombinasi seimbang antara probiotik dan prebiotik, yang mana prebiotik akan dimanfaatkan oleh bakteri probiotik untuk mendukung kelangsungan hidup dan pertumbuhannya dalam saluran pencernaan inang (Schrezenmeir dan Vrese 2001), sehingga secara tak langsung keberadaannya lebih efektif meningkatkan respons imun dan resistensi inang terhadap penyakit serta kinerja pertumbuhan udang (Li
et al. 2009) dan ikan (Geraylou et al. 2013), dibandingkan dengan aplikasi probiotik maupun prebiotik secara terpisah (Merriefieldet al.2010).
2
ekstrim (Widodo et al. 2003) dan mampu memperpanjang daya simpan bakteri (Weinbreck et al. 2010). Mikroenkapsulasi juga memungkinkan terjadinya konversi cairan menjadi serbuk sehingga memudahkan penanganan dan pengemasannya (Yuliani et al.2007). Metode mikroenkapsulasi organisme bersel tunggal, contohnya bakteri, yang paling umum digunakan adalah spray drying
(Triana et al. 2006; Caliskan dan Dirim 2013). Metode ini diketahui mampu mempertahankan viabilitas mikrokapsul Bifidobacteria dan oligofruktosa yang diperkaya inulin (Freire et al. 2012). Di samping itu, penggunaan metode spray dryingdapat mengurangi kadar air bahan yang dimikroenkapsulasi sehingga daya simpannya lebih tahan lama dibandingkan dengan metode lainnya (Rajam et al.
2012).
Penelitian ini mengkaji tentang gabungan antara pemberian probiotik
Bacillussp. NP5 RfRdan prebiotik komersil berupa mannan oligosakarida (MOS). Bakteri probiotik Bacillus sp. NP5 merupakan bakteri yang berasal dari saluran pencernaan ikan nila (Oreochromis niloticus) (Putra dan Widanarni 2015). Prebiotik MOS berasal dari dinding sel Saccharomyces cerevisiae yang diproduksi secara komersil dan merupakan prebiotik aditif untuk makanan hewan.
Pada penelitian sebelumnya (Zubaidah 2014; Munaeni et al. 2014) yang melaporkan bahwa kombinasi probiotik Bacillus sp. NP5 RfR dan prebiotik ekstrak ubi jalar yang dibuat dalam bentuk mikrokapsul sinbiotik dan diberikan secara oral melalui pakan mampu meningkatkan kinerja pertumbuhan udang vaname yang diuji tantang dengan Vibrio harveyi. Akan tetapi, kombinasi antara bakteri Bacillus sp. NP5 dan prebiotik komersil berupa MOS belum diketahui potensinya apabila dikemas dalam bentuk mikrokapsul sinbiotik (MS), khususnya pada udang vaname yang diko-infeksi WSSV dan V. harveyi. Berdasarkan hal tersebut penelitian ini dilakukan untuk menentukan dosis terbaik pemberian mikrokapsul sinbiotik melalui pakan terhadap respons imun, kinerja pertumbuhan dan resistensi udang vaname yang diko-infeksi dengan WSSV danV. harveyi.
Perumusan Masalah
3
serta efeknya terhadap respons imun, kinerja pertumbuhan dan resistensi udang vaname yang diko-infeksi dengan WSSV danV. harveyi.
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan dosis optimum pemberian MS kombinasi Bacillus sp. NP5 RfR dan MOS melalui pakan yang menghasilkan respons imun, kinerja pertumbuhan, dan resistensi terbaik pada udang vaname yang diko-infeksi dengan WSSV danV. harveyi.
Manfaat Penelitian
Penelitian ini bermanfaat sebagai informasi dasar pengembangan teknologi MS untuk pencegahan penyakit yang disebabkan ko-infeksi WSSV danV. harveyi
pada budidaya udang vaname.
Hipotesis
Hipotesis dari penelitian ini adalah pemberian MS dengan dosis tertentu melalui pakan dapat meningkatkan respons imun, kinerja pertumbuhan dan resistensi pada udang vaname yang diko-infeksi WSSV danV. harveyi.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini mengkaji efek aplikasi MS Bacillus sp. NP5 RfR dan MOS yang diberikan melalui pakan selama 30 hari terhadap respons imun, kinerja pertumbuhan dan resistensi pada udang vaname yang diko-infeksi WSSV danV. harveyi.
2 METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Agustus 2014–Maret 2015 di Laboratorium Kesehatan Ikan, Laboratorium TerpaduSouth East Asian Food and Agriculture Science and Technology Institut Pertanian Bogor dan Laboratorium Kesehatan dan Lingkungan Balai Budidaya Air Payau, Situbondo, Jawa Timur.
Materi Uji
4
mannan oligosakarida (MOS) yang bersumber dari dinding sel S. cerevisiae
(mengandung 30% protein; 1.4% lemak dan 13% serat kasar). Isolat WSSV dan
V.harveyiyang digunakan diperoleh dari koleksi BPBAP Situbondo, Jawa Timur. Hewan uji yang digunakan adalah benur udang vaname specific pathogen free (SPF), dengan bobot 5.44±0.44 g ekor-1, yang diperoleh dari Unit Produksi Udang Gelung, Balai Budidaya Air Payau Situbondo, Jawa Timur. Benur tersebut telah diaklimatisasi selama 2 minggu dalam bak fiber ukuran 5×2×1 m3 dengan ketinggian air 60 cm.
Rancangan Penelitian
Penelitian ini menggunakan rancangan acak lengkap (RAL) terdiri dari tiga perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0.5% (MS0.5), 1.0%
Komposisi yang digunakan dalam pembuatan sinbiotik adalah probiotik
Bacillussp. NP5 RfRsebesar 1% (w/w) (Putraet al.2015), dengan kepadatan 109 -1010 CFU g-1 berat basah (Wang 2007) dan prebiotik MOS sebesar 0.4% (w/w) (Zhang et al. 2012). Produksi biomassa probiotik dilakukan dengan teknik subkultur pada media sea water complete (SWC) broth (bacto peptone 0.5%,
yeast extract 0.1%, glycerol 0.3%, air laut 75% dan akuades 25%) dengan inokulan 108 CFU ml-1 sebanyak 10% (v/v). Inkubasi bakteri dilakukan dalam
waterbath shaker selama 18 jam pada suhu 29 oC dengan kecepatan 200 rpm. Selanjutnya, pemanenan sel bakteri dilakukan dengan cara memindahkan hasil kultur bakteri ke dalam tabung corning 50 ml kemudian disentrifuse selama 15 menit dengan kecepatan 6000 rpm suhu 4 oC yang menghasilkan biomassa sel untuk dipanen. Hasil panen tersebut dicuci dengan larutan phosphat buffer saline
(PBS) (1,5 M NaCl; 15 mM KH2PO4; 100 mM Na2HPO4; 30 mM KCl, 1000 ml akuades) sebanyak 2 kali, hingga diperoleh pellet bakteri dengan kepadatan 108– 1010CFU g-1, lalu dihomogenkan dan disentrifusi selama 15 menit pada kecepatan Tabel 1 Rancangan Penelitian
Perlakuan
(P) Keterangan
MS0,5 Pemberian mikrokapsul sinbiotik dosis 0.5% secara oral melalui pakan komersil,
kemudian diko-infeksi WSSV danV. harveyi.
MS1,0 Pemberian mikrokapsul sinbiotik dosis 1.0% secara oral melalui pakan komersil,
kemudian diko-infeksi WSSV danV. harveyi.
MS2,0 Pemberian mikrokapsul sinbiotik dosis 2.0% secara oral melalui pakan komersil,
kemudian diko-infeksi WSSV danV. harveyi.
Kp Kontrol positif; pemberian pakan komersil, kemudian diko-infeksi WSSV dan V. harveyi.
5
6000 rpm. Setelah itu, ditambahkan larutan PBS sebanyak 50 ml dan dihomogenisasi. Hasil dari suspensi ini merupakan probiotik yang kemudian dicampurkan dengan prebiotik dan bahan penyalut.
Bahan penyalut yang digunakan berupadenatured whey protein (DWP) dan
maltodekstrin. Proses pembuatan DWP dilaksanakan menurut prosedur yang dilakukan oleh De Castro-Cislaghi et al. (2012), yaitu dengan cara penambahan pil rennet yang telah digerus sebanyak 0.05 g L-1 dan larutan CaCl2 40% (m/v) sebanyak 0.4 ml L-1 pada susu sapi pasteurisasi segar, lalu diaduk selama 10 menit. Setelah itu, susu diinkubasi dalam inkubator dengan suhu 37 oC selama satu jam dan menghasilkan campuran susu segar yang menggumpal. Selanjutnya, campuran tersebut disaring sehingga didapatkan protein whey, yaitu bagian larutan hasil penyaringan yang berwarna kuning. Protein whey tersebut dipanaskan pada suhu 90 C selama 30 menit untuk menghasilkan DWP, dan disimpan pada lemari pendingin bersuhu 4C sampai akan digunakan.
Sebelum proses mikroenkapsulasi dilakukan, prebiotik MOS dilarutkan dalam PBS steril sebanyak 0.4% (w/w) dari bobot basah probiotik, kemudian ditambahkan maltodekstrin sebanyak 10% (w/v). Campuran MOS dan
maltodekstrindipanaskan pada suhu 80oC selama 30 menit, lalu didinginkan pada suhu ruang (Freireet al.2012).
Mikroenkapsulasi Sinbiotik
Komposisi yang digunakan dalam pembuatan MS (probiotik dan MOS), protein whey dan maltodextrin adalah 1:1(v/v):10% (w/w) (Caliskan dan Dirim, 2013; Zubaidah 2014; Munaeni et al. 2014). Bahan-bahan tersebut kemudian dihomogenkan menggunakanstirer plate selama 30 menit.Selanjutnya dilakukan prosesspray drying (Rajam et al. 2012) menggunakan spray dryer (Mini bunchi 190). Proses mikroenkapsulasi dilakukan pada suhu 110–120 C pada inlet dan 55–58 C pada outlet. Sebelum digunakan, MS ini dapat disimpan dalam lemari pendingin bersuhu–20oC.
Preparasi Pakan Mengandung Mikrokapsul Sinbiotik
Pakan perlakuan yang mengandung MS dibuat dengan cara mencampur (coating) pakan komersil dengan MS. Masing-masing jumlah MS untuk membuat dosis sesuai perlakuan MS (0.5%, 1% dan 2%) dicampurkan dengan pakan komersil berupa pellet dan ditambahkan putih telur 2% (v/v) sebagai binder dan air sebagai pelarut sebanyak 6% (v/w), kemudian dikering-anginkan selama 5–10 menit, dan disimpan pada lemari pendingin sebelum digunakan.
Preparasi Filtrat VirusWhite Spot Syndrome Virusdan BakteriVibrio harveyi
Virus yang digunakan pada penelitian ini adalah white spot syndrome virus
6
difilter denganmilipore0.45 µm. Hasil filtrasi disimpan padafreezerdengan suhu -80oC hingga akan digunakan.
Bakteri yang digunakan pada penelitian ini adalah V. harveyi hasil koleksi Laboratorium Kesehatan dan Lingkungan, Balai Perikanan Budidaya Air Payau, Situbondo, Jawa Timur. Resistensi bakteri dilakukan dengan antibiotik rifampisin sebagai penanda, yang berfungsi sebagai pembeda antara bakteri inokulan dan bakteri yang sudah ada dalam media pemeliharaan maupun yang terdapat pada tubuh udang (Lampiran 1). Bakteri V. harveyi yang telah resisten (RfR) selanjutnya dikultur ulang dan dimurnikan serta ditentukan nilai total plate count
(TPC) untuk digunakan dalam uji tantang.
UjiIn Vivo
Uji in vivo dalam penelitian ini meliputi aplikasi mikrokapasul sinbiotik melalui pakan dan uji tantang pada udang vaname.
Aplikasi mikrokapsul sinbiotik
Aplikasi pemberian MS secara oral melalui pakan dilakukan dengan cara memelihara udang vaname selama 30 hari di dalam akuarium ukuran 60×35×30 cm3sebanyak 15 buah yang telah dilengkapiaeratordan telah dilakukan sterilisasi menggunakan detergen, dikeringkan, kemudian diisi air laut sebanyak 40 liter tiap akuarium, dan ditebari udang sebanyak 15 ekor/akuarium.
Perlakuan pemberian pakan mengandung MS pada perlakuan MS dan tanpa mengandung MS pada kontrol dilakukan 4 kali sehari, yaitu pada pukul 07.00, 11.00, 15.00, dan pukul 19.00 dengan feeding rate(FR) 6% dari biomassa udang vaname per hari. Penggantian air akuarium dilakukan secara kontinyu, dan akuarium dibersihkan dari kotoran sisa pakan dan feses setiap hari selama penelitian.
Uji tantang
Uji tantang dilakukan terhadap udang setelah pemeliharaan selama 30 hari, yaitu dengan cara injeksi konsentrat partikel virus (WSSV) pada udang perlakuan MS dan Kp sebanyak 100 µl ekor-1 udang (104 copy ml-1). Pada udang dengan kontrol negatif (Kn) dilakukan injeksi PBS dengan konsentrasi yang sama. Injeksi dilakukan pada bagian punggung udang, tepatnya di antara segmen ketiga dan keempat. Selanjutnya, dilakukan infeksi bakteri V. harveyi selang 24 jam pascainjeksi virus dengan cara perendaman atauimersi106CFU ml-1(Phuocet al.
2009) pada perlakuan MS dan Kp. Pengamatan gejala klinis dilakukan selama 3 hari pascainjeksi.
7
Parameter Pengamatan
Respons Imun
Total haemocyte count (THC)
Total haemocyte dihitung mengacu pada Liu and Chen (2004), dengan langkah-langkah sebagai berikut; hemolim diambil sebanyak 0.1 ml dari pangkal kaki renang menggunakan syringe 1 ml yang telah terisi 0.3 ml antikoagulan Na-Sitrat 3.8%, jika hemolim dan antikoagulan telah tercampur secara homogen, maka diambil tetesan kedua untuk diamati menggunakan haemocytometer dan dihitung dibawah mikroskop dengan perbesaran 400x.
Aktivitasphenoloksidase (PO)
Aktivitas phenoloxidase diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-dihidroxyphenylalanine (L-DOPA). Hemolim yang telah diencerkan selanjutnya disentrifus dengan kecepatan 700gpada suhu 4oC selama 20 menit, menghasilkan supernatan untuk dibuang danpelletdiambil untuk dicuci dan diperoleh pellet sebanyak 1 ml, kemudian disuspensikan ke dalam 200 ml
cacodylate-citrate buffer (0.01M sodium cacodylate; 0.45 M sodium chloride; 0.01 M trisodium citrate; pada pH 7.0) dan disentrifus kembali selama 20 menit. Dari suspensi tersebut, diambil sebanyak 100 µl untuk diinkubasi selama 10 menit pada suhu 25–26oC dalam 50 ml trypsin (T-0303, Sigma, 1 mg/ml) sebagai pengaktif, kemudian ditambahkan 50 ml L-DOPA selama 5 menit, dan ditambahkan cacodylate buffer (0,01 M sodium cacodylate; 0,45 M sodium chloride; 0,01 Mcalcium chloride; 0,26 Mmagnesium chloride; pH 7) sebanyak 800 ml selama 5 menit. Sebanyak 100 µl dari suspensi akhir ini diambil dan dimasukkan ke dalammicroplate, dan diukur dengan panjang gelombang 492 nm (Hsiehet al.2008).
Aktivitasrespiratory burst (RB)
Aktivitas respiratory burst hemosit dihitung berdasarkan reduksi Nitroblue Tetrazolium (NBT) menjadi formazan dalam kadar negatif superoxide. Prosedur aktivitas RB ini dilakukan berdasarkan Singhet al. (2013), yaitu sebanyak 50 μ l
haemolim segar dimasukkan ke dalammicroplatedan diinkubasi pada suhu 37oC selama 1 jam. Setelah 1 jam, darah dibuang dengan cara membalikkanmicroplate,
selanjutnya dilakukan tiga kali pembilasan menggunakan PBS. Selanjutnya, sebanyak 50 μ llarutan NBT ditambahkan ke tiap lubang microplatedan kembali diinkubasikan selama satu jam pada suhu 37 oC. Setelah proses inkubasi,
microplatedikeluarkan dan larutan NBT dibuang, kemudian dicuci dengan 50 μ l
8
Kelimpahan Bakteri di Usus
Penghitungan jumlah bakteri dalam usus udang meliputi perhitungan total viable bacterial count(TBC),presumptive Vibrio count(PVC), totalBacillusNP5 RfR count dan total V. harveyi RfR count. Sampel yang diambil dan ditimbang sampel usus dari udang vaname tiap perlakuan MS maupun kontrol, kemudian dihomogenkan dalam larutan phosphat buffer saline (PBS) 0.9 ml. Media yang digunakan pada penelitian ini adalah sea water complete (SWC) agar, SWC + RfR, media selektif Thiosulphate Citrate Bile-Salt Sucrose (TCBS) agar, dan TCBS + RfR. Kelimpahan bakteri dihitung menggunakan metode cawan sebar.
Kinerja Pertumbuhan
Kinerja pertumbuhan seperti laju pertumbuhan spesifik (LPS), rasio konversi pakan (RKP) dilakukan setelah pemberian pakan mengandung MS selama 30 hari.
Laju pertumbuhan spesifik
Laju pertumbuhan spesifik (LPS) dihitung dengan menggunakan rumus yang digunakan Akramiet al.(2012) dan Chotikachindaet al.(2012) :
LPS (%/hari) = Ln(Wt)–Ln(W0)×100 T
Keterangan :
LPS : laju pertumbuhan spesifik
Wt : bobot rata-rata udang pada akhir penelitian (gram) W0 : bobot rata-rata udang pada awal penelitian (gram)
t : periode pemeliharaan (hari). Rasio konversi pakan
Rasio konversi pakan (RKP), dihitung dengan menggunakan rumus dalam Akramiet al.(2012) :
Bt : Biomassa udang pada saat akhir perlakuan (gram) Bm : Biomassa udang yang mati saat perlakuan (gram) B0 : Biomassa udang pada saat awal perlakuan (gram).
Pengamatan Gejala Klinis
Pengamatan gejala klinis dilakukan secara visual atau observasi secara langsung selama masa uji tantang ko-infeksi WSSV dan V. harveyi. Pengamatan gejala klinis tersebut dilakukan untuk mengamati kondisi udang yang mengalami abnormalitas, akibat dari ko-infeksi WSSV danV. harveyi.
9
pada karapas atau permukaan tubuh udang. Sedangkan pengamatan gejala klinis terhadap infeksiV.harveyimeliputi kondisi umum warna tubuh, warna insang atau otot daging atau usus, tingkah laku atau gerakan udang.
Uji Konfirmasi terhadap ko-infeksi WSSV danV.harveyi
Konfirmasi infeksi WSSV pada udang vaname dilakukan dengan menggunakan metode polymerase chain reaction (PCR), berdasarkan metode yang telah digunakan pada penelitian sebelumnya (Nunan dan Lightner 2011). Konfirmasi bakteri V.harveyi dilakukan dengan menggunakan metode gores kuadran pada media spesifik TCBS+RfR.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup atau survival rate (SR) udang vaname dapat diketahui dari jumlah udang pada akhir perlakuan dibagi dengan jumlah udang awal, dengan rumus yang digunakan dalam Sanget al.(2009).
KH (%) = Nt ×100 N0 Keterangan :
KH : kelangsungan hidup
Nt : jumlah udang pada akhir perlakuan (ekor) N0 : jumlah udang pada awal perlakuan (ekor)
Parameter Kualitas Air
Parameter kualitas air yang diamati pada penelitian ini adalah suhu, pH, salinitas, oksigen terlarut, dan TAN (Total Amonia Nitrogen), nitrit dan nitrat. Pengukuran kualitas air dilakukan pada awal, tengah, dan akhir penelitian.
Analisis Data
Data ditabulasi menggunakan Microsoft Excel 2010, dan diuji dengan
analisis of varians (ANOVA). Jika berpengaruh nyata dilanjutkan dengan uji lanjut Duncan selang kepercayaan 95%, dengan menggunakan program SPSS versi 16.
3 HASIL DAN PEMBAHASAN
Respons Imun
Total Haemocyte Count(THC)
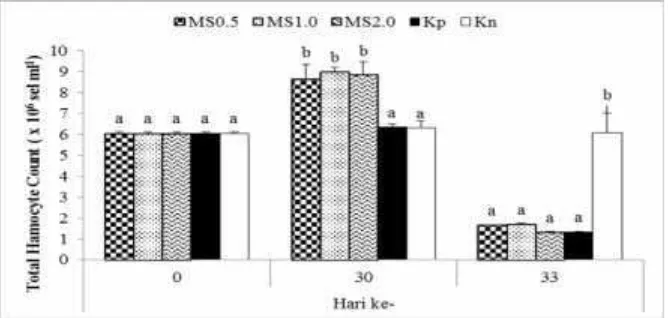
10
Gambar 1 Total hemocyte count (THC) udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan
Data hemosit di akhir pemeliharaan menunjukkan bahwa pemberian MS dosis 0.5%, 1% dan 2% menghasilkan peningkatan nilai THC (Gambar 2). Hal ini sejalan dengan yang dilaporkan oleh Partida-Arangureet al.(2012), bahwa seiring dengan penambahan sinbiotik pada pakan akan meningkatkan total hemosit pada udang vaname. Hemosit memiliki peranan penting sebagai respons imun krustase untuk memerangi serangan patogen (Rodriguez dan Le Muollac 2000; Chiu et al.
2007), dengan cara mengenal setiap partikel asing yang masuk ke dalam tubuh udang, kemudian meresponss melalui mekanisme antara lain; intracellular signaling cascade, fagositosis, enkapsulasi dan agregasi nodular (Rodriguez dan Le Muollac 2000). Selanjutnya, nilai THC setelah uji tantang mengindikasikan bekerjanya fungsi pertahanan udang, ditunjukkan dengan menurunnya nilai THC jika dibandingkan saat akhir pemeliharaan. Costa et al. (2009) dan Yeh et al. (2009) menyatakan bahwa jumlah hemosit yang semakin menurun merupakan efek dari pertahanan tubuh akibat infiltrasi dan akumulasi hemosit pada jaringan yang terinfeksi, dan kematian sel hemosit akibat dariapoptosis.
AktivitasPhenoloxidase(PO)
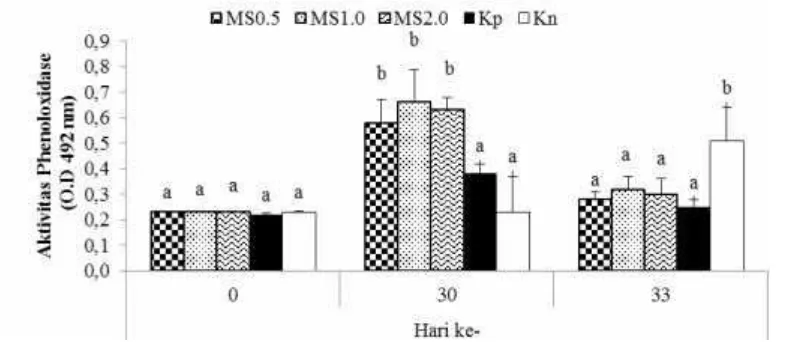
11
Gambar 2 Aktivitasphenoloxidase(PO) udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan
Nilai PO menandai adanya kemampuan udang vaname dalam mengenali benda asing yang masuk ke dalam tubuhnya (Garcia-Carreno et al. 2008) dan adanya aktivitas pertahanan tubuh udang (Costaetal. 2009). Berkaitan dengan hal tersebut, pemberian sinbiotik dosis 0.5%, 1% dan 2% dalam penelitian ini mampu meningkatkan kekebalan tubuh udang, hal ini sesuai dengan yang dilaporkan oleh Li et al. (2009) bahwa penggunaan sinbiotik pada pakan mampu menyeimbangkan mikroflora usus pada udang vaname dan dapat meningkatkan respons imun serta resistensi terhadap serangan penyakit. Namun secara kumulatif kemampuan tersebut menurun setelah dilakukan uji tantang. Peningkatan aktivitas PO juga ditemukan pada pemberian Lactobacillus plantarum (Chiu et al. 2007), sedangkan Cerenius et al. (2010) menemukan fenomena menurunnya kekebalan tubuh udang ditunjukkan oleh nilai aktivitas PO setelah uji tantang yang semakin menurun. Dalam hal ini, nilai aktivitas PO dan THC pada umumnya selalu bersinergi, di mana haemosit berfungsi untuk memproduksi dan melepaskan PO ke dalam hemolim dalam bentuk inactive pro-enzyme yang disebut proPO. Pada kondisi normal, peningkatan jumlah hemosit diiringi dengan peningkatan produksi proPO, atau sebaliknya (Smithet al. 2003)
AktivitasRespiratory Burst(RB)
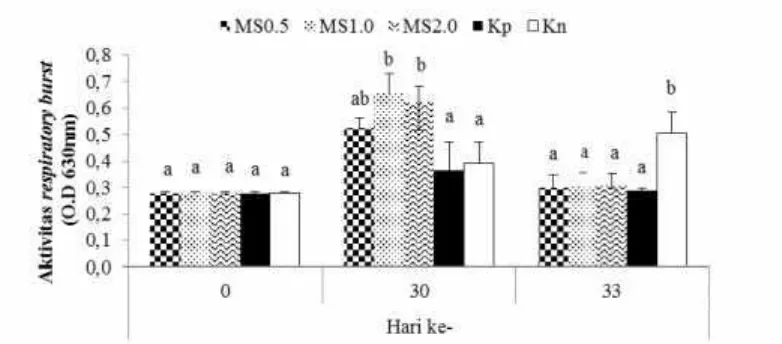
12
Gambar 3 Aktivitas respiratory burst (RB) udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan
Peningkatan nilai aktivitas RB di akhir pemeliharaan menunjukkan bahwa perlakuan penambahan sinbiotik dosis 1% dan 2% dapat meningkatkan sistem imun atau kekebalan tubuh udang vaname. Probiotik NP5 RfRdan prebiotik MOS yang dicampurkan dalam bentuk MS dapat memberikan pengaruh menguntungkan berupa respons imun udang vaname. Ringo et al. (2010) menyatakan bahwa prebiotik dapat meningkatkan aktivitas RB. Li et al. (2009), melaporkan bahwa suplementasi pakan dengan bakteri Bacillus OJ memberikan pengaruh yang signifikan terhadap respons imun pada udang vaname. Penurunan aktivitas RB setelah uji tantang diduga berkaitan dengan menurunnya nilai THC, seiring dengan bekerjanya fungsi pertahanan pada tubuh udang yang terinfeksi penyakit. Keseluruhan aktifitas RB ini terjadi pada sel hemosit yang melakukan aktivitas penghapusan partikel asing pada proses fagositosis (Rodriguez dan Le Muollac 2000).
Kelimpahan Bakteri di Usus
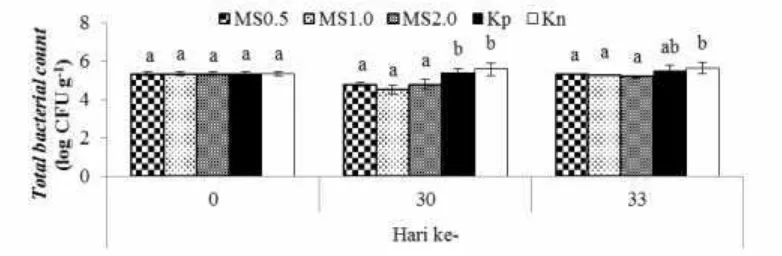
Hasil penghitungantotal viable bacterial count (TBC) pascapemberian MS selama 30 hari (Gambar 4) memperlihatkan bahwa TBC perlakuan MS secara nyata (p<0.05) lebih rendah dibandingkan dengan kontrol pada umur pemeliharaan 30 hari. TBC pada perlakuan MS1.0sebanyak4.49±0.22Log CFU g-1. Nilai TBC perlakuan MS0.5, sebanyak 4.77±0.10 Log CFU g-1 dan perlakuan MS2.0 sebanyak 4.78±0.27 Log CFU g-1. Untuk Kp dan Kn, TBC masing–masing sebanyak 5.49±0.21 Log CFU g-1 dan 5.63±0.33 Log CFU g-1. Selanjutnya, TBC perlakuan MS juga lebih rendah (p<0.05) terhadap Kn, namun sama dengan Kp setelah uji tantang.
13
yang merugikan. Ringo et al. (2010) menyatakan bahwa prebiotik oligosakarida dapat meningkatkan status kesehatan, dan keberadaan bakteri di usus dan menekan bakteri yang berpotensi merusak.
Gambar 4 Total viable bacterial count(TBC) dalam usus udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dengan dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Hurufsuperscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan.
Nilai presumptive vibrio count (PVC) (Gambar 5) cenderung mengalami penurunan di akhir pemeliharaan, kecuali pada perlakuan MS2.0 dan kontrol yang masih relatif sama dengan nilai PVC di saat awal pemeliharaan. Nilai PVC di akhir pemeliharaan pada perlakuan MS0.5 dan MS1.0 masing-masing sebanyak 4.87±0.21 Log CFU g-1dan 4.91±0.07 Log CFU g-1, lebih rendah daripada Kpdan Knmasing-masing sebanyak 5.38±0.12 Log CFU g-1dan 5.47±0.10 LOG CFU g-1, sedangkan perlakuan MS2.0 5.37±0.03 Log CFU g-1 adalah sama dengan kontrol. Setelah uji tantang, terjadi peningkatan nilai PVC pada perlakuan MS yang sama dengan kontrol (p>0.05).
Presumptive vibrio count atau PVC mengalami penurunan setelah diberi perlakuan sinbiotik kecuali pada perlakuan MS2.0, hal ini sesuai dengan yang dikemukakan oleh Cerezuela et al.(2010), bahwa probiotik mampu memberikan manfaat dengan menghasilkan molekul antibakteri berupa bakteriosin yang secara langsung dapat menghambat bakteri lain atau virus dan yang berpartisipasi aktif dalam memerangi infeksi. Hal ini sejalan dengan yang dilaporkan oleh Delgado
14
Gambar 5 Presumptive vibrio count (PVC) dalam usus udang vaname selama penelitian dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif (Kp) dan kontrol negatif (Kn). Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan
Hasil penghitungan Vibrio harveyi RfR count (Gambar 6) pascauji tantang menunjukkan bahwa jumlah Vibrio harveyi RfR pada perlakuan MS (3.95–4.01 log CFU g-1) adalah lebih rendah (p<0.05) daripada Kp (4.55±0.16 log CFU g-1), dan tidak ditemukan Vibrio harveyi RfR pada Kn. Populasi sel bakteri V.harveyi RfR pada perlakuan MS0.5, yaitu sebanyak 3.95±0.37 Log CFU g-1, perlakuan MS2.0 sebanyak 3.97±0.13 Log CFU g-1dan perlakuan MS1.0 sebanyak 4.01±0.32 Log CFU g-1. Pada Kp sebanyak 4.55 ± 0.16 Log CFU g-1.
Kelimpahan PVC dan V. harveyi RfR setelah uji tantang mengalami peningkatan. Menurut Chiu et al. (2007) penambahan bakteri probiotik setelah periode tertentu pada udang dapat meningkatkan jumlah populasi sel bakteri pada Gambar 6 Populasi sel bakteriV. harveyiRfR dalam usus udang vaname setelah uji
15
saluran pencernaan. Selain itu lingkungan tempat hidup udang atau ikan dapat mempengaruhi kelimpahan jumlah sel bakteri dalam saluran pencernaan (Austin 2006). Oleh sebab itu, kelimpahan populasi sel bakteri dalam usus udang pada penelitian ini diduga ikut dipengaruhi oleh kompleksitas jenis dan kemampuan metabolit berbagai spesies bakteri dari lingkungan, terutama setelah uji tantang, apalagi proses uji tantang bakteri V.harveyi RfR dilakukan melalui proses perendaman.
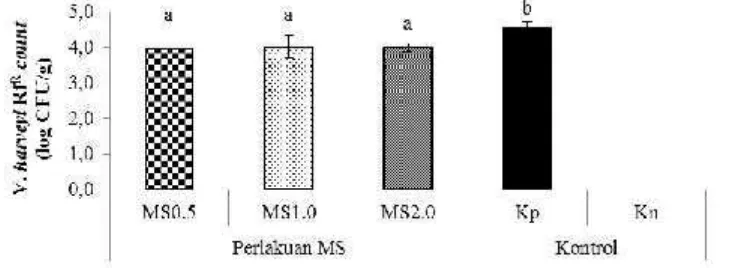
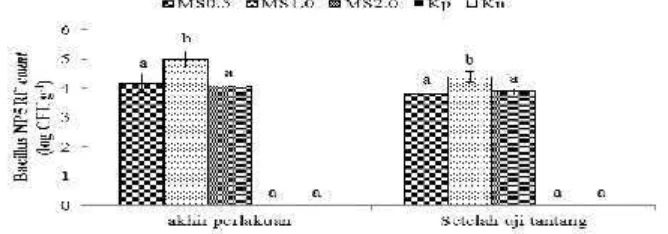
Hasil penghitungan Bacillus sp. NP5 RfR dilakukan setelah pemberian mikrokapsul sinbiotik dan setelah uji tantang (Gambar 7). Hasil menunjukkan bahwa pada akhir perlakuan, pada MS1.0 berbeda nyata (p<0.05) terhadap perlakuan MS0.5 dan MS2.0. Populasi sel bakteriBacillus sp. NP5 RfRpada akhir perlakuan tertinggi pada perlakuan MS1.0, yaitu sebanyak 5±0.04 Log CFU g-1. Perlakuan MS0.5 dan MS2.0, dengan populasi sel bakteri Bacillus sp. NP5 RfR masing – masing sebesar 4.17 ± 0.31 Log CFU g dan 4.08 ± 0.28 Log CFU g-1. Setelah uji tantang, perlakuan MS1.0 menunjukkan hasil yang berbeda (p<0.05) terhadap perlakuan MS0.5dan MS2.0. Perlakuan MS1.0dengan populasi sel bakteri
Bacillussp. NP5 RfR tertinggi, yaitu sebesar 4.39±0.19 Log CFU g-1. Sedangkan perlakuan MS0.5 dan MS2.0 dengan masing–masing populasi sel bakteri Bacillus sp. NP5 RfRsebesar 3.83±0.19 Log CFU g-1dan 3.88±0.15 Log CFU g-1.
Gambar 7 Bacillus NP5 RfR count pada usus udang vaname pada saat akhir perlakuan dan setelah uji tantang dengan perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan. Huruf superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan
Populasi sel bakteri Bacillus sp. NP5 RfRpada perlakuan MS1.0 yang lebih tinggi daripada perlakuan lainnya ini menunjukkan bahwa Bacillus sp. NP5 RfR dapat bertahan hidup di dalam usus dan mencapai organ target. Selain itu, tingginya populasi bakteri Bacillus sp. NP5 RfR pada perlakuan MS1.0 menunjukkan bahwa populasi bakteri tersebut mampu menekan populasi sel bakteri lainnya, yang bersifat merusak. Probiotik memberikan efek yang baik pada udang vaname, karena dapat menghambat pergerakan sel bakteri lain di dinding usus (translokasi), meningkatkan fungsi penghalang mukosa sehingga meningkatkan responss imun non spesifik atau memodulasi inflamasi (Cerezuela
16
Komposisi populasi sel mikroba di saluran pencernaan udang vaname dipengaruhi oleh adanya aplikasi sinbiotik. Li et al. (2009), melaporkan bahwa total sel bakteri pada saluran pencernaan udang vaname mengalami penurunan dengan semakin tinggi dosis probiotik dan prebiotik yang diberikan. Selanjutnya, Danielset al. (2010), melaporkan hasil penelitiannya bahwa penggunaan probiotik dan prebiotik akan bekerja secara sinergis, dimana bakteri probiotik yang digunakan adalah Bacillus sp. dan mannan oligosakarida (MOS) dapat meningkatkan pertumbuhan dan mikroba yang ada dalam saluran pencernaan.
Kinerja Pertumbuhan
Laju Pertumbuhan Spesifik (LPS)
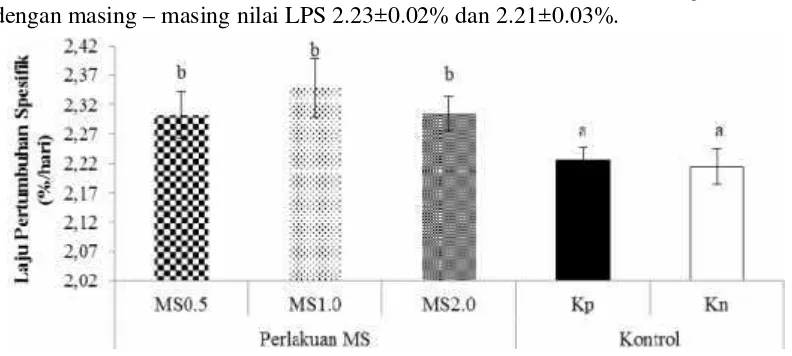
Data laju pertumbuhan spesifik (LPS) hasil penelitian (Gambar 8) menunjukkan bahwa perlakuan MS memiliki LPS lebih tinggi (p<0.05) daripada kontrol. LPS pada perlakuan MS1.0 yaitu 2.35±0.05%, selanjutnya perlakuan MS2.0 yaitu 2.3 ±0.03%, perlakuan MS0.5 yaitu 2.30±0.04%. Untuk Kp dan Kn dengan masing–masing nilai LPS 2.23±0.02% dan 2.21±0.03%.
Gambar 8 Laju pertumbuhan spesifik (LPS) pada saat akhir perlakuan sinbiotik dari udang vaname dengan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan. Huruf
superscript berbeda pada periode pengamatan yang sama menunjukkan perbedaan yang signifikan (p<0.05) antar perlakuan Tingginya LPS pada perlakuan MS diduga karena adanya penambahan MS pada pakan. Hal ini menunjukkan bahwa bakteri BacillusNP5 RfRdan prebiotik mannan oligosakarida di dalam usus udang dapat meningkatkan pertumbuhan. Hal tersebut sesuai dengan penelitian Daniels et al. (2010) yang menggunakan sinbiotik dengan bakteri probiotik Bacillus spp dan prebiotik mannan oligosakarida dapat meningkatkan pertumbuhan, konversi pakan, respons imun dan resistensi penyakit terhadap lobster Homarus gammarusL. Menurut Zhanget al. (2012), bahwa penambahan MOS sebesar 0,4% dapat meningkatkan
performance pertumbuhan seperti weight growth (WG) dan specific growth rate
17
Penambahan sinbiotik pada pakan akan memacu pertumbuhan dari udang vaname. Kelimpahan bakteri Bacillus NP5 RfR pada usus yang cenderung lebih tinggi terdapat pada perlakuan MS1.0. Hal ini menunjukkan korelasi positif antara jumlah bakteri Bacillus NP5 RfR dengan laju pertumbuhan spesifik. Penelitian Zubaidah (2014) dan Nurhayati et al. (2015), dimana semakin meningkatnya bakteri Bacillus NP5 RfR dan SKT-b maka laju pertumbuhan spesifik juga semakin meningkat.
Rasio Konversi Pakan (RKP)
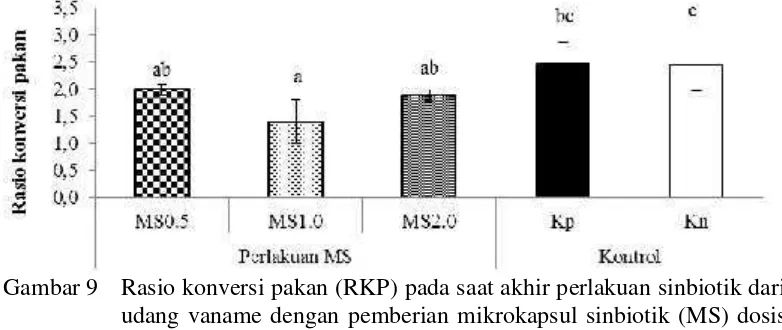
Data RKP hasil penelitian (Gambar 9) menunjukkan bahwa hanya perlakuan MS1.0 yang memiliki RKP lebih rendah yaitu 1.4±0.4% dibandingkan Kp yaitu 2.46±0.4% dan Kn2.47±0.5%, sedangkan perlakuan MS0.5dan MS2.0dengan RKP masing-masing 1.88±0.1% dan 1.99±0.1% hanya berbeda dengan Kn yaitu 2.46±0.5%.
Rendahnya nilai RKP perlakuan MS1.0 menunjukkan efisiensi pakan yang lebih rendah jika dibandingkan dengan kontrol dan mengindikasikan bahwa prebiotik MOS mampu mendukung aktivitas probiotik Bacillus NP5 dalam merombak pakan yang diberikan pada udang vaname, sehingga pakan lebih mudah dicerna dan termanfaatkan oleh udang yang ditunjukkan oleh rendahnya konversi pakan (Ringo et al. 2010; Daniels et al. 2010). Selain itu, Putra dan Widanarni (2015) menyebutkan bahwa suplementasi probiotik Bacillus sp. NP5 RfR mampu meningkatkan aktivitas enzim amilase, kecernaan karbohidrat dan performa pertumbuhan pada tilapia.
Gambar 9 Rasio konversi pakan (RKP) pada saat akhir perlakuan sinbiotik dari udang vaname dengan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan. Huruf
18
Gejala Klinis
Hasil pengamatan gejala klinis (Gambar 10) pada udang setelah uji tantang memperlihatkan warna merah hingga coklat pada seluruh tubuh, dengan tekstur daging terasa lunak. Gejala klinis untuk infeksi WSSV adalah : nafsu makan menurun, usus kosong, tubuh berwarna merah, lunak, terdapat bintik putih pada bagian kulit. Sementara itu, gejala klinis untuk infeksi V.harveyi adalah : kulit badan rusak, bagian ekor dan kaki renang berwarna merah, insang berwarna coklat, otot dan dagingnya berwarna gelap dan ususnya kosong, gerakan lemah dan menyentak-nyentak (Jiravanichpaisal et al. 1994 ).
Menurut Soetrisno (2004), infeksi ringan untuk WSSV menunjukkan gejala nafsu makan dari udang akan menurun terlihat dari usus yang kosong, infeksi ringan ini akan diikuti pola kematian yang terus meningkat. Pada infeksi selanjutnya udang banyak berwarna merah dan bertubuh lunak walaupun beberapa masih ada yang tubuhnya masih keras. Infeksi berat, udang akan terlihat banyak terjadi bintik putih pada bagian dalam kulit dengan permukaan kulit yang tetap halus. Selain itu, terlihat adanya infeksi sekunder oleh Vibrio harveyi, ditandai dengan adanya kerusakan jaringan dan nekrosis di seluruh tubuh sampai bagian ekor.
Wuet al. (2005) melaporkan bahwa injeksi WSSV sebanyak 104 copy ml-1 pada udang windu dapat meningkatkan kematian, dua hari sejak masa injeksi WSSV. Selain itu, kerusakan jaringan tubuh seperti hepatopancreas, insang, otot pada udang windu, udang vaname,blue carbsdankuruma shrimpjuga mengalami kerusakan (Oidtmann and Stentiford). Hal ini mengindikasikan bahwa injeksi konsentrat WSSV sebanyak 104copy ml-1 dapat mengakibatkan infeksi berat pada udang vaname.
Pengamatan gejala klinis menunjukkan bahwa setelah uji tantang udang yang diko-infeksi WSSV dan V.harveyi adalah gejala penyakit WSD. Virus ini dapat menginfeksi sel mesodermal dan pangkal ektodermal, seperti subkutikula epithelium, organ limfoid, hemosit, jaringan haematopoietic, stomach cuticular epidermis dan jaringan penghubung pada udang (Sanchez-Martinez 2007). Gejala-gejala tersebut diikuti oleh kerusakan jaringan olehVibrio harveyi.Hal ini mengindikasikan bahwa bakteri Vibrio harveyi bersifat oportunistik. Menurut Selvin dan Lipton (2003), udang yang melemah akibat infeksi WSSV mudah mengalami infeksi sekunder olehVibriosp.
19
Konfirmasi WSSV danVibrio harveyi
Hasil pengujian PCR pada sampel dari masing-masing perlakuan MS dan Kp(Gambar 11) memperlihatkan nilai positif terhadap infeksi WSSV, ditunjukkan dengan pita DNA yang teramplifikasi pada panjang 942 bp. Selanjutnya, konfirmasi terhadap penghitungan populasi bakteri V. harveyi RfR juga menunjukkan terdapat V. harveyi RfR pada perlakuan MS dan Kp. Jika dikomparasikan terhadap data kelangsungan hidup, maka penelitian ini mengungkap bahwa ko-infeksi WSSV danV. harveyiRfRmenyebabkan tingginya mortalitas pada udang vaname perlakuan MS maupun Kp.
Tingkat Kelangsungan Hidup
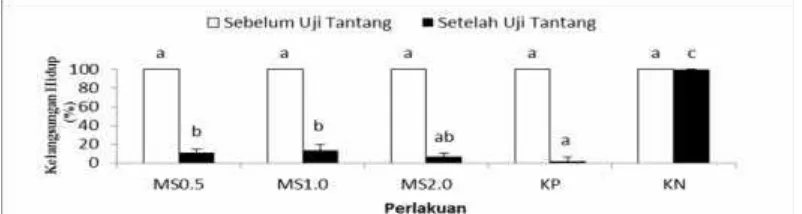
Data kelangsungan hidup perlakuan MS dan kontrol pada akhir perlakuan adalah 100%, kemudian menunjukkan perbedaan yang nyata (p<0.05) setelah dilakukan uji tantang. Kelangsungan hidup udang vaname pada MS1.0 sebanyak 13.33±6.67% dan perlakuan MS0.5 sebanyak 11.11±3.85% lebih tinggi (p<0.05) dibandingkan dengan Kp 2.22±3.85%, namun kelangsungan hidup perlakuan MS secara kumulatif lebih rendah (p<0.005) dibandingkan dengan Kn (100%) (Gambar 12)
Gambar 12 Kelangsungan hidup udang vaname sebelum dan setelah diko-infeksi WSSV danV. harveyipada perlakuan pemberian mikrokapsul sinbiotik (MS) dosis 0,5% (MS0.5), 1% (MS1.0), dan 2% (MS2.0) melalui pakan, kontrol positif
(Kp) dan kontrol negatif (Kn). Huruf superscript berbeda menunjukkan
perbedaan yang signifikan (p<0.05) antar perlakuan
Gambar 11 Hasil uji PCR udang vaname terhadap infeksi WSSV. band 1: penanda negatif; band2: kontrol negatif (Kn); band3: kontrol positif (Kp) terdeteksi WSSV;band4 (sampel MS0.5),band5 (sampel MS1.0),
20
Ko-infeksi berat WSSV dan V.harveyi mengakibatkan mortalitas udang vaname sebesar 97.78%, dan pemberian mikrokapsul sinbiotik sebesar 0.5% dan 1% secara signifikan mampu menurunkan mortalitas udang vaname sebesar 8.89–
11.11%. Udang vaname yang diuji tantang dengan WSSV melalui injeksi dan V. harveyimelalui perendaman, menunjukkan tingkat kelangsungan hidup cenderung semakin menurun. Menurut Phuoc et al. (2009), udang vaname yang terpapar virus WSSV secara tunggal, maupun ko-infeksi WSSV dan V. campbelli 104 CFU/udang, WSSV dan bakteriV. harveyiBB120 106CFU/udang selama 84–360 jam akan menyebabkan kematian 80–100% pada 84–156 pasca infeksi. Febrianti
et al.(2016) melaporkan bahwa infeksi WSSV secara tunggal pada udang vaname menyebabkan kematian hingga 64.44% atau hanya berhasil mempertahankan tingkat kelangsungan hidup 35.55% pada kontrol positif.
Penelitian ini menunjukkan bahwa pemberian MS dosis 0,5% (MS0.5) dan 1% (MS1.0) melalui pakan komersil yang selanjutnya diko-infeksi dengan WSSV danV. harveyisecara signifikan (p<0.05) menghasilkan kelangsungan hidup lebih tinggi (11.11% dan 13.33%) dibandingkan dengan perlakuan MS lainnya maupun kontrol. Selanjutnya, Li et al. (2009) menyatakan bahwa sinbiotik kombinasi dari prebiotik dan bakteriBacillusOJ (PB) dalam pakan memberikan efek yang positif pada sistem kekebalan udang terhadap infeksi WSSV.
Parameter Kualitas Air
Dari hasil pengukuran kualitas air selama penelitian menunjukkan bahwa kondisi kualitas air masih dalam kondisi yang normal berdasarkan SNI tahun 2006, kecuali TAN. Adapun hasil monitoring kualitas air selama penelitian adalah suhu 29±0 oC; oksigen terlarut 6.296±0.630 mg L-1; TAN: 1.196±0.906 mg L-1; salinitas 33±0 ppt; pH 7.955±0.239; nitrit 0.129±0.136 mg L-1; nitrat 7.866±2.107 mg L-1.
Tingginya TAN disebabkan oleh adanya penguraian bahan organik yang mengandung protein dan asam amino secara anaerobik. Bahan organik yang tinggi ini, berasal dari sisa-sisa pakan dan ekskresi udang vaname itu sendiri. Munaeniet al.
(2014) melaporkan bahwa dari hasil penelitiannya kandungan TAN yang diperoleh adalah sebesar 0.61-1.75. Meskipun TAN yang diperoleh cukup tinggi pada media pemeliharaan, hal ini tidak mengakibatkan kematian pada udang vaname. Selain itu, pertumbuhannya cukup baik, dapat dilihat pada kinerja pertumbuhan dari udang vaname (2.64%-3.05%).
SIMPULAN DAN SARAN
Simpulan
21
sinbiotik ini belum mampu meningkatkan resistensi udang terhadap ko-infeksi berat WSSV danV.harveyi.
Saran
Perlu dilakukan penelitian lanjutan tentang aplikasi mikrokapsul sinbiotik dengan menurunkan dosis ko-infeksi WSSV dan Vibrio harveyi berdasarkan LD50.
DAFTAR PUSTAKA
Akrami R, Razeghi-Mansour M, Chitsaz H, Ziaee R and Ahmadi R. 2012. Effect of dietary mannan-oligosaccharide (MOS) on growth performance, survival, body composition and some hematological parameters of carp juvenile Cyprinus carpio. Journal of Animal Science Advances. 2: 879-885.
Anal AK and Singh H. 2007. Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery. Trends in Food Science and Technology. 18: 240-251.
Austin B. 2006. The bacterial microflora of fish. Science World Journal. 6: 931-945.
Caliskan G and Dirim SN. 2013. The effects of different drying conditions and the amounts of maltodextrin addition during spray drying of sumac extract.
Food and Bioproducts Processing.411: 1-10.
Cerenius L, Jiravanichpaisal P, Hai-peng L and Söderhälz I. 2010. Crustacean
immunity in invertebrate immunity.Bioscience. 13: 239-259.
Cerezuela R, Meseguer J and Esteban MA. 2011. Current knowledge in synbiotic use for fish aquaculture: a review. Journal Aquaculture Research Development. 8: 1-7.
Chiu CH, Guu YK, Liu CH, Pan TM and Cheng W. 2007. Immune responsses and gene expression in white shrimp, Litopenaeus vannamei, induced by
Lactobacillus plantarum.Fish and Shellfish Immunology. 23: 364-377. Chotikachinda R, Lapjatupon W, Chaisilapasung S, Sangsue D and Tantikitti C.
2008. Effect of inactive yeast cell wall on growth performance, survival rate and immune parameters in pacific white shrimp Litopenaeus vannamei. Songklanakarin Journal of Science and Technology. 30: 687-692.
Costa AM, Buglione CC, Bezerra FL, Martins PCC and Barracco MA. 2009. Immune assessement of farm-reared Penaeus vannamei shrimp naturally infected by IMNV in NE Brazil.Aquaculture. 291: 141-146.
Daniels CL, Merrifield DL, Boothoryd DP, Davies SJ, Factor JR and Arnold KE. 2010. Effect of dietary Bacillus spp and mannan oligosaccharides (MOS) on European lobster Homarus gammarus L larvae growth performance, gut morphology and gut microbiota.Aquaculture. 304: 49-57.
22
with whey: Survival under simulated gastrointestinal conditions, tolerance to NaCl, and viability during storage. Journal of Food Engineering. 113: 186-193.
Delgado GTC, Tamashiro WMSC, Junior MRM and Pastore GM. 2010. Immunomodulatory effects of fructans. Food Research International. 43: 1231-1236.
Febrianti D, Yuhana M and Widanarni. 2016. Dietary Synbiotic Microcapsule influence immune responses, growth performance and microbial populations to white spot syndrome virus in white shrimp (Litopenaeus vannamei).Journal of Fisheries and Aquatic Science.11: 28-42.
Freire CBF, Prudencio ES, Amboni RDMC, Pinto SS, Murakami ANN and Murakami FS. 2012. Microencapsulation ofBifidobacteriaby spray drying in the presence of prebiotics.Food Research International. 45: 306–312. Garcia-Carreno FL, Cota K and Navarrete del Toro MA. 2008. Phenoloxidase
activity of hemocyanin in whiteleg shrimpPenaeus vannamei: conversion, characterization of catalytic properties, and role in postmortem melanosis.
Journal of Agricultural and Food Chemistry. 56: 6454-6459.
Geraylou Z, Souffreau C, Rurangwa E, Meester LD, Courtin CM, Delcour JA, Buyse J and Ollevier F. 2013. Effects of dietary arabinoxylan-oligosaccharides (AXOS) and endogenous probiotics on the growth performance, non-specific immunity and gut microbiota of juvenile Siberian sturgeon Acipenser baerii. Fish and Shellfish Immunology. 35: 766-775.
Gullian M, Thompson F and Rodriguez J. 2004. Selection of probiotic bacteria and study of their immunostimulatory effect in Penaeus vannamei.
Aquaculture. 233: 1-14.
Hsieh SL, Ruan YH, Li YC, Hsieh PS, Hu CH, Kuo CM. 2008. Immune and physiological responsses in Pacific white shrimp Penaeus vannamei to
Vibrio alginolyticus.Aquaculture.275: 335–341.
Jiravanichpaisal P and Miyazaki T. 1994. Histopathology, biochemistry and pathogenicity of Vibrio harveyi infecting black tiger prawn Penaeus monodon. Journal Aquaculture Animal Health.6: 27-35.
Li J, Tan B, and Mai K. 2009. Dietary probiotic bacillus OJ and somaltooligosaccharides influence the intestine microbial populations, immune responsses and resistance to white spot syndrome virus in shrimp
Litopenaeus vannamei.Aquaculture. 291: 35-40.
Liu CH and Chen CJ. 2004.Effect of ammonia on the immune responsse of white shrimpLitopenaeus vannameiand its susceptibility toVibrio alginolyticus.
Fish and Shellfish Immunology. 16: 321-334.
Mahious AS, Getesoupe FJ, Hervi M, Metailler R and Ollevier. 2006. Effect of dietary inulin and oligosaccharides as prebiotics for weaning turbot,Psetta maxima(Linnaeu, C. 1758).Aquaculture International. 14: 219-229. Munaeni W, Yuhana M and Widanarni. 2014. Effect of micro-encapsulated
synbiotic at different frequencies for luminous vibriosis control in white shrimpLitopenaeus vanamei. Microbiology Indonesia. 8: 73-80.
23
Nurhayati D, Widanarni and Yuhana M. 2015. Dietary synbiotic influence on the growth performances and immune responsses to co-infection with Infectious Myonecrosis Virus and Vibrio harveyi in Litopenaeus vannamei. Journal of Fisheries and Aquatic Sciences. 10: 13-23.
Oidtmann B and Stentiford GD. 2011. White spot syndrome virus (WSSV) concentration cructacean tissues: A review of data relevant to asses the risk associated with commodity trade. Transboundary and Emerging Diseases.
Partida-Arangure BO, Luna-González A, Fierro-Coronado JA, Flores-Miranda MC and González-Ocampo HA. 2012. Effect of inulin and probiotic bacteria on growth, survival, immune responsse, and prevalence of white spot syndrome
virus (WSSV) inLitopenaeus vannameicultured under laboratory conditions.
African Journal of Biotechnology. 12: 3366-3375.
Phuoc LH, Corteel M, Thanh NC, Nauwynck H, Pensaert M, Alday-Sanz V, den Broeck WY, Sorgeloos P and Bossier P. 2009. Effect of dose and challenge routes of vibrio spp. on co-infection with white spot syndrome virus inPenaeus vannamei.Aquaculture. 290: 61-68
Putra AN and Widanarni. 2015. Screening of amylolitic bacteria as candidate of probiotics in tilapia Oreochromis sp. Research Journal of Microbiology. 10: 1-13.
Putra AN, Utomo NBP and Widanarni. 2015. Growth performance of tilapia
Oreochromis sp fed with probiotic, prebiotic and synbiotic in diet.
Pakistan Journal of Nutrition. 14: 263-268.
Rajam R, Karthik P, Parthasarathi S, Joseph GS and Anandharamakhrisnan C. 2012. Effect of whey protein-alginate wall sistems on survival of microencapsulated Lactobacillus plantarum in simulated gastrointestinal conditions.Journal of Functional Foods. 4: 891-898.
Ringo E, Olsen RE, Gifstad TO, Dalmo RA, Amlund H and Hemre GI. 2010. Prebiotics in aquaculture: A review.Aquaculture Nutrition. 16: 117-136. Rodriguez L and Le Moullac G. 2000. State of the art immunological tools and
health control of penaeid shrimp.Aquaculture. 191: 109-119.
Sanchez-Martinez JG, Guzman GA and HM. Ruiz. 2007. White spot syndrome in cultured shrimp : A review.Aquaculture Research. 38: 1339-1354.
Sang FM, Fotedar R and Filer K. 2011. Effect of dietary mannan-oligosaccharidae on the survival, growth, immunity and digestive enzyme activity of freshwater crayfish, Cherax destructor Clark (1936). Aquaculture Nutrition. 17: 629-635.
Schrezenmeir J and Vrese M. 2001. Probiotics, prebiotics, and synbiotics-approaching a definition. The American Journal of Clinical Nutrition. 73: 361-364.
Selvin J and Lipton AP. 2003. Vibrio alginolyticus associated with white spot disease ofPenaeus monodon.Disease of Aquatic Organisms. 57: 147-150. Singh SK, Tiwari VK, Chadha NK, Prakash C, Sukham M, Das P, Mandal SC and
24
Smith VJ, Brown JH and Hauton C. 2003. Immunostimulation in crustacean: does it really against infection.Fish and Shellfish Immunology. 15: 71-90. Soetrisno CK. 2004. Mensiasati Penyakit WSSV di Tambak. Aquaculture
Indonesia.5: 19-31.
Teixeira-Lopes MA, Vieira-Girao PRN, Freire JEC, Rocha IRCB, Costa FHF and Radis-Baptista G. 2011. Natural co-infectious hypodermal and hematopietic necrosis virus (IHHNV) and infectious mynecrosis virus (IMNV) inLitopenaeus vannameiin Brazil.Aquaculture. 312: 212-216. Triana E, Eko Y dan Novik N. 2006. Uji viabilitas Lactobacillus sp
terenkapsulasi.Biodiversitas. 7: 114-117.
Wang YB. 2007. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture. 269: 259-264.
Weinbreck F, Bodnar I and Marco ML. 2010. Can encapsulation lengthen the shelf-life of probiotic bacteria in dry products. International Journal Food Microbiology. 136: 364-367
Widodo, Soeparno dan Wahyuni E. 2003. bioenkapsulasi probiotik Lactobacillus casei dengan pollard dan tepung terigu serta pengaruhnya terhadap viabilitas dan laju pengasaman.Jurnal Teknologi dan Industri Pangan. 14: 98-106.
Wu W, Wang L and Zhang X. 2005. Identification of white spot syndrome virus (WSSV) envelope proteins involved in shrimp infection. Virology. 332: 578-583.
Xie X, Li H, Xu L and Yang F. 2005. A simple and efficient method for purification of intact white spot syndrome virus (WSSV) viral particles.
Virus Research. 108: 63-67.
Yeh SP, Chen YN, Hsieh SL, Cheng W and Chun-Hun L. 2009. Immune responsse of white shrimp, Littopenaeus vanameii, after a concurrent infection with white spot syndrome virus and infectious hypodermal and hematopoietic necrosis virus.Fish and Shellfish Immunology. 26: 582-588. Yuliani S, Desmawarni, Harimurti H dan Yuliani SS. 2007. Pengaruh laju alir umpan dan suhu inlet spray drying pada karakteristik mikrokapsul oleoresin jahe.Jurnal Pasca Panen. 4: 18-26.
Zhang J, Yongjian LA, Lixia T, Huijun Y, Guiying L and Donghui X. 2012. Effects of dietary mannan oligosaccharide on growth performance, gut morphology and stress tolerance of juvenile Pacific white shrimp,
Litopenaeus vannamei.Fish and Shellfish Immunology. 33: 1027-1032. Zubaidah A. 2014. Pemberian mikrokapsul sinbiotik dengan dosis berbeda
melalui pakan untuk pencegahan vibriosis pada udang vaname
25
LAMPIRAN
Lampiran 1 Pembuatan mutan rifampisin resisten pada isolat bakteri
V.harveyi
Tahapan pembuatan bakteri menjadi resisten terhadap rifampisin (RfR)
1. Sebanyak 1 ml biakan cair bakteriV.harveyidisentrifuse pada kecepatan 3000 rpm selama 5 menit.
2. Supernatan dibuang, pelet ditambahkan larutan fisiologis sebanyak supernatan yang dibuang (1 ml) lalu divorteks.
3. Suspensi bakteri ini disentrifuse kembali pada kecepatan 3000 rpm selama 5 menit lalu supernatannya dibuang dan ditambahkan kembali larutan fisiologis sebanyak 1 ml.
4. Sebanyak 100 μ l suspensi bakteri uji lalu disebar secara merata pada
permukaan Media Thiosulfate Citrate Bile Salt Agar (TCBS) yang telah
mengandung antibiotik rifampisin (50μ g/ml).
5. Sebagai kontrol, sebanyak 100 μ l suspensibakteri uji hasil pengenceran serial 10-5, 10-6, dan 10-7 disebar secara merata pada permukaan media agar yang tidak mengandung antibiotik.
6. Kultur diinkubasikan pada inkubator bersuhu ruang selama 24-48 jam.
7. Koloni bakteri yang tumbuh merupakan koloni bakteri yang telah resisten terhadap antibiotik rifampisin.