MANIPULASI SPEKTRUM CAHAYA TERHADAP
PERTUMBUHAN DAN KUALITAS WARNA
IKAN BOTIA
Chromobotia macracanthus
Bleeker
ANNISA KHAIRANI ARAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Manipulasi Spektrum Cahaya terhadap Pertumbuhan dan Kualitas Warna Ikan Botia Chromobotia macracanthus Bleeker adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2015
Pertumbuhan dan Kualitas Warna Ikan Botia Chromobotia macracanthus Bleeker. Dibimbing oleh KUKUH NIRMALA, DINAR TRI SOELISTYOWATI dan SUDARTO.
Ikan botia Chromobotia macracanthus Bleeker merupakan ikan hias air tawar endemik yang berasal dari pulau Sumatera dan Kalimatan dan bernilai ekonomis penting. Ikan botia menjadi komoditas favorit ekspor. Ikan botia mengalami ancaman berupa tingginya overfishing, terancam punah dan laju pertumbuhan yang lambat. Upaya peningkatkan kualitas dan kuantitas budidaya ikan tersebut dapat dilakukan dengan manipulasi lingkungan berupa penggunaan spektrum cahaya LED (Light - Emmiting Diode).
Penelitian ini bertujuan untuk mengevaluasi spektrum cahaya LED di media pemeliharaan terhadap respon fisiologis, pertumbuhan dan kualitas warna benih ikan botia. Penelitian ini menggunakan RAL (Rancangan Acak Lengkap) yang terdiri atas 5 perlakuan dengan 3 ulangan yaitu kontrol negatif (cahaya ruang lampu tube), kontrol positif (LED putih), LED merah, LED hijau dan LED biru. Benih ikan botia yang digunakan memiliki rata-rata panjang total (PT) 3.88±0.19 cm, panjang standar (PS) 3.38±0.19 cm dengan bobot 0.61±0.11 gram.
Hasil penelitian menunjukkan bahwa performa respon fisiologis, dan kualitas warna benih ikan botia yang terbaik pada perlakuan LED merah dengan kisaran konsentrasi kortisol sebesar 13.70-30.20 ng ml-1, kualitas warna dengan Toca color finder (TFC) dengan rata-rata rangking skoring pada warna perut sebesar 35.90, sirip dada sebesar 42.20 dan sirip ekor sebesar 38.30, keragaan warna visual pada warna perut sebesar 41.61±0.57 %, warna sirip dada sebesar 75.22±2.69 %, dan sirip ekor sebesar 67.87±3.89 % serta jumlah sel kromatofor sebesar 361 sel. Performa respon pertumbuhan yang terbaik diperoleh pada perlakuan LED hijau dengan tingkat kelangsungan hidup sebesar 96.29±3.21 %, laju pertumbuhan harian sebesar 2.35±0.27 %, pertumbuhan mutlak sebesar 0.030±0.003 gr/ekor/hari, pertumbuhan panjang mutlak pada PT sebesar 1.69±0.11 cm, pertumbuhan panjang mutlak pada PS sebesar 1.66±0.29 cm dan efisiensi pakan sebesar 2.90±0.15 %.
SUMMARY
ANNISA KHAIRANI ARAS. Spectrum Manipulation on Growth and Color Quality of Juvenile Botia Chromobotia macracanthus Bleeker. Supervised by KUKUH NIRMALA, DINAR TRI SOELISTYOWATI and SUDARTO.
Botia Chromobotia macracanthus Bleeker is one of the endemic ornamental fish species from Sumatera and Borneo. Botia experienced threat of the high overfishing, endangered and relatively slow grow. Environmental manipulation such as LED (Light - Emmiting Diode) light spectrum expected can be applied to increase quality and quantity of botia production in cultured system. This study aimed to evaluate the performance LED light spectrum on physiological response, growth and color quality of juvenile Botia. The experiment was design by completely randomize design with three replications consisted of R (negative control, room ligth with tube lamp), P (positive control with LED white), M (LED red), H (LED green) and B (LED blue). The juveniles were used Botia Sumatera with average of total length (TL) of 3.88±0.19 cm/individual, standard lenght (SL) of 3.38±0.19 cm/individual and body weight of 0.61±0.11 g/individual.
The best performance of physiological responses and color quality juvenile botia was found in LED red treatment with a concentration cortisol of 13.70-30.20 ng ml-1, color quality with Toca color finder (TFC) of average scoring on body was color 35.90, pectoral fin of 42.20 and caudal fin of 38.30, visual color diversity on body color of 41.61±0.57 %, pectoral fin color of 75.22±2.69 %, and caudal fin color of 67.87±3.89 % and chromatophores cells of 361 cells. The best performance of growth responses was found in LED green with survival rate of 96.29±3.21 %, specific grwoth rate of 2.35±0.27 %, the absolute weight growth of 0.030±0.003 gr/ekor/hari, the absolute growth of TL 1.69±0.11 cm, the absolute growth of SL 1.66±0.29 cm and efficiency of feed 2.90±0.15 %.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
MANIPULASI SPEKTRUM CAHAYA TERHADAP
PERTUMBUHAN DAN KUALITAS WARNA
IKAN BOTIA
Chromobotia macracanthus
Bleeker
ANNISA KHAIRANI ARAS
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Manipulasi Spektrum Cahaya terhadap Pertumbuhan dan
Kualitas Warna Ikan Botia Chromobotia macracanthus Bleeker Nama : Annisa Khairani Aras
NIM : C151130461
Disetujui oleh Komisi Pembimbing
Dr. Ir. Kukuh Nirmala, M.Sc Ketua
Dr. Ir. Dinar Tri Soelistyowati, DEA Anggota
Dr. Ir. Sudarto, M.Sc Anggota
Diketahui oleh
Ketua Program Studi
Dr. Ir. Widanarni, M.Si
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr
rahmat dan karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini ialah manipulasi lingkungan budidaya perikanan, dengan judul Manipulasi Spektrum Cahaya terhadap Pertumbuhan dan Kualitas Warna Ikan Botia Chromobotia macracanthus Bleeker. Tesis ini bersumber pada hasil penelitian yang dilaksanakan pada bulan Desember 2014 sampai Februari 2015 bertempat di Institut Pertanian Bogor.
Penulis menyadari bahwa terselesaikannya tesis ini tidak terlepas dari segala bantuan dan dukungan dari berbagai pihak, baik ide, tenaga, moril maupun material. Oleh karena itu, penulis menyampaikan rasa terima kasih yang mendalam kepada Bapak Dr. Ir. Kukuh Nirmala, M.Sc, Ibu Dr. Ir. Dinar Tri Soelistyowati, DEA dan Bapak Dr. Ir. Sudarto, M.Sc sebagai komisi pembimbing atas waktu dan bimbingannya mulai penyusunan proposal, pelaksanaan penelitian hingga penulisan tesis. Penulis juga menyampaikan rasa terima kasih kepada Dr. Ir. Nur Bambang Priyo Utomo, M.Si sebagai dosen penguji tamu dan Dr. Dinamella Wahjuningrum S.Si, M.Si sebagai perwakilan dari program studi Ilmu Akuakultur SPS IPB yang telah memberikan saran dan semangatnya dalam ujian sidang tesis ini.
Terima kasih disampaikan pada Direktoral Jendral Penddikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) tahun 2013 sehingga penulis dapat memperdalam ilmu di Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih dan penghargaan yang tinggi penulis haturkan pada suami dan buah hati tercinta: Oktavia Nando dan Jibran Khairi Alfatih atas segala doa, kasih sayang, bantuan, dukungan dan semangatnya. Ungkapan terima kasih juga disampaikan kepada Umi Asmidar dan Abi A. Razyman Zakaria, kakak tercinta Asfia Fitri Aras, S.T, adik tercinta R.B. Panji Aras dan Farid Miftahul Aras atas doa, dukungan dan kasih sayangnya. Terima kasih kepada ayah mertua Amir Syarifuddin dan ibu mertua Jasniwati atas segala doa yang diberikan.
Terima kasih kepada seluruh rekan–rekan S2 Ilmu Akuakultur angkatan 2013 atas kebersamaannya dan menempuh studi, rekan–rekan di Laboratorium Lingkungan Akuakultur serta adik–adik S1 atas kebersamaan dan kerjasamanya selama penelitian. Di samping itu, penghargaan penulis sampaikan kepada Bapak Agus Priyadi dari Balai Penelitian dan Pengembangan Budidaya Ikan Hias dan Bapak Gholib Assahad, S.Pt, M.Si dari Universitas Syiah Kuala yang telah membantu selama pengumpulan data.
DAFTAR ISI
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xii
1 PENDAHULUAN ... 1
Latar Belakang ... 1
Rumusan Masalah ... 2
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
Hipotesis ... 3
2 METODE ... 3
Waktu dan Tempat Penelitian ... 3
Materi Uji... 3
Rancangan Percobaan ... 4
Metode Penelitian ... 4
Parameter Uji ... 7
Analisis Data ... 10
3 HASIL DAN PEMBAHASAN ... 11
Respon Fisiologis ... 11
Performa Pertumbuhan dan Kelangsungan Hidup ... 13
Kualitas Warna ... 16
4 SIMPULAN DAN SARAN ... 21
Simpulan ... 21
Saran ... 21
DAFTAR PUSTAKA ... 21
LAMPIRAN ... 24
DAFTAR TABEL
1. Gambaran proksimat cacing darah (bloodworm) ... 4 2. Puncak panjang gelombang spektrum cahaya lampu LED yang digunakan 5 3. Nilai parameter fisika kimia perairan pada setiap perlakuan selama 56
hari pemeliharaan ... 6 4. Tingkat laku ikan botia yang diamati ... 7 5. Skala warna Toca Color Finder (TCF) yang digunakan ... 10 6. Kisaran konsentrasi kortisol pada akhir pemeliharaan ikan botia C.
macracanthus Bleeker ... 11 7. Respon tingkah laku benih ikan botia C. macracanthus Bleeker ... 12 8. Data parameter pertumbuhan benih ikan botia C. macracanthus Bleeker ... 13 9. Skoring warna oranye pada perut, sirip dada dan sirip ekor benih ikan
botia C. macracanthus Bleeker pada akhir pemeliharaan ... 17 10. Rata-rata rangking skoring warna perut, sirip dada dan sirip ekor benih
ikan botia C. macracanthus Bleeker ... 17 11. Hasil analisis warna merah benih ikan botia C. macracanthus Bleeker
dengan aplikasi Adobe Photoshop CS4 ... 18
DAFTAR GAMBAR
1. Panjang gelombang spektrum cahaya lampu LED yang digunakan ... 5 2. Pertumbuhan panjang total (PT) rata-rata benih ikan botia C. macracanthus
Bleeker selama 56 hari masa pemeliharaan ... 14 3. Pertumbuhan panjang standar (PS) rata-rata benih ikan botia C.
macracanthus Bleeker selama 56 hari masa pemeliharaan ... 15 4. Pertumbuhan panjang mutlak pada panjang total (PT) selama 56 hari
pemeliharaan ... 15 5. Pertumbuhan panjang mutlak pada panjang standar (PS) selama 56 hari
pemeliharaan ... 16 6. Hasil pengamatan kualitas warna benih ikan botia secara visual dari setiap
perlakuan spektrum cahaya LED ... 18 7. Jumlah sel kromatofor benih ikan botia C. macracanthus Bleeker ... 19 8. Hasil pengamatan histologi sel kromatofor benih ikan botia C.
macracanthus Bleeker ... 20
DAFTAR LAMPIRAN
1. Skema susuanan rangkaian lampu LED selama 56 hari pemeliharaan ... 24 2. Prosedur pengukuran hormon kortisol dengan metode ELISA ... 25 3. Pengamatan keragaan warna secara visual dengan aplikasi Adobe
Photoshop CS4 pada benih ikan botia C. macracanthus Bleeker ... 26 4. Analisis statistik tingkat kelangsungan hidup benih ikan botia C.
macracanthus Bleeker ... 27 5. Analisis statistik laju pertumbuhan harian benih ikan botia C.
macracanthus Bleeker ... 27 6. Analisis statistik pertumbuhan mutlak benih ikan botia C. macracanthus
7. Analisis statistik pertumbuhan mutlak panjang total benih ikan botia C.
macracanthus Bleeker ... 28 8. Analisis statistik pertumbuhan mutlak panjang standar benih ikan botia C.
macracanthus Bleeker ... 29 9. Analisis statistik efisiensi pakan benih ikan botia C. macracanthus
Bleeker ... 29 10. Analisis statistik jumlah konsumsi pakan benih ikan botia C.
macracanthus Bleeker ... 30 11. Analisis statistik warna perut, sirip dada dan sirip ekor benih ikan botia
C. macracanthus Bleeker ... 30 12. Analisis statistik nonparametrik dengan uji Kruskal-Wallis dan uji lanjut
Mann-Whitney U pada warna perut benih ikan botia ... 32 13. Analisis statistik nonparametrik dengan uji Kruskal-Wallis dan uji lanjut
Mann-Whitney U pada warna sirip dada benih ikan botia ... 36 14. Analisis statistik nonparametrik dengan uji Kruskal-Wallis dan uji lanjut
Mann-Whitney U pada warna sirip ekor benih ikan botia ... 40 15. Analisis statistik jumlah sel kromatofor benih ikan botia C.
1
PENDAHULUANLatar Belakang
Ikan botia (Chromobotia macracanthus Bleeker) yang memiliki nama komersil clown loach tergolong ikan hias air tawar endemik yang berasal dari pulau Sumatera dan Kalimatan. Ikan ini memiliki daya tarik yang luar biasa yakni bentuk badannya seperti torpedo dengan punggung agak melengkung, mulut kecil meruncing ke arah bawah dan warna tubuh yang berbelang oranye dan hitam. Ikan botia dikenal sebagai perenang yang gesit dan lincah serta hidup secara bergerombol merupakan ikan favorit kategori pertama untuk jenis ikan hias ekspor dengan jumlah permintaan yang tinggi (Ng and Tan 1997).
Ikan botia merupakan ikan bernilai ekonomis penting. Ikan botia ukuran 2 inchi dijual dengan harga Rp 3.000 – Rp 6.000 per ekor di dalam negeri, sedangkan harga ikan botia di pasaran Eropa dihargai 13 Euro (Dahruddin 2011). Selain itu, ikan botia memiliki permintaan ekspor yang tinggi. Ini terlihat dari volume dan nilai ekspor ikan botia pada tahun 2012 mampu mencapai 29.280 kg dan nilai ekspor sebesar US$ 775.384 (KKP 2013). Permintaan yang begitu tinggi tidak diiringi dengan ketersediaan ikan botia. Total jumlah ikan botia yang berasal dari tangkapan alam sebanyak 740.000 ekor pada tahun 2010 mengalami penurunan dari tahun 2009 sekitar 32.42% (Mailinda 2012). Penurunan kelimpahan populasi ikan hias botia di alam berdampak pada penurunan produksi per tahun.
Selain itu, ikan botia juga mengalami ancaman berupa tingginya overfishing yang berakibat menipisnya ikan botia di alam dan bergantung dengan musim. Pada musim kemarau ikan botia bersembunyi di cekungan dasar sungai dan pada musim hujan ikan botia memijah. Ikan botia yang berasal dari tangkapan alam memiliki tingkat mortilitas yang tinggi berkisar antara 24.66–52.45% (Rifai dan Nurdiawati 1990). Hal ini dikarenakan ikan botia tidak tahan dengan fluktuasi suhu dan apabila terinfeksi penyakit cepat berkembang dan akhirnya mati.
Pengembangbiakan ikan botia telah dilakukan oleh Balai Penelitian dan Pengembangan Budidaya Ikan Hias sejak tahun 2004. Laju pertumbuhan ikan botia tergolong lambat. Pemeliharaan ikan botia dari larva hingga mencapai ukuran yang siap dipasarkan yaitu 2–2.5 inchi memerlukan waktu pemeliharaan 6-8 bulan. Hasil penelitian Chumaidi et al. (2009) menyatakan bahwa larva ikan botia ukuran awal 5.58±0.12 mm dengan padat tebar 20 ekor/wadah dan dipelihara selama 28 hari menghasilkan pertumbuhan panjang mutlak sebesar 12.80±1.85 mm dan tingkat kelangsungan hidup sebesar 80%. Penelitian lainnya menyatakan bahwa pertambahan panjang benih ikan botia sebesar 1 inchi (2.5 cm) memerlukan waktu pemeliharaan 105 hari (Satyani et al. 2010).
Pigmentasi pada kulit ikan bertanggung jawab dalam kecerahan warna (Ahilan et al. 2008). Warna disebabkan oleh adanya sel pigmen atau kromatofor yang terdapat di lapisan dermis pada sisik, di luar maupun di bawah sisik. Faktor yang mempengaruhi pigmentasi karotenoid meliputi kandungan pigmen dalam pakan, status kesehatan dan stimulasi lingkungan. Pigmen pada ikan mengandung berbagai jenis karotenoid yang berbeda-beda dominasinya pada setiap spesies. Karotenoid yang umum dimiliki ikan yakni beta karoten yaitu warna oranye dan astaxanthin yaitu warna merah (Gupta et al. 2007).
Pencahayaan memiliki karakteristik berupa spektrum (panjang gelombang), intensitas dan fotoperiode (lama penyinaran) yang dapat mempengaruhi secara langsung maupun tidak langsung terhadap respons fisiologis, reproduksi dan pertumbuhan ikan (Boeuf and Le Bail 1999). Respons ikan secara langsung misalnya pergerakan berkumpulnya ikan di bawah cahaya dan kemudahan dalam mencari makan. Spektrum cahaya mempengaruhi kinerja pertumbuhan ikan (Karakatsouli et al. 2007), perilaku (Volpato et al. 2004) dan fisiologis (Karakatsouli et al. 2008). Penggunaan cahaya buatan dalam sistem budidaya dengan kombinasi spektrum, intensitas dan fotoperiode yang tepat menghasilkan konsentrasi pigmen pada sel kromatofor lebih tinggi, sehingga warna lebih cemerlang (Tume et al. 2009).
Light - Emitting Diode (LED) merupakan jenis lampu pencahayaan lebih efisien dibandingkan dengan lampu flouresen. Karena LED berdaya kecil sehingga biaya listrik murah dan lebih tahan lama dibandingkan lampu flouresen (Medkour et al. 2013). Penelitian menggunakan LED dalam rekayasa lingkungan untuk budidaya sudah dilakukan oleh Shin et al. (2011) dengan menggunakan spektrum cahaya LED merah, LED hijau dan LED biru untuk melihat peningkatkan kadar antioksidan sebagai respons stres oksidatif pada ikan yellowtail clownfish Amphiprion clarkii. Penelitian ini memberikan hasil terbaik pada LED merah berupa ekspresi dan aktivitas SOD (superoxide dismutase) dan katalase dan plasma H2O2, lipid peroksidasi (LPO) dan kadar melatonin sebagai
induksi stres oksidatif. Elsbaay (2013) mengatakan bahwa spektrum biru menghasilkan laju pertumbuhan harian ikan nila terbaik sebesar 4.05%. Namun, studi tentang efek spektrum cahaya LED pada pertumbuhan ikan botia belum dilakukan. Manipulasi pencahayaan menggunakan lampu LED dapat dijadikan terobosan strategi untuk meningkatkan laju pertumbuhan dan kualitas warna ikan botia dalam sistem budidaya yang prospektif dan ekonomis..
Rumusan Masalah
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi spektrum cahaya LED di media pemeliharaan terhadap respons fisiologis, pertumbuhan dan kualitas warna benih ikan botia.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi bagi pembudidaya dalam penerapan teknologi manipulasi lingkungan untuk meningkatkan produksi ikan hias yang berkualitas.
Hipotesis
Spektrum cahaya LED dapat mempengaruhi respons fisiologis, laju pertumbuhan dan kualitas warna ikan botia.
2
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Desember 2014 hingga Februari 2015 bertempat di Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, FPIK, IPB. Pengukuran panjang gelombang lampu LED dilakukan di Laboratorium Spektroskopi, Departemen Fisika, FMIPA, IPB. Analisis konsentrasi kortisol dilakukan di Laboratorium Fisiologi, FKH, Universitas Syiah Kuala. Preparat sel kromatofor dilakukan di Laboratorium Patologi, FKH, IPB. Sedangkan analisis kualitas air dilakukan di Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, FPIK, IPB.
Materi Uji Benih Ikan Botia
Ikan uji yang digunakan adalah benih ikan botia yang berasal dari populasi induk ikan botia Sumatera generasi kedua yang merupakan koleksi Balai Penelitian dan Pengembangan Budidaya Ikan Hias, Depok, Jawa Barat. Rata-rata bobot tubuh (BT) benih yang digunakan 0.61±0.11 gram/ekor, rata-rata panjang total (PT) 3.88±0.19 cm dan rata-rata panjang standar (PS) 3.38±0.19 cm. Padat tebar ikan tiap perlakuan dan ulangan adalah 18 ekor/akuarium.
Pakan Cacing Darah (Bloodworm)
Tabel 1. Gambaran proksimat cacing darah (bloodworm)
Parameter Cacing darah (bloodworm)
Bobot basah (%) Bobot kering (%)
Penelitian ini dilakukan dengan metode eksperimental. Rancangan percobaan yang digunakan pada penelitian ini berupa rancangan perlakuan: satu faktor dengan 5 spektrum cahaya LED serta masing-masing terdapat 3 ulangan dan rancangan lingkungan berupa Rancangan Acak Lengkap (RAL), yaitu:
1. Perlakuan R( kontrol negatif) = cahaya ruang dengan lampu tube 2. Perlakuan P (kontrol positif) = LED warna putih (spektrum penuh) 3. Perlakuan M = LED warna merah (625 nm)
4. Perlakuan H = LED warna hijau (525 nm) 5. Perlakuan B = LED warna biru (470 nm)
Metode Penelitian
Penelitian ini terdiri dari tahap persiapan, tahap pengujian, pengumpulan data dan pengukuran kualitas air. Tahap persiapan meliputi pengukuran panjang gelombang lampu LED, persiapan wadah dan pengapdaptasian pada media air bersalinitas 3 ppt selama 7 hari. Tahap pengujian dan pengumpulan data yaitu pemberian perlakuan selama 56 hari dan mengamati pertumbuhan, warna ikan, respons fisiologis terhadap stres melalui analisis darah, pertumbuhan dan kualitas warna ikan botia. Data pendukung yang dikumpulkan adalah pengukuran kualitas air.
Pengukuran Panjang Gelombang Lampu LED
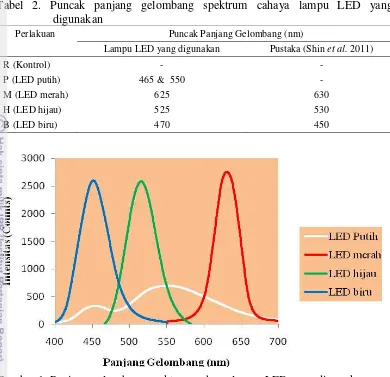
Tabel 2. Puncak panjang gelombang spektrum cahaya lampu LED yang digunakan
Perlakuan Puncak Panjang Gelombang (nm)
Lampu LED yang digunakan Pustaka (Shin et al. 2011)
R (Kontrol) - -
P (LED putih) 465 & 550 -
M (LED merah) 625 630
H (LED hijau) 525 530
B (LED biru) 470 450
Gambar 1. Panjang gelombang spektrum cahaya lampu LED yang digunakan
Persiapan Wadah dan Pengadaptasian
Pengujian Ikan
Perlakuan spektrum cahaya LED diberikan dengan lama penyinaran 12 jam dan intensitas cahaya 550 lux mengacu penelitian Nurdin (2014). Lampu LED mulai dihidupkan pada jam 07.00 dan dimatikan pada jam 19.00 (Shin et al. 2013). Pengecekan intensitas cahaya dilakukan dengan Lux meter di permukaan air. Perlakuan diberikan selama 56 hari. Ikan uji diberi pakan alami cacing darah (blood worm) dengan metode pemberian pakan hingga kenyang atau ad satiation dan feeding frequency sebanyak dua kali sehari yakni pada pukul 08.00 dan 16.00 WIB. Jumlah pakan yang dihabiskan dicatat untuk mengetahui jumlah konsumsi pakan. Penyiponan dilakukan setiap hari setelah diberi pakan agar sisa pakan tidak mempengaruhi kualitas air pemeliharaan.
Pengumpulan Data
Data yang dikumpulkan meliputi respons fisiologis terhadap stres yaitu dengan mengukur kadar kortisol dan mengamati tingkah laku berenang dan nafsu makan, pertumbuhan, kualitas warna dan kualitas air. Kadar kortisol diukur pada akhir perlakuan. Respons makan dan berenang diamati setiap hari. Sedangkan performa pertumbuhan diukur dengan penimbangan bobot dan pengukuran panjang dilakukan setiap 14 hari sekali. Kualitas warna ikan botia diukur menggunakan Toca Color Finder (TCF), keragaan warna dan penghitungan sel kromatofor dilakukan pada akhir perlakuan.
Pengukuran Kualitas Air
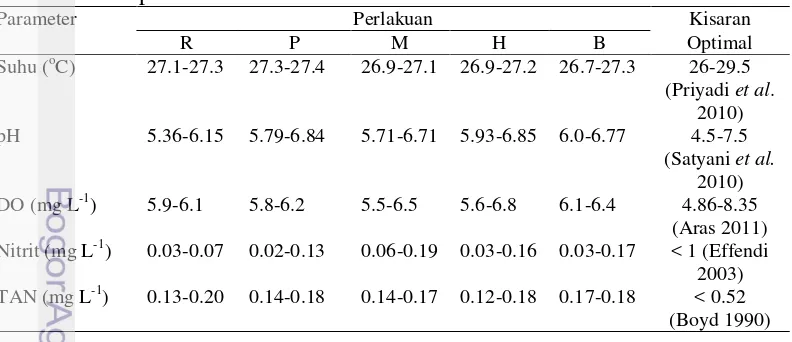
Nilai parameter fisika kimia air yang diukur dalam penelitian ini meliputi suhu, pH, oksigen terlarut, nitrit dan total amonia nitrogen (TAN). Data hasil pengukuran parameter kualitas air selama 56 hari pemeliharaan (Tabel 3).
Tabel 3. Nilai parameter fisika kimia perairan pada setiap perlakuan selama 56 hari pemeliharaan
Parameter Perlakuan Kisaran
R P M H B Optimal
Parameter kualitas air media pada perlakuan spektrum cahaya LED secara umum masih layak untuk mendukung kelangsungan hidup dan pertumbuhan benih ikan botia karena dalam lingkungan terkontrol. Kualitas air yang layak ini disebabkan oleh adanya pengelolaan kualitas air yang baik seperti penggunaan top filter pada setiap akuarium yang berfungsi untuk menyaring kotoran yang ada di dalam akuarium serta pencucian filter dilakukan setiap minggu sekali. Selain itu, penyiponan juga dilakukan setiap hari agar dapat mempertahankan dan menjaga nilai parameter kualitas air pada kondisi optimal.
Parameter Uji 1. Kortisol
Analisis kadar kortisol dilakukan untuk mengevaluasi peningkatan respons stres dikontrol oleh sistem endokrin melalui pelepasan hormon kortisol dan katekolamin. Indikator respons stres terlihat pada peningkatan sekresi kortisol sebagai usaha ikan dalam mempertahankan homeostasis. Analisis kadar kortisol dilakukan menggunakan metode ELISA (Enzyme Linked Immuno Sorbent Assay). Prinsip uji pengukuran hormon kortisol adalah teknik ELISA kompetitif (Competitive Enzyme Immunoassay) yaitu sumur pelat (microplate) dilapisi dengan antibodi monoklonal terhadap molekul kortisol. Standar dan sampel ditambahkan ke dalam sumur pekat dan berkompetisi dengan kortisol yang telah dilabel/dikonjugasi dengan enzim Cortisol-Horseradish Peroxidase (HRP, conjugate) untuk berikatan dengan antibodi (antikortisol) yang ada pada sumur pelat. Setelah inkubasi, ditambahkan larutan substrat sehingga terjadi perubahan warna biru. Intensitas warna berbanding terbalik dengan konsentrasi hormon kortisol. Jika didapatkan intensitas warna yang pekat (biru pekat) maka kosentrasi hormon kortisol sedikit, sebaliknya jika intensitas warna terang maka jumlah hormon kortisol lebih banyak. Setelah itu ditambahkan larutan penyetop untuk menghentikan reaksi enzimatis (warna akan berubah menjadi kuning). Intensitas warna yang terbentuk selanjutnya dibaca menggunakan ELISA reader pada panjang gelombang 450 nm. Konsentrasi hormon kortisol selanjutnya dihitung menggunakan program MPM 6. Prosedur pengukuran hormon kortisol secara rinci dapat dilihat pada Lampiran 2.
2. Tingkah Laku Ikan Botia
Perubahan tingkah laku ikan botia yang diamati selama pemberian perlakuan meliputi tingkah laku berenang dan mengenali pakan. Berikut kriteria penjelasan tingkah laku ikan botia:
Tabel 4. Tingkah laku ikan botia yang diamati
Respons Tingkah Laku yang Diamati Deskripsi Respons
Respons mengenali pakan Ikan mendekati pakan yang diberikan
Respons reflek ikan Ikan bergerak menghindar ketika akuarium
ditepuk-tepuk
Respons berenang Ikan berenang aktif di akuarium
Respons tingkah laku tersebut akan diberi skoring berupa tanda sebagai
Tingkat kelangsungan hidup merupakan persentase jumlah ikan yang hidup dari total ikan yang dipelihara per perlakuan. Untuk mengetahui tingkat kelangsungan hidup ikan pada penelitian ini, digunakan rumus sebagai berikut (Goddard 1996):
TKH = tingkat kelangsungan hidup (%) Nt = jumlah ikan pada akhir pengamatan No = jumlah ikan pada awal pengamatan
4. Laju Pertumbuhan Harian
Laju pertumbuhan harian merupakan laju pertambahan bobot ikan dalam persen dan dinyatakan dalam persamaan sebagai berikut (Huisman 1987):
α = [ -1] x 100...(2) Keterangan:
α = Laju pertumbuhan harian (%) Wt = Bobot rata-rata ikan ke-t (gram) Wo = Bobot rata-rata ikan ke-0 (gram) t = Lama pemeliharaan
5. Pertumbuhan Mutlak
Pertumbuhan mutlak (PM) dihitung berdasarkan selisih bobot rata-rata akhir (Wt) dengan bobot rata-rata awal (Wo) pemeliharaan, kemudian dibandingkan dengan waktu pemeliharaan (t) dan dihitung menggunakan rumus (Effendie 1979). Pertumbuhan mutlak dihitung dengan menggunakan persamaan sebagai berikut:
...(3) Keterangan:
PM = Pertumbuhan mutlak (gram/ekor/hari) Wt = Bobot rata-rata pada hari ke-t (gram) Wo = Bobot rata-rata saat tebar (gram)
6. Pertumbuhan Panjang
sedangkan panjang standar adalah jarak antara ujung kepala dengan pangkal ekor. Pengukuran ini menggunakan milimeter blok yang dilakukan setiap 14 hari sekali.
7. Pertumbuhan Panjang Mutlak
Panjang total dan panjang standar tubuh ikan diukur setiap 14 hari sekali dengan menggunakan milimeter blok. Pertumbuhan panjang mutlak dihitung dengan menggunakan persamaan sebagai berikut:
...(4) Keterangan :
Pm = Pertumbuhan panjang mutlak (cm)
Lt = Panjang rata-rata akhir pemeliharaan (cm) Lo = Panjang rata-rata awal pemeliharaan (cm)
8. Efisiensi Pakan
Efisiensi pakan menunjukkan seberapa banyak pakan yang dimanfaatkan oleh ikan dari total pakan yang diberikan, dihitung menggunakan persamaan sebagai berikut (Takeuchi 1988):
EP = x 100...(5) Keterangan:
EP = Efisiensi pakan (%)
Wt = Biomassa ikan pada akhir pemeliharaan (g)
W0 = Biomassa ikan pada awal pemeliharaan (g)
Wd = Biomassa ikan yang mati selama pemeliharaan (g)
F = Jumlah pakan yang diberikan selama penelitian (g)
9. Jumlah Konsumsi Pakan
Jumlah konsumsi pakan (JKP) benih ikan botia diketahui dengan cara menimbang jumlah pakan yang dimakan selama penelitian.
10. Kualitas Warna
Tabel 5. Skala warna TCF yang digunakan
Skala Warna Gambaran Warna
1
2
3
4
5
11. Keragaan Warna secara Visual
Keragaan warna diamati secara visual pada akhir pemeliharaan dengan menggunakan kamera DSLR (Digital Single-Lens Reflex). Kemudian dianalisis dengan metode konversi gradasi warna menurut skala dan persentase menggunakan aplikasi Adobe Photoshop CS4 yang juga digunakan pada penelitian Aslianti dan Afifah (2012). Pengamatan dilakukan terhadap 3 titik meliputi warna perut, sirip dada dan sirip ekor dengan 3 kali ulangan per perlakuan. Pengamatan keragaan warna secara visual dengan aplikasi Adobe Photoshop CS4 terdapat pada Lampiran 3.
12. Jumlah Sel Kromatofor
Penghitungan sel kromatofor pada lapisan epidermis tubuh ikan dilakukan pada awal dan akhir penelitian. Metode ini menggunakan teknik histologi dengan pewarnaan Haematoksilin dan Eosin dengan 3 kali ulangan per perlakuan. Metode ini juga diterapkan pada penelitian Sari et al. (2012), Tume et al. (2009).
Analisis Data
3
HASIL DAN PEMBAHASAN
Hasil yang didapatkan dari penelitian ini meliputi tiga parameter utama yaitu respons fisiologis (kortisol, tingkah laku), performa pertumbuhan dan kelangsungan hidup meliputi tingkat kelangsungan hidup (TKH), laju pertumbuhan harian (LPH), pertumbuhan mutlak (PM), pertumbuhan panjang, pertumbuhan panjang mutlak, efisiensi pakan (EP) serta parameter kualitas warna (kualitas warna dengan Toca Color Finder (TCF), keragaan warna secara visual, jumlah sel kromatofor).
Respons Fisiologis
Stres merupakan reaksi fisiologis untuk bertahan pada ikan terhadap penyebab stres (stresor) yang muncul karena perubahan lingkungan. Respons fisiologis terhadap stres pada ikan dapat dikategorikan ke dalam tiga tahap, yaitu: respons stres primer, sekunder dan tersier. Menurut Iwama et al. (2005), respons stres primer digambarkan berhubungan erat dengan respons neuroendokrin melalui pelepasan hormon stres berupa katekolamin dan kortisol. Pada penelitian ini dilakukan penghitungan konsentrasi kortisol pada akhir pemeliharaan (Tabel 6).
Tabel 6. Kisaran konsentrasi kortisol pada akhir pemeliharaan ikan botia C. macracanthus Bleeker
Perlakuan Kisaran Konsentrasi Kortisol (ng ml-1)
R 17.30–90.50
P 15.70–65.70
M 13.70–30.20
H 11.40–41.50
B 7.40–60.60
Keterangan: R: (kontrol negatif) cahaya ruang; P: (kontrol positif) LED putih; M: LED merah; H: LED hijau; B: LED biru.
Konsentrasi kortisol pada akhir pemeliharaan berkisar 7.40–90.50 ng ml-1. Kisaran konsentrasi kortisol terendah diperoleh pada perlakuan M (LED merah) sebesar 13.70–30.20 ng ml-1 dan diikuti perlakuan H (LED hijau), B (LED biru) dan P (kontrol positif dengan LED putih) sebesar 11.40-41.50 ng ml-1, 7.40-60.60 ng ml-1 dan 15.70-65.70 ng ml-1. Sedangkan kisaran konsentrasi kortisol tertinggi diperoleh pada perlakuan R (kontrol negatif dengan cahaya ruang) sebesar 17.30-90.50 ng ml-1. Kisaran konsentrasi kortisol yang rendah menggambarkan tingkat keragaman benih ikan botia yang mengalami stres sedikit. Sebaliknya, kisaran konsentrasi kortisol yang tinggi menggambarkan tingkat keragaman benih ikan botia yang mengalami stres banyak. Kisaran konsentrasi kortisol perlakuan M (LED merah) menggambarkan keragaman benih ikan botia yang mengalami stres lebih sedikit dibandingkan perlakuan R (kontrol negatif dengan cahaya ruang).
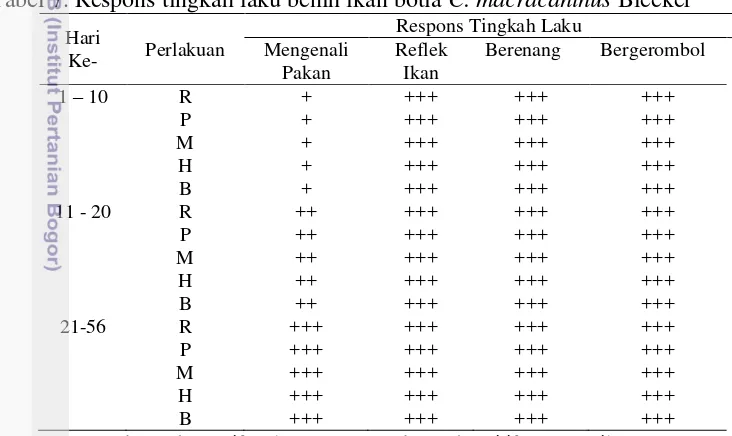
pakan, reflek ikan, berenang dan bergerombol selama 56 hari pemeliharaan (Tabel 7).
Respons tingkah laku benih ikan botia memiliki peningkatan secara bertahap. Pada hari pertama hingga hari ke sepuluh memiliki respons rendah berupa mengenali pakan. Hal ini terlihat dari jumlah pakan yang dimakan juga rendah. Namun, pada hari ke-11 hingga hari ke-20 terjadi peningkatan respons mengenali pakan menjadi respons sedang. Hal ini diduga benih ikan botia mulai beradaptasi terhadap perlakuan yang diberikan. Selain itu, jumlah pakan yang dimakan mulai bertambah. Sedangkan pada hari ke-21 hingga 56 hari pemeliharaan, respons tingkah laku menjadi tinggi baik itu respons mengenali pakan di semua perlakuan. Pada tahapan ini, benih ikan botia diduga telah beradaptasi dengan sempurna terhadap perlakuan yang diberikan. Untuk respons reflek ikan, berenang dan bergerombong dari awal pemeliharaan hingga 56 hari pemeliharaan, respons yang diberikan tinggi. Hal ini dikarenakan ikan botia memiliki sifat yang agresif dan bergerak aktif.
Tabel 7. Respons tingkah laku benih ikan botia C. macracanthus Bleeker Hari
Keterangan: R: (kontrol negatif) cahaya ruang; P: (kontrol positif) LED putih; M: LED merah; H: LED hijau; B: LED biru. (-): tidak ada respons; (+): respons rendah; (++): respons sedang; (+++): respons tinggi
Menurut Iwama et al. (2005), respons ikan yang terkena stresor akan mempengaruhi sel, organisme individual, hingga populasi. Sinyal yang paling terlihat dari adanya stresor pada ikan berupa respons tingkah laku. Tingkah laku menjadi bagian terpenting sebagai upaya bertahan hidup untuk mengembalikan keadaan normal dalam waktu yang singkat. Ikan yang tidak mampu mempertahankan respons fisiologis terhadap stres maka akan menurunkan kelangsungan hidupnya. Jika dilihat dari respons tingkah laku pada awal pemeliharaan yang rendah dan dibandingkan dengan persentase tingkat kelangsungan hidup terlihat bahwa ada penurunan kelangsungan hidup pada perlakuan kontrol negatif, LED hijau dan biru (Tabel 8).
meningkat seiring lama pemeliharaan. Ikan yang tidak mampu beradaptasi terhadap stresor akan mengalami penurunan pertumbuhan (Iwama et al. 2005). Hal ini terlihat pada pertumbuhan panjang total (Gambar 2) dan panjang standar (Gambar 3) benih ikan botia selama 14 hari pertama (sampling ke-1) mengalami pertumbuhan yang rendah. Pertumbuhan panjang total dan standar benih ikan botia pada sampling ke-2 hingga akhir pemeliharaan mengalami peningkatan. Hal ini diduga benih ikan botia telah mengalami adaptasi terhadap perlakuan yang diberikan.
Performa Pertumbuhan dan Kelangsungan Hidup
Tingkat kelangsungan hidup benih ikan botia pada penelitian ini sebesar 94.44±5.56% - 100±0.00% dan laju pertumbuhan harian sebesar 1.62±0.40% – 2.35±0.27% (Tabel 8). Hasil analisis sidik ragam (ANOVA) menunjukkan bahwa perlakuan spektrum cahaya LED tidak berpengaruh nyata terhadap tingkat kelangsungan hidup (TKH) dan laju pertumbuhan harian (LPH) benih ikan botia (p>0.05) (Lampiran 4 dan Lampiran 5). Kinerja pertumbuhan terbaik terdapat pada perlakuan D dengan laju pertumbuhan mutlak (PM), efisiensi pakan (EP) dan jumlah konsumsi pakan (JKP) yaitu 0.030±0.0.003 gr/ekor/hari, 2.90±0.15% dan 293.97±8.27 g (p<0.05) (Lampiran 6, Lampiran 7 dan Lampiran 8) dengan kontrol negatif (R), tetapi tidak berbeda nyata (p>0.05) dengan perlakuan kontrol positif (P), LED merah (M) dan LED biru (B).
Tabel 8. Data parameter pertumbuhan benih ikan botia C. macracanthus Bleeker
Parameter Perlakuan Spektrum LED
R P M H B
TKH (%) 94.44±5.56a 100±0.00 a 100±0.00 a 96.29±3.21 a 98.15±3.21 a LPH (%) 1.77±0.56 a 2.08±0.42 a 1.80±0.37 a 2.35±0.27 a 1.62±0.40 a PM
(g/ekor/hari)
0.015±0.004 b 0.022±0.006 ab 0.022±0.006 ab 0.030±0.003 a 0.019±0.004 ab
EP (%) 1.24±0.06 c 1.87±0.68 bc 2.34±0.25 ab 2.90±0.15 a 1.70±0.08 bc JKP (g) 268.78±7.62 d 315.23±8.04 a 312.25±4.18 ab 293.97±8.27 bc 291.07±6.20 c Keterangan: R: (kontrol negatif) cahaya ruang; P: (kontrol positif) LED putih; M: LED merah; H:
LED hijau; B: LED biru. Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (uji lanjut Tukey; p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku.
yang saling melengkapi, yakni rod lebih mendekati membran pembatas terluar dan segmen terluar pada kon dilindungi oleh epithelium berpigmen. Ikan botia telah beradaptasi dengan spektrum cahaya LED hijau dan memudahkan melihat serta memakan pakan cacing darah atau bloodworm.
Indikator pemanfaatan pakan dalam menghasilkan biomassa ikan selama pemeliharaan ikan botia dapat dilihat pada persentase efisiensi pakan. Semakin tinggi persentase efisiensi pakan maka pakan yang diberikan dapat termanfaatkan dengan optimal dan biomassa ikan botia yang dihasilkan akan besar pula. Pada penelitian ini diduga perlakuan LED hijau merupakan spektrum cahaya yang terbaik pada ikan botia dengan nilai efisiensi pakan yang terbesar dan penyerapan nutrisi pakan yang optimal (Tabel 8). Hal ini sejalan dengan Boeuf and Le Bail (1999) mengatakan bahwa cahaya mempengaruhi pertumbuhan ikan dan juga merangsang laju konsumsi pakan. Penelitian lain menunjukkan bahwa penggunaan spektrum merah pada ikan trout memiliki konversi pakan yang terbaik sebesar 1.57±0.02 (Karakatsouli et al. 2008) dan spektrum warna biru pada ikan nila memiliki konversi pakan yang terbaik sebesar 1.04±0.01 (Elsbaay 2013).
Pertumbuhan panjang total (PT) pada setiap perlakuan selama 56 hari pemeliharaan menunjukkan tingkat pertambahan PT yang positif, yaitu semakin lama masa pemeliharaan semakin meningkat pula pertumbuhan PT benih ikan botia (Gambar 2). Pada akhir pemeliharaan rata-rata pertumbuhan PT benih ikan botia tertinggi diperoleh perlakuan LED hijau yaitu 5.44 cm dan diikuti perlakuan LED merah sebesar 4.98 cm, perlakuan LED putih sebesar 4.93 cm, perlakuan LED biru sebesar 4.90 cm serta perlakuan kontrol negatif atau cahaya ruang sebesar 4.29 cm.
Gambar 2. Pertumbuhan panjang total (PT) rata-rata benih ikan botia C. macracanthus selama 56 hari masa pemeliharaan.
merah sebesar 4.38 cm, perlakuan LED putih sebesar 4.35 cm, perlakuan LED biru sebesar 4.31 cm serta perlakuan kontrol negatif atau cahaya ruang sebesar 3.73 cm.
Gambar 3. Pertumbuhan panjang standar (PS) rata-rata benih ikan botia C. macracanthus selama 56 hari masa pemeliharaan.
Selain pertumbuhan panjang benih ikan botia selama 56 hari pemeliharaan, pertumbuhan panjang mutlak pada panjang total (PT) dan panjang standar (PS) juga memberikan hasil yang berbeda secara signifikan. Pada Gambar 4 terlihat bahwa pertumbuhan panjang mutlak pada PT benih ikan botia berbeda secara signifikan antara perlakuan LED hijau dengan cahaya ruang (kontrol negatif), namun tidak berbeda nyata antar perlakuan LED putih (kontrol positif), LED merah dan LED biru. Pertumbuhan panjang mutlak pada panjang total (PT) pada perlakuan berturut-turut yaitu R (0.52±0.27 cm); P (0.96±0.37 cm); M (1.03±0.20 cm); H (1.69±0.11 cm) dan B (1.03±0.33 cm).
Gambar 4. Pertumbuhan panjang mutlak pada panjang total (PT) selama 56 hari pemeliharaan. Nilai yang tertera merupakan nilai rata-rata dan simpangan baku dengan huruf berbeda menunjukkan pengaruh perlakuan yang berbeda nyata (uji lanjut Tukey; p<0.05).
Kontrol Negatif
LED Putih
LED Merah
LED Hijau
Untuk pertumbuhan panjang mutlak pada panjang standar (PS) benih ikan botia terlihat bahwa perlakuan LED hijau memberikan hasil yang signifikan terhadap keempat perlakuan lainnya. Pertumbuhan panjang mutlak pada PS yang terbaik diperoleh pada perlakuan H yaitu sebesar 1.66±0.29 cm; kemudian diikuti oleh perlakuan B sebesar 0.94±0.32 cm, perlakuan M sebesar 0.93±0.18 cm; kemudian perlakuan P sebesar 0.90±0.28 cm dan perlakuan R sebesar 0.46±0.18 cm (Gambar 5).
Gambar 5. Pertumbuhan panjang mutlak pada panjang standar (PS) selama 56 hari pemeliharaan. Nilai yang tertera merupakan nilai rata-rata dan simpangan baku dengan huruf berbeda menunjukkan pengaruh perlakuan yang berbeda nyata (uji lanjut Tukey; p<0.05).
Kualitas Warna
Ikan botia merupakan ikan yang bernilai ekonomis penting dan banyak diminati karena daya tarik warnanya berbelang oranye dan hitam. Kriteria umum pada pemilihan ikan hias yang diminati oleh pasar meliputi ukuran, kualitas warna, dan jenis kelamin (Moorhead 2012). Kualitas warna menjadi indikator keindahan ikan hias. Kualitas warna pada penelitian ini meliputi penyesuaian skala warna TCF, keragaan warna secara visual dan jumlah sel kromatofor.
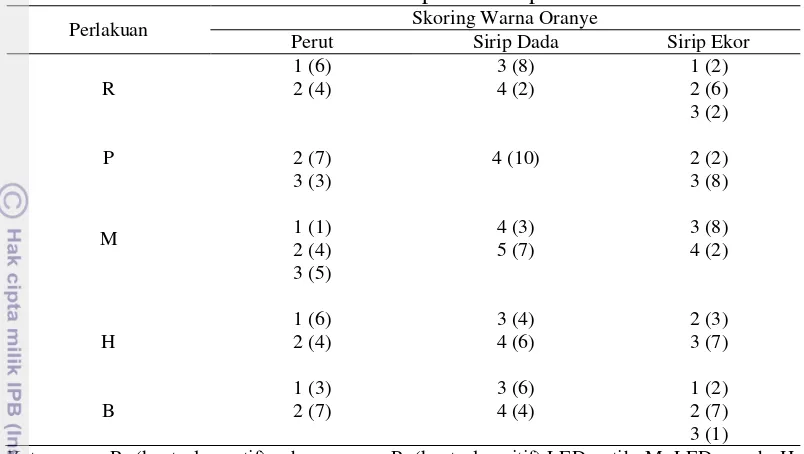
Pengamatan kualitas warna dengan skala warna TCF dilakukan oleh 10 panelis untuk melihat tingkat skoring warna pada perut, sirip dada dan sirip ekor. Berdasarkan pengamatan di akhir pemeliharaan, skor tertinggi pada perut benih ikan botia yaitu skor 3 yang dimiliki oleh perlakuan P (kontrol positif) dan perlakuan M (LED merah), skoring warna sirip dada dan sirip ekor yaitu skor 5 dan skor 4 diperoleh perlakuan M (LED merah) (Tabel 9).
Kontrol Negatif
LED Putih
LED Merah
LED Hijau
Tabel 9. Skoring warna oranye pada perut, sirip dada dan sirip ekor benih ikan botia C. macaracanthus Bleeker pada akhir pemeliharaan
Perlakuan Skoring Warna Oranye
Perut Sirip Dada Sirip Ekor
Keterangan: R: (kontrol negatif) cahaya ruang; P: (kontrol positif) LED putih; M: LED merah; H: LED hijau; B: LED biru.
Setelah panelis memberikan penilaian terhadap skoring warna benih ikan botia, data skoring warna diubah menjadi rangking. Berdasarkan Tabel 9, warna oranye pada perut, sirip dada dan sirip ekor benih ikan botia memiliki rata-rata rangking skoring warna yang terbaik diperoleh perlakuan M sebesar 35.90, 42.20 dan 38.30 di antara perlakuan yang lain. Perlakuan spektrum cahaya LED memberikan pengaruh yang signifikan terhadap skoring warna perut, sirip dada dan sirip ekor benih ikan botia (uji Kruskall Wallis, p<0.05).
Kemudian perlakuan spektrum cahaya LED dilakukan uji lanjut Mann-Whitney U (p<0.05) dengan membandingkan antar perlakuan (Tabel 10). Hasil uji dilanjut nonparametrik pada rangking skoring warna perut diperoleh perlakuan M dan perlakuan P terdapat perbedaan yang nyata dengan perlakuan R, H dan B. Rangking skoring warna sirip dada pada perlakuan M memberikan pengaruh yang signifikan di antara perlakuan lainnya. Sedangkan rangking skoring warna sirip ekor pada perlakuan M memberikan pengaruh yang nyata terhadap perlakuan R, H dan B. Tetapi perlakuan P, M dan H tidak saling berpengaruh nyata terhadap rangking skoring warna sirip ekor benih ikan botia.
Tabel 10. Rata-rata rangking skoring warna perut, sirip dada dan sirip ekor benih ikan botia C. macracanthus Bleeker
Perlakuan Rata - rata rangking skoring warna
Perut Sirip dada Sirip ekor
Untuk melihat kualitas warna dilakukan juga pengecekan keragaan secara visual ikan botia dengan menggunakan aplikasi Adobe Photoshop CS4 pada akhir pemeliharaan. Keragaan secara visual memiliki nilai persentase sebesar 41.26±1.55% – 75.22±2.69% (Tabel 10). Penghitungan kualitas warna ini menggunakan tiga titik yang diamati pada contoh benih ikan botia yaitu bagian warna perut, sirip dada dan sirip ekor. Hasil analisis sidik ragam (ANOVA) menunjukkan bahwa perlakuan spektrum cahaya LED berpengaruh nyata terhadap keragaan secara visual. Keragaan secara visual pada sirip dada dan sirip ekor dengan nilai persentase terbesar diperoleh pada perlakuan M sebesar 75.22±2.69% dan 67.87±3.89%. Perbandingan kualitas warna dari keragaan secara visual dapat dilihat pada Gambar 6. Hal ini menunjukkan bahwa perlakuan spektrum cahaya LED mampu meningkatkan performasi warna pada benih ikan botia.
Tabel 11. Hasil analisis kualitas warna benih ikan botia C. macracanthus Bleeker dengan aplikasi Adobe Photoshop CS4
Perlakuan Keragaan Warna Visual (%)
Perut Sirip Dada Sirip Ekor R 41.26±1.55a 63.54±0.90b 49.76±2.17b P 42.75±1.18a 66.52±2.99ab 61.58±6.93ab M 41.61±0.57a 75.22±2.69a 67.87±3.89a H 42.20±2.36a 72.65±5.78ab 63.23±5.64ab B 41.68±0.33a 70.94±5.39ab 53.39±6.14b
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan pengaruh perlakuan yang berbeda nyata (uji lanjut Tukey; p<0.05). Nilai yang tertera merupakan nilai rata-rata dan simpangan baku. R: (kontrol negatif) cahaya ruang; P: (kontrol positif) LED putih; M: LED merah; H: LED hijau; B: LED biru.
R (kontrol negatif) P (kontrol positif) M (LED merah)
H (LED hijau) B (LED biru)
Kualitas warna benih ikan botia juga dilihat dari jumlah sel kromatofor. Sel kromatofor atau sel pigmen ditemui di dermis, di lapisan atas atau stratum spongiosum dan di lapisan bawah atau stratum compactum (Roberts and Ellis 2012). Statum spongiosum merupakan jaringan longgar yang terdiri kolagen dan serat retikula serta berisikan sel pigmen atau kromatofor. Sedangkan stratum compactum terdiri dari jaringan kolagen yang menentukan struktur terang atau gelapnya kulit. Kapasitas warna dapat berubah dengan penyesuaian lingkungan, aktivitas seksual atau penyakit yang berkembang secara cepat di ikan dan menginduksi sebagai modulasi kontrol serta saling mempengaruhi daya absorpsi dan refleksi dari sel pigmen (Robert and Ellis 2012). Penyesuaian lingkungan berupa spektrum cahaya yang berbeda diduga akan mempengaruhi sel pigmen atau sel kromatofor serta mempengaruhi juga kualitas warna benih ikan botia.
Penghitungan jumlah sel kromatofor dilakukan pada akhir pemeliharaan. Jumlah sel kromatofor pada perlakuan spektrum cahaya LED berkisar 147-361 sel (Gambar 7). Hasil analisis sidik ragam (ANOVA) menunjukkan adanya pengaruh yang sangat nyata terhadap jumlah sel kromatofor pada setiap perlakuan spektrum cahaya LED dan perhitungan dilanjutkan dengan uji lanjut Tukey (p<0.05)(Lampiran 14). Hasil uji lanjut menunjukkan pada perlakuan M (LED merah) memberikan respons terbaik terhadap peningkatan jumlah rata-rata sel kromatofor sebanyak 361 sel. Perlakuan P (kontrol positif), H (LED hijau) dan B (LED biru) memberikan pengaruh yang tidak berbeda nyata satu sama lain (p<0.05) dengan jumlah rata-rata sel kromatofor berturut-turut sebesar 238 sel, 243 sel dan 223 sel. Sedangkan perlakuan A (kontrol negatif) dengan menggunakan cahaya ruang yang berasal lampu tube memiliki pengaruh yang berbeda nyata dan memiliki nilai sel rata-rata kromatofor terendah sebesar 147 sel (p<0.05).
Gambar 7. Jumlah sel kromatofor benih ikan botia C. macracanthus Bleeker. Nilai yang tertera merupakan nilai rata-rata dan simpangan baku dengan huruf berbeda menunjukkan pengaruh perlakuan yang berbeda nyata (uji lanjut Tukey; p<0.05).
Jumlah sel kromatofor yang berbeda di setiap perlakuan diduga karena jumlah pakan yang dimakan ikan berbeda pula. Hal ini dikarenakan komponen utama pembentuk pigmen warna atau sel kromatofor adalah karotenoid yang tidak Kontrol Negatif
LED Putih
LED Merah
LED Hijau
mampu disintesis dari tubuh ikan dan hanya terpenuhi dari pakan. Pakan yang diberikan berupa cacing darah atau bloodworm memiliki kandungan pigmen karoten berupa astaxanthin sebesar 5.11 ng g-1 (Chittapun et al. 2013). Nilai efisiensi pakan yang terbaik diperoleh pada perlakuan M (LED merah) dan H (LED hijau) (Tabel 8) diduga mencerminkan banyaknya kandungan karoten yang dimakan benih ikan botia. Pakan yang dikonsumsi oleh benih ikan botia akan terekspresi pada sel kromatofor. Perlakuan M (LED merah) diduga merupakan spektrum cahaya terbaik sehingga mempermudah benih ikan botia melihat pakan yang diberikan.
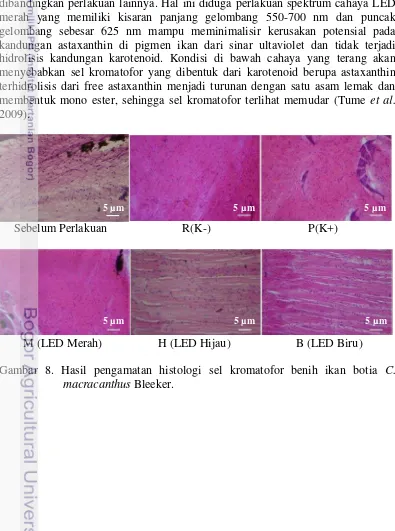
Hasil pengamatan histologi sel kromatofor benih ikan botia (Gambar 8). Sebelum pemberian perlakuan spektrum cahaya memiliki sel kromatofor yang sedikit dan menyebar. Sedangkan pada akhir pemeliharaan perlakuan spektrum cahaya terlihat sel kromatofor pada LED merah lebih banyak dan rapat dibandingkan perlakuan lainnya. Hal ini diduga perlakuan spektrum cahaya LED merah yang memiliki kisaran panjang gelombang 550-700 nm dan puncak gelombang sebesar 625 nm mampu meminimalisir kerusakan potensial pada kandungan astaxanthin di pigmen ikan dari sinar ultaviolet dan tidak terjadi hidrolisis kandungan karotenoid. Kondisi di bawah cahaya yang terang akan menyebabkan sel kromatofor yang dibentuk dari karotenoid berupa astaxanthin terhidrolisis dari free astaxanthin menjadi turunan dengan satu asam lemak dan membentuk mono ester, sehingga sel kromatofor terlihat memudar (Tume et al. 2009).
Sebelum Perlakuan R(K-) P(K+)
M (LED Merah) H (LED Hijau) B (LED Biru) Gambar 8. Hasil pengamatan histologi sel kromatofor benih ikan botia C.
macracanthus Bleeker.
5 µm 5 µm 5 µm
5 µm 5 µm
4
SIMPULAN DAN SARAN
Simpulan
Spektrum cahaya LED merah menghasilkan respons fisiologis dan kualitas warna terbaik berdasarkan jumlah sel kromatofor, skoring Toca Color Finder pada sirip dada dan keragaan secara visual pada sirip dada dan sirip ekor. Sedangkan spektrum cahaya LED hijau menghasilkan performa pertumbuhan terbaik berdasarkan pertumbuhan mutlak panjang standar.
Saran
Dari hasil penelitian ini, disarankan dilakukan penelitian lanjutan berupa lama pemberian perlakuan dengan kombinasi spektrum cahaya LED merah dan LED hijau guna meningkatkan produksi serta kualitas warna benih ikan botia.
DAFTAR PUSTAKA
Ahilan B, Jegan K, Felix N, Ravaneswaran K. 2008. Influence of botanical additives on the growth and colouration of adult gold fish Carrassius auratus (Linn.). J Veterinary & Animal Sciences. 4 (4): 129-134.
Aliambar. 1999. Pengaruh pengendalian hewan terhadap temperatur, nadi dan respirasi, nilai hematologi dan kimia darah rusa Cervus timorensis. [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Aras AK. 2011. Penggunaan paparan medan listrik 10 volt dan salinitas 3 ppt terhadap kinerja produksi ikan botia Chromobotia macracanthus Bleeker dengan kepadatan berbeda. [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Aslianti T, Afifah N. 2012. Peningkatan kualitas warna benih ikan kakap merah
Lutjanus sebae melalui pakan yang diperkaya dengan minyak buah merah Pandanus conoideus sebagai sumber beta-karoten. Jurnal Ilmu dan Teknologi Kelautan Tropis. 4 (2): 171-181.
Boeuf G, Le Bail PY. 1999. Does light have an influence on fish growth?. Aquaculture. 177: 129-152.
Boyd CE, Tucker CS. 1998. Pond aquaculture water quality management. New York (US): Springer Science+Business Media.
Boyd CE. 1990. Water Quality in Ponds for Aquaculture. Birmingham (AL): Birmingham Publishing Co.
Chao NL, Prang G. 1997. Project Piaba - towards a sustainable ornamental fishery in the Amazon. Aquarium Sciences and Conservation, 1: 105-111.
Chittapun S, Darawan R, Mariena K. 2013. Identification and nutritional value of live feeds for ornamental fish from Bangkok metropolitan market in Thailand. Chiang Mai J. Sci. 40(3): 364-375.
Chumaidi, Nurhidayat, Agus P. 2009. Pemeliharaan larva ikan botia (Chromobotia macracanthus) menggunakan pakan alami yang diperkaya nutrisinya. Jurnal Akuakultur Indonesia. 8(1): 11-18.
Dahruddin H. 2011. Ikan botia:maskot ekspor ikan hias asli Indonesia.[Majalah Ilmiah]. Fauna Indonesia. 10(1): p 17-21.
Effendie MI. 1979. Metode Biologi Perikanan. Bogor (ID):Yayasan Dewi Sri. Elsbaay AM. 2013. Effect of photoperiod and different artificial lightcolor on nila
tilapia growth rate. IOSR-JAVS. 3: 5-12.
Faridah N. 2010. Efektivitas ekstrak lidah buaya Aloe vera dalam pakan sebagai imunostimulan untuk mencegah infeksi Aeromonas hydrophila pada ikan lele dumbo Clarias sp. [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Goddard S. 1996. Feed Management in Intensive Aquaculture. New York (US):
Chapman and Hall. p 194.
Gupta SK, Jha AK, Pal AK, Venkateshwarlu G. 2007. Use of natural carotenoid for pigmentation in fish. Journal Natural Product Radiance. 6(1): 46-49. Hickman CP, Roberts LS, Keen SL, Eisenhour DJ, Larson A, I’Anson H, 2011.
Integrated Principles of Zoology 15th ed. New York (US): McGraw-Hill. 749-751 p.
Huisman EA. 1987. Principles of Fish Production. Netherland (NL): Wageningen Agricultural University Press. p 57-122.
Indarti S, Muhaemin M, Hudaidah S. 2012. Modified toca colour finder (M-TCF) dan kromatofor sebagai penduga tingkat kecerahan warna ikan komet (Carasius auratus auratus) yang diberi pakan dengan proporsi tepung kepala udang (TKU) yang berbeda. e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. 1(1): 9-16.
Iwama GK, Afonso LOB, Vijayan MM. 2005. The Physiology of Fishes: Stress in Fishes. Evans DH, Claiborne JB, editor. New York (US): CRC Press. 320– 322 p.
Karakatsouli N, Papoutsoglou SE, Pizzania G, Tsatsos G, Tsopelakos A, Stella C, Kalogiannis D, Dalla C, Polissidis A, Papadopoulou-Daifoti Z. 2007. Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions. Aquacultural Engineering. 36: 302-309.
Karakatsouli N, Papoutsoglou SE, Panopoulos G, Papoutsoglou ES, Chadio S, Kalogiannis. 2008. Effects of light spectrum on growth and stress responsse of rainbow trout Oncorhynchus mykiss reared under recirculating system conditions. Aquacultural Engineering. 38: 36-42.
KKP [Kementerian Kelautan dan Perikanan]. 2013. Statistik Ekspor Hasil Perikanan Menurut Komoditi, Provinsi dan Pelabuhan Asal Ekspor 2012. Jakarta (ID): KKP Pres. p 14.
Kurnia A, Satoh S, Hanzawa S. 2010. Effect of Paracoccus sp. and their genetically modified on skin coloration of red sea bream. Hayati J Biosci. 17(2): 79-84.
Mainassy MC, Uktolseja JLA, Martosupono M. 2011. Pendugaan kandungan beta karoten ikan lompa (Thryssa baelama) di perairan Pantai Apui, Maluku Tengah. J Fish Sci. 8 (2): 51-59.
Mailinda. 2012. Kelimpahan populasi ikan hias botia (Chromobotia macracanthus) dan persepsi masyarakat terhadap pemanfaatannya di sungai Batanghari kota Jambi. [Tesis]. Depok (ID): Universitas Indonesia.
Moorhead J. 2012. Aquaculture Farming Aquatic Animal and Plants 2nd ed: Ornamentals. Lucas JS and Southgate PC, editor. Oxford (GB): Blackwell Publishing Ltd. p 603.
Ng PKL, Tan HH. 1997. Freshwater fishes of Southeast Asia: potential for the aquarium fish trade and conservation issues. Aquarium Sciences and Conservation. 1: 79-90.
Nurdin M. 2014. Perbedaan lama penyinaran dan intensitas cahaya terhadap pertumbuhan serta sintasan benih ikan tengadak Barbonymus schwanenfeldii. [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Prayogo HH, Rostika R, Nurruhwati I. 2012. Pengkayaan pakan yang mengandung maggot dengan tepung kepala udang sebagai sumber karotenoid terhadap penampilan warna dan pertumbuhan benih rainbow kurumoi (Melanotaenia parva). Jurnal Perikanan dan Kelautan. 3(3): 201-205.
Priyadi A, Ginanjar R, Permana A, Slembrouck J. 2010. Tingkat densitas larva botia (Chromobotia macracanthus) dalam satuan volume air pada akuarium sistem resirkulasi. Prosiding Forum Inovasi Teknologi Akuakultur. 439-446. Rifai SA, Nurdiawati S. 1990. Penampungan ikan hias botia (Botia macracanthus Bleeker) sistim sangkar di danau. Buletin Penelitian Perikanan Darat Jambi. 9: 39-42.
Roberts RJ, Ellis AE. 2012. Fish Pathology 4th ed: the Anatomy and Physiology of Teleosts. Roberts RJ, editor. Oxford (GB): Blackwell Publishing Ltd. p 17-20.
Sari NK, Santoso L, Hudaidah S. 2012. Pengaruh penambahan tepung kepala udang dalam pakan terhadap pigmentasi ikan koi (Cyprinus carpio) jenis kohaku. e-Jurnal Rekayasa dan Teknologi Budidaya Perairan. 1(1): 31-38. Satyani D, Nina M, Lili S. 2010. Gambaran pertumbuhan panjang benih ikan
botia (Chromobotia macracanthus) hasil budidaya pada pemeliharaan dalam sistem hapa dengan padat penebaran 5 ekor per liter. Prosiding Forum Inovasi Teknologi Akuakultur. 395-402.
Shahidi F, Metusalach A, Brown JA. 1998. Carotenoid pigments in sea foods and aquaculture. Crit Rev Food Sci Nutr. 38:1-6.
Shin HS, Lee J, Choi CY. 2011. Effects of LED light spectra on oxidative stress and the protective role of melatonin in relation to the daily rhythm of the yellowtail clownfish, Amphiprion clarkii. Comparative Biochemistry and Physiology, Part A. 160: 221-228.
Takeuchi T. 1988. Laboratory Work Chemical Evaluation of Dietary Nutrients. In: Fish Nutrition and Mariculture. Watanabe T, editor. Department of Aquatic Bioscience. Tokyo University of Fisheries. p 179-225.
Tume RK, Sikes AL, Tabrett S, Smith DM. 2009. Effect of background colour on the distribution of astaxanthin in black tiger prawn (Penaeus monodon): Effective method for improvement of cooked colour. Aquaculture. 296: 129-135.
Lampiran 1. Skema susunan rangkaian lampu LED selama 56 pemeliharaan.
Jarak lampu LED hingga permukaan air akuarium:
LED Putih = 24 cm LED Hijau = 20 cm
LED Merah = 5 cm LED Biru = 4 cm
Lampiran 2. Prosedur pengukuran hormon kortisol dengan metode ELISA
Sebelum digunakan, semua reagen harus dibiarkan pada suhu kamar (18-25°C). Selanjutnya, larutan standar dipersiapkan dengan kosentrasi 10,20,50,100 200,400,dan 800 ng/ml dan larutan QC (quality control). Adapun prosedur pengukuran hormon kortisol adalah sebagai berikut:
1. Setiap sumur pelat (microplate) diisi dengan larutan standar, sampel dan QC (quality control) sebanyak 20 μl.
2. Konjugat enzim HRP Cortisol (Enzym Conjugate) sebanyak 200 μl ditambahkan ke dalam setiap sumur, kemudian dikocok perlahan selama kurang lebih 10 detik.
3. Sumur pelat diinkubasi pada suhu kamar selama 60 menit
4. Kemudian larutan dalam sumur pelat dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 300 μl setiap sumur. Pencucian dilakukan sebanyak 4 kali menggunakan alat Microplate Strip Washer. Setelah pencucian selesai, dikeringkan dengan cara dibanting secara perlahan pada kertas penyerap.
5. Ditambahkan 100 μl larutan substrat (TBM Substrate) pada masing-masing
sumur pelat.
6. Inkubasi selama 20 menit pada suhu ruang.
7. Setelah larutan substrat diinkubasi, reaksi enzimatis dihentikan dengan
menambahkan 100μl larutan penyetop (Stop Solution, H2SO4 0,5 M) ke dalam
setiap sumur pelat.
Lampiran 3. Pengamatan keragaan warna secara visual dengan aplikasi Adobe Photoshop CS4 pada benih ikan botia C. macracanthus Bleeker
Perhitungan wana merah RGB di sirip dada ikan botia:
Lampiran 4. Analisis statistik tingkat kelangsungan hidup benih ikan botia C. macracanthus Bleeker
ANOVA Tingkat Kelangsungan Hidup
Sum of Squares df Mean Square F Sig. Kontrol Negatif 3 94,4433
LED Hijau 3 96,2933
LED Biru 3 98,1467
Kontrol Positif 3 100,0000
LED Merah 3 100,0000
Sig. ,283
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 5. Analisis statistik laju pertumbuhan harian benih ikan botia C. macracanthus Bleeker
ANOVA Laju Pertumbuhan Harian
Sum of Squares df Mean Square F Sig.
Means for groups in homogeneous subsets are displayed.
Lampiran 6. Analisis statistik pertumbuhan mutlak benih ikan botia C.
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 7. Analisis statistik pertumbuhan mutlak panjang total benih ikan botia C. macracanthus Bleeker
ANOVA Pertumbuhan Mutlak Panjang Total
Sum of Squares df Mean Square F Sig.
Means for groups in homogeneous subsets are displayed.
Lampiran 8. Analisis statistik pertumbuhan mutlak panjang standar benih ikan botia C. macracanthus Bleeker
ANOVA Pertumbuhan Mutlak Panjang Standar
Sum of Squares df Mean Square F Sig.
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 9. Analisis statistik efisiensi pakan benih ikan botia C. macracanthus Bleeker
Lampiran 10. Analisis statistik jumlah konsumsi pakan benih ikan botia C. macracanthus Bleeker
ANOVA Jumlah Konsumsi Pakan
Sum of Squares df Mean Square F Sig.
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3,000.
Lampiran 11. Analisis statistik warna perut, sirip dada dan sirip ekor benih ikan botia C. macracanthus Bleeker
ANOVA Kontrol Negatif 3 41,2567 LED Merah 3 41,6100
LED Biru 3 41,6833
LED Hijau 3 42,1967 Kontrol Positif 3 42,7467
Sig. ,695
Means for groups in homogeneous subsets are displayed.
ANOVA Kontrol Negatif 3 65,8600 Kontrol Positif 3 66,5233
LED Biru 3 70,9367
LED Merah 3 75,2233 LED Hijau 3 76,5833
Sig. ,055
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3,000.
Kontrol Positif 3 61,5800 61,5800 LED Hijau 3 63,2267 63,2267
LED Merah 3 67,8700
Sig. ,062 ,601
Means for groups in homogeneous subsets are displayed.
Lampiran 12. Analisis statistik nonparametrik dengan uji Kruskal-Wallis dan uji lanjut Mann-Whitney U pada warna perut benih ikan botia
Kruskal-Wallis Test Ranks
Perlakuan N Mean Rank skoring kontrol negatif 10 16,90
kontrol positif 10 34,60
A (kontrol negatif) vs B (kontrol positif) Ranks
Asymp. Sig. (2-tailed) ,002 Exact Sig. [2*(1-tailed
Sig.)] ,005
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
Test Statisticsa
skoring Mann-Whitney U 15,000
Wilcoxon W 70,000
Z -2,821
Asymp. Sig. (2-tailed) ,005 Exact Sig. [2*(1-tailed
Sig.)] ,007
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
A (kontrol negatif vs D (LED hijau)
Asymp. Sig. (2-tailed) 1,000 Exact Sig. [2*(1-tailed
Sig.)] 1,000
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
A (kontrol negatif vs E (LED biru)
Asymp. Sig. (2-tailed) ,189 Exact Sig. [2*(1-tailed
Sig.)] ,280
b
B (kontrol positif vs M (LED merah)
Asymp. Sig. (2-tailed) ,576 Exact Sig. [2*(1-tailed
Sig.)] ,631
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
B (kontrol positif vs D (LED hijau)
Asymp. Sig. (2-tailed) ,002 Exact Sig. [2*(1-tailed
Sig.)] ,005
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
Test Statisticsa
skoring Mann-Whitney U 24,500
Wilcoxon W 79,500
Z -2,387
Asymp. Sig. (2-tailed) ,017 Exact Sig. [2*(1-tailed
Sig.)] ,052
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
C (LED merah) vs D (LED hijau)
Asymp. Sig. (2-tailed) ,005 Exact Sig. [2*(1-tailed
Sig.)] ,007
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
C (LED merah) vs E (LED biru)
Asymp. Sig. (2-tailed) ,021 Exact Sig. [2*(1-tailed
Sig.)] ,035
b
D (LED hijau) vs E (LED biru)
Asymp. Sig. (2-tailed) ,189 Exact Sig. [2*(1-tailed
Sig.)] ,280
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
Lampiran 13. Analisis statistik nonparametrik dengan uji Kruskal-Wallis dan uji lanjut Mann-Whitney U pada warna sirip dada benih ikan botia
Kruskal-Wallis Test
Ranks
perlakuan N Mean Rank skoring warna sirip dada kontrol negatif 10 13,80
kontrol positif 10 31,00
A (kontrol negatif) vs B (kontrol positif) Ranks
perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol negatif 10 6,50 65,00
kontrol positif 10 14,50 145,00
Total 20
skoring warna sirip dada Mann-Whitney U 10,000
Wilcoxon W 65,000
Z -3,559
Asymp. Sig. (2-tailed) ,000 Exact Sig. [2*(1-tailed
Sig.)] ,002
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
A (kontrol negatif) vs C (LED merah) Ranks
Perlakuan N Mean Rank Sum of Ranks
skoring warna sirip dada kontrol negatif 10 5,80 58,00
LED merah 10 15,20 152,00
Asymp. Sig. (2-tailed) ,000 Exact Sig. [2*(1-tailed
Sig.)] ,000
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
A (kontrol negatif) vs D (LED hijau) Ranks
Perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol negatif 10 8,50 85,00
LED hijau 10 12,50 125,00
Asymp. Sig. (2-tailed) ,075 Exact Sig. [2*(1-tailed
Sig.)] ,143
b
A (kontrol negatif) vs E (LED biru) Ranks
perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol negatif 10 9,50 95,00
LED biru 10 11,50 115,00
Asymp. Sig. (2-tailed) ,342 Exact Sig. [2*(1-tailed
Sig.)] ,481
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
B (kontrol positif) vs C (LED merah) Ranks
Perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol positif 10 7,00 70,00
LED merah 10 14,00 140,00
Asymp. Sig. (2-tailed) ,001 Exact Sig. [2*(1-tailed
Sig.)] ,007
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
B (kontrol positif) vs D (LED hijau) Ranks
Perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol positif 10 12,50 125,00
LED hijau 10 8,50 85,00
Test Statisticsa
Asymp. Sig. (2-tailed) ,029 Exact Sig. [2*(1-tailed
Sig.)] ,143
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
B (kontrol positif) vs E (LED biru) Ranks
Perlakuan N Mean Rank Sum of Ranks skoring warna sirip dada kontrol positif 10 13,50 135,00
LED biru 10 7,50 75,00
Asymp. Sig. (2-tailed) ,004 Exact Sig. [2*(1-tailed
Sig.)] ,023
b
a. Grouping Variable: perlakuan b. Not corrected for ties.
C (LED merah) vs D (LED hijau)
Asymp. Sig. (2-tailed) ,001 Exact Sig. [2*(1-tailed
Sig.)] ,001
b